II -4-4) Mécanisme d'attaque des ions
chlores :
Les ions chlorures qui pénètrent dans le
béton peuvent réagir chimiquement avec l'aluminate tricalcique
(C3A en nomenclature des cimentiers) et former des
monochloroaluminates hydratés (C3A. CaCl2.
10H2O), relativement stables dans le béton.
Par rapport au mécanisme induit par la
carbonatation, le mécanisme de corrosion électrochimique en
présence de chlorures est différent dans le sens où la
corrosion n'est plus une corrosion généralisée mais une
corrosion locale sous forme de piqûres [12]. Si l'on
observe que la vitesse de corrosion est, en général, plus
élevée en présence d'ions chlorure, les mécanismes
physico-chimiques sous-jacents ne sont pas encore parfaitement
expliqués. Toutefois, il apparaît qu'une conséquence de la
présence des ions chlorure est la dissolution locale de la couche
passive et une migration à travers celle-ci. De très faibles
concentrations en chlorures (> 0,01 %) modifieraient la morphologie de la
couche passive en formant le composé FeOOH, puis des ions complexes
instables FeCl3 - qui consomment les ions hydroxyles
présents selon les réactions :
Fe + 3 Cl- ? FeCl3
- + 2e-
FeCl3 - + 2 OH-?
Fe(OH)2 + 3 Cl-
Les électrons libérés par la
réaction d'oxydation se déplacent à travers le
métal jusqu'aux sites cathodiques. Selon les réactions ci-dessus,
le processus conduit à une diminution du pH et à un recyclage des
ions chlorure (Figure II -19).
La création de piles électrochimiques sur
l'armature conduit progressivement à la dissolution du métal dans
les zones anodiques.
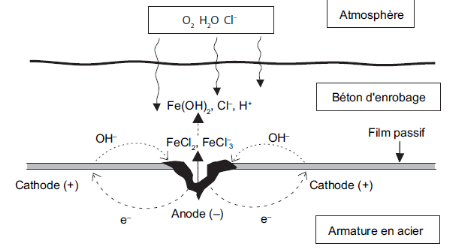
Figure II -19 :
mécanisme de la corrosion électrochimique
en présence de chlorures.
L'attaque du métal est localisée en des
points particuliers se matérialisant par des trous étroits : les
piqûres. A la surface du métal, on observe une distribution de
micropiles, les piqûres sont les sites anodiques et le film passif
environnant constitue de larges surfaces cathodiques.
Les piqûres constituant les sites anodiques et le
film passif les surfaces cathodiques, on observe des micropiles dont le rapport
des surfaces cathode/anode est élevé. Cela conduit à des
densités de courant de corrosion localement très grandes.
Au niveau des aires cathodiques, la production des ions
OH- relève le pH, ce qui réduit les
possibilités d'attaques ultérieures sur ces surfaces. Pour que
les réactions se poursuivent, il faut que les ions Cl- soient
toujours disponibles au détriment des ions OH- afin de
maintenir le rapport Cl-/OH- au-dessus de la valeur
critique de dépassivation. Or, la formation des produits de corrosion
intermédiaires contenant du chlore diminue temporairement la
concentration en chlorures. En outre l'apport d'ions OH- à
partir de la réserve alcaline du liquide interstitiel tend à
repassiver les zones attaquées et limite la propagation de la corrosion.
Si l'apport en chlorures se maintient, la concentration de ces derniers
augmente dans les aires anodiques, puis se redistribue grâce aux courants
de corrosion sur toute l'armature.
Les variations d'humidité et les gradients de
concentration en chlorures créent de nouvelles anodes qui finissent par
se rassembler en larges zones corrodées.
La corrosion est d'autant plus élevée que la
quantité de chlorures disponible au niveau de l'armature est
importante.
Il est difficile de connaître exactement la
concentration en chlorures libres « critique » (appelée encore
« seuil ») susceptible de permettre l'amorçage de la corrosion
des armatures. En effet, cette concentration dépend de nombreux
paramètres tels que, notamment, la microstructure au contact des
armatures. De plus, Béton d'enrobage la concentration en chlorures de la
solution interstitielle n'est pas identique (même au voisinage des
armatures) à la concentration au niveau des sites de corrosion
(piqûres). En outre, l'amorçage de la corrosion dépend du
potentiel électrochimique de l'acier .Un critère
d'amorçage de la corrosion souvent retenu est celui proposé par
Hausman [25]. Il prend en compte le rapport entre la
concentration en chlorures libres et en hydroxyles au droit des armatures
:
[Cl-] / [OH-] = 0,6. Plus ce rapport est
élevé, plus la vitesse de corrosion est grande. Ce critère
est compatible avec une analyse thermodynamique de la stabilité de la
couche de passivation en fonction du pH, et sa fiabilité a
été démontrée expérimentalement .On peut
alors déduire de ce critère la valeur de la concentration «
critique » en chlorures, si l'on connaît le pH de la solution
interstitielle.
Précisons de plus que cette relation permet
d'intégrer les interactions entre carbonatation (diminution de la
concentration en OH-) et pénétration des chlorures
(augmentation de la concentration en chlorures libres). Rappelons ici que
l'état hydrique du béton est un paramètre
déterminant vis-à-vis de la corrosion des armatures, d'une part,
pour le transport des espèces chimiques (nécessité d'une
phase gazeuse pour le transport du CO2 gazeux et d'une phase liquide
pour les ions chlorure), et, d'autre part, pour les réactions chimiques
entre ces espèces et le béton. [10]
| 


