CHAPITRE I : BIOLOGIE DES ABEILLES
I- Généralités
I-1-
Définition
L'abeille est un insecte social appartenant à l'ordre des
hyménoptères (PLATAUX et QUENU, 1972 ; MEDORI et COLIN,
1982). Ils sont apparus il y a 45 millions d'années, nettement avant
l'homme (DANIEM, 1983) Cependant, certains paléontologues
découvrirent leurs fossiles dans les ambres de la baltique depuis plus
de 60 millions d'années (WINSTON, 1993).
Les mieux connus et les plus utilisées en apiculture sont
dans le genre Apis et font partie de l'espèce Apis
mellifera mellifera comportant plusieurs races géographiques qui
peuplent actuellement l'Europe, l'Afrique, l'Asie occidentale,
l'Amérique du nord, l'Amérique sud, l'Australie et la Nouvelle
Zélande (GIRAUDET, 2008).
I-2-Taxonomie
Tableau N° 01 : les abeilles dans le
monde des insectes
|
Les abeilles font partie du règne animal
|
|
Principaux
|
|
Clase
|
Insectes
(plus de 800 000 espèce différentes)
La classe des insectes se subdivise en 32 ordres
|
|
Ordre
|
Hyménoptères
-Apocrites (abdomen réuni aux thorax par un
pédoncule)
-Aculéates (abdomen terminé par un dard ou un
aiguillon
|
|
Super famille
|
Apoïdea
-Abeilles diverses (20 000 espèces)
|
|
Famille
|
Apidae
-abeilles sociales ou solitaires (langue longue- nidification
variable)
|
|
Genre
|
Apis
(abeilles sociales se multiplie par essaimage)
|
|
Espèce
|
Apis mellifica
(abeilles domestique)
|
(REGARD, 1988)
I-3)
Répartitions géographiques des abeilles mellifères en
Algérie
L'élevage des abeilles est répandu dans l'ensemble
des zones agro écologiques et s'insère harmonieusement dans les
systèmes de production arboricoles des zones de montagne, des oasis et
des plaines.
Le cheptel apicole algérien est constitué de deux
races.
- Apis mellifica intermissa, dite « abeille
tellienne » ou « abeille noire du Tell » dont l'aire de
distribution se confond avec l'atlas tellien.
- Apis mellifica sahariensis, encore appelée
« abeille saharienne » implantée au sud ouest de
l'Algérie (Béchar, Ain Sefra) de couleur noir, productive,
prolifique, résistante aux maladies et aux prédateurs mais
néanmoins fort agressive et présentant une propension à
l'essaimage, l'abeille tellienne est la race dominante en Algérie
où elle se présente sous la forme de plusieurs
variétés (dont cinq identifiées par les apiculteurs :
« Anzi », « Ghalmi », « Begri », ainsi que deux
variantes sauvages kabyles : « Thih Arzine»et «harezzine »
adaptées aux divers biotopes (ABDELGUERFI et RAMDANE,
2003)
II- la colonie d'abeilles
II-1- Définition
Elle est constituée d'une reine unique, d'ouvrières
et de faux bourdons. La reine est la seule femelle fertile de la colonie. Les
ouvrières sont les individus les plus nombreux, les mâles, sont
plus volumineux que les femelles. On compte jusqu'à 2500 par colonie
(LARAME, 2007)
Chez l'abeille, la vie commune est permanente. Il n'existe aucune
période de repos ou d'hibernation au sens propre du mot. En plein
coeur de l'hiver l'abeille vit dans la ruche, se nourrit, se déplace,
crée la chaleur indispensable à la vie du groupe, seule
l'activité est ralentit et ne reprend que sous certaines conditions
(REGARD, 1988).
La reine commence la ponte au printemps, le nombre d'abeilles
augmente alors considérablement dans la colonie (HAUBRUGE, 1998).
II-2-Les membres de la colonie
II-2-1-La reine
II-2-1-1- Morphologie
La reine est l'organe féminin de la reproduction dans la
colonie. En fait c'est la mère commune à tout ce qui vit dans la
ruche (REGARD, 1988).elle est presque deux fois plus long et 2.8 fois plus
lourde qu'une ouvrière (LOIRICHE, 1979) et se reconnaît par son
abdomen allongée qui dépasse largement la pointe des ailes au
repos(SEGEREN et al, 2004) aussi par des ailes plus courtes, des
pattes sans brosses ni corbeilles, une langue plus courte, des glandes
cirières et salivaires non fonctionnelles, elle est aussi muni d'un dard
qu'elle n'utilise que très rarement ou pour détruire les autres
reines(MEDORI et COLIN, 1982).
L'unique alimentation de la larve destinée à
devenir des larves reine est la gelée royale déposée en
grande quantité dans la cellule royale (LAYENS et BONNIER, 1987).
II-2-1-2- Appareil reproducteur
Occupe presque toute la cavité abdominale. Il est
formé de deux ovaires comprenant chacun 150 à 200 ovarioles
prolongés par deux oviductes (MEDORI et COLIN, 1982) dont leurs
rôle est d'acheminer les oeufs jusqu'à la cavité vaginale
qui débouche dans la chambre de l'aiguillon de la reine ((HAUBRUGE,
1998) qui est largement ouverte entre les courbures des soies de l'aiguillon et
le dernier sternite (RUTTNER et TRYASKO, 1968).
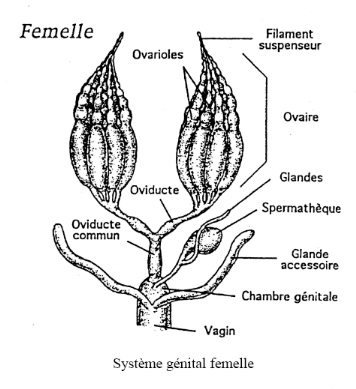
Figure 01: l'appareil
génital de la reine
(RACCAUD -SCHOELLER, 1980)
II-2-2-
L'ouvrière
II-2-2-1- Morphologie
L'ouvrière est une femelle atrophié, ou encore
ayant évolué différemment (REGARD, 1988) elle naît
à partir d'un oeuf fécondé mais il s'agit d'une femelle
incapable de se reproduire (ROMANO et TECINES, 2009).
Elles vivent de trente à quarante cinq jours en moyenne
pendant la belle saison, elle est plus petite et plu légères que
les mâles et la reine (DANIEM, 1983). De face la tête de
l'ouvrière est triangulaire le bout de ses ailes au repos touche
l'extrémité de son abdomen (SEGEREN, 2004) (figure 03).
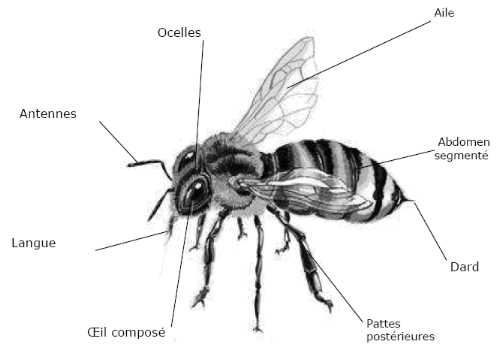
Figure02: morphologie de l'ouvrière
II-2-2-2- Appareil
reproducteur
Il est formé de deux ovaires atrophiés
prolongés par deux oviductes débouchant dans le vagin (MEDORI et
COLIN, 1982) (figure 03). Les ouvrières peuvent pondre mais sans faire
féconder. Elles ne peuvent en effet pas s'accoupler. Leurs oeufs
donneront toujours des mâles (HAUBRUGE, 1998).
Le nombre des ovarioles est très variable, il oscille
entre 2 et 12 et peut allez dans certaines cas jusqu'au 20 ovarioles (PAIN,
1968).
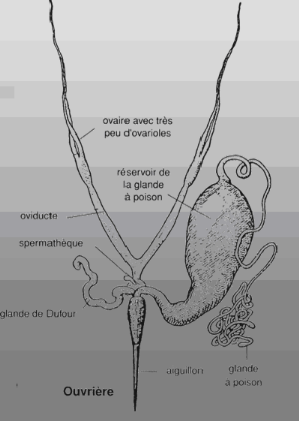
Figure 03 : Appareil reproducteur de
l'ouvrière
(PAIN, 1968)
III- Nutrition des abeilles
III-1-Nutrition des larves d'ouvrières
Les larves d'abeilles reçoivent une nourriture
spéciale ou gelée royale qui est une sécrétion des
glandes hypo pharyngiennes des abeilles ouvrières. Cette
sécrétion se distingue des sécrétions des glandes
hypo pharyngiennes des reines, à la foie par sa consistance et par ses
propriétés biologiques (BOGDANOVSKY ,1963) .
Les nourrices commencent les visites d'inspection dés que
l'oeuf est pondu et les continuent à intervalles rapprochés
pendant les stades ovulaire et larvaires
Les nourrices visitent les larves à peu prés 1300
fois par jour, soit plus d'une fois par minute (CHAUVIN ,1958).
Les jeunes larves, de petite taille, sont toujours
entourées d'un excès de nourriture ou même flottent
dessus ; elle est d'une teinte grisâtre uniforme et de consistance
pâteuse.
La nourriture consommée par la larve constitue le facteur
le plus important jusqu'à la période entre le second, et le
troisième jour, la nourriture laissée non consommée dans
la cellule, dépasse de beaucoup le poids de la larve
elle-même ; presque quatre fois le poids de la larve d'un jour. En
fait, il n'est distribué que peu ou pas de nourriture à la larve
le second jour (HAYDAK, 1968).
Le troisième jour, la distribution est reprise et il se
produit une augmentation considérable de la quantité de
nourriture dans les cellules des larves de trois jours par rapport à la
quantité donnée aux larves de deux jours. La composition de la
nourriture est aussi modifiée le troisième jour elle contient
beaucoup de carbohydrates. Les grains de pollen digérés se
trouvent régulièrement dans la nourriture de la larve (HAYDAK,
1968) qui est de 68- 73mg durant la vie larvaire d'une ouvrière (KELLER,
2003).
Le poids moyen de nourriture par cellule pourvue d'une larve
d'ouvrière était de 3.69mg dans les cellules avec des larves de
1jour ; de 8,76mg dans les cellules de 4,4jour ; la plus grande
quantité (9,10 mg à 11,79mg) se trouvant dans les cellules avec
des larves de 2jours et demi à trois jours (HAYDAK, 1968).
III-1-2-Nutrition des larves de reines
Les larves destinées à devenir des reines sont
élevées dans des cellules spéciales et pourvues, durant
leur vie, d'une abondance de nourriture ; elles en ont suffisamment
même après leurs operculation. Il y a peu de variations dans la
composition de la gelée donnée aux larves jeune et vielles. Les
nourrices de larves de reines déposent alternativement deux types de
sécrétions : une lacté opaque et une claire et
aqueuse. La larve de reine jusqu'au 3 jours reçoit plus de
sécrétion blanche, celle de 4 jours et au-dessus, plus de
sécrétion claire.
Pendant les trois ou quatre premiers jours de leurs vie, les
larves de reines grandissent plus lentement que les larves d'ouvrières
d'age correspondant (HAYDAK, 1968).
III-2-Nutrition des jeunes abeilles et des abeilles
adultes par les plantes mellifères
III-2-1-Définition des planes
mellifère
Le mot mellifère provient du latin mellis qui
signifie miel. Les plantes mellifères sont des plantes qui produisent un
suc avec lequel les abeilles produisent le miel. Ce suc est le nectar des
plantes. En mythologie, le nectar était considéré comme un
breuvage divin à base de miel qui procurait l'immortalité
à ceux qui en buvaient (COUPLAN et MARMY, 2002).
III-2-2-Les principales plantes mellifères en
Algérie
Les plantes mellifères appartiennent à
différentes familles, dont la famille des Rosaceae est plus
représentée par huit espèce mellifères, la
deuxième position est occupée par les Fabaceae qui sont
caractérisées par leurs richesse en protéines, la
même position est aussi occupée par les Astéraceae
représenté par les plantes se développant dans les rives.
Les Laminaceae et les Barassicaceae occupent la troisième position
(CHEFROUR et TAHAR, 2006)
Tableau N° 02 : Les principales
plantes mellifères
|
Nom commun
|
Nom latin
|
|
Plantes de plaines
|
Acacia (Robinier « faux acacia »)
Coquelicot
Houx
Moutarde blanche
Noisetier
Trèfle blanc
|
Robinia pseudoacaia
Papaver Rhoes
Ilex aquifolium
Sinapsis alba
Corylus avellana
Trifolium repens
|
|
Plantes méditerranéennes
|
Amandier
Arbousier
Laurietin
Romarin
|
Prumus dulcis
Arbutus unedo
Viburmum tinus
Rosmarinus oficinalis
|
|
Plantes de culture
|
Tournosol
lavandin
|
Helianthus annuus
Lavadula intermedia
|
(AUPINEL, 2009)
III-2-2-1-Le nectar
Le nectar est composé principalement de sucres
(saccharose, fructose, glucose), et constitue la principale source de glucides
chez les abeilles en apportant 80% des sucres nécessaires à leur
alimentation. Globalement, la concentration en sucre varie de 15 à 75%
selon les espèces végétales (ROTRAIS et al,
2005).
Le nectar est donc la principale source d'énergie des
insectes pollinisateurs. Les sucres interviennent également dans la
synthèse des lipides. Chez l'abeille domestique, le nectar est
transformé en miel par déshydratation, et est consommé
sous cette forme par toutes les castes et tous les stades de
développement. La consommation de sucre maximale chez les
ouvrières butineuses pour lesquelles l'activité de vol requiert
des besoins énergétiques accrus, et les ouvrières d'hiver
qui doivent accumuler des réserves (DERELLE, 2008).
III-2-2-2-Le pollen
Contenu dans les fleurs, le pollen est l'unique et indispensable
source de protéines, de minéraux, de graisses et de plusieurs
autres éléments pour les abeilles (KELLER et al,
2003).Les besoins sont très importants puisqu'une colonie en consomme en
moyenne entre 20 et 40 kg par an. L'alimentation pollinique des larves et des
jeunes abeilles influe directement sur le développement, la taille, la
durée de vie des abeilles ouvrières et leur immunité.
(MONTEZ, 2009) en effet un pollen de qualité accroît la
résistance des abeilles aux produits toxiques (AUBERT, 2007).
Des travaux récents montrent qu'il y a une relation entre
la teneur en protéines de certains pollens, la quantité
ingérée et le développement des glandes hypo pharyngiennes
et des ovaires des abeilles nouvellement émergées (PIERRE et
CHAUZAT, 2005).
Une grande quantité de pollen est consommée entre
le troisième et le sixième jour de la vie des abeilles et cette
consommation s'étend jusqu'au dixième jour : elle est de
60mg/abeille (BRUNEAU, 2006).
CHAPITRE II: DEVELOPPEMENT OVARIEN CHEZ L'ABEILLE "APIS
MELLIFERA"
Les organismes vivants n'existent que dans un temps
limité connaissant une échéance finale.
Inéluctablement, une déchéance régulière des
fonctions vitales après la maturité va entraîner la mort.
En effet, les individus possèdent un potentiel biotique c'est: l'acte de
reproduction (LAMY, 2001 ; THIERRY, 2001)
1- La reproduction des insectes
Chez la plupart des insectes, la reproduction est biparentale
(Raccaud -SCHOELLER, 1980), essentiellement sexuée, Mâles et
femelles doivent se retrouver. La reproduction sexuée peut être
totalement remplacée par une reproduction sans mâle, la
parthénogenèse (LAMY, 2001). Dans la ruche des abeilles
l'ouvrière est la résultat d'un oeuf fécondé
c'est-à-dire reproduction sexuée, et le faux bourdon c'est le
résultat de la parthénogenèse (SELIEMANAISSA et
al, 1994)
La reproduction naturelle de l'abeille a lieu au cours du mois
de mai principalement et plus exceptionnellement en juillet (DI-RUGGIERO,
et al 2009).
2- La fécondation
Chez les abeilles, la fécondation dite indirecte, se
fait par l'intermédiaire d'un spermathèque (HANOT, 2004).
Lorsqu'elle atteint sa maturité sexuelle et que les
conditions atmosphériques sont favorables, la reine quitte la colonie
pour son premier vol nuptial. Il y a trois facteurs atmosphériques
importants pour ce vol: température plus haute que 20°C ; absence
ou peu de nuages, très peu de vent (DEROTH, 1980). Une bonne
fécondation assure d'une part le remplissage de la spermathèque
par les spermatozoïdes et d'autre part une diversité
génétique maximale dans les conditions naturelles. Les reines
peuvent se faire féconder par plusieurs males c'est la polyandrie, les
males qui réussissent à féconder une reine meurent
(DEROTH, 1980; LAMY, 2001; E.COLIN et al, 2006; DI-RUGGIERO, 2009).
I-
L'ovogenèse
I-1- L'ovaire et son fonctionnement
Les ovaires des insectes ainsi que des abeilles sont
composés d'un nombre variable d'ovarioles formés de deux parties
essentielles: le germarium et le vitellarium. (RAABE, 2009)
Le germarium se différencie le premier. Il contient les
cellules germinales, des cellules mésodermiques qui vont devenir les
cellules folliculaires et dans certains cas des cellules soeurs des ovogonies
qui joueront un rôle nutritif et que l'on appelle les trophocytes.
Le vitellarium représente la majeure partie de
l'ovariole; c'est à son niveau que se réalise la
vitellogenése (RACCAUD -SCHOELLER, 1980; RAABE, 2009).Il existe chez les
insectes plusieurs types d'ovarioles selon la présence ou l'absence de
trophocytes (Figure 04).
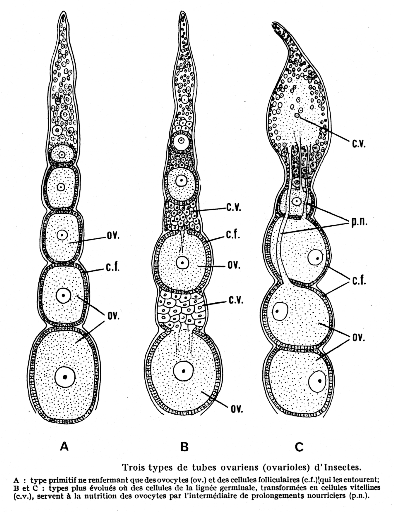
Figure04: Trois types de tubes ovariens
(ovarioles) des insectes
(RACCAUD -SCHOELLER, 1980)
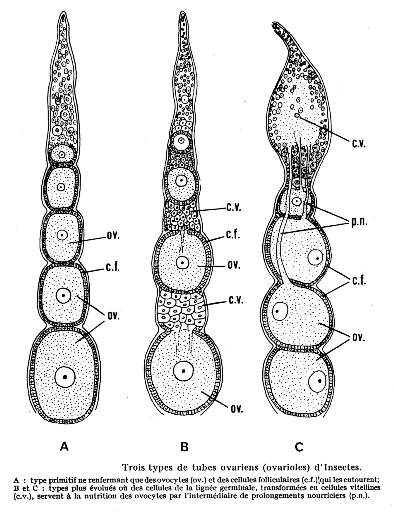
Les ovarioles panoïstiques sont dépourvus de
cellules nourricières; les ovarioles méroïstiques, des
trophocytes sont présents; les ovarioles méroïstiques
polytrophiques, l'ovocyte reste associé à un certain nombre de
cellules soeurs et descend avec elles dans le vitellarium; les ovarioles
méroïstiques acrotrophiques, les cellules nourricières
restent dans le germarium où elles constituent un tissu trophique
central. (RACCAUD-SCHOELLER, 1980; KHALIFA, 1990 ; RAABE, 2009).
Selon LOUVEAUX (1976) et (1985) chaque ovariole produit
environ quatre à cinq oeufs par 24 heures en saison active.
L'ovariole de l'abeille, ainsi que tous les Apidés, est
de type méroïstiques polytrophiques (BEAUMONT et CASSIR, 1983;
KHALIFA, 1990).
I-2- Les étapes de l'ovogenèse
I-2-1- Différenciation des ovocytes et des
trophocytes
Lorsque l'ovogenèse débute il y a multiplication
des ovogonies et des cellules folliculaires à la partie basale du
germarium (RAABE, 1964).
Les cellules germinales se divisent pour donner des ovogonies
primaires subit un nombre précis de mitoses; Après une
deuxième division mitotique, chaque ovogonie donne naissance à un
seul oocyte et trois cellules nutritives (RACCAUD-SCHOELLER, 1980).
Ces dernières se multiplient jusqu'à arriver
à 48 trophocytes par ovocyte (LOUVEAUX, 1976; KHALIFA, 1990).
I-2-2- Vitellogenése
A l'extrémité antérieure du vitellarium,
l'ovocyte commence à se charger de réserves nutritives qui
peuvent avoir différentes origines: exogènes et
endogènes.
D'après LOUVEAUX (1976) et RACCAUD -SCHOELLER (1980),
les réserves vitellines s'accumulent d'abords dans les trophocytes, et
puis passent dans l'ovocyte à travers une ouverture qui subsiste lors de
la séparation des deux types de cellules, et lorsque l'ovule devient
mûr les trophocytes seront entièrement résorbées.
A la fin de la vitellogenése, l'ovocyte est
entouré alors qu'il est encore dans l'ovariole par deux enveloppes: la
membrane vitelline, la plus interne, très fine, et le chorion plus
épais (RACCAUD-SCHOELLER, 1980).
I-2-3- Ovulation
Lorsque l'ovocyte qui se trouve à la base de l'ovariole
est arrivé à maturité, le follicule se rompt et l'ovocyte
doit traverser le bouchon épithélial. Après l'ovulation le
follicule vide ou follicule résiduel s'effondre, ses cellules
dégénèrent puis disparaissent (RACCAUD - SCHOELLER,
1980).
I-3- Contrôle endocrine de l'ovogenèse
I-3-1- Contrôle endocrine de la vitellogenése
La périodicité que manifeste fréquemment
l'activité ovarienne un contrôle hormonal (RACCAUD -SCHOELLER,
1980).les hormones de contrôle et de régulation interne sont
généralement produites par le système endocrine
retro-cérébrale.
D'après RACCAUD-SCHOELLER(1980). BEAUMONT et CASSIER
(1983) la sécrétion endocrine est assurée par deux types
de glandes:
· Corpora cardiaca, en contrôlant plusieurs
activités physiologiques.
· Corpora allata, en produisant l'hormone juvénile
qui à la fois une fonction juvénillisante au stade larvaire, et
une fonction gonadotrope au stade imaginal, ainsi que son action sur
l'activité des glandes annoncées à l'appareil
génital.
Le cerveau, par l'intermédiaire des cellules
neurosécrétrices et par l'excitation nerveuse du corpora allata,
peut aussi agir sur la formation des oeufs et par conséquent sur la
fécondité des insectes (KHALIFA, 1990).
En effet, l'activité des cellules
neurosécrétrices du cerveau augmente au cours de la
maturité sexuelle de la reine d'abeille mellifique (KHALIFA, 1986).
Les recherches relatives au contrôle endocrine de la
vitellogenése des insectes ont été effectuées sur
des espèces de plusieurs ordres différents, les seules
données développées seront celles obtenues sur les
criquets locusta migrtoria, celles-ci permettent de formuler un
schéma général assez simple qui s'applique dans ses
grandes lignes à de nombreuses espèces (Figure 05) (JOLY,
1968).
Des informations externes et internes variées
(photopériode, phéromones excitatrices mâles, copulation,
alimentation) sont transmises par les organes sensoriels au cerveau, soit
directement, soit par l'intermédiaire de la chaîne nerveuse
ventrale. Le cerveau les intègre et élabore dans ses cellules
neurosécrétrices deux substances différentes: la
sécrétion des cellules A-B et la sécrétion des
cellules C (GIRARDIE, 1966).
Lorsque les conditions externes sont favorables, ces deux
substances sont déchargées dans l'hémolymphe à
partir des corpora cardiaca.
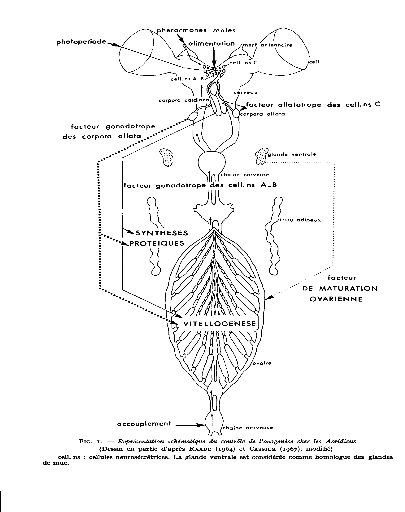
Figure 05: Représentation
schématique du contrôle endocrine de l'ovogenèse
(RAABE (1946) et CASSIER (1967), modifié)
La sécrétion des cellules A-B a une action
gonadotrope directe sur l'ovaire (GIRARDIE, 1966) et stimule les
synthèses protéiques au niveau d'un tissu d'une grande importance
métabolique, le tissu adipeux (RAABE, 2009).
La sécrétion des cellules C joue un rôle
gonadotrope indirect : elle active les corpora allata (GIRARDIE, 1966, 1967).
Ces organes sont soumis, par ailleurs, à un contrôle inhibiteur
cérébral (CASSIER, 1967).
Les corpora allata, à leur tour, exercent une action
gonadotrope (JOLY 1960; CASSIER, 1964) qui revêt deux aspects
différents. Ils interviennent d'une part en contrôlant dans le
tissu adipeux la synthèse des protéines nécessaires
à la vitellogenése (RAABE, 2009) .Il favorisent d'autre part, au
niveau du follicule, le passage des protéines hémolymphatique
dans l'ovocyte en induisant un élargissement des espaces
extracellulaires (BENTZ, 1970).
I-3-2- contrôle endocrine des premiers stades de
l'ovogenèse
On s'est souvent demandé pourquoi l'ovaire était
incapable de fonctionner chez les larves puisque celles-ci étaient
riches en hormone des corpora allata et la notion de puberté à
été formulée. Selon cette conception l'ovaire devrait pour
pouvoir se développer passer par une étape particulière
réalisée au cours de la vie nymphale (JOLY, 1960, RAAB, 2009).
II-
Nutrition et développement des organes sexuels adulte
L'importance du facteur trophique, capable de transformer les
abeilles en ouvrières ou en reines, de déterminer des
caractères spécifiques, par abondance ou par carence, et surtout
d'agir sur la maturation sexuelle (PAIN, 1968).
Les deux principales substances alimentaires
récoltées par les abeilles butineuses sont, d'une part, le
pollen, de nature essentiellement azotée ; d'autre part, le nectar,
sécrété par les fleurs ou la feuille des
végétaux, essentiellement sucré .Le nectar ne parait pas
constituer un facteur de croissance, pour l'abeille ; et par conséquent,
il ne peut contribuer à l'ovogenèse (PERNAL et CURRIE, 2000).
C'est un composé plus ou moins concentré de différents
sucres, glucose, lévulose, saccharose, assez pauvre en protéines,
en lipides et en sels minéraux.
Le pollen conditionne non seulement l'élevage des
larves mais aussi la capacité des jeunes ouvrières à
élever le couvain.
Les ouvrières possèdent grâce leur corps
adipeux, des réserves pour la croissance des oeufs. Pour
démontrer l'action de ces substances réservées, plusieurs
biologistes sont attachés à nourrir des ouvrières de miel
et de sucre, en les privant de protéines. Ils obtinrent pourtant des
ouvrières à gros ovaires, c'était la preuve que les oeufs
ne peuvent se former sans protéines (PAIN, 1968).
Quant au rôle de l'effet des protéines du pollen
sur le déclenchement de l'ovogenèse. C'est au delà des
trois premiers jour de l'alimentation larvaire que se fait la distinction entre
alimentation des ouvrières et des reines .Un apport alimentaire plus
pauvre, ou le pollen prend une certaine part (environ 5%), entraine une
régression des ovarioles chez les ouvrières (PIERRE et CHAUZAT,
2005) .
III- Développement chez l'abeille ouvrière
«Apis mellifera»
Dans une société d'abeille de 40000 à 50000
ouvrières, il n'ya qu'une seule reine (BRIEN, 1966), qu'est l'organe
féminin de la reproduction dans la colonie (REGARD, 1988à), la
présence d'une reine provoque des phénomènes internes plus
complexes. La reine empêche l'apparition d'autres individus reproducteurs
(HESS, 1942), émettait une substance chimique qui avait pour effet de
freiner le développement des ovaires chez les ouvrières (BRIEN,
1966, LOIRICHE, 1979; KIEVITS, 2003; DOMBROSKI, 2002) ce médiateur
chimique à été effectivement révélé
et isolé on lui à donné le nom de phéromone (BRIEN,
1966).
III-1-cycle biologique de l'abeille ouvrière
L'ouvrière est une femelle atrophiée, ou encore
ayant évolué différemment. En effet l'atrophie dans son
développement ne concerne que les organes de reproduction (Regard,
1988).
L'ouvrière nait à partir d'un oeuf pondu dans l'une
des cellules hexagonales constituant les rayons (GIRAUDET, 2008).
L'évolution de l'oeuf en larve, nymphe, insecte parfait
s'effectue en 21 jours (Figure 06).
- 1ere jour: ponte de l'oeuf.
- 4ème jour: naissance de larve.
- 9ème jour: operculation de la cellule
- 21ème jour: naissance de l'abeille (WINSTON,
1993).
Figure06: développement de
l'ouvrière d'abeille de l'oeuf jusqu'à la mort
(Regard ,1988)
III-1-1- L'oeuf
En forme de bâtonnet de 1,4 à 1,6
millimètres légèrement courbé enveloppé
d'une membrane blanc nacré poreuse.
L'oeuf est placé verticalement sur le fond de
l'alvéole par l'extrémité postérieure lors de la
ponte, il s'incline peu à peu jusqu'à se coucher
complètement à la fin du troisième jour (MEDORI et COLIN,
1982).
La membrane qui entoure l'oeuf : le chorion est percée, du
coté antérieur, par un orifice minuscule: le micropyle; c'est par
le que le spermatozoïde pénètre dans l'oeuf lors de la
fécondation (CHAUVIN, 1999).
III-1-2- La larve
A l'issue du troisième jour, une larve de couleur blanc
nacré sort de l'oeuf.
Entourée d'une cuticule inextensible, elle doit subir des
mues pour se développer.
D'abord couchée au fond de la cellule sur un lit de
gelée royale, aliment essentiel des trois premiers jours, elle
reçoit ensuite une pâtée de miel et de pollen si elle est
destinée à être ouvrière. Après six jour, la
larve de l'ouvrière tisse un cocon et se transforme en nymphe (MEDORET
et COLIN, 1982; Regard, 1988).
III-1-3- La nymphe
C'est une phase de la vie caractérisée par de
grands changements de structure, la plupart des tissus larvaires sont
détruits, c'est l'histolyse suivie d'une reconstruction de tissu propre
à l'imago donnant à l'insecte son aspect définitif. Cette
phase due de 12 à 21 jours (MEDORET et COLIN, 1982).
III-2- l'effet de la phéromone
Une ruche comporte un très grand nombre d'individus, et
la survie de la colonie dépend de la coordination des activités
au sein de celle-ci, en liaison avec les conditions du milieu (KIEVIIS,
2003).Une colonie d'abeille domestique (Apis mellifera) dont la
réussite sociale est en partie due à la communication chimique
par l'utilisation de phéromones (KIEVITS, 2003; MAISONNASSE, 2009).
III-2-1- Définition de la phéromone
Les phéromones sont des substances
sécrétées par des individus et qui, reçues par
d'autres individus de la même espèce, provoquent une
réaction spécifique, un comportement ou une modification
biologique (CHAUVIN, 1960; DUPONT, 2002).
III-2-2- Localisation de la phéromone
La phéromone est produite ou entreposée dans la
glande mandibulaire des reines, (CHAUVIN, 1960); la reine la
sécrète par ses téguments, léchées sans
cesse par les ouvrières qui la prélèvent, l'absorbent et,
par la voie des incessants échanges de nourriture la transmettent
à toute la ruche (BRIEN, 1966), produite aussi par les glandes tarsales
(empreinte du pied) ou par les glandes tergites (dos de l'abdomen) (KIEVITS,
2003).
III-2-3- Action de la phéromone
Par l'action de la phéromone, la reine dirige
l'activité de toutes ses soeurs de la ruche. On a pu établir
également que la reine agirait de différente façon sur les
ouvrières (LOIRICHE, 1979):
1)-Les attirerait vers elles, comme l'aimant attire le fer; 2)-
les empêcherait d'édifier de nouvelles cellules royales; 3)-
freinerait chez elles le développement des ovaires ; 4)- elles attirent
les males et stimulent la monte au cour de l'accouplement; 5)- les susciterait
constamment à construire des rayons de cire avec des cellules
ordinaires; 6)- elles motivent la récolte du pollen chez les
ouvrières (CHAUVIN,1960; LOIRCHE , 1979; WOSSLER et CREWE , 1999;
KIEVITS,2003).
Le monde de transmission des phéromones est double, d'une
part ce sont des substances volatiles; d'autre part elles sont transmises par
contact entre les abeilles (KIEVITS, 2003).
III-2-4- Autres phéromones
Les phéromones de couvain stimulent le butinage surtout le
pollen et préviennent le développement ovarien des
ouvrières.
Les abeilles reconnaissent à l'odeur leur colonie, et sont
capables de différencier leurs soeurs de leurs demi-soeurs, elles
élèvent de préférence une reine qui est leur vraie
soeur. Cette reconnaissance n'empêche pas les abeilles de se tromper
assez de ruche; elles rentrent alors sans difficulté dans les ruches
voisines.
Peut fausser l'appréciation de la qualité des
colonies quand il favorise systématiquement les mêmes ruches
(WINSTON, 1993), ce phéromone s'appelle: La dérive
Le rôle de la reine est primordial dans la
société d'abeille Apis mellifera, elle permet la
cohésion et la stabilité de la colonie. La reine contrôle
la physiologie et le comportement des ouvrières, par le biais de
phéromones modificatrices et incitatrices. La phéromone des
glandes mandibulaires (Queen Manibular Pheromone, QMP) a un rôle majeur
dans ces régulations (MAI SONNASSE et al, 2009).
IV-3- L'ouvrière Pondeuse
La reine diffère des autres par sa structure
générale et son apparence, bien que les ouvrières soient
des femelles tout comme la reine, leurs ovaires ne sont pas
développés. En d'autres termes, les abeilles ouvrières
sont stériles (DEMIRSOY et al).
Tant que la colonie possède une reine, l'apiculture peut
très bien ne pas noter de différence (MORITZ et al,
2001), mais dés que la reine disparaît (ruche orpheline)
l'ouvrière peut devenir pondeuse, ses organes génitaux
atrophiés se développent c'est-à-dire lorsque la reine est
enlevée, il se produit une carence de la phéromone (BRIEN, 1966;
MEDORI et COLIN, 1982; JEAN-PROST, 1987; MORTIZ et NEUMANN, 2001).
L'ouvrière pondeuse prenant la relève de la reine
ne produira jamais que des mâles, et la colonie sera très
rapidement bourdonneuse (MEDORI et COLIN, 1982; CHIRON, 2008).
II-4-3-1- la ponte des ouvrières
La ponte des ouvrières à ce quelle est
irrégulière, les oeufs sur le bord de la cellule et non au fond;
parfois deux ou plusieurs oeufs par cellule. Il est rare qu'une telle ruche
puisse être récupérée, le mieux est de la disperser
complètement (WINSTON, 1993; BEAUMONT et CASSIER, 1996).
II-4-3-2- l'ovaire des ouvrières
Les ovaires des ouvrières s'étirent depuis la
hauteur du jabot jusqu'au sixième ganglion abdominale. Les deux
oviductes disposés latéralement ont aussi l'aspect de deux
filaments blanchâtres, qui se réunissent en un oviducte commun
sous les sixième et septième ganglions abdominaux.
Le nombre des ovarioles constituant les ovaires d'une
ouvrières adulte est très variable (PAIN, 1968).
Selon MEIER(1916), il oscille entre 2 et 12 ovarioles;
d'après ZANDER (1922) et KOSCHEVNIKOV (1905) entre 1 à 20. Selon
VONRHIEN (1933), les ovaires se composent le plus souvent de 5 à 6
tubes ovariques. HESS (942) compte aussi en moyenne 4 à 6 ovarioles par
ovaire.et, dans certains cas, leur nombre peut aller de 1 à 21.
Dans 13% de cas, l'ovaire droit et le gauche comprennent le
même nombre d'ovarioles. Dans 76% des cas, l'ovaire gauche contient un
nombre d'ovarioles plus élevé que celui de l'ovaire droit (PAIN,
1968).
Le diamètre des ovaires d'une ouvrière adulte
d'abeille est très petit. La largeur de chaque ovariole varie de 0.059
à 0.080mm (PAIN.1968).
CHAPITRE I : MATERIELS
ET METHODES
1- Recherche du couvain
naissant
Le couvain naissant doit être prélevé au
stade nymphal prêt à l'éclosion, dans une ruche
peuplée et indemne de toutes maladies et parasites

Figure 07:Naissance des l'ouvrières
adultes
2-l'émergence
L'émergence des abeilles ouvrières a eu lieu
après vingt quatre heures d'incubation à 34#177;1°C et
75%d'Hr
Les abeilles ouvrières sont encagées par petits
groupes de 120. Elles sont introduites par 20 à l'aide d'un tube
à essai d'une façon assez rapide pour que les abeilles ne
s'échappent pas.
Le prélèvement est effectué toutes les 24
heures. PAIN (1960) les encage de la même façon pour que les
individus les plus nombreux se répartissent plus facilement et d'une
manière plus homogène.

Figure 08: émergence des abeilles
ouvrières
3- description des
cagettes :
Nous avons utilisé des cagettes en bois de dimensions 6 x
8 x 10 cm.
La cagette est constituée est constituée d'un
plateau en bois et d'un couvercle en verre plexiglas.
L'un des deux côtés parallèles est pourvu
d'un nourrisseur à candi et d'un abreuvoir.
La cagette est pourrue d'orifices d'aération.

Figure 09: cagette d'élevage
4- nourriture
Est une pâte assez consistante composé de miel, de
sucre glace et de pollen.
L'eau potable (eau de robinet) est régulièrement
disponible.
5- candi
Le pollen utilisé est multi florale récolté
dans la région de Chlef.
Le pollen doit être séché
préalablement dan une étuve à 50° ensuite
trituré à l'aide d'un mortier à l'aide d'un pilon.
Le candi est préparé avec les proportions
suivantes :
44%de miel +44% de sucre glace + 12% de pollen.
Les composés sont mélangés et pétris
en vue d'obtenir une pâte non collante

Sucre glace
Le pollen
Le miel
Figure 10: les ingrédients du candi
6-L'élevage
Deux élevages successifs sont réalisés le
premier du 15 mars au 22 avril 2010 avec 08 répétitions, le
second du 25 avril au 28 mai avec 07 répétitions.
24 heures après l'émergence, 120 abeilles par
cagette sont maintenue dans une étuve, en conditions constantes
d'élevage : 34 #177;1°C ; humidité relative 70 #177;5
%.


Figure 11: les abeilles dans une cagette
d'élevage
Figure 12: les cagettes d'élevage dans
une étuve
7- La
mortalité
Durant la première semaine d'élevage le taux de
mortalité était normale 3 abeilles par cagette soit 2.5% ensuite
le taux a atteint 30% dans certains cagettes.
Les causes de mortalité sont méconnues.
8-prélèvement
des abeilles
Pour l'étude de chaque stade de développement, nous
avons prélevé 20 abeilles à partir de chaque cagette
Les abeilles sont tuées à l'aide du chloroforme.
9- Pesage des
abeilles
Les abeilles sont pesées dans une balance de
précision puis placées ces abeilles dans des eppendorphes
numérotés
10- dissection des
abeilles
·
Matériels et réactifs :
Ø une loupe binoculaire
Ø ciseau très pointu
Ø cuvette à dissection
Ø des épingles entomologiques
Ø pince
Ø Solution de Ringer : composé de :
· Chlorure de sodium
· Chlorure de potassium
· Bicarbonate de sodium
· Chlorure de calcium
· Eau distillée
|
8,5 g
0,25 g
0,20 g
0,30 g
1000 g
|
Ajouter le chlorure de calcium, seulement après
dissolution des autres sels (PH 7- 7,4), stériliser par filtration ou
autoclavage, Conservation limitée (MARCHAL et al, 1987).

Figure 14 : La cire

Figure 13 : Stéréoscope
binoculaire
Figure 15 : Des épingles
entomologiques
Ø
Méthodes
La dissection
La dissection a été effectuée sous une loupe
binoculaire. L'abeille ouvrière est fixée à l'aide
d'aiguilles entomologiques dans une boite de pétri de 9 cm de
diamètre contenant la cire solidifiée.
L'abeille doit être couverte d'une solution physiologique,
le Ringer.
Après la fixation on pratique une incision de chaque
coté de l'abdomen par un ciseau pointu, et à l'aide de pince on
enlève les huit segments abdominaux. Il apparaît la masse
énorme de l'intestin postérieure, le rectum, l'intestin
grêle et une partie de l'intestin moyen qui de chaque coté de
celui-ci. On trouve les ovaires au niveau du huitième au neuvième
sternite (KOUDIL et DOUMANDJI, 2008) alors que chez les glossines on le trouve
au niveau du sixième sternite (WILFRID et al, 2005).

Cire naturelle
Épingle dans le thorax
Epingle dans le dernier segment
Figure 16: la dissection de l'abeille
Biométrie des
ovaires
Pesage des ovaires
La paire d'ovaires est coupée à la base de
l'oviducte médian, essoré et pesé dans une balance de
précision.
Mesure de la longueur
Après étalonnage du stéréoscope
binoculaire monté d'un micromètre objectif, les longueurs de
l'ovariole et de l'ovocyte basal le plus développé sont
mesurées
Dénombrement des ovarioles
Sous un microscope, de grossissement (X10), on dénombre
les ovarioles par ovaire gauche ainsi que par ovaire droit.
Dénombrement des follicules : on
dénombre les follicules par l'ovariole le plus
développé
CHAPITRE II : RESULTATS ET DISCUSSIONS
I- Résultats
I-1- Caractérisation biométrique des stades
de l'ovariole et de son ovocyte basal
Le nombre moyen d'ovarioles par ovaires gauche et droit est
variable au cours des mois ; il est faible en mai et maximal en mars et
avril. Le nombre d'ovarioles n'est pas significativement différent entre
l'ovaire gauche et l'ovaire droit durant les mois, mars et avril (P>0,05),
mais significativement différent en mai (P<0,05). Le nombre total
d'ovarioles des deux ovaires de l'ouvrière est significativement
différent entre les mois d'avril et mai (P<0,05) ; mais, la
différence n'est pas significative entre mars et avril (P>0,05).
(Tableau 03, figure 17).
Une corrélation significativement marquée entre
le poids de l'abeille, la longueur de l'ovariole et celle de son ovocyte basal
(r<0.05), le même pour la longueur de l'ovaire doit et gauche
(r<0.05)
Durant la phase de maturation des ouvrières
orphelines, la longueur de l'ovariole mesure 1,28#177;0.25 mm et la croissance
folliculaire est constante et lente. A la fin de la vitellogenèse, la
longueur de l'ovariole s'accroît rapidement et atteint 5,05 #177; 0,067
mm. L'ovariole comporte, à ce stade 11 follicules (Tableau 04, figure
18). La longueur de l'ovariole et celle de son ovocyte basal peuvent
caractériser les différents stades de développement:
Le stade 1 correspond à un ovariole de 1,05 #177; 0,10
mm de long comportant 1 à 2 follicules basaux de 0,041#177; 0,018mm. Le
stade 2 qualifie l'ovariole de 1,32 #177; 0,21mm de long et comporte un
ovocyte basal de 0,089 #177; 0,03mm de long. C'est à ce moment que
commence le gonflement et la constriction entre l'ovocyte et la grappe de
trophocytes. Le stade 3 se caractérise par une longueur de la grappe de
trophocytes supérieure ou approximativement égale à celle
de l'ovocyte de 0,35 #177; 0,038mm; la longueur de l'ovariole mesure à
ce stade 1.64#177; 0,34 mm. Le stade 4 ou début de la
vitellogenèse apparaît à partir du 12ème
jour de l'âge adulte des ouvrières. Pour une longueur ovariolaire
de 2,98 #177; 1mm, celle de l'ovocyte basal est supérieur à 0,4mm
laquelle devient plus longue que celle de sa grappe de trophocytes. Durant le
dernier stades de la vitellogenèse (5), l'ovariole atteint 5,05 #177;
0,067 mm de long, ce qui correspond à un ovocyte basal de 1.30#177; 0.21
mm de long (Tab.2, fig.2)
Tableau 03 : Nombre
d'ovariole/ovaire/ouvrière
|
Mois
|
mars (n=120)
|
avril (n= 220)
|
mai (n=215)
|
|
poids des ouvrières
|
112,233 #177; 0,028
|
112,759 #177; 0,019
|
98,729 #177; 0,016
|
|
Nombre d'ovariole/ ovaire gauche
|
12,608 #177; 4,255
|
14,432 #177; 2,872
|
12,009 #177; 3,522
|
|
Nombre d'ovariole/ ovaire droit
|
11,275 #177; 4,290
|
13,114 #177; 2,833
|
10,879 #177; 3,522
|
|
Nombre d'ovariole / ouvrière
|
11,942 #177; 0,0245
|
13,773 #177; 0,0270
|
11,444 #177; 0,004
|
|
Nombre d'abeilles pourvues de
10 à 12 ovariole/ovaire
|
20/120
|
46/220
|
58/215
|
|
Nombre d'abeilles pourvues de
14 à 21 ovariole/ ovaire
|
62/120
|
120/220
|
75/215
|
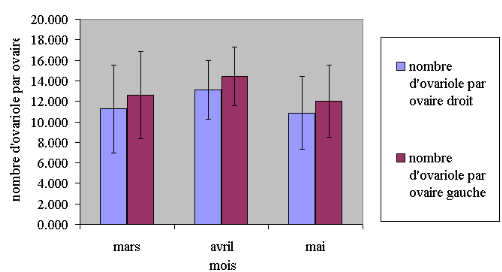
Figure 17 : Evolution du
nombre d'ovariole par ovaire droit et gauche (ANOVA, n=555, moyenne#177;
écart type)
Tableau 04 : Evolution de la longueur de
l'ovariole et de l'ovocyte basal correspondant (mm)
|
nombre de follicule/ ovariole
|
longueur de l'ovocyte basal
|
longueur de l'ovariole (mm)
|
|
1
|
0,026
|
0,91
|
|
2
|
0,056
|
1,10
|
|
3
|
0,088
|
1,20
|
|
4
|
0,093
|
1,45
|
|
5
|
0,123
|
1,63
|
|
6
|
0,187
|
1,84
|
|
7
|
0,28
|
2,24
|
|
8
|
0,35
|
3,10
|
|
9
|
0,65
|
3,31
|
|
10
|
0,98
|
4,10
|
|
11
|
1,15
|
5,71
|
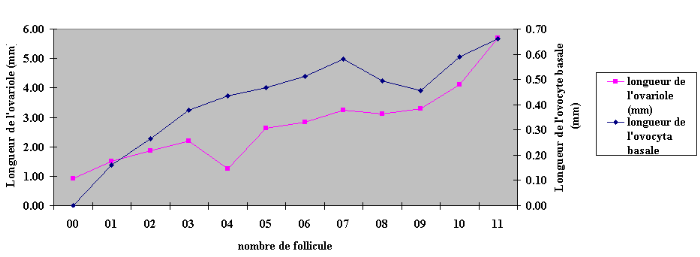
Figure 18 : Evolution de la longueur de
l'ovariole et de l'ovocyte basal (mm)
I-2- Caractérisation biométrique des stades
ovariens et leur pourcentage
Pour caractériser les stades ovariens, nous avons
calculé leur signification biométrique et évalué
leur pourcentage avec l'âge. La longueur de l'ovocyte basal de même
que le poids ovarien, ne sont pas significativement différents entre les
abeilles, en prévitellogenèse, âgées de 12 jours et
celles âgées de 18 jours ; par contre, ils sont très
significativement différents entre l'âges de 18 et 24 jours.
Pour les abeilles en vitellogenèse, il y une
différence significative dans la longueur de l'ovocyte basal mais pas
dans le poids ovarien entre les abeilles âgées de 12 jours et
celles âgées de 18 jours. Entre ces dernières et celles
âgées de 24 jours, il n'y a pas de différence
observée ni dans la longueur de l'ovocyte basal ni dans le poids
ovarien. Le stade de la fin vitellogenèse et celui de la maturation
ovocytaire ne sont pas significativement différents tant au niveau du
poids ovarien qu'au niveau de la longueur ovocytaire (Tableau 05, figure 20 a
et b).
Quant au taux des différents stades de
développement ovarien, le pourcentage des abeilles en
prévitellogenèse demeure en régression au profit de celui
des abeilles en vitellogenèse, et ce, avec la progression d'âge.
Finalement, à l'âge adulte de 18 jours, 22.53 #177; 6,4% des
abeilles sont en fin de la vitellogenèse et à l'âge de 24
jours 08,5 #177; 2,34 % arrivent à la maturation ovarienne (Tableau 05,
figure 18).
Dans l'ensemble, à l'âge de 6 jours, la
totalité des abeilles ouvrières orphelines sont en
prévitellogenèse (figure 18); leurs ovocytes basaux ont 0,049
#177; 0,058 mm de long (figure 19). Ce qui correspond à un poids ovarien
de 0,624 #177; 0,120 mg (figure 21).
A l'âge de 12 jours, 22,7 #177; 12,7 % des abeilles
sont en vitellogenèse (figure 19). Leurs ovocytes basaux mesurent 0.94
#177; 0,352 mm de long (figure 20) et leur poids ovarien est de 1,78 #177; 1,12
mg (figure 21). A l'âge de 18 jours, 22.52 #177; 5,3% des abeilles
atteignent la fin de la vitellogenèse ou stade 4 (fig.3). La longueur
de leur ovocyte basal est de 1,28 #177; 0,281 mm (figure 20 a) et le poids
ovarien est de 3.76 #177; 1,19 mg (figure 21).
Le 5 ème stade ou maturation ovocytaire est
atteint chez 08.25 #177; 2,34 % des ouvrières âgées entre
18 et 20jours (figure 19). La longueur de leurs ovocytes basaux est de 1,32
#177; 0,215 mm (figure 20). Ceci correspond à un poids ovarien de 4,25
#177; 1,25 mg (figure 21).
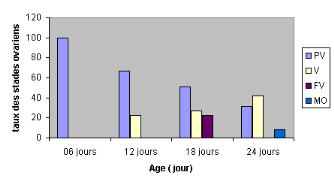
Figure 19 : pourcentage des stades
ovariens en fonction de l'âge
PV : le taux des abeilles en
prévitellogenèse diminue avec l'âge
V : le taux de
vitellogenèse atteint 42.10#177;5.4 à l'âge de 24 jours
FV : 22.52#177;5.3 des
abeilles sont en Fin de vitellogenèse à l'âge de 18
jours
MO : 8.25#177;2.34 des
abeilles atteignent la maturation ovocytaire à 24 jours
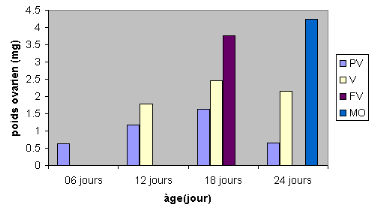
Figure 20 : Evolution du poids ovarien
à différents stades de développement du poids ovarien en
fonction de l'age.
PV :
prévitellogenèse
V : vitellogenèse
FV : Fin de
vitellogenèse
MO : maturation ovocytaire
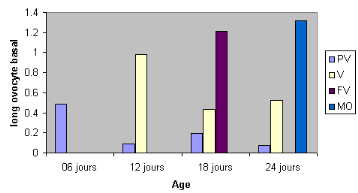
Figure 21 : Evolution de la longueur de
l'ovocyte basal à différents stades de développement en
fonction de l'âge
PV :
prévitellogenèse
V : vitellogenèse
FV : Fin de
vitellogenèse
MO : maturation ovocytaire
I-3- Longueur de l'ovocyte basal et poids ovarien tout
stade confondu
La longueur de l'ovocyte basal tout stade
confondu est significativement différente entre les abeilles
âgées de 6 à 12 jours, de 18 à 24 jours
(P<0.05) ; depuis l'âge de 12 jusqu'à 18 jours, il n'y a
pas de différence significative dans la longueur ovocytaire (P>0,05)
(Tableau 06, figure 22). Parallèlement, le poids ovarien tout stade
confondu est significativement différent entre les abeilles
âgées de 6 à 12 jours (P<0 .05). Par contre,
il n'y a pas de différence significative de poids ovarien entre celles
âgées de18 à 24 jours (P>0,05), (Tableau 05, figure 23).
À partir de la troisième semaine de la vie adulte des abeilles,
la moyenne de la longueur ovocytaire et celle du poids ovarien sont en
régression continue.
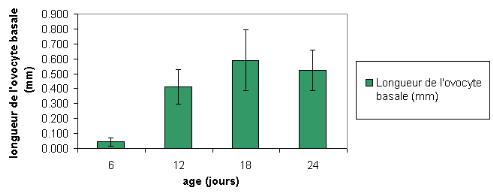
Figure 22 : longueur de l'ovocyte basal
tout stades confondu.
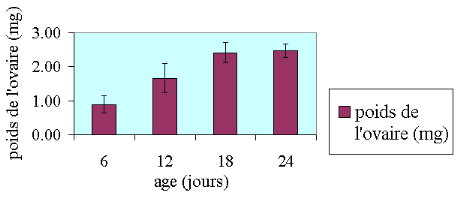
Figure 23 : poids
des ovaires tout stades confondu.
II-2-Discussion
Lors d'un orphelinage les ouvrières stériles
peuvent activer leurs ovaires et devenir des ouvrières pondeuses (PIRK
et al, 2002 ; SHELLEY et al, 2004 ; LUBBE, 2005).
Le développement ovarien passe par plusieurs stades identifiés
pour la première fois par HESS en 1942, ainsi le stade I période
de prévitellogenèse qui a lieu essentiellement dans le
germarium, qui comprend l'extrémité antérieure de
l'ovariole qui contient les cellules germinales et de leurs
dérivés (PATRICIO et GRUZ-LANDIM, 2002). Les ovarioles ont
l'aspect de deux filaments transparents, à ce stade ils ne sont pas
devisés en chambres (PAIN, 1961).
Le stade II considéré comme non
développé (FLEIG, 1995), à ce stade un étranglement
commence à apparaître au niveau du follicule.
Le stade III : est qualifié d'ovaire appartenant
à la classe 3 puisque les oeufs ont la forme d'une saucisse et sont plus
allongés, les ovocytes sont distincts, sont considérés de
degré II (KOUDJIL et DOUMANDJI, 2008).
Le processus vitellogénique commence à ce stade les
ovaires sont donc vitellogène avec des trophocytes en
développement (WHEELER et KAWOOYA, 1990)
Le stade IV : encore en vitellogenèse, l'ovaire est
mature avec au moins un oeuf (WHEELER et KAWOOYA, 1990). Le nombre de
follicules est de six à neuf follicules.
Le stade VI fin de vitellogenèse la croissance
folliculaire est maximale (GRUDU et GLUZZARO, 2008)
La phase de maturation ovocytaire est caractérisée
par la diminution du poids moyen chez les abeilles peut être
expliquée par la présence de 8.5#177;2.5% des ouvrières
ayant développé leurs ovaires de façon optimale ;
leurs poids ovarien est plus élevé mais non significativement de
celui des abeilles aboutissant à la fin de vitellogenèse (KOUDJIL
et DOUMANDJI, 2008).
Le développement ovarien est en fonction de la nourriture
durant le stade larvaire et adulte, ainsi des abeilles qui reçoit de
grandes quantités de protéines durant le stade larvaire et adulte
développent leurs ovaires de façon optimales (SHELLY et
al, 2005) ceci implique un pollen de qualité de haute valeur
nutritionnel (AUBERT, 2006) le pollen d'Aloé permet un
développement ovarien supérieure à celui du pollen de
tournesol (HUMMAN et al, 2007).
La régression ovarienne est observée chez Apis
capensis en présence des ouvrières pondeuses qui sont
beaucoup plus proche des reines que des ouvrières des autres races
(MONNIN et PETTER, 1977) et qui peuvent pondent des oeufs
parthénogénétiquement diploïdes par un processus
d'autofécondation (MORITZ et al, 2001).
L'acide -9-oxo-2- décénoique inhibe le
développement ovarien des ouvrières (CHAUVIN, 1966), ainsi les
ouvrières pondeuses du cap Apis capensis produit un bouquet
phéromonal dont l'acide -9-oxo-2- décénoique ou
phéromone mandibulaire des reines d'abeilles (RAABE, 2009).
La quantité de cet acide est en moyenne de 12.5 ug par
ouvrière du cap de quatre jours, ensuite la qualité a
augmenté continuellement pour atteindre chez les ouvrières
âgée de plus 100 jours une valeur moyenne de 413ug par
ouvrière du cap valeurs qui se situe dans la fourchette des
quantités trouvées chez les reines (HUMLING, 1979).
Table des matières
Remerciement
Dédicaces
Résumé
Abstract
ãáÎÕ
Introduction
Partie bibliographique
CHAPITRE I : BIOLOGIE DES
ABEILLES
3
I- Généralités
3
I-1- Définition
3
I-2-Taxonomie
3
I-3) Répartitions géographiques des
abeilles mellifères en Algérie
4
II- la colonie d'abeilles
4
II-1- Définition
4
II-2-Les membres de la colonie
5
II-2-1-La reine
5
II-2-1-1- Morphologie
5
II-2-1-2- Appareil reproducteur
5
II-2-2- L'ouvrière
6
II-2-2-1- Morphologie
6
II-2-2-2- Appareil reproducteur
6
III- Nutrition des abeilles
7
III-1-Nutrition des larves d'ouvrières
7
III-1-2-Nutrition des larves de reines
8
III-2-Nutrition des jeunes abeilles et des abeilles
adultes par les plantes mellifères
8
III-2-1-Définition des planes
mellifère
8
III-2-2-Les principales plantes mellifères
en Algérie
8
III-2-2-1-Le nectar
9
III-2-2-2-Le pollen
9
CHAPITRE II: DEVELOPPEMENT OVARIEN CHEZ
L'ABEILLE "APIS MELLIFERA"
11
1- La reproduction des insectes
11
2- La fécondation
11
I- L'ovogenèse
12
I-1- L'ovaire et son fonctionnement
12
I-2- Les étapes de l'ovogenèse
13
I-2-1- Différenciation des ovocytes et des
trophocytes
13
I-2-2- Vitellogenése
13
I-2-3- Ovulation
14
I-3- Contrôle endocrine de
l'ovogenèse
14
I-3-1- Contrôle endocrine de la
vitellogenése
14
I-3-2- contrôle endocrine des premiers stades
de l'ovogenèse
16
II- Nutrition et développement des organes
sexuels adulte
16
III- Développement chez l'abeille
ouvrière «Apis mellifera»
17
III-1-cycle biologique de l'abeille
ouvrière
17
III-1-1- L'oeuf
18
III-1-2- La larve
18
III-1-3- La nymphe
18
III-2- l'effet de la phéromone
18
III-2-1- Définition de la
phéromone
18
III-2-2- Localisation de la phéromone
19
III-2-3- Action de la phéromone
19
III-2-4- Autres phéromones
19
IV-3- L'ouvrière Pondeuse
20
II-4-3-1- la ponte des ouvrières
20
II-4-3-2- l'ovaire des ouvrières
20
Partie pratique
CHAPITRE I : MATERIELS ET
METHODES
21
1- Recherche du couvain naissant
21
2-l'émergence
21
3- description des cagettes
22
4- nourriture
23
5- candi
23
6-L'élevage
23
7- La mortalité
24
8-prélèvement des abeilles
24
9- Pesage des abeilles
24
10- dissection des abeilles
24
Matériels et réactifs
24
Méthodes
26
La dissection
26
Biométrie des ovaires
27
Conclusion
Annexes
Références bibliographiques
| 


