
 |
Validation de procédé de production d'antigène viral sur culture cellulaire BHK21( Télécharger le fichier original )par Ghaith Ben Messaoud Institut supérieur des technologies médicales de Tunis - Licence appliquée en biotechnologies médicales 2013 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||
Le virus de la rubéole contient deux types de protéines: ? Protéines structurales
6
? Protéines non structurales
ISTMT-IPT 2012-2013
7
Le rôle des protéines de la rubéole a été démontré à partir de cellules infectées par le virus. Les premières études ont montré plusieurs protéines de poids moléculaire 200, 150, 87, 75 et 27 kDa dans les cellules infectées par le virus.
Des travaux plus récents ont révélé que la protéine de 200 kDa est un précurseur de polyprotéine qui est clivée pour produire deux produits, de 150 et 90 kDa.
? Produit 150 a une activité enzymatique protéase.
? Produit 90 a une activité hélicase et réplicase.
De plus, il y a présence d'une courte région de fonction inconnue dite motif X et un acide aminé (méthyltransférase).
Ainsi l'ordre des gènes du virus pour la 5'OFR est 5'-méthyl-X-protéase-hélicase-réplicase-3' (Lee et al., 2000).
? Protéine de capside C
La protéine de capside est une protéine non glycosyléé, phosphorylée. Sa masse moléculaire est entre 33 à 38 kDa. La protéine de capside C contient des clusters de résidus proline et arginine de nature basique qui sont impliqués dans leur liaison avec l'ARN génomique du virus formant ainsi les nucléocapsides virales. L'interaction de la protéine de capside avec l'ARN viral ne peut pas être uniquement dépendante de la densité des résidus basiques parce que d'autres régions de base au sein de la protéine ont été trouvées pour lier mal. Dans le génome du virus de la rubéole 29 nucléotides tronçon (nucléotide 347 à 375) interagissent avec la protéine de capside (Lee et al., 2000).
? Protéines membranaires E1 et E2
Les protéines de l'enveloppe du virus sont E1 et E2, ces protéines sont des glycoprotéines membranaires.
La glycoprotéine E1 du virus a une masse moléculaire de 58 kDa, alors que la glycoprotéine E2 est hétérogène de 42 à 47 kDa.
E1 contient trois sites de N- glycosylation pour toutes les souches alors que le nombre de sites de N-glycosylation de la protéine E2 semble varier selon la souche.
ISTMT-IPT 2012-2013
8
Le rôle majeur de la N-glycosylation sur l'antigénicité et l'immunogénicité d'E1 a été étudié. Les études dans lesquelles E1 a été exprimé dans Escherichia coli ont indiqué que la glycosylation peut être nécessaire pour le repliement d'E1.
Les fonctions des protéines E1 et E2 ont été largement étudiées en utilisant des anticorps monoclonaux, il a été montré que la protéine E1 contient au moins six épitropes différents, dont certains sont liés à l'hémagglutination et de neutralisation. E1 apparaît comme la protéine de surface principale, avec des domaines impliqués dans la fixation du virus à la cellule.
La fonction de E2 n'est pas encore totalement déterminé mais E2 contient hémagglutination partielle et épitopes neutralisants (Lee et al., 2000).
Le virus de la rubéole est le seul virus dans la famille des Togaviridae à avoir un génome qui contient un seul brin d'ARN de polarité positive, son génome est d'environ 10 kilobase (kb) (Yumei et al., 2007), soit environ 9764 nucléotides.
Le génome contient deux trames de lecture (ORF):
? ORF 5' proximal codant pour 2 protéines non structurales est qui sont p150 et p90. L'ORF 5' proximal contient environ 6345 nucléotides.
? ORF 3' proximal codant pour les trois protéines structurales E1, E2 qui sont les protéines de l'enveloppe et enfin C qui est une protéine de la capside. L'ORF 3' proximal contient environ 3189 nucléotides. Ainsi l'ordre des gènes pour l'ARN 40S (coefficient de sédimentation) est 5'-p150-p90-C-E2-E1-3'. Le génome du virus de rubéole a un contenu élevé en G + C de 69%, le plus élevé de tout virus connu jusqu'à ce jour l'ARN (Lee et al., 2000).
Le génome contient également des régions non transcrites (UTR) à son extrémité 5' et 3' et entre les ORF (la région de jonction) (Yumei et al., 2007).
ISTMT-IPT 2012-2013
9
Figure 5: Représentation du génome de la rubéole (Bienvenu et al., 2004)
Les effets de la réplication du virus de la rubéole sur la cellule hôte est dépendante du type de cellules infectées. Ainsi, il faut être prudent de ne pas extrapoler d'une lignée cellulaire à l'autre, et plus important encore, de la réplication du virus de la rubéole dans des lignées cellulaires à la réplication du virus de la rubéole chez les humains.
La fixation du virus de la rubéole à des récepteurs cellulaires se produit probablement par l'intermédiaire des sites de liaison sur l'E2 et / ou E1 glycoprotéines moléculaires, même si le récepteur cellulaire du virus de la rubéole n'a pas été identifié pas plus que le site récepteur de liaisons sur une ou les deux glycoprotéines (Banatvala et al., 2007).
La pénétration du virus dans la cellule se fait par le phénomène d'endocytose et relargue sa nucléocapside dans le cytosol. La réplication du virus se fait dans le cytoplasme. Après le phénomène de décapsidation, les deux tiers 5' terminaux de l'ARN 40S se traduisent en polypeptides non structuraux nécessaires à la synthèse de l'ARN complémentaire de polarité négative.
Cette étape donne naissance à des ARN double brins, les intermédiaires de réplication. L'ARN messager 24S est après traduit en protéine C et les glycoprotéines E1 et E2 qui sont essentiels et entrent dans la structure des nouveaux virions. La protéine C se combine
ISTMT-IPT 2012-2013
10
ISTMT-IPT 2012-2013
11
ISTMT-IPT 2012-2013
12
à L'ARN 40S formant ainsi la nucléocapside. Le virus acquière son enveloppe par le phénomène de bourgeonnement à partir des membranes intracellulaires ou plasmiques de la cellule cible. L'enveloppe est faite des lipides des cellules hôtes et des glycoprotéines E1 et E2 hérissant ainsi l'enveloppe sous forme de spicule (Denis, 1999).
Figure 6: Réplication du virus de la rubéole (Bienvenu et al., 2004)
Les immuglobulines M (IgM) spécifiques apparaissent après quelques jours de l'infection et sont suivies par l'apparition des immuglobulines G (IgG).
Le taux d'IgM augmente jusqu'à un maximum dans les 10 premiers jours puis ce taux diminue pour devenir presque négligeable après quelques semaines.
L'augmentation rapide des IgM spécifique est utile pour diagnostiquer l'infection. Les IgG vont être maximales en même temps que les IgM et persistent plusieurs années, de même pour les immuglobulines A (IgA) qui sont détectables dans le sérum et dans les sécrétions naso-pharyngées.
L'immunité cellulaire précède l'apparition des anticorps de quelques jours, est atteint un maximal au même moment de l'apparition des anticorps. Elle reste détectable plusieurs années (Collier et al., 2004).
La réponse immunitaire contre la rubéole et d'autres virus implique le traitement de peptides viraux et leur présentation à la fois CD8+ lymphocytes T cytotoxiques (CTL) restreints par des allèles HLA (Human leukocyte antigen) de classe I et de cellules T CD4+ restreints par des allèles HLA de classe II (Ovsyannikova et al.,2009).
Figure 7: Cinétique d'apparition des anticorps lors d'une infection et réinfection rubéolique ( www.microbe-edu.org)
Le virus se propage par un contact direct entre les humains (voie respiratoire). La rubéole est une maladie qui touche surtout les enfants.
Cette maladie est cosmopolite et épidémique qui se propage le plus souvent au printemps à cause du climat. Elle varie en fonction de l'âge la zone géographique et surtout le programme de vaccination dans les pays. Dans les pays tropicaux l'infection par cette maladie survient chez les enfants à un âge précoce.
Au 19éme siècle l'épidémie de la rubéole était beaucoup plus fréquente avec des conséquences dramatiques. Au Etats-Unis la rubéole a engendré 12,5 million de cas, et 20000 enfants sont nés avec un syndrome de rubéole congénitale entre 1964 et 1965.
En 1969 cette épidémie a connu une chute importante en raison des compagnes et la politique de vaccination de certains pays comme l'Australie, Finlande, France, Grande Bretagne, Suède (Denis, 1999).
Il n'existe pas de traitement curatif de la rubéole.
Aucun traitement préventif n'a fait la preuve de ses efficacités après le contage. Les gammaglobulines sont inefficaces.
La prévention repose donc sur la vaccination:
? Vaccination de tous les enfants a partir de l'âge de 12 mois, avec rappel entre 3 et 6 ans dans le but d'atteindre une couverture vaccinale supérieur a 95%.
? Vaccination de rattrapage systémique de tous les enfants non vaccinés antérieurement entre 11 et 13 ans.
? Vaccination des femmes non immunisées doit se faire (chez la femme la sérologie de la rubéole est obligatoire pour le certificat prénuptial. Pour les femmes enceintes séronégatives, la vaccination doit être faite après l'accouchement (Anglaret et al., 2002).
Le premier vaccin contre le virus de la rubéole a été fait en 1969.Une seule dose du vaccin entraine des taux d'anticorps chez prés de 95% des personnes sensibles. Ces taux d'anticorps persistent au moins 18 ans chez plus de 90% des personnes vaccinées.
Le vaccin contre la maladie de la rubéole est souvent bien toléré. Des effets indésirables peuvent survenir au cours de la vaccination comme le rash (éruption), l'adénopathie, l'arthrite et la fièvre.
Parmi les contre indications à la vaccination contre cette maladie, on peut trouver la présence de maladie fébrile, l'immunodéficience, les antécédents de réaction anaphylactique à la néomycine et la grossesse.
Le virus vivant atténué de la rubéole dans le vaccin peut traverser le placenta et infecter le foetus mais aucun cas d'embryopathie rubéolique n'a été signalé chez les enfants dont les femmes ont été vaccinées au cours des premiers mois de la grossesse.
ISTMT-IPT 2012-2013
13
Le vaccin peut être administré avec toute sécurité en période postpartum, aux femmes allaitante, il peut aussi être administré aux enfants de femmes enceintes (Dontigny et al., 2008).
La souche BHK21 (baby hamster kidney ) a été isolée à partir du rein de hamster syrien. Elle possède plusieurs caractéristiques et propriétés qui font d'elle un support génétique facile dans son utilisation:
? Elle doit être facilement clonable afin d'obtenir des lignées provenant d'une cellule isolée.
? Elle doit posséder une hérédité stable, qui évolue peu au cours des divisions successives.
? Elle se cultive à la fois en tapis et en suspension.
Le caryotype de la souche BHK21 est stable. Il est très proche de celui de l'animal. Cette souche possède en total entre 43 à 44 chromosomes dans son caryotype assez difficile à distinguer par les techniques de coloration homogène.
Les conditions optimales de clonage correspondent à un pH de 7,2 et une température de 37°C.
Les milieux MEM et 199 ne permettent pas un clonage correct de la souche BHK21 (efficacité d'étalement inférieure à 1/100). Seul le milieu MEM complémenté avec les acides aminés non essentiels permet cette croissance clonale en présence de sérum foetal bovin. Le temps de dédoublement des cellules est 14 heures (Caboche et al., 1973).
Les cellules BHK21 se multiplient rapidement au cours de 48 premières heures et font une couche complète et confluente pour une incubation de 72 heures (Rahman et al., 2007).
La multiplication du virus se fait dans le cytoplasme. L'ARN du virus va servir de messager. Il y a formation d'un intermédiaire de réplication. L'ARN est encapsidé et les virions acquièrent leur peplos par le phénomène de bourgeonnement grâce à la membrane
ISTMT-IPT 2012-2013
cytoplasmique ou dans les vacuoles intracytoplasmiques et libérées dans le milieu extérieur.
L'hémagglutinine présenté sur le peplos apparait sur les bourgeons de la membrane cytoplasmique. Dans ce cas il est possible de faire une hemadsorption surtout sur les cellules VERO (lignée cellulaire provenant de rein de singe cercopithèque) ou BHK21 (Huraux et al., 1991).
Figure 8: Détection du virion de la rubéole dans
les cellules BHK21 (Risco et al., 2003) Figure 9: Cellules VERO et BHK21 infectées par
le virus de la rubéole. (Risco et al., 2003)
14
La recherche du virus de la rubéole ne se fait que dans les laboratoires de virologie de haute technologie, elle est limitée au diagnostic anténatal. Elle s'effectue soit par isolement sur culture cellulaire soit par technique RT-PCR simples ou multiplex.
Le diagnostic sérologique repose soit sur la présence d'IgM antivirus de la rubéole sans ou avec les IgG soit sur la séroconversion ou ascension du titre des anticorps IgG ou totaux. La recherche des anticorps anti rubéoliques fait appel au titrage des anticorps par inhibition de l'hémagglutination, méthode ELISA indirecte ou immunocapture qui permet la différenciation entre les IgG et IgM. La détermination de l'avidité est aussi appliquée au
ISTMT-IPT 2012-2013
15
laboratoire spécialisé pour faire la différence entre la primo-infection (infection acquise) ou réinfection (Gaudelus, 2008).
Le virus de rubéole peut se propager dans des cultures de tissu mais ne donne pas un effet cytopathique (ECP).
Toutefois dans la culture du virus de la rubéole certains cellules produisent une cytopathologie suffisante détectable par les observateurs expérimentés (Jawetz et al., 1973).
On cite ci-dessous quelques lignées cellulaires animales pour la culture de virus de la rubéole:
· BHK 21: de Stoker et Macpherson. C'est une lignée cellulaire qui provient des reins de bébé hamster, cette lignée a subi plusieurs transformations et a été clonée plusieurs fois. Certains clones ont donne un ECP alors que d'autre permettent d'obtenir un titre élève d'hémagglutinine.
· RK13: c'est une lignée de reins de lapin.
· SIRC: lignée issu de cornée de lapin établie par Leerhoy du sérum Institut de Copenhague.
· VERO: lignée cellulaire provenant de rein de singe cercopithèque.
Dans la pratique on utilise surtout:
· RK13 et SIRC pour l'isolement du virus, ces lignées donnent un ECP total et rapide.
· BHK21 et d'autre lignée comme PS-Y155 (lignée cellulaire de rein de porc) ou
lignée de reins de singes BSC1 pour la
préparation et le titrage de
l'hémagglutinine.
La culture in vitro a permis de comprendre plusieurs phénomènes sur la pathogénicité de la rubéole (Maurin, 1984).
La détection du génome viral est réalisée soit par hybridation moléculaire directe ou par la méthode d'amplification génique (méthode de PCR: Polymerase Chain Reaction).
ISTMT-IPT 2012-2013

16
C'est en 1986 que Terry et al ont rapporté le premier essai de diagnostic anténatal de l'infection rubéolique par hybridation moléculaire.
? L'hybridation moléculaire directe repose sur l'utilisation de sonde localisée dans la région 3' du gène E1. Cette hybridation permet de détecter 1 à 2 pico-gramme d'ARN.
? D'autres auteurs ont mis au point la méthode d'amplification génique en utilisant des amorces dans le gène E1.
Toutes ces techniques nécessitent la validité sur un grand nombre de prélèvements.
? La recherche d'ARN viral par PCR nichée (Nested PCR) semble avoir une excellente sensibilité (détection d'une a deux copies d'ARN). Elle se fait a partir de la de villosité choriale, du placenta ou du produit d'avortement (Denis, 1999).
? La méthode Reverse Transcriptase PCR (RT-PCR) a été développée et évalué pour la détection de l'ARN du virus de la rubéole directement prélevé à partir d'échantillons cliniques en utilisant des amorces qui ont amplifié 592 nucléotides, d'une région variable dans le gène E1.
La sensibilité de la PCR a été jugée équivalente à celle des essais déjà publiés, qui amplifient les petites régions du gène E1 (Cooray et al., 2006).
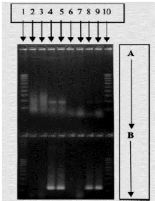
Figure 10: Technique de détection de l'infection rubéolique a partir du liquide amniotique
de foetus par PCR et électrophorèse RT-PCR(A),Nested PCR(B) (Bienvenu et al.,2004)
ISTMT-IPT 2012-2013

17
L'ultracentrifugation en gradient de densité de saccharose a permis la séparation des immunoglobulines (IgG et IgM) et de résoudre le problème chez la femme enceinte ayant en début de grossesse une suspicion de contamination rubéoleuse (signes cliniques et/ou anticorps à titre élevé). La présence d'IgM spécifique de la rubéole dans le sang du sujet indique qu'il y a une affection récente, alors que leur absence est en faveur d'une réponse du type secondaire chez un individu anciennement protégé. En plus des IgM, il y a habituellement présence d'IgG à titre supérieur.
La valeur de cet examen apparaît certaine, mais les IgM n'étant pratiquement plus décelables après un mois, dans le sang de la femme ne doit pas excéder cette valeur si on veut disposer de résultats interprétables ( Maurin et al., 1973).
La mesure de l'avidité des IgG peut aider à dater l'infection (Picone et al., 2005).
On a montré que le test d'avidité des IgG est utile pour différencier entre une récente ou ancienne infection de la rubéole ou une réinfection, elle est particulièrement utile pour étudier la rubéole chez les femmes enceintes (Mubareka et al., 2007).
Les techniques d'ELISA (Enzyme-Linked-Immuno-Sorbent-Assay) sont des techniques sensibles et faciles à réaliser. La stabilité du virus (stabilité génétiques) fait que ce test sérologique est fiable (Ellakhdi et al., 2009).
La technique a été appliquée avec succès pour la détection des anticorps spécifiques de la rubéole.
? Presque les kits ELISA IgG spécifiques pour la détection de la rubéole sont tous disponibles dans le commerce et de type indirect, en utilisant l'antigène (Ag) de la rubéole fixé à une phase solide (microplaque de polystyrène des plaques ou des billes en plastique). La source de l'antigène (peptide, l'antigène du virus recombinant ou entier) affecte la sensibilité et la spécificité du test. Après le lavage et l'élimination des antigènes non liés, le sérum dilué est ajouté et incubé avec l'antigène immobilisé. Les anticorps spécifiques de la rubéole présents dans le sérum se lient à l'antigène. Ensuite, les anticorps non liés sont éliminés par lavage
ISTMT-IPT 2012-2013

18
et un anti-IgG humain conjugué à enzyme est ajouté pour l'incubation. La quantité du conjugué qui se lie à chaque puits est proportionnelle à la concentration de l'anticorps de la rubéole spécifiques présents dans le sérum du patient. Les plaques sont ensuite lavées et le substrat est ajouté, il en résulte un développement de la couleur. La réaction enzymatique est arrêtée après une courte période d'incubation, et la densité optique est mesurée par un instrument lecteur ELISA.
? Les kits ELISA IgM disponibles dans le commerce pour la détection des IgM contre la rubéole spécifiques sont principalement de deux types:
A. ELISA indirecte: Le principe de l'essai a été décrit ci-dessus pour la rubéole IgG, sauf pour l'utilisation de l'enzyme et l'anti-IgM humain étiqueté comme conjugué. Dans cet essai, des résultats faux négatifs peuvent se produire en raison d'une concurrence dans le dosage entre les anticorps IgG spécifiques avec une forte affinité, tandis que l'IgM spécifiques à une plus faible affinité pour l'antigène.
B. ELISA IgM de capture: Dans ces essais l'anticorps anti IgM humain est fixé à la phase solide pour la capture des IgM sériques. L'antigène du virus de la rubéole est lié à un anticorps marqué par une enzyme pour détecter le complexe anticorps-antigène. Ce type d'essai permet d'éliminer la nécessité d'un prétraitement de l'échantillon avant le dosage (Mendelson et al., 2006).
Les billes de latex, gélatine ainsi que le globule rouge peuvent jouer le rôle de particules révélatrices de la présence des anticorps qui vont agglutiner les antigènes recouvrant leur surface. Le recours à l'agglutination dépend de la disponibilité de l'antigène purifié (Chapel et al., 2004).
Les tests d'agglutination au latex sont particulièrement utiles pour les laboratoires de soins de santé primaires, car ils sont simples et les résultats sont faciles à interpréter. Depuis 1982, plusieurs études comparatives des tests commerciaux d'agglutination au latex pour la détection des anticorps de la rubéole ont été signalées ( León et al, 1988).
La sensibilité et la spécificité du test d'agglutination au latex étaient de 100% et 94% (Weissfeld et al., 1982).
ISTMT-IPT 2012-2013

19
Dans le test d'hémolyse radiale pour les anticorps spécifiques du virus de la rubéole, les sérums obtenus peu après la primo-infection produisent une perturbation appelée «hémolyse ménagée». L'hémolyse ménagée est provoquée par un anticorps IgG contre le virus de la rubéole et représente un nouveau principe de sérodiagnostic. Cette technique, a coté du dosage des IgM, permet le diagnostic rapide de la rubéole récente, sur un échantillon unique de sérum (Hedman et al., 1986).
La neutralisation du virus est définie comme la perte de pouvoir infectieux due à la réaction d'un virus avec un anticorps spécifique.
La neutralisation peut être utilisée pour identifier le virus isolé ou comme dans le cas du diagnostic de rubéole de mesurer la réponse immunitaire au virus.
Comme un test fonctionnel, la neutralisation s'est avérée très sensible, technique spécifique et fiable, mais elle ne peut être réalisée que dans des laboratoires de virologie qui comprennent seulement une petite fraction des laboratoires effectuant la sérologie de la rubéole (Mendelson et al., 2006).
Le principe de la technique de fixation du complément repose sur le principe que le complément est fixé puis activé par le complexe antigène-anticorps. Après la décomplémentation du sérum à tester (pour éliminer toute source non contrôlée du complément), ce dernier est mis en présence de l'antigène viral à étudier avec une quantité définie de complément de cobaye. La réaction est révélée par l'ajout d'un second couple antigène-anticorps constitué de globules rouge revêtus d'anticorps anti-globule rouge. Si le sérum ne contient pas l'anticorps spécifique du virus à étudier le complément pout se fixer sur le second couple et entraine la lyse des globules rouges, mais si le complément est consommé par le premier couple et les globules rouges restent intacts. Ainsi l'hémolyse signifie l'absence d'anticorps (Mammette, 2002).
Les antigènes spécifiques de la rubéole utilisés pour la fixation du complément ont été synthétisés dans des cultures tissulaires de cellules RK-13 (Rabbit kidney) et des cultures primaires de rein de singe vert africain.
ISTMT-IPT 2012-2013

20
Les anticorps qui fixent le complément apparaissent chez des patients atteints de rubéole peu de temps après la fin de l'éruption et persistent pendant au moins 8 mois (Sever, et al., 1965).
Jusqu'à maintenant, l'évaluation de l'immunité contre la rubéole et son diagnostic ont été effectués principalement par le test d'Inhibition d'hémagglutination (IHA) qui est basé sur la capacité du virus de la rubéole, à agglutiner les globules rouges. Le test IHA est un travail intensif, et est actuellement réalisé principalement par des laboratoires de référence. IHA est le «gold standard» de test sur lequel la quasi-totalité de dépistage de la rubéole et d'autres tests de diagnostic sont mesurés. Pendant le test, l'agglutination est inhibée par la liaison d'anticorps spécifiques à l'agglutinine virale. Les titres sont exprimés comme la plus haute dilution inhibant l'hémagglutination dans des conditions d'essai normalisées (Mendelson et al., 2006).
Les globules rouges humains, ou ceux d'autres animaux peuvent agglutiner le virus à différentes quantités. Le virus peut être identifié par l'hémagglutination qui est une méthode quantitative, rapide et peu couteuse. Ce test mesure le nombre total de particules virales présentes et peut servir à mesurer la quantité d'anticorps spécifiques (Jawetz et al., 1973).
? Le développement des tests d'hémagglutination et inhibition de l'hémagglutination pour le virus de la rubéole a fourni des outils précieux pour la détection des anticorps dirigés contre ce virus. Ces tests sont plus rapides et plus faciles à réaliser que le test de neutralisation pour la détection des anticorps par fluorescence, elles fournissent des informations plus fiables sur la sensibilité que ceux du test de fixation du complément (Auletta, et al., 1968).
. 1
eerie
1
·4°e t des

0
ISTMT-IPT 2012-2013

21
Pour réussir le procédé de culture de l'hémagglutinine rubéolique il faut d'abord réussir le
procédé de stérilisation et désinfection du laboratoire (local et matériel):
? Désinfection du laboratoire
? Stérilisation du matériel (Les équipements doivent être nettoyés et entretenus
régulièrement)
? Contrôle de stérilité
C'est l'étape primordiale, et la plus essentielle.
La stérilisation avec l'alcool 95% ou l'éthanol à 70% est utilisé pour nettoyer et désinfecter les paillasses et les équipements du laboratoire (Microscope inversé, Hotte, Bain marie, Appareil Roller, Etuve).
Le formol a été mis dans l'eau chaude (10 ml de formol ont été mises dans 500ml d'eau bouillie) pour stériliser le laboratoire. La vapeur de formol dégagée va assurer une stérilisation presque totale de tout le laboratoire et même des équipements (Hotte, Appareil Roller, Bain marie, Etuve) qui sont en fonctionnement ou à porte ouvertes.
Un contrôle de stérilité sur boites de pétris contenant la gélose nutritive est nécessaire pour s'assurer de la stérilisation des surfaces et de l'atmosphère.
Les flacons, verreries, tubes et bouteilles Roller utilisés lors de la culture cellulaire doivent être lavés et stérilisés.
Tout le matériel utilisé a été lavé par un détergent ou désinfectant, séché dans un four à 60°C avant d'être stérilisé.
La stérilisation du matériel est obligatoire. Elle peut se faire de deux manières: ? Stérilisation par la chaleur sèche
? Stérilisation par la chaleur humide
ISTMT-IPT 2012-2013
La stérilisation par la chaleur sèche se fait grâce au four Pasteur. Les verreries, bouteilles Roller, tubes et flacons en verre pyrex sont mises 1h à 200°C au four.
La méthode de stérilisation par la chaleur humide est assurée par l'autoclave.
Tout le matériel (verrerie, tubes, flacons et bouteilles d'eau distillée...) est mis dans l'autoclave pour une stérilisation à 120°C pendant 30 min (le cycle dure 2h tenant compte du temps de chauffage et de refroidissement de l'autoclave).
Le matériel utilisé, les solutions de contrôle de stérilité (Thioglycolate et Bouillon Trypto caséine de soja) et Tryptose phosphate passent par un seul cycle d'autoclavage avec des températures différentes suivant la notice des milieux de culture.
I.3. Contrôle de stérilité du localAprès la désinfection, la gélose nutritive a été répartie dans des boites de pétris. Les boites contenant le gel sont placées semi ouvertes sur les paillasses et les équipements de culture (Etuve, Appareil Roller, Hotte) pendant 30 min puis incubées dans l'étuve à 37°C pendant 14 jours avec lecture tous les 24 h pour s'assurer de la stérilité du matériel et du local. |
|
|
Figure 11: Contrôle de stérilité |
|
|
||
· Bain marie(JOUAN)
· Microscope (CK Olympus
TOXKYO)·
22
Roller (WHERTON 753680)
· Centrifugeuse (sigma 3K30)ISTMT-IPT 2012-2013
|
|
||
· Plaque de microtitration
· Plaque ELISA· Micropipette multicanaux
· Polyéthylène glycol: PEG6000
· Chlorure de sodium 1M: NaCl· Tampon Glycine (1M, pH=10)
· Di-éthyle Ether· Solution Tween 80
· Tampon GGB· Tampon Tacetal (Tampon Acide +Tampon Alcalin)
· Tampon de lavage PBS-Tween (phosphate buffered saline-Tween)
· Tampon Carbonate/Bicarbonate (0,1M, pH=9,6)
· Tampon de saturation PBS-Tween-Gélatine 5%
·

23
Conjugué anti IgG humain
· Substrat chromogène OPD (Orto-
Phénylène Diamine)· Solution d'arrêt (acide sulfurique H2SO4 4N)
Le milieu DMEM (LONZA lab. LOT N 2MB103 CAT BE12-604f) est un milieu de culture cellulaire nécessaire au maintien et à la prolifération des cellules BHK21.
Il s'agit d'un milieu avec L Glutamine et 4.5g de glucose. Il contient plusieurs composantes comme les vitamines, les acides aminés et des sels inorganiques. Nous avons ajouté au milieu DMEM plusieurs autres Figure 12: Milieu DMEM
ISTMT-IPT 2012-2013
éléments comme l'antibiotique (pénicilline et streptomycine), le sérum de veau foetal et la tryptose phosphate, ce qui va favoriser la croissance cellulaire. Le milieu DMEM est utilisé à différentes concentrations: 0%, 2%, 5% et 10% sérum de veau foetal (SVF) (annexe 1) selon les étapes de la culture cellulaire ou au cours de l'inoculation du virus. Lors de la culture cellulaire le milieu DMEM est conservé à +4°C (Le milieu doit être conservé au froid et l'abri de la lumière).
? Sérum de veau foetal (SVF)
La présence de sérum est indispensable pour la croissance des cellules.
Figure 13: SVF
Le sérum de veau foetal (SVF) (GIBCO BRL Cat No 10106-060 lab .LOT N40G8843F) possède divers facteurs de croissance qui permettent la prolifération cellulaire, des hormones, des protéines, des facteurs d'attachement, comme la fibronectine, qui contribuent à une bonne adhésion, indispensable à la division cellulaire, et assure un rôle protecteur.
Le SVF est d'abord décomplémenté à 55°C pendant 30 min pour éliminer son action toxique sans détruire les protéines.
Le sérum doit être conservé à -20°C et à +4°C après de son utilisation.
? Solution d'antibiotique (ATB)
Figure 14: Antibiotiques
24
Les antibiotiques (ATB) (annexe 1) utilisés sont la pénicilline G et la streptomycine. La pénicilline G (Pharmachim Bulgaria Lot NO 702321.1H) est utilisée contre les contaminations bactériennes surtout par les bactéries Gram positives alors que la streptomycine (Pharmadrug Production GmbH, Lot NO 4140) agit sur certains bacilles Gram négatifs et certaines cocci Gram positives.
Ces deux ATB sont fournis sous forme de poudre. Ils sont préparés sous forme de mélange dans 100ml d'eau distillée.
ISTMT-IPT 2012-2013
Cette solution d'ATB est utilisée pour réduire le risque de contamination dans la culture cellulaire.
Les solutions d'antibiotiques sont conservées à +4°C.
|
|||
|
|||
La trypsine (GIBCO BRL lab.lot N3055949 Cat N25300-054, flacon de 100ml) est une enzyme utilisée en culture cellulaire pour détacher des cellules adhérentes sur les flasques de culture.
Figure 16: Trypsine
Le traitement par la trypsine affecte un peu la viabilité des cellules. C'est pourquoi l'action de la trypsine doit être limitée et inhibée par l'ajout du SVF.
Cette solution est conservée à -20°C et à +4°C après son utilisation. La trypsine est activée à 37°C.
La stérilisation du milieu de culture est un procédé important. Cette étape nous permet d'éviter la contamination du milieu. (Elle se fait sous hotte).
25
Le milieu DMEM doit subir une stérilisation à froid. La pression exercée par la bouteille d'azote pousse le milieu DMEM à travers 2 membranes filtrantes de 0,45 et 0,22 um. Ces deux membranes empêchent le passage des microorganismes.
ISTMT-IPT 2012-2013
26
Après la filtration, le milieu DMEM doit être reparti dans des flacons et conservé à +4°C.
Le milieu de culture DMEM (0%, 2%, 5% et 10% SVF) et les autres additifs doivent subir un test de stérilité avant d'être utilisé en culture cellulaire.
1 ml de chaque lot (milieu DMEM et des additifs) est ajouté dans 5ml des milieux de contrôle de stérilité (Thioglycolate, Bouillon Trypto-caséine soja et gélose sabouraud) avec un témoin de chaque solution. La lecture des tubes pour la vérification de la contamination se fait pendant 14 jours à 37°C dans l'étuve.
Figure 17: Contrôle de stérilité du milieu de culture et additifs
? Bouillon Trypto- caséine soja
Le Bouillon Trypto-caséine soja (BIOKAR Lot/Batch 9M577) (annexe 2) permet de détecter et révéler une contamination par des germes aérobies.
La lecture pour le contrôle de stérilité se fait quotidiennement pendant 14 jours.
? Thioglycolate
Le bouillon Thioglycolate (Scharlau Ref.03-187) (annexe 2) est utilisé pour le contrôle et la détection d'une éventuelle contamination par les bactéries anaérobies.
La lecture pour le contrôle de stérilité se fait aussi quotidiennement pendant 14jours.
? Gélose Sabouraud
La Gélose Sabouraud a été préparée est fournie par le Laboratoire général de L'institut Pasteur de Tunis. C'est un milieu solide utilisé pour détecter une éventuelle contamination par les champignons (levures et moisissures).
ISTMT-IPT 2012-2013
27
L'incubation de la gélose sabouraud se fait entre 20 à 25 °C. La lecture du test de stérilité se fait chaque jour pendant 14 jours.
? Lignée cellulaire BHK21
La lignée cellulaire BHK21 va servir de support pour la culture en masse et la prolifération du virus de la rubéole afin de produire l'HA.
Dans ce projet l'ampoule qui contient les cellules BHK21 du passage 123 du 20/4/1996 congelée dans l'azote liquide.
Les cellules sont maintenues en vie dans l'ampoule qui contient un milieu de conservation constitué par SVF et le DMSO noté aussi diméthylsulfoxyde.
Figure 18: Observation
microscopique des cellules BHK21
? Souche virale (virus de la rubéole M33)
Le virus de la rubéole M33 a été préparé a partir de la cellule souche VERO (lignée cellulaire dérivant de rein de singe). La cellule VERO donne un ECP en un temps court. La multiplication virale dans la culture cellulaire peut être mesurée par une quantification de l'ECP.
La souche M33 (suspension virale préparée a partir de la cellule VERO) a été fournie du service de Virologie Clinique de L'institut Pasteur de Tunis. Cette souche est utilisée lors de ce projet pour la production et la validation de l'HA rubéolique grâce à la lignée cellulaire BHK21.
Les étapes de la culture cellulaire pour la production de l'HA du virus de la rubéole sont décrites comme suit:
ISTMT-IPT 2012-2013
28
Il faut pratiquer une bonne technique pour obtenir une proportion élevée de cellules survivantes à cette procédure.
L'ampoule qui contient les cellules BHK21 a été retirée de la bouteille d'azote liquide, puis décongelée au Bain marie à 37°C pendant quelques secondes.
Après la décongélation le contenu de l'ampoule a été transféré dans une flasque de culture de 25 cm2 avec ajout de 10 ml du milieu DMEM 10% SVF pour éliminer l'action du DMSO et pour le réveille cellulaire.
? Cette étape se fait sous la Hotte.
La flasque qui contient les cellules BHK21 est mise dans l'étuve à 37°C sous 5% de CO2 pour l'incubation. L'incubation se fait pendant 4 à 5h à 37°C pour que les cellules adhérent au fond du flasque. Après, l'état des cellules et leur adhésion au fond du flasque est vérifiée à l'aide d'un microscope inversé., puis un changement de milieu DMEM 5% SVF est effectué, et la flasque est ensuite remise à l'étuve à 37°C.
Figure 19: Décongélation des cellules BHK21
Après 48h d'incubation à 37°C une deuxième vérification de l'état des cellules est effectuée par le microscope inversé.
L'ancien milieu DMEM 5% SVF, contenu dans la flasque 25 cm2 est déjà épuisé. Un virage de sa couleur vers le jaune signifie que le milieu est devenu défavorable pour les cellules et leur multiplication. Un premier passage de la flasque 25cm2 vers une flasque 75cm2 contenant le milieu DMEM 5% SVF est alors effectué.
? Le passage cellulaire se fait grâce à la solution de trypsine (étape de trypsination).
? D'abord il faut éliminer l'ancien milieu DMEM 5% SVF de la flasque 25cm2. Un rinçage des cellules par la solution de trypsine est effectué pour décoller les cellules
ISTMT-IPT 2012-2013
de support. Une incubation quelques secondes dans l'étuve est nécessaire pour que la trypsine effectue son rôle de dissociation.
? Lorsque les cellules sont bien dispersées un ajout d'une quantité du milieu DMEM 5% SVF (10ml) pour inhiber l'action de la trypsine est effectué. La pipette a un rôle important grâce à son mouvement d'aspiration et de refoulement avec une forte vitesse pour la dissociation des cellules. Le contenue de la flasque 25cm2 est transféré dans une autre flasque plus grande (75cm2) et une quantité suffisante du milieu DMEM 5% SVF est ajoutée pour le bon déroulement de la culture.
Après 48h d'incubation un deuxième passage cellulaire de la flasque 75cm2 vers la flasque 150cm2 est nécessaire après une vérification de l'état des cellules.
|
|
||
Chaque passage nécessite un temps d'incubation de 48h. De cette manière tous les passages seront effectués dans les diverses flasques 25, 75,150 et 225cm2 puis dans les bouteilles Roller.
29
(Les étapes d'élimination du milieu DMEM 5% SVF, de la trypsination, de la dissociation des cellules et d'ajout du nouveau milieu de culture dans les flasques puis dans les bouteilles Roller sont les mêmes dans tous les passages).
ISTMT-IPT 2012-2013
30
Figure 22: Passage des cellules BHK21
L'inoculation virale en culture cellulaire a pour but la multiplication du virus et la production d'HA.
Le tube contenant la suspension virale M33 est décongelé et le milieu DMEM 5% SVF est éliminé des bouteilles Roller. L'étape qui suit est l'inoculation. Dans chaque bouteille Roller 1 ml de la suspension virale est mis, soit environ 1 virus pour 2 cellules (On compte 200 millions de cellules par bouteille Roller. 1 ml de semence virale a un titre de 108 virus). 30 ml du milieu DMEM 2% SVF sont ajoutés dans la bouteille Roller.
Figure 23: Inoculation du virus
Après une heure d'incubation à température ambiante les bouteilles sont mises dans l'appareil Roller à 37°C avec une rotation continue pour une durée de 7h. Enfin, un rinçage avec le milieu DMEM 0% SVF est effectué et un nouveau milieu DMEM 0% est ajouté et l'incubation se poursuit pour une durée de 3 jours à 37°C dans le milieu DMEM 0% SVF.
Le procédé de passage cellulaire et inoculation du virus est résumé comme suit:
1 flasque 25 cm 2 1 flasques 75 cm2 2 flasques 150cm2
4 flasques 225cm2 4 bouteilles Roller Inoculation virale
ISTMT-IPT 2012-2013
31
ISTMT-IPT 2012-2013
32
Après 3 jours d'incubation vient l'étape de la récolte. Le surnageant dans chaque bouteille Roller est récupéré dans un flacon de 500ml. Puis nous avons ajouté à ce surnageant le Chlorure de sodium (NaCl) 2,2g% et le Polyéthylène glycol (PEG 6000) 6g%. Après homogénéisation par agitation. Le précipité a été mis sous agitation à +4°C.
Après 48h sous agitation à +4°C nous avons procédé à une centrifugation à 4°C à 3000 tours/min pendant une heure. Par la suite le surnageant est éliminé et le culot est resuspendu dans le Tampon Glycine de pH 10 (annexe 3) (soit environ 1 ml/bouteille Roller), ensuite la solution Tween 80 à 1,25% est ajouté au culot (annexe 3) (soit 1 volume de Tween 80 est ajouté a 9 volume d'HA). Ce mélange est incubé à 4°C pour une durée de 3 à 5 min.
La solution de Di-éthyle Ether (5 volume de Di-éthyle Ether) est ajoutée sous agitation à +4°C pendant 15 min. Le mélange, est par la suite centrifugé à +4°C pendant 15 min à 3000 tours/min. La phase aqueuse ainsi obtenue, est récupérée et conservée à -20°C.
C'est le lot d'HA rubéolique (1/2013).
Figure 24: Lot d'hémagglutinine
Après la production de l'HA rubéolique vient l'étape du titrage.
Le titrage de l'HA se fait par la technique d'hémagglutination.
L'hémagglutination est la capacité de l'antigène (Ag) viral à agglutiner les globules rouges (GR).
Pour effectuer le test d'hémagglutination il faut:
? GR de pigeon; fournis par le service de Microbiologie Vétérinaire de L'institut Pasteur de Tunis.
· Tampon Tacetal (annexe 4) préparé et utilisé pour effectuer les différentes dilutions.
· Tampon GGB (annexe 4) préparé et utilisé pour le lavage des GR du pigeon.
· Ag rubéolique (Lot de l'HA rubéolique 1/2013).
Trois lavages des GR avec le Tampon GGB sont faits.
Les GR 0,25% sont mélangés avec le Tampon Tacetal.
Dans une plaque de microtitration, la répartition des solutions est comme suit:
· 75 ul de Tampon Tacetal ont été mise dans la 1ère cupule.
· Dans les autres cupules 25 ul de Tampon Tacetal sont ajoutés.
· Dans la 1ère cupule nous avons mis 25 ul de l'HA rubéolique.
· Le contenu de la 1ère cupule est mélangé. 25ul de la solution (Tampon Tacetal +HA) sont passés à la 2ème cupule.
Cette procédure est effectuée de la même manière dans les 7 autres cupules, sauf dans la dernière (témoin négatif).
Enfin 25 ul de GR dans toutes les cupules sont ajoutés.
? Homogénéiser sur une brique de glace à +4°C et laisser une heure à température ambiante à l'abri des vibrations et chocs pour faire la lecture de la plaque.
Figure 25: Titrage de l'hémagglutinine rubéolique
ISTMT-IPT 2012-2013
33
? Sérums humains
Des sérums (titrés) IgG négatifs, fortement positifs et moyennement positifs des malades sont utilisés pour la validation de l'HA rubéolique déjà préparée.
Ces sérums qui ont été fournis par le service de Virologie Clinique de L'institut Pasteur de Tunis sont titrés et conservés à -20°C.
? L'HA rubéolique (Ag)
L'HA rubéolique du lot (1/2013) est utilisé dans le test ELISA. Le rôle de l'HA est la sensibilisation de la plaque ELISA.
Le test ELISA indirect IgG pour la détection des anticorps anti rubéoliques de type IgG est une technique immuno-enzymatique. Ce test permet la visualisation du complexe immun (Ac-Ag) grâce à une réaction colorée produite par le Substrat chromogène Ortho-Phénylène-Diamine(OPD) préalablement fixé sur le Conjugué anti IgG marqué par la peroxydase.
ISTMT-IPT 2012-2013
Substrat
chromogène OPD
Conjugué anti IgG humain marqué à la peroxydase
IgG anti rubéolique
Hémagglutinine rubéolique
34
Principe du test ELISA indirect
Les étapes du test ELISA indirect sont résumées comme suit:
? Sensibilité de la plaque (coating de l'Ag)
L'étape de sensibilisation consiste à mettre dans chaque cupule de la plaque 100 ul d'HA rubéolique (lot 1/2013) dilué au 1/50ème et1/100ème dans le Tampon Carbonate/Bicarbonate (0,1M, pH=9,6) (annexe 5).
Cette étape nécessite un temps d'incubation d'une heure à 37°C ou une nuit à +4°C.
ISTMT-IPT 2012-2013
|
|||
Figure 26: Lavage par le Tampon PBS Tween de la plaque ELISA
? Saturation de la plaque
200 ul de Tampon de saturation PBS-Tween-Gélatine 5% (annexe 5) ont été mises dans chaque cupule de la plaque ELISA une heure à 37°C pour occuper les sites qui sont restés vides après l'étape de la sensibilisation.
Cette étape est importante pour éviter les résultats faux positifs.
? Lavage
Trois lavages successifs par le Tampon PBS-Tween ont été effectués une deuxième fois pour éliminer les particules non fixés.
|
|||
|
|||
? Lavage
35
Cette étape comporte six lavages successifs par le Tampon PBS-Tween pour éliminer les Ac non fixés à l'Ag rubéolique.
ISTMT-IPT 2012-2013
36
? Incubation du Conjugué
Le Conjugué anti IgG humain couplé à l'enzyme peroxydase (annexe 5) a été dilué à 1/10000 dans le Tampon PBS-Tween-Gélatine 5% et repartis à raison de 100 ul dans chaque cupule pour une durée d'incubation d'une heure à 37°C.
? Lavage
Chaque cupule de la plaque est lavée six fois par le Tampon PBS-Tween pour éliminer le Conjugué anti IgG humain non fixé.
? Incubation du Substrat chromogène OPD (Orto-Phénylène Diamine)
(annexe 5)
Le Substrat chromogène OPD est mis à raison de 100 ul par cupule pour une durée d'incubation de 30 min à température ambiante à l'obscurité pour le bon déroulement de la réaction de la dégradation du Substrat et l'apparition de la couleur orangée (il faut recouvrir la plaque ELISA par du papier aluminium).
? Arrêt de la réaction
Après les 30 min d'incubation la réaction enzymatique doit être arrêtée par l'ajout de 50 ul d'acide sulfurique H2SO4 4N (annexe5) dans chaque cupule.
? Lecture de la plaque par spectrophotomètre
La lecture de la plaque ELISA se fait grâce au spectrophotomètre lecteur de plaque ELISA à une longueur d'onde comprise entre 492 et 620 nm.
? Le test ELISA indirect est utilisé pour la validation de l'HA rubéolique produite. C'est un test de routine qui se base sur la révélation des anticorps IgG dans les sérums grâce à l'HA préparé au Laboratoire d'Immunotechnologie et Réactifs Biologiques (LIRB).
0
00
37
ISTMT-IPT 2012-2013
La culture en masse des cellules BHK21 a permis de produire l'HA rubéolique. Chaque passage cellulaire nécessite un temps d'incubation de 48h.
Les différents passages de la culture cellulaire et la production d'HA sont décrites comme suit:
1 flasque 25 cm 2 1 flasques 75 cm2 2 flasques 150cm2
4 flasques 225cm2 4 bouteilles Roller Inoculation virale
Production d'HA
Pour le titrage de l'Ag, l'agglutination des GR par l'HA est révélée par la présence d'une voile tapissant au fond de la cupule (agglutinats visibles à l'oeil nu).
Tableau 1: Résultats de titrage de l'HA
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|||||||||||||||||
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
? Le titre de l'hémagglutinine rubéolique est compris entre 512 et 1024 unité hémagglutinante (UHA).
·
ISTMT-IPT 2012-2013

38
Ce test est fait 2 fois, avec toujours les même résultats.
· Ce titre est considéré, élevé.
Dans le test ELISA indirect IgG 6 sérums ont été utilisés pour contrôler l'efficacité et la spécificité du lot d'HA produit par la technique de culture cellulaire :
· 2 sérums négatifs
· 2 sérums moyennement positifs de titre 13 et 10 UI/ml
· 2 sérums fortement positifs de titre 237 et 228 UI/ml
Ces sérums vont nous servir aussi pour connaitre dans le stade de préparation du Kit ELISA et la dilution adéquate d'HA à utiliser pour l'étape de la sensibilisation de la plaque ELISA.
Les résultats des différentes combinaisons testées sont présentés dans les tableaux suivants: Tableau 2: Test numéro 1
· Dilution de l'HA = 1/50
· Dilution du sérum = 1/50
· Dilution du Conjugué = 1/10000
· Substrat OPD = 0,5 mg/ml
|
|
|
|
|
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|||
ISTMT-IPT 2012-2013
39
Ces résultats nous permettent de déduire l'absence du bruit de fond puisque le DO du Blanc est de l'ordre de 0,06.
· Dans les cupules des sérums moyennement positifs et fortement positifs il y a apparition d'une coloration orangée traduite par une absorbance de l'ordre de 0,779 et 0,842 (soit un DO > 0,5; 0,5 est le seuil de positivité de notre test ELISA), en effet dans les cupules des sérums négatifs il n'y a pas de coloration et le DO des deux sérums négatifs est inférieur à 0,5.
Tableau 3: Test numéro 2
· Dilution de l'HA = 1/50
· Dilution du sérum = 1/100
· Dilution du Conjugué = 1/10000
· Substrat OPD = 0,5 mg/ml
|
|
|
|
|
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|||
Comparé au premier essai seulement la dilution des sérums a changé de 1/50 à 1/100. Ceci confirme l'absence de bruit de fond.
· Dans les cupules des sérums moyennement positifs et fortement positifs il y a apparition de coloration orangée, de même pour les sérums négatifs la DO est toujours inferieure a 0,5.
ISTMT-IPT 2012-2013
40
? Pour les sérums moyennement positifs et fortement positifs la DO a relativement diminué par rapport a une dilution de sérum de 1/50.
Tableau 4: Test numéro 3
? Dilution de l'HA = 1/100
? Dilution du sérum = 1/100
? Dilution du Conjugué = 1/10000
? Substrat OPD = 0,5 mg/ml
|
|
|
|
|
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|||
Dans le 3éme test, le passage d'une dilution à la fois d'HA et des sérums de 1/50 à 1/100 entraine une baisse importante de l'absorbance surtout pour les sérums positifs et en particulier les sérums moyennement positifs dont le DO est devenu inferieur au seuil de positivité.
ISTMT-IPT 2012-2013
41
Tableau 5: Test numéro 4
? Dilution de l'HA = 1/100
? Dilution du sérum = 1/50
? Dilution du Conjugué = 1/10000
? Substrat OPD = 0,5 mg/ml
|
|
|
|
|
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|
||
|
||||
|
|
|
||
|
|
|||
Dans le 4ème test nous avons essayé de garder une dilution d'HA à 1/100 et de prendre les sérums à 1/50. Ainsi nous avons obtenu des résultats concordants qui montrent l'absence de bruit de fond. La DO des sérums négatifs est inferieure à 0,5 (seuil de positivité) et pour les sérums moyennement positifs et fortement positifs le signal obtenu est relatif au titre de chaque sérum.
En tenant compte des résultats obtenus avec les 4 essais réalisés nous montrons que dans les conditions des essais 1, 2 et 4 le signal obtenu pour les différents sérums y compris le Blanc est concordant avec les titres préétablis avec le Kit de commerce (Kit SIEMENS Enzygnost ELISA IgG) et aussi dans les conditions préétablies et standardisées pour notre Kit ELISA IgG Pasteur, développé antérieurement dans notre laboratoire.
Pour le lot d'HA que nous avons produit et pour des raisons de rentabilité économique, nous choisissons les conditions de l'essai numéro 4 qui fixe une dilution d'HA à 1/100.
ISTMT-IPT 2012-2013
42
Cette dilution sera respectée pour l'étape de sensibilisation des plaques dans le procédé de préparation du Kit ELISA IgG Pasteur.
4JLøtps1
~~~ e'r"0
c
~rsP~
P
ISTMT-IPT 2012-2013
43
Dans le domaine de la virologie la culture cellulaire a été un moyen qui a permis de
comprendre plusieurs phénomènes sur la pathogénicité des virus.
En effet la culture du virus de la rubéole sur les cellules BHK21 a permis la production de
l'hémagglutinine rubéolique.
Pour produire l'hémagglutinine rubéolique il faut d'abord réussir:
? Le procédé de stérilisation du local et du matériel par des règles de conduite
strictes dans les salles de culture.
? Le procédé de préparation des réactifs utilisant la culture des cellules BHK21.
? Le procédé de culture des cellules en masse.
? Le procédé de récolte et d'extraction de l'hémagglutinine rubéolique.
? Le titrage de l'hémagglutinine rubéolique par la technique d'hémagglutination.
Le lot d'hémagglutinine rubéolique produit a été validé par le test ELISA indirect IgG.
Les résultats obtenus après le test ELISA indirect sont positifs selon les critères et les conditions standardisées.
A l'heure actuelle d'autres travaux de recherche sont en cours de réalisation au Laboratoire d'Immunotechnologie et Réactifs Biologiques. Ces travaux sont basés sur l'amélioration de la qualité de l'hémagglutinine produite, utilisée pour le diagnostic et la production d'un Kit pour le diagnostic de cette maladie.
L'objectif de ces travaux est de contribuer au développement d'un Kit local pour éviter l'importation des Kits commercialisés destinés au diagnostic de la maladie de la rubéole.
Jusqu'à maintenant les résultats de ces travaux sont prometteurs et laissent à espérer un progrès meilleur dans ce domaine.
es
,le
JLéfCJW
o~raPni~1
Pityli
·
ISTMT-IPT 2012-2013

44
Anglaret.X, Mortier.E. Maladies infectieuses. 3ème édition. Paris: Editions ESTEM De BOECK DIFFUSION, Editions MED- LINE, 2002; p 122.
· Armengaud.D. Pédiatrie. 3ème édition. Paris: Editions ESTEM De BOECK DIFFUSION, Editions MED- LINE, 2003;p 280-281.
· Auletta.AE, Gitnick.GL, Whitmire.CE & Sever .JL. An Improved Diluent for Rubella Hemagglutination and Hemagglutination-Inhibition Tests. Applied Microbiology 1968; 16: 691-694.
· Banatvala.J, Peckham.C. Rubella Viruses. Series Editors: Arie J.Zuckerman, Royal Free and University College Médical School, London, UK Isa K. Mushahwar, Abbolt Laboratories, Abbolt Park, USA, 1ère édition. UK: Elsevier, 2007; p 5.
· Bienvenu .AL, Delecroix .É. La rubeole en 2004. DES de bactériologie-virologie-hygiène, 2004.
· Caboche.M, Giffard.G. Conditions de clonage et de culture en suspension de la souche BHK21/13 de hamster syrien Sensibilité des cultures aux inhibiteurs du métabolisme des acides nucléiques. Ann.bio.anim.bioch.biophys 1973; 13: 643657.
· Chapel.H, Haeney.M, Misbah.S, Snowden.N. Immunologie clinique De la théorie à la pratique, avec cas cliniques. 4ème édition. Oxford: Editions De Boeck Université, 2004; p 330.
· Chosidow .O. Virus et peau. Paris. Editions ESTEM, 1994; p 200.
·
ISTMT-IPT 2012-2013

45
Collier.L, Oxford.J. Virologie humaine. De la biologie a la clinique. Médecine - Science Flammarion, 2004; p 99.
· Cooray.S, Warrener.L, Jin.L. Improved RT-PCR for diagnosis and epidemiological surveillance of rubella. Journal of Clinical Virology 2006 ; 35: 73-80.
· Denis.F. Les virus transmissibles de la mère à l'enfant. Paris : Edition John Libby Eurotext ,1999; p 346-357.
· Dontigny.L, Arsenault.MY & Martel.MJ. Rubéole au cours de la grossesse. Journal of Obstetrics and Gynaecology Canada 2008 ; 30 :159-166.
· Ellakhdi.FE, Bjani.A, Takourt.B, Farouqi.B, Benslimane.A & Fellah.H. Comparaison de deux techniques immunoenzymatiques ELISA pour la détection des anticorps IgG sériques. LES TECHNOLOGIES DE LABORATOIRE 2009; 4: 10-14.
· Feigin.RD, Cherry.J, Demmler.R, Kaplan.S. Textbook of Pediatric Infectious Diseases volume 2. 5ème Edition. Philadelphia: SAUNDERS, 2004; p 2134-2135.
· Gaudelus.J. Vaccinologie. DOIN EDITEURS. Wolters Kluwer France, 2008; p183.
· Guillet.M. Rubéole congénitale en 2010 et vaccination. Congenital rubella in 2010 and vaccination. Antibiotiques 2010 ; 12: 171-180.
· Hedman.K, Salonen.EM, Keski.OJA J & Raiha.K. Single-serum radial hemolysis to detect recent rubella virus infection. .The Journal of infectious diseases 1986 ; 154: 1018-1023.
· Huraux.JM, Nicolas.JC, Agut.H. Virologie. De la biologie a la clinique. Médecine- Science Flammarion, 1991; p 211.
·
ISTMT-IPT 2012-2013

46
Jawetz.E, Melnick.JL, Adelberg.EA. MICROBIOLOGIE MEDICALE. Paris: Librairie Maloine S.A. éditeur. Québec les presses de l'université Laval, 1973; p 373- 498.
· Lasek-Duriez.A, Hubiche. T, Aladjidi.N, Lamireau .T & Taïeb.A, Léauté-Labrèze . C. Exanthème chronique chez un enfant atteint de rubéole congénitale. Chronic exanthema in a child with congenital rubella. Annales de Dermatologie et de Vénéréologie 2008 ; 135: 222-224.
· Lee.JY, Bowdern.DS. La réplication du virus de la rubéole et liens vers Tératogénicité. Clinical Microbiol Reviews 2000 ; 13 : 571-587.
· León.P, de Ory.F , Domingo.C, López. J.A & Echevarría. J.M. Evaluation of a Latex Agglutination Test for Screening Antibodies to Rubella Virus. European Journal of Clinical Microbiology and Infectious Diseases 1988; 7: 196-199.
· Mammette.A .VIROLOGIE MEDICALE. Collection AZAY presse universitaire de Lyon ,2002 ; p 204-318.
· Maurin J. Virologie médicale. Flammarion médicale science, 1984 ; P 589
· Maurin. J, Bezançon. J. Importance de la séparation des immunoglobulines G et M dans la rubéole: Résultats obtenus par ultracentrifugation. Médecine et Maladies Infectieuses 1973 ; 3 : 329-334.
· Mendelson.E, Aboudy.Y, Smetana.Z, Tepperberg.M & Grossman.Z. Laboratory assessment and diagnosis of congenital viral infections: Rubella, cytomegalovirus (CMV), varicella-zoster virus (VZV), herpes simplex virus (HSV), parvovirus B19 and human immunodeficiency virus (HIV). Reproductive Toxicology 2006 ; 21:350-382.
·
ISTMT-IPT 2012-2013

47
Mubareka .S, Richards.H, Gray.M & Tipples.G A. Evaluation of Commercial Rubella Immunoglobulin G Avidity Assays. Journal of Clinical Microbiology 2007; 45: 231-233.
· Ovsyannikova.IG, Vierkant.RA, Pankratz.VS, O'Byrne.MM , Jacobson.RM & Poland.G A. HLA haplotype and supertype associations with cellular immune responses and cytokine production in healthy children after rubella vaccine. Vaccine 2009 ; 27 : 3349-3358.
· Pebret.F. Maladies infectieuses Toutes les pathologies des programmes officiels des études médicales ou paramedicals.Paris .Editions HEURES DE FRANCE, 2003 ; p 510-511.
· Picone.O, Grangeot-Keros.L. Rubéole et grossesse. EMC-Gynécologie-Obstétrique 2005 ; 2 : 343-353
· Risco.C, Carrascosa.JL & Frey.TK. Structural maturation of rubella virus in the Golgi complex. Virology 2003; 312: 261-269.
· Sever.JL, Huebner.RJ, Castellano.GA, Sarma.PS, Fabiyi.A, Schiff.GM et al. Rubella complement fixation test. Science 1965 ; 148 : 385-387.
· Rahman.S-Ur, Rabbani.M, Sahidullah, Muhammad.K & Iqball.Z. Studies on In Vitro Culture Characteristics of Adherent Baby Hamster Kidney-21 (BHK-21). Cell Line. International journal of agriculture and biology 2007; 9: 821-826.
· Weissfeldt.AS, Sonnenwirth.AC. New Latex Agglutination Test for Rapid Determination of Rubella Immune Status. Journal of clinical microbiology 1982; 16:971-972.
· Yumei.Z, Ushijima.H & Frey.TK. L'analyse génomique des divers génotypes du virus de la rubéole. Journal of general virology 2007 ; 88 : 932-941.
ISTMT-IPT 2012-2013
Site internet

48
AØØC%CS
Préparation de la solution de Tryptose phosphate
Dans 500 ml d'eau distillée, ajouter 29,5g Tryptose phosphate (DIFCO)
Porter le volume à 1 L
Visser légèrement le flacon
Autoclaver à 120°C pendant 15 min
Laisser le flacon refroidir jusqu'au lendemain
Garder à température ambiante
Préparation de l'antibiotique (Pénicilline-Streptomycine)
Pénicilline .5.000.000 UI
Streptomycine .2,5g
Filtration avec 100 ml d'eau
distillée Utilisation de 2 ml dans 1L de milieu
Préparation du milieu de culture DMEM 0%
Dans un flacon de 1L de DMEM ajouter :
50 ml Tryptose phosphate
2 ml pénicilline-streptomycine
Faire le contrôle de stérilité sur Bouillon Trypto-caséine soja
Thioglycolate
Gélose Sabouraud
Préparation du milieu de culture DMEM 2%
Dans un flacon de 1L de DMEM ajouter:
50 ml Tryptose phosphate
2 ml pénicilline-streptomycine
20 ml de SVF
Faire le contrôle de stérilité sur Bouillon Trypto-caséine soja
Thioglycolate
Gélose Sabouraud
Préparation du milieu de culture DMEM 5%
Dans un flacon de 1L de DMEM ajouter:
100 ml Tryptose phosphate
2 ml pénicilline-streptomycine
50 ml de SVF
Faire le contrôle de stérilité sur Bouillon Trypto-caséine soja
Thioglycolate
Gélose Sabouraud
Préparation du milieu de culture DMEM 10%
Dans un flacon de 1L de DMEM ajouter :
100 ml Tryptose phosphate
2 ml pénicilline-streptomycine
100 ml de SVF
Faire le contrôle de stérilité sur Bouillon Trypto-caséine soja
Thioglycolate
Gélose Sabouraud
Préparation de milieu de conservation et conservation des cellules BHK21
Les composants du milieu de conservation sont mis dans un tube de 50ml comme suit:
DMEM .25ml
SVF .5ml
Solution d'Albumine bovine (10%) 2,5ml
Saccharose (10%) .2,5ml
L'Albumine bovine et le saccharose sont préparés d'avance. Nous avons mélangé 1g de Saccharose et d'Albumine bovine chacun dans un tube de 10ml d'eau distillée.
Faire le contrôle de stérilité sur Bouillon Trypto-caséine soja
Thioglycolate
Gélose Sabouraud
Les cellules BHK21 destinées à la conservation sont traitées par la solution de trypsine avec le milieu DMEM 5% SVF et repartis dans des tubes de 50ml. Ces tubes sont ensuite mis dans la centrifugeuse à 800 rpm à 4°C pendant 3 min. Le surnageant est jeté. Le culot est reparti dans le milieu de conservation sans DMSO; soit environ 3,6 ml, puis 0,4 ml de DMSO sont ajoutés lors de la conservation. La solution est mélangée puis repartie dans des ampoules à raison de 1 ml dans chaque ampoule.
Ces ampoules sont mises à : - 20°C pour une heure
- 40°C pour une journée
-70°C pendant une nuit et -170°C dans l'azote liquide.
La conservation des cellules est une étape essentielle dans la culture cellulaire. Les cellules conservées sont utilisées en cas de besoin.
Préparation de milieu Thioglycolate
Dans 500 ml d'eau distillée ajouter 15g Thioglycolate (Scharlau)
Faire une agitation par l'agitateur magnétique jusqu'à homogénéisation du milieu
Visser légèrement le flacon
Autoclaver à 120°C pendant 15 min
Laisser le flacon refroidir jusqu'au lendemain
Garder à température ambiante
Préparation du milieu Bouillon Trypto-caséine soja
Dans 500 ml d'eau distillée ajouter 15g Bouillon Trypto-caséine soja (BIOKAR)
Faire une agitation par l'agitateur magnétique jusqu'à homogénéisation du milieu
Visser légèrement le flacon
Autoclaver à 120°C pendant 15 min
Laisser le flacon refroidir jusqu'au lendemain
Garder à température ambiante
rubéolique
Préparation de Tampon Glycine 1M
Glycine .75,07g/L
Eau distillée qsp 1000 ml
Ajuster le pH à 10 avec NaOH N Préparation de la solution Tween 80 à 1,25%
Tween 80 1,25g
PBS qsp 100ml
rubéolique
Préparation de Tampon de lavage GGB
Barbital 0,58g/L
Gélatine 0,60g/L
Barbital sodique .0,38g/L
Glucose 10g/L
NaCl 8,50g/L
CaCl2 anhydre 0,02g/L
MgSO4 7H2O 0,12g/L
H2O qsp 1000 ml
Conservation à +4°C
Ajouter l'Albumine bovine avant l'emploi
.4g/L
Ajuster le pH à 7,4 -7,6 Stérilisation par filtration
Préparation de Tampon Tacetal Tampon Acide:
NaCl 8,7g/L
Na2HPO4 (12H2O) 15,75g/L
NaH2PO4 anhydre 24, 34g/L
H2O qsp 1000 ml
Filtrer sur 0,45 um et 0,22 um Garder à
+4°C
pH 5,8
Tampon Alcalin:
NaCl .7,02g/L
BO3H3 3,09g/L
NaOH N 24 ml
Albumine bovine 4,0g/L
H2O qsp 1000 ml
Filtrer sur 0,45 um et 0,22 um Garder à
+4°C
pH 9,0
Préparation de Tampon Tacetal
Mélanger un volume de Tampon Acide avec un volume de Tampon Alcalin
Régler le pH à 6,2
Garder à +4°C
Tampon Phosphate ? Solution 1:
KH2PO4 1M 136g
H2O qsp 1L
? Solution 2:
K2HPO4 1M .174g
H2O qsp 1L
Ajouter sous pH-mètre la solution 1 à la solution 2 jusqu'à atteindre pH 7,4
Tampon PBS
? PBS (0,15 M NaCl + 0,01 M Tampon Phosphate 7,4)
-NaCl .87,6g
H2O qsp .1L
-Tampon Phosphate 10ml
H2O qsp ..1L
? PBS Tween 20 à 0,1%
Tween 20 1ml
PBS qsp 1L
? PBS Tween 20 Gélatine 0,5%
-Gélatine (sigma) 0,5%
-5g de Gélatine dissoute par chauffage dans 100ml d'eau distillée
-Gélatine 5% 10ml
-PBS Tween 20 qsp .100ml
Tampon Citrate 1M
? Citrate de sodium 1M (C6H5Na3O72H2O)
C6H5Na3O72H2O 294,10 g
H2O qsp .1L
? Acide citrique 1N C(OH) (COOH) (CH2COOH) 2H2O
C(OH) (COOH) (CH2COOH) 2H2O ..210,14g
H2O qsp 1L
Ajouter sous pH-mètre la solution d'Acide citrique 1N à la solution 1M de Citrate de sodium jusqu'à obtenir un pH 5
Tampon Carbonate/Bicarbonate ? Solution 1:
NaHCO3 1M .84,01g
H2O qsp .1L
? Solution 2:
Na2CO3 1M .105,99g
H2O qsp .1L
Ajouter sous pH-mètre la solution 1 à la solution 2 jusqu'à obtenir pH 9,6
Solution Substrat chromogène
OPD 5 mg
H2O2 30% 10ul
Tampon Citrate pH 5 0,1 M 10ml
Fonction des Tampons pour le test ELISA
? Tampon de saturation PBS-Tween-Gélatine 5%
Le Tampon de saturation PBS-Tween-Gélatine 5% est un Tampon de saturation utilisé dans le test ELISA indirect pour occuper les sites qui sont restés vides après fixation de l'Ag rubéolique au fond des puits de la plaque ELISA. Il est utilisé aussi pour diluer les sérums à tester et le Conjugué anti IgG humain couplé à l'enzyme peroxydase.
? Tampon de lavage PBS-Tween (phosphate buffered saline-Tween)
Le Tampon de lavage PBS-Tween est utilisé pour faire le lavage après chaque étape du test ELISA.
? Tampon Carbonate/Bicarbonate (0,1M, pH=9,6)
Le Tampon Carbonate/Bicarbonate est utilisé pour effectuer les différentes dilutions de l'Ag rubéolique dans l'étape de sensibilisation de la plaque.
? Substrat chromogène OPD (Orto-Phénylène Diamine)
Le Substrat chromogène OPD est une solution révélatrice du complexe immun (Ac-Ag). Suite à la rencontre du Substrat chromogène OPD avec l'enzyme peroxydase fixé déjà sur le Conjugué anti IgG humain couplé à l'enzyme peroxydase, il va y avoir une réaction de dégradation et apparition de couleur orangée.
? Pour les résultats faux positifs il y a virage vers la couleur jaune.
? Le Conjugué anti IgG humain
Le Conjugué anti IgG humain (SIGMA A-6029, LOT 84117381) est couplé a l'enzyme peroxydase. Ce Conjugue ne peut se fixer que sur le complexe immun (Ac-Ag).
La révélation du complexe immun (Ac-Ag) se fait grâce à l'enzyme peroxydase au contact avec le Substrat chromogène OPD.
? Solution d'arrêt (acide sulfurique 112SO4 4N)
L'acide sulfurique 112SO4 4N permet l'arrêt de la réaction ELISA.
|
Résumé: La culture cellulaire a été introduite dans les années 1920 et s'est grandement étendue au cours des années 1940. Cette discipline est devenue importante dans divers domaines comme le domaine de virologie. La culture de certains virus a permis de résoudre plusieurs problèmes comme le diagnostic des maladies causées par ces virus. L'objectif de notre projet de fin d'études consiste à maitriser la technique de culture cellulaire pour cultiver le virus de la rubéole sur la cellule BHK21. La culture de ce virus va nous permettre ensuite de réaliser le diagnostic de la maladie de la rubéole. Les cellules BHK21 ont été infectées par le virus de la rubéole afin de produire l'hémagglutinine rubéolique. Cette étape va nous permettre d'assurer les autres étapes du procédé de la préparation d'un Kit de sérodiagnostic de la rubéole. Pour le lot d'HA produit nous avons pratiqué la technique d'hémagglutination pour connaitre le titre de l'hémagglutinine rubéolique. Cette technique a donné un titre compris entre 512 et 1024 UHA. Ce titre est considéré comme élevé. La deuxième technique était le test ELISA. Ce test nous a permis de valider l'hémagglutinine rubéolique et de connaitre la dilution la plus élevée de l'antigène qui est de 1/100 avec une dilution de 1/50 pour le sérum. Avec ces dilutions nous avons trouvé une bonne concordance entre le Kit local et le Kit commercial moyennant des sérums de malade à titres préétablis par le service de Virologie clinique à L'institut Pasteur de Tunis. |
|
Abstract: Cell culture was introduced in the 1920's and was greatly expanded in the 1940's. This discipline became increasingly important in various fields such as the field of virology. Culture of certain viruses allowed to solve several problems such as the diagnosis of diseases caused by these viruses. The aim of our final studies project is to study end master the technique of cell culture to grow rubella virus on BHK21 cell. The culture of this virus will then allow us to make the diagnosis of the rubella disease. BHK21 cells were infected with rubella virus to produce rubella hemagglutinin. This step will allow us to ensure the further process steps for preparing a kit rubella serodiagnosis. For the produced batch of HA we practiced the technique of hemagglutination to know the titer of the hemagglutinin rubella. This technique gave a titer between 512 and 1024 UHA. This titer is considered high. The second technique was the ELISA test. This test allowed us to validate the hemagglutinin rubella and to know the higher dilution of the antigen which is 1/100 and 1/50 of serum. With these dilutions we found good agreement between the local Kit and the commercial kit through infected serums of predetermined titer by the Pasteur Institute of Tunis's Clinical Virology department. |

