INTRODUCTION
La qualité microbiologique des aliments est de
première importance pour la sécurité alimentaire. En
Europe comme aux Etats-Unis la sécurité alimentaire constitue un
sujet d'inquiétude tant des instances officielles que des consommateurs.
Les produits avicoles sont à l'origine de pathologies microbiennes dans
le monde, qu'il s'agisse de dindes ou de poulets (grippe aviaire,
salmonelloses, campylobactériose, etc.) (Donald, Août:/ Septembre
2004.). Certains pathogènes alimentaires colonisent
préférentiellement le tractus digestif des volailles :
plusieurs types de Salmonella et Campylobacter jejuni
notamment. Les salmonelles ne sont généralement pas
pathogènes pour les volailles, hormis certaines souches de
Salmonella Enteritidis, mais provoquent des infections parfois graves
chez l'homme. Les Salmonella spp. sont présentes dans
l'intestin de l'homme et des animaux vertébrés (Bornert, 2000).
De nombreux sérovars sont ubiquistes et à l'origine de
toxi-infections alimentaires chez l'homme et d'infections diverses chez les
animaux.
Les maladies infectieuses d'origine alimentaire sont souvent
liées à des défauts d'hygiène (Arvieux, 1998) et
peuvent être graves comme le cas des toxi-infections à
Salmonella.
Plus de soixante pour cent (60 %) des toxi-infections dans le
monde sont dues à Salmonella. Les salmonelloses sont de ce fait
devenues un phénomène de santé public ce qui justifie
l'implication de l'Organisation Mondiale de la Santé (OMS) dans la lutte
contre les salmonelloses (Salm-Surv, 2005).
En Côte d'Ivoire le poulet est l'un des aliments les
plus prisés par les consommateurs. En effet la viande de poulet est
relativement accessible à toutes les bourses et sa consommation exclut
tout tabou. Le poulet est même l'un des animaux le plus utilisé
lors des sacrifices, des cérémonies de grande
réjouissance. Le réservoir principal de la contamination aux
salmonelles demeurt les ovo produits ainsi que les produits des volailles.
C'est ainsi qu'une étude portant sur les viscères de poulets
vendus sur les marchés d'Abobo (Abidjan en Côte d'Ivoire) a permis
de détecter 56% comme taux de portage à Salmonella
(Traoré, 2003). Une autre étude conduite cette fois sur les
gésiers de poulet à Abidjan en Côte d'Ivoire a permit de
confirmer un taux de portage à Salmonella de 52% (Ouattara,
2005).
Bien que très fréquemment contaminées par
des salmonelles les viandes de volailles sont rarement mises en cause en tant
qu'aliments à l'origine de toxi-infections alimentaires (Bornert, 2000).
Ces denrées sont habituellement consommées très cuites, la
cuisson constituant généralement un traitement assainissant
efficace.
L'objectif global de notre étude consistera à
évaluer l'effet de la cuisson sur la survie des salmonelles et à
déterminer le temps mortel de trois souches de Salmonella en
bouillon de culture, dans l'oeuf entier et dans les
gésiers de poulet.
I-REVUE BIBLIOGRAPHIQUE
I-1) HISTORIQUE ET TAXONOMIE DES
SALMONELLES
I-1-1) HISTORIQUE
Eberth en 1880 découvre l'agent responsable de la
fièvre typhoïde dont la culture de la bactérie a
été possible en 1884 par Gaffky. Le genre Salmonella a
été utilisé après que le bactériologiste
américain Daniel Salmon eut isolé en 1886 (Encyclopédie
ENCARTA 2004), avec quelques collègues, une bactérie provenant du
porc (maintenant connu comme Salmonella Choleræsuis )
qui était considérée comme étant la cause de la
fièvre porcine (choléra du porc). En 1896 Widal a mis en
évidence la diversité antigénique des souches de
salmonelles. A ce jour on a isolé plus de 2500 sérotypes de
salmonelles.
Depuis les premières observations rapportées par
Eberth jusqu'à nos jours, le genre Salmonella n'a pas
cessé de présenter une importance considérable dans les
domaines vétérinaires et sur le plan médical, tant par les
pertes économiques dues à la maladie animale, que par la forte
incidence chez l'homme ; des fièvres typhoïdes et des
toxi-infections alimentaires à salmonelles (Bornert, 2000).
I-1-2) TAXONOMIE
v Domaine : Bacteria
v Phylum : Proteobacteria
v Classe : Gammaproteobacteria
v Ordre : Enterobacteriale
v Famille : Enterobacteriaceae
v Genre : Salmonella
La nomenclature des salmonelles est particulièrement
complexe car elle a fait l'objet de controverses et de confusions liées,
principalement, à un avis de la "Commission Judiciaire". Le nouveau
système (utilisation des nomenclatures validement publiées par
l'opinion 80, couplée à l'interprétation taxonomique de
(Le Minor and Popoff, 1987) et à l'interprétation taxonomique de
(Reeves et al., Nov.1989) est employé par un nombre toujours
croissant de bactériologistes. Il apparaît clairement que la
"Commission Judiciaire" recommande l'utilisation du nouveau système. Ce
nouveau système reconnaît que le genre Salmonella
possède trois espèces :
· Salmonella bongori
· Salmonella enterica ou Salmonella
choleraesuis.
· Salmonella subterranea
(Shelobolina et al., Nov 2004), qui est une souche
bactérienne isolée d'un sédiment acide et contaminé
par des nitrates et de l'uranium.
La seconde espèce la plus importante comprend six
sous-espèces que sont (Grimont et al., 2000):
Ø Salmonella enterica subsp.
arizonae.
Ø Salmonella enterica subsp.
diarizonae
Ø Salmonella enterica subsp.
enterica.
Ø Salmonella enterica subsp.
houtenae.
Ø Salmonella enterica subsp.
indica.
Ø Salmonella enterica subsp.
salamae.
I-2) SALMONELLES ET POULETS
Le poulet, la dinde, le porc, le boeuf, les autres viandes et
volailles constituent des sources importantes de protéine et d'autres
nutriments. Malheureusement, ces aliments comme les oeufs, le lait cru et tous
les aliments crus d'origine animale peuvent aussi transporter la
Salmonella et d'autres bactéries. La bonne nouvelle est que ces
bactéries ne causent pas forcément de maladies. Parmi les
sérotypes les plus fréquemment incriminés lors des
toxi-infections à salmonelles Salmonella Enteritidis, Hadar et
Virchow sont considérés comme assez typiques de la filière
aviaire. Quoique moins spécifique des volailles, le sérotype
Typhimurium est aussi très fréquemment rencontré dans les
élevages de poulets, de dindes et de canards (Rajashekra et
al., 2000). Le fort taux d'infection salmonellique des oiseaux
d'élevage est la cause de la fréquente contamination des produits
avicoles par les salmonelles (Bornert, 2000).
L'origine exacte de la contamination des volailles par
les salmonelles est encore mal connue mais l'on pense qu'elle serait
liée à leur alimentation, à l'eau de boisson et à
l'environnement.
Au cours des deux dernières décennies,
Salmonella Enteritidis est devenu l'une des principales causes
d'infection humaine, les oeufs de poule étant l'une des sources majeures
du pathogène. Ce fait est attribué à la capacité
inhabituelle de ce sérovar à coloniser le tissu ovarien des
poules et à être présent dans le contenu des oeufs en
coquille intacts (FSIS, janvier1988.). Le poulet est le principal type de
volaille consommé dans de nombreux pays à un pourcentage
élevé. Ces poulets sont colonisés par des salmonelles
durant la croissance, la peau et la chair des carcasses sont fréquemment
contaminées par le pathogène pendant l'abattage et la
transformation.
I-3) MICROFLORE DU TRACTUS
DIGESTIF
Le gésier a une fonction importante comme un organe de
barrière, qui empêche des bactéries pathogènes
d'entrer dans le tube digestif distal (Bjerrum et al., Mars
2005).
Le tractus digestif de la volaille est totalement différent de
celui des autres espèces animales en particulier avec un jabot, un
intestin grêle très long, un gros intestin très complexe
doté de deux ceca en « cul de sac » et d'un colon
très court se terminant par le cloaque.
La microflore du jabot,
qui compte beaucoup de lactobacilles (Donald, Août:/ Septembre 2004.),
assure non seulement la production d'acides gras volatiles, mais
également l'hydrolyse de l'amidon. Dans l'intestin grêle, la flore
est beaucoup plus complexe et la recherche n'en est qu'au tout début
tant en termes de quantification des souches que de connaissance de la
complexité de l'écologie microbienne. La flore anaérobie
domine dans la partie basse du tractus digestif. Le colon, très court,
contrairement aux autres espèces animales, n'assure qu'un rôle de
convoyeur du digesta. Enfin, les deux très longs ceca possèdent
un orifice très étroit qui restreint l'entrée des fluides
et des grosses particules. L'ensemble du gros intestin est le siège de
fermentations importantes, donc de la production d'acides gras volatiles, mais
aussi de la synthèse vitaminique et de la digestion des fibres.
Comme
chez l'Homme, le tractus digestif de la volaille est intimement lié au
statut immunitaire et, plus généralement, à la
santé de l'organisme dans son ensemble. L'alimentation et les
supplémentations influent sur l'écologie
microbienne.
L'intérêt pour cette microflore s'explique par
trois facteurs :
o la recherche d'une utilisation optimale des
nutriments
o la prévention des pathologies aviaires
o la sécurité de l'alimentation de l'Homme par
l'élimination des pathogènes.
L'on peut trouver des salmonelles dans l'intestin du
bétail, de la volaille, des chiens, des chats et de beaucoup d'autres
animaux.
I-4 BIOLOGIE DES SALMONELLES
I-4-1) DEFINITION DES
SALMONELLES
Les salmonelles appartiennent à la famille des
Enterobacteriaceae. En microscopie optique, elles apparaissent comme
des bâtonnets a Gram négatif de 0,3 um à 1um de large et
longs de 1 à 6 um, mobiles grâce à une ciliature
péritriche (à l'exception du sérovar Gallinarum-Pullorum).
Les salmonelles sont des bactéries mésophiles se
développant à des températures comprises entre 5,2°C
et 47°C et de manière optimale entre 35 et 37°C, à des
pH compris entre 4,5 et 9, avec une activité en eau (Aw)
supérieur à 0,93. La Salmonella est une bactérie
naturellement présente dans l'intestin des animaux, en particulier chez
les volailles et les porcs. Elle vit également dans l'environnement. La
salmonelle peut survivre un an ou plus dans les aliments à faible
activité d'eau (ICMSF., 1996). Les personnes qui consomment des
aliments contaminés par Salmonella sont susceptibles de
contracter la salmonellose.
I-4-2) POUVOIR PATHOGENE DES
SALMONELLES
Le pouvoir pathogène est différent pour les
salmonelles typhiques, paratyphiques et pour les salmonelles non
typhiques.
I-4-2-1
Salmonella typhique et paratyphique
Les Salmonella responsables des fièvres
typhoïdes ayant l'homme pour seul réservoir, la contamination se
fait par ingestion d'eau ou d'aliments ayant subi une contamination
fécale d'origine humaine. Comme toutes les maladies à
transmission oro-fécale, ces fièvres surviennent le plus souvent
dans des zones où l'hygiène est précaire, et frappent
principalement les pays en développement en Asie, en Afrique ou en
Amérique Latine. Les données mondiales les plus récentes
font état de 17 millions de cas annuels de fièvre typhoïde,
et de 600 000 morts (Hu and Kopecko, 2003)
Les fièvres typhoïdes et paratyphoïdes sont
causées par des Salmonella strictement adaptées à
l'homme, Salmonella Typhi, Salmonella Paratyphi A et
certaines souches de Salmonella Paratyphi B. Après une
période d'incubation de une à deux semaines, survient une
fièvre continue accompagnée de maux de
tête, d'anorexie, d'abattement
("tuphos" torpeur en grec), de douleurs abdominales avec
diarrhée ou constipation. Dans les formes bénignes, l'état
reste stationnaire pendant une quinzaine de jours puis la convalescence dure
plusieurs semaines. Dans les formes plus graves où des complications
peuvent survenir au niveau de l'intestin, du coeur ou de la vésicule, la
fièvre typhoïde peut être fatale en l'absence de traitement.
Le taux de mortalité est de 10% comparé à moins de 1% pour
les autres formes de salmonellose. Une antibiothérapie appropriée
abaisse le risque de mortalité à moins de 1%, mais on isole de
plus en plus de souches résistantes aux antibiotiques : au Vietnam, 75%
des souches isolées sont résistantes aux antibiotiques
classiquement utilisés, contre moins de 1% en France. Il existe de plus
un portage chronique de Salmonella Typhi : après
guérison d'une fièvre typhoïde, 2 à 5% des individus
continuent à excréter ces bactéries. Les symptômes
des fièvres paratyphoïdes sont similaires, mais le plus souvent
moins sévères, le taux de mortalité de cette salmonellose
étant par ailleurs bien plus bas que celui de la fièvre
typhoïde.
I-4-2-1
Salmonella non typhique
La salmonellose est une maladie grave qui peut même
parfois être mortelle. La salmonellose est la zoonose la plus
fréquente dans les pays européens. L'infection survient
habituellement après l'ingestion de produits d'origine animale. Les
salmonelles peuvent être présentes dans toute une série de
denrées alimentaires telles que les oeufs crus, la volaille, le porc, le
boeuf, d'autres produits à base de viande et les produits laitiers.
Les gastro-entérites sont provoquées par des
Salmonella ubiquistes présentes chez l'homme et les animaux. La
durée d'incubation est généralement de 1 à 2 jours
et dépend de la dose ingérée, de la santé de
l'hôte et des caractéristiques de la souche de
Salmonella. Les salmonelloses provoquent une forte
fièvre accompagnée de diarrhées,
vomissements et douleurs abdominales. Chez des adultes de condition physique
normale, une gastro-entérite disparaît sans traitement
après 3 à 5 jours en moyenne. En revanche, une
antibiothérapie doit être prescrite chez les personnes
âgées, les nourrissons, ou les personnes
immunodéprimées chez lesquelles l'infection peut être plus
sévère, voire mortelle.
Les principaux symptômes de la salmonellose (infections
non typhoïdiques) sont la diarrhée non sanglante, les douleurs
abdominales, la fièvre, les nausées et des vomissements qui
surviennent généralement 12-36 heures après l'ingestion.
Toutefois, les symptômes peuvent varier considérablement depuis
une maladie grave rappelant la typhoïde jusqu'à l'infection
asymptomatique. La maladie peut également entraîner des
complications plus sérieuses. Chez les sujets en bonne santé, la
dose infective varie selon les sérovars, les aliments incriminés
et la sensibilité des individus. Alors que certains (Varnam and Evans,
1991) ont pu montrer que 20 cellules pouvaient suffire à constituer une
dose infective minimale, d'autres études ont régulièrement
fait état d'un ordre de grandeur supérieur à
106 cellules(Korsak et al., 2004).
I-4-3 Caractères biochimiques des
Salmonella
Les Salmonella possèdent les
caractères généraux de la famille des Enterobacteriaceae
et des caractères différentiels intrinsèques.
I-4-3-1 Caractères de
famille
Huit principaux caractères déterminent la
famille des Enterobacteriaceae, ce sont :
1. bacilles à coloration de Gram négatif,
2. souvent mobiles grâce à leur ciliature
péritriche (rarement immobiles), non sporulés
3. bacilles qui cultivent sur les milieux ordinaires
4. bacilles aéro-anaérobies facultatifs
5. bacilles qui fermentent le glucose avec ou sans production
de gaz
6. bacilles qui réduisent les nitrates en nitrites
7. bacilles qui ne possèdent pas de cytochrome oxydase
(Hanes, 2003; ICMSF., 1996).
8. bacilles qui possèdent une catalase.
Certaines souches n'obéissent pas à tous ces
caractères, c'est le cas de :
Erwinia qui ne réduit pas les nitrates, de
Shigella dysenteriae sérotype 1 (SD1) qui ne possède pas
de catalase, de Salmonella galinarum-pullorum qui est immobile.
I-4-3-2 Caractères différentiels du
genre Salmonella
Les principaux caractères biochimiques permettant
l'identification
du genre Salmonella (Humbert et al., 1998)
sont :
Ø L'absence d'une uréase active, de tryptophane
ou de phénylalanine désaminase,
Ø l'absence de production d'indole et d'acétoine
(test de Voges-Proskauer négatif),
Ø La production d'hydrogène sulfureux à
partir du thiosulfate (présence d'une thiosulfate réductase).
Ø La décarboxylation fréquente de la
lysine et de l'ornithine,
Ø La pousse fréquente sur le milieu au citrate
de Simmons
I-4-4 Antigènes des
Salmonella
Les Salmonella peuvent posséder trois types
d'antigènes présentant un intérêt diagnostic (Dumas,
1958).
I-4-4-1 Antigène somatique O (Ag O)
L'antigène O est un antigène de la paroi. Les
antigènes O sont portés par les chaînes spécifiques
du lipopolysaccharide (LPS). L'antigène O possède des
propriétés immunisantes, c'est un complexe contenant une
protéine, un polysaccharide et un composé phospholipidique. On
distingue 67 facteurs O selon la nature des sucres entrant dans la
constitution des unités oligosaccharidiques du polysaccharide
(Humbert et al., 1998).
Les antigènes O sont formés d'une fraction
lipidique appelée lipide A qui est responsable des effets toxiques, du
core ou partie basale et du polysaccharide support de la
spécificité (Gledel and Corbion, 1991)
Les antigènes sont classés en facteurs O majeurs
et en facteurs O accessoires. Les facteurs majeurs sont liés à la
présence de certains sucres (abéquose pour O : 4,
tyvélose pour O : 9) (Humbert et al., 1998).
L'antigène somatique est stable ; il résiste
à l'alcool et au phénol pendant deux heures et demi à la
température de 100°C (Dumas, 1958).
I-4-4-2 Antigène flagellaire (Ag
H)
C'est un polymère de flagelline (protéine de
structure des flagelles). Cet antigène est thermolabile, détruit
par la chaleur à 100° C, par l'action de l'alcool et par les
ferments protéolytiques. Il résiste au formol et perd son
agglutinabilité par les anticorps en présence d'alcool et d'acide
phénique. Son développement optimum s'obtient sur les milieux
liquides mous après un séjour de 8 heures à 37 °C
(Dumas, 1958). La grande majorité des sérovars possèdent
deux systèmes génétiques et peut exprimer alternativement
deux spécificités différentes pour leur antigène
flagellaire. On dit que les antigènes flagellaires de
Salmonella sont diphasiques (Humbert et al., 1998).
I-4-4-3 L'antigène de virulence (Ag
Vi)
C'est un antigène de l'enveloppe, il a
été identifié chez trois types de sérovars :
Typhi, Paratyphi C et Dublin mais toutes les souches de ces sérovars ne
possèdent pas forcement cet antigène (Humbert et al.,
1998).
Cet antigène est considéré comme un
antigène de surface (Dumas, 1958), il est distinct de
l'antigène somatique et de l'antigène flagellaire.
L'antigène Vi rend les germes inagglutinables par les anticorps O quand
il est abondant. Il ne se développe pas si les cultures sont
effectuées au dessous de 25°C et au dessus de 40°C. Un
chauffage à 100°C le détruit et les germes deviennent
agglutinables par les anticorps O. Il est de nature
glucidolipidopolypeptidique.
A côté de ces antigènes il existe dans
le genre Salmonella, des structures protéiques de
surface : les pilis qui se différencient en pilis communs
(intervenant dans l'hémagglutination mannose dépendante) et en
pilis sexuels (intervenant dans la conjugaison bactérienne) et dont la
présence est codée par des plasmides (Gledel and Corbion, 1991).
I-5 ISOLEMENT ET IDENTIFICATION DES SALMONELLES
I-5-1 ISOLEMENT DES SALMONELLES
Salmonella Typhi, Paratyphi A, B, C sont
isolés de préférence dans le sang et dans les
matières fécales des typhoïdiques (Dumas,
1958). Les Salmonella qui provoquent les
intoxications alimentaires ou des gastro-entérites aiguës sont
toujours recherchées dans les matières fécales et dans les
aliments.
La mise en évidence de Salmonella peut
être directe (technique bactériologique) ou indirecte (technique
sérologique) selon (Humbert et al., 1998).
L'analyse microbiologique
d'une denrée alimentaire est de mettre en évidence les
microorganismes responsables d'altération de la qualité marchande
et/ou sanitaire. Les méthodes d'analyse varient en fonction du type
d'aliment, du danger potentiel qu'il présente, et des
caractéristiques de conservation, consommation (cru ou cuit) et du type
de germe recherché. Les denrées alimentaires sont des milieux
favorables pour le développement d'une multitude de germes dont certains
sont pathogènes. Devant la difficulté de rechercher une
espèce bactérienne pathogène en très faible
proportion dans un produit fortement contaminé par les bactéries
les plus diverses des méthodes conventionnelles d'analyse,
d'échantillonnage et d'isolement ont été
proposées.
Plusieurs normes régissent la recherche de
Salmonella en hygiène des aliments (Humbert et al.,
1998)
ü -les normes horizontales applicables à tous les
types de produits (ISO6579 Décembre 1993) au niveau international
ü les normes sectorielles spécifiques à un
type de produit (NF V59 - 109 pour la gélatine alimentaire)
La recherche de Salmonella dans une denrée
alimentaire selon la norme ISO 6579 comporte quatre étapes
essentielles :
ü le préenrichissement
ü l'enrichissement
ü l'isolement
ü l'identification biochimique et sérologique.
I-5-1-1 Le pré-enrichissement
C'est une phase non sélective qui utilise un milieu
riche dans lequel l'échantillon est dilué au dixième
(1/10) et pour laquelle l'incubation dure une vingtaine d'heure à
35°C ou 37°C (Humbert et al., 1998). Le
Préenrichissement permet aux bactéries sublétales de
récupérer l'ensemble de leurs potentialités au terme de
leur incubation.
Les milieux utilisés sont des milieux liquides, le
plus souvent on utilise l'eau peptonée tamponnée ou le bouillon
lactosé (Humbert et al., 1998). Pour les
produits laitiers on peut utiliser la solution de Ringer ou la solution tampon
phosphate.
I-5-1-2 L'enrichissement
L'enrichissement vise à minimiser la croissance des
autres bactéries associées au prélèvement et de
poursuivre la multiplication sélective des Salmonella. 0,1ml ou
1ml de la solution de préenrichissement est transférée
dans un ou plusieurs milieux d'enrichissement (10ml de milieu).
Les milieux d'enrichissement sont classés en trois
familles (Humbert et al., 1998) :
ü les bouillons au sélénite
ü les bouillons à base de tétrathionate (le
bouillon Müller Kauffmann)
ü les bouillons qui contiennent du vert de malachite et
du chlorure de magnésium (bouillon Rapapport de Vassiliadis).
I-5-1-3 L'isolement
C'est une phase sélective qui utilise des milieux
solides coulés en boîtes de Pétri. Les milieux d'isolement
contiennent une variété d'association de facteurs
sélectifs (Humbert et al., 1998).
Les Salmonella apparaissent sous forme de colonies
caractéristiques par leur forme, leur couleur et leur morphologie.
Les milieux solides utilisés pour l'isolement
sont :
ü -le milieu de Rambach
ü le milieu Hektoen
ü la gélose Salmonella -Shigella
(gélose SS)
ü la gélose au vert brillant et au rouge de
phénol (VB-RP)
ü le milieu xylose-lysine-tergitol (XLT)
ü le milieu Compass Salmonella
ü le milieu mannitol lysine cristal violet vert brillant
ü la gélose désoxycholate citrate lactose
saccharose (DCLS)
ü la gélose Xylose Lysine désoxycholate
(XLD)
ü la gélose au sulfite de Bismuth.
En dehors des procédés de diagnostic
bactériologiques conventionnels d'autres techniques non conventionnelles
peuvent être utilisées.
Ce sont entre autre :
ü la sensibilité au phage 01 de Félix et
Callow
ü les systèmes standardisés (API 20 E,
RAPID 20 E, Entérotubes Roches, MIS entérobactéries.)
La lyse par le phage 01 (Félix et Callow) qui peut
être utilisée comme épreuve de confirmation à
l'appartenance à Salmonella ne fournit pas des résultats
positifs avec toutes les souches (Gledel and Corbion, 1991).
I-5-2 IDENTIFICATION BIOCHIMIQUE
L'identification biochimique des colonies jugées
caractéristiques se fait en deux étapes :
Ø la recherche des caractères de famille,
très souvent ce sont la coloration de Gram, la présence de la
catalase, l'absence d'une cytochrome oxydase, la mobilité, le type
respiratoire, la culture sur milieu ordinaire et la fermentation du glucose
suffisent pour que les caractères différentiels soient
recherchés.
Ø la recherche des caractères
différentiels nécessite des cultures pures. On utilise à
cet effet le portoir réduit de Le Minor qui est un ensemble de cinq
milieux :
ü le milieu Kliger-Hajna
ü le milieu citrate de Simmons
ü le milieu lysine de fer ou milieu de Taylor
ü le milieu urée-tryptophane
ü le milieu mannitol mobilité nitrate.
v Le milieu Kliger-Hajna (milieu solide)
Le milieu Kliger-Hajna a une couleur rouge carmin. Ce milieu
n'est valable que pour les germes fermentaires. Il entre dans le cadre de
l'étude du métabolisme glucidique et permet l'exploitation de
quatre paramètres :
Ø La fermentation du glucose : Lorsque en
anaérobiose la souche fermente le glucose, il y a formation d'acides
organiques qui acidifient le milieu et entraînent le virage du culot du
rouge au jaune.
Ø La fermentation du lactose (sur la pente) : Elle
se traduit aussi par une coloration jaune du milieu. Cette fermentation
témoigne de la production d'une béta-galactosidase qui hydrolyse
le lactose en galactose et en glucose qui est ensuite utilisé comme
source d'énergie. Les souches qui ne produisent pas de
béta-galactosidase (lactose -) ne peuvent acidifier le milieu, par
conséquent ne peuvent faire virer la couleur de la pente qui reste
rouge. Pour les souches lactose (-), il est nécessaire de faire le test
à l'ONPG (ortho nitrophenyl-galactoside) pour confirmer qu'elles ne
sont pas productrices de béta-galactosidase. En effet certaines souches
apparemment lactose (-) au vu de la couleur de la pente, peuvent être en
réalité des souches lactose (+) qui n'arrivent pas à
faire virer la couleur du milieu parce que le lactose ne peut
pénétrer dans la cellule bactérienne et réagir avec
l'enzyme. Le test de l'ONPG (analogue de lactose) a pour but de faire
éclater les bactéries par choc osmotique dans de l'eau
distillée stérile. Dans ces conditions l'enzyme, si elle existait
dans la bactérie est libérée dans le milieu et
réagit avec l'ONPG entraînant un changement de couleur. Dans le
cas contraire un test négatif confirme que la souche était
effectivement dépourvue de béta-galactosidase.
Ø Production de gaz : Dans le processus
fermentaire du glucose, la décarboxylation du pyruvate est à
l'origine d'un dégagement de dioxyde de carbone (CO2) dont la
pression dans le tube décolle la gélose ; la souche est
ainsi dite gaz (+). Par contre les bactéries gaz (-) ne produisent
aucune trace de gaz.
Ø Production d'Hydrogène sulfuré
H2S: Elle est marquée par une coloration noire de la
gélose issue de sa combinaison avec les ions ferriques. L'absence de
production de H2S ne provoque pas de coloration noire du milieu.
v Le milieu lysine de fer ou milieu de Taylor (couleur
violet)
Il est enrichi en L-lysine et contient du glucose en faible
concentration. Ce milieu permet une étude des constituants en
aérobiose et en anaérobiose.
En aérobiose, il y'a production de lysine
désaminase (LDA) qui catalyse la désamination de la lysine pour
donner des cetoacides qui se combinent avec les sels de fer et donnent une
coloration rouge vineux à la surface de la pente.
Les souches LDA (-) par contre ne peuvent faire virer la
couleur de la pente.
En anaérobiose, le glucose, substrat
préférentiellement utilisé, est fermenté pour
acidifier le milieu. L'utilisation de la lysine comme substrat secondaire
nécessite une lysine décarboxylase (LDC) qui alors est
activée. La LDC, responsable de la décarboxylation de la lysine,
produit la cadavérine qui va alcaliniser le milieu préalablement
acidifié par la fermentation du glucose. Pour les souches LDC (+) le
milieu reste violet : tout se passe comme si la couleur violet avait
viré au jaune et est redevenu violet grâce à la LDC. C'est
pourquoi en l'absence de LDC la coloration du culot reste au stade jaune. Par
ailleurs, il peut y avoir production de H2S
révélé par la formation de sulfure de fer noir.
v Le milieu citrate de Simmons (couleur verte)
Il contient le citrate comme seul source de carbone. Les
bactéries qui seront capables d'utiliser cette source de carbone, vont
croître sur cette gélose et entraîner une variation de pH
à l'origine du virage du milieu au bleu. La gélose reste verte
pour les souches citrate (-).
v Le milieu Urée-indole (milieu liquide)
Le milieu urée-indole ou milieu
urée-tryptophane, est un milieu orange, constitué d'urée
et de tryptophane. Il permet de rechercher trois activités enzymatiques
du métabolisme protéique, à savoir l'uréase, la
tryptophanase et la tryptophane désaminase.
· L'uréase : cette enzyme hydrolyse
l'urée pour donner du carbonate et de l'ammoniac responsables de
l'alcalinisation du milieu qui vire au rose. La couleur jaune demeure pour les
souches qui ne possèdent pas d'uréase active
(uréase -). Ce milieu permet de distinguer le genre Salmonella
(uréase négative donc pas de changement de coloration)
du genre Proteus qui possède une uréase active et
fait virer le milieu au rose.
· La tryptophanase : elle dégrade le
tryptophane pour donner l'indole. Après addition du réactif de
Kovacs, le dimethyl-amino-4-benzaldehyde qu'il contient réagit avec
l'indole et forme un composé coloré en rouge (anneau rouge). Les
souches incapables de provoquer une telle réaction parce que
dépourvues de tryptophanase seront dites indole (-).
· La tryptophane désaminase (TDA) :
L'acide indole pyruvique issu de la dégradation du tryptophane par la
TDA réagit avec le perchlorure de fer III qu'on ajoute pour donner un
précipité brun foncé.
v Le milieu au glycérol (milieu liquide)
Ce milieu est très souvent ajouté aux autres
milieux du portoir de Le Minor ; il est de couleur verte. Il permet de
distinguer Citrobacter de Salmonella Les bactéries
du genre Citrobacter dégradent le glycérol en provoquant
une acidification du milieu (coloration jaune) les Salmonella ne le
dégradent pas, la coloration verte est maintenue.
I-6 THERMORESISTANCE DE Salmonella dans les produits
alimentaires.
La contamination par Salmonella des produits
alimentaires est paucimicrobienne (faible contamination) et superficielle, ce
qui fait que la cuisson adéquate permet une élimination totale de
ces germes. La cuisine inadéquate a été citée comme
un contribuant facteur dans 67% des premières manifestations dans
lesquelles la Salmonella était agent de l'étiologie
(Bean and Griffin, 1990.). Ces premières manifestations ont
impliqué une variété de nourritures, y compris viande et
volaille, lait, glace, fromage, oeufs et produits de l'oeuf, chocolat, et
épices, comme véhicules de transmission (D'aoust, 1989).
La salmonelle est reconnue comme étant la cause
principale des fièvres entériques et des gastro-entérites.
Elle est sensible à la chaleur, et capable de se développer
à une température maximale de 49,5°C. Les pratiques de
sécurité alimentaire ordinaires sont capables de détruire
la Salmonella et les autres bactéries. Comme chez toutes les
autres viandes ou poissons, l'on peut trouver des bactéries dans le
poulet cru ou peu cuit. La majorité d'entre elles se multiplient
rapidement au cours du stockage en dehors du réfrigérateur et
avant la cuisson. La congélation ne tue pas les bactéries, seule
une cuisson au-delà de 100°C les élimine (FSIS, 1998). Le
poulet cru doit être manipulé avec précaution afin
d'éviter les contaminations croisées. Cela peut arriver si le
poulet cru ou ses sucs sont mis en contact avec des aliments cuits ou crus
(salade) qui vont être consommés. Par exemple, cela arrive si l'on
coupe des tomates sur une planche à découper non nettoyée
sur laquelle on a préalablement découpé du poulet cru (.).
Salmonella Enteritidis, un des sérovars des
salmonelles, est en particulier associé à la volaille et aux
oeufs avec leur coquille. Une cuisson adéquate la tue mais cette
bactérie se trouve dans des aliments faits à la main, comme une
salade au poulet par exemple. Les souches thermorésistantes de
Salmonella sont rares et la thermorésistance est
influencée par l'activité de l'eau. Elle augmente quand
l'activité de l'eau du substrat diminue (ICMSF, 1996). Ainsi des
études effectuées (Denis et al., 1992), ont
montré que la thermorésistante de Salmonella
Enteritidis est multipliée par un facteur de 7 à
60°C dans l'oeuf entier salé à 11% (aw = 0,91) par rapport
à l'oeuf entier nature (aw = 0,98). Des Salmonella
"habituées" à des milieux relativement secs (aw, de 0,95)
ont une résistance thermique plus élevée. La persistance
de l'exposition à une faible activité en eau réduit
cependant la thermorésistante (Mattick, Novembre 2000).
La vitesse avec laquelle les micro-organismes sont tués
par la chaleur dépend de la température, de l'humidité, du
type de micro-organismes et du milieu dans lequel se trouvent les
micro-organismes pendant le traitement thermique. Si les micro-organismes sont
piégés dans des tartres ou autres substances, ils se trouvent
protégés et la chaleur même élevée risque
d'être inefficace. La destruction thermique des micro-organismes suit
généralement une loi d'ordre 1 (Mafart, 1991) :
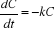
En intégrant cette relation on obtient :
log Ct = logC0 - K × t,
Où C0 est la population originelle de
micro-organismes vivants (numération initiale des organismes viables) et
Ct le nombre total des survivants au bout du temps t, K est une
constante (pente de la droite) et dépend du micro-organisme dont il
s'agit et des conditions d'expérience. K est le taux de
létalité. On voit que le nombre de micro-organismes survivants au
temps «t» est fonction du niveau d'infection initial, ainsi que de la
constante taux de mortalité et du temps de chauffage.
Les salmonelles sont réputées être peu
thermorésistantes puisqu'elles sont tuées rapidement lorsque la
température dépasse 70 °C comme dans le processus de
pasteurisation habituellement appliqué dans les entreprises
agro-alimentaires. La thermorésistance des micro-organismes est
habituellement définie par deux facteurs essentiels. La valeur D indique
le temps nécessaire (en minutes) pour
obtenir une réduction de 90 % du nombre de
micro-organismes viables présents avant le traitement. Cette valeur va
dépendre de plusieurs facteurs: le micro-organisme, le milieu dans
lequel la bactérie se trouve, la température, le pH, le
sérotype et l'aw (mesure de l'eau libre contenue dans une denrée
alimentaire, cette eau libre est nécessaire à la croissance des
micro-organismes). Un deuxième facteur utile à connaître
est le paramètre z. Il s'agit d'une valeur, exprimée en
degrés Celsius, permettant de connaître a priori l'effet
de l'augmentation de température sur l'augmentation de la destruction
des bactéries par la chaleur. Pour Salmonella, cette valeur est
proche de 5° C (Varnam and Evans, 1996). Elle correspond à
l'augmentation de température qu'il faudrait
appliquer pour diminuer la valeur D d'un facteur 10.
La détermination de la thermosensibilité des
bactéries par la méthode des tubes capillaires donne des
résultats peu fiables pour des températures
élevées. L'incertitude de la durée de montée en
température prend beaucoup d'importance au regard des courts temps de
chambrage. Une solution italienne consiste à utiliser un
échangeur pilote permettant un chauffage très rapide. Des
chercheurs italiens développent un appareillage pour déterminer
les cinétiques de destruction des microorganismes thermosensibles, les
coliformes notamment. Il s'agit d'un échangeur thermique de paillasse,
en acier inoxydable. Les coefficients de transfert de chaleur
élevés permettent une montée en température
très rapide. On peut donc déterminer avec fiabilité les
caractéristiques de thermosensibilité bactérienne pour des
températures élevées, justifiant des temps de chambrage
courts. Ce qui n'est pas le cas lorsqu'on utilise des tubes capillaires en
verre plongés dans un bain-marie(Clementi et al., 1995). Lorsque les
températures de traitement sont inférieures où
égales à 60°C, ces auteurs obtiennent les même
résultats d'avec la méthode utilisant les tubes capillaires
plongés dans un bain-marie.
II- MATERIEL ET METHODES
II-1-MATERIEL
II-1-1 Matériel
biologique
Comme matériel biologique nous avons utilisés
les gésiers de poulet cuits et non cuits ; les oeufs de poulet,
trois souches de Salmonella (Salmonella Hadar,
Salmonella Enteritidis, Salmonella Typhimurium).
II-1-2
Matériel de manipulation
Le matériel de manipulation est constitué de
matériel usuel, régulièrement utilisé pour les
manipulations en microbiologie des aliments.
Ce sont: un autoclave, un bec bunsen, des boîtes de
Pétri de 90mm de diamètre, du papier aluminium, trois
étuves de 37, 42 et 80°C, des bains maries réglés
à 37°C, 55°C, 60°C et 48°C, un bain de glace, des
flacons stériles, des Erlenmeyers, des éprouvettes
graduées, des tubes à essais avec ou sans vis, une balance
électronique, un distillateur, un réfrigérateur, des
portoirs, un marker, de l'eau de javel (12°chl), des fourchettes et des
couteaux, des pipettes, une plaque chauffante, du coton cardé, des tubes
à hémolyse, un poupinel, des barreaux aimantés, une
spatule, des pinces, des lames et lamelles, une anse de platine, un microscope
optique, des tubes capillaires en verre sodocalcique de diamètre 6.5 mm
et d'hauteur 15mm, etc.
II-1-3 Les milieux de
culture
Les milieux de cultures utilisés pour l'étude
sont:
-les milieux ordinaires (gélose TCSA, gélose
PCA, bouillon Müller Hinton, gélose Müller Hinton, eau
peptonée tamponnée, tryptone-sel) de l'eau distillée
stérile.
-les milieux sélectifs (géloses SS et Hektoen,
bouillon rappaport de Vassiliadis, bouillon Müller-kauffmann).
-les milieux d'identification de Salmonella
(gélose kligler-Hajna, milieu urée indole, milieu au
glycérol, milieu à la lysine de Taylor).
II-1-4 Les
réactifs
Les réactifs utilisés pour notre étude,
sont ceux qui ont servi à effectuer la coloration de Gram. Ce sont: le
violet de gentiane phéniqué, le Lugol, La Fuschine de Ziehl
dilué, le réactif de Kovacks.
L'éthanol est utilisé comme solvant.
II-2- METHODES
II-2-1- Echantillonnage
Nous avons mené une enquête préliminaire
qui nous a permis de recenser les vendeurs de gésiers de poulet dans
la commune de Cocody. Parmi ces vendeurs nous avons retenu ceux qui vendaient
le plus grand nombre de gésiers.
Un prélèvement de 5 échantillons
(gésiers cuits) est effectué par semaine chez les vendeurs
retenus.
Une fois collectés, les échantillons sont
transportés immédiatement au laboratoire (environ 20 minutes)
dans des sachets plastiques stériles pris individuellement.
Dix grammes sont prélevés à partir de
chaque gésier pour ainsi constituer l'unité d'analyse ou la prise
d'essai. Le gésier est manipulé avec du matériel
stérile. Entre deux dissections les mains sont soigneusement
lavées avec de l'eau de Javel à 12° diluée au
dixième et abondamment rincées avec de l'eau de robinet, tandis
que les couteaux sont stérilisés par flambage à l'alcool.
Le support utilisé comme tare au niveau de la balance (papier aluminium)
est utilisé une seule fois par pesée. Les mains, ne rentrent
jamais en contact avec l'unité d'analyse pour éviter toute
contamination par le manipulateur.
Le nombre d'échantillon analysé est de 60
gésiers cuits, qui s'est effectué pendant trois mois.
Les trois souches de Salmonella serviront à
contaminer un produit alimentaire, pour ensuite réaliser l'étude
de la thermorésistante de ces souches.
II-2-2-Méthode de recherche de
Salmonella
La recherche de Salmonella a été faite
en 4 étapes selon la norme ISO 6579: le pré-enrichissement,
l'enrichissement, l'isolement et enfin l'identification.
II-2-2-1- Le
pré-enrichissement
La prise d'essai (10g) de gésier cuit est directement
mise dans 90 ml d'eau peptonée tamponnée, puis placée
à l'étuve à 37°C pendant 20 heures. Ceci permet aux
salmonelles (éventuellement présentes) de se multiplier en
abondance ; elles deviennent ainsi facilement détectables par la
suite.
Le pré-enrichissement permet la croissance des
salmonelles soumises à un stress ou endommagées par des facteurs
comme l'exposition à la chaleur, la congélation, la
déshydratation, les agents de conservation, une forte pression osmotique
ou d'importantes fluctuations de température (Andrews, 1989; D'aoust,
1989).
II-2-2-2-
Enrichissement
Dans 10 ml de bouillon de Rappaport de Vassiliadis contenus
dans chaque tube à vis stérile, nous mettons 0,1 ml de subculture
à l'aide d'une pipette stérile. Les bouillons sont ensuite
incubés à l'étuve à 42°C pendant un temps de
18 à 24 heures. La sélectivité du bouillon et la
température d'incubation relativement élevée
entraînent l'élimination d'une grande partie de la flore
d'accompagnement et favorisent la croissance des salmonelles.
II-2-2-3-
Isolement
Deux géloses sélectives ont été
utilisées : les géloses SS et Hektoen. Elles sont
ensemencées par technique de stries d'épuisement à partir
d'un même bouillon d'enrichissement et mis en incubation à
l'étuve 37°C.
Après 24 heures, les colonies isolées sur les
géloses présentant les caractéristiques macroscopiques des
salmonelles (colonies incolores à centre noir sur SS et colonies
verdâtre ou bleuâtres à centre noir sur Hektoen) sont
repiquées sur gélose ordinaire pour être soumises à
une identification plus fine. Pour chacune des deux géloses cinq
colonies caractéristiques sont prélevées pour
l'identification.
II- 2-2-4-
L'identification
L'identification des souches de salmonelles fait appel
à une sélection biochimiques des isolats analysés, en
fonction de réactions biochimiques déterminantes; et à une
identification sérologique.
ü Identification de la famille des
Entérobactéries.
Cette identification est rendue possible, après avoir
vérifié que les souches en question sont réellement des
Entérobactéries.
Pour cela, nous avons réalisé un repiquage de
cinq colonies suspectes, sur de la
gélose sélective (gélose Hektoen), dans
le but d'obtenir des souches pures.
Ces souches sont cultivées sur gélose ordinaire
(gélose PCA) que nous avons mis à incuber 24 heures à
37°C.
Nous avons par la suite effectué la coloration de Gram
et l'observation de l'état frais en vue d'obtenir les caractères
majeurs des Entérobactéries.
La coloration de Gram
La coloration de Gram est une technique qui permet de mettre
en évidence les caractères morphologiques (forme et taille) des
bactéries.
Principe de la coloration de Gram.
La coloration de Gram mise au point en 1884, s'effectue en
trois temps :
v Dans un premier temps, les bactéries sont
colorées en violet par un colorant basique tel que le violet de gentiane
puis par une solution de lugol (mordançage).
v Dans un deuxième temps, qualifié de temps de
différenciation, les bactéries sont soumises à l'action de
l'alcool ou d'un mélange alcool + acétone. Les bactéries
se répartissent en deux catégories : celles qui conservent
la coloration violette et qui sont qualifiées de bactéries
à Gram positif et celles qui sont décolorées et qui sont
appelées bactéries à Gram négatif.
v Dans un troisième temps, afin de mieux visualiser
les bactéries décolorées, on procède à un
traitement par la fuchsine ou par la safranine. Les bactéries à
Gram positif apparaissent alors violettes et les bactéries à Gram
négatif se recolorent en rouge ou en orange.
Le violet de gentiane se fixe sur des composants
cytoplasmiques et après ce temps de coloration, toutes les
bactéries sont violettes. Chez les bactéries à Gram
négatif, la paroi, riche en lipides, laisse passer l'alcool (ou le
mélange alcool + acétone) qui décolore le cytoplasme alors
que, chez les bactéries à Gram positif, la paroi constitue une
barrière imperméable à l'alcool et le cytoplasme demeure
coloré en violet.
Pour ce faire, nous avons réalisé des frottis
avec chacune des colonies suspectes, sur des lames propres.
Sur ces frottis, nous avons ajouté le violet de
gentiane que nous avons laissé reposer pendant 2 minutes. Après
ces 2 minutes, nous avons rincé les lames à l'eau de robinet. Par
la suite, nous avons recouvert les différentes lames de quelques gouttes
de Lugol que nous avons laissé reposer pendant 45 secondes. Après
avoir renversé le Lugol, nous effectuons la même opération
avec l'alcool. Enfin, nous ajoutons quelques gouttes de fuschine sur les
frottis, que nous laissons aussi reposer pendant 2 minutes.
La lame est observée après rinçage
à l'eau de robinet, et séchage à la flamme.
L'observation se fait au microscope optique, à
l'objectif 100, après ajout de quelques gouttes d'huile à
immersion sur les différents frottis.
Toutes les souches suspectées et observées sont
de petits bacilles à coloration rouge ou orange caractérisant les
bactéries Gram négatif (bg-).
L'état
frais
L'état frais est une étape qui permet de mettre
en évidence le type de mobilité et la forme des
bactéries.
Pour cela, nous avons ensemencé un bouillon ordinaire
(bouillon Müller Hinton) que nous avons incubé pendant 24 heures
à 37°C.
Une goutte de ce bouillon est déposée à
partir d'une anse de platine, sur une lame porte-objet et recouverte par une
lamelle couvre-objet et l'observation est faite au microscope optique avec les
objectifs (10 puis 40).
Les souches de Salmonella sont mobiles à ciliatures de
type péritriche
ü Identification du genre Salmonella
La souche de Salmonella sp peut être confondue
avec certaines Entérobactéries, de par la similitude de certains
de leurs caractères biochimiques. Ce sont Citrobacter,
Edwarsiella tarda, Proteus vulgaris et
mirabilis.
Pour éliminer donc ces souches proches des salmonelles
des tests de présomption sont effectuées, dans le but
d'identifier les caractères de genre des Salmonella sp.
Pour effectuer cette identification du genre nous avons
ensemencé une mini galerie de 4 milieux d'identification, à
savoir: le milieu Kligler-Hajna, le milieu urée-indole, le milieu au
glycérol et le milieu «LDC» à la lysine de Taylor.
Le milieu urée-indole (orange)
Nous avons introduit environ 1 ml de ce milieu dans un tube
à hémolyse stérile.
Par la suite nous l'avons ensemencé avec une souche
pure, prélevée sur gélose Hektoen. Après incubation
à 37°C pendant 24 heures, une lecture est faite.
La couleur du milieu reste inchangé pour les souches
suspectes, et sont dites uréase négative (non productrices
d'uréase). Dans le cas contraire, il vire au rose.
Pour la mise en évidence de la production d'indole,
nous avons ajouté quelque goutte du réactif de Kovacs dans les
tubes du milieu urée-indole. La dégradation du tryptophane est
marquée par l'apparition d'un anneau jaune, pour les salmonelles qui
sont dites indole négatif. Dans le cas contraire, nous avons un anneau
rouge.
Le milieu Kliger-Hajna
Nous avons ensemencé la gélose à partir
du milieu urée-indole, par piqûre centrale dans le culot et par
stries d'épuisement au niveau de la pente, avec une suspension de
bactérie suspecte. Les tubes sont mis à incuber à
37°C pendant 24 heures.
Le milieu au glycérol (vert)
Nous avons ensemencé ce milieu à partir du
milieu kligler-Hajna.
Après 24 heures d'incubation à 37°C, la
coloration verte reste inchangée pour les souches de Salmonella
qui sont dites glycérol négatif.
Le milieu «LDC» à la lysine de Taylor
(violet)
Nous devrions ensemencer ce milieu, en anaérobiose dans
des tubes à hémolyse, à partir des mêmes souches
pures suspectées; et incubés à 37°C à
l'étuve pendant 24 heures.
La coloration reste inchangée pour les souches de
Salmonella, et sont dites Lysine décarboxylase positive
(LDC+).
En effet la bactérie fermente le glucose dans un
premier temps, ce qui acidifie le milieu (virage du violet au jaune). Dans un
second temps, la salmonelle qui possède une
décarboxylase se met en action ; et les métabolites
formés à partir des aminoacides alcalisent le milieu, qui fait
virer l'indicateur de pH au violet (formation de la cadavérine à
partir de la lysine).
Les résultats des caractères biochimiques vont
nous permettre de confirmer si l'Entérobactérie analysée
est une salmonelle ou pas (tableau I et II).
Tableau I caractères biochimiques
d'identification de Salmonella
|
Milieux
|
Caractères biochimiques
|
Salmonella non typhiques
|
Salmonella typhiques
|
|
S.Typhi
|
S.Paratyphi A
|
|
Milieu Hajna- Kligler
|
Glucose
|
+
|
+
|
+
|
|
Gaz
|
+
|
-
|
|
H2S
|
+
|
+ (faible)
|
-
|
|
Lactose
|
+/-
|
-
|
|
Milieu urée-indole
|
Uréase
|
-
|
-
|
|
Indole
|
-
|
-
|
|
Milieu glycérol
|
Glycérol
|
-
|
-
|
|
Milieu LDC
|
LDC
|
+
|
+
|
Tableau II: caractères différentiels
d'avec les bactéries de la tribut
H2S+gaz+
|
souches
|
Uréase
|
Indole
|
Glycérol
|
LDC
|
|
Salmonella non typhique
|
-
|
-
|
-
|
+
|
|
Citrobacter
|
-
|
-
|
+
|
-
|
|
Edwarsiella tarda
|
-
|
+
|
|
+
|
|
Proteus mirabilis
|
+
|
-
|
-
|
|
Proteus vulgaris
|
+
|
+
|
-
|
II-2-3 - ETUDE DE LA THERMORESISTANCE DE TROIS SOUCHES DE
SALMONELLES
La thermorésistance de trois serotypes de
salmonelles (S. Hadar, S. Enteritidis et S. Typhimurium) est
étudiée dans un bouillon de culture, dans l'oeuf entier et dans
des gésiers après contamination de ces différents
produits.
Préparation de l'inoculum
Des essais préliminaires ont
été effectués pour standardiser le protocole de
préparation de l'inoculum. Le protocole retenu se présente comme
suit :
ü Prélever une colonie de la souche qu'on barbotte
dans 10 ml d'EPT
ü Mettre au bain marie à 37°C pendant 3
heures.
ü Pour obtenir une suspension de 106
bactéries /ml, on prélève 0,3 ml qu'on
introduit dans 10 ml d'eau distillée stérile
ü Pour obtenir une suspension de 108
bactéries/ml, on prélève 7,6 ml du bouillon qu'on
introduit dans 5 ml d'eau distillée stérile.
II-2-3-1- EN BOUILLON DE CULTURE
La suspension préparée est repartie en raison
d'un millilitre (1ml) dans les tubes capillaires scellés à la
flamme du bec bunsen. Ces différents tubes contenant la suspension sont
placés au bain marie préalablement réglé à
la température choisie pour l'étude de la
thermorésistante. Le premier tube est retiré après une
minute d'incubation et les autres tubes vont être retiré à
intervalle de deux minutes jusqu'au dernier tube. Chaque tube retiré est
plongé dans un bain de glace pour le refroidir et ensuite pour
arrêter la croissance microbienne.
Nous nous sommes servis d'une scie pour découper les
tubes capillaires et le contenu est ensemencé avec une gélose
nutritive (TCSA). Les boites de Pétri ensemencés sont mis
à l'incubateur à 37°C pendant 24H.
II-2-3-2- DANS UN OEUF
ENTIER
Nous avons prélevé 0,3mL du bouillon (inoculum)
qu'on introduit dans un tube à vis contenant 10ml d'un oeuf entier
frais. L'oeuf entier est contaminé à 106
bactéries/ml. Avec une pipette stérile nous avons repartit
1ml de l'oeuf contaminé dans chaque tube capillaire scellé pour
ensuite le soumettre à l'effet de la température au bain marie.
Les tubes seront retirés et placés au bain de glace pour ensuite
les casser puis l'ensemencement de leur contenu se fera avec la gélose
TCSA. Les boites de Pétri seront incubés à la
température de 37°C pendant 24 Heures afin de suivre
quantitativement la destruction de la Salmonelle au cours du temps par l'effet
du traitement thermique appliqué.
.
II-2-3-3- DANS LES GESIERS DE
POULET
Plusieurs échantillons de gésiers non cuits
achetés sur les marchés à Cocody ont été
broyés et mélangés dans un récipient, puis
stérilisés dans l'autoclave à 121°C pendant 15mn.
Afin de s'assurer de la stérilité du produit, un
dénombrement total des germes a été effectué
suivant la méthode NF ISO 4833. Ainsi 1g de gésier
stérilisé a été prélevé et mis dans
9ml d'eau peptonée. Après 1 h de décantation, 1ml du
liquide surnageant a été étalé sur de la
gélose nutritive et incubé à 30°C pendant 48h pour
dénombrement.
Le gésier stérilisé a été
inoculée par 3% de la suspension mère d'inoculum. Elle a
été par la suite agitée pendant 5mn puis répartie
dans des tubes en verre à raison de 1g chacun. Chaque tube contient
environ 106 bactéries/g.
Les tubes ont subi par la suite un traitement thermique à
l'aide d'un bain-marie. Ils ont été prélevés
à intervalles de temps prédéterminés puis
analysés afin de suivre quantitativement la destruction de la salmonelle
au cours du temps par l'effet du traitement thermique appliqué.
III-RESULTATS ET DISCUSSION
III-1 RESULTATS
III-1-1 RESULTATS DES SALMONELLES ISOLEES
DES GESIERS CUITS
|
Type de prélèvement
|
Nombre de gésier
|
Temps de la cuisson (min)
|
Résultats
|
|
P1
|
5
|
15
|
négatif
|
|
P2
|
5
|
30
|
négatif
|
|
P3
|
5
|
7 avec pré cuisson
|
négatif
|
|
P4
|
5
|
20
|
négatif
|
|
P5
|
5
|
26
|
négatif
|
|
P6
|
5
|
17
|
négatif
|
|
P7
|
5
|
22
|
négatif
|
|
P8
|
5
|
25
|
négatif
|
|
P9
|
5
|
18
|
négatif
|
|
P10
|
5
|
20
|
négatif
|
|
P11
|
5
|
15
|
négatif
|
|
P12
|
5
|
25
|
négatif
|
|
Total
|
60
|
|
100% négatif
|
III-1-2 RESULTATS DE L'ETUDE DE LA THERMORESISTANCE DES 3
SOUCHES DE SALMONELLA
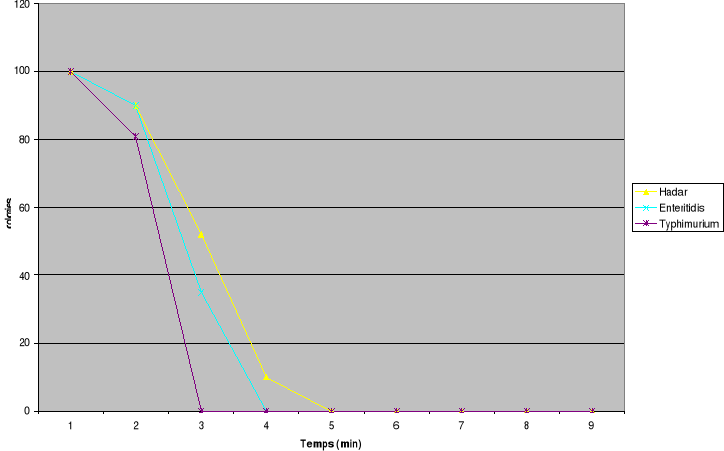
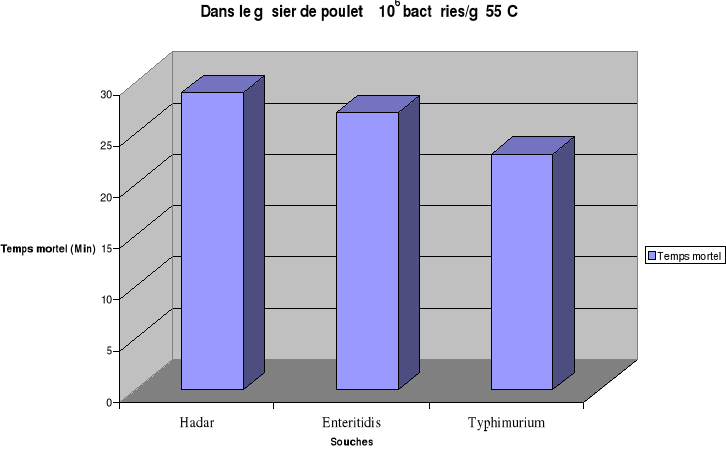
Fig1 : Thermorésistance de
Salmonella Hadar, Enteritidis, Typhimurium dans le bouillon de culture
à 102 bactéries/mL (55°C)
III-2 DISCUSSION
Aucune souche de Salmonella n'a été
isolée des gésiers cuits achetés chez les vendeurs. Dans
les échantillons analysés la température de cuisson et la
durée de la cuisson sont suffisantes pour la destruction totale
d'éventuelles souches de salmonelles.
Ces résultats sont conformes avec ceux de (Rajashekra
et al., 2000) qui ont montré que la viande de poulet est
occasionnellement mise en cause lors des toxi-infections alimentaires en
Grande-Bretagne.
En France, les viandes de volailles sont suspectées
dans 16% des foyers de salmonelloses survenues en 1997(Haeghebaert et
al., 1999). Des toxi-infections collectives assez clairement
associées à la consommation de viande de poulet ont
été rapporté (Chaud et al., 1995), car l'inactivation des
salmonelles dépend de nombreux facteurs et il a été
montré que la survie de ces bactéries pouvait être
observée lors de certains traitements thermiques réputés
assainissant, tels que la cuisson des oeufs durs (Chantarapanont et al.,
2000).
La composition de l'aliment et le sérotype de
salmonelle en présence peuvent faire varier de façon
considérable le résultat obtenu en matière
d'assainissement par la cuisson. Pour cela une analyse qualitative a
été effectuée toutes les 2min. L'étude a
montré qu'après 11min de chauffage à 55°C, il y a
destruction totale de S. Hadar et de 9min de chauffage à la
même température pour une destruction totale de S. Enteritidis et
de S. Typhimurium pour une concentration initiale de l'inoculum de
106 bactéries/mL dans le bouillon de culture. La
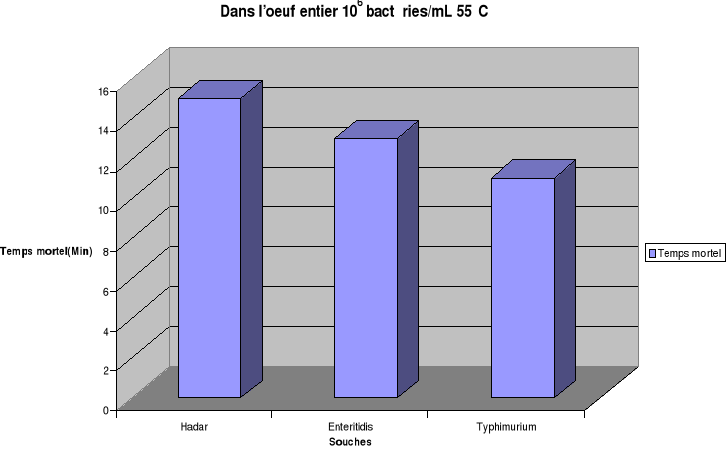
température de chauffage étant fixée à 55°C,
pour une concentration initiale de 106 bactéries/mL ou de
106 bactéries/g le temps de destruction totale (Temps mortel)
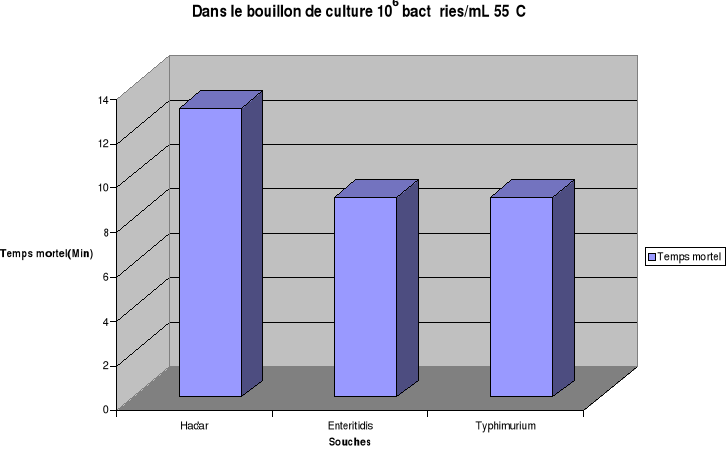
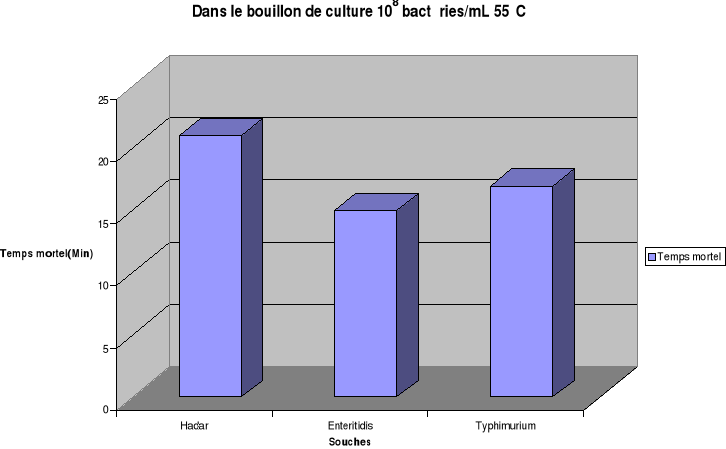
est estimé respectivement pour Hadar, Enteritidis et Typhimurium
à 15 min, 13 min et 11min dans l'oeuf entier ; de 29 min, 27 min et
23 min dans le gésier de poulet.
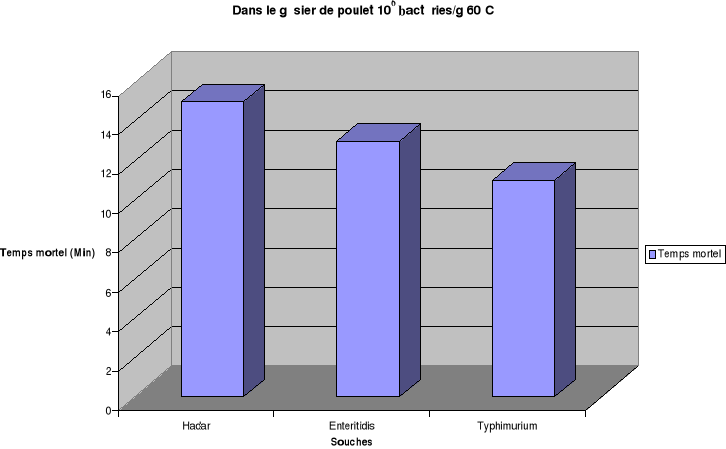
Pour une charge bactérienne de 106
bactéries/mL où de 106 bactéries/g et la
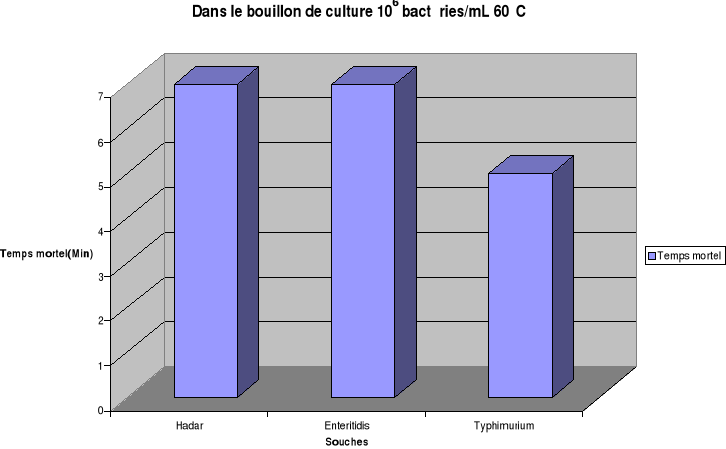
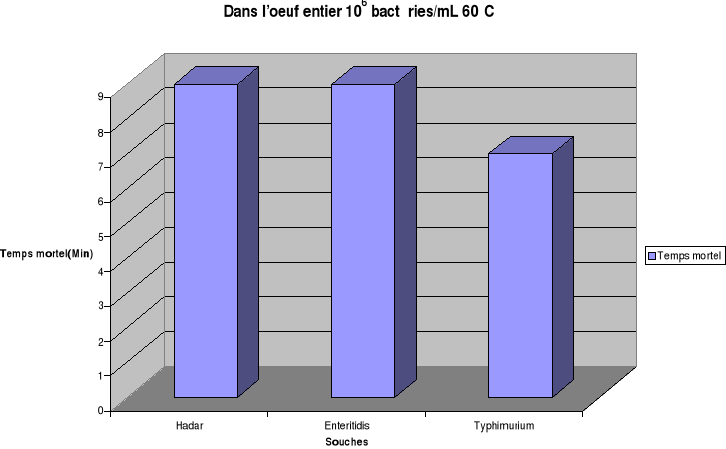
température de chauffage fixée à 60°C, les temps de
destruction totale de Salmonella Hadar sont estimés à
7min, 9min, 15min respectivement dans le bouillon de culture, dans l'oeuf
entier et dans le gésier de poulet. Les temps mortels de S.
Enteritidis sont de 7min, 9min, 13min et pour S. Typhimurium de 5min,
7min, 11min respectivement pour les même matrices.
Ces résultats permettent de déduire que les
salmonelles sont plus résistantes à la température dans
les gésiers de poulet que dans l'oeuf entier. Par contre la
thermorésistance des souches de Salmonella étudiées est
plus importante dans l'oeuf entier que dans le bouillon de culture. Ces
résultats confirment le fait que la thermorésistance augmente
quand l'activité de l'eau du substrat diminue(ICMSF., 1996).
La résistance thermique (D en min) de Salm. Typhimurium
DT104 chauffé dans le bouillon du poulet à 58°C varie de
1,45min à 2,35min dans le boeuf (Juneja and Eblen, 2000 Jun;:.). Les
niveaux de la performance courants exigent que les programmes du traitement
thermiques doivent accomplir une 6.5log10 réduction de Salmonella pour
le boeuf cuit, rôti de boeuf prêt à manger(Service, 1999)
En estimant la charge initiale dans le bouillon de poulet
à 106bactéries /g, le temps mortel sera de 6,5xD
(soit 9,425min). Ce résultat est en corrélation avec celui que
nous avons trouvé dans le gésier de poulet qui est de 11min
à 60°C pour le serotype Typhimurium étudié.
La résistance à la chaleur de six serotypes de
Salmonella (y compris Enteritidis, Heidelberg, et Typhimurium) dans l'oeuf
entier liquide a été déterminée. Le temps de
réduction décimal (D) de chacun des six serotypes a
été déterminé dans l'oeuf entier liquide
chauffé à 56,7°C dans les tubes capillaires en verre
immergés dans un bain-marie a varié de 3,05 à 4,09
min(Brackett et al., 2001 Jul). En utilisant la concentration de 106
bactéries/mL, le temps mortel pourra être estimé à
6xD soit 18,3min pour Enteritidis et Typhimurium alors que pour détruire
complètement Enteritidis et Typhimurium à 55°C dans l'oeuf
entier liquide nous avons trouvé un temps mortel de 13min et 11min
respectivement. Par contre à 60°C, le temps mortel est de 9min pour
Enteritidis et de 7min pour Typhimurium.
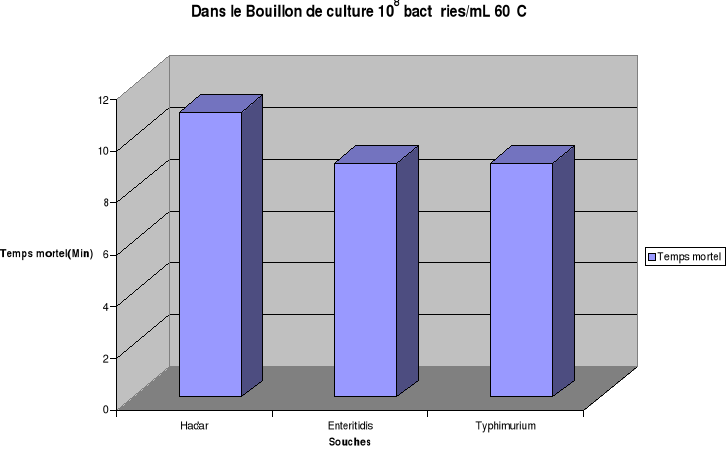
Pour une charge initiale à 108
bactéries/mL, en bouillon de culture le temps mortel est de 21min,
15min, 17min respectivement pour Hadar, Enteritidis, Typhimurium à
55°C et de 11min, 9min, 9min pour ces mêmes souches en bouillon de
culture à 60°C.
L'estimation des temps mortels aux différentes
concentrations et en fonction des substrats permettent de déduire que
Salmonella Hadar est plus thermorésistante que
Salmonella Enteritidis. Par contre Salmonella Typhimurium
parait plus thermosensible que Salmonella Enteritidis dans les
substrats utilisés. En effet ces substrats sont
généralement contaminés par Salmonella
Enteritidis et Hadar et leurs contaminations par Salmonella
Typhimurium est moins spécifique(Rajashekra et al., 2000).
Ailleurs en France, en 1994 Salmonella Hadar a
été trouvée responsable d'une épidémie
touchant 164 personnes. En 1995 Salmonella Hadar (dans le même
pays) était à l'origine de 15 foyers de toxi-infection
alimentaires. Le réseau national de santé publique
français suggérait qu'il y' avait un lien très
étroit entre ces infections et la consommation de viande de volaille non
cuite(Decludt et al., 1996). Un processus thermique efficace s'avère
donc nécessaire pour contrôler le potentiel pouvoir de
contamination des produits carnés lors de la cuisson.
CONCLUSION ET PERSPECTIVE
La difficulté de l'étude de la
thermorésistance réside au fait qu'une surestimation de la
résistance à la chaleur se répercute sur la qualité
organoleptique du produit, alors qu'une sous-estimation occasionne
l'augmentation de la probabilité que le contaminant pathogène
persiste après traitement de la chaleur ou la cuisson.
La Salmonella enterica a longtemps
été reconnue comme un pathogène apporté par la
nourriture et il continue à être une principale cause de
premières manifestations des infections alimentaires collectives
associées à la consommation de la viande et de la volaille.
Cette persistance provient du fait de l'omniprésence de
Salmonella dans l'environnement, sa proéminence dans plusieurs
secteurs de l'industrie d'élevage et de l'agriculture, et le vaste
mouvement de la nourriture et les ingrédients de la nourriture sur le
plan mondial.
Cette étude est importante pour les ménages, les
vendeurs de viande cuite au bord des rues d'être informé sur de
telles variations quand à la limite de l'acceptation du temps de cuisson
sur les points du contrôle critiques qui assurent la
sécurité contre le pathogène que constituent les
salmonelles.
En perspective, nous envisageons que cette étude soit
approfondie sur les divers points suivants :
Déterminer les temps de réduction
décimal D des sérotypes étudiés ainsi que la valeur
z.
Déterminer les mécanismes de la
thermorésistance des Salmonella et les gènes
responsables de cette résistance.
Références bibliographiques.
., A., Quels microorganismes peut-on trouver dans le poulet. Food
info net.
Andrews, W.H., 1989, Methods for recovering injured "classical"
enteric pathogenic bacteria (Salmonella, Shigella, and enteropathogenic
Escherichia Coli) from foods., In: chapter 3.in B.Ray (Ed) injured index and
Pathogenic Bacteria, CRCpress, Boca Raton, F. pp. 55-113.
Arvieux, C., 1998, Les toxi-infections alimentaires. Digest
14 (6), 4-16.
Bean, N.H., Griffin, P.M., 1990, Foodborne disease outbreaks in
the United States, 1973-1987: pathogens, vehicles, and trends. J. Food
Prot. 53, 804-817.
Bjerrum, L., Pedersen, A.B., Engberg, R.M., Mars 2005, The
influence of whole wheat feeding on Salmonella infection and gut flora
composition in broilers. Avian Dis. 49, 9-15.
Bornert, G., 2000, le poulet sans salmonelles : mythe ou
réalité ? Revue Méd. Vét. 151(12),
1083-1094.
Brackett, R.E., Schuman, J.D., Ball, H.R., Scouten, A.J., 2001
Jul, Thermal inactivation kinetics of Salmonella spp. within intact eggs heated
using humidity-controlled air. J Food Prot 64 (7), 934-938.
Chantarapanont, W., Slutsker, L., Tauxe, R., Beuchat, L., 2000,
Factors influencing inactivation of Salmonella Enteritidis in
hard-cooked eggs. J Food Prot. 63, 36-43.
Chaud, P., Guyonnet, J.P., Dabouineau, L., 1995, les poulets
achetés rôtis chez un traiteur, un mode de transmission des
salmonelloses ? Etude d'une toxi-infection alimentaire à Salmonella
Typhimurium survenue dans une commune de l'Hérault. Bulletin
Epidémiologique Hebdomadaire. 24, 109-110.
Clementi, F., Parente, E., Ricciardi, A., Addario, G., Moresi,
M., 1995, Heat resistance of Escherichia coli in goat milk: a comparison
between the sealed capillary tube technique and a laboratory slug flow heat
exchanger. Ital. J. Food. Sci. 3, 235-243.
D'aoust, J.-Y. 1989. Salmonella. In Chapter 9. Foodborne
Bacterial Pathogens, Marcel Dekker Inc,. (New York, NY, In M.P.Doyle (Ed)), pp.
327-445.
Decludt, B., Haeghebaert, S., Bouvet, P., Grimont, P.A.D., 1996,
Epidemiologie de salmonellose à Salmonella serotype Hadar,
France Juin-Septembre 1995. BEH 32, 14-41.
Denis, C., Protais, J., Corbio, B., Picoche, B., Colin, P.,
Lahellec, C., Pichon, P., Fremy, S., Boscher, E., Audiiot, V., 1992,
Thermorésistance de Salmonella Enteritidis inoculée dans des
ovoproduits, influence de l'activité de l'eau sur la
thermorésistance. Industries alimentaires et agricoles 112 (9),
659- 663.
Donald, E.C., Août:/ Septembre 2004., Communication sur la
flore pathogène des volailles. Newsletter n°10.
Dumas, J., 1958, Tribu des Salmonellae, In:
Bactériologie Médicale. Flammarion et Cie, pp. 399-433.
Encyclopédie ENCARTA 2004. Salmonelles (Microsoft).
FSIS, U., janvier1988., Service d'inspection et de la
sécurité des aliments du Département de l'Agriculture des
Etats-Unis.
Gledel, J., Corbion, B.e.a., 1991, Le genre Salmonella dans le
contrôle Microbiologique, 2ème édition Edition, 480 p.
Grimont, P., Grimont, F., Bouvet, P., 2000, Taxonomy of the genus
Salmonella., In: Wray C., W.A. (Ed.) Salmonella in Domestic Animals.
CABI Publishing, Oxon, pp. 1-17.
Haeghebaert, S., Delarocque-Astagneau, E., Vaillant, V., Le
Querrec, F. 1999. Les toxi-infections alimentaires collectives en France en
1997. In bulletin épidémiologique annuel (Réseau National
de Santé Publique Saint Maurice.), p. 192.
Hanes, D., 2003, Nontyphoid Salmonella, Bier J. (Eds)
International Handbook of Foodborne Pathogens Edition. Milotis N., New york,
137-149 pp.
Hu, L., Kopecko, D., 2003, typhoid salmonella., Bier J.,
International Handbook of Foodborne pathogens. Edition. Milotis N, New York,
151-165 pp.
Humbert, F., Sautra, L., Federighi, M., Jouve, J.-L., 1998, Les
salmonelles, In: Manuel de bacteriologie alimentaire. pp. 27-52.
ICMSF., 1996, Micro-organisms in Foods. Microbiological
specifications of food pathogens. Blackie academic & Professional
5, 217- 225.
Juneja, V.K., Eblen, B.S., 2000 Jun;:. Heat inactivation of
Salmonella typhimurium DT104 in beef as affected by fat content. Lett Appl
Microbiol. 30(6), 461-467.
Korsak, N., Clinquart, A., Daube, G., 2004, Salmonella spp dans
les denrées alimentaires d'origine animale: un réel
problème de santé publique? Ann.Med.Vet. 148,
174-193.
Le Minor, L., Popoff, M.Y., 1987, : Request for an Opinion.
Designation of Salmonella Enterica sp. Nov. nom. rev, as the type and only
species of the genus Salmonella. Int. J. Syst. Bacteriol. 37, 465-468.
Mafart, P., 1991, Génie Industriel Alimentaire, In:
Technique et Documentation. Lavoisier, Paris.
Mattick, K.L.e.a., Novembre 2000, sécurité
alimentaire. Applied and Environmental Microbiology 66, 4921-4925.
Ouattara, G.H., 2005. Taux de portage, serotypage et
antibiorésistance des souches de salmonelles isolées des
gésiers de poulets vendus sur les marchés d'Abidjan. DEA. Cocody,
Abidjan.
Rajashekra, G., Haverly, E., Halvorson, D., Ferris, K., Lauer,
D., Nagaraja, K., 2000, Multidrug-resistant Salmonella Typhimurium DT
104 in poultry. J.Food prot 63 (2), 155-161.
Reeves, M.W., Evins, G.M., Heiba, A.A., Plikaytis, B.D., Farmer
III, J.J., Nov.1989, Clonal nature of Salmonella Typhi and its genetic
relatedness to other Salmonella as shown by multilocus enzyme electrophoresis
and proposal of Salmonella bongori comb. J. Clin. Microbiol. 27,
313-320.
Salm-Surv, G. 2005. Un réseau de l'OMS pour la
surveillance des maladies d'origine alimentaire,. In note d'information INFOSAN
N°6 / - Programme Global Salm-Surv de l'OMS.
Service, U.S.D.o.A.F.S.a.I., 1999, Performance standards for the
production of certain meat and poultry products. Fed. Regist. 64,
732-749.
Shelobolina, E.S., Sullivan, S.A., O'neill, K.R., Nevin, K.P.,
Lovley, D.R., Nov 2004, Isolation, characterization, and U (VI)-reducing
potential of a facultatively anaerobic, acid-resistant bacterium from low-pH,
nitrate- and U (VI)-contaminated subsurface sediment and description of
Salmonella subterranea sp. . Appl. Environ. Microbiol. 70,,
2959-2965.
Traoré, I., 2003. Portage et antibiorésistance des
souches de salmonelles isolées des viscères de poulets vendus sur
les marchés d'Abobo. DEA. Abobo-Adjamé, Abidjan.
Varnam, A.H., Evans, M.G., 1991, Foodborne Pathogens. Wolfe
Publishing Ltd.
Varnam, A.H., Evans, M.G. 1996. Salmonella,
édition, n., ed. (London, Manson publishing), pp. 51-86.
ASPECTS DES COLONIES SUSPECTES DE Salmonella SUR LES
MILIEUX D'ISOLOMENT USUELS
|
COLONIES SUSPECTES :
Salmonella
|
Autres colonies non
suspectes
|
|
Gélose VB-RP
|
Ø Colonies rouges car lactose -, saccharose -
|
Ø Colonies jaunes car lactose + et/ou saccharose +
|
|
Gélose Hektoen
|
Ø Colonies vertes ou bleues car lactose -, saccharose -,
salicine -
Ø Centre noir car H2S+
|
Ø Colonies jaunes car lactose + et/ou saccharose +
et /ou salicine+
|
|
Gélose SS
|
Ø Colonies incolores car lactose -
Ø Centre noir car H2S+
|
Ø Colonies rouges car lactose +
|
|
Gélose DCL
|
Ø Colonies incolores car lactose -
Ø Centre noir car H2S+
|
Ø Colonies rouges car lactose +
|
| 


