|

Ep igrap hie
n
L'intelligence n'est pas de tout savoir mais de savoir où
trouver l'information (Einstein, A).
n Les os et le cerveau de l'homme moderne contiennent de plus
en plus d'aluminium, ses dents et ses reins de plus en plus de mercure
(Anonyme, 2008) <
www.bioperfection.com/sante/toxicite
> (17-04- 2008).

Dédicace
A mon père KONDA ku MBUTA Augustin pour l'esprit
perfectionniste qu'il m'a inculqué et pour le soutien matériel
dont j'ai toujours bénéficié ;
A ma mère MOKE MAWETE Emilie pour le grand amour
maternel et pour tous les encouragements qui m'ont permis d'aller toujours de
l'avant ;
A mes frères et soeurs : KONDA Audry, KONDA Mirna,
KONDA Guelord, KONDA Pamela, KONDA Bénédicte, KONDA Gracia, KONDA
Martin et KONDA Exaucé. Que ce cheminement soit pour vous non seulement
un exemple à suivre mais aussi un objectifprioritaire à atteindre
avant toute chose.
A mes cousins et cousines, demi-frères et demi-soeurs,
neveux et nièces, oncles et tantes, grands-mères et
grands-mères pour le même patrimoine sanguin qui coule dans nos
veines et l'héritage génétique que nous partageons.
A vous tous, je dédie ce présent travail.

Remerciements
Au terme de ce travail qui sanctionne la fin de notre
deuxième cycle universitaire, qu'il nous soit permis de manifester notre
profonde reconnaissance à tous ceux qui ont contribué à sa
réalisation.
Nous pensons tout d'abord au Professeur MBUYI MUSONGELA qui,
malgré ses multiples occupations, a bien voulu assumer la direction du
présent travail. Qu'il trouve ici l'expression de notre très
haute considération.
Nous remercions d'une manière particulière les
Chefs de Travaux et Assistants TUAKUILA Joël, NGBOLUA Jean-Paul, KABAMBA
Martin et KABENA Odette pour leurs remarques et suggestions
bénéfiques à l'élaboration de ce travail.
Que tous nos collègues d'auditoire: Mani LEKWA, Willy
KETO, Bébé NKONGO, Rudi TSHIMANGA, Jolly TSHIBWABWA et sans
oublier ceux du « Staff Q.L » : Yannick MULUMBA, Noé KALALA et
Trésor BAENDO, soient rassurés qu'ils resteront à jamais
graver dans notre coeur.
Que tous nos condisciples du Collège Saint
Raphaël, du Staff « Avec le temps » et autres pour les moments
inoubliables passés ensemble.
Nous remercions aussi nos chers amis le webmaster Mtoto Mzuri
pour avoir contribué à la mise en forme finale du présent
travail, Mfuka Confiance pour nous avoir aidé à cartographier la
zone d'étude et surtout à Hursile NSIMBA pour son
réconfort permanent.
Enfin que tous nos amis dont nous taisons expressément
les noms de peur d'omettre certains trouvent ici l'expression de nos
sincères et amicaux remerciements.
"Ad vitam aeternam"
KONDA KUMBUTA Ready
Alias R.K.OGM.

Liste des sigles et abréviations
°C : degré Celsius
iag : microgramme
ial : microlitre
Å : angström
AAS : atomic absoption spectrometry (spectrométrie
d'absorption atomique)
ACGIH : american conference of governmental industrial
hygienists
(conférence gouvernemental américain des
hygiénistes industriels)
Al : aluminium
ANOVA : analyse de variance
cc : centimètre cube équivalent du millilitre (ml)
Cf. : confère
cm3 : centimètre cube
Fig. : figure
g : gramme
Ge : germanium
HCl : acide chlorhydrique
Hg : mercure
HNO3 : acide nitrique
IBE : indice biologique d'exposition (pour les sujets
professionnellement exposés)
IC : intervalle de confiance
ICP-MS : inductively coupled plasma mass spectrometer
(spectrométrie de masse à plasma induit par haute
fréquence)
In : indium Ir : iridium L ou l : litre m : mètre
m2 : mètre carré
m3 : mètre cube
mg : milligramme

MG : moyenne géométrique N : taille de
l'échantillon
NHANES : national health and nutrition examination survey
(inspection nationale d'examination de la nutrition et de la santé)
OMS : organisation mondiale de la santé
ORS : octopole reaction system (système de réaction
à huit pôles)
P : degré de signification statistique
P50 : 50 è percentile P75 : 75
è percentile P90: 90 è percentile P95 : 95
è percentile ppb : partie par billion (partie par mille
milliard)
ppm : partie par million
PTWI : provisional tolerable weekly intake (absorption
hebdomadaire prévisionnelle tolérable)
Rh : rhodium
Se : sélénium
SNC : système nerveux central
SnCl2 : chlorure d'étain ou chlorure stanneux TCA : acide
trichloroacétique
TLV : thresold limit value (valeur limite seuil)
Toxi-UCL : Laboratoire de Toxicologie Industrielle et
Environnementale de l'Université Catholique de Louvain
TWA : thresold weighted average (valeur limite moyenne
pondérée) v/v : volume par volume
VME : valeur limite moyenne d'exposition.
Abstract
Aim of study: A human biomonitoring of internal contamination
has been undertaken in one of quarters of Kinshasa town, in order to evaluate
eventual risks in the population in association with urines concentrations of
aluminium and mercury.
Materials and methods: Population of study has been
constituted by 110 subjects males and females aged at least 6 years. Period of
the recolt of samples was being extended from April 22nd to May
23rd. The urines concentrations of aluminium have been measured
using ICP-MS and those of mercury by AAS. The ArcGIS 9.2 and Ikonos softwares
were used to cartography the area of study. NCSS 2004 and PrismPadgraph 3.0
computer programs have been used for statistical analysis of datas.
Results: The geometrics averages obtained for whole of the
participants were 12,43 (11,11-13,90) itg/L with a 95th percentile
of 55,73 (33,34-156,00) itg/L for aluminium and 5,71 (5,29-6,17) itg/L with a
95th percentile of 14,33 (11,89-23,43) itg/L for mercury. For
aluminium signicants differences have been observed between sexes (P<0,05)
and between the consumers of beer and non consumers (P<0,05). While one high
significant difference alone has been noted between smokers and non smokers for
mercury (P<0,05).
Conclusion: Urines metallics concentrations are abnormally
highest and the observed values illustrate some more severes intoxications for
certains subjects. Moreover, the risks incurred by population of Kinshasa can
be compared with population exposed professionally and raise some problems in
public health.
Résumé
Objectifs : un biomonitoring humain de contamination interne a
été conduit au quartier Matadi dans la commune de Bumbu, afin de
mettre en évidence les éventuels risques encourus par la
population exposée à l'aluminium et au mercure.
Matériel et méthodes : la population
d'étude est constituée de 110 sujets de sexes masculin et
féminin de plus de 6 ans. La période de récolte des
échantillons biologiques s'est étendue du 22 avril au 23 mai
2008. Les concentrations urinaires d'aluminium ont été
mesurées par ICP-MS et celles du mercure par AAS. Ensuite les programmes
ArcGIS 9.2 et Ikonos ont été utilisés afin de
cartographier le milieu d'étude. Enfin, les logiciels NCSS 2004 et Prism
Padgraph 3.0 ont été utilisés pour les traitements
statistiques des données.
Résultats : les moyennes géométriques
obtenues pour l'ensemble des participants étaient de 12,43 (11,11-13,90)
gg/L avec un 95è percentile de 55,73 (33,34-156,00) 1.1g/L
pour l'aluminium et de 5,71 (5,29-6,17) gg/L avec un 95è
percentile de 14,33 (11,89-23,43) gg/L pour le mercure. En ce qui concerne
l'aluminium, des différences significatives ont été
observées entre les sexes (P<0,05) et entre les consommateurs de la
bière et les non- consommateurs (P<0,05). Par contre, pour le
mercure, une seule différence hautement significative a
été notée entre les fumeurs et les non-fumeurs
(P<0,05).
Conclusion : les concentrations urinaires en micropolluants
anormalement élevées qui ont été observées,
indiquent des intoxications plus ou moins sévères pour certains
sujets. En outre, les risques encourus par la population sont comparables
à ceux de la population professionnellement exposée et
soulève donc un problème de santé publique.

Introduction
En République Démocratique du Congo (RDC)
où les règles phytosanitaires sont inexistantes, les normes
sanitaires et hygiéniques réglementant la teneur des
micropolluants environnementaux chez l'homme font défaut. A cet effet,
il est donc urgent de mener une enquête transversale afin
d'évaluer l'état de santé de la population de Kinshasa et
en particulier celle du quartier Matadi dans la commune de Bumbu à la
suite de leur exposition aux substances xénobiotiques.
Un choix particulier a été opéré
sur l'aluminium et le mercure que l'on considère comme principales
sources d'exposition et d'intoxication de la population à cause de ses
habitudes alimentaires et cosmétologiques.
En effet, l'usage abusif des produits cosmétiques ainsi
que des habitudes hygiéniques de la population congolaise en
général et des kinois en particulier sont devenus une
préoccupation majeure du point de vue sanitaire. La
dépigmentation de la peau (par application des savons mercuriels
contenant de l'iodure de mercure ou autres produits) chez la grande
majorité des femmes et certains hommes depuis les années 70
jusqu'à nos jours, ne cesse d'exposer les consommateurs, utilisateurs ou
patients à de graves problèmes de santé à court,
moyen et long terme (LINDSEY et al., 2004).
Par ailleurs, force est de constater également que
l'artisanat kinois qui fournit des ustensiles de cuisine en aluminium bon
marché mais dont la qualité ne respecte pas les normes
internationales de fabrication est une source d'exposition et d'intoxication
aluminique surtout pour les populations à faible revenu de Kinshasa
(GUILLARD, 2004).
C'est dans ce cadre qu'une étude visant
l'évaluation de ces deux micropolluants dans la population cible a
été réalisée pour mesurer le niveau de
contamination de cette dernière.
Etant donné que la population kinoise serait
exposée à des métaux toxiques tels que l'aluminium et le
mercure, nous nous fixons comme objectifs de:
· Déterminer les concentrations en métaux
lourds dans les urines de la population cible;
· Mesurer leurs moyennes géométriques dans
les urines de la population cible;
· Calculer les intervalles de confiance à 95% et les
percentiles (50è , 75è,90 è et
95è) ;
· Comparer les résultats obtenus entre les groupes
et avec les données de la littérature.
L'intérêt d'une telle étude est
évident; car elle servirait de données de référence
pour les études épidémiologiques ultérieures.

Outre l'introduction, la conclusion et les annexes, ce
présent travail est subdivisé en deux parties : la partie
théorique qui contient le chapitre premier consacré à la
revue de la littérature sur l'aluminium et le mercure; la seconde partie
expérimentale qui contient le deuxième chapitre traite les
matériel et méthodes ainsi que du dernier chapitre qui analyse
les résultats et leur discussion.
Chapitre I : Revue de la littérature
1. Aluminium
1.1. Définition et répartition
L'aluminium est un métal blanc gris (HACHET, 1992).
Constituant à peu près 8% de l'écorce terrestre, il est le
troisième élément après l'oxygène et le
silicium. C'est un métal léger, de numéro atomique 13 et
de poids atomique 27, mais qui se comporte comme un métal lourd dans
l'organisme (MOREAU, 1993).
Par ailleurs, les nombreuses propriétés
physico-chimiques de l'aluminium (basse densité environ 2,70
g/cm3, grande malléabilité, grande ductilité,
bonne conductivité électrique et chimique, résistance
à la corrosion, à la traction, etc.) en font un métal
très utilisé pour des applications diverses et variées
(GOURIER-FRERY, 2003).
1.2. Formes chimiques
L'aluminium existe principalement sous deux formes : les
poussières métalliques et les sels solubles (HACHET, 1992). En
effet, la forme chimique sous laquelle l'aluminium est ingéré par
l'organisme se présente sous la forme de sels qui, pour être
absorbés, doivent être solubles. Ainsi, on ne devrait même
pas parler d'aluminium mais plutôt des sels d'aluminium <
www.invs.santé.fr/publications/2004>
(17-04-2008). Ceci revient à dire qu'il se trouve très souvent
sous la forme combinée, lié à d'autres molécules
inorganiques comme le chlore, le fluor, ou lié à des acides
organiques comme l'acide citrique, l'acide glutamique, l'acide lactique, le
maltol, etc. (PILETTE, 2008).
1.3. Principales sources d'exposition anthropiques
(HACHET, 1992 ; MOREAU, 1993 ; REICHL, 2002 ; PILETTE, 2008)
Cimenterie et
ciments
Les additifs alimentaires (colorants, anticoagulants)
Cosmétiques et produits
d'hygiène
(brunisateur,
dentifrices, déodorants,
antiperspirants, rouge
à
lèvres,...)
Usage médicamenteux
(substances actives
contenant
l'Aluminium par ex. les
antiacides, l'Al vaccinal,...)
Traitement de l'eau du robinet
ou de ville (alun
sulfate
d'aluminium, chlorure de
polyaluminium,...)
Usage professionnel et
industriel (fonderie de
minerai
avec les risques occultés de
pluies d'Al,...)
Modes de cuisson et
de préparation
(papillotes,
ustensiles
de cuisine,...)
Conditionnements
et
acidités
(canettes,
emballages,...)
Figure 1 : Schéma illustrant les sources d'exposition
aluminique pour l'homme.
1.4. Importance dans l'organisme
L'aluminium est omniprésent dans notre vie
quotidienne. Il est cependant, un cation dangereux à dose relativement
forte mais nécessaire comme oligoélément à
très faible dose pour éviter l'insomnie, l'anxiété
et diverses névrites. Cofacteur de la vitamine B 1, il stimule les
fonctions cérébrales et régularise le sommeil. Lorsque la
fonction rénale est normale, une absorption journalière d'environ
20 mg d'Al ne pose
pas de problème. La prise d'aluminium par
l'intermédiaire de l'alimentation (thé, carotte, etc.) ne
présente aucun danger et peut-être utile dans la prévention
des effets nocifs de surcharges aluminiques grâce à ses
propriétés anti-oxydantes (REICHL, 2002 ; PILETTE, 2008)
<
www.naturosante.com/rubriques/conseils/>
et <
www.imaage-paris.com/actu/article>
(17-04-2008).
1.5. Toxicité et organes cibles
La toxicité de l'aluminium a été prise
en compte vers 1972 chez les insuffisants rénaux dialysés
chroniques (MOREAU, 1993). En médecine de l'environnement, on
s'intéresse principalement aux composés inorganiques d'aluminium
avec l'ion trivalent Al3+ (REICHL, 2002). Seuls les sulfates,
nitrates et chlorures d'aluminium, solubles, sont potentiellement toxiques mais
pas les silicates et les phosphates d'aluminium qui sont insolubles <
www.invs.sante.fr/publications/2004>
(17-04-2008).
Toxique en grandes quantités, l'aluminium semble
affecter les os (causant sa fragilité ou ostéoporose), les reins,
le cerveau, les poumons, l'estomac, et les muscles (REICHL, 2002) ; <
www.pharmacorama.com/Rubriques/>
(18-04-2008). Il est aussi génotoxique c'est-à-dire capable de
provoquer des mutations dans les gènes, aussi bien dans les cellules
végétales qu'animales (PILETTE, 2008).
1.6. Toxicocinétique
Certains facteurs jouent un rôle dans la manifestation
des effets toxiques : l'espèce, l'âge, le sexe, l'appartenance
ethnique, les variations individuelles, des facteurs physiologiques (grossesse,
nutritions, hyperventilation, hypersudation,...), des états
pathologiques (hépatites, asthme,...), des facteurs environnementaux,
etc. (BERAUD, 2001).
Absorption : elle dépend de la spéciation et de
la solubilité du composé dans le milieu biologique
considéré. L'aluminium peut être ingéré par
voie digestive (0,1 à 1%), inhalé par voie pulmonaire ou
pénétré par voie transcutanée (De DUGGAN, et al.
1992). Son absorption au niveau intestinal est surtout facilitée par les
acides organiques et le glutamate. Il peut aussi pénétrer par
injection intraveineuse, intramusculaire ou sous-cutanée (PILETTE,
2008).
Distribution et bioaccumulation : 80% de l'aluminium sont
transportés liés aux protéines (albumine ou transferrine).
La distribution tissulaire prédomine au niveau de l'os, siège de
stockage (TESTUD, 1998). La charge naturelle en aluminium chez le sujet sain
varie de 30 à 50 mg (ATSDR, 1999), et se répartit essentiellement
dans les os (de l'ordre de 50%), les poumons (environ 25%) et le foie (20
à 25%). Le pourcentage restant se répartit dans les autres
organes, notamment le SNC et la rate (GOURIER-FRERY, 2003).
Métabolisme : le lieu d'absorption serait plutôt
stomacal ou duodénal proximal parce que l'aluminium est soluble à
pH autour de 4 mais peu soluble à pH 6 à 9 (MOREAU, 1993).
L'aluminium en se déposant au niveau des os est sous forme de phosphate
d'aluminium difficilement soluble (REICHL, 2002).
Excrétion : elle est principalement rénale
(95%) et faiblement fécale (<5%) (REICHL, 2002). En outre,
l'arrêt de l'exposition est suivi d'un relargage à partir des os
et d'une excrétion urinaire pendant plusieurs mois ou années
(TESTUD, 1998). Cependant, il existe par ailleurs des différences
importantes entre individus sans oublier l'effet de l'âge : « plus
on vieillit, plus les fonctions rénales sont perturbées et moins
on élimine l'aluminium » (GOURIER-FRERY, 2003 ; GUILLARD, 2004)
<
www.invs.santé.fr/publications/2004>
(18-04-2008).
1.7. Toxicodynamique
Le rayon de l'ion Al3+ étant de 0,5
Å, il est donc très polarisant, ce qui explique qu'il interagit
avec les molécules d'eau et les anions hydroxyle, sulfate, phosphate et
fluorure <
www.pharmacorama.com/Rubriques>
(18-04-2008). Au contact d'un acide fort, des ions Al3+ peuvent se
détacher pour être libéré en solution (REICHL,
2002).
La demi-vie dépend de la durée d'exposition mais
aussi de la distribution de l'aluminium à partir des sites de stockage ;
elle serait triphasique : une demi-vie urinaire d'environ 7 heures, une de
quelques semaines et une de plusieurs mois voire années selon
l'ancienneté de l'exposition (GOURIER-FRERY, 2003) <
www.inrs.fr> (01-09-2008).
Interaction : dans l'organisme, l'ion aluminium
présente des analogies avec l'ion ferrique avec lequel il pourrait
entrer en compétition au niveau de certains enzymes ou sites de
fixation <
www.pharmacorama.com/Rubriques>
(18-04-2008). Comme c'est le cas du fer, l'aluminium interfère aussi
avec le métabolisme du fluor, du phosphore, du cuivre, du vanadium, du
zinc, du silicium, ce qui peut donner lieu à de multiples
désordres. Au niveau du foie, il perturbe le métabolisme des
graisses et favorise ainsi l'obésité (PILETTE, 2008). Le manque
de fer, de calcium et magnésium augmente également l'absorption
de l'aluminium <
www.invs.sante.fr/publications/2004>
(18-04-2008).
1.8. Doses acceptables et valeurs d'exposition biologique
Des valeurs aux alentours de 10 iag d'Al/l de sang sont
normales. Un taux supérieur à 60 iag d'Al/l de sang est le signe
d'une véritable intoxication. Les symptômes cliniques apparaissent
à partir de taux supérieur à 60 ig/l de sang pour les
sujets professionnellement exposés (REICHL, 2002 ; TESTUD, 1998).
Tableau 1 : Valeurs limites pour l'aluminium (ACGIH, 2003 ;
Toxi-UCL, 2007)
Formes physico-chimiques
|
TLV-TWA
|
Valeurs de référence
|
Métal et oxyde
Poudre pyrophorique Sels solubles
Alkyls
|
10 mg/m3 5 mg/m3 2 mg/m3 2
mg/m3
|
< 30 gg/g de créatinine
Idem
Idem
Idem
|
|
2. Mercure
2.1. Définition et répartition
Ce métal blanc argenté est le seul qui,
à la température ordinaire, se présente sous la forme d'un
liquide très mobile de densité 13,53 g/cm3 ; de
numéro atomique 80 et de poids atomique 200,59. Il est non toxique
lorsqu'il est pur. (HACHET, 1992). Le mercure n'est cependant pas
biodégradable ni dégradable. Il reste un polluant tant qu'il est
accessible pour les êtres vivants. En outre, il est assez peu abondant
dans la nature (Encarta, 2007). Il est soluble dans les acides en formant des
composés mono et bivalents ; il n'est attaqué ni par l'eau, ni
par les alcalins.
Médicaments et vaccins
(mercurochrome,...)
Crémation des
ordures ménagères
Industrie chimique et
des métaux
(peinture,
pigment,...)
Vapeur de mercure
provenant d'amalgames
dentaires, des
thermomètres
brisés, baromètres,
Raffinerie,
Papeterie,...)
Fongicides et
insecticides
(agriculture)
Produits cosmétiques &
Savons
antiseptiques
(Mekako®, Top®,
Jaribu®,...)
Fabrication et destruction
des matériels
électriques
(piles, ampoules,
batteries,...)
Industrie du textile et
du cuir
Poissons (surtout
les prédateurs)
2.2. Principales sources d'exposition anthropiques
(FREMY et al, 2000 ; HACHET, 1992 ; LANNOYE, 2001 ; Encarta,
2007).
2.3. Spéciation ou formes chimiques
Le mercure existe sous trois différentes formes :
élémentaire ou métallique, inorganique (sels de mercure)
et organique (composés arylés, alkoxyalkylés et
alkylés) (FLEISHER, 2001).
2.4. Importance dans l'organisme
Le mercure n'a aucune fonction métabolique qui serait
indispensable chez l'homme. Il peut donc causer une très grande
variété d'effets délétères (FLEISHER,
2001).
2.5. Toxicité et organes cibles dominants
Le mercure est considéré comme le métal
lourd le plus toxique. Il existe trois formes de toxicité : aiguë,
à court terme (subaiguë ou subchronique) et à long terme
(chronique). La toxicité peut varier en fonction de différents
facteurs notamment la voie d'absorption, la rapidité d'administration,
la concentration, la solubilité, la volatilité, la nature du
véhicule servant à dissoudre la substance (BERAUD, 2001).
L'intoxication au mercure s'appelle « mercurialisme ou
hydrargyrisme (hydrargyrie) ». Le mercure est aussi
considéré comme un toxique polyvalent qui touche toutes les
biomembranes et tous les systèmes enzymatiques. Il peut aussi avoir des
activités génotoxiques et/ou cytotoxiques (LANNOYE, 2001 ; EXLEY
et al. 2007).
La répartition du mercure dans l'organisme est
dépendante de la forme chimique : la fixation concerne principalement le
système nerveux central (SNC), les reins et à un degré
moindre, les muscles et le foie. Le danger de l'exposition chez la femme en
gestation vient du risque d'encéphalopathie foetale car la
barrière placentaire étant aisément franchie par les
dérivés de faible poids moléculaires tels que le
méthylmercure, etc. (HACHET, 1992).
Tableau 2 : Toxicité comparée du mercure et de
ses composés selon leur spéciation
(TESTUD, 1998)
Formes
chimiques
|
Voies d'entrées
|
Organes cibles dominants et effets
|
Hg élémentaire
|
Inhalation des vapeurs
|
· SNC (syndrome psychoorganique, tremblement,
encéphalopathie)
· Peau et muqueuses (érythème, stomatite)
· Poumons (en aigu) : pneumonie mercurielle
· « Fièvre des métaux »
|
Hg inorganique
|
Ingestion ; inhalation de
vapeurs, poussières
ou
aérosols ; pénétration cutanée
|
· Reins (glomérulopathie et/ou tubulopathie)
· Peau et muqueuse (brûlure, eczéma)
|
Hg organique
|
Idem
|
Dérivés alkylés
· SNC (encéphalopathie)
· Malformations congénitales Dérivés
arylés et alkoxyalkylés
· Voies respiratoires (rhinites, asthme)
· Peau (eczéma)
· Reins (glomérulopathie et/ou tubulopathie)
|
|
2.6. Toxicocinétique
L'absorption du mercure peut se faire par ingestion
(négligeable), inhalation (74 à 80%), pénétration
cutanée (faible).
Distribution et bioaccumulation : en raison de sa grande
diffusibilité et de sa liposolubilité notable, le mercure est
distribué dans tout l'organisme. Toutefois, son temps de
rétention le plus long se situe dans le cerveau et les reins (REICHL,
2002).
Métabolisme : dans un premier temps, le mercure
métallique se trouvant dans le sang est rapidement oxydé en ion
mercurique (Hg inorganique) dans les érythrocytes, par voie
métabolique peroxyde d'hydrogène/catalase. L'oxydation peut
également avoir lieu dans les poumons. En outre, des études chez
les animaux suggèrent que le foie, le cerveau et d'autres tissus,
jusqu'à un certain point, pourraient constituer des sites d'oxydation.
Dans l'organisme, différentes biotransformations peuvent provoquer un
phénomène de détoxification ou de toxification (BERAUD,
2001).
voie rénale et fécale respectivement à
60% et 40% ; les composés mercuriels organiques les sont aussi à
hauteur de 10% et 90% d'excrétion par voie rénale et
fécale (REICHL, 2002).
2.7. Toxicodynamique
Le mécanisme de l'action toxique du mercure repose sur
l'inhibition des enzymes thiols dépendantes et sur la perturbation du
système de transport des tubules rénaux. La réduction de
l'activité anticholinestérasique du sérum
qu'entraîne le mercure peut être utilisé comme test de
dépistage de l'intoxication mercurielle (HACHET, 1992).
La demi-vie du mercure métallique dans le sang serait
biphasique avec des demi-vies de 4 à 45 jours selon le modèle
pharmacocinétique à base physiologique (TRUCHON, G., 2004) tandis
que la demi-vie du mercure métallique dans l'urine est de l'ordre de 55
jours mais peut varier approximativement de 1 à 3 mois (ROELS et al.
1991 ; JONSSON et al. 1999).
Interaction : dans l'organisme des interactions entre toxiques
peuvent conduire à des effets de synergie, antagonisme, induction ou
inhibition enzymatique (BERAUD, 2001). Très souvent le mercure prend la
place du cuivre dans le métabolisme de la tyrosine (MOREAU, 1993).
L'ingestion d'alcool éthylique diminue la rétention pulmonaire
des vapeurs de mercure de même que la pénicilline et ses
dérivés augmentent l'excrétion urinaire du mercure
organique (TRUCHON, 1999).
2.8. Valeurs acceptables et indices d'exposition biologique
Tableau 3 : Valeurs limites pour les composés
mercuriels (REICHL, 2002 ; OMS,
1997 ; NHANES, 2003)
Formes chimiques
|
V1WE
|
I7E
|
PTWI
|
Valeurs de référence
|
Mercure (vapeur) Composés alkylés (en Hg)
Composés arylés et inorganiques (en Hg)
Méthylmercure Mercure total
|
0,05 mg/m3
0,01mg/m3
3
0,1 mg/m
2
2
|
2
50 gg/g de
créatinine
15 gg/l de sang
100 gg/l de sang
_
|
2
2
2
200 gg
300 gg
|
<5 gg/g de créatinine
|
|
1
Chapitre II : Matériels et méthodes
2.1. Matériels
a) Matériel biologique
Les urines humaines ont été choisies comme
matériel biologique dans l'optique de déceler une exposition
interne de deux métaux (Al et Hg).
· :* Choix des matériels
biologiques
La voie d'élimination de loin la plus importante de
certains métaux comme l'aluminium et le mercure présents dans le
sang est assuré par l'excrétion urinaire (PILETTE, 2008).
Cependant, l'aluminium et le mercure urinaires sont moins
influencés que leurs formes sériques par le fait que le
prélèvement se soit déroulé à jeun ou
après le repas (PILETTE, 2008). Il a aussi été
suggéré que l'excrétion urinaire soit
considérée comme un meilleur indicateur d'exposition car elle
reflète principalement l'exposition récente (RÖLLIN et al,
1996) ou la charge corporelle.
b) Matériel de prélèvement et de
laboratoire
Les prélèvements des échantillons dans
notre population cible a nécessité l'utilisation des
matériels ci-après :
· Paires de gant
· Flacons en polyéthylène stériles
· Ouate.
Les analyses au laboratoire pour le dosage de l'aluminium et du
mercure ont exigé un appareillage spécial :
· ICP-MS Agilent 7500 pour l'Al
· CETAC M-6000 A Automated Mercury Analyser (AAS) pour le
Hg. Le choix de ces deux méthodes est dicté par les avantages
qu'elles offrent dans la détermination des micropolluants (CHAPPUIS,
1995).
2.2. Méthodes
a) Prélèvement des échantillons et
Conservation
· 110 personnes âgées de 6 ans et plus ont
été sélectionné aléatoirement pour
recueillir environ 10 cc d'urines directement dans des flacons stériles
en polyéthylène de 125 ml sans ajout de préservatif ;
· Ensuite tous les échantillons
récoltés ont été acheminés endéans 6
heures au laboratoire en vue d'être conservées dans un
congélateur à -20°C. Ceci en attendant les analyses
proprement dites dans un laboratoire de Toxicologie Industrielle et
Environnementale de l'Université Catholique de Louvain en Belgique ;
b) Questionnaire
Le profil des styles de vie des participants a
été établi à l'aide d'un questionnaire. Ces
informations nous ont paru essentielles pour l'interprétation des
résultats. Les sujets proposés dans le questionnaire rempli par
les participants sont : âge, sexe, habitude alcoolique, tabagique et
alimentaire, origine linguistique (voir le questionnaire en Annexe II). Chaque
personne participant à l'étude a dûment rempli le
formulaire d'enquête avant de fournir les urines.
c) Méthode de laboratoire
1°) Dosage d'Aluminium urinaire
Le couplage torche à plasma-Spectromètre de
masse (Inductively Coupled Plasma-Mass Spectrometer ou ICP-MS) est une
technique permettant de doser en quelques minutes plus de 50
éléments du tableau périodique sur les solutions à
des teneurs très inférieures à 14 ig/l ou (ppb).
Cette technique est la plus utilisée en raison de sa
très bonne limite de détection et des faibles
interférences ; elle est en outre particulièrement adaptée
à l'analyse toxicologique (KAMOUN, 1997).
Principe :
L'échantillon est amené jusqu'à la torche
à plasma par une pompe péristaltique. Au contact de l'argon,
l'échantillon est alors atomisé puis ionisé dans sa
totalité sous forme de cations monovalents. Une interface
composée de deux cônes de nickel et d'une série de
lentilles permet de stopper les photons et focaliser les ions pour les amener
au quadripôle pour la séparation en masse. Cette séparation
est effectuée pour chaque ion en fonction du rapport masse
atomique/charge (m/e-). Le faisceau ionique est amené sur un
détecteur de type multiplicateur d'électrons. L'ensemble du
système est dirigé par informatique (KAMOUN, 1997).

Mode opératoire :
L'appareil ICP-MS Agilent 7500 Ce Octopole Reaction System
(ORS) a été utilisé pour doser l'aluminium urinaire.
Brièvement, 500 pl d'urine ont été ajoutés à
4500 pl de diluant [HCl 0,5% (v/v) ; HNO3 1% (v/v) et 50 pl de solution de
chaque standard interne à ppm (Se, Ge, Rh, In, Ir)]. La solution de
calibrage a été préparée en additionnant 50 pl de
la solution avec 450 pl de l'acide et 4500 pl de diluant pour obtenir des
solutions multiéléments à 0 ; 10 ; 50 ; 250 ; 500 ; 5000
ppb. La limite de détection de 1,57 ug/l.
2°) Dosage du mercure urinaire
La spectrométrie d'absorption atomique permet de doser
dans pratiquement toute sorte d'échantillon, un ou plusieurs
éléments prédéfinis choisis dans une liste en
contenant environ 70.
Cette technique présente plusieurs avantages tels qu'un
emploi plus général et une bonne spécificité. Elle
est aussi utilisée en toxicologique pour le dosage de divers
métaux y compris le mercure (KAMOUN, 1997).
Principe :
Pour comprendre le principe d'absorption atomique, on peut se
reporter à une expérience due à Kirkho~~, vieille de plus
d'un siècle, dans laquelle il a montré que les gaz incandescents
absorbent aux mêmes longueurs d'onde que celles qu'ils peuvent
émettre. Le mercure contenu dans l'échantillon est réduit
sous forme métallique à l'aide de solution SnCl2-CdCl2 et les
vapeurs de Hg métallique produites sont orientées vers le
faisceau d'une lampe en Hg. Le dosage dépend de l'absorption par
l'échantillon des radiations du faisceau issues de lampe en Hg.
L'appareil affiche l'absorbance en faisant le rapport des intensités
transmises en absence puis en présence de l'échantillon (KAMOUN,
1997 ; ROUESSAC et al, 2004).
La concentration du mercure est déterminée par la
relation :
A = k.c
où
A : absorbance
c : concentration de l'élément
k : coefficient propre à chaque élément pour
la longueur d'une d'onde choisie.
Mode opératoire :
L'appareil CETAC M-6000 A automated Mercury Analyser a
été utilisé pour le dosage du mercure. Brièvement,
2 ml de la solution fraîche d'acide trichloroacétique (TCA)
contenant L-cystéine ont été ajoutés à 1 ml
d'urine. Le tout a été mis en contact avec la solution de
SnCl2-CdCl2 avec un débit de 0,8 ml/min dans un puits pour produire des
vapeurs froides. La solution de calibration a été
préparée à partir de la solution 2 mg/l de Hg
diluée à 100 ml avec le réactif TCA de rinçage pour
obtenir des solutions à 0 ; 5 ; 10 ; 20 ppb. Le seuil de
détection est de 0,8 ug/l.
d) Méthode statistique
Les logiciels NCSS 2004 et Prism Padgraph version 3.0 ont
été utilisés pour les traitements statistiques des
résultats. Les distributions ont été examinées et
les percentiles 50è, 75è,
90è, 95è déterminés. La
mesure de la tendance centrale a été calculée par la
moyenne géométrique. Cette dernière a été
calculée seulement lorsque de résultats détectables est
supérieur à 60%. Pour ce calcul, les résultats individuels
sous la limite de détection ont été remplacés par
une valeur égale à la moitié de cette limite. Le test de
Student et l'analyse de la variance ont été appliqués pour
tester les différences entre les groupes (GRAIS, 2000 ; ANCELLE,
2002).
e) Description de la population étudiée
v La population étudiée est
constitué de 110 volontaires de 6 ans et plus en tenant compte d'un
équilibre entre les deux sexes.
Pour un nombre total de 41.058 habitants (Bureau du Quartier,
2007), chaque sujet avait une chance de 0,27% de constituer
l'échantillon.
v La période de récolte des
échantillons biologiques s'est étendue du 22 avril au 23 mai
2008. Etant donné que le Bureau du quartier Matadi n'avait aucune liste
recensant ses habitants, il nous a été impossible de
réaliser une présélection des sujets comme l'exige
l'échantillonnage aléatoire simple (EAS). La population
d'étude a été sensibilisée au préalable puis
le recueil des urines s'est déroulé une seule fois par les
volontaires eux-mêmes pour toute l'étude.
I) Cartographie du milieu d'étude
Sur base des informations recueillies au Bureau du quartier
concernant ses limites. Nous sommes nous même descendus sur terrain pour
vérifier les frontières réelles de la zone
d'étude.
Ensuite grâce aux images satellitaires Ikonos (4 m de
résolution spatiale en composition colorée et 1 m en
panchromatique), nous avons pu réaliser les deux cartes ci-dessous ayant
des limites plus ou moins précises, en utilisant le logiciel ArcGIS
d'ESRI.

Ainsi, les coordonnées géographiques du quartier
Matadi sont les suivantes:
· Aunord: 15°17'03»Eet-4°22'19»N
· Ausud: 15°17'19»Eet-4°22'51»N
· A l'Est : 15°17'29»E et -4°22'27»N
· A l'Ouest: 15°16'58»E et
-4°22'44»N
En définitive, le quartier Matadi occupe une superficie
d'environ 634506 m2
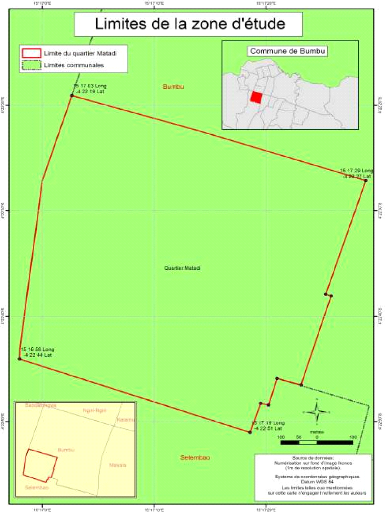
Fig.3 : Carte représentant les limites du quartier Matadi
dans la commune Bumbu
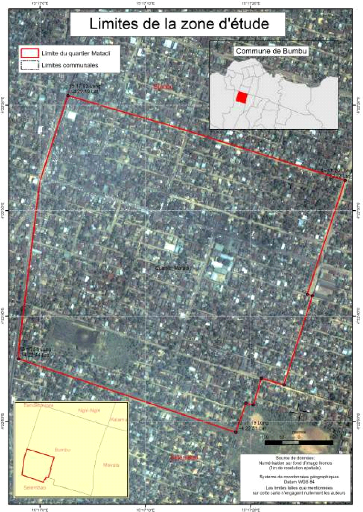
Fig.4 : Spatiocarte représentant l'image
satéllitaire de la zone d'étude

Chapitre III : Résultats et discussion
Le tableau 4 présente les résultats de
différentes concentrations d'aluminium (iag/L) chez 110 sujets du
Quartier Matadi dans la commune de Bumbu. Les moyennes
géométriques ont été calculées avec un
intervalle de confiance à 95% pour l'ensemble des participants et en
fonction des facteurs endogènes (âge et sexe), exogènes
(tabagisme, alcoolisme, hygiène personnelle, habitudes alimentaires)
ainsi que les origines culturelles de la population.
Tableau 4 : Moyennes géométriques et Percentiles
sélectionnées de la concentration urinaire en aluminium (1.ig/L)
dans la population de
Bumbu, 2008.
Caractéristiques
population
|
Moyenne géométrique
[IC à 95%]
|
|
Percentiles sélectionnées
[IC à
95%]
|
|
Taille
échantillon
|
|
|
0è
|
75è
|
90è
|
95è
|
|
Total, tous les groupes
|
12,43 (11,11-13,90)
|
12,18 (10,86-13,30)
|
18,61 (15,89-21,42)
|
31,04 (25,31-39,64)
|
55,73 (33,34-156,00)
|
110
|
Groupes d'âge
|
|
|
|
|
|
|
6-11 ans
|
12,98 (9,04-18,65)
|
14,21 (7,11-24,78)
|
22,33 (14,21-26,68)
|
26,65 (21,97-31,33)
|
26,68 (21,97-31,39)
|
17
|
12- 19 ans
|
12,04 (9,34-15,52)
|
11,06 (9,05-15,66)
|
18,17 (14,73-32,73)
|
33,65(19,37-202,00)
|
54,13 (44,96-63,29)
|
33
|
20 ans et plus
|
12,49 (10,91-14,29)
|
12,03 (10,63-13,30)
|
18,61(15,49-22,98)
|
31,06(25,31-58,12)
|
60,88 (33,34-168,40)
|
60
|
Sexe
|
|
|
|
|
|
|
Mâle
|
10,54 (8,99-12,35)
|
11,06 (9,08-12,59)
|
15,77 (13,93-19,37)
|
23,66 (19,57-40,62)
|
35,75 (23,66-141,40)
|
53
|
Femelle
|
14,62 (12,49-17,10)
|
13,42 (11,64-15,38)
|
23,89 (17,56-26,69)
|
35,21 (26,69-61,80)
|
75,15 (35,45-202,00)
|
57
|
Tabac
|
|
|
|
|
|
|
Fumeurs
|
12,65 (10,74-14,91)
|
12,16 (11,61-14,06)
|
18,67 (14,67-26,61)
|
33,34 (24,39-56,27)
|
40,62 (32,73-141,40)
|
24
|
Non-fumeurs
|
12,30 (10,57-14,32)
|
12,20 (9,92-13,79)
|
18,67 (15,66-22,89)
|
28,13 (24,06-58,12)
|
91,48 (28,49-172,70)
|
86
|
Alcool (Bière)
|
|
|
|
|
|
|
Oui
|
10,77 (9,30-12,38)
|
10,52 (9,30-12,38)
|
18,05 (13,93-23,66)
|
25,72 (22,98-56,27)
|
46,88 (25,83-168,40)
|
41
|
Non
|
13,75 (11,90-15,88)
|
12,96 (11,78-14,67)
|
19,13 (15,87-24,78)
|
33,34 (25,75-58,12)
|
76,65 (34,27-202,00)
|
69
|
Groupe linguistique
|
|
|
|
|
|
|
Kongo
|
12,83 (11,26-14,62)
|
12,18 (10,63-13,98)
|
19,54 (15,99-24,06)
|
31,12 (25,83-45,57)
|
54,98 (31,19-141,40)
|
60
|
Lingala
|
9,95 (7,14-13,85)
|
10,52 (8,72-13,35)
|
15,49 (12,38-23,89)
|
24,61 (16,23-168,0)
|
67,48 (58,65-76,31)
|
22
|
Swahili
|
10,17 (4,98-20,74)
|
9,47 (4,45-12,96)
|
12,96 (5,55-172,70)
|
141,79(109,07-174,50)
|
172,70 (139,98-205,41)
|
10
|
Luba
|
12,21 (8,89-16,76)
|
12,30 (8,00-17,19)
|
16,34 (11,82-31,06)
|
29,33 (24,96-33,69)
|
31,06 (26,29-35,82)
|
12
|
Autres
|
18,20 (10,87-30,46)
|
16,41 (12,50-19,88)
|
22,14 (16,93-315,00)
|
122,93 (83,59-162,27)
|
315 (275,66-354,34)
|
6
|
|
Le tableau 4 ci-haut présente les résultats de
différentes concentrations urinaires d'aluminium (jtg/l) chez 110 sujets
habitant le quartier Matadi dans la commune de Bumbu. Les moyennes
géométriques et les percentiles (50è , 75
è, 90 è et 95è) ont
été calculés pour un intervalle de confiance à 95%.
Le t-test et l'analyse de la variance ont été appliqués
pour déceler des différences entre les groupes
étudiés. Les caractéristiques des participants ont
été également déterminées: âge, sexe,
tabagisme, alcoolisme (bière).
La moyenne géométrique obtenue pour l'ensemble
des participants était de 12,43 (11,11-13,90) pg/l avec un 95
è percentile de 55,73 (33,34-156,00) pg/l. Concernant les
caractéristiques des participants, nous avons trouvé des valeurs
presque similaires entre les catégories d'âge, le statut tabagique
et les origines linguistiques.
Une différence hautement significative a
été observée entre les sexes (P<0,05 cf. Annexe I). Les
valeurs étaient élevées chez les femmes par rapport aux
hommes (14,62 vs 10,54) j.ig/l. Ceci pourrait être attribuable à
la fréquence élevée de l'usage des antiperspirants
(talc,...) et la consommation des antiacides locales (argiles fumés)
à base d'aluminium, très prisés chez les femmes.
Une autre différence significative a été
notée entre les consommateurs de la bière et les
non-consommateurs (P<0,05 cf. Annexe I). Ici les valeurs étaient
élevées chez les non-consommateurs de la bière par rapport
aux consommateurs (15,88 vs 11,90) pg/l. Cette différence serait due en
partie à l'effet synergique entre toxiques et surtout à
l'influence du sexe féminin très souvent non consommateur de la
bière.
Les résultats trouvés dans cette étude
sont dans la gamme des valeurs de référence issues de la
littérature scientifique (GOURIER-FRERY, 2003). Notons cependant une
grande variabilité de nos résultats. Cela serait dû aux
effets de dilution d'urines récoltées pour cette étude.
Des concentrations d'aluminium urinaires <20 jtg/L
reflète un état normal, ce qui signifie qu'il n'y a aucun risque
pour la santé (PILETTE, 2008).
L'aluminium comme métal ubiquitaire est aussi
considéré comme élément géodépendant
dans certaines régions du monde, chez les populations ayant comme
boisson locale le thé vert (MOREAU, 1993).
2
La figure 5 ci-dessous donne l'évolution des
concentrations en aluminium urinaire en fonction du sexe.

20
30
10
40
0
Mâle Femelle
Sexe
Fig.5 : Distribution de l'Aluminium urinaire en fonction du sexe
(Moyenne géométrique #177; SE).
Il ressort de la figure ci-haut que les concentrations de
l'aluminium urinaire des femelles sont nettement supérieures à
celles des sujets mâles. Cette différence est en parfait accord
avec le résultat du test de Student qui indique une différence
hautement significative entre les deux sexes. Cette différence peut
s'expliquer par une forte consommation des antiacides, des jus de fruits ainsi
que l'usage des antiperspirants utilisés plus chez les femelles que chez
les mâles.
Le tableau 5 ci-dessous met en évidence les
différentes valeurs du mercure urinaire (jtg/L) dans la population
étudiée.
Tableau 5 : Moyennes géométriques et Percentiles
sélectionnées de la concentration urinaire en mercure (gg/L) dans
la population
de Bumbu, 2008.
Caractéristiques
population
|
Moyenne géométrique
[IC à 95%]
|
|
Percentiles sélectionnées
[IC à
95%]
|
|
Taille
échantillon
|
|
|
0è
|
75è
|
90è
|
95è
|
|
Total, tous les groupes
|
5,71 (5,29-6,17)
|
5,41(4,86-5,93)
|
8,13(7,28-9,04)
|
11,36(10,34-13,89)
|
14,33(11,89-23,46)
|
110
|
Groupes d'âge
|
|
|
|
|
|
|
6-11 ans
|
8,08 (6,08-10,75)
|
8,78(5,34-12,83)
|
12,10(8,77-16,80)
|
15,81(13,32-18,29)
|
16,80(14,31-19,29)
|
17
|
12 - 19 ans
|
5,65 (4,63-6,91)
|
12,10(8,77-16,80)
|
7,04(5,98-11,60)
|
12,80(9,04-64,44)
|
19,74(16,85-22,63)
|
33
|
20 ans et plus
|
5,24 (4,73-5,95)
|
5,18(4,17-6,13)
|
8,03(7,25-8,77)
|
11,02(9,71-13,89)
|
14,19(11,36-23,81)
|
60
|
Sexe
|
|
|
|
|
|
|
Mâle
|
4,72 (4,26-5,24)
|
4,37(4,13-4,98)
|
6,01(5,43-7,65)
|
10,00(8,07-13,89)
|
13,02(10,00-20,06)
|
53
|
Femelle
|
6,88 (6,19-7,65)
|
6,60(5,83-7,53)
|
9,42(8,16-11,31)
|
12,64(11,31-17,24)
|
18,80(12,83-45,83)
|
57
|
Tabac
|
|
|
|
|
|
|
Fumeurs
|
6,06 (5,27-6,95)
|
5,65(5,16-6,33)
|
8,16(6,98-10,12)
|
11,60(9,71-23,81)
|
21,14(11,13-64,44)
|
24
|
Non-fumeurs
|
5,53 (5,03-6,07)
|
5,04(4,62-5,95)
|
8,11(7,12-9,42)
|
11,36(10,34-14,14)
|
14,27(11,36-20,06)
|
86
|
Alcool (Bière)
|
|
|
|
|
|
|
Oui
|
4,87 (4,38-5,43)
|
4,73(4,25-5,40)
|
6,33(5,72-7,67)
|
8,84(7,65-10,90)
|
10,50(8,91-40,56)
|
41
|
Non
|
6,39 (5,75-7,10)
|
6,12(5,32-7,12)
|
9,41(8,07-11,19)
|
11,60(9,71-23,81)
|
17,76(13,60-45,83)
|
69
|
Origine linguistique
|
|
|
|
|
|
|
Kongo
|
5,46 (4,98-5,98)
|
5,12(4,73-5,93)
|
8,03(7,18-9,12)
|
11,34(10,00-12,83)
|
13,41(11,36-17,24)
|
60
|
Lingala
|
6,11 (5,11-7,31)
|
5,95(5,40-6,57)
|
7,78(6,13-11,13)
|
14,77(8,59-23,81)
|
20,44(18,89-21,99)
|
22
|
Swahili
|
6,50 (3,52-12,00)
|
5,18(2,91-8,78)
|
8,78(4,25-64,44)
|
53,73(41,94-65,52)
|
64,44(52,65-76,23)
|
10
|
Luba
|
5,48(4,12-7,30)
|
4,86(4,00-6,33)
|
6,14(4,75-16,80)
|
14,72(12,50-16,94)
|
16,80(14,58-19,02)
|
12
|
Autres
|
6,95 (4,59-10,50)
|
6,18(3,89-10,50)
|
10,71(6,49-45,83)
|
30,17(24,44-35,90)
|
45,83(40,10-51,56)
|
6
|
|
De ce tableau, il ressort les différentes valeurs
urinaires en mercure (pg/l) chez 110 volontaires habitants le quartier Matadi
dans la commune de Bumbu. Les moyennes géométriques et les
percentiles (50è , 75 è, 90
è et 95è) ont été
calculés avec toujours un intervalle de confiance à 95%. Le
t-test et l'analyse de la variance ont été appliqués pour
tester des différences entre les groupes étudiés. Les
caractéristiques des participants ont été également
analysées comme précédemment.
La moyenne géométrique obtenue pour l'ensemble
des participants était de 5,71 (5,29-6,17) pg/l avec un 95
è percentile de 14,33 (11,89-23,46) pg/l. En ce qui concerne
les caractéristiques des participants, nous avons trouvé des
valeurs presque similaires avec une absence de signification statistique entre
les tranches d'âge, le sexe, le statut alcoolique et les origines
linguistiques.
Une seule différence hautement significative a
été observée entre les fumeurs du tabac par rapport aux
non-fumeurs (P<0,05 cf. Annexe I). Cependant, les valeurs étaient
élevées chez les fumeurs par rapport aux non-fumeurs (6,06 vs
5,53) j.ig/l. Ceci pourrait être attribué aux effets interactifs
entre toxiques (addition ou synergie). En outre, cette corrélation entre
la consommation du tabac chez ces sujets fumeurs et leur probable intoxication
au mercure révèle une toxicomanie volontaire (RÖLLIN,
1996).
Toutefois, la grande variabilité de ces résultats
serait également dû aux effets de dilution d'urines
récoltées telle que constatée antérieurement dans
le tableau 4.
La mesure des taux urinaire du mercure permet de mettre en
évidence les composés inorganiques. Les valeurs
supérieures à 10 jtg/L indiquent la présence d'un risque
sanitaire grandissant pour ces sujets (ATSDR, 1999).
La figure 6 ci-dessous donne l'évolution des
concentrations mercurielles en fonction de l'usage des produits
éclaircissants.
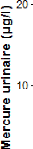


Fig.6 : Distribution du mercure urinaire en fonction de l'usage
des produits éclaircissants.
Néanmoins la figure 6 met en évidence des
concentrations anormalement élevées chez les personnes utilisant
les produits éclaircissants par rapport à d'autres. Les
études démontrent qu'entre les deux sexes, ce sont plus les
femmes qui utilisent une large gamme de produits éclaircissants avec une
grande fréquence et qui augmente probablement le risque d'une
intoxication aux effets sanitaires graves à long terme.
Cette différence observée peut s'expliquer par
le fait que la grande majorité de ces produits sont fabriqué
à base d'iodure de mercure qu'on appelle communément «sels
de mercure» (LINDSEY et al, 2004). Ce dernier intoxique l'organisme
grâce à son absorption percutanée (cutanée).
D'où la présence de cette substance inorganique dans les urines
à des proportions relativement inquiétantes malgré
l'absence de signification statistique entre les deux groupes.
Le tableau 6 ci-dessous présente brièvement les
concentrations urinaires en aluminium et mercure après correction
à la créatinine (pg/g de créatinine). Toutefois, cette
correction à la créatinine n'a pas été prise en
compte pour interpréter les résultats précédents
étant donné que la créatinine urinaire provenant des
muscles est un paramètre qui varie selon l'âge, le sexe,
l'état de santé, etc. La comparaison des concentrations urinaires
pour ces deux métaux avant et après correction à la
créatinine et surtout par rapport aux valeurs de référence
nous permet d'ajuster notre évaluation des risques encourus par notre
population d'étude exposée à ces métaux.
En effet, avec une population présumée saine de
110 Kinois nous fait observer des variations de 4,98 iag/L à 30,46 iag/L
pour l'aluminium et de 3,52 iag/L à 12,00 iag/L pour le mercure. Tandis
que les travaux antérieurs de LAUWERYS en 2001 dans la population saine
de 766 Italiens indiquent des concentrations variant de 2,3 iag/L à 19,5
iag/L (PILETTE, 2008).
Tableau 6. Concentration urinaire en métaux
après correction à la créatinine (iag/g
de
créatinine)
N P95 MG (Ic à 95%) NHANESIII GerES III
|
|
Aluminium 110 44,91 8,60 (7,59-9,74)
|
- -
|
|
Mercure 110 14,33 5,71 (4,86-5,93) 0,62 (0,58-0,66) 0,34
(0,33-0,35)
De ce tableau, il ressort ce qui suit :
· Pour l'aluminium, sur un total de 110 sujets, la
moyenne géométrique toute catégorie confondue et le
95è percentile des concentrations calculées avant correction
à la créatinine se présentent respectivement comme suit :
12,43(11,11-13,90) et 55,73(33,34-156,00) en iag/L et après correction
à la créatinine, elles se présentent comme suit :
8,60(7,59-9,74) et 44,91 en iag/g de créatinine. Toutefois, les
concentrations urinaires en aluminium avant et après correction à
la créatinine sont nettement différentes et ont sensiblement
tendance à diminuer après correction à la
créatinine. Cependant, l'absence de valeurs de référence
après correction à la créatinine pour l'aluminium ne nous
permet pas d'établir une comparaison plausible.
· Pour le mercure, une moyenne géométrique et
le 95è percentile des concentrations urinaires ont été
calculés avant correction à la créatinine et se
présentent respectivement comme suit : 5,71 (5,29-6,17) et 14,33 (11,89-
23,46) en iag/L et après correction à la créatinine, elles
se présentent comme suit : 5,71 (4,86-5,93) et 14,33 en iag/g de
créatinine. Ici aussi les concentrations urinaires en mercure
après correction à la créatinine ont
légèrement tendance à diminuer. Cependant, si l'on compare
les valeurs obtenues avec les normes américaines et allemandes qui se
présentent respectivement comme suit : 0,62(0,58-0,66) et
0,34(0,33-0,35) en iag/g de créatinine <
www.cdc.gov/nceh/report/results>
(01-02-2009) ;
<
www.umweltbundesmt.de/survey>
(01-02-2009), l'on constate qu'elles sont nettement supérieures à
celles-ci malgré leur tendance à diminuer.
En effet, sur base de cette comparaison, nous pouvons
constater que 95% de la population présente des concentrations en
mercure anormalement élevées par rapport aux valeurs de
référence. Ceci illustre le degré de risque auquel la
population est exposée face à l'utilisation des produits à
base de ces micropolluants.

Conclusion
Ce présent travail avait comme objectif la
détermination des concentrations urinaires de deux métaux lourds
(Al et Hg) dans la population.
Nous avons utilisé la spectrométrie de masse
à plasma induit par haute fréquence (ICP-MS) pour la mise en
évidence de l'aluminium urinaire et la spectrométrie d'absorption
atomique (AAS) pour le mercure. Enfin, le t-test et l'analyse de la variance de
ces résultats nous ont permis de déceler les différences
entre les groupes étudiés puis les comparer avec les
données de la littérature.
Au regard de ces résultats, nous pouvons conclure que
la population kinoise en général et du quartier Matadi en
particulier, présente dans certains cas des risques plus importants
d'intoxication liés à divers micropolluants et plus
précisément ceux liés à l'aluminium et au
mercure.
Néanmoins, les concentrations urinaires
élevées de ces métaux ne nous donnent qu'une indication de
la charge corporelle réellement présente dans l'organisme. Elles
peuvent faire soupçonner une accumulation dans les organes mais elles ne
la prouvent pas et des taux urinaires bas n'excluent pas une intoxication
(PILETTE, 2008).
Cependant, avec les contraintes éthiques actuelles, du
vivant de l'homme, il est pratiquement impossible d'évaluer les vraies
valeurs en telle ou telle autre substance.
Suggestions et recommandations
Il faudrait que l'Etat congolais puisse fixer des valeurs
limites qui régissent les différentes substances toxiques dans
l'air, les aliments, les produits cosmétiques, les peintures, etc.
Il serait souhaitable que l'Etat puisse financer la
création des centres antipoison à travers toute la
République.
Pour tous les Kinois, le meilleur moyen de se prémunir
des effets de l'aluminium et du mercure est de s'en abstenir : éviter
d'en respirer, éviter d'en consommer, éviter de s'en faire
injecter, éviter de s'en appliquer.
Etant donné le coût financier énorme, nous
souhaiterions que l'Etat congolais puisse subventionner le suivi de la
population aux risques avérés sur une longue période afin
de légiférer sur l'impact à long terme des substances
chimiques avec lesquelles nous vivons tous les jours.
Etre en mesure de fixer nos propres valeurs de
référence (valeurs de référence congolaises) pour
l'air, l'eau, les aliments, etc.
Sensibiliser la population face aux dangers liés à
ces micropolluants.
Références bibliographiques
A. Livres (ouvrages)
1. ANCELLE, T. (2002) :
»Statistique-Epidémiologie», éd. Maloine, Paris, 300
p.
2. ARNOULD, J.P in BERAUD, J. (2001):»Le technicien
d'analyse biologique: guide théorique et pratique, éd.
Tech&Doc, Londres-Paris-New York, 2080 p.
3. CHAPPUIS, P. (1995) : «Technique d'analyse des
oligoéléments chez l'homme», éd. Lavoisier
Tec&Doc, Paris, 158 p.
4. FREMY, M. et FREMY, D. (2000) : «Quid 2000»,
éd. Robert Laffont, Paris, pp. 1585c, 1651b.
5. GRAIS, B. (2000) : »Statistique descriptive : Techniques
statistiques1», éd. Dunod, 3è éditions,
Paris, pp. 127-144.
6. HACHET, J.C. (1992) : »Dictionnaire de
toxicologie», éd. Masson, Paris, pp. 4, 217-220.
7. KAMOUN, P. (1997) : »Appareils et méthodes en
biochimie et biologie moléculaire», éd. Flammarion, Paris,
418 p.
8. LANNOYE, P. (2001) : «Amalgame dentaire et
métaux lourds; quels risques pour la santé et
l'environnement?», éd. Frison-Roche, Paris, pp. 57-59, 134- 135.
9. LINDSEY, K. et HANS-MARTIN, H. (2004) : »Les savons au
mercure : un scandale des temps moderne», éd. Anamed,
2è édition, Winnenden, pp. 7-14
10. MOREAU, P. (1993) : »La micronutrition clinique en
biologie et en pratique clinique», éd. Tec&doc, Paris, p.
130.
11. PILETTE, J. (2008) : «Aluminium et vaccins»,
éd. Dangles, Paris, 120 p.
12. REICHL, F.X. (2002) : »Atlas de poche de
médecine de l'environnement», éd. Maloine, Paris, 366 p.
13. ROUESSAC, F. et ROUESSAC, A. (2004) : «Analyse chimique
: méthodes et techniques instrumentales modernes», éd.
Dunod, 6è édition, Paris, 462 p.
14. TESTUD, F. (1998) : »Pathologie toxique en milieu de
travail», éd. ESKA, Paris, 447 p.
15. TRUCHON, G. (1999) : »Guide de surveillance
biologique : prélèvement et interprétation des
résultats», 5è édition, Etudes et
recherche/IRSST, Montréal <
www.irsst.qc.ca >
(17-04-2008).
16. TRUCHON, G. (2004) : »Guide de surveillance
biologique : prélèvement et interprétation des
résultats», 6è édition, Etudes et
recherche/IRSST, Montréal <
www.irsst.qc.ca >
(17-04-2008).
B. Articles
17. Agency for Toxic Substances and Diseases Registry
(1999):»Toxicological profiles for mercury, Atlanta (mise à jour
MO2016599) <
www.atsdr.cdc.gov/toxprofiles/
>
18. American Conference of Governmental Industrial Hygienists
(2001): «Documentation of the thresold limit values for chemical
substances, 7th ed, Cincinnati <
www.acgih.org >
19. De DUGGAN, J.M., DICKESON, J.E., TYNAN, P.E, HOUGHTON, A.
et FLYNN, J.E. (1992): «Aluminium beverage cans as a dietary source of
aluminium», Medical journal of Australia, n° 4 April, 156(9) :
60425
20. EXCEY, C.; CHARLES, L.M.; BARR, L.; MARTIN, C.; POLWART,
A. et DARBRE, P.D.(2007) : «Aluminium in human breast tissue»,
journal of inorganic Biochemistry n° 101, p. 1346 <
www.elsevier.com/locate/jinorgbio
> (2521022008).
21. GOURIER-FRERY, C., FRERY, N., BERR, C., CORDIER, S. et
coll.(2003) : « Aluminium. Quels risques pour la santé ? Volet
épidémiologique de l'expertise collective/Evaluation des risques
sanitaires liés l'exposition de la population française à
l'aluminium, éd. Invs-Afssap, Paris, pp. 1253.
22. GUILLARD, O. (2004) <
www.invs.sante.fr/publications/
> (1820422008)
23. JONSSON et al. (1999)<
www.epa.gov/mercury >
(1720422008) CAS n°74392 9726.
24. NHANES (2003) <
www.cdc.gov/nceh/report/results
> (120222009)
25. OMS (1997) : «Données en ligne sur les
métaux lourds»< www.who.int > (172 0422008).
26. ROELS et al. (1991) <
www.epa.gov/mercury >
(1720422008) CAS n°74392972 6.
27. RÖLLIN, H.B., THEODOROU, P. et CANTRELL, A.C. (1996)
: «Biological indicators of exposure to total and respirable aluminium
dust fractions in a primary aluminium smelter», Occupational and
Environnemental Medecine Journal, 53:4172421, Johannesbourg
28. Toxi-UCL (2007)
www.uclouvain.be (120222009).
C. Sites Internet et anonymes
29. Encarta encyclopédie (2007): DVD Microsoft (Support
audiovisuel)
30. Bureau du quartier Matadi (Commune de Bumbu/Kinshasa),
Estimation 2007.
31. <
www.bioperfection.com >
(1620422008)
32. <
www.invs.sante.fr/publications/2004
> (1720422008)
33. <
www.naturosanté.com/rubriques/conseils/
> (1720422008)
34. <
www.imaage2paris.com/actu/articles
> (1820422008)

35.
<
www.pharmacorama.com/Rubriques/>
(1820422008)
36. <
www.elsevier.com/locate/jinorgbio
> (2521022008).
37. <
www.uclouvain.be/toxi>
(0120222009)

Table des matières
Epigraphie I
Dédicace II
Remerciements III
Liste des sigles et abréviations IV
Abstract 1
Résumé 2
Introduction 3
Chapitre I : Revue de la littérature 5
1. Aluminium 5
1.1. Définition et Répartition 5
1.2. Formes chimiques 5
1.3. Principales sources d'exposition anthropiques 6
1.4. Importance dans l'organisme 6
1.5. Toxicité et Organes cibles 7
1.6. Toxicocinétique 7
1.7. Toxicodynamique 8
1.8. Doses acceptables et valeurs d'exposition biologique 8
2. Mercure 9
2.1. Définition et Répartition 9
2.2. Principales sources d'exposition anthropiques 10
2.3. Spéciation ou Formes chimiques 11
2.4. Importance dans l'organisme 11
2.5. Toxicité et Organes cibles dominants 11
2.6. Toxicocinétique 12
2.7. Toxicodynamique 13
2.8. Doses acceptables et indices d'exposition biologique 14
Chapitre II: Matériel et méthodes 15
2.1. Matériel 15
a) Matériel biologique 15
b) Matériel de prélèvement et de
laboratoire 15
2.2. Méthodes 16
a) Prélèvement des échantillons et
Conservation 16
b) Questionnaire 16
c) Méthode de laboratoire 16
d) Méthode statistique 18
e) Description de la population étudiée 18
Chapitre III : Résultats et discussion 22
Conclusion 31
Suggestions et recommandations 32
Références bibliographiques 33
A. Livres (ouvrages) 33
B. Articles 34
C. Sites Internet et anonymes 34
Table des matières 36
ANNEXE I : Tests statistiques 38
Aluminium 38
Tableau 7 : Analyse de la variance et t-test selon les
caractéristiques des participants.
38
Mercure 38
ANNEXE II: Questionnaire d'enquête 39
Identification du sujet étudie 39
38
|
ANNEXE I : Tests statistiques
|
Aluminium
Tableau 7 : Analyse de la variance et t-test selon les
caractéristiques des participants.
|
N
|
P
|
|
Total, 6 ans et plus
Groupes d'âge
|
110
|
|
|
6- 11 ans
|
17
|
0,95
|
|
12 - 19 ans
|
33
|
|
|
20 ans et plus
|
60
|
|
|
Sexe
|
|
|
|
Mâle
|
53
|
0,004
|
|
Femelle
|
57
|
|
|
Tabac
|
|
|
|
Fumeurs
|
24
|
0,81
|
|
Non-fumeurs
|
86
|
|
|
Alcool (Bière)
|
|
|
|
Oui
|
41
|
0,03
|
|
Non
|
69
|
|
|
Origine linguistique
|
|
|
|
Kongo
|
60
|
0,15
|
|
Lingala
|
22
|
|
|
Swahili
|
10
|
|
|
Luba
|
12
|
|
|
Autres
|
6
|
|
N=Taille de l'échantillon ; P=Degré de
signification statistique.
Mercure
Tableau 8 : Analyse de la variance et t-test pour les
caractéristiques des participants.
|
N
|
P
|
|
Total, 6 ans et plus
Groupes d'âge
|
110
|
|
|
6- 11 ans
|
17
|
0,12
|
|
12 - 19 ans
|
33
|
|
|
20 ans et plus
|
60
|
|
|
Sexe
|
|
|
|
Mâle
|
53
|
0,08
|
|
Femelle
|
57
|
|
|
Tabac
|
|
|
|
Fumeurs
|
24
|
0,001
|
|
Non-fumeurs
|
86
|
|
|
Alcool (Bière)
|
|
|
|
Oui
|
41
|
0,51
|
|
Non
|
69
|
|
|
Origine linguistique
|
|
|
|
Kongo
|
60
|
0,26
|
|
Lingala
|
22
|
|
|
Swahili
|
10
|
|
|
Luba
|
12
|
|
|
Autres
|
6
|
|
N=Taille de l'échantillon ; P=Degré de
signification statistique
39
ANNEXE II : Questionnaire d'enquête
Identification du sujet étudié
N° sujet
|GG||GG||GG||GG||GG||GG|
11 1
AGE. Dans quelle tranche d'âge vous situez-vous ?




1 Moins de 6 ans 2 6 - 11 ans 3 12 - 19 ans 4 20 ans et plus
SEXE
1 Male 2 Femelle






LIEU DE RESIDENCE (zone géographique). Dans quelle zone
géographique vous situez-vous ? 1 Funa 2 Lukunga 3 Mont-Amba 4
Tshangu
TABAGISME. Fumez-vous la cigarette ? 1 Oui 2 Non


ALCOOL (bière). Consommez-vous la bière ?
1 Oui 2 Non Si Oui, laquelle consommez-vous
régulièrement :
POISSONS. Consommez-vous les poissons ?


1 Oui 2 Non Si Oui, de quel type régulièrement :
MEDICATION HABITUELLE. Prenez-vous régulièrement un
médicament ?
1 Oui 2 Non si oui, veuillez spécifier son nom :
PRODUITS COSMETIQUES. Utilisez-vous un produit cosmétique
(lotion, crème, savon de beauté) ? 1 Oui 2 Non Si oui, veuillez
préciser le nom du produit régulièrement
utilisé:
STATUT SOCIOPROFESSIONNEL. Dans quelle catégorie
socioprofessionnelle vous situez-vous ?





1 employé 2 ouvrier 3 écolier ou étudiant 4
chômeur 5 Autres
ORIGINE ETHNIQUE OU PROVINCIALE. Dans quelle langue nationale
êtes-vous originaire?

1 Lingala 2 Swahili 3 Tshiluba 4 Kikongo 5 Autres
|
|



