1. Aluminium
1.1. Définition et répartition
L'aluminium est un métal blanc gris (HACHET, 1992).
Constituant à peu près 8% de l'écorce terrestre, il est le
troisième élément après l'oxygène et le
silicium. C'est un métal léger, de numéro atomique 13 et
de poids atomique 27, mais qui se comporte comme un métal lourd dans
l'organisme (MOREAU, 1993).
Par ailleurs, les nombreuses propriétés
physico-chimiques de l'aluminium (basse densité environ 2,70
g/cm3, grande malléabilité, grande ductilité,
bonne conductivité électrique et chimique, résistance
à la corrosion, à la traction, etc.) en font un métal
très utilisé pour des applications diverses et variées
(GOURIER-FRERY, 2003).
1.2. Formes chimiques
L'aluminium existe principalement sous deux formes : les
poussières métalliques et les sels solubles (HACHET, 1992). En
effet, la forme chimique sous laquelle l'aluminium est ingéré par
l'organisme se présente sous la forme de sels qui, pour être
absorbés, doivent être solubles. Ainsi, on ne devrait même
pas parler d'aluminium mais plutôt des sels d'aluminium <
www.invs.santé.fr/publications/2004>
(17-04-2008). Ceci revient à dire qu'il se trouve très souvent
sous la forme combinée, lié à d'autres molécules
inorganiques comme le chlore, le fluor, ou lié à des acides
organiques comme l'acide citrique, l'acide glutamique, l'acide lactique, le
maltol, etc. (PILETTE, 2008).
1.3. Principales sources d'exposition anthropiques
(HACHET, 1992 ; MOREAU, 1993 ; REICHL, 2002 ; PILETTE, 2008)
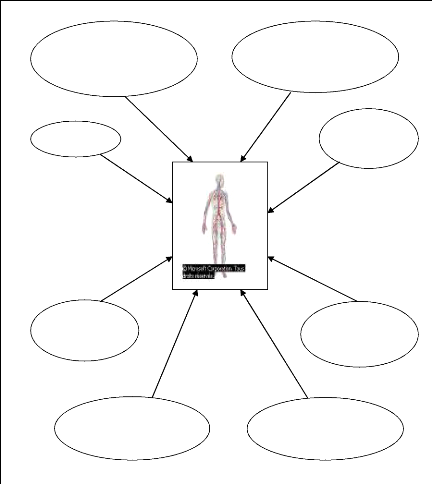
Cimenterie et
ciments
Les additifs alimentaires (colorants, anticoagulants)
Cosmétiques et produits
d'hygiène
(brunisateur,
dentifrices, déodorants,
antiperspirants, rouge
à
lèvres,...)
Usage médicamenteux
(substances actives
contenant
l'Aluminium par ex. les
antiacides, l'Al vaccinal,...)
Traitement de l'eau du robinet
ou de ville (alun
sulfate
d'aluminium, chlorure de
polyaluminium,...)
Usage professionnel et
industriel (fonderie de
minerai
avec les risques occultés de
pluies d'Al,...)
Modes de cuisson et
de préparation
(papillotes,
ustensiles
de cuisine,...)
Conditionnements
et
acidités
(canettes,
emballages,...)
Figure 1 : Schéma illustrant les sources d'exposition
aluminique pour l'homme.
1.4. Importance dans l'organisme
L'aluminium est omniprésent dans notre vie
quotidienne. Il est cependant, un cation dangereux à dose relativement
forte mais nécessaire comme oligoélément à
très faible dose pour éviter l'insomnie, l'anxiété
et diverses névrites. Cofacteur de la vitamine B 1, il stimule les
fonctions cérébrales et régularise le sommeil. Lorsque la
fonction rénale est normale, une absorption journalière d'environ
20 mg d'Al ne pose
pas de problème. La prise d'aluminium par
l'intermédiaire de l'alimentation (thé, carotte, etc.) ne
présente aucun danger et peut-être utile dans la prévention
des effets nocifs de surcharges aluminiques grâce à ses
propriétés anti-oxydantes (REICHL, 2002 ; PILETTE, 2008)
<
www.naturosante.com/rubriques/conseils/>
et <
www.imaage-paris.com/actu/article>
(17-04-2008).
1.5. Toxicité et organes cibles
La toxicité de l'aluminium a été prise
en compte vers 1972 chez les insuffisants rénaux dialysés
chroniques (MOREAU, 1993). En médecine de l'environnement, on
s'intéresse principalement aux composés inorganiques d'aluminium
avec l'ion trivalent Al3+ (REICHL, 2002). Seuls les sulfates,
nitrates et chlorures d'aluminium, solubles, sont potentiellement toxiques mais
pas les silicates et les phosphates d'aluminium qui sont insolubles <
www.invs.sante.fr/publications/2004>
(17-04-2008).
Toxique en grandes quantités, l'aluminium semble
affecter les os (causant sa fragilité ou ostéoporose), les reins,
le cerveau, les poumons, l'estomac, et les muscles (REICHL, 2002) ; <
www.pharmacorama.com/Rubriques/>
(18-04-2008). Il est aussi génotoxique c'est-à-dire capable de
provoquer des mutations dans les gènes, aussi bien dans les cellules
végétales qu'animales (PILETTE, 2008).
1.6. Toxicocinétique
Certains facteurs jouent un rôle dans la manifestation
des effets toxiques : l'espèce, l'âge, le sexe, l'appartenance
ethnique, les variations individuelles, des facteurs physiologiques (grossesse,
nutritions, hyperventilation, hypersudation,...), des états
pathologiques (hépatites, asthme,...), des facteurs environnementaux,
etc. (BERAUD, 2001).
Absorption : elle dépend de la spéciation et de
la solubilité du composé dans le milieu biologique
considéré. L'aluminium peut être ingéré par
voie digestive (0,1 à 1%), inhalé par voie pulmonaire ou
pénétré par voie transcutanée (De DUGGAN, et al.
1992). Son absorption au niveau intestinal est surtout facilitée par les
acides organiques et le glutamate. Il peut aussi pénétrer par
injection intraveineuse, intramusculaire ou sous-cutanée (PILETTE,
2008).
Distribution et bioaccumulation : 80% de l'aluminium sont
transportés liés aux protéines (albumine ou transferrine).
La distribution tissulaire prédomine au niveau de l'os, siège de
stockage (TESTUD, 1998). La charge naturelle en aluminium chez le sujet sain
varie de 30 à 50 mg (ATSDR, 1999), et se répartit essentiellement
dans les os (de l'ordre de 50%), les poumons (environ 25%) et le foie (20
à 25%). Le pourcentage restant se répartit dans les autres
organes, notamment le SNC et la rate (GOURIER-FRERY, 2003).
Métabolisme : le lieu d'absorption serait plutôt
stomacal ou duodénal proximal parce que l'aluminium est soluble à
pH autour de 4 mais peu soluble à pH 6 à 9 (MOREAU, 1993).
L'aluminium en se déposant au niveau des os est sous forme de phosphate
d'aluminium difficilement soluble (REICHL, 2002).
Excrétion : elle est principalement rénale
(95%) et faiblement fécale (<5%) (REICHL, 2002). En outre,
l'arrêt de l'exposition est suivi d'un relargage à partir des os
et d'une excrétion urinaire pendant plusieurs mois ou années
(TESTUD, 1998). Cependant, il existe par ailleurs des différences
importantes entre individus sans oublier l'effet de l'âge : « plus
on vieillit, plus les fonctions rénales sont perturbées et moins
on élimine l'aluminium » (GOURIER-FRERY, 2003 ; GUILLARD, 2004)
<
www.invs.santé.fr/publications/2004>
(18-04-2008).
1.7. Toxicodynamique
Le rayon de l'ion Al3+ étant de 0,5
Å, il est donc très polarisant, ce qui explique qu'il interagit
avec les molécules d'eau et les anions hydroxyle, sulfate, phosphate et
fluorure <
www.pharmacorama.com/Rubriques>
(18-04-2008). Au contact d'un acide fort, des ions Al3+ peuvent se
détacher pour être libéré en solution (REICHL,
2002).
La demi-vie dépend de la durée d'exposition mais
aussi de la distribution de l'aluminium à partir des sites de stockage ;
elle serait triphasique : une demi-vie urinaire d'environ 7 heures, une de
quelques semaines et une de plusieurs mois voire années selon
l'ancienneté de l'exposition (GOURIER-FRERY, 2003) <
www.inrs.fr> (01-09-2008).
Interaction : dans l'organisme, l'ion aluminium
présente des analogies avec l'ion ferrique avec lequel il pourrait
entrer en compétition au niveau de certains enzymes ou sites de
fixation <
www.pharmacorama.com/Rubriques>
(18-04-2008). Comme c'est le cas du fer, l'aluminium interfère aussi
avec le métabolisme du fluor, du phosphore, du cuivre, du vanadium, du
zinc, du silicium, ce qui peut donner lieu à de multiples
désordres. Au niveau du foie, il perturbe le métabolisme des
graisses et favorise ainsi l'obésité (PILETTE, 2008). Le manque
de fer, de calcium et magnésium augmente également l'absorption
de l'aluminium <
www.invs.sante.fr/publications/2004>
(18-04-2008).
1.8. Doses acceptables et valeurs d'exposition biologique
Des valeurs aux alentours de 10 iag d'Al/l de sang sont
normales. Un taux supérieur à 60 iag d'Al/l de sang est le signe
d'une véritable intoxication. Les symptômes cliniques apparaissent
à partir de taux supérieur à 60 ig/l de sang pour les
sujets professionnellement exposés (REICHL, 2002 ; TESTUD, 1998).
Tableau 1 : Valeurs limites pour l'aluminium (ACGIH, 2003 ;
Toxi-UCL, 2007)
2. Mercure
2.1. Définition et répartition
Ce métal blanc argenté est le seul qui,
à la température ordinaire, se présente sous la forme d'un
liquide très mobile de densité 13,53 g/cm3 ; de
numéro atomique 80 et de poids atomique 200,59. Il est non toxique
lorsqu'il est pur. (HACHET, 1992). Le mercure n'est cependant pas
biodégradable ni dégradable. Il reste un polluant tant qu'il est
accessible pour les êtres vivants. En outre, il est assez peu abondant
dans la nature (Encarta, 2007). Il est soluble dans les acides en formant des
composés mono et bivalents ; il n'est attaqué ni par l'eau, ni
par les alcalins.
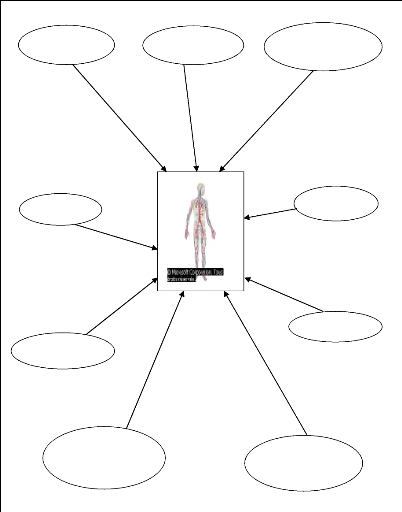
Médicaments et vaccins
(mercurochrome,...)
Crémation des
ordures ménagères
Industrie chimique et
des métaux
(peinture,
pigment,...)
Vapeur de mercure
provenant d'amalgames
dentaires, des
thermomètres
brisés, baromètres,
Raffinerie,
Papeterie,...)
Fongicides et
insecticides
(agriculture)
Produits cosmétiques &
Savons
antiseptiques
(Mekako®, Top®,
Jaribu®,...)
Fabrication et destruction
des matériels
électriques
(piles, ampoules,
batteries,...)
Industrie du textile et
du cuir
Poissons (surtout
les prédateurs)
2.2. Principales sources d'exposition anthropiques
(FREMY et al, 2000 ; HACHET, 1992 ; LANNOYE, 2001 ; Encarta,
2007).
2.3. Spéciation ou formes chimiques
Le mercure existe sous trois différentes formes :
élémentaire ou métallique, inorganique (sels de mercure)
et organique (composés arylés, alkoxyalkylés et
alkylés) (FLEISHER, 2001).
2.4. Importance dans l'organisme
Le mercure n'a aucune fonction métabolique qui serait
indispensable chez l'homme. Il peut donc causer une très grande
variété d'effets délétères (FLEISHER,
2001).
2.5. Toxicité et organes cibles dominants
Le mercure est considéré comme le métal
lourd le plus toxique. Il existe trois formes de toxicité : aiguë,
à court terme (subaiguë ou subchronique) et à long terme
(chronique). La toxicité peut varier en fonction de différents
facteurs notamment la voie d'absorption, la rapidité d'administration,
la concentration, la solubilité, la volatilité, la nature du
véhicule servant à dissoudre la substance (BERAUD, 2001).
L'intoxication au mercure s'appelle « mercurialisme ou
hydrargyrisme (hydrargyrie) ». Le mercure est aussi
considéré comme un toxique polyvalent qui touche toutes les
biomembranes et tous les systèmes enzymatiques. Il peut aussi avoir des
activités génotoxiques et/ou cytotoxiques (LANNOYE, 2001 ; EXLEY
et al. 2007).
La répartition du mercure dans l'organisme est
dépendante de la forme chimique : la fixation concerne principalement le
système nerveux central (SNC), les reins et à un degré
moindre, les muscles et le foie. Le danger de l'exposition chez la femme en
gestation vient du risque d'encéphalopathie foetale car la
barrière placentaire étant aisément franchie par les
dérivés de faible poids moléculaires tels que le
méthylmercure, etc. (HACHET, 1992).
Tableau 2 : Toxicité comparée du mercure et de
ses composés selon leur spéciation
(TESTUD, 1998)
2.6. Toxicocinétique
L'absorption du mercure peut se faire par ingestion
(négligeable), inhalation (74 à 80%), pénétration
cutanée (faible).
Distribution et bioaccumulation : en raison de sa grande
diffusibilité et de sa liposolubilité notable, le mercure est
distribué dans tout l'organisme. Toutefois, son temps de
rétention le plus long se situe dans le cerveau et les reins (REICHL,
2002).
Métabolisme : dans un premier temps, le mercure
métallique se trouvant dans le sang est rapidement oxydé en ion
mercurique (Hg inorganique) dans les érythrocytes, par voie
métabolique peroxyde d'hydrogène/catalase. L'oxydation peut
également avoir lieu dans les poumons. En outre, des études chez
les animaux suggèrent que le foie, le cerveau et d'autres tissus,
jusqu'à un certain point, pourraient constituer des sites d'oxydation.
Dans l'organisme, différentes biotransformations peuvent provoquer un
phénomène de détoxification ou de toxification (BERAUD,
2001).
voie rénale et fécale respectivement à
60% et 40% ; les composés mercuriels organiques les sont aussi à
hauteur de 10% et 90% d'excrétion par voie rénale et
fécale (REICHL, 2002).
2.7. Toxicodynamique
Le mécanisme de l'action toxique du mercure repose sur
l'inhibition des enzymes thiols dépendantes et sur la perturbation du
système de transport des tubules rénaux. La réduction de
l'activité anticholinestérasique du sérum
qu'entraîne le mercure peut être utilisé comme test de
dépistage de l'intoxication mercurielle (HACHET, 1992).
La demi-vie du mercure métallique dans le sang serait
biphasique avec des demi-vies de 4 à 45 jours selon le modèle
pharmacocinétique à base physiologique (TRUCHON, G., 2004) tandis
que la demi-vie du mercure métallique dans l'urine est de l'ordre de 55
jours mais peut varier approximativement de 1 à 3 mois (ROELS et al.
1991 ; JONSSON et al. 1999).
Interaction : dans l'organisme des interactions entre toxiques
peuvent conduire à des effets de synergie, antagonisme, induction ou
inhibition enzymatique (BERAUD, 2001). Très souvent le mercure prend la
place du cuivre dans le métabolisme de la tyrosine (MOREAU, 1993).
L'ingestion d'alcool éthylique diminue la rétention pulmonaire
des vapeurs de mercure de même que la pénicilline et ses
dérivés augmentent l'excrétion urinaire du mercure
organique (TRUCHON, 1999).
2.8. Valeurs acceptables et indices d'exposition biologique
Tableau 3 : Valeurs limites pour les composés
mercuriels (REICHL, 2002 ; OMS,
1997 ; NHANES, 2003)



