|
|
REPUBLIQUE DU CAMEROUN
Paix -- Travail - Patrie
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR UNIVERSITE DE
YAOUNDE I
|
|
REPUBLIC OF CAMEROUN
Peace - Work - Fatherland
MINISTRY OF HIGHER
EDUCATION
THE UNIVERSITY OF YAOUNDE I
|
FACULTE DES SCIENCES
FACULTY OF SCIENCE
DEPARTEMENT DE BIOLOGIE ET PHYSIOLOGIE
ANIMALES
DEPARTMENT OF ANIMAL BIOLOGY AND PHYSIOLOGY
Dynamique de la faune culicidienne sur le
campus de l'Université de Yaoundé
I
(Cameroun)
MEMOIRE
Présenté et soutenu en vue de l'obtention du
Diplôme d'Etudes
Approfondies (DEA) en BIOLOGIE ANIMALE
PAR:
KAMGANG MBOUHOM David Basile
Maître
es Sciences, option : Parasitologie
Matricule : 98X310
Sous la direction de :
Dr. Frédéric SIMARD Pr. Albert
SAME-EKOBO
Chargé de Recherche Professeur
(IRD-OCEAC) (Université de Yaoundé I)
Année académique 2005-2006

DEDICACE
Je dédie ce travail à :
- mes parents M. et Mme françois et Elisabeth MBOUHOM
;
- ma nourrice maman Sara Piadjie ;
- toute ma famille.
Pour leur affection et leur encouragement, qu'ils trouvent
ici le fruit des prières et des sacrifices consentis pour moi.

REMERCIEMENTS
Au moment où j'achève la rédaction de ce
travail réalisé au Laboratoire de Recherche sur le Paludisme de
l'OCEAC, je ne saurais m'empêcher d'exprimer ma reconnaissance à
tous ceux qui y ont contribué de près ou de loin. Je pense
particulièrement à :
- Dr Jean-Jacques MOKA, secrétaire général
de l'OCEAC pour m'avoir accordé un stage académique dans cette
institution;
- Professeur Albert SAME-EKOBO pour avoir accepté à
m'encadrer malgré ses
multiples occupations et pour avoir initié ma
collaboration avec l'OCEAC ;
- Dr Frédéric SIMARD pour m'avoir accepté au
Laboratoire de Recherche sur le
Paludisme de l'OCEAC et pour avoir dirigé ce travail;
- Drs Parfait AMBENE-AWONO, Christophe ANTONIO-NKONDJIO et
Josiane ETANG pour leurs critiques et leurs suggestions;
- Dr Luc SIGHA, chercheur à l'Institut de la Recherche
Géologique et Minière (IRGM) pour m'avoir donné un
pluviomètre ;
- monsieur Philippe BOUSSES pour ses critiques pertinentes et ses
suggestions; - Dr Isabelle MORLAIS pour sa rigueur et ses conseils ;
- tous les enseignants du département de Biologie et
Physiologie Végétales, du département de Science de la
Terre et du département de Biologie et Physiologie Animales de
l'Université de Yaoundé I pour la qualité de
l'enseignement dont ils nous ont fait bénéficier tout au long de
notre cursus universitaire ;
- MM. Roger BEYENE, Jean Claude TOTO et Elysée
NCHOUTPOUEN pour m'avoir initié aux techniques d'échantillonnage
des moustiques et à l'utilisation des clés d'identification
morphologique des Culicidae ;
- monsieur Isaac TCHIKANGWA pour son assistance à
l'insectarium ;
- MM. Jean-Pièrre AGBOR, Sylvie KEMLEU et Rose NYAMBAN
pour m'avoir initié aux différentes techniques de biologie
moléculaires et biochimiques ;
- MM. Philippe NWANE, Collince KAMDEM et Mouhamadou CHOUAIBOU
pour leur assistance technique et leurs suggestions;
- M. Joachim ETOUNA pour sa contribution à la
réalisation de la carte présentant la zone d'étude et le
relevé des positions GPS ;
- tous les résidents de la cité universitaire qui
ont accepté que les enquêtes se déroulent dans leur chambre
;

- mes amis Alice MADAHA, Sandrine NSANGO, Judy NGALLIAKO,
Aimé TOKEMNGONG, Christian WANDJI, Emmanuel PETGA, Magloire TONDA,
Fabien KANA, Maurice NKAM, Françoise MADEN, Billy TENE, Bertrand
NKOUEMOU et Daniel CHOLOM pour leur encouragement;
- mes camarades NAGA-NDONGO, Guy LEUKEFACK, Solange MEYIN,
Charlotte GWET, Hermine MAHOT, Virginie OLOMOU, Ida MBARGA et Emmanuel ELANGA
pour leur collaboration;
- je ne saurais terminer sans exprimer ma profonde gratitude
à Mlle Mireille DZUKAM pour son soutien moral et ses encouragements qui
m'ont été capitales dans les moments difficiles.

SOMMAIRE
DEDICACE i
REMERCIEMENTS ii
SOMMAIRE iv
LISTE DES FIGURES vii
LISTE DES TABLEAUX viii
LISTE DES ABREVIATIONS ix
RESUME x
ABSTRACT xi
Introduction 1
Chapitre 1 : Revue de la littérature 3
1.1. Les Culicidae 3
1.1.1. Place des Culicidae dans le règne animal
3
1.1.2. Morphologie générale des Culicidae
5
1.1.2.1. Les Sufs 5
1.1.2.2. La larve 5
1.1.2.3. La nymphe 5
1.1.2.4. L'imago ou adulte 7
1.1.3. Identification des Culicidae 9
1.1.3.1. Identification morphologique 9
1.1.3.2. Identification par cytogénétique 9
1.1.3.3. Identification par PCR 9
1.1.3.4. Autres techniques d'identification 10
1.1.4. Rôle vecteur des Culicidae 10
1.1.4.1. Genre Aedes Meigen 1818 10
1.1.4.2. Genre Culex Linné 1758 11
1.1.4.3. Genre Anopheles Meigen 1818 11
1.1.5. Quelques données sur la faune culicidienne du
Cameroun 12
1.2. Transmission du paludisme 14
1.2.1. Définition du paludisme 14
1.2.2. Indices entomologiques de la transmission 16
1.3. Lutte antivectorielle 18

Chapitre 2 : Matériel et méthodes
20
2.1. Description de la zone d'étude 21
2.2. Points de capture des moustiques 22
2.3. Mesure des paramètres climatologiques
(température, hygrométrie et
pluviométrie) 22
2.4. Collecte des données entomologiques 22
2.4.1. Récolte des stades pré-imaginaux 22
2.4.2. Capture des moustiques adultes 23
2.4.2.1. Capture au moyen des pièges lumineux 23
2.4.2.2. Capture par pulvérisation intra-domiciliaire
d'insecticides 23
2.5. Elevage et montage des moustique 25
2.6. Identification des moustiques 25
2.6.1. Identification morphologique 25
2.6.2. Identification moléculaire des anophèles du
complexe Anopheles gambiae 25
2.6.2.1. Préparation du matériel biologique 26
2.6.2.2. Protocole d'amplification par PCR (Scott et
al., 1993) 27
2.6.2.3. Protocole de digestion enzymatique (Favia et
al., 1997) 29
2.6.2.4. Technique d'électrophorèse 32
2.6.2.4.1. Principe 32
2.6.2.4.2. Préparation du gel 32
2.6.2.4.3. Distribution des échantillons et migration
électrophorétique 32
2.6.2.4.4. Photographie et interprétation du gel 33
2.7. Détermination de l'infestation des anophèles
33
2.7.1. Principe 33
2.7.2. Protocole ELISA CSP monospécifique 33
2.7.3. Indice entomologique de la transmission 34
2.8. Analyse statistique 34
Chapitre 3 : Résultats et discussion
35
3.1. Résultats 35
3.1.1. Données climatologiques 35
3.1.2. Données entomologiques 37
3.1.2.1. Inventaire de la faune culicidienne 37
3.1.2.2 Faune culicidienne récoltée au stade
larvaire 39
3.1.2.3. Faune culicidienne récoltée au stade
adulte 41

3.1.2.4 Variation des effectifs de Culex quinquefasciatus
en fonction de la pluviométrie. 41
3.1.2.5 Espèces et formes moléculaires du complexe
Anopheles gambiae 41
3.1.2.6. Indice circumsporozoïte 41
3.2. Discussion 43
Conclusion et perspectives 47
Références bibliographiques 48
Annexes 56
Annexe 1 : Photos des différents types de gîte
prospectés 56
Annexe 2 : Séquences des amorces utilisées pour
l'identification des espèces du complexe Anopheles gambiae et
représentation schématique du test diagnostic de 3 espèces
du
complexe Anopheles gambiae d'après Scott et
al. (1993) 58
Annexe 3 : Réactifs et quantité pour ELISA-CSP
59

LISTE DES FIGURES
Figure 1 : Particularités morphologiques
des principaux genres de Culicidae d'intérêt
médical
(Lane et Crosskey, 1993) 6
Figure 2 : Morphologie générale
des Culicidae adultes (Lane et Crosskey, 1993) 8
Figure 3 : Développement de
Plasmodium falciparum chez l'anophèle (A1), chez l'homme
(A2) et espérance de vie infectante des anophèles
(B) 15
Figure 4 : Zone d'étude et localisation
des points de collecte des données entomologiques 21
Figure 5 : Piège lumineux type CDC 24
Figure 6 : Récolte des moustiques
après pulvérisation intra-domiciliaire d'insecticide 24
Figure 7 : Moustique monté sur minutie
24
Figure 8 : Schéma du principe de la PCR
(Polymerase Chain Reaction) 28
Figure 9 : Cycles des températures d'une
PCR pour l'identification des espèces et des formes
moléculaires d'An. gambiae s.s (Fanello et
al., 2002) 29
Figure 10 : Photographie d'un gel
montrant l'identification de An. gambiae s.s de forme
moléculaire M 30
Figure 11 :
Distribution mensuelle des précipitations et variation de la
température extérieure
et du taux d'hygrométrie sur le campus de
l'Université de Yaoundé I de mars 2005 à
février 2006 35
Figure 12 : Variation
mensuelle des effectifs de Cx. quinquefasciatus en fonction de la
pluviométrie 42

LISTE DES TABLEAUX
Tableau 1 : Caractères morphologiques
distinctifs des espèces identifiées (Gillies et De
Meillon, 1968 ; Gillies et Coetzee, 1987 ; Jupp, 1996)
37
Tableau 2 : Composition du milieu réactionnel
d'une PCR pour l'identification des espèces
du complexe An. gambiae (Scott et al., 1993)
29
Tableau 3 : Composition du milieu réactionnel
pour la digestion enzymatique de l'ADN
d'An. gambiae s.s (Favia et al., 1997)
30
Tableau 4 : Effectif et composition de la faune
culicidienne échantillonnée sur le campus de
l'Université Yaoundé I de mars à
décembre 2005 38
Tableau 5 : Caractérisation
et localisation des différents gîtes larvaires potentiels
prospectés
et distribution des espèces présentes de mars
à décembre 2005 40

LISTE DES ABREVIATIONS
ACm : anticorps monoclonal ADN : acide
désoxyribonucléique
BB : blocking buffer
BSA : bovine serum albumine CDC : center for diseases control CSP
: circumsporozoïtic protein dNTP : dinucléotide triphosphate
DIDP : Direction des Infrastructures et de la Planification
EDTA: ethylene diamine tetra-acetic acid ELISA: Enzyme Linked
ImmunoSorbent Assay
GPS: geographical positioning system Mm : millimètre
ul : microlitre
mM : millimolaire
MSP : Ministère de la Santé Publique
OCEAC : Organisation de Coordination pour la lutte contre les
Endémies en Afrique Centrale OMS : Organisation Mondiale de la
Santé
PCR : polymerase chain reaction Pmoles : pico-moles
RFLP : restriction fragment length polymorphism
s.l; s.s : sensu lato (sens large) ; sensu stricto
(sens strict)
UI : unité internationale
UTM : universal transverse mercator

RESUME
La lutte contre les maladies à transmission vectorielle
est basée en grande partie sur le contrôle des vecteurs. Pour
rendre cette lutte efficace, la connaissance de la biologie et de la taxonomie
des vecteurs est indispensable.
De mars à décembre 2005, nous avons
effectué un suivi longitudinal en vue d'échantillonner la faune
culicidienne présente sur le campus de l'Université de
Yaoundé I. Les moustiques provenaient des collectes trimestrielles des
stades pré-imaginaux dans treize gîtes larvaires sur le campus et
des captures mensuelles des adultes grâce au piège lumineux CDC
dans quatre chambres et aux pulvérisations intra-domiciliares
d'insecticides dans six chambres de la Cité Universitaire. Au total,
1213 moustiques adultes ont été capturés dont 381 au moyen
de pièges lumineux et 832 issus de la faune résiduelle matinale.
Au total, douze espèces culicidiennes ont été
identifiées: Culex quinquefasciatus, Cx. univittatus,
Cx.duttoni, Cx. guiarti, Cx. decens, Cx.
chorleyi, Cx. tigripes, Cx. poicilipes, Mansonia
africana, M. uniformis, Aedes albopictus et
Anopheles gambiae. Les espèces Cx. chorleyi, Cx.
poicilipes, Cx. guiarti et Cx. tigripes n'ont été
récoltées qu'aux stades pré-imaginaux et les
espèces Ma. africana et Ma. uniformis au stade
adulte.
Les moustiques récoltés au stade adulte sont
composés à 96,9% de Cx. quinquefasciatus.
An. gambiae, le seul vecteur du paludisme identifié, ne
représente que 0,5% de la faune adulte. La détermination de
l'infection des anophèles par le test ELISA CSP n'a pas
révélé la présence de la protéine CSP dans
les glandes salivaires des femelles testées. Le faible effectif des
anophèles récoltés (6 individus) ne permet pas de
conclure. L'analyse par PCR des membres du complexe An. gambiae a
révélé la seule présence d~An. gambiae s.s
de forme moléculaire M sur le campus universitaire.
Mots clés: Culicidae, vecteur,
maladie, Université de Yaoundé I

ABSTRACT
The fight against vector borne diseases is based largely on
vector control. For this fight to be more efficient, knowledge of the biology
and the taxonomy of vectors is needed.
From march to december 2005, we performed longitudinal survey
in order to sample Culicidae fauna present on the campus of the
University of Yaoundé I. Mosquito's came of the quarterly collections of
immature stages in thirteen breeding sites on the campus and the monthly
captures of adults using CDC miniature light traps in four rooms and by spray
in six rooms of the Academic City. A total of 1213 adult mosquitoes were
captured, among which 381 by CDC miniature light traps and 832 by spray. To the
total twelve Culicidae species have been identified: Culex
quinquefasciatus, Cx. univittatus, Cx.duttoni, Cx. guiarti, Cx. decens, Cx.
chorleyi, Cx. tigripes, Cx. poicilipes, Mansonia africana, Ma. uniformis, Aedes
albopictus and Anopheles gambiae. Cx. chorleyi, Cx.
poicilipes, Cx. guiarti and Cx. tigripes species have
been collected at the immature stages and Ma. africana and Ma.
uniformis species at their adult stage.
The adult fauna are composed to 96.9% of Cx.
quinquefasciatus. Only malaria vector identified is An. gambiae,
it is represents just 0.5% of the adult fauna. The CSP protein has not detected
in the salivary gland of anopheles by ELISA CSP test. Low sample size (6
individuals) doesn't permit to conclude. Only the M molecular form of An.
gambiae was observed.
Key words: Culicidae, vector, diseases, University of
Yaoundé I.

Introduction
Les Culicidae regroupent l'ensemble des insectes
diptères holométaboles communément appelés
moustiques. Ils occupent l'ensemble des terres émergées à
l'exception du continent antarctique et de quelques îles (Mouchet et
Carnevale, 1991). Ils constituent le plus important groupe de vecteurs d'agents
pathogènes transmissibles à l'homme. Les mâles et les
femelles se nourrissent de jus sucrés, mais seules les femelles sont
hématophages dans la plupart des cas. Au cours de leur repas de sang,
elles peuvent transmettre les virus ou les parasites responsables de plusieurs
affections telles que les arboviroses, les filarioses et le paludisme.
Quatre principaux genres Mansonia, Culex, Aedes et
Anopheles sont impliqués dans la transmission de ces
pathogènes dans le monde dont trois Culex, Aedes et
Anopheles en Afrique (Lane et Crosskey, 1993). Les larves de
moustiques se développent dans les collections d'eau dont le type est
variable suivant le genre et l'espèce. La plupart des moustiques
vecteurs d'agents pathogènes à l'homme sont anthropophiles (se
nourrissent sur l'homme) et endophiles (se reposent dans les habitations
après leur repas de sang) ou exophiles (quittent rapidement les
habitations pour gagner des refuges extérieurs après leur repas
de sang) (Rhodain et Perez, 1985 ; Vicens et al., 1993 ; Mouchet et
al., 2004).
De toutes les affections transmises à l'homme par
piqûre de moustiques, le paludisme est celle dont la prévalence
est la plus élevée (OMS, 2001). Il occasionne plus d'un million
de décès chaque année dans le monde, Environ 80% des cas
surviennent en Afrique au Sud du Sahara et l'immense majorité des
victimes se compte parmi les enfants de moins de cinq ans (OMS, 2005).
Au Cameroun, le paludisme est responsable de 35 à 45%
des décès dans les centres de santé, représente 42%
de la morbidité chez les enfants de moins de cinq ans, 30% des
hospitalisations et 26% des arrêts maladies, 40% des dépenses
annuelles pour la santé des ménages (Samé-Ekobo, 2005).
En général, la lutte contre ces maladies
à transmission vectorielle repose en grande partie sur le contrôle
des vecteurs. Pour qu'elle soit efficace, cette lutte doit être
sélective, spécifique et orientée contre les vecteurs
cibles. A cet effet, il est important de bien connaître la
bioécologie et la composition de la faune culicidienne dans une
région donnée afin de mettre sur pied des méthodes de
lutte efficaces.
Des études menées au Cameroun ont montré que
l'urbanisation influence qualitativement et quantitativement la faune
culicidienne (Fondjo et al., 1992 ; Antonio-Nkondjio et al.,
2005; Samé-Ekobo, 2005). De nouvelles espèces de moustiques
continuent à être décrites dans le

monde, la plus récente au Cameroun est Anopheles
ovengensis (Awono-Ambéné et al., 2004), vecteur du
paludisme. Il est aussi connu que certains paramètres
météorologiques tels que les précipitations, la
température et l'hygrométrie jouent un rôle sur le
développement et la répartition des espèces de
Culicidae dans le monde (Rodhain et Perez, 1985 ; Mouchet et
al., 2004). A cet effet, nous nous sommes proposés d'effectuer
une étude détaillée de la faune culicidienne
associée à un relevé des données
météorologiques. Cette étude a pour
objectif général la contribution à la connaissance des
Culicidae sur le campus de l'Université de Yaoundé I
dans l'optique d'évaluer les risques de transmission de maladies en
particulier le paludisme dans ce milieu. Pour y parvenir, trois objectifs
spécifiques ont été fixés:
- identifier les différentes espèces de moustiques
présentes sur le campus en utilisant différentes méthodes
de capture (larves, adultes) ;
- caractériser la dynamique de ces populations dans le
temps par un suivi longitudinal;
- évaluer le risque d'infection palustre par la recherche
des Plasmodium dans les glandes salivaires des anophèles.

Chapitre 1 : Revue de la littérature
1.1. Les Culicidae
Les Culicidae sont des diptères
holométaboles (à métamorphose complète) au corps
recouvert de soies allongées ou d'écailles. Ils se
développent à travers les stades Suf, larve et nymphe qui sont
aquatiques avant d'atteindre le stade adulte aérien. Cette famille
comprend plus de 3500 espèces réparties dans le monde (Eldridge,
2005).
1.1.1. Place des Culicidae dans le règne animal
La place des Culicidae dans le règne animal
d'après Lane et Crosskey (1993) est la suivante Embranchement
des Arthropodes:
- corps à symétrie bilatérale ;
- corps métamérisé et recouvert d'une
cuticule.
Sous-embranchement des Mandibulates (ou
Antennates):
- présence d'une paire d'antennes à rôle
sensoriel ;
- présence d'une paire de mandibules.
Classe des Insectes :
- respiration trachéenne ;
- trois paires d'appendices locomoteurs.
Sous-classe des Ptérygotes :
- présence de deux paires d'ailes. Section des
Oligonéoptères:
- champ jugal évolué ;
- ailes repliées en arrière au repos.
Super-ordre des Mécoptéroïdes : -
pièces buccales de type suceur ou piqueur ;
- stipes des maxilles divisés transversalement.
Ordre des Diptères:
- présence d'une seule paire d'ailes et une paire
d'haltère ;
- tarses pentamères.
Sous-ordre des Nématocères :
- antennes longues, filiformes et à nombreux articles;

- palpes grêles de deux à cinq articles.
Infra-ordre des Culicimorphes :
- antennes des mâles touffues spécialisées
pour entendre les femelles ;
- pédicelle bulbeux dans les deux sexes.
Superfamille des Culicoidea :
- spiracle ouvert.
Famille des Culicidae :
- appareil buccal constitué d'une trompe allongée
;
- présence d'écailles sur les nervures des
ailes.
Cette famille se divise en trois sous-familles.
* Sous-famille des Anophelinae :
- palpes aussi longs que la trompe dans les deux sexes;
- abdomen entièrement dépourvu
d'écailles.
Cette sous-famille comprend 3 genres (Bironella, Chagasia,
Anopheles) parmi lesquels seul le genre Anopheles à une
importance médicale.
Genre Anopheles Meigen 1818 :
- tergites et sternites dépourvus d'écailles ;
- scutellum arrondi.
* Sous-famille des Culicinae :
- palpes plus courts que la trompe chez les femelles ;
- présence d'un siphon respiratoire chez les larves.
Elle comporte 29 genres. Les principaux genres d'importances
médicales sont les suivants. Genre Aedes Meigen 1818
:
- surface des ailes avec des écailles larges plutôt
symétriques ;
- griffes des tarses I et II généralement
dentelées.
Genre Culex Linné 1758 :
- pulvilli présente ;
- cerques courts et peu visibles.
Genre Mansonia Blanchard 1901 :
- moustique marron et trapu ;
- ailes avec des écailles sombres et claires
asymétriques.
* Sous-famille des Toxorhynchitinae:
- moustique de très grande taille (8- 13 mm) à
couleur métallique ;
- proboscis recourbé.
|
Elle est représentée par un seul genre:
Genre Toxorhynchites Theobad 190
|
|
1.1.2. Morphologie générale des Culicidae
Elle varie avec le stade de développement, le genre et
l'espèce (Fig. 1).
1.1.2.1. Les oeufs (Fig. 1 A - C)
Ils mesurent environ 1 mm de long (Lane et Crosskey, 1993),
sont déposés à la surface de l'eau par les femelles,
d'abord blancs puis deviennent bruns noirâtres. Selon les genres, ils
peuvent être ovoïdes et pourvus de flotteurs latéraux chez
les Anopheles (Fig. 1C) ou apicaux chez les Culex (Fig. 1A) ;
subtriangulaires, à l'exemple du genre Aedes (Fig. 1B) ;
sphériques chez les Toxorhynchites ou ont un filament terminal
(Mansonia). Ils peuvent être pondus solément ou sous
forme de radeaux.
1.1.2.2. La larve (Fig. 1 D- F)
Elle présente un corps nettement divisé en trois
parties: la tête, le thorax, l'abdomen. Le thorax est beaucoup plus
développé que la tête et l'abdomen, ce qui permet de
distinguer les larves de moustiques de celles des autres diptères. La
larve est apode. La tête est constituée d'un frontoclypeus
médian et de deux plaques épicrâniennes latérales.
Elle présente une paire d'antennes, deux yeux et deux brosses buccales.
Les pièces buccales sont de type broyeur. Le thorax n'est pas
apparemment segmenté. Des paires de soies longues ou courtes, plus ou
moins ramifiées, s'y insèrent. Elles sont très
utilisées en systématique. L'abdomen est constitué de dix
segments. Le segment dix est pourvu d'une brosse ventrale. Le segment huit
porte, dans les genres autres que celui des anophèles, un siphon
respiratoire, de taille variable suivant les genres. Il est long chez les
Culex (Fig. 1D), court chez les Aedes (Fig. 1E) et donc
inexistant chez les Anopheles (Fig. 1F).
1.1.2.3. La nymphe (Fig. 1G)
Elle est en forme de virgule ou de point d'interrogation. Sa
tête fusionne avec le thorax pour constituer un ensemble très
développé appelé céphalothorax. Deux trompettes
respiratoires s'ouvrent dorsalement au niveau du céphalothorax.
L'abdomen est constitué de dix segments dont huit sont visibles. Le
segment huit porte deux palettes natatoires pouvant elles-même s'orner de
denticules ou de soies. Il existe également de nombreuses soies sur les
segments abdominaux.

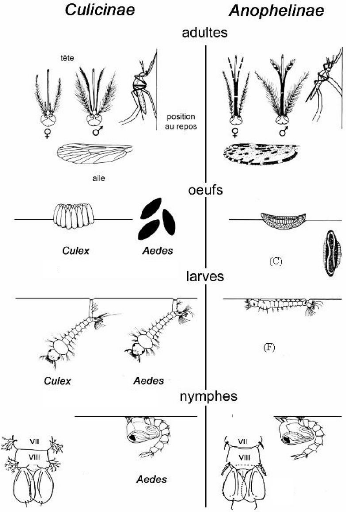
(A) (B)
(D) (E)
(G)
Culex et
Anopheles
Figure 1: Particularités morphologiques
des principaux genres de Culicidae d'intérêt
médical (Lane et Crosskey, 1993)

1.1.2.4. L'imago ou adulte
Le moustique adulte a un corps allongé, de 5 à 20
millimètres de long (Rodhain et Perez, 1985). Le corps comporte trois
parties: la tête, le thorax, l'abdomen (Fig. 2)
- La tête
Elle comprend deux yeux composés, de nombreuses
ommatidies s'étendant sur les faces latérales mais aussi sur une
grande partie de la face dorsale et sur la face ventrale. Entre les yeux
s'insèrent deux antennes constituées de 15 articles chez les
mâles, 16 chez les femelles. Chez les mâles, elles portent de longs
et nombreux verticilles de soies (antennes plumeuses). Chez les femelles, les
soies sont plus courtes et nettement moins nombreuses (antennes glabres). En
dessous des antennes et de part et d'autre du proboscis se situent deux palpes
maxillaires penta-articulés. Les palpes maxillaires sont longs,
dilatés ou non à leur extrémité, suivant le genre
et le sexe. Les six pièces buccales, transformées en stylets
vulnérants, se disposent dans une gouttière formée par le
labium pour constituer la trompe vulnérante. Le labium présente
à son extrémité deux languettes mobiles appelées
labelles.
- Le thorax
Il est globuleux, composé de trois segments
soudés: prothorax, mésothorax et métathorax, dont chacun
présente une partie dorsale (tergum) et une partie ventrale (sternum),
les pièces latérales étant des pleures. Sur chacun de ces
segments s'insère une paire de pattes. Le mésothorax, très
développé, porte en plus une paire d'ailes, une paire de
stigmates et un prolongement appelé scutellum. Le métathorax
porte une paire de stigmates et une paire de balanciers (ou haltères).
Les pattes comprennent du corps vers l'extrémité : la hanche, le
trochanter, le fémur, le tibia et un tarse subdivisé en cinq
parties dont le dernier segment porte deux griffes et parfois un empodium et
deux pulvilles. Les ailes comportent trois parties: l'allule et la frange
alaire, de petites tailles et l'aile proprement dite plus étendue. La
membrane de l'aile, transparente, est soutenue par des nervures longitudinales
et transversales qui délimitent des cellules. En outre, ces nervures
portent des écailles et le bord postérieur de l'aile est
orné d'une frange d'écailles. Des écailles de formes, de
couleurs et de dispositions variées, couvrent également les
segments thoraciques et les pattes.
- L'abdomen
Il possède dix segments, dont huit visibles. Chacun
d'eux présente une partie dorsale (tergite) et une partie ventrale
(sternite), reliées par une membrane souple latérale. Ces
segments sont ornés de soies et d'écailles de couleur et de
disposition variées (écailles absentes chez les
Anophelinae). Le dixième segment porte le génitalia pour
le mâle (phallosome) et les cerques pour les femelles.

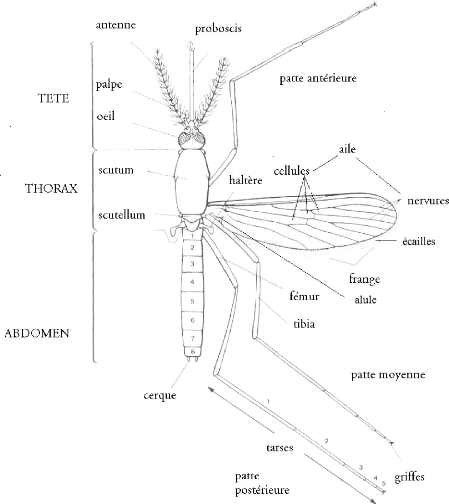
Figure 2: Morphologie générale des
Culicidae adultes (Lane et Crosskey, 1993)

1.1.3. Identification des Culicidae
La différenciation des espèces de moustiques
peut se faire de plusieurs façons. Les méthodes les plus
utilisées se basent sur l'étude des caractères
morphologiques, de la cytogénétique ou sur l'analyse de l'ADN par
PCR (Polymerase Chain Reaction).
1.1.3.1. Identification morphologique
Cette technique est basée sur l'observation de
critères morphologiques discriminants. A cet effet, plusieurs
clés dichotomiques d'identification des stades pré-imaginaux et
imago des Culicidae ont été établies. Pour la
région Afrique, Edwards (1941), Hopkins (1952), Jupp (1996) ont
défini les critères taxonomiques pour les Culicinae ;
Gillies et De Meillon (1968), Gillies et Coetzee (1987),
Awono-Ambéné et al. (2004), ont défini pour les
anophèles. Hervy et al. (1998) ont proposé une
clé informatisée des anophèles afrotropicaux sous forme de
CD-ROM.
1.1.3.2. Identification par
cytogénétique
Dans les cellules nourricières des ovaires des femelles
semi-gravides et les glandes salivaires des larves de stade 4 des Culicidae
se trouvent des chromosomes polythènes (chromosomes géants
qui ont 200 à 300 fois la taille des chromosomes au début de la
mitose). Ces chromosomes dits polythènes présentent une
succession de bandes sombres et claires après coloration à
l'orcéine. Ces bandes peuvent servir de marqueur de l'espèce
(Coluzzi et Sabatini, 1967 ; Coluzzi, 1968 ; Coluzzi, et al.,
1985).
1.1.3.3. Identification par PCR (Polymerase Chain
Reaction)
La technique de la polymérisation en chaîne (PCR)
a été développée à la fin des années
1980 (Saïki et al., 1985). C'est une technique d'amplification
sélective d'une séquence d'ADN flanquée par deux amorces
(primers) de séquence connue. Elle permet d'obtenir un grand
nombre de copies d'un segment particulier d'ADN appelé ADN cible qu'il
est alors possible de caractériser et d'identifier.
L'application de cette technique permet d'identifier
rapidement des spécimens de moustiques collectés sur le terrain
à n'importe quel stade de développement (Scott et al.,
1993). Plusieurs protocoles d'identification par PCR ont été mis
sur pied. A titre d'exemple: on a ceux de Scott et al. (1993) et
Fanello et al. (2002) pour les espèces du complexe
Anopheles gambiae

(espèces morphologiquement très voisine, voire
indifférenciables, dont l'identification demande souvent l'utilisation
de critères mixiologiques, cytogénétiques, biochimiques ou
moléculaires), Cohuet et al. (2003) pour les espèces du
groupe An. Funestus, Kengne et al. (2003) pour les
espèces du groupe An. nili.
1.1.3.4. Autres techniques d'identification
* La technique d'électrophorèse des
isoenzymes est basée sur la propriété qu'ont les
molécules chargées de se déplacer dans un champ
électrique, en fonction de leur charge et de leur masse vers l'anode ou
la cathode. Ceci est le cas des enzymes qui sont des molécules
chargées qui peuvent migrer sur un support où existe un champ
électrique. L'inconvénient de cette technique est qu'elle ne
s'applique qu'à du matériel vivant ou congelé à
l'état frais (Miles, 1979).
* La morphométrie est basée sur
la taille de différents appendices des Culicidae pour leur
différenciation. Les espèces An. arabiensis et An.
gambiae s.s ont pu être différenciées à partir
des critères morphométriques à savoir la taille
légèrement plus grande de la première espèce
(Petrarca et al., 1998). Mais ce paramètre ne peut pas
être utilisé comme critère diagnostique permettant
l'identification des individus, car la taille des moustiques adultes
dépend aussi de la nutrition aux stades larvaires.
1.1.4. Rôle vecteur des Culicidae
Les Culicidae constituent le groupe de vecteurs le
plus important en santé publique. Ils sont impliqués dans la
transmission de nombreux agents pathogènes. Pour qu'une espèce de
moustique soit considérée comme vecteur d'agents
pathogènes à l'homme, elle doit permettre le développement
de l'agent pathogène (compétence vectorielle); elle doit avoir
une grande longévité et être suffisamment abondante
localement; elle doit être anthropophile. Les principaux vecteurs
appartiennent aux genres Aedes, Culex et
Anopheles.
1.1.4.1. Genre Aedes Meigen 1818
Les femelles piquent essentiellement le jour et certaines
espèces de ce genre sont impliquées principalement dans la
transmission d'arboviroses.
L'espèce Ae. albopictus est connue comme
étant le vecteur majeur de la dengue en Asie du Sud Est (Smith,1956;
Rudnick et al.,1977) et dans plusieurs autres régions: La
Réunion, Hawaï, Japon, Indonésie, Seychelles, Sud de la
Chine, Thaïlande et Malaisie (Sabin,1952 ; Gould et al.,1968 ;
Chan et al.,1971 ; Jumali et al.,1979).

Il a été montré également qu'il
est le vecteur du virus du Chikungunya (Reiter et al., 2006), de
l'encéphalite japonaise, du «Ross river virus»(Mitchell et
al., 1987). Hormis ces arbovirus, Ae. albopictus peut aussi
transmettre les filaires telles que Dirofilaria immitis des chiens
à l'homme.
Ae. aegypti est le vecteur naturel de nombreux agents
infectieux (Degallier et al., 1988). Cette espèce joue un
rôle essentiel dans la transmission épidémique de trois
arbovirus d'importance médicale majeure: c'est le vecteur principal
interhumain de virus de la fièvre jaune, de la dengue (Chritopher, 1960
; Galliard, 1931) et de la fièvre Chikungunya (Thonnon et al.,
1999). La réceptivité des souches d'élevage d'Ae.
aegypti vis-à-vis des filaires Brugia malayi et
Dirofilaria immitis a été démontrée
(Rodhain et Perez, 1985).
D'autres espèces telles que: Ae. furcifer, Ae.
opok, Ae. neoafricanus, Ae. luteocephalus permettent la transmission du
virus de la fièvre jaune des primates à l'homme en Afrique de
l'Ouest; Ae. africanus est le vecteur naturel secondaire de la
fièvre jaune de l'homme à l'homme et les espèces Ae.
polynesiensis, Ae. pseudoscutellaris, Ae. tangae et Ae. vigilax
sont impliquées dans la transmission des filaires
apériodiques Wuchereria bancrofti pacifica
(Lane et Crosskey, 1993).
1.1.4.2. Genre Culex Linné
1758
A la différence des Aedes à
activité essentiellement diurne, les femelles de ce genre piquent
essentiellement la nuit et sont impliquées dans la transmission de la
filariose de Bancroft et de certaines arboviroses.
L'espèce Culex quinquefasciatus est largement
répandue en Afrique Sub-saharienne. Il n'a pas de rôle vecteur en
Afrique de l'Ouest ainsi qu'en Afrique Centrale mais il engendre partout une
forte nuisance en milieu urbain. En Afrique de l'Est, il est vecteur de la
filariose de Bancroft (Hamon et al., 1967). D'autres espèces
telles que: Cx. bitaeniorhynchus, Cx. annulirostris et
Cx. pipiens molestus en Asie, Cx. antennatus en Afrique sont
également impliquées dans la transmission de cette filariose.
En ce qui concerne la transmission des arboviroses,
l'espèce Cx. tritaeniorhynchus est le vecteur de
l'Encéphalite Japonaise (Lane et Crosskey, 1993; Aubry, 2005) et
d'autres espèces de Culex sont vecteurs de l'Encéphalite
de Saint Louis, de l'Encéphalite Equine Américaine, de
l'Encéphalite de la Murray et du virus de West Nile (Aubry, 2005).

1.1.4.3. Genre Anopheles Meigen 1818
Ce genre compte environ 450 espèces connues dans le
monde, mais seules 70 à 80 sont impliquées dans la transmission
du paludisme humain (Mouchet et al., 2004). Certaines d'entre-elles
transmettent également des filarioses (Wuchereria bancrofti,
Brugia malayi, Brugia timori) et des arboviroses.
En Afrique, les espèces An. gambiae s.s,
An arabiensis, An. funestus, An. nili et An.
moucheti sont considérées comme des vecteurs majeurs de
paludisme à Plasmodium falciparum. D'autres espèces
comme An. pharoensis, An. hanchoki, An. melas, An. merus, An.
paludis, An. coustani, An. rivulorum, An. brunipes, An. mascarensis jouent
un rôle secondaire ou local dans la transmission du paludisme
(Antonio-Nkondjio et al., 2002 ; Fontenille et al., 2003 ;
Fontenille et Simard, 2004 ; Mouchet et al., 2004 ; Antonio-Nkondjio
et al., 2005). A ces vecteurs secondaires s'ajoute une nouvelle
espèce vectrice, An. Ovengensis, récemment
découverte au Sud Cameroun (Awono-Ambéné et al.,
2004). La répartition de ces vecteurs n'est pas uniforme sur le
continent. An. gambiae s.s et An. funestus sont
rencontrés un peu partout en Afrique, alors que An. moucheti et
An. nili sont confinés dans la région forestière
et périforestière et An. arabiensis en zone de savane
(Gillies et De Meillon, 1968).
Les espèces An. funestus, An. gambiae, An. nili
sont aussi impliquées dans la transmission de la filariose de
Bancroft en Afrique tropicale (Gillies et De Meillon, 1968 ; Lane et Crosskey,
1993). En Asie du Sud les espèces An. barbirostris,
An. donaldi, An. anthropophagus sont vecteurs des filaires
Wuchereria bancrofti et Brugia malayi (Lane et Crosskey,
1993).
Le virus O'Nyong Nyong en Afrique subsaharienne est
également transmis par les anophèles, plus
particulièrement An. funestus et An. gambiae (Gillies
et De Meillon, 1968).
1.1.5. Quelques données sur la faune culicidienne du
Cameroun
Les études entomologiques antérieures
réalisées au Cameroun ont permis de mettre en évidence
environ 300 espèces de moustiques réparties dans 14 genres au
Cameroun (Rageau et Adam, 1952 ; Rickenbach et al., 1976a ; Rickenbach
et al., 1976b ; Hervy et al., 1998 ; Fontenille et Toto, 2001
; Awono-Ambéné et al., 2004). La distribution de ces
espèces sur l'ensemble du territoire varie d'un écosystème
à l'autre.
- Genre Mansonia
Les espèces Ma. africana et Ma. uniformis
sont les plus connues au Cameroun. Ce sont des
moustiques
anthropophiles et très agressifs (Manga et al., 1992). Ces
espèces se rencontrent
partout où se trouvent de grandes
étendues d'eau peuplées de plantes aquatiques qui

permettent à leurs larves de se développer. Leur
présence a été signalée dans toutes les provinces
du pays (Rageau et Adam, 1952 ; Rickenbach et al., 1976a)
- Genre Culex
Plusieurs espèces de ce genre sont connues au Cameroun.
Cependant, celles qui méritent une attention particulière sont
Cx. quinquefasciatus et Cx. tigripes. Cx tigripes
est la seule espèce au Cameroun dont les larves dévorent
celles des autres Culicidae (Rageau et Adam, 1952). Cx.
quinquefasciatus est l'espèce responsable de la plus grande part
des nuisances culicidiennes en milieu urbain au Cameroun (Fondjo et
al., 1992 ; Manga et al., 1992 ; Nimpaye et al.,
2001). Les gîtes larvaires de ces espèces sont presque toujours
constitués de collection d'eaux chargées de débris
organiques (Rageau et Adam, 1952 ; Hougard et al., 1993 ; Barbazan et
al., 1997 ; Fontenille et Toto, 2001).
- Genre Aedes
Plusieurs espèces d'Aedes ont
été signalées au Cameroun. Les espèces les plus
étudiées sont Ae. aegypti, Ae. africanus et Ae.
albopictus. Ae. aegypti est une espèce très domestique.
Ae. africanus est une espèce présente en milieu
forestier où elle est responsable de la transmission selvatique
(primates) ainsi que interhumaine de la fièvre jaune en zone rurale
(Vicens et al., 1993 ; Bouchite et al., 1995). Ae.
albopictus a été signalé au Cameroun en 1998
(Fontenille et Toto, 2001), et son rôle vecteur n'est pas encore connu au
Cameroun. Une mise à jour récente de la distribution d'Ae.
aegypti et la première carte de distribution d'Ae. albopictus
au Cameroun a été récemment par Simard et
al. (2005).
Les larves de ce genre se développent
généralement dans les creux d'arbres, les vieux pneus, les
boîtes de conserves, les creux de rocher, les aisselles de feuilles
engainantes, les cabosses de cacao (Rageau et Adam, 1952; Fontenille et Toto,
2001; Nchoutpouen, 2003; Simard et al., 2005).
- Genre Anopheles
C'est le genre le plus important en santé publique vu
son rôle dans la transmission du paludisme et de la filariose au
Cameroun. Les principales espèces sont An. gambiae s.s, An.
arabiensis, An. funestus, An. moucheti, An. nili. L'espèce
An. gambiae s.s est représentée au Cameroun par les deux
formes moléculaires M et S (Wondji et al., 2002 ; Wondji et
al., 2005). Cette espèce se rencontre sur toute
l'étendue du territoire, sauf sur les montagnes où elle est
absente à plus de 1500 m d'altitude (Manga et al, 1993).
An. arabiensis est majoritairement, voire seule, présente dans
la partie septentrionale du pays (Fondjo, 1996; Wondji et al., 2005).
An. funestus se rencontre un peu partout tout au long de
l'année et permet de pérenniser la transmission du paludisme.
An. moucheti est présent dans la région

forestière et dans la savane post-forestière
où elle s'étend jusqu'au 6° de latitude Nord (Mouchet et
Gariou, 1966 ; Antonio-Nkondjio et al., 2002 ; Antonio-Nkondjio et
al., 2005 ; Antonio-Nkondjio et al., 2006). An. nili
est rencontré principalement au Sud Cameroun. Les anophèles
exploitent une grande variété de gîtes larvaires. Ainsi les
espèces An. gambiae s.s et An. arabiensis
préfèrent les collections d'eaux claires et
ensoleillées, An. funestus les lacs et étangs
à végétation dressée, An. nili les
rivières et fleuves à courant rapide, An. moucheti les
fleuves à courant lent (Fontenille et al., 2003).
1.2. La transmission du paludisme.
1.2.1. Définition
Le paludisme encore appelé malaria, est une affection
due à la présence dans le sang d'un parasite unicellulaire
(protozoaire) du genre Plasmodium. La transmission de la maladie d'un
homme infecté à un homme sain est assurée par la
piqûre d'un moustique femelle du genre Anopheles. Le cycle de
développement des Plasmodium implique deux hôtes: un
vertébré (homme ou animal) et un invertébré
(l'anophèle femelle) chez qui se déroule le cycle sporogonique ou
sexué (Fig. 3A).
En effet, lors de la prise d'un repas de sang sur un Homme
infecté, l'anophèle ingère différents stades
érythrocytaires du parasite (corps en rosace, schizontes,
gamétocytes). Dans l'estomac du moustique, les éléments
asexués sont digérés. Le gamétocyte femelle
s'arrondit et donne un unique gamète femelle, le gamétocyte
mâle se divise en quatre gamètes mâles mobiles, de forme
filamentaire. La fécondation du gamète femelle par le
gamète mâle (12) donne un zygote (13) mobile, l'ookinète
qui est le seul stade diploïde du cycle. Après la division
méiotique, l'ookinète (14) traverse la paroi stomacale de
l'anophèle, se fixe sous la paroi épithéliale et donne
l'oocyste (15, 16) dans lequel s'individualisent les sporozoïtes. Une fois
libérés dans l'hémolymphe après éclatement
de l'oocyste (17), les sporozoïtes gagnent les glandes salivaires (18): la
femelle est alors infectante et épidémiologiquement dangereuse
(Fig. 3B). Les sporozoïtes seront transmis à l'homme lors d'un
nouveau repas de sang du moustique. La durée de ce cycle varie de 10
à 40 jours suivant la température extérieure et les
espèces en causes (Mazier, 1991).

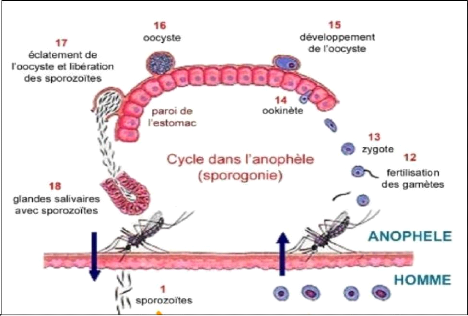
A1
A2
Source: http : //
ebischoff. free. fr / Palu2.
html
Cycle gonotrophique
B

R1 R2 R3 R4 R5 R6 R7
Nullipare
2j 2-3j
P1 P2 P3 P4 P5
4-5j

|
Phase de développement des parasites sans risque de
transmission
R1, R2&: repas de sang; P1, P2... : ponte; j: jour
|
Age épidémiologiquement dangereux
|
Figure 3: Développement de Plasmodium
falciparum chez l'anophèle (A1), chez l'homme
12. c oogq l mison
(A2) et espérance de vie infectante des anophèles
(B)

1.2.2. Indices entomologiques de la
transmission
En un lieu donné, plusieurs facteurs influencent la
transmission du paludisme du moustique à l'homme. L'estimation
quantitative de cette transmission se fait à travers un certain nombre
d'indices mathématiques calculés à partir des
données recueillies lors des enquêtes entomologiques.
- Densité agressive
Encore appelée taux d'agressivité, elle est le
produit de la densité anophélienne en relation avec l'Homme (m)
et du taux d'anthropophilie (a). Elle s'exprime en nombre de piqûres
d'anophèles par Homme par unité de temps. Elle s'obtient en
capturant les anophèles venant piquer l'homme et en divisant le nombre
d'anophèles capturés par le nombre de sujets utilisés, par
unité de temps.
- Taux de parturité
On obtient le taux de parturité d'une population
anophélienne en calculant le pourcentage de femelles pares (qui ont
pondu au moins une fois) par rapport au nombre total des femelles
examinées. Une population anophélienne sera d'autant plus
dangereuse épidémiologique ment que son taux de parturité
sera élevé. En effet, seuls les anophèles pares sont
susceptibles d'être infectantes.
TP = P x 100/ (P + NP)
TP = Taux de parturité
P = nombre de femelles pares
NP = nombre de femelles nullipares
- Taux quotidien de survie
Il permet d'estimer la longévité des vecteurs.
Pour qu'un anophèle atteigne un âge
épidémiologiquement dangereux, il faut que sa
longévité soit supérieure à la durée du
cycle sporogonique (cycle d'incubation extrinsèque) du
Plasmodium. Ce taux est fonction de la proportion de femelles pares et
de la durée du cycle gonotrophique (durée en jours
séparant deux repas de sang successifs). Pour une population en
équilibre,
P = XITP
x = durée du cycle gonotrophique (en jours)
TP = taux de parturité
P = taux quotidien de survie
- Taux d'infection des anophèles
Le taux d'infection (S) est la proportion de moustiques
infectés dans une population. Il s'exprime sous forme de pourcentage
(nombre de moustiques infectés sur nombre de moustiques examinés
fois cent)

- Taux d'inoculation entomologique (h)
C'est le nombre de piqûres infectantes que reçoit un
homme pendant une période donnée. C'est le produit du taux de
piqûre par l'indice circumsporozoïtique (ou sporozoïtique).
h = ma x s ma = agressivité
S = indice sporozoïtique
- Indice de stabilité
C'est un paramètre qui permet de caractériser la
pérennité de la transmission du paludisme dans une région
donnée. Selon Mouchet et al. (1993), cet indice permet de
distinguer :
* les zones à paludisme stable où la forte
transmission entraîne une prémunition qui n'empêche pas les
habitants d'être parasités, mais limite les manifestations
cliniques aux classes d'âge les plus jeunes ;
* les zones à paludisme instable où le
caractère épisodique de la transmission ne permet pas le
développement de la prémunition, la maladie sévissant sous
forme d'épidémie mortelle ;
* les zones intermédiaires entre ces deux situations.
Ist = a/-Logep
Si Ist< 0,5 Zone à paludisme instable
0,5 < Ist <2,5 Zone de paludisme à stabilité
moyenne
Ist > 2,5 Zone à paludisme stable
- Espérance de vie infectante
L'espérance de vie (E) et l'espérance de vie
infectante (Ei) sont calculées à partir du taux quotidien de
survie selon la formule de Mac Donald (1957).
Espérance de vie (E) E = 1/-Logep
Espérance de vie infectante (Ei) Ei =
pn/-Logep
C'est un paramètre qui permet de prévoir, dans
une population donnée, la proportion d'individus qui, après la
prise d'un repas de sang infectant, vivra suffisamment longtemps pour
transmettre le Plasmodium. Cet indice est le plus important
paramètre de la transmission du paludisme, car la diminution de la
valeur de ce paramètre est l'objectif visé par les campagnes de
lutte antivectorielle.
- Capacité vectorielle (CV)
Elle est définie comme le nombre de moustiques d'une
population donnée qui deviennent infectants à partir d'un sujet
infectant. C'est un paramètre qui permet d'évaluer la
transmission Homme/anophèle et d'estimer l'impact d'une action de
contrôle par exemple.

CV =
ma2pn/-Logep
ma = agressivité
P = taux quotidien de survie
n = durée du cycle sporogonique
1.3. Lutte antivectorielle
La lutte contre les vecteurs vise à rompre la
chaîne épidémiologique au niveau du vecteur, en
réduisant la densité de vecteurs, leur longévité,
l'intensité du contact Homme vecteur et/ou en réduisant la
compétence vectorielle d'une espèce vectrice. Elle peut
être dirigée contre les stades larvaires ou adultes. Les
principales méthodes de contrôle des vecteurs sont :
- l'enlèvement ou la destruction des petits
récipients tels que les boîtes de conserve, les bouteilles, les
pneus ou coques de noix de coco qui peuvent servir de gîtes larvaires.
C'est la méthode préconisée pour lutter contre les larves
d'Aedes (OMS, 1999) ;
- l'élimination des gîtes larvaires par le
drainage des eaux ou le remblayage des zones marécageuses ou des mares
stagnantes est recommandé pour la lutte contre les larves des
Anopheles, mais l'efficacité de cette technique est moindre car
il suffit d'une petite flaque d'eau ensoleillée pour que An. gambiae
qui est le vecteur majeur du paludisme en Afrique se développe ;
- l'utilisation des toxines bactériennes s'est
avérée efficace contre les larves de Cx. quinquefasciatus
en Afrique équatoriale (Hougard et al., 1993; Barbazan et
al., 1997) ;
- le focardage des mares, étangs, lacs contribue à
diminuer le nombre de Mansonia ;
- les aspersions intra-domiciliaires d'insecticides à
effet rémanent tuent les anophèles ainsi que d'autres moustiques
qui se reposent dans les habitations (endophiles) ;
- l'utilisation des répulsifs (baumes ou parfums qu'on
applique sur la peau ou sur les vêtements, serpentins anti-moustiques,
plaquettes insecticides à vaporisateur électrique) est efficace
contre les moustiques endophages et exophages ;
- les pulvérisations spatiales avec des diffuseurs
d'insecticides liquides dont les vapeurs sont toxiques pour les insectes
volants ; ces aérosols ont été utilisés dans les
grandes campagnes de luttes contre les Aedes lors des
épidémies de dengue et fièvre jaune ;
- la pose des grillages à mailles très fines au
niveau des portes, fenêtres, autres ouvertures des habitations pour
empêcher la pénétration des moustiques adultes endophages
tels que la majorité des anophèles vecteurs (OMS, 2003) ;

- l'utilisation des moustiquaires imprégnées
d'insecticides est la méthode de choix préconisée par
l'initiative «Roll Back Malaria» de l'OMS et recommandée par
le Programme National de Lutte contre le Paludisme au Cameroun.

Chapitre 2. Matériel et méthodes
2.1. Description de la zone d'étude
L'étude a été menée sur le campus
principal de l'Université de Yaoundé I (Fig. 4). Il est
situé en plein cSur de la ville de Yaoundé, au sommet de la
colline Ngoa-Ekelle au lieu dit plateau Atemengue, dans l'arrondissement de
Yaoundé III, dans le département du Mfoundi, avec pour
coordonnées géographiques 32 hémisphère Nord
à 777873 m du méridien central et à 426826 m de
l'équateur.
La superficie du campus occupée est d'environ 59 hectares,
y compris les terrains de sport (DIDP).
La couverture pédologique est formée de sols
ferrallitiques rajeunis avec érosion et remaniés, intimement
associés à des sols minéraux bruns et à des sols
peu évolués (Valerie, 1995).
La végétation est composée
essentiellement de graminées. Les formations herbacées
hydrophiles poussent dans les bas fonds marécageux. On note la
présence d'arbustes, d'arbres fruitiers, de plantes ornementales, et
d'espaces cultivables par endroits.
Le climat est équatorial de type guinéen avec en
moyenne 1500 à 1600 mm de pluie par an, réparties en quatre
saisons : une grande saison sèche de mi-novembre à mi-mars; une
petite saison des pluies de mi-mars à fin juin ; une petite saison
sèche de juillet à août et une grande saison des pluies de
septembre à mi-novembre. Les températures moyennes varient entre
18,9 et 27,9°C (Suchel et Tsalefack, 1995). L'hygrométrie moyenne
mensuelle est toujours supérieure à 70% (Omoko, 1984).
Le relief est accidenté avec une altitude moyenne de
750m, et un bas fond marécageux où se trouvent les étangs,
les bassins de piscicultures et où sont drainées les eaux de
ruissellement ainsi que les eaux usées provenant du campus (restaurant,
cité universitaire, laboratoires). On note par endroit des collections
d'eau stagnante, parfois très polluées et/ou riches en
matière organique; un manque de système de drainage des eaux et
un centre d'épuration des eaux usées non fonctionnel. Un ruisseau
permanent traverse le campus.

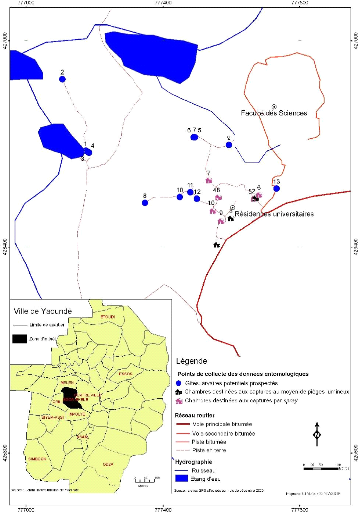
Figure 4 : Zone d'étude et localisation
des points de collecte des donn

2.2. Points de capture
L'étude s'est déroulée de mars 2005
à février 2006. Le choix des gîtes larvaires a
été fait après la première descente sur le terrain,
au cours de laquelle différents types de gîtes potentiels ont
été prospectés ; tous ceux qui ont été
positifs (présence de la larve de moustique) ont été
retenus. Ainsi, un suivi a été fait dans 13 gîtes tous les
trois mois. La capture des moustiques adultes a été faite dans 10
chambres de la Cité Universitaire, dont 4 destinées à la
capture au moyen des pièges lumineux et 6 pour la capture par
pulvérisation intra-domiciliaire d'insecticide. Toutes ces chambres ont
été choisies au hasard au rez-dechaussée dans 6
bâtiments de la Cité Universitaire avec le consentement des
occupants.
2.3. Mesure des paramètres climatologiques
(température, hygrométrie et pluviométrie) -
La température et l'hygrométrie : les
relevés hebdomadaires ont été effectués grâce
à un thermo-hygromètre enregistreur qui indique la
température et l'humidité ambiante et enregistre leurs valeurs
maximales et minimales, l'appareil est resté sur le site en permanence
pendant toute la durée de l'étude.
- La pluviométrie : les hauteurs des
précipitations ont été relevées grâce
à un pluviomètre à lecture directe gradué en
millimètres. Les relevés ont été faits
journalièrement.
2.4. Collecte des données
entomologiques
L'échantillonnage des moustiques a été fait
aux stades pré-imaginaux et adulte.
2.4.1. Récolte des stades
pré-imaginaux
Les larves et/ou les nymphes ont été
collectées à quatre reprises pendant les mois de mars, juin,
septembre et décembre dans treize gîtes numérotés.
La position de chaque gîte a été relevée dans la
projection UTM et le système géodésique WGS84, grâce
à un appareil GPS portatif.
La méthode de collecte utilisée est celle du
«dipping» ou trempage (Service, 1993). Elle consiste à
prélever l'eau du gîte à l'aide d'une louche ou d'un petit
bac, puis y observer la présence des larves de moustiques. Elles sont
alors prélevées à l'aide d'une pipette et
transférées dans un récipient portant le numéro du
gîte et contenant l'eau du gîte. Ensuite, les larves sont
transportées à l'insectarium de l'OCEAC et mises en
élevage avant identification.

2.4.2. Capture des moustiques adultes
Deux méthodes de capture ont été
utilisées: la capture au moyen de pièges lumineux du type CDC
avec un volontaire dormant sous moustiquaire non imprégnée et la
capture par pulvérisation intra domiciliaire d'insecticide commercial au
pyrèthre.
2.4.2.1. La capture au moyen de pièges lumineux
type CDC
La capture a été effectuée de mars
à décembre 2005 dans quatre chambres de la cité
universitaire, à raison d'une nuit de collecte par mois. Le piège
lumineux CDC pourvu d'une lampe à incandescence et d'un moteur est
installé à environ 1,5 m du sol, auprès d'un lit couvert
d'une moustiquaire non imprégnée d'insecticide (Fig. 5). Le
volontaire dort sous la moustiquaire, à l'endroit habituel de son lieu
de repos. Les moustiques qui entrent dans la chambre pour le piquer sont
attirés par la lumière du piège (les autres
lumières de la chambre étant éteintes) ; le moteur, en
faisant tourner une petite hélice, aspirera les insectes attirés
pour les refouler dans une cage en tulle. Ils seront collectés le
lendemain et transportés au laboratoire pour identification.
2.4.2.2. La capture par pulvérisation
intra-domiciliaire d'insecticide
La capture a été effectuée dans six
autres chambres de la cité universitaire, à raison d'une
matinée par mois pendant la même période. Pour ce faire,
toutes les ouvertures sont fermées pour éviter que les moustiques
ne s'échappent, puis des draps blancs sont étalés au sol.
Après pulvérisation des bombes insecticides du commerce
(Wanfu®), on laisse s'écouler environ dix minutes ;
puis, à l'aide des pinces fines, les moustiques tombés sur les
draps sont prélevés et mis dans les boîtes de pétri
(référencées) (Fig. 6) et transportés au
laboratoire pour identification. Cette méthode nous permet de
récupérer tous les moustiques dans une pièce bien
fermée et d'évaluer la composition de la faune endophile.


Figure 5 : Piège lumineux type CDC
Figure 6 : Récolte des moustiques après
pulvérisation intra-domiciliaire d'insecticide
|
Aiguille
Moustique Minutie
Paillette
|
Figure 7 : Moustique monté sur minutie

2.5. Elevage et montage des moustiques
Les larves récoltées ont été
séparées en sous familles (Culicinae, Anophelinae). Les
larves de Culex tigripes ont rapidement été
isolées des autres Culicinae à cause de leur action
prédatrice. Ensuite, ces larves ont été mises dans des
bacs couverts de tulle moustiquaire, contenant l'eau de source et portant
chacun une étiquette. Sur chaque étiquette, nous avons
indiqué la sous famille et le numéro du gîte. Nous passions
tous les matins les nourrir avec de la farine pour alevins (Tétra
Min® Baby), et trier les nymphes qui étaient
transférées dans des boîtes en verre puis placés
dans une cage couverte de tulle moustiquaire, en vue de l'émergence des
adultes. Ceux-ci étaient nourris avec une solution de sucre à
10%.
A l'émergence, les moustiques adultes sont tués
et montés sur minutie pour identification morphologique. Sur un
moustique couché dorso-ventralement, on insère une minutie
montée sur paillette au centre du thorax entre les deux pattes
médianes. Puis, cette paillette est épinglée par une
grosse aiguille sur laquelle on insère d'autres paillettes. Sur ces
paillettes, on inscrit les informations se rapportant au moustique. Le
moustique ainsi monté est identifié,
référencé (Fig. 7), et conservé dans une
boîte de collection.
2.6. Identification des spécimens
Nous avons utilisé les techniques morphologiques
classiques et les tests moléculaires pour les anophèles.
2.6.1. Identification morphologique
Les adultes issus de l'élevage et des captures ont
été examinés sous la loupe binoculaire et
identifiés à l'aide des clés d'identification
morphologiques établies par Gillies et De Meillon (1968) et Gillies et
Coetzee (1987) pour les anophèles, Edwards (1941), Jupp (1996) et par
référence aux collections de l'OCEAC pour les Culicinae.
Le tableau 1 présente les caractères morphologiques distinctifs
de quelques moustiques adultes. Chaque anophèle identifié est
placé individuellement dans un tube eppendorf de 1,5 ml contenant du
silicagel (dessiccateur), puis il lui est attribué un numéro. Les
anophèles ainsi collectés sont conservés à -
20°C. Ils seront utilisés pour les techniques de biologie
moléculaire et de biochimie au laboratoire.

Tableau 1 : Caractères morphologiques
distinctifs des espèces identifiées (Gillies et De Meillon, 1968;
Gillies et Coetzee, 1987; Jupp, 1996)
|
Espèces
|
Caractères distinctifs
|
|
An. gambiae s.l
|
Palpe à trois bandes pâles; cinq taches pâles
au niveau de la costa, dont deux basales; base de la première nervure
pâle; pattes tachetées.
|
|
Ae. albopictus
|
Scutum avec une large ligne médiane argentée qui
part de la marge antérieure jusqu'à la zone
préscutellaire; scutum sans tache pâle à l'angle.
|
|
Cx. quinquefasciatus
|
Apex du proboscis souvent pâle; sternites blancs non
bandés; tergites à bande basale pâle.
|
|
Cx. duttoni
|
Trompe avec un anneau pâle bien défini au milieu;
soie mésépimérale inférieure présente ;
tarses à anneaux pâles, tibia moyen avec une bande pâle
antérieure.
|
|
Cx. tigripes
|
Moustique de grande taille; fémurs et tibias,
excepté le fémur postérieur, portent en avant une
rangée d'environ 10 petites taches pâles sur fond sombre.
|
|
Cx. chorleyi
|
Proboscis entièrement sombre; tergite avec une mince bande
basale pâle incomplète sur certains segments.
|
|
Cx. decens
|
Ecailles scutales uniformément brun rougeâtre, palpe
entièrement sombre chez le mâle ; tergite avec une large bande
basale.
|
|
Cx. guiarti
|
Tergite sans bande basale ; abdomen avec taches pâles
baso-latérales ; flagellum 3 et 4 plus courts que les autres.
|
|
Cx. univittatus
|
Fémur moyen avec une ligne pâle longitudinale ;
fémur moyen avec une dorsale noire s'étendant jusqu' à
l'extrémité basale du fémur; tergite avec une large bande
basale confluente et une tache baso-latérale.
|
|
Cx. poicilipes
|
Trompe avec un anneau pâle bien défini au milieu;
pas de soie mésépimérale inférieure ; fémurs
et tibias avec des rangées de petites taches antérieures ; tarses
à anneaux pâles aux articulations.
|
|
Ma. africana
|
Ecailles pâles du thorax formant des taches ; face
antérieure des tibias portant des taches blanches bien
séparées les unes des autres.
|
|
Ma. uniformis
|
Ecailles pâles du thorax formant deux bandes
longitudinales; taches pâles des faces antérieures des tibias plus
ou moins confluentes.
|

2.6.2. Identification moléculaire des
anophèles du complexe An. gambiae
Les espèces et les formes moléculaires ont
été identifiées par la technique de PCR-RFLP
(Restriction Fragment Length Polymorphism); celle-ci permet de
déterminer simultanément les espèces du complexe An.
gambiae ainsi que les formes moléculaires M et S lorsqu'il s'agit
d~An. gambiae s.s. sur la base d'un polymorphisme de séquence
observé sur l'ADN
ribosomal (Fanello et al., 2002). Cette
méthode résulte de la combinaison des protocoles établis
par Scott et al. (1993) et Favia et al. (1997). Cette
technique d'identification par la biologie moléculaire comporte
plusieurs étapes: la préparation du matériel biologique,
l'amplification de l'ADN par PCR, la digestion enzymatique,
l'électrophorèse et la révélation des bandes.
2.6.2.1. Préparation du matériel
biologique
Le moustique est sorti de son tube de conservation et
déposé sur une feuille de papier. Les pattes (2 pattes) sont
coupées à l'aide des pinces fines et introduites dans un
microtube portant le numéro du moustique. Le reste du moustique est
remis dans le tube de conservation pour d'autres fins (ELISA CSP si le
moustique a été capturé au stade adulte par exemple). Les
pinces sont ensuite nettoyées avec du papier essuie tout, puis la
dissection du moustique suivant nécessite une nouvelle feuille de papier
pour éviter une éventuelle contamination. En effet, un tout petit
fragment de patte peut donner l'ADN suffisant pour être à
l'origine d'une contamination.
Les ailes ou un petit fragment de l'abdomen peuvent
également être utilisés comme matériel de
départ.
2.6.2.2. Protocole d'amplification par PCR (Scott et al.,
1993)
Principe (Fig. 8)
La polymérisation en chaîne est basée sur
le principe de la réplication de l'ADN double brin lors de la mitose
(Clavel, 1993). Cette réaction se fait sur plusieurs cycles comprenant
chacun 3 étapes:
- la dénaturation, phase au cours de
laquelle l'ADN double brin est dénaturé en simple brin par
l'augmentation de la température entre 90°C et 97°C (De
Bruijn, 1988 ; Innis et Gelfand, 1990). En fonction de la longueur et de la
composition en bases de la séquence d'ADN cible, cette phase de
dénaturation dure de 15 à 30 secondes. En général,
la dénaturation de tout le génome dure 5 minutes à une
température de 94°C;

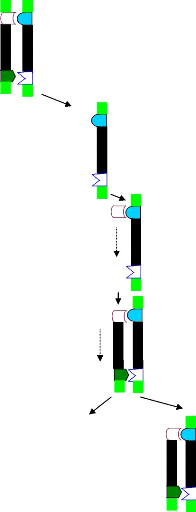
ADN génomique
Séquence d,ADN à amplifier
3,
5,
3,
5,
5,
3,
5,
3,
5,
3,
5,
3,
5,
Dénaturation ou
séparation des brins d,ADN
Hybridation
des amorces
3,
ADN néoformé

Polymérisation ou
extension des amorces
par l,ADN
polymérase
Dénaturation Hybridation puis polymérisation
|
Séquences d,ADN complémentaires
Amorces
|
5,
|
|
Sens de l,extension
|
|
|
3,
|
Figure 8 : Schéma du principe de la PCR
(Polymerase Chain Reaction)
A chaque cycle 2n brins d,ADN
néoformés sont produits (n = nombre de cycles)

- l'hybridation, phase de refroidissement au
cours de laquelle les amorces s'apparient (ou s'hybrident) à leur
séquence complémentaire sur l'ADN cible. La température
d'hybridation varie entre 50°C et 72°C. Elle dépend de la
séquence et du nombre de nucléotides des amorces;
- l'élongation, au cours de laquelle
chaque amorce fixée sur l'un des brins va s'étendre à
partir de son côté 3' par juxtaposition de nucléotides
(dNTPs) par l'ADN polymérase. L'élongation des amorces se fait en
sens opposé en intercalant la séquence à amplifier. Elle
dure de 30 secondes à 2 minutes et se déroule à une
température de 72°C.
Ces 3 étapes sont en général
répétées 20 à 35 fois (Saïki et al.,
1985; Tosi et Acuto, 1992) selon les quantités d'ADN de
départ.
Le milieu réactionnel a été
préparé comme l'indique le tableau 1. Cette solution a
été distribuée dans des microtubes à paroi fine de
0,2ml (25ul par microtube), contenant au préalable deux pattes de
moustiques. Les microtubes sont ensuite fermés et placés dans le
thermocycleur pour l'amplification de l'ADN. La figure 9 représente les
cycles des températures de cette amplification.
2.6.2.3. Protocole de la digestion enzymatique (Favia et
al., 1997)
Le milieu réactionnel est préparé comme
l'indique le tableau 2. Cette solution a été distribuée
dans des microtubes à paroi fine de 0,2ml (15ul par micro tube). Dans
chaque micro tube, nous avons ajouté 10ul de solution d'ADN
amplifié. Les microtubes sont fermés et placés dans
l'étuve (37°C) pendant 3 heures au minimum ou toute la nuit. Les
fragments d'ADN amplifiés sont digérés avec une enzyme de
restriction (Favia et al., 1997); cette enzyme (Hhal : Haemophilus
haemoliticus) coupe le fragment au niveau des sites de restriction de la
manière suivante.
5'&&&&&&.GCGC.&&&3'
3'&&&&&.
CGCG&&&.5'
Ainsi, la digestion de deux ADN différents pour un
locus donné produit des fragments de longueurs différents dont la
migration sur un gel d'agarose à 2% permet de déterminer les
formes moléculaires M et S chez An. gambiae s.s.


35 cycles
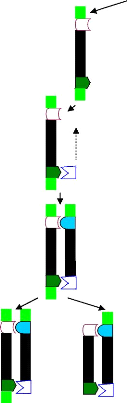
72°
72°
5'
56°
20''
94° 94°
3' 30''

30''

Dénaturation Hybridation Elongation
Figure 9 : Cycle des températures d'une
PCR pour l'identification des espèces et des formes moléculaires
d'Anopheles gambiae s.s (Fanello et al., 2002)
Tableau 2 : Composition du milieu
réactionnel d'une PCR pour l'identification des espèces du
complexe An. gambiae (Scott et al., 1993)
|
Réactif
|
Concentration initiale
|
Concentration finale
|
Volume (ul) par tube
|
|
ddH2O
|
|
|
19,45
|
|
Tampon (+MgCl2)
|
10X
|
1X
|
2,50
|
|
dNTPs
|
5mM
|
0,2mM
|
1,00
|
|
UN*
|
10uM
|
5pmoles
|
0,50
|
|
AR*
|
10uM
|
5pmoles
|
0,50
|
|
GA*
|
10uM
|
5pmoles
|
0,50
|
|
ML*
|
10uM
|
5pmoles
|
0,50
|
|
Taq DNA polymérase ADN
|
5UI/ul pattes
|
0,25UI
|
0,05
|
|
Total
|
|
|
25,00
|
dNTPs : Dinucléotide triphosphates ; UN : Amorce
universelle ; AR : Amorce arabiensis ; GA : Amorce gambiae ;
ML: Amorce melas ; * : Séquence et taille des bandes
présentées en annexe 2 ; ddH2O : Eau bi-distillée ; UI :
Unité internationale ; X : concentration de la solution tampon.

Tableau 3 : Composition du milieu
réactionnel pour la digestion enzymatique de l'ADN d'An. gambiae
s.s (Favia et al., 1997).
|
Réactif
|
Concentration initiale
|
Concentration finale
|
Volume (ul) par tube
|
|
ddH2O
|
|
|
12,00
|
|
Tampon
|
10X
|
1X
|
2,50
|
|
BSA
|
10mg/ml
|
0,1mg/ml
|
0,25
|
|
Enzyme
|
10UI/ul
|
0,1UI/ul
|
0,25
|
|
ADN
|
ADN amplifié
|
|
10,00
|
|
Total
|
|
|
25,00
|
X : Concentration de la solution tampon; BSA: Bovine serum
albumin; ddH2O : Eau bidistillée ; UI : Unité internationale.
Témoins
+
Sens de migration
M M M M M M M M M MM M MT N A M
S
-
Puits de dépôt
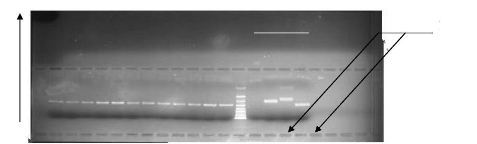
Figure 10: Photographie d'un gel montrant
l'identification de An. gambiae s.s de forme moléculaire M.
MT : marqueur de taille (100 pb) ; M : forme moléculaire M
(367 pb) ; S : forme moléculaire
M S
S (257 pb) ; A : An. arabiensis (292 pb) ; N :
négatif ; pb : paire de base.

2.6.2.4. Technique d'électrophorèse
2.6.2.4.1. Principe
La technique d'électrophorèse consiste à
faire migrer, dans un gel d'agarose, l'ADN amplifié ou
digéré, sous l'influence d'un champ électrique. Cette
migration est fonction de la taille du fragment d'ADN. Les molécules
d'ADN chargées négativement vont migrer de l'anode (-) vers la
cathode (+), les molécules de haut poids moléculaires se
déplaçant moins vite que les molécules de plus faible
poids moléculaires
2.6.2.4.2. Préparation du gel
Deux types de gel d'agarose ont été utilisés
au cours de ce travail:
- un gel à 1,5% pour identifier les espèces du
complexe An. gambiae;
- un gel à 2% pour déterminer les formes
moléculaires M et S d'An. gambiae s.s.
Pour préparer le gel d'agarose à 1,5% (ou 2%),
nous avons mesuré à l'aide d'une éprouvette graduée
100ml de tampon TBE 1X (Tris-borate-EDTA). Dans un erlenmeyer en verre,
l'agarose (1,5 ou 2g) et le tampon ont été
mélangés, puis portés à ébullition sur un
agitateur magnétique chauffant (250°C) pendant 2 à 4
minutes, jusqu'à l'obtention d'une solution translucide ; celle-ci a
été soumise à un refroidissement progressif par trempage
dans un bac d'eau froide. A l'état tiède, nous y avons
ajouté 5ul de BET (Bromure d'éthidium). Après agitation,
le gel a été coulé dans une cuve sur laquelle ont
été suspendus deux peignes. Laissé à la
température ambiante pendant une heure environ pour
polymérisation, le gel est ensuite débarrassé des peignes.
On peut y observer des puits où seront déposées les
solutions d'ADN amplifié ou digéré. Le gel est
immergé dans une cuve de migration contenant du TBE 1X.
2.6.2.4.3. Distribution des échantillons et
migration électrophorétique
Sur un morceau de parafilm, ont été
déposées des gouttelettes de 2ul de bleu de charge (bleu de
bromophénol 0,25% + bleu de xylène cyanol 0,25% + sucrose 4% +
eau distillée) qui permet de maintenir l'ADN au fond du puit et de
contrôler le front de migration. Ensuite, 10ul de chaque
échantillon d'ADN amplifié ou digéré ont
été prélevés et mélangés au bleu de
charge puis déposés au fond du puit. L'embout de la pipette
servant à la distribution des échantillons à analyser a
été changé après chaque dépot. Puis, ont
été déposés sur chaque rangée de puits: un
témoin négatif où l'ADN est remplacé par de l'eau
stérile; 3ul de marqueur de taille connu (Superladder-Low); 3
échantillons témoins d'espèces: An. gambiae

s.s., An. arabiensis et An. melas lorsqu'il
s'agissait de l'identification des espèces; ou des échantillons
témoins des formes M et S lorsqu'il s'agissait de la
détermination des formes moléculaires d'An. gambiae
s.s.
Enfin, notre cuve est fermée et reliée à un
générateur de courant continu (140 volts-500mA); la migration
dure 45 minutes.
2.6.2.4.4. Photographie et interprétation du gel
A la fin de la migration électrophorétique, les
bandes correspondant aux fragments d'ADN de tailles différentes sont
visualisées aux rayons ultraviolets grâce à la fluorescence
des molécules de BET fixées sur les fragments d'ADN. Les
différentes bandes obtenues sont comparées à celle du
marqueur de taille et des différents témoins. Ceci permet de
déterminer la taille des différents fragments d'ADN
amplifiés ou digérés. La figure 10 représente la
photographie d'un gel montrant l'identification de l'espèce An.
gambiae s.s de forme moléculaire M.
2.7. Détermination de l'infestation des
anophèles
L'infestation des anophèles femelles par Plasmodium
a été mise en évidence par la technique ELISA
(Enzyme Linked ImmunoSorbent Assay) qui permet de détecter la
protéine CircumSporozoïte de Plasmodium (CSP) dans les
glandes salivaires des anophèles. Cette technique a été
mise au point par Burkot et al. (1984) puis améliorée
par Wirtz et al. (1987).
2.7.1. Principe
Il consiste à coupler la protéine CSP à
un anticorps monoclonal de capture (ACm) anti-CSP préalablement
fixé sur la paroi d'une plaque MAXISORP. Le complexe antigène
anticorps formé est ensuite révélé par un ACm
anti-CSP couplé à la peroxydase. L'adjonction d'un substrat qui
sera dégradé sous l'action de l'enzyme produit une coloration
visible et mesurable par densité optique.
2.7.2. Protocole ELISA CSP
monospécifique
La tête et le thorax de chaque moustique sont
coupés et placés dans des tubes portant le numéro du
moustique. Puis, on y ajoute 20ul de Np-40 (Nonidetp-40) pour faciliter
l'extraction des protéines circumsporozoïtiques et le tampon de
broyage à raison de 380ul de tampon par tubes. Ces broyats sont ensuite
conservés au congélateur à -20°C. Chaque plaque ELISA
est sensibilisée à raison de 50ul d'ACm de capture par puit et
laissé incuber pendant

une nuit à +4°C; cette incubation permet
l'adsorption de l'ACm sur les parois de la plaque. Le lendemain, les plaques
sont vidées de leur contenu, puis 200ul de tampon BB (Blocking
Buffer) sont mis dans chaque puit pour saturer les sites de fixation des
ACm. Après une heure d'incubation à température ambiante,
les plaques sont de nouveau vidées de leur contenu, puis 50ul de broyat
de moustique sont ajoutés dans chaque puit. Le témoin
négatif est constitué du tampon BB seul; quant aux puits des
témoins positifs, 50ul de protéine circumsprozoïtique de
l'espèce plasmodiale testée sont utilisés.
Après deux heures d'incubation les plaques sont
vidées et lavées 2 fois au PBS/tween 20. Ensuite, une solution
d'ACm conjugué à la peroxydase préparée 10 minutes
avant la fin de l'incubation est ajoutée à raison de 50ul par
puit. Après une heure d'incubation à température ambiante,
les plaques sont de nouveau vidées et lavées 4 fois au PBS/Tween
20. Le substrat composé d'un mélange (ortho-tolidine,
N,N-diméthyl formamide, tampon citrate, eau oxygénée)
préparé 5 minutes avant la fin de l'incubation est ensuite
distribué (100ul par puit). Les plaques sont ensuite conservées
30 minutes à l'obscurité. La dégradation du substrat sous
l'action de la peroxydase se traduit par une coloration bleue. Cette
réaction est stoppée en ajoutant 50ul d'acide sulfurique 4N par
puit, ce qui donne une coloration jaune. La lecture s'effectue au moyen d'un
spectrophotomètre à 450 et 650 nm. L'intensité seuil des
positifs est fixée à 3 fois la moyenne des témoins
négatifs. La composition des réactifs et les quantités
utilisées sont présentées en annexe 3.
2.7.3. Indice entomologique de la
transmission
Au cours de ce travail, aucun moustique n'a été
positif au test ELISA, par conséquent les autres indices n'ont pas pu
être calculés.
2.8. Analyse statistique
Le degré de liaison entre la densité
culicidienne (Cx. quinquefasciatus) et la pluviométrie a
été évalué par le test du coefficient de
corrélation linéaire. Elle permet d'établir les
interrelations probables entre les différentes variables. Deux
séries de variables sont plus ou moins fortement liées selon que
r est plus ou moins proche de 1, avec 0 < r < 1. Le signe plus signifie
que la relation entre variables est proportionnelle (corrélation
positive). Le signe moins signifie que la relation entre variables est
inversement proportionnelle (corrélation négative). Par
convention, si r = 1, on parlera de corrélation parfaite; et si r = 0,
on parlera de corrélation nulle.

Chapitre 3: Résultats et discussion
3.1. Résultats
3.1.1. Données climatologiques
Les données pluviométriques relevées en
continu sur le terrain ont montré que la distribution annuelle des
pluies a été bimodale, présentant 2 pics de pluies en
avril et octobre (Fig. 11). De mars 2005 à février 2006, la
pluviométrie totale a été de 1164,1 mm répartie sur
123 jours. Le mois le moins pluvieux a été juillet avec 26,6 mm
de pluies et le plus pluvieux octobre avec 307,1 mm.
La température a très peu varié et a
oscillé autour de la moyenne de 27,8°C. Les
températures les plus élevées ont été
observées en mars (38,5°C), avril (38,2°C), mai (39,2°C)
et les plus basses en juillet (21,3°C) et août (21,2°C).
L'amplitude thermique a été plus faible de novembre 2005 à
février 2006 (< 10°C) que pendant les huit autres
mois de l'étude où elle atteint 17°C en mai 2005.
Le taux d'hygrométrie est resté constamment
supérieur à 60%, atteignant un maximum de 90% en septembre.
Globalement, les variations du taux d'hygrométrie sont plus importantes
pendant les mois les plus pluvieux.

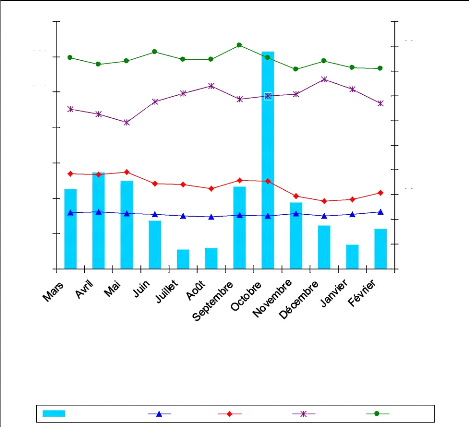
Hauteur des precipitations (mm)
250
200
350
300
150
100
50
0
Précipitations T° min T° max Rh min Rh max
2005 - 2006
40
20
90
80
70
60
50
30
0
100
10
Temperature (°C);
Hygrometrie (%)
Figure 11 : Distribution mensuelle des
précipitations et variation de la température extérieure
et du taux d'hygrométrie sur le campus de l'Université de
Yaoundé I de mars 2005 à février 2006

3.1.2. Données entomologiques
3.1.2.1. Inventaire de la faune culicidienne
Au cours de notre étude, douze espèces
culicidiennes réparties dans quatre genres ont été
récoltées. Le genre Culex à huit espèces:
Cx. (Culex) quinquefasciatus Say 1823, Cx. (Culex)
duttoni Theobald 1901, Cx. (Culex) univittatus Theobald 1901,
Cx. (Culex) guiarti Blanchard 1905, Cx. (Culex) chorleyi Edwards
1941, Cx. (Culex) poicilipes Theobald 1903, Cx. (Culex) decens
Theobald 1901 et Cx. (Lutzia) tigripes Degrandpré &
Decharmoy 1900; le genre Mansonia à deux espèces:
Ma. (Mansonioides) africana Theobald 1901 et Ma. (Mansonioides)
uniformis Theobald 1901; le genre Aedes à une
espèce: Aedes (Stegomyia) albopictus (Skuse) 1894; le genre
Anopheles à une espèce : Anopheles (Cellia) gambiae
s.l. Giles 1902.
La richesse spécifique culicidienne a varié avec
le stade de récolte ; c'est ainsi que dix espèces ont
été identifiées à partir des larves
récoltées dans différents gîtes et mises en
élevage et sept espèces à partir de la capture des
moustiques adultes (tableau 4). Les espèces Cx. univittatus, Cx.
guiarti, Cx. chorleyi, Cx. poicilipes, et Cx. decens ont
été obtenues uniquement à partir des collectes larvaires.
Les espèces Ma. africana, Ma. uniformis ont été
obtenues seulement au stade adulte dans les chambres de la cité
universitaire. Les cinq autres espèces Cx. quinquefasciatus, Cx.
univittatus, Cx. duttoni, Ae. albopictus, An. gambiae ont
été collectées aux stades larvaires et adulte.

Tableau 4 : Effectif et composition de la faune
culicidienne échantillonnée sur le campus de l'Université
Yaoundé I de mars à décembre 2005
|
Espèces
|
Méthodes de capture
|
|
|
Collectes
larvaires *
|
Moustiques adultes
|
|
|
Pièges lumineux
|
Spray
|
Total (%)
|
|
Cx.quinquefasciatus
|
596
|
371
|
804
|
1175 (96,9)
|
|
Cx. univittatus
|
31
|
1
|
8
|
9 (0,7)
|
|
Cx. duttoni
|
216
|
5
|
2
|
7 (0,6)
|
|
Cx. poicilipes
|
52
|
0
|
0
|
0
|
|
Cx. guiarti
|
63
|
0
|
0
|
0
|
|
Cx. tigripes
|
60
|
0
|
0
|
0
|
|
Cx. decens
|
208
|
0
|
0
|
0
|
|
Cx. chorleyi
|
154
|
0
|
0
|
0
|
|
Ma. africana
|
0
|
1
|
1
|
2 (0,2)
|
|
Ma. uniformis
|
0
|
1
|
2
|
3 (0,2)
|
|
Ae. albopictus
|
368
|
1
|
10
|
11 (0,9)
|
|
An. gambiae
|
464
|
1
|
5
|
6 (0,5)
|
|
Total
|
2215
|
381
|
832
|
1213 (100)
|
*: Les nombres dans cette colonne
représentent les effectifs de moustiques identifiés au stade
adulte, après émergence à l'insectarium.

3.1.2.2. Faune culicidienne récoltée au
stade larvaire
Au cours de nos prospections larvaires, 13 gîtes ont
été identifiés et caractérisés (tableau 5).
Le relevé précis des coordonnées GPS (Geographical
Positionning System) de chaque gîte nous a permis de
répéter notre échantillonnage exactement au même
endroit à chacune de nos quatre visites en mars, juin, septembre et
décembre 2005. Au total, 2217 moustiques ont été
identifiés après émergence (tableau 4) parmi lesquels 235
ont été montés sur minutie et conservés dans une
boîte de collection au laboratoire.
Pendant les quatre périodes de récolte, la
richesse spécifique culicidienne a varié d'un gîte à
un autre. Cependant, certaines espèces ont été
présentes dans la majorité des gîtes prospectés:
Cx. quinquefasciatus (12 gîtes), Cx. tigripes (8
gîtes), An. gambiae (7 gîtes), Cx. duttoni (6
gîtes). L'espèce Ae. albopictus a été
retrouvée dans deux types de gîtes (creux d'arbre et vieux pneu;
gîtes n 3, 5 et 7 dans le tableau 5). Tous les gîtes où
An. gambiae s.l a été récoltée
étaient des collections d'eau plus ou moins claires et
ensoleillées (gîte n° 1, 2, 4, 8, 10, 11 et 12 dans le
tableau 5). Cx. quinquefasciatus était présent dans tous
les gîtes à l'exception du gîte n° 8 qui est une flaque
d'eau bien claire et ensoleillée (tableau 5).
Nous avons également noté une variation de la
richesse spécifique et de la positivité de certains gîtes
en fonction de la date de récolte. Ainsi, 3 gîtes; 5 gîtes
et 4 gîtes ont été négatifs (absence de larve)
respectivement aux mois de juin, septembre, décembre sur les 13 retenus
pour l'échantillonnage des stades pré-imaginaux (tableau 5).
L'absence des larves de moustiques dans certains gîtes larvaires
prospectés au cours de la période de récolte était
liée à l'absence d'eau dans les gîtes (c'est le cas du
gîte 10 et 11 aux mois de septembre et décembre), de sa mise en
place récente (c'est le cas du gîte 8 au mois de juin), à
l'aménagement du milieu qui aboutit à la disparition du
gîte (cas du gîte 3 au mois de juin, septembre, décembre) ou
à la non stagnation des eaux rendant impossible le développement
des larves (c'est le cas du gîte 9 aux mois de juin, septembre et
décembre).

|
* Une photographie de chacun de ses gîtes est
donnée en annexe 1.
|
|
Tableau 5: Caractérisation et
localisation des différents gîtes larvaires potentiels
prospectés et distribution des espèces présentes de mars
à décembre 2005
Gîte N° Caractéristiques* Position GPS**
Mois de récolte
Longitude (m) Latitude (m) Altitude (m) Mars Juin Septembre
Décembre
1 Bordure d'étang contenant de l'eau 777174 426808 718
Cx. quinquefasciatus Cx. quinquefasciatus Cx. duttoni Cx.
poicilipes
claire, ensoleillée, avec une Cx. decens Cx. duttoni
Cx. guiarti
végétation dressée par endroit.
Cx. univittatus An. gambiae
2 Bassin de pisciculture à eau claire, 777106 426888 721
Cx. tigripes Cx. quinquefasciatus Cx. quinquefasciatus An. gambiae
ensoleillée, avec une végétation Cx.
univittatus Cx. duttoni Cx. tigripes
dressée par endroit An. gambiae Cx. decens Cx.
decens
An. gambiae An. gambiae
3 Vieux pneu contenant une eau 777180 426677 720 Cx.
quinquefasciatus Absence de larve Absence de larve Absence de larve
claire et ensoleillée. Ae. albopictus
|
4 Bac de stockage piscicole ensoleillé
contenant une eau légèrement
chargée de
débris organiques.
|
777184 426674 719 Cx. duttoni
An. gambiae
|
Cx. quinquefasciatus Cx. decens
An. gambiae
|
Cx. quinquefasciatus Cx. univittatus
Cx. poicilipes
An. gambiae
|
Cx. quinquefasciatus Cx. duttoni
Cx. tigripes
Cx. poicilipes
An. gambiae
|
5 Creux d'arbre à terre contenant une 777494 426719 756
Cx. duttoni Cx. chorleyi Cx. decens Cx. decens
eau chargée de débris organiques à Cx.
tigripes Ae. albopictus Cx. quinquefasciatus Cx. tigripes
l'ombrage. Ae. albopictus
6 Creux d'arbre à terre contenant une 777490 426719 749
Cx. duttoni Cx tigripes Absence de larve Absence de larve
eau chargée de débris organiques à Cx.
tigripes Cx. decens
l'ombrage. Cx. poicilipes Cx.
quinquefasciatus
|
7 Creux d'arbre à 2m du sol
contenant une eau chargée de débris organiques
à l'ombrage.
|
777492 426720 746 Cx. quinquefasciatus
Cx. guiarti
Ae. albopicus
|
Cx. quinquefasciatus Cx. decens
Cx. tigripes
Ae. albopictus
|
Cx. quinquefasciatus Cx. quinquefasciatus
Cx. guiarti
Ae. albopictus
|
8 Flaque d'eau claire bien ensoleillée 777347 426528
732 An. gambiae Absence de larve An. gambiae An. gambiae
|
9 Eau d'égout déversée dans le
champ à l'ombrage.
|
777593 426697 743 Cx. quinquefasciatus
Cx. guiarti
Cx. unvittatus
|
Absence de larve Absence de larve Absence de larve
|
|
10 Bac à laver les mains contenant une
eau à coloration verdâtre.
|
777449 426545 754 An. gambiae Cx. quinquefasciatus
Absence de larve Absence de larve
|
11 Bac à fleur mal entretenu contenant 777480 426559 768
Cx. quinquefasciatus Cx. quinquefasciatus Absence de larve Cx.
quinquefasciatus
une eau riche en débris organiques An. gambiae Cx.
tigripes Cx. decens
et ensoleillée. Cx. decens An. gambiae
An. gambiae
|
12 Bac à fleur mal entretenu contenant
une eau riche en débris organiques et
ensoleillée.
|
777499 426540 749 An. gambiae Cx. quinquefasciatus
Cx. tigripes
An. gambiae
|
An. gambiae Cx. quinquefasciatus
Cx. tigripes
Cx. decens
Cx. poicilipes
An. gambiae
|
13 Fosse contenant les eaux usées 777732 426570 761
Cx. quinquefasciatus Cx. quinquefasciatus Cx. quinquefasciatus Cx.
quinquefasciatus
provenant du restaurant Cx. poicilipes Cx. tigripes Cx.
duttoni Cx. tigripes
universitaire Cx. tigripes, Cx. decens
C d
** Les données GPS sont géocodées dans la
projection UTM (Universal Transverse Mercator) et le système
géodésique WGS 84. Tous nos gîtes sont situés dans l
l'altitude se donnent en mètre.
3.1.2.3. Faune culicidienne récoltée au
stade adulte
Au cours de nos dix mois de récolte, 1213 Culicidae
adultes ont été récoltés composés
à 96,9% de Cx. quinquefasciatus (tableau 4). Les 3,1 % restant
se répartissent entre les espèces Cx. duttoni, Cx.
univittatus, Ae. albopictus, Ma. africana, Ma.
uniformis et An. gambiae s.l. Parmi ces moustiques, 381 ont
été capturés au moyen des pièges lumineux et 832
par pulvérisation intra-domiciliaire d'insecticides.
3.1.2.4. Variation des effectifs de Cx.
quinquefasciatus adultes en fonction de la pluviométrie
La figure 12 montre la variation mensuelle des effectifs de
Cx. quinquefasciatus en fonction de la pluviométrie. La
variation des effectifs de Cx. quinquefasciatus a été
inversement proportionnelle à la pluviométrie (r = -0,57).
L'association entre ces deux paramètres est statistiquement
significative p (ddl=8) < 0,05. Seules les données de Cx.
quinquefasciatus ont été utilisés parce que la faune
culicidienne est composée essentiellement par cette espèce. Les
effectifs nuls observés au mois janvier et février sont dus
à un problème logistique (les bâtiments étaient
fermés pour réfection).
3.1.2.5. Espèces et formes moléculaires du
complexe Anopheles gambiae
Un total de 224 An. gambiae s.l soit 219 issus des
émergences et 5 capturés au stade adulte, ont été
analysés pour l'identification des espèces et des formes
moléculaires. L'analyse moléculaire a montré que tous
étaient An. gambiae s.s de forme moléculaire M.
3.1.2.6. Indice circumsporozoïtique
La protéine CSP a été recherchée
par ELISA chez tous les anophèles collectés au stade adulte (6
individus). Aucune des femelles testées n'a révélé
la présence de la protéine CSP dans les glandes salivaires.

Pluviometrie (mm)
350
300
250
200
150
100
50
0
Pluviométrie (mm) Nb de Cx. quinquefasciatus
2005 -2006
450
400
350
300
250
200
50
0
150
100
Nombre de specimens de
Cx.
quinquefasciatus
adultes collect& par session de
capture
Figure 12 : Variation mensuelle des effectifs de
Cx. quinquefasciatus en fonction de la pluviométrie

3.2. Discussion
Notre étude a permis d'identifier douze espèces
culicidiennes dont la présence avait été
déjà signalée au Cameroun dans la région de
Yaoundé par Rageau et Adam (1952), Rickenbach et al. (1976b),
Fondjo et al. (1992), Manga et al. (1992), Nimpaye et al.
(2001), Fontenille et Toto (2001), Nchoutpouen (2003), Toto et Beyene (non
publié). Les espèces culicidiennes obtenues des récoltes
larvaires montrent qu'elles colonisent une large gamme de gîtes. Cx.
quinquefasciatus a été retrouvée dans 12 des 13
gîtes prospectés. Ces gîtes sont constitués pour la
plupart par des collections d'eau stagnante chargée de débris
organiques. La présence de nombreux gîtes favorables au
développement des Culex se justifierait par le niveau de
pollution organique du milieu. Ces observations sont corroborées par les
travaux de Darriet et al. (1986) qui ont montré que la forte
présence de Cx. quinquefasciatus peut être
considérée comme un marqueur biologique de l'urbanisation.
La présence d'An. gambiae s.l témoigne
de la bonne adaptation de cette espèce au milieu urbain. Les mêmes
observations ont été faites par Robert et al., 1986 ;
Trape et Zoulani, 1987 ; Fondjo et al, 1992 ; Manga et al,
1992 ; Robert et al., 2003 ; Antonio-Nkonjio et al., 2005.
L'espèce Ae. albopictus a été
retrouvée dans les creux d'arbres et les vieux pneus. Ces observations
confirment celles de Fontenille et Toto, 2001, Nchoutpouen, 2003, Simard et
al., 2005 qui ont montré que ceux-ci constituaient les
gîtes de prédilection d'Ae. albopictus au Cameroun.
Ae. aegypti vecteur urbain de la fièvre jaune au Cameroun
(Vicens et al., 1993) n'a pas été retrouvé dans
nos échantillons. Cette situation pourrait refléter le fait que
depuis l'introduction d'Ae. albopictus au Cameroun, cette
espèce tend à coloniser peu à peu les gîtes
larvaires jusqu'ici occupés par Ae. aegypti et à entrer
en compétition avec ce dernier. Une telle situation a été
observée aux Etats Unis en 1985 où l'invasion d'Ae.
albopictus a remplacé totalement Ae. aegypti (Hawley,
1988). Il est important de noter qu'Ae. albopictus est le principal
vecteur de la dengue qui est une maladie en expansion dans le monde (Gubler,
1998) et constitue de ce fait un risque potentiel pour le Cameroun. Ae.
aegypti est actuellement présent dans la partie septentrionale du
pays, où Ae. albopictus est absent (Nchoutpouen, 2003 ; Simard
et al., 2005).
La richesse spécifique de la faune culicidienne
récoltée au stade adulte est peu différente de celle que
Manga et al. (1992) ont observé à Obili, un quartier
très proche de notre zone d'étude. Les quelques divergences
observées entre notre étude et celle de Manga et al.
(1992) tiennent essentiellement au fait qu'un certain nombre de
spécimens n'ont pas été identifiés à

Obili, aux différentes méthodes de collecte
utilisées et au fait qu'Ae. albopictus n'était pas
encore présente au Cameroun en 1992.
La faune imaginale est composée à 96,9% de
Cx. quinquefasciatus. La forte dominance de cette espèce est
liée au niveau de pollution du milieu et à l'absence de
système de drainage des eaux usées qui contribuent à sa
pullulation. Des observations similaires ont été faites
également par Fondjo et al. (1992) à Nkolbikock un
quartier de Yaoundé, Diallo et al. (1998) et Diallo et
al. (2000) à Dakar au Sénégal, Robert et
al. (1986) à Diaradougou au Burkina Faso qui sont tous des
milieux urbanisés. Ceci concorde avec les observations faites aux stades
préimaginaux.
La présence des espèces Ma. africana et
Ma. uniformis s'explique par la présence de l'étang
naturel renfermant des végétaux dont les parties immergées
sont favorables au développement de cette espèce. La faible
proportion de ces espèces dans nos échantillons par rapport
à celle de Manga et al. (1992) serait liée au focardage
permanent de l'étang et aux techniques de capture utilisées.
L'absence de cette espèce dans les récoltes larvaires est en
effet liée à son écologie, car les stades
préimaginaux vivent fixés sur les parties immergées des
plantes aquatiques et la méthode de récolte que nous avons
employée ne permet pas de les atteindre. Aedes albopictus a une
activité essentiellement diurne et exophage (Hawley, 1988) et est donc
forcément sous représenté dans la capture des adultes dans
cette étude axée sur la collecte de moustique actifs la nuit
(capture par piège lumineux) et endophiles (spray).
En accord avec les recommandations des différents
comités d'éthique nationaux et institutionnels, nous avons
choisi, dans ce travail, de ne pas utiliser la technique de collecte des
arthropodes hématophages anthropophiles par capture directe sur sujet
humain. Nous l'avons remplacée ici par la technique de capture au
piège lumineux. Sur le plan qualitatif, les résultats obtenus au
cours de notre étude avec cette technique sont comparables à ceux
obtenus par la technique de spray, les mêmes espèces ayant
été échantillonnées avec les deux techniques. Sur
le plan quantitatif, les effectifs collectés restent faibles et il nous
a été en particulier impossible de détecter une
transmission palustre sur le campus en dépit d'un total de 40
équivalents homme nuit de capture (4 chambres fois 10 nuits). En effet,
un seul anophèle a été collecté par cette technique
équivalent à 0,03 piqûre par homme par nuit (pi/h/n). En
mettant ce résultat en rapport avec nos efforts de capture et celui
obtenu par la technique de capture direct sur sujet humain au quartier Dakar
(Yaoundé) par Nimpaye et al., 2001 malgré le fait que
les conditions environnementales ne soient pas exactement les mêmes, nous
remarquons qu'avec un total de 192 équivalents homme nuit de capture (8
hommes fois 24 nuits), 728 anophèles avaient été
récoltés, soit 4 piqûres par homme par nuit.

An. gambiae s.l ne représente que 0,5% de la
faune culicidienne adulte alors que de nombreux gîtes larvaires
productifs ont été observés. L'éloignement des
gîtes des chambres destinées aux captures pourrait expliquer ce
faible pourcentage. Les études sur la dispersion des anophèles
ont en effet montré qu'ils se dispersent très peu en zone de
forte densité de population humaine (Sebatineli et al., 1986 ;
Trape et Zoulani, 1987 ; Manga et al., 1992 ; Robert et al.,
2003).
L'absence des espèces Cx. poicilipes, Cx. guiarti,
Cx. chorleyi, Cx. tigripes et Cx. decens dans les chambres
découle également de leur biologie, car ces espèces sont
exclusivement zoophiles et exophiles (Jupp, 1996).
La densité culicidienne (Cx. quinquefasciatus)
a été maximale au mois de juillet quand la pluviométrie a
été minimale. Ceci pourrait être dû au fait qu'en
période de faibles précipitations, les gîtes qui sont pour
la plupart des collections d'eaux stagnantes provenant de la cité
universitaire, des restaurants universitaires et de divers laboratoires sont
peu perturbés et propices au développement des larves de
Culicidae. La densité culicidienne faible observée en
octobre résulte de l'abondance des pluies qui ont contribué au
lessivage des gîtes. L'interprétation des fluctuations d'abondance
des Culicidae en fonction des régimes des précipitations
doit aussi tenir compte de l'intervalle de temps qui existe entre les jours de
pluie et les jours de capture, car les phases de développement larvaire
du moustique peuvent durer de 8 à 12 jours (Rhodain et Perez, 1985).
L'étude taxonomique des anophèles du complexe
An. gambiae par la technique de la biologie moléculaire a
révélé la présence d'une seule espèce,
An. gambiae s.s., en accord avec les observations de Wondji et
al. (2005) quant à la distribution des espèces du
complexe au Cameroun. La détermination des formes moléculaires M
et S d'An. gambiae s.s montre que cette zone est colonisée
uniquement par la forme moléculaire M, ce qui est similaire aux
observations de Wondji et al. (2005) dans la région de
Yaoundé. Plusieurs hypothèses pourraient être
énoncées pour expliquer la présence exclusive de la forme
moléculaire M dans notre population. Il peut s'agir de l'urbanisation du
milieu (car les travaux de Wondji et al. (2005) ont montré que
la forme M était prédominante en milieu urbain et
périurbain), l'exclusion compétitive entre les deux formes (car
ces mêmes travaux ont montré que même en zone de sympatrie
une forme était toujours prédominante sur l'autre), l'isolement
écologique (deux formes M et S colonisent les gîtes
différents pour leur développement larvaire). Il serait
intéressant d'étudier l'écologie larvaire de chacune des
formes dans plusieurs localités afin de clarifier cette dernière
hypothèse.

La détermination du taux d'infection des
anophèles a été faite par la technique ELISA. La
présence de la protéine CSP n'a pas été
révélée sur les moustiques testés. Le très
faible effectif de moustiques adultes collectés (6 individus) ne permet
aucune extrapolation et nous pouvons seulement dire que la transmission du
paludisme sur le campus est en dessous du niveau de sensibilité des
méthodes que nous avons employées. Cependant, le vecteur majeur,
An. gambiae est bien présent et les résidents sont donc
exposés a un risque potentiel de transmission du paludisme.
L'importation des parasites sur le campus est très probable car la
population d'étudiants est très mobile et la durée de la
phase infectante d'un porteur de gamétocytes pour les moustiques est
compatible avec des déplacements sur de longues distances ou de longues
périodes (Bousema et al., 2004 ; Boudin et al., 2004).
De plus, l'origine géographique variée de la population
estudiantine et des souches géographiques de Plasmodium falciparum
qu'elle est susceptible de véhiculer pourrait favoriser localement
la diffusion des chimiorésistances (Shanks et al., 2005). Les
travaux antérieurs menés dans certains quartiers de la ville de
Yaoundé ont montré que le taux d'infestation des anophèles
varie de 1,2 à 5,2% (Manga et al., 1992 ; Fondjo et
al., 1992 ; Nimpaye et al., 2001). La non infection des
anophèles récoltés pourrait également être
liée à la parturité de ceux-ci, car seuls les
anophèles pares sont susceptibles d'être infectant ; nous n'avons
pas en effet étudié ce paramètre au cours de notre
étude. Les études parasitologiques et sociologiques nous
permettraient très certainement de préciser
l'épidémiologie du paludisme sur le campus. Il est important de
rappeler que des observations entomologiques similaires à celle que nous
avons observées ont été faites dans d'autres villes en
Afrique subsaharienne par Robert et al. (1986) à Bobo-Dioulasso
(Burkina Faso); Thompson et al. (1997) à Maputo au Mozambique;
Diallo et al. (1998), Diallo et al. (2000) à Dakar au
Sénégal et l'étude de la parasitémie a bien
révélé la présence de sujets humains
infectés. Il faut retenir qu'en Afrique subsaharienne des variations
importantes du niveau de transmission existent entre les villes et entre
différents quartiers au sein d'une même ville (Robert et
al., 2003).

Conclusion et perspectives
Le travail que nous venons de présenter a
été effectué sur le campus de l'Université
Yaoundé I qui est un milieu urbanisé. Il avait pour objectif
général la contribution à la connaissance des
Culicidae sur le campus dans l'optique d'évaluer les risques de
transmission de maladies, et en particulier du paludisme, dans ce milieu.
Il ressort de cette étude que:
- la transmission du paludisme est sous le seuil de
détection des méthodes entomologiques que nous avons
utilisées ;
- le seul vecteur du paludisme identifié est An.
gambiae de forme moléculaire M. En reconnaissant le fort potentiel
adaptatif de cette espèce, il y'a un risque pour le futur ;
- la présence d'Ae. albopictus est une preuve
supplémentaire de l'implantation de cette espèce au Cameroun
jusqu'au cSur de la ville. Cette situation pourrait entraîner des
changements dans l'épidémiologie d'arboviroses (dengue,
ckikungunyia, fièvre jaune) pour lesquelles il est un bon vecteur
potentiel.
Les informations obtenues de cette étude permettent
d'envisager de nouvelles perspectives pour la surveillance des maladies
transmises par la piqûre de moustiques. Ainsi, nous pensons, qu'il sera
souhaitable :
- d'intégrer des méthodes complémentaires
(études parasitologiques et sociodémographiques) et d'autres
méthodes entomologiques plus spécifiques pour la surveillance, en
particulier en zone de faible transmission ou transmission
hétérogène;
- de mieux comprendre les mécanismes d'adaptation des
anophèles à leur environnement pour mieux prévenir leur
expansion en zone urbaine ;
- d'évaluer le rôle vectoriel d'Ae. Albopictus
au Cameroun en cherchant à isoler différents arbovirus des
spécimens collectés sur le terrain.

Références bibliographiques
Antonio-Nkondjio, C., Awono-Ambéné, P.,
Toto, J. C., Meunier, J. Y., Zébazé-Kemleu, S., Nyabam, R.,
Wondji, C. S., Tchuinkam, T. & Fontenille, D., 2002. High malaria
transmission intensity in a village close to Yaoundé, the capital city
of Cameroun. J. Med. Entomol., 39 (2): 350-355.
Antonio-Nkondjio, C., Simard, F.,
Awono-Ambéné, P., Ngassam, P., Toto, J. C., Tchuinkam, T. &
Fontenille, D., 2005. Malaria vectors and urbanization in the
equatorial forest region of south Cameroon. Trans. Roy. Soc. Trop. Med.
Hyg., 99: 347-354.
Antonio-Nkondjio, C., Kerah, C. H., Simard, F.,
Awono-Ambéné, H. P., Chouaibou, M., Tchuinkam, T. &
Fontenille, D., 2006. Complexity of the malaria vectorial system in
Cameroon: contribution of secondary vectors to malaria transmission. J.
Med. Entomol., 43 (6)
Awono-Ambéné, P.,
Kengne, P., Simard, F., Antonio-Nkondjio, C. & Fontenille, D., 2004.
Description and binomics of Anopheles (Cellia) ovengensis
(Diptera: Culicidae), a new malaria vector species of the Anopheles nili
group from south Cameroon. J. Med. Entomol., 41 (4):
561-568.
Aubry, P., 2005. Fièvre jaune, dengues et
autres arboviroses tropicales. Actualités 2005, Med. Trop.,
7p.
Barbazan, P., Baldet, T., Darriet, F. Escaffre, H.,
Djoda, D. H. & Hougard, J. M., 1997. Control of
Culex quinquefasciatus (Diptera: Culicidae) with Bacillus
sphaericus in Maroua, Cameroon. J. Am. Mosq. Control. Assoc.,
13(3):263-9.
Boudin, C., Van Der Kolk, M., Tchuinkam, T., Gouagna,
C., Bonnet, S., Safeukui, I., Mulder, B., Meunier, J. Y. & Verhave, J. P.,
2004. Plasmodium falciparum transmission blocking immunity
under conditions of low and high endemicity in Cameroon. Parasite
Immunol., 26: 105-110.
Bouchite, B., Barbazan, P., Mauclère, P. &
Millan, J., 1995. Enquête épidémiologique sur deux
cas mortels de fièvre jaune survenus dans la ville de
Ngaoudéré (Province de l'Adamaoua-Cameroun). Rapport non
publié de l'antenne ORSTOM auprès du Centre Pasteur du Cameroun
N°3/95.
Bousema, J. T., Gouagna, C. L., Drakeley, J. C.,
Meutstege, A. M., Okech, B. A., Akim, I. N. J., Beier, J. C., Githure, J. I.,
& Sauerwein, R. W., 2004. Plasmodium

falciparum gametocyte carriage in asymptomatic children
in western Kenya. Malaria Journal, 3:18.
Burkot, T. R., Williams, J. L. & Schneider, I.,
1984. Identification of p. falciparum infectedMosquitoes by a double
antibody enzyme linked immunosorbent assay. Am. J. Trop. Med. Hyg., pp
783-788.
Clavel, C., Bininger, I., Polette, M., Boutterin, M. C.
& Birembaut, P., 1993. Polymerase
chain reaction et pathologie. Principes et application. Ann.
Pathol., 13 (2): 88-96. Chan, K. L., Chan, Y. C.
& Ho, B. C., 1971. Aedes aegypti (Linné) and
Aedes albopictus
in Singapour city. Competition between
species. Bull. Wld. Hlth.
Org., 44: 643-649. Christhopher,
S. R., 1960. Aedes aegypti L., the yellow fever mosquito. Its
life history
bionomic, and structure. Cambridge University Press,
London-New-York, 739p.
Cohuet, A., Simard, F., Toto, J. C., Kengne,
P., Coetzee, M. & Fontenille, D., 2003.
Species identification within the Anopheles funestus
group of malaria vectors in
Cameroon and evidence for a new species. Am. J. Trop. Med.
Hyg., 69 (2): 200-205. Coluzzi, M. and Sabatini,
A., 1967. Cytogenic observations on species A and B of
Anopheles gambiae complex. Parasitologia,
9: 73-88.
Coluzzi, M., 1968. Chromosomi politenici delle
cellue nutrici ovariche nel complesso gambiae del genre Anopheles.
Parasitologia, 9: 179-183.
Coluzzi, M., Petrarca, V. & Di Meco, M. A., 1985.
Chromosomal inversion intergradation and incipient speciation in
Anopheles gambiae. Bull. Zool., 52:
45-63.
Darriet, F., Robert, V. & Carnevale, P., 1986.
Nouvelles perspectives de lutte contre Culex quinquefasciatus
dans la ville de Bobo-Dioulasso (Burkina Faso). Congrès «
L'eau, la Ville et le Développement », I.S.T.E.D., Marseille, 9-11
juin 1986.
Degallier, N., Herve, J. P., Travassor Da Rosa, A. P.
A. & Filho, G. C. 1988. Aedes aegypti (Linné) :
Importance de la bio écologie dans la transmission de la dengue et des
autres arboviroses. Bull. Soc. Pathol. Exot., 81:
97-110.
De Bruijn, M. L. H., 1988. Diagnostic DNA
amplification no respite for elusive parasite. Parasitology Today,
4: 293-295.
Diallo, S., Konaté, L., Faye, O., Ndir, O.,
Faye, M., Gueye, A. & Diouf, M., 1998. Le paludisme dans le
district sanitaire sud de Dakar, Sénégal: 2. Données
entomologiques. Bull. Soc. Pathol., 91: 259-263.

Diallo, S., Konaté, L., Ndir, O., Dieng, T.,
Dieng, Y., Bah, I. B., Faye, O. & Gaye, O.,
2000. Le paludisme dans le district sanitaire
centre de Dakar, Sénégal: Données
entomologiques, parasitologiques et cliniques. Cahiers
santé 10: 221-229.
Edwards, F. W., 1941. Clé des
Culicinae adultes de la région éthiopienne. Clé
simplifiée de
détermination des larves de Culicidae en
région éthiopienne. ORSTOM. Labo.
Entomol. Med. S. S. Bondy. Traduction de Rageau, J.
Eldrige, F. B., 2005. Mosquitoes, the
Culicidae. In Marquardt, C. W., Black, C. W., Freier, E. J.,
Hagedorn, H. H., Hemingway, J., Higgs, S., James, A. A., Kondrtieff, B., More,
G. C., Biology of Disease Vectors, Elsevier. Academic. Press,
2e Ed., pp: 95- 111.
Favia, G., Della Torre, A., Bagayoko, M.,
Lanfroncotti, A., Sagnon, N. F., Touré, Y. T. & Coluzzi, M., 1997.
Molecular identification of sympatric chromosomal forms of
Anopheles gambiae and further evidence of their reproductive
isolation. Insect. Mol. Biol., 6:
377-383.
Fanello, C., Santolamazza, F. & Della Torre, A.,
2002. Simultaneous identification of spcies and molecular forms of the
Anopheles gambiae complex by PCR-RFLP. Med. Vet. Entomol.,
16: 461-464.
Fondjo, E., Robert, V., Le goff, G., Toto, J. C. &
Carnevale, P., 1992. Le paludisme urbain à
Yaoundé (Cameroun). 2- Etude entomologique dans deux quartiers peu
urbanisés. Bull. Soc. Path. Exot., 85:
57-63.
Fondjo, E., 1996. Etude du comportement du
complexe An gambiae et de la transmission du paludisme dans deux
faciès éco-climatiques au Mali et au Cameroun. Thèse
doctorat 3e cycle. Min. Ens. Sec. Sup. Rech. Sc. ISFRA. Mali, 92p.
Fontenille, D. & Toto, J. C., 2001.
Aedes (stegomia) albopictus (skuse), a potential new dengue vector in
southern Cameroon. Emerging Infectious Diseases. 7:
1066-1067.
Fontenille, D., Cohuet, A.,
Awono-Ambéné, P., Antonio-Nkondjio, C., Wondji, C., Kengne, P.,
Dia, I. Boccolini, D., Duchemin, J. B., Rajaonarivelo, V., Dabire, R.,
Adja-Akre, M., Ceainu, C., Le Goff, G. & Simard, F., 2003.
Systématique et biologie des anophèles vecteurs de
Plasmodium en Afrique, données récentes. Méd.
Trop., 63 (3): 247-253.
Fontenille, D. & Simard, F., 2004.
Unravelling complexities in human malaria transmission dynamics in
Africa through a comprehensive knowledge of vector populations. Comp.
Immun. Microbiol. Infect. Dis., 27 : 357-375.

Galliard, H., 1931. Culicidés du Gabon.
I- Culicinés (suite). Remarque sur la biologie des
Mansonioides et d'Aedes (Stegomyia). Ann.
Parasit. Hum. Comp., 32: 563-579. Gillies, M. T.
& B. De Meillon., 1968. The Anophelinae of Africa south
of the Sahara.
Publication of the South African Institute for Medical
Research, 54: 343p.
Gillies, M. T. & Coetzee, M., 1987. A
supplement to the Anophelinae of Africa south of the
Sahara Publication of the South African Institute for Medical
Research. 55: 143p. Gould, D. L., Yuil, T. M.,
Moussa, M. A. Simasathien, P. & Rutledge, L. C., 1968. An
insular outbreak of dengue haemorrhagic fever. III.
Identification of vectors and
observations on vector ecology. Am. J. Trop. Med.
Hyg.,17: 609-618.
Gubler, D. J., 1998. Dengue and dengue
haemorrhagic fever. Clinical Microbiology Reviews. 11
(3): 480-496.
Hamon, J. G., Burnett, F., Adam, J. P., Rickenback, A.
& Grjebine, A., 1967. Culex pipiens fatigans Wiedeman, Wuchereria
bancrofti Cobbold, et le développement économique de l'Afrique
tropicale. Bull. Wld. Hlth.
Org., 37: 277-286.
Hawley, W. A., 1988. The
biology of Aedes albopictus. J. Am. Mosq. Control Assoc.
4: 1-40. Hervy, J. P., Le Goff, G., Geoffroy, B.,
Hervé, J. P., Manga, L. & Brunhes, J., 1998. Les
anophèles de la région afrotropicale. CD-ROM,
ORSTOM éditions, Paris.
Hopkins, G. H. E., 1952. Mosquitoes of the
Ethiopian region. I. Larval bionomics of
mosquitoes and taxonomy of Culicinae larvae. British
Museum & B. Quaritch Ltd Ed.,
355p.
Hougard, J. M., Mbentengam, R.,
Lochouarn, L., Escaffre, H., Darriet, F., Barbazan,
P.
& Quillevere, D., 1993. Campaign against
Culex quinquefasciatus using Bacillus
sphaericus: results of a pilot project in a large urban
area of equatorial Africa
Bull. Wld. Hlth.
Org., 71(3):367-75.
Innis, M. A. & Gelfang, D. H., 1990.
Optimization of PCR Protocols: A Guide to Methods and applications.
Academic Press Inc, 3-12.
Jumali, S., Gubler, D. J., Nalim, S., Eram, S. &
Saroso, J. S., 1979. Epidemic dengue haemorrhagic fever in rural
Indonesia. III. Entomological studies. Am. J. Trop. Med. Hyg.,
28:717-724.
Jupp, p. G., 1996. Mosquitoes of southern
Africa: Culicinae and Toxorhynchitinae Hartebeespoort (South
Africa): Ekolgilde publishers. 155p.
Kengne, P., Awono-Ambene, P., Antonio-Nkondjio, C.,
Simard, F. & Fontenille, D., 2003. Molecular identification of
members of the Anopheles nili group, African malaria vectors. Med.
Vet. Entomol., 17:1-9.

Lane, P. R. & Crosskey, R. W., 1993. Medical
insects and arachnids. Chapman and Hall, 723p.
Mac Donald, G., 1957. The epidemiology and
control of malaria. London Oxford University Press. 201 p.
Manga, L., Robert, V., Messi, J., Desfontaine, M.
& Carnevale, P., 1992. Le paludisme urbain à
Yaoundé, Cameroun. 1 Etude entomologique dans deux quartiers centraux.
Mém. Soc. R. Belge Ent., 35: 155-162.
Manga, L., Fondjo, E., Carnevale, P. & Robert, V.,
1993. Importance of low dispersion of Anopheles gambiae (Diptera:
Culicidae) on malaria transmission in hilly towns in South Cameroon.
J. Med. Entomol., 30(5): 936-938.
Mazier, D., 1991. Cycle et biologie des
Plasmodium. In Danis, M. and Mouchet, J. Paludisme.
Paris: Ellipses/Aupelf, pp 25-32.
Miles, S. J., 1979. Abiotchemical key to adult
member of the Anopheles gambiae group of species (Diptra:
Culicidae). J. Med. Hyg., 15: 297-299.
Mitchell, C. J. Miller, B. R., & Gubler, D. J.,
1987. Vector competence of Aedes albopictus from Houston,
Texas, For dengue serotypes 1 to 4, yellow fever and Ross River viruses. J.
Am. Mosq. Control. Asso., 3: 460-465.
Mouchet, J. & Gariou, J., 1966.
Anopheles moucheti au Cameroun. Cahiers ORSTOM,
série Entomologie médicale et parasitologie, 4
(6): 71-81.
Mouchet, J., Carnevale, P., Coosemans, M., Fontenille,
D., Ravaojanahary, C., Richard, A. & Robert, V., 1993. Typologie
du paludisme en Afrique. Cahiers santé. 3:
219- 220.
Mouchet, J. & Carnevale, P., 1991. Les
vecteurs et la transmission. In Danis, M. and Mouchet, J., Paludisme.
Paris : Ellipses/Aupelf pp : 35-59.
Mouchet, J., Carnevale, P., Coosemans, M., Julvez, J.,
Manguin, S., Richard-Lenoble & Sircoulon, J., 2004.
Biodiversité du paludisme dans le monde. John Libbey
Eurotext, Paris. 428p.
Nchoutpouen, E., 2003.
Répartition et biologie d'Aedes albopictus et
d'Aedes aegypti, vecteurs potentiels de la dengue et de la
fièvre jaune au Cameroun. Mémoire de DEA, Université de
Yaoundé I. 66p.
Nimpaye, H., Van Der Kolk, M., Fontenille, D. &
Boudin, C., 2001. Le paludisme urbain à Yaoundé
(Cameroun) en 2000. Etude entomologique dans le quartier central "Dakar".
Bull. Liais. Doc. OCEAC, 34 (2): 11-14.
OMS, 1999. La lutte antivectorielle.
Méthodes à usage individuel et communautaire. 449p.

OMS, 2001. Stratégies recommandées
par l'OMS contre les maladies transmissibles. Prévention et lutte.
WHO/CDS/CPE/SMT/2001. 13, 200p.
OMS, 2003. Entomologie du paludisme et
contrôle des vecteurs : Guide du stagiaire. Edition provisoire.
WHO/CDS/CPE/SMT/2003. 18, 102p.
OMS, 2005. Rapport mondial sur le paludisme.
www.who.int/malaria
Omoko, 1984. Dynamique de l'eau dans un sol
ferralitique et étude comparée entre l'évapotranspiration
mesurée et calculée en climat équatorial. Thèse de
Doctorat 3e cycle Université de Bordeau. 126 P.
Petrarca, V., Sabatinelli, G., Toure, Y. T. & Di
Deco, M. A., 1998. Morphometric multivariate analysis of field sample
of adult An. Arabienis and An. gambiae s.s. J. Med.
Entomol., 35: 16-25.
Rageau, J. & Adam, J. P., 1952. Culicinae du
Cameroun. Ann. Parasit., 27(6): 610- 635.
Reiter, P., Fontenille, D. & Paupy, C., 2006. Aedes
albopictus as an epidemic vector of
chikungunya virus: another emerging problem? Lancet Infect
Dis, 6 (8): 463-4.
Rickenbach, A., Eouzan, J.
P., Ferrara, L. & Bailly-Choumara, H., 1976a. Données
nouvelles sur la présence et la répartition des
Toxorhynchitinae et Culicinae (Diptera,
Culicidae) au Camerou 1.Genres Toxorhynchites,
Malaya, Hodgesia, Uranotaenia,
Aedeomyia, Culiseta, Orthopodomyia, Ficalbia, Mansonia
et Aedes. Cah. ORSTOM,
Sér. Méd. et Parasitol.,14
(1): 61-68.
Rickenbach, A., Eouzan, J. P., Ferrara, L. &
Bailly-Choumara, H., 1976b. Données nouvelles sur la
présence et la répartition des Toxorhynchitinae et
Culicinae (Diptera, Culicidae) au Cameroun 2. Genres
Eretmapodites et Culex. Cah. ORSTOM, Sér. Méd. et
Parasitol.,14 (2):, 93-100.
Robert, V., Gazin, P., Ouédraogo, V. &
Carnevale, P., 1986. Le paludisme urbain à BoboDioulasso
(Burkina Faso). 1. Etude entomologique de la transmission. Cah. ORSTOM.
Sér. Med. Parasitol. 2: 121-128.
Robert, V., Macintyre, K., Keating, J., Trape, J. F.,
Duchemin, J. B., Mcwilson, W. & Beier, J. C., 2003. Malaria
tranmission in urban sub-Saharan Africa. Am.J. Trop. Med. Hyg.
68 (2): 169-176.
Rodhain, F. & Perez, C., 1985. Précis
d'entomologie médicale et vétérinaire. Maloine
Editeur, Paris. 458p.
Rudnick, A., Marchette, N. J. & Garcia R., 1977.
Possible jungle dengue recent studies and hypothesis. J. Med. Sci.
Biol. 20:69-74.

Samé Ekobo, A., 2005. Aspect
épidémiologique du paludisme au Cameroun. Malaria reseach
and control in Cameroon. Journal of the Cameroon Academy of
Sciences, 5: 3-24. Sabin, A. B., 1952.
Reseach on dengue during World War II. Am. J. Trop. Med.
Hyg., 1: 30-
50.
Saïki, R. K., Scharf, S., Falona, F., Mullis, K.
B., Horn, G. T., Herlich, H. A. & Arnhein, N., 1985. Enzymatic
amplification of beta-globin genomic sequences and restriction site analysis
for diagnostic of sickle cell anemia. Science, 230, 1350.
Scott, J. A., Brogdon, W. G. & Collins, F. H.,
1993. Identification of single specimens of the Anopheles gambiae
complex by polymerase chain reaction. Am. J. Trop. Med. Hyg.,
49:520-529.
Sebatinelli, G., Rossi, P. & Belli, A., 1986.
Etude de la dispersion d'Anopheles gambiae s.l dans une zone
urbaine de Ouagadougou. Parasitologia, 28: 33- 39.
Service, M. W., 1993. Mosquito ecology: Field
Sampling Methods. Vector biology and control, Liverpool of Tropical
Medicine, second edition, 988p.
Shanks, G. D., Biomndo, K., Guyatt, H. L. & Snow,
R. W., 2005. Travel as a risk factor for uncomplicated Plasmodium
falciparum malaria in the highlands of western Kenya. Trans. R. Soc.
Trop. Med. Hyg., 99 (1): 71- 4
Simard, F., Nchoutpouen, E., Toto, J. C. &
Fontenille, D., 2005. Geographical distribution and breeding site
preference of Aedes albopictus (Diptera : Culicidae) in Cameroon,
Central Africa. J. Med. Entomol., 42 (5): 726-731.
Smith, C. E. G., 1956. The history of dengue in
tropical Asia and its probable relationship to the mosquito Aedes aegypti.
Am. J. Trop.Med. .Hyg., 59:243-252.
Suchel, J. B. & Tsalefack, M., 1995. La
climatologie. In Atlas régional Sud Cameroun. ORSTOM
édition. Planche 3, 8-9.
Thompson, R., Begtrup, K., Cuamba, N., Dgedge, M.,
Mendis, C., Gamage-Mendis, A., Enosse, S. M., Barreto, J., Sinden, R. E. &
Hogh, B., 1997. The Matola malaria project: a temporal and spatial
study of malaria transmission and disease in a suburban area of Maputo.
Mozambique. Am. J. Trop. Med. Hyg., 57: 550-559.
Thonnon, J., Spiegel, A., Diallo, A. & Fontenille,
D., 1999. Epidémies à virus de
Chikunguya en 1996 et 1997 au Sénégal. Bull.
Soc. Path. Exot., 92: 79-82.
Tosi, M. & Acuto, O., 1992. Grandeurs et
limites de la PCR In : Amplication Enzymatique
des séquences nucléotidiques par PCR. Ed.
INSERM, Paris, 1-4.

Trape, J. F. & Zoulani, A., 1987. Malaria
and urbanization in central Africa. The exemple of Brazzaville. Part II.
Results of entomological surveys and epidemiological analysis. Trans. Roy.
Soc. Trop. Med. Hyg., 81: 10-18.
Valerie, M., 1995. La pédologie.
In Atlas regional Sud Cameroun. Edition ORSTOM. Planche2,
6-7.
Vicens, R., Robert, V., Pignon, D., Zeller, H.,
Ghipponi, P. M. & Digoutte, J. P., 1993. L'épidémie
de fièvre jaune de l'Extrême Nord du Cameroun en 1990 : premier
isolement du virus amaril au
Cameroun. Bull. Wld. Hlth.
Org., 71(2): 173-176.
Wondji, C., Simard, F. & Fontenille, D.,
2002. Evidence for genetic differentiation between the molecular forms
M and S within the Forest chromosomal form of Anopheles gambiae in
area of sympatry. Insect. Mol. Biol., 11(1):
11-19.
Wondji, C., Simard, F., Petrarca, V., Etang, J.,
Santolamazza, F., Della Torre, A. & Fontenille, D., 2005. Species
and populations of the Anopheles gambiae complex in Cameroun with special
emphasis on chromosomal and molecular forms of Anopheles gambiae s.s.
J. Med. Entomol., 42 (6): 998-1005.
Wirtz, R. A., Zvala, F., Charoenvit, Y., Campbell, G.
H., Burkott ,T. R., Scheider, I., Esser, K. M., Beaudoin, R. L. & Andre, R.
G., 1987. Comparative testing of monoclonal antibodies against P.
falciparum sporozoites for ELISA development. Bull. Wld Hlth Org.,
65: 39-45

Annexe.
Annexe 1: Photos des différents types de
gîte prospectés



1. Etang d'eau 2. Bassin de pisciculture

3. Vieux pneu 4. Bac de stockage des poissons
5 (6). Creux d'arbre au sol 7. Creux d'arbre à 2 m du
sol


8. Flaque d'eau 9. Eau d'égout déversée dans
le champ
10. Bac à laver les mains 11 (12). Bac à fleur mal
entretenu
13. Eau usée provenant du restaurant I
Annexe 2:
- Séquences des amorces utilisées
pour l'identification des espèces du complexe Anopheles
gambiae

+
+
-
-
Région conservée du génome (chez toutes
les espèces)
Région variable et séquences spécifiques
d'espèce
Spécificité Séquence Taille du fragment
amplifié
Universelle (UN) 5' GTGTGCCCCTTCCTCGATGT 3'
An. arabiensis (AR) 5' AAGTGTCCTTCTCCATCCTA 3' 315 pb
An. gambiae (GA) 5' CTGGTTTGGTCGGCACGTTT 3' 390pb
An. melas (ML) 5' TGACCAACCCACTCCCTTGA 3' 464pb
An. arabiensis
An. gambiae
An. melas
UN
AR
GA
ML
+
+
+
-
-
+
-
--
- Représentation schématique du test diagnostic de
3 espèces du complexe Anopheles gambiae d'après Scott et
al. (1993)

Annexe 3: Réactifs et quantité pour
ELISA-CSP
- PBS (Phosphate Buffered Saline)
Reconstituer le PBS en poudre Sigma: 9,7 g dans un litre d'eau
distillée
-NP40/BB = Nonidet P40 pour une plaque 2ml =
25ul NP 40 + 2 ml BB (blocking buffer), agiter (préparer pour 5 plaques
10 ml + 125 ul NP 40)
-BB (blocking buffer) = Dans un litre PBS,
ajouter :
1) 5 g de Caséine
2) 0,1 g de Thiomérosal
3) 0,04 g de phenol red
4) 10 g de BSA
Agiter deux heures
-PBS/TWEEN 20 - 500 ul de Tween 20 dans 1 l de
PBS, agiter
Substrat de Peroxydase = pour 3 plaques:
· 5 mg d'Ortho-tolidine dans 0,25ml de
N,N-diméthylformamide
· 30 ml de Tampon citrate
· 12ul de H2O2 à 10% (ou 4 ul 0 30%, ou
6ul à 20% ).
Tampon Citrate pH4
- Préparer le Tampon Citrate pH4 : pour 1 litre:
Acide citique,
Hydroxyde de Sodium 4,48g
- Dissoudre la soude dans 200ml d'eau bidistillée, puis
l'acide citrique dans cette solution. Ajouter 400ml d'eau bidistillée.
Ajuster le pH à 4 avec l'acide Chlorhydrique 1N. Compléter
à 1 l avec l'eau bidistillée.
RECONSTITUTION DES ANTICORPS MONOCLONAUX LYOPHILISES
(ACm)
· milieu reconstitution = 1/2 volume H2O + 1/2 volume
Glycérol
- 1,0 mg ACm + 2 ml milieu reconstitution - 0,5 mg ACm + 1 ml
milieu reconstitution - 0,25 mg ACm + 0,5 ml milieu reconstitution
QUANTITE D'ACM NECESSAIRE :
- Sensibilisation : ACm capture dans du PBS
· CAPTURE pour une plaque P.
falciparum : 15 ul/5 ml PBS
- Révélation : ACm conjugués à
peroxydase dans BB
* CONJUGUES pour une plaque P. falciparum
: 7,5 ul/5ml BB

| 


