|
Etude comparative de l'efficacité de trois
schémas de prévention antipalustre chez la femme
enceinte
au Burkina Faso: cas du district sanitaire
de
Boussé
|
Par
OUEDRAO GO AMADOU
Thèse présentée pour l'obtention du
diplôme de :
DOCTORAT EN MEDECINE
(diplôme
d'état)
UNIVERSITE DE OUAGADOUGOU, BURKINA FASO
2007
Vue et approuvée par le directeur de thèse :
Professeur Agrégé Michel AKOTION
GA
ynécologue obstétricien
UNIVERSITE DE OUAGADOUGOU, BURKINA FASO
RESUME
Le paludisme chez la femme enceinte est associé
à l'anémie maternelle et au faible poids de naissance chez
l'enfant. En Afrique de l'Est, l'utilisation de la
sulfadoxinepyriméthamine (SP) en traitement préventif
intermittent (TPI) offre une meilleure efficacité par rapport à
la chimioprophylaxie hebdomadaire à la chloroquine (CQ). Dans le
contexte du Burkina Faso, nous avons comparé l'efficacité de la
chimioprophylaxie hebdomadaire à la chloroquine (CQ/Hebdo), du TPI
à la CQ (TPI/CQ) à deux doses et du TPI à la SP (TPI/SP)
à deux doses sur la prévention de l'infection et de
l'anémie maternelle.
Entre avril 2004 et septembre 2005, nous avons
randomisé dans trois groupes de traitement les gestantes entre 15 et 25
SA participant à la consultation prénatale (CPN) du CMA de
Boussé. Au total, 648 femmes ont été suivies avec mesure
du taux d'hémoglobine et la recherche de la parasitémie
périphérique à chacune des trois CPN
programmées.
A l'inclusion, 48,1% des femmes avaient une infection palustre
et 66,0% avaient une anémie (taux d'hémoglobine < 11 g/dL).
Les primigestes et les secondigestes étaient les plus infectées
par rapport aux multigestes. Au terme du suivi, la prévalence de
l'infection du sang périphérique était de 20,4%, 27,6% et
10,1% respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP. La
prévalence de l'infection était moins élevée dans
le groupe TPI/SP (p< 0,001). La prévalence de l'anémie
était de 53,1%, 49,1% et 36,9% respectivement dans les groupes CQ/Hebdo,
TPI/CQ et TPI/SP. Cette prévalence était moins
élevée dans le groupe à TPI/SP (p= 0,01). Le gain moyen
d'hémoglobine par groupe de traitement était de 0,53g/dL,
0,47g/dL et 1,06g/dL respectivement dans les groupes CQ/Hebdo, TPI/CQ et
TPI/SP. Le gain d'hémoglobine était plus significatif dans le
groupe du TPI/SP (p= 0,006).
Au Burkina Faso, le TPI à la SP apparaît comme le
plus efficace des trois protocoles expérimentés dans la
prévention de l'infection et de l'anémie maternelle. Il doit donc
remplacer la chloroquine dans le cadre de la prévention du paludisme
chez la femme enceinte comme recommandé par l'OMS.
Mots des : Paludisme chez la femme enceinte,
chimioprophylaxie, traitements prophylactiques intermittents, district
sanitaire de Boussé, Burkina Faso.
Par :
OUEDRAO GO AMADOU
Directeur de thèse :
Professeur Agrégé Michel AKOTION
GA
Thèse soutenue publiquement le mercredi 23 mai
2007
Devant un jury composé de :
Président du jury
: Professeur Jean LANKOANDE, gynécologue
obstétricien
Membre : Prof. Agreg~ Ludovic KAM,
pédiatre
Membre : Prof. Agrege Blandine THIEBA,
gynécologue obstétricien
Membre : Docteur Sodiomon SIRIMA, médecin
épidémiologiste chercheur/paludologie
TABLE DES MAT1ERES
Matières Pages
INTRODUCTION6666666...666666666...666666666...1
I]
PROBLEMATIQUE66666666666666..6666666666.....3
II] GENERALITES66666666666666666.666666..666.5
II.1. Fardeau du paludisme au Burkina
Faso66.666666.66666666......5
11.1.1 Le paludisme au Burkina
Faso66666666666.66666666..5
11.1.2 Le paludisme dans le
district sanitaire de Bousse66..666666666..5
5
11.2.1 Systematique des
plasmodies6666666666..666666666...5
11.2.2 Le
cycle biologique des
plasmodies66666666666666666..5
11.2.3 Les vecteurs du
paludisme6666666666.666666666.667
II.3 Physiopathologie du
paludisme66666666666666666.66.........8
.
II.2 Les agents pathogènes du paludisme
|
11.3.1 Pathogenie de quelques symptomes
palustres . .8
11.3.2 Facteurs influencant l~evolution naturelle du
paludisme chez
l~homme66666666666666666666666666..66..66...9
II.4 Manifestations cliniques du
paludisme6666666..66666666666 10
11.4.1 Le paludisme
simple66666.66.666666666666666....10
11.4.2 Le paludisme
grave666666.66666666666666666610
11. 5. 1mmunologie du
paludisme pendant la grossesse 11
|
|
11. 6 1mpact du paludisme sur la grossesse ..
|
11
|
|
11. 7 1mpact de la grossesse sur le paludisme
|
12
|
|
11.8 Lutte contre le paludisme
|
14
|
|
II.8.1 La lutte contre les vecteurs
|
....14
|
|
II.8.1.1 La lutte contre les larves des vecteurs
|
14
|
|
II.8.1.2 La lutte contre les adultes de moustiques ..
|
14
|
|
II.8.1.3 La réduction du contact homme-vecteur
|
14
|
|
II.8.2 La lutte contre le parasite
|
15
|
|
11.9 Les medicaments antipaludiques
|
15
|
|
II.9.1 Historique des antipaludiques
|
....15
|
|
II.9.2 Classification des antipaludiques
|
16
|
|
II.9.3 Pharmacologie de quelques antipaludiques
|
17
|
II.9.4. Situation actuelle de la résistance du Plasmodium
aux antipaludiques usuels au Burkina
|
Faso
|
...19
|
|
II.9.5 Indications de quelques antipaludiques pendant la
grossesse
|
.. 20
|
|
II.9.6. Les traitements préventifs intermittents
|
.21
|
|
11.10. Revue documentaire
|
22
|
|
111] OBJECT1FS
|
24
|
|
111.1. Objectif general
|
. 24
|
|
111.2. Objectifs specifiques
|
24
|
|
IV].METHODOLO GIE
|
25
|
|
IV.1. Cadre de l'étude ..
|
25
|
|
IV.1.1. Le Burkina Faso
|
25
|
|
IV.1.2. Le district sanitaire de Boussé
|
.26
|
|
IV.1.3. Le CMA de Boussé
|
27
|
|
IV.1.4. Le CNRFP ..
|
27
|
|
IV.2. Type et période de l'étude
|
28
|
|
IV.2.1. Type d'étude
|
. 28
|
|
IV.3. Population de l'étude
|
28
|
|
IV.3.1. Les critères d'inclusion
|
28
|
|
IV.3.2. Les critères d'exclusion
|
28
|
|
IV.3.3. Les schémas thérapeutiques
|
.29
|
|
IV.4. Echantillonnage et taille de l'échantillon
|
29
|
|
IV.4.1. Type d'échantillonnage
|
..29
|
|
IV.4.2. Taille de l'échantillon
|
29
|
|
IV.5. La collecte des données
|
.30
|
|
IV.5.1. La collecte des données cliniques
|
......30
|
|
IV.5.4. La collecte des données para cliniques
|
30
|
|
IV.6. Quelques définitions opérationnelles
|
32
|
|
IV.7. Considérations éthiques
|
..32
|
|
IV.8. Méthodes de traitement et d'analyse des
données
|
32
|
|
V] RESULTATS
|
34
|
|
V.1.Distribution des femmes de l'étude au cours du
suivi
|
.. .34
|
V.2. Caractéristiques sociodémographiques,
cliniques et paracliniques des femmes D
|
l'inclusion
|
36
|
|
V.2.1. L'âge des femmes
|
...36
|
|
V.2.2. L'ethnie des femmes
|
....36
|
|
V.2.3. La gravidité
|
36
|
|
V.2.4. La possession de moustiquaires imprégnées
d'insecticides
|
37
|
|
V.2.5. Prévalence de l'infection palustre....
|
..38
|
|
V.2.6. Prévalence de l'anémie maternelle
|
...40
|
|
V.3. L'impact du type de chimioprophylaxie sur
l'infection palustre ..
|
..41
|
|
V.3.1. Ala deuxième CPN
|
41
|
|
V.3.2. A la troisième CPN
|
.43
|
|
V.3.3. Evolution de la prévalence de l'infection
périphérique au cours du suivi
|
44
|
|
V.4. L'impact du type de chimioprophylaxie sur
l'anémie maternelle
|
45
|
|
V.4.1. Ala deuxième CPN
|
.45
|
|
V.4.2. A la troisième CPN
|
....47
|
|
V.4.3. Evolution de la prévalence de l'anémie au
cours du suivi
|
48
|
|
V.4.4. Le gain d'hémoglobine au cours du suivi
|
49
|
|
VI] DISCUSSION
|
51
|
|
VI. 1. Limites de la methodologie
|
51
|
VI.1.1. L'échantillonnage ..51
VI.1.2. Les critères d'exclusion 51
VI.1.3. L'administration des médicaments .51
VI.2. Caracteristiques de l'echantillon a l'inclusion
. .51
VI.2.1. L'indice plasmodique à l'inclusion .. 51
VI.2.2. L'anémie à l'inclusion 52
VI.4. Possession de moustiquaires impregnees
53
VI.2. L'efficacite des differents types de
chimioprophylaEie...... 53
VI.2.1. Impact sur l'infection périphérique 53
VI.2.2. Impact sur l'anémie maternelle ..54
CONCLUSION. 56
RECOMMANDATIONS 57
BIBLIO GRAPHIE 58
ANNEXES ..65
TABLEAUX ET FIGURES
Liste des tableaux.
Tableau I. Caractéristiques des femmes à
l'inclusion
Tableau II. Infection périphérique maternelle selon
la gravidité à la 1ère CPN Tableau III.
Anémie maternelle selon la gravidité à la première
CPN
Tableau IV. Infection périphérique maternelle
selon la gravidité à la 2ème CPN Tableau V.
Infection périphérique maternelle selon la gravidité
à la 3ème CPN Tableau VI. Anémie maternelle
selon la gravidité à la deuxième CPN
Tableau VII. Anémie maternelle selon la gravidité
à la troisième CPN Listes des figures.
Figure 1: Distribution du paludisme dans le monde
Figure 2 : Cycle biologique du Plasmodium
Figure 3 : Manifestation du paludisme pendant la grossesse
Figure 4: Périodes recommandées par l'OMS pour
l'administration des traitements préventifs intermittents au cours de la
grossesse
Figure 5 : Zones de transmission du paludisme au Burkina
Figure 6 : Répartition des femmes selon le groupe de
traitement et le nombre de consultations prénatales
Figure 7 : Répartition des femmes de l'étude selon
la gravidité
Figure 8 : Evolution de la prévalence de l'infection
périphérique maternelle au cours du suivi Figure 9 : Evolution de
la prévalence de l'anémie au cours du suivi
Figure 10 : Gain en hémoglobine par groupe de traitement
au cours du suivi
REMERCIEMENTS
L'auteur voudrait avant tout remercier :
Au service de maternité du CHU-YALGADO
OUEDRAOGO
Professeur AKOTION GA Michel qui a
accepté de diriger ce travail.
Docteur OUATTARA Tiémoko qui a
accepté de lire notre travail et de nous prodiguer de précieux
conseils.
Au Centre National de Recherche et de Formation sur
le Paludisme (CNRFP) Docteur SIRIMA Sodiomon qui a accepté
de nous confier ce travail et aussi de le codiriger.
Docteur KONATE T. Amadou qui nous à
toujours guidé dans la conception de notre travail et qui nous a sans
cesse prodigué des conseils qui ont été pour nous d'un
grand enseignement.
Docteur OUEDRAO GO Alphonse qui nous a beaucoup
aidé tant dans notre apprentissage que dans la vie.
Docteur BOU GOUMA Edith qui nous a
conseillé et facilité notre séjour de stagiaire au
CNRFP.
Aux Docteurs SAGNON N'Falé, NEBIE Issa, TIONO
Alfred, GANSANE Adama, SOULAMA Issiaka, BADOLO Athanase, YARO
Jean-Baptiste.
Aux Messieurs DIARRA Amidou, OUEDRAO GO Amidou,
OUEDRAO GO André Lin, SANKARA Amadou, ZOUN GRANA Benoit, KOUTIEBOU
Roland, a Madame CONVELBO Nathalie et à Mademoiselle
BADOLO Marie Claire.
Au district sanitaire de BOUSSE
A tout le personnel du district sanitaire et en particulier au
personnel de la Maternité du CMA de Boussé.
LEXIQUE
M = pour cent
ADN= Acide Désoxyribo Nucléique
CIVD= Coagulation Intra-Vasculaire
Disséminée Cm= centimètre
CM= Centre Médical
CMA= Centre Médical avec Antenne
chirurgicale
CNRFP= Centre National de Recherche et de
Formation sur le Paludisme CNRST= Centre National de Recherche
Scientifique et Technologique CPN= Consultation
prénatale
CQ = Chloroquine
CQ/Hebdo= Chimioprophylaxie hebdomadaire
à la chloroquine
CREN= Centre de Récupération et
d'Education Nutritionnelle
ddl = degré de liberté
DDT=
Dichloro-diphényl-trichloro-éthane DHFr=
Dihydrofolate réductase
dL = décilitre
ET = Ecart-type
FPN= Faible Poids de Naissance
g =gramme
G6PD= Glucose 6 Phosphate
Déshydrogénase GE/FM= Goutte Epaisse/Frottis
Mince Hg= Hémoglobine
HLA= Human Leucocytes Antigen
HU= Hauteur Utérine
IP= Indice Plasmodique
Km = Kilomètre
mm = millimètre
MTI= Matériaux Traités aux
Insecticides OMS= Organisation Mondiale de la Santé
PABA= Acide para-amino-benzoïque PDV =
perdue de vue
SA= Semaine d'Aménorrhée
SIDA= Syndrome d'Immunodéficience Acquise
SMI= Santé Maternelle et Infantile
SP = Sulfadoxine-Pyriméthamine
TDR = Training in Tropical Disease
TNF= Tumor Necrosis Factor
TPI = Traitement Préventif
Intermittent
TPI/CQ= Traitement Préventif Intermittent
à la Chloroquine
TPI/SP= Traitement Préventif Intermittent
à la Sulfadoxine-Pyriméthamine
Vs = Versus
vii
INTRODUCTION
Le paludisme est une maladie parasitaire connue et
décrite depuis l'antiquité. Il semble avoir été un
fléau de tous les temps. Avant 1630, le paludisme était
déjà connu comme une maladie liée à l'environnement
et appelé "fièvre des marécages". C'est aujourd'hui la
première maladie parasitaire dans le monde avec 300 à 500
millions de cas chaque année. Il est causé par le
Plasmodium qui est un endoparasite à parasitisme
obligatoire permanent, transmis à l'homme lors de la piqûre de
l'anophèle femelle.
En dépit des efforts énormes consentis dans la
lutte contre cette maladie dans le monde et surtout dans les pays tropicaux, le
paludisme reste un des plus grands problèmes de santé publique en
ce début du troisième millénaire. Cette parasitose
sévit préférentiellement dans la zone inter-tropicale
(figure 1). De ce fait, elle touche des pays en développement où
l'ignorance et la pauvreté des populations rendent difficile la lutte
pour son contrôle. La maladie est endémique dans la plupart des
pays tropicaux d'Afrique, d'Asie et d'Amérique, et menace 43% de la
population mondiale qui y vit [58]. Parmi les groupes à risques du
paludisme dans les zones endémiques, figurent les femmes enceintes et
les enfants de moins de cinq ans.
L'Afrique sub-saharienne constitue un vaste foyer où le
paludisme sévit de façon endémique occasionnant
d'énormes conséquences socio-économiques. Le coût
direct du paludisme y a été estimé à 800 millions
de dollars US en 1987 et a dépassé un milliard 800 millions de
dollars US en 1995 [63]. Il faut ajouter à cela des dommages indirects
inestimables au niveau socio-sanitaire.
Depuis 1937, les effets néfastes du paludisme sur la
grossesse sont étudiés et décrits [65]. Dans les pays
touchés par la maladie, cinquante millions de femmes enceintes sont
exposées aux conséquences néfastes du paludisme chaque
année [54], dont environ 24 millions en Afrique [48]. Selon les
estimations en Afrique, 75 000 à 200 000 décès infantiles
par an sont attribuables à l'infection à Plasmodium
falciparum pendant la grossesse [48]. Dans les régions de forte
transmission de Plasmodium falciparum, où les femmes
adultes ont une immunité acquise considérable, l'infection peut
être peu ou pas symptomatique, mais chaque épisode infectieux
contribue à l'anémie maternelle et à la parasitémie
placentaire qui prennent une importance considérable au moment de
l'accouchement [52]. Ainsi, même si la mortalité directe est
réduite chez la femme enceinte en zone d'endémie, les
conséquences en terme de morbidité et mortalité indirecte
restent importantes par l'exposition à l'anémie. Dans ces
régions, l'impact le plus visible du paludisme sur la santé
maternelle est en effet l'anémie sévère, un important
contributeur à la mortalité maternelle [2 ; 24; 31 ; 54] par
l'aggravation des hémorragies et des infections puerpérales en
période périnatale. Des études hospitalières
récentes ont même identifié l'infection à
Plasmodium falciparum comme la principale cause indirecte de
décès maternel au Mozambique [16] et au Zimbabwe [44].
Après le constat d'échec de l'éradication du
paludisme par l'OMS en 1968, de nouveaux objectifs ont été
redéfinis dans le cadre de la lutte contre la maladie:
- la prise en charge des cas, par le diagnostic et la prise en
charge précoce,
- la lutte anti-vectorielle par des méthodes simples
individuelles et collectives
- la prévention et le contrôle des
épidémies.
S'agissant de la prévention médicamenteuse, elle
est de nos jours essentiellement recommandée pour les femmes enceintes
et les sujets neufs expatriés en zone d'endémie. Cette
prévention a longtemps été préconisée avec
la chloroquine (médicament autrefois efficace, peu cher et largement
disponible) en prise hebdomadaire chez la femme enceinte [30]. Cependant, face
à l'extension rapide de la chloroquino-résistance dans la plupart
des pays d'Afrique, et aux contraintes de la prise hebdomadaire, l'OMS
suggère un paquet d'interventions chez la femme enceinte menacée
de paludisme. Ce paquet d'interventions comporte les traitements
préventifs intermittents, l'utilisation de matériaux
imprégnés d'insecticides, la prise en charge des cas de paludisme
et le traitement de l'anémie [64].
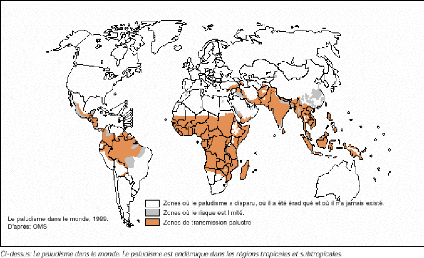
Figure 1: Distribution du paludisme dans le
monde (OMS, 1999)
PROBLEMATIQUE
Le Burkina Faso est un pays sahélien d'Afrique de
l'Ouest avec une forte endémicité palustre. Le paludisme y
sévit toute l'année avec une forte incidence en saison pluvieuse
(mai à novembre). Les populations à risque de cette maladie sont
les enfants de moins de 5 ans et les femmes enceintes.
Malgré les efforts consentis par l'Etat et les
partenaires au développement, le paludisme reste la première
cause de morbidité et de mortalité dans notre pays
particulièrement pour les groupes vulnérables sus-cités
[27].
Le paludisme de la femme enceinte au Burkina Faso est
particulièrement important et comme dans d'autres pays africains, la
politique nationale de prévention recommandait une chimioprophylaxie
à la chloroquine chez la femme enceinte afin de réduire l'impact
du paludisme dans la morbi-mortalité pendant la grossesse [30]. Cette
chimioprophylaxie se fait par administration d'une dose curative initiale, puis
par la prise hebdomadaire de 300 mg de chloroquine. Cette stratégie qui
était une recommandation de l'OMS est largement utilisée dans
notre pays. Elle est associée à l'utilisation de matériaux
traités aux insecticides (MTI) dans la prévention du paludisme
chez la femme enceinte. La prescription d'une chimioprophylaxie
s'intègre dans le paquet de prestation de routine de la consultation
prénatale où la chloroquine est gratuite.
Malgré cette stratégie, il persiste une forte
morbidité palustre pendant la grossesse comme le montrent les
résultats suivants : 29,3 % d'infection du sang maternel
périphérique, 22 % d'infection placentaire et 76,2 %
d'anémie maternelle dans le district sanitaire de Koupéla en 2001
[51]. Cette situation s'explique essentiellement par le niveau actuel de
résistance à la chloroquine et les problèmes d'observance
de ces longs traitements en prise hebdomadaire [51].
Depuis quelques années, l'utilisation de la
sulfadoxine-pyriméthamine en traitement préventif intermittent
pendant la grossesse a été initiée dans certains pays
d'Afrique de l'Est comme une alternative à la chimloprophylaxie
hebdomadaire dans la prévention du paludisme chez la femme enceinte.
Face aux premiers résultats encourageants obtenus avec ce protocole [40
; 46 ; 48], l'OMS recommande le TPI à la SP dans les pays africains
où la chloroquinorésistance est élevée. Cependant,
l'inobservance liée à la contrainte de la prise hebdomadaire de
la chloroquine dans la chimioprophylaxie hebdomadaire suggère
l'utilisation de la chloroquine en TPI. Cela permettra d'éviter le
problème d'observance et évaluer ainsi la part de la
chloroquinorésistance dans l'échec de cette stratégie.
C'est dans ce contexte de transition que nous nous sommes
proposé d'évaluer l'efficacité de différents
protocoles de prophylaxie antipalustres chez la femme enceinte afin d'orienter
le choix d'un schéma adapté à la situation de notre
pays.
Nous avons comparé entre eux la chimioprophylaxie
hebdomadaire à la CQ, le traitement préventif intermittent
à la CQ et le traitement préventif intermittent à la
SP.
ENERALITE ET REVUE DE LA LITTERATURE
II.1. FARDEAU DU PALUDISME AU BURKINA FASO
II.1.1 Le paludisme au Burkina Faso
Au Burkina Faso, le paludisme est la première cause de
morbidité et de mortalité [28]. Le paludisme représentait
33,2% de l'ensemble des diagnostics posés en consultations
médicales en 2003 et est incriminé dans 43,87% de l'ensemble des
décès enregistrés dans les formations sanitaires [28].
Environ 74% des décès surviennent chez des enfants
âgés de moins de 5 ans [30]. Ainsi le paludisme est une maladie
qui entrave sérieusement le développement humain durable. Son
impact négatif porte sur la productivité économique,
l'éducation des enfants, l'espérance de vie, l'épargne
familiale et nationale. Son impact chez les femmes enceintes est
considérable entraînant surtout l'anémie et des faibles
poids de naissance. Une étude réalisée en période
de saison sèche (saison de faible transmission) dans le district
sanitaire de Houndé a montré que 21,8% des femmes étaient
infestées à leur première CPN en 2003 [57]. En 2001,
Sirima et al. dans le district sanitaire de Koupéla ont
retrouvé en période de haute transmission 29,2% de
parasitémie paludéenne et 76,2% d'anémie maternelle chez
la femme enceinte [51].
II.1.2 Le paludisme dans le district sanitaire de
Bousse
Le district sanitaire de Boussé dont les limites sont
celles du Kourwéogo, province frontalière du Boulkiemdé,
province où est apparue pour la première fois la
résistance du parasite à la chloroquine au Burkina [3]. Au plan
socio-sanitaire, les deux localités sont comparables et appartiennent au
même faciès épidemiologique. La ville de Boussé,
cadre de la collecte de nos données est située à 35 Km de
la ville de Nanoro où le taux d'échec thérapeutique global
à la chloroquine était de 63,3% et le taux d'échec
thérapeutique global à la SP était de 10% [66].
II.2 LES AGENTS PATHO GENES DU PALUDISME
II.2.1 Systematique des plasmodies
Les plasmodies sont des protozoaires de l'embranchement
des Sporo~oaires, de la classe des Coccidiae,
de la sous-classe des Hemato~oe, de l'ordre des
Haemosporididae, de la famille des Plasmodiidae et du
genre Plasmodium. A ce jour, quatre espèces
plasmodiales pathogènes pour l'homme ont été
identifiées. Ce sont: Plasmodium malariae, P. vivax, P.
falciparum et P. ovale. Les quatre espèces de
Plasmodium sont différemment reparties dans l'espace
intertropicale. Mais P. falciparum, l'espèce la plus
pathogène, puisque potentiellement mortelle, est la plus rependue et est
prédominante en Afrique sub-saharienne [5 ; 14].
II.2.2 Le cycle biologique des plasmodies
Le cycle biologique du parasite s'effectue chez l'homme qui
est son hôte intermédiaire, et chez le moustique qui est son
hôte définitif. Sa multiplication chez l'homme est asexuée
tandis que chez le moustique, elle est sexuée. La biologie des
plasmodies est importante et explique l'épidémiologie, la
clinique, le diagnostic et le traitement du paludisme.
11.2.2.1 Le cycle du Plasmodium che~ l~homme
C'est la schizogonie ou cycle asexué.
II.2.2.1.1 Le cycle intra h!patique
Lors de son repas sanguin chez l'Homme, l'anophèle
femelle infecté injecte en même temps que sa salive, des formes
plasmodiales appelées sporozoïtes. En 40 minutes, ces
sporozoïtes atteignent le foie où ils colonisent les
hépatocytes et deviennent des trophozoïtes. Ces trophozoïtes
vont se multiplier par schizogonie pour donner des schizontes. Les schizontes
mûrs appelés corps bleus renferment 10 000 à 30 000
mérozoïtes qui sont libérés dans le sang après
éclatement des hépatocytes. Le cycle intra-hépatique dure
de 7 à 8 jours.
II.2.2.1.3 Le cycle sanguin
Après éclatement des schizontes
hépatiques, les mérozoïtes liberés arrivent dans le
sang et pénètrent dans les érythrocytes au bout de
quelques minutes. Ils prennent alors une forme en anneau de 1 à 2 lam
appelées trophozoïtes sanguins. Ces trophozoïtes se
nourrissent de l'hémoglobine érythrocytaire et produisent des
pigments appelés l'hémozoïne. Les noyaux des
trophozoïtes se multiplient pour donner des schizontes sanguins. Les
schizontes mûres ont entre 8 et 32 mérozoïtes selon
l'espèce plasmodiale et constituent des rosaces. La durée de
maturation du trophozoïte sanguin est de 48 heures pour Plasmodium
falciparum. Après l'éclatement des rosaces, les
mérozoïtes pénètrent dans de nouveaux globules rouges
et recommencent un nouveau cycle érythrocytaire. Cependant, après
un certain nombre de cycles érythrocytaires, il apparaît des
formes sexuées qui sont les gamétocytes uninuclées qui
permettront la poursuite du cycle sexué chez le moustique.
11.2.2.2 Le cycle du Plasmodium che~ le moustique
C'est la sporogonie ou cycle sexué. Il s'effectue chez
les femelles de certaines espèces d'anophèles de la sous-famille
des A nophelines. Lors de son repas sanguin par piqûre
d'Homme contaminé, l'anophèle absorbe toutes les formes
parasitaires du Plasmodium qui seront digérées,
sauf les gamétocytes.
Dans l'estomac de l'insecte, 8 à 10 gamètes
apparaissent après exflagellation d'un gamétocyte mâle. Le
gamète femelle apparaît après expulsion d'un corpuscule
chromatinien du gamétocyte femelle.
La fécondation entre les 2 gamètes femelle et
mâle donne un oeuf mobile appelé ookinète. Ce dernier
quitte rapidement la paroi de l'estomac du moustique, traverse la membrane
péritrophique, passe entre les cellules de la paroi stomacale, et se
retrouve à la face externe sous la membrane séreuse. Il se
transforme en oocyste dans lequel s'individualisent les sporozoïtes.
Les sporozoïtes liberés après
éclatement de l'oocyste, gagnent les glandes salivaires d'où ils
sont expulsés lors d'un nouveau repas sanguin du moustique.
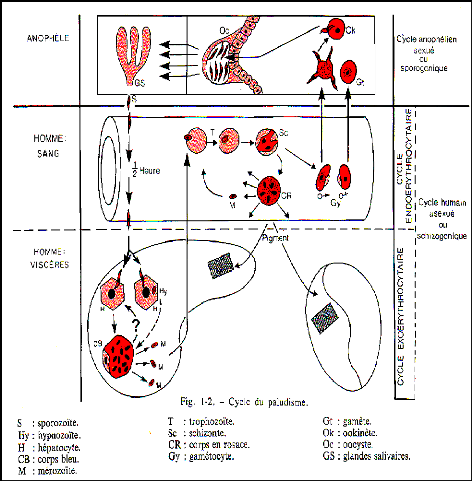
Figure 2 : Cycle biologique du Plasmodium
[14]
11.2.3 Les vecteurs du paludisme
Environ 400 espèces de moustiques ont été
décrites avec environ 20 qui jouent un rôle vecteur dans le
paludisme. Les plus importants en Afrique tropicale sont: Anopheles
gambiae, Anopheles arabiensis, Anopheles funestus, Anopheles moucheti,
Anopheles nili.
Le développement de l'anophèle se fait en 2
phases successives. La première phase est aquatique et regroupe les
phases pré-imaginaux (oeufs, larves, nymphes) et la deuxième
phase est une phase aérienne ou phase imago (adulte).
II.3.PHYSIOPATHOLO GIE DU PALUDISME
La symptomatologie du paludisme est liée directement ou
indirectement à la schizogonie érythrocytaire alors que la
schizogonie hépatique est asymptomatique. Les manifestations cliniques
du paludisme sont polymorphes et témoignent d'une physiopathologie
complexe et diversifiée. Tous les mécanismes des
différents symptômes ne sont pas totalement connus à ce
jour. Si certains mécanismes sont bien élucidés, d'autres
sont actuellement au stade d'hypothèses.
II.3.1 Pathogénie de quelques symptômes
palustres
La fievre
Elle est due principalement à l'éclatement des
rosaces pendant la schizogonie érythrocytaire. En effet,
l'éclatement des rosaces va libérer dans la circulation sanguine
l'hémozoïne qui est un pigment malarique pyrogène. La
synchronisation de l'éclatement des rosaces détermine le
caractère intermittent de la fièvre paludéenne. Comme la
durée de la maturation du trophozoïte aboutissant à la
libération de nouveaux mérozoïtes est de 48 heures pour
Plasmodiumfalciparum, la fièvre se produit avec un
intervalle libre de 2 jours.
En plus de l'hémozoïne, le TNF (facteur de
nécrose tissulaire), une cytokine secrétée par l'organisme
en réaction au paludisme joue un rôle secondaire dans la
genèse de la fièvre. En général, la fièvre
est inaugurée par des frissons et suivie de sueurs profuses au moment de
la défervescence thermique.
L'anémie
L'anémie est fréquemment rencontrée dans
le paludisme à Plasmodiumfalciparum. Dans le sang,
jusqu'à 10% des globules rouges peuvent être parasités par
des trophozoïtes érythrocytaires qui se nourrissent de
l'hémoglobine et entraînent l'éclatement des
érythrocytes. La destruction importante des globules rouges
entraîne une anémie de type hémolytique.
L'hémoglobinurie
Elle est la conséquence de l'excrétion des
métabolites de l'hémoglobine dans les urines. Elle est
relativement rare et s'accompagne généralement d'une
anémie sévère.
L'acidose
Elle est probablement due à l'anoxie tissulaire avec
utilisation de voies métaboliques anoxiques générant de
l'acide lactique. Cette acidose métabolique, si elle est importante, se
traduit par une respiration profonde de type Kussmaül et par une odeur
aigrelette de l'haleine.
L'hypoglycemie
L'hypoglycémie serait due à une diminution de la
néoglucogenèse hépatique ou résulterait d'une
consommation exagérée de glucose par les plasmodies mûres.
Cette hypoglycémie peut être aggravée par le traitement
à la quinine.
L'hypoglycémie est essentiellement un signe biologique,
mais peut s'exprimer par des troubles du comportement, des pertes de
connaissance, des convulsions, de la transpiration, etc.
L'insuffisance rénale
C'est le résultat d'une nécrose tubulaire
aiguë. Elle est réversible et se traduit par une oligurie
inférieure à 0,3 ml/kg/heure. Elle est favorisée par le
collapsus et l'hypotension. Des oedèmes et/ou un hoquet
caractérisent un stade avancé d'insuffisance rénale.
L'ictere
C'est un ictère hémolytique avec
prédominance de bilirubine non conjuguée issue de la
transformation de l'hémoglobine dégradée en bilirubine
colorant les téguments.
Les hemorragies diffuses
Elles sont dues à des troubles de la crase sanguine par
hypercatabolisme du fibrinogène ou par coagulation intra-vasculaire
disséminée (CIVD) avec coagulopathie de consommation.
Les alterations de la conscience et autres manifestations
neurologiques
Elles sont dues à une anoxie de l'encéphale
produite par 3 mécanismes impliquant l'anémie, la
cytotoxicité et la défaillance circulatoire.
Le collapsus cardiovasculaire
Il est le résultat de la déshydratation, de la
défaillance cardiaque anémique ou des troubles neurologiques
centraux.
11.3.2 Facteurs influencant l'evolution naturelle du
paludisme chez l'homme
Plusieurs facteurs peuvent influencer les manifestations
cliniques et la gravité du paludisme chez l'Homme. Certains facteurs
jouent un rôle négatif tandis que d'autres jouent un rôle
positif dans l'évolution du paludisme vers les formes graves.
11.3.2.1 Lesfacteurs de gravité
n L'espèce Plasmodium falciparum est la
seule capable de générer des formes graves du paludisme. Elle est
aussi en cause dans des formes bénignes surtout en zone
d'endémie.
n Certaines souches de Plasmodium falciparum
seraient plus virulentes que d'autres.
n Le statut immunitaire défavorable du patient. Les
enfants de 6 mois à 5 ans en zone d'endémie, les personnes en
zone de transmission instable et les sujets neufs sont exposés aux
formes graves du paludisme du fait d'une immunité de prémunition
absente ou insuffisante.
n L'utilisation répétée des antipaludiques
efficaces, en prophylaxie ou en traitement curatif prolongé, expose au
paludisme grave.
n L'ampleur de la réaction de l'organisme (c'est à
dire son niveau élevé de production de TNF) conditionnerait la
survenue des formes graves.
11.3.2.2. Lesfacteurs de protection
n L'antigène Duffy favorise l'invasion du globule
rouge par les mérozoïtes de Plasmodium vivax.
L'absence de cet antigène protège les individus de race noire du
paludisme à P. vivax.
n Certaines hémoglobinopathies (drépanocytose S,
C, E, F, la â thalassémie et l'ovalocytose) confèrent une
relative protection vis à vis du paludisme [39].
n Le déficit en G6PD confère aussi une relative
protection.
n Certains antigènes HLA confèreraient une
relative protection contre Plasmodium
falciparum.
n La résidence en zone d'endémie à forte
transmission palustre confère une immunité acquise
protégeant les individus des formes graves du paludisme. Cette
immunité explique le portage asymptomatique en zone d'endémie.
C'est une immunité humorale par Ig G circulantes et cellulaire par
action de macrophages et de lymphocytes T dans la rate. Les anticorps Ig G
traversent la barrière placentaire et confèrent une protection au
nouveau-né et au nourrisson jusqu'à 6 mois.
11.4 MAN1FESTAT1ONS CL1N1QUES DU PALUD1SME
11.4.1 Paludisme simple
C'est la forme bénigne de la maladie
caractérisée par l'absence de signes de gravité. Le cas de
paludisme simple se définit comme une sensation de malaise suivie de
fièvre, la fièvre étant l'élément cardinal.
Ce signe caractéristique peut s'accompagner de:
n céphalées;
n frissons;
n fortes transpirations ;
n nausées et même vomissement ;
n une forme légère de diarrhée ;
n anorexie ;
n douleurs articulaires et musculaires ;
n ou d'autres symptômes mineurs.
Le paludisme simple peut guérir ou évoluer vers des
formes graves.
11.4.2 Le paludisme grave
Le paludisme grave est presque toujours le fait de
Plasmodium falciparum. Selon l'OMS [64], un patient est atteint de
paludisme grave s'il présente une goutte épaisse positive
à Plasmodium falciparum
(formes asexuées) associée à l'une des manifestations
suivantes:
- changement de comportement, prostration ou somnolence,
- altération de la conscience ou coma,
- hypoglycémie,
- acidose,
- détresse respiratoire ou oedème pulmonaire,
- oligurie ou insuffisance rénale aiguë,
- anémie sévère (hématocrite
inférieur à 20%, Hg inférieure à 6g/dL ou
inférieure à 8g/dL chez la femme enceinte),
- collapsus cardio-vasculaire ou choc,
- hémoglobinurie,
- ictère,
- hémorragies diffuses,
- hyperpyrexie supérieure ou égale à
41°Celsius,
- parasitémie supérieure ou égale à
5%.
II.5 IMMUNOLO GIE DU PALUDISME PENDANT LA
GROSSESSE
Le paludisme pendant la grossesse est associé à
des modifications de différents paramètres biologiques et
immunologiques: influence des cytokines (défenses de type Th2
(prémunition) plus que Th1 (réponse initiale), intervention
d'hormones stéroïdes placentaires immunosuppressives, influence de
différentes protéines comme HCG, alpha foetoprotéine, etc.
La gravité du paludisme chez la femme enceinte est fonction de la
parité et porte surtout sur les premières grossesses (en
particulier les primigestes du fait de la naïveté immunologique).
Au cours des grossesses ultérieures, les défenses placentaires
garderont mémoire des premières attaques parasitaires
protégeant partiellement les multipares. L'augmentation de la
densité parasitaire dans le sang et le placenta secondaire à
cette immunomodulation est associée à l'anémie de la
mère, à la prématurité et surtout aux faibles poids
de naissance.
II.6 IMPACT DU PALUDISME SUR LA GROSSESSE
Le paludisme est une maladie dont les conséquences sur
la grossesse sont importantes. Outre la morbidité des mères, il y
a la souffrance de l'oeuf qui peut aboutir à sa mort. Du 1er
au 4ème mois de la grossesse, on a une accentuation des
phénomènes d'intolérance gastrique et une aggravation des
autres signes sympathiques de la grossesse. En plus, l'anémie survient
plus facilement induisant un déséquilibre humoral, qui lorsqu'il
s'ajoute à l'impaludation du foetus, entraîne l'avortement ou la
mort in utero [61]
Le paludisme, du fait de l'hyperthermie, induit des menaces
d'avortement, des avortements spontanés et des accouchements
prématurés. La colonisation du placenta par les trophozoïtes
entraîne son altération structurelle et fonctionnelle
entraînant une souffrance foetale, l'avortement ou parfois la
mort in utero.
Du 4ème au 9ème mois, on
peut avoir un retard de croissance intra-utérin avec un faible poids de
naissance à l'accouchement. Une infestation du foetus conduit au risque
de naissance prématurée ou à terme la naissance d'un
nouveau-né porteur de paludisme congénital.
Il y a également le risque d'accouchement dans un
contexte d'asthénie et d'anémie chez la femme enceinte avec un
risque important de:
- choc sévère par hémorragie au moment de
l'accouchement,
' infections puerpérales en suites de couche,
- thrombophlébite et embolies en post-partum.
II.7 IMPACT DE LA GROSSESSE SUR LE PALUDISME
La grossesse amène une modification de la circulation
abdominale à cause du volume de l'utérus et de la constitution de
l'anévrysme placentaire, pouvant retentir sur la circulation
splénique et favoriser l'essaimage des hématozoaires
séquestrés dans la rate. Ce phénomène a pour
conséquences une augmentation de la fréquence des épisodes
de paludisme et l'entretien de l'anémie par hémolyse.
La grossesse favorise la reviviscence des schizontes,
augmentant la fréquence des formes graves du paludisme chez les femmes
en zone de faible transmission, ainsi que des anémies importantes
[61].
En zone de forte transmission du paludisme, l'infection
à Plasmodium falciparum entraîne une
séquestration placentaire du parasite qui peut persister même en
l'absence de parasitémie périphérique. En l'absence de
traitement, une infection acquise au début de la grossesse persiste dans
le placenta tout au long de la grossesse. Les conséquences de cette
situation sont l'anémie maternelle et le faible poids de naissance,
surtout chez les primigestes [20 ; 57].
La grossesse modifie aussi la symptomatologie du paludisme en
accentuant les vomissements, la déshydratation et l'amaigrissement
surtout au premier trimestre de la grossesse (Figure 3).
L'infection par Plasmodium falciparum pendant
la gossesse



Zone de haute transmission Zone de faible
transmission
L'infection sans symptômes Formes symptomatiques
(fievre)
L'infection placentaire Risque d'accouchement
premature
L'anemie Transport des nutriments
Faible poids de naissance
Risque de mortalite infantile.
Figure 3 : Manifestations du paludisme pendant la
grossesse
11.8 LA LUTTE CONTRE LE PALUD1SME
La lutte antipaludique est l'ensemble des mesures
destinées à supprimer, ou tout au moins à réduire,
la mortalité et la morbidité due au paludisme [62].
Dans les zones où la transmission du paludisme est
intense, les activités de lutte ont pour but de réduire la
transmission, de freiner la mortalité évitable et de soulager la
souffrance des individus infectés. Elles comportent des mesures
préventives et des mesures curatives basées sur la
chimiothérapie. On peut schématiser les méthodes de lutte
antipaludique en 2 volets: la lutte anti-plasmodique et la lutte
anti-vectorielle.
11.8.1 La lutte contre les vecteurs
La lutte contre les vecteurs comporte la lutte contre les larves
et la lutte contre les adultes de moustiques.
11.8.1.1 La lutte contre les larves de moustiques
La lutte conte les larves comporte plusieurs stratégies
:
- L'aménagement de l'environnement
C'est avant tout la destruction des gîtes larvaires qui
doit se faire aux alentours des habitations sur un périmètre dont
le rayon est supérieur à la distance de vol des moustiques (1,5
à 2 km) [43].
- La lutte biologique
Elle se fait par l'introduction de poissons larvivores dans
les retenues d'eau ou l'infestation des gîtes par des bactéries
entomopathogènes. Ces techniques sont onéreuses et
décevantes quant aux résultats d'ensemble.
- L'épandage de larvicides Consiste à mettre dans
les gîtes larvaires des produits chimiques qui détruisent les
larves.
11.8.1.2. La lutte co ntre les adultes de
moustiques
Elle consiste au traitement intra domiciliaire par des
insecticides (DDT, dieldrine, etc.) ou par des serpentins fumigènes.
11.8.1.3. La reduction du contact homme- vecteur
Les mesures de protection individuelle sont
représentées par des moustiquaires et rideaux simples ou
traités aux insecticides, l'utilisation de crèmes
répulsives, etc.
Les mesures de protection collectives sont
représentées par les rideaux simples ou imprégnés
d'insecticides, les grillages de protection des fenêtres, les bombes
insecticides, serpentins fumigènes, etc.
11.8.2 La lutte contre le parasite
La lutte contre le parasite comporte essentiellement 3 volets :
le traitement curatif, la prophylaxie médicamenteuse et les vaccins
antipaludéens.
- Le traitement curatif
Le traitement du paludisme par la quinine était connu
depuis longtemps, mais l'essor des traitements s'est fait avec la
découverte des antipaludiques de synthèse pendant la
deuxième guerre mondiale. Actuellement, il y a un très grand
nombre de médicaments antipaludiques sur le marché. Si les
anciens médicaments sont généralement peu coûteux,
les nouveaux antipaludiques sont financièrement inaccessibles à
la majorité des populations africaines.
- La prophylaxie médicamenteuse
La prophylaxie médicamenteuse antipalustre est la
prévention de l'infection paludéenne par la prise
régulière de médicaments antipalustres ou par le
traitement préventif intermittent. Pratiquée de façon
extensive par le passé, elle est maintenant restreinte aux femmes
enceintes, aux sujets neufs expatriés en zone d'endémie et
à tout sujet en zone de transmission instable.
- Les vaccins antipaludéens Les vaccins sont encore du
domaine de la recherche.
11.9 LES MED1CAMENTS ANT1PALUD1QUES.
11.9.1 Historique des antipaludiques
Les indiens du Pérou connaissaient depuis longtemps les
vertus curatives des écorces de quinquina contre les fièvres des
marais. Mais ce n'est qu'en 1820 que Pelletier et Caventou isolent
l'alcaloïde actif du quinquina: la quinine. En 1830, Maillot utilisera la
quinine en Algérie. Pendant la deuxième guerre mondiale, la
chloroquine a été découverte et sera mise sur le
marché en 1947 [18]. Depuis, de nombreux autres antipaludiques ont
été découverts ou synthétisés, multipliant
la gamme des antipaludiques disponibles.
II.9.2 Classification des antipaludiques [4]
A.LES SCHIZONTICIDES
Groupe I: Action rapide, resistance
longue et dif~icile a apparaftre
1. La Quinine-------------------->
Naturel
2.
Les amino-4-quinoleïnes
- Chloroquine
- Amodiaquine
Lysosomotropes Synthèse
3. Les 4-quinoleïne-méthanols
-Méfloquine
-Halofantrine.
4. Quinghaosou (artémisinine) >
Naturel
roupe II: Action lente, resistance rapide et
aisée a apparaftre
1. Les antifoliques
' Les sulfones
' Les sulfamides.
Anti-mitamitabolites 2. Les
antifoliniques. Synthèse
' Les biguanides
- Diaminopyrimidines
B.LES GAMETOCIDES
Les
amino-8-quinoleines------------------------------------------------>
Synthèse
Il faut noter que quelques molécules connues comme
antibiotiques se sont révélées avoir des
propriétés antipaludiques. Ce sont: la clindamycine,
l'azythromycine, la tétracycline, la doxycycline, etc. [35 ; 37]
11.9.3. Pharmacologie de quelques antipaludiques
II .9.3.1. Les schi~o nticides
- La quinine
C'est un alcaloïde naturel contenu dans l'écorce
du quinquina (Cinchona o~~icinalis, C. calisaya, C.
succirubia,) [23]. Elle exerce une action schizonticide sanguine
rapide sur toutes les espèces plasmodiales, par action sur l'ADN
parasitaire. Elle n'a pas d'activité sur les formes
hépatiques.
La quinine constitue la molécule de
référence dans le traitement des formes graves du paludisme du
fait de sa rapidité d'action et de la quasi-absence de
résistances.
Aux doses thérapeutiques, la quinine n'est pas
contre-indiquée pendant la grossesse ou pendant l'allaitement. Elle
traverse la barrière placentaire.
La quinine existe sous formes orales, intraveineuses et
rectales. Elle possède un faible effet antipyrétique et
analgésique.
Sur l'utérus gravide, la quinine provoque des
contractions utérines à des doses toxiques entraînant
l'avortement. Aux doses thérapeutiques, la quinine est sans danger pour
la grossesse. Les doses thérapeutiques sont de 20 mg/kg en dose de
charge et 10 mg/kg toutes les 8 heures chez l'adulte et toutes les 12 heures
chez l'enfant.
- Les amino-4-quinoleines
Elles sont représentées par la chloroquine et
l'amodiaquine. Ce sont les médicaments les plus utilisés dans le
traitement de l'accès palustre. La chloroquine est utilisée dans
la chimioprophylaxie du paludisme chez la femme enceinte, alors que
l'amodiaquine n'est recommandée que dans le TPI [35].
Prise par voie orale, l'absorption est rapide, mais la
concentration plasmatique est variable d'un sujet à l'autre. Les
amino-4-quinoleines sont aspirées par le trophozoïte
intraérythrocytaire chez lesquelles elles se concentrent dans les
vacuoles nutritives et bloquent le métabolisme du parasite. Elles
complexent aussi l'hémozoïne, entraînant la lyse
parasitaire.
Les amino-4-quinoleines traversent la barrière
placentaire.
Dans le traitement du paludisme simple, la chloroquine et
l'amodiaquine sont utilisées à la dose de 25 mg/kg repartis en 3
jours.
Aux doses thérapeutiques, on ne connaît pas
d'effets abortifs ou tératogènes liés à la
chloroquine. En chimioprophylaxie chez la femme enceinte, elle est
utilisée à la dose de 300 mg/kg par semaine. L'amodiaquine peut
être utilisée en TPI par administration de 3 doses curatives au
cours de la grossesse [37].
- Les 4 quinoleines méthanols
Elles sont représentées par la
méfloquine et l'halofantrine. Elles ont le même mécanisme
d'action que les amino-4-quinoleines, mais restent actives sur les souches
résistantes à la chloroquine. La méfloquine peut
être utilisée en chimioprophylaxie à raison de 5 mg/kg par
semaine, mais reste le traitement des accès simples à souches
résistantes à la chloroquine. Des doutes ont été
émis quant à l'innocuité de la méfloquine pendant
la grossesse. Même si son
utilisation pendant la grossesse reste
déconseillée, des études récentes ne semblent pas
confirmer les craintes initiales. Quant à l'halofantrine, elle est
embryotoxique [37].
- Les derives de l~artemisinine
L'artémisinine est extraite d'une plante de la
médecine traditionnelle chinoise connue sous le nom d'armoise douce ou
quinghaosou (Artemisia annua). La dihydroartémisinine
(DHA) est son seul dérivé actif et possède une puissante
activité schizonticide sur les gamétocytes matures infectieux et
jeunes non infectieux. Elle est indiquée dans le traitement du paludisme
simple et grave. Pour l'instant son utilisation n'est pas conseillée
pendant la grossesse faute de données suffisantes. Les études
pré cliniques montrent invariablement que l'artémisinine et ses
dérivés n'ont pas d'activité mutagène ou
tératogène, mais tous ces composés ont provoqué une
résorption des foetus chez des rongeurs à des doses
élevées [37].
- Les antifoliques
Ils sont représentés par les sulfones et les
sulfamides. Ce sont des substances chimiques de synthèse intervenant
dans le métabolisme du parasite. Le parasite a besoin d'acide folinique
pour sa maturation et surtout pour la synthèse de ses acides
nucléiques. Les antifoliques bloquent l'enzyme qui transforme l'acide
para-amino-benzoïque (PABA) en acide folique. Les antifoliques ont une
action lente.
- Les antifoliniques
Ils sont représentés par les biguanides et les
diaminopyrimidines. Ce sont des médicaments de synthèse qui ont
la capacité de bloquer la Dihydrofolate-réductase, l'enzyme
assurant la transformation de l'acide folique en acide folinique. Les
antifoliniques sont des antimétabolites lents dont l'utilisation
isolée génère rapidement des résistances.
Les antifoliques et les antifoliniques sont utilisés en
association dans le traitement du paludisme, essentiellement avec l'association
de sulfadoxine-pyriméthamine.
Elles sont utilisées par voie orale et intramusculaire
dans le traitement de l'accès palustre résistant à la
chloroquine. Dans la prévention du paludisme chez la femme enceinte, la
sulfadoxine-pyriméthamine est utilisée en TPI. Du fait des effets
tératogènes possibles avant l'organogenèse, le TPI n'est
possible qu'après le premier trimestre de grossesse. Bien qu'il existe
un risque théorique d'ictère chez les prématurés
nés de mère ayant reçu des sulfamides au cours du
3ème trimestre, il ne semble pas qu'il y'ait un risque accru
d'ictère nucléaire [37 ; 48].
On pense que l'acide folique administré même
à des doses physiologiques en même temps que la
sulfadoxine-pyriméthamine peut s'opposer à l'action de la
sulfadoxine [37].
11.9.3.2. Les gamétocides
- Les amino-8-quinoleines
Elles sont représentées essentiellement par la
primaquine très active contre les gamétocytes de toutes les
espèces plasmodiales rencontrées chez l'homme ainsi que sur les
hypnozoïtes des formes à rechute. Elle peut entraîner une
anémie hémolytique aiguë chez les individus
déficients en G6PD. Elle est contre-indiquée chez la femme
enceinte en raison de l'hémolyse qu'elle peut entraîner chez le
foetus relativement déficient en G6PD en traversant la barrière
placentaire [37].
11.9.4. Situation actuelle de la resistance du Plasmodium
aux antipaludiques usuels au Burkina Faso
On entend par résistance aux antipaludiques l'aptitude
d'une souche parasitaire à survivre ou à se multiplier
malgré l'administration et l'absorption d'un médicament
donné à des doses égales ou supérieures à
celles qui sont habituellement recommandées, mais qui restent dans les
limites de tolérance du sujet [62]. Des interactions diverses entre le
médicament, le parasite et son hôte humain interviennent dans
l'apparition et la progression de la pharmacorésistance. Le mode
d'action du médicament au niveau moléculaire conditionne de
manière déterminante la vitesse à laquelle se
développe la résistance. La généralisation et
l'utilisation irrationnelle des antipaludiques contribuent à
l'apparition et la progression de la chimiorésistance [37].
L'apparition de la chimiorésistance est allée de
paire avec une augmentation de la mortalité spécifique du
paludisme sur les continents asiatique et africain. L'augmentation de la
fréquence et la gravité des épidémies est
également attribuée à la résistance aux
antipaludiques [37].
La chloroquinorésistance de Plasmodium
falciparum a été soupçonnée en
Thaïlande en 1957 et mise en évidence en Colombie en 1960. Depuis
elle s'est propagée largement à travers le monde et a atteint
l'Afrique en 1978 par le Soudan [4].
Au Burkina Faso, les premiers cas de résistance
in vitro ont été rapportés en 1983 dans la
région de Koudougou [3] tandis qu'en 1988 [17], les premiers cas de
résistances in vivo ont été
rapportés. Depuis, les taux de résistances n'ont cessé
d'augmenter. En 2003, sur des résultats d'une large étude, il y
avait 45,4% d'échecs thérapeutiques avec la chloroquine [56].
Mais la chloroquino-résistance varie sur le plan géographique et
selon la période de l'année [45 ; 56].
L'amodiaquine est généralement plus efficace que
la chloroquine, mais il existe une résistance croisée entre ces
deux molécules. En Afrique de l'Ouest, elle reste toujours efficace en
monothérapie [37]. En 1997 dans notre pays, 100% de réponses
cliniques satisfaisantes et 2,4% de résistances parasitologiques ont
été notés à Bobo-Dioulasso [66].
La sulfadoxine-pyriméthamine rencontre une forte
résistance en Asie du Sud-Est et dans le bassin de l'Amazonie. En
Afrique orientale l'échec existe dans une fourchette de 10 à 50%
dans les essais d'efficacité thérapeutique de 14 jours [37]. Au
Burkina Faso, les premiers cas de résistance in vivo ont
été rapportés en 1990 et 1991 dans la région de
Bobo-Dioulasso [1]. De 1% de résistance clinique de 1998 à 2000
dans la même région [18], le taux d'échec
thérapeutique est passé à 10% à Nanoro en 2002'2003
[55].
Pour la quinine on a noté une baisse de la
sensibilité en Asie du Sud-Est, mais cette molécule reste
très efficace sur les souches africaines de Plasmodium
falciparum. [37]. Au Burkina Faso, si une baisse de la
sensibilité à la quinine a été signalée, les
études existantes ne notent pas de résistances [10; 55].
Pour les dérivés de l'artémisinine, aucune
résistance n'a été notée jusqu'à ce jour
[37].
11.9.5. 1ndications de quelques medicaments antipaludiques
pendant la grossesse
Tous les antipaludiques ne sont pas indiqués dans le
traitement curatif ou la prévention médicamenteuse du paludisme
chez la femme enceinte.
Pour qu'un médicament soit utilisable chez la femme
enceinte, il doit prouver son innocuité pour la mère, pour le
foetus et plus tard pour le nourrisson allaité [35]. Les indications et
contre-indications de plusieurs médicaments ont évolué au
fil des ans. Actuellement, on classe en 3 groupes les médicaments
antipaludiques par rapport à leurs indications chez la femme enceinte
[35].
Medicaments generalement consider~s comme
indiques:
n chloroquine,
n quinine,
· proguanil,
n sulfonamides,
n pyriméthamine,
n dapsone
n clindamycine.
Medicaments a innocuite non confirm~e ou sans
donnees suffisantes :
n amodiaquine, chlorproguanil,
n ·
méfloquine,
n malarone,
n artémisinine
n azythromycine.
Medicaments consider~s comme contre-indiques chez la
femme enceinte :
n primaquine,
n taténoquine,
n halofantrine
n doxycycline et tétracycline.
11.9.6. Les traitements preventifs intermittents (TP1)
Les traitements préventifs intermittents constituent des
schémas prophylactiques alternatifs à la politique de
chimioprophylaxie hebdomadaire à la chloroquine pendant la grossesse.
Cette stratégie est limitée par la mauvaise compliance des femmes
au traitement et par la chloroquinorésistance de Plasmodium
falci~arum.
Le TPI consiste en l'administration d'une dose curative d'un
antipaludique efficace à intervalle prédéfinis durant la
grossesse. Les premiers traitements débutent après la fin du
premier trimestre de grossesse. Toute femme doit recevoir aux moins deux doses
de TPI dans le second et le troisième trimestre. Le TPI assure la
clairance du parasite au niveau placentaire au moment de la croissance rapide
du foetus (Figure 4). Le maximum de bénéfices est obtenu avec 2
à 3 doses durant la grossesse [25].
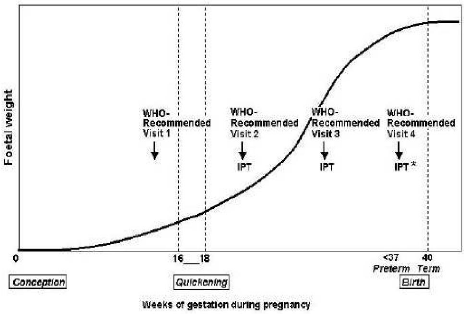
Figure 4. Periodes recommandees par l~OMS pour
l~administration des traitements preventifs intermittents au cours de la
grossesse [25]
II.10 REVUE DOCUMENTAIRE
Au Kenya, Parise M.E. et al., dans une
étude menée avant l'adoption du TPI à la SP, ont
mesuré différents paramètres chez la femme enceinte dans
une zone de forte transmission palustre. Au cours de la grossesse et dans 2
sites différents, les taux d'anémies étaient de 79% et
95%, les taux d'anémies sévères de 8% et 24% et les taux
de parasitémie périphérique étaient de 51% et 40%
respectivement.
Parmi les femmes à parasitémie positive, 79% et
50% avaient eu une histoire récente de fièvre. 57% et 50% de
celles qui ont eu une fièvre récente avaient une
parasitémie périphérique. A Kisumu, la prévalence
de l'anémie était plus importante chez les femmes
parasitées ; 87% vs 70% [41].
Shulman et al. en 1997 dans le district de
Kilifi au Kenya, dans une étude portant sur le TPI à la SP dans
la prévention de l'anémie sévère ont trouvé
des taux d'anémie de 14,5% et 23,7% respectivement chez les femmes ayant
reçu de la SP et chez celles ayant reçu un placebo. Le TPI
à la SP permettrait de réduire de 39% le taux d'anémie
[46].
Au Malawi, l'étude de Linda J.Shultz et
al sur l'efficacité des régimes antipalustres contenant
SP et/ou CQ dans la prévention de l'infection périphérique
et placentaire à Plasmodium falciparum chez les femmes
enceintes constitue une autre étude de référence. Elle a
été menée dans une zone de forte
chloroquino-résistance (80%) et de forte transmission palustre. Au
moment du recrutement, 65% des femmes étaient parasitées. A
l'accouchement, les taux d'infection périphérique étaient
de 32% et 3% respectivement pour les régimes CQ hebdomadaire et de SP en
TPI. Par ailleurs, 30 à 40% seulement des femmes observaient le
traitement par auto-administration hebdomadaire de CQ [48].
Au Mali, de mars 1998 à mars 2001, Kayentao K.
et al. ont comparé l'effet des TPI à la SP et
à la CQ avec la chimioprophylaxie hebdomadaire à la chloroquine
pendant la grossesse. Au total, 58,8% des femmes étaient
parasitées au moment de leur inclusion. Durant leur suivi, les femmes
ayant eu une ou plusieurs gouttes épaisses positives dans les groupes de
chimioprophylaxie hebdomadaire, de TPI à la CQ et de TPI à la SP
étaient respectivement de 24,1%, 24,7% et 17,2%. Les proportions
d'anémie du troisième trimestre étaient respectivement de
58,4%, 58,3% et 40,4% [22].
Au Burkina, Toé R. et al. ont
étudié en période de saison sèche (saison de faible
transmission) le niveau d'infection des femmes en grossesse et ont
montré que 21,8% des femmes étaient infestées à
leur première CPN [57].
Une étude de Sirima et a/ en 2001 dans
le district sanitaire de Koupéla portant sur l'effet de la chloroquine
en chimioprophylaxie dans la prévention du paludisme maternel a
donné les résultats suivants :
Malgré une large utilisation de la chimioprophylaxie
avec la chloroquine (93% des femmes reçues en CPN ont dit utiliser la
chloroquine dont la moitié (50,2%) a eu une chimioprophylaxie
complète), 29% des femmes ont été infestées pendant
la grossesse. 76,2% ont montré une anémie dont 12%
d'anémie sévère.
L'anémie modérée et l'anémie grave
étaient fortement liées à la parasitémie avec un
risque relatif (RR) respectivement de 1,23 et 2,36 [51 ; 50].
OBJECTIFS DE L'ETUDE
III.1. OBJECTIF GENERAL
Comparer l'efficacité de la chimioprophylaxie
hebdomadaire à la CQ et celle des traitements préventifs
intermittents à la CQ et à la SP sur la prévention du
paludisme chez la femme enceinte.
III.2. OBJECTIFS SPECIFIQUES
1. Déterminer les taux de survenue d'infection du sang
maternel périphérique dans chacun des 3 groupes de traitement au
cours du suivi
2. Déterminer les taux de survenue d'anémie
maternelle dans chacun des 3 groupes de traitement au cours du suivi
3. Comparer l'efficacité des 3 protocoles
expérimentés sur la prévention de l'anémie
maternelle et de l'infection du sang périphérique chez la
mère
4. Formuler des recommandations de chimioprophylaxie efficace
contre le paludisme pendant la grossesse au Burkina Faso
METHODOLO GIE
IV.1. CADRE DE L'ETUDE
Notre étude s'est déroulée dans le district
sanitaire de Boussé situé dans la région sanitaire du
Plateau central.
IV.1.1. Le Burkina Faso
Le Burkina Faso est un pays enclavé au coeur de
l'Afrique de l'Ouest. Il couvre une superficie de 274 000 Km2 et est
limité par six pays voisins. Il compte 12 419 677 habitants [28]
composant plus de soixante ethnies. L'économie est essentiellement
basée sur l'agriculture et l'élevage. Sur le plan climatique, le
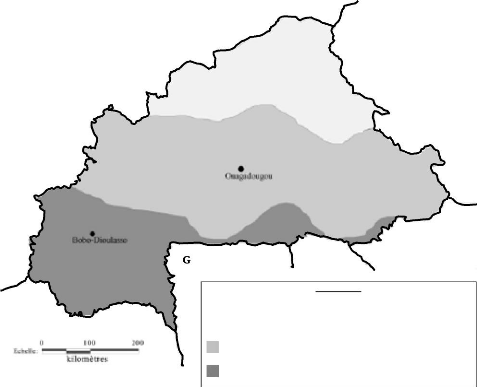
pays est subdivisé en 3 zones qui correspondent à 3 faciès
épidémiologiques vis-à-vis du paludisme comme le montre la
figure 5 [56]:
- La zone sahélienne correspondant à la partie
nord du pays où la transmission du paludisme est du type
saisonnière courte (2 à 3 mois) et fonction des aléas
climatiques.
- La zone centrale correspondant à une transmission
saisonnière longue de 4 à 6 mois dans l'année.
- La zone du sud-ouest où la transmission est permanente
avec une accentuation en saison des pluies.
Sur le plan administratif, le pays est subdivisé en 45
provinces et 13 régions administratives. Le territoire national est
subdivisé en 13 régions sanitaires comportant 55 districts
sanitaires.
Source : Centre Mura2.
Cote d'Ivoire
Mali Niger
hana
? Capitale
? Ville
? Zone de transmission saisonnière courte
? Zone de transmission permanente
Zone de transmission saisonnière longue
?Boussé
Togo
LE GENDE
Bénin
Figure 5. Zones de transmission du paludisme au Burkina
Faso
IV.1.2. Le district sanitaire de Boussé
Les données de notre étude ont
été collectées au centre médical avec antenne
chirurgicale (CMA) de Boussé. L'aire du district sanitaire est
habitée par 127 764 habitants dont 36 029 femmes de plus de 14 ans. Le
chef-lieu du district est situé à une cinquantaine de km au
nord-ouest de Ouagadougou dans la zone de transmission saisonnière
longue. Le district sanitaire compte 12 CSPS et 1 CMA. Le personnel est
composé de 2 médecins, 26 infirmiers, 3 sage-femmes et
maïeuticiens et 12 accoucheuses auxiliaires. Dans le district, en 2003, 6
388 grossesses étaient attendues et 4 974 étaient inscrites
à la CPN, donc un taux de couverture prénatale de 77,86% [28].
IV.1.3. Le CMA de Boussé
Le Centre Médical avec Antenne Chirurgicale (CMA) de
Boussé est la structure sanitaire de référence du
district. Il comporte une unité de consultation sous la forme de
dispensaire niché, une consultation de médecin, une unité
d'hospitalisation, une maternité, un laboratoire d'analyses
médicales, un dépôt pharmaceutique et un CREN. La
maternité assure les CPN, les soins de SMI, les soins post-natals et les
soins gynécologiques et obstétricaux.
IV.1.4. Le CNRFP : (Centre National de Recherche et de
Formation sur le Paludisme)
Le Centre National de Formation et de Recherche sur le
Paludisme (CNRFP) est un organisme public créé en 1983. D'abord
Projet de lutte contre le paludisme dans la ville de Ouagadougou avec la
collaboration technique et financière de l'Italie, il devient ensuite
Centre de lutte contre le paludisme (CLP) en 1986. En 1993, le Centre est
transformé en Centre National de Lutte contre le Paludisme (CNLP)
rattaché à la Direction Générale de la Santé
Publique (DGSP). C'est seulement en 1998 que le service prend son appellation
actuelle. Depuis février 2006, le CNRFP est rattaché au
Secrétariat Général du Ministère de la Santé
avec pour mission :
- La recherche sur le paludisme et les pathologies
associées ;
- La contribution à la recherche, à l'orientation
de la politique de santé par la réduction du fardeau du paludisme
;
- la formation sur le paludisme ;
- Contribuer à la formation et au recyclage des
chercheurs, des étudiants et des agents de santé dans le domaine
du paludisme.
Ses attributions sont de :
- Servir de laboratoire associé au CNRST, aux
Universités et aux hôpitaux du Burkina Faso, et à toute
autre structure de recherche et de formation nationale, pour la recherche et la
formation en santé en générale et sur le paludisme en
particulier ;
- Servir de centre d'excellence au niveau national pour la
recherche et la formation sur le paludisme.
Le CNRFP est subdivisé en 3 départements dont un
département des sciences biomédicales, un département de
santé publique et un département de gestion des données.
Il y a aussi un service administratif et un service de comptabilité.
IV.2. TYPE ET PERIODE DE L'ETUDE
IV.2.1. Type d'étude
Il s'est agi d'un essai clinique randomisé à
l'inclusion. Nous avons procédé par étude longitudinale
avec suivi d'une cohorte de femmes enceintes reparties en 3 groupes de
traitement recevant la chimioprophylaxie à la chloroquine pour le
premier groupe, le TPI à la chloroquine pour le deuxième groupe
et le TPI à la SP pour le troisième groupe.
IV.2.2. Periode de l'etude
Initialement prévue pour durer 9 mois, notre étude
s'est étalée sur une période de 15 mois (avril 2004
à septembre 2005) à cause de la faible affluence à la CPN
du CMA de Boussé.
IV.3. POPULATION DE L'ETUDE
La population de notre étude a été les
femmes enceintes durant la période de l'étude, résidant
dans le district sanitaire de Boussé et fréquentant la
Maternité du CMA de Boussé. Des critères d'inclusions ont
guidé le recrutement des femmes de l'étude.
IV.3.1. Les criteres d'inclusion
Ont été incluses dans notre étude les femmes
satisfaisant aux critères suivants:
n femme enceinte résidant dans le district sanitaire de
Boussé,
n âge gestationnel compris entre 15 et 25 semaines
d'aménorrhée,
n femme en première CPN.
IV.3.2. Les criteres d'exclusion
Ont été exclues de notre étude:
n les femmes enceintes non résidant dans le district
sanitaire de Boussé,
n les femmes enceintes dont l'âge gestationnel
était inférieur à 15 semaines d'aménorrhée
ou supérieur à 25 semaines d'aménorrhée,
n les femmes avec antécédents d'allergie à
la chloroquine ou aux sulfamides,
n les femmes qui refusent de signer le consentement
informé,
n les femmes porteuses de grossesses pathologiques.
IV.3.3. Les schémas thérapeutiques
La chimioprophylaxie hebdomadaire a la Chloroquine
(CQ/hebdo) est un schéma préventif consistant à
l'administration d'une dose curative (25mg/Kg de chloroquine base sur 3 jours)
dès la première CPN quelque soit la période, puis 300mg
par semaine jusqu'à 45 jours après la fin de la grossesse.
Le traitement préventif intermittent a la
chloroquine (TPI/CQ) est un schéma préventif consistant
à administrer une dose curative de chloroquine (25mg/kg de chloroquine
base en 3 jours) à la première CPN entre la
15ème et la 25ème semaine
d'aménorrhée, puis une seconde dose au 7ème
mois de la grossesse.
Le traitement préventif intermittent a la
sulfadoxine-pyriméthamine (TPI/SP) est un schéma
préventif consistant à administrer une dose curative de
sulfadoxine-pyriméthamine (1500 mg de sulfadoxine et 75 mg de
pyriméthamine en une seule dose) à la première CPN entre
la 15ème et la 25ème semaine
d'aménorrhée, puis une seconde dose au 7ème
mois de la grossesse.
IV.4. ECHANTILLONNAGE ET TAILLE DE L'ECHANTILLON
IV.4.1. Type d'échantillonnage
Notre sélection a permis d'affecter les femmes
répondant aux critères d'inclusion et donnant leur consentement
dans l'un des trois groupes de traitement. La répartition s'est faite
lors de la consultation prénatale par tirage aléatoire
d'enveloppes scellées identiques contenant chacune un des trois
protocoles de traitement de l'étude. Pour tendre vers la situation
réelle, l'administration du traitement n'a pas été
supervisée.
IV.4.2. Taille de l'échantillon
Notre principal critère de jugement a été
l'infection du sang maternel périphérique.
Selon une étude récente, sa prévalence
chez des femmes sous chimio-prophylaxie hebdomadaire à la chloroquine
est estimée à 34,9% [35]. Nous avons
développé des tests de comparaison deux à deux (TPI/CQ
vs CQ/Hebdo, TPI/CQ vs TPI/SP et TPI/SP vs
CQ/Hebdo). Si nous voulons mettre en évidence une différence de
40% entre les TPI et la CQ/Hebdo, en supposant un taux de
perdu de vue de 10%, avec une puissance de
80%
et une précision de 95% il faudrait
enrôler dans chaque bras au moins 216 femmes enceintes.
Au total il faut 648 femmes pour les trois groupes de
traitement.
IV.5. LA COLLECTE DES DONNEES
Des étudiants en 7ème année
de médecine (dont nous même) et des sages-femmes ont
été les enquêteurs sur le terrain, sous la supervision des
enquêteurs principaux du CNRFP. Les femmes ont été
intégrées aux cohortes de l'étude en fonction de
critères d'inclusion précédemment décrits.
Elles ont fait ensuite l'objet d'une collecte de
données à la première CPN avant l'administration des
traitements et aux deux autres CPN programmées. Pendant le suivi, les
femmes qui n'arrivaient pas à la CPN à la date programmée
étaient l'objet de recherche active de la part des enquêteurs.
IV.5.1. La collecte des donnees cliniques
A l'inclusion, pour chaque femme éligible,
l'enquêteur a recueilli les données suivantes sur:
n l'identité du sujet (nom, adresse, date de naissance,
données socio-économiques...) ;
n les critères d'éligibilité ;
n le consentement éclairé ;
n la répartition de la parturiente par tirage au sort
dans un groupe de traitement ;
n les antécédents cliniques,
gynéco-obstétricaux et de prévention du paludisme
(utilisation de MTI) ;
n les informations prénatales : age gestationnel, la
hauteur utérine, le vaccin antitétanique, le poids, la taille, la
tension artérielle, le test de la syphilis, la température
axillaire,
etc.
L'examen clinique complet permettait de s'assurer que la
grossesse n'était pas associée à une pathologie
cliniquement décelable et pouvant compromettre son bon
déroulement. Dans les situations où l'âge gestationnel
n'est pas indiqué avec précision, la HU servait à estimer
l'âge physiologique théorique de la grossesse.
IV.5.4. La collecte des donnees para cliniques
Des prélèvements sanguins ont été
effectués pour rechercher l'anémie et la parasitémie et
réaliser un test rapide (PRH-2, Optimal-it®) chez toutes les femmes
ayant une température axillaire = 37,5°C. Si le test rapide est
positif, la femme est prise en charge suivant le schéma national
(Quinine) en attendant la lecture de la goutte épaisse.
IV.5.4.1. le taux d'hemoglobine
La mesure du taux d'hémoglobine a été
faite sur place grâce à un hémoglobinomètre portatif
de marque HemoCue®-B Hemoglobine A nalyser. Cet appareil
se compose d'un photomètre et de micro cuvettes de
prélèvement à usage unique. La technique de mesure a
été la suivante: A l'aide d'un vaccinostyle, on faisait une
piqûre franche à la pulpe du 2ème, 3ème
ou 4ème doigt de sorte à avoir une goutte de sang
veineux. Puis le prélèvement sanguin se faisait à l'aide
d'une micro cuvette qui aspirait le sang par capillarité. Ensuite la
micro cuvette était introduite dans le photomètre pour lecture.
Le taux d'hémoglobine était lu par photométrie et le
résultat affiché en g/dL sur un écran électronique
à cristaux liquides.
Une cuvette de contrôle était toujours
utilisée avant chaque série de dosage sur le terrain et
permettait de calibrer l'appareil avant son utilisation.
IV.5.4.2. La goutte epaisse et la
densiteparasitaire
La goutte épaisse et le frottis mince ont
été confectionnés sur place. A l'aide de quelques gouttes
de sang on mesurait le taux d'hémoglobine et on réalisait sur une
lame de verre la GE/FM qui étaient ensuite séchées
à l'air ambiant. Sur le site de l'enquête, les
prélèvements ainsi faits étaient fixés au
méthanol et colorés pendant 45 minutes au Giemsa dilué
à 5%. Puis les lames étaient acheminées au laboratoire de
parasitologie du CNRFP où elles étaient lues au microscope
optique. A chaque fois que la goutte épaisse était positive, la
lecture du frottis mince était systématique pour identifier
l'espèce plasmodiale.
IV.5.4.3. Le suivi
Pour le suivi des femmes de l'étude, les
données ont été collectées à la
2ème et 3ème CPN, respectivement
fixées au 7ème mois (entre 28 et 32 SA) et
8ème mois (entre 33 et 36 SA) de la grossesse. - La collecte
des données à la 2ème et 3ème
CPN après 1 et 2 doses de traitement pour les 2 groupes à TPI
était identique à celle de la 1ère CPN (pas
encore reçu de traitement). Les seules différences étaient
le contrôle du groupe d'appartenance, la non randomisation et l'absence
de recueil du consentement et de vérification des critères
d'éligibilité.
Les comprimés de CQ et de SP étaient remis aux
femmes pour auto-administration non supervisée.
Toutes les femmes de l'étude ont reçu une
supplémentation en fer et acide folique (200 + 0,25 mg/jour) comme
préconisé par le Ministère de la santé.
IV.6. QUELQUES DEFINITIONS OPERATIONNELLES
n Anémie maternelle: taux d'hémoglobine < 11
g/dL de sang capillaire chez la femme enceinte.
n Anémie maternelle sévère: taux
d'hémoglobine < 8g/dL de sang capillaire.
n Fièvre= température axillaire non
corrigée supérieure ou égale à
37,5°Celsius.
IV.7. CONSIDERATIONS ETHIQUES
La présente étude a été
approuvée par le Comité d'éthique sur la recherche en
santé du Burkina Faso et le Comité d'éthique de
l'OMS/TDR.
Pour obtenir le consentement éclairé, chaque
femme de l'étude a bénéficié d'un entretien
individuel pendant lequel ont été expliquées les
motivations de l'étude, les procédures de l'étude, les
risques et avantages pour les communautés et les individus. A chaque
fois, nous avons insisté sur le caractère volontaire de la
participation. A la fin de chaque entretien, les femmes consentantes ont
signé des formulaires de consentement éclairé (ou y ont
apposé leurs empreintes digitales pour les illettrées). Ce
formulaire comportait un témoignage indépendant de l'obtention du
consentement éclairé (voir annexes).
Pour les femmes n'ayant pas atteint l'âge de la
majorité civile (18 ans), le consentement éclairé du mari
ou du tuteur était nécessaire.
Afin d'assurer la confidentialité des informations
recueillies, chaque femme participant à l'étude a obtenu un
numéro de code permettant d'assurer l'anonymat. En plus,
l'administration du questionnaire ainsi que l'examen clinique était
individuel et personnalisée. Les registres spécifiques et les
fiches codées anonymes étaient gardés dans des endroits
à accès réservé.
Pour assurer une certaine sécurité aux femmes
dans la collecte des données, nous avons utilisé des
vaccinostyles, des micro-cuvettes, des gants à usage unique ainsi que de
l'alcool, de l'eau de Javel pour prévenir les infections chez les femmes
participant à l'étude.
Dans les cas d'épisode de paludisme avéré
avec un sérodiagnostic du paludisme positif, les femmes ont
été traitées suivant les recommandations en vigueur et
selon la forme clinique, sans tenir compte du régime prophylactique
administré.
Si la chloroquine est un médicament
considéré comme n'ayant pas de danger pour la mère et le
foetus aux doses conseillées, l'utilisation de la SP pendant la
grossesse reste encore prudente surtout au premier trimestre. Pour ces raisons
nous avons exclu de notre étude toutes les grossesses de moins de 15
semaines d'aménorrhée pour éviter les éventuels
entraves à l'organogenèse.
Les médicaments de l'étude (chloroquine et la SP)
ont été donnés gratuitement aux femmes. Les autres frais
de la CPN ont été supportés par l'étude.
IV.8. METHODES DE TRAITEMENT ET D'ANALYSE DES
DONNEES
Les données collectées ont été
vérifiées pour assurer leur conformité aux besoins de
l'étude,
puis saisies en double et validées à l'aide du
micro-ordinateur en utilisant le logiciel EPI
INFO version 6.04. L'analyse des données a
été faite à l'aide de ce même logiciel. Plusieurs
variables ont été définies pour l'analyse. Ainsi nous
avons considéré l'âge, le nombre de grossesses, la
prophylaxie administrée, les résultats de la GE, le taux
d'hémoglobine et la possession de moustiquaire. L'analyse nous a permis
de comparer entre elles les statistiques de l'anémie et de la
parasitémie périphérique dans les différents
groupes de traitement à chaque CPN.
Pour les variables qualitatives, les tests statistiques de
comparaison des proportions ont utilisé le chi carré de PEARSON
et le test exact de FISCHER.
Pour les variables quantitatives, nous avons utilisé le
test de STUDENT et le test de
KRUSKAL-WALLIS pour comparer les moyennes des
variables à distribution non normale.
La valeur p= 0,05 a été adoptée comme
seuil de signification.
RESULTATS
V.1. DISTRIBUTION DES FEMMES DE L'ETUDE AU COURS DU
SUIVI
Au cours de notre étude, une cohorte de 648 femmes
enceintes a été suivie. Ces femmes sont reparties dans 3 groupes
de traitement: 209 dans le groupe de chimioprophylaxie hebdomadaire à la
chloroquine, 221 dans le groupe de TPI à la chloroquine et 218 dans le
groupe de TPI à la sulfadoxine-pyriméthamine. La distribution de
l'échantillon cours du suivi est résumée dans la figure
6.
Nombre de femmes randomisées
648

Groupe de
chimioprophylaxie
hebdomadaire
209
Groupe de TPI à la
CQ
221
Groupe de TPI à la
SP
218
1 décès 27 PDV


|
|
|
|
|
|
|
|
2 avortements 24 PDV
|
|
|
|
35 PDV
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nombre de femmes
ayant eu une
2ème
CPN
181 (86,6%)

Nombre de femmes
ayant eu une
2ème
CPN
195 (88,2%)
Nombre de femmes
ayant eu une
2ème
CPN
183 (83,9%)

Nombre de femmes
ayant eu une
3ème
CPN
147 (70,3%)
Nombre de femmes
ayant eu une
3ème
CPN
163 (73,7%)
Nombre de femmes
ayant eu une
3ème
CPN
149 (68,3%)
Figure 6. Repartition des femmes selon le groupe de
traitement et le nombre de
consultations prenatales
V.2. CARACTERISTIQUES SOCIO-DEMO GRAPHIQUES, CLINIQUES
ET PARACLINIQUES DES FEMMES A L'INCLUSION
V.2.1. L'age des femmes
La moyenne d'âge des femmes de l'étude
était de 23,7 #177; 5,92 ans. Les âges variaient de 16 à 51
ans. Chez les primigestes, l'âge moyen était de 19,17 #177; 1,82
ans. Chez les secondigestes, il était de 21,79 #177; 2,53 tandis que
chez les multigestes, il était de 28,91 #177; 5,51 ans. Environ 30% des
femmes de notre étude avait moins de 20 ans comme l'indique le tableau
I.
V.2.2. L'ethnie des femmes
Les femmes de notre échantillon étaient à
98,6% de l'ethnie mossi. Il y avait 3 femmes samo, 2 femmes dafing, 2 femmes
peulh, 1 femme bobo et 1 femme gourounsi.
V.2.3. La gravidite
La différence de répartition des primigestes, des
secondigestes et des multidestes dans les différents groupes de
traitement n'était pas statistiquement significative.
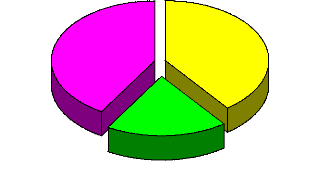
123; 19%
268; 41%
257; 40%

|
Primigestes Secondigestes Multigestes
|
Figure 7. Répartition des femmes selon la
gravidité
V.2.4. La possession de moustiquaires
imprégnées d'insecticides
Seules 12,5% des femmes de l'échantillon ont
déclaré posséder une moustiquaire et 5,4% ont
déclaré posséder une moustiquaire imprégnée
d'insecticide. Il n'y avait pas de différence significative entre les
taux d'utilisation des moustiquaires dans les 3 groupes de traitement comme
l'indique le tableau I (p= 0,85).
Tableau I. Caractéristiques des femmes a
l'inclusion
|
|
Valeurs par groupe de traitement
|
|
|
Caractéristiques
|
CQ/Hebdo TPI/CQ
(n = 221)
(n = 209)
|
TPI/SP
(n = 218)
|
lobal
(N =
648)
|
p
|
|
Age moyen #177; ET (en années)
|
24,28#177;6,3
|
23,26#177;5,6
|
23,59#177;5,8
|
23,70#177;5,92
|
0,19
|
|
Etendue des âges
|
16 - 51
|
17 - 42
|
17 - 45
|
16 - 51
|
|
|
Age < 20 ans
|
53
|
79
|
61
|
193
|
|
|
(25,4%)
|
(35,7%)
|
(28,0%)
|
(29,8%)
|
0,04
|
|
Age gestationnel moyen
|
21,79#177;2,8
|
21,60#177;2,7
|
21,74#177;2,6
|
21,71#177;2,7
|
0,74
|
|
#177; ET (en SA)
Primigestes
|
67
|
94
|
96
|
257
|
|
|
(32,1%)
|
(42,5%)
|
(44,0%)
|
(39,6%)
|
0,02
|
|
Secondigestes
|
44
|
42
|
37
|
123
|
|
|
(21,1%)
|
(19,0%)
|
(17,0%)
|
(19,0%)
|
0,56
|
|
Multigestes
|
98
|
85
|
85
|
268
|
|
|
(46,9%)
|
(38,5%)
|
(39,0%)
|
(41,4%)
|
0,17
|
|
Possession de moustiquaire
|
27
|
29
|
25
|
81
|
|
|
(12,9%)
|
(13,1%)
|
(11,4%)
|
(12,5%)
|
0,85
|
|
Distance moyenne de la formation sanitaire (en Km).
|
3,27#177;2,3
|
3,59#177;2,3
|
3,27#177;5,0
|
3,41#177;2,3
|
0,24
|
V.2.5. Prevalence de l~infection palustre
V.2.5.1. Les resultats globaux
L'indice plasmodique dans l'échantillon à
l'inclusion était de 48,1% (n=648).
La parasitémie moyenne était de 3287
trophozoïtes/XL de sang. Les extrêmes allaient de 8 à 76885
trophozoïtes/XL.
Chez les 312 femmes infectées à l'inclusion,
99,3% avaient une infection monospécifique à Plasmodium
falciparum. Des infections mixtes ont été notées
dans 4 cas et étaient dues à Plasmodium ovale
et Plasmodium falciparum.
V.2.5.2. Selon la gravidite
L'indice plasmodique analysé en fonction du nombre de
grossesses des femmes de l'étude montrait 63,0%, 48,8% et 33,6%
respectivement chez les primigestes, les secondigestes et les multigestes comme
le montre le tableau II. Ces différences étaient très
significatives et montraient un taux d'infection très
élevé chez les primigestes et les secondigestes par rapport aux
multigestes (÷2 = 45,61 ; 2ddl ; p< 0,001). Les primigestes
étaient significativement plus infectées que les secondigestes
(p= 0,008), elles mêmes plus infectées que les multigestes (p=
0,004).
Tableau II. Infection périphérique
maternelle selon la gravidité a la 1Ore CPN
|
|
Valeurs par groupes de traitement
|
|
|
ravidité
|
CQ/Hebdo
(n = 209)
|
TPI/CQ
(n = 221)
|
TPI/SP
(n = 218)
|
lobal
(N =648)
|
|
Primigestes
|
32/67
|
64/94
|
66/96
|
162/257
|
|
(47,8%)
|
(68,1%)
|
68,8%)
|
(63,0%)
|
|
Secondigestes
|
19/44
|
25/42
|
16/37
|
90/123
|
|
(43,2%)
|
(59,5%)
|
(43,2%)
|
(48,8%)
|
|
Multigestes
|
27/98
|
29/85
|
34/85
|
27/268
|
|
(27,6%)
|
(34,1%)
|
(40,0%)
|
(33,6%)
|
|
Total
|
78/209
|
118/221
|
116/218
|
312/648
|
|
(37,3%)
|
(53,4%)
|
(53,2%)
|
(48,1%)
|
V.2.5.3. Selon le groupe de traitement
A l'inclusion, l'indice plasmodique était de 37,3%,
53,4% et 53,2% respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP. Les
différences entre ces proportions étaient statistiquement
significatives (÷2 = 14,4 ; 2ddl ; p< 0,005). Dans le groupe
de chimioprophylaxie hebdomadaire, le taux d'infection à l'inclusion
était moins élevé que dans les 2 autres groupes de
traitement. La parasitémie moyenne par groupe de traitement était
de 1942#177;3027, 3747#177;7978 et 3724#177;8584 trophozoïtes par ml,
respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP. Les
différences entre les moyennes des densités parasitaires
n'étaient pas statistiquement significatives (p=0,24).
V.2.5.4. Selon l~age des femmes
L'indice plasmodique était de 63,2% chez les femmes de
moins de 20 ans et 41,8% chez les femmes de 20 ans et plus. Cette
différence était statistiquement significative
(÷2 = 24,98 ; 1ddl ; p < 0,0001).
V.2.6. Prévalence de l~anémie maternelle
V.2.6.1. Les résultats globaux
A l'inclusion, 66,0% des femmes de l'étude
présentaient une anémie et 4,6% de l'ensemble présentaient
une anémie sévère
V.2.6.2. Selon la gravidité
A l'inclusion, les primigestes et les secondigestes
étaient les plus anémiées (75,5% et 62,6%) en comparaison
des multigestes (58,6%). Les différences étaient significatives
(÷2= 17,52 ; 2ddl ; p< 0,001).
Tableau III. Anémie maternelle selon la
gravidité a la premiere CPN
|
Valeurs par groupe de traitement
|
|
|
ravidité
|
CQ/Hebdo
(n = 209)
|
TPI/CQ
(n = 221)
|
TPI/SP
(n = 218)
|
lobal
(N = 648)
|
|
Primigestes (n=257)
|
49/67
|
68/94
|
77/96
|
194/257
|
|
(73,1%)
|
(72,3%)
|
(80,2%)
|
(75,5%)
|
|
Secondigestes (n=123)
|
24/44
|
31/42
|
22/37
|
77/123
|
|
(54,5%)
|
(73,8%)
|
(59,5%)
|
(62,6%)
|
|
Multigestes (n=268)
|
66/98
|
46/85
|
44/85
|
156/268
|
|
(68,0%)
|
(54,1%)
|
(51,8%)
|
(58,4%)
|
|
lobal
|
140/209
|
145/221
|
143/218
|
428/648
|
|
(67,0%)
|
(65,6%)
|
(65,6%)
|
(66,0%)
|
V.2.6.3. Selon le groupe de traitement
A l'inclusion, 66,0% des femmes de notre échantillon
présentaient une anémie biologique. L'anémie était
détectée chez 67,0%, 65,6% et 65,6% des femmes respectivement
dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP. Ces proportions n'avaient pas de
différences statistiquement significatives (p= 0,94).
Le groupe de TPI/SP présentait un plus fort taux
d'anémie sévère (8,3%) par rapport au groupe de CQ/Hebdo
(1,9%) et le groupe TPI/CQ (3,6%). Les différences étaient
significatives (p = 0,005).
V.2.6.4. Selon l'age des femmes
Au total, 76,2% des femmes de moins de 20 ans
présentaient une anémie à la première CPN contre
61,8% chez les femmes ayant 20 ans et plus. La différence était
statistiquement très significative (÷2 = 12,54 ; 1ddl ;
p < 0,0004).
V.3. L'IMPACT DU TYPE DE CHIMIOPROPHYLAXIE SUR
L'INFECTION PALUSTRE
V.3.1. A la deuxieme CPN V.3.1.1. Les resultats
globaux
A la deuxième CPN, 20,6% des 559 femmes étaient
infectées. Chez ces femmes infectées, 99,1% avaient une infection
monospécifique à Plasmodium falciparum. Une
seule infection mixte a été notée et était due
à Plasmodium ovale et Plasmodium
falciparum.
V.3.1.2. Selon la gravidite
Comme le montre le tableau IV, les primigestes et les
secondigestes restent les plus infectées (30,2% et 20,6%) en comparaison
aux multigestes (12,1%). (÷2 = 22,58; 2ddl; p< 0,001)
Tableau IV. Infection périphérique
maternelle selon la gravidité a la 2eme CPN
Valeurs par groupe de traitement
|
ravidité
|
|
|
|
|
|
CQ/Hebdo
(n = 181)
|
TPI/CQ
(n = 195)
|
TPI/SP
(n = 183)
|
Global
(N =559)
|
|
Primigestes
|
17/55
|
30/77
|
17/80
|
64/112
|
|
(30,9%)
|
(39,0%)
|
(21,3%)
|
(30,2%)
|
|
Secondigestes
|
6/38
|
14/37
|
02/32
|
22/107
|
|
(15,8%)
|
(37,8%)
|
(06,3%)
|
(20,6%)
|
|
Multigestes
|
13/88
|
10/81
|
06/71
|
29/240
|
|
(14,8%)
|
(12,3%)
|
(08,5%)
|
(12,1%)
|
|
Total
|
36/181
|
54/195
|
25/183
|
115/559
|
|
(19,9%)
|
(27,7%)
|
(13,7%)
|
(20,6%)
|
V.3.1.3. Selon le groupe de traitement
A la deuxième CPN programmée, l'infection
maternelle était de 19,9%, 27,7% et 13,7% respectivement dans les
groupes CQ/Hebdo, TPI/CQ et TPI/SP. Ces différences étaient
statistiquement significatives (÷2 = 11,45 ; 2ddl ; p= 0,003).
La réduction de l'infection était de 46,4%, 48,1% et 74,2%
respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP. La
différence des taux de réduction de l'infection
périphérique était très significative
(÷2 =36,51 ; 2ddl ; p< 0,0001). Cependant, cette
différence de réduction n'était pas significative entre
les deux groupes à chloroquine (p= 0,72)
V.3.1.4. Selon l~age des femmes
Parmi les femmes de moins de 20 ans, 34,6% présentaient
une goutte épaisse positive à la deuxième CPN contre
seulement 15,1% chez les femmes ayant 20 ans et plus. La différence
était statistiquement significative (÷2 = 26,11 ; 1ddl ;
p < 0,0001).
V.3.2. A la troisieme CPN V.3.2.1. Les résultats
globaux
A la troisième CPN, 19,6% des 459 femmes
présentaient une infection palustre. Ces infection étaient
à 100% monospécifiques et dues à Plasmodium
falciparum.
V.3.2.2. Selon la gravidité
A la troisième CPN, les primigestes et les
secondigestes restaient les plus infectées (27,6% et 20,9%) en
comparaison aux multigestes (11,9%). Ces différences étaient
statistiquement significatives (÷2= 15,11 ; 2ddl ; p<
0,001).
Tableau V. Infection périphérique
maternelle selon la gravidité a la 3eme CPN
|
ravidité
|
Valeurs par groupe de traitement
|
|
|
CQ/Hebdo
(n = 147)
|
TPI/CQ
(n = 163)
|
TPI/SP
(n = 149)
|
Global
(N = 459)
|
|
Primigestes.
|
15/45
|
27/60
|
06/67
|
48/172
|
|
(33,3%)
|
(45,0%)
|
(09,0%)
|
(27,9%)
|
|
Secondigestes
|
06/31
|
10/31
|
02/24
|
24/86
|
|
(19,4%)
|
(32,3%)
|
(08,3%)
|
(20,9%)
|
|
Multigestes.
|
09/71
|
08/72
|
07/58
|
24/201
|
|
(12,7%)
|
(11,1%)
|
(12,1%)
|
(11,9%)
|
|
Total
|
30/147
|
45/163
|
15/149
|
90/459
|
|
(20,4%)
|
(27,6%)
|
(10,1%)
|
(19,6%)
|
V.3.2.3. Selon le groupe de traitement
A la dernière CPN programmée, l'infection du sang
périphérique chez la mère était de 20,4%,
27,6%
et 10,1% respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP comme
l'indique le tableau V. Ces différences sont
significatives (÷2 = 15,8 ; 2ddl ; p< 0,001). La
différence entre le groupe TPI/SP et les groupes à chloroquine
était significative (p= 0,014 pour CQ/Hebdo vs TPI/SP ; p<
0,001 pour TPI/CQ vs TPI/SP). Par contre il n'y avait pas de
différences significatives entre les groupes CQ/Hebdo et TPI/CQ (p=
0,13).
V.3.*.4. Selon l~age des femmes
Parmi les femmes de moins de 20 ans, 29,2% présentaient
une goutte épaisse positive à la troisième CPN contre
seulement 10,3% chez les femmes ayant 20 ans et plus. La différence
était statistiquement significative (÷2 = 31,29 ; 1ddl ;
p < 0,0001).
V.3.3. Evolution de la prevalence l~infection peripherique
au cours du suivi
Pour tous les trois groupes de traitement, l'indice
plasmodique était décroissant au cours du suivi. A la
troisième CPN programmée, on observait une réduction de
l'infection périphérique maternelle de 45,3%, 48,3% et 81,0%
respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP. Cette
décroissance était plus marquée dans le groupe de TPI/SP
comme le montre la figure 8.
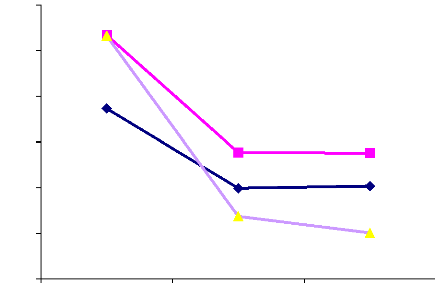
53,2
50
10,1
0
60
53,4
27,7 27,6
19,9 20,4
13,7
37,3
Prevalence de l'infection (%)
40
30
20
10
CPN1 CPN2 CPN3

CQ/Hebdo TPI/CQ TPI/SP
Figure 8. Evolution de la prévalence de
l'infection périphérique
maternelle au cours du
suivi.
V.4. L'IMPACT DU TYPE DE CHIMIOPROPHYLAXIE SUR L'ANEMIE
MATERNELLE
V.4.1. A la deuxieme CPN V.4.1.1. Les resultats
globaux
A la deuxième CPN programmée, le taux global
d'anémie était de 57,4%. L'anémie sévère a
été retrouvée chez 3,2% des 559 femmes.
V.4.1.2. Sclon la gran-idite
On n'observait pas de différences statistiquement
significatives entre les taux d'anémie chez
les primigestes (62,3%),
les secondigestes (59,8%) et les multigestes (52,1%) à la
deuxième
CPN (÷2= 5,08 ; 2ddl ; p= 0,07). Cependant il y
avait une différence significative entre le groupe CQ/Hebdo et le groupe
TPI/SP (p= 0,02).
Tableau VI. Anémie maternelle selon la
gravidité a la deuEiéme CPN
|
ravidité
|
Valeurs par groupe de traitement
|
|
|
CQ/Hebdo
(n = 181)
|
TPI/CQ
(n = 195)
|
TPI/SP
(n = 183)
|
lobal
(N = 559)
|
|
Primigestes (n=212)
|
35/55
|
53/77
|
44/80
|
132/112
|
|
(63,6%)
|
(68,8%)
|
(55,0%)
|
(62,3%)
|
|
Secondigestes (n=107)
|
23/38
|
25/37
|
16/32
|
64/107
|
|
(60,5%)
|
(67,6%)
|
(50,0%)
|
(59,8%)
|
|
Multigestes (n=240)
|
54/88
|
40/81
|
31/71
|
125/240
|
|
(61,4%)
|
(49,4%)
|
(43,7%)
|
(52,1%)
|
|
lobal
|
112/181
|
118/195
|
91/183
|
321/240
|
|
(61,9%)
|
(60,5%)
|
(49,7%)
|
(57,4%)
|
V.4.1.3. Selon le groupe de traitement
Par groupe de traitement, le taux d'anémie était
de 61,9%, 60,5% et 49,7% respectivement pour les groupes CQ/Hebdo, TPI/CQ et
TPI/SP. Il y avait une différence statistiquement significative entre
ces proportions (÷2= 6,66 ; 2ddl ; p= 0,03). Cependant, il n'y
avait pas de différence entre les deux groupes à chloroquine (p=
0,78). L'anémie sévère a été relevée
dans 2,2%, 4,1% et 3,3% respectivement pour les groupes CQ/Hebdo, TPI/CQ et
TPI/SP. Les différences n'étaient pas statistiquement
significatives (p=0,58).
V.4.1.4. Selon l~age des femmes
Parmi les femmes de moins de 20 ans, 66,0% présentaient
une anémie à la deuxième CPN contre 54,1% chez les femmes
ayant 20 ans et plus. La différence était statistiquement
significative (÷2 = 6,55 ; 1ddl ; p = 0,01).
V.4.2. A la troisieme CPN
V.4.2.1. Les résultats globaux
A la troisième CPN, 46,4% des 459 femmes
présentaient une anémie. L'anémie sévère
concernait 2,4% des femmes.
V.4.2.2. Selon la gravidité
Il n'y avait pas de différences statistiquement
significatives entre les taux d'anémie chez les primigestes (48,3%),
chez les secondigestes (50,0%) et chez les multigestes (43,3%) comme le montre
le tableau VII (÷2= 1,47 ; 2ddl ; p= 0,4).
Tableau VII. Anémie maternelle selon la
gravidité a la troisieme CPN
|
ravidité
|
Valeurs par groupe de traitement
|
|
|
CQ/Hebdo
(n = 147)
|
TPI/CQ
(n = 163)
|
TPI/SP
(n = 149)
|
lobal
(N = 459)
|
|
Primigestes
|
27/45
|
32/60
|
24/67
|
83/172
|
|
(60,0%)
|
(53,3%)
|
(35,8%)
|
(48,3%)
|
|
Secondigestes
|
15/31
|
17/31
|
11/24
|
43/86
|
|
(48,4%)
|
(54,8%)
|
(45,8%)
|
(50,0%)
|
|
Multigestes
|
36/71
|
31/72
|
20/58
|
87/201
|
|
(50,7%)
|
(43,1%)
|
(34,5%)
|
(43,3%)
|
|
lobal
|
78/147
|
80/163
|
55/149
|
213/459
|
|
(53,1%)
|
(49,1%)
|
(36,9%)
|
(46,4%)
|
V.4.2.3. Selon le groupe de traitement
A la troisième CPN, la prévalence de
l'anémie était de 53,1%, 49,1% et 36,9% respectivement
dans
les groupes CQ/Hebdo, TPI/CQ et TPI/SP comme le montre le tableau VII. Les
différences entre ces proportions étaient
statistiquement significatives (÷2= 8,49 ; 2ddl ; p= 0,01).
Cependant la différence entre les 2 groupes à chloroquine
n'était pas statistiquement significative (p= 0,48).
Au terme du suivi, seulement 03,4%, 03,1% et 00,7% des femmes
des trois groupes respectifs avaient une anémie biologique
sévère. Cependant, les différences n'étaient pas
statistiquement significatives (p= 0,24).
V.4.2.4. Selon l~age des femmes
Parmi les femmes de moins de 20 ans, 54,4% présentaient
une anémie à la troisième CPN contre 43,4% chez les femmes
ayant 20 ans et plus. La différence était statistiquement
significative (÷2 = 4,41 ; 1ddl ; p = 0,03).
V.4.3. Evolution de la prevalence de l~anemie au cours du
suivi
Au cours du suivi, nous avons observé une
décroissance progressive de la prévalence de l'anémie dans
les trois groupes de traitement de notre cohorte. Cette prévalence a
connu une réduction de 20,7%, 09,9% et 47,7%
respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP.
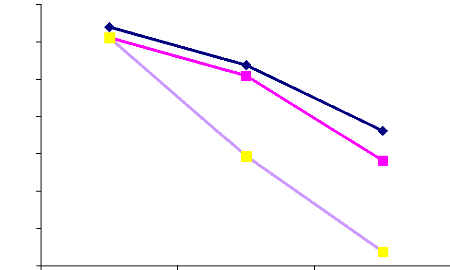
70
67
65
Prevalence de l'anemie (%)
60
55
50
45
40
65,6
65,6
61,9
60,5
49,7
36,9
35
53,1
49,1
CPN1 CPN2 CPN3
Figure 9. Evolution de la prévalence de
l'anémie au cours du suivi.
V.4.4. Le gain d'hemoglobine au cours du suivi
Dans les trois groupes de traitement, les taux moyens
d'hémoglobine ont connu une hausse progressive au cours du suivi. Le
gain moyen d'hémoglobine par groupe de traitement était de
0,53g/dL, 0,47g/dL et 1,06g/dL respectivement dans les groupes CQ/Hebdo, TPI/CQ
et TPI/SP. Les différences de gain étaient statistiquement
significatifs (p= 0,006). Cependant, il n'y avait pas de différence
entre les 2 groupes à chloroquine (p= 0,77). A la troisième CPN,
le taux d'hémoglobine était respectivement de 10,85 g/dL, 10,90
g/dL et 11,41 g/dL respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP.
Il y avait des différences statistiquement significatives entre ces
moyennes (p= 0,001 par le test de Kruskal-Wallis). Les deux groupes à
chloroquine ne présentaient pas de différences (P= 0,76).
Le gain en hémoglobine entre l'inclusion et la
troisième CPN était très significatif dans le groupe
CQ/Hebdo (t= 9,46 ; p= 0,002) et dans le groupe TPI/CQ (t= 11,70 ; p= 0,0006).
Ce gain était très hautement significatif dans le groupe TPI/SP
(t= 48,85 ; p < 0,00001).
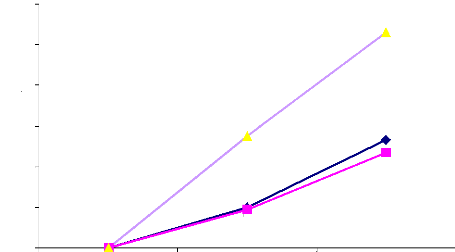
0,2
0,19
0
0
1,2
1,06
1
Gain en hemoglobine (g/dL)
0,8
0,6
0,4
0,2
0,55
0,53
0,47
Inclusion CPN2 CPN3
Figure 10. Gain en hémoglobine par groupe de
traitement au cours du
suivi.
DISCUSSION
VI. 1. LIMITES DE LA METHODOLO GIE
VI.1.1. L'echantillonnage
Dans notre étude, l'échantillon n'a
concerné que les femmes vues en consultations prénatales. Du fait
du caractère accidentel de ce type d'échantillonnage, il y a eu
l'exclusion de toutes les femmes n'assistant pas aux CPN. Il est possible qu'il
y ait un biais des résultats lié à une différence
de caractéristiques entre celles assistant aux CPN et celles qui ne
consultent pas.
VI.1.2. Les critéres d'exclusion
L'exclusion des femmes arrivant tôt à la CPN
avant la 15ème SA et celles arrivant tardivement à la
CPN après la 25ème SA pourrait écarter de
l'échantillon des femmes aux caractéristiques
particulières.
L'âge de la grossesse a été estimé
à partir de la date des dernières règles donnée par
les participantes. Du fait que la proportion des femmes analphabètes
était élevée, cette donnée manquait souvent de
précision, faisant que l'âge estimé des grossesses
était imprécis. Cependant la confrontation de cette donnée
d'interrogatoire avec la mesure de la hauteur utérine nous permettait
d'estimer l'âge de la grossesse.
VI.1.3. L'administration des medicaments
Les médicaments de l'étude ont été
administrés sans supervision. La prise des médicaments
était auto rapportée sans qu'aucune preuve ne soit produite par
une chimio-détection des métabolites des médicaments au
niveau sanguin ou urinaire. Compte tenu des effets secondaires des
médicaments, de fausses déclarations sur la prise pourraient
augmenter improprement les taux d'échec prophylactique.
VI.2. CARACTERISTIQUES DE L'ECHANTILLON A
L'INCLUSION
VI.2.1. L'indice plasmodique a l'inclusion
L'indice plasmodique à l'inclusion pour les femmes
enceintes dans notre étude était de 48,1%. Cette
prévalence était plus élevée que les 37,2% chez les
femmes en première CPN en saison de haute transmission constatés
dans le district sanitaire de Koupéla en 2001 [50 ; 51] et les 21,8%
constatés en saison de faible transmission dans le district sanitaire de
Houndé en 2004
[57]. Notre résultat est inférieur aux 58,8%
constatés sur quatre années d'étude au Mali [22] et 65%
constatés en 1994 au Malawi [48].
Les différences de prévalence de l'infection
palustre chez les femmes de Boussé, les femmes de Koupéla et les
femmes de Houndé pourraient s'expliquer par les différences du
niveau d'endémicité du paludisme ainsi que les différences
du niveau de la transmission selon la saison. Les études au Mali et au
Malawi n'ayant concerné que les femmes dans leur première ou
seconde grossesse plus susceptibles à l'infection, trouvent un indice
plasmodique normalement plus élevé.
L'indice plasmodique analysé en fonction du nombre de
grossesses montre un niveau d'infection périphérique plus
élevé chez les primigestes et les secondigestes par rapport aux
multigestes (p < 0,001). Notre constat est similaire à celui d'autres
études au Burkina [51 ; 50], au Kenya [40] et au Malawi [42]. Ces
résultats traduisent une plus grande vulnérabilité des
primigestes et des secondigestes à l'infection palustre.
L'indice plasmodique était significativement plus
élevé chez les femmes enceintes de moins de 20 ans que chez
celles qui ont 20 ans et plus (p< 0,0001). Le même constat a
été fait par Rogerson et al. en 2000 [42].
L'âge supérieur à 20 ans apparaît comme un facteur de
protection contre l'infection paludéenne pendant la grossesse. Ainsi
l'apparente protection chez les multigestes serait liée à
l'âge plus élevé dans ce groupe de femme. En 2000 au
Malawi, Rogerson et al. étaient arrivés à
la même conclusion [42]. Ce constat s'expliquerait par le fait qu'en
milieu endémique, l'immunité de prémunition
s'accroît avec l'âge [9 ; 59].
VI.2.2. L'anémie a l'inclusion
A l'inclusion, 66,0% des femmes de l'étude
présentaient une anémie. La prévalence de l'anémie
dans notre étude est la même que celle trouvée à
Bobo-Dioulasso en 1996 par Méda et al. [33]. Cependant,
notre résultat était inférieur aux 81,6% obtenus à
Koupéla en 2001 [51] et aux 78,8% obtenus au Mali [22].
Bien que moins parasités, les femmes de Koupéla
présentaient un taux d'anémie plus important. Ce qui nous fait
penser qu'il existe certainement d'autres facteurs fortement contributifs
à l'anémie maternelle en zone d'endémie palustre. En plus
l'étude de Koupéla a inclus les femmes jusqu'au troisième
trimestre de grossesse alors que la susceptibilité à
l'anémie s'accroît avec l'âge de la grossesse [33].
La différence trouvée au Mali pourrait être
due au fait que cette étude n'a pris en compte que les primigestes et
les secondigestes qui sont plus susceptibles à l'anémie que les
multigestes.
Nos résultats montrent que les primigestes et les
secondigestes sont plus susceptibles de développer une anémie au
cours de la grossesse. Nos résultats sont similaires aux constats faits
dans d'autres études [51 ; 42].
VI.4. Possession de moustiquaires
imprégnées
Le taux de couverture en moustiquaires traitées aux
insecticides est très faible dans la zone
d'étude. Dans notre échantillon, seules 12,5%
des femmes ont déclaré posséder une moustiquaire et 05,4%
ont déclaré posséder une moustiquaire
imprégnée d'insecticide. Ces taux étaient plus bas quez
ceux des moyennes nationales respectivement de 40,4% et 14,7% [67]. Cela montre
que la politique nationale de promotion de l'utilisation des MTI n'est pas bien
vulgarisée.
VI.2. L'EFFICA CITE DES DIFFERENTS TYPES DE
CHIMIOPROPHYLA XIE
VI.2.1. Impact sur l'infection peripherique
VI.2.1.1. A la deuxieme CPN
A la deuxième CPN, les taux d'infection
périphérique chez la mère se caractérisaient par
une diminution de 46,4%, 48,1% et 74,2% de l'indice plasmodique respectivement
dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP. Le TPI à la SP était
associé à une réduction significative des taux de
l'infection périphérique par rapport aux 2 groupes à
chloroquine. Cette tendance a aussi été constatée au Mali
par Kayentao et al. [22] et au Malawi par Schultz et
al. [48].
Nos résultats montrent que malgré la prophylaxie
médicamenteuse, les primigestes et les secondigestes restaient les plus
exposées à l'infection périphérique en comparaison
aux multigestes. L'efficacité de la chimioprophylaxie serait donc
dépendante de la situation immunitaire des femmes.
VI.2.1.2. A la troisieme CPN
L'infection périphérique recherchée entre
33 et 36 semaines de grossesse montrait un indice plasmodique bas dans le
groupe TPI/SP en comparaison aux deux groupes à chloroquine. Nous
constatons que la chloroquine prise en chimioprophylaxie hebdomadaire comme en
TPI produisait les mêmes effets dans la prévention de l'infection
du sang périphérique. Le même constat a été
fait au Mali dans la région de Mopti proche du Burkina Faso [22].
Bien que nous n'ayons pas pu mesurer l'observance par la
détection chimique, nous pensons que l'échec de la
prévention par la chloroquine serait plus dû à la
chloroquino-résistance qu'à la non observance du traitement.
Contrairement aux conclusions faites à Koupéla en
2001 [51], l'utilisation de la chloroquine
dans notre étude restait
associée à une réduction significative de l'indice
plasmodique. Cette
réduction dans le groupe TPI/SP était
significativement plus élevée que celle dans les groupes à
chloroquine (p< 0, 001). La réduction de 81,0% de l'indice
plasmodique dans le groupe TPI/SP est comparable aux résultats de 85%
obtenu au Kenya de 1996 à 1997 [46].
L'efficacité protectrice des différents
traitements donnés en prophylaxie restait dépendante de la
gravidité et de l'âge de la gestante. Les mulitgestes restaient
significativement plus protégées que les primigestes et les
secondigestes.
VI.2.2. Impact sur l~anemie maternelle
VI.2.2.1. Ala deuxieme CPN
A la deuxième CPN, les taux d'anémie dans les
trois groupes ont connu une réduction de 07,6%, 07,7% et 24,2%
respectivement dans les groupes CQ/Hebdo, TPI/CQ et TPI/SP. Les
différences entre les trois groupes de traitement étaient
statistiquement significatives (p= 0,03). Cependant, les taux d'anémie
entre les 2 groupes à chloroquine restaient similaires. La
réduction de l'anémie était plus importante chez les
primigestes et les secondigestes en comparaison aux multigestes.
VI.2.2.2. A la troisieme CPN
Au dernier contrôle des taux d'hémoglobine, la
prévalence de l'anémie dans les trois groupes de l'étude
était de 53,1%, 49,1% et 36,9% respectivement dans les groupes CQ/Hebdo,
TPI/CQ et TPI/SP. Ces résultats sont comparables aux 58,4%, 58,3% et
40,4% obtenus au Mali. Les différences entre ces proportions
étaient significatives et traduisaient une réduction plus
importante de l'anémie dans le groupe de TPI/SP comparativement aux 2
groupes à chloroquine.
Il n'y avait plus de différences statistiquement
significatives entre les primigestes, les secondigestes et les multigestes.
Cela était dû au fait que la réduction des proportions
d'anémie était très importante chez les primigestes et les
secondigestes tandis qu'elle était peu importante chez les multigestes.
Comme Rogerson et al. au Malawi en 2000 [42], nous sommes
arrivés à la conclusion que l'efficacité de la prophylaxie
médicamenteuse contre l'anémie chez la femme enceinte est plus
marquée chez les primigestes et les secondigestes que chez les
multigestes. Cela prouve que la part de l'anémie palustre est plus
importante chez les primigestes et les secondigestes que chez les
multigestes.
Le taux moyen d'hémoglobine à l'inclusion dans
notre cohorte était de 10,37 #177; 1,4. Ce taux était plus
important dans notre série que celui trouvé au Mali (9,60 g/dL).
Cette différence tenait au fait que les multigestes avaient une moyenne
de taux d'hémoglobine plus élevée que les primigestes et
les secondigestes, seules prises en compte dans l'étude citée
[22].
Au terme de notre suivi le gain en hémoglobine
était de 0,53, 0,47 et 1,06 g/dL
respectivement dans les groupes
CQ/Hebdo, TPI/CQ et TPI/SP. Nos résultats sont
inférieurs à ceux obtenus au Mali par Kayentao
et a. (1 g/dL, 1 g/dL et 1,4 g/dL) [22] et au Malawi par
Schultz et a. (2,6 à 4,8 g/dL) [48]. Cela pourrait
s'expliquer par le fait que ces études citées n'ont pris en
compte que les primigestes et les secondigestes dont le gain
d'hémoglobine est significativement plus important que celui des
multigestes.
A l'inclusion, l'anémie sévère
était peu rependue dans notre échantillon. Les 4,6%
trouvés étaient peu élevés par rapport aux 13,5%
obtenus à Koupéla [51] et 14,6% trouvés au Mali [22]. Cela
pourrait s'expliquer par le fait qu'au Mali, l'étude ne prenant en
compte que les primigestes et les secondigestes (plus susceptibles de faire une
anémie sévère) trouve normalement des taux plus
élevés dans le groupe des femmes suivies. L'étude de
Koupéla ayant recruté certaines femmes tardivement dans leur
grossesse augmentait le risque de trouver des anémies
sévères.
CONCLUSION
A l'issue de notre étude, nous arrivons à la
conclusion que le TPI à la sulfadoxinepyriméthamine constitue une
meilleure alternative à la chimioprophylaxie à la chloroquine,
peu efficace aujourd'hui. Si cette dernière molécule, du fait de
sa disponibilité et de son coût accessible est restée
longtemps efficace au Burkina [9 ; 11 ; 21] et préconisé dans la
prévention du paludisme chez la femme enceinte [30], aujourd'hui, elle
n'offre plus une protection suffisante comme le montrent nos
résultats.
La SP, médicament peu cher et d'administration facile
offre une meilleure protection contre l'anémie et l'infection du sang
périphérique. Connaissant les liens déjà mis en
évidence entre l'infection périphérique, l'anémie,
l'infection placentaire, le faible poids de naissance et la morbidité et
mortalité péri-natale, l'évidence est que la
sulfadoxine-pyriméthamine doit remplacer la chloroquine dans la
prévention du paludisme maternel. En plus, le traitement intermittent
offre de plus grandes chances d'observance du traitement par rapport à
la chimioprophylaxie hebdomadaire.
Cependant, quelques questions restent posées et
méritent des recherches supplémentaires pour apporter des
réponses satisfaisantes. Entre autres, la protection de la femmes
enceinte avant la 15ème SA devrait faire l'objet de consensus
plus large.
L'efficacité des politiques de prévention du
paludisme maternel par le TPI à la SP dépendrait certainement de
l'accessibilité géographique et financière de la SP, ainsi
que la formation du personnel de santé à sa prescription.
Enfin, compte tenu que la SP est un schizonticide pour lequel
la résistance est rapide et aisée à apparaître, il
nous semble logique que l'alternative pourrait tourner court avec l'apparition
de la résistance parasitologique. Cette résistance pourrait
croître rapidement et compromettre la nouvelle chimioprophylaxie. Ce qui
nous fait dire que des mesures de protection de la molécule sont
indispensables afin d'offrir une certaine longévité à
cette alternative. Déjà, la recherche doit s'intéresser
à d'autres schémas afin de préparer dès maintenant
d'autres alternatives efficaces au TPI à la SP.
PERSPECTIVES ET RECOMMANDATIONS
PERSPECTIVES
Au terme de notre étude sur l'efficacité de trois
schémas de prévention médicamenteuse du paludisme chez la
femme enceinte, les perspectives qui nous semblent intéressantes sont
:
- Réévaluer régulièrement
l'efficacité de la sulfadoxine-pyriméthamine sur la
prévention du paludisme et sur l'amélioration de la survie du
nourrisson.
- Etablir et mettre en oeuvre un protocole de pharmacovigilance
pour la SP.
- Prospecter d'autres schémas de prévention pour
préparer une alternative efficace aux schémas que nous
proposons.
RECOMMANDATIONS
Considérant les résultats de notre étude,
nous formulons les recommandations suivantes :
4 Aux autorités politiques et sanitaires du
Burkina Faso
- Faciliter l'accessibilité géographique ainsi que
la gratuite de la SP dans le cadre des consultations prénatales.
- Faciliter l'accessibilité financière et
géographique des MTI partout au Burkina Faso.
- Favoriser la mise en oeuvre accélérée de
la nouvelle politique de prévention du paludisme maternel par le TPI
à la SP sur toute l'étendue du territoire nationale.
- Doter les centres de santé en support d'information et
d'éducation des populations sur la prévention du paludisme
maternel.
4 Aux agents de santé
- Prescrire le TPI à la sulfadoxine-pyriméthamine
pour la prévention du paludisme chez la femme enceinte.
4 A la communauté
- Adhérer à la stratégie de
prévention du paludisme maternel par le TPI à la SP.
- Fréquenter les consultations prénatales pour les
femmes enceintes.
BIBLI0 GRAPHIE
1. Aouba A.E. Analyse de la situation de la
chimiorésistance du paludisme au Burkina Faso: conséquences
thérapeutiques. These de Midecine. FSS. Ouagadougou.
1992.
2. Arrnon P.J. Maternal deaths in
Tanzania. Transaction of Royal Society of Tropical Medicine and
Hygiene. 1979; 73. pp 284-88.
3. Baudon D., Decouvoux Roux J. et Sondo B.
Etude de la sensibilité de Plasmodium falciparum à la chloroquine
dans une savane de Haute-Volta à paludisme hyper-endémique :
utilisation de tests in vitro et in vivo.
Bulletin de la Societe de Pathologies Exotiques. 1984,
77, pp 658-665.
4. Belkaid M., Tabet Derraz 0., Zenaidi N. et Harnrioui
B. Cours de parasitologie. Tome1. OPU. Alger 1994.
245p.
5. Bouree P. Deuxième conférence
panafricaine sur le paludisme, Dakar, Sénégal. Midecine
Tropicale. 1996, 56, 111p.
6. Brabin B.J. An analysis of malaria in
pregnancy in Africa. Bulletin of World Health Organisation.
61: 1983. pp 1005-1016.
7. Brabin B.J. The Risks and Severity of
Malaria in Pregnant Women. 1991 Geneva, Switzerland:. Applied Field Research in
Malaria Reports, No. 1. World Health Organisation.
8. Cot M., Boussinesq M., Gazin P., Boudon D. et
Carnevale P. Acquisition de l'iimmunité en zone
d'endémie palustre (savane soudano-sahélienne). 1988, A
nnales de la Societe Belge de Midecine Tropicale. 135-140.
9. Cot M., Le Hesran J.Y., Miailhes P., Roisin A.,
Fievet N., Barro D., Etya'Ale D., Deloron P., Carnevale P. and
Breart G. Effect of chloroquine prophylaxis during pregnancy on
maternal haematocrit. Annals of Tropical Medicine
andparasitology.1998. 92, pp 37-43.
10. Del Nero L., Larnizana L., Pietra V., and Nebie
I. Sensitivity to ntimalarial drugs by P. falciprum
in Goundry, Oubritenga province, Burkina Faso. Parasitologia,
1994, 36, pp 287-293.
11. Dictionnaire thérapeutique : Edition
Afrique francophone. Edition 2000 Vidal. 624p.
12. Doanio J.M.C. Transmission du paludisme
à Kafine, un village de riziculture irriguée de
Côte-d'Ivoire et essai de lutte par utilisation des moustiquaires "Olyset
Net" en zone de résistance de Anopheles gambiae s.s.
(Giles 1902) au pyréthrinoïdes. Abidjan 2003 ; 213 p.
13. Fleming A.F., Ghatoura G.B., Harrisson K.A.,
Briggs N.D. and Dunn D.T. The prevention of anemia in pregnancy in
primigravidae in the guinea savanna of Nigeria. Annals of Medicine and
Parasitology. 1986. 80, pp. 211- 233.
14. Gentilini M. Paludisme.
Médecine Tropicale. 5ème edition.
91-121.Flammarion Médecine Science.1993, pp
99-122.
15. Gilles H.M., Lawson JB., Sibelos M., Voller A.,
Allan N. Malaria, anaemia, and pregnancy. Annals of Tropical
Medicine and Parasitology. 63: 1969 pp245-263.
16. Granja A.C., Machungo F., Gomes A., Bergstrom
S. Adolescent maternal mortality in Mozambique. Journal
ofAdolescent Health 2001. 28, 303-306.
17. Guiguemdé T.R., Aouba A., Ouédraogo
J.B. and Lamizana L. Ten years surveillance of drug-resistant malaria
in Burkina Faso (1982-1991). American Journal of Tropical Medecine and
Hygiene. 1994. 50, pp 699- 704.
18. Guiguemde T.R., Ouedraogo J.B., Zongo I., Tinto H.
et Zampam O. Détection des formes résistantes de
Plasmodium falciparum aux antimalariques au Burkina Faso. IRSS
et PNLP. Rapport 2003.
19. Guyatt H.L., Snow R.W. The epidemiology and
burden of Plasmodium falciparum malaria-related anaemia among
pregnant women in sub-Saharan Africa. American Journal of Tropical
Medicine and Hygiene. 64 (suppl. 1): 2000, pp 36-44.
20. Hommel M. Immunology of malaria.
Health cooperation papers. 1996. 15. pp 53-69.
21. Kabore B. Surveillance de
l'efficacité thérapeutique de la chloroquine a Ouagadougou en
89-90. These de médecine. Ouagadougou 1991. 111p.
22. Kayentao K., Kodio M., Newman R.D.,
Maiga H., Doumtabé D., Ongoiba A., Couibaly D., Keita A.S., Maiga B.,
Mungai M., Parise M.E. and Doumbo O. Comparison of Intermittent
Preventive Treatment with Chemoprophylaxis for the Prevention of Malaria during
Pregnancy in Mali. Journal of Infectious diseases. 2005,
191.pp 109-116.
23. Larousse medical illustré. Edition
1968, Librairie Larousse, Paris. 1214 p
24. Luxemburger C., Mc Gready R., Kham A. et
al. Effects of malaria during pregnancy on infant mortality in
aria of low malaria transmission. American Journal
ofEpidemiology. 2001 154, 459-465.
25. Marchesini P and Crawley J. Reducing the
burden of malaria in pregnancy. January 2004. Supporting Agency, RBM,
IVHO. pp 3-4.
26. McGregor I.A. Epidemiology, malaria and
pregnancy. American Journal of Tropical Medicine and Hygiene. 33:
1984, pp 517-525.
27. Ministere de la Sante du Burkina Faso, DEP.
Annuaire statistique 2002 ; 168p.
28. Ministere de la Sante du Burkina Faso, DEP.
Annuaire statistique 2003 ; 179p.
29. Ministere de la sante, de l'hygiene et de
la prevention (Senegal). Rapport de l'atelier national de consensus
sur la politique de traitement antipaludique au Sénégal.
Dakar 25-26 juin 2003.
30. Ministere de la Sante. Directives
nationales pour une prise en charge rationnelle des cas de paludisme au Burkina
Faso : (traitement curatif et chimioprophylaxie) Ouagadougou, Burkina Faso,
2000.
31. Mtimavalye L.A.R., Lisasi D. and Ntuyabaliwe
W.K. Maternal mortality in Dar es Salam, Tanzania. East Africa
Medicine Journal. 1980; 57 pp 111-118
32. Mutabingwa T.K., Malle L.N., De Geus A. and
Oosting J. Malaria chemo suppression in pregnancy. II. Its effect on
maternal hemoglobin levels, placental malaria and birth weight.
Tropical and Geographical Medicine. 1993; 45. pp
49-55.
33. N. Méda, L. Mandelbrot, M. Cartoux, B.
Dao, A. Ouangré et F. Dabis. Anémie de la grossesse au
Burkina Faso (Afrique de l'Ouest), 1995-1996 : prévalence et facteurs
associés. 2000. Bulletin de l'OMS, recueil
d'articles N° 2, 2000, pp
140-145.
34. Newman R.D., Hailemariam A., Jimma D., Degifie
A., Kebede D., Rietveld A.E., Nahlen B.L., Barnwell J.W.,
Steketee R.W., Parise M.E. Burden of malaria during pregnancy in areas
of stable and unstable transmission in Ethiopia during a nonepidemic
year. Journal of Infectious Diseases 187 ; 2003, pp 1765-
1772.
35. Newman R.D., Parise M.E., Slutsker L., Nahlen B.
and Steketee R.W. Safety, efficacy and determinants of effectiveness
of antimalarial drugs during pregnancy: implications for prevention programs in
Plasmodium falciparum-endemic sub-saharan Africa. Tropical Medicine and
International Health. 2003. Vol. 8. no 6. pp
488-506.
36. Nosten F., Mc Gready R., Looareesuwan S. and White
N.J. Maternal malaria: time for action. Tropical
Medicine and International Health. June 2003.
8 pp. 485-487.
37. OMS. L'utilisation des antipaludiques:
rapport d'une consultation informelle de l'OMS. 13-17novembre
2000 Genève 2001, 156p.
38. OMS. Rapport sur la santé dans le
monde 2001. Organisation Mondiale de la Santi.
Génève.
39. Ouédraogo A. L. Hémoglobines
S et C et tableau clinique du paludisme de l'enfant de moins de cinq ans dans
le district sanitaire de Tenkodogo, Burkina-faso. Mimoire de
DEA. 2002. 44p.
40. Parise M.E., Ayissi J. G., Nahlen B.L., Schultz
l.J., Roberts J.M., Misore A., Muga R., Oloo A.J., and Steketee R.W.
Efficacy of sulfadoxine-pyrimethamine for prevention of placental malaria in
area of Kenya with a high prevalence of malaria and human immunodeficiency
virus infection. American Journal of Tropical
Medicine and Hygiene. 1998, 59 (5), pp 813-822.
41. Parise M.E., Lewis L.S., Ayisi J. G., Ahlen
B.L.N., Slutsker L., Muga R., Sharif S.K., Hill j. and Steketee R. W.
A rapid assessment approch for public health decision-making related to the
prevention of malaria during pregnancy. Bulletin of IFHO.
Volume 81 N° 5. Genebra 2003. pp 1-19.
42. Rogerson S.J., Chaluluka E., Kanjala M., Mkundika
P., Mhango C. and Molyneux M.E. Intermittent
sulfadoxine-pyrimethamine in pregnancy: effectiveness against malaria morbidity
in Blantyre, Malawi, in 1997-99. Transaction of the Royal Society of
Tropical Medicine and Hygiene. 2000. 94, pp.
549-553.
43. Rozendaal J.A.. La lutte anti-vectorielle:
Méthodes à usages individuels et communautaires. Genève,
OMS. 1999; 449p.
44. Rutgers S. Two years maternal mortality in
Matebeland north Province, Zimbabwe. Central African Journal
ofMedicine. 2001 47, 39-43.
45. Sanou B. Efficacité
thérapeutique de la chloroquine et de la
sulfadoxine-pyriméthamine dans le traitement du paludisme simple
à Plasmodium falciparum au Burkina Faso.
Mimoire de Master of Science. Antwerpen, 2003.
46. Shulman C.E., Dorman E.K., Cutts F., Kawuondo K.,
Bulmer J.N., Peshu N. Intermittent sulfadoxine-pyrimethamine to
prevent severe anaemia segondary to malaria in pregnancy: a randomized
placebo-controlled trial. Lancet, 1999, 353
pp 632-63.
47. Shulman C.E., Graham W.J., Jilo H., Lowe B.S.,
New L., Obiero J., Snow R.W., Marsh K. Malaria is an important cause
of anaemia in primigravidae: evidence from a district hospital in coastal
Kenya. Transaction of Royal Society and Tropical Medicine and Hygiene.
90: 1996, pp 535-539.
48. Shultz L.J., Steketee R.W., Macheso A. Kazembe
P., Chitsulo L. and Wirima J.J. The efficacy of antimalarial regimens
containing sulfadoxine-pyrimethamine and/or chloroquine in preventing
peripheral and placental Plasmodium falciparum infection among
pregnant women in Malawi. The American Journal of Tropical Medicine and
Hygiene. 51(5) 1994, pp. 515-522.
49. Sirima S. B., Bougma E. C., Konaté A.,
Tiono A., Diarra A. et Doumbo O. Morbidité du paludisme en zone
hyper-endémique du Burkina Faso: étude de l'indice plasmodique et
de l'incidence des formes cliniques. 12+mesjourn!es des sciences de la
sante de Bobo-Dioulasso. 2004, p 41.
50. Sirima S.B., Cotte A.H., Konaté A., Moran
A.C, Asamoa K., Bougouma E.C., Diarra A., Ouédraogo A., Parise M.E. and
Newman R.D. Malaria prevention during pregnancy: assessing the disease
burden one year after implementing a program of intermittent preventive
treatment in Koupéla district, Burkina Faso. American Journal of
Tropical Medicine and Hygiene. 75(2), 2006, pp. 205-211.
51. Sirima S.B., Sawadogo R., Moran A.C.,
Konaté A., Diarra A., Yaméogo M., Parise M.E. and Newman
R.D. Failure of a Chloroquine Chemoprophylaxis Program to Adequately
Prevent Malaria during Pregnancy in Koupéla District, Burkina
Faso: Clinical and Infectious Disease. 2003,
36. pp 1374-1382.
52. Steketee R. W.; Wirima J.J., Slutsker L., Heymann
D.L. and Breman J. G. The problem of malaria and malaria control in
pregnancy in sub-Saharian Africa. American Journal of Tropical Medicine
and Hygiene 1996. 55 (suppl.1), pp 2-7.
53. Steketee R.W., Breman J. G., Paluku K.M., Moore
M., Roy J. and Ma-Disu M. Malaria infection in pregnant women in
Zaire: The effects and the potentiel for intervention. Annals of
Tropical Medicine and Paragytology. 1988. 82,
pp.113-120.
54. Steketee R.W., Nahlen B.L., Parise M.E. and Menendez
C. The burden of malaria in pregnancy in malaria-endemic
areas. American Journal of Tropical Medicine and Hygiene
2001. 64, suppl. pp 28-35.
55. Tinto H., E.B. Zoungrana, S.O. Coulibaly, J.B.
Ouédraogo, M. Traoré, T. R. Guiguemdé, E.
Van Mark and U. D'Alessandro. Chloroquine and
sulfadoxine-pyrimethamine efficacy for uncomplicated malaria treatement and
haematological recovery in children in Bobo-Dioulasso during a 3 years period
1998-2000. Tropical medicine and International health. 2002,
Volume 7 pp 925-930.
56. Tinto H., J.B. Ouédraogo, Traoré
B., Coulibaly S.O. et Guiguemdé T.R. Etude de la
sensibilité in vitro de 232 isolats de
Plasmodium falciparum aux antipaludéens au Burkina
Faso. Bulletin de la Societe de Pathologies Exotiques.
2001, 94, 2 bis, pp 188-191.
57. Toé R., Henry M. C., Sia D.,Lanou H., Ki
J. P., Koudogbo V., Korgo P., Roberfroid D., Tinto H., D'Alessandro U.,
Kolsteren P., Méda N., Ouédraogo J.B. et Guiguemdé
T.R. Infestation palustre chez la femme enceinte en saison
sèche dans le district sanitaire de Houndé (résultats
préliminaires.). 12es journ!es des sciences de la sante de
Bobo-Dioulasso. 2004, p 5.
58. Tolba K. M. Conditions de vie et de
bien-être des personnes. Dans: Sauvons la
planète. London. Chapman et Hall. 1992, pp 147-209.
59. Trape J.F. The dielmo project: A
longitudinal study of natural malaria infection and the mechanisms of
protective immunity in community living in a holo endemic area of
Senegal. American Journal of Tropical Medicine and Hygiene.
1994; 5 (1) 123'137.
60. Verhoeff F.H., Brabin B.J., Chimsuku L., Kazembe
P., Russel W.B. and Broadhead R. L. An evaluation of the effects of
intermittent sulfadoxine- pyrimethamine treatment in pregnancy on parasite
clearance and risk of low birthweight in rural Malawi. Annals of
tropical Medicine and Parasitology. 1998. 92. pp 141'
150.
61. WHO & UNICEF. The African malaria
Report 2003. 117 p.
62. WHO. Chemotherapy of malaria and resistance
to antimalarials. Report of a WHO Scientific Group. Geneva.
1973. (WHO Technical Report Series, N░ 529).
63. WHO. Report of the African regional
consultation on control of anemia in pregnancy. Geneva 1999: WHO,
mimeographed document, AFR/MCH/86.
64. WHO. Severe Plasmodium
falciparum malaria. Transaction of The Royal Society of
Tropical Medicine and Hygiene. 2000. 94
(Suppl. 1) p 90 .
65. Wickaramsuriya G.A.W. Clinical Features of
Malaria in Pregnancy: malaria and Ankylostomiasis in Pregnant
women. 1937 London: Oxford University Press.
66. Zabré S.E. et Guiguemdé
T.R. Etude de la sensibilité in vivo
de Plasmodium falciprum à l'amodiaquine vs
chloroquine en milieu urbain périphérique de Bobo'
Dioulasso selon le test standard OMS de 14 jours. 1998 (Poster).
67. Zon H. et Barrere M. dans Enquête
démographique et de Santé de la population 2003,
TNSD ; pp 189' 202.
ANNEXES
FICHE D'INFORMATION DU PATIENT
Nous aimerons que vous participiez à une étude
médicale sur laquelle nous vous donnerons tout de suite des
informations. Avant toute décision de votre part, nous voudrions vous
dire que :
· votre participation est entièrement volontaire.
· Vous pouvez refuser de participer à
l'étude à tout moment ; le refus de participer à
l'étude n'entraînera pas de pénalités ou de perte de
bénéfices auxquels vous aviez entièrement droit au CM de
Boussé. Si vous décidez de vous retirer de l'étude plus
tard, prenez seulement soin d'informer un membre de l'équipe de
recherche ou informez l'investigateur principal.
Introduction :
Le paludisme est une cause importante de souffrance et de
décès des femmes en grossesse au Burkina Faso. Il est
causé par un parasite qui est normalement transmis à l'homme par
les piqûres de moustiques.
Sur financement du Programme spéciale de Recherche sur
les Maladies Tropicales (OMS/TDR), le Centre National de Recherche et de
Formation sur le Paludisme est en train de mener une recherche pour voir la
meilleure chimioprophylaxie antipalustre chez la femme en grossesse dans votre
district. Cela va nous aider à trouver les meilleurs moyens pour
prévenir les effets du paludisme sur les femmes enceintes et leurs
bébés.
Comme vous le savez, vous pouvez parfois avoir le paludisme et
vous sentir malade. Mais parfois, il se peut que vous ayez le paludisme sans
pour autant vous sentir malade. Le meilleur moyen pour nous de savoir combien
de femmes ont ce problème est de tester le sang des femmes. De
même lorsque vous êtes enceinte et que vous avez le paludisme, il
se peut que le bébé naisse petit et faible même si vous ne
vous êtes pas sentie malade. Pour nous, la seule façon de savoir
combien de femmes peuvent avoir ce problème est de tester le sang du
placenta (le délivre) après la naissance du bébé.
Nous proposons d'étudier ces problèmes chez environ 684 femmes
dans le district.
Cette étude a été approuvée par le
Comité d'Ethique sur la Recherche en Santé du Burkina Faso. Votre
participation à cet essai pourrait être votre contribution
à la recherche de solution à ce fléau qui frappe durement
les enfants et les femmes enceintes du Burkina Faso..
Procedures :
Avant de démarrer l'étude un médecin va
tout d'abord vous demander si vous avez déjà eu des effets
secondaires à des médicaments par le passé. Si vous avez
eu de tels problèmes après avoir pris un des médicaments
que nous allons utiliser pour le traitement du paludisme, vous ne pouvez pas
participer à l'étude.
- A chaque CPN, un médecin va poser des questions sur
vous et sur votre santé depuis que vous êtes tombée
enceinte. Il examinera votre fiche clinique, prendra votre température
et votre poids. Il vous distribuera soit de la chloroquine soit de la
Sulfadoxine-pyriméthamine. Le choix du médicament ne
dépend du médecin mais est tiré au sort. Avant de recevoir
le médicament, une carte d'identification vous sera
délivrée. Selon votre groupe vous recevrez
* Groupe 1 : dose curative au premier contact
ensuite chloroquine 300 mg/semaine pendant toute la grossesse
* Groupe 2 : Chloroquine en traitement
intermittent, première cure au contact, deuxième cure au
7ème mois et troisième cure le 8ème
mois de gestation. La cure consiste en un traitement de 25mg/kg réparti
en trois jours (10 mg J0, 10 mg le J1 et 5 mg le J2 soit 6 comprimés de
Chloroquine 100mg J0, 6 cpJ1 et 3 cpJ2)
* Groupe 3 :
Sulfadoxine-pyriméthamine en traitement intermittent, première
cure au contact, deuxième cure au 7ème mois et
troisième cure le 8ème mois de gestation. La cure
consiste en une dose unique de SP 1,5g/0,075g soit 3 comprimés
* Quelque soit son groupe, toute femme qui fera un accès
palustre sera traitée à la chloroquine si c'est un accès
palustre simple et à la quinine si c'est un cas de paludisme grave.
Il vérifiera ensuite la prise des médicaments en
prélevant des urines pour le dosage des métabolites.
L'infirmier fera un prélèvement capillaire
à la pulpe du doigt pour voir si vous n'êtes pas
anémiées. Le prélèvement servira également
à la confection d'une goutte épaisse/frottis mince pour la
recherche de parasites du paludisme. Il utilisera une nouvelle aiguille pour
chaque personne. Si vous avez eu de la fièvre récemment, il
examinera votre sang de suite pour voir si vous avez le paludisme. Ils vous
demanderons d'attendre au centre médical le jour même
jusqu'à ce que l'on obtienne les résultats. Cela prendra 30
à 45 minutes supplémentaires. Si lui ou le médecin
trouvent que vous avez le paludisme, ils vous traiterons avec un
médicament appelé Chloroquine. S'ils trouvent également
que vous avez besoin d'être traitée pour l'anémie, ils en
informeront le personnel clinique pour qu'il ne manque pas de vous donner un
traitement en observant les règlements cliniques.
Vous passerez quand même la visite médicale pour
l'examen clinique régulier avec le personnel de la clinique. Les
traitements anti-paludiques et la supplémentation en fer/acide folique
seront donnés gratuitement. Les autres affections (infections
uro-génitales, pneumopathies, HTA) seront prises en charge
gratuitement.
- Au moment de l'accouchement avant la naissance du
bébé, l'infirmier prélèvera quelques gouttes de
sang au bout de votre doigt pour voir si votre sang est atteint de paludisme.
Il utilisera une nouvelle aiguille pour chaque personne. Si vous avez de la
fièvre et qu'il décèle le paludisme dans votre sang avant
la naissance du bébé, il vous traitera avec de la Chloroquine. Si
vous ne vous sentez pas malade mais qu'il trouve du paludisme dans votre sang
avant la naissance du bébé, il vous demandera de revenir dans la
semaine pour pouvoir tester de nouveau votre sang. Nous faisons cela parce que
souvent le paludisme disparaît après la naissance du
bébé. Si vous avez encore le paludisme, il vous traitera avec de
la Chloroquine.
Après que vous aurez accouché, le médecin
et l'infirmier pèserons et examinerons votre bébé. Ils
examineront de même le placenta et le cordon qui vous relie au
bébé pour voir si on y trouve les parasites du paludisme. Il est
rare que l'on trouve le paludisme dans la corde qui vous relie au
bébé, mais si c'est le cas, ils vous demanderont de revenir une
semaine après la naissance pour qu'ils puissent prélever du sang
sur le bébé (avec une piqûre au talon). S'ils trouvent que
le bébé est atteint de paludisme, Ils le traiteront avec de la
Chloroquine.
Après l'accouchement, le médecin prendra environ
une demi-heure pour vous poser des questions, vérifier votre
température et mesurer votre taille et la circonférence de votre
bras. Risques:
Vous-même ou le bébé allez sentir une
« piqûre » qui va durer quelques secondes lorsqu'on va vous
piquer le doigt ou le talon de votre bébé pour prendre du
sang.
La Chloroquine est efficace pour traiter le paludisme et a
été utilisée sans risque pour traiter le paludisme chez
les adultes et les enfants. Si vous ou votre bébé avez des effets
secondaires que vous pensez être dus à la chloroquine, veuillez
revenir à la clinique de suite pour voir l'un des médecins et
vous faire traiter.
Comme vous le savez, nous sommes toujours
préoccupés par le fait que des événements anormaux
puissent survenir alors que vous êtes enceinte qui pourraient affecter le
bébé que vous portez. Il se peut que vous ayez vu des
bébés qui sont nés avec des anomalies. Nous ne pouvons
rien contre ces dernières et ce n'était pas de la faute de la
femme ni du personnel de la clinique. Si nous vous traitons avec un
médicament, nous en utilisons seulement un que nous considérons
être très sûr et qui ne causerait aucun de ces
problèmes.
Bénéfices :
En tant que volontaire participant à l'étude
vous-même et/ou votre bébé bénéficierez d'un
suivi médical attentif et gratuit. Vous serez traités si vous
avez le paludisme avant et une semaine après la naissance. Les autres
affections (infections uro-génitales, pneumopathies, HTA) seront prises
en charge gratuitement. Les résultats de cette étude nous
aideront à savoir comment prévenir au mieux le paludisme chez les
femmes enceintes dans le district.
Assurance de confidentialité de l'identité des
participants:
Les informations vous concernant ou que vous donnerez à
l'équipe de recherche, resteront confidentielles et seront seulement
vues par un nombre défini de personnes du CNRFP et par les organisations
comme le Comité d'Ethique sur la Recherche en Santé du Burkina
Faso qui sont responsables de la bonne conduite de l'essai. Toutes ces
personnes se sont engagées par écrit à respecter le secret
sur ce qu'ils ont pu être amenés à savoir vous
concernant.
Dans tous les rapports, les participants seront
repérés seulement par un numéro de l'étude.
L'accès aux fiches sera limité seulement aux membres de
l'équipe de recherche et tous les fichiers seront tenus dans des
armoires fermées à clé. Les informations collectées
pourraient être réexaminées de façon anonyme (sans
votre identité) par les représentants du Comité d'Ethique
sur la Recherche en Santé du Burkina Faso, en fonction de leur part de
responsabilité dans la recherche. Vous recevrez une copie de ce
consentement. Toutes les fiches de consentement seront gardées à
la fin de l'étude dans une enveloppe scellée qui sera remise au
promoteur. Votre identité complète (nom, adresse) sera
détachée de toutes les fiches et conservée dans un endroit
où seule une personne aura le droit d' y accéder. Les
informations que nous collectons seront conservées pendant au moins 15
ans.
Résultats de l'étude :
Au cours et à la fin de l'étude vous serez
informé des résultats qui vous concernent comme les
résultats de tous les tests réalisés à partir de
vos prélèvements de sang. Une copie de ces résultats vous
sera donnée et expliquée. A la fin de l'étude le Dr Sirima
vous informera, comme tous les
autres volontaires des résultats de cette étude et
de leur importance pour la recherche de la meilleur chimioprophylaxie
antipalustre chez la femme en grossesse.
Adresses utiles avant et pendant toute l'étude:
Pour toute information complémentaire relatif à
l'essai ou à votre état de santé contacter Dr. Sodiomon
Bienvenu SIRIMA au Centre National de Recherche et de Formation sur le
paludisme : Standard: 32 46 95, 32 46 96, ligne directe : 30 12 86 ou Mobile:
20 04 44
Pour des informations concernant vos droits en tant que
participant à l'essai contacter le comité Institutionnel de
Bio-ethique du CNRFP tel .... Ou le comité National sur l'Ethique dans
la recherche en santé S/c Ministère de la Santé Tel: 226
32 41 76
|
IDENTIFICATION DU SUJET
|
|
Date de la visite
|
|
Investigateur
|
|
Numéro d'ordre
|
|
|
Centre de Santé
|
|
Initiaux Nom et prénom de la patiente
|
|
Code de l'étude
|
|
|
ADMISSION: la Gestante répond 't' elle aux critères
d'inclusion? Inclusion (O/N) [toutes doivent etre oui]
|
Répondre aux questions ci'dessous
Exclusion
(O/N) [toutes doivent etre non]
|
|
Femme enceinte résidant dans le district de Boussé
(O/N)
|
|
Femme enceinte non résidante dans le district sanitaire de
Boussé (O/N)
|
|
|
Femme en consultation pré natale (O/N)
|
|
Age gestationnel < 15 semaines ou > 25 semaines
d'aménorrhées (O/N)
|
|
|
Age gestationnel compris entre 15 et 25 semaines (O/N)
|
|
Antécédents d'allergie à la chloroquine et
aux sulfamides (O/N)
|
|
|
Première CPN (O/N)
|
|
Refus de signer le consentement (O/N)
|
|
|
|
Grossesse pathologique (O/N)
|
|
|
ANNEXER LE FORMULAIRE DE CONSENTEMENT
ENRE GISTREMENT: Si toutes les réponses aux
critères d'inclusion sont OUI et celles des critères d'exclusion
sont NON, alors procéder a l'enregistrement de la gestante:
· Randomiser le patiente dans un groupe de
traitement
· Attribuer a la gestante un numéro et
remplir son identité comme indiqué ci-dessus
· Remplir les informations
sociodémographiques ci-dessous
|
SOCIO-DEMO GRAPHIE
|
Langue parlée couramment*
|
|
Age (en années)
|
|
Date de naissance (JJ/MM/AAAA)
|
|
Ethnie
|
|
Situation matrimoniale
|
Mariée (O/N)
|
|
Divorcée(O/N)
|
|
|
|
Célibataire(O/N)
|
|
Profession
|
Ménagère (O/N)
|
|
Fonctionnaire(O/N)
|
|
|
|
Elève (O/N)
|
|
|
· Mener l'interview dans la langue couramment parlée
par la patiente
Information confidentielle: remplir Nom et
prénom du la patiente
|
sans abréviation - découper cette
partie
|
de la page et conserver Numéro
d'ordre
|
a part
|
Nom du conjoint
|
|
Code de l'étude
|
|
Village
|
|
Quartier
|
Département
|
|
|
IDENTIFICATION DU SUJET
|
Date de la visite
|
|
Investigateur
|
|
Numéro d'ordre
|
|
Centre de Santé
|
|
Initiaux Nom et prénom de la patiente
|
|
Code de l'étude
|
|
· Randomiser dans le groupe de
traitement
|
Groupe de traitement (1, 2, 3)
· ACCES AU CENTRE MEDICAL COMBIEN DE TEMPS AVEZ
VOUS MIS POUR VENIR ICI (MINUTES)
|
|
|
DISTANCE DE VOTRE HABITATION DU CENTRE DE SANTE (EN
KM)
|
|
· ANTECEDENTS Nombre de grossesse
|
|
CLINIQUES,
Parité
|
GYNECO-OBSTETRICAUX
ET PREVENTION DU PALUDISME Nbre d'avortement
Nbre de naissances vivantes
|
|
Fièvre pendant cette grossesse (O/N)
|
Fièvre pendant les 7 derniers jours (O/N)
|
|
Prise d'antipaludique pendant la grossesse (O/N)
|
Prise d'antipaludique les 7 derniers jours (O/N)
|
|
Possession de
Matériaux Imprégnés ou non
|
Moustiquaire non imprégnés
|
|
Moustiquaire Imprégnée
|
|
|
|
Rideaux imprégnés
|
|
Si oui à possession de
moustiquaire, préciser la
fréquence
d'utilisation
· DONNEES DE LA VISITE
Age gestationnel
(semaine)
|
6 à 7 fois par semaine
|
|
3 à 5 fois par semaine
|
|
|
|
N'utilise pas
|
|
|
Hauteur utérine (en cm)
|
|
Saisons sèche
Poids (en kg)
|
|
Taille de la parturiente (en cm)
|
|
Tension artérielle
|
Max (mm) Min (mm):
|
|
Vaccin anti'tétanique dose 1 (O/N)
· EXAMEN ET TRAITEMENT Température
axillaire
|
DU JOUR
Taux en
|
Syphilis positif (O/N)
d'hémoglobine
g/dl
|
|
|
OMI
Prélèvement pour GE/ Frottis (O/N)
|
|
Test rapide de diagnostic du
paludisme (O/N) *
|
Prélèvement d'urine (O/N)
|
|
Nombre de comprimés remis à la patiente pour sa
chimioprohylaxie du paludisme
|
Nombre de comprimé de fer remis
|
|
Date de la prochaine CPN
|
------------/------------/200----
|
|
IDENTIFICATION DU SUJET
|
Date de la visite
|
|
Investigateur
|
|
Numéro d'ordre
|
|
Centre de Santé
|
|
Initiaux Nom et prénom de la patiente
|
|
Code de l'étude
|
|
· Groupe de traitement
|
Groupe de traitement (1, 2, 3)
|
|
La gestante est elle venue d'elle-même à la CPN
programmée ? (O/N)
|
|
· ANTECEDENTS CLINIQUES ET PREVENTION
Fièvre depuis la dernière visite prénatale
(O/N)
|
|
DU PALUDISME
Fièvre pendant les 7 derniers jours (O/N)
|
|
Traitement d'un accès palustre depuis la dernière
visite prénatale (O/N)
|
|
Si oui le quel
antipaludique
|
Avez'vous avalé tous les comprimés antipaludiques
qui vous étaient remis (O/N)
|
|
Vous est il arriver d'oublier d'en prendre pendant certaines
semaine ?* (O/N)
|
|
Combien de comprimés avez-vous pris par
semaine ?*
|
|
Vérifier combien de comprimé d'antipaludique reste
t il ?
|
|
Combien de temps après votre retour de la CPN avez-vous
pris vos antipaludiques ? (en jour)
|
|
Les avez-vous pris du coup ? (O/N)
|
|
Si non en combien de jours ?
|
|
Combien de comprimés par jour ?
|
|
Avez'vous avalé tous les comprimés de fer qui
vous était remis ?
|
|
Combien de comprimés de fer avez'vous pris par jour
|
|
Vérifier combien de comprimés de fer reste t il
?
|
|
Utilisation de moustiquaire depuis la dernière
consultation
· DONNES DE LA VISITE PRENATALE Age
gestationnel (semaine)
|
6 à 7 fois par semaine (O/N) 3 à 5 fois par
semaine (O/N)
|
|
|
1à
2 fois par
|
semaine (O/N) N'utilise pas (O/N)
Hauteur utérine (en cm)
|
Poids (en kg)
|
|
Taille de la parturiente (en cm)
|
|
Tension artérielle Max (mm)
|
Min (mm):
|
|
Vaccin anti-tétanique dose 2 (O/N)
· EXAMEN ET TRAITEMENT Température
axillaire
|
|
DU JOUR
Taux
|
Syphilis positif (O/N)
d'hémoglobine Prélèvement
|
OMI
pour GE/ Frottis
|
|
Test rapide positif (O/N) **
|
|
Prélèvement d'urine (O/N)
|
|
Nombre comprimer remis à la
patiente pour sa chimioprohylaxie
|
|
Nombre de comprimé de fer remis
|
|
Date de la prochaine CPN
|
|
|
IDENTIFICATION DU SUJET
|
Date de la visite
|
|
Investigateur
|
|
Numéro d'ordre
|
|
Centre de Santé
|
|
Initiaux Nom et prénom de la patiente
|
|
Code de l'étude
|
|
· Groupe de traitement
|
Groupe de traitement (1, 2, 3)
|
|
La gestante est elle venue d'elle-même à la CPN
programmée ? (O/N)
|
|
· ANTECEDENTS CLINIQUES ET PREVENTION
Fièvre depuis la dernière visite prénatale
(O/N)
|
|
DU PALUDISME
Fièvre pendant les 7 derniers jours (O/N)
|
|
Traitement d'un accès palustre depuis la dernière
visite prénatale (O/N)
|
|
Si oui le quel
antipaludique
|
Avez-vous avalé tous les comprimés antipaludiques
qui vous étaient remis (O/N)
|
|
Vous est il arriver d'oublier d'en prendre pendant certaines
semaine ?* (O/N)
|
|
Combien de comprimés avez-vous pris par
semaine ?*
|
|
Vérifier combien de comprimé d'antipaludique reste
t il ?
|
|
Combien de temps après votre retour de la CPN avez'vous
pris vos antipaludiques ? (en jour)
|
|
Les avez'vous pris du coup ? (O/N)
|
|
Si non en combien de jours ?
|
|
Combien de comprimés par jour ?
|
|
Avez'vous avalé tous les comprimés de fer qui
vous était remis ?
|
|
Combien de comprimés de fer avez'vous pris par jour
|
|
Vérifier combien de comprimés de fer reste t il
?
|
|
Utilisation de moustiquaire depuis la dernière
consultation
· DONNES DE LA VISITE PRENATALE Age
gestationnel (semaine)
|
6 à 7 fois par semaine (O/N) 3 à 5 fois par
semaine (O/N)
|
|
|
semaine (O/N) N'utilise pas (O/N)
Hauteur utérine (en cm)
|
Poids (en kg)
|
|
Taille de la parturiente (en cm)
|
|
Tension artérielle Max (mm)
|
Min (mm):
|
|
Vaccin anti'tétanique dose 3 (O/N)
· EXAMEN ET TRAITEMENT Température
axillaire
|
|
DU JOUR
Taux
|
Syphilis positif (O/N)
d'hémoglobine Prélèvement
|
OMI
pour GE/ Frottis
|
|
|
|
Test rapide positif (O/N) **
|
|
Prélèvement d'urine (O/N)
|
|
|
Nombre comprimer remis à la
patiente pour sa chimioprohylaxie
|
|
Nombre de comprimés de fer remis
|
|
|
Une autre CPN est elle nécessaire
|
|
Si oui pourquoi
|
|
Date de la
nouvelle CPN
|
|
Dédicaces
tW-ma mere
tWtoi ma mere ra a toyoemS ma&
re toinik gat meileeki4p de-Wee wile gege. t9X k4ylleg an/nieg
efekiekg ne m/o/nt fru' toyatmlibmna eraegiumeio meg
rezOoingaiiitegf ck,ore/mie,,A, eerie' n/a hag mztermi ta
ibeu et ta adointe'grthge mow/ &mead to eolzgo kio ek eeg
nowaretedeg affprileg ek doateg et aye ciek rep n/ai frig toyatmS gm
comae/A t~~oWe mat to étheilietiow, ?rn, re ma noelleeik ale
goitiraefrzeueSe et Ito/no/mak freto tai et megireeg et gang.
A mesfreres et sceurs
911amounata, Daouda, Cheick Ibrahim,
Doudou, Xadidiatou et Sophie
A mes amis
Ouédraogo G. (Yves, Ouedraogo Sayouba
Xossodo, Oubda Erançoise, Ouédraogo Richard de Xopa et
Ouoba
niche(
A mes camarades
Dr Xarama Robert, Sawadogo Abdramane, Dr
Lankoandé .7-fermann, Dr Toguiyini Zackaria,
Xoudougou Jean-Baptiste,
Dr Zigani .7-farouna
| 


