3.3) Comparaison des résultats entre la classe
témoin et les classes expérimentales
Comparaison des réponses exactes de la classe
témoin à ceux des classes expérimentales après les
enseignements et elles sont traduites dans la figure 10.
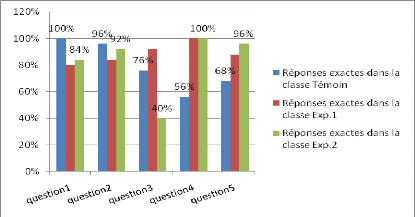
Figure 10 : Comparaison des réponses exactes
de la classe témoin à ceux des classes expérimentales
après les enseignements.
La figure 10 montre que le taux des réponses exactes
est très élevé dans les deux classes expérimentales
par rapport à la classe théorique ou témoin. Cette
différence est très remarquable et importante pour les questions
n°4 et 5 qui font appels à une manipulation ou activité
expérimentale, elle traite la notion du test d?ion. Au niveau de la
question n°4 on constate un écart de 40% ente les classes A et B et
la classe théorique, cet écart est environ de 30% à la
5ème question.
A partir de ces résultats, nous pouvons dire que le
cours expérimental contribue mieux à la compréhension des
notions par les élèves que le cours théorique.
3.4) Les activités réalisées
Cette partie présente le déroulement du cours
théorique dans la classe témoin, et une synthèse du
déroulement des cours TP dans les deux classes expérimentales 1
et 2.
A) Présentation
Nous avons choisi de tester une activité
expérimentale portant sur la réaction chimique. Les objectifs
visés à notre étude sont :
· L?objectif général : caractériser
les ions en solution aqueuse ;
· L?objectif spécifique 1 : mettre en
évidence l?existence des ions dans un composé ;
· L?objectif spécifique 2 : utiliser les
caractéristiques d?un ion pour son identification.
B) Condition de réalisation
a. Présentation des classes
expérimentales
Les activités sont réalisées au
lycée Chaminade dans la seconde C12 et C10. Le test d?identification des
ions fait partie du chapitre de la Réaction Chimique, et l?enseignant a
développé le premier objectif général qui demande
de caractériser les ions en solution aqueuse et le
second à caractériser un ion pour son
identification. Les activités se sont déroulées au cours
d?une séance de deux heures (2) dans les deux classes. L?effectif des
élèves dans chacune des classes est de vingt cinq (25)
élèves. Les photos 4, 5 et 6 (voir l?annexe) représentent
la disposition des élèves dans les deux classes
expérimentales.
Le début de la séance a été
précédé par un entretien préalable avec
l?enseignant pour lui préciser nos attentes et lui suggérer une
stratégie. Il faut souligner que dans les deux classes
expérimentales nous avons travaillé avec le même
enseignant. Nous avons ensemble avec l?enseignant monté le protocole
expérimental et les différentes étapes de la leçon.
Dans cet entretien nous avons donné des précisions à
l?enseignant sur les stratégies de la manipulation à savoir :
v' L?évaluation écrite avant l?enseignement ;
v' Le contrôle de pré-requis ;
v' La présentation de la situation problème ;
v' La phase des explications ;
v' La présentation des manipulations ;
v' La consolidation des notions ;
v' L?évaluation écrite après
l?enseignement.
L?enseignant a respecté son cheminement habituel :
salutation, contrôle des présences...à l?exception des
éléments ou stratégies précités.
b. L'évaluation avant l'enseignement
Dans cette phase nous avons procédé à la
remise des questionnaires d?évaluation aux élèves, elle
est aussi appelée évaluation diagnostique : les
élèves se sont mis au travail. Le but de cette séquence
est de voir les difficultés des apprenants et elle a duré en
moyenne dans les deux classes six (6) minutes.
c. Contre des prérequis Nous avons
demandé dans cette phase à l?enseignant de poser des
questions sur la notion enseignée, afin de
repérer les différentes conceptions des élèves qui
permettront à l?enseignant de bien présenter la situation
problème.
d. Présentation de la situation
problème
Selon RAYNAL et REUNIEN (1997) la situation problème
« c?est une pédagogie conçue par l?enseignant dans le but de
créer pour des élèves, un espace d?analyse autour d?un
problème à résoudre. De permettre également aux
élèves de conceptualiser des nouvelles représentations sur
un sujet précis à partir de cet espace problème »
Pour notre travail, on peut dire que son objectif est aussi
d?identifier et de chercher les éléments pour l?explication et la
résolution du problème.
Nous avons demandé à l?enseignant de prendre
des exemples dans la vie quotidienne ou dans l?environnement des
élèves afin de leur faire percevoir l?intérêt des
activités expérimentales.
e. Les explications
Dans cette phase d?explication nous avons
suggéré au professeur d?expliquer avec précision, comment
mettre en évidence les ions dans un composé et le test qui sert
à identifier un ion en solution aqueuse. Le professeur doit ainsi briser
les conceptions des élèves sur les notions enseignées.
f. La manipulation
Nous avons présenté les différentes
stratégies de la manipulation au professeur pour le bon suivi du
protocole expérimental que nous avons monté de la manière
suivante :
Protocole
expérimental
· L'objet du TP est de savoir
identifier les ions présents dans l?eau en faisant un test.
· Matériel et produit pour la
classe
v' Solution Hydroxyde de sodium (pour les ions cuivre)
v' Solution aqueuse de nitrate d?argent (pour les ions chlorure)
v' Solution d?eau minérale contenant des ions Cl-
v' Les tubes à essais (5)
v' Compte gouttes
v' Béchers (3)
Voir à l?annexe les photos des matériels
utilisés
+ Problématique :
Comment pourrai-t-on vérifier qu?une solution contient
bien les ions indiqués.
+ Hypothèses :
L?eau minérale renferme les ions chlorure
Cl-, et la solution de sulfate de cuire contient les ions
cuivre Cu2+.
+ Protocole
On va utiliser le fait que l?addition :
-de la solution de nitrate d?argent (AgNO3) à une
solution contenant les ions chlorure Cl- donne un
précipité blanc de chlorure d?argent AgCl2 qui
noirci à la présence de la lumière.
- de la solution Hydroxyde de sodium à
une solution contenant les ions sulfate SO donne un précipité
Bleu d?hydroxyde de cuivre Cu(OH)2. Verser dans deux tubes
à essais quelques cm3 de (Cu2+,
SO42-) dans A et d'eau minérale B ; ajouter
quelques gouttes de la Soude dans A et de nitrate d'argent dans
B.
+ Observation
Apparition immédiate d?un précipité blanc
dans A de chlorure d?argent AgCl2 qui noirci à la présence de la
lumière ;
Apparition immédiate d?un précipité blanc
dans B.
+ Equations bilan
Dans le flacon A : Ag+ + Cl- AgCl
Dans le flacon B : Cu2+ + 2OH- Cu(OH)2
+ Conclusion
Les hypothèses sont vérifiées, l?eau
minérale renferme bien des ions
chlorure (Cl-) et le
sulfate de cuivre renferme bien les ions cuivre II
Cu2+
| 


