|
REPUBIQUE ALGERIENNE DEMOCRATIQUE &
POPULAIRE


Ministère de l'Enseignement Supérieur
& Recherche Scientifique
Université de Hassiba Ben Bouali
-Chleff
Faculté des Sciences
Département de Biologie
Option : Nutrition Humaine
Niveau : Master 2
Mémoire fin d'étude
Sur
DOSAGE DES POLYPHENOLS DE LA
TOMATE « Agora »
ET ETUDE DE
LEUR POUVOIR ANTIOXYDANT
Présentée par :
Hireche Messaouda
Devant le jury composant
de :
Melle Koiche Malika Maître de
conférences UHBBC Présidente
Mme Allem Rachida Maitre de conférences
UHBBC Promotrice
Mme Tabti Maître
assistante UHBBC Examinatrice
Mr Bouguerrah Maître assistant
UHBBC Examinateur

Promotion : 2012-2013
TABLE DES MATIERES
|
|
|
|
|
Résumé
|
|
|
Abstract
|
|
|
Liste des Figures
|
|
|
Liste des Tableaux
|
|
|
Liste d'Abréviations
|
|
|
Introduction
|
01
|
|
PARTIE 1 : SYNTHESE BIBLIOGRAPHIQUE
|
|
|
I . La tomate
|
|
|
1)
Généralités ...........................................................................
|
03
|
|
2) Description botanique
...............................................................
|
05
|
|
3) Croissance et développement
......................................................
|
05
|
|
4) Composition du fruit et des feuilles de la tomate
................................
|
06
|
|
4.1 Composition des feuilles.
.................................................
|
06
|
|
4.2 Composition des fruits
....................................................
|
07
|
|
5) Tomate et qualité du fruit
...........................................................
|
09
|
|
5.1 Qualité organoleptique
...................................................
|
09
|
|
5.2 Qualité et valeur santé du fruit
..........................................
|
09
|
|
6) Importance économique et production actuel
....................................
|
10
|
|
6.1 Importance
mondiale.......................................................................
|
10
|
|
6.2 Importance en
Algérie......................................................................
|
11
|
|
II . POLYPHENOLS
|
|
|
1) Généralités biochimiques
...........................................................
|
12
|
|
2) Localisation et rôles dans les plantes
.............................................
|
12
|
|
3) Importances pour l'homme
.........................................................
|
14
|
|
4) Composés phénoliques de la tomate
................................................
|
17
|
|
5) Influence de l'environnement sur la synthèse des
composées phénoliques
|
17
|
|
6) Rôles et propriétés des polyphénols
..................................................
|
19
|
|
6.1 Rôle des composés
phénoliques.....................................................
|
19
|
|
6.2 Propriétés des composés
phénoliques............................................
|
20
|
|
|
|
III - LES ANTIOXYDANTS :
|
|
|
1) Généralités sur les antioxydants
...................................................
|
21
|
|
2) Mécanisme d'action des radicaux libre.
..........................................
|
21
|
|
3) Principales sources d'antioxydants
................................................
|
25
|
|
4) Rôle du complexe antioxydant
.....................................................
|
27
|
|
5) Fruits, légumes et les antioxydants
................................................
|
28
|
|
6) Les antioxydants de la tomate
......................................................
|
28
|
|
6.1 Les
polyphénols..............................................................................
|
29
|
|
6.2 Le
lycopène....................................................................................
|
30
|
|
|
|
PARTIE 2 : ETUDE EXPERIMENTALE
|
|
|
Matériel et méthodes
|
|
|
I. Matériel
................................................................................
|
32
|
|
II. Méthodes d'analyse
...................................................................
|
32
|
|
1. Préparation de la matière première
..................................................
|
34
|
|
2. Analyses physico-chimiques
.........................................................
|
34
|
2.1. Détermination de la teneur en eau
............................................
|
34
|
2.2. Détermination du potentiel d'hydrogène
....................................
|
35
|
2.3. Détermination de l'acidité titrable
............................................
|
35
|
2.4. Détermination de la teneur en cendre
.........................................
|
36
|
2.5. Détermination de la densité
...................................................
|
37
|
2.6. Détermination du résidu sec soluble
(Brix)............................................
|
38
|
2.7. Détermination de la teneur en sucre
totaux............................................
|
39
|
|
3. Extraction des composés phénoliques
...............................................
|
39
|
|
3.1 Analyses biochimiques
............................................................
|
40
|
|
3.1.1 Dosage des polyphénols totaux
.............................................
|
40
|
|
3.1.2 Dosage des flavonoïdes
......................................................
|
41
|
|
3.1.3 Dosage des anthocyanes
......................................................
|
42
|
|
3.1.4 Dosage du lycopène
...........................................................
|
43
|
|
4. Etude de l'activité antioxydante de la poudre de
tomate...............................
|
45
|
|
4.1 Test du pouvoir antioxydant par réduction du fer
(FRAP)........................
|
45
|
|
|
|
PARTIE 3 : Résultats et
discussion
|
|
|
1. Composition globale de la
tomate...................................................................
|
46
|
|
2. Résultats des analyses physico-chimiques
.........................................
|
46
|
|
2.1Teneur en eau
..........................................................................
|
47
|
2.2
pH .................................................................................
|
48
|
2.3 Acidité titrable
.......................................................................
|
49
|
2.4 Teneur en cendre
....................................................................
|
50
|
2.5 Densité
................................................................................
|
50
|
2.6 Le
Brix.........................................................................................................
|
51
|
2.7 Teneur en sucre
totaux.................................................................................
|
51
|
|
3. Résultats des analyses biochimiques
.................................................
|
53
|
|
3.1 Teneur en polyphénols totaux
.....................................................
|
53
|
|
3.2 Teneur en flavonoïdes
...............................................................
|
54
|
|
3.3 Teneur en anthocyanes
................................................................
|
55
|
|
3.4 Teneur en lycopène
..................................................................
|
56
|
|
4. Test in vitro de l'activité anti oxydante
.............................................
|
57
|
|
4.1. Réduction du fer (FRAP)
.........................................................
|
57
|
|
|
|
|
|
Conclusion générale
|
61
|
|
Références bibliographique
|
|
|
Annexes
|
|
Résumé
Cette étude a été conçue
pour le dosage des micro-constituants (composés phénoliques,
lycopène) de la tomate et pelure séchée réduit en
poudre et l'évaluation de leur activité anti oxydante. Dans notre
expérimentation : la première partie consiste à l'
analyse physico-chimiques sur la poudre obtenu à base de tomate et
pelure, afin de déterminer leurs propriétés
physico-chimique (Teneur en eau, pH, acidité, cendre..) la
deuxième partie est le dosage des composés phénoliques
telles les polyphénols totaux avec le réactif de folin cicalteu
en utilisant l'acide gallique comme standard , ainsi que le lycopène et
comparer ces teneurs entre ces deux échantillons, ces derniers
présentent des teneurs appréciables en lycopène avec 128
mg/100g , 158.1 mg EAG/100g de polyphénols totaux et encore de 12.5 %
de cendre pour le fruit (pelure+pulpe) et pour les pelures
séchées réduit en poudre on a trouvé 61.58 mg/100g
de lycopène , 138.86 mg EAG/100g de polyphénols totaux et 8.5% de
cendre. Notre travail consiste aussi à l'étude du pouvoir
antioxydant par réduction de fer (FRAP) ; la réaction est
révélée par le virement de couleur jaune du fer ferrique
(Fe+3) en couleur bleu vert du fer ferreux (Fe+2), ce
test a montré que ces extraits phénoliques présentent un
bon pouvoir anti oxydant. En outre il révèle que la poudre de la
pelure est riche en antioxydant ainsi que le fruit (pelure+pulpe). Ces
résultats suggèrent que l'utilisation des sous produits de
tomate qui sont riche en antioxydant permettrait mieux de protéger
l'homme contre les radicaux libre responsable des maladies cardiovasculaire et
certains cancers.
Mots clés : Poudre de la tomate,
Composés phénoliques, lycopène, activité anti
oxydante.
Abstract
This study was conceived for the determination of
micro-constituents (phenolic compounds, lycopène) of tomato and peels
dried reduced on powders and the evaluation of their anti-oxidant activity. In
our experiments: the first part consist with the physic-chemical analysis of
the powder obtained containing tomato and peels in order to determine their
properties physic-chemical (water content, pH, acidity, ashes,...), the second
part was the determination of the phenolic compounds such total
polyphénols with the reagent of Folin Cicalteu by using the gallic acid
as standard, as well as lycopène and to compare theses contents between
these two samples. The later present contents lycopène with 128m/100g ,
158.1 mg EAG/100g of total polyphénols and still of 12.5% of ash for the
fruit (peel+pulp) and the peels dried reduced on powder were found 61.58g/100g
of lycopène, 138.86 mg of total polyphénols EAG /100g and 8.5% of
ash. Our work also involves the study of the anti oxidant capacity by reducing
iron (FRAP), the reaction is revealed by the transfer of yellow ferric iron (Fe
+3) in green blue color of ferrous iron (Fe +2) this test
showed that the phenolic extracts exhibit good antioxidant power. In addition,
it reveals that the powder of the peel is rich in antioxidant and the fruit
(peel + pulp). These results suggest that the use of by-products of tomato that
are rich in antioxidants would better protect people against the free radicals
responsible for cardiovascular disease and some cancers.
Keywords: tomato powder, phenolic compounds,
lycopene, anti-oxidant activity.
LISTE DES FIGURES :
|
Figure 01 Composition moyenne de la
matière sèche du fruit de tomate...................
|
08
|
|
Figure 02 Représentation des
différentes phases de prolifération du cancer et du potentiel
lieu d'action des polyphénols
végétaux........................................................
|
15
|
|
Figure 03 Exemples de composés
phénoliques identifiés chez la tomate..................
|
16
|
|
Figure 04 Mécanisme d'action des
radicaux libre......................................................
|
22
|
|
Figure 05 Production des formes active de
l'oxygène et des intermédiaires qui en
découlen6.....................................................................................................................
|
24
|
|
Figure 06Structure moléculaire du
lycopène..............................................................
|
30
|
|
Figure 07 Mécanisme proposé
pour le rôle du lycopène dans les maladies chroniques
.......................................................................................
|
32
|
|
Figure 08 Les fractions de la tomate
fraîche.............................................................
|
48
|
|
Figure 09 Teneur en eau des tomates et
pelures en poudre.......................................
|
49
|
|
Figure 10 Valeurs du pH des tomates et
pelures en poudre......................................
|
50
|
|
Figure 11 Taux d'acidité titrable des
tomates et pelures en poudre.........................
|
51
|
|
Figure 12 Taux de cendre des tomates et
pelures en poudre...................................
|
52
|
|
Figure 13 La valeur de la densité des
tomates et pelures en poudre.......................
|
53
|
|
Figure 14 Les valeurs en résidu sec
soluble des tomates et pelures en poudre........
|
54
|
|
Figure 15 Taux en sucre totaux des tomates et
pelures en poudre..........................
|
54
|
|
Figure 16 Teneur en polyphénols totaux
des tomates et pelures en poudre.............
|
56
|
|
Figure 17 Teneur en flavonoïdes des
tomates et pelures en poudre........................
|
57
|
|
Figure 18 Teneur en anthocyanes des tomates
et pelures en poudre......................
|
57
|
|
Figure 19 Teneur en lycopène des
tomates et pelures en poudre............................
|
58
|
|
Figure 20 Pouvoir réducteur des deux
extraits (pelures et fruit) et acide ascorbique..
|
61
|
|
Figure 21 Pouvoir réducteur des deux
extraits...........................................................
|
61
|
LISTE DES TABLEAUX
|
Tableau 01 Culture maraichères et
industriel de la tomate en Algérie.......................
|
03
|
|
Tableau 02 Composition du fruit de
tomate...............................................................
|
08
|
|
Tableau 03 Production mondiale de la tomate
en 2007.............................................
|
10
|
|
Tableau 04 Evolution de la tomate en
Algérie entre 2003-2009................................
|
11
|
|
Tableau 05 Teneur en quelques composés
phénolique de la tomate fraiche..............
|
13
|
|
Tableau 06 Principaux antioxydant et
l'activité antioxydante des différentes fractions de la
tomate...................................................................................................
|
29
|
X
|
Tableau 01 Culture maraichères et
industriel de la tomate en Algérie.......................
|
03
|
|
Tableau 02 Composition du fruit de
tomate...............................................................
|
08
|
|
Tableau 03 Production mondiale de la tomate
en 2007.............................................
|
10
|
|
Tableau 04 Evolution de la tomate en
Algérie entre 2003-2009................................
|
11
|
|
Tableau 05 Teneur en quelques composés
phénolique de la tomate fraiche..............
|
13
|
|
Tableau 06 Principaux antioxydant et
l'activité antioxydante des différentes fractions de la
tomate...................................................................................................
|
29
|
LISTE DES ABRÉVIATIONS
ANS Anthocyane Synthase
A° Acidité titrable
Ac Acide
AH Antioxydant
C4H Cinnamate 4
Hydroxylase
CHS Chalcone Synthase
CHI Chalcon isomérase
d densité
DO densité optique
DFR Dihydro Flavonols
réductase
EC Equivalent de la Catéchine
ED Eau distillée
E 160d Extrait de la tomate
« lycopène » " C40H6"
F3OH Flavonone-3Hydroxylase
FRAP Pouvoir antioxydant par
réduction ferrique
FS Flavone synthase
FLS Flavonols Synthase
FGT Flavonoïde glucsyl
transférase
F5H Férulate 5 -Hydroxylase
FAO Organisation des Nations Unies pour
l'alimentation et l'agriculture
HQT Hydroxycinnamoyl-COA quinate
Hydroxycinnamoyl transférase
Ha Hectare
INRA Institut National de la Recherche
Agronomique
INSEE Institut National de la Statistique et
des Etudes Economiques
MS Matière Sèche
MF Matière fraîche
MeOH Méthanol
OMT
0-Méthyltransférase
PAL Phénylalanine amanomia liase
pH Potentiel d'Hydrogène
PTS Pelure de tomate séchée
Qx Quintaux
UV Ultra Violet
4CL COA-Ligase
INTRODUCTION
De nombreuses études
épidémiologiques ont démontré les effets
bénéfiques d'un régime riche en fruit et légumes,
ces effets pourraient être en partie dus aux micro-constituants
(caroténoïdes, composés phénoliques, vitamines,
minéraux, etc) contenues dans ces produits (Chanforan, 2010).
La tomate s'est révélée
être riche en micro-constituants antioxydants, d'après certains
études une consommation régulière de la tomate ou de
produit à base de tomate réduirait les risques de cancer mais
également les maladies cardiovasculaires, de diabète et
d'ostéoporose (Chanforan, 2010).
Les sous produits de tomate ont actuellement un grand
intérêt pour la nutrition animale et humaine parce qu'ils sont
d'excellentes sources d'antioxydant naturels en grande partie sous forme de
caroténoïdes, composés phénolique et acide
ascorbique.
Les multiples atouts santé des fruits et
légumes sont liés à leur faible teneur calorique, à
leur richesse en micro constituants
dits « phytomicronutriments », ces derniers ont
été qualifiés de métabolites secondaires car l'on
pensait qu'ils n'étaient que des déchets du métabolisme
des plantes. Ce sont notamment des pigments, des aromes et des tanins
astringents, voire des composés sans couleur, sans odeur et sans saveur.
On sait aujourd'hui qu'ils ne sont pas si secondaires que cela et qu'ils
contribuent à protéger la plante contre champignons de
pourritures, rayonnement UV, etc. Ces composés de structures chimiques
extrêmement variées, sont souvent propres à une
espèce ou à un groupement d'espèces et participent
à l'identité chimique de la plante (Djeridane et al,
2006).
Ce sont les polyphénols qui font partie des quatre
principaux antioxydants végétaux à côté de la
vitamine C et E ainsi que les caroténoïdes. Les orientations
récentes des recherches sur les polyphénols visent d'une part
à mieux comprendre les mécanismes d'action au niveau
moléculaire et cellulaire et à évaluer par des
études cliniques leur incidence sur certains marqueurs clé
associés aux pathologies. D'autre part, les recherches
épidémiologiques visant à préciser les associations
entre les niveaux de consommation des divers polyphénols et les niveaux
d'apports les plus favorables à la prévention des diverses
pathologies.
C'est dans ce cadre que nous avons mené notre
étude qui concerne le dosage des polyphénols de la tomate
« Lycopersicum esculentum Mill » variété
Agora et de leur effet anti oxydant.
Notre étude est devisée en deux
parties :
- Une synthèse bibliographique formée de trois
parties traitant une étude sur la plante, les polyphénols et
l'effet de l'extrait poly phénolique sur l'activité
antioxydante.
- Une partie expérimentale, où nous avons
effectué des analyses physico-chimiques
de la tomate et sa pelure, l'extraction ; le dosage de
leurs polyphénols et lycopène et leur effet sur l'activité
antioxydante.
PARTIE 1 :
SYNTHESE BIBLIOGRAPHIQUE
I/ La tomate
1/ Généralités :
La tomate (Lycopersicum esculentum
Mill), elle porte d'autre synonymes : Taxonomiques telles :
Solanumspurium J.F.Gmel , Lycopersicon solanum Medik et Nomenclaturaux
telles : Solanum lycopersicon L , Lycopersicon lycopersicum (L)
H.Karst.(Laterrot Henri ;1998) est originaire des vallées
fertiles du Mexique. Elle a d'abord été cultivée et
améliorée par les indiens du Mexique, avant d'être
ramenée
en Europe par les conquistadores. Neuf espèces sauvages
peuvent être observées en Amérique du sud, dont seulement
deux comestibles, la « tomate groseille »
(Solanum pimpinellifolium) et la « tomate cerise
» (Solanum lycopersicum var cesariforme) qui est l'ancêtre
de nos tomates actuelles (De Broglie et Guéroult,
2005; Renaud, 2006).
En Algérie, elle occupe une place importante
dans le secteur maraicher, et considérée comme une espèce
prioritaire comme la pomme de terre et l'oignon.
Tableau 01 : Culture maraichère
et industrielle de la tomate en Algérie
(MADR ; 2009)
|
Espèce
|
Superficies
(hectare)Ha
|
Production
(quintaux)Qx
|
|
Tomates industrielle
|
12173
36.93%
|
3822731
4.97%
|
|
Tomate maraichère
|
20789
63.06%
|
6410343
8.33%
|
Selon le tableau 01, nous remarquons que la
tomate est cultivée selon deux modes de production à savoir en
culture maraichère et en culture industrielle, La superficie totale
réservée est de 32962Ha représentée par 63.06% pour
la tomate maraichère et 36.93% pour la tomate industrielle.
La production de tomate maraichère,
représente 08.33% par rapport à la production totale des cultures
maraichères et industrielles, Par contre pour la tomate industrielle, le
taux de représentativité est de 4.97% par rapport à la
production des cultures maraichères et industrielles, n ce qui concerne
les rendements, on peut dire qu'ils sont presque similaires avec une
légère hausse en tomate industrielle, ceci montre bien que les
techniques adoptées pour les deux modes de productions sont conformes
à l'espèce étudiée (Senoussi, 2010).
Variétés de
Tomate en Algérie :
Il existe plusieurs variétés
maraichères en Algérie : (Senoussi,
2010).
- les variétés fixées dont les
caractéristiques génotypiques et phénotypiques se
transmettent pour les générations descendantes où on peut
citer les plus utilisées en Algérie telles que : La
Marmande, La Saint Pierre et Aicha.
- les Hybrides qui du fait de l'effet
Hétérosis, présentent la faculté de réunir
plusieurs caractères d'intérêt (bonne
précocité, bonne qualité de résistance aux maladies
et aux attaques parasitaires et donc bon rendement). Ces hybrides ne peuvent
être multipliés vu qu'ils perdent leurs caractéristiques
dans les descendances ; les plus utilisés en Algérie :
Actana, Agora, Bond, Nedjma, Tafna, Tavira, Toufan, Tyeron, Zahra, Farouna, Top
48, Zeralda, Suzana, Zigana et Joker.
Pour la tomate Industrielle :
(Senoussi ,2010).
- les variétés les plus utilisées
sont : Rio Grande (80%)- Roma- Elgon - Universalmech- Castlong- Heintz-
Pico De Aneto - Roma Vf.
- Les Hybrides : Zenith et Sabra.
Toutes les variétés actuelles sur le
marché sont pour la plus part des variétés fixées
et peu d'hybrides.
2/ Description botanique :
La tomate (Solanum lycopersicum L.) est une plante
climactérique, diploïde à 2n=24chromosomes (Judd et
al, 2002), qui appartient à l'ordre des solanales et à la
famille des Solanaceae et genre Lycopersicon (Atherton et Rudich, 1986). Ses
feuilles sont alternes, simples, et sans stipule. Les fleurs sont
actinomorphes, autogames, de couleur jaune et réunies en inflorescences
pentamères, sauf le gynécée qui possède 2 et 5
carpelles (Abbayes et al, 1963).
L'ovaire supère est formé d'au moins
deux carpelles soudés, et comprend de très nombreux ovules en
placentation axile (Judd et al, 2002). Le calice est à
pièces partiellement soudées et la corolle est gamopétale
(Abbayes et al, 1963) .
Le fruit est une baie plus ou moins grosse, de forme
variable (sphérique, oblongue, allongée), et de couleurs
variées (blanches, rose, rouge, jaune, orange, verte, noire) selon les
variétés (Renaud, 2003). Les graines sont réparties dans
des loges remplies de gel. La paroi de l'ovaire évolue en
péricarpe charnu et délimite des loges.
3/ Croissance et développement :
Les différentes variétés de
tomates sont classées selon deux types : déterminé et
indéterminé, en fonction du développement de leur tige
(Atherton et Rudich, 1986).
La croissance déterminée est due à une
mutation génétique : le self pruning factor.
Chez les variétés à croissance
déterminée, la tige après avoir donné un faible
nombre de bouquets, se termine elle-même par une inflorescence. Les
pousses latérales se terminent également par une
inflorescence.
Ce caractère déterminé est
intéressant pour les cultures précoces et pour les cultures
industrielles (Pecaut et Philouze, 1968).
Les variétés à croissance
indéterminée présentent un nombre indéfini
d'inflorescences sur la tige principale comme sur les tiges latérales.
Cette croissance peut cependant être interrompue par des facteurs
extérieurs comme le gel, ou régulée en taillant les
plantes (Mikanowski et Mikanowski, 1999). La plupart des cultivars disponibles
sont des variétés à croissance
indéterminée.
Le nombre de fruits par grappe est fonction de la
variété utilisée, et peut être
déterminé en taillant les plantes, une fois la floraison des
fruits effectuée.
La courbe de croissance des fruits est d'allure
sigmoïdale et comprend trois périodes :
ü Une première phase de croissance lente d'une
quinzaine de jours après anthèse, pendant laquelle a lieu la
majorité des divisions cellulaires.
Pendant cette période, se détermine le
potentiel de croissance du fruit à travers le nombre de cellules
formées.
ü Une deuxième phase de croissance rapide jusqu'au
stade vert mature. C'est pendant cette phase, dite de grandissement cellulaire,
que le potentiel généré à la première
étape est plus ou moins réalisé selon les conditions
climatiques et les équilibres végétatifs /
génératifs de la plante.
ü Une troisième phase dite de maturation,
caractérisée par une croissance lente ainsi qu'un changement
brutal de la couleur, de la texture et de la composition chimique du fruit. En
effet, c'est essentiellement une période de transformations biochimiques
qui dépend des composés stockés et de l'environnement du
fruit (Grasselly et al, 2000).
Il faut noter que les fruits verts sont également
photosynthétiques et que cette activité est non
négligeable (Carrara et al, 2001).
4/ Composition du fruit et des feuilles de tomates
4.1. Composition des feuilles
Les feuilles de tomates sont toxiques à cause des
quantités importantes d'alcaloïdes
qu'elles contiennent. Par exemple, la déhydrotomatine
et l'á-tomatine sont des
glycoalcaloïdes présents en grande quantité
dans les feuilles et les tiges de tomate (Kozukue et al, 2004).
Les feuilles de tomate contiennent également d'autres
métabolites secondaires, comme les composés
phénoliques ; Les principaux sont la rutine et l'acide
chlorogénique, ces deux molécules sont également
impliquées dans la résistance des plantes contre
certaines maladies, voire contre des herbivores (Johnson K S,
2005; Mittelstra et al, 2006).
Les feuilles possèdent donc des pigments
photosynthétiques : de la chlorophylle a et b et des
caroténoïdes dont le béta-carotène et la
lutéïne (Mortain-Bertrand et al, 2008). Les teneurs en
saccharide y sont relativement importantes, l'amidon et le saccharose
étant majoritaires, mais des hexoses (fructose et glucose) sont
également présents (Khelil et al, 2007; Mortain-Bertrand
et al, 2008).
4.2. Composition des fruits
Les fruits de tomate sont majoritairement composés
d'eau, environ 95%, et possèdent peu de lipides et protides, ce qui en
fait un aliment peu calorique, 15 à 20 calories pour 100g (Tableau 02).
La matière sèche des fruits est principalement composée de
sucres, environ 50% de la MS (Blanc, 1986) (Figure 01). Le saccharose
importé des feuilles, est hydrolysé dans les fruits en glucose et
fructose. Le jeune fruit peut également stocker des sucres sous forme
d'amidon qui sera dégradé au cours de la maturation.
L'acide citrique est l'acide le plus présent dans le
fruit mûr de tomate, suivi de l'acide malique (Grasselly et al,
2000). Les tomates possèdent également de nombreuses vitamines :
A, B1, E et C, ainsi que des fibres (1.8g pour 100g MF), des acides
aminés essentiels, des sels minéraux (potassium, chlore,
magnésium, phosphore) et des oligoéléments (fer, zinc,
cuivre, cobalt, bore, nickel, iode) (Tableau 02). L'intérêt
nutritionnel de la tomate réside également dans le fait que ce
fruit contient de nombreux métabolites secondaires, et des
antioxydants.
En effet, la tomate contient des polyphénols, des
flavonoïdes comme la rutine et des dérivés d'acides
hydroxycinnamiques comme l'acide chlorogénique (Moco et al,
2006).
Tableau 02 : Composition du fruit de
tomate. Les données sont en grammes/ 100g
de la matière fraîche consommable (Grasselly et
al, 2000).
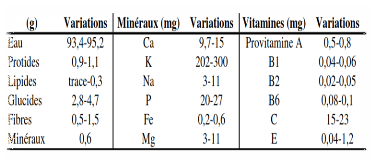
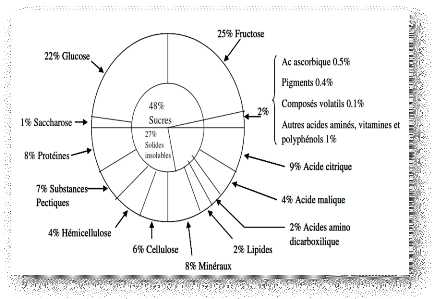
Figure 01 : Composition moyenne de la
matière sèche du fruit de tomate (Davies et Hobson ,2005).
5/Tomate et qualité des fruits :
5.1. Qualité organoleptique du fruit de
tomate
La qualité organoleptique d'un fruit
réunit l'ensemble des composantes évaluées par quatre des
cinq sens. La vue et le toucher sollicités au moment de l'achat
où une attention particulière sera apportée à la
couleur, la forme et la fermeté du fruit. L'odorat et le goût
interviennent au moment de la consommation pour la perception des saveurs,
sucrées et acides essentiellement, des arômes et de la texture en
bouche.
La flaveur (saveur et
arômes) du fruit se caractérise majoritairement par des
composantes chimiques associées à la teneur en sucres et en
acides (Causse M et al. 2001).
Enfin, de nombreux attributs sont
utilisés pour décrire la texture du fruit tels que la
fermeté, la farinosite, la jutosité, la peau gênante, le
fondant, le croquant (Barrett et al. 1998).
5.2. Qualité et valeur santé du fruit
La qualité est une notion complexe puisque sa
définition varie selon que l'on se place dans la situation du
producteur, du distributeur ou du consommateur. Pour le producteur les
critères importants sont le rendement, la résistance aux
maladies, et les capacités d'adaptation aux contraintes
pédo-climatiques (Kaluzny-Pinon et al, 2001). Le distributeur
s'intéresse plus à la durée de vie du produit,
l'homogénéité des lots, et à sa bonne tenue lors de
la conservation et du transport (Guichard, 1999). Enfin pour le consommateur,
la qualité du fruit est l'association de plusieurs paramètres :
son aspect (couleur), sa texture (fermeté), son goût (saveur,
arôme) et, depuis peu, sa valeur-santé (Kaluzny-Pinon et
al, 2001). La qualité gustative des fruits peut se
décomposer en trois parties : la texture, la saveur et les arômes.
La texture est principalement caractérisée par la fermeté
du fruit.
L'arôme du fruit est défini par la concentration
en composés aromatiques volatile, et enfin la saveur est relative aux
teneurs en sucre et acide (Grasselly et al, 2000).
En outre peu d'études donnent des indications
sur les doses efficaces (consommation en repas par jour à base de
tomate), un seul apport pourrait être suffisant, sachant qu'un apport
important de lycopène pourrait être néfaste (Giovannucci
,1999).
6/ Importance économique et production
actuelle
6.1. Importance Mondiale :
La tomate est la troisième espèce
cultivée au monde, après la pomme de terre et la
patate douce, et le deuxième légume le plus
consommé (De Broglie et Guéroult, 2005). Ce légume (fruit)
représente donc un enjeu économique, et est soumis à une
concurrence importante. Cent cinquante(150) millions de tonnes de tomates sont
produites annuellement dans le monde ; Cette production se répartit
sur tous les continents : 44% en Asie, 22,5% en Amérique, 21,5% en
Europe, 12% en Afrique (Grasselly et al, 2000). La France est le
sixième producteur européen, derrière la Turquie,
l'Italie, l'Espagne, la Grèce et le Portugal (données INTERFEL
2008). Selon l'INSEE, en France, environ 800 000 tonnes de tomates ont
été produites en 2004, dont 580 000 commercialisées en
produits frais (senoussi, 2010)
Tableau 03 : Production mondiale
de la tomate en 2008 (FAO, 2008)
|
Pays
|
Production
( 103 tonnes)
|
(%)
|
Pays
|
Production
( 103 tonnes)
|
(%)
|
|
Monde
|
124 875
|
100%
|
Maroc
|
1 206
|
0.96%
|
|
Chine
|
31 644
|
25.34%
|
Portugal
|
1 085
|
00.86%
|
|
USA
|
11 043
|
08.84%
|
Algerie
|
1 023
|
00.81%
|
|
Turquie
|
10050
|
08.04%
|
Syrie
|
946
|
00.75%
|
|
Egypt
|
7 600
|
06.08%
|
France
|
790
|
00.63%
|
|
Espagne
|
4 651
|
03.72%
|
Autres
|
14 869
|
12.06%
|
|
Tunisie
|
960
|
00.76%
|
6.2. Importance en Algérie :
La culture de la tomate occupe une
place prépondérante dans l'économie agricole
Algérienne. Près de 33 000 ha sont consacrés
annuellement à la culture de tomate
(Maraichère et industrielle), donnant une production
moyenne de 11 millions de quintaux et des rendements moyen d'environ 311 Qx/ha
(MADR, 2009). Ces derniers demeurent faibles et assez éloignés de
ceux enregistrés dans d'autres pays du bassin
méditerranéen (Tunisie, Maroc, Espagne, France, Italie)
producteurs de tomate, où les rendements varient entre 350 Qx/ha
à 1500Qx/ha (FAO, 2008).
Tableau 04 : Evolution de la production
de la tomate en Algérie entre 2003-2009 (MADR ;2009)
|
2003
|
2004
|
2005
|
2006
|
2007
|
2008
|
2009
|
|
Superficies
Ha
|
18650
|
19432
|
21089
|
20436
|
20079
|
19655
|
20789
|
|
Production
Qx
|
4569330
|
5121950
|
5137280.4
|
5489336
|
5673134
|
5592491
|
6410341
|
|
Rendement
Qx/Ha
|
245.00
|
263.60
|
243.60
|
268.60
|
282.50
|
284.50
|
308.40
|
Les données du tableau 04 montrent
une augmentation de la superficie et de la production due à la
consommation élevée de ce légume (fruit) notamment
à compter de l'année 2004 qui se stabilise aux alentours de 20000
Ha avec une production moyenne de 5.570755 Qx. Cette augmentation de la
production n'est pas liée uniquement à l'augmentation des
superficies mais aussi aux techniques utilisées dans le calendrier
cultural et l'entretien de la culture qui se sont améliorées
progressivement.
II . POLYPHENOLS :
1/ Généralités biochimiques :
Les composés phénoliques (ou
polyphénols) sont des molécules qui appartiennent au
métabolisme secondaire. Les polyphénols constituent un groupe
important de métabolites secondaires, environ 10 000 composés ont
été caractérisés jusqu'à aujourd'hui. La
plupart des molécules phénoliques sont formées à
partir de deux acides aminés aromatiques la tyrosine et surtout de la
phénylalanine. Ces acides aminés sont formés de
façon variable suivant les végétaux, (Guignard, 2000).
Les polyphénols sont des molécules
très diversifiées, constituées d'un ou plusieurs cycles
benzéniques portant une ou plusieurs fonctions hydroxyles, Les formes
les plus simples sont représentées par deux principaux groupes
dont dérivent de nombreux composés : les acides
hydroxycinnamiques et les flavonoïdes, ces derniers sont des
composés en C6-C3-C6, qui renferment plusieurs milliers de
molécules pouvant être regroupées en plus de dix classes,
induisant une nomenclature complexe. Ils sont issus du para-coumaroyl CoA et de
3 molécules de malonyl-CoA qui forment l'hydroxychalcone comprenant 2
noyaux benzéniques.(Macheix et al,2005).
2 /Localisation et rôle dans les
plantes :
A l'échelle de la cellule, les composés
phénoliques sont principalement répartis dans deux compartiments
: les vacuoles et la paroi. Dans les vacuoles, les polyphénols sont
conjugués, avec des sucres ou des acides organiques, ce qui permet
d'augmenter leur solubilité et de limiter leur toxicité pour la
cellule. Au niveau de la paroi, on trouve surtout de la lignine et des
flavonoïdes liés aux structures pariétales.
Les composés phénoliques sont
synthétisés dans le cytosol. Une partie des enzymes
impliquées dans la biosynthèse des phénylpropanoïdes
est liée aux membranes du réticulum endoplasmique, où
elles sont organisées en métabolons (Winkel, 2004; Macheix et
al, 2005).
D'autres organites du cytoplasme, comme des
vésicules golgiennes ou des chloroplastes, peuvent participer à
la biosynthèse des composés phénoliques mais ce ne sont
pas des lieux d'accumulation (Macheix et al, 2005).
Au sein même des feuilles la répartition des
composés est variable, par exemple les anthocyanes et les
flavonoïdes sont majoritairement présents dans l'épiderme
(Tomas- Barberan et Espin, 2001; Cheynier et Sarni-Manchado, 2006). Les
composés phénoliques (tableau 05) interviennent dans un grand
nombre de processus physiologiques chez la plante et dans les interactions avec
leur environnement, leur structure leur conférant des fonctions
très spécifiques (Desjardin, 2008).
Tableau 05 : Teneurs en quelques
composés phénoliques dans la tomate fraîche. (Desjardin,
2008).
|
Composés phénoliques Teneurs
(mg/100g de MS)
|
|
Acide Chlorogénique
3.67-21.0
Rutine 19.8 -
31.23
Naringénine
0 - 22.78
|
Par ailleurs les composés phénoliques
peuvent avoir un rôle de signal (Treutter, 2006), des flavonoïdes
permettent par exemple la mise en place de la symbiose entre des
Fabacées et des bactéries, ce qui permet à ces plantes de
fixer directement l'azote atmosphérique. Ils participent aux
phénomènes de pollinisation puisqu'ils sont responsables de la
coloration des fleurs (Macheix et al, 2005).
De plus les flavonoïdes ont un rôle de filtre
contre le rayonnement UV, ce qui explique leur localisation dans les tissus
externes (Gould et Lister, 2006). Enfin les flavonoïdes comme les
dérivées hydroxycinnamiques jouent un rôle important dans
la résistance des plantes aux stress environnementaux (Walton et Brown,
1999). Lors de blessures ou d'attaques de pathogènes fongiques et
bactériens, la synthèse de composés phénoliques est
stimulée ou induite (Sawa, 1999).
3/ Importances pour l'homme :
Chez l'homme l'efficacité d'un traitement, comme
une alimentation riche en fruits et légumes, est quantifiée via
des marqueurs biologiques. Par exemple le taux d'espèces
réactives avec l'acide thiobarbiturique est utilisé pour
témoigner le niveau d'oxydation des lipides, relatif aux stress
oxydatifs (Johnson I T, 2008).
En outre l'efficacité des molécules
présentes dans les fruits et légumes, dont les
polyphénols, est prouvée in vitro mais reste
à confirmer in vivo, et les doses à prescrire restent
difficiles à établir (Johnson I T, 2008).
Les effets bénéfiques chez l'homme, de
la consommation d'un fruit ou d'un légume en particulier ne peuvent pas
se résumer uniquement à l'effet d'une seule substance (Liu, 2004;
Bazzano, 2008).
Ces composés interviennent également
à différents stades de développement des cancers,
notamment en stimulant la mort de cellule et en inhibant certaines enzymes
(Figure 02).
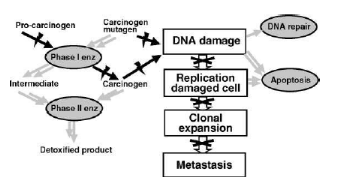 Figure 02 : Représentation des
différentes phases de prolifération du cancer et des potentiels
lieux d'action des polyphénols végétaux. Les doubles
flèches grises indiquent un effet stimulateur alors que les
flèches noires indiquent un effet inhibiteur des
phénols.(Hollamn, 2001). Figure 02 : Représentation des
différentes phases de prolifération du cancer et des potentiels
lieux d'action des polyphénols végétaux. Les doubles
flèches grises indiquent un effet stimulateur alors que les
flèches noires indiquent un effet inhibiteur des
phénols.(Hollamn, 2001).
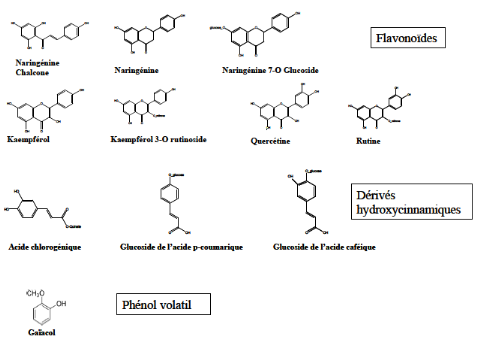
Figure 03: Exemple de composés
phénoliques identifiés chez la tomate ( Stewart et al,
2000; Slimestad et Verheul, 2005).
4/ Composés phénoliques de la
tomate :
Le fruit de la tomate renferme de nombreux
métabolites, dont plusieurs dizaines
de polyphénols. L'équipe de Mocco (2006) a
effectué un important travail de détermination de ces
composés par spectrométrie de masse. Ils ont par la suite
complété leur étude en apportant des données de
répartition des composés dans le fruit en tenant compte du stade
de maturation du fruit (Moco et al, 2007).
En effet la composition phénolique des fruits de
tomates évolue avec la maturation du fruit (Fleuriet et Macheix, 1981;
Gautier et al, 2008), et elle varie également quantitativement
et qualitativement suivant les cultivars étudiés, les tomates
cerises étant généralement les plus riches (Raffo et
al, 2002).
Les flavonoïdes sont majoritairement
trouvés sur la partie externe du fruit (peau
et péricarpe), et les principaux composés
détectés sont la naringénine chalcone et des glucosides de
la naringénine, des formes glycosilées de la quercétine
comme la rutine, et des dérivés glycosilés du
keampférol, les formes aglycones n'étant détectées
qu'après hydrolyse (Figure 02 et 05) (Hunt et Baker, 1980; Krause et
Galensa, 1992; Stewart et al, 2000; Bauer et al, 2004;
Slimestad et Verheul, 2005).
Cependant les feuilles renferment des quantités
importantes de polyphénols totaux (Stout et al, 1998). L'acide
chlorogénique et la rutine semblent être les composés les
plus abondants (Wilkens R T et al, 1996).
5/Influence de l'environnement sur la synthèse des
composés phénoliques :
Les composés phénoliques
interviennent dans de nombreux phénomènes pour permettre à
la plante de s'adapter à son milieu (Macheix et al, 2005).
a)Lumière :
La lumière agit de façon quantitative et
qualitative et est corrélée à une augmentation des teneurs
en composés phénoliques et plus particulièrement de
flavonoïdes dans les tissus (Macheix et al, 2005).
L'activité de certaines enzymes de la voie de
biosynthèse des polyphénols est stimulée par la
lumière, c'est le cas, entre autres, de la PAL (Flores et al,
2005), de la C4H (Bell-Lelong et al, 1997) et de la CHS (Feinbaum et
Ausubel, 1988). En cultivant des tomates sous une forte intensité
lumineuse, Wilkens et al. (1996) ont quantifié environ deux
fois plus de rutine et d'acide chlorogénique que dans les plantes
cultivées sous une faible intensité lumineuse. Il faut
également rappeler le rôle de photoprotection des
flavonoïdes.
b) Température :
La température peut modifier les teneurs en
polyphénols chez les fruits pendant
la phase de croissance, mais également après la
récolte, Pour les plantes de tomate, un stress thermique semblerait
apparaître à partir de 35°C, causant l'accumulation de
composés phénoliques tels que les flavonoïdes et les acides
hydroxycinnamiques. En effet, un stress thermique provoqué par des
températures froides (4°C) ou élevées entraîne
une augmentation des activités PAL et CHS qui a pour conséquence
d'augmenter les teneurs en composés phénoliques (Leyva et
al, 1995). En outre, l'oxydation des composés phénoliques
par les polyphénols oxydases (PPO) et peroxydases (POD) est
inhibée, ce qui maximise l'accumulation des polyphénols (Rivero
et al, 2001).
c)Enrichissement en CO2 :
Les cultures sous enrichissement en CO2 vont modifier
le statut carboné de la plante et augmenter la disponibilité en
carbone (Haukioja et al, 1998).
Une augmentation de 30% des teneurs en composés
phénoliques dans les feuilles peut être observée (Penuelas
et Estiarte, 1998) mais ce comportement est très dépendant des
plantes et des molécules étudiées.
En outre, la synthèse des tannins, des
terpènes et de la lignine ne semblent pas modifiée par un
enrichissement en CO2 (Koricheva et al, 1998; Penuelas et Estiarte,
1998).
L'équipe de Wang (2003) a obtenu des teneurs en
phenylpropanoïdes et en flavonoïdes significativement plus
importantes chez des framboisiers cultivés sous enrichissement en CO2
(Wang S. Y. et al, 2003).
6/ Rôles et Propriétés Des
Polyphénols :
6.1. Le rôle des composés
phénoliques :
ils peuvent en effet intervenir dans:
La fertilité, la pigmentation, la signalisation et la
protection contre des agents biotiques et abiotiques et encore la formation de
polymères structuraux comme la lignine; (Guignard et al
1985;Macheix et al., 2005) .
Des travaux plus anciens ont montré que
les phénols seraient associés à de nombreux
processus physiologiques: croissance cellulaire, différenciation,
organogenèse, dormance des bourgeons, floraison et
tubérisation, les cellules végétales répondent aux
stimuli environnementaux en synthétisant les métabolites
secondaires qui peuvent les protéger contre les agents de l'agression,
lorsque la plante est soumise à des blessures mécaniques. Ces
réactions aboutissent à la formation au niveau de la blessure
d'un tissu cicatriciel résistant aux infections (Fleuriet et Macheix,
1990; Brouillard et al., 1997 Macheix et al,
2005).
Ils ont un rôle dans les critères de
qualité (couleur, astringence, amertume et qualité
nutritionnelles...) qui orientent les choix de l'homme dans sa consommation des
organes végétaux (fruits, légumes,tubercules) et des
produits qui en dérivent par transformation; (Macheix et
al., 2005; Dicko et al., 2006) .Et selon Sarni
Machando et Cheynier (2006), les polyphénols exercent un effet majeur
sur les caractères organoleptiques des produits.
Ils ont aussi un rôle dans la variation de certaines
caractéristiques des végétaux lors des traitements
technologiques (préparation des jus de fruits, des besoins
fermenté ...), pendant lesquels apparaissent fréquemment des
brunissent enzymatiques qui modifient la qualité du produit
fini;(Fleuriet et Macheix, 1990; Macheix et al., 1990 ;
Lattanzio et al., 1994).
6.2. Propriétés des composés
phénoliques :
Parmi les antioxydants naturels ; les composés
phénoliques, et plus particulièrement
les acides phénoliques et les flavonoïdes,
suscitent un intérêt grandissant.
Ce sont des composées, naturels, qui permettent de
ralentir le phénomène d'oxydation
qui favorisent le vieillissement cellulaire en interrompant le
passage du stress oxydatif
et interceptant le « message » de l'apoptose (mort
cellulaire programmé) (Macheix et al, 2005).
L'homme n'est pas capable d'assurer la
biosynthèse de la plus part des antioxydants, en particulier ceux de
nature phénolique. Il doit les trouvés dans la ration
journalière est alors un facteur nutritionnel considéré
comme positif par les nutritionnistes et bénéfique à notre
santé (Bravo, 1998).
Les différents constituants
végétaux de notre ration alimentaire quotidienne sont
généralement riches en polyphénols
à forte activité antioxydante et, selon les habitudes
alimentaires, nous pouvons en ingérer 100mg par
jour.
Cela est vrai dans Les régimes dits «
méditerranéens »ou la consommation de fruits, de
légumes, céréales et d'huile d'olive est importante
(Besançon, 2000).
III - LES ANTIOXYDANTS :
1/ Généralités sur les
antioxydants :
L'oxygène est la source de vie pour les
organismes aérobies. Mais l'oxygène peut être
également une source d'agression pour l'organisme (Ekoumou , 2003). En
effet des dérivés hautement réactifs de l'oxygène
peuvent apparaître au cours des réactions enzymatiques ou sous
l'effet des rayons U.V. Les formes de l'oxygène provoquant ces troubles
sont: l'oxygène singulet O, le peroxyde d'hydrogène
H2O2, les peroxydes alkyles ROOH, le radical superoxyde
O2, les radicaux hydroxyles HO, peroxydes ROO et alkoxyles RO (Cavina
,1999).Les conséquences au niveau de l'organisme se font ressentir sur
l'ADN, les lipides et les protéines (Ahmet, 2003).
2/ Mécanisme d'action des radicaux
libres :
Les radicaux libres peuvent être
considérés comme des déchets du métabolisme
cellulaire. Ce sont des atomes et des molécules
dotés d'une forte énergie et qui, avant d'être
neutralisés détruisent ce qu'ils rencontrent. Ils sont produits
dans toutes les cellules de l'organisme tout à fait normalement et en
faible quantité dans les mitochondries. Il s'agit des ions
oxygène, hydroxyde et de l'eau oxygénée qui sont
libérés lors des réactions biochimiques. Avant
d'être neutralisés ils provoquent des lésions sur tous les
éléments qu'ils côtoient (Boss, 2002).
L'organisme sait cependant se défendre contre
eux, grâce aux enzymes antioxydantes contenues dans nos cellules. Ces
enzymes sont aidées dans leur action antiradicalaire par la vitamine E,
C, provitamine A, le zinc et le sélénium (Boss, 2002).
Dans la figure (04), la génération de ROS
est initiée pendant la respiration.
Cette génération est facilitée par
l'implication de divers facteurs physiologiques et environnementaux (UV,
radiation, ozone, cigarette, pollution,....).
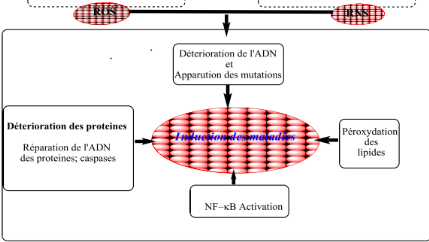
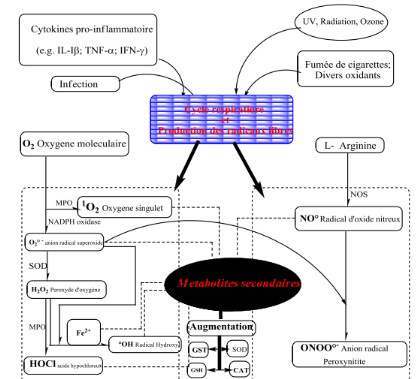
Figure 04: Mécanisme d'action des
radicaux libre ( Franceschini,1994).
L'utilisation de plantes renfermant des flavonoïdes,
seules ou en association, est en progression constante en raison d'une demande
croissante par les consommateurs de produits d'origine naturelle et en raison
de l'intérêt porté aux plantes aussi bien
médicinales qu' alimentaires contenant cette classe de composés
d'origine naturelle ayant des propriétés justifiant leur emploi
dans la prophylaxie des maladies cardiovasculaires, Alzheimer, des cancers.
2.1. Les dérivés de l'oxygène
2.1.1. L'ion peroxyde
L'ion peroxyde est formé par fixation d'un
électron sur l'oxygène moléculaire.
Les ions superoxydes sont produits pendant la
réoxydation des flavines.
2.1.2. Oxygène singulet
Il est produit sous l'action d'une lumière
visible en présence d'un appareil photo
sensibilisateur. Diverses solutions de capture de parade
antiradicalaire, des radicaux oxygénés mettent en oeuvre des
agents chimiques ou biologiques.
Pour la capture des intermédiaires radicalaires,
ils existent plusieurs voies :(figure 05)
- le radical formé à partir de
l'oxygène (radical anion, radical hydroxylé) se fixe sur un
centre insaturé (double liaison) et libère dans sa combinaison un
nouveau radical par suite de réactions homologues qui constituent une
polymérisation.
- le radical peut être capturé par un atome d'H
issu d'un porteur qui va neutraliser ce radical.
- le radical oxygéné peut subir une combinaison
avec un autre radical du milieu dans
La réaction de couplage ou de terminaison.
- le radical peut attaquer un cycle et l'ouvrir en se
neutralisant par addition et déplacement d'un H (exemple vit E)
(LePerchec, 1994).
Figure 05 : Production des formes actives
de l'oxygène et des intermédiaires qui en découlent
(LePerchec, 1994).
3/ Principales sources d'antioxydants :
Certaines classes thérapeutiques
telles que les AINS (anti-inflammatoire non
stéroïdien), les anti
hyperlipoproteinémiques, les ß-bloquants et antihypertenseurs sont
connus pour leurs propriétés antioxydantes (Ahmet, 2003).
Le plus simple des capteurs des radicaux libre est
l'alcool éthylique, agent de transfert d'hydrogène qui conduit
à un composé biologiquement compatible,
l'acétaldéhyde, bio oxydable par la chaîne enzymatique avec
production d'énergie.
CH3 CH2OH + 2
R
· ?CHCH=O + 2 RH3
a) Les médicaments :
Certains médicaments (exemple du probucol
(lurselle)) fait diminuer le taux du
cholestérol dans le sang et, la N-
acétylcystéine agit dans la régénération du
glutathion en pénétrant les cellules, ces
propriétés ont été reconnue lors d'études
sur les phospholipides des feuilles de certains végétaux. En
effet les thiols sont beaucoup plus actifs que les hydrocarbures, les alcools
ou les phénols comme agents de capture radicalaire (LePerchec, 1994).
GSH + OH
· ?
GS
· + H2O
2GS ? GS-GS
La capacité de protection du glutathions est
jugée supérieure à celle d'un antioxydant aussi puissant
que l'á-tocophérol.
In vitro, le glutathion introduit une
période d'induction à la prise d'oxygène par
l'hémoglobine et retarde l'oxydation de la fraction hydrocarbonée
insaturée des lécithines (esters insaturées d'acide gras
de phospholipides) et de l'aniline (Mieyal, 1978).
b) Les vitamines
- Acide ascorbique : Vitamine
C
La Vitamine C contient une forme énediol qui
produit la forme dicétonique par transferts successifs de ses deux
atomes d'H. La forme énediol est régénérée
par l'intervention d'enzyme superoxyde dismutase en présence d'une
catalase.
On trouve la vitamine C dans les légumes, les
choux, le poivron, le persil,
les agrumes et le kiwi. Elle joue un rôle important dans
la régénération de la vitamine E (Boss , 2002).
- La vitamine E
Elle semble devoir fixer le radical hydroxyle avec
formation d'une molécule d'ouverture de cycle. On la retrouve dans les
huiles végétales (arachides, soja, chardon, tournesol, olive
pressé à froid), les amandes, les graines, le lait, les oeufs,
les légumes à feuilles vertes (Boss, 2002).
- ß-carotène
Parmi les photo-protecteurs actifs, le
ß-carotène apparaît comme un piégeur efficace. Sa
constitution polyiénique lui confère une capacité de
piégeage de l'oxygène par formation d'un dioxétane
(addition d'une oléfine et d'une molécule d'oxygène) ou
par production d'hydroperoxydes (insertion d'oxygène dans toutes
liaisons C-H conjuguées d'une double liaison) susceptibles d'être
réduits à leur tour. Il est présent dans les
légumes verts, la salade, les carottes, l'abricot, le melon, les
épinards, la papaye (Boss, 2002).
c) Les antioxydants naturels :
Ils sont présents dans toutes les parties des
plantes supérieures. Ce sont des composés phénoliques
(flavonoïdes, xanthones, coumarines, caroténoïdes,
dérivés d'acide phénolique, tanins, anthocyanines,...).
4/ Rôle du complexe antioxydant :
La vie en aérobiose se traduit au niveau
cellulaire par l'existence d'une chaîne respiratoire mitochondriale
nécessaire au stockage de l'énergie sous forme d'adénosine
triphosphate (ATP). La chaîne respiratoire est une succession de
phénomènes d'oxydoréduction au cours desquels il existe
des transferts d'électrons. Ces électrons peuvent réagir
avec une molécule avoisinante pour aboutir à la formation d'un
radical libre.
Un radical libre est une espèce chimique
contenant un ou plusieurs électrons non appariés sur l'orbite
électronique la plus externe.
Les radicaux libres sont produits au cours de nombreuses
réactions engagées
dans les mécanismes physiologiques, (respiration
mitochondriale).(Boss,2000)
- Mécanisme
pathologique
L'athérosclérose est un bon modèle
de pathologie liée au stress oxydant car c'est à la fois une
maladie dégénérative, inflammatoire et infectieuse.
Dans toutes les cellules aérobies, les radicaux
libres sont essentiellement des radicaux oxygénés. Leur
hyperactivité les engage dans des réactions de
dénaturation des constituants cellulaires de type peroxydation, avec les
glucides, les lipides, les protéines et l'ADN, formant des produits
très instables.
Ceux-ci donnent lieu à des réactions en
chaîne générant de nouveaux radicaux libres. Ce processus
de peroxydation s'auto-entretient de lui-même et il faut attendre
l'obtention de produits stables par réaction entre deux radicaux ou
l'intervention de substances protectrices dites «piégeurs de
radicaux libres» pour l'arrêter.
5/Fruits, légumes et les antioxydants :
Les études d'intervention visant à
montrer qu'une alimentation riche en fruits et légumes à une
incidence positive sur les taux plasmatiques en antioxydants sont très
diversifiées et surtout concluantes.
L'ensemble des études épidémiologiques
dans diverses régions du globe montre indéniablement que la
consommation de fruits et légumes entraine une augmentation
significative de la concentration plasmatique en antioxydants, dont la vitamine
C et divers caroténoïdes comme l'á- et le
ß-carotène, la lutéine et le lycopène (Le Marchand L
et al ; 1994- Steptoe A et al ; 2003).
Ainsi, il a été montré que la
consommation de trois à huit portions de fruits et légumes par
jour permet, après deux semaines, d'augmenter significativement la
concentration plasmatique en vitamine C et en ß-carotène de 72,8
et 53 %, respectivement (Zino, 1997).
6/ Les antioxydants de la tomate :
Les études d'intervention (ou
épidémiologique) visant à montrer qu'une alimentation
riche en fruits et légumes ayant une incidence positive sur les taux
plasmatiques en antioxydants, sont très diversifiées et surtout
concluantes. L'ensemble des études épidémiologiques dans
diverses régions du globe montre indéniablement que la
consommation de fruits et légumes entraine une augmentation
significative de la concentration plasmatique en antioxydants, dont la vitamine
C et divers caroténoïdes comme l'á- et le
â-carotène, la lutéine et le lycopène (Le Marchand
et al., 1994 ; Steptoe et al., 2003).
Ainsi, il a été montré que la
consommation de trois à huit portions de fruits et légumes par
jour permet, après deux semaines, d'augmenter significativement la
concentration plasmatique en vitamine C et en â-carotène de 72,8
et 53 %, respectivement (Zino, et al, 1997).
Par ailleurs, dans une étude récente, il a
été montré que la non consommation de fruits et
légumes conduit à la diminution des taux sériques en
vitamine C de l'ordre de 3,55 ug/ mL et d'autres antioxydants, constituant de
ce fait, un risque majeur pour l'incidence des maladies cardiovasculaires. Le
tableau 06 récapitule les principaux antioxydants et l'activité
antioxydante des différentes fractions de la tomate.
Tableau 06 : Principaux antioxydants et
l'activité antioxydante des différentes fractions de la tomate
(Ramandeep.k et al, 2005).
|
Fractions
|
Polyphénols totaux
(mg/100g)
|
Flavonoïdes (mg rutine)
|
Lycopène
(mg/100g)
|
Acide ascorbique
(mg/100g)
|
Activité antioxydante
(uM TEAC/100g)
|
|
Pelure
|
29.1
|
20.4
|
8.7
|
16.9
|
212.6
|
|
Purée
|
12.7
|
8.2
|
2.8
|
8.9
|
81.8
|
|
Graines
|
22.0
|
12.1
|
1.6
|
8.4
|
114.0
|
6.1. Les polyphénols
Les polyphénols sont capables de piéger
les radicaux libres découlant aussi bien des réactions
d'oxydation de différents nutriments que de celles de l'organisme.
La richesse des structures des polyphénols en
résidus hydroxyles, leurs confère une meilleure capacité
à neutraliser les radicaux libres. Etant des antioxydants primaires et
radicalaires, ils peuvent ralentir la formation de radicaux libres et
interrompre la chaîne autocatalytique.
Les composés phénoliques de la tomate sont
des antioxydants actifs et contribuent aux effets synergiques de
lycopène ( Ramandeep. K et al ; 2005).
Des effets antioxydants synergiques contre l'oxydation de LDL
ont été obtenus quand le lycopène a été
employé en association avec différents polyphénols (
Krinsky.N.I ;1989).
6.2. Le lycopène
Le lycopène appartient à la famille des
caroténoïdes, c'est un polyène acyclique
de chaîne ouverte avec 13 doubles liaisons et une
formule moléculaire de C40H56.
Il a 11 doubles liaisons conjuguées disposées
linéairement, le rendant le plus long caroténoïde (Fig.
08).
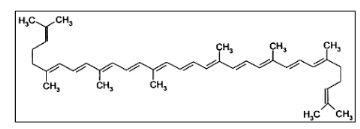
Figure 06 : La
structure moléculaire du lycopène.(Stahl et
al ;2000).
Le lycopène est plus soluble dans le chloroforme,
le benzène, et d'autres solvants organiques que dans l'eau. Dans les
systèmes aqueux, il tend à agréger et précipiter
sous forme de cristaux. Le lycopène est absorbé plus facilement
par le corps humain lorsqu'il est préparé dans le jus, la sauce,
la pâte, et le ketchup (Gartner.C et al,1997).
Ceci peut se produire en partie parce que le
lycopène est inclus dans la matrice de fruit frais et des cellules
végétales, ce qui empêche son dégagement complet.
La transformation des produits alimentaires peut
améliorer la biodisponibilité du lycopène en
dégradant les parois cellulaires ce qui affaiblit les forces des
liaisons entre le lycopène et la matrice de tissu, et augmente sa
biodisponibilité. En plus, la forme isomérique du lycopène
peut être changée des trans-isomères aux
cis-isomères sous l'effet de la température ce qui augmente son
absorption (Rao, 2006).
En outre, parce que le lycopène est soluble dans la
phase grasse, l'absorption augmente dans les régimes lipidiques (Lee .A
et al, 2000).
6.2.1. effets biologiques du lycopène
La plupart des réactions oxydatives que
l'oxygène est susceptible de provoquer dans l'organisme humain sont
extrêmement lentes.
Il est donc peu toxique par lui-même. Mais sous
l'action de radiations ionisantes, de rayons UV, de métaux de
transition ou au cours de réaction enzymatiques, plusieurs
espèces beaucoup plus réactives sont produites.
L'appellation « espèces réactives de
l'oxygène » (ERO), inclus les radicaux libres de l'oxygène
proprement dit, mais certains dérivés oxygénés
réactifs non radicalaires donc la toxicité est importante (A.V.
Rao L.G ; 2007).
Les mécanismes de défense contre
l'oxydation, sont génétiquement programmés, comme la
production d'enzymes superoxyde dismutase et glutathion peroxydase. Par contre,
d'autres mécanismes proviennent de composés alimentaires comme la
vitamine C, la vitamine E et le sélénium et probablement de
substances caroténoïdes.
La capacité du lycopène à
neutraliser les radicaux libres provenant de l'oxygène
moléculaire se fait physiquement et chimiquement (figure 07).
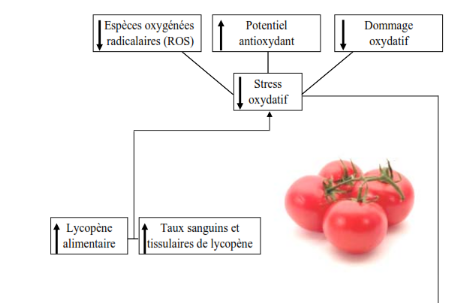
Figure 07 : Mécanisme
proposé pour le rôle du lycopène dans les maladies
chroniques (Yefsah, 2007).
PARTIE 2 :
ETUDE EXPERIMENTALE
« Matériels &
méthodes »
Matériel et méthodes
L'ensemble de ce travail a été
réalisé au laboratoire de chimie du département de
génie de procédé, Université de Hassiba Ben Bouali
de Chleff pendant trois mois (du 14 Mars jusqu'à juin).
I. Matériel
1. Matériel végétal
Ø La tomate « Lycopersicum esculentum
Mill » étudiée variété
«Agora » , provient de la région de Chleff durant la
période Mars, Avril et Mai.
L'échantillon obtenu a été réduit
en échantillon de laboratoire, la tomate est récoltée
à pleine maturité, lavée et nettoyée ensuite
emballées dans des sachets alimentaire et placer au
réfrigérateur (4°C) pendant toute la durée des
essais.
2. Produits et réactifs chimique
§ Eau distillée
§ Solution d'hydroxyde de sodium (NaOH) 0.1N
§ Phénolphtaléine
§ Méthanol
§ Solution du réactif Folin Cicalteu
§ Bicarbonate de sodium Na2CO3
§ Acide gallique
C7H6O5
§ Nitrite de sodium NaNO2
§ Trichloride d'aluminium AlCl3
§ Ethanol absolu
§ Acide chlorhydrique HCl
§ Bisulfite de sodium NaHSO3
§ Cyclohexane C6H12
§ Phosphate monobasique de sodium Na
H2PO4, 2 H2O
§ Phosphate dibasique de sodium
Na2HPO4
§ Ferricyanure de potassium
K3Fe(CN)6
§ Acide trichloracétique
C2HCl3O2
§ Chlorure ferrique FeCl3
§ Acide ascorbique
C6H8O6
§ Phénol C6H6O
§ Acide sulfurique H2SO4
3. Appareillage
§ Balance analytique de précision de paillasse
§ Spectrophotomètre
§ PH mètre (HANNA)
§ Four à moufle (Hereaus)
§ Etuve réglée à 50°C
(MEMMERT)
§ Centrifugeuse à 6000 tour par minute
§ Dessiccateur
§ Bain marie (WISE BATH)
§ Agitateur plaque chauffante.
§ Rota vapeur (RVO 004)
§ Réfractomètre d'Abb
II. Méthodes d'analyses
Elles se rapportent aux expériences
suivantes :
ü Obtention de la poudre de tomate et pelures par
séchage à l'étuve à température
50°C.
ü Analyses physico-chimiques.
ü Extraction des composés phénoliques
ü Dosage des composés phénoliques et du
lycopène
ü Tester le pouvoir anti oxydant
1. Préparation de la matière
première
Les tomates ont été vidées de leur
contenu de graines et découpées avec un couteau, en lamelles.
Pour la pelure : on a pris les tomates et les mettre dans
de l'eau chaude pour quelques secondes ensuite la pelure s'enlève
facilement.
1.1. Séchage à l'étuve
Le séchage est fait à une température de
50°C pendant 48 heures.
1.2. Broyage
Les tomates ainsi que la pelure séchées
vont être réduits en poudre à l'aide d'un mortier.
1.3. Tamisage
La poudre est tamisée par un tamis de
diamètre 250 um.
1.4. Extraction
La poudre obtenue est soumise à l'extraction.
2. Analyses physico-chimiques
2.1. Détermination de la teneur en eau
La teneur en eau est déterminée sur un
échantillon de 3g et on la place dans l'étuve
réglée à 103 °C jusqu'à obtention d'un poids
constant.
Mode opératoire
- Séchée des capsules vides à
l'étuve durant 15 mn à une T° de 103°C.
- Tarer les capsules après refroidissement dans un
dessiccateur.
- Peser dans chaque capsule 3 g d'échantillons et les
placer dans l'étuve réglée à 103°C pendant
trois heures.
- Retirer les capsules de l'étuve, les placer dans le
dessiccateur et après refroidissement on les pèse.
- L'opération est répétée
jusqu'à obtention d'un poids constant (en réduisant la
durée de séchage 30mn) pour éviter la
caramélisation.
La teneur en eaux par rapport à la masse humide est
calculée par la formule suivante :
W mh = (mi - mf ) /
mi x 100
Où :
W mh : masse, en gramme, humide
mi : masse, en gramme,
initiale
mf : masse, en gramme, finale
(après dessiccation).
2.2. Détermination du potentiel d'hydrogène
« pH »
On met la tomate/pelure séchée dans un
bécher et on ajoute neuf fois son volume d'eau distillée (ED). On
chauffe dans un bain marie pendant 30 minutes en remuant de temps en temps,
ensuite le mélange et broyé dans un mortier (AFNOR, 1982).
Puis on étalonne le pH mètre avec une solution
tampon dont pH est de 7 et 4, en plongeant l'électrode dans la solution
de tomate et la lecture se fait directement sur le pH mètre. (En prenant
soins que l'électrode soit complètement immergée dans la
solution).
2.3. Détermination de l'acidité titrable
« A° »
La méthode utilisée pour la
détermination de l'acidité titrable est décrite par Ilkay
et Aziz ,2011 ; le titrage de l'acidité se fait avec une solution
de NaOH (0.1N) en présence de phénolphtaléine comme
indicateur de couleur.
On pèse 10 g dans une fiole conique puis on ajoute
50ml d'ED récemment bouillis et refroidis, puis on mélange
jusqu'à l'obtention d'un liquide homogène.
On chauffe le contenu au bain marie pendant 30 minutes,
après refroidissement, on verse le mélange dans une fiole
jaugé de 100 ml en complétant jusqu'au trait de jauge avec
l'ED.
Après filtration on prélève 10 ml du
filtrat dans 10 ml d'ED, on ajoute des gouttes de phénolphtaléine
et on titre avec NaOH (0.1N) jusqu'à l'obtention d'une couleur rose
persistante pendant 30 secondes.
L'acidité titrable est calculée
d'après la formule suivante :
A° = % ( 100 x V1 x 100
) / (V0 x M x 10 ) x 0.07 = 175 x V1 /V0 x
M
Où :
M : masse en gramme
prélevée
V0 : volume en millilitre de
la prise d'essai
V1 : volume en millilitre de
solution NaOH à 0.1N
0.07 : facteur de conversion de
l'acidité titrable en équivalent d'acide citrique
(« C6H12O8 » pour 100 g de
tomate).
2.4. Détermination de la teneur en cendre
Selon AFNOR, 1982, cette méthode est
basée sur la destruction totale de toute
Les particules charbonneuses et la pesée de la
matière minérale restante.
La poudre de (2 g) est mise dans des capsules
(M1) qui sont placées dans un four réglé
à 550°C pendant cinq heures jusqu'à obtention d'une couleur
grise, claire ou blanchâtre, après refroidissement on pèse
les capsules (M2).
On exprime la matière organique par la formule
suivante :
MO % = (M1 -
M2 / P) x 100
La teneur en cendre (cd) est
calculée comme suit :
Cd =
100-MO%
Où :
MO : matière organique en %
M1 : masse des capsules +
prise d'essai
M2 : masse des capsules +
cendres
P : masse de la prise d'essai
2.5. Détermination de la densité
Selon James (1980), la densité
est obtenue en calculant le quotient de la masse volumique d'une solution de la
même masse volumique d'eau distillé à 20°C.
Le pycnomètre est pesé vide
(m0). On le rempli d'ED récemment bouillie et refroidies aux
environs de 20°C. Avant de faire pesée, le niveau d'eau est
ajusté au trait de repère après avoir bouché le
pycnomètre.
Après cette opération, on
prépare une solution de la poudre obtenue, après filtration, la
solution obtenue est remplacé par l'ED ensuite pesée.
La densité est calculée par la formule
suivante :
D =
m2 - m0 / m1 - m0
Où :
m0 : masse en grammes, du
pycnomètre vide
m1 : masse en grammes, du
pycnomètre rempli d'ED
m2 : masse en grammes, du
pycnomètre rempli de la solution de tomate
2.6. Détermination du résidu sec soluble
(° Brix) (Afnor, 1970)
On entend par résidu sec soluble
(déterminé par réfractométrie), la concentration en
saccharose d'une solution aqueuse ayant le même indice de
réfraction que le produit analysé, dans les mêmes
conditions de préparation et de température .Cette concentration
est exprimée en pourcentage massique.
On mesure à 20°C, l'indice de
réfraction de l'échantillon préparé.
Mode opératoire
Ø On pèse 5g de la poudre dans un bécher
de 250 ml.
Ø On ajoute une quantité d'ED égale neuf
fois la masse du produit.
Ø On chauffe un bain marie pendant 30 mn en remuant de
temps en temps.
Ø Après refroidissement, on ajoute de l'ED
jusqu'à ce que la totalité du contenu du bécher soit
approximativement 100 ml.
Ø On mélange avec soin, 20 mn après on
centrifuge le mélange.
Ø On détermine le taux du résidu sec
soluble par réfractomètre.
Le résidu sec soluble est donné par la formule
suivante :
Brix (%) = M x M1 /E
Où :
M : masse totale de la solution
pesée contenu dans le bécher
M1 : masse du résidu sec pour
100g de produit analysé (g).
E : masse de produit utilisé
(g).
2.7. Détermination de la teneur en sucre totaux
Les sucres sont
déterminés par le test au phénol .En présence de
l'acide sulfurique concentré, les oses sont déshydratés en
composé de la famille des dérivées furfurique. Ces
produits ce condensent avec le phénol pour donné des complexes
jaune-orangé. La teneur en sucre totaux est déterminée par
spectrophotométrie à une longueur d'onde de 490 nm (Goodon,
1997).
Mode opératoire
Ø 0.1 ml d'extrait hydro-alcoolique de poudre
(dilué dans de l'ED 1/10 (p/p)).
Ø On ajoute 0.4 ml d'ED.
Ø 0.3 ml de 5g/100g de phénol et on
mélange.
Ø Puis on ajoute 1.8 ml de l'acide sulfurique.
Ø On mesure l'absorbance (DO) de la couleur obtenu
à 490 nm à l'aide d'un spectrophotomètre (Mehdi Ghiafeh et
al, 2006). La teneur en sucres totaux est
déterminée en glucose comme standard.
3. Extraction des composés
phénoliques
Principe
La méthode d'extraction utilisée pour les
composés phénoliques est celle de. L'objectif de l'extraction
est de séparer les substances phénoliques de la poudre solide, le
solvant dissous le principe actif à l'intérieur du solide et
l'entraîner à l'extérieur.
Le choix du méthanol possède l'avantage
d'être facilement éliminé sous vide et il donne en plus un
meilleur rendement d'extraction qui dépasse celui obtenu avec l'eau de 7
fois. Le rendement d'extraction en polyphénols augmente
avec le temps de contact (Djeridane et al, 2006).
Mode opératoire
· 5 g obtenu sont ensuite macérés dans
100ml d'un mélange hydro-alcoolique MeOH (méthanol-eau)
(80/20=v/v) pendant 48 heures à une température ambiante.
· Ce mélange est filtrer par papier whatman.
· Le résidu obtenu est repris pour une
deuxième fois avec un volume de 50 ml du même mélange
hydroalcoolique pendant 24 heures à température ambiante.
· On obtient donc un extrait hydroalcoolique brut.
· On évapore le méthanol par rota vapeur
à 65 °C.
· On obtient un extrait phénolique conservé
à 6°C jusqu'à utilisation.
3.1 Analyses biochimiques
3.1.1 Dosage des polyphénols totaux
Le dosage des polyphénols totaux dans les
extraits des deux échantillons a été effectué par
spectrophotométrie selon la méthode du réactif de Folin -
Cicalteu (Singleton et al, 1999).
Principe
Ce dosage est fondé sur la quantification de la
concentration totale de groupements hydroxyles présents dans l'extrait.
Le réactif de Folin - Cicalteu consiste en une solution jaune acide (Ac)
contenant un complexe polymérique d'ions (hétéro
polyacides). En milieu alcalin, le réactif de Folin - Cicalteu oxyde les
phénols en ions phénolates et réduit partiellement ses
hétéro polyacides d'où la formation d'un complexe bleu
(Daels ,1999).
Mode opératoire
Dans un tube à essai on introduit :
- 0.2 ml d'extrait (préparé dans l'eau
distillée avec les dilutions convenables)
- On ajoute 1 ml du réactif de Folin- Cicalteu
fraîchement préparé (10 fois dilué)
- 0.8 ml de la solution de Na2Co3
à 7.5% (7.5g dans 100 ml)
- L'ensemble est incubé à une température
ambiante pendant deux heures.
- La lecture est effectuée contre un blanc sans extrait
à l'aide d'un spectrophotomètre à 765nm
Expression des résultats
Le taux de polyphénols totaux dans nos extraits a
été calculé à partir d'une courbe
d'étalonnage linéaire (y = ax + b) établie avec des
concentrations précises d'acides gallique Comme standard de
référence, dans les mêmes conditions que
l'échantillon.
3.1.2 Dosage des Flavonoïdes
Principe
La quantification des flavonoïdes
a été effectuée par une méthode adaptée par
Zhishen et al, (1999) avec le trichlorure d'aluminium et la
soude. Le trichlorure d'aluminium forme un complexe jaune avec les
flavonoïdes et la soude forme un complexe de couleur rose absorbe dans le
visible a 510 nm.
Mode opératoire
Ø 500 ul de l'extrait brut de la poudre de la
tomate/pelure .
Ø Mélangés avec 2 ml d'eau
distillée
Ø Suivis de 150 ul de nitrite de sodium (NaNO2)
à 5%.
Ø Après 5 min, 100 ul de trichlorure
d'aluminium (AlCl3) à 10% (m/v) est rajouté au mélange
.Après 6 min d'incubation à la température ambiante
Ø 1 ml de carbonate de sodium (NaCO3)
à 1 M est additionné. Immédiatement
Ø Le mélange est complètement
agité afin d'homogénéiser le contenu
Ø L'absorbance de la solution de couleur rosâtre
est déterminée à 510 nm contre un blanc.
Préparation de la courbe
d'étalonnage
Une courbe d'étalonnage est
réalisée en parallèle dans les mêmes conditions
opératoires en utilisant de la catéchine comme contrôle
positif.
La teneur en flavonoïdes totaux des extraits de
plante étudiée est exprimée en milligramme (mg)
équivalent de la catéchine par 100 gramme de la matière
végétale sèche (mg EC/100g).
3.1.3 Dosage des Anthocyanes
Le dosage des anthocyanes s'effectue
en utilisant deux propriétés dues à leurs
structures :
- La modification de leurs couleurs en fonction du pH.
- La transformation en dérivés incolores sous
l'action de certains réactifs comme les ions bisulfite.
Principe
La décoloration des anthocyanes
par l'acide sulfureux et les bisulfites alcalins est une réaction qui se
fait à pH 3 jusqu'à pH 1. D'autre part la réaction est
réversible mais uniquement dans le cas des anthocyanines. La
difficulté de la réaction en milieu acide s'explique par le
passage du bisulfite sous forme d'acide sulfureux moins dissocié, avec
diminution de la concentration en ions HSO3 (Ribérau, 1968).
La détection des molécules est assurée par des mesures
spectrophotométrique à 520nm.
Mode opératoire
ü dans un tube à essai, on mélange 1 ml
d'extrait avec 1 ml d'ethanol (solution d'ethanol à 95% acidifiée
à 0.1% d'HCl pur) et 20 ml d'HCl à 35% diluée à 2%
dans l'ED.
ü on prépare des cuves pour le
spectrophotomètre comme suit :
- Cuve A : 5 ml du mélange + 2 ml d'ED
- Cuve B : 5 ml du mélange + 2 ml de bisulfute de
sodium
ü Repos 20 mn
ü Lecture par spectrophotomètre à 520
nm.
On peut exprimer approximativement la variation d'absorbance
(DOA -DOB) par :
C (mg/ml) = (DOA -DOB) x 875
Où :
C : Concentration des anthocyanes en
mg/ml.
DOA : Densité optique de la cuve
A
DOB : Densité optique de la cuve
B
875 : Pente de la droite d'étalonnage
obtenu à partir de malvidine-3 glucoside (Ribérau, 1968).
3.1.4 Dosage du Lycopène
Lycopène est un pigment
liposoluble, du fait de sa grande disponibilité, il est beaucoup
utilisé comme colorant (E160d), c'est un tétra terpène de
la famille des carotènes.
Principe
La température de fusion de
lycopène est 175°C, puisqu'il est liposoluble alors son extraction
se fait soit dans le cyclohexane (d=0.78), le dichlorométhane (d=1.32),
et l'éthanol (d=0.79). L'identification du lycopène se fait par
spectrophotomètre à 472 nm (Benakmoum et al, 2008).
Mode opératoire
Ø 0.1 g de la poudre dans 10 ml de
(hexane-acétone-éthanol, (50/50/1)
Ø Agiter pendant 10 mn
Ø Centrifuger à 5000 tours par minute pendant 15
mn
Ø 1 ml de la phase organique est extrait en suite
dilué dans 10 ml d'hexane
Ø Dans une cuve on met un échantillon de la
phase organique
Ø L'absorbance est mesurée à 472 nm
La teneur en lycopène est exprimée selon la
formule suivante :
C(ìg/g) = Abs 472 x Fd x
106 x V / 3450 x 100x P
Où:
Fd : Facteur de dilution
V : Volume du solvant d'extraction
3450 : Coefficient d'extinction de
l'hexane
P : Poids de la prise d'essai
4. Etude de l'activité antioxydante de la
poudre de tomate:
Ø Test du pouvoir anti oxydant par
Réduction du Fer (FRAP : ferric reducing antioxidant
power)
Principe
L'évaluation est basée
sur la réaction de réduction du (Fe+3) présent
dans le complexe ferrocyanure de potassium en (Fe+2), la
réaction est révélée par le virement de couleur
jaune du fer ferrique (Fe+3) en couleur bleu vert du fer ferreux
(Fe+2), l'intensité de cette coloration est mesuré par
spectrophotomètre à 700 nm.
Le protocole expérimental utilisé est celui de
Yildirim et al, 2001

Mode opératoire
Ø 0.5ml d'échantillon à
différentes Concentrations est mélangée avec 1.25ml d'une
solution tampon du phosphate 0.2M (PH 6.6) et 1.25ml d'une solution de
Ferricyannure de potassium K3Fe(CN)6 à 1% (1 g de
K3Fe(CN)6 dans 100ml d'eau distillé).
Ø Incubation (bain marie) à 50°C pendant
20mn ensuite refroidissement.
Ø 2.5ml d'acide Trichloracétique à 10%
sont ajoutés pour stopper la réaction ensuite centrifugation
3000T/mn pendant 10mn
Ø 1.25ml du surnageant sont ajoutés à
1.25ml d'ED et 250ul d'une solution de chlorure ferrique à 0.1%
fraichement préparé.
Ø Lecture se fait contre un blanc à 700nm.
Le blanc : en remplaçant l'extrait par l'eau
distillée qui permet de calibrer l'Appareil.
Le contrôle positif est représenté par
l'acide ascorbique dont l'absorbance à été mesurer dans
les mêmes conditions que les échantillons
? Absorbance signifie une augmentation du pouvoir
réducteur des extraits.
ETUDE EXPERIMENTALE :
Résultat & discussions
Résultat et discussions
1. Composition globale de la tomate
Les trois fractions de la tomate
fraîche « Agora » sont données dans la figure
08 ; La teneur en pulpe, exprimée en pourcentage pondérale
(poids de la pulpe /poids du fruit frais) est de 89%, quant aux pelures, elles
représentent environ 8% (MF) du poids total de la tomate. Les
résultats obtenus sont légèrement supérieur
à ceux trouvés par Zidane, (2009) qui est 75% pour la pulpe et 25
% pour la pelure et graines, ce qui peut s'expliquer par les conditions dans
les quelles sont réalisés les mesures, sachant que
l'instabilité de la teneur en eau du produit dépend de sa
structure et les zones géographiques de la récolte.
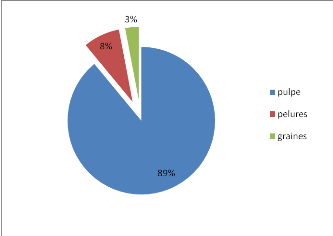
Fig 08.Les fractions de la tomate
fraîche
2. Résultats des analyses physico-chimiques
La connaissance du pH, la densité, du taux
d'humidité, de l'acidité titrable ainsi que du taux de cendres,
nous permet d'apprécier la qualité de la matière
première mise en oeuvre.
2.1. Teneur en eau
L'humidité nous permet de rapporter les
résultats des constituants biochimiques de
la matière sèche, une teneur en eau est faible
explique une teneur élevée en matière sèche, cette
corrélation négative se manifeste dans nos deux
échantillons, comme le démontre la figure 09. La teneur la plus
élevée est de la tomate séchée de (94.26%), ou
(05.74%) de matière sèche, et la pelure séchée
présente une teneur de (3.07%), ou de (96.93%) de matière
sèche, ces taux dépend de l'efficacité de séchage,
se situent dans l'intervalle trouvé par Martin et al, (2010)
qui est entre 93.05% et 95% pour les tomates séchée et entre 2.9
et 3.07 pour les pelures trouvé par Larid, (2011).
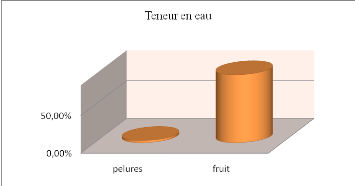
Fig .09. Teneur en eau des tomates et pelures
en poudre
2.2. pH
Le potentiel d'hydrogène est une des variables
utilisées pour caractériser les propriétés des
milieux. Relativement facile à mesurer, le pH est utilisé dans de
nombreux domaines comme variable opératoire, caractérisant du
produit fini ou encore à des fins de contrôle de qualité.
De nombreuses études se sont attachées à corréler
sa valeur à des lois cinétiques de réactions, des
qualités organoleptiques de produits ou encore des activités
enzymatiques (Boukhiar, 2009), le pH des extraits aqueux est mesuré pour
permettre l'interprétation de certains résultats
d'activité biologique (Amiour ,2009).
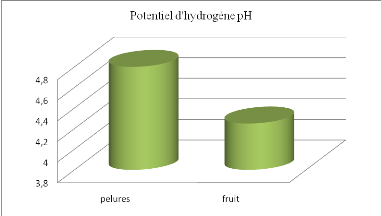
Les résultats obtenus (figure 10) montre que la
valeur du pH de la tomate séchée est de 4.25 qui est dans les
normes Daniel, (2005) a trouvé un pH < 4.5. Les pelures de
tomates séchées présentent un pH acide de 4.8. Ce pH est
préjudiciable aux bactéries mais appropriés au
développement de la flore fongique (Reynes et al, 1994).
Fig .10. Valeurs du pH des tomates et pelures
en poudre
2.3. L'acidité titrable
L'acidité titrable est une mesure de
la concentration totale d'acide. Dans la titration avec une base, tous les ions
H+ sont neutralisés qu'ils soient ionisés ou
non.
L'acidité est étroitement liée à
la composition biochimique de la tomate. Selon la figure 11, L'acidité
de la tomate séchée est de 5.74g/100g tandis que la pelure
présente une acidité de 4.55 g/100g, cela pourrait être
liée à la fermentation partielle d'échantillons, en raison
de la durée de séchage, et à l'activité enzymatique
de la pectine au cours de la phase initiale du séchage (Okanlawon ,
2002).
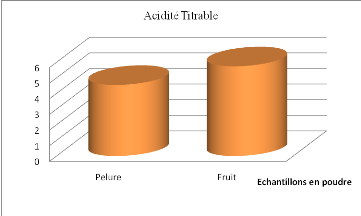
Fig.11. Valeurs d'acidité titrable des
tomates et pelures en poudre
2.4. Le taux de Cendres
Le taux de cendres représente la
quantité totale en sels minéraux présents dans un
échantillon. Selon la figure 12, la valeur trouvée dans la tomate
séchée est de 12.5% alors que pour les pelures de tomate
séchée est de 8.5% qui est largement supérieur à
ceux trouvés par Navarro et al, (2011) qui est 3.1%,
elles sont probablement liées à deux facteurs
principaux : les variétés de tomates
utilisées pour les préparations des poudre , Peut être que
le traitement thermique par évaporation de la poudre fait diminuer la
teneur en sels minéraux et donc en taux cendres.
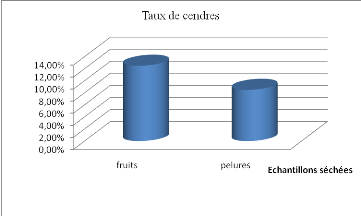
Fig.12. Taux de cendres des tomates et pelures
en poudre
2.5. La densité
Les valeurs obtenues sont indiquées
sur la figure 13. Nous avons remarqué une légère
différence de densité entre la tomate et la pelure
séchée, cela est du à la différence dans la
composition chimique en polyphénols de chaque échantillon.
La valeur la plus élevée est enregistrée
dans la pelure (1.014), dans la tomate séchée, la densité
est de 1.037 ces résultats se situent dans l'intervalle trouvé
par Zidane, (2009) qui est de 1.010 et 1.049.
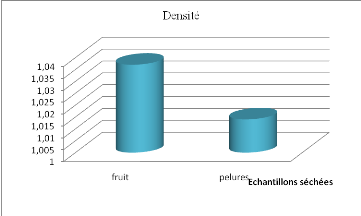
Fig.13. La Valeur de la densité des
tomates et pelures en poudre
2.6. Le Brix (%)
La pelure de la tomate séchée
présente un résidu sec de 39.10%, correspond à un indice
de réfraction de 3.92.La mesure des teneurs en extrait sec soluble des
pelures de tomates ont montré un taux soluble comparable à celui
des pelures de tomates fraîches. Alors que pour les tomates
séchées : le taux de résidu sec est de 47.89%, il
correspond à un indice de réfraction de 5.25 qui est
supérieur à celui de la pelure séchée (figure
14).
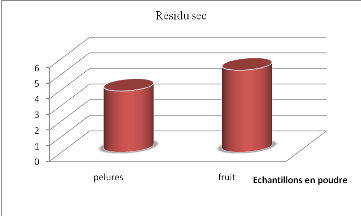
Fig.14. Les valeurs du résidu sec des
tomates et pelures en poudre
2.7. Teneur en sucres totaux
Selon la figure 15, le taux de sucre totaux contenu dans le
fruit est de 1.38 g/100g tandis que pour les pelures est de 1.13 g/100g. Ce
taux de sucre totaux peut varier, il est lié à la réaction
du brunissement non enzymatique (Georgelis et al, 2006 ; Mehdi
Ghiafeh et al ,2006).
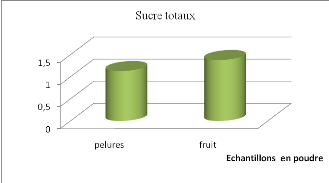
Fig.15. Taux de sucre totaux des tomates et
pelures en poudre
3. Résultats des analyses biochimiques
3.1 Teneur en polyphénols totaux
Le dosage des polyphénols totaux, nous donne une
estimation globale de la teneur en différentes classes des
composés phénoliques contenus au niveau de l'extrait
hydro-alcoolique de la poudre des pelures et fruits.
Avant de procéder à la détermination
de la teneur en composés phénoliques , nous avons établi
une courbe d'étalonnage en utilisant l'acide gallique comme
composé de référence ( méthode décrite en
annexe 1), les teneurs en composé phénolique des deux
échantillons sont consignés dans la figure 16.
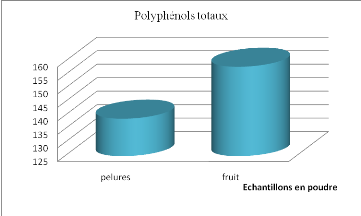
Fig.16. Teneur en polyphénols totaux
des pelures et tomates en poudre
En comparant la teneur en polyphénols de la pelure qui est
138.85 mg d'acide gallique /100ml et des pelures de 158.1 mg d'acide gallique
/100ml on peut dire que les activités antioxydante efficace de la tomate
sont attribuées à leurs polyphénols principalement l'acide
Chlorogénique, rutine et l'acide gallique.
Les teneurs en composés phénoliques totaux des
extraits aqueux sont plus élevées que celles des extraits
organiques. La majorité des composés phénoliques
trouvés dans les fruits, notamment les tanins condensés.
L'étude menée par Cieslik et al, (2006) sur la teneur en
polyphénols de certains fruits a noté des valeurs de 28.1, 11.6
et 7.8 mg GAE /100 ml pour le kiwi, pastèque et melon, cette grande
différence est due à plusieurs facteurs comme :
- L'espèce : le taux de polyphénols est
différent d'une espèce à une autre.
- Période de récolte : c'est aussi lié
à la période de maturité du fruit où le taux de
polyphénols atteint son maximum (Raffo et al, 2002).
- Les conditions climatiques (qui diffèrent d'une
région à une autre).
- Le solvant d'extraction :le choix du solvant
(méthanol, éthanol..etc) agit sur la quantité de
polyphénols extraite.
De ce fait on peut considérer la tomate comme une
source antioxydante naturelle.
3.2 Teneur en flavonoïdes
La quantité de flavonoïdes dans nos extraits a
été déterminée à partir de la courbe
d'étalonnage du catéchines (méthode démontré
en annexe 1). Les résultats obtenus exprimés en milligrammes par
gramme de la matière sèche en équivalent du
catéchine, selon la figure 17, le taux de flavonoïdes du fruit est
de 37.24 mg/100g, alors que pour les pelures il est de 24.80 mg/100g. La
teneur en flavonoïdes est supérieur à celle des
flavonoïdes données par Haddadi, (2005) des fruits et
légumes : mandarines, pamplemousses, pommes, fraises qui sont
respectivement de 3.22, 7.12, 2.10 et 17.53 mg/100g.
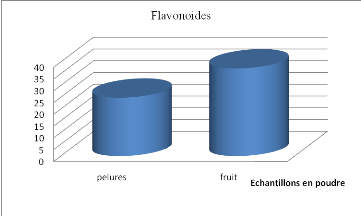
Fig.17. Teneur en flavonoïdes des pelures
et tomates en poudre
3.3. Teneur en anthocyanes
La teneur en anthocyanes pour la poudre
des tomates et pelures est estimée respectivement de 13.125 mg/ml et
11.375 mg/ml, ces deux valeurs présentent une légère
différence (figure 18)
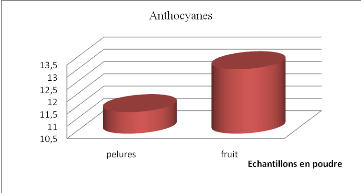
Fig.18. Teneur en anthocyanes des pelures et
tomates en poudre
Il est important de signaler que les anthocyanes, sur le plan
théorique augmentent avec la maturation des fruits. Elle est
étroitement corrélée avec la nature des fruits. Par
ailleurs, les différentes réactions qui peuvent prendre place
dans la diminution des anthocyanes sont :
Les réactions de condensation des anthocyanes et/ou
flavanols avec d'autres molécules comme l'acide puracique, venyl
phénole ou l'acide glycoxylique (Barker et al, 1997 ; Dos
Santos et al, 1996).
La combinaison des anthocyanes avec les tanins donnent des
polymères qui possèdent des propriétés et des
couleurs différentes à celles des anthocyanes.
3.4 Teneur en lycopène
Selon la figure 19, la teneur en
lycopène est de 62.59mg/100g pour les pelures et de 128.69 mg/100g de
tomates en poudre.

Fig.19. Teneur en lycopène des pelures
et tomates en poudre
Il est bien connu que le taux d'extraction augmente avec
le temps de contact
(Lapornik et al, 2005). Le lycopène contenu dans
la poudre des deux échantillons est extrait par macération
à l'aide d'un solvant assisté par une agitation. La teneur en
lycopène était mesurée par spectrophotométrie UV-
visible. On constate qu'avec la macération, l'extraction de ce
caroténoïde été satisfaisante.
Selon d'autres études, Rozzi et
al, (2002) on constaté que la pelure et les graines de tomate
contiennent 24 ìg de lycopène /g de poids sec, Botsoglou et
al, (2004) ont signalé une teneur en lycopène de
281mg/100g du poids sec, tandis que Lahmari et al,(2012) ont
signalé la teneur en lycopène de la tomate séchée
entre 14.76 et 15.45 mg/100 g (MS).
La variation de la teneur en lycopène de la tomate
obtenu est probablement due a des différences dans leur conditions de
croissance (Toor, 2005). Beaucoup de facteurs y compris la maturité, la
chaleur et la variété utilisé peuvent affecter la
concentration de lycopène contenu dans le fruit de tomate (Thompson et
al, 2000 ; Sharma et al, 1996).
La pelure de la tomate est une source riche en
lycopène, car elle contient environ 5 fois plus de lycopène
que la pulpe entière de la tomate (Botsoglou et al, 2004).
Par conséquent, la PTS (pelure de la tomate séchée) peut
être une source importante des antioxydants naturels pour l'industrie
alimentaire.
4. Test in vitro de L'activité anti oxydante
4.1. Réduction de fer (FRAP)
L'activité anti oxydante des deux extraits a
été évaluée en utilisant la méthode FRAP
.Cette dernière est un essai simple, rapide et reproductible. Il est
universel peut être appliqué aussi bien chez les plantes que les
plasmas et dans les extraits organiques et aqueux (Li et al, 2008).
La présence des réductants dans les
extraits provoque la réduction de fer Fe3+ complexe
ferricyanide à la forme ferreux. Par conséquent, Fe2+
peut être évalué en mesurant et en surveillant
l'augmentation de la densité de la couleur bleu vert dans le milieu
réactionnel à 700 nm. En d'autre terme, le système
FeCl3/K3Fe(CN) 6 confère à la
méthode la sensibilité pour la détermination «
semi quantitative » des concentrations des polyphénols, qui
participent à la réaction redox (Amarowicz et al,
2004).
D'après la courbe d'acide ascorbique
(méthode démontré en annexe1) on mesure le pouvoir
réducteur des deux extraits selon leur absorbance.
Les valeurs présentées selon les figures 20 et
21, montrent le pouvoir réducteur des deux extraits à
différentes concentrations.
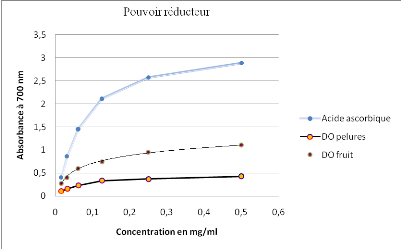
Fig.20. Pouvoir réducteur des deux
extraits (Pelures et fruit) et acide ascorbique.
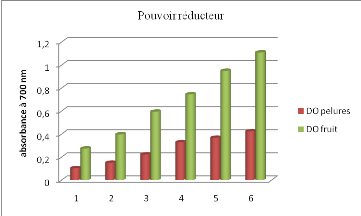
Fig.21. Pouvoir réducteur des deux
extraits
D'après nos résultats, pour les deux
extraits testés, une augmentation de la réduction du fer est
proportionnelle aux concentrations utilisées.
Tous nos extraits présentent des activités
antioxydant nettement inférieures à celle de la
référence (acide ascorbique), pour ce dernier la
réduction est presque totale à partir d'une concentration de 0.5
mg/ml.
Les extraits de la poudre de tomate (pelure+ pulpe) est
actif comparativement à la poudre de la pelure seule.
A la concentration de 0.125 mg/ml les deux extraits
s'avèrent puissant vis-à-vis de réduction de fer (les
valeurs de DO=0.746 et DO = 0.329 respectivement).
Le pouvoir réducteur des deux extraits est due
à la présence du lycopène et de groupement hydroxyle dans
les composés phénoliques qui peuvent servir comme donneur
d'électron. Par conséquent, les antioxydants peuvent être
considérés comme des réductants et inactivateurs des
oxydants (Siddhuraju et Becker, 2007). Quelques études
antérieures ont également montré que le pouvoir
réducteur d'un composé peut servir comme indicateur significatif
de son activité antioxydante potentielle (Jeong et al
,2004).
On peut conclure pour l'activité antioxydante
que :
ü Les extraits bruts sont plus actifs, cela est due
surement à la complexité de ces extraits en substance poly
phénoliques et la synergie entre eux pour une meilleure activité
antioxydante (Vermerris et Nicholson, 2006).
ü L'efficacité de l'antioxydant (AH) augmente si
la force de la liaison A-H est faible et le radical (A) résultant doit
être le plus stable possible, ce qui est le cas pour les composés
phénoliques et flavonoïdes, se sont des meilleurs donneurs
d'électron ou d'hydrogène (Shaidi et Naczk, 2004).
ü Plusieurs études ont montré que les
groupements hydroxyles dans les composés phénoliques et
flavonoïdes sont responsables de leur pouvoir antioxydant (Heim et
al, 2002).
ü En générale, les activités de nos
extrait sont moyenne, ce qui est confirmé par l'étude de Zidani ,
(2009) et Martin et Mohand, (2010).
CONCLUSION GENERALE
CONCLUSION GENERALE
La famille des polyphénols
renferme de nombreux composés d'intérêt nutritionnel et
valorisables dans l'industrie alimentaire et pharmaceutique et dans la
cosmétologie en raison de leurs propriétés
réductrices (antioxydant) , de leur capacité à interagir
avec les ions métalliques et une grande variété de
protéines.
La tomate, fruit largement consommé frais mais
aussi sous forme transformée, est reconnu pour ses qualités
nutritionnelles. Riche en micro constituants, tels les caroténoïdes
(lycopène en particulier), les composés phénoliques et la
vitamine C.
En ce qui concerne les paramètres
physico-chimiques, la teneur en eau présente une différence nette
est observé entre le fruit (94.26%) et les pelures (3.07%), pour les
valeurs de pH ; le fruit présente un pH légèrement
acide (4.28) par rapport à la pelure (4.8).
Les résultats obtenus ont montré que nos
échantillons analysées sont riche en composés
phénolique pour le fruit (épépinée) présente
un taux en polyphénols totaux légèrement
élevée (158.1 mg EAG/ml) par rapport à celle des pelures
séchées (138.69 m EAG/ml), de même la teneur en
flavonoïdes du fruit (37.24 mg/ml) comparativement aux pelures(24.80mg/ml)
, quant à la teneur des anthocyanes ; les deux échantillons
présentent presque les mêmes taux : 13.125 mg/ml pour le
fruit (sans graines) et 11.375 mg/ml pour les pelures, et pour le
lycopène on a trouvé 128.69 mg/ml pour le fruit et 61.59mg/ml
pour les pelures, ce qui confirme leur pouvoir élevée
d'antioxydant qui était proportionnel à différentes
concentration des pelures et fruits réduits en poudre. Ces
résultats confirment les données de la littérature, qui
ont classé la tomate dans la catégorie des antioxydants
naturels.
En général, on peut conclure que nous deux
échantillons sont riches en composés phénoliques, on
parlant de la pelure autant qu'un déchet industriel lors de la
transformation de la tomate en DCT (double concentré de tomate) et de la
poudre de tomate séchée.
En perspective il est intéressant de :
- Réaliser une étude in vivo
antibactérienne afin de déterminer que les polyphénols de
la tomate ont un effet antibactérien.
- Appliquer la poudre de la tomate comme un agent liant dans
l'industrie pharmaceutique.
- valoriser les sous produits de tomates au niveau du
marché local et d'inciter les agriculteurs à
s'intéressée au séchage des tomates et leurs
déchets, on augmentant leur commercialisation sur tout le territoire
Algérien.
REFERENCES BIBLIOGRAPHIQUES
A :
Ø Abbayes H, Chadefaud M, Ferre Y., Feldmann J.,
Gaussen H., Grasse P.,Leredde M., Ozenda P.Prevot A. (1963). Botanique
Anatomie_Cycles evolutifs_systématique. Masson et Cie.8 : 52-65
Ø Atherton J.,C.Rudich J. (1986). The tomato crop. A
scientific basis for improvement.2: 142-144.
Ø Ahmet S.(2003).Etude phytochimique et des
activités biologiques de Balanites aegyptica ( Balanitaceae)
.Thèse pharmacie banak .117.
Ø A.V.Raol.G.(2007).Carténoids and Human Health
.Pharmacoligical research.55:207-216.
Ø Afnor., (1982). Recueil de normes
françaises des produits dérivés des fruits et
légumes jus de fruits. Ed. AFNOR : 325.
Ø Amiour S. (2009). Etude quantitative des composes
phénoliques des extraits de grenade et evaluation in vitro de leur
activité biologique, mémoire de magister en biologie, centre
universitaire de batna.76-77
Ø Amarowicz R, Estrella I, Hernandez T, Robredo S,
Troszynska A, Kosinska A, Pegg R.( 2010) . Free radicals-scavenging capacity:
antioxidant activity and phenolic composition of green lentil (Lens
culinaris); Food Chemistry 121; Ed: ELSEVIER.705-711.
B :
Ø Bauer S., Schulte E.Thier H. P. (2004). Composition
of the surface wax from tomato-II.Quantification of the components at the ripe
red stage and during ripening. European Food Research and Technology 2195:
487-491.
Ø Bazzano L. A. (2008). Epidemiologic evidence for the
effect of fruit and vegetables on cardiovascular diseases, diabetes and
obesity. Improving the health-promoting properties of fruit and vegetable
products. Tomas-Barberan, F. A.Gil, M. I.Cambridge, UK. New York, USA, Woodhead
publishing limited CRC press: 119-144.
Ø Bell-Lelong D. A., Cusumano J. C., Meyer K.Chapple C.
(1997). Cinnamate-4-hydroxylase expression in arabidopsis. Regulation in
response to development and the environment. Plant Physiology 113: 729-738.
Ø Barrett D M , Garcia E, Wayne JE(1998).Textural
modification of processing tomatoes.CRC Critical Reviews in food science and
nutrition 38:17-258.
Ø Barker H, Seaton R, Robinson
A. (1997). Internal and external photoprotection in developing leaves
of the CAM plant Cotyledon orbiculata. Plant, Cell and
Environment .20: 617-624.
Ø Blanc D. (1986). "The influence of cultural practices
on the quality of production in protected cultivation with special references
to tomato production." Acta Horticulturae. 191: 85-98.
Ø Besançon P. (2000). Effets
bénéfiques pour la santé des fruits et des légumes.
Alimentation méditerranéenne et santé : actualité
et perspectives. Montpellier, John libbey. 99-108.
Ø Benakmoum, A., Abbedou, S., Ammouche, A., Panagiotis,
K., Dimitrios, G (2008).
Valorisation of low quality edible oil with tomato peel waste.
Food Chemistry 110 :684-690.
Ø Bravo L (1998). Polyphenols: chemistry, dietary,
sources, metabolism and
nutritional significance, Nutr.Rev.56: 317-333.
Ø Brouillard, R., Figrvire, P., El habiri, M., and
Dangles, O. (1997). Molecular interaction of phenolic compounds in relation to
the color of fruit and vegetables. In : les polyphénols en
agroalimentaire. Sarni-Manchado, P; Cheynier, V. 2006. Tec et Doc
Lavoisier-Paris. 125-145.
Ø Boss.I.P.L. (2002). Etudes des activités
bilogiques fagara xanthoxyloides LAM (Rutaceae).Thèse de Pharmacie,
Bamako. 133.
Ø Boukhiar A. (2009). Analyse du processus traditionnel
d'obtention du vinaigre de dattes tel qu'appliqué au sud
Algérie : essai d'optimisation. Mémoire de magistère,
centre universitaire de Boumerdes. 45-52.
Ø Botsglon N,Papageorgeogious G, Nikolakakis I, Florou
P, Giannenas I, Dotas V, Sinapis E.(2004). Effect of dietary dried tomato pulp
on oxidative stability of japenese quail meat.J.Agric.Food chem..Vol 52.10.
C :
Ø Cavina M (1999) ; Investigation phytochimique
de trois plantes indonésiennes au propriété antioxydante
et anti radicalaire : « Tinospora crispa (Menispermaceae),
Merremia emerginata ( Convolvulaceae) et Orpheaen neandra
(Annonnanceae).Thèse de Doctorat. université de
l'indonésie. 10-19.
Ø Chanforan C (2010) ; Stabilité de
microconstituants de la tomate ( composés phénolique,
carténoide, vitamine C et E) au cours des procédés de
transformation :études en systèmes modèles mis en
point d'un modèle stoechio-cinétique et validation pour
l'étape unitaire de préparation de sauce tomate . Thèse
doctorale. 54-68 ,84-88.
Ø Cieslik E., Greda A., Adamus W. ( 2006). Contents of
polyphenols in fruit and vegetables.Food Chemistry, 94: 135-142.
Ø Carrara S., Pardossi A., Soldatini G. F., Tognoni
F.Guidi L. (2001). "Photosynthetic activity of ripening tomato fruit."
Photosynthetica .1: 75-78.
Ø Causse M, Saliba-Colombani V, Lesschaeve I, Buret M
(2001). Genetic analysis of organoleptic quality in fresh market tomato. 2.
Mapping QTLs for sensory attributes. Theoretical and Applied Genetics 102:
273-283.
Ø Cheynier V.Sarni-Manchado P (2006). Structures
phénoliques et goût. Les polyphénols en agroalimentaire.
Lavoisier: 398.
D :
Ø Daels rakotoarison D. (1999). Extraits
phénoliques d'aubépine, de cola et
d'églantier.Thèse de doctorat, université de Lille-II,
France.
Ø De Broglie L., A.Guéroult D. (2005). Tomates
d'hier et d'aujourd'hui. Lavoisier.15-20.
Ø Desjardin Y (2008). Physiological and ecological
functions and biosynthesis of healthpromoting compounds in fruit and
vegetables. Improving the health-promoting properties of fruit and vegetable
products. Tomas-Barberan, F. A.Gil, M. I.Cambridge, UK. New York, USA, Woodhead
publishing limited CRC press:201-247.
Ø Davies JN, Hobson GE. 1981. The constituents of tomato
fruit - the influence of environment, nutrition, and genotype. CRC Critical
Reviews in Food Science and Nutrition 15: 205-280.
Ø Dicko, MH., Gruppen, H., Traoré, A.S., Alphons,
G.J., Willem, J.H., and Berkel, V.2006. Phenolic compounds and related enzymes
as determinants of sorghum for food use.Biotechnology and Molecular Biology
Review.1: 21-38
Ø Djeridane A, yousfi M, nagjemi B, boutassouna D, stocker
P, vidal N. (2006). Antioxidant activity of some algian medicinal plants
extracts containing phenolic compound, food chemistry.97 : 654-660.
Ø Dos-Santos P J, Brillouet J M, Cheynier V,
Moutounet M.(1996). Detection and partial characterization of new
anthocyanin-derived pigments in wine. J. Sci. food Agric.21 :35-37
E :
Ø Ekoumou C.(2003). Etude phytochimique et
pharmacologique de cinq recettes traditionnelle utilisés dans le
traitement des infections Urinaire et la Cystite. Thèse Pharmacie,
Bamako, 145.
F :
Ø FAO (2008). L'actualité agricole en
Méditerranée. Ed. CIHEAM .33 .
Ø Feinbaum R. L.Ausubel F. M (1988). "Transcriptional
regulation of the A
rabidopsis thaliana chalcone synthase gene." Molecular and
Cellular Ciology: 1985-1992.
Ø Fleuriet A.Macheix J. (1981)."Quinyl ester and
glucose derivatives of hydroxycinnamic acids during growth and ripening of
tomato fruit." Phytochemistry 20: 667-671.
Ø Fleuriet, Macheix (1990). le brunissement
enzymatique et la qualité des fruits. In la maîtrise de la
qualité des fruits frais; 9éme colloque sur les recherches
fruitées. INRA, In: Les polyphénols en agroalimentaire.
Sarni-Manchado, P; Cheynier, V. 2006. Tec et Doc. Lavoisier-Paris. 249-258.
Ø Flores F. B., Oosterhaven J., Martinez-Madrid M.
C.Romojaro F (2005). "Possible regulatory role of phenylalanine ammonia-lyase
in the production of anthocyanins in asparagus (Asparagus officinalis L)."
Journal of the Science of Food and Agriculture 85: 925-930.
Ø Franceschini P (1994) ; La peau et son
vieillissement, Ed .Flammarion Dominos,
Paris, 125.
G :
Ø Gautier H., Diakou-Verdin V., Benard C., Pfeiffer
F., Reich M., Buret M., Bourgaud F., Poëssel J. L., Caris-Veyrat
C.Génard M. (2008). "How does tomato quality (sugar, acid and
nutritional quality) vary with ripening stage, temperature and
irradiance?"Journal of Agricultural and Food Chemistry 56: 1241-1250.
Ø Giovannucci E (1999). "Tomatoes, tomato-based
products, lycopene, and cancer : review of the epidemiologic literature" .
Journal of the national cancer institute 91: 317-331.
Ø Giovannucci E (2007). "Does prostate-specific
antigen screening influence the results of studies of tomatoes, lycopene, and
prostate cancer risk?" Journal of the National Cancer Institute 99:
1060-1062.
Ø Georgelis N, Scott JW, Baldwin EA.( 2006). Inheritance
of high sugars from tomato accession PI 270248 and environmental variation
between seasons. Journal of the American Society for Horticultural Science
131:41-45.
Ø Gould K. S.Lister C. (2006). Flavonoïd
functions in plants. Flavonoids: Chemistry,biochemistry and applications.
Andersen, O. M.Markham, K. R., CRC Press. 8: 397441.
Ø Grasselly D., Navez B.Letard M (2000). Tomate, pour
un produit de qualité. Lavoisier. 25-35.
Ø Guignard, J. ( 2000). Biochimie végétal
. 2éme edition Dunod. 188.
Ø Guichard S (1999). Flux hydriques, croissance et
qualité du fruit de tomate ( Lycopersicon esculentum
Mill.) en conditions estivales sous serre, Université aix Marseille III:
118.
Ø Gartner . C, Stahl.W, Sies.H( 1997) ; Lycopen
is more bioavailable from tomato paste than from fresh tomatoes
.Am.J.Clin.Nutri.66-116, 116-122.
Ø Goodon B. (1997). Guide pratique d'analyse dans les
industries des céréales.Tec.et Doc .346-354.
H :
Ø Haddadi.H (2005). « Détermination
del'activité antioxydante de quelques fruits. Mémoire de
magister.Université de Béjaia :76.
Ø Haukioja E., Ossipov V., Koricheva J., Honkanen T.,
Larsson S.Lempa K (1998). "Biosynthetic origin of carbon-based secondary
compounds: cause of variable responses of woody plants to fertilization?"
Chemoecology 8: 133-139.
Ø Heim K.E., Tagliaferro A.R., et Bobilya D.J. (2002)
Flavonoid antioxidants:chemistry, metabolism and structure-activity
relationship; Journal. Nutr. Biochem. 13: 572-584.
Ø Hollman P. C. H (2001). "Evidence foe health benefits
of plant phenols local or systemic effects?" Journal of the science of Food
and agriculture 81: 842-852.
Ø Hunt G., Baker E. A (1980). "Phenolic constituents of
tomato fruit cuticles."
Phytochemistry .7: 1415-1419.
I :
Ø Ilkay T., Aziz E. (2011). «Brix degree and
sorbitol/xylitol level of anthntic pomegranate (Punica gramatum) juice. Food
Chemistry 127: 1404-1407.
J:
Ø James A. (1980).» Plumbing : Installation and
design.Resto Publishing Company.Sci.of fluids 6: 26-152.
Ø Johnson K. S . (2005). "Plant phenolics as radical
scavengers in the context of insect (Manduca sexta) hemolymph and midgut
fluid." Journal of Agricultural and Food Chemistry 53: 10120-10126
Ø Johnson K. S.Felton G. W (2001). "Plant phenolics as
dietary antioxidants for herbivorous insects: a test with genetically modified
tobacco." Journal of Chemical Ecology 27: 2579-2597.
Ø Judd W. S., Cambell C S., A. K. E.P S (2002).
Botanique Systématique Une Perspective Phylogénétique. De
Boeck Université.54-65
Ø Jeong S.M., Kim S.Y, Kim D.R, Jo S.C, Nam K.C, Ahn D.U,
Lee S.C.(2004). Effects of heat treatment on the antioxidant activity of
extracts from citrus peels. Journal of Agriculture and Food Chemistry 52:
3389-3393.
K :
Ø Kaluzny-Pinon L., Letard M.Zambujo C (2001). "La
tomate se concentre sur le gout". Culture Légumière 61: 25-31.
Ø Kavanaugh C. J., Trumbo P. R.Ellwood K. C . (2007).
"The U.S. food and drug
administration's evidence-based review for qualified health
claims: Tomatoes,
lycopene, and cancer." Journal of the National Cancer
Institute 99 : 1074-1085.
Ø Khelil A., Menu T.Ricard B (2007). "Adaptative
response to salt involving carbohydrate metabolism in leaves of a
salt-sensitive tomato cultivar." Plant Physiology and Biochemistry 45:
551-559.
Ø Kozukue N., Han J., Lee K.Friedman M (2004).
"Dehydrotomatine and alpha -tomatinecontent in tomato fruits and vegetative
plant tissues." Journal of Agricultural and Food Chemistry 7: 2079-2083.
Ø Krause M.Galensa R (1992). "Bestimmung von naringenin
und naringenin-chalkon intomatenschalen mit RP-HPLC nach festphasenextraktion."
Zeitschrift fur Lebensmittel Untersuchung und Forschung 194: 29-32.
Ø Koricheva J., Larsson S., Haukioja E.Keinanen M
(1998). "Regulation of woody plansecondary metabolism by resource availability:
hypothesis testing by means of metaanalysis.". Oikos 83: 212-226.
Ø Krinsky N.I (1989). «Antioxydant functions of
cartenoids free radic».biol Med 6:35-167.
L :
Ø Laterrot Henri (1998). la tomate : Origine,
diversité, creation, Variétal, Lycopersicon esculentum,
Classification des espèces, société botanique de
Vanclus,Bull soc.Bot.Vancluse .INRA, Agronomic : 4-5.
Ø Lapornik B, Prosek M, Wandra A. (2005). Comparaison
of extracts prepare from plant by product using different solvent and
extractive.Journal of food engineering.71:2.214-222.
Ø Lahmari N, Fahlal D et Azani I.(2012). Influence des
methodes de séchage sur la qualité des tomates
séchées. Thèse de magistère.Laboratoire science des
aliments, université Hadj lakhdar, Batna.
Ø Lee. A , Thurnham.D.I Chopra.M (2000). Consumption of
Tomato products with olive oil but not sunflower oil increase the antioxidant
activity of plasma.Free Radic, Biol.med .10: 1051-1055.
Ø Le Marchand L & Al (1994). A pilot study
on the use of plasma Cartenoid and Ascorbic Acid as Markers of compliance to
high fruit and vegetable dietary intervention. Cancer epidémiol
biomarkers . 3 : 51-245.
Ø Le Perchec (1994) ; Les molécules de la
beauté, de l'hygiène et de la protection. Ed Nathan,
Paris.142.
Ø Leyva A., Jarillo J. A., Salinas J.Martinez-Zapater
J. M (1995). "Low temperature inducesthe accumulation of Phenylalanine
Ammonia-Lyase and Chalcone Synthase mRNAsof Arabidopsis thaliana in a
light-dependent manner." Plant Physiology 108: 39-46.
Ø Liu R. H . (2004). Potential synergy of
phytochemicals in cancer prevention: mechanismaction. International Research
Conference on Food, Nutrition, and CanWashington : 15-16.
Ø Lattanzio V, Cardinah A, Palmier S .1994. The role of
phenolics in the post harvest
physiology of fruits and vegetables: browniong reaction and
fingal disease Ital. J Food sci, 6: 3-22.
Ø Li H-B. , Wong C-C., Cheng K-W., Feng C.(2008) .
Antioxidant properties in vitro and total phenolic contents in methanol
extracts from medicinal plants.
Lebensmittel- Wissenschaft and Technology, 41 :
385-390.
M :
Ø Macheix J. J., Fleuriet A.Jay-Allemand C (2005). Les
composés phénoliques des végétaux : Un exemple de
métabolites secondaires d'importance économique .Bio ed.
54-65.
Ø MADR . ( 2009). Ministère de l'Agriculture et
du Développement Rural , Direction des Statistiques.62.
Ø Martin A et Mohand A. (2010). Valorisation de
résidus de transformation industrielles des tomates. Mémoire
ingénieur agronome, science alimentaire, université Saad dahleb
de Blida.
Ø Mehdi Ghiafeh, Davidia P, Vijayanands K, Ramana
.(2006). Effect of different pretreatments and deshydratation methods on
quality characteristics and storage stability of tomato powder.LWT.
40:1832-1840.
Ø Mikanowski L.Mikanowski P .(1999). Tomate. Biol ED.
62-65.
Ø Mieyal JJ.(1978). Mecanism of enzyme like reaction
involving human hemoglobin.Biorganic chemistry.Vol IV,Van Tamelen.Acad.Press,
New York. 315-348.
Ø Mittelstraß K., Treutter D., Pleßl M.,
Heller W., Elstner E. F.Heiser L. (2006). "Modification of primary and
secondary metabolism of potato plants by nitrogen application differentially
affects resistance to Phytophtora infestans and Alternaria
solani." Plant Biology 8: 653-661.
Ø Moco S., Bino R. J., Vorst O., Verhoeven H. A., De
Groot J., Van Beek T. A., Vervoort J.DeVos C. H. R. (2006). "A liquid
chromatography-mass spectrometry-based metabolomedatabase for tomato." Plant
Physiology 141:1205-1218.
Ø Moco S., Capanoglu E., Tikunov Y., Bino R. J.,
Boyacioglu D., Hall R. D., Vervoort J.De Vos C. H. R. (2007). "Tissue
specialization at the metabolite level is perceived during the development of
tomato fruit." Journal of Experimental Botany 58: 41-314-146.
Ø Mortain-Bertrand A., Stammitti L., Telef N.,
Colardelle P., Brouquisse R., Rolin D.Gallusci P (2008). "Effects of exogenous
glucose on carotenoid accumulation in tomato leaves." Physiologia Plantarum
134: 246-256.
N :
Ø Navarro - Gonzalez I, Garcia - Valverde V, Garcia -
Alonso J, Jesus - Periago M.(2011). Chemical profile, functional and
antioxidant properties of tomato peel fiber. J. foods.10-101.
O :
Ø Okanlawon S, Ibrahim M, Oyebani A.(2002). Effect of
predrying treatment on the storage of dried tomato.Tropical science.40-42.
P :
Ø Pecaut P.Philouze J (1968). "Les
variétés de tomate cultivées en France.PHM 87:
49-59-73.
Ø Penuelas J.Estiarte M. (1998). "Can elevated CO2
affect secondary metabolism andecosystem function?" Trends in Ecology &
Evolution 13: 20-24.
R :
Ø Ramandeep.K,Toor, Geoffrey.P. Savage( 2005).
Antioxidant activity in different fraction of tomatoes. Food research
international 38:487-494.
Ø
Rao.A.v (2006). Lycopene Content of Tomato Products: Its Stability,
Bioavailability and In VivoAntioxidant Properties. Food and nutrition
research.10:1016-1043.
Ø Raffo A., Leonardi C., Fogliano V., Ambrosino P.,
Salucci M., Gennaro L., Bugianesi R.,Giuffrida F.Quaglia G(2002). "Nutritional
value of cherry tomatoes (Lycopersicumesculentum Cv Naomi F1) harvested at
different ripening stages." Journal of Agricultural and Food Chemistry .22:
6550-6556.
Ø Raffo A., La Malfa G., Fogliano V., Maiani G.Quaglia
G. (2006). "Seasonal variations in antioxidant components of cherry tomatoes."
Journal of Food Composition and Analysis 19: 11-19.
Ø Renaud V. (2003). Tous les légumes courants,
rares ou méconnus cultivables sous nosclimats. 49 :549-565
Ø Renaud V. (2006). Les tomates qui ont du goût,
Eugen Ulmer, Paris. 19: 11-19.
Ø Reynes M, Bouabidi H, Piombo G, Risterucci A.(1994).
Caractérisation des principales variétés de dattes
cultivée dans la région du djérid en tunisie.Journal of
fruits.Vol 49. 289-298.
Ø Rivero R. M., Ruiz J. M., Garcia P. C., Lopez-Lefebre
L. R., Sanchez E.Romero L. (2001)."Resistance to cold and heat stress:
accumulation of phenolic compounds in tomato and watermelon plants." Plant
Science 160: 315-321.
Ø Ribéreau-Gayon P.(1968). Les composés
phénoliques des végétaux. Ed. Dunod Paris : 254.
Ø Rozzi N, Singh R, Vierling R et Warkins B.(2002).
Supercritical fluid extraction of lycopène from Tomato processind by
products. Journal of Agricultral and Food chemistry.50: 2638-2643.
S :
Ø Sarni-Manchado, P ; Cheynier, V(2006).
les polyphenols en agroalimentaire, Tec et Doc Lavoisier-Paris. 10:
31-32.
Ø Sawa T., Nakao M., Akaike T., Ono K.Maeda H. (1999).
"Alkylperoxyl radical-scavenging activity of various flavonoids and other
phenolic compounds : implications for the anti-tumor-protector effect of
vegetales." Journal of Agricultural and Food Chemistry 47: 397-402.
Ø Scalbert A., Manach C., Morand C.,
Rémésy C.Jiménez L. (2005). "Dietary polyphenols and the
prevention of diseases." Critical Reviews in Food Science and Nutrition
45(4):287-306.
Ø Shahidi f., Naczk m.(2004). Extraction and analysis of
phenolics in food; Journal of Chromatography A 1054; Ed: ELSEVIER. 95-111.
Ø Sharma S, Le Maguer M.(1996). Lycopene in tomatoes and
tomato pulp fractions.Ital.J.Food.SCi.2:107-113.
Ø Singh M.Ramassamy C. (2008). Beneficial effects of
phenolic compounds from fruit andvegetables in neurodegenerative diseases.
Improving the health-promoting propertiesof fruit and vegetable products.
Tomas-Barberan, F. A.Gil, M. I. Cambridge, UK .New York, USA, Woodhead
publishing limited CRC press: 145-181.
Ø Singleton VL.,Orthofer R.,Lamuela-Raventos . (1999).
«Analysis of total phenols and other oxidants substrates and antioxidants
by means of Folin-Ciocalteu reagent.Methods Enzymol 299: 152-178.
Ø Slimestad R.Verheul M. J. (2005). "Seasonal variation
in the level of plant constituents in greenhouse production of cherry
tomatoes." Journal of Agricultural and Food Chemistry 53: 3114-3119.
Ø Soto-Zamora G., Yahia E. M., Brecht J. K.Gerdena A.
(2004). "Effects of the post harvested hot air treatments on the quality and
antioxidant levels in tomato fruit." Scientia Horticulturae 84: 284-296.
Ø Stewart A. J., Bozonnet S., Muller W., Jenkins G. I.,
Lean M. E. J.Crozier A. (2000)."Occurence of flavonols in tomatoes and
tomato-based products." Journal of
Agricultural and Food Chemistry 48: 2663-2669.
Ø Stahl & al .(2000) . Cartenoids and
Cartenoids plus Vit E Protect against ultraviolet light-induced erythema in
humans.Am.J.Clin.Nutri . 71: 795-798.
Ø Steptoe .A & al .(2003). Behavioural
counseling to increase consumption of fruit and vegetables in low income adults
: randomised trail.BMJ. 61,326,855.
Ø Snoussi sid Ahmed (2010). Etude de base sur la tomate
en Algérie Rapport de mission : 5-10, 34-36.
Ø Siddhuraju P., Becker K. (2007). The antioxidant and
free radical scavenging activities of processed cowpea (Vigna unguiculata (L.)
Walp.) seed extracts.
Food Chemistry, 101: 10-19.
T :
Ø Tomas-Barberan F. A.Espin J. C. (2001). "Phenolic
compounds and related enzymes as determinants of quality in fruits and
vegetables." Journal of the Science of Food and agriculture 81: 853-876.
Ø Toor R. K., Savage G. P.Heeb A. (2006). "Influence of
different types of fertilisers on the major antioxidant components of
tomatoes." Journal of Food Composition and Analysis 19: 20-27.
Ø Toor R, Savage G.(2005). Antioxidant activity in
different fraction of tomatoes. Food research International.38:487-497.
Ø Thompson K, Marshall M, Sims C, Wei C, Sargent S,
Scott J.(2000). Cultivar, maturity and heat treatment on lycopène
content in tomatoes .food.Sci.65:791-795.
Ø Treutter D. (2006). "Significance of flavonoids in
plant resistance: a review." Environment and Chemistry Letter 4: 147-157.
V :
Ø Vermerris W. et Nicholson R.(2006). Phenolic compound
chemistry; Ed: Springer:1-70.
W:
Ø Walton N. J.Brown D. E. (1999). Chemivals from
plants, Perspectives on secondary products,World Scientific.56-66
Ø Wang S. Y., Bunce J. A.Maas J. L. (2003). "Elevated
carbon dioxide increases contents of antioxidant compounds in field-grown
strawberries." Journal of Agricultural and Food Chemistry 51: 4315-4320.
Ø Wilkens R. T., Spoerke J. M.Stamp N. E. (1996).
"Differential responses of growth and two soluble phenolics of tomato to
resource availability." Ecology 77: 247-258.
Ø Winkel B. S. J. (2004). "Metabolic channeling in
plants." Annual Review of Plant Biology 55:85-107.
Y :
Ø Yefsah - Idres.A (2007) ; Biodisponibilité et
incidence Physico-Chimique chez le Rat .Thèse Magistère.INA .El
Harrach.Alger. 7-14.
Ø YILDIRIM A., MAVI A. et KARA A. A.(2001).
Determination of antioxidant and antimicrobial activities of Rumex crispus
L. extracts; Journal of Agricultural and Food Chemistry 49: 411-420.
Z :
Ø Zhishen J, Mengcheng T, Jianming W (1999). Research
on antioxidant activity of flavonoids from natural materials. Food Chem. 64:
555-559.
Ø Zidani Sofiane.(2009). Valorisation des pelures de
tomate séchées en vue de leur incorporation dans la margarine.
Thèse Doctorat.
Ø Zino .S & Al (1997). Randomised
Controled trial of effect of fruit and vegetable consumption on plasma
concentration of lipids and antioxidant.BMJ. 91:314-1787.
ANNEXES
Protocole
Expérimentale :
Broyage
Séchage « l'étuve 50-60
°C »
Matière Végétale
« Tomates et pelures»
Extraction
Pesée
Analyses Physico-chimiques
Extraction des polyphénols à partir des fruits et
pelures
Dosage de Lycopène
Extraits Phénoliques
Dosage des polyphénols totaux
Dosage des Flavonoides
Dosage des Antocyanes
Evaluation du pouvoir
Anti -oxydant
Annexes 1 :
Les courbes d'étalonnages :
Préparation d'acide Gallique :
2mg d'Acide Gallique + 1ml éthanol
C = (cxv)/m
C : Teneur en (mg d'acide gallique / g de matière
sèche)
c : Concentration d'acide Gallique établie
à partir de la courbe d'étalonnage (mg/ml)
v : Volume de l'extrait méthanolique
m : Poids de la matière sèche(g).
On dilue la solution standardisé d'acide Gallique de
manière à avoir les Concentrations suivante :
2/1/0.5/0.25/0.12/0.06/0.03/0.01 mg/ml
On dilue 0.5ml de chacune de ces solutions dans 5ml d'ED.
Puis on ajoute 0.5ml de Réactif de Folin et on laisse
reposer 3mn.
On ajoute ensuite 0.5ml de la solution saturée de
Na2CO3 à 10%
La couleur bleu commence à apparaître.
Après 1 heure du Temps on mesure la DO des ces solutions avec un
spectrophotomètre UV à 750nm.
|
DO
|
0,158
|
0,33
|
0,452
|
0,622
|
0,85
|
1,0353
|
1,2
|
|
Concentration mg/ml
|
0,0156
|
0,0187
|
0,0312
|
0,0375
|
0,0625
|
0,1
|
0,125
|
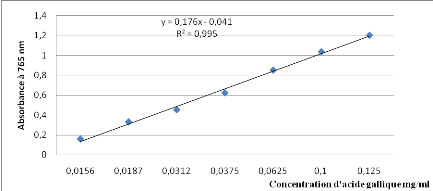
Fig. Courbe d'étalonnage des
polyphénols totaux
Courbe d'étalonnage des
Catéchines
|
Concentration mg/ml
|
4,637
|
9,274
|
13,911
|
18,548
|
23,185
|
27,822
|
32,459
|
37,096
|
|
Absorbance nm
|
0,09
|
0,186
|
0,264
|
0,408
|
0,493
|
0,632
|
0,738
|
0,933
|
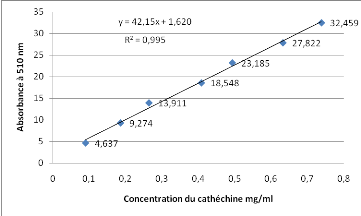
Fig. Courbe d'étalonnage des
Flavonoïdes
Courbe d'étalonnage des sucres
totaux
|
Absorbance nm
|
0
|
0,002
|
0,004
|
0,006
|
0,008
|
0,01
|
|
Concentration mg/ml
|
0
|
0,076
|
0,138
|
0,209
|
0,301
|
0,41
|
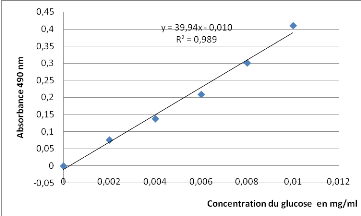
Fig. Courbe d'étalonnage des sucres
totaux
Courbe d'étalonnage du
lycopène
|
Concentrations mg/ml
|
0
|
0,0021
|
0,005
|
0,007
|
0,009
|
|
DO
|
0
|
0,556
|
1,349
|
1,998
|
2,5
|
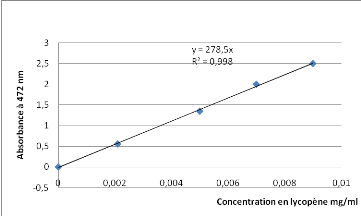
Fig. Courbe d'étalonnage du
lycopène
Courbe du pouvoir réducteur d'acide
ascorbique
|
Concentrations mg/ml
|
0,01562
|
0,03125
|
0,06125
|
0,125
|
0,25
|
0,5
|
|
DO
|
0,409
|
0,865
|
1,456
|
2,113
|
2,575
|
2,889
|
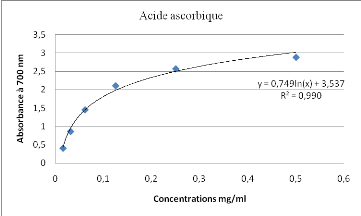
Fig. Pouvoir réducteur d'acide
ascorbique
Préparation des Solutions :
Préparation du Folin Ciocalteu :
Selon Djeridane et al, (2006), la solution du
Folin- Ciocalteu doit être diluée à 1/10.
Donc, on place 1 ml du réactif concentré dans
une fiole et on complète jusqu'à 10 ml avec l'eau
distillée.
Préparation d'une solution de 250ml de
NaOH 0.1 :
1. Calcul de la masse NaOH pour préparer 250 ml de
0.1N
n = (mNaOH / M NaOH) x Z (eq)
/ V (l)
donc :
mNaOH = n x M NaOH x V (l)
/ Z (eq)
2. La masse Molaire :
M = 23+16+1= 40 g/mole
Z = 1
Alors :
m NaOH = 0.1 x 40 x 0.25/1 = 1 g
Préparation d'une solution de 0.1N HCl
de 250 ml
1. On calcul la concentration de la solution commerciale (
solution mère) du HCl :
La masse volumique de la solution mère est
donnée par la relation :
d= umère / ueau
umère = d x ueau = 1.18 x 1000 =
1180g/l
un litre de solution mère a une masse de 1180 g.comme
le pourcentage massique en acide HCl est de 35% , on peut dire que :
1L de solution mère contient m = 1180 x ( 35 x 100) =
413 g d'HCl
2. La masse molaire d'HCl :
M (HCl) = 1+3505 = 36.5 g/mole
1L de solution mère contient n = m/M = 413 /63 = 11.31
mole d'acide
La concentration molaire volumique de la solution mère
est donc :
C mère = n/v = 11.31 /1 = 11.31 mole/l
3. Préparation d'une solution diluée
(fille) :
nfille = n mère /
Cfille x V fille = Cmère x V
mère ? 0.1 x 0.25 =11.31 x V mère
prélevé
donc : V mère prélevé =
0.0022 l = 2.2ml prélevé de la solution mère d'HCl pour
préparer une solution de 0.1N de 250 ml
Préparation d'une solution tampon de
phosphate (0.1 M)
Solution A: 0.1M
Na2HPO4 · 2H2O 35.61
g
ou Na2HPO4 · 7H2O 53.65
g
ou Na2HPO4 · 12H2O 71.64
g
et on ajoute H2O pour 1 L de solution
Solution B: 0.1 M
NaH2PO4 · H2O 27.6 g
ou NaH2PO4 · 2H2O
31.21
et on ajoute H2O pour 1 L de solution
Préparer en mélangeant deux solutions comme est
indiqué dans ce tableau et diluer à 100 ml avec H2O
distillée
|
pH à 25 °C
|
Solution A
|
Solution B
|
|
6.4
|
13.25
|
36.75
|
|
6.6
|
18.75
|
31.25
|
|
6.8
|
24.5
|
25.5
|
|
7.0
|
30.5
|
19.5
|
|
7.2
|
36.0
|
14.0
|
|
7.4
|
40.5
|
9.5
|
|
7.6
|
43.5
|
6.5
|
|
7.8
|
43.75
|
4.25
|
|
8.0
|
47.35
|
2.65
|
Annexe 2 :
Fiches signalétique des produits chimiques
utilisés :
1. ACIDE CHLORIDRIQUE
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
ACIDE CHLORIDRIQUE
|
|
Nom chimique
|
Acide chlorhydrique
|
|
Synonymes
|
Chlorure d'hydrogène, anhydre Acide chlorhydrique.
|
|
Formule moléculaire
|
HCl
|
|
Usage du produit
|
Le désétamage, le décapage et le
détartrage des métaux, le traitement des minerais, la fabrication
d'engrais, la fabrication des colorants, l'industrie des explosifs, la
fabrication de produits pharmaceutiques, la fabrication de produits
photographiques, la fabrication de produits alimentaires, l'industrie des
matières plastiques, l'industrie des colles et des gélatines, la
préparation des chlorures et des sels métalliques, les
réactifs analytiques.
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Liquide fumant
|
|
Aspect
|
Pas de données
|
|
Odeur
|
Âcre, décelable à 1-5 ppm
|
|
Point de fusion
|
- 35 °C , 31,5 % HCl
|
|
Point d'ébullition
|
108,6 °C, 20.2 % HCl
|
|
Densité relative
|
1,18 à 20 °C , 36% HCl
|
|
pH
|
zéro (0); fortement acide
|
|
DONNEE TOXICOLOGIQUE
|
|
CL50 (rat, inhl)
|
3124 ppm / 1 h
|
|
CL50 (souris, inhl)
|
1108 ppm / 1 h
|
|
DL50 (lapin - oral)
|
900 mg/kg
|
|
Effets De L'exposition A Long Terme (Chronique)
|
Une exposition répétée et prolongée
à de faibles concentrations de brouillard ou de vapeurs peut
décolorer et attaquer
l'émail des dents, causer des saignements du nez et des
gencives, et engendrer une bronchite et une gastrite chroniques.
Une exposition répétée à de faibles
concentrations de liquide, de brouillard ou de vapeurs peut causer rougeurs,
enflures et
douleurs (dermatite). L'acide chlorhydrique ne s'accumule pas
dans le corps.
|
2. ACIDE TRICHLOROACETIQUE
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Acide trichloracétique
|
|
Nom chimique
|
Acide trichloracétique
|
|
Synonymes
|
/
|
|
Formule moléculaire
|
CCl3.COOH
|
|
Usage du produit
|
Réactif chimique
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
solide
|
|
Aspect
|
/
|
|
Odeur
|
piquant
|
|
Point de fusion
|
54-56°C
|
|
Point d'ébullition
|
197°C
|
|
Densité relative
|
1.63
|
|
pH
|
<1 (50 g/l, 20°C)
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 (voie orale, rat)
|
3320 mg/kg
|
|
Effets De L'exposition
|
- En cas d'inhalation : irritations des muqueuses, toux et
dyspnée.
- En cas de contact avec la peau : brûlures.
- En cas de contact avec les yeux : brûlures. Danger de
perte de la vue !
- En cas d'ingestion: brûlures dans la bouche, le
pharynx, le tube digestif et le tractus gastro-intestinal.
D'autres propriétés dangereuses ne peuvent
être exclues. Manipuler ce produit avec les précautions d'usage
pour un produit
chimique.
|
3. HYDROXYDE DE SODIUM
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Soude caustique
|
|
Nom chimique
|
Hydroxyde de sodium.
|
|
Synonymes
|
Lessive ; soude à lessive , Soude caustique 10 %, 12
%, 15 %, 16 %, 16.6 %, 18 %, 20 %, 21 %, 25 %, 30 %, 31 %, 33%, 34%. 67 % 40 %,
50 %.
|
|
Formule moléculaire
|
NaOH.
|
|
Usage du produit
|
Nettoyeur. Traitement au métal. Traitement de l'eau.
Stabilisation du pH de l'eau. Agent neutralisant dans l'industrie du
pétrole. Réactif en laboratoire. Industrie des pâtes et
papiers. Produit chimique intermédiaire.
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Liquide.
|
|
Aspect
|
Liquide incolore
|
|
Odeur
|
Inodore
|
|
Point de fusion
|
5 - 12 (50 %)
|
|
Point d'ébullition
|
140 - 144 (50 %)
|
|
Densité relative
|
1.11 (10 %); 1.22 (20 %); 1.33 (30 %); 1.43 (40 %); 1.53 (50%)
|
|
pH
|
14.0 (5 % solution).
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 (cutané, lapin)
|
1 350 mg/kg
|
|
EFFETS DE L'EXPOSITION
|
De nombreuses publications en littérature scientifique
confirment les propriétés sévèrement irritantes de
l'exposition aiguë et à court terme à l'hydroxyde de sodium
chez les animaux et les humains et traite des effets toxiques (comme la mort,
les blessures aux yeux ou les changements au niveau de la morphologie des
poumons). Ces effets sont probablement liés aux
propriétés corrosives du présent composé.
|
4. ETHANOL
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Éthanol dénaturé
|
|
Nom chimique
|
Alcool éthylique dénaturé
|
|
Synonymes
|
Alcool dénaturé anhydre, Alcool
dénaturé 95 %, Éthanol anhydre
|
|
Formule moléculaire
|
C2
H6
O
|
|
Usage du produit
|
L'alcool éthylique est employé souvent comme
substance de remplacement de divers solvants dont : l'éthylène
glycol, le chloroforme, l'acétone,
l'acétaldéhyde, l'heptane, le toluène et l'isopropanol. Il
peut lui-même être
remplacé par des mélanges à base d'eau
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Liquide
|
|
Aspect
|
Liquide incolore
|
|
Odeur
|
caractéristique d'alcool et ester
|
|
Point de fusion
|
/
|
|
Point d'ébullition °C
|
75.6
|
|
Densité relative
|
0.8105
|
|
pH
|
Sans objet.
|
|
DONNEE TOXICOLOGIQUE
|
|
EFFETS DE L'EXPOSITION
|
Peut être fatal par ingestion, inhalation ou absorption par
la peau. Irritant sévère. Peut
causer une dépression du système nerveux.
Organes-cibles: yeux, peau, reins, foie,
coeur, système nerveux central, sang, gastro intestinale,
système respiratoire,
poumons, système reproducteur. 2000 ppm (ACÉTATE
D(c)ÉTHYLE) est hautement
dangereux pour la vie ou la santé.
Oculaire : Cause une irritation sévère. Les
vapeurs irritent les yeux. Le dommage cause par le
contact avec le liquide est réversible et des soins
médicaux appropriés assureront une
guérison au bout de quelques jours. Le dommage
causé se présente habituellement
sous forme d'une conjonctivite bénigne, qui se manifeste
surtout par une rougeur au
niveau de la conjonctive.
|
5. BICARBONATE DE SODIUM
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Bicarbonate de sodium
|
|
Nom chimique
|
Sodium bicarbonate
|
|
Synonymes
|
Bicarbonate de soude,hydrogénocarbonate de sodium, "baking
soda" chez les anglo-saxons
|
|
Formule moléculaire
|
NaHCO3
|
|
Usage du produit
|
· Produits de bain effervescents : bombes de bain, galets de
bain
· Dentifrices
· Bains de bouche
· Déodorants
· Comme ajusteur de pH, pour corriger un pH trop acide
(crèmes, gels lavants...)
· Additif alimentaire E 500
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Poudre blanche
|
|
Aspect
|
Cristalline
|
|
Odeur
|
Sans odeur
|
|
Point de fusion °C
|
50
|
|
Point d'ébullition °C
|
851
|
|
Densité relative
|
2,20
|
|
pH
|
8.0-8.6
|
|
DONNEE TOXICOLOGIQUE
|
|
EFFETS DE L'EXPOSITION
|
Non toxique
|
6. METHANOL
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Méthanol
|
|
Nom chimique
|
Méthanol
|
|
Synonymes
|
alcool méthylique, carbinol, alcool de
bois, naphte de bois ou esprit de bois
|
|
Formule moléculaire
|
C
H3
OH
|
|
Usage du produit
|
solvant dans les vernis-lacque, peintures, ciments, encres,
antigel, colorants, plastiques et diverses peintures industrielles. C'est aussi
un carburant pour les fusées.
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Liquide
|
|
Aspect
|
Liquide incolore
|
|
Odeur
|
Caractéristique
|
|
Point de fusion °C
|
-97,8
|
|
Point d'ébullition °C
|
64.7
|
|
Densité relative
|
0.79-0.8
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50/orale/rat
|
1187- 2769 mg/kg
|
|
DL50/cutanée/lapin
|
17000 mg/kg
|
|
CL50/inhalatoire/4h/rat
|
128,2 mg/l/4h
|
|
Effets toxicologiques
|
Toxicité aiguë : Toxique par inhalation. Toxique par
contact cutané. Toxique en cas d'ingestion.
|
7. PHÉNOLPHTALÉINE
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Phénolphtaléine
|
|
Nom chimique
|
Phénolphtaléine
|
|
Synonymes
|
3,3-bis(4-hydroxyphényl)-1-(3H) monobenzofuranone
(le symbole öö (phi-phi)
|
|
Formule moléculaire
|
C20H14O4
|
|
Usage du produit
|
pH indicateur
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Solide
|
|
Aspect
|
Poudre jaune
|
|
Odeur
|
Inodore
|
|
Point de fusion °C
|
258 à 263
|
|
Point de congélation °C
|
261
|
|
Densité relative
|
1.3
|
|
pH
|
8.2-10
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 (orale, rats)
|
>1000 mg/kg
|
|
EFFETS DE L'EXPOSITION
|
Inhalation L'inhalation des
poussières peut provoquer
l'irritation légère des voies respiratoires, en
causant l'étouffement, le souffle court. L'exposition
sévère toxique.
Contact avec la peau Aucune renseignement
disponible.
Peut causer l'irritation légère, le
rougissement, la
démangeaison, la douleur.
Contact avec les yeux Aucune renseignement
disponible.
Peut causer l'irritation légère, temporaire, le
rougissement,
la démangeaison, la douleur, .les larmes. La
sévérité
compte sur la concentration et la durée de
l'exposition.
Ingestion Peut causer l'irritation, avec les
nausées, vomil, la diarrhée. Les doses grandes peut être
toxique.
Effets de l'exposition constante au
produit
Peut causer, en le cas rare, une grave réaction
allergique.
Dans ce cas-là, la réaction cause l'enflement,
le
rougissement et la démaneaison du peau, et on a
rendu
compte de la mort à cause de la réaction
allergique. n'est pas applicable a l'exposition industrielle.
L'exposition prolongée ou répétée
peut causer les
dommages aux reins, aux uretères, à la vessie.
|
8. FOLIN-CIOCALTEU
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Réactif de Folin-Ciocalteu de phénol
|
|
Nom chimique
|
Réactif de Folin-Ciocalteu de phénol
|
|
Formule moléculaire
|
HCl +H3PO4+Na2WO4.2H2O
|
|
Usage du produit
|
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Liquide
|
|
Aspect
|
Liquide jaune
|
|
Odeur
|
Légèrement piquant
|
|
Densité relative
|
1.234
|
|
pH
|
< 0.5
|
|
DONNEE TOXICOLOGIQUE
|
|
Estimation de toxicité aigue
|
> 2.000mg/kg
|
|
EFFETS DE L'EXPOSITION
|
Irritation des muqueuse de la bouche, de la gorge, de
l'oesophage, et de tube digestif
|
9. ACIDE GALLIQUE
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Acide Gallique
|
|
Nom chimique
|
Acide 3,4,5-trihydroxybenzoïque
|
|
Formule moléculaire
|
C7H6O5
|
|
Usage du produit
|
Pour des fins de recherche en laboratoire
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
poudre
|
|
Aspect
|
Cristalline blanche
|
|
Odeur
|
inodore
|
|
Point de fusion °C
|
251
|
|
Point d'ébullition °C
|
220
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 Oral(e) - lapin
|
5,000 mg/kg
|
|
Effet de toxicité
|
Peut être nocif par inhalation. Provoque une irritation du
système respiratoire.
Peut être nocif par ingestion.
Peut être nocif en cas d'absorption par la peau. Provoque
une irritation de la peau.Provoque une irritation des yeux.
|
10. CHLORRURE D'ALUMINIUM
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Chlorure d'aluminium
|
|
Nom chimique
|
Chlorure d'aluminium
|
|
Synonymes
|
Trichlorure d'aluminium, Chlorure d'aluminium (III)
|
|
Formule moléculaire
|
AlCl3
|
|
Usage du produit
|
· Pour usages de laboratoire, analyse, recherche et chimie
fine.
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Poudre
|
|
Aspect
|
Solide jaune
|
|
Odeur
|
Piquant
|
|
Point de fusion °C
|
190
|
|
Point d'ébullition °C
|
178
|
|
Densité relative
|
2.44
|
|
pH
|
2.4
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 oral rat
|
3730 mg/kg
|
|
DL50 oral souris
|
1130 mg/kg
|
|
Effet toxicologique
|
Par contact oculaire: brûlures.
Par inhalation de la poussière: toux, difficultés
respiratoires. Irritatives voies respiratoires.
Par ingestion: nausées, vomissements. Irritation des
muqueuses de bouche, gorge, oesophage et tractus intestinal.
D'autres caractéristiques dangereuses ne sont pas à
écarter. Observe les précautions habituelles lors de la
manipulation de produits
chimiques.
|
11. NITRITE DE SODIUM
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Nitrite de sodium
|
|
Nom chimique
|
Acide nitreux, sel de sodium.
|
|
Synonymes
|
Nitrite de sodium FCC ; Nitrite de sodium de qualité non
agglomérant ; Nitrite de sodium HQ de qualité
non agglomérant ; Nitrite de sodium QAM (qualité
antimottant).
|
|
Formule moléculaire
|
NaNO2.
|
|
Usage du produit
|
Agent de polymérisation. Agent de conservation et fixatif
de couleur utilisés dans les viandes fumées et
salées. Photographie. Agent oxydant. Réactif en
laboratoire. Sel caloporteur. Antidote contre l'empoisonnement au cyanure.
Produit chimique intermédiaire
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Solide.
|
|
Aspect
|
Cristaux blancs ou jaunâtres.
|
|
Odeur
|
Légère odeur.
|
|
Point de fusion °C
|
271
|
|
Point d'ébullition °C
|
320 - 490
|
|
Densité relative
|
2.17
|
|
pH
|
7.0 (10g/L). 8.0 - 9.0 (100g/L; 20°C)
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 ( orale, rat)
|
80 - 180 mg/kg
|
|
CL50 (inhalation, rat,4h)
|
1.45 - 5.5 mg/m
|
|
Données toxicologiques
|
Nitrite de sodium peut entraîner des effets
mutagènes selon des études effectuées chez des animaux en
laboratoire.
|
12. ACIDE ASCORBIQUE
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Acide ascorbique
|
|
Nom chimique
|
3-oxo-L-Gulofuranolactone.
|
|
Synonymes
|
Vitamine C ; Acide L-ascorbique ; Acide ascorbique
U.S.P.-F.C.C. ; Acide ascorbique enduit de type
EC ; Acide ascorbique C-90.
|
|
Formule moléculaire
|
C6H8O6
|
|
Usage du produit
|
· Vitamine. Élément nutritif essentiel.
Additif pour les aliments.
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Solide.
|
|
Aspect
|
Poudre ou cristaux blancs ou blanc cassé.
|
|
Odeur
|
Inodore
|
|
Point de fusion °C
|
190
|
|
Densité relative
|
1.65
|
|
pH
|
3 (5mg/mL).2 (50mg/ml)
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 (orale, rat)
|
11 900 mg/kg
|
|
Données toxicologiwues
|
L'ingestion chronique de 50 à 80 g/jour peut causer une
gastroentérite et une
irritation anale après 10 jours de consommation.
L'ingestion chronique de 1 g/jour peut causer de la
diarrhée. Chez les individus sensibles, une
quantité de 4 à 12 g/jour peut amener la formation d'urate et
de calculs cystiniques dans la vessie.
|
13. CHLORURE FERRIQUE
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Chlorure ferrique en solution, 30 à 60 %.
|
|
Nom chimique
|
Chlorure de fer (III) Solution aqueuse.
|
|
Synonymes
|
Chlorure ferrique 37 %, 38 %, 39 %, 41 %, 43 %; Chlorure
ferrique 33 - 37 % Traitement de l'eau .
|
|
Formule moléculaire
|
FeCl3
|
|
Usage du produit
|
Traitement de l'eau. Coagulant pour les eaux industrielles et le
traitement des eaux usées. Désinfectant. Additif alimentaire.
Colorant à mordant. Produit chimique intermédiaire.
|
|
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Liquide.
|
|
Aspect
|
Solution rouge-brun.
|
|
Odeur
|
Légère odeur d'acide.
|
|
Point de fusion °C
|
-50
|
|
Point d'ébullition °C
|
105 - 111
|
|
Densité relative
|
1.2 - 1.5
|
|
pH
|
< 2
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 (orale, rat)
|
316 - 1 600 mg/kg
|
|
Données toxicologiques
|
peut entraîner une sensibilisation de la peau ou d'autres
réactions allergiques. La sensibilisation est un processus par lequel un
changement biologique se produit chez un sujet en raison d'une exposition
antérieure à une substance et qui fait en sorte que ce sujet
réagit plus fortement en cas de nouvelle exposition à cette
substance.
|
14. FERRICYANURE DE POTASSIUM
|
IDENTIFICATION DU PRODUIT
|
|
Nom chimique
|
Hexacyanoferrate (III) de potassium
|
|
Synonymes
|
Red prussiate, Potassium hexacyanoferrate (III).
|
|
Formule moléculaire
|
K3Fe(CN)6
|
|
Usage du produit
|
· Pour usage de laboratoire seulement
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Poudre
|
|
Aspect
|
Poudre cristalline rouge
|
|
Odeur
|
Inodore.
|
|
Densité relative
|
1.89
|
|
DONNEE TOXICOLOGIQUE
|
|
EFFETS DE L'EXPOSITION
|
Peut être dangereux par ingestion, inhalation ou absorption
par la peau.
Le contact excessif avec les yeux peut causer une irritation.
Le contact excessif avec la peau peut causer une irritation.
Peut causer une inflammation de l'appareil respiratoire. Peut
causer une pneumonite sévère.
Peut causer des troubles gastro intestinaux. Peut causer des
nausées, des vomissements, des douleurs abdominales et une intoxication
par le fer. La décoloration de l'urine qui devient rose est une
indication convaincante
d'empoisonnement par le fer. Peut former de cyanure
d'hydrogène (toxique) au contact des acides gastriques.
|
15. CYCLOHEXANE
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Cyclohexane
|
|
Nom chimique
|
Cyclohexane
|
|
Synonymes
|
Hexahydrure de benzène.
|
|
Formule moléculaire
|
C6H12
|
|
Usage du produit
|
· Solvant industriel, nettoyeur et dégraisseur.
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Liquide.
|
|
Aspect
|
Liquide incolore
|
|
Odeur
|
Odeur d'hydrocarbure.
|
|
Point de fusion °C
|
6.5
|
|
Point d'ébullition °C
|
81
|
|
Densité relative
|
0.78
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 (orale,rat)
|
> 5 000 mg/kg
|
|
DL50 (cutané,lapin)
|
> 2 000 mg/kg
|
|
CL50 (inhalation , rat,4h)
|
> 32 880 mg/m
|
16. BISULFITE DE SODIUM
|
IDENTIFICATION DU PRODUIT
|
|
Nom du produit
|
Bisulfite de sodium,solution 15-40%
|
|
Nom chimique
|
Acide sulfurous, sel de monosodium, Solution aqueuse.
|
|
Synonymes
|
Bisulfite de sodium 19 %, 20 %, 38 % ; Solution aqueuse de
bisulfite de sodium (8511) ; Solution aqueuse de sulfite monosodique ;
Solution aqueuse de sulfite de sodium et d'hydrogène ; Solution aqueuse
de pyrosulfite de sodium.
|
|
Formule moléculaire
|
NaHSO3.H2O
|
|
Usage du produit
|
Agent réducteur. Produit pharmaceutique. Antioxydant.
Désinfectant. Source de SO2. Acide industriel. Additif. Galvanoplastie.
Produit chimique intermédiaire.
|
|
PROPRIETES PHYSIQUES ET CHIMIQUES
|
|
Etat physique
|
Liquide
|
|
Aspect
|
Liquide allant du jaune à l'incolore
|
|
Odeur
|
Odeur âcre d'anhydride sulfureux.
|
|
Point de fusion °C
|
6
|
|
Point d'ébullition °C
|
104
|
|
Densité relative
|
1.18 - 1.37
|
|
pH
|
3 - 5
|
|
DONNEE TOXICOLOGIQUE
|
|
DL50 (orale, rat)
|
2000 mg/kg
|
|
Données toxicologiques
|
Bisulfite de sodium une sensibilisation respiratoire ou d'autres
réactions allergiques. Certaines personnes sont extrêmement
sensibles à l'ingestion de quantités infimes de sulfite. Les
symptômes peuvent comprendre la broncho constriction, l'état de
choc, des malaises gastro-intestinaux, un oedème
angioneurotique, des rougeurs à la peau et une sensation
de picotement.
|
3. Valeur Nutritionnelle de 100 g de poudre
de tomate
4. Composition biochimique des pelures de tomates
séchées
Teneur en lycopène dans les dérivées
de tomate
|
Aliments
|
Portion
|
Teneur en lycopène (mg)
|
|
Pâte de tomates en conserve
|
½ tasse (125 ml/140 g)
|
39,8
|
|
Purée de tomates en conserve
|
½ tasse (125 ml/130 g)
|
28,7
|
|
Sauce tomate en conserve
|
½ tasse (125 ml/130 g)
|
18,1
|
|
Soupe aux tomates en conserve,
condensée
|
½ tasse (125 ml/133 g)
|
14,5
|
|
Tomates séchées au soleil
|
½ tasse (125 ml/30 g)
|
13,1
|
|
Jus de tomate
|
½ tasse (125 ml/128 g)
|
11,6
|
|
Tomates en conserve
|
½ tasse (125 ml/127 g)
|
3,5
|
|
Tomate crue
|
1 (123 g)
|
3,2
|
|
Ketchup
|
1 c. à table (15 ml/15 g)
|
2,5
|
Source : Santé
Canada. Fichier canadien sur les éléments nutritifs, 2011

| 


