Introduction
Les lipases ou triacylglycérol hydrolases
(E.C.3.1.1.3), largement répandues chez tous les êtres vivants
(Taipa et al., 1992), ont l'avantage d'être disponibles en
grande quantité et à faible coût, d'être
sélectives vis-à-vis de leurs substrats et de ne pas
nécessiter de cofacteurs. Ces enzymes présentent de ce fait une
grande importance en biotechnologie. Elles sont de plus en plus
utilisées dans les domaines médical, thérapeutique,
chimique et alimentaire (Ghandi, 1997). L'étude de ces enzymes a
contribué à l'élaboration d'une enzymologie interfaciale,
la catalyse se produit en milieu hétérogène à
l'interface huile-eau (Verger et al., 1973 ; Ransac et
al., 1990). Il en résulte que les propriétés
biochimiques de ces enzymes dépendent autant de la
« qualité » de cette interface que de certains
paramètres classiques tels que le pH ou la force ionique.
Chez les animaux supérieurs, plusieurs lipases sont
produites à différents niveaux du tube digestif. Ces lipases
jouent un rôle fondamental dans le métabolisme lipidique en
permettant l'absorption des lipides alimentaires.
La plupart des recherches actuelles, réalisées
sur la famille génétique des lipases sont focalisées sur
les animaux supérieurs. On ignore jusqu'à ce jour le mode
d'action du système lipolytique des animaux primitifs marins. Pour
cette raison nous nous sommes intéressés, dans ce présent
travail, à la purification et à la caractérisation
biochimique de la lipase de crabe vert impliquée dans la digestion des
lipides alimentaires.
La caractérisation biochimique de la lipase digestive
de crabe, nous permettra de la comparer avec les lipases connues des animaux
supérieurs et de l'exploiter si elle présentera des
caractéristiques nouvelles recherchées.
I- Les enzymes
lipolytiques
1- Introduction
Les enzymes lipolytiques forment une classe d'enzymes
parfaitement solubles dans l'eau. Elles sont responsables de l'hydrolyse des
lipides. Elles agissent sur des substrats lipidiques insolubles dans l'eau mais
qui s'organisent spontanément au contact de l'eau pour former des
émulsions, des micelles, des liposomes ou des films monomoleculaires.
Les lipases ou triacylglycerols acylhydrolases (EC.3.1.1.3)
forment une famille hétérogène d'enzymes qui
catalysent, en milieu hétérogène, la réaction
d'hydrolyse des liaisons esters de triacylglycerols.
Les lipases sont des estérases capables d'hydrolyser
des substrats insolubles tels que les glycérides à longues
chaînes (Verger, 1985).
Leur polarité vient du fait de leur comportement
cinétique (Sarda et Desnuelle, 1958) car l'hydrolyse des lipides
insolubles dans l'eau est beaucoup plus rapide lorsqu'elles sont sous formes de
micelles, d'où le phénomène d'activation interfaciale qui
les différencie des estérases.
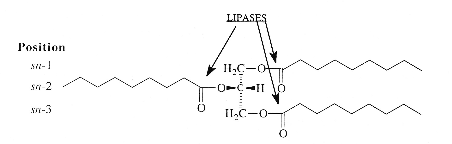

Figure 1 : liaisons esters carboxyliques des
triacylglycérols hydrolysables par les lipases
2- Cinétique
enzymatique de la lipolyse
Contrairement à la plupart des enzymes qui agissent en
phase aqueuse, les lipases agissent en milieu hétérogène,
à l'interface lipide/eau, où elles s'y adsorbent. Il en
résulte que les propriétés biochimiques de ces enzymes
dépendent autant de la "qualité" de cette interface que des
paramètres plus classiques tels que le pH ou la force ionique.
Les activités catalytiques des lipases sont
étroitement dépendantes de la pression de surface en
présence d'agents tensioactifs tels que les sels biliaires et certaines
protéines alimentaires. Cette modulation peut s'exercer soit sur
l'étape d'adsorption de l'enzyme à l'interface soit sur
l'étape de catalyse interfaciale (figure 2).
L'enzymologie conventionnelle, basée sur le
modèle de Michaelis et Menten, ne peut pas être directement
appliquée dans le cas des réactions qui se déroulent en
milieu hétérogène. C'est pourquoi, après avoir
examiné le mode d'action de plusieurs lipases, une enzymologie
interfaciale a été développée par Verger et de
Haas (Verger & de Haas, 1973).
E* E*S P
E*
Kd Kp
E
Emulsion d'huile
Interface huile/eau


Figure 2 : Modèle cinétique
interfaciale. La réaction enzymatique est décomposée en
deux étapes (Verger & de Haas, 1973) :
1- La première est l'adsorption de l'enzyme (E)
à l'interface huile-eau (E*). Cette réaction partielle est
régie par deux constantes de vitesse Kp et Kd, représentant
respectivement la pénétration de l'enzyme à l'interface et
la désorption de l'enzyme.
2- La deuxième résulte de la formation d'un
complexe enzyme-substrat (E*S), ayant la dimension d'une concentration
surfacique (mole/m2). Le modèle de Michaelis-Menten est alors
établi dans un plan.
Le critère de l'activation interfaciale n'est pas
relié obligatoirement à la présence du volet. Il n'est ni
nécessaire ni suffisant pour définir une estérase comme
une lipase (Ferrato et al., 1997). Actuellement, il est admis que le
critère expérimental le plus sûr pour discriminer une
lipase d'une estérase est la capacité d'hydrolyser les
triacylglycérols à chaînes longues.
Sayari et al., (2001) ont montré que la lipase
de Staphylococcus aureus NCTC 8530 (SAL1) est une vraie lipase
malgré qu'elle n'hydrolyse pas une émulsion d'huile d'olive. En
effet cet enzyme possède un pouvoir de pénétration lui
permettant de s'adsorber et de dégrader la dicaprine
déposée sous forme de couches monomoleculaires à 35
mN.m-1. Les mêmes auteurs ont conclu que les films
monomoléculaires peuvent être utilisés comme critère
pour différencier les lipases qui sont incapables d'hydrolyser les
triacylglycérols à chaînes longues, des
estérases.
II- Les lipases du monde
marin
Plusieurs projets de recherche ont focalisé leurs
objectifs sur l'étude de la physiologie de la lipolyse de certains
animaux marins. En effet, chez les espèces de poissons
téléostéens, des études ont montré que les
lipases dépendantes de sels biliaires jouent un rôle important
dans la digestion des lipides (Gjellesvik et al., 1992). La lipase
isolée à partir du caecum pylorique de la morue atlantique
nécessite la présence de sels biliaires pour hydrolyser les
triacylglycérols insolubles. Cet enzyme, 1,3 spécifique, agit
à un pH optimal de 8,25 et une température optimale de 25°C.
Patton et Nevenzel (1974) ont décrit la présence de deux lipases
pancréatiques différentes et actives chez le petit requin, une
lipase non spécifique activée par les sels biliaires et une autre
montrant une spécificité pour les esters primaires (positions 1
et 3). Des résultats similaires ont été obtenus par
Tocher et Sargent (1984) sur une autre espèce : la
Salmogairdnerii.
Chez l'espèce Cyprinron macrostomus, une lipase a
été isolée à partir des intestins qui agit entre
pH 6,5 et 9. Sa masse moléculaire est de l'ordre de 50 kDa et son
activité spécifique est de 254 U/mg (Dejerli et Akpinar,
2002).
Tableau 1 : Localisation tissulaire de
l'activité lipasique chez certains animaux marins.
|
Espèce animale
|
Description
|
Tissu contenant l'activité lipasique
|
Présence de colipase
|
Présence de sels biliaires
|
Références
|
|
Morue
(Gadus morhua)
|
Poisson osseux
|
Pancréas discret
|
+
|
nd
|
Brokerhoff
1970
|
|
Raie
(Raja radita)
|
Poisson cartilagineux
|
Pancréas discret
|
+
|
+
|
Brockerhoff 1970
|
|
Ecrevisse
(Cherax uadricarnitus)
|
Arthropode
(crustacé)
|
Hépatopancréas
|
_
|
_
|
Brokeroff
1970
|
|
Homard
(Homorus americanus)
|
Arthropode
(crustacé)
|
Hépatopancréas
|
nd
|
nd
|
Brokerhoff
1970
|
|
Lombric
(Lumbrcus terrestus)
|
Annélide
|
Non spécifié
|
nd
|
nd
|
Brokerhoff
1970
|
III- Les Crabes
1- Position systématique
Selon la classification des crustacés donnée par
Beaumont et Cassier (1973), les crabes se placent dans la position taxonomique
suivante :
Ils font partie de l'embranchement des Arthropodes puisqu'ils
possèdent des appendices articulés et un système nerveux
ventral. Ils appartiennent à la classe des crustacés vue qu'ils
ont une cuticule incrustée de sels et de minéraux et leurs
organes extérieurs ont une disposition segmentaire. Les crabes
intègrent la sous-classe des eucaridea, l'ordre des décapodes et
l'infra-ordre de brachyoures.
2- Morphologie des
crabes
Les crabes sont caractérisés par leur
céphalothorax qui constitue la plus grandes partie du corps, et qui, au
dessous duquel se trouve replié l'abdomen réduit. Le
céphalothorax porte vers l'avant une paire de pédoncules
oculaires, une paire d'antennules, une paire d'antennes, ventralement six
paires de pièces buccales et latéralement cinq paires de
péréiopodes (Bauchau, 1966). L'abdomen porte cinq paires de
pléopodes réduits.
3- Système digestif
L'appareil digestif des arthropodes est
généralement constitué d'un intestin antérieur, un
intestin moyen et un intestin postérieur. L'intestin antérieur,
comprend la bouche, l'oesophage et l'estomac. L'intestin moyen du crabe est
sous forme d'un grand tube présentant des dérivations qui
constituent le caecum digestif. L'intestin postérieur est formé
par l'intestin tubulaire, le rectum et l'anus.
Le caecum digestif de couleur noirâtre ou
jaunâtre selon l'alimentation, constitue l'hépatopancréas.
Ce dernier occupe la partie antérieure de la carapace, sur les chambres
branchiales et entoure le coeur et les gonades. A l'entrée de la bouche,
les mandibules coupent l'aliment en petites pièces qui passeront ensuite
au niveau de l'estomac où se déroule l'hydrolyse par le biais des
enzymes secrétés par l'hépatopancréas à
travers un canal.
L'absorption des produits d'hydrolyse et le stockage des
nutriments se déroulent au niveau de l'intestin moyen.
Hépatopancréas
Gonades
Chambres branchiales
Anus


Figure 3: Hépatopancréas de
crabe en noir
I- Matériel
1- Réactifs
Le deoxycholate de sodium (NaDC), le taurodeoxycholate de
sodium (NaTDC), le persulfate d'ammonium, le
N,N,N',N'-tétramétyl-éthylène diamine (TEMED), le
tris (hydroxyméthyl aminométhane (Tris-HCl), l'acide
éthylène diamine tétra-acétique (EDTA) et le
sérum albumine bovine (BSA) sont de Sigma Chemical Company (St. Louis,
USA). La tributyrine (TC4) (pureté 99 %) et la benzamidine
sont de Fluka (Bucks, Suisse). Le sodium dodécyl sulfate (SDS),
l'acrylamide et la bisacrylamide sont de Bio-Rad (Paris, France). La gomme
arabique (GA) est de Mayaud Backer LTD (Royaume Unis). L'acétate de
vinyle est de Aldrich (Steinheim , Allemagne).
2- Animaux
Les Crabes vert (Carcinus mediterranus) sont ramassés
vivants à la cote de Sidi Mansour (Sfax) et les
hépatopancréas sont collectés immédiatement puis
stockés à -20°C.
3- Protéines
Le sérum albumine bovine est de Sigma ; la lipase
pancréatique de dinde est gracieusement fournie par Ahmed FENDRI
(LBGEL) ; la lipase digestive de scorpion et les anticorps anti-SDL et
anti-TPL de lapin sont gracieusement fournis par Nacim ZOUARI (LBGEL) ; la colipase de dromadaire est gracieusement fournie
par Abir BEN BACHA (LBGEL).
4- Supports
chromatographiques
Le séphacryl S-200, la Mono-Q Sépharose et la
DEAE-cellulose sont de Pharmacia Chemicals (Uppsala, Suède). Les gels
sont utilisés selon les instructions du fournisseur.
5- Appareillage
Le pH-Stat est de Metrohm (Suisse). Le
spectrophotomètre à longueur d'ondes variable est de Cecil CE
1020 (Royaume Unis). L'appareil d'électrophorèse est de Bio-Rad
(France). Le bain-marie est d'Aplex (France). Le collecteur de fraction et la
pompe péristaltique sont de Pharmacia LKB (Suède). La
centrifugeuse AllegraTM 21R est de Beckman (USA). La cellule
d'ultrafiltration est d'Amicon (Suède).
II- Méthodes
1- Dosage de l'activité
lipolytique
L'activité lipolytique est mesurée à pH 8
par titration des acides gras libérés avec du NaOH 100 mM
à l'aide d'un pH-Stat (Gargouri et al., 1986). Le substrat
utilisé est une
émulsion d'huile d'olive à 10 % (10 ml d'huile
d'olive dans 90 ml de gomme arabique à 10 %), le test contient 10 ml
d'émulsion, 20 ml d'eau distillé. Dans le cas du test avec la
tributyrine (TC4), le milieu de dosage standard contient 250 ul de
TC4 dans 30 ml tampon Tris-HCl 2 mM, pH 8. L'activité
enzymatique est exprimée en unité internationale (UI). Une
unité d'activité lipolytique correspond à la
libération d'une umole d'acide gras par minute.
2- Dosage de l'activité phospholipasique
L'activité phospholipasique est mesurée à
l'aide d'un pH-stat, à pH 8 et à 60°C par titration des
acides gras libérés avec NaOH 100 mM, suite à l'hydrolyse
du substrat . Le substrat utilisé est une émulsion de
phosphatidylcholine. Le test contient 10 ml d'émulsion et 20 ml tampon
Tris-HCl 2 mM, DOC 6 mM et CaCl2 7 mM. L'activité phospholipasique est
exprimée en unité enzymatique qui correspond à la
libération d'une micromole d'acides gras par minute.
3- Détermination de
la concentration en protéines
La concentration de protéines est
déterminée selon la méthode spectrophotométrique
décrite par Bradford (1976) en utilisant le sérum albumine bovine
comme standard, dont le coefficient d'extinction molaire
E1%1cm est de 6,7.
4- Effet de la
température sur l'activité lipasique
L'influence de la température sur l'activité de
l'enzyme a été étudiée en mesurant
l'activité à pH 8 et à différentes
températures en utilisant la tributyrine comme substrat.
5- Effet du pH sur
l'activité lipasique
L'activité lipasique est mesurée sur une
émulsion de tributyrine à température optimale et à
différents pH.
6- Stabilité de la
lipase de crabe en fonction de la température
La stabilité de l'enzyme en fonction de la
température a été étudiée en incubant
l'enzyme à différentes températures pendant 10 min.
Après centrifugation l'activité lipasique est mesurée dans
le surnageant dans les conditions optimales.
7- Stabilité de la
lipase de crabe en fonction du pH
L'enzyme a été incubé à
différents pH variant de 3 à 10 en utilisant différents
tampons. Après 10 min d'incubation, l'échantillon est
centrifugé pendant 5 min à 10 000 rpm et
l'activité lipasique est mesurée dans les conditions optimales
dans le surnageant.
8- Effet des ions calcium
Les mesures de l'activité lipolytique sont
effectuées sur une émulsion d'huile d'olive et sur la tributyrine
en présence de concentrations croissantes en CaCl2 dans les
conditions optimales de pH et de température. En absence de calcium,
l'activité lipolytique est mesurée en présence de 10 mM
EDTA.
9- Effet du
détergent naturel sur l'activité lipasique
L'effet du NaDC sur l'activité lipasique a
été réalisé en mesurant l'activité de
l'enzyme sur la tributyrine ou l'huile d'olive comme substrat. Le test est
effectué dans les conditions optimales de température et de
pH.
10- Dosage des sels
biliaires dans l'hépatopancréas de crabe
C'est une méthode de dosage enzymatique qui se base sur
l'utilisation de 3á hydroxy stéroide
déshydrogénase (Sigma).
a) Préparation
de la solution (Enzyme/NAD+) au moment de l'expérience
Pour préparer une solution (Enzyme/NAD+)
avec une concentration diluée au 1/100 par rapport au stock soit 0.05
U/ml, on mélange 2 ml H20 contenant 2 mg NAD+
avec 2 ml tampon (30 mM Tris-HCl, 1 mM EDTA , pH 9,4) contenant 0,2 U de
la déshydrogénase.
b) Dosage des
échantillons
On mélange 400 ul de
l'échantillon d'hépatopancréas dilué au 1/100 avec
600 ul de la solution d'enzyme préalablement préparée.
Après incubation de l'échantillon pendant 1 h à 37°C,
on mesure l'absorbance à 340 nm contre un blanc contenant 400 ul
d'échantillon et 600ul H20.
Une gamme étalon est préalablement
préparée dans les mêmes conditions avec des concentrations
de taurodéoxycholate de sodium variant de 0,005 à 0,5 mM.
11-Analyse des
protéines par électrophorèse et
immunorévélation
La pureté des protéines est suivie par
électrophorèse sur gel de polyacrylamide à 12 %, en
présence de dodécylsulfate de sodium (SDS) (Laemmli, 1970).
Pour l'immunorévélation, les protéines
sont électrotransférées sur une membrane de
nitrocellulose à partir du gel de polyacrylamide, pendant 1heure sous
une tension de 220V, dans un tampon 20 mM Tris-HCl, 150 mM glycine et 20 % de
méthanol. La qualité de transfert est vérifiée par
coloration transitoire des protéines au rouge ponceau (0,2% dans l'acide
trichloracétique 3 %). Pour empêcher toute fixation non
spécifique des anticorps, la membrane est préalablement
saturée par incubation pendant 1heure dans une solution contenant 3 %
de poudre de lait lyophilisé (Régilait, Nestlé) dans le
tampon PBS-Tween 20 (8 g/l NaCl ; 0,1 g/l KH2PO4. ; 2,9 g/l
Na2HPO4,2H2O ; 0,05 % Tween 20), à
température ambiante. Après plusieurs lavages avec le tampon
PBS-Tween 20, la membrane est incubée pendant 1heure à
température ambiante avec l'anticorps anti-SDL ou anti-TPL (2ug/ml).
L'excès d'anticorps est ensuite éliminé par trois
lavages de 10 min avec le tampon PBS-Tween 20. Après le dernier
lavage, la membrane est incubée pendant 1heure avec un deuxième
anticorps anti-IgG couplé à la phosphatase alcaline (Sigma) et
dilué au 1/2000 dans le tampon PBS-Tween 20. Ce deuxième
anticorps est spécifique des IgG de lapin. La membrane est ensuite
lavée trois fois avec le tampon PBS-Tween 20 et deux fois avec un tampon
0,1M Tris-HCl, 0,1M NaCl, 1mM MgCl2, 5mM
5-bromo-4-chloro-3-indolylphosphate alcalin avec son substrat qui
génère un précipité violet sur la membrane au
niveau des bandes reconnues. La réaction est arrêtée par
plusieurs lavages avec de l'eau distillée.
I- Niveau des enzymes
lipolytiques et de la colipase dans l'hépatopancréas de crabe
vert
1- Mise au point des
activités lipasique et phospholipasique dans l'homogénat
Le céphalothorax de crabe débarrassé de
sa cuticule, constitue le tissu biologique renferment
l'hépatopancréas. A 1 g de tissu frais on ajoute 1 ml de tampon
20 mM Tris-HCl, 100 mM NaCl, 2 mM benzamidine, pH 8, l'ensemble est
traité à l'aide d'un mixeur (2 x 30s) à froid.
Après centrifugation (10 min, 10000 rpm) l'activité est
mesurée dans le surnageant.
Le taux de lipase de crabe vert mesuré sur une
émulsion de tributyrine dans les conditions optimales est de 50 UI/ g de
tissu frais. Alors que, l'activité phospholipasique mesurée sur
une émulsion de phosphatidylcholine comme substrat, est de l'ordre de 10
UI/g de tissu frais.
Le tableau 2 montre que la lipase de crabe présente un
niveau d'activité relativement faible par rapport à un
invertébré comme celui de scorpion. Alors que les niveaux
d'activité phospholipasique sont comparables.
Tableau 2 : Valeurs moyennes des
activités lipasique et phospholipasique exprimée en UI/g de tissu
frais d'hépatopancréas de crabe ou de scorpion.
|
Espèces animales
|
Activité lipasique
(UI/ g de tissu frais)
|
Activité phospholipasique
(UI/g de tissu frais)
|
|
Crabe vert
|
50
|
10
|
|
Scorpion (Nacim et al., 2005)
|
530
|
10
|
Ces résultats montrent que le crabe vert est
équipé d'enzymes lipolytiques lui permettant d'hydrolyser les
principaux lipides alimentaires : les triacylglycérols et les
phospholipides.
2- Recherche de la colipase
dans l'hépatopancréas de crabe
Il est bien connu, chez les animaux supérieurs, que la
lipase pancréatique a besoin d'un cofacteur protéique
thermostable pour s'exprimer. On a voulu savoir si la lipase de
l'hépatopancréas de crabe a besoin d'une colipase pour agir, pour
cela un homogénat d'hépatopancréas est traité
à 65°C pendant 30 min pour inactiver la lipase. L'homogénat
est ensuite centrifugé et utilisé pour tester la présence
d'une colipase. L'utilisation d'un excès de cette solution ne permet pas
de réactiver ni la lipase d'hépatopancréas de crabe
inhibée par les sels biliaires ni la lipase pancréatique de dinde
inhibée par NaTDC. Ces résultats sont en faveur de l'absence de
la colipase dans l'hépatopancréas de crabe.
3- Recherche de sels
biliaires dans l'hépatopancréas de crabe
A fin de mieux connaître les éléments
impliqués dans la lipolyse et l'absorption des lipides chez les crabes,
on a testé la présence de sels biliaires au niveau de
l'hépatopancréas. L'expérience réalisée dans
les conditions décrites précédemment montre que
l'hépatopancréas de crabe ne présente pas de sels
biliaires. Ce résultat confirme l'idée que les sels biliaires ne
sont apparus que lorsqu'il y a une séparation de
l'hépatopancréas en deux organes pancréas et foie.
II. Purification de la
lipase de crabe vert
Préparation de
l'homogénat
30 g de tissu frais de l'hépatopancréas de crabe
sont homogénéisé dans 30 ml de tampon 20 mM Tris-HCl, 100
mM NaCl, 2 mM benzamidine, pH 8 (tampon A) à l'aide d'un mixeur (Waring
blender) 2 x 30 secondes puis centrifugé 30 min à 12000 rpm et
à 4°C. L'activité lipasique est
récupérée puis mesurée dans le surnageant sur la
Tributyrine (TC4) dans les conditions optimales. Le protocole
expérimental de purification de la lipase digestive de crabe (LDC)
comporte les étapes suivantes.
1- Traitement à
60°C
Le surnageant récupéré après
centrifugation contenant 1500 UT, subit un traitement thermique à
60°C pendant 10 min. La solution lipasique est alors centrifugée
pendant 30 min à 12000 rpm et à 4°C. Le surnageant obtenu,
contenant 80 % de l'activité de départ (1200 UT), constitue la
charge de l'étape de chromatographie échangeuse d'anions
(DEAE-cellulose).
2- Chromatographie
échangeuse d'anions
Le surnageant contenant 1200UT est déposé sur
une colonne de DEAE cellulose (20 x 2,5 cm) préalablement
équilibrée dans le tampon A. L'enzyme ne s'adsorbe pas sur la
matrice et il est élué et récupéré dans la
phase de lavage. L'activité totale récupérée
après cette étape est de 800 UT.
3- Précipitation au
sulfate d'ammonium
La préparation enzymatique obtenue subit une
précipitation fractionnée au sulfate d'ammonium entre 30% et 60%
de saturation sous agitation à 4°C. Après 1 heure
d'agitation, le milieu est centrifugé pendant 30 min à 12000 rpm
à 4°C. Le culot est repris dans un minimum de tampon A. La solution
obtenue contenant 500 UT constitue la charge de l'étape de filtration
sur Séphacryl S-200.
4- Filtration sur
Séphacryl S-200
La charge ainsi obtenue est déposée sur une
colonne Séphacryl S-200 (2,5 x150 cm) préalablement
équilibrée dans le tampon A. L'élution des
protéines s'effectue avec le même tampon à un débit
de 30 ml/h. Le profil d'élution, présenté sur la figure 4,
montre que la LDC est éluée entre 1,3 et 1,5 V0.
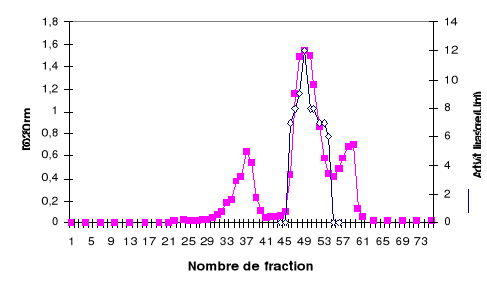
Figure 4 : Profil d'élution de la LDC
déposée sur une colonne de filtration Séphacryl S-200
équilibrée dans le tampon A. La charge (8 ml) contient 500 UT. Le
débit est de 30 ml/h. Le volume de fraction est de 6 ml.
5- Chromatographie
échangeuse d'anions : Mono Q-Sépharose
Après la filtration sur Séphacryl S-200, les
fractions contenant l'activité lipasique (300 UT) sont
rassemblées et déposées sur une colonne de Mono
Q-Sépharose (3 x 10 cm) équilibrée dans le tampon 20 mM
Tris-HCl, 20 mM NaCl, 2 mM Benzamidine, pH 8 (tampon B). Les protéines
fixées sont éluées avec un gradient linéaire de
NaCl (20 mM à 350 mM). Le débit d'élution est de 45
ml/h.
Le profil d'élution présenté sur la
figure 5, montre que la lipase est éluée à une
concentration de NaCl comprise entre 200 mM et 250 mM.
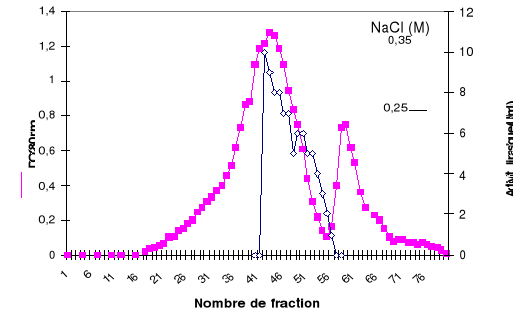
Figure 5 : Profil d'élution de la LDC
sur une colonne échangeuse d'anions Mono Q-Sépharose. La colonne
(3 x 10 cm) est équilibrée avec le tampon B. Les protéines
retenues sont éluées par 2x100 ml de gradient linéaire de
NaCl (20 mM à 350 mM) dans le tampon B. Le débit est de 45 ml/h.
le volume de fraction est de 3 ml.
6- Electrophorèse
sur gel de polyacrylamide en présence de SDS
L'analyse par électrophorèse, de certaines
fractions protéiques issues de la dernière étape sur gel
de polyacrylamide dans les conditions dénaturantes, montre que la LDC
se présente sous forme d'une seule bande de masse moléculaire 65
kDa (figure 6).
MT P1 P2 P3
96 kDa
67 kDa
43 kDa
30 kDa
20 kDa
14 kDa
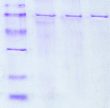
Figure 6 :Electrophorèse sur gel de
polyacrylamide à 12 % dans les conditions dénaturantes. Les
échantillons (5U chacun) sont précipités par deux volumes
d'acétones, le culot est ensuite repris dans le tampon
dénaturant. MT : marqueur de taille ; P1, P2, P3 :
fractions 57, 58 et 59 issues de la dernière étape de
chromatographie.
7- Bilan de purification de
la lipase de crabe vert
Tableau 3 : Le Bilan de purification de la
LDC.
|
Etape de purification
|
Activité totale
(UT)
|
Protéines
(mg)a
|
AS
(UI/mg)
|
Rendement
|
Facteur de
purification
|
|
Homogénat
|
1500
|
16.5
|
3.03
|
100
|
1.00
|
|
Traitement T=60°C, 10 min
|
1200
|
1.96
|
12.2
|
80
|
4.02
|
|
DEAE cellulose
|
800
|
0.61
|
82
|
54
|
27
|
|
Précipitation
(NH4)2SO4 60%
|
500
|
0.48
|
104
|
34
|
34.3
|
|
Séphacryl S-200
|
300
|
0.07
|
210
|
20
|
69.3
|
|
Mono Q-Sépharose
|
150
|
0.05
|
500
|
10
|
165
|
a : le dosage des protéines est effectué
par la méthode de Bradford (1976)
III- Caractérisation
biochimique de la lipase digestive de crabe vert
1- Activité lipasique en fonction
de la température
Il est bien établi que tous les enzymes
lipolytiques du règne animal agissent à 37°C. A cette
température une faible activité est décelée dans
l'hépatopancréas de crabe. Par contre (figure 7) une augmentation
de la température de 37°C à 60°C s'accompagne par une
augmentation significative de l'activité lipolytique. Ce résultat
surprenant mérite, dans l'avenir, d'être expliqué sur le
plan physiologique et biochimique.
TC4/pH 8
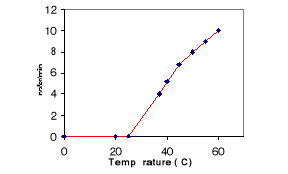
Figure 7 : Profil d'hydrolyse d'une
émulsion de TC4 par la LDC à températures
croissantes.
2- Cinétique
d'hydrolyse de la tributyrine et de l'huile d'olive
Pour avoir une idée sur le comportement aux
interfaces de la LDC, on a suivi l'hydrolyse d'une émulsion de
tributyrine (TC4) et d'une émulsion d'huile d'olive par la LDC en
fonction du temps. Les résultats sont présentés dans la
figure 8.
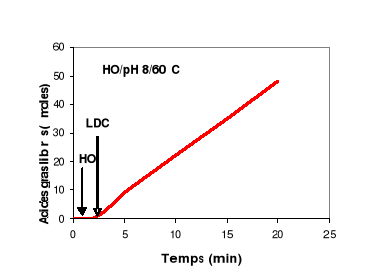
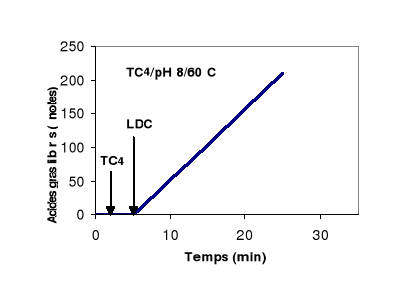

Figure 8 : Cinétique d'hydrolyse d'une
émulsion de HO et de TC4 par la LDC. L'activité lipasique est
mesurée à pH 8 et à 60°C.
Cette figure montre que quelque soit la longueur de la
chaîne acyle du TG, la LDC présente une cinétique
d'hydrolyse qui reste linéaire pendant 20 min. On peut donc conclure que
malgré la tension interfaciale élevée à l'interface
TC4/eau, et malgré l'accumulation des acides gras libres à
chaînes longues à l'interface HO/eau, la LDC continue à
hydrolyser efficacement ses substrats. Ces résultats montrent que la LDC
est plus stable aux interfaces que la plupart des lipases pancréatiques
(Gargouri et al., 1983 ;1984 a ; 1984 b ; 1985).
3- Effet du pH sur
l'activité de la LDC
L'activité spécifique a été
mesurée à différents pH et à 60°C
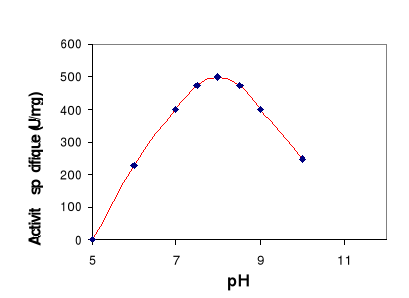
Figure 9 : Effet du pH sur l'activité
de la LDC. L'activité lipasique est mesurée à
différents pH et à 60°C sur une émulsion de
tributyrine.
Ces résultats montrent que la LDC présente un pH
optimum égale 8 et elle est capable d'agir dans un large spectre de pH
compris entre 7 et 10. Une activité spécifique de 500 U/mg est
obtenue à pH 8 en utilisant la tributyrine comme substrat.
4- Stabilité de la
LDC en fonction de pH
La LDC a été incubée à
température ambiante à différents pH et. L'activité
lipasique est mesurée après 30 min d'incubation. La figure 10
montre que la LDC reste stable dans un large spectre de pH compris entre 5 et
9. Aux pH extrêmes l'enzyme est inactivé.
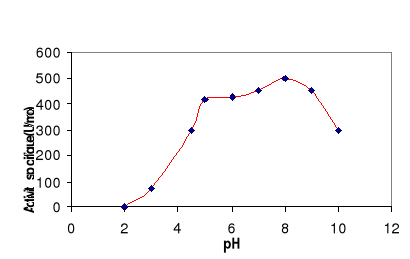
Figure 10 : Effet du pH sur la
stabilité de la LDC. L'enzyme est incubé à
différents pH dans différents tampons, à
température ambiante. L'activité spécifique est
mesurée sur la tributyrine comme substrat à pH 8 et à
60°C.
5- Effet de la
température sur l'activité de la LDC
L'activité spécifique a été
mesurée à différentes températures à pH
8.
Les résultats portés sur la figure 11 montrent
que la LDC est pleinement active entre 40°C et 60°C. La
température optimale est de 60°C. La LDC est inactivée
au-delà de 65°C.
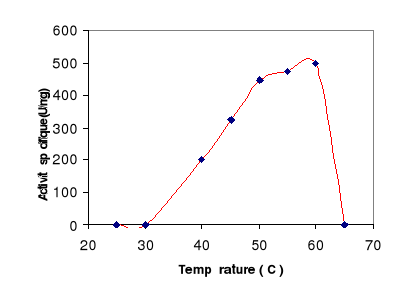
Figure 11 : Effet de la température
sur l'activité de la LDC. L'activité lipasique est
mesurée à pH 8 sur une émulsion de tributyrine à
différentes températures.
6- Stabilité de la
LDC en fonction de la température
L'effet de la température sur la stabilité de la
LDC est présenté sur la figure 12, qui montre que l'enzyme reste
stable et actif après une incubation de 15 min à une
température inférieure à 50°C. A cette
température 80% de l'activité lipasique est mesurée.
Au-delà de 55°C la LDC est totalement inactivée quand elle
est incubée en solution. Par contre quand l'enzyme est incubé en
présence de son substrat (figure 11) il reste stable jusqu'à
60°C.
Ce résultat confirme que la présence de substrat
protège l'enzyme de l'effet de la température. Ce
phénomène est bien connu chez les enzymes qui agissent en milieu
hétérogène.
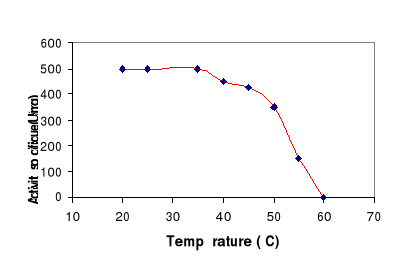
Figure 12 : Effet de la température
sur la stabilité de la LDC. L'enzyme est préincubé
à différentes températures pendant 15 min.
L'activité lipasique est mesurée sur une émulsion de
tributyrine à pH 8 et à 60°C.
7- Effet de calcium sur
l'activité de la LDC
L'activité spécifique a été
mesurée en présence de concentrations croissantes de calcium. La
figure 13 montre que la LDC est capable d'agir en absence de calcium. En effet,
en présence de 10 mM d'EDTA, la LDC présente son activité
maximale sur une émulsion d'huile d'olive ou de tributyrine comme
substrat.
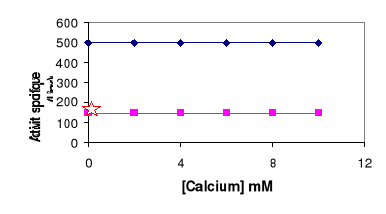
TC4
HO

Figure 13 : Effet de calcium sur
l'activité de la LDC. L'activité lipasique est mesurée
à pH 8 et à 60°C sur une émulsion de tributyrine ou
d'huile d'olive. L'étoile indique l'activité de la LDC
mesurée en présence de 10 mM EDTA.
8- Effet d'un
composé amphipatique sur l'activité de la LDC
Dans le but d'avoir une idée sur le pouvoir de
pénétration de la LDC, nous avons mesuré l'activité
lipasique en présence d'un composé amphipatique naturel NaDC.
La figure 14 montre que la LDC perd son activité au fur
et à mesure qu'on augmente la concentration du NaDC. L'inactivation
totale est obtenue à 2 mM de NaDC. L'effet inhibiteur de NaDC dans le
système tributyrine/eau ou huile/eau peut être relié
à un changement de la qualité de l'interface qui diminue le
pouvoir de pénétration de la LDC. L'enzyme est alors
relargué dans la phase aqueuse (Gargouri et al., 1986).
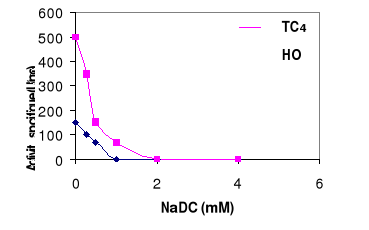
Figure 14 : Effet de NaDC sur
l'activité de la LDC. L'activité lipasique est mesurée
à pH 8 et à 60°C sur une émulsion d'huile d'olive ou
de tributyrine en présence de concentrations croissantes de NaDC.
L'addition de colipase pancréatique de dromadaire ne
permet pas de réactiver la LDC ce qui est en faveur de l'absence
d'homologie structurale entre la lipase pancréatique et la lipase
purifiée à partir de l'hépatopancréas de crabe.
9-
Immunoréactivité des anticorps polyclonaux anti-SDL et anti-TPL
avec la LDC
On a voulu savoir si la LDC présente une certaine
homologie structurale avec une lipase pancréatique classique ou d'une
lipase d'Arthropode terrestre (le scorpion). Pour cela on a incubé la
LDC en présence d'anticorps polyclonaux anti-SDL ou anti-TPL. Nos
résultats montrent que les pAbs anti-TPL réagissent d'une
manière spécifique avec la TPL, par contre aucun croisement n'est
observé quand ces anticorps sont incubés avec la LDC. De la
même manière les pAbs anti-SDL sont incapables de croiser avec la
LDC.
On peut conclure qu'il n'existe pas de déterminants
antigéniques communs entre la LDC et les lipases pancréatiques
classiques d'une part et d'autre part entre la LDC et la lipase d'un
invertébré terrestre.
La lipase de crabe peut être considérée
comme un nouvel enzyme qui fera partie d'un groupe de lipases d'animaux peu
évolués. La séquence de cet enzyme nous permettra de mieux
établir la relation structure fonction de cette nouvelle classe
d'enzymes.
SDL LDC TPL
Anti-TPL
TPL LDC SDL
Anti-SDL


Figure 15 :
Crossimmuno-réactivité des anticorps polyclonaux anti-TPL ou
anti-SDL
Conclusion et Perspectives
Dans ce présent travail, la purification et la
caractérisation biochimique partielle de la lipase digestive de crabe
(LDC) ont été réalisées.
Nos résultats montrent
que :
§ La masse moléculaire de la LDC est de 65 kDa.
§ Contrairement à toutes les lipases de
règne animal, La température optimale d'action de la LDC est de
60°C.
§ La cinétique d'hydrolyse d'une émulsion
d'huile d'olive ou de tributyrine reste linéaire pendant 20 min.
§ L'activité spécifique de la LDC
purifiée est de 500 UI/mg sur la tributyrine comme substrat.
§ Le calcium n'est pas nécessaire pour
déclencher l'activité lipasique.
§ La LDC est stable et active entre pH 6 et 10
après 30 min d'incubation à température ambiante.
§ Le NaDC inhibe la LDC à une concentration de 2
mM.
§ Les résultats d'immunoréactivité
de la LDC vis-à-vis de deux types d'anticorps polyclonaux anti-SDL et
anti-TPL suggèrent que la LDC ne présente pas d'homologie
structurale ni avec les lipases pancréatiques classiques ni avec une
lipase d'un arthropode terrestre (le scorpion).
Perspectives :
§ Déterminer la séquence primaire de la
LDC.
§ Déterminer et exprimer le gène qui code
pour la LDC.
§ Modéliser ou cristalliser la LDC pour
déterminer la structure tertiaire.
§ Approfondir l'étude immunologique.
Sommaire
Introduction
1
Etude bibliographique
I- Les enzymes lipolytiques
2
1- Introduction
2
2- Cinétique enzymatique de la lipolyse
2
II- Les lipases du monde marin
4
III- Les Crabes
5
1- Position systématique
5
2- Morphologie des crabes
5
3- Système digestif
5
Matériel & Méthodes
I- Matériel
7
1- Réactifs
7
2- Animaux
7
3- Protéines
7
4- Supports chromatographiques
7
5- Appareillage
7
II- Méthodes
7
1- Dosage de l'activité lipolytique
7
2- Dosage de l'activité
phospholipasique
8
3- Détermination de la concentration en
protéines
8
4- Effet de la température sur
l'activité lipasique
8
5- Effet du pH sur l'activité lipasique
8
6- Stabilité de la lipase de crabe en
fonction de la température
8
7- Stabilité de la lipase de crabe en
fonction du pH
8
8- Effet des ions calcium
9
9- Effet du détergent naturel sur
l'activité lipasique
9
10- Dosage des sels biliaires dans
l'hépatopancréas de crabe
9
a) Préparation de la solution
(Enzyme/NAD+) au moment de l'expérience
9
b) Dosage des échantillons
9
11-Analyse des protéines par
électrophorèse et immunorévélation
9
Résultats & Discussion
I- Niveau des enzymes lipolytiques et de la
colipase dans l'hépatopancréas de crabe vert
10
1- Mise au point des activités lipasique et
phospholipasique dans l'homogénat
10
2- Recherche de la colipase dans
l'hépatopancréas de crabe
10
3- Recherche de sels biliaires dans
l'hépatopancréas de crabe
11
II. Purification de la lipase de crabe vert
11
Préparation de l'homogénat
11
1- Traitement à 60°C
11
2- Chromatographie échangeuse d'anions
11
3- Précipitation au sulfate d'ammonium
11
4- Filtration sur Séphacryl S-200
12
5- Chromatographie échangeuse
d'anions : Mono Q-Sépharose
12
6- Electrophorèse sur gel de polyacrylamide
en présence de SDS
13
7- Bilan de purification de la lipase de crabe
vert
14
III- Caractérisation biochimique de la
lipase digestive de crabe vert
14
1- Activité lipasique en fonction de
la température
14
2- Cinétique d'hydrolyse de la tributyrine
et de l'huile d'olive
15
3- Effet du pH sur l'activité de la LDC
15
4- Stabilité de la LDC en fonction de pH
16
5- Effet de la température sur
l'activité de la LDC
16
6- Stabilité de la LDC en fonction de la
température
17
7- Effet de calcium sur l'activité de la
LDC
17
8- Effet d'un composé amphipatique sur
l'activité de la LDC
18
9- Immunoréactivité des anticorps
polyclonaux anti-SDL et anti-TPL avec la LDC
19
Conclusion & Perspectives
B
Bauchau A., la vie des crabes, édition
Paul Le Chevalier (1966) 142-143
Beaumont A., Cassier P., travaux pratiques de
biologie animale, zoologie, embryologie, histologie (1973), édition
Bordas ; Paris (1991) 472-473.
Bradford M.M., A rapid and sensitive method
for the quantitation of quantities of protein utilising the principle of
protein-drye binding, Anal. Biochem. 72 (1976) 248-254.
Brady L., Brzozowski A.M., Derewenda Z.S., Dodson E.,
Dodson G.G., Tolley S., Turkenburg J.P., Christiansen L., Huge-Jensen B.,
Norskov L., Thim L., Menge U., A serine protease triad forms the
catalytic centre of a triacylglycerol lipase, Nature 343 (1990) 767-770.
Brockerhoff H., Hoyle R.J., Hwrang P.C.
Digestive enzymes of the American lobster, Homarus americanus. J.Fish Res.
Board Can. 27 (1970) 1357-1370.
D
Dejerli N., Akpinar MA., Partial purification
of intestinal triglyceride lipase from Cyprinion Hechel and effect of
pH on enzyme activity, Turk journal 26 (2002) 133-143.
Desnuelle P., Sarda L., Ailhaud G.,
Inhibition de la lipase pancréatique par le
diéthyl-p-nitrophényl phosphate en émulsion,
Biochim. Biophys. Acta 37 (1960) 570-571.
F
Ferrato F., Carrière F., Sarda L., Verger
R., A critical reevaluation of the phenomenon of interfacial
activation, Methods Enzymol. 286 (1997) 327-347.
G
Gandhi N.N., Applications of lipase, J. Am.
Oil Chem. Soc. 74 (1997) 621-634.
Gargouri Y., Julien R., Bois A. G., Verger R., Sarda
L., Studies on the detergent inhibition of pancreatic lipase activity,
J. Lipid Res. 24 (1983) 1336-1342.
Gargouri Y., Julien R., Sugihara A., Verger R., Sarda
L. Inhibition of pancreatic and microbial lipases by proteins,
Biochem. Biophys. Acta 795 (1984a) 326-331.
Gargouri Y., Julien R., Pièroni G., Verger R.,
Sarda L. Studies on the inhibition of pancreatic and microbial
lipases by soybean proteins, J. Lipid Res. 25 (1984b) 1214-1221.
Gargouri Y., Pièroni G., Rivière C.,
Sarda L., Verger R., Inhibition of lipases by proteins: a binding
study using dicaprin monolayers, Biochemistry 25 (1985) 1733-1738.
Gargouri Y., Piéroni G., Rivière C.,
Saunière J.F., Lowe P.A., Sarda L., Verger R., Kinetic assay of
human gastric lipase with short and long chain triacylglycerol emulsion,
Gastroenterology 91 (1986) 919-925.
Gjellesvik D.R., Lambardo D., Walther B.T.,
Pancreatic bile salt dependent lipase from Cod (Gadus morhua):
Purification and proprieties, Biochem. Biophys. Acta 1124 (1992) 123-134.
L
Laemmli U.K., Cleavage of structural proteins
during the assembly of the head of bacteriophage T4, Nature 227
(1970) 680-685.
P
Patton J.S., Nevenzel J.C., Fat digestion in
fish, Journal of American Oil chemist society 51(1974) 112-117.
R
Ransac S., Rivière C., Soulié J.M.,
Gancet C., Verger R., De Haas G.H. Competitive inhibition of
lipolytic enzymes I. A kinetic model applicable to water insoluble competitive
inhibitors, Biochem. Biophys. Acta 1043 (1990) 57-66.
S
Sarda L., Desnuelle P., Action de la lipase
pancréatique sur les esters en émulsion, Biochim. Biophys. Acta
30 (1958) 513-521.
Sayari A., Verger R., Gargouri Y.,
Comparative kinetic studies of two staphylococcal lipases using the
monomolecular film technique, J. Biochem. Mol. Biol. 34 (2001) 457-462.
T
Tocher D.R., Sergent J., Studies on
triacylglycerol, wax and sterol ester hydrolase in the intestinal caeca of rain
boutrout (Salmogairdnerii) fed diet rich in triacylglycerol and wax
ester,Comparative Biochemistry and Physiology 77B (1984) 561-571.
Taipa M.A., Aires-Barros M.R., Cabral J.M.S.,
Purification of lipases, J. Biotechnol. 26 (1992) 111-142.
U
Uppenberg J., Hansen M.T., Patkar S., Jones
T.A., Sequence, crystal structure determination and refinement of two
crystal forms of lipase Bfrom Candida antarctica, Structure 2 (1994)
293-308.
V
Verger R., de Haas G.H., Enzyme reactions in
a menbrane model. 1. New technique in monolayers, Chem. Phys. Lipids 10 (1973)
127-136.
Verger R., hydrolases et
dépolymerases, enzymes d'intérêt industriel, (Mouranche A.
et Coste C., eds) Gauthirr-Villars (1985) 313-329.
W
Winkler F.K., d'Arcy A., Hunziker W.,
Structure of human pancreatic lipase, Nature 343 (1990) 771-774.
Z
Zouari N., Miled N., Cherif S., Mejdoub M., Gargouri
Y., Purification and characterization of a novel lipase from the
digestive glands of a primitive animal: The scorpion, Biochem. Biophys. Acta.
1726 (2005) 67-74.
Résumé
La plupart des recherches actuelles sont
focalisées à l'étude des lipases des animaux
supérieurs. On ignore jusqu'à ce jour le mode d'action du
système lipolytique des animaux primitifs marins. Pour cette raison
nous nous sommes intéressés, dans ce présent travail,
à la purification et à la caractérisation biochimique de
la lipase de crabe impliquée dans la digestion des lipides
alimentaires.
Les crabes verts, utilisés dans cette
étude, comptent parmi les animaux marins les plus primitifs. Leur
apparition remonte à l'ère secondaire (-250 à -60 millions
d'années).
La lipase digestive de crabe (LDC) a
été purifiée à partir de
l'hépatopancréas. Elle apparaît sous forme d'un polypeptide
de 65 kDa. L'activité spécifique de l'enzyme purifié,
mesurée sur la tributyrine, est de 500 UI/mg à pH 8 et à
60°C.
L'étude de quelques caractéristiques
biochimiques de l'enzyme montre que :
Ø La LDC est une vraie lipase. Elle dégrade les
TG à chaînes longues.
Ø Contrairement à toutes les lipases de
règne animal, La LDC présente une température optimale
d'action de 60°C.
Ø La LDC est stable et active entre pH 6 et 10
après 30 min d'incubation à température ambiante.
Ø Le calcium n'est pas nécessaire pour
déclencher l'activité lipasique.
Ø La LDC ne présente pas d'homologie structurale
ni avec les lipases pancréatiques classiques ni avec une lipase d'un
arthropode terrestre (le scorpion).
Mots clefs :
Animal primitif marin, hépatopancréas, lipase de
crabe, purification, homologie structurale.
ABREVIATIONS
LDC : lipase digestive de crabe
SDL : lipase digestive de scorpion
TPL : lipase pancréatique de dinde
pAbs : anticorps polyclonaux
TG : triacylglycérol
H.O. : huile d'olive
TC4 : tributyrine
NaDC : déoxycholate de sodium
NaTDC : taurodéoxycholate de sodium
EDTA : l'acide éthylène diamine
tétra-acétique
AS : activité spécifique
Da : dalton
MM : masse moléculaire
rpm : rotation par minute
h : heure
min : minute
s : seconde
UI : unité enzymatique internationale
DO : densité optique
SB : sels biliaires

Le présent travail a été effectué
au laboratoire de Biochimie et de
Génie Enzymatique des
Lipases à l'ENIS, sous la direction du
Professeur Youssef-Talèl GARGOURI.
J'exprime toute ma gratitude et ma plus profonde
considération à Monsieur le Professeur
Youssef-Talèl GARGOURI, Directeur du département
du Génie Biologique et du Laboratoire de Biochimie et de Génie
Enzymatique des Lipases, pour avoir bien voulu diriger ce travail. Je le
remercie pour l'attention avec laquelle il a suivi ce travail, pour les
conseils très bénéfiques qu'il m'a prodigués, ainsi
pour la disponibilité dont il a toujours fait preuve à mon
égard.
J'adresse mes sincères remerciements à Monsieur
Slim CHERIF pour sa sympathie, ses fructueuses discussions au
cours de la réalisation de ce travail et pour l'aide considérable
qu'il m'a apporté tout au long de ce stage. Qu'il trouve ici
l'expression de ma vive reconnaissance.
Je remercie Madame Sémia CHAABOUNI,
Professeur à l'ENIS et directrice d'Unité
d'Enzymes et Bioconversion de m'avoir honoré en acceptant de
présider ce jury. Mes remerciements s'adressent également
à Monsieur Samir JAOUA, Professeur au
CBS et directeur de laboratoire du Biopesticides d'avoir
accepté de juger ce travail.
J'adresse mes sincères remerciements à Mr.Nacim
ZOUARI et Mr. Ahmed FENDRI pour les conseils très
bénéfiques et pour l'aide considérable qu'ils m'ont
apporté tout au long de ce stage.
Mes remerciements s'adressent également aux Dr.
Adel SAYARI, Maître assistant à
l'ENIS , Dr. Nabil MILED, Maître
assistant à l'ISBS, et Dr. Sofiane
BEZZINE, Maître de conférence à
l'ISBS, pour leurs fructueuses discussions.
Que tous les membres du LBGEL : Fakher, Maher, Hbib
Horcheni, Hbib Mosbah, Ali, Ikram, Molka, Abir, Hanène Louati,
Hanène Ghamgui, Nedia, Sawsen, Ahlem et Aida trouvent l'expression de
mon profond respect.
Je ne trouverai jamais les mots pour remercier mes
collègues de PFE : Ali, Mohammed, Sana, Souhir, Hajer, Soumaya,
Mazen, Islem, Ines, Amin, Hichem et Arselen, pour leur amitié et les
bons moments que j'ai passé avec eux
Finalement je remercie tous ceux qui ont contribué de
près ou de loin à la réalisation de ce mémoire
Heykel.

A mes chers parents Hédi et Néjia
Sans leurs sacrifices, leur bienveillance,
Je ne pouvais jamais être ce que je suis aujourd'hui
Que Dieu les protège et garde heureux et en bonne
santé.
Au
Hommes de ma vie, mes frères
Bilel, Yassine, Seif el Islem et Nafaa
Que Dieu nous garde toujours unis
A
Mon oncle Mohamed et sa petite famille
Qui m'ont soutenu pendant mon cursus universitaire
A
Mes grands parents
Qu'ils reçoivent toute ma reconnaissance et l'expression
de ma profonde affection
A
Toute ma famille
Mes amis Badr, Arafet, Aymen , Anis et Atef
Tous ceux qui me sont chers

MEMOIRE
Présenté à
L'Ecole Nationale d'Ingénieurs de
Sfax
(Département de Génie
Biologique)
Option : Biotechnologie
en vue de l'obtention
du Diplôme National d'Ingénieur en
Génie Biologique
Par
Heykel TRABELSI
Adel HADJ IBRAHIM
Ce travail a été réalisé
dans le Laboratoire de Biochimie et de Génie Enzymatique des
Lipases
Année Universitaire 2005-2006
Pr. Sémia CHAABOUNI
Président
Pr. Samir JAOUA Membre
Pr. Youssef-Talèl GARGOURI
Encadreur
Mr. Slim CHERIF
Encadreur
Soutenu le 12 Juin 2006, devant la commission
d'examen :
Cycle de Formation d'Ingénieurs dans la
discipline Génie Biologique
Projet de fin d'études
N° d'ordre : 2006-GB
République Tunisienne
Ministère de l'Enseignement Supérieur
Université de Sfax
Ecole Nationale d'Ingénieurs de Sfax
Département de Génie
Biologique
CONTRIBUTION À L'ÉTUDE DU SYSTÈME
LIPOLYTIQUE D'UN ANIMAL MARIN PRIMITIF
LE CRABE VERT
| 


