5. Classification des enzymes
Les enzymes sont classees et nominees en fonction de la nature
des reactions chimiques qu'elles catalysent. Il y a six classes principales de
reactions catalysees par les enzymes (Tableau III.1), ainsi qu'un certain
nombre de sous-classes et de sous-sous-classes a l'interieur de chaque classe.
Chaque enzyme se voit assignee deux noms et une classification a quatre
chiffres (Donald Voet et Judith G. Voet, 1998).
Tableau III. 1 : Classification des enzymes
selon la reaction catalysee.
Classification Type de reaction catalysee
Oxydoreductases Transferases Hydrolases Lyases
Isomerases Ligases
Oxydoreduction
Transfert de groupes fonctionnels
Hydrolyse
Elimination de groupes et formation de doubles liaisons
Isomerisation
Formation de liaison couplee a l'hydrolyse de l'ATP
6. Les enzymes etudiees
6.1. L'a- amylase
L'amylase a ete purifiee en 1835 du malt par Anselme Payen et
Jean Persoz. Leur travail les a merles de suspecter que des substances
semblables, maintenant connues sous le nom d'enzymes, pouvaient participer dans
les processus biochimiques.
Elle est repandue dans tous les organismes vivants. Dans les
systemes digestifs des humains et beaucoup d'autres mammiferes, elle est aussi
appelee « diastase » (Encyclopaedia Britannica,
2007).
L'amylase hydrolyse l'amidon, le glycogene, et la dextrine
pour former le glucose, le maltose et les dextrines.
Une alpha-amylase appelee la ptyaline est produite par les
glandes salivaires, tandis que l'amylase pancreatique est secret& par le
pancreas dans le petit intestin (Encyclopaedia Britannica,
2007). La Ptyaline commence la digestion du polysaccharide dans la
bouche ; le processus est complete dans le petit intestin par l'amylase
pancreatique, parfois appelee l'amylopsine (The Columbia Encyclopedia,
2006)
Les Béta-amylases sont presentes dans les levures, les
moules, les bacteries, et les plantes, en particulier dans les grains. La
13-amylase attaque l'amylose de chain droite mais ne peut pas attaquer la
majeure partie de l'amylopectine de chain en branche (Encyclopaedia
Britannica, 2007).
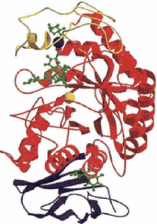
Figure 111.13. Structure de l'alpha amylase
pancreatique humaine.
Les trois domaines sont montres : le domaine A est rouge; le
domaine B est jaune ; le domaine C est noir. L'ion de calcium (sphere bleue) et
l'ion de chlorure (sphere jaune) sont egalement montres a proximite immediate
du centre catalytique. Le ligand d'acarbose (bouleet-bdton vert) est lie au
site actif. Des ligands de monosaccharide et de disaccharide (dans la
representation de boule-et-bfiton) sont attaches aux accepteurs exterieurs
(Minxie Qian et al, 1997).
6.1.1. La reaction specifique
Les a-amylases (a-1,4-glucan-4-glucanohydrolase, EC 3.2.1.1)
sont les enzymes omnipresentes synthetisees dans tous les genres de la vie, de
poids moleculaire 50 kDa. Tous les a-amylases lient au moms un ion fortement
conserve de Ca2+ qui est exige pour l'integrite structurale et pour
l'activite enzymatique (Nushin Aghajari et al,
2002).
L'a-amylase pancreatique humaine (APH) catalyse l'hydrolyse de
la liaison glycosidique a(1-4) en polymeres de glucose tels que l'amidon. L'APH
est composee de 496 acides amines en une seule chain de polypeptide liee aux
ions essentiels de chlorure et de calcium. L'hydrolyse de l'amidon ou les
substrats se produisent avec la conservation nette de la configuration au
centre anomerique de sucre, et sont censes proceder par l'intermediaire d'un
double mecanisme de &placement comportant la formation et l'hydrolyse d'un
intennediaire de b covalent glycosyle-enzyme (Dr. Anjuman Begum,
2007).
6.1. 2. Interet de l'inhibition de
l'alpha amylase
Les amylases sont une partie de la plus large classe des
enzymes hydrolytiques appelees les glycosidases, clivent les liaisons
glycosidiques de l'amidon dormant les fragments de disaccharide qui sont plus
tard decomposes en glucose (Figure III. 14).
OH
0
|
HO
|
HO0
HO
Amidon
|
OH
0
OH
H00 0
HO
HO
|
amylase
|
|
disaccharicles - glucose
|
|
Les inhibiteurs qui bloquent la reaction hydr olyt ique
|
OH
HO
HO
H5
HO
(1`
-0
Ffp,,
OH HN-4
NHO. HN
HN7i
OH No NH2
NH
HN
Octapeptide lineaire
1-1C
OH
I-10
FIN
HO
HOo
HO
acarbose
Four le traitement de diabete
Les inhibiteurs
OH
O
N
HN
H2N
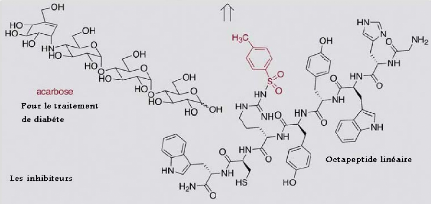
Figure III. 14. Les inhibiteurs : l'acarbose
et l'octapeptide de la reaction catalysee par l'amylase (Nicola Pohl,
2005).
Les inhibiteurs des amylases ont déjà montre
leur utilite en aidant les diabetiques (Franco, O.L. et al,
2002). Les niveaux de glucose des diabetiques peuvent étre
contrOles apres des repas par l'administration d'un inhibiteur d'amylase tel
que l'acarbose. Acarbose est un produit naturel obtenu par la fermentation et
est structurellement lie au substrat d'oligosaccharide d'amylase, car jusqu'a
cinq residus de glucose sont connus pour étre adaptes dans le site actif
d'amylase (Machius et al, 1996). Il est interessant
que certains plantes et micro-organismes produisent les inhibiteurs d'amylase
qui sont bases sur des proteins plutOt que les carbohydrates. Ces proteins
inhibitrices, qui s'etendent dans la taille de 32 acides amines avec 3 liaisons
disulfures a plus de 19 kDa, regule l'activite d'amylase endogene, par exemple
dans les grains des plantes, aussi bien que pour defendre contre les amylases
digestives d'autres organismes telles que les insectes (Breuer,
2003).
On a rapporte que l'inhibition des a-amylases induit la
tolerance des carbohydrates, la satiete et la perte de poids, et pour prolonger
le vide gastrique. Les inhibiteurs d' a-amylase ont ainsi un potentiel
therapeutique pour le traitement de l'obesite et du diabete non-insulin
(Juliet A. Gerrard et al, 2000).
6.2. La trypsine
Sous le terme de trypsine immun reactive (TIR), on regroupe un
ensemble de molecules qui ont en commun d'être reconnues par divers
anticorps developpes contre la trypsine humaine cationique ou trypsine-1. Cette
protease est issue de l'activation du plus abondant des trypsinogenes produits
par le pancreas chez l'homme.
La trypsine est une protein de 201 acides amines d'un poids
moleculaire de 23 kDa et qui possede quatre ponts disulfures.
La trypsine est synthetisee par les cellules acines du
pancreas sous forme d'une pro-enzyme qui inactive le trypsinogene. Il existe en
fait deux trypsines originaires de deux isoformes differentes du trypsinogene
mais a capacites catalytiques quasi identiques. Cette activite proteolytique
est tres intense ; elle se manifeste au niveau des liaisons carboxyliques de la
lysine et de l'arginine.
La plus grande partie de la secretion pancreatique passe dans
le duodenum mais une faible partie est retrouvee dans le serum oil elle est
amen& par les voies veineuses, lymphatiques et peritoneales. Il existerait
egalement une secretion endocrine. La trypsine serique peut donc representer un
passage fortuit de l'enzyme dans la circulation mais aussi un recyclage
enzymatique ou encore un mecanisme d'autoregulation de la synthese. Une infime
proportion du trypsinogene secrete se retrouve dans la circulation sanguine,
oil it est detectable par des techniques sensibles.
Le pouvoir proteolytique de la trypsine est trop intense pour
qu'elle circule isolement dans la circulation sanguine. Elle se presente donc
dans le serum, liee a des inhibiteurs des proteases tels que
l'ai-antitrypsine et l'a2-macroglobuline. La trypsine
developpe son activite dans les voies intestinales (0. Gaillard,
1996).
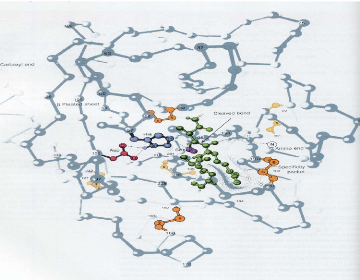
Figure 111.15. Structure par rayons X de la
trypsine bovine.
Dessin de l'enzyme complexes avec son substrat polypeptidique
(en vert) dont la chaine laterale d'arginine occupe la poche de specificite de
l'enzyme (en pointilles bleu), la chaine des Ca, les pouts
disulfures et les chains laterales de la triade catalytique, Serine 195,
Histidine 57, et Aspartate 102 sont representees (D. Voet et J. G.
Voet, 1995).
6.2.1. La reaction specifique
La trypsine est une enzyme de la digestion synthetisee et
secret& par les cellules acinaires pancreatiques, en passant par le canal
pancreatique, dans le duodenum (la partie superieure du petit intestin), elle
catalyse l'hydrolyse d'une liaison peptidique d'un residu chargé
positivement : l'arginine et la lysine (D. Voet et J. G. Voet,
1995).
6.2.2. Interet de l'inhibition de la
trypsine
Trypsine-like proteases a serine composent une famille
d'enzymes avec une importante activite. Its sont connus pour étre
impliques dans beaucoup d'etats physiologiques et desordres pathologiques. Leur
activite non contrOlee est nes dangereuse et mene souvent aux maladies
serieuses comme emphyseme, fibrose cystique ou developpement et progression de
cancer. Par exemple, l'enzyme principale dans la croissance et la metastase de
tumeur est activateur plasminogen d'urokinase (uPA) appartenant a la famille de
protease a serine (trypsine-type).
Dans des conditions physiologiques normales, cette enzyme joue
un role essentiel dans des processus d'angiogenese mais ces resultats non
contrOles d'activite dans d'enormes niveaux de la plasmine active, qui facilite
le mouvement des cellules de cancer (Marcin Sienczyk et Jozef
Oleksyszyn, 2004).
Formes moleculaires multiples d'inhibiteurs de trypsine (TI)
et chymotrypsine (CI), qui sont des enzymes digestives typiques des insectes,
des mammiferes et des micro-organismes, et subtilisine (SI), une proteinase de
beaucoup de bacteries et mycetes phytopathogenique (Alexander V.
Konareva et al, 2001).
La grande variete d'inhibiteurs de protease a serine sont
fournies par plusieurs sources telles que les tissus, micro-organismes,
plantes, etc., jouent un role important en reglant les enzymes proteolytiques.
L'analyse des complexes de protease-inhibiteur aide a la comprehension du
mecanisme d'action, aussi bien que pour concevoir des inhibiteurs. Les
inhibiteurs de protease sont repandus en nature, variant de petites molecules,
peptides aux proteins. Jusqu'ici, 18 differents inhibiteurs de protease ont ete
classifies et la liste est en croissance continue. Dans la plupart des
inhibiteurs de protease la boucle de reactif-site, avec la geometrie
specifique, bloque le site actif et la region substrat-liante (B. Syed
Ibrahim et Vasantha Pattabhi, 2005).
L'activation inadequate du trypsinogene dans le pancreas mene
au developpement de la pancreatite. Une fois que la trypsine est activee, elle
est capable d'activer beaucoup d'autres proenzymes digestives. Ces enzymes
pancreatiques activees augmentent plus loin l'autodigestion du pancreas. La
trypsine active egalement des cellules par l'intermediaire du recepteur de
trypsine. Le recepteur de la trypsine est egalement connu en tant qu'un des
recepteurs actives par protease, a savoir PAR-2, recemment. Les cellules
acinaires et les cellules de conduction expriment PAR-2 abondant. L'activite de
la trypsine dans le pancreas est contrOlee principalement par l'inhibiteur
pancreatique secrete de la trypsine (PSTI), qui est egalement connu en tant que
type 1 de Kazal d'inhibiteur de protease de serine (SPINK1).
PSTI est synthetise dans les cellules acinaires du pancreas et
agit en tant qu'un inhibiteur normal efficace de trypsine pour empécher
l'occurrence de la pancreatite. Quand le trypsinogene est active a la trypsine
dans le pancreas, PSTI lie immediatement a la trypsine pour empécher
davantage l'activation des enzymes pancreatiques. PSTI bloque egalement
l'activation supplementaire des cellules pancreatiques par l'intermediaire du
recepteur de trypsine, PAR-2 (figure III. 16).
Activation des cellules : acinaires
de conduction inflammatoires
a travers le rècepteur de la trypsine
(PAR-2)
Kallikreinog6ne f Chymotrypsino gene Proelastase roc arb
oxyp eptidase rop hasp holipas e A2
Kallikreine Chyrnotrypsine Elastase
Carboxy-peptidase Phospholipase A2
Figure 111.16. Voies d'activation des
proenzymes et du PAR-2 par la trypsine.
Une fois que la trypsine est activee, elle est capable
d'activer beaucoup d'autres proenzymes digestifs. La trypsine active egalement
les cellules pancreatiques et inflammatoires par l'intermediaire de PAR-2.
L'activite de trypsine dans le pancreas est contrOlee principalement par PSTI.
Quand le trypsinogene est active a la trypsine dans le pancreas, PSTI lie
immediatement a la trypsine pour empécher davantage l'activation des
enzymes pancreatiques (Masahiko Hirota et al,
2003).
| 


