|
FACULTE DE MEDECINE, PHARMACIE
ET D'ODONTO-STOMATOLOGIE

ANNEE 2006
N° 29
PRISE EN CHARGE ET EVALUATION
DU TRAITEMENT MEDICAMENTEUX
DU GLAUCOME PRIMITIF A ANGLE OUVERT :
Etude rétrospective à propos de 87
cas colligés
dans la clinique ophtalmologique
spécialisée
du Croissant Rouge Marocain de Kénitra
THESE
POUR OBTENIR LE GRADE DE DOCTEUR EN
PHARMACIE
(DIPLOME D'ETAT)
PRESENTEE ET SOUTENUE PUBLIQUEMENT
Le 13 juillet 2006
PAR
Dr. BENOMAR Oussama
MEMBRE DE JURY
|
Président
|
:
|
Pr.
|
Doudou
|
BA
|
:
|
Chimie Analytique
|
|
Membres
|
:
|
Pr.
|
Madoune Robert
|
NDIAYE
|
:
|
Ophtalmologie
|
|
|
Pr.
|
Babacar
|
FAYE
|
:
|
Pharmacologie
|
|
|
Pr.
|
Mamadou
|
BADIANE
|
:
|
Chimie Thérapeutique
|
|
|
|
|
|
|
|
|
Directeur de thèse
|
:
|
Pr.
|
Babacar
|
FAYE
|
:
|
Pharmacologie
|
|
Co-directeur de thèse
|
:
|
Dr.
|
Guata Yoro
|
SY
|
:
|
Pharmacologie
|
À la mémoire de mon
Père
Voici déposé à tes pieds un des
fruits de tes efforts et de tes sacrifices.
J'aurai tant aimé partager ces moments avec toi
mais c'est ainsi que Dieu l'a voulu. Je pense que tu aurais été
fier de moi.
Tes conseils, toujours judicieux, et ta
bénédiction fortifié m'ont toujours accompagné. Tu
m'as comblé d'amour et d'affection, et tu m'as préparé
à affronter la vie d'adulte.
Saches que je ne vis qu'à travers tes mots et tes
commandements...
Dans l'espérance d'honorer ce merveilleux
personnage que tu étais Père.
Puisse Allah t'accorder sa miséricorde.
Amen
sommaire
|
Introduction
|
1
|
|
Première partie : Etude
bibliographique
|
6
|
|
Premier chapitre :
Généralités sur le
glaucome.................
|
7
|
|
I. Définition du glaucome
............................................
|
7
|
|
II. Rappel anatomique de l'oeil
.......................................
|
9
|
|
II.1. Le globe oculaire
..............................................
|
9
|
|
II.1.1. Les
enveloppes.............................................
|
9
|
|
II.1.2. Le
contenu................................................
|
9
|
|
II.2. La cornée
.....................................................
|
11
|
|
II.3.
L'iris..........................................................
|
11
|
|
II.4. L'angle irido-cornéen
.............................................
|
12
|
|
II.5. Le nerf
optique..................................................
|
14
|
|
II.5.1. La papille
..................................................
|
14
|
|
III- Physiologie de l'humeur
aqueuse.................................
|
15
|
|
II.1. Propriétés physiques et chimiques
..............................
|
16
|
|
II.1.1. Propriétés
physiques.......................................
|
16
|
|
II.1.2. Composition
chimique.....................................
|
16
|
|
II.1.3. Débit d'humeur
aqueuse....................................
|
17
|
|
II.2. Régulation de la formation de l'humeur
aqueuse..................
|
18
|
|
II.2.1. Système nerveux
autonome.................................
|
18
|
|
II.2.1.1. Innervation
sympathique...............................
|
18
|
|
II.2.1.2. Innervation
parasympathique...........................
|
19
|
|
II.2.2. Système
adénylcyclase....................................
|
19
|
|
II.3. Régulation de l'excrétion de l'humeur
aqueuse...................
|
20
|
|
II.3.1. Influences hormonales et
nerveuses.........................
|
20
|
|
II.3.2. Influence du muscle
ciliaire.................................
|
20
|
|
II.3.3. Prostaglandines et élimination
uvéosclérale..................
|
21
|
|
II.4. La pression
intraoculaire.......................................
|
21
|
|
II.4.1. Mesure de la pression
intraoculaire..........................
|
22
|
|
IV- Classification des
glaucomes.....................................
|
23
|
|
IV.1. Le glaucome primitif à angle
ouvert.................................
|
25
|
|
IV.1.1.
Epidémiologie.............................................
|
26
|
|
VI.1.1.1.
Prévalence..........................................
|
26
|
|
VI.1.1.2.
Age..................................................
|
26
|
|
VI.1.1.3.
Sexe.................................................
|
26
|
|
VI.1.1.4. Facteurs
ethniques....................................
|
27
|
|
VI.1.1.5. Hérédité du
GPAO....................................
|
27
|
|
IV.1.2. Etude
clinique.............................................
|
27
|
|
IV.1.2.1. Causes de l'hyperpression
intraoculaire.................
|
27
|
|
IV.1.2.1. Signes
cliniques.......................................
|
28
|
|
IV.1.2.2. Pathogénie de
l'excavation.............................
|
29
|
|
IV.2. Autres types du
glaucome......................................
|
30
|
|
IV.2.1. Le glaucome par fermeture de
l'angle...........................
|
30
|
|
IV.2.2. Le glaucome
congénital....................................
|
31
|
|
V- Examens et
dépistage.............................................
|
32
|
|
V.1. La tonométrie ou la mesure de la pression
intraoculaire............
|
32
|
|
V.2. L'examen du fond
d'oeil........................................
|
32
|
|
V.3. La périmétrie ou l'examen du champ
visuel......................
|
33
|
|
V.4. La gonioscopie ou l'examen de l'angle
iridocornéen..............
|
33
|
|
V.5. Autres examens
paracliniques...................................
|
34
|
|
Deuxième chapitre : Traitement du
glaucome..................
|
35
|
|
A - Traitement
médicamenteux.....................................
|
36
|
|
I.
Bêtabloquants..................................................................
|
36
|
|
I.1. Mode
d'action..................................................
|
36
|
|
I.2.
Pharmacocinétique..............................................
|
36
|
|
I.3. Classification pharmacologique des
â-bloquants..................
|
37
|
|
I.3.1. Activités sympathomimétique
intrinsèque.....................
|
37
|
|
I.3.2. Effet stabilisant de
membrane................................
|
38
|
|
I.3.3. sélectivité
â1................................................
|
38
|
|
I.4. Effets
secondaires...............................................
|
39
|
|
I.4.1. Effets secondaires
locaux....................................
|
39
|
|
I.4.2. Effets secondaires
généraux.................................
|
39
|
|
I.4.3. Phénomène
d'échappement..................................
|
40
|
|
I.5. Différents collyres
bêtabloquants.................................
|
41
|
|
I.5.1. Maléate de
timolol..........................................
|
41
|
|
I.5.2.
Métipranolol................................................
|
41
|
|
I.5.3.
Cartéolol...................................................
|
42
|
|
I.5.4.
Bétaxolol...................................................
|
42
|
|
I.5.5.
Béfunolol...................................................
|
43
|
|
I.5.6.
Lévobunolol................................................
|
43
|
|
II. Agonistes á - adrénergiques
...............................................
|
44
|
|
II.1. Agonistes á-adrénergiques non
sélectifs..........................
|
44
|
|
II.1.1. Mode
d'action..............................................
|
44
|
|
II.1.2.
Pharmacocinétique.........................................
|
45
|
|
II.1.3. Effets
secondaires..........................................
|
46
|
|
II.1.3.1. Effets secondaires
locaux...............................
|
46
|
|
II.1.3.2. Effets secondaires
généraux.............................
|
47
|
|
II.1.4. Différents agonistes
á-adrénergiques non sélectifs............
|
47
|
|
II.1.4.1.
Adrénaline.............................................
|
47
|
|
II.1.4.2.
Dipivéphrine..........................................
|
47
|
|
II.2. Agonistes á-adrénergiques
sélectifs........................................
|
48
|
|
II.2.1.
Clonidine..................................................
|
48
|
|
II.2.2.
Apraclonidine.............................................
|
48
|
|
II.2.2.1. Mode
d'action.........................................
|
49
|
|
II.2.2.2.
Indications.............................................
|
50
|
|
II.2.2.3.
Associations...........................................
|
51
|
|
II.2.2.4. Effets
secondaires......................................
|
52
|
|
II.2.3.
Brimonidine...............................................
|
53
|
|
Effets
indésirables......................................
|
53
|
|
III.
Cholinergiques..................................................
|
54
|
|
III.1. Mode
d'action................................................
|
54
|
|
III.2.
Pharmacocinétique............................................
|
55
|
|
III.3. Mode
d'administration.........................................
|
56
|
|
III.4. Effets
secondaires.............................................
|
56
|
|
IV. Les
prostaglandines..............................................
|
58
|
|
IV.1. Mode
d'action................................................
|
58
|
|
IV.2.
Pharmacocinétique............................................
|
59
|
|
IV.3. Effets
secondaires.............................................
|
60
|
|
IV.3.1.
Systémiques..............................................
|
60
|
|
IV.3.2.
Oculaires.................................................
|
60
|
|
V. Inhibiteurs de l'anhydrase carbonique
......... .....................
|
61
|
|
Mode
d'action................................................
|
61
|
|
V.1. IAC prescrits per os ou par voie
parentérale......................
|
62
|
|
V.1.1.
Administration.............................................
|
62
|
|
V.1.2. Effets
secondaires..........................................
|
62
|
|
V.2. IAC par voie
locale.............................................
|
64
|
|
V.2.1.
Pharmacocinétique.........................................
|
64
|
|
V.2.2. Effets
secondaires..........................................
|
65
|
|
V.2.3. Comparaison avec
l'acétazolamide..........................
|
66
|
|
V.2.4. Mono- et
bithérapie........................................
|
67
|
|
VI. Agents
hyperosmotiques...................................................
|
68
|
|
VI.1.
Glycérol......................................................
|
68
|
|
VI.2.
Mannitol......................................................
|
68
|
|
VII. Intérêt de nouveaux
vecteurs....................................
|
69
|
|
B. Traitement non
médicamenteux.................................
|
70
|
|
I.
Trabéculectomie...................................................
|
70
|
|
I.1.
Définition.......................................................
|
70
|
|
I.2. Mode
d'action..................................................
|
70
|
|
I.3. Résultats de la
trabéculectomie...................................
|
70
|
|
I.4.
Floro-5-uracile..................................................
|
71
|
|
II.
Trabéculoplastie..................................................
|
71
|
|
II.1. Mode
d'action.................................................
|
72
|
|
II.2. La chute
pressionnelle..........................................
|
72
|
|
III.
L'iridectomie....................................................
|
73
|
|
III.1. L'iridectomie
chirurgicale.....................................
|
73
|
|
III.2. L'iridectomie au
laser.........................................
|
74
|
|
III.2.1. Laser a
Aragon...........................................
|
74
|
|
III.2.2. Laser
Yag................................................
|
74
|
|
IV. Iridoplastie
périphérique.........................................
|
75
|
|
DEUXIEME PARTIE : TRAVAIL
PERSONNEL
|
76
|
|
I. Matériels et
méthodes..............................................
|
77
|
|
I.1. Cadre
d'étude...................................................
|
77
|
|
I.1.1. La clinique ophtalmologique
spécialisée de Kénitra............
|
77
|
|
I.1.1.1. Présentation du
centre...................................
|
79
|
|
I.1.1.2.
Personnels.............................................
|
79
|
|
I.1.1.3. Programme de la
clinique................................
|
81
|
|
I.2. Population
d'étude...............................................
|
82
|
|
I.2.1. Critères
d'inclusion.........................................
|
82
|
|
I.2.2. Critères
d'exclusion........................................
|
82
|
|
I.2.3. Nombre de malades
maintenus..............................
|
82
|
|
I.3.
Méthodologie...................................................
|
83
|
|
I.4. Fiche d'enquête et
questionnaire.................................
|
83
|
|
II.
Résultats.........................................................
|
84
|
|
II.1. Caractéristiques des
patients....................................
|
84
|
|
II.1.1. Sexe des
patients...........................................
|
84
|
|
II.1.2. Age des
patients............................................
|
85
|
|
II.1.3. Antécédents cliniques des
patients...........................
|
86
|
|
II.1.4. Antécédents oculaires des
patients...........................
|
88
|
|
II.1.5. Nombre de consultations effectuées par
les patients...........
|
90
|
|
II.1.6. Les pressions intraoculaires initiales des
patients..............
|
91
|
|
II.2. Evaluation du traitement
médical................................
|
93
|
|
II.2.1. Les schémas thérapeutiques
utilisés..........................
|
93
|
|
II.2.2. Prescription des différentes classes
thérapeutiques............
|
94
|
|
II.2.3. Evolution des pressions intraoculaires des
patients............
|
96
|
|
II.2.4. Evolution des différentes classes
thérapeutiques..............
|
98
|
|
II.2.4.1. les
bêtabloquants.......................................
|
98
|
|
II.2.4.2. Inhibiteurs de l'anhydrase
carbonique...................
|
100
|
|
II.2.4.3.
Mydriatiques..........................................
|
101
|
|
II.2.4.4.
Myotiques.............................................
|
102
|
|
II.2.4.5.
Prostaglandines........................................
|
103
|
|
II.2.5. Evaluation des schémas
thérapeutiques......................
|
104
|
|
II.2.5.1.
Monothérapie..........................................
|
105
|
|
II.2.5.2.
Bithérapie.............................................
|
105
|
|
II.2.5.3.
Trithérapie.............................................
|
107
|
|
II.3.
Questionnaire..................................................
|
109
|
|
II.3.1. Observance du
traitement...................................
|
109
|
|
II.3.2. Coût du
traitement.........................................
|
111
|
|
II.3.3. Effets
secondaires.........................................
|
112
|
|
II.4. Interventions
chirurgicales.....................................
|
113
|
|
III.
Discussion.......................................................
|
115
|
|
CONCLUSION
|
120
|
|
BIBLIOGRAPHIE
|
124
|
|
ANNEXES
|
134
|
LISTE DES ABREVIATIONS
|
AIC
|
:
|
Angle irido-cornéen
|
|
AMM
|
:
|
Autorisation de mise sur le marché
|
|
AMP
|
:
|
Adénosine monophosphate
|
|
AMPc
|
:
|
Adénosine monophosphate cyclique
|
|
ASI
|
:
|
Activité sympathomimétique intrinsèque
|
|
ATP
|
:
|
Adénosine triphosphate
|
|
C/D
|
:
|
Excavation / Papille (Cup / Disc)
|
|
CRM
|
:
|
Croissant Rouge Marocain
|
|
ESM
|
:
|
Erreur standard à la moyenne
|
|
GAF
|
:
|
Glaucome à angle fermé
|
|
GPAO
|
:
|
Glaucome à angle ouvert
|
|
HA
|
:
|
Humeur aqueuse
|
|
HDL
|
:
|
Hight density lipoprotein
|
|
HPO
|
:
|
Hyper pression oculaire
|
|
IAC
|
:
|
Inhibiteur de l'anhydrase cyclique
|
|
M/F
|
:
|
Masculin / Féminin
|
|
OD
|
:
|
OEil droit
|
|
OG
|
:
|
OEil gauche
|
|
PIO
|
:
|
Pression intraoculaire
|
|
VIP
|
:
|
Vasoactive intestinal peptide
|
Introduction
Le terme de glaucome regroupe plusieurs affections oculaires
mettant en jeu le pronostic visuel par atteinte du nerf optique via une
hypertension intraoculaire et des anomalies de vascularisation papillaire.
Ces affections se caractérisent par :
- un tonus oculaire élevé,
- une altération de la papille optique,
- des anomalies du champ visuel [30].
Le glaucome est une maladie insidieuse et, le plus souvent,
indolore. Une quantité substantielle de tissus nerveux peut
dégénérer avant que le patient souffre d'une atteinte
mesurable de ses champs visuels. Le glaucome peut éventuellement mener
à une cécité suite à la perte des champs visuels
périphériques et centraux [78].
Un glaucome peut se développer chez n'importe qui,
à n'importe quel moment de la vie, mais la fréquence de cette
affection est plus élevée dans les groupes suivants :
-
personnes âgées de plus de 40 ans,
- histoire familiale de
glaucome,
- hypermétropes,
- diabétiques,
- populations
noires.
Parmi les différentes formes de glaucomes, le glaucome
primaire à angle ouvert (GPAO) est le plus fréquent. C'est la
deuxième cause de cécité dans les pays
développés et concerne 1 à 2 % de la population de plus 40
ans ; sa prévalence est de 0,93 % et augmente, à partir de
70 ans, de 1% tous les 5 ans (3 % à 75 ans, 4 % à 80 ans). Le
glaucome est sept fois plus fréquent dans la race noire que dans la race
blanche et est, par la même occasion, plus grave
[30].
Le traitement anti-glaucomateux demeure encore aujourd'hui une
tache complexe, car les glaucomes embrassent des tableaux cliniques très
différents dont nous ne connaissons pas les causes mais seulement
quelques facteurs de risques, seule la pression intraoculaire est vraiment
accessible à un traitement. Les glaucomes constituent donc un
véritable problème de santé publique dans le monde entier,
puisqu'ils sont en constante augmentation, en rapport avec l'accroissement de
la population et de l'espérance de vie [5].
Le but de ce travail est de :
- Evaluer la place du traitement médicamenteux dans la
prise en charge du glaucome.
- Evaluer l'efficacité du traitement antiglaucomateux de
chaque classe thérapeutique.
- Comparer les différents schémas
thérapeutiques utilisés
- Evaluer Les cas d'échecs thérapeutiques et/ou
ayant nécessité une intervention chirurgicale.
Aperçu historique
Dans l'antiquité, « glaukos »
exprimait une couleur : glauque ; c'est une couleur verdâtre
qui rappelle l'eau de mer, en relation avec une divinité marine
« Glaucos ». C'est vers 400 ans avant Jésus-Christ
qu'Hippocrate introduisit le concept de glaucome, le définissant comme
un ensemble de maladies menant à la cécité
[12].
L'histoire du glaucome commençait dés qu'on
avait évalué la notion de pression intraoculaire. C'est ainsi
qu'au 10ème siècle, ATTABARI aurait était le premier
à mentionner l'augmentation de la tension intraoculaire dans son
ouvrage : LIVRE DU TRAITEMENT HIPPOCRATIQUE. Par la suite, cette
hypertonie oculaire aurait été étudiée par BERGER
en 1744, en insistant sur le rôle d'une augmentation de la pression
intraoculaire, et en distinguant cet état des autres entités
telles que la mégalo-cornée, le staphylome antérieur, etc
[11].
L'invention de l'ophtalmoscope en 1850 par HERMANN VON
HELMHOLTZ et l'avancement des connaissances au cours des siècles ont
d'abord relié le glaucome à une condition dans laquelle la
pression intraoculaire est suffisamment élevée pour causer une
excavation caractéristique de la tête du nerf optique et une perte
associée de champ visuel [32].
En 1869, AL DOLF WEBER décrivit le principe de la
tonométrie par aplanissement qui est fondé sur la loi d'IMBERT
et FICK. Cette découverte avait orienté les chercheurs à
réaliser des traitements dans le but de diminuer l'hypertonie oculaire,
et freiner par la suite l'évolution de la maladie glaucomateuse. Pour
cela, ALBERCHT VONGRAEFE pratiqua en 1866 avec succès la première
iridectomie (traitement chirurgical) en réalisant un orifice dans la
périphérie de la chambre antérieure. Tandis que, les
premières tentatives de traitement au laser de cette hypertonie, en 1974
et 1976, avaient pour but la création de perforation au niveau du
trabéculum.
Certaines substances antiglaucomateuses avaient marqué
l'histoire du glaucome. C'est ainsi que WISTRAND découvrit en 1951 la
présence d'anhydrase carbonique dans le corps ciliaire de l'iris du
lapin. Son rôle fut très vite suspecté dans la
sécrétion de l'humeur aqueuse. D'ailleurs l'inhibition de
l'anhydrase carbonique au niveau du corps ciliaire entraîne une
diminution de 50 % de la sécrétion d'humeur aqueuse
[7].
Dés 1977 le rôle presseur des prostaglandines fut
démontré chez l'animal ; en application locale sur les yeux
de lapin, les prostaglandines entraînent une réduction durable de
la pression intraoculaire après une courte phase d'augmentation
[11].
Actuellement, l'avancée de la recherche a
révolutionné le traitement antiglaucomateux. Ainsi la
sclérectomie profonde non perforante est devenu une nouvelle technique
chirurgicale d'intervention filtrante antiglaucomateuse. Elle a
été réalisée par ZIMMER HAN et COLL, puis par
ARENAS, sous le nom de trabéculectomie abexterno. Elle a
été ensuite développée et élargie par
FYODOROV, KOSLOV et COLL [8].
1ere partie etude bibliographique
I - Définition du glaucome
Le glaucome est un regroupement de maladies oculaires
caractérisées par une dégénérescence et une
excavation progressive de la tête du nerf optique (un amincissement
progressif de l'anneau neuro-rétinien). (Figure 1)
Cette neuropathie s'associe à une perte graduelle et
irréversible des champs visuels périphériques
reliée à la sévérité de l'atteinte des
tissus [78].
Ainsi les glaucomes sont un groupe d'affections
caractérisées par :
- des altérations du nerf optique,
- des anomalies du champ visuel,
- une élévation de la pression intraoculaire.
Cette élévation n'est maintenant
considérée que comme un facteur de risque du glaucome et non sa
cause première. Cette triade symptomatique donne son unité
à un ensemble de tableaux disparates sources de menace pour la fonction
visuelle [72].
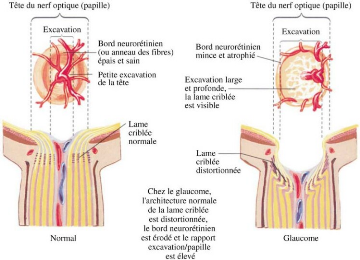
Figure 1 : Excavation de la
tête du nerf optique associée au glaucome [20]
II - Rappel anatomique de l'oeil
L'oeil est l'organe récepteur des impressions
visuelles, il se présente sous forme d'un ovoïde à grand axe
sagittal, situé dans la cavité orbitaire et appendu au nerf
optique [69].
II.1. Le globe oculaire:
Le globe oculaire est quasiment une sphère d'environ 25
mm de diamètre (oeil emmétrope), son axe
antéro-postérieur est grossièrement sagittal. Il est
séparé latéralement des parois osseuses de l'orbite par un
matelas graisseux, beaucoup plus épais en dedans qu'en dehors.
Schématiquement l'oeil est formé de trois
enveloppes et d'un contenu. (figure 2)
II.1.1. Les enveloppes
Elles sont concentriques et formées de dedans et dehors
par :
- Un pseudo-squelette : la sclérotique, tissu
conjonctif prolongé en avant par la cornée transparente
- Une tunique intermédiaire : essentiellement
vasculaire, l'uvée (analogie avec un grain de raisin dépourvu de
sa peau). En arrière, la choroïde, en avant le corps ciliaire et
l'iris.
- La rétine : une membrane profonde, sensorielle
et nerveuse.
II.1.2. Le contenu
Il s'agit de milieux transparents :
- le corps vitré en arrière,
- le cristallin derrière l'iris,
- l'humeur aqueuse derrière la cornée.
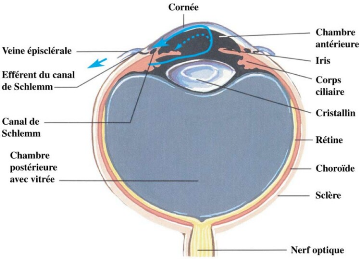
Figure 2. Anatomie
générale de l'oeil et flot de l'humeur aqueuse
[20]
On individualise habituellement ces structures en deux
segments :
* Le segment antérieur formé par la
cornée, le cristallin, l'iris, l'angle iridocornéen et le corps
ciliaire
* Le segment postérieur formé par la
sclérotique, la choroïde, la rétine et le corps vitré
[26].
II.2. La cornée
C'est une calotte de sphère transparente,
enchâssée dans l'ouverture antérieure de la
sclérotique, comme un hulot. Epaisse de 1 mm en
périphérie, elle a un diamètre de 11 à 12 mm. A la
périphérie de la cornée apparaît parfois un anneau
blanchâtre appelé gérontoxon.
La cornée est richement innervée par les nerfs
ciliaires et douée d'une grande sensibilité. La zone d'union
entre la sclérotique et la cornée est appelée le limbe
scléro-cornéen, dans laquelle est creusé un canal
annulaire sans paroi propre, le canal de Schlemm. Celui-ci recueille l'humeur
aqueuse et se continue en dehors avec les veines épisclérales
[69].
II.3. L'iris
C'est un diaphragme circulaire situé dans un plan
frontal, il est réuni au bord antérieur du corps ciliaire par la
racine de l'iris. Au centre il est perforé par la pupille. Il est
séparé de la cornée en avant par l'angle
irido-cornéen et en arrière du vitré par l'angle
irido-ciliaire (chambre antérieure).
L'iris présente deux faces :
- La face antérieure : de surface
irrégulière, séparée entre ses 2/3
périphériques et son 1/3 central, par un accident
circulaire : la collerette. Des cryptes se situent de part et d'autre de
cette collerette. L'iris est plus au moins pigmenté, ce qui
détermine sa couleur (la couleur des yeux) : bleu s'il n'existe que
les pigments postérieurs, brune si des pigments du stroma
antérieur s'y ajoutent.
- La face postérieure : est très
pigmentée et finement plissée par les lignes concentriques. Elle
répond à la face antérieure du cristallin.
La pupille est un orifice mobile de petit diamètre
à la vive lumière, de grand diamètre à
l'obscurité (myosis et mydriase). Deux muscles lisses animent cette
pupille : l'un, le sphincter entoure comme un bandeau circulaire l'orifice
pupillaire. L'autre, le dilateur, est plat, étalé devant
l'épithélium pigmentaire, il est innervé par le
sympathique.
La vascularisation de l'iris est assurée par des
artères radiaires issues du grand cercle artériel de l'iris. Les
veines symétriques rejoignent les veines ciliaires et choroïdiennes
[26].
II.4. L'angle irido-cornéen
(AIC)
Il est situé dans l'angle de réunion du limbe
scléro-cornéen et de l'iris. C'est une zone de constitution
complexe, par où l'humeur aqueuse est évacuée hors du
globe, selon des conditions qui s'équilibrent avec la
sécrétion. L'angle est constitué du centre vers la
périphérie par plusieurs couches : le trabéculum
uvéal, le trabéculum scléral, le trabéculum
cribriforme, filtres microscopiques que traverse l'humeur aqueuse pour
être drainée finalement par le canal de Schlemm, véritable
sinus veineux circulaire intrascléral, en relation avec des
efférents épiscléraux. (Figure 3)
L'obstruction de cette voie d'excrétion crée les
conditions du glaucome aigu. L'obstruction microscopique de l'angle large,
crée les conditions du glaucome chronique [26].
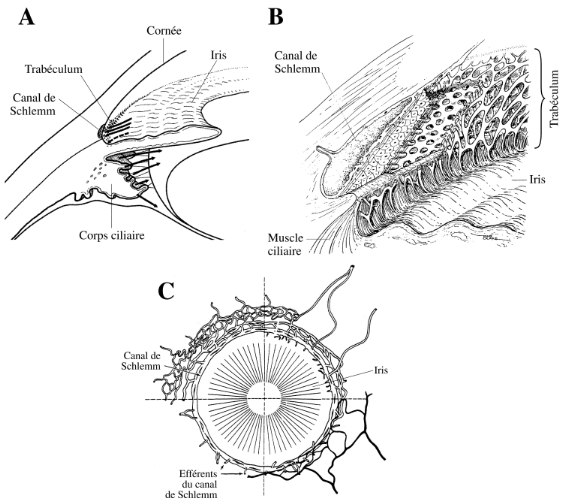
(A) Schéma détaillé de l'angle
irido-cornéen
(B) Description des couches cellulaires filtrantes composant le
trabéculum
(C) Vue radiale du canal de Schlemm et ses efférents
Figure 3 : Anatomie de l'angle
irido-cornéen, du trabéculum et du canal de Schlemm
[4]
II.5. Le nerf optique
Les fibres rétiniennes traversent la choroïde et
la sclérotique, sortent du globe oculaire et constituent le nerf
optique. Il est séparé du tissu cellulo-adipeux orbitaire par les
trois membranes méningées : la pie-mère,
l'arachnoïde, la dure-mère, se continuant avec la
sclérotique. C'est un cordon cylindrique, blanchâtre, d'un
diamètre de 5 mm, qui contient de chaque côte le chiffre
impressionnant de 1.200.000 fibres nerveuses.
On lui décrit trois portions :
- Portion intra-orbitaire : Elle constitue l'axe du
cône musculo-tendineux de l'orbite où le nerf optique est
accompagné par les nerfs et les vaisseaux du globe oculaire et de ses
annexes et, en particulier, par l'artère ophtalmique, son satellite.
- Portion intra-canaculaire : Elle se situe dans le canal
optique (long de 5 à 8 mm), dans lequel l'artère lui est
externe.
- Portion intra-crânienne : C'est la portion
où le nerf optique occupe l'étage moyen de la base du
crâne, situé sous la face inférieur du lobe frontal, en
dehors de la carotide interne qui, après avoir donné
l'artère ophtalmique, se devise en ses quatre terminales
[69].
II.5.1. La papille
Correspond à l'origine du nerf optique,
c'est-à-dire au point où il quitte le globe oculaire.
Située à 4 mm en dedans du pôle postérieur, elle
forme un petit disque blanchâtre, opaque, légèrement
excavé, de 1,5 mm de diamètre.
Elle est formée par les fibres optiques et ne contient
pas de cellules visuelles, ceci se traduit par une tache aveugle sur le
relevé du champ visuel [69].
III. Physiologie de l'humeur aqueuse
Liquide des chambres antérieures et postérieures
de l'oeil, l'humeur aqueuse (HA) est le déterminant le plus important de
la pression intraoculaire (PIO) ; cette dernière résulte, en
effet, d'un déséquilibre dynamique entre les processus de
formation de l'HA et ses possibilités d'élimination. Cette
pression, élevée par rapport aux pressions interstitielles des
autres tissus, contribue à maintenir le globe oculaire en état de
distension permanente, condition importante pour le bon fonctionnement du
système optique oculaire.
L'humeur aqueuse est formée principalement au niveau
des procès ciliaires, à partir du plasma, ainsi elle provient du
sang mais sa composition en est différente, les deux liquides
étant séparés par une barrière anatomique et
fonctionnelle appelée barrière hématoaqueuse. Elle est
sécrétée au niveau des procès ciliaires du corps
ciliaire, passe entre pupille et cristallin pour gagner la chambre
antérieure et enfin évacuée au niveau de l'angle
iridocornéen par la voie principale trabéculo-canaliculaire et
par la voie accessoire uvéosclérale. Elle traverse les mailles du
trabéculum pour gagner le canal de Schlemm. De là, elle passe
dans les veines épisclérales par l'intermédiaire des
veines aqueuses.
En dehors de son influence primordiale sur la PIO et de son
rôle optique, l'HA assure, en outre, une fonction métabolique
nutritionnelle vis-à-vis du cristallin, de la cornée et du
trabéculum, aussi bien par les nutriments qu'elle leurs fournit que par
leurs déchets qu'elle élimine [70].
II.1. Propriétés physiques et
chimiques
La composition de l'HA dépend des mécanismes mis
en jeu lors de sa formation mais aussi des échanges avec les tissus
qu'elle baigne : corps ciliaire, iris, cristallin, cornée, et les
constituants de l'angle iridocornéen. De ce fait, l'HA de la chambre
postérieure est sensiblement différente de l'HA de la chambre
antérieure [70].
II.1.1. Propriétés
physiques
? Indice de réfraction : 1,3353 (à peu
près identique à celui de l'ultrafiltrat sanguin).
? Viscosité : 1,025 à 1,10 (par rapport
à l'eau à 22° C).
? Osmolarité : aux environs de 303 mOsmol. (L'HA
est légèrement hypertonique de 3 à 4 mEq par rapport au
plasma : ceci est le fait du sodium et de l'acide ascorbique).
? Volume total : 0,3 ml (chambre antérieure 0,25
mL, chambre postérieure 0,06 mL [70].
II.1.2. Composition chimique
L'eau est le principal constituant de l'HA (99,6 %).
Parmi les autres constituants, certains sont à des taux
plus faibles que ceux du sang : acides aminés, protéines de
structures de répartition identique (deux tiers d'albumine, un tiers de
globuline) mais 100 à 200 fois moins concentrés ; enzymes
(protéase, anticholinestérase, phosphatase alcaline, histaminase,
hyaluronidase, anhydrase carbonique) ; Glucose, urée, acide urique,
créatine, ions bicarbonates.
D'autres sont en excès par rapport au plasma :
sodium, chlorure, acide ascorbique, acide lactique.
D'autres, enfin, ont des concentrations dans l'HA voisines de
celles du sang tels le potassium, le calcium, et les phosphates
[70].
II.1.3. Débit d'humeur aqueuse
Le débit du flux d'HA, mesuré par
fluorophotométrie, est de l'ordre de 2,50 l/min en période
diurne. Ceci représente un renouvellement de 1% par minute du volume
qu'elle occupe au niveau du segment antérieur. Le renouvellement complet
de l'HA se fait donc en moins de 2 heures.
La sécrétion d'HA n'est pas constante sur le
nycthémère. Elle dépend d'un rythme circadien avec une
diminution du taux de sécrétion la nuit de l'ordre de 30%
(débit nocturne d'environ 1,5 L/min). Le mécanisme précis
de cette variation est inconnu, mais une activité plus intense du
système nerveux sympathique durant le jour a été
évoquée [64].
II.2. Régulation de la formation de l'humeur
aqueuse
Dans les conditions normales, la vitesse de formation de l'HA
a peu de raison de varier ; il n'est donc pas certain que, en dehors des
variations de nature circadienne, un véritable mécanisme
régulateur existe. Les facteurs influençant cette
sécrétion sont néanmoins nombreux, les mieux connus
étant liés à l'action du système nerveux autonome
[21].
II.2.1. Système nerveux
autonome
II.2.1.1. Innervation sympathique
Elle provient de la chaîne sympathique cervicale et
parvient à l'oeil par les nerfs ciliaires. Elle est présente dans
les vaisseaux sanguins uvéaux, les procès ciliaires et l'angle
iridocornéen, indiquant que le système nerveux sympathique peut
influencer à la fois la sécrétion et l'excrétion
d'HA.
Les agonistes sélectifs (isoprotérénol,
territorienne) stimulent la production d'HA chez l'homme durant le sommeil.
Chez l'homme éveillé, les agonistes n'ont pas d'effet sur la
secretion d'HA. Les antagonistes (timolol) réduisent la formation d'HA
durant le jour mais pas durant la nuit. On peut donc en déduire que la
nuit, la formation d'HA est à un niveau basal, non stimulé, alors
qu'elle augmente durant le jour par activation des récepteurs
secondaire à une augmentation d'activité du système
nerveux sympathique et/ou à une augmentation de la concentration des
catécholamines circulantes.
Les agonistes 2 (clonidine, apraclonidine) réduisent,
en revanche, la formation d'HA. Les agonistes adrénergiques non
sélectifs, tels que l'épinéphrine, ont ainsi une
dualité d'effets sur le flux d'HA : stimulation par les
récepteurs et inhibition par les 2 récepteurs
[28].
II.2.1.1. Innervation parasympathique
Si la stimulation des fibres parasympathiques
véhiculées par la IIIe paire et se dirigeant vers l'oeil
entraîne des modifications de l'élimination de l'HA, l'effet sur
la formation d'HA n'a pas été mis en évidence de
façon probante. Des lésions de la voie parasympathique
empruntant le nerf facial et le ganglion ptérygopalatin diminuent, en
revanche, la PIO chez les sujets sains comme chez les patients glaucomateux, la
stimulation expérimentale ayant l'effet contraire chez les singes. La
plupart des fibres nerveuses du facial à destinée oculaire,
issues du ganglion ptérygopalatin, contiennent à la fois le
neurotransmetteur classique acétylcholine et le neuropeptide vasoactive
intestinal peptide (VIP). Si l'élévation de la PIO, lors de la
stimulation du facial, est en grande partie due à la vasodilatation
intraoculaire et à l'augmentation de la pression
épisclérale veineuse secondaire, le VIP, libéré
dans l'oeil durant cette stimulation, pourrait également avoir une part
de responsabilité par augmentation de la formation d'HA
[57].
II.2.2. Système
adénylcyclase
Actuellement prévaut la théorie d'une
corrélation dans le même sens entre la formation d'AMPc et celle
d'HA. Le système adénylcyclase est couplé à
différents récepteurs, stimulateurs (, VIP) et inhibiteurs (2,
neuropeptide Y), également intramenbranaires, qui agissent sur lui par
l'intermédiaire d'une protéine G stimulatrice ou inhibitrice. Les
agonistes et VIP, qui stimulent la formation d'AMPc, augmentent la production
d'HA, alors que les agonistes 2 diminuent la formation des deux substances
[15].
II.3. Régulation de l'excrétion de l'humeur
aqueuse
II.3.1. Influences hormonales et
nerveuses
Les trabéculum reçoit une innervation à
la fois du système parasympathique et du système sympathique, en
plus de l'innervation sensitive.
Les cellules trabéculaires possèdent des
récepteurs sensibles aux glucocorticoïdes ainsi qu'aux substances
adrénergiques, parasympathiques et dopaminergiques. Les
récepteurs stimulés par les glucocorticoïdes
(sécrétés physiologiquement selon un rythme circadien)
vont freiner la libération extracellulaire d'enzymes lysosomiales
favorisant ainsi la résistance à l'élimination de l'HA.
Les agonistes -adrénergiques augmentent la facilité
d'élimination par l'activation des récepteurs qui entraîne
probablement une formation accrue d'AMPc. Les agonistes muscariniques, en
revanche, n'apparaissent par avoir d'effet direct sur le trabéculum,
mais agissent de façon indirecte par l'intermédiaire du muscle
ciliaire [54].
II.3.2. Influence du muscle ciliaire
Du fait des rapports intimes entre trabéculum et
extrémité antérieure du muscle ciliaire, l'état du
muscle ciliaire exerce une influence sur la configuration du trabéculum.
Quand le muscle ciliaire se contracte, le trabéculum est
étiré, entraînant un élargissement des espaces
intratrabéculaires favorisant l'élimination trabéculaire
de l'HA.
Le muscle ciliaire est innervé à la fois par le
système nerveux parasympathique (III) et par le système
sympathique. La stimulation du nerf oculomoteur comme d'administration de
pilocarpine, agoniste muscarinique, augmente la facilité
d'élimination par voie trabéculaire en agissant sur la
contraction du muscle ciliaire [37].
II.3.3. Prostaglandines et élimination
uvéosclérale
On a montré que l'effet hypotensif oculaire des
prostaglandines était dû à leurs possibilités
d'augmenter l'élimination uvéosclérale. Cet effet peut
être dû à la relaxation du muscle ciliaire ; des
modifications structurales à l'intérieur du muscle peuvent
également y contribuer. Par ailleurs, la libération de
prostaglandines a été incriminée lors de l'action
hypotensive oculaire d'autres substances, épinéphrine par
exemple, car leur effet hypotensif s'est trouvé être réduit
par les inhibiteurs de la synthèse des prostaglandines
[13].
II.4. La pression intraoculaire
La pression oculaire dans une population normale se repartit
selon une courbe gaussienne et la valeur pathologique de la pression n'est
qu'une notion statistique. En fait, il faut faire intervenir d'autres notions
telles que l'age, la réfraction du sujet, le sexe, pour voir
apparaître un groupe de tensions anormales échappant à la
courbe gaussienne et constituant le groupe des glaucomateux. Ce problème
de détermination d'une valeur normale a fait l'objet de nombreuses
études et pour rester schématiques nous dirons que :
- La pression oculaire normale est de 15 mmHg +/- 2,5
- La pression oculaire peut être
considérée comme étant dans les limites statistiques de la
normale jusqu'à 20 mmHg
- En dessous de 18 mmHg il n'y a aucune évidence de
glaucome
- Entre 18 et 25 mmHg, le diagnostic devra être
interprété dans chaque cas en fonction des
caractéristiques propres au sujet (age, sexe, réfraction,
état vasculaire) et des examens complémentaires (tonographie,
champ visuel, état de la papille)
- Au dessus de 25 mmHg on peut porter le diagnostic
d'hypertonie oculaire mais ne parler de glaucome que lorsque les autres signes
de la maladie sont retrouvés [26].
II.4.1. Mesure de la pression
intraoculaire
La pression intraoculaire se mesure en clinique à
l'aide de tonomètres, il en existe trois types :
- les tonomètres par indentation (Schiotz)
- Les tonomètres par aplanissement ou aplanation
(Goldman, Perkins, Marckay Harg)
- Les tonomètres non-contact [68].
IV- Classification des glaucomes
Ce concept très général crée le
cadre nosologique de cette affection, mais ne suffit pas à examiner la
diversité de ses présentations cliniques. Deux facteurs
interviennent obligatoirement pour compléter cette définition et
la rendre utilisable sur le plan clinique :
· Le niveau de la pression intraoculaire :
L'hypertonie intraoculaire, statistiquement considérée comme
telle au dessus de 21 mmHg, est le facteur le plus important du glaucome,
à tel point qu'elle entre classiquement dans sa définition en
étant même confondue régulièrement avec lui.
· Etat de l'angle irido-cornéen
(AIC) : Le degré d'ouverture de l'AIC conditionne la
présentation clinique du glaucome. Un AIC ouvert est macroscopiquement
normal et définit le glaucome à angle ouvert, alors qu'un AIC
fermé résulte de l'accolement de la racine de l'iris au
trabéculum et s'oppose à l'évacuation de l'humeur aqueuse
hors de l'oeil.
Avant tout autre critère, un glaucome doit être
qualifié soit de primaire ou de secondaire. Le glaucome secondaire
survient lorsque le glaucome est accompagné ou causé par d'autres
traumatismes ou pathologies oculaires et/ou systémiques. Chacun des
trois types majeurs de glaucome peut être déterminé comme
primaire ou secondaire [78].
Tableau I : Classification des
glaucomes [78]
|
Glaucomes primaires
|
Glaucomes secondaires
|
|
Glaucomes à angle ouvert
|
? Glaucome primaire à angle ouvert
(à tension élevée)
? Glaucome à tension normale
|
? Glaucome relié à une pression
veineuse épisclérale élevée
? Glaucome pigmentaire
? Glaucome exfoliatif
? Glaucome lié aux
stéroïdes
? Glaucome lié à une tumeur
intraoculaire
? Glaucome par traumatisme post-chirurgical ou
accidentel
|
|
Glaucomes à angle fermé
|
? Glaucome (primaire) à angle
fermé à bloc pupillaire
? Glaucome (primaire) à angle
fermé avec iris en plateau
? Glaucome à mécanisme mixte (a
aussi une composante à angle ouvert)
|
? Glaucome relié à un bloc
pupillaire secondaire (plusieurs causes)
? Glaucome néovasculaire
? Glaucome relié à un flot
inversé de l'humeur aqueuse (bloc ciliaire)
? Glaucome relié à une tumeur
intraoculaire
? Glaucome par traumatisme
|
|
Glaucomes congénitaux
|
? Glaucome congénital primaire
|
?Syndrome d'Axenfeld-Rieger
? Hypoplasie de l'iris
? Iridogoniodysgénésie
? Aniridie
? Syndrome de Lowe
? Anomalie de Peters
? Syndrome de Sturge-Weber
|
IV.1. Le glaucome primitif à angle ouvert
(GPAO)
C'est une atrophie antérieure du nerf optique et une
excavation caractéristique, d'évolution chronique et
progressive, due à la mort des cellules ganglionnaires
rétiniennes associées aux changements typiques du champ
visuel.
Les patients atteints de glaucome à angle ouvert sont
asymptomatiques. On les détecte cliniquement par une atrophie optique,
une excavation caractéristique de la papille et, plus tard dans
l'évolution de la maladie, une perte de champ visuel.
L'élévation de la pression intraoculaire (PIO)
est consécutive à une perturbation de l'excrétion de
l'humeur aqueuse, et l'examen gonioscopique confirme que l'angle
irido-cornéen est, par définition, ouvert
[55].
VI.1.1. Epidémiologie
VI.1.1.1 Prévalence
Le GPAO est le plus fréquent des glaucomes, puisqu'il
représente, en fonction des régions et des critères
diagnostiques, 50 à 70% de l'ensemble des glaucomes.
La fréquence de la maladie augmente avec l'âge
(elle passerait à 5% chez les sujets de plus de 65 ans). Elle est plus
importante chez les sujets présentant une myopie forte, un syndrome
pseudo-exfoliatif ou une dispersion pigmentaire, et lorsqu'il existe des
parents glaucomateux. L'influence du diabète sucré sur la
survenue d'un GPAO est généralement admise (environ 12% des
glaucomateux sont diabétiques), et il est vraisemblable que
l'hérédité des deux maladies ait des caractères
communs [75].
VI.1.1.2. Age
Le GPAO survient surtout chez les sujets de plus de 50 ans,
mais peut être retrouvé dans la troisième ou la
quatrième décennie de la vie, particulièrement lorsqu'il
existe des antécédents familiaux de glaucome. Le terme de
« glaucome juvénile » a longtemps été
retenu pour les cas survenant avant 40 ans [75].
VI.1.1.3. Sexe
Une étude conduite à Framingham
[35] en 1977, sur 2 631 personnes, concluait que le GPAO
avec atteinte du champ visuel est plus fréquent chez les hommes que chez
les femmes. D'autres études épidémiologiques ont
également souligné l'évolution plus sévère
du glaucome pour le sexe masculin. Cette prédominance apparaît
encore plus marquée chez les sujets de moins de 40 ans
[35].
VI.1.1.4. Facteurs ethniques
Statiquement, le GPAO est plus fréquent chez les sujets
de race noire. Par ailleurs, il apparaît chez eux plus précocement
y est plus sévère, et aboutit plus vite et plus souvent à
la cécité.
Les raisons de cette gravité sont multiples, et
incomplètement élucidées : facteurs
économiques, géographiques, culturels particularité
tissulaires [75].
VI.1.1.5. Hérédité du
GPAO
L'existence de facteurs génétiques est admise
depuis longtemps dans la pathogénie du GPAO : la maladie est 15
fois plus fréquente chez les sujets dont les parents proches sont
glaucomateux (8,5% de porteurs d'un GPAO dans la parenté au premier
degré).
Le mode de transmission précis de la maladie est encore
controversé, et il n'est pas sûr qu'il s'agisse d'un classique
modèle mendélien [42].
VI.1.2. Etude clinique
VI.1.2.1. Causes de l'hyperpression
intraoculaire
Depuis longtemps, on sait que l'augmentation pressionnelle du
GPAO est liée à une augmentation de la résistance à
l'écoulement de l'humeur aqueuse. Dès 1946, on a montré
que le gradient « pression oculaire - pression veineuse
épisclérale » s'élevait dans le GPAO, alors que
le gradient « pression dans le canal de Schlemm - pression veineuse
épisclérale » restait inchangé : le
siège de la résistance à l'écoulement se situait
donc entre la chambre antérieure et le canal de Schlemm, ce qui a
été confirmé ultérieurement. La résistance
au delà du canal de Schlemm (veines aqueuses, veines
épisclérales). Ne paraît pas affectée dans le
GPAO.
En réalité, 4 à 10% des sujets de plus de
40 ans présentent une HPO ; or la prévalence du GPAO
inférieure à 1% dans cette même population. En d'autres
termes, les HPO peuvent être 10 fois plus fréquentes que les GPAO,
avérés ! La probabilité qu'ont les patients
hypertendus d'être un jour glaucomateux est donc faible, mais augmente
avec les chiffres de la PIO : les sujets dont la pression est de l'ordre
de 23 ou 24 mm Hg semblent développer des altérations du champ
visuel avec une incidence de seulement 5 % en 10 ans ; si la PIO est au
alentours de 30 mm Hg, l'incidence peut atteindre 10 %
[75].
VI.1.2.2. Signes cliniques
Les patients glaucomateux sont typiquement asymptomatiques,
l'examen peut révéler :
- une PIO élevée (au moins 21 mmHg à au
moins une prise),
- un index cup/disc (C/D ; excavation/papille)
élargi,
- une asymétrie C/D,
- des zones localisées d'amincissement du bord neural
(encoche)
- des hémorragies en flammèches
péripapillaires.
L'examen du fond d'oeil à la lumière
anérythre peut révéler la disparition de certaines couches
de fibres nerveuses. La gonioscopie est normale, le champ visuel
révèle des scotomes arqués incluant un ressaut nasal, des
défauts en coins paracentraux et temporaux [51].
VI.1.2.3. Pathogénie de
l'excavation
Les causes de la destruction optique dans le glaucome
chronique ne sont pas encore parfaitement connues, et font l'objet de
très nombreux travaux, parmi les théories
évoquées :
- Théorie ischémique, ou
théorie des « gradients »
Elle a été la plus longtemps admise. Dans cette
hypothèse, l'hypertonie intraoculaire réduit la vascularisation
de la tête du nerf optique, et diminue l'apport nutritif
nécessaire aux fibres optiques et au tissu de soutien.
- Théorie mécanique
L'hyperpression intraoculaire provoquerait un bombement vers
l'arrière de la lame criblée, et un glissement les unes sur les
autres des couches collagènes la constituant. Les fibres optiques
seraient véritablement cisaillées à ce niveau.
- Théorie de l'altération du flux
axoplasmique
Comme dans toutes les cellules nerveuses, il existe dans les
cellules ganglionnaires rétiniennes un double courant transportant
molécules et organites, l'un centrifuge, l'autre centripète au
corps cellulaire. Ce courant est indispensable à la fonction conductrice
de l'axone, à la croissance et au maintien des neurones, et à
l'évacuation des produits du catabolisme. Ce transport peut être
altéré par l'hypoxie, et donc l'ischémie, mais aussi par
une compression ou des agents toxiques [62].
- Théorie de l'apoptose
L'apoptose est un mot grec qui signifie "chute de
pétales ou de feuilles". Ce phénomène décrit la
mort programmée des cellules ganglionnaires rétiniennes dans les
tissus.
IV.2. Autres types du glaucome
IV.2.1. Le glaucome par fermeture de l'angle
(GFA)
Le GFA est une maladie entièrement différente du
glaucome chronique. L'hypertension oculaire est ici liée à une
anomalie anatomique qui permet le blocage de l'angle par l'iris lors de la
mydriase.
Typiquement, les symptômes associés à une
augmentation subite de la pression intraoculaire suite à la fermeture de
l'angle irido-cornéen sont une vive douleur oculaire et une vision
floue. Il évolue par crises séparées par des intervalles
de tension normale et le diagnostic risque de ne pas être
évoqué, si l'angle n'est pas examiné
systématiquement en gonioscopie. L'anatomie du glaucome par fermeture de
l'angle explique son mécanisme. L'iris refoulé en avant par le
cristallin bloque l'humeur aqueuse dans la chambre postérieure,
l'hypertension de cette chambre refoule en avant la racine de l'iris,
entraînant le blocage l'angle. L'hypertonie cède lorsque le bloc
papillaire est levé d'où son caractère intermittent
[72].
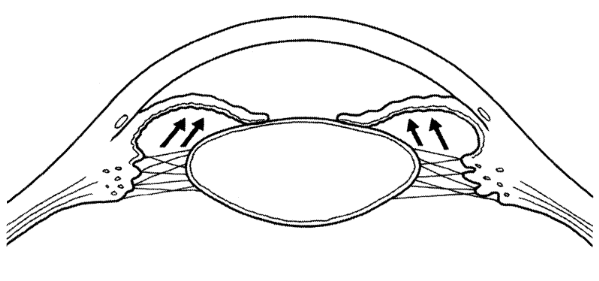
Figure 5 : Occlusion de l'angle
irido-cornéen occasionnée par l'accolement de l'iris sur le
cristallin [4]
IV.2.3. Le glaucome congénital
Est dénommé comme tel l'état oculaire
caractérisé par une HIO congénitale ou postnatale
responsable d'atrophie optique glaucomateuse. Dans la très grande
majorité des cas, le glaucome congénital est la
conséquence d'une dysgénésie du segment antérieur
de l'oeil qui justifie la dénomination plus exacte de glaucome
dysgénésique.
Ni le nouveau né, ni l'enfant en bas âge
n'exprime de difficultés visuelles, c'est à l'entourage, en
particulier les parents et le pédiatre, qui pouvaient être
alertés par des signes cornéens très évocateurs
comme: une mégalocornée, une opacité cornéenne et
une buphtalmie.
Le traitement relève de la chirurgie par goniotomie
(ablation des reliquats mésenchymateux de l'AIC), trabéculectomie
ou sclérotomie profonde. Dans la forme très frustre et
débutante, un traitement hypotonisant par un collyre bêtabloquant
très faiblement dosé peut être envisagé
[76].
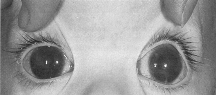
Figure 6: Glaucome congénital
[4]
V- Examens et dépistage
Quatre examens clés permettent de diagnostiquer et de
surveiller un glaucome. La mesure de la pression intraoculaire, ou
tonométrie ; l'examen de fond d'oeil, pour
apprécier la papille ; l'évaluation du champ visuel, ou
périmétrie ; l'examen de l'angle
irido-cornéen, ou ganioscopie, pour préciser le type de
glaucome [44].
V.1. La tonométrie ou la mesure de la pression
intraoculaire
Apres instillation d'un anesthésique local, la mesure
de la pression intraoculaire se fait par aplanation d'une petite surface de la
cornée par une sonde. C'est la technique de référence
(tonométre de Goldman) et elle est absolument indolore.
La pression intraoculaire normale varie de 10 à 21
mmHg, mais il faut savoir qu'il existe des variations
nycthémérales de la pression intraoculaire mesurée
à l'aplanation, comme la rigidité du globe oculaire ou
l'épaisseur de la cornée, qui sont variables d'un individu
à l'autre.
Il est également possible de mesurer la pression
intraoculaire sans contact direct avec un tonométre à air, qui
propulse un petit jet d'air sur la cornée [5].
V.2. L'examen du fond d'oeil
L'ophtalmologiste recherche les lésions
caractéristiques du glaucome, à savoir l'amincissement de
l'anneau neuro-rétinien, qui se traduit par l'augmentation du
creusement, ou l'excavation de la papille et sa pâleur. Cette majoration
de l'excavation traduit la diminution du nombre de fibres nerveuses du nerf
optique et explique les anomalies de la fonction visuelle. Cet amincissement de
l'anneau neuro-rétinien peut être asymétrique ou se
résumer à une encoche, il faut alors corréler cette
atteinte à l'existence d'un déficit et à sa localisation
sur le relevé du champ visuel.
L'existence d'une hémorragie sur le disque optique a
également une grande valeur et s'accompagne souvent d'une perte en
fibres visuelles en regard.
Cet examen est non douloureux, et ne nécessite pas
systématiquement la dilatation pupillaire, mais celle-ci est
préférable, ce qui entraîne un éblouissement
temporaire du patient par la lumière. Cette dilatation est
réalisée après l'examen de l'angle irido-cornéen et
n'est pas contre-indiquée si celui-ci est ouvert
[63].
V.3. La périmétrie ou l'examen du champ
visuel
Le champ visuel constitue l'ensemble des points de l'espace
qu'un oeil immobile est capable de voir. La périmétrie permet
d'établir pour chaque oeil une carte du champ visuel et de localiser les
zones déficitaires (scotomes) où la vision est perdue. Elle est
le plus souvent réalisée à l'aide de
périmètres automatisés et chaque oeil est testé
séparément [17].
V.4. La gonioscopie ou l'examen de l'angle
iridocornéen
Après instillation d'un collyre anesthésique, un
verre de contact est appliqué sur la cornée, il permet de
visualiser l'angle irido-cornéen et ses éléments et
d'identifier ainsi le type de glaucome, ce qui est indispensable pour le choix
du traitement. Il permet de dépister les angles susceptibles de se
fermer et de proposer alors un traitement au laser (iridectomie)
[44].
V.5. Autres examens paracliniques
- Photographie des fibres optiques rétiniennes,
- Mesure de la surface de l'anneau neuro-rétinien,
- Angiographie fluorescéinique,
- Vision des couleurs,
- Sensibilité au contraste [75].
Faute de ne pouvoir encore agir directement sur les cellules
ganglionnaires pour empêcher leur destruction, et sans preuve
évidente de l'intérêt de prescrire des produits à
visée vasculaire dans l'immense majorité des cas, il reste
entendu que l'énumération des moyens de traiter les glaucomes se
confond encore avec celle des différentes méthodes permettant
d'abaisser la pression intraoculaire [24].
Les objectifs du traitement sont de trois ordres :
- Préserver la fonction visuelle : cela ne se
résume pas à la conservation de l'acuité visuelle
tardivement altérée dans les glaucomes, mais aussi et surtout
à celle du champ visuel
- Préserver la qualité de vie : le glaucome
est une maladie chronique qui peut agir sur la qualité de vie des
patients. Donc une stratégie médicamenteuse antiglaucomateuse
permet de favoriser une bonne observance, et de diminuer les risques
d'évolution vers la cécité.
- Un coût acceptable : cela n'est pas synonyme de
traitement bon marché, mais plutôt de traitements efficaces
d'emblée qui évitent les modifications et les escalades
thérapeutiques génératrices de dépenses
supplémentaires [11].
A - Traitement médicamenteux
I. Bêtabloquants (ou antagonistes bêta
-adrénergiques)
L'utilisation de collyres aux â-bloquants a
été suggérée dans le traitement de l'hypertension
intraoculaire et du glaucome depuis plus de 30 ans. Ils demeurent le traitement
médical antiglaucomateux le plus prescrit, habituellement en
première intention, en raison de leur efficacité et de leur
excellente tolérance locale [60].
I.1. Mode d'action
Les collyres â-bloquants agissent en diminuant la
sécrétion active de l'humeur aqueuse par les cellules claires de
l'épithélium ciliaire. Ils bloquent précisément
l'action de l'enzyme adénylate-cyclase membranaire, essentiellement sur
les sites â2-adrénergiques de ces cellules ciliaires.
L'adénylate-cyclase transforme l'adénosine triphosphate (ATP)
intracellulaire en adénosine monophosphate (AMP) cyclique qui commande
la sécrétion aqueuse. A la conception classique de pompes
ioniques s'est substituée celle de « canaux
ciliaires », situés à la jonction cellules
claires/cellules pigmentées, dont les transits sont commandés par
l'AMPc [18].
I.2. Pharmacocinétique
Globalement, l'action hypotensive oculaire d'un collyre
â-bloquant commence 20 minutes environ après l'instillation, et
atteint un maximum d'efficacité entre 2 et 4 heures. Cet effet peut se
prolonger au-delà de 24 heures.
La réduction de la PIO est de l'ordre de 30 à 35
% dans les premiers jours, mais peut légèrement diminuer les
semaines suivantes. L'efficacité sur la baisse de pression est
sensiblement identique d'un â-bloquant à l'autre, peut-être
un peu plus faible avec le bétaxolol. L'effet hypotenseur est
différent d'un individu à un autre, et un â-bloquant
faiblement dosé peut fournir une baisse de pression significativement
importante. Il est donc toujours souhaitable de prescrire d'abord le plus
faible dosage, et d'ajuster ultérieurement la posologie.
De même, compte tenu de leur durée d'action
prolongée, le rythme d'administration des â-bloquants peut
être limité chez certains patients à une instillation
quotidienne, même sans vecteur permettant une
« libération prolongée ». Dans ce cas, le
collyre sera préférentiellement instillé le matin
plutôt qu'en milieu de journée ou le soir, compte tenu de la
baisse spontanée de la sécrétion ciliaire vespérale
et nocturne.
En cas d'instillation unilatérale, le passage
systémique entraîne habituellement un petite baisse de pression au
niveau de l'autre oeil [29].
I.3. Classification pharmacologique des
â-bloquants
En dehors de l'effet proprement â-adrénolytique
responsable de la baisse de pression, au moins trois propriétés
pharmacologiques additionnelles différencient les â-bloquants
[88].
I.3.1. Activité sympathomimétique
intrinsèque
Classiquement, lorsque les récepteurs â sont
déjà occupés par un agent â-bloquant (un
antagoniste), toute action sympathomimétique est inhibée et
l'arrivée sur ces récepteurs d'un agent endogène
â-agoniste (comme l'adrénaline) ne peut pas avoir d'effet
stimulant. Certains â-bloquants (cartéolol, béfunolol,
pindolol) ont une action intermédiaire :
En occupant les récepteurs, ils provoquent tout de
même une réponse sympathomimétique
modérée ; mais ils restent des agents â-bloquants
à part entière, car ils s'opposent à l'action des
â-stimulants endogènes. Ces agents â-bloquants ont une
action dite « sympathomimétique intrinsèque »
(ASI) et sont qualifiés d'« agonistes partiels »
[81].
I.3.2. Effet stabilisant de membrane
Certains â-bloquants peuvent s'opposer aux
échanges ioniques transmembranaires, entraînant un effet
anesthésique local. Cette
« propriété » représente un danger
potentiel pour la cornée (risque d'ulcère). Aucun collyre
â-bloquant (à l'exception du bupranolol, non commercialisé
en France) ne possède actuellement un effet stabilisant de membrane
suffisamment important pour rendre ses instillations dangereuses
[76].
I.3.3. sélectivité
â1
La plupart des â-bloquants agissent simultanément
sur les récepteurs â1 et â2. Le blocage des
récepteurs â2 peut entraîner, chez des sujets
prédisposés, des complications broncho-pulmonaires et une
augmentation des résistances vasculaires périphériques
(syndrome de Raynaud, diminution du débit sanguin coronaire,
ischémie du nerf optique).
Le bétaxolol, produit à priori sans
action bloquante â2, est capable d'abaisser la PIO de manière
presque aussi importante que les autres produits, en diminuant donc les
risques de complications liées au blocage des récepteurs
â2. On parle de molécule «â1-sélective» ou
encore cardiosélective (sans effet broncho-pulmonaire)
[31].
I.4. Effets secondaires
I.4.1. Effets secondaires locaux.
Les â-bloquants sont, le plus souvent, parfaitement bien
tolérés localement, ce qui explique leur large utilisation. Ils
n'entraînent pas de modifications de la pupille, ni de l'accommodation.
Il n'y a aucune douleur à l'instillation. Les allergies au
â-bloquants sont très rares.
Si l'on mesure instrumentalement la sensibilité
cornéenne, elle est souvent un peu diminuée, même lorsque
l'activité stabilisante de membrane est très faible. Il faudrait
théoriquement en tenir compte chez des sujets présentant une
affection cornéenne.
Une diminution de la sécrétion lacrymale est
fréquente. Elle peut faire basculer un patient présentant une
hypolacrymie sans irritation fonctionnelle vers une sémiologie de
sécheresse oculaire patente, souvent mal supportée. L'irritation
locale peut persister, même après l'arrêt du traitement. Si
le collyre â-bloquant reste indispensable, il faut alors prescrire des
larmes artificielles. Les porteurs de lentilles cornéennes doivent
être prévenus et surveillés [47].
I.4.2. Effets secondaires
généraux
Le passage systémique des â-bloquants est assez
faible, mais suffisant chez des sujets prédisposés pour
entraîner des complications, parfois gravissimes. Ces complications sont
néanmoins rares, compte tenu de la fréquence de prescription de
ces collyres.
Complications cardiaques
Les â-bloquants sont responsables de bradycardives,
voire d'arythmies ou de syncopes (d'évolution parfois fatale). Les blocs
auriculo-ventriculaires de 2e et 3e degrés sont
donc des contre-indications absolues à la prescription de tels produits.
L'insuffisance cardiaque et les bradycardies sinusales sont des
contre-indications relatives (solliciter l'avis du cardiologue).
Les â-bloquants peuvent être impliqués dans
l'aggravation d'un syndrome de Raynaud, d'une artériopathie
oblitérante : ce sont des contre-indications relatives.
Autres complications décrites
Elles sont difficiles à imputer directement au
collyre : myasthénies, diminution de la libido, troubles
dépressifs, difficultés à l'équilibration d'un
diabète sucré par perturbations de la glycogénolyse
[60].
I.4.3. Phénomène
d'échappement
Il a été essentiellement décrit avec la
maléate de timolol, mais il est commercialisé depuis plus
longtemps que les autres collyres. Dans de rares cas, l'efficacité du
produit paraît effectivement disparaître, ou diminuer fortement,
après une durée d'instillation éminemment variable d'un
cas à l'autre. Sa nature est encore controversée : perte
d'action réelle du produit ou progression de la maladie
sous-jacente ? Le remplacement immédiat par un autre collyre
â-bloquant ne relance que rarement les variations de pression
après instillation. En revanche, une fenêtre thérapeutique,
encore appelée "wash-out", de 1 à 2 mois permet
fréquemment de récupérer l'action hypotensive du produit.
Certains conseillent empiriquement d'interrompre les instillations 1 ou 2 jours
par semaine, pour diminuer le risque d'apparition de cet échappement
[79].
I.5. Différents collyres
bêtabloquants
I.5.1. Maléate de timolol
Il est commercialisé sous sa forme lévogyre.
C'est le collyre â-bloquant de référence,
le premier commercialisé (1979 pour la France), et de loin le plus
prescrit à l'heure actuelle dans le monde. C'est un collyre
â-bloquant sans sélectivité â1 et sans ASI. Les
instillations sont dans l'immense majorité des cas parfaitement bien
tolérées. Il est disponible aux concentrations de 0,1 %, 0,25 %
et 0,50 %.
Une forme à libération prolongée a
été plus récemment mise à disposition, aux
concentrations de 0,25 % et 0,50 %. Le véhicule est un polysaccharide
anionique dérivé d'une gomme de gellane. En contact avec les
cations du film lacrymal précornéen, le produit forme un gel,
permettant au principe actif de rester sur le globe durant une longue
période, et autorisant a priori une seule instillation quotidienne.
Récemment sont apparus des collyres associant timolol
et pilocarpine, ou encore un collyre associant timolol et dorzolamide
[46].
I.5.2.Métipranolol
Il a beaucoup de points communs avec le timolol : c'est
un â-bloquant complet sans ASI. Il est disponible aux concentrations de
0,1 % 0,3 % et 0,6 %.
La tolérance locale en est globalement un peu moins
bonne, tout au moins avec les fortes concentrations, et les patients peuvent,
plus souvent qu'avec le timolol, se plaindre de brûlures et de
picotements à l'instillation en début de traitement.
Le métipranolol a une diffusion réduite dans
l'organisme (le passage sanguin n'est pas décelable par chromatographie
gazeuse), ce qui limiterait les effets latéraux cardiovasculaires
[1].
I.5.3. Cartéolol
C'est un â-bloquant puissant et non sélectif,
dont l'efficacité sur la baisse de pression est aussi meilleure que
celle du timolol. Il présente une forte ASI, avec les avantages
potentiels - oculaires et généraux - de cette
propriété. La tolérance locale est
généralement excellente.
Les â-bloquants peuvent intervenir sur les lipides
sanguins, en diminuant le taux de HDL- cholestérol (le
« bon » cholestérol) et en augmentant celui des
triglycérides. De manière significative, le cartéolol
diminue un peu moins le taux de HDL-cholestérol que le
timolol.
Il est commercialisé aux concentrations de 0,5 % 1% et
2%. Un collyre l'associe, en France, à la pilocarpine
[27].
I.5.4. Bétaxolol
C'est un collyre â-sélectif mais ne
possédant pas d'ASI. La fréquence des effets secondaires chez les
asthmatiques et les insuffisants respiratoires est diminuée par rapport
aux collyres non â-sélectifs. Bien que son action soit
« cardiosélective », le pouls cardiaque ne se
ralentit pas significativement à l'effort. Les autres avantages
potentiels d'un tel produit ont été présentés plus
haut.
Une forme à 0,50 %, entraînait fréquemment
une irritation locale à l'instillation, tout au moins pendant les
premières semaines du traitement. Le passage à une forme en
suspension à 0,25 % a permis une nette amélioration de la
tolérance locale tout en diminuant simultanément l'importance du
passage systémique [80].
I.5.5. Béfunolol
C'est un â-bloquant non sélectif, comparable au
cartéolol, car il présente comme lui une ASI. Il est peu
commercialisé dans le monde.
La tolérance locale à l'instillation est
pratiquement aussi bonne qu'avec le cartéolol. Par ailleurs, le collyre
commercialisé contient un principe mouillant, l'alcool polyvinylique,
qui peut améliorer cette tolérance chez des sujets
présentant une hypolacrymie.
Il est commercialisé aux concentrations de 0,25 % et
0,50 % [76].
I.5.6. Lévobunolol
C'est un â-bloquant non sélectif dépourvu
d'ASI.
Sa demi-vie est plus longue, grâce en particulier
à sa métabolisation en dihydrolévobunolol, et la baisse de
pression obtenue peut durer plus de 24 heures, ce qui pourrait autoriser une
seule instillation quotidienne, bien que l'autorisation de mise sur le
marché (AMM) français conseille deux instillations quotidiennes.
Les effets secondaires locaux et généraux sont identiques
à ceux du timolol. Les phénomènes d'échappement
seraient moins importants qu'avec le timolol. Il est disponible aux dosages de
0,10 % et 0,50 % [9].
II Agonistes á - adrénergiques (ou
sympathomimétiques)
II.1. Agonistes á-adrénergiques non
sélectifs (Mydriatiques)
L'action hypotensive oculaire de l'adrénaline est
connue depuis le début du siècle. Mais il fallut attendre la
diffusion de la pratique de la gonioscopie, vers 1950, pour repérer la
contre-indication majeure représentée par l'étroitesse de
l'angle iridocornéen, et pour prescrire les agonistes á -
adrénergiques dans le traitement des glaucomes [76].
II.1.1. Mode d'action
L'adrénaline est un stimulateur non sélectif de
l'ensemble des récepteurs sympathomimétiques : â1,
â2, á1 et á2... qui sont eux-mêmes retrouvés
dans la plupart des tissus intraoculaires. Plusieurs mécanismes, dont
certains sont encore mal connus, participent à la baisse de
pression :
-La sécrétion d'humeur aqueuse est
légèrement diminuée les premières minutes suivant
l'instillation, par vasoconstriction ciliaire (á2)... mais elle augmente
secondairement (augmentation de l'ultrafiltration par stimulation â2,
augmentation de l'activité des cellules ciliaires
épithéliales non pigmentées par stimulation á2).
-L'action prédominante est une augmentation de la
facilité d'écoulement par stimulation de récepteurs
trabéculaires, essentiellement â2. Cette diminution de la
résistance à l'écoulement serait provoquée par une
fragmentation du cytosquelette et vraisemblablement, en activant une
hyaluronidase locale via une production d'AMPc.
-L'adrénaline semble aussi augmenter la
perméabilité des voies uvéosclérates (voir
prostaglandines), car il peut encore faire baisser la PIO alors que l'angle
iridocornéen est synéchié sur 360°. L'implication de
prostaglandines endogènes dans ce mécanisme est probable, car
l'administration d'indométacine diminue l'effet hypotenseur oculaire de
l'adrénaline.
-Enfin, l'adrénaline pourrait également agir sur
le flux sanguins intraoculaires et sur la pression veineuse
épisclérale, dont on sait qu'ils interviennent à des
degrés variables dans la régulation de la PIO.
En dehors de l'action sur la PIO, l'adrénaline
entraîne une mydriase par stimulation des récepteurs â du
dilatateur de l'iris, et des effets constricteurs puis dilatateurs sur les
vaisseaux conjonctivaux traduisant une excitation couplée des
vasorécepteurs á (constriction) et â (dilatation)
[10, 87].
II.1.2. Pharmacocinétique
Lorsqu'elle est instillée, l'adrénaline (ou la
dipivéphrine) provoque une chute de la PIO d'environ 30 à 40 %,
débutant dès la 15e minute, maximale entre la
4e et 6e heure, restant forte de 12 à 18 heures,
et persistant parfois au-delà de 24 heures. Cet effet est sensiblement
identique à celui obtenu par un collyre â-bloquant. Une ou deux
instillations par jour sont donc efficaces à couvrir le
nycthémère, et cette efficacité n'est pas augmentée
si l'on accroît le nombre d'instillations quotidiennes
[74].
II.1.3. Effets secondaires
Ils sont nombreux et freinent considérablement leur
prescription, vouée à disparaître progressivement à
cause de l'émergence des nouvelles familles thérapeutiques
antiglaucomateuses dont la tolérance est meilleure.
II.1.3.1. Effets secondaires locaux
- Mydriase modérée, peu gênante
fonctionnellement, mais pouvant créer de véritables fermetures de
l'angle iridocornéen chez les sujets prédisposés au
blocage pupillaire. Ce risque impose une gonioscopie et une évaluation
clinique de la profondeur de la chambre antérieure avant la prescription
d'un sympathomimétique, lorsqu'une iridectomie n'est pas
présente.
- Brûlures à l'instillation assez
fréquentes, qui diminuent souvent en intensité après
quelques jours de traitement.
- Céphalées, parfois insupportables, qui peuvent
justifier l'interruption du traitement.
- Hyperhémie conjonctivale habituelle, après une
phase immédiate de blanchiment, qui survient vers la 5e heure
après l'instillation.
- Blépharoconjonctivite allergique.
- Apparition de dépôts pigmentaires
noirâtres d'adénochrome après un traitement
prolongé, sur le bord des paupières. La conjonctive, et parfois
l'épithélium cornéen qui sont sans conséquence. Les
lentilles cornéennes de contact peuvent être colorées
après plusieurs semaines de traitement.
- Rarement, chute des cils, sténose des points
lacrymaux ou formation de calculs lacrymaux.
- Toxicité endothéliale cornéenne
discutée.
- OEdème maculaire cystoïde, qui pourrait survenir
chez certains sujets âgés aphaques après plusieurs mois de
traitement, régressant en principe à l'arrêt du traitement.
La nature « vasospastique » du processus est
suspectée.
II.1.3.2. Effets secondaires généraux
L'adrénaline instillée passe dans la circulation
sanguine, et peut donc entraîner des effets circulatoires
généraux tels que la tachycardie, extrasystoles, palpitations et
anxiété, voire augmentation de la pression artérielle.
L'adrénaline doit donc être contre-indiquée chez les grands
hypertendus artériels, les sujets âgés
artérioscléreux, où l'adrénaline pourrait
être impliquée [38, 41].
II.1.4. Différents agonistes
á-adrénergiques non sélectifs
II.1.4.1. Adrénaline
L'adrénaline est utilisée localement, sous forme
de chlorhydrate, de bitartrate ou d'adrénaline base, dans des
préparations de 1 %. Une forme à 1 % est associée
à l'acéclidine [52].
II.1.4.2. Dipivéphrine
Elle est obtenue en rajoutant deux radicaux d'acide pivalique
à l'adrénaline, dont elle est une prodrogue. Intacte, elle n'a
qu'une très faible activité pharmacologique. Elle est plusieurs
centaines de fois plus lipophile que l'adrénaline, et traverse donc
beaucoup plus facilement la cornée. A l'intérieur de celle-ci, la
dipivéphrine est rapidement hydrolysée en adrénaline par
les estérases locales, le processus étant entièrement
terminé à l'intérieur de la chambre antérieure. La
biodisponibilité de l'adrénaline est donc très
augmentée et, à activité hypotensive égale, la
dipivéphrine peut être beaucoup moins concentrée (0,1 %).
Certains effets latéraux, locorégionaux mais surtout
généraux, sont ainsi diminués, mais il faut retenir que se
trouve une quantité identique d'adrénaline à
l'intérieur de l'oeil (mydriase, risque maculaire). La
dipivéphrine a déjà largement remplacé
l'adrénaline dans le traitement du glaucome, mais l'expérience
montre que de rares patients préfèrent le collyre à
l'adrénaline plutôt qu'à la dipivéphrine
[74].
II.2. Agonistes á-adrénergiques
sélectifs (ou á2-adrénergiques)
II.2.1. Clonidine
Le développement en ophtalmologie des agonistes
á2- adrénergiques a débutée avec la
découverte de l'action hypotensive de la clonidine. Cette
dernière diminue la PIO de façon rapide (dès la 2e heure),
elle est puissante (diminution de 3 à 4 mmHg chez le sujet sain) et
sensible (composé actif à la dose de 0,125 %). En instillation
répétée, la clonidine entraîne malheureusement une
hypotension artérielle marquée, de nature orthostatique, peu
compatible avec son utilisation dans une pathologie où l'apport
vasculaire au nerf optique doit justement être préservé. La
baisse de pression artérielle est liée au passage
encéphalique de la molécule lipophile, ce qui a pour effet
d'activer les récepteurs á2- adrénergiques
présynaptiques et les récepteurs centraux. Les effets
potentiellement néfastes de la clonidine sur le nerf optique ont
considérablement limité son développement en ophtalmologie
[33].
II.2.2. Apraclonidine
La synthèse de molécules imidazoliniques ne
franchissant pas la barrière hématoencéphalique a permis
de limiter les effets centraux de la clonidine.
L'apraclonidine, ou p-aminoclonidine, est un de ces
prototypes. L'apraclonidine diffère de la clonidine par
l'adjonction en C4 d'un radical amine-NH2, rendant la molécule plus
hydrophile. Cette modification chimique n'altère pas significativement
les propriétés hypotensives oculaires de la clonidine, mais sa
structure polaire lui confère une perméabilité
limitée de la barrière hématoencéphalique et donc
un risque faible d'hypotension artérielle [16].
II.2.2.1. Mode d'action
L'apraclonidine réduit la sécrétion
ciliaire de l'humeur aqueuse (30 à 35 %) sans perturber ses
capacités d'écoulement trabéculaire. Cet effet est
médié par les sites récepteurs
á2-adrénergiques présents dans l'épithélium
ciliaire. Elle peut réduire la PIO à des valeurs très
basses, parfois au niveau ou en deçà de la pression veineuses
épisclérale (9 mmHg). L'instillation unique ou
répétée d'apraclonidine entraîne une
vasoconstriction locale limitée au segment antérieur de l'oeil
(par stimulation des récepteurs á1- adrénergiques), sans
effet significatif sur la circulation papillaire. La vasoconstriction a pour
autre conséquence de stabiliser la barrière hématoaqueuse,
ce qui explique probablement l'efficacité particulière de
l'apraclonidine dans la prévention des pics hypertenseurs induits par le
laser. l'apraclonidine ne modifie pas significativement le flux
uvéoscléral de l'humeur aqueuse. Comparativement aux
â-bloquants peu efficaces la nuit, les agonistes á2 demeurent
actifs durant tout le nycthémère , ce qui leur confère un
avantage clinique supplémentaire. L'explication de ce
phénomène n'est pas claire mais l'apraclonidine pourrait
réprimer de façon permanente l'activité basale de
l'adénylate cyclasse ciliaire, même lorsque celle-ci est à
un niveau minimal (période nocturne) [43].
II.2.2.2. Indications
Le développement de l'apraclonidine a d'abord
concerné son utilisation dans les procédures pratiquées au
laser : iridotomies et capsulotomies au laser Nd : YAG,
trabéculoplastie au laser argon. La réaction uvéale
inflammatoire observée au décours de ces interventions
s'accompagne fréquemment d'une phase hypertonique initiale. La
focalisation du faisceau laser sur les tissus oculaires s'accompagne d'une
rupture de la barrière hématoaqueuse avec libération
intracamérulaire de médiateurs de l'inflammation
présentant une action hypertonisante. L'élévation de la
PIO est logiquement plus importante chez les patients glaucomateux dont les
capacités trabéculaires sont diminuées ; ses
conséquences sont, elle aussi, plus graves du fait de l'hypertonie
préexistante.
Son efficacité est supérieure aux autres
médicaments antiglaucomateux (pilocarpine, acétazolamide,
â-bloquants) ou aux corticoïdes locaux, et son utilisation est
dénuée des complications allergiques locales observées
lors d'un traitement chronique. L'efficacité de l'apraclonidine diminue
l'incidence et la gravité des pics hypertoniques postopératoires.
Le champ d'action de l'apraclonidine s'est rapidement élargi au
traitement du glaucome chronique à angle ouvert. Chez des patients
glaucomateux, la diminution moyenne de la PIO avoisine 25 %, ce qui est
comparable à ce que l'on observe avec un â-bloquant. Les
données pharmacodynamiques indiquent une durée d'action
significative pendant 8 heures, Pour certains, l'efficacité de
l'apraclonidine sur la PIO diminue progressivement avec le temps chez un nombre
relativement important de patients.
Chez des patients présentant un glaucome non
contrôlé médicalement et conservant leur traitement
topique, l'apraclonidine à la concentration à 0,5 % permet une
réduction supplémentaire de la PIO de l'ordre de 3 mmHg à
différents moments de la journée au bout de 90 jours. Même
si cette réduction peut sembler faible en valeur absolue, le gain
thérapeutique permet de retarder le « moment de la
chirurgie » chez 60 % des patients (contre 32 % dans le groupe
témoin). Une propriété intéressante de
l'apraclonidine est donc de manifester une efficacité à un stade
avancé de la maladie, alors que le patient est déjà soumis
à un traitement lourd.
Ainsi on peut raisonnablement penser que la molécule
peut être utilisée dans toutes les circonstances d'hypertonie
oculaire aiguë qui requièrent d'emblée une association
médicamenteuse, comme dans le glaucome aigu par fermeture de l'angle ou
les glaucomes réfractaires, ou les hypertonies oculaires de nature
inflammatoire (glaucome associée à une uvéite, syndrome de
Posner-Schlossman, glaucome traumatique ou néovasculaire) [65,
66].
II.2.2.3. Associations
Bien que partageant le même site d'action (procès
ciliaires), l'association d'apraclonidine et d'un â-bloquant est
synergique. Chez des patients traités par timolol à 0,5 % et dont
la PIO n'est pas maîtrisée, l'addition d'un traitement par
apraclonidine à 0,5 % ou à 1 % administré deux fois par
jour permet une réduction supplémentaire de la PIO de l'ordre de
20 %. L'effet persiste après un traitement combiné de 3 mois,
atteignant 5 mmHg 3 heures après la dernière instillation, 3 mmHg
8 heures après celle-ci. L'effet sur la pression de l'apraclonidine
à 0,5 % chez des patients traités médicalement persiste
au bout de 2 ans, la PIO étant réduite en moyenne de 20 %.
Environ 20 % des patients ne sont plus contrôlés
médicalement au décours de cette période, suggérant
que le glaucome a progressé ou que la molécule a perdu une partie
de son activité (tachyphylaxie) [82].
II.2.2.4. Effets secondaires
Le profil de tolérance de l'apraclonidine constitue
indiscutablement un facteur limitant pour une utilisation importante. Ce n'est
pas tant les complications cardiovasculaires du médicament
á2-adrénergique que les effets indésirables oculaires qui
sont redoutés. Du fait d'un passage limité de la barrière
hématoencéphalique. La prudence est de règle chez les
patients présentant une pathologie cardiovasculaire sévère
ou instable, en raison du tropisme de la molécule pour le système
nerveux végétatif.
L'effet indésirable systémique le plus souvent
rapporté est La sécheresse de la bouche, relativement bien
tolérée, car elle diminue avec le temps. La sensation d'un
goût amer dans la bouche est parfois observée (3 %), mais est
simplement passagères et sans conséquence.
-une sécheresse nasale (2 % des cas).
-Autres symptômes sont décrits mais avec une
faible fréquence : asthénie (< 3 %), somnolence,
céphalées (< 3 %), rhinite, malaise, myalgies, dyspnée
asthmatiforme.
L'utilisation prolongée de l'apraclonidine peut
être responsable d'une intolérance oculaire de nature
vraisemblablement allergique: hyperhémie conjonctivale, chémosis,
réactions eczématiformes [56, 86].
II.2.3. Brimonidine
La brimonidine est une imidazoline hautement sélective
des récepteurs á2-adrénergiques dont la structure chimique
est proche ce celle de la clonidine et de l'apraclonidine, mais plus lipophile
que cette dernière. La baisse de PIO observée après
instillation de brimonidine est liée à une diminution de
production de l'humeur aqueuse, avec un effet possible sur son
élimination uvéosclérale.
Tout comme l'apraclonidine, la brimonidine à 0,5 %
administrée selon un protocole similaire s'oppose efficacement à
l'hypertonie oculaire accompagnant la trabéculoplastie au laser argon.
L'effet sur la pression de la brimonidine à 0,2 % instillée deux
fois par jour est globalement comparable à celle du timolol à 0,5
%. Bien que partageant le même mécanisme d'action, l'association
aux collyres â-bloquants (en cas d'inefficacité
thérapeutique) est synergique. Comparativement à l'apraclonidine,
la brimonidine ne semble pas donner lieu à des phénomènes
d'échappement thérapeutique (tachyphylaxie)
[85].
Effets indésirables
Les principaux effets indésirables rencontrés
avec la brimonidine sont principalement de nature systémique,
liés au passage de la barrière hématoencéphalique
de la molécule : sécheresse buccale, fatigue et somnolence.
Même si la fréquence cardiaque ou la pression artérielle
sont peu perturbées par l'instillation de brimonidine, la prudence doit
être de mise chez les patients présentant des
antécédents cardiovasculaires sérieux. La fréquence
des effets systémiques semble supérieure à celle
occasionnée par l'apraclonidine. La brimonidine donne lieu à des
réactions d'intolérance locale de nature allergique dont
l'incidence est significative (5 % à 3 mois, environ 12 % au bout de 1
an) [58].
III. Cholinergiques (ou Myotiques)
Pendant longtemps au centre de la pharmacopée
antiglaucomateuse, les myotiques sont maintenant relégués au
second plan du fait du développement de nouvelles classes
thérapeutiques. En dépit d'une tolérance locale variable,
les myotiques demeurent cependant des médicaments efficaces dans le
traitement du glaucome [76].
III.1. Mode d'action
L'effet cholinergique peut être reproduit par les
parasympathomimétiques directs et les anticholinestérasiques. Ces
derniers inactivent l'acétylcholinertérase, enzyme chargée
d'hydrolyser l'acétylcholine, et augmentent la concentration
d'acétylcholine dans la fente synaptique. Les molécules qui se
fixent de façon compétitive sur les récepteurs
postsynaptiques muscariniques sont les parasympathomimétiques directs
comme la pilocarpine (le chef de file), la méthacholine, le carbachol
et l'acéclidine.
Les deux phénomènes pharmacologiques
observés après instillation de parasympathomimétiques sont
le myosis et la contraction du muscle ciliaire. Les effets des myotiques sur la
sécrétion de l'humeur aqueuse sont discutés et leur action
réside essentiellement en une diminution de la résistance
à l'écoulement trabéculaire. Alors que la racine de l'iris
entre en contact avec le muscle ciliaire et le trabéculum uvéal,
les fibres longitudinales du muscle ciliaire s'insèrent fortement
à l'éperon scléral et, par son intermédiaire,
à la partie postérieure du trabéculum
cornéoscléral. La contraction du muscle ciliaire se transmet
à ces deux dernières structures par l'intermédiaire de
leur insertion commune, l'éperon scléral, provoquant une
rotation postérieure de 15° de l'éperon scléral.
L'éperon exerce une traction mécanique rapide sur les mailles
intertrabéculaires, ce qui a pour effet de les ouvrir « en
éventail ». L'élargissement concomitant des espaces
intertrabéculaires facilite l'écoulement de l'humeur aqueuse. Un
effet direct sur l'activité biochimique des cellules
trabéculaires contribuerait également à la baisse de PIO.
A contrario, les myotiques réduisent l'évacuation
uvéosclérale de l'humeur aqueuse, ce qui peut expliquer certaines
hypertonies paradoxales lors de la prescription de pilocarpine chez un patient
présentant un angle aux fonctions compromises (lors d'une
récession traumatique de l'angle) [75].
III.2. Pharmacocinétique
La pilocarpine, extraite d'une plante rutacée
sud-américaine, le pilocarpus jaborandi, possède, comme la
plupart des alcaloïdes, une bonne pénétration
cornéenne du fait de son profil mixte hydrosoluble et liposoluble. Sa
biodisponibilité dépend de facteurs locaux, en particulier de la
teneur en mélanine des tissus uvéaux. En effet, le pigment
mélanique est capable de fixer de façon non spécifique la
drogue et donc d'en modifier sa pharmacocinétique. Cette notion de
susceptibilité individuelle nécessite de vérifier
l'efficacité d'un faible dosage de pilocarpine (1 ou 2 %) avant
d'augmenter la concentration du collyre. Chez le mélanoderme, la
pilocarpine présente un effet pressionnel moins important mais plus
prolongé (dosage à 4 %). Enfin, l'augmentation de la
concentration du collyre myotique s'accompagne surtout d'un allongement de la
durée d'action du produit et non pas de l'intensité de l'effet
induit [76].
III.3. Mode d'administration
En collyre, la pilocarpine possède une durée
d'action limitée, ce qui nécessite théoriquement une
triple instillation sur le nycthémère, ne favorisant pas ainsi
l'observance thérapeutique. Cela explique le développement de
nombreuses formes galéniques, qu'il s'agisse d'émulsions, de gels
visqueux ou d'implants thérapeutiques solubles, permettant une
augmentation du temps de contact cornéen ou une libération
constante et prolongée du PA (jusqu'à 8 jours) ainsi qu'une
réduction de ses effets latéraux.
A la posologie utilisée, l'effet pharmacologique du
carbachol est principalement dû à l'activation des
récepteurs muscariniques. L'acéclidine 2 %, cholinergique de
synthèse, s'avère également aussi efficace que la
pilocarpine, avec des effets secondaires moins accusés. Le rythme
d'administration est de l'ordre de quatre fois par jour.
Bien que leur pharmacocinétique prolongée
autorise une réduction du nombre des instillations (une seule fois par
jour le soir au coucher pour l'écothiopate iodure ou Phospholine iodide
®), les anticholinestérasiques organophosphorés sont peu
utilisés en clinique du fait de leurs effets secondaires marqués
[75].
III.4. Effets secondaires
Les effets indésirables des
parasympathomimétiques sont surtout locaux et liés à la
stimulation des sites muscariniques du :
- Sphincter irien (myosis, effet sténopéique,
baisse de vision nocturne)
- Muscle ciliaire (spasme d'accommodation pendant 2 heures
après instillation, pseudomyopie induite particulièrement chez
les sujets jeunes ou myopes, décollement postérieur du
vitré, rupture de la barrière hématoaqueuse)
- de la glande lacrymale (larmoiement réflexe,
irritation palpébrale).
Pour ces raisons, une bonne indication de la pilocarpine est
le glaucome chronique à angle ouvert survenant chez le pseudophaque.
Toute prescription de myotique nécessite un examen soigneux
régulier de la périphérie rétinienne du fait du
risque de décollement de rétine (traction
vitréorétinienne par contraction ciliaire). La dilatation
maximale permet également d'éviter les synéchies
postérieures dues au myosis prolongé. La diminution de profondeur
de la chambre antérieure (- 0,25 mm) est surtout observée avec la
pilocarpine.
Ces complications sont réduites avec certains
cholinergiques de synthèse (acéclidine) ou par les gels et
émulsions de pilocarpine. En revanche, les
anticholinéstérasiques au long cours sont plus irritant, et
peuvent entraîner une rigidité plastique de l'iris ainsi que la
formation de kystes iriens par rupture de la barrière
hémato-aqueuse. Ils seraient en outre responsables d'un effet
cataractogène (opacités ioniques à travers la capsule
cristallinienne).
Si l'action des anticholinestérasiques est plus
prolongée, les effets indésirables locaux (myosis) et surtout
généraux (sensibilité accrue au curare en cas
d'anesthésie générale responsable d'une véritable
« intoxication cholinergique » marquée par des
douleurs abdominales et des diarrhées, d'une bradycardie et d'une
hypotension artérielle) limitent l'utilisation de ces drogues dans la
thérapeutique antiglaucomateuse [76].
IV. Les prostaglandines
Les prostaglandines sont des produits de l'acide arachidonique
(par l'intermédiaire de l'intervention d'une cyclo-oxygènase),
acide gras polyinsaturé, lié aux phospholipides membranaires de
la plupart des cellules de mammifères. Elles forment une famille
extrêmement complexe, agissant telles des hormones locales
(« autacoïdes ») pour induire des effets
physiologiques et pharmacologiques très variés, confinés
au niveau de l'organe qui les synthétise.
Elles sont connues depuis longtemps des ophtalmologistes pour
leur rôle dans les processus inflammatoires oculaires. Mais ces
molécules peuvent intervenir aussi - entre autres - sur le
métabolisme aqueux, soit en augmentant, soit en diminuant la pression
intraoculaire selon les molécules et les espèces.
Les travaux les plus importants ont abouti à retenir la
molécule appelée PhXA 41 ou latanoprost, première
prostaglandine disponible pour traiter hypertensions intraoculaires et
glaucomes [2].
IV.1. Mode d'action
La tonographie et les études fluorophotomériques
ont démontré que les prostaglandines abaissent la PIO en
augmentant la facilité d'écoulement de l'humeur aqueuse, mais
qu'elles ne réduisent pas la sécrétion aqueuse, et
qu'elles n'augmentent pas (aux doses usuelles) l'excrétion
trabéculaire.
Les prostaglandines se fixent sur des récepteurs
prostanoïdes, le latanoprost est, au niveau du muscle ciliaire, un
agoniste sélectif du récepteur appelé FP. Cette
sélectivité explique l'absence ou la modestie des effets
latéraux habituellement observés avec d'autres
prostaglandines.
Elles agissent en réalité en augmentant la
résorption uvéosclérale, comme l'ont
démontré l'utilisation de substances radioactives, mais le
mécanisme précis de cette action est encore incomplètement
établi. A l'intérieur du muscle ciliaire, les espaces entre les
fibres sont élargis, peut-être grâce à un
relâchement des fibres musculaires, mais plus certainement grâce
à une perte ou une modification du matériel extracellulaire par
l'intervention de collagénases. Cet effet est réversible en
quelques jours. Le trabéculum se trouve ainsi exagérément
concurrencé par un "by-pass" de l'humeur aqueuse, sorte de
cyclodialyse chimique [83, 49].
IV.2. Pharmacocinétique
Le dosage optimal retenu a été, avec le
latanoprost, celui de 0,005 %. La baisse de la PIO débute 3 à 4
heures après l'instillation, est maximale entre la 8e et la 12e heure,
et persiste encore à la 24e heure. Cette longue durée d'action
autorise une seule instillation par jour. Appliqué le soir, le
latanoprost diminue la PIO moyenne diurne plus significativement que ne le fait
le timolol (27 à 34 %, contre plutôt 20 à 33 % pour le
timolol)... alors qu'appliqué le matin, le latanoprost a la même
action que le timolol. Cette efficacité reste identique à 6 mois,
et à 1 an. IL est efficace pour entraîner une baisse la PIO
même lorsque celle-ci est inférieure à 20 mmHg, et peut
donc être prescrit dans les cas de glaucome à pression normale
[3].
Le latanoprost peut être combiné à
d'autres thérapeutiques antiglaucomateuses pour renforcer la baisse de
pression :
- les â-bloquants, avec une baisse supplémentaire
de la PIO d'environ 15 %.
- la pilocarpine. Cet effet additionnel peut paraître
surprenant, car la pilocarpine augmente la contraction du muscle ciliaire, et
l'on pourrait s'attendre à une inefficacité du latanoprost
lorsque le patient reçoit déjà un myotique. Cela ne se
vérifie donc pas en pratique, tout au moins en utilisant de la
pilocarpine à 2 %, la combinaison des deux drogues entraînant une
baisse de pression plus importante que chacune d'elles instillée
isolément [71].
IV.3. Effets secondaires
a- Systémiques
Vraisemblablement parce que latanoprost se retrouve à
une concentration plasmatique extrêmement faible, de surcroît avec
un métabolisme rapide, aucun effet systémique ne fut
signalé (pouls, tension artérielle, appareil respiratoire,
examens biologiques) [76].
b- Oculaires
Chez l'homme, le latanoprost n'a aucun effet sur la taille de
l'iris et sur l'accommodation.
Le latanoprost a très peu d'affinité avec les
récepteurs qui interviennent dans la réponse inflammatoire (EP2),
ce qui explique la bonne tolérance locale rapportée. En revanche,
une hyperhémie conjonctivale chronique est parfois signalée (dans
mois de 5 % des cas) sans différence entre les instillations faites le
soir ou le matin.
Quelques rares cas indiquent la possibilité d'un
oedème maculaire cystoïde, chez des yeux ayant subi une chirurgie
de la cataracte compliquée, mais qui paraît totalement
réversible à l'arrêt du traitement.
Le seul problème est celui d'une possible pigmentation
irienne (essentiellement pour les iris à la coloration partiellement
brune) [73].
V. Inhibiteurs de l'anhydrase carbonique
(IAC)
Les Inhibiteurs de l'anhydrase carbonique (IAC) sont
principalement représentés par les sulfonamides aromatiques
hétérocycliques dont le chef de file est l'acétazolamide.
Ils sont efficaces pour réduire la PIO dans les glaucomes primitifs,
dans les glaucomes associés à une anomalie
développementale de l'angle iridocornéen ou dans les glaucomes
secondaires, le dorzolamide autorise maintenant une prescription locale
[34].
Mode d'action
Ils réduisent la sécrétion de l'humeur
aqueuse d'environ 40 à 60%. Cet effet est probablement dû à
l'inhibition de l'anhydrase carbonique présente dans
l'épithélium ciliaire non pigmenté (sous forme d'isoenzyme
de type II et IV). Même si l'acidose observée dans les comas
métaboliques s'accompagne d'une profonde hypotonie oculaire, de nombreux
arguments expérimentaux plaident pour un mécanisme d'action
purement ciliaire. L'anhydrase carbonique a pour rôle de catalyser la
réaction d'hydratation du gaz carbonique avec production de bicarbonates
et de protons. L'acétazolamide diminue la production de bicarbonates et
modifie le pH intracellulaire épithélial, ce qui a pour effet de
bloquer la sortie du sodium et donc de limiter les flux liquidiens hors de la
cellule épithéliale ciliaire [10].
V.1. Inhibiteurs de l'anhydrase carbonique prescrits
per os ou par voie parentérale
Ils se limitent souvent à l'acétazolamide,
d'autres IAC sont employés comme : méthazolamide ou
dichlorophénamide.
V.1.1. Administration
La posologie utilisée pour l'acétazolamide varie
de 150 à 750 mg pour la forme orale, répartie harmonieusement en
3, voire 4, prises toutes les 8 heures, et est de 500 mg sous forme injectable
intraveineuse éventuellement renouvelable. Des doses inférieures
sont préférées chez les patients dont le poids corporel
est bas (15 mg/kg/j chez l'enfant par voie orale ; 5 à 10 mg/kg/ 6h
par voie intraveineuse).
Le méthazolamide possède une durée
d'action supérieure à celle de l'acétazolamide, permettant
d'espacer la posologie. Les doses utilisées étant moins
élevées, le méthazolamide peut être plus facilement
prescrit au long cours. La voie veineuse est très utile dans la crise de
glaucome aigu du fait des vomissements. Le recours aux IAC permet de
réduire rapidement la PIO, de diminuer l'ischémie relative dont
souffrent les muscles iriens et donc d'optimiser l'action des myotiques.
L'augmentation des doses de l'acétazolamide au-delà de ces
limites est inefficace, voire nocive, par augmentation de la diurèse
alcaline (due à l'élimination urinaire des bicarbonates)
[10].
II.4.2.2. Effets secondaires
La prescription de l'acétazolamide n'est pas sans
danger et un nombre considérable de sujets glaucomateux ne peuvent
poursuivre leur traitement du fait de la survenue d'effets
indésirables :
- L'acidose métabolique, qui se traduit par une
altération de l'état général (anorexie,
asthénie, amaigrissement) et une perte de la libido. Les lithiases
urinaires et les coliques néphrétiques sont liées à
l'acidose métabolique et à la diminution de l'élimination
rénale des citrates (Le méthazolamide présente des effets
secondaires rénaux moins prononcés). Ce risque, qui
s'atténue après la première année de traitement,
peut être limité par la prise de bicarbonates ou de citrates.
- L'hypokaliémie, à l'origine de
paresthésies des extrémités et d'une faiblesse musculaire,
doit être recherchée par un dosage de la kaliémie au
moindre doute, par un électrocardiogramme, et peut être
prévenue par l'adjonction de potassium (comprimés, sirops,
agrumes, bananes ou fruits secs) qui n'est généralement prescrite
qu'après diagnostic de l'hypokaliémie. En effet, la diminution du
potassium sanguin est généralement transitoire et survient le
plus souvent en début de traitement. Elle est plus fréquente
lorsque d'autres médicaments hypokaliémiants (corticoïdes,
digitaliques) sont parallèlement prescrits.
D'autres effets secondaires sont également
décrits : intolérance digestive, mauvais goût avec les
boissons gazeuses, myopie transitoire, rashs cutanés, aplasie
médullaire de mécanisme idiosyncratique mais dont la survenue
n'est pas liée à la dose cumulée.
L'ophtalmologiste doit être ainsi alerté lorsque
le patient présente des signes en faveur d'une aplasie
médullaire, tels que des ecchymoses inexpliquées, des
pétéchies, une anémie symptomatique ou la survenue
d'infections à répétition. La prudence est aussi de
règle chez les insuffisants cardiaques, chez les diabétiques
(hyperglycémie induite et risque de coma acidocétosique).
Les insuffisances d'origine hépatique, respiratoire ou
rénale, représentent des contre-indications absolues au
traitement [76].
V.2. Inhibiteurs de l'anhydrase carbonique par voie
locale
Près de 40 ans se sont écoulés entre la
découverte de l'effet sur la pression de l'acétazolamide et la
mise sur le marché du dorzolamide, les pharmacologues se sont rapidement
accordés l'intérêt des formes topiques des IAC, permettant
une diminution des effets indésirables systématiques de la
molécule. Bien que de nombreuses molécules conjuguent les
propriétés galéniques et biologiques requises, seul le
dorzolamide a suffisamment été développé pour
être actuellement disponible en clinique.
Un intérêt majeur des IAC sous forme locale est
l'amélioration du profil de tolérance systématique du fait
de la vectorisation oculaire. La dose journalière maximale d'une goutte
de dorzolamide à 2 % instillé trois fois par jour dans les deux
yeux est de 6 mg, ce qui correspond à une quantité
négligeable, par rapport à celle apportée par
l'acétazolamide par voie orale [61].
V.2.1. Pharmacocinétique
Chez des patients présentant une hypertonie oculaire,
le dorzolamide à 2%, administré trois fois par jour, diminue la
PIO d'environ 16 %, l'effet maximal étant obtenu 2 heures après
installation. Huit heures après, l'efficacité du dorzolamide
diminue pour se stabiliser à environ 15 % des valeurs initiales. Le
choix de la concentration de 2 % correspond au sommet de la courbe dose-effet
et assure une stabilité de l'activité pharmacologique sur le long
terme. Des études cliniques ont comparé l'effet hypotonisant
oculaire du dorzolamide à 2 % instillé deux à trois fois
par jour. Les deux schémas posologiques entraînent une
réduction globalement similaire de la PIO, mais l'analyse des courbes
nycthémérales indique que l'effet sur la pression est
prolongé en fin de journée par l'administration triquotidienne.
En monothérapie, ce schéma posologique est ainsi logiquement
préconisé alors qu'en association médicamenteuse, une
simple instillation biquotidienne, peut suffire pour contrôler
durablement la PIO dans la plupart des cas [50].
V.2.2. Effets secondaires :
Les principaux effets indésirables avec le dorzolamide
sont locaux : brûlures à l'instillation (environ 10 à
15 % des patients), démangeaisons et picotements oculaires. Une
conjonctivite allergique est notée chez environ 6 % des patients,
survenant typiquement 4 à 6 semaine après l'introduction du
collyre. Il est intéressant d'observer que les patients allergiques aux
sulfamides ne sont pas particulièrement sujets à une allergie
oculaire au dorzolamide. Un goût amer dans la bouche est signalé
par plus d'un patient sur quatre traité avec le dorzolamide sans que cet
effet indésirable soit gênant. La présence d'anhydrase
carbonique dans la cornée et l'accumulation intracornéenne de son
précurseur ont fait craindre un effet néfaste du dorzolamide sur
les échanges hydroélectrolytiques cornéens.
Plusieurs études menées chez l'homme font
mention d'une augmentation modérée de l'épaisseur
cornéenne après 4 à 6 semaines de traitement, sans que la
densité cellulaire endothéliale cornéenne soit apparemment
perturbée. La prudence doit être de règle en cas
d'utilisation chez des patients dont la fonction endothéliale
cornéenne est défaillante [84].
V.2.3. Comparaison avec
l'acétazolamide
Des études préliminaires indiquent que le
patient sous acétazolamide par voie orale peut être traité
avec le dorzolamide sans modification significative de l'efficacité
(mais avec suppression des effets indésirables systématiques).
Dans la majorité des cas, la PIO n'est pas
significativement modifiée lorsque le dorzolamide est remplacé
par l'acétazolamide. Il est cependant démontré qu'une dose
quotidienne de 500 mg d'acétazolamide est plus efficace q'une
instillation triquotidienne de dorzolamide à 2 % dans le contrôle
des pics hypertoniques oculaires survenant après chirurgie de la
cataracte. De même, chez les sujets volontaires sains, l'inhibition de la
sécrétion de l'humeur aqueuse est plus marquée avec
l'acétazolamide (administré à fortes doses) qu'avec le
dorzolamide. L'apparente supériorité clinique de
l'acétazolamide pourrait s'expliquer par des différences d'ordre
pharmacocinétique (voie orale, voie topique) ou pharmacologique
(inhibition de l'isoenzyme de type II pour le dorzolamide, inhibition des
isoenzymes II et IV pour l'acétazolamide).
En pratique, le remplacement de l'acétazolamide par le
dorzolamide (choix judicieux en cas de glaucome unilatéral, de
traitement de l'oeil non opéré dans les suites d'une chirurgie
filtrante controlatérale) doit faire l'objet d'une attention
particulière, la PIO devant être systématiquement
vérifiée. L'association de deux IAC pourrait aboutir à un
gain de pression, mais est peu recommandée du fait du risque de
potentialisation des effets indésirables.
Dans les situation aiguës (glaucome par fermeture de
l'angle), l'acétazolamide est préférable à la
dorzolamide, à la fois pour des raisons pharmacocinétiques et
pharmacodynamiques [39, 53].
V.2.4. Mono- et bithérapie
En monothérapie, l'instillation triquotidienne de
dorzolamide à 2 % exerce des effets hypotonisants oculaires globalement
comparables à ceux obtenus avec le bétaxolol à 0,5 %,
mais légèrement inférieurs à ceux du timolol
à 0,5 %. Chez des patients présentant une hypertonie oculaire
et/ou un glaucome chronique, la baisse de la PIO est de l'ordre de 6 mm Hg deux
heures après instillation du dorzolamide, de l'ordre de 4 à 5
mmHg huit heures après celle-ci. Le dorzolamide constitue ainsi une
indication thérapeutique intéressante en monothérapie en
cas de contre-indications générales aux collyres -bloquants.
En association au timolol à 0,5 % ( à raison
d'une instillation deux fois par jour), le dorzolamide à 2 % (à
raison d'une instillation deux fois par jour) apporte un gain de pression
supplémentaire, de l'ordre de 15 à 20 % chez des patients
glaucomateux. L'efficacité clinique du dorzolamide à 2 % est
comparable à celle de la pilocarpine à 2 % (à raison d'une
instillation quatre fois par jour) lorsque les deux collyres sont
associés à un collyre -bloquant (réduction
supplémentaire de la PIO de l'ordre de 20 %). Le dorzolamide n'a pas
été étudié en trithérapie, en particulier en
association à des collyres partageant le même mécanisme
d'action antisécrétoire, mais il est probable que l'effet sur
pression du dorzolamide s'atténue lorsque la sécrétion de
l'humeur aqueuse est préalablement réduite.
De nouveaux IAC sous forme locale sont commercialisés
tels que l'association timolol-dorzolamide ou le brinzolamide qui produit,
à 1 % (2 ou 3 fois par jour), une baisse de pression équivalente
à celle obtenue par le dorzolamide en instillation triquotidienne
[14, 45].
VI. Agents hyperosmotiques (Traitement
complémentaire)
Les agents hyperosmotiques sont largement utilisés en
clinique dans le traitement de l'hypertonie aiguë (glaucome par fermeture
de l'angle et glaucome secondaire) rétrocédant partiellement aux
-bloquants et aux IAC. Leur utilisation dans le glaucome chronique n'est pas
recommandée.
Les substances hyperosmolaires réduisent la PIO par
séquestration vasculaire des fluides et élévation de la
pression oncotique sanguine. Leur mécanisme d'action s'explique
essentiellement par une déshydratation du vitré, et la
réduction de la formation ciliaire de l'humeur aqueuse.
VI.1. Glycérol
Le glycérol est utilisé à la posologie de
1 à 1,5 g/kg par voie orale (dose maximale de 120 g/j). L'effet sur la
pression est fonction de l'absorption digestive du composé mais est
rapide, maximal au bout de 30 minutes et durant 6 heures environ. Sa voie
d'administration en fait un médicament facile à prescrire en
cabinet de ville dans le glaucome par fermeture de l'angle
VI.2. Mannitol
Le mannitol est administré par voie intraveineuse
à la même posologie dilué à 20 % (8 à 10
ml/kg), à 10 % (15 à 20 ml/kg), à 5 % (30 à 40
ml/kg), en perfusion rapide (moins de 30 minutes). Le temps de la perfusion
conditionne en pratique l'efficacité du produit. La baisse de la PIO
débute au bout de 20 minutes pour se maintenir pendant 2 à 6
heures. Le mannitol demeure efficace même en présence
d'inflammation oculaire [25, 65].
VII. Intérêt de nouveaux
vecteurs
En dehors de la mise au point de nouvelles molécules
hypotensives oculaires, les axes actuels de la recherche concerne
l'amélioration des vecteurs pharmacologiques pour augmenter la
biodisponibilité, réduire les effets secondaires, et obtenir une
plus grande stabilité de l'effet dans le temps, avec finalement une
diminution des concentrations et de la posologie. Cela peut être obtenu
en augmentant la pénétration du principe actif à travers
la cornée, et l'utilisation de bioprécurseurs est une
première réponse ; ou en essayant d'allonger le temps de
résidence du médicament sur le globe en améliorant les
systèmes de vectorisation galénique (lentilles
prétrempées, gels, implants solubles ou insolubles, liposomes,
nanoparticules, nanocapsules...).
L'approche traditionnelle dans le traitement du glaucome
consiste à diminuer la pression intraoculaire. Toutefois, cette
démarche n'empêche pas les pertes de champ visuel, il faudra
à l'avenir avoir pour objectif la survie des cellules ganglionnaires de
la rétine. En plus d'utiliser des agents contrôlant la pression
intraoculaire, il sera bon de considérer des médicaments
neuroprotecteurs et d'autres pouvant améliorer le débit sanguin
oculaire. Ainsi les nouvelles molécules visent à
- Prévenir la neurotoxicité due au glutamate en
bloquant le canal calcium et améliorer le débit sanguin oculaire.
- Inhiber l'accumulation intracellulaire de calcium.
- Inhiber de l'oxyde nitrique synthase.
Bref, à l'avenir, l'efficacité d'un
médicament contre le glaucome dépendra de sa capacité
à protéger les cellules ganglionnaires de la rétine et
surtout à préserver la fonction visuelle [59,
48].
B - Traitement non médicamenteux
I. Trabéculectomie
I.1. Définition
La trabéculectomie est une intervention chirurgicale
décrite en 1968 consistant à réséquer, sous un
volet scléral, une portion profonde du limbe
scléro-cornéen contenant la trabéculum et le canal de
Schlemm [36].
I.2. Mode d'action
Le but était de laisser les deux
extrémités du canal de Schlemm directement en contact avec
l'humeur aqueuse, sans l'intermédiaire du réseau
trabéculaire. Mais des études histologiques ont vite
montré que se produisait le plus souvent une obstruction fibreuse des
extrémités sectionnées du canal.
La trabéculectomie est une intervention relativement
courte (moins de 40 minutes habituellement), qui peut être
réalisée sous anesthésie locale ou
générale [75].
I.3. Résultats de la
trabéculectomie
Les résultats tonométriques de la
trabéculectomie sont globalement excellents, puisque des séries
statistiques donnent 80 à 90 % de retour à la pression normale.
Dans la plupart des cas, la poursuite d'un traitement médical n'est plus
nécessaire. L'efficacité de la trabéculectomie est
généralement attestée par la présence d'une bulle
de filtration. Il faut différencier celle-ci d'une
« pseudobulle » parfois très saillante, non
fonctionnelle, réaliser par ne accumulation des tissus conjonctivaux
cicatriciels : dans ce cas, le massage oculaire digital n'a aucune
tendance à accroître la taille du soulèvement, et ne
s'accompagne pas d'une baisse de pression.
Les résultats sur l'évolution des
déficits périmétriques sont plus contestés ;
certains trouvent que la trabéculectomie arrête toute
détérioration du champ visuel central, mais d'autres
études prouvent que celui-ci s'aggrave dans 20% des cas (ce qui risque
de priver définitivement le patient de son acuité visuelle)
[23].
I.4. Floro-5-uracile
La cause essentielle de l'échec d'une intervention
filtrante est la formation d'une fibrose sous-conjonctivale bloquant
l'évacuation de l'humeur aqueuse. La prolifération
fibroblastique, processus cicatriciel physiologique en est la cause. Cette
prolifération survient dès le 2e jour
postopératoire, qu'elle est particulièrement intense ente le
3e et le 6e jour, et qu'elle disparaît vers le
12e jour.
Le fluoro-5-uracile (5-FU) est un analogue structural de la
pyrimidine, et présente une action antimétabolique. Il inhibe en
culture la prolifération fibroblastique. Injecté par voie
sous-conjonctivale, il est efficace pour diminuer le risque d'échec
d'une intervention filtrante [35].
II. Trabéculoplastie
La trabéculoplastie a largement fait la preuve de son
efficacité pour la baisse de la PIO. Elle est souvent une
précieuse alternative au traitement chirurgical du GPAO, et parfois
même au traitement médical lorsque celui-ci est mal
toléré.
En 1976, on a imaginé une autre possibilité de
traitement utilisant l'énergie laser. Le trabéculum étant
un anneau formé d'une compaction de lamelles présentant
elles-mêmes une multitude d'espaces, on a envisagé d'augmenter la
facilité d'écoulement en provoquant un étirement de ce
tissu, et donc une diminution de la densité trabéculaire. Pour
cela, on a placé sur toute la circonférence du
trébéculum une centaine de petits impacts, courts mais puissants
[75].
II.1. Mode d'action
Les brûlures provoquent un raccourcissement
immédiat des fibres collagènes constituant le trabéculum,
en entraînant donc un rétrécissement concentrique de
l'anneau trabéculaire. Le collapsus du trabéculum et du canal de
Schlemm est ainsi levé, grâce à la distension des espaces
préexistants et peut-être aussi grâce à l'ouverture
de nouvelles voies de passage pour l'humeur aqueuse. Des études au
microscope électronique d'yeux traités ont effectivement
montré des modifications anatomiques de la trame trabéculaire
[67].
II.2. La chute pressionnelle
La trabéculoplastie diminue en moyenne la PIO de 6
à 13 mmHg. Elle repousserait immédiatement l'indication
opératoire chez quatre candidats à la chirurgie sur cinq.
L'importance du traitement médical est diminué deux fois sur
trois, et celui-ci peut même être totalement supprimé dans
10 % des cas.
La baisse de pression est d'autant plus importante que la PIO
de départ est haute et que le sujet traité est âgé.
Il est tout de même possible de diminuer une PIO inférieure
à 20 mmHg sous traitement médical maximal (sans qu'il s'agisse de
glaucome à pression normale) : près d'une fois sur deux, la
PIO baisse de plus de 20 % [77].
III. L'iridectomie
L'iridectomie consiste en la confection d'un trou dans la
périphérie de l'iris. Cet orifice, en court-circuitant la pupille
qui gène ou bloque le passage de l'humeur aqueuse, n'a pas besoin
d'être particulièrement large pour rétablir une
communication normale entre la chambre postérieure et la chambre
antérieure. L'iridectomie peut être chirurgicale ou au laser
[75].
III.1. L'iridectomie chirurgicale
L'iridectomie chirurgicale contemporaine se fait au travers
d'une incision transcornéenne (technique de Charleux), elle peut se
réaliser sous anesthésie locale avec injection
rétrobulbaire ou parabulbaire ou même avec une simple
anesthésie superficielle de contact (dans les cas favorables)
Contrairement à l'iridectomie au laser, elle ne
comporte pas de poussée hypertonique postopératoire
En pratique, après anesthésie, on fixe le globe
avec une pince de Paufique par le droit supérieur. La lame
pénètre la cornée à la limite des arcades
vasculaires et se dirige vers l'angle ; l'iris est saisi avec la pince de
Bonn et attiré vers l'extérieur puis coupé. On
vérifie sur la pièce que l'épithélium
postérieur est présent, on reforme la chambre antérieure
si nécessaire, l'incision étant auto-étanche, toute suture
est inutile [6].
III.2. L'iridectomie au laser
L'iridectomie peut être réalisée avec de
nombreux types de laser mais essentiellement, en pratique actuelle, le laser
à Aragon et le laser Yag [75].
III.2.1. Laser à Aragon
Par sa grande diffusion et son efficacité dans la
grande majorité des cas, il occupe encore une place
privilégiée pour la pratique d'une iridectomie dans le GAF.
L'énergie est délivrée par un laser à aragon
bleu-vert, à l'optique bien réglée, permettant de disposer
d'une puissance d'au moins deux watts à sa sortie.
Après préparation par un myotique, trente
minutes auparavant, la procédure débute par l'instillation de
quelques gouttes d'anesthésique de contact et la mise en place de verre
focalisateur qui concentre l'énergie du laser sur l'iris, permettant un
travail plus fin et plus efficace, mais aussi plus sûr tout en facilitant
le travail au laser à la surface de l'iris et en particulier la
réalisation d'une iridectomie.
III.2.2. Laser Yag
Le laser Yag fonctionne en mode disruptif, ce qui rend
l'iridectomie plus facile, plus rapide significativement plus efficace qu'une
iridectomie au laser à aragon.
Sans préparation parallèle au laser thermique,
on peut réaliser l'iridectomie en un à cinq impacts d'un laser
fonctionnant en nanosecondes avec une puissance de 7 à 10
millijoules ; l'iridectomie obtenue présente un aspect
déchiqueté [40].
IV. Iridoplastie
périphérique
Elle consiste dans la mise en place,
généralement au travers d'un verre à gonioscopie
focalisateur, d'impacts de laser à Aragon larges (250 à 500 um),
et assez prolongés ( 2 ms), non confluents, à la
périphérie de la racine. La chaleur provoque une
rétraction du tissu irien, qui se maintient en grande partie lors de la
cicatrisation, ce qui diminue l'épaisseur de la racine de l'iris et
rouvre l'angle. L'iridoplastie périphérique est indiquée
à la place de l'iridectomie quand il existe un iris-plateau, elle l'est
aussi dans la nanophtalmie et le glaucome malin [19].
Deuxieme partie Travail personnel
I. Matériels et méthodes
I.1. Cadre d'étude
La Fédération Internationale des
Sociétés de la Croix-Rouge et du Croissant-Rouge compte
parmi les plus grandes organisations humanitaires au monde, fondée en
1919 à Paris, au lendemain de la première guerre mondiale, par
Henry DUNANT (1829-1919). C'est Henry DAVIDSON, président du conseil de
guerre de la Croix-Rouge américaine, qui a proposé le
regroupement des sociétés nationales en une
fédération. L'objectif principal était d'améliorer
la santé des populations qui avaient tant souffert pendant les
années de guerre. Aujourd'hui, la Fédération regroupe 178
sociétés membres.
Le Croissant-Rouge Marocain (CRM) a été
créé en 1957 par feu Mohammed V. Il est présidé par
Son Altesse Royale Lalla Malika. Son principal but est d'offrir des soins de
très haut niveau accessibles à toutes les couches de la
société, en particulier les plus démunies. C'est ainsi que
le CRM dispose de sept centres spécialisés, repartis dans tout le
royaume (dont la clinique ophtalmologique de Kénitra), et de 350 centres
de santé servis par près de 100 médecins
spécialisés, 400 infirmières et 5000 volontaires
actifs.
I.1.1. La clinique ophtalmologique
spécialisée de Kénitra
Le clinique est un établissement non gouvernemental
relevant du Croissant-Rouge Marocain, classé juridiquement comme
organisme à but non lucratif. Il a été créé,
grâce à un don de la Fondation Monégasque «John
MEYER», sous l'égide et avec la participation de la Croix-Rouge de
Monaco et mis en service le 1er Octobre 1990.
Figure 7 : Localisation de la
ville de Kénitra [22]
I.1.1.1. Présentation du
centre
Le centre est équipé de six
unités :
- Unité d'accueil et de réception
(Régisseur, secrétaire, caissière)
- Unité de consultation : Elle dispose de
deux salles d'examen avec lampe à fente, tonomètre à air,
réfractomètre, kératométre...
- Unité d'exploration : laser,
angiographie, échographie A et B, rétinographie...
- Unité chirurgicale : Elle dispose d'une
dizaine de lits et de deux salles de bloc opératoire dotées de
microscopes opératoires où on peut effectuer la phako-vitrectomie
et la chirurgie des annexes.
- Unité d'orthoptie : Elle est
équipée de champ visuel automatique, potentiel
évoqué visuel, électro-oculographe et
électro-rétinographe...
- Unité de gardiennage et
d'entretien (gardien, chauffeur, agents d'entretien)
I.1.1.2. Personnels
Le centre dispose de :
* 4 médecins ophtalmologues
* une orthoptiste
* 10 infirmières spécialisées (plus 2
stagiaires)
*Administrateur, administrateur adjoint, comptable,
secrétaires...
* Agents d'entretien, cuisiniers, gardien, chauffeur

La clinique ophtalmologique du CRM à
Kénitra
I.1.1.3. Programme de la clinique
Pour mener à bien ses fonctions, la clinique a mis au
point et applique deux programmes :
- Un programme normal
permanent : La clinique offre des services de soins
oculaires de très haut niveau, assurés par un personnel
spécialisé (universitaires) au moyen d'un matériel
sophistiqué. Ces prestations sont offertes au public à des tarifs
abordables. Précisons, à ce propos, que la clinique adopte une
politique à trois niveaux :
? Les indigents (soins gratuits) : Ils
représentent 15 % de l'ensemble des patients accueillis par la
clinique.
? Les payants : Ils bénéficient d'une
réduction de 30 % par rapport aux tarifs pratiqués par des
cliniques similaires privées.
? Les assurés (bénéficiant d'une prise en
charge par un organisme mutualiste) : Ils représentent près
de 50 % de l'ensemble des payants.
Ainsi, la clinique assure chaque année
approximativement :
* 8000 consultations ophtalmologiques.
* 100 actes d'exploration.
* 650 actes chirurgicaux.
* 2000 consultations orthoptiques.
- Un programme ambulatoire : Il
s'agit de campagnes de consultations ophtalmologiques à travers le
territoire. Ainsi, entre la période de Décembre 2002 et Octobre
2005, plus de 5300 ont bénéficié de ce programme.
I.2. Population d'étude
La population de notre étude est composée
exclusivement des patients ayant consultés à la clinique
ophtalmologique spécialisée du Croissant Rouge de Kénitra
au Maroc.
I.2.1. Critères d'inclusion
Il s'agit de malades des deux sexes atteints du glaucome
primitif à angle ouvert (GPAO) et traités par des
antiglaucomateux. Pour l'analyse des pressions intraoculaires et
l'évaluation des classes thérapeutiques, on ne prendra en compte
que les yeux atteints de GPAO.
I.2.2. Critères d'exclusion
Tous malades atteints d'un autre type du glaucome ou
d'hypertonie oculaire ou encore ne suivant pas un traitement
médicamenteux, ainsi que les yeux sains ou atteints d'un autre type de
glaucome (dans l'analyse des pressions intraoculaires et l'évaluation
des classes thérapeutiques).
I.2.3. Nombre de malades maintenus
Apres dépouillement de 107 dossiers de patients
glaucomateux, nous avons pu identifier 87 cas de GPAO, dont 44 ont
répondu à notre questionnaire.
La quasi-majorité des patients sont issus des
régions ouest et nord du Maroc ; une bonne partie parmi eux
résident dans la province de Kénitra même.
I.3. Méthodologie
Il s'agit d'une étude de type rétrospectif
effectuée sur les dossiers colligés au programme permanant de la
clinique ophtalmologique CRM de Kénitra ; sur une période de
4 ans allant du 1er janvier 2002 au 31 décembre 2005. Cette
étude rétrospective a été complétée
par un entretien direct dirigé (voir annexe 2).
Les tableaux ont été présentés
avec les moyennes et leurs erreurs standard à la moyenne (ESM)
calculées selon la formule :
Erreur standard à la moyenne : ESM = Ecart type
(ón)
n-1
Les baisses moyennes de la PIO ont été
calculées selon la formule :
Baisse moyenne de la PIO (%) = PIO n+1
- PIO n x 100
PIO n
Pour le traitement et l'analyse des données, nous avons
eu recours à deux logiciels : Access 2003 et Excel 2003.
I.4. Fiche d'enquête et
questionnaire
Nous l'avons établie en fonction des besoins de notre
étude et formulée de façon à obtenir le maximum de
renseignements concernant l'état du patient et l'évolution de son
traitement. (Voir annexe 1 et 2)
II. Résultats
II.1. Caractéristiques des
patients
II.1.1. Sexe des patients
Sur les 87 patients de notre enquête, 58,62 % sont de
sexe masculin et 41,38 % de sexe féminin, soit un sexe ratio (M/F) de
1,42. Signalons que nos critères d'inclusion ne prenaient nullement en
considération le sexe du patient.
Tableau II : Répartition des
patients selon le sexe
|
Sexe
|
Nombre de cas
|
Pourcentage
|
|
Féminin
|
36
|
41,38 %
|
|
Masculin
|
51
|
58,62 %
|
|
Total
|
87
|
100 %
|
Sexe ratio (M/F) = 1,42
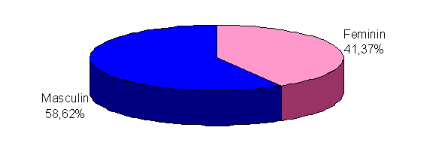
Figure 8 :
Répartition des patients selon le
sexe
II.1.2. Age des patients
Nos patients sont âgés de 35 à 90 ans,
avec plus de 80 % âgés entre 50 et 80 ans, tranche à
laquelle on peut ajouter 6,90 % de patients âgés de 40 à 49
ans et 8,05 % âgés de plus de 80 ans. Signalons la présence
d'un seul cas du glaucome juvénile.
Ainsi, la moyenne d'âge est de 65,07 +/- 0,12 ans.
Tableau III : Répartition des
patients selon la tranche d'âge
|
Tranche d'âge
|
Nombre de cas
|
Pourcentage
|
|
Inférieure à 40 ans
|
1
|
1,15 %
|
|
40 à 49 ans
|
6
|
6,90 %
|
|
50 à 59 ans
|
19
|
21,84 %
|
|
60 à 69 ans
|
27
|
31,03 %
|
|
70 à 79 ans
|
27
|
31,03 %
|
|
Supérieure à 80 ans
|
7
|
8,05 %
|
|
Total
|
87
|
100 %
|
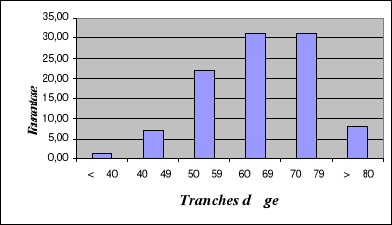
Figure 9 : Répartition des
patients selon la tranche d'âge
II.1.3. Antécédents cliniques des
patients
Parmi les 87 patients, 33 présentent des
antécédents cliniques, soit 37,93 % des cas, tandis que les
54 autres, ou 62,07 % des cas, n'ont pas signalé
d'antécédents cliniques.
Tableau IV : Répartition des
patients selon la présence ou non d'antécédents
cliniques
|
Antécédents cliniques
|
Nombre de cas
|
Pourcentage
|
|
Sans
|
54
|
62,07 %
|
|
Avec
|
33
|
37,93 %
|
|
Total
|
87
|
100 %
|
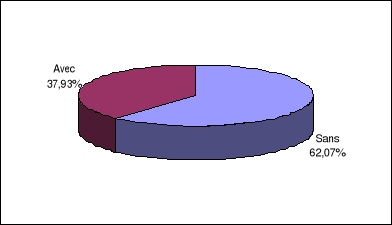
Figure 10 : Répartition des
patients selon la présence ou non d'antécédents
cliniques
Parmi les antécédents cliniques
enregistrés, l'HTA occupe la première place avec 20,69 % des cas,
suivie du diabète avec 13,79 % des cas, puis de la cardiopathie et du
rhumatisme avec respectivement 4,60 % et 3,45 % des cas. On a par ailleurs
signalé un cas d'asthme et un autre d'hépatite.
Tableau V : Répartition des
antécédents cliniques
|
Type d'antécédent
clinique
|
Nombre de cas
|
Pourcentage
|
|
HTA
|
18
|
20,69 %
|
|
Diabète
|
12
|
13,79 %
|
|
Cardiopathie
|
4
|
4,60 %
|
|
Rhumatisme
|
3
|
3,45 %
|
|
Asthme
|
1
|
1,15 %
|
|
Hépatite
|
1
|
1,15 %
|
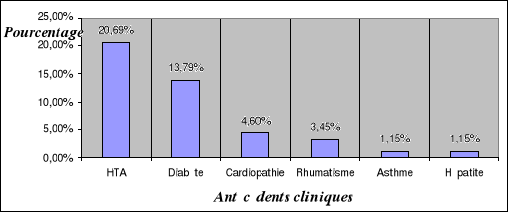
Figure 11 : Répartition des
antécédents cliniques
II.1.4. Antécédents oculaires des
patients
Parmi les 87 patients, 37 présentent des
antécédents oculaires, soit 42,53 % des cas; tandis que les
50 autres, ou 57,47 % des cas, n'ont pas signalé
d'antécédents oculaires.
Tableau VI : Répartition des
patients selon la présence ou non d'antécédents
oculaires
|
Antécédents
oculaires
|
Nombre de cas
|
Pourcentage
|
|
Sans
|
50
|
57,47 %
|
|
Avec
|
37
|
42,53 %
|
|
Total
|
87
|
100 %
|
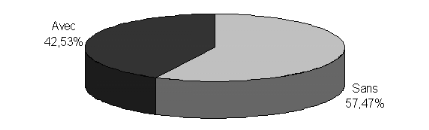
Figure 12 : Répartition des
patients selon la présence ou non d'antécédents
oculaires
Parmi les antécédents oculaires
consignés, la cataracte occupe la première place avec 35,63 % des
cas, suivie de l'aphakie avec 9,20 % des cas, puis de la dystrophie
cornéenne et de la kératite avec, respectivement, 2,30 % et 1,15
% des cas.
Tableau VII : Répartition des
antécédents oculaires
|
Antécédents oculaires
|
Nombre de cas
|
Pourcentage
|
|
Cataracte
|
31
|
35,63 %
|
|
Aphakie
|
8
|
9,20 %
|
|
Dystrophie cornéenne
|
2
|
2,30 %
|
|
Kératite
|
1
|
1,15 %
|
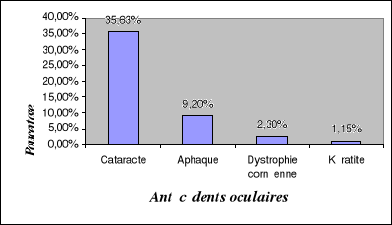
Figure 13: Répartition des
antécédents oculaires
II.1.5. Nombre de consultations effectuées
Au départ, nous avions 87 patients, mais au fur et
à mesure des consultations, certains ont été perdus de
vue.
Ainsi, seuls 49 patients, soit 56,32 % des cas, ont
effectué 4 consultations ou plus à la clinique,
*12, soit 13,79 % des cas, ont effectué 3
consultations,
*8, soit 9,20 % des cas, ont effectué 2
consultations,
*18 patients, soit 20,69 % des cas, ont effectué 1
seule consultation.
Tableau VIII : Nombre de consultations
effectuées par les patients
|
Nombre de consultations
effectuées
|
Nombre de patients
|
Pourcentage
|
|
Une
|
18
|
20,69 %
|
|
Deux
|
8
|
9,20 %
|
|
Trois
|
12
|
13,79 %
|
|
Quatre et plus
|
49
|
56,32 %
|
|
Total
|
87
|
100 %
|
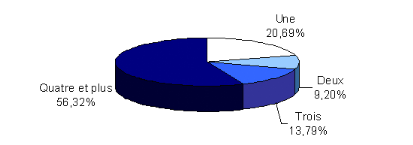
Figure 14 : Nombre de consultations
effectuées par les patients
II.1.6. Les pressions intraoculaires initiales des
patients
La suite des résultats sera présentée en
tenant compte des yeux atteints et non plus des cas. Ainsi, le tableau N° IX
couvre seulement 131 yeux atteints de GPAO. En divisant les valeurs de PIO
initiales enregistrées en 4 intervalles, on constate que :
* 54,96 % des PIO initiales sont incluses dans l'intervalle 21
à 29 mmHg,
* 20,61 % des PIO initiales sont incluses dans l'intervalle 30
à 39 mmHg,
* 11,45 % des PIO initiales sont incluses dans l'intervalle 40
à 49 mmHg,
* 3,82 % des PIO initiales sont incluses dans l'intervalle 50
à 59 mmHg.
* On n'a pas pu mesurer la PIO chez 9,16 % des yeux, qui
présentent des valeurs très élevées,
supérieures à 59 mmHg, et que le tonométre n'arrive pas
à chiffrer.
Tableau IX : Répartition des
yeux atteints selon les intervalles des pressions intraoculaires
initiales
|
Intervalles des PIO
|
Nombre d'yeux atteints
|
Pourcentage
|
|
21 à 29 mmHg
|
72
|
54,96 %
|
|
30 à 39 mmHg
|
27
|
20,61 %
|
|
40 à 49 mmHg
|
15
|
11,45 %
|
|
50 à 59 mmHg
|
5
|
3,82 %
|
|
PIO importante
|
12
|
9,16 %
|
|
Total
|
131
|
100 %
|
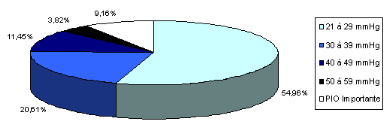
Figure 15 : Répartition des
yeux atteints selon les intervalles des PIO initiales
II.2. Evaluation du traitement médical
II.2.1. Les schémas thérapeutiques
utilisés
On peut classer les différents schémas
thérapeutiques prescrits en monothérapie, bithérapie et
trithérapie.
Ainsi, on constate que les monothérapies arrivent en
tête avec 47,13 % dans la première consultation, suivies des
bithérapies avec 42,53 % et enfin des trithérapies avec 10,34
%.
Dans les consultations ultérieures, les
bithérapies sont prédominantes sur les monothérapies,
environ 50 %, alors que les monothérapies se stabilisent autour de 38 %
à la 3ème consultation.
La fréquence des trithérapies varie entre 10,34
% à la 1ère consultation et 13,33 % à la
4ème consultation.
Tableau X : Répartition des
schémas thérapeutiques
|
Schémas
thérapeutiques
|
1ère
consultation
|
2ème
consultation
|
3ème
consultation
|
4ème
consultation
|
|
Monothérapie
|
47,13 %
|
40,00 %
|
38,35 %
|
37,78%
|
|
Bithérapie
|
42,53 %
|
47,69 %
|
50,88 %
|
48,89%
|
|
Trithérapie
|
10,34 %
|
12,31 %
|
10,77 %
|
13,33%
|
|
Total
|
100 %
|
100 %
|
100 %
|
100 %
|
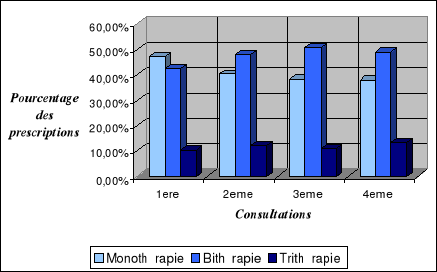
Figure 16 : Répartition des
schémas thérapeutiques
II.2.2. Prescription des différentes classes
thérapeutiques
Le tableau N° XI montre le pourcentage de prescription des
différentes classes d'antiglaucomateux suivant les 4 consultations.
Ainsi, on constate une prodominance globale des
bêtabloquants avec des pourcentages de prescription variant de
40 % (en 1ère intention) à 31,65 % (en
4ème intention), suivis respectivement par :
* Les IAC : avec des pourcentages de prescription
variant de :
29,56 % (en 1ère intention) à 15,19
% (en 4ème intention),
* Les prostaglandines : avec des pourcentages de
prescription variant de :
15,65 % (en 1ère intention) à 26,58
% (en 4ème intention),
* Les Mydriatiques : avec des pourcentages de
prescription variant de :
7,83 % (en 1ère intention) à
6,33 % (en 4ème intention),
* Les associations : avec des pourcentages de
prescription variant de :
4,35 % (en 1ère intention) à
20,25 % (en 4ème intention),
* Les myotiques : avec des pourcentages de
prescription variant de :
2,61 % (en 1ère intention) à 0% (en
4ème intention),
Tableau XI : Répartition de la
prescription des classes thérapeutiques dans chacune des
consultations
|
Classes
thérapeutiques
|
En 1ère
intention
|
En 2ème
intention
|
En 3ème
intention
|
En 4ème
intention
|
|
Bêtabloquants
|
40,00%
|
33,93%
|
38,54%
|
31,65%
|
|
IAC
|
29,56%
|
25,89%
|
19,79%
|
15,19%
|
|
Prostaglandines
|
15,65%
|
20,54%
|
23,96%
|
26,58%
|
|
Mydriatiques
|
7,83%
|
6,25%
|
9,38%
|
6,33%
|
|
Associations
|
4,35%
|
9,82%
|
8,33%
|
20,25%
|
|
Myotiques
|
2,61%
|
3,57%
|
0%
|
0%
|
|
Total
|
100,00%
|
100,00%
|
100,00%
|
100,00%
|
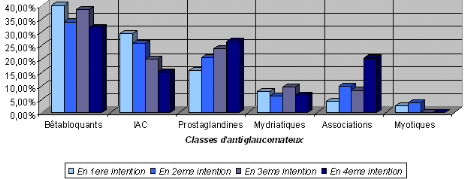
Figure 17 : Répartition de la
prescription des classes thérapeutiques dans chacune des consultations
II.2.3. Evolution des pressions intraoculaires des
patients
En ne tenant compte que des patients ayant effectué les
4 consultations, et seulement des yeux atteints, nous avons calculé
les moyennes des pressions intraoculaires enregistrées dans chacune des
4 consultations. Ainsi, nous avons trouvé une moyenne de
30,86 +/- 0,12 mmHg de PIO initiales, 24,13 +/- 0,14
mmHg dans les 2èmes consultations, 19,94 +/- 0,15
mmHg dans les 3èmes consultations et 19,23 +/-
0,15 mmHg dans les 4èmes
consultations.
Tableau XII : Moyenne des pressions
intraoculaires enregistrées dans les quatre
consultations
|
Consultations
|
Moyenne des pressions
intraoculaires
(en mmHg)
|
|
1ères
|
30,86 +/- 0,12
|
|
2èmes
|
24,13 +/- 0,14
|
|
3èmes
|
19,94 +/- 0,15
|
|
4èmes
|
19,23 +/- 0,15
|
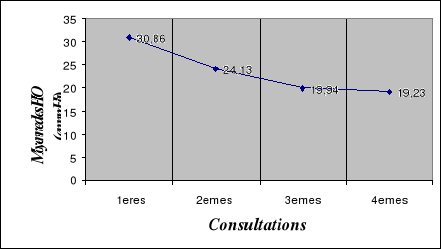
Figure 18 : Moyenne des pressions
intraoculaires enregistrées dans les quatre
consultations
II.2.4. Evolution des différentes classes
thérapeutiques
II.2.4.1. les bêtabloquants
Le tableau N° XIII montre les moyennes des baisses de pression
obtenues chaque fois que nous avons eu affaire à des schémas
thérapeutiques comprenant un bêtabloquant, tout en calculant par
la même occasion l'erreur standard à la moyenne (ESM)
Ainsi, nous avons eu une baisse moyenne de PIO de :
* -8,68 +/- 1,12 % avec un bêtabloquant seul
(monothérapie),
*-28,42 +/- 1,16 % avec un bêtabloquant en association
avec un IAC (bithérapie),
* -24,02 +/- 4,47 % avec un bêtabloquant en association
avec un IAC et un prostaglandine (trithérapie),
* -13,33 % avec un bêtabloquant en association avec une
prostaglandine et un mydriatique (l'absence de l'ESM montre qu'il y a eu un
seul cas).
Tableau XIII : Baisse moyenne des
pressions intraoculaires obtenue avec les
bêtabloquants
|
Bêtabloquant
|
Classes thérapeutiques
associées
|
Baisse moyenne de la PIO
|
|
Monothérapie
|
(seul)
|
-8,68 +/- 1,12 %
|
|
Bithérapie
|
IAC
|
-28,42 +/- 1,16 %
|
|
|
Mydriatique
|
-45,38 +/- 5,45 %
|
|
|
Prostaglandine
|
-24,91 +/- 1,94 %
|
|
Trithérapie
|
IAC + Prostaglandine
|
-24,02 +/- 4,47 %
|
|
|
IAC + Mydriatique
|
-16,35 +/- 4,84 %
|
|
|
IAC + Myotique
|
-15,88 +/- 5,97 %
|
|
|
Prostaglandine + Mydriatique
|
-13,33 %
|

Figure 19 : Baisse moyenne des pressions
intraoculaires obtenue avec les
bêtabloquants
II.2.4.2. Inhibiteurs de l'anhydrase
carbonique
Tableaux XIV : Baisse moyenne des
pressions intraoculaires obtenue avec un inhibiteur de l'anhydrase
carbonique
|
IAC
|
Classes thérapeutiques
associées
|
Baisse moyenne de la PIO
|
|
Monothérapie
|
(seul)
|
-12,38 +/- 6,30 %
|
|
Bithérapie
|
Bêtabloquant
|
-28,42 +/- 1,16 %
|
|
|
IAC
|
-13,14 +/- 12,42 %
|
|
|
Prostaglandine
|
-26,63 +/- 5,62 %
|
|
|
Mydriatique
|
-18,75 %
|
|
Trithérapie
|
Bêtabloquant + Prostaglandine
|
-24,02 +/- 4,47 %
|
|
|
Bêtabloquant + Mydriatique
|
-16,35 +/- 4,84 %
|
|
|
Bêtabloquant + Myotique
|
-15,88 +/- 5,97 %
|
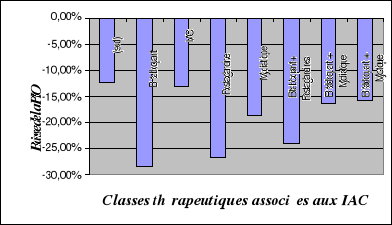
Figure 20 : Baisse moyenne des pressions
intraoculaires obtenue avec un inhibiteur de l'anhydrase carbonique
II.2.4.3. Mydriatiques (ou
á2-adrénergiques)
Tableaux XV: Baisse moyenne des pressions
intraoculaires obtenue avec un mydriatique
|
Mydriatique
|
Classes thérapeutiques
associées
|
Baisse moyenne de la PIO
|
|
Monothérapie
|
(seul)
|
-20,28 +/-7,99 %
|
|
Bithérapie
|
Bêtabloquant
|
-45,38 +/- 5,45 %
|
|
|
IAC
|
-18,75 %
|
|
|
Prostaglandine
|
-57,14 %
|
|
Trithérapie
|
Bêtabloquant + IAC
|
-16,35 +/- 4,84 %
|
|
|
Bêtabloquant + Prostaglandine
|
-13,33 %
|

Figure 21: Baisse moyenne des pressions
intraoculaires obtenue avec un mydriatique
II.2.4.4. Myotiques (ou
Cholinergiques)
Tableaux XVI : Baisse moyenne des
pressions intraoculaires obtenue avec un myotique
|
Myotique
|
Classes thérapeutiques
associées
|
Baisse moyenne de la PIO
|
|
Bithérapie
|
Prostaglandine
|
-53,85 %
|
|
Trithérapie
|
Bêtabloquant + IAC
|
-15,88 +/- 5,97 %
|
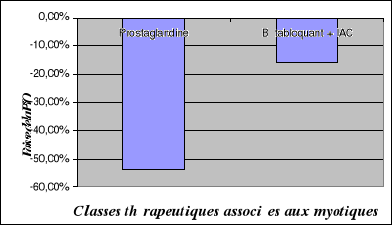
Figure 22 : Baisse moyenne des pressions
intraoculaires obtenue avec un myotique
II.2.4.5. Prostaglandines
Tableaux XVII: Baisse moyenne des
pressions intraoculaires obtenue avec une prostaglandine
|
Prostaglandine
|
Classes thérapeutiques
associées
|
Baisse moyenne de la PIO
|
|
Monothérapie
|
(seul)
|
-43,35 +/- 3,06 %
|
|
Bithérapie
|
Bêtabloquant
|
-24,91 +/- 1,94 %
|
|
|
IAC
|
-26,63 +/- 5,26 %
|
|
|
Mydriatique
|
-57,14%
|
|
|
Myotique
|
-53,85%
|
|
|
Prostaglandine (une autre)
|
-28,03 +/- 5,54 %
|
|
Trithérapie
|
Bêtabloquant + IAC
|
-24,02 +/- 4,47 %
|
|
|
Bêtabloquant + Mydriatique
|
-13,33%
|
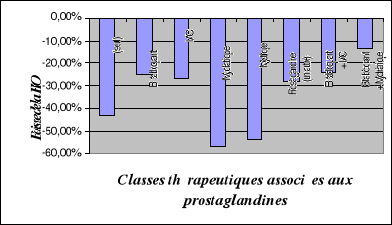
Figure 23 : Baisse moyenne des
pressions intraoculaires obtenue avec une prostaglandine
II.2.5. Evaluation des schémas
thérapeutiques
II.2.5.1. Monothérapie
Le tableau N° XVIII propose une comparaison des moyennes de
baisse de la PIO dans des situations de monothérapie. On remarque que la
baisse la plus remarquable est obtenue avec les prostaglandines avec -43,35 +/-
3,06 %, suivie de celle due aux mydriatiques, avec -20,28 +/- 7,99 %. Les
bêtabloquants ferment la marche avec une moyenne de baisse de -8,68 +/-
1,12 %.
Tableaux XVIII : Baisse moyenne obtenue
avec les différentes classes d'antiglaucomateux en
monothérapie
|
Classes
thérapeutiques
|
Baisse moyenne de la PIO
|
|
Bêtabloquant
|
-8,68 +/- 1,12 %
|
|
IAC
|
-12,38 +/- 6,30 %
|
|
Mydriatique
|
-20,28 +/- 7,99 %
|
|
Prostaglandine
|
-43,35 +/- 3,06 %
|
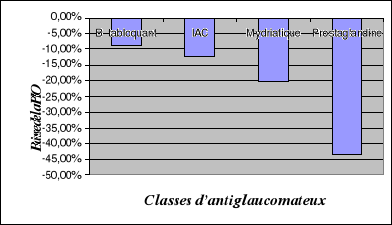
Figure 24 :
Baisse moyenne obtenue avec les différentes classes
d'antiglaucomateux en monothérapie
II.2.5.2. Bithérapie
Le tableau N° XIX propose une comparaison des moyennes de
baisse de la pression intraoculaire dans des situations de bithérapie.
On remarque que la baisse la plus remarquable est celle obtenue avec un
mydriatique + un bêtabloquant, avec -45,38 +/- 5,45 %, suivie de celle
due à un IAC + un bêtabloquant avec -28,42 +/- 1,16 %, alors que
l'association de deux IAC (local + général) n'a donné que
-13,14 +/- 12,42 % de baisse de la PIO.
Tableaux XIX : Baisse moyenne des
pressions intraoculaires obtenue avec différentes combinaisons de deux
classes d'antiglaucomateux
|
Classes thérapeutiques
associées
|
Bêtabloquant
|
IAC
|
Prostaglandine
|
Mydriatique
|
Myotique
|
|
Bêtabloquant
|
|
-28,42
+/- 1,16 %
|
-24,91
+/- 1,94 %
|
-45,38
+/- 5,45 %
|
|
|
IAC
|
-28,42
+/- 1,16 %
|
-13,14
+/- 12,42 %
|
-26,63%
+/- 5,62 %
|
-18,75 %
|
|
|
Prostaglandine
|
-24,91
+/- 1,94 %
|
-26,63
+/- 5,62 %
|
-28,03
+/- 5,54 %
|
-57,14 %
|
-53,85 %
|
|
Mydriatique
|
-45,38
+/- 5,45 %
|
-18,75 %
|
-57,14 %
|
|
|
|
Myotique
|
|
|
-53,85 %
|
|
|
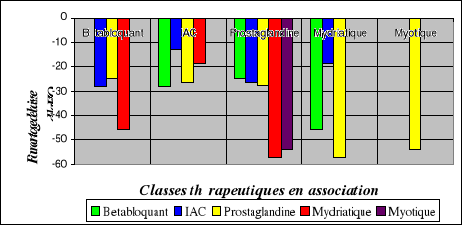
Figure 25 : Baisse moyenne des pressions
intraoculaires obtenue avec différentes combinaisons de deux classes
d'antiglaucomateuxII.2.5.3.
Trithérapie
Le tableau N° XX propose une comparaison des moyennes de baisse
de la pression intraoculaire dans des situations de trithérapie. On
remarque que la baisse la plus remarquable est celle obtenue avec
bêtabloquant + prostaglandine + IAC, avec -24,02 +/- 4,47 %, suivie de
celle due à l'association bêtabloquant + Mydriatique+ IAC avec
-16,35 +/- 4,84 %, alors que l'association bêtabloquant + IAC + myotique
n'a donné que -15,88 +/- 5,97 %.
Tableau XX : Baisse moyenne des
pressions intraoculaires obtenue avec les différentes associations de
trois classes d'antiglaucomateux
|
Classes thérapeutiques
associées
|
Baisse moyenne de la PIO
|
|
Bêtabloquant + IAC + Mydriatique
|
-16,35 +/- 4,84 %
|
|
Bêtabloquant + IAC + Myotique
|
-15,88 +/- 5,97 %
|
|
Bêtabloquant + IAC + Prostaglandine
|
-24,02 +/- 4,47 %
|
|
Bêtabloquant + Prostaglandine + Mydriatique
|
-13,33 %
|
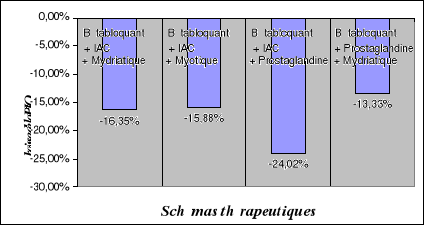
Figure 26: Baisse moyenne des pressions
intraoculaires obtenue avec les différentes associations de trois
classes d'antiglaucomateux
II.3. Questionnaire
II.3.1. Observance du traitement
A la question : -Preniez-vous votre traitement
régulièrement ?
La réponse `Non' équivaut à une
observance nulle
Si la réponse est `Oui', on pose une autre
question :
«Vous arrive-t-il de rater une prise ?»
La réponse `Souvent' équivaut à une
observance faible
La réponse `De temps à autre' équivaut
à une observance moyenne
La réponse `Rarement' équivaut à une
observance satisfaisante
La réponse `Jamais' équivaut à une
observance excellente
Ainsi, nous avons eu : ? 54,55 % d'observance
excellente
· 25,00 % d'observance satisfaisante
· 6,82 % d'observance moyenne
· 6,82 % d'observance faible
· 6,82 % d'observance nulle
Tableau XXI : Observance du
traitement
|
Observance
|
Nombre de cas
|
Pourcentage
|
|
Excellente
|
24
|
54,55 %
|
|
Satisfaisante
|
11
|
25,00 %
|
|
Moyenne
|
3
|
6,82 %
|
|
Faible
|
3
|
6,82 %
|
|
Nulle
|
3
|
6,82 %
|
|
Total
|
44
|
100 %
|
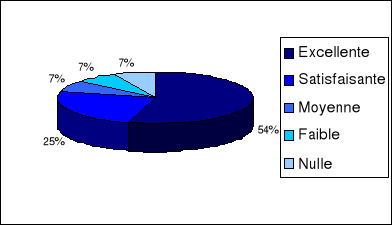
Figure 27 : Observance du
traitement
II.3.2. Coût du traitement
La question concernant le coût du traitement a
été posée avec 3 options de réponse:
coûteux, abordable ou pas cher.
50 % des patients trouvent le traitement coûteux, 45,45
% le trouvent abordable et seulement 4,55 % le trouvent pas cher.
Tableau XXII : Coût du
traitement
|
Coût du traitement
|
Nombre de patients
|
Pourcentage
|
|
Coûteux
|
22
|
50 %
|
|
Abordable
|
20
|
45,45 %
|
|
Pas cher
|
2
|
4,55 %
|
|
Total
|
44
|
100 %
|
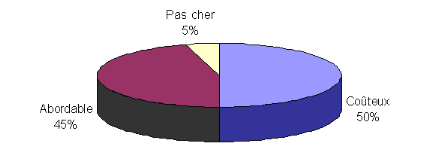
Figure 28 : Coût du
traitement
II.3.3. Effets secondaires
A la réponse : "Avez-vous remarqué des
effets secondaires ?",
40,91 % des patients interrogés ont affirmé
qu'ils ne sentaient aucun effet secondaire. 59,89 % ont en revanche
signalé quelques effets, qu'on peut répartir comme
suivant :
* 22,73 % des interrogés se plaignent d'une
démangeaison oculaire,
* 20,45 % des interrogés se plaignent d'une irritation
oculaire,
* 9,09 % des interrogés se plaignent d'un larmoiement
exagéré,
* 6,82 % des interrogés se plaignent d'un brouillard
visuel.
Tableau XXII : Effets
secondaires
|
Effets secondaires
|
Nombre de cas
|
Pourcentage
|
|
Aucun effet secondaire
|
18
|
40,91 %
|
|
Démangeaison oculaire
|
10
|
22,73 %
|
|
Irritation oculaire
|
9
|
20,45 %
|
|
Larmoiement exagéré
|
4
|
9,09 %
|
|
Brouillard visuel
|
3
|
6,82 %
|
|
Total
|
44
|
100 %
|
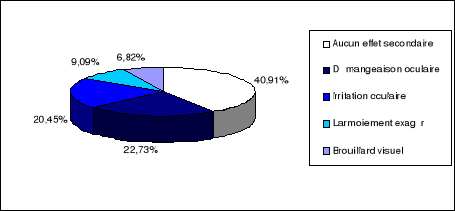
Figure 29 : Effets
secondaires
II.4. Interventions chirurgicales
Devant certains échecs du traitement, certains
patients ont recouru à la chirurgie. Ainsi, 24 yeux (sur les 131
atteints, soit 18,32 %) ont subit des interventions chirurgicales.
La trabéculectomie est l'opération la plus
pratiquée (16 fois), suivie de l'iridectomie + cataracte (6 fois) et
enfin de l'iridectomie périphérique et de
l'éviscération, après complication (1 fois chacune).
Tableau XXIV : Interventions
chirurgicales
|
Interventions chirurgicales
|
Nombre d'yeux opérés
|
|
Trabéculectomie
|
16
|
|
Cataracte + Iridectomie
|
6
|
|
Iridectomie périphérique
|
1
|
|
Eviscération
|
1
|
|
Total
|
24
|
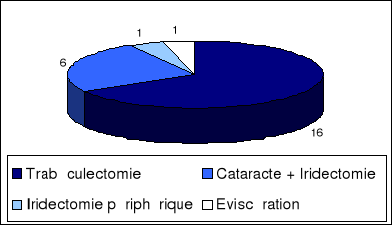
Figure 30 : Interventions
chirurgicales
III. Discussion
Dans notre étude, les hommes représentent 58,62
% des cas contre 41,38 % pour les femmes. La prédominance, certes
faible, du sexe masculin dans le glaucome primitif à angle ouvert a
été également confirmée par une étude
conduite par JAMPEL et McGUIGHAN [35].
Les personnes âgées représentent la
quasi-majorité de nos patients. En effet dans 90 % des cas, ils sont
âgés de plus de 50 ans, avec une moyenne d'âge autour de
65,07 +/- 0,12 ans et des âges extrêmes de 35 et 90 ans. Ces
observations montrent que le GPAO est reparti de façon très large
dans les différents âges de la vie au delà de 35 ans. Cette
même tendance avait été rapportée par SELLEM
[75].
L'apparition du glaucome a été soulignée
comme étant plus fréquente chez les sujets hypertendus et/ou
diabétiques ou présentant des antécédents
oculaires. Nos résultats ont montré que 37,93 % de nos patients
présentent des antécédents cliniques, dont l'HTA (20,69 %)
et le diabète (13,79 %). Près de 42,53 % de nos patients
présentent des antécédents oculaires, avec une nette
prédominance de la cataracte (35,63 %). L'existence de liens entre
l'HTA, le diabète et la cataracte d'une part et le glaucome d'autre part
a été rapportée dans la littérature
[75].
Dans 60 % des cas, les patients présentent des valeurs
de pression intraoculaire comprises dans l'intervalle 21 à 29 mmHg,
alors que dans près de 40 % des cas les valeurs de PIO étaient
supérieures à 30 mmHg. Les valeurs importantes de PIO à la
première consultation traduisent en général une prise en
charge tardive du glaucome, due probablement au caractère silencieux de
la maladie.
Lors de la 1ere consultation, la monothérapie est
légèrement prédominante, alors qu'à partir de la
2eme consultation, la bithérapie devient significative, de même
qu'à la 3eme et 4eme consultation. La trithérapie est
habituellement réservée à des situations de pressions
intraoculaires rebelles.
En comparant l'effet des différentes classes
d'antiglaucomateux en monothérapie, on constate que la baisse la plus
considérable est obtenue avec les prostaglandines (-43,35 +/- 3,06 %),
une baisse considérable qui confirme ce qui a été
rapporté par la littérature [3]. Ensuite
viennent les mydriatiques (-20,28 +/- 7,99 %) puis les IAC (-12,38 +/- 6,30 %),
et enfin les bêtabloquants (-8,68 +/- 1,12 %),.
La bithérapie est très utilisée dans le
traitement du GPAO et les baisses de PIO obtenues justifient en
général cette démarche.
Les valeurs de baisse de la PIO varient de -13,14 +/- 12,42 %
à -57,14 %.
* Bêtabloquant + mydriatique (-45,38 +/- 5,45 %),
l'apport du mydriatique (une réduction supplémentaire de 36,70 %)
dépasse les 20 % annoncés par STEWART WC. et al
[82].
* Bêtabloquant + IAC (-28,42 +/- 1,16 %) l'apport de l'
IAC (une réduction supplémentaire de 19,74 %) est confirmé
par la littérature [14].
* Bêtabloquant + prostaglandine (-24,91 +/- 1,94 %)
l'apport de la prostaglandine (une réduction supplémentaire de
16,23 %) est confirmé par la littérature
[71].
* Prostaglandine + prostaglandine (-28,03 +/- 5,54 %)
* Prostaglandine + IAC (-24,91 +/- 1,94 %).
Les trithérapies sont généralement
réservées aux cas de pressions intraoculaires rebelles, ainsi on
a enregistré seulement 4 associations qui comprennent toutes des
bêtabloquants et fréquemment un IAC. La baisse de la PIO la plus
élevée est celle obtenue en associant un bêtabloquant + IAC
+ prostaglandine (-24,02 +/- 4,47 %).
La prescription des bêtabloquants est beaucoup plus
fréquente au cours des 4 consultations, c'est-à-dire les
bêtabloquants constituent le traitement antiglaucomateux le plus
prescrit, en première intention et même dans des stades plus
avancés de la maladie. Ceci est vraisemblablement dû à leur
efficacité et à leur bonne tolérance locale [60].
Les prostaglandines se présentent actuellement comme la
classe d'antiglaucomateux de choix, du fait de leur efficacité dans la
régulation de la pression intraoculaire.
Dans les traitements au long cours, en particulier à
partir de la 4eme consultation, on a noté une prescription importante
d'associations de principes actifs comme l'association dorzolamide +
timolol (Cosopt®) et latanoprost +
timolol (Xalacom®).
La PIO moyenne de nos patients est de 30,86 +/- 0,12 mmHg au
cours de la première consultation. Sous l'effet du traitement
antiglaucomateux, elle diminue, en général à la 2eme et
3eme consultation et se stabilise autour de 19,23 +/- 0,15 mmHg à la
4eme consultation.
Ces résultats suggèrent que :
- le traitement médicamenteux permet en
général de normaliser la PIO, en particulier lorsque le glaucome
est pris en charge précocement.
- C'est en général vers la 3eme - 4eme
consultation que l'effet thérapeutique apparaît de manière
significative.
La baisse moyenne de la PIO obtenue avec un
bêtabloquant est de -8,68 +/- 1,12 %. Cette baisse est
considérablement inférieure à celle décrite dans
la littérature " La réduction de la PIO est de l'ordre de 30
à 35 % dans les premiers jours, mais peut légèrement
diminuer les semaines suivantes." [29]. Dans notre
étude, l'efficacité des bêtabloquants semble plus
importante lorsque ces derniers sont en association avec un mydriatique (-45,38
+/- 5,45), un IAC (-28,42 +/- 1,16 %) ou encore avec des prostaglandines
(-24,91 +/- 1,94 %).
Le traitement avec des inhibiteurs de l'anhydrase
carbonique en monothérapie entraîne une baisse moyenne de PIO
de -12,38 +/- 6,30 %. Ce résultat est similaire à celui
rapporté par la littérature (15 %) [50].
Lorsqu'ils sont associés aux prostaglandines, ils
entraînent une meilleure baisse de la PIO (-26,63% +/- 5,62 %).
En monothérapie, les mydriatiques
présentent une baisse importante de la PIO (-20,28 +/-7,99 %).
Lorsqu'ils sont associés aux bêtabloquants la baisse de la PIO
devient synergique (-45,38 +/- 5,45 %) et significativement différente
de la somme des baisses de PIO obtenues avec ces deux sous classes lorsqu'elles
sont administrées séparément [85].
Des résultats similaires sont obtenus lors de
l'association mydriatique + prostaglandine (-57,14 %). Toutefois, nous n'avons
obtenu qu'un seul patient dans notre étude ayant été mis
sous cette association.
Dans notre étude, l'utilisation des
prostaglandines en monothérapie a donné les meilleures
baisses de PIO (-43,35 +/- 3,06 %). L'efficacité des prostaglandines
semble toutefois moins importante lors d'une association avec les
bêtabloquants (-24,91 +/- 1,94 %). Ces résultats sont
superposables à ceux décrits dans la littérature
[3].
Dans près de 80% des cas, l'observance aux traitement
par les médicaments était satisfaisante. Les résultats de
nos enquêtes ont montré que les patients respectaient en
général la prescription médicale.
Chez ces patients d'ailleurs, 40,91 % d'entre eux ne se
plaignaient pas d'effets secondaires liés au traitement
antiglaucomateux. Toutefois nous avons noté des cas de
démangeaisons oculaires (22,73 %) et d'irritations oculaires (20,45 %),
mais nous n'avons pas pu établir des liens de cause à effet entre
ces effets secondaires et les sous-classes d'antiglaucomteux.
Nos travaux ont montré qu'il existait des cas
d'échec au traitement médicamenteux (18,32 %). En effet, pour ces
patients, la PIO n'était pas normalisée malgré un
traitement médical. Toutefois, nous avons remarqué que lorsque le
traitement par les médicaments était institué
précocement, l'évolution de la PIO était en
général en faveur d'un retour vers des valeurs normales de la PIO
(environ 80 % des cas).
Conclusion
Le terme "glaucome" regroupe plusieurs affections oculaires
caractérisées par une dégénérescence et une
excavation progressive de la tête du nerf optique. Il s'agit d'une
maladie insidieuse, le plus souvent indolore, d'évolution chronique et
progressive pouvant entraîner une cécité.
Le glaucome primitif à angle ouvert (GPAO) constitue la
forme la plus fréquente de cette maladie. Cette affection est
généralement liée à une hypertension
intraoculaire.
Le glaucome constitue un problème de santé
publique à l'échelle mondiale. Sa progression est aujourd'hui en
rapport avec l'accroissement de la population mondiale mais surtout à
l'évolution favorable de l'espérance de vie. La fréquence
d'apparition du glaucome augmente avec l'age, elle serait de 5 % chez les
sujets de plus de 65 ans. Elle est plus fréquente chez les sujets
présentant des antécédents oculaires, de diabète ou
d'hypertension artérielle.
Le traitement médical du glaucome primitif à
angle ouvert vise à préserver la fonction visuelle, le plus
souvent en diminuant la pression intraoculaire qui est le facteur de risque
principal.
Notre étude a été réalisée
à la clinique ophtalmologique spécialisée de
Kénitra au Maroc, qui est un établissement non gouvernemental de
Croissant Rouge Marocain à but non lucratif.
Le but de notre travail a été
d'évaluer :
- La place du traitement médicamenteux dans la prise en
charge du GPAO.
- L'efficacité du traitement antiglaucomateux de chaque
classe thérapeutique.
- Les cas d'échecs thérapeutiques et/ou ayant
nécessité une intervention chirurgicale.
Les patients ont été suivis pendant 4
consultations, ceci nous a permis de recueillir les différents
schémas thérapeutiques qui ont été proposés.
L'efficacité des traitements a été évaluée
grâce à l'appréciation de la pression intraoculaire. Ce
travail a été complété par un interrogatoire sur
l'acceptabilité et l'observance du traitement.
Sur les 87 patients de notre étude, 58,62 % sont du
sexe masculin contre 41,38 % de sexe féminin, avec un sexe ratio
Homme/Femme de 1,42. Ces patients sont âgés en moyenne de 65,07
+/- 0,12 ans. La tranche d'âge la plus touchée est celle de 50
à 79 ans qui constitue 83,90 % de notre population. Dans 20,69 % des
cas, nos patients présentent des antécédents
d'hypertension artérielle et dans 13,79 %, de diabète. La
cataracte est présente chez 35,63 % des patients.
A la 1ère consultation, le schéma
thérapeutique prédominant est la monothérapie (47,13 %),
alors qu'à la troisième consultation, la bithérapie est de
50,88 % contre 38,35 % pour la monothérapie et 10,77 % pour la
trithérapie.
A la 1ère consultation, la PIO moyenne des
patients était de 30,86 +/- 0,12 mmHg. Sous l'effet du traitement, elle
s'est stabilisée en moyenne autour de 19,94 +/- 0,15 et 19,23 +/- 0,15
mmHg à la 3ème et 4ème consultation
respectivement.
En monothérapie, les prostaglandines présentent
une meilleure efficacité avec une baisse moyenne de la PIO de 43,35 +/-
3,06 %. Cet effet est encore plus important lorsque les prostaglandines sont
associées aux mydriatiques (57,14 %) ou aux myotiques (53,85 %). Dans
notre étude, une bithérapie associant les prostaglandines aux
bêtabloquants diminue l'effet hypotenseur oculaire des prostaglandines
(24,91 +/- 1,94 % vs 43,35 +/- 3,06 %).
En trithérapie, en association avec un
bêtabloquant + un IAC ou encore un bêtabloquant + un mydriatique,
les prostaglandines présentent un effet hypotenseur moins important que
lorsqu'elles sont utilisées en monothérapie.
Certaines classes thérapeutiques entraînent une
baisse de la PIO moins importante que celle obtenue avec les prostaglandines.
En effet, les bêtabloquants et les IAC diminuent la PIO de 8,68 +/- 1,12
% et de 12,38 +/- 6,30 % respectivement, lorsqu'ils sont utilisés en
monothérapie.
Les résultats de notre étude montrent
également que l'observance au traitement est excellente dans 54,59 % des
cas et satisfaisante dans 25 % des cas.
Des cas d'échecs thérapeutiques ont
été notés. En effet sur les 131 yeux traités, 24
d'entre eux, soit 18,32 %, ont fait l'objet d'interventions chirurgicales.
En résume, le GPAO, lorsqu'il est dépisté
précocement, peut être pris en charge par un traitement
médical qui assure en général une normalisation de la PIO.
Les bêtabloquants et les IAC seraient mieux indiqués dans les
hypertensions intraoculaires modérées et surtout en
monothérapie. Les médicaments de choix du traitement de
l'hypertension intraoculaire importante seraient les prostaglandines en
monothérapie ou en association avec les mydriatiques. Les
trithérapies, même associant les prostaglandines, ne seraient pas
les meilleurs schémas thérapeutiques, puisqu'elles
n'entraînent pas, en général, une meilleure baisse de la
PIO que les schémas de mono- et bithérapies.
Bibliographie
[1] AKINHBEHIN T. , VILLAD JR.
Metipranolol-associated granulomatous anterior uveitis.
Br J Ophlhalmol., 1991 ; 75 : 519- 524.
[2] ALM A., VILLUMSEN J.
PhXA34, a new potent ocular hypotensive drug. A study on
dose-response relationship and on aqueous humor dynâmics in healthy
volunteers.
Arc Ophthalmol., 1991 ; 109 : 1564-1568.
[3] ALM A., STJERNCHANTZ J.
Effects on intraocular pressure and side effects of 0.005 %
Latanoprost applied once daily. evening or mornlng. Acomparison with timolol.
Ophthalmology, 1995 ; 102 : 1743-1752.
[4] ALWARD WL.
The requisites in ophthalmology.
Dans Krachmer, J.S. (éd.), Glaucoma. Mosby, St-Louis
(2000) : 10-14.
[5] AUIDUGE A., AUZEMERY A., CESSON JF., DUCOUSSO
F.
La stratégie de lutte contre le glaucome.
Cahiers santé, 1998 ; 8 : 157-158.
[6] BÉCHETOILLE A.
Glaucomes primitifs par fermeture de l'angle.
EMC (Paris-France) ; 21280A10 ; 1989 ; 4 : 16.
[7] BECHETOILLE.A
Les glaucomes.
2 édition Jappenard, 1997 ; 1 : 7.
[8] BECHETOILLE A., BRON A.
Les bonnes pratiques thérapeutiques de glaucome chronique
à angle ouvert.
Journal français d'ophtalmologie, 2000 ;
23 : 272-277.
[9] BERSON FG., COHEN HB., FOERSTER RJ., LASS JH.,
Levobunolol compared with timolol for the long, term control of
elevated Intraocular pressure.
Arch Ophthalmol., 1985 ; 103 : 379-382.
[10] BRON A., LIPPA EA., GUNNING F.
Multiple dose efficacy comparison of the two topical carbonic
anhydrase inhibitors sezolamide and MK-927.
Arch Ophthalmol., 1991 ; 109 : 50-53.
[11] BRON A.
Traitement des glaucomes.
La revue du praticien, 2001, 51 : 2198-2201.
[12] BROWN FG., FLETCHER R.
Historical background and evolution of primary health care.
Modern Optometry. Glaucoma in Optometric Practice. Oxford :
Blackwell Scientific Publications, 1990 : 1-17.
[13] CAMRAS CB., PODOS SM.
The role of endogenous prostaglandins in clinically-used and
investigational glaucoma therapy. In: Bito LZ, Sternschantz J eds. The ocular
effects of prostaglandins and other eicosanoids.
New York: Alan R Liss, 1989.
[14] CAMRAS CB.
The Brinzolamide Primary Therapy Study Group. A triple-masked,
primary therapy study off the efficacy and safety of BID and TID-dosed
brinzolamide 1 % compared TID-dorzalamide 2 % and BID-dosed timolol 0.5 %.
Invest Ophthalmol Vis Sci., 1997 ; 38 : S560.
[15] CEPELIC J., CERMOHORSKY M.
The effects of adrenergic agonists on the adenylate cyclase in
albino rabbit ciliary processes.
Exp Eye Res., 1981 ; 32 : 291-299.
[16] CHANDLER ML., DE SANTIS L.
Studies of p-aminoclonidine as a potential antiglaucoma agent.
Invest Ophthalmol Vis Sci., 1985 ; 25 (suppl) : S227.
[17] CHEVALERAUD J.P.
L'examen du champ visuel.
EMC (Paris, France) ; 1986 ; 6 : 18.
[18] COAKES RL., BRUBAKER RS.
The mechanism 01 timolol in lowering intraocular pressure.
Arch Ophthalmol., 1981 ; 96 : 2045-2048.
[19] COLLIGNON, BRACH J.
Le glaucome par fermeture de l'angle.
J Fr Ophtalmol., 1984 ; 7 : 333-346.
[20] DANYLUK AW., PATON D.
Diagnosis and Management of Glaucoma.
Clinical Symposia (CIBA-GEIGY), 1992 ; 43: 3- 4.
[21] DENIS P.
Contribution à l'étude de la régulation
neuropharmacologique de la pression intra-oculaire.
Thèse, Paris, 1990.
[22] ENCARTA 2005
Encyclopédie ; Collection Microsoft ® Encarta
2005.
[23] ETIENNE R.
Le glaucome primitif à angle ouvert, comité de
lutte contre le glaucome
Simep, Ed. Villeurbanne; 1982 : 219.
[24] ETIENNE R.
Traitement médical et chirurgical des glaucomes.
Marseille: Diffusion générale de librairie ;
1987 : 1-329.
[25] FEITI ME., KRUPIN T.
Hyperosmotic agents. ln: Rich R. Shietds MB Krupin T
Eds. The glaucomas. St Louis: CV Mosby, 1989 : 551-555.
[26] FLAMENT J.
Ophtalmologie Pathologie du système visuel.
MASSON, 2002 : 219-247.
[27] FREEDMAN SF.; SHIEDS MB.; LOBAUGH B., SAMSA
GP.
Effects of ocular carteolol and timolol on plasma high-density
Iipoprotein cholesterol level.
Am J Ophthalmol, 1993 ; 116 : 600-604.
[28] GHARAGOZIOO NZ., LARSON NS., KULLERSTAND
W.
Terbutaline stimulates aqueous humor flow in humans during
sleep.
Arch Ophtalmol, 1989 ; 49 : 389-402.
[29] GLAUCOMA LASER TRIAL RESEARCH GROUP.
The Glaucoma Laser Trial (GLT). IV. Contralateral effects of
timolof on the intraocular pressure 0f eyes treated with ALT.
Opthalmic. Surg., 1991 ; 22: 234-240.
[30] HAMARD H.
Décision en ophtalmologie.
Editions VIGOT, 1993 : 78-91.
[31] HARRIS LS., GREENSTEIN SH., BLOOM AF.
Respiratory difficulties with betaxolol.
Am J Ophthalmol., 1986 ; 102 : 274-275.
[32] HENKIND P., PRIEST RS., SCHILLER G.
Glossary of clinical terms.
G. Compendium of Ophthalmology. Philadelphia: J.B. Lippincott
Company, 1983 : 122-124.
[33] HODAPP E., KOLKER A., KASS MA., GOLDBERG L., BECKER
B.
The effect of topical clonidine on intraocular pressure.
Arch Ophthalmol., 1981 ; 99 : 1208-1211.
[34] HOSKINS H.D.; KASS M.A.
Carbonic anhydrase inhibitors. ln: Becker-Shaffer's diagnosis and
therapy of the glaucomas.
ST Louis: CV Mosby, 1989 : 470-484.
[35] JAMPEL H., McGUIGHAN L.
Biology of experimental glaucoma filtering surgery failure.
Invest Ophtalmol Vis Sci., 1987 ; 28 : 378.
[36] KAHN HA., MILTON RC.
Alternative definitions of open-angle glaucoma, effet on
prevalence and association in the Framingham eye study.
Arch Ophtalmol., 1980 ; 98 : 2172-2177.
[37] KAUFMAN PL.
Pressure-dependent ouflow. In: Ritch E, Shields MB, Krupin T.
Eds. The glaucomas. St-Louis: CV Mosby, 1989.
[38] KERR CL., HAAS J., DRANCE S., WALTERS M., SCHULTZER
M.
Cardiovascular effects of epinephrine and dipivalyl epinephrine
applied topically to the eye in patients with glaucoma.
Br J Ophthalmol., 1982 ; 66 : 109-112.
[39] KITAZAWA Y., AZUMA L., ARAIE M., SHIRATO S.
Topical dorzolamide hydrochloride can be a substitute for oral
carbonic anhydrase inhibitors.
Invest Optlhalmol Vis Sci., 1994 ; 35 : S2177.
[40] KLAPPER RM.
Q-swiched neodinium : YAG laser iridectomy.
Ophtalmology, 1984 ; 91 : 1017-1021.
[41] KOHN AN., MOSS A., HARGETT N., RITCH R., SMITH H.
Clinical comparison of dipivalyl epinephrine and epinephrine ln
the treatment 0f glaucoma.
Am J Ophthalmol., 1980 ; 87 : 196-201.
[42] KOLKER AE., HETHERINGTON JJr.
Becker-shaeffer's diagnosis and therapy of the glaucomas.
C.V. Mosby Co. Ed. St Louis, 1993 : 608.
[43] KOSKELA T., BRUBAKER RF.
Apraclonidine and timolol. Cambined effects in previously
untreated normal subjects.
Arch Ophtalmol., 1991 ; 109 : 1069-1074.
[44] LACHKAR Y., BERKANI M.
Le glaucome.
Concours médical, 2001 ; 123 : 27.
[45] LAIBOVITZ R., STRAHLMAN ER., BARBER BL.
Comparison of quality of life and patient preference of
dorzolamide and pilocarpine as adjunctive therapy to timoIoI in the treatment
of glaucoma.
J Glaucoma., 1995 ; 4 : 306-31.
[46] LAURENCE J. et al.
A double-masked placebo-controlled evaluation of timolol in a gel
vehicule.
J Glaucoma., 1993 ; 2 : 177-180.
[47] LE JEUNNE C., BRINGER L., MONDJEE TZ., MUNERA Y.
Cardiovascular effects of eye drops containing timolol,
carteolol, metipranolol and betaxolol in elderly subjects.
Thérapie ; 1989 ; 43 : 89-92.
[48] LI Y., SCHLAMP CL., NICKELLS RW.
Experimental induction of retinal ganglion cell death in adult
mice.
Invest Ophthalmol Vis Sci., 1999 ; 40 : 1004-1008.
[49] LINDSEY JD., WEINREB RN.
Induction of c-Fos by prostaglandin F2a in human ciliary smooth
muscle cells. Invest Ophthalmol Vis Sci., 1994 ; 35 : 242-245.
[50] LIPPA EA., CARSTON LE., EHINGER B.
Dose response and duration of action of dorzolamide. A topical
carbonic anhydrase inhibitor.
Arch Ophthalmol., 1992 ; 110: 495-499.
[51] MANDAVA S., SWEENEY T., GUYER D.
Atlas de poche en couleur d'ophtalmologie.
FLAMMARION, 2001 : 238.
[52] MANDELL AI., STENTZ F., KITABCHI AE.
Dipivalyl epinephrine : a new pro-drug in the treatment of
glaucoma. Ophthalmology, 1981 ; 85 : 268-273.
[53] MAUS TL., LARSSON L., McLAREN JW., BRUBAKER RF.
Comparison of dorzolamide and acetazolamide as suppressors of
aqueous humor flow in humans.
Arch Ophthalmol., 1997 ; 115 : 45-49.
[54] NEUFELD A.H.
Influences of cyclic nucleotides on outflow facility in the
vervet monkey.
Exp Eye Res., 1981 ; 27 : 387-397.
[55] NEWELL W.
The Glaucomas. Édité par Klein EA. Ophthalmology
principles and concepts fifth.
Edition St-Louis : The C.V. Mosby Company, 1982 : 340-341.
[56] NGUYEN KD., SHIN DH.
Prevalence of apraclonidine allergy and its relationship to
propine allergy.
Invest Ophlhalmol Vis Sci., 1996 ; 37 : S1103.
[57] NILSON SF.
Studies on ocular blood flow and aqueous humor dynamics. Effects
of VIP and PHI related to the effects of facial nerve stimulation.
Acta Univ Uppsala., 1986 ; 43 : 1-38.
[58] NORDLUND JR., PASQUALE LR., ROBIN AL.
The cardiovascular pulmonary and ocular hypotensive effects of
0.2 % brimonidine.
Arch Ophthalmol., 1995 ; 113 : 77-83.
[59] OSBORNE NN., UGARTE M., CHAO M.
Neuroprotection in relation to retinal ischemia and relevance to
glaucoma.
Surv Ophthalmol., 1999 ; 43 : S102-S128.
[60] PILLUNAT L.; STODTMEISTER R.
Ellect of different antiglaucoma tous drugs on ocular perfusion
pressures.
J Ocul Pharmacol., 1988 ; 4 : 231-242.
[61] PLEILLER N.
Dorzolamide : development and clinical application of a topical
carbonic anhydrase inhibitor.
Surv Ophthalmol., 1997 ; 42 : 137-151.
[62] QUIGLEY HA., SANCHEZ RM.
Chronic glaucoma selectivity damages large optic nerve fibers.
Invest Ophthalmol Vis Sci., 1987 ; 28 :
913-920.
[63] REGEVAND GS.
Le glaucome : le nouveau rôle du médecin
traitant dans la prise en charge du patient glaucomateux.
Médecine et hygiène, 1999 ; 57 :
81-82.
[64] REISS GR., LEED DA., TOPPER JE., BRUBAKER
RF.
Aqueous humor flow during sleep.
Invest Ophthalmol Vis Sci., 1984 ; 25 :
776-778.
[65] ROBIN AL., POLIACK IP., DELALLER JM.
Effects 01 topical ALO2145 on the acute intraocular pressure use
after argon laser iridectomy.
Arch Ophlhalmol., 1987 ; 105 : 1208-1211.
[66] ROBIN AL.; Ritch R., Shin DH., Smythe B., Mundorf
T.
Short-term efficacy of apraclonidine hydrochloride added to
maximum-toleraled therapy for glaucoma.
Am J Ophthalmol., 1995 ; 120 : 423-432.
[67] RODRIGUES MM., SPAETH GL.
Electron microscopy of aragon laser therapy in phakic open-angle
glaucoma.
Ophthalmology, 1989 : 198-210.
[68] ROMANET JP., NOEL C.
Humeur aqueuse et pression intraoculaire.
EMC (Elsevier,Paris), Ophtalmologie ; 1998 : 8.
[69] ROUGIER J. ; MAUGERY J.
Ophtalmologie pour le praticien.
SIMEP, 1989 ; 82 : 1-4.
[70] RUGEVAND GS.
Le glaucome : le nouveau rôle du médecin
traitant dans la prise en charge du patient glaucomateux.
Médecine et hygiène, 1999 ; 57 :
81-82.
[71] RULO AH., GREVE EL., HOYNG PF.
Additive effect of latanoprost and timolol in patients wilh
elavated intraocular pressure.
Br J Ophthalmol., 1994 ; 78 : 899-902.
[72] SARAUX H., BIAIS B., ROSSAZZA C.
Ophtalmologie.
MASSON, 2eme edition ; 1988 : 217-234.
[73] SELEM G., STJERNSCHANTZ J., RESUL B.
Prostaglandin-induced iridial pigmentation in primates.
Surv ophthalmol., 1997 ; 41 : S125-128.
[74] SELLEM E., COTTIER F., MAUGERY J.
Efficacité et tolérance de la dipivéphrine
dans le traitement de l'hypertension intraoculaire primitive.
Bull Soc Ophtalmol., 1987 ; 5 : 675-680.
[75] SELLEM E.
Glaucome primitif à angle ouvert.
-Editions techniques- EMC (Paris, France), Ophtalmologie ;
1998 : 29.
[76] SELLEM E., DENIS P.
Pharmacologie des médications antiglaucomateuses.
EMC (Elsevier, Paris), 1998 : 11.
[77] SHARPE ED., SIMMONS RJ.
Aragon laser trabeculoplasty as a means of decreasing intraocular
pressure from normal levels un glaucomatous eyes.
Am J Ophtalmol., 1985 ; 99 : 704-707.
[78] SHIELDS MB., RICH R., KRUPIN T.
Classification of the glaucomas.
2nd ed., Mosby eds ; 1996 : 1-4.
[79] STEINERT RF., THOMAS JV., BOGER WP.
Long term drift an continued efficacy after multiyear timolol
therapy.
Arch Ophthalmol., 1981 ; 99 : 100-103.
[80] STEWART RH., KIMBROUGH RL., WARD RL.
Betaxolol versus timolol : a 6-month double-blind comparison.
Arch Ophthalmol., 1986 ; 104 : 46-48.
[81] STEWART W.C.
Carteolol. An ophtalmic-adrenergic blocker with intrinsic
sympathomimetic activy.
J Glaucoma., 1994 ; 3 : 339-342.
[82] STEWART WC., RITCH R., SHIN DH., LEHMANN RP.
The efficacy of apraclonidine as an adjunct to timolol therapy.
Arch Ophthalmol., 1995 ; 113 : 287-292.
[83] STJEMSCHANTZ J.
Prostaglandins as ocular hypotensive agents, development of an
analogue for glaucoma treatment.
Adv Protaglandin Thromboxane Leukof Res, 1995 ; 23 : 63-68.
[84] STRAHLMAN E.R.; TIPPING R.; VOGEL R.
International Dorzolamide Study Group. A double-masked.
randomized one-year study comparing dorzolamide (Trusopt), timolol and
betaxolol.
Arch Ophthalmol., 1995 ; 113 : 1009-1016.
[85] THE BRIMONIDINE-ALT STUDY GROUP
Effect of brimonidine 0.5 % on intraocular pressure spikes
following 360 degree argon laser trabeculoplasty.
Ophthalmic Surg Lasers, 1995 ; 26 : 404-409.
[86] THOMPSON CD., McDONALD TL., GARST ME., WIESE
A.
Mechanisms of adrenergic agonist Induced allergy bioactivation
and antigen formation.
Exp Eye Res., 1997 ; 64 : 767-773.
[87] TOWNSEND DJ., BRUBAKER RF.
Immediate effect of epinephrine on aqueous formation in the
normal human eye as measured by fluorophotometry.
Invest Ophthalmol Vis Sci., 1980 ; 19 : 256-259.
[88] Zimmerman TJ.
Les collyres â-bloquants : une revue comparative.
J Ocul Pharmacol., 1993 ; 9 : 4-12.
Annexes
Annexe 1 : Fiche
d'enquête
Fiche
N°:
Etat civil
N° d'entrée :
Age :
Sexe :
Antécédents personnels :
Examen ophtalmique initial
Date 1:
Pression intraoculaire : OD OG
Acuité visuelle sans correction : OD
OG
Acuité visuelle avec correction : OD
OG
Examen du champ visuel :
Examen de la papille (C/D) :
Autres examens :
Traitement
Antiglaucomateux : (1) (2)
(3)
Forme : (1) (2)
(3)
Posologie : (1) (2)
(3)
Traitement adjuvant : (a) (b)
(c)
Forme : (a)
(b) (c)
Posologie : (a)
(b) (c)
Consultations ultérieures :
Date 2:
Pression intraoculaire : OD OG
Acuité visuelle sans correction : OD
OG
Acuité visuelle avec correction : OD
OG
Antiglaucomateux : (1) (2)
(3)
Forme : (1) (2)
(3)
Posologie : (1) (2)
(3)
Traitement adjuvant : (a) (b)
(c)
Forme : (a)
(b) (c)
Posologie : (a)
(b) (c)
Remarques:
Date 3:
Pression intraoculaire : OD OG
Acuité visuelle sans correction : OD
OG
Acuité visuelle avec correction : OD
OG
Antiglaucomateux : (1) (2)
(3)
Forme : (1) (2)
(3)
Posologie : (1) (2)
(3)
Traitement adjuvant : (a) (b)
(c)
Forme : (a)
(b) (c)
Posologie : (a)
(b) (c)
Remarques :
Date 4:
Pression intraoculaire : OD OG
Acuité visuelle sans correction : OD
OG
Acuité visuelle avec correction : OD
OG
Antiglaucomateux : (1) (2)
(3)
Forme : (1) (2)
(3)
Posologie : (1) (2)
(3)
Traitement adjuvant : (a) (b)
(c)
Forme : (a)
(b) (c)
Posologie : (a)
(b) (c)
Remarques :
Renseignements
complémentaires
Remarques générales:
Complications :
Intervention chirurgicale :
Annexe 2 :
Questionnaire
-Preniez-vous votre traitement
régulièrement ?
Observance : Excellente
Satisfaisante
Moyenne
Faible
Nulle
-Comment trouvez-vous le coût du traitement ?
Coûteux
Abordable
Pas cher
-Avez-vous remarqué des effets secondaires ?
Oui (lesquels ?)
Non
- De manière générale, êtes-vous
satisfaits de l'effet du traitement ?
Oui
Non
Serment de GALIEN
Je jure, en présence des maîtres
de la faculté, des conseillers de l'ordre des pharmaciens et de mes
condisciples :
D'honorer ceux qui m'ont instruit dans les
préceptes de mon art et de leur témoigner ma reconnaissance en
restant fidèle a leur enseignement.
D'exercer dans l'intérêt de la
santé publique, ma profession avec conscience et de respecter non
seulement la législation en vigueur, mais aussi les règles de
l'honneur, de la probité et du désintéressement.
De ne jamais oublier ma responsabilité
et mes devoirs envers le malade et sa dignité humaine.
En aucun cas, je ne consentirai à
utiliser mes connaissances et mon état pour corrompre les moeurs ou
favoriser des actes criminels.
Que les hommes m'accordent leur estime si je
suis fidèle à mes promesses.
Que je sois couvert d'opprobre et
méprisé de mes confrères si j'y manque.
VU
VU
LE PRESIDENT DU JURY LE
DOYEN
VU ET PERMIS D'IMPRIMER
LE RECTEUR DE L'UNIVERSITE CHEIKH ANTA DIOP DE
DAKAR
| 


