INTRODUCTION
Les chercheurs, et plus particulièrement les
chimistes, s'intéressent depuis longtemps
aux nucléotides. Durant les années 50, la
découverte de la structure de l'acide
désoxyribonucléique (ADN) et la
compréhension du rôle des acides nucléiques au coeur des
cellules, ont suscité un vif intérêt au sein
du corps scientifique. L'inhibition du
fonctionnement des acides nucléiques a fait l'objet de
nombreux travaux en particulier il a
clairement été démontré que les
analogues de nucléosides interfèrent avec les
nucléosides
naturels, modifiant ainsi le métabolisme cellulaire. Les
propriétés thérapeutiques de ces
composés sont très variables : anti tumorales ou
antivirales. Ces dernières années, une grande
variété de composés hétérocycliques
soutenant l'anneau 1H-1,2,4-triazole Ont été due
synthétisés à leurs activités biologiques de large
spectre comprenant
activities5-7 :
anti-inflammatoire, insecticide, antiviral et anti tumoral, dont certaines ont
été développées en agents commercialement
antifongiques tels que le triadimefon, le triadimenol et le diniconazole ils
ont précédemment synthétisé beaucoup de genres de
composés hétérocycliques tels que les
dérivés 1,3,4-oxadiazole, 1,2,4-triazole, 1,3,4-thiadiazole et
1,2,3-triazole qui ont montré la croissance
8-10de normalisation :antibactérienne,
antituberculose et de plantes. Il est bien connu que la synthèse des
nucléosides tende à contenir la multi-structure dans une
molécule. L'activité biologique d'un Nucléoside
peut être améliorée par la promotion de sa
combinaison avec la microstructure des cellules et de l'accumulation de
diverses activités biologiques résultant de l'incorporation de
différents noyaux hétérocycliques et
non-hétérocycliques dans elle. Incité par les faits
mentionnés ci-dessus et en vue de obtenez nouveau et améliorez
les agents biologiquement actifs.
Dans ce chapitre introductif, nous nous proposons de
décrire la structure des
nucléosides ainsi que leurs rôles dans les
traitements de l'herpès. Cela passera par
une nécessaire présentation d'autres notions que
sont les nucléotides, les polynucléotides ainsi
que les acides nucléiques.
A- 2-1- LES NUCLEOSIDES ET NUCLEOTIDES :
DEFINITION, STRUCTURE
Comme nous l'avons mentionné dans l'introduction
générale, les nucléosides sont des
molécules naturelles d'une importance capitale car ils
jouent un rôle essentiel dans de très
nombreux processus biologiques. Ce sont des précurseurs de
l'acide désoxyribonucléique
(ADN) et de l'acide ribonucléique (ARN) .
Les nucléosides sont des
glycosylamines8 faits en attachant un
nucléobase (souvent désigné simplement sous le nom de la
base) à un ribose ou à un anneau de deoxyribose. Les exemples de
ces derniers incluent la cytidine, l'uridine, l'adénosine, la guanosine,
la thymidine et l'inosine. En bref, un nucléoside est une base
liée pour sucrer. Les nucléosides peuvent être
phosphorylés par les kinases spécifiques dans la cellule,
produisant les nucléotides, qui sont les modules moléculaires de
l'ADN et de l'ARN.
Des nucléosides sont produits pendant que la
deuxième étape dans la digestion d'acide nucléique, par
lequel les nucleotidases décomposent des nucléotides (tels que le
nucléotide de thymine) en nucléosides (tels que la thymidine) et
phosphate. Les nucléosides, à leur tour, sont plus tard
décomposés en lumen du système digestif par des
nucleosidases en bases et ribose (ou deoxyribose) azoté, et
intérieur la cellule par des phosphorylases de nucléoside en
bases azotées, et ribose-1-phosphate (ou deoxyribose-1-phosphate).
Des nucléosides peuvent être produits en
combinant des nucléobases avec des anneaux de deoxyribose aussi bien
(Figure A-4). Les nucléosides diffèrent des
nucléotides en ayant un groupe d'hydroxyle attaché au carbone le
numéro 5 (celui qui ne sont pas dans l'anneau) du ribose, plutôt
que d'un ou plusieurs des groupes de phosphate.
Ces acides sont constitués de sous unités
appelées nucléotides, qui renferment le patrimoine
héréditaire de chaque individu et le code
génétique permettant à chaque cellule de reproduire
deux cellules filles en tous points identiques aux modèles
parentaux.
Du point de vue structural, les nucléosides
résultent de l'assemblage d'une base azotée
(purique ou pyrimidique) et d'une partie glucidique (ribose pour
l'ARN et désoxyribose pour
l'ADN), reliées entre elles par une liaison carbone-azote
(Figure A-4)
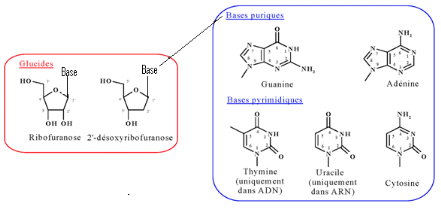
Fig A-4- Structure générale d'un
nucléoside
Les nucléotides résultent de la phosphorylation
des nucléosides. Ainsi on appelle nucléotide, tout motif complet
qui comporte un groupe phosphate, un sucre et une base azotée
(Figure A-5).
La liaison entre les différents nucléosides d'un
nucléotide est assurée par de l'acide
phosphorique qui estérifie les fonctions alcool en
position 3' et 5' du sucre.
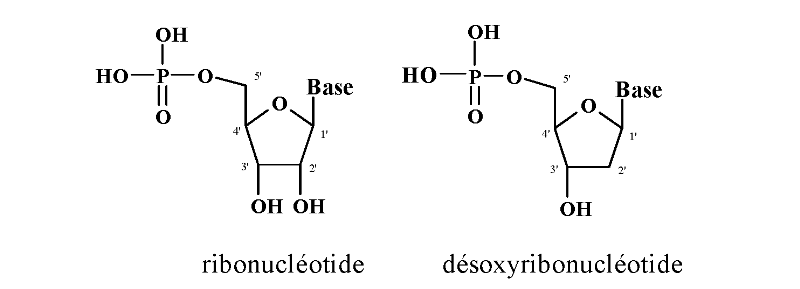
Fig A-5 : Structure
général de ribo- et désoxyribonucléotide
On appelle oligonucléotides et
polynucléotides , des macromolécules constituées par
L'enchaînement de plusieurs nucléotides
reliés entre eux par une liaison 3',5'-phosphodiester.
Un seul groupement phosphoryle réunit les deux
nucléotides contigus en estérifiant d'une part
L'hydroxyle en position 3' d'un premier nucléotide et
d'autre part l'hydroxyle en position 5'
de l'autre nucléotide (Figure A-6).
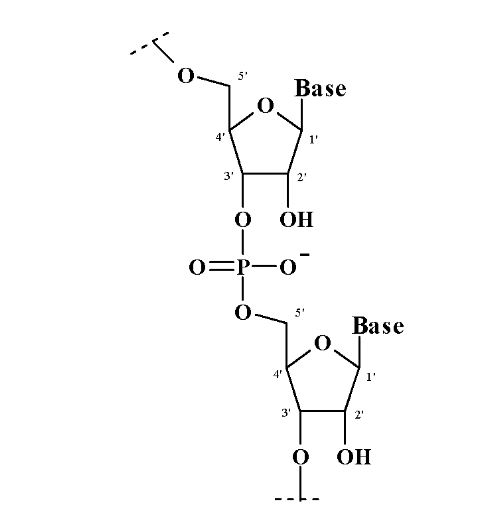
Fig A-6 : Schéma d'un
binucléotide
A- 2-2- STRUCTURE ET FONCTION DE L'ADN
J.D. Watson et F.H.C. Crick.1 ont proposé en 1953, une
structure de l'ADN. Elle
Comprend deux chaînes de poly nucléotides
présentant dans l'espace une configuration
hélicoïdale : elles s'enroulent autour d'un axe
central imaginaire en formant une double hélice
(Figure A-7).
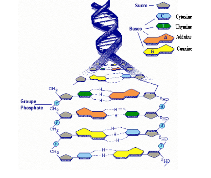
Fig A-7 : Structure de l'ADN
Ces deux brins de nucléotides sont
antiparallèles, les deux squelettes pentose-phosphate se
trouvent sur les bordures extérieurs de l'hélice,
alors que les bases azotées se font face à
l'intérieur et s'apparient par des liaisons
hydrogène qui maintiennent ensemble les deux brins.
Dans cette double hélice, chacune des bases azotées
a un complément exclusif : l'adénine est
toujours appariée avec la thymine et la guanine avec la
cytosine (ces bases sont
respectivement représentées par les lettres A, T, G
et C). (Figure A-8).
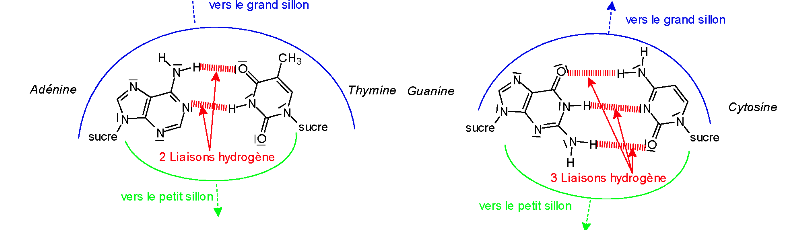
Fig A-8 : Appariement des bases par liaisons
hydrogène
A-2-3- Naturels
Nucléosides
Dans la dernière partie du 20ème siècle
l'industrie pharmaceutique a développé un intérêt
croissant pour les analogues des nucléotides et des nucléosides.
Les nucléotides sont des esters de phosphate des
nucléosides, se composant d'une partie de sucre, d'un ribose
(â--D-ribofuranose) et d'un désoxyribose 2 (2-deoxy- â
-D-ribofuranose), respectivement ; ceux-ci sont liés à une base
de purine ou de pyrimidine par une obligation â -N-glycosidique par N9 de
la purine et du N1 de la base hétérocyclique de pyrimidine.
L'adénine de bases de purine (6-aminopurine) et la
guanine (2-amino-6-oxypurine) sont communes à l'ARN et à l'ADN,
de même que la cytosine de base de pyrimidine (aminopyrimidine 2-oxy-4-).
Cependant, le uracile de base de pyrimidine (2,4-dioxy-pyrimidine) est
seulement trouvé en ARN tandis que thymine, (pyrimidine
2,4-dioxy-5-méthyle) l'appareillement bas l'équivalent, est
trouvé en ADN. Invariablement, en tous les nucléosides naturels,
la configuration au centre anomérique (C-1 ') est â. Tableau
A-2-1
En 1909, on a proposé le terme "nucléoside" par
Levene et Jacobs pour décrire les dérivés d'hydrate de
carbone des purines et du pyrimidines11.(adenine ou
la guanine) ou la base hétérocyclique de pyrimidine (cytosine,
thymine ou uracile) par l'intermédiaire d'une obligation glycosidique,
par le N-9 de la purine ou le N-1 de la base de pyrimidine .
Il n'avait pas lieu jusqu'aux années 60, cette chimie
impliquant des nucléosides et des nucléotides a fourni
l'infrastructure fondamentale et la méthodologie synthétique
nécessaires pour produire de nombreux nucléosides naturels et
structurellement modifiés biologiquement actifs. L'activité
biologique des agents anticancéreux tels que 5-fluoro-2'-deoxyuridine
(FUDR), arabinosylcytidine (ara-C), 8-azainosine, avec la découverte
d'un nucléoside antiviral efficace :arabinosyladenosine (ara-A) et
l'agent antitumoral , toyocamycin a indiqué
la valeur potentielle des analogues modifiés de
nucléoside en tant qu'agents chimio-
thérapeutiques12 ;13
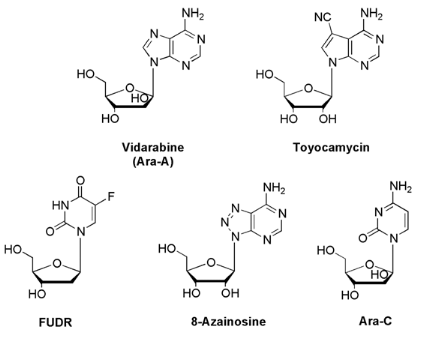
Fig A-9- Nucléosides Agents
chimiothérapie
Plus tard ; l'importance de ces analogues de
nucléoside a été réaffirmée avec
l'apparition d'HIV comme agent étiologique principal
d'AIDS.14 que la première drogue
approuvée pour le traitement d'HIV était le nucléoside
modifié AZT qui empêche HIV-1
transcriptase.15 renversé
en outre, plusieurs autres analogues de nucléoside impliqués dans
l'inhibition du transcriptase HIV-1 renversé, à savoir le ddC, le
ddI, les d4T et les 3TC, ont fourni bien plus de signification à
l'utilisation des analogues de nucléoside en tant qu'agents
chimiothérapeutiques biologiquement efficaces (le figure
A-10).14,16 ,17
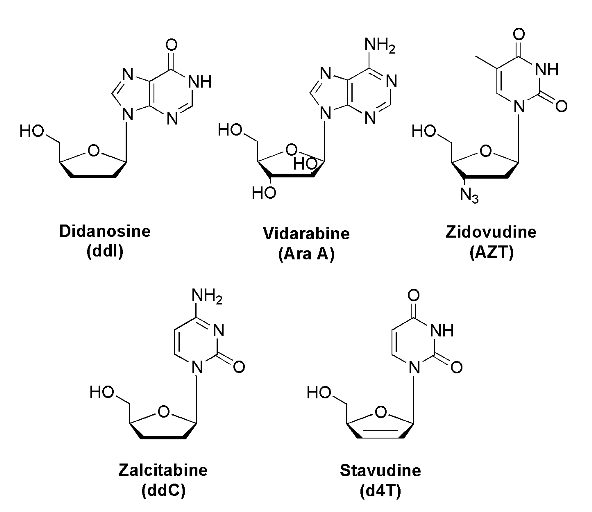
Fig A-10- Nucléoside efficaces de
HIV
D'autres approches aux modifications des purines ont
impliqué l'incorporation d'autres hétéroatomes tels que le
soufre ou l'oxygène, qui permettent à la partie
hétérocyclique de maintenir son
aromaticité18. Les modifications impliquant
d'autres bases hétéro aromatique telles que le démuni de
pyrimidines aussi intensivement étudié que des purines,
cependant, leurs modifications ont principalement eu comme conséquence
les nucléosides pyrimidine-basés par aza/deaza et les
systèmes19 prolongés d'anneau de
pyrimidine. 5-Azacytidine, avec son analogue 2'-deoxy, a montré
l'activité biologique significative contre des cellules de la
leucémie L1210 et est actuellement employé dans la
médicine.
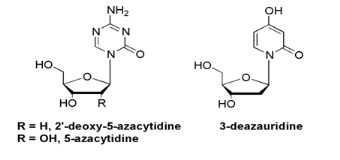
Fig A-11- Nucléosides pyrimidine
modifiés biologiquement efficaces
Une autre modification structurale qui a été
intensivement employée est le remplacement isosteric de l'oxygène
de furanose de la partie de sucre avec une sous-unité de
méthylène (où X = CH2) ayant pour
résultat un nucléoside carbocyclique (Figure A-12).
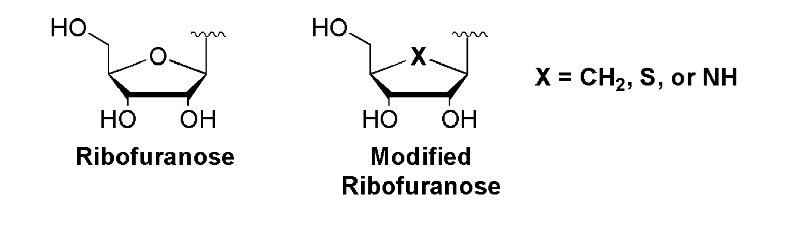
Fig A-12- Quelques
modifications de la partie de ribose
Tableau A-2-1. Nucléoside et deoxynucleoside naturale
A-2-4- Description et Classification des
Analogues de Nucléosides:
Dans la médecine plusieurs analogues de
nucléoside sont employés en tant qu'agents antiviraux ou
anticancéreux. La polymérase virale incorpore ces composés
avec des bases de non-canon. Ces composés sont activés dans les
cellules en étant converti en nucléotides, ils sont
administrés comme nucléosides puisque les nucléotides
chargés ne peuvent pas facilement croiser des membranes de
cellules5. Dans la biologie moléculaire
plusieurs analogues de sucre de l'épine dorsal existent. En raison de la
basse stabilité de l'ARN, qui est enclin à l'hydrolyse, on
emploie plusieurs analogues plus stables de l'alternative nucleoside/nucleotide
qui lient correctement à l'ARN10. Ceci est
réalisé en employant un sucre différent d'épine
dorsale. Ces analogues incluent LNA, le morpholino, PNA.
Un acide nucléique verrouillé
(LNA)8 (Figure A-13) souvent désigné
sous le nom de l'ARN inaccessible, est un nucléotide modifié
d'ARN. La partie de ribose d'un nucléotide de LNA est modifiée
avec un pont supplémentaire reliant les carbones 2'et 4'.
L'acide nucléique de peptide
(PNA)8 :est un polymère artificiellement
synthétisé semblable à l'ADN ou à l'ARN et est
employé dans la recherche biologique et les traitements médicaux.
PNA n'est pas connu pour se produire naturellement sous les formes modernes de
la vie.
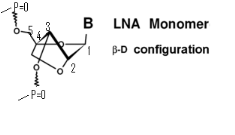
Fig
A-13- Acide nucléique verrouillé LNA
Ces bandes de nucléotides d'un sucre non-canon,
dideoxyribose qui manque du groupe de l'hydroxyle 3'(qui accepte le phosphate)
et ne peut pas donc obligation avec la prochaine base, terminant la
chaîne comme les polymérases d'ADN la confondent avec un
deoxyribonucleotide régulier.
Les analogues de nucléosides9
constituent des structures aptes à inhiber les virus ;
Les nucléosides sont classifiés dans deux
catégories principales :
des N-nucléosides et des C-nucléosides. Les
anciens sont des nucléosides ayant une obligation entre le carbone
anomérique de la partie de sucre et l'azote de la partie basse tandis
que les derniers ont une obligation entre le carbone anomérique et le
carbone de la base.
En outre, chaque partie du sucre ou de la base peut être
modifiée. Les changements de la partie de sucre de nucléosides
incluent des modifications des substituants de sucre et du remplacement de
l'oxygène avec un autre atome. Ces changements peuvent produire des
variations importantes d'activité et de degré
biologiques10 de toxicité sélective,
aussi bien que dans leurs propriétés chimiques et physiques
respectives. En particulier, les modifications du 2'- et les 3'- des positions
ont produit des composés avec une large gamme d'activité
biologique.
La substitution de l'oxygène 4'-d'anneau avec d'autres
hétéroatomes affecte la conformation et les
propriétés biologiques du nucléoside. Des
nucléosides dont X l'oxygène d'anneau du sucre est
remplacé par le carbone, l'azote, le soufre, et le phosphore s'appellent
généralement les nucléosides carbocycliques,
azanucléosides, thionucléosides, et phosphanucléosides,
respectivement (Figure A-14). Un exemple d'une utilisation
médicale de cette classe des nucléosides a été le
4'-thionucleosides, qui montre un large spectre d'activité biologique et
de stabilité chimique et enzymatique
augmentée6.
Les nucléosides cycliques,
Ces nucléosides sont des didésoxynucléosides qui, sous
leur forme triphosphatée, interfèrent avec la réplication
virale de deux manières : soit en inhibant la transcriptase inverse par
compétition avec les substrats naturels, soit par incorporation dans la
chaîne d'ADN proviral en formation20. Dans ce
dernier cas ils agissent en tant que terminateurs de la chaîne du fait
qu'ils ne possèdent pas d'hydroxyle en 3'.
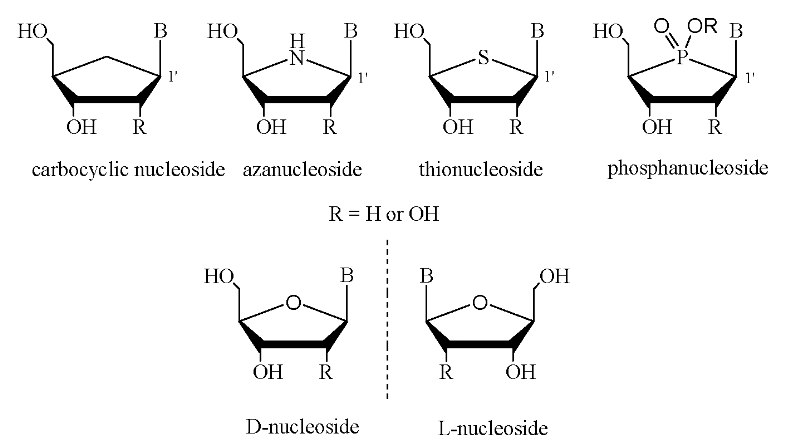
Fig A-14- Analogues de Nucléoside
CLASSIFICATIONS DES ANALOGUES DE
NUCLEOSIDES
Nucléosides Cycliques
Nucléosides Acycliques
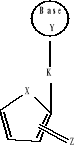
Seco-AcycloNucléoside
Acyclo Nucléoside
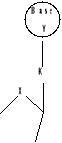
X=O,N,S,P,C,Si......ect
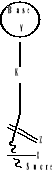
X=O: Nucléoside
(Normal)
X=N : Azanucleoside
X=S : Thionucleoside
X= P : Phosphanucleoside
X= C : Carboxylique nucleoside
Z=Zero,1,2,3,......ect ; Y= N,O,S,C, ..ect; K=
Zero;,N,O,S,C,.ect
X-Cyclique-Y ;K-Nucléoside
X-Acyclo-Y ;K-Nucléoside
X-Seco-Acyclo-Y ;K-Nucléoside
X= O= Normal
Nucléoside
Y,K=N: Cyclo -N-Nucleoside
Acyclo-N-Nucleoside
Seco-Acyclo-N-Nucleoside
Y,K=O: Cyclo -O-Nucleoside
Acyclo-O-Nucleoside Seco-Acyclo-O
-Nucleoside
Y,K=S: Cyclo -S-Nucleoside
Acyclo-S-Nucleoside Seco-Acyclo-S
-Nucleoside
Y,K=C: Cyclo-C- Nucleoside
Acyclo-C-nucleoside Seco-Acyclo-C
-Nucleoside
X=N= Aza Nucléoside
Y,K= N Aza-Cyclo-N-Nucléoside
Aza-Acyclo-N-Nucléoside
Aza-Seco-Acyclo-N-Nucléoside
Y,K=O Aza-Cyclo-O-Nucléoside
Aza-Acyclo-O-Nucléoside
Aza-Seco-Acyclo-O-Nucléoside
Y,K=S Aza-Cyclo-S -Nucléoside
Aza-Acyclo-S -Nucléoside Aza-Seco-Acyclo-S
-Nucléoside
Y,K=C Aza-Cyclo-C -Nucléoside
Aza-Acyclo-C -Nucléoside Aza-Seco-Acyclo-C
-Nucléoside
X=S =Thio Nucléoside
Y,K= N Thio-Cyclo-N-Nucléoside
Thio-Acyclo-N-Nucléoside
Thio-Seco-Acyclo-N-Nucléoside
Y,K=O
Thio-Cyclo-O-Nucléoside
Thio-Acyclo-O-Nucléoside
Thio-Seco-Acyclo-O-Nucléoside
Y,K=S Thio-Cyclo-S -Nucléoside
Thio-Acyclo-S -Nucléoside Thio-Seco-Acyclo-S
-Nucléoside
Y,K=C Thio-Cyclo-C -Nucléoside
Thio-Acyclo-C -Nucléoside Thio-Seco-Acyclo-C
-Nucléoside
X=C = Carboxylique
Nucléoside
Y,K= N
Carbo-Cyclo-N-Nucléoside
Carbo-Acyclo-N-Nucléoside
Carbo-Seco-Acyclo-N-Nucléoside
Y,K=O Carbo-Cyclo-O-Nucléoside
Carbo-Acyclo-O-Nucléoside
Carbo-Seco-Acyclo-O-Nucléoside
Y,K=S Carbo-Cyclo-S
-Nucléoside Carbo-Acyclo-S -Nucléoside
Carbo-Seco-Acyclo-S -Nucléoside
Y,K=C Carbo-Cyclo-C -Nucléoside
Carbo-Acyclo-C -Nucléoside
Carbo-Seco-Acyclo-C -Nucléoside
Fig A-15-Classification des Nucléosides
et des Analogues de Nucléoside
Ø Pour X= O et Y= N :
Cyclique-N-Nucléoside, exemple :
est le plus grand groupe ; les membres classiques sont (T),
21-23 3'-amino-3'-deoxyadenosine 24
-25 (Fig A-16) le decoyinine (angustmycin A);
psicofuranine (d'angustmycinC) 26 -27;
3'-deoxyadenosine (cordycepin) 28-29, et
arabinofuranosyladenine (Ara A).
Ils sont tous les analogues d'adénosine avec des sucres
modifiés. Le triphosphate de Cordycepin a été
employé intensivement pour étudier le mécanisme
synthèse de ARN. Ara A, d'abord d'isolement dans l'éponge marine
et plus tard des filtrats de culture de streptomyces
d'antibiotiques30-31, est employé
actuellement comme agent antiviral. 2'-Amino-2'-deoxyadenosine (Fig
A-16) a été découvert comme métabolite
d'Actinomadura ayant l'activité
d'antimycoplasma32.
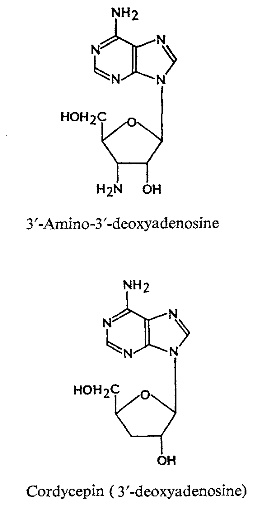 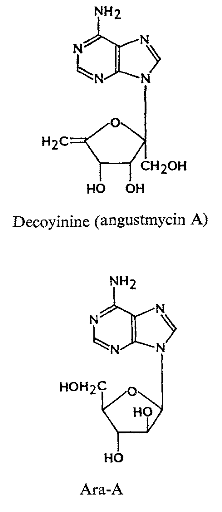 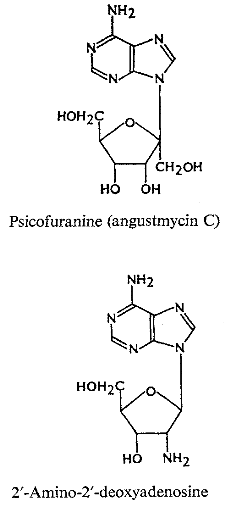
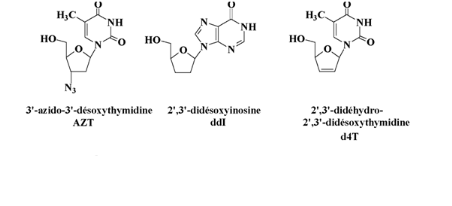
Fig A-16-Cyclique -N-nucléoside
Avec :l'AZT (Retrovir®),33
le ddI (Videx®)34,
le d4T (Zerit®)35
Ø Pour X=O et
Y=C :Cyclique-C-Nucléoside , exemple :
Formycins A (Fig A-17) et B sont des
nucléosides de pyrazolopyrimidine. Pyrazomycin (pyrazofurin) est un
nucléoside de pyrazole. Showdomycin a un anneau de maleimide et le
minimycin (oxazinomyciri) a un anneau d'oxazinedione. La chimie et la biologie
de ce groupe ont été intensivement passé en
revue36-39 .que ce groupe de nucléoside a
été montré pour avoir un précurseur
biosynthétique commun, glutamate et comme montré
dans (Fig A-17), l'anneau de maleimide du showdomycin
est formée de carbons-2, 3, 4 et 5 de
glutamate40-41 ,cependant de minimycin utilise les
carbones-3, 4 et 5,42 -43et l'anneau de pyrazole de
formycin44 -45et de
pyrazofurin46 est formé de les carbones-1,
2, 3 et 4.
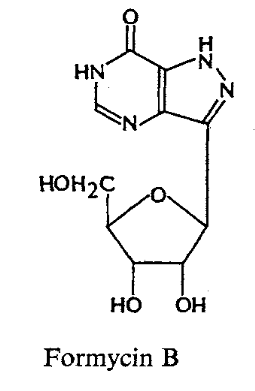 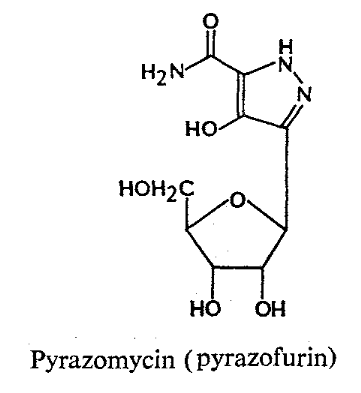 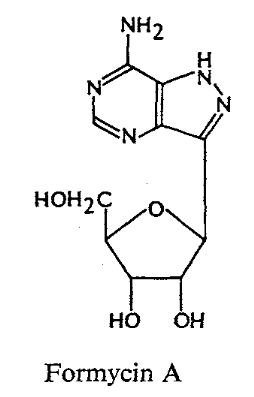 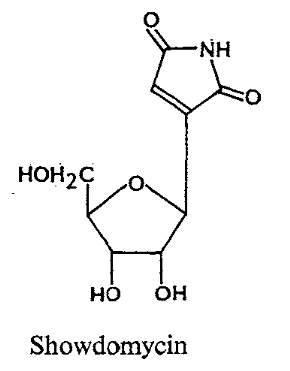 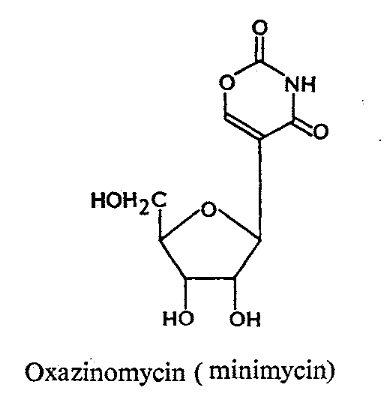
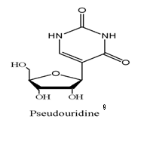
Fig A-17-Cyclique -C -nucléoside
Les C-Nucléosides ont C1 'de leurs parties de sucre
liées à différents hétérocycles par une
obligation de carbone-carbone. Bien que les N-nucléosides, avec un lien
glycosidique de
C1'-N soient naturellement prédominants, il y a
également les C-nucléosides normaux, avec un lien glycosidique de
C1'-C.
Due à leur obligation glycosidique de c-c,
C-nucléosides sont stable à l'hydrolyse enzymatique et montrent
souvent les propriétés d'antibactérien, antivirales et
antitumorales. En outre, beaucoup de C-nucléosides normaux et
artificiels ont été récemment synthétisés et
on l'a constaté que la plupart d'entre elles possède des
activités biochimiques.
Isonucleosides sont une classe spéciale des
nucléosides modifiés en lesquels la partie basse est
située le carbone à 2'- ou à 3'- de sucre.
La synthèse des isonucléosides est basée sur
le fait que même avec la transposition de la base
hétérocyclique au 2'- ou 3'-position, l'arrangement spatial entre
la base et le groupe 5'-hydroxy est maintenu, et la "nouvelle" obligation
glycosidique est plus stable vers l'hydrolyse enzymatique que la
classique6.
les L-nucléosides, les énantiomères des
D-nucléosides normaux, ne sont pas généralement
identifiés par les enzymes mammifères normales, mais sont
identifiés par les enzymes virus-codées ou bactériennes.
Ceci a comme conséquence la toxicité minimale de centre serveur
et la bonne activité d'antiviral/antibacterial. Par conséquent
elles sont récemment devenues d'intérêt en raison de leur
activité antivirale potentielle contre
HIV6.
Ø Pour X=O et K=O Cyclique-O
-Nucléoside , exemple :
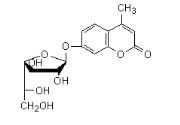
Ø Pour X=O et K=S Cyclique-S
-Nucléoside : exemple :
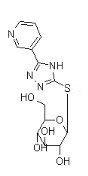
Ø Pour X= N , Y= N :Aza-Cyclique
-N-Nucléoside :
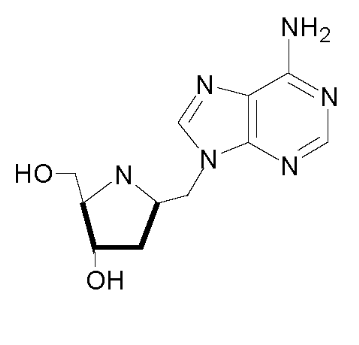
Fig A-18-
Azanucleoside47
Ø Pour X= N , K=O :Aza-Cyclique
-O-Nucléoside : Formule
Générale :
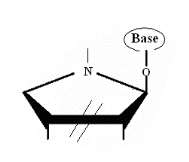
Ø Pour X= N , K=S :Aza-Cyclique
-S-Nucléoside : Formule
Générale :
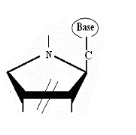
Ø Pour X= N ,
K=C :Aza-Cyclique -C-Nucléoside : Formule
Générale :
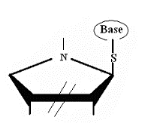
Ø Pour X= S , Y= N :
,Thio-Cyclique-N-Nucléoside
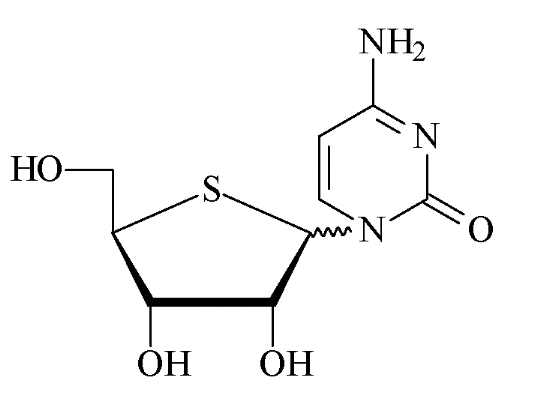
Fig A-19 -
Cytidin48
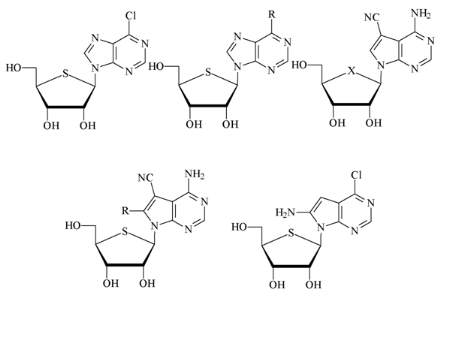
Fig A-20- Derivées de
4'-Thiotoyocamycin
en 1972, à des Bobek, Whistler et
Bloch49 ont réussi les
4'-Thio-Derivées de composé de l'antibiotique Toyocamycin
(7-Cyano-7-deazaadenosin,) 50,51 (Fig
A-20) ainsi que les autres dérivés
représentés. Le Toyocamycin lui-même est plus significatif
un dérivé dans pur importante d'activité anti-Tumeur. Tous
le Nucléoside représenté ont montré clairement un
effet inhibitrice sur cela dans vitro-Wachstum de L-1210 les cellules.
4'Thiotoyocamycin lui-même se sont avérés dehors plus
activement.
Ø Pour X= S , K=O : Thio-Cyclique-O
-Nucléoside : exemple:
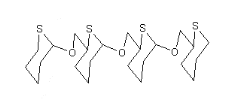
Biothiopolymére
Ø Pour X= S , K=S : ,Thio-Cyclique-S
-Nucléoside: exemple:
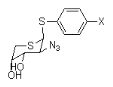
Ø Pour X=S, Y= C : Thio-Cyclique -C
-Nucléoside : exemple :
Fig
A-21-Tiazofurin52
Les nucléosides carboxyliques, en lesquels la partie
de D-ribose du nucléoside est remplacée par un système de
cyclopentane 53, sont stables vers l'hydrolyse par
des phosphorylases et montrent souvent le biostabilité augmenté.
Le remplacement d'Isostérique de l'oxygène du furanose avec un
groupe de méthylène a été montré pour avoir
non seulement comme conséquence la résistance enzymatique
améliorée54;55, mais la
toxicité également réduite des nucléosides
carbocycliques comparés aux
conventionnels56.
Cette modification structurale qui a été
intensivement employée est le remplacement de l'oxygène de la
partie de sucre avec une sous-unité de méthylène
(où X = CH2-) ayant pour résultat un nucléoside
carbocyclique.
Ø Pour X= C ,Y= N : Carbocyclique-N
-Nucléoside :

Fig A-22-
Lobucavir57
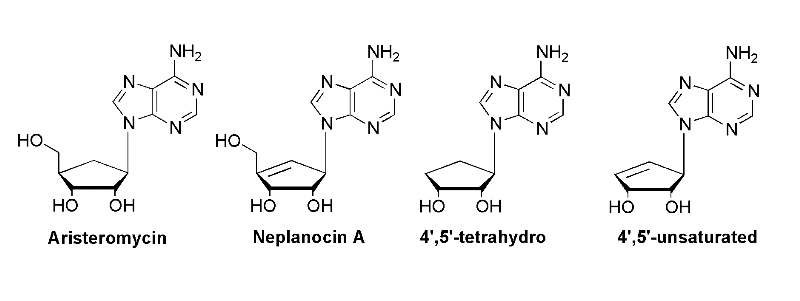
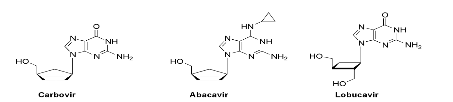
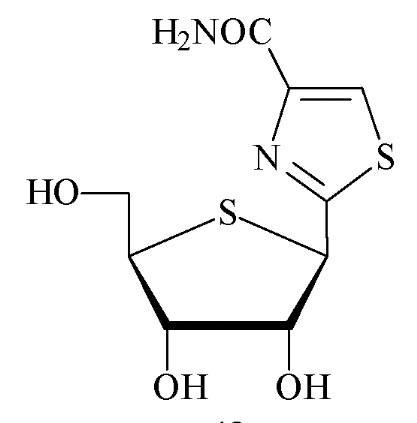
Fig A-23- Nucléosides Carbocycliques
Antiviraux
l'aristeromycin et le neplanocin A Carbocycliques et
leur dérivées ont montré l'activité biologique
significative contre SAHase et ADN MeTase, une autre cible enzymatique
importante pour les agents antiviraux, antiparasitaires et anticancéreux
(Fig A-23).58,59 bien que les
nucléosides carbocylique soient synthétiquement provocants, une
génération des nucléosides carbocycliques antiviraux
extrêmement efficaces tels que le carbovir, l'abacavir et le lobucavir
ont été produits.
Ø Pour X= C ,K =O : Carbocyclique-O
-Nucléoside : Formule
Générale :
Ø Pour X= C , K =S : Carbocyclique-S
-Nucléoside : Formule
Générale :
Ø Pour X=C , Y= C :Carbocyclique-C
-Nucléoside :
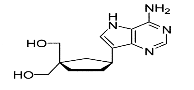
Fig A- 24-
[3-(4-Amino-5H-pyrrolo[3,2-d]pyrimidin-7-yl)-1-hydroxymethylcyclopentyl]
Methanol52
Les efforts étendus dans la recherche des
agents chimiothérapeutiques contre le cancer et la maladie infectieuse
virale ont mené à la découverte d'une
variété d'analogues biologiquement actifs de nucléoside, y
compris nucleosides60 carbocyclique
abacavir61 et
C-nucléosides62. C-nucléoside
carbocyclique est une classe unique des nucléosides en lesquels
l'hétérocycle est relié à une partie de sucre par
une obligation de c-c au lieu de l'obligation de C-N des nucléosides
normaux. Les C-Nucléosides ont suscité l'attention
considérable due non seulement de la stabilité chimique mais
également des activités biologiques intéressantes des
composés naturels tels que le : showdomycin, les formycins,
l'oxazinomycin, etc.63 en outre, plusieurs
C-nucléosides synthétiques biologiquement actifs tels que le
pseudoisocytidine64 ;
thiazufurin65.
En outre, les nucléosides contenant des parties de
sucre avec deux hétéroatomes dans l'anneau de sucre se sont
avérés être les agents antiviraux tout à fait
efficaces, particulièrement le dioxo- et les
oxothio-nucléosides.
Les nucléosides acycliques, d'autre part,
diffèrent des nucléosides conventionnels parce que l'anneau de
sucre est remplacé par une partie
acyclique66. Le premier nucléoside acyclique
pour montrer l'inhibition sélective de la réplique de HSV
était acyclovir, un nucléoside basé par guanosine dont
l'efficacité clinique comme agent antiviral a stimulé un grand
intérêt pour les nucléosides acycliques.
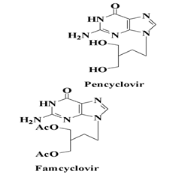
Donc Les analogues de nucléosides acycliques : qui
contient seco et acyclo nucleosides comprenant les dérivées
l'acyclovir, le pencyclovir, le gancyclovir et leur prodrogues (le
valacyclovir et le famcyclovir). Ils constituent les traitements de premiers
choix contre les infections au VHS12.
Cependant, ces derniers antiviraux ne sont pas encore
approuvés pour le traitement de l'infection au VHS mais ont tout de
même démontré une efficacité dans l'inhibition de la
réplication du VHS .
En prendre maintenant des exemples sur les nucléosides
acycliques le plus courants :
v
X-Seco-Acyclo-Y-Nucléoside
Pour la classification des Seco -Acyclo
-Nucléoisides67il ya 5 groupes
principal :
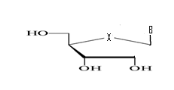
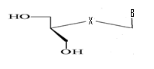
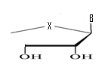
a)-Seco
-Acyclo-Nucléoside avec un
débranchement :
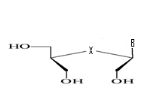 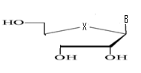 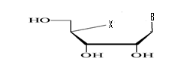
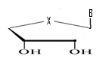
b)-Diseco
-Acyclo-Nucléoside avec deux
débranchement :
c)-Triseco
-Acyclo-Nucléoside avec Trois
débranchement :
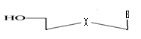 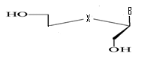 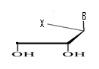 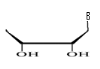
d)-Tetraseco -Acyclo-Nucléoside avec
Quatre débranchement :
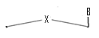 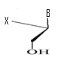 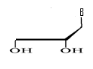
e)-Pentaseco -Acyclo-Nucléoside avec Cinq
débranchement :
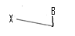
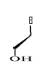 Avec X= O ; S ; C Avec X= O ; S ; C
Ø Pour X= O ; Y=N : Seco
-Acyclo-N-Nucléoside
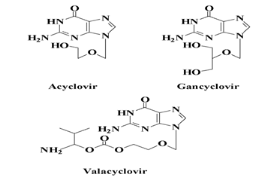
Fig A-25- Seco -Acyclo-N-Nucléoside
anti VHS
L'Acyclovir et ses dérivés :
l'Acyclovir est un analogue de la 2'-désoxyguanosine. Sa
découverte a été la plaque tournante du
traitement des infections herpétiques et, depuis
plusieurs années, l'Acyclovir et ses dérivés
sont considérés comme le traitement de choix des
infections au VHS-1, VHS-2 et au VZV. Il démontre une
efficacité remarquable et est très
peu toxique.
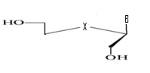
Ø Pour X= O ; Y=C : Seco -Acyclo-C
-Nucléoside
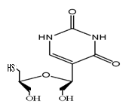
Fig A-26-Seco-Pseudouridines
67
Ø Pour X=C ; Y=N : Seco -Acyclo-N
-Nucléoside
Pour acyclonucléoside :
la formule en général :
v
X-Acyclo-Y,K-Nucléoside
Ø Pour
X-Acyclo-N-Nucléoside : Formule
générale : 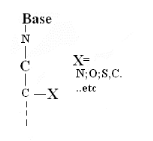
Pour
· X=O : Acyclo-N-Nucléosides
· X=N : Aza-acyclo-N-Nucléoside
· X=S : Thio-acyclo-N-Nucléoside
· X=C :Carbo-acyclo-N-Nucléoside
Ø Pour X-Acyclo-O
-Nucléoside : Formule
générale :
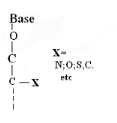
Pour
· X=O : Acyclo-O -Nucléoside
· X=N : Aza-acyclo-O -Nucléoside
· X=S : Thio-acyclo-O -Nucléoside
· X=C :Carbo-acyclo-O -Nucléoside
Ø Pour X-Acyclo-S
-Nucléoside : Formule
générale :
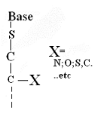
Pour
· X=O : Acyclo-S -Nucléoside
· X=N : Aza-acyclo-S -Nucléoside
· X=S : Thio-acyclo-S -Nucléoside
· X=C :Carbo-acyclo-S -Nucléoside
Ø Pour X-Acyclo-C
-Nucléoside : Formule
générale :
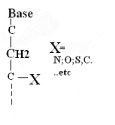
Pour
· X=O : Acyclo-C -Nucléoside
· X=N : Aza-acyclo-C -Nucléoside
· X=S : Thio-acyclo-C -Nucléoside
· X=C :Carbo-acyclo-C -Nucléoside
voici quelques exemples : qui utilisent comme des agents
antiviral et anti tumeur : (Fig A-27)
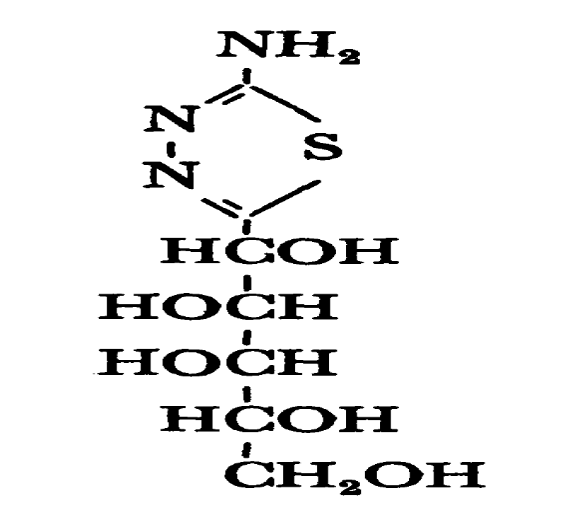 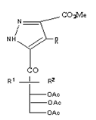
Pyrazole
69
Thiadiazole
68 Avec
R1= H ; R2= OAc
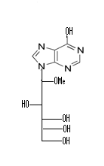 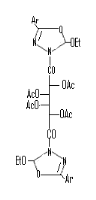
Hypoxanthine70
Oxadiazolines70
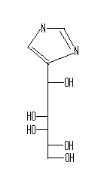
Imidazole70
Fig A-27 -Acyclonucléoside
A-2-5- Synthèse des
Nucléosides :
Une des étapes clés de la synthèse des
nucléosides est le couplage de la base
Pyrimidine, purine ou autre, avec le glucide comme exemple. Nous
nous proposons d'abord de présenter brièvement quelques
méthodes de couplage les plus courantes.
A-2-5-1- Méthode de Hilbert et
Johnson
Parallèlement à ces méthodes employant des
sels de métaux lourds, Hilbert et Johnson6
ont développé une procédure de couplage également
appelée méthode de quaternisation.
Elle est appliquée principalement pour la synthèse
de nucléosides pyrimidiques.
Elle s'effectue par condensation de 2,4-dialcoxypyrimidines sur
des halogénures acétylés, selon le mécanisme
suivant (schéma A-1) :
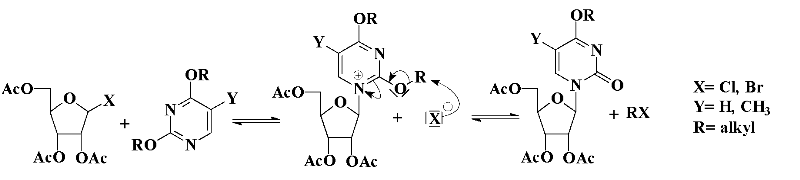
Schéma A-1-
Méthode de couplage de Hilbert et Johnson
Cette méthode donne des rendements variables qui sont
influencés par plusieurs facteurs :
- la facilité de dissolution du sucre
halogéné, favorisée par l'utilisation de solvants tels
que l'acétonitrile .
- l'aptitude du groupe alkyle R du sel quaternaire
intermédiaire à subir l'attaque nucléophile de l'ion
halogénure X- ; il est possible dans certains cas d'utiliser un
catalyseur tel que HgBr2 qui, en se complexant avec le sel
quaternaire, favorisera l'élimination du groupe :
R en position 2 .
- l'électronégativité du substituant Y en
position 5
A-2-5-2- Méthode de
Vorbrüggen
En remarquant que les catalyseurs de Friedel-Crafts
permettent la conversion
des 1-acyloxy sucres acétylés en leur
dérivés 1-acétylés et 1-halogénés,
Vorbrüggen et Coll7. ont tenté la
réaction avec des pyrimidines et des sucres per-acétylés
ou 1-acétylé-2,3,5-
tribenzoylés.
La réaction est réalisée à
température ambiante dans un solvant polaire (1,2-dichloroéthane,
acétonitrile ou mélange des deux en proportions variables).
Après divers essais réalisés avec différents
catalyseurs de Friedel et Crafts (ZnCl2, TiCl4, AlCl3, SnCl4 ou BF3-Et2O), il
apparaît que la combinaison 1,2-dichloroéthane/SnCl4 donne de bons
résultats.
Ce solvant ainsi que l'acétonitrile sont d'utilisation
aisée car ils sont facilement purifiables et
permettent un chauffage à plus de 70°C si
nécessaire7. Cependant l'emploi de l'un ou
de
l'autre engendre des modifications du comportement des
réactions (temps, proportions des
produits N-1 et N-3 substitués sur les bases
pyrimidiques).
La quantité de catalyseur employée
dépend de la nature du réactif glucidique utilisé :
0,25 éq. sont suffisants pour réaliser un couplage
entre une base silylée et un sucre halogéné
en position anomérique, alors que 0,75 à 1,5
éq. sont nécessaires dans le cas de sucres
1-Ométhyle ou 1-O-acétyle, ces derniers
étant moins sensibles mais moins réactifs.
Le mécanisme de la réaction de glycosylation
(Schéma A-2) met en jeu la participation
du groupement en position 2 du sucre : le groupement acyloxy
(acétyle ou benzoyle)
intervient pour former un intermédiaire
«sucre-cation» cyclique qui encombre la face
. L'attaque nucléophile de la base silylée se fait
alors préférentiellement sur la face .
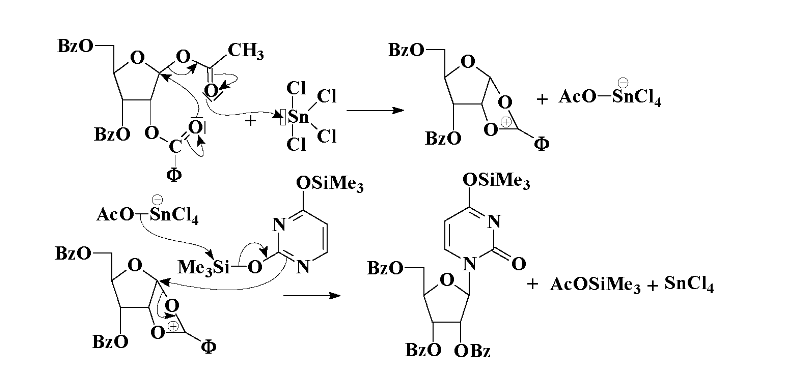
Schéma A-2-Mécanisme du couplage
de Vorbrüggen appliqué aux bases pyrimidiques
La méthode de Vorbrüggen est devenue la plus
fréquemment employée dans la synthèse
des nucléosides en raison de ses nombreux avantages :
- elle peut être appliquée non seulement aux
pyrimidines et à leurs dérivés, mais aussi
aux purines, aux thiazoles et à d'autres
hétérocycles azotés ;
- la fixation du groupe TMS sur la base est très
aisée ;
- le TMS s'élimine facilement en fin de réaction au
cours du traitement ;
- les rendements obtenus sont élevés du fait de
l'activation par des groupes TMS pour
l'attaque nucléophile ;
- la possibilité d'utiliser des sucres
1-acétylés ou 1-O-méthylés plus stables et
facile
d'accès.
A-2-6- Synthése d'Acyclo-
N-Nucléosides
Les transformations de la partie base
d'hétérocyclique ont eu comme conséquence des analogues de
nucléoside avec une variété d'applications
thérapeutiques71. D'ailleurs,
l'élaboration de la méthodologie synthétique et, en
particulier, le développement en chimie d'accouplement de
carbone-carbone a produit des méthodes efficaces pour la
génération de beaucoup de composés de roman.
Comme nous l'avons montré au précédent,
l'acyclo -Nucléoside est l'un des
composés à présenter une action
significative sur les bactéries. A l'heure actuelle, on ne
connaît que très petite nombre de
dérivés de l'acyclo-N-Nucléoside possédant un
caractère antiviral reconnu.
La recherche de composés, si possible plus actifs que ceux
existant72, constitue donc une
étapeimportante dans le domaine de la chimie fine. De nombreuses
équipes de recherche se sontintéressées à la
synthèse d'analogues de l'acyclo-N-Nucléoside.
Ces analogues sont synthétisés par modification de
la partie glucidique des nucléosides. Les acyclonucléosides
peuvent être considérés comme étant de la famille
qu'ils possèdent la fonction éther ainsi que le groupement
hydroxyle.
Par rapport aux
nucléosides73, ils gardent le même
squelette carboné et la chiralité du
carbone anomérique, par contre ils perdent la
rigidité de la partie glucidique puisqu'il n'y a
plus de liaison entre les carbones 2' et 3'.
Pour notre part, nous présentons: la synthèse, la
caractérisation structurale et l'évaluation
antivirale de quelques analogues N-acycliques de
nucléosides portant comme partie base,
dérivée de triazol.
Sur la base des considérations ci-dessus, les analogues
originaux de N-acyclo nucléoside ont dirigé sur
l'intérêt considérable toujours réveillé
renversé de transcriptase74 Dans l'espoir
d'élucider et/ou de trouver de meilleurs agents
thérapeutiques, les analogues du deoxynucléoside 3'-modifie
semblent être l'une des cibles
recommandées75.
Ils agissent en tant qu'inhibiteurs d'enzyme ou en tant que
terminateurs à chaînes d'ADN-polymérisation virale dus au
manque ou changement du groupe 3'-hydroxyle.
Le N modifié -nucléosides a attaché au
hétérocycle original à la partie anomérique de
sucre, ont également maintenu l'attention, et ils ont obtenu une
nouvelle classe des analogues de nucléoside de
hétérocycle.76
l'accès à nouveau des N-acyclonucléosides,
visant pour présenter l'intérêt biologique en tant
qu'agents antiviraux ou anticancéreux, a été
également étudiés.
Le nucléoside et leurs analogues ont émergé
en tant qu'agents thérapeutiques importants dans le traitement de
plusieurs maladies virales77, comprenant
AIDS.77-78 Ceux-ci fonctionnent à
côté de bloquer le transcriptase renversé
virally-codé (RT).75 que la majorité
d'analogues de nucléoside se composent des modifications des substrats
normaux dans la base hétérocyclique ou dans la partie de
sucre.76 Les analogues azotées de
acyclonucléoside ont l'activité efficace
anti-HIV et sélective. Dans l'adition, dû au manque de la
tringlerie conventionnelle de glycoside, ils sont stables in vivo au fendage
par des phosphorylases et des hydrolases79,80. Ces
dernières années, nous sommes devenus intéressés
à explorer le potentiel thérapeutique des
N-acyclonucléosides81,82, Les études
théoriques structurales employant des méthodes laissent
établir que les paramètres principaux structuraux comme distance
entre la base et l'hydroxyle groupent ou la position relative entre la base
hétérocyclique et le sucre15, sont
très semblables à ceux des nucléosides normaux.
La découverte des isomères structuraux
N-acyclonucléosides 77-84:
comme :9-(1,3-dihydroxy-2-propoxymethyl) guanine (DHPG) et
9-(2,3-dihydroxy-1propoxymethyl) guanine(iso-DHPG) (Fig A-28) comme
drogues antivirales efficaces et fortement sélectives pour le traitement
des infections recto du virus d'herpès (HSV) a stimulé une
recherche étendue des nucléosides acycliques qui sont des agents
antiviraux plus efficaces. Jusqu'ici85,
les études de structure-activité ont prouvé
que la chaîne latérale des nucléosides acycliques joue un
rôle principal dans l'activité antivirale (phosphorylation). En
conséquence, beaucoup de chimistes de nucléoside ont
dirigé leurs efforts vers la synthèse des analogues de
DHPG ; NDG (iso-DHPG) et d'autres N-acyclonucléosides avec de
divers chaînes latérales.
D'autre part, les N-nucléosides sont une grande classe
des anti métabolites. Les drogues importantes de cette classe sont le
brednin, le pyrazofurin et la ribavirine et ses
analogues86 qui sont dotées
d'activité immunosuppressive, antitumorale et antivirale,
respectivement.
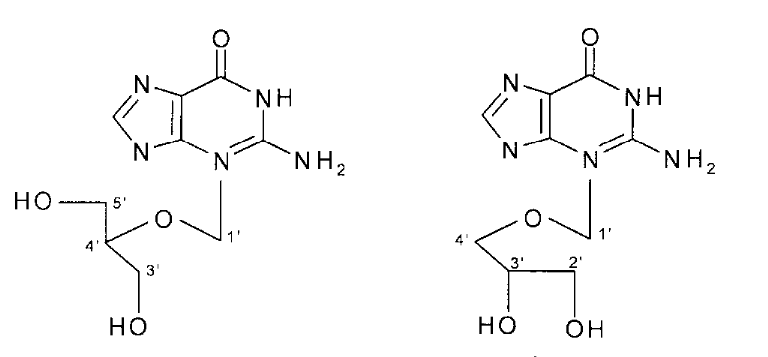
DHPG NDG
Fig A-28- Structures de DHPG et NDG
La recherche actuelle présente une voie commode pour
la préparation d'une série d'analogues DHPG et NDG dans lesquels
les dérivés de triazole remplacent la partie de guanine. Pour
mener aux nouveaux acyclonucleosides d'azole, la réaction a
été effectuée par l'intermédiaire d'un
cycloaddition 1,3-dipolar 16,18entre les azotures
acycliques de sucre à l'avance préparés qui
réagissent comme diène avec de l'acétylène
(Schéma A-3) ; Ces composés ont été
alors examinés par des études in vitro pour des activités
antivirales.
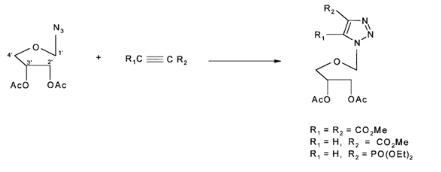
Schéma A-3-
Préparation Analogue NDG à base Triazol
A-2-7- Nucléoside
Antibiotiques
Sur la base des considérations ci-dessus, les analogues
originaux de nucléoside ont dirigé sur l'intérêt
considérable toujours réveillé renversé de
transcriptase 87 . Dans l'espoir d'élucider
et/ou de trouver de meilleurs agents thérapeutiques, les analogues du
N-nucléosides 88 . Ils agissent en tant
qu'inhibiteurs d'enzyme ou en tant que terminateurs à chaînes
d'ADN. les nucléosides a attaché au
hétérocycle original à la partie anomèrique de
sucre, ont également maintenu l'attention, et ils ont obtenu une
nouvelle classe des analogues de nucléoside de
hétérocycle,qui se comportent la plupart du temps comme des
substrats biologiquement
active 89 .
Des Nucléosides Antibiotiques sont trouvés en tant
que groupes divers de N-Nucléosides. Ils incluent une
variété de modifications structurales des nucléosides,
menant souvent aux molécules complexes. Leurs activités
biologiques sont également étendues, y compris
l'antibactérienne, antifongique, antitrypanosomal, antitumoral,
antiviral, herbicide, insecticide. Elle n'étonne pas que les
nucléosides antibiotiques montrent de telles activités
biologiques diverses, parce que les nucléosides jouent des rôles
dans les voies métaboliques cellulaires les plus fondamentales telles
que des porteurs de métabolite, des donateurs d'énergie, des
messagers secondaires, et des cofacteurs pour différentes enzymes.
Ainsi, non seulement la synthèse d'acide nucléique mais
également la synthèse de protéine, et la synthèse
de glycoprotéine : sont des cibles des nucléosides
antibiotiques.
des nucléosides antibiotiques ont été
passés en revue par Suhadolnik dans 197090et
1979.91-93 en 1982, passé en revue leur
biochimie et Buchanan et Wightman94 passé en
revue la chimie. Cependant, des douzaines de nouveaux nucléosides
antibiotiques ont été découvertes dans la
dernière décennie et leurs rôles biologiques ont
été déterminés. En cette partie, des
nucléosides antibiotiques de actuellement sont
énumérés avec leurs structures ; Leur chimie et
biologie ont été brièvement passées en revue, pour
éviter de recouvrir avec des revues précédentes.
Nucléosides antibiotiques ont été classifiés sur
la base de leurs structures, cette classification est conventionnelle ;
certains des nucléosides antibiotiques possèdent les dispositifs
structuraux couvrant plus de deux groupes dans la classification des
nucléosides.
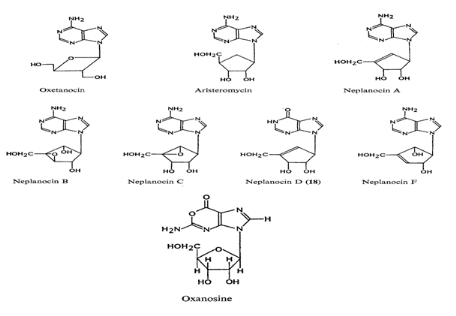
Fig A-29- Nucléoside Antibiotique
Neplanocins A -D et F sont des produits très efficaces ;
comme l'aristeromycin ,ils sont des analogues carbocycliques
d'adénosine, ayant un anneau époxyde-cyclopentane ou d'anneau
Cyclopentane. Neplanocin A : a des activités antitumorales et
antivirales fortes. Mais son activité antimicrobienne est
limitée. Plusieurs synthèses totales ont été
réalisé 95-97 .le produit n'est pas
phosphorylée en cellules et la molécule intacte empêche
fortement l'hydrolase en cellules. Seulement un nombre restent de
composés sont connus dans ce groupe.
Oxanosine98 : est unique en structure et dans
l'activité biologique. La structure en laquelle N-l de guanosine est
remplacé par l'oxygène a été établi par
analyse X-ray.99 ce nucléoside a
montré l'activité faible contre les bactéries
gram-négatives se sont avérés pour empêcher
Escherichia coli GMP synthétase.100 que le
mécanisme de l'activité antitumorale a été
étudié.
PARTIE B (RESULTATS ET DISCUTION)
| 


