|
Dédicaces
Dédicaces A mes
très chers parents
Sources inépuisables d'amour, d'affection et de
sacrifices. En témoignage de
ma reconnaissance pour leur
inéluctable patience, leur sacrifice et leur
soutien au cours de mes
longues études. Toutes les dédicaces du monde ne
sauraient
exprimer mon profond amour et ma vive gratitude. Que Dieu leur
donne
santé et longue vie.
A mes frères :
Je suis sincèrement reconnaissante de votre soutien et
dévouement
impérissable. Acceptez ici, l'expression de ma vive
gratitude en témoignage
de notre attachement fraternel sans
égal.
A ma famille
Je dédie ce travail à ma
chère famille sans exception.
A tous mes ami(e) s
En reconnaissance de votre compagnie fructueuse et des liens de
solidarité
qui nous réunissent.
A tous ceux qui me sont chers
Je dédie ce modeste
travail.
Remerciements
Je souhaite en premier lieu remercier tout le personnel du
Laboratoire Régional de Diagnostic Épidémiologique et
d'Hygiène de Milieu de la Direction Régionale de la Santé
de Fès pour leur accueil chaleureux afin d'accomplir mon stage de fin
d'étude avec en tête Mr. EL OUALI LALAMI Abdelhakim le docteur
chef du laboratoires de m'avoir accepté en tant que stagiaire, merci
pour les nombreuses discussions que nous avons eu et les conseils toujours
plein de bon. Je pense que je n'aurai pas pu trouver un meilleur environnement
pour mon projet de fin d'étude. Je le remercie enfin de m'avoir appris
de nombreuses connaissances et expressions qui resteront à jamais dans
ma mémoire.
Je remercie également mes Professeurs Mr. El OUAZZANI.
F et Mr. GREECH. H, mes tuteurs de stage, d'avoir accepté d'encadrer ce
travail, de m'avoir aidé à développer un esprit critique
et analytique, ainsi que pour leur soutien, leur aide, leur conseils et leur
disponibilité, afin de concrétiser ce rapport.
Je tiens à dire un immense merci à Mr. ELOUALTI.
A de m'avoir accueilli et pour la liberté et la confiance qu'il a su
m'accorder tout au long de mon stage, je voudrais aussi le remercier de m'avoir
laissé développer tout les aspects passionnants de ce travail,
pour le temps qu'il m'a consacré tout au long de cette période,
sachant répondre à toutes mes interrogations, sans oublier sa
participation au cheminement de ce rapport.
Je présente également mes vifs remercîments
aux membres de jury
composés de Mr. OUAZZANI CHAHDI Fouad, Mr. GRECHE Hassan,
Mr.
ALILOU El Houssine, Mr. EL OUALI LALAMI Abdelhakim, Mr. KANDRI
RODI Youssef, Mr. ELOUALTI Abdelaziz pour avoir accepter de juger ce travail
Aussi je tiens à remercier Dr. BENNANI L. docteur
responsable de l'unité d'hygiène au LRDEHM pour l'honneur qu'elle
me fait en acceptant d'examiner mes résultats bactériologiques,
Mr. FAOUZI qui m'a aidé a choisir les sites et de me fournir leurs base
de données ainsi la carte topographique de la ville de Fès. Je
remercie également tout le personnel du LRDEHM : Mr AABOUCH, Mr. HAMID,
Mr. LMRAOUI ...
J'aimerai remercier tous ceux que j'ai côtoyés au
cours de ce précieux stage et qui m'ont aidé de près ou de
loin dans la réalisation de ce travail. Ce serait trop long de tous vous
citer.
Je voudrais ensuite remercier un par un les stagiaires qui
m'ont accompagné durant cette magnifique période de stage.
Très bonne chance pour vos soutenances
Organigramme du laboratoire
Liste des tableaux :
Tableau 1 : Milieux de culture et conditions d'incubation des
germes
recherchés 37
Tableau 2: Résultats des analyses bactériologiques
des différents sites
étudiés UFC/100g 46
Tableau 3 : Résultats des analyses physico-chimiques de la
totalité des sites
étudiés en ppm 51
Tableau 4 : Résultats des analyses des métaux
lourds des différents sites en
ppm 58
Listes des figures
|
Figure 1 : Situation des sites de prélèvements
|
34
|
|
Figure 2 : Tarière d'échantillonnage
|
35
|
|
Figure 3 : Principe de la spectrophotométrie d'absorption
atomique
|
43
|
Figure 4 : Principe de fonctionnement de
Spectrophotométrie d'absorption44
Figure 5 : Evolution des différents germes cherchés
dans la zone de
Monfleuri 47
Figure 6 : Evolution des différents germes cherchés
dans la zone de Sidi
brahim 48
Figure 7 : Evolution des différents germes cherchés
dans la zone de Merja 48
Figure 8 : Evolution des différents germes cherchés
dans la zone de
Wisslane 48
Figure 9 : Evolution des différents germes cherchés
dans la zone de Tghate
49
Figure 10 : Evolution des différents germes
cherchés dans la zone de Medina
49
|
Figure 11 : Evolution des différents germes
cherchés dans la zone de
|
|
|
Bensouda
|
49
|
|
Figure 12 : Evolution des différents germes
cherchés dans la zone de
|
|
|
Massira
|
50
|
|
Figure 13 : Evolution des différents germes
cherchés dans la zone de
|
|
|
Doukkarat
|
50
|
|
Figure 14 : Variation du pH des différents sites
étudiés
|
55
|
|
Figure 15 : Variation de l'humidité des différents
sites étudiés
|
55
|
|
6
|
|
|
Figure 16 : Variation de la concentration des Nitrates des
différents sites
étudiés 56
Figure 17 : Variation de la concentration du phosphore total des
différents
sites étudiés 56
Figure 18 : Variation de la concentration des orthophosphates des
différents
sites étudiés 56
Figure 19 : Variation de la concentration des nitrites des
différents sites
étudiés 57
Listes des abréviations
CF : Coliforme fécaux
CT : Coliformes totaux
SF : Streptocoques fécaux
ASR : Anaérobie Sulfuto Réducteur GT : Germes
totaux
Zn : Zinc
Cu : Cuivre
Pb : Plomb
Ni: Nickel
Cd: Cadmium
Cr: Chrome
UFC: Unité formant colonie
Sommaire
|
Dédicaces
|
1
|
|
Remerciements
|
2
|
|
Organigramme du laboratoire
|
4
|
|
Listes des abréviations
|
8
|
|
Introduction
|
14
|
|
Partie I : Étude bibliographique
|
17
|
|
I- Intérêt d'étude de sol de certains sites
dans la ville de Fès :
|
17
|
|
I-1- Actions chimiques :
|
17
|
|
I-2- Actions biologiques :
|
18
|
|
I-3- Réglementations et recommandations :
|
18
|
|
II- Les facteurs pris en compte dans l'étude :
|
18
|
|
II-1- Les paramètres liés au sol.
|
18
|
|
II-1-1- Indice de battance :
|
18
|
|
II-1-2- Filtrance :
|
19
|
|
II-1-3- La présence d'hydromorphie :
|
19
|
|
II-1-4- La présence d'une rupture de
perméabilité :
|
20
|
|
II-2- La pente :
|
20
|
|
II-3- Le climat:
|
20
|
|
III- Effet de la contamination sur la sante et l'environnement :
|
22
|
|
IV- Caractéristiques du sol :
|
22
|
|
IV-1- Caractéristiques microbiologiques du sol :
|
22
|
|
9
|
|
|
|
IV-1-1- Coliformes Totaux :
|
22
|
|
IV-1-2- Coliformes Fécaux :
|
23
|
|
IV-1-3- Streptocoques Fécaux :
|
23
|
|
IV-1-4- Anaérobies-Sulfito-Réducteur :
|
24
|
|
IV-1-5- Germes Totaux :
|
24
|
|
IV-1-6- Staphylocoque aureus:
|
24
|
|
IV-1-7- Salmonella :
|
25
|
|
IV-1-8- Pseudomonas :
|
26
|
|
IV-2- Caractéristiques physico-chimiques du sol :
|
26
|
|
IV-2-1- pH :
|
26
|
|
IV-2-2- Humidité relative:
|
26
|
|
IV-2-3- Nitrate (NO3-) :
|
26
|
|
IV-2-4- Nitrites (NO2-) :
|
27
|
|
IV-2-5-Phosphates :
|
27
|
|
IV-2-6- Orthophosphates :
|
28
|
|
IV-2-7- Chlorures :
|
28
|
|
IV-2-8- Cations échangeables Ca2+ et
Mg2+ :
|
28
|
|
IV-3- Caractéristiques des métaux lourds :
|
29
|
|
IV-3-1- Zinc :
|
29
|
|
IV-3-2- Cuivre :
|
29
|
|
IV-3-3- Plomb :
|
29
|
|
IV-3-4- Nickel :
|
30
|
|
10
|
|
|
|
IV-3-5- Cadmium :
·
IV-3-6- Chrome :
·
Partie II : Matériels et méthodes
V- Présentation du milieu d'étude :
V-1- Détermination des sites d'études :'
|
30 30 33 33 33
|
V-1-1- Sites habitables :
·
|
33
|
V-1-2- Sites industriels:
|
33
|
V-1-3- Sites agricoles :
|
33
|
V-2- Cadre géographique des sites d'études :
|
|
33
|
|
|
VI- Prélèvements et analyses du sol
:
·
|
35
|
|
VI-1- Échantillonnage du sol
:
·
|
35
|
|
VI-1-1 Préparations des suspensions dilutions des sols
:
·
|
35
|
|
VI-1-2- Préparations des dilutions :
|
36
|
|
VI-2- Méthodes d'analyses bactériologiques :'
|
37
|
|
VI-3-Étude de caractère morphologique
:
·
|
39
|
|
VI-3-1- Coloration de Gram :
·
|
39
|
|
VI-4- Méthode d'analyse physico-chimique
:
·
|
39
|
|
VI-4-1- pH :
·
|
39
|
|
VI-4-2- Humidité :
·
|
39
|
|
VI-4-3-Nitrates :
|
39
|
|
VI-4-4-Nitrites :
·
|
41
|
|
VI-4-5- Cations échangeables :
·
|
41
|
|
11
|
|
|
|
VI-4-6- Phosphates :
·
VI-4-7- Orthophosphates :
·
VI-4-8- Chlorures :
|
41
42
42
|
|
VI-5- Méthode d'analyse des métaux lourds :
|
42
|
|
VI-5-1-Principe :
·
|
42
|
|
VI-5-2-Appareillage :
·
|
43
|
|
Partie III : Résultats et discussions
|
46
|
|
VII- Evolution des paramétres bactériologiques :
|
46
|
|
VIII-- Evolution des paramètres
physico-chimiques des sols :
|
51
|
|
VIII-1- pH :
·
|
52
|
|
VIII-2- L'humidité relative:
|
52
|
|
VIII-3- Nitrates :
|
52
|
|
VIII-4- Phosphore totale :
|
53
|
|
VIII-5- Orthophosphates :
·
|
54
|
|
VIII-6- Nitrites :
·
|
54
|
|
VIII-7- Chlorures :
·
|
55
|
|
VIII-8- Cations échangeables :
·
|
55
|
|
IX- Evolution des paramètres métaux lourds des sols
:
·
|
58
|
|
Conclusion et perspectives
|
61
|
|
Références bibliographiques
|
63
|
|
Annexe1
|
67
|
|
Annexe 2
|
68
|
|
12
|
|
|
Annexe 3 : 69
Annexe 4 70
Introduction
Depuis les années 90, le Maroc a adapté une
stratégie purement industrielle afin de profiter de ces
bénéfices. Cette stratégie semblait être bonne au
niveau économique mais en réalité, elle a causé
beaucoup de dégât aux sols marocains de point de vue qualitatif et
quantitatif. Maintenant, le pays essaye de s'adjuver une stratégie
reposant sur un développement durable axé sur trois (3)
cotés : Environnemental, social et économique. Ceux-ci dans le
but de préserver l'environnement et assurer une continuité de
développement durable. La dégradation de l'environnement est un
fléau devenu plus en plus critique et préoccupant ces
dernières années. Les principaux constituants de l'environnement
touchés sont les eaux de surface, l'air et le sol.
La contamination des sols est devenue donc un fait tournant vu
qu'il engendre beaucoup de questions en parallèle et pose ainsi la
problématique suivante : Par quelle manière les sols sont
contaminés? Quels sont les principaux contaminants chimiques ou
microbiologiques? Quelles sont les effets qui peuvent provoquer par
conséquent sur l'environnement et la santé humaine ou animale?
Comment on s'y exposé et par quelle voie? Quelles sont les
décisions à apprendre pour supprimer ou compenser les risques des
contaminants?
Comme chaque pays industriel, les sols du Maroc aussi sont
contaminés par des rejets domestiques, industriels et d'agriculture. Ces
rejets provoquent des effets néfastes à cause de la
prolifération des germes surtout pathogènes et les produits
chimiques notamment les métaux lourds, les pesticides, les
détergents...
Dans ce travail, nous allons détailler le
problème de la contamination des sols qui pourra affecter la
santé humaine, la faune et la flore de façon directe ou/et
indirecte, en caractérisant la qualité des sols de quelques sites
situés à la ville de Fès.
Nous avons choisi trois (3) sites à analyser :
industriel, habitable et cultivable pour les quels nous avons effectué
des analyses de trois (3) types microbiologiques, physico-chimiques et
métaux lourds.
TUDE
BiBlioGR-
ApHiQUE
Partie I : Étude bibliographique
I- Intérêt d'étude de sol de certains
sites dans la ville de Fès :
Le sol est classé comme étant la plus importante
matrice, épais de quelques millimètres a plusieurs dizaines de
mètres, il recouvre les deux tiers des terres émergées.
Milieu hétérogène et complexe, le sol forme une succession
de couches aux caractéristiques physicochimiques et biologiques
spécifiques. Il est constitué d'éléments organiques
(humus), d'éléments minéraux repartis en fractions
glissières (sable) ou fines (argiles), d'une partie gazeuse, de
végétaux et d'animaux (Antoine, 2001). Son contamination peut
provoquer des effets néfastes sur la chaine alimentaire et par suite le
déséquilibre des écosystèmes. En effet,
l'étude des sols pollués dans le but de la caractérisation
ou la détermination de leurs degrés de pollutions, est devenue
importante actuellement et obligatoirement demandée pour prévenir
et surveiller la terre et la santé de vie. C'est pourquoi, des
congrès locaux, nationaux et internationaux sont
régulièrement organisés pour sensibiliser le monde
à et les incité à prendre leurs responsabilités.
Plusieurs facteurs favorisent la pollution à la zone de notre
étude, citons les dépôts industriels, domestiques...
I-1- Actions chimiques :
La pollution des sols par voie chimique résulte de
l'accumulation d'éléments toxiques ou d'agents pathogènes
liés à l'industrie chimique et métallurgique ainsi
qu'à l'activité pétrolière.
Cette pollution se fait sous forme de retombées
aériennes après la dispersion des éléments toxiques
dans l'atmosphère ou bien par rejets directs à partir des sites
producteurs.
I-2- Actions biologiques :
La contamination biologique du sol est produite via les
animaux et leurs fumiers, ainsi que d'autres phénomènes naturels
disant les volcans, les inondations etc
I-3- Réglementations et recommandations
:
Jusqu'à présent, le Maroc n'a pas encore
créé une réglementation a propos de la contamination des
sols. Par contre, il y en a des arrêtées portant sur la
qualité des eaux superficielles, les eaux destinées à
l'irrigation ainsi que pour les rejets industriels ou domestiques dans les eaux
usées.
Et comme première recommandation pour arriver à
la création d'une réglementation et d'une législation sur
la contamination du sol, il faudra impérativer l'adoption de la charte
de l'environnement et de développement durable qui traite dans
l'ensemble tout les problèmes reliés a l'environnement.
II- Les facteurs pris en compte dans l'étude :
II-1- Les paramètres liés au sol.
II-1-1- Indice de battance :
L'indice de battance est défini comme étant
l'aptitude d'un sol tendant à se désagréger et à
former une croûte en surface sous l'action des facteurs externes (pluie,
tassement, érosion...).
La battance pourra stopper la respiration et l'alimentation en
eau des sols, au détriment de leur vie biologiques et de leur
reproductivité.
Ce paramètre permet de classer le sol selon trois classes
:
1- Sol non à peu battant.
2- Sol assez battant.
3- Sol battant a très battant.
II-1-2- Filtrance :
La filtrance est définie comme étant
l'approximation de la capacité du sol à
permettre l'infiltration de l'eau à travers les premiers
centimètres du sol. Elle dépend de la texture, de l'état
calcique, de la pierriste.
Cette filtrance classe le sol selon trois classes :
1- Sols filtrants a très filtrants.
2- Sols peu filtrants.
3- Sol non filtrants.
II-1-3- La présence d'hydromorphie :
La présence d'hydromorphie est due à l'apparition
de gleys ou pseudogleys (c à d réductions /oxydation de fer) pour
des profondeurs de 20 à 70 cm.
Ce paramètre permet de classer les sols selon deux classes
:
1- Sol hydromorphe.
2- Sol non hydromorphe.
II-1-4- La présence d'une rupture de
perméabilité :
La présence d'une rupture de perméabilité
est due l'apparition d'un horizon
argileux ou d'un substrat
imperméable pour des profondeurs de 40 à 70 cm.
Ce paramètre permet de classer les sols selon deux classes
:
1- Présence d'une rupture de
perméabilité.
2- Absence d'une rupture de perméabilité.
II-2- La pente :
La pente agit sur les écoulements de surface ainsi que
sur les écoulements hypodermiques c'est-à-dire sous la surface du
sol mais au-dessus des nappes phréatiques permanentes, elle croit avec
l'indice de battance et la filtrance.
Ce paramètre permet de classer les sols selon deux classes
:
1- Sols non sensibles aux écoulements de surface.
2- Sols sensibles aux écoulements de surface.
II-3- Le climat:
II-3-1- Période orageuse :
La période orageuse inclut la saison de printemps et
d'été, elle résulte de la multiplication de la pente et
l'indice de battance.
Elle définie comme étant le rapport Eaux
superficielles/Eaux souterraines notée ESU/ESO, avec attribution d'un
numéro de 1 à 4 pour chaque ressource et que la somme
étant égale à 4.
On distingue cinq classes pour la période orageuse :
1- ESU 0/ESO 4 : Pluie reconstituant la réserve du sol et
possibilité d'infiltration en profondeur.
2- ESU 1/ESO 3 : Pluie reconstituant la réserve du sol et
possibilitéd'écoulement latéral en
subsurface.
3- ESU 2/ESO 2 : Écoulement de surface, reconstitution de
la réserve utile puis infiltration en profondeur.
4- ESU 3/ESO 1 : Écoulement de surface, de subsurface et
reconstitution de la réserve utile.
5- ESU 4/ESO 0 : Écoulement en surface (et reconstitution
de la réserve utile).
II-3-2- Période hivernale :
La période hivernale comporte la saison de l'automne et de
l'hiver, elle résulte de la multiplication de la filtrance par la
pente.
Elle définie comme étant le rapport Eaux
superficielles/Eaux souterraines notée ESU/ESO, avec attribution d'un
numéro de 1 à 4 pour chaque ressource et que la somme
étant égale à 4.
On distingue cinq classes pour la période hivernale :
1- ESU 0/ESO 4 : Écoulement en profondeur uniquement si
le substrat est filtrant.
2- ESU 1/ESO 3 : Infiltration et Écoulement de surface
possible si fortes pluies.
3- ESU 2/ESO 2 : Écoulement de surface et
infiltration.
4- ESU 3/ESO 1 : Écoulement de surface dominant.
Écoulement hypodermique.
5- ESU 4/ESO 0 : Écoulement de surface dominant.
Écoulement hypodermique.
III- Effet de la contamination sur la sante et
l'environnement :
Un sol contaminé peut présenter trois types de
risques environnementaux qui se traduiront en risque sur la sante humaine :
1- Le contact direct des polluants avec les occupants du sol
à titre d'exemple : jeux d'enfants sur un site pollué. Des
recherches ont été faite par plusieurs chercheurs sur les HAP ont
montre qu'une exposition relativement prolongée, pourra avoir des effets
nocifs sur le système respiratoire, les irritations aux yeux....
2- Lessivage des polluants par les eaux d'infiltration et
transfert des polluants vers les eaux souterraines et superficielles (pollution
possible des ressources en eau).
3- Réintroduction des polluants dans la chaine
alimentaire par les végétaux et les organismes vivants du sol,
les contaminants s'accumulent à la surface des racines et des feuilles,
mais ne se déplacent pas qu'en très petite quantité des
racines aux pousses. Donc les plantes cultivés dans un sol
contaminé peuvent avoir plus de contaminant dans les racines que dans
les tiges et les feuilles.
IV- Caractéristiques du sol :
IV-1- Caractéristiques microbiologiques du sol :
IV-1-1- Coliformes Totaux :
Les Coliformes totaux regroupent plusieurs espèces
bactériennes de la
famille des entérobactéries qui se
présentent sous formes de bâtonnet, Gram
négatives, non
sporulant, possédant l'enzyme â-galactosidase permettant
l'hydrolyse du lactose à 37 °C afin de produire
des colonies rouges avec des reflets métalliques sur un milieu bien
approprie. Le groupe des coliformes est utilisé depuis la fin du
19ème siècle comme indicateur de pollution
fécale (Archibald, 2000). La plupart des espèces de ce groupe se
retrouveront naturellement dans le sol ou la végétation (Edberg
et al., 2000).
IV-1-2- Coliformes Fécaux :
Les Coliformes fécaux ou coliformes
thermotolérants, sont un sous-groupe des coliformes totaux capables de
fermenter le lactose à une température de 44 °C (Barthe et
al., Edberg et al., 2000).
Bien que la présence de coliformes fécaux
témoigne habituellement d'une contamination d'origine fécale,
plusieurs coliformes fécaux ne sont pas d'origine fécale,
provenant plutôt d'eaux enrichies en matière organique, tels les
effluents industriels du secteur des pâtes et papiers ou de la
transformation alimentaire (Barthe et al., 1998).
L'intérêt de la détection de ces
coliformes, à titre d'organismes indicateurs, réside dans le fait
que leur survie dans l'environnement est généralement
équivalente à celle des bactéries pathogènes et que
leur densité est généralement proportionnelle au
degré de pollution produite par les matières fécales.
IV-1-3- Streptocoques Fécaux :
Les Streptocoques fécaux appartiennent à la
famille des Streptococcaceae. Ce sont des hôtes normaux de
l'intestin de l'homme et des animaux à sang chaud, ils sont
éliminés en grand nombre dans les matières fécales
(Kenner et al, 1970).
Certaines espèces des streptocoques peuvent avoir d'autres
milieux de vie dans le sol et la végétation (Merzouki, 1992).
Le groupe CF/SF est souvent utilise pour indiquer la source de
contamination fécale, si ce rapport est supérieur à 1, la
pollution est d'origine humaine. Lorsque le rapport est inferieur à 1 la
pollution fécale serait d'origine animale (Davenport et al., 1976).
IV-1-4- Anaérobies-Sulfito-Réducteur :
Les Anaérobies Sulfito Réducteurs sont largement
répandues dans l'environnement. Elles sont présentes dans les
matières fécales humaines et animales, ainsi que dans les eaux
usées et le sol. Elles survivent dans le sol pendant longtemps, car
elles sont plus résistantes que les formes végétatives
à l'action des facteurs chimiques et physiques. Elles peuvent ainsi
fournir des indications sur une pollution éloignée ou
intermittente.
IV-1-5- Germes Totaux :
Appelés aussi bactéries mésophiles
aérobies, ces derniers renseignent sur la charge bactérienne
globale. La plupart des sols contiennent une importante population de
microorganismes, même si les organismes ne sont pas pathogènes.
Les « bactéries mésophiles aérobies
» peuvent être considérées comme des organismes
indicateurs, quoiqu'elles soient une mesure beaucoup moins précise et
sûre de la contamination du sol que d'autres indicateurs plus
précisément définis.
IV-1-6- Staphylocoque aureus:
Coque à gram positif de 0,5 à 1 ìm de
diamètre, non sporulé, immobile,
aéro-anaérobie
facultatif, possédant une catalase. Appartient au genre
Staphylococcus phylogénétiquement
proche des genres Enterococcus, Bacillus et Listeria. 35
espèces dont certaines sont subdivisées en sousespèces
sont actuellement décrites dans le genre Staphylococcus. Cette
dernière, isolée en 1985 à partir d'abcès chez le
mouton, est anaérobie et peu connue. Elle se caractérise par la
production de pigment, d'une coagulase, d'un facteur agglutinant lié
à la paroi ayant une affinité pour le fibrinogène
(clumping factor) et de nombreuses autres enzymes et toxines
responsables de sa virulence.
La présence de S. aureus dans le sol constitue
un risque pour la santé humaine parce que certaines souches sont
capables de produire des entérotoxines dont l'ingestion provoque une
intoxication.
IV-1-7- Salmonella :
Salmonella est un bacille Gram négatif non sporulant,
dont la mobilité propre est assurée par des flagelles
péritriches (et qui est de type aéroanaérobie. Ces
bâtonnets de 2 à 3 ìm de long sont des bactéries
mésophiles, peu exigeantes d'un point de vue nutritionnel. Leur
développement est optimal pour des températures proches de la
température corporelle des animaux à sang chaud 35 à
37°C, et un pH de 6,5 à 7,5. Leur multiplication reste
assurée pour des températures de 6,7 à 41°C. Le large
spectre de températures (-20 à 60°C) et de pH (4,1 à
9) auxquels elles sont capables de survivre, ainsi que leur capacité
à résister à de aw (activité de l'eau) de 0,94 en
font des bactéries extrêmement résistantes aux conditions
environnementales même difficiles (congélation) et expliquent leur
caractère ubiquiste.
IV-1-8- Pseudomonas :
Les pseudomonas sont des bacilles à Gram positif,
aérobies stricts, capables de se multiplier sur des milieux usuels,
mobiles par ciliature polaire, possédant une oxydase, ils sont capables
de fermenter le glucose et pouvant produire des pigments.
Ils sont rencontrés dans les sols, sur les
végétaux et surtout dans les végétaux et surtout
dans les eaux douces et marines
IV-2- Caractéristiques physico-chimiques du sol
:
IV-2-1- pH :
C'est une mesure qui donne des indicateurs sur l'acidité
ou la basicité du sol. Les mesures sont effectuées grâce
à un pH-mètre.
IV-2-2- Humidité relative:
Qui parle de l'humidité dans le sol parle de la
présence de l'eau, elle est définie conne étant une mesure
importante pour la détermination du potentiel de production d'une
culture. Elle est aussi importante dans la modélisation des bassins de
drainage où l'humidité dans le sol reflète la
quantité d'eau présente dans les deux premiers mètres du
sol.
L'humidité du sol aide aussi dans la prédiction
d'inondations, car un sol saturé ne peut pas absorber plus de pluie ou
d'eau de ruissellement.
IV-2-3- Nitrate (NO3-) :
Les nitrates sont des compose chimiques d'azote et
d'oxygène. On les trouve à l'état naturel dabs certains
légumes, dans la viande en conserve et dans le sol. Il y en a aussi dans
les engrais commerciaux et les déjections animales. Les nitrates sont
nécessaires à la croissance des végétaux mais la
présence
excessive dans le sol peut contaminer les sources d'alimentation
en eau et entrainer des risques pour la sante humaine et animale.
Les nitrates ne sont pas toxiques directement, mais ils
favorisent la prolifération des algues (eutrophisation) ayant pour
conséquence une baisse de la teneur en dioxygène de l'eau et donc
une action sur la vie aquatique. En outre les nitrates sont susceptibles de se
transformer en nitrites par réduction et en nitrosamines par action des
amines sur les nitrates.
IV-2-4- Nitrites (NO2-) :
Les nitrites (NO2 -) sont des ions naturels présents
partout dans l'environnement. Ils sont le produit de l'oxydation de l'azote
(qui représente en gros 78 % de l'atmosphère) par les
microorganismes dans les plantes, le sol ou l'eau et, dans une moindre mesure,
par les décharges électriques comme la foudre. Ils sont
utilisés comme des agents de conservation.
Les nitrites consommés directement, ou formés
après la conversion des nitrates en nitrites dans l'estomac,
réagissent avec les composés de fer dans le sang humain qui
réduit la capacité de ces composés de fer pour lier
l'oxygène. Les bébés de moins de 6 mois d'âge sont
particulièrement sensibles, entraînant des symptômes tels
que l'essoufflement et une couleur bleue autour de la bouche
dénommée syndrome du bébé bleu
(Méthémoglobinémie).
IV-2-5-Phosphates :
Le phosphate est un élément essentiel à
la vie, repartie partout dans le corps humain. C'est un élément
intégrant des membranes cellulaires, jouant un rôle important dans
l'apport en énergie et se trouvant dans le matériel
génétique humain.
Les phosphates rejetés dans la nature surtout des
engrais et des détergents à lessive. Ces produits devraient donc
contenir une grande quantité de phosphate.
IV-2-6- Orthophosphates :
Les orthophosphates ne sont généralement
présents qu'à l'état de trace dans les milieux aquatiques
naturels. Leur présence dans l'eau favorise la croissance des algues
dés que l'eau est exposée à la lumière :
phénomène d'eutrophisation, qui est néfaste à
l'équilibre aquatique (Khamar, 2002).
IV-2-7- Chlorures :
Les chlorures sont des éléments essentiels et
les principaux anions extracellulaires du corps. Ce sont des ions très
mobiles, qui traversent facilement les membranes cellulaires.
Les chlorures sont largement répandus dans la nature,
généralement sous forme de sels de sodium (NaCl) et de potassium
(KCl); ils représentent environ 0,05 % de la lithosphère. Ce sont
les océans qui contiennent de loin la plus grande quantité de
chlorures dans l'environnement.
IV-2-8- Cations échangeables Ca2+ et Mg2+ :
On appelle ion une particule chargée
électriquement qui se forme quand un atome neutre ou un groupe d'atomes
perd ou perdent un ou plusieurs électrons. Les cations
échangeables dominants sont : Ca2+, Mg2+,
K+, Na+, Al3+. Les 4 premiers cations sont
appelés bases échangeables. Dans les sols acides, les cations
suivants dominent : Ca2+, Mg2+, K+ et Al3+
selon le type de sites d'échanges, le pH et leur abondance relative.
Dans les sols calcaires, Ca2+, Mg2+ dominent tandis que
dans les sols salins, c'est le cas du Na+.
IV-3- Caractéristiques des métaux lourds
:
IV-3-1- Zinc :
Le zinc est utilisé lors de la galvanisation de
pièces métalliques, dans la production d'alliages. Le zinc se lie
à des liants inorganiques et est hydrolysé à un pH de 7
à 7,5. Il forme du Zn(OH)2 à un pH supérieur à 8.
L'état d'oxydation le plus commun est II qui peut être lie
à des liants inorganiques ou à des minéraux
colloïdaux. Le zinc précipite dans des conditions d'anoxie sous la
forme ZnS, et sous la forme non précipitée, forme
ZnOH+, ZnCO3 et ZnCl+.
IV-3-2- Cuivre :
Le cuivre est utilisé dans l'industrie
électrique notamment mais il est aussi présent par exemple dans
l'industrie pharmaceutique, les ustensiles de cuisine, les canalisations
d'eau.
Les sources anthropiques de cuivre dans l'environnement sont :
l'exploitation minière, les rejets domestiques et industriels,
l'industrie métallurgique. Le cuivre est extrêmement toxique pour
le biote aquatique. Le cuivre se retrouve à l'état naturel sous
forme de sulfures, d'oxydes ou de carbonates.
IV-3-3- Plomb :
Forme des alliages avec l'étain, le cadmium le cuivre,
l'Argent et le calcium. Ces composés sont utilisés pour la
fabrication du PVC, du verre de plomb. Le plomb est ses composés sont
reconnues comme étant toxiques pour les être humains. Le plomb
peut être ingéré par voies gastro-intestinales. Le plomb
à une forte tendance à la bio-accumulation dans les eaux et le
sang. Il
existe à l'état natif, il se distingue des ions
alcalins et alcalino-terreux en solution puisqu'il peut être hydrolyse
à de faible valeur de pH.
IV-3-4- Nickel :
Le nickel est une substance que l'on retrouve dans le milieu
naturel, essentiellement dans les minerais sulfurés extraits des
sous-sols et dans les minéraux silicatés se trouvant en surface.
Dans l'environnement, le nickel est surtout combiné à
l'oxygène (oxydes) et au soufre (sulfures).
Le nickel pur est un métal blanc brillant et dur
utilisé couramment pour fabriquer des alliages de métaux solides
et durables. On retrouve ce métal dans de nombreux objets courants,
comme les casseroles inoxydables, les pièces de monnaie et les piles
rechargeables.
IV-3-5- Cadmium :
Le cadmium (Cd) est un élément naturellement
présent à l'état de traces dans l'écorce terrestre
et à également été émis dans l'environnement
par des activités humaines : métallurgie du zinc et du plomb,
automobiles, rejets ou incinérations de batteries et accumulateurs,
emplois de peintures ou pigments, combustions de combustibles fossiles,
épandages d'engrais phosphatés et de boues de stations
d'épuration.
L'exposition chronique au cadmium par ingestion (voie orale)
peut provoquer des atteintes de la fonction rénale. Le cadmium
s'accumule dans l'organisme au cours de la vie (dans le foie puis dans le rein)
et sa toxicité est liée à cette accumulation
progressive.
IV-3-6- Chrome :
Le chrome (Cr) est un métal dur, cassant et blanc
argenté (point de fusion 1875 °C), soluble dans HCl et
H2SO4 mais pas dans HNO3, H3PO4 ou HClO4
résiste à l'oxydation de l'air, très connu
pour son utilisation comme garniture décorative sur les appareils
électroménagers et les automobiles.
Dans sa forme minérale habituelle (chromite), le chrome
possède des propriétés thermorésistantes qui
trouvent des applications dans divers types de fourneaux. Le chrome forme
aisément différents composés chimiques qui ont une vaste
gamme d'applications, comme les pigments et les agents tannants.
11 ATERiELs
ET
METHoDEs
Partie II : Matériels et méthodes V-
Présentation du milieu d'étude :
V-1- Détermination des sites d'études
:
V-1-1- Sites habitables :
Les sites habitables que nous avons ôté pour sont
:
> Monfleuri.
> Hay el massira.
> El medina (Sidi boujida, Rssif, Sahrij gnawa, Bab el
fetouh).
V-1-2- Sites industriels:
Les sites industriels que nous avons choisis sont :
> Bensouda. > Doukkarat. > Sidi brahim.
V-1-3- Sites agricoles :
Parmi les sites agricoles disponibles, nous avons choisi :
> Tghate.
> Merja.
> Wisslane.
V-2- Cadre géographique des sites d'études
:
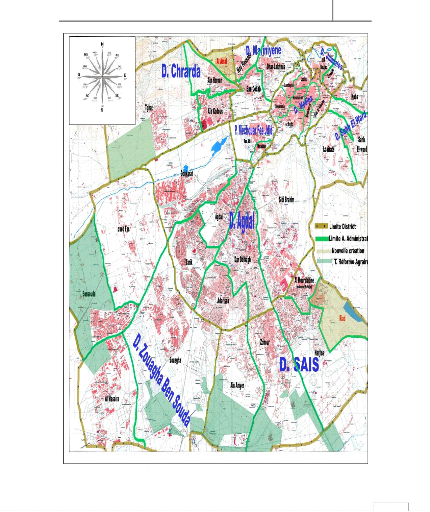
Mémoire MASTER
Figure 1 : Situation des sites de
prélèvements
34
VI- Prélèvements et analyses du sol :
VI-1- Échantillonnage du sol :
Nous avons réalisé un échantillonnage
composite pour les sols, à différents niveaux et à
différents profondeurs (0-15 cm, 15-30 cm). Pour chaque niveau et pour
chaque profondeur les sols sont généralement
prélevés grâce a une tarière (figure1) selon la
méthode décrite par Mekki et al., (2006). Ils sont
homogénéisés pour constituer un seul échantillon
représentatif de ce niveau à la profondeur correspondante.
Figure 2 : tarière
d'échantillonnage
NB : Par manque de ce matériel, nous avons utilisé
une perle.
Les échantillons des sols sont prélevés
à cinq endroits distincts en respectant une forme
géométrique d'un rectangle avec un point au centre. Les
prélèvements récoltés sont ensuite
mélangés dans un sac stérile.
VI-1-1 Préparations des suspensions dilutions des
sols :
VI-1-1-1- Pour les analyses microbiologiques :
Pour respecter les conditions de stérilité et les
conditions aseptiques, nous
avons restreint certaines étapes pour que
les résultats soient représentatifs et
ne présentent pas d'erreur. La procédure que nous
avons choisie est la suivante :
D'abord, nous avons procédé a une étape
de broyage des échantillons afin de les réduire en poudre fine,
ensuite nous avons pesé 10 g du sol et nous avons versé 100 ml de
l'eau distillé stérile et nous l'avons laissée
décanter pour procéder ensuite à des dilutions
jusqu'à l'ordre de 10-6 (Pochon et al., (1962)).
VI-1-1-2- Pour les analyses physico-chimiques :
En plus des étapes déjà décrite
pour les analyses microbiologiques, nous avons ajouté une phase
d'extraction en utilisant un papier WATMAN pour récupérer la
phase aqueuse qui nous sera utile lors de la manipulation. (Rodier 1996).
VI-1-2- Préparations des dilutions :
Pour les échantillons des sols, il convient de
pratiquer plusieurs dilutions. Ainsi après avoir
homogénéisé par agitation mécanique les
échantillons à analyser, 10 ml de chaque échantillon est
prélevé à l'aide d'une micropipette, puis dilue dans un
flacon contenant 90 ml d'eau distillée stérile. A partir de ce
flacon, on procède de la même manière à des
séries de dilution donnant une progression géométrique de
10-1. En suivant la même technique et en changeant le
cône de la micropipette à chaque passage on prépare a
partir de chaque dilution la suivante jusqu'à 10 -6. (Rodier
1996).
Ensuite l'ensemencement se fait par profondeur,
c'est-à-dire qu'on verse 1 ml de l'échantillon dans une boite de
pétri ensuite on verse le milieu de culture et on
homogénéise. (APHA et al., 1998).
VI-2- Méthodes d'analyses bactériologiques
:
Les analyses bactériologiques ont concerné le
dénombrement des germes
totaux, coliformes fécaux, coliformes totaux,
streptocoques, anaérobies sulfito réducteurs, staphylococcus,
pseudomonas et salmonelle.
Ces germes ont été recherchés par la
méthode d'ensemencement en profondeur.
Les milieux de culture utilisés ainsi que les conditions
d'incubation des différents germes recherchés sont
représentés dans le tableau suivant.
Tableau 1 : milieux de culture et
conditions d'incubation des germes recherchés
|
Paramètres
|
Milieu de culture
|
Incubation
|
observations
|
Référence
normative
|
|
-Coliformes Totaux
|
Tergitol
|
37 °C! 24h à 48 h
|
Dénombrement de toutes les colonies de couleur rouges
briques.
|
ISO 9308-1
|
|
-Coliformes Fécaux
|
Tergitol
|
44 °C! 24h à 48 h
|
Dénombrement de toutes les colonies de couleur rouges
briques.
|
NM 03.7.003
|
|
37
|
|
|
|
-
Streptocoque s Fécaux
|
Slanetz et bartley
|
37 °C/ 24h à 48 h
|
Dénombrement de toutes les colonies de couleur roses.
|
ISO 7899-2
|
|
-Germes Totaux
|
Plate Count Agar
|
37 °C et 22 °C/ 24 h à 48h
|
Dénombrement de toutes les colonies.
|
ISO 6222
|
|
-Anaérobies Sulfito Réducteurs
|
SPS
|
37 °C/ 24h à 48 h
|
Dénombrement de toutes les colonies de couleur noires.
|
ISO 6461-2
|
|
-
Staphylococc us
|
Chapman
|
37 °C/ 24h à 48 h
|
Dénombrement de toutes les colonies de couleur jaunes
et
roses.
|
|
|
- Pseudomonas
|
Cétrimide
|
37 °C/ 24h à 48 h
|
Dénombrement de toutes les colonies de couleur
verdâtres.
|
MMA 1997
|
|
-Salmonella
|
Hektoen
|
37 °C/ 24h à 48 h
|
Dénombrement de toutes les colonies de couleur Colonies
bleuvert à centre noir.
|
NM 03.7.050
|
|
38
|
|
|
VI-3-Etude de caractère morphologique
:
VI-3-1- Coloration de Gram :
La coloration de Gram se fait selon le protocole de Hans
Christain Gram, il s'agit d'une coloration qui permet de mettre en
évidence les propriétés de la paroi bactérienne, et
d'utiliser ces propriétés pour les distinguer et les classer.
Les bactéries Gram + sont celles qui ont une membrane
qui possède beaucoup d'acide techoique et peu de lipides, l'alcool ne
traverse pas cette membrane et le cytoplasme reste violet.
Les bactéries dont la membrane ne possède pas
beaucoup d'acide techoique et de lipides, l'alcool traverse la membrane et lave
le violet de gentiane. Pendant la coloration suivante a la fuchsine de Ziehl,
le cytoplasme se colore en rose. Ces bactéries sont des bactéries
Gram- (Hart et al., 2002).
VI-4- Méthode d'analyse physico-chimique :
VI-4-1- pH :
La mesure de pH est réalisée à l'aide d'un
pH-mètre.
VI-4-2- Humidité :
La méthode consiste à peser le poids des
échantillons avant et après séchage dans l'étuve
à 105 °C et pendant 14 heures.
VI-4-3-Nitrates :
Les nitrates sont dosés par la méthode de
salicylate de sodium. Les nitrates en présence de salicylate donnent le
paranitro-salicylate de sodium coloré en jaune.
La méthode de dosage consiste à prendre 5 ml du
l'extrait déjà préparé, on ajoute 5 ml de l'eau
distille ainsi qu'1 ml du salicylate de sodium. La solution obtenue est
évaporée dans un bain marie à une température de
80°C. Après on la laisse refroidir et on ajoute 2 ml d'acide
sulfurique concentre (qui doit être dissout totalement).
Après 10 min, on ajoute 15 ml d'eau distille puis 15 ml
de tartrate double de Na et K qui développe une coloration jaune,
après on fait la lecture au spectrophotomètre à une
longueur ë= 415nm et on note la densité optique correspondante.
L'étape suivante consiste à préparer une
solution déjà contaminé par les nitrates connaissant la
concentration et procéder au même protocole déjà
cité et ensuite on note la nouvelle densité.
La méthode qui nous permettra de déterminer la
concentration de notre échantillon s'appelle méthode des ajouts
dosés, qui n'est autre qu'une simple relations de trois
c'est-à-dire qu'à chaque densité optique correspond
à une concentration sachant qu'on a déjà
préparé une solution de concentration en nitrate connue.
NB : pour toutes les mesures effectuées par
spectrophotomètre, nous avons adopté la méthode des ajouts
dosés et pour chaque manipulation, nous avons préparé des
solutions contaminées par les éléments recherchés
avec une concentration connue.
VI-4-4-Nitrites :
L'acide sulfurique en milieu chlorhydrique en présence
d'ions NH4 + et de phénol forme avec les ions NO2 - un complexe
coloré en jaune. Cette méthode s'appelle méthode au
réactif Zambelli.
La méthode consiste à prendre 50 ml de
l'échantillon à analyser et de lui ajouter 2 ml du réactif
de Zambelli (formé d'acide chlorhydrique pur, d'acide sulfanilique, de
phénol cristallisé de NH4Cl et de l'eau distillé) ensuite
agiter et laisser reposer pendant 10 min, après on ajoute 2 ml
d'ammoniaque pur et on effectue la lecture à une longueur ë=435
nm.
VI-4-5- Cations échangeables :
Le dosage des cations échangeables se fait par une
simple méthode de titrage, on prend un volume de 10 ml de
l'échantillon à analyser et on le sature par une solution
d'acétate d'ammonium 1N ajustée à pH=8.2 et ensuite on
dose le tout par l'EDTA.
VI-4-6- Phosphates :
Le dosage du phosphore total est effectué âpres
minéralisation de l'échantillon à chaud en présence
d'acide sulfurique et de persulfate de potassium (K2S2O8).
La méthode consiste à prendre une prise d'essai
de l'échantillon de 50 ml, on lui ajoute 1 ml de H2SO4 et 0.4
g de persulfate de potassium poudre, on porte le tout à
ébullition à une température de 120°C et pendant 30
min, âpres on ajoute 3 gouttes de phénophtaléine. Ensuite
on alcalinise par une solution de NaOH jusqu' à une coloration rose, et
on décolore ensuite par H2SO4, âpres on ajoute 1 ml de l'acide
ascorbique et 4 mn du réactif combine. On attend 30 min et on fait la
lecture à une longue ë=882nm.
VI-4-7- Orthophosphates :
Le principe de cette méthode réside à la
formation en milieu acide d'un complexe avec le molybdate d'ammonium et le
tartrate double d'antimoine et de potassium.
La méthode consiste à prendre une prise d'essai
de 20 ml de l'échantillon et de lui ajouté 1 ml d'acide
ascorbique ainsi que 4 ml du réactif combiné, on laisse reposer
30 min et on observe une coloration bleu ensuite on fait la lecture à
une longueur ë=880 nm.
VI-4-8- Chlorures :
Les chlorures sont dosés en milieu neutre par une
solution titrée de nitrate d'argent en présence de chromate de
potassium. La fin de réaction est indiquée par l'apparition de la
teinte rouge caractéristique du chromate d'argent
La méthode consiste à introduire un volume de
1ml de l'échantillon et de lui ajouter 2 a 3 gouttes d'acide nitrique
pur et 3 gouttes de solution de chromate de potassium, ensuite on titre par une
solution de nitrate d'Argent jusqu'à apparition d'une teinte
rougeâtre.
VI-5- Méthode d'analyse des métaux lourds
:
VI-5-1-Principe :
La méthode adoptée pour l'analyse des
métaux lourds est la spectrophotométrie d'absorption atomique,
elle permet de quantifier les éléments métalliques en
solutions. Chaque élément à un nombre d'électrons
associés à son noyau. La configuration orbitale normale et la
plus stable des électrons est appelée état de base.
Lorsque qu'une énergie est fournie à un atome, ce dernier
l'absorbe et adopte une configuration électronique appelée
état d'excitation. Cet état est instable et l'atome
retourne immédiatement à son état de base libérant
ainsi une énergie lumineuse.

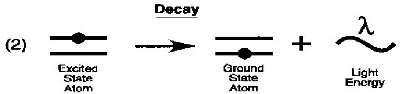
Figure 3 : principe de la spectrophotométrie
d'absorption atomique
VI-5-2-Appareillage :
Lors du procédé d'absorption atomique
l'énergie fournie à l'atome provient d'une source lumineuse
appelle lampe à cathode creuse. L'atome dans son état de base
absorbe l'énergie lumineuse à une longueur d'onde
spécifique et passe un état d'excitation. Un détecteur
mesure la quantité de lumière absorbée et un signal
électronique est produit en fonction de l'intensité lumineuse. Ce
signal est traité et la quantité d'analyte dans
l'échantillon est déterminée en fonction de l'absorbance
mesurée.
Le contact entre les atomes et la source lumineuse est
assurée par la cellule d'absorption. Cette cellule est en faite une
flamme générée par la combustion d'acétylène
en présence d'oxygène. L'échantillon à analyser est
aspire par l'appareil et transformé en aérosol. La flamme atomise
ensuite les
éléments contenus dans l'aérosol et les
place en travers du faisceau de la lampe à cathode creuse.
La lampe à cathode creuse émet le spectre
lumineux spécifique à l'élément analysé. La
cathode et l'anode de la lampe sont composées uniquement de
l'élément dont le spectre lumineux doit être produit. Un
potentiel électrique est appliqué entre l'anode et la cathode, ce
qui à pour effet d'ioniser le gaz contenu dans la lampe. Les ions de gaz
vont ensuite entrer en collision avec la cathode, ce qui déloge des
atomes métalliques. Ces atomes vont aussi entrer en collision avec les
ions de gaz ce qui les fait passer à un état d'excitation. Ils
retournent aussitôt à leur état de base ce qui produit
l'énergie lumineuse désirée.
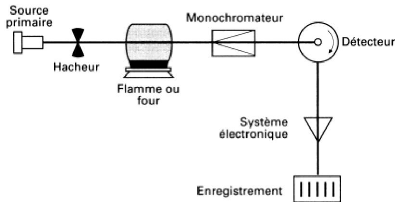
Figure 4 : Principe de fonctionnement de
Spectrophotométrie d'IEsorStio4
Résuliais
ti
DiscussioNs
Partie III : Résultats et discussions VII-
Evolution des paramétres bactériologiques :
Tableau 2: Résultats des analyses
bactériologiques des différents sites étudiés
UFC/100g
|
Monfleuri
|
Sidi brahim
|
Merja
|
|
profondeur
|
0-15
|
15-30
|
0-15
|
15-30
|
0-15
|
15-30
|
|
Coliforme Totaux
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
7,13E+03
|
1,00E+01
|
|
Coliforme Fécaux
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
6,93E+02
|
1,00E+02
|
|
Streptocoques
|
0,00E+00
|
0,00E+00
|
1,71E+05
|
2,37E+05
|
3,04E+05
|
1,71E+05
|
|
ASR
|
1,67E+04
|
2,00E+03
|
1,33E+01
|
3,33E+00
|
3,33E+00
|
3,33E+00
|
|
Germe Totaux à 22°C
|
1,55E+05
|
2,60E+06
|
7,11E+05
|
4,77E+06
|
3,00E+05
|
1,84E+06
|
|
Germe Totaux à 37°C
|
1,91E+07
|
6,50E+08
|
8,80E+06
|
1,88E+07
|
2,02E+06
|
7,72E+06
|
|
Staphylococcus
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
1,63E+05
|
1,47E+05
|
|
Pseudomonas
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
|
Salmonella
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
|
Wisslane
|
Tghate
|
Medina
|
|
profondeur
|
0-15
|
15-30
|
0-15
|
15-30
|
0-15
|
15-30
|
|
Coliforme Totaux
|
3,48E+05
|
1,01E+06
|
1,04E+05
|
2,50E+06
|
9,73E+05
|
3,38E+05
|
|
Coliforme Fécaux
|
1,73E+03
|
6,67E+00
|
7,06E+04
|
2,39E+05
|
0,00E+00
|
2,97E+02
|
|
Streptocoques
|
2,74E+03
|
3,00E+01
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
|
ASR
|
3,33E+00
|
6,67E+00
|
6,67E+00
|
1,00E+01
|
6,67E+01
|
1,00E+02
|
|
Germe Totaux à 22°C
|
4,89E+06
|
5,67E+06
|
1,33E+06
|
2,37E+07
|
3,81E+05
|
5,65E+05
|
|
Germe Totaux à 37°C
|
7,28E+06
|
1,51E+06
|
6,46E+06
|
2,03E+07
|
2,04E+06
|
5,44E+06
|
|
Staphylococcus
|
5,65E+05
|
4,53E+05
|
1,48E+04
|
6,85E+05
|
3,72E+05
|
4,67E+03
|
|
Pseudomonas
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
|
Salmonella
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
|
Bensouda
|
massira
|
Doukkarat
|
|
profondeur
|
0-15
|
15-30
|
0-15
|
15-30
|
0-15
|
15-30
|
|
Coliforme Totaux
|
2,01E+05
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
7,61E+05
|
2,18E+07
|
|
Coliforme Fécaux
|
0,00E+00
|
6,70E+04
|
0,00E+00
|
0,00E+00
|
5,21E+05
|
6,80E+06
|
|
Streptocoques
|
2,14E+06
|
1,77E+06
|
5,71E+05
|
2,70E+05
|
0,00E+00
|
0,00E+00
|
|
ASR
|
3,33E+00
|
0,00E+00
|
1,00E+01
|
3,33E+00
|
6,67E+00
|
3,33E+00
|
|
Germe Totaux à 22°C
|
2,56E+05
|
1,01E+06
|
6,75E+05
|
1,08E+06
|
4,08E+06
|
2,04E+06
|
|
Germe Totaux à 37°C
|
2,93E+05
|
4,23E+06
|
1,56E+06
|
5,90E+06
|
9,06E+06
|
3,43E+08
|
|
Staphylococcus
|
0,00E+00
|
1,05E+05
|
1,03E+05
|
1,69E+03
|
5,20E+03
|
6,63E+03
|
|
Pseudomonas
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
|
Salmonella
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
0,00E+00
|
|
46
|
|
|
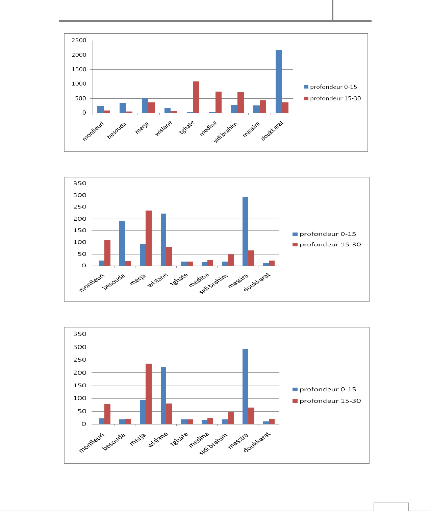
Les analyses des sols des différents sites choisis ont
mis en évidence la présence des bactéries en profondeur.
La littérature rapporte que les germes peuvent exister jusqu'à 60
cm vu que les pores des sols à cette profondeur sont imbibés
d'eau et se comporte comme un milieu aquatique anaérobie pour les
bactéries. Les entérobactéries, étant
anaérobies facultatives, ont beaucoup de facilité a survivre
(Powell et al.,2003).
Dans la profondeur 0-15 cm, nous avons constaté une
concentration moins élevée des germes étudiés que
celle enregistrée dans la profondeur 15-30. Cela pourrait être
expliqué par l'intensité des rayons solaires, en particulier les
rayons UV, sur la surface du sol, qui ont un effet bactéricide. Alors
que pour les Streptocoques, on les trouve en concentration élevée
à la profondeur 0-15, du fait qu'ils sont plus résistants
à la température.
Le rapport CF/SF est supérieur à 1 dans les
sites de : Tghate, Medina et Doukkarat, ce qui montre qu'il s'agit d'une
contamination fécale d'origine humaine. Alors que pour les autres sites,
la contamination fécale est de type animal, puisque le rapport CF/SF est
inferieur à 1.
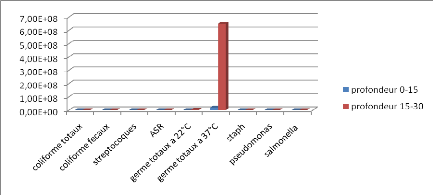
Figure 5 : Evolution des différents germes
cherchés dans la zone de Monfleuri
48
Mémoire MASTER
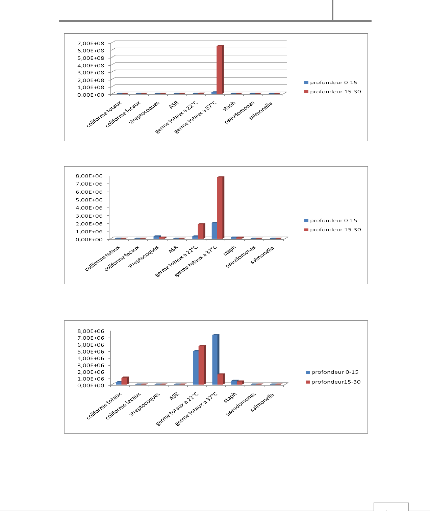
Figure 6 : Evolution des différents germes
cherchés dans la zone de Sidi brahim
Figure 7 : Evolution des différents germes
cherchés dans la zone de Merja
Figure 8 : Evolution des différents germes
cherchés dans la zone de Wisslane
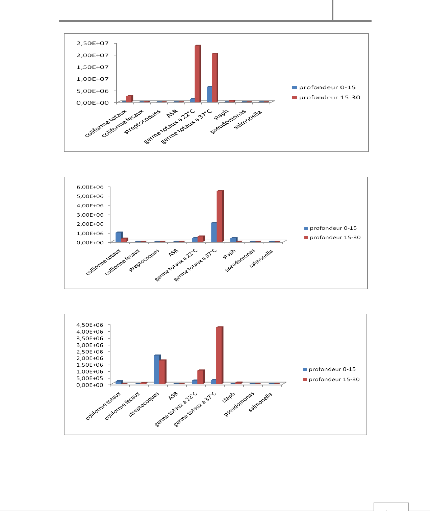
Figure 9 : Evolution des différents germes
cherchés dans la zone de Tghate
Figure 10 : Evolution des différents germes
cherchés dans la zone de Medina
Figure 11 : Evolution des différents germes
cherchés dans la zone de Bensouda
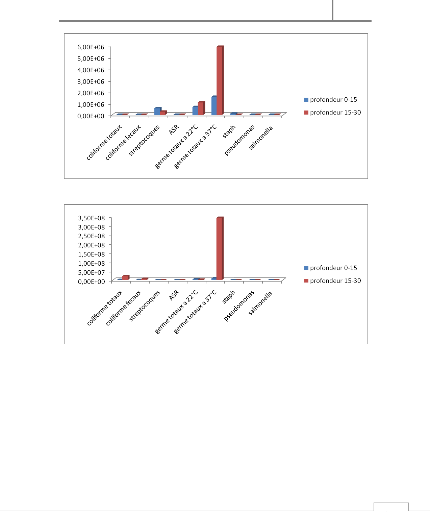
50
Mémoire MASTER
Figure 12 : Evolution des différents germes
cherchés dans la zone de Massira
Figure 13 : Evolution des différents germes
cherchés dans la zone de Doukkarat
VIII- Evolution des paramètres physico-chimiques des
sols :
Tableau 3 : Résultats des analyses
physico-chimiques de la totalité des sites étudiés en
ppm
|
Sites
|
|
Wisslane
|
|
Tghate
|
|
Medina
|
|
|
Profondeur
|
|
0-15
|
15-30
|
|
0-15
|
Profondeur
|
|
0-15
|
15-30
|
|
pH
|
|
7,65
|
|
7,81
|
|
|
8,1
|
|
|
Humidité
|
|
20,0%
|
|
8,6%
|
|
|
19,1%
|
|
|
Nitrates (mg/kg)
|
|
238,33
|
71,67
|
|
354,17
|
|
38,82
|
|
530,63
|
|
363,75
|
|
Phosphore total (mg/kg)
|
|
21,9
|
108,38
|
|
192,2
|
|
20,33
|
|
94,4
|
|
234,25
|
|
Orthophosphates (mg/kg)
|
|
13,1
|
65
|
|
115,3
|
|
12,2
|
|
56,6
|
|
140,6
|
|
Nitrites (mg/kg)
|
|
3,54
|
21,24
|
|
2,52
|
|
34,35
|
|
3,38
|
|
6,9
|
|
Chlorures (mg/kg)
|
< 1
|
|
< 1
|
< 1
|
|
< 1
|
|
< 1
|
|
< 1
|
|
|
Cations échangeables
(mg/kg)
|
< 1
|
|
< 1
|
< 1
|
|
< 1
|
|
< 1
|
|
< 1
|
|
|
Sites
|
|
Wisslane
|
|
Tghate
|
|
|
Medina
|
|
|
Profondeur
|
|
0-15
|
15-30
|
|
0-15
|
15-30
|
|
0-15
|
15-30
|
|
pH
|
|
8,85
|
|
8,27
|
|
|
8,9
|
|
|
Humidité
|
|
11,1%
|
|
17,6%
|
|
|
14,3%
|
|
|
Nitrates (mg/kg)
|
|
152,5
|
59,79
|
|
34,17
|
|
1082,5
|
|
16,65
|
|
736,67
|
|
Phosphore total (mg/kg)
|
|
221
|
79,64
|
|
17,88
|
|
18,11
|
|
15,33
|
|
23,87
|
|
Orthophosphates (mg/kg)
|
|
200
|
47,8
|
|
10,7
|
|
10,9
|
|
9,2
|
|
50
|
|
Nitrites (mg/kg)
|
|
3,29
|
21,4
|
|
3,82
|
|
15,7
|
|
3,46
|
|
20,01
|
|
Chlorures (mg/kg)
|
< 1
|
|
< 1
|
< 1
|
|
< 1
|
|
< 1
|
|
< 1
|
|
|
Cations échangeables
(mg/kg)
|
< 1
|
|
< 1
|
< 1
|
|
< 1
|
|
< 1
|
|
< 1
|
|
|
Sites
|
|
Wisslane
|
|
Tghate
|
|
|
Medina
|
|
|
Profondeur
|
|
0-15
|
15-30
|
|
0-15
|
15-30
|
|
0-15
|
15-30
|
|
pH
|
|
8,91
|
|
7,92
|
|
|
8,82
|
|
|
Humidité
|
|
12,0%
|
|
8,1%
|
|
|
15,4%
|
|
|
Nitrates (mg/kg)
|
|
265,94
|
705,83
|
|
244,72
|
|
432
|
|
2170,5
|
|
358,75
|
|
Phosphore total (mg/kg)
|
|
17,44
|
47,53
|
|
292,33
|
|
64,85
|
|
292,33
|
|
64,85
|
|
Orthophosphates (mg/kg)
|
|
13
|
28,5
|
|
175,4
|
|
38,9
|
|
6,5
|
|
12,6
|
|
Nitrites (mg/kg)
|
|
2,16
|
28,32
|
|
4,61
|
|
15,59
|
|
1,8
|
|
10,11
|
|
Chlorures (mg/kg)
|
< 1
|
|
< 1
|
< 1
|
|
< 1
|
|
< 1
|
|
< 1
|
|
|
Cations échangeables
(mg/kg)
|
< 1
|
|
< 1
|
< 1
|
|
< 1
|
|
< 1
|
|
< 1
|
|
|
51
|
|
|
VIII-1- pH :
Les valeurs moyennes du pH pour les sols agricoles varient de
8,10 à 8,85,
pour les sols industriel, le pH varie de 7,81 à 8,91et
finalement pour les sols habitables, le pH varie de 7,65 à 8,90.
Les valeurs du pH trouvés sont des pH basiques, elles
concordent avec celles déjà réalisés par (Habib Ben
Hassine, 2006).
VIII-2- L'humidité relative:
Les valeurs moyennes de l'humidité sont comprises entre
8 % et 20 % pour les sites habitables, entre 8 % et 16 % pour les sites
industriels et entre 12% et 20 % pour les sites agricoles.
Les trois types de sites : Monfleuri, Merja et Doukkarat
présentent la valeur la plus élevée en terme
d'humidité, ceux-ci pourrait être expliqué par leurs
proximité des fleuves (Oued Fès pour les deux derniers, Oued
Mirra pour le site de Monfleuri).
VIII-3- Nitrates :
Les valeurs trouvées pour les sites habitables à
une profondeur entre 0-15 sont comprises entre 16,65 ppm et 238 ppm, alors que
pour la profondeur 15-30, les valeurs sont respectivement 71,7 ppm et 736,7
ppm.
Pour les sites industriels et pour une profondeur de 0-15, les
valeurs trouvées sont entre 266 ppm et 2117,5 ppm, alors que pour la
deuxième profondeur, ces valeurs sont entre 38,9 ppm et 705,9 ppm.
Pour la première profondeur des sites agricoles, les
valeurs sont respectivement 34,2 et 530,7 ppm, alors que pour la
deuxième profondeur, les valeurs sont comprises entre 59,8 et 1082,5
ppm.
Les nitrates proviennent en général de la
décomposition de matières végétales ou animales,
d'engrais utilisés en agriculture, du fumier, d'eaux usées
domestiques et industrielles, des précipitations.
Les valeurs les plus élevées enregistrées
dans chaque type de site sont celles de Doukkarat, Massira et Merja. Ceci est
expliqué par l'intensité élevée de l'usage des
engrais et les fumiers dans les sites agricoles, les déchets et les eaux
usées des sites industriels et des déchets d'origine humaine pour
les sites habitables.
VIII-4- Phosphore totale :
Pour les sites industriels et pour une profondeur de 0-15, les
valeurs trouvées sont entre 10,75 et 192,20 ppm, pour les sites
agricoles entre 17,88 et 221 ppm alors que pour les sites habitables, les
valeurs sont entre 15,33 et 292,33 ppm.
Alors que pour la deuxième profondeur, les valeurs du
phosphore total concernant les sites industriels sont entre 20,33 et 47,53 ppm,
pour les sites agricoles, les valeurs sont 18,11 et 234,25 ppm et pour les
sites habitables entre 23,87 et 108,38 ppm.
Les résultats trouvés concordent avec les
statistiques cités par le Conseil Scientifique Régional de
l'Environnement de Bretagne, puisque les valeurs moyennes trouvées ne
dépassent pas 400 ppm1.
1 Conseil Scientifique Régional de
l'Environnement de Bretagne Séance du 14 Décembre 1999 - Version
définitive du 11 Mars 2001 Contribution de Pierre Aurousseau, Professeur
(le phosphore dans les sols)
VIII-5- Orthophosphates :
Les valeurs trouvées pour les sites habitables à
une profondeur entre 0-15 sont comprises entre 9,2 et 175,4 ppm, alors que pour
la profondeur 15-30, les valeurs sont respectivement 38,9 et 65 ppm.
Pour les sites industriels et pour une profondeur de 0-15, les
valeurs trouvées sont entre 6,5 et 115,3ppm, alors que pour la
deuxième profondeur, ces valeurs sont entre 12,2 et 38,9ppm.
Pour la première profondeur des sites agricoles, les
valeurs sont comprises entre 10,7 et 200 ppm, alors que pour la deuxième
profondeur sont entre 12,2 et 140,6ppm.
Les orthophosphates sont la forme dissoute du phosphore, ils
proviennent essentiellement de l'épandage agricole. Les sites Wisslane,
Massira et Sidi Brahim possèdent une forte teneur comparée aux
autres sites, ceci pourrait être expliqué par leur origine
agricole.
VIII-6- Nitrites :
Pour les sites industriels et pour une profondeur de 0-15, les
valeurs trouvées sont entre 1,80 et 2,52 ppm, pour les sites agricoles
entre 3,29 et 3,82 ppm alors que pour les sites habitables, les valeurs sont
entre 3,46 et 4,61 ppm.
Alors que pour la deuxième profondeur, les valeurs des
nitrites concernant les sites industriels sont entre 10,11 et 34,35 ppm, pour
les sites agricoles, les valeurs sont 6,90 et 21,40 ppm et finalement, pour les
sites habitables elles sont comprises entre 15,59 et 21,24 ppm. Les nitrites
proviennent en général de la décomposition de
matières végétales ou animales, d'engrais utilisés
en agriculture, du fumier, d'eaux usées domestiques et industrielles.
VIII-7- Chlorures :
Les valeurs des chlorures trouvées dans l'ensemble des
sites est inférieur a 1 ppm, a priori ces éléments sont
présents en trace et nécessite l'adoption d'une méthode de
dosage plus sensible (photométrie de flamme).
VIII-8- Cations échangeables :
Les valeurs des cations échangeables trouvées
dans l'ensemble des sites est inférieur a 1 ppm, a priori ces
éléments sont présents en trace et nécessite
également l'adoption d'une méthode de dosage plus sensible
(photométrie de flamme).
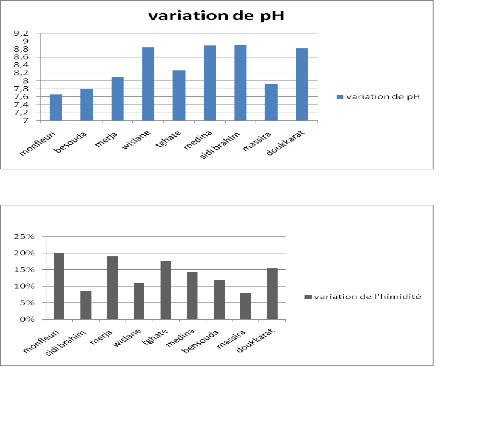
Figure 14 : Variation du pH des différents sites
étudiés
Figure 15 : Variation (1I('hXP iditéIdes
différents sites étudiés
56
Mémoire MASTER
Figure 16 : Variation de la concentration des Nitrates
des différents sites étudiés
Figure 17 : Variation de la concentration du phosphore
total des différents sites étudiés
Figure 18 : Variation de la concentration des
orthophosphates des différents sites étudiés
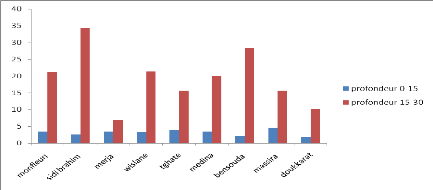
Figure 19 : Variation de la concentration des nitrites
des différents sites étudiés
IX- Evolution des paramètres métaux lourds
des sols :
Tableau 4 : Résultats des analyses des
métaux lourds des différents sites en ppm
|
Cd
|
Cr
|
Cu
|
Ni
|
Pb
|
Zn
|
|
Merja 15-30
|
0.312
|
83.581
|
30.719
|
54.421
|
138.315
|
83.893
|
|
Bensouda 15-30
|
0.337
|
39.606
|
33.033
|
34.550
|
81.909
|
83.594
|
|
Tghate 15-30
|
0.354
|
34.697
|
22.659
|
32.042
|
70.457
|
61.959
|
|
Medina 15-30
|
0.320
|
64.917
|
15.830
|
46.849
|
122.479
|
66.836
|
|
sidi brahim 15-30
|
0.332
|
38.500
|
40.823
|
79.324
|
103.884
|
89.944
|
|
Wisslane 15-30
|
0.325
|
47.641
|
24.552
|
130.566
|
106.665
|
73.820
|
|
Massira 15-30
|
0.349
|
78.603
|
23.529
|
47.406
|
122.000
|
63.789
|
|
Doukkarat 15 -30
|
0.246
|
5.543
|
2.833
|
73.291
|
8.007
|
14.535
|
|
Merja 0-15
|
0.331
|
59.112
|
21.194
|
140.413
|
106.303
|
67.391
|
|
Bensouda 0-15
|
0.353
|
0.353
|
0.353
|
0.353
|
0.353
|
42.302
|
|
Tghate 0-15
|
0.318
|
47.608
|
13.534
|
109.229
|
77.702
|
79.454
|
|
Medina 0-15
|
0.313
|
50.143
|
8.462
|
21.624
|
92.607
|
47.635
|
|
sidi brahim 0-15
|
0.315
|
35.113
|
25.666
|
15.273
|
80.618
|
89.279
|
|
Wisslane 0-15
|
0.314
|
46.884
|
15.680
|
42.336
|
102.548
|
58.957
|
|
Massira 0-15
|
0.320
|
82.591
|
19.367
|
49.939
|
113.642
|
41.135
|
|
Doukkarat 0-15
|
0.329
|
33.109
|
12.848
|
32.945
|
197.174
|
54.359
|
|
Monfleuri 0-15
|
0.339
|
63.655
|
23.255
|
25.632
|
114.070
|
65.862
|
|
Valeur de
référence
|
2
|
150
|
100
|
50
|
100
|
300
|
Les différents métaux lourds recherchés
dans l'ensemble des sites sont en présents en valeurs inferieurs aux
valeurs de référence sauf pour le Nickel (Ni) et le Plomb (Pb)
qui excédent ces valeurs dans certains sites.
Les sites possédant un forte teneur en Plomb
excédant la valeur de référence sont : Wisslane, Massira,
Doukkarat, Monfleuri, Tghate et Merja dans la profondeur 0-15 cm et Medina,
Sidi brahim, Wisslane, Massira et Merja à une profondeur de 15-30 cm.
L'existence du Plomb dans ces sols a une forte concentration
ne pourrait être expliqué que par leur proximité de routes
à circulation dense; d'industries ayant utilisé du plomb,
d'usines de recyclage de piles au plomb et de grands bâtiments ou
structures d'acier (tels que les ponts et les châteaux d'eau) pouvant
contenir de la peinture au plomb qui s'effrite.
Aussi, on pourra ajouter l'application par le passé de
pesticides au plomb, les engrais commerciaux et les boues d'épuration
(parfois utilisées comme engrais dans l'agriculture).
Les sites possédant un forte teneur en Nickel
dépassant la valeur de référence sont : Wisslane, Sidi
brahim, Doukkarat et Merja dans la profondeur 15-30 cm et Tghate et Merja
à une profondeur de 0-15 cm.
L'origine anthropique du nickel n'est pas agricole mais
résulte des émissions des centrales et des
incinérateurs.
La part la plus importante du nickel relâché dans
l'environnement est adsorbée par les sédiments et les particules
du sol et devient par conséquent immobile.
O oNcLusioN
ET
pERspEcTi-
YEs
Conclusion et perspectives
L'ensemble des analyses bactériologiques faites au
niveau de plusieurs sites démontrent que le sol constitue la matrice la
plus importante, de point de vue qu'il renferme un nombre et une
diversité des micro-organismes importante dans les différentes
profondeurs de l'ordre de 106.
Les analyses physico-chimiques montrent que les
éléments toxiques choisis existent en sol, notamment les nitrates
qui sont présents à une concentration élevée
comparé aux autres paramètres (2170,5 ppm) ainsi que les
phosphores mais en concentration acceptable (292.33 ppm). Les nitrites et les
orthophosphates sont présents en faible concentration (34.52 ppm, 175,4
ppm).
Les analyses des métaux lourds montrent qu'il y a une
contamination par le Nickel et le Plomb uniquement (dépasse les valeurs
des références (supérieur à 100 pour les Pb et
supérieur à 50 pour le Ni)) alors que pour les autres
métaux, il n'y a aucune contamination.
Cette étude a révélé que le site
industriel Doukkarat est le plus contaminé par rapport aux autres sites
industriels, le site agricole Merja et le site habitable Massira sont les plus
contaminés de leur catégorie.
Dans une étude future, le choix d'autres
paramètres qui sont plus toxiques et plus répondus dans l'air,
l'eau et le sol bien évidement tell que les HAP, les furanes et
dioxines, les HAM peut être très utile et donnera un valeur
ajoutée à ce type d'étude.
Une étude plus complète à travers la
colonne de sol jusqu'à la nappe et sur une longue période
permettra non seulement la mise en évidence de la contamination
bactériologique de la nappe mais aussi montrer l'effet
saison.de plus cette étude peut
être étendues aux autres micro-organismes pathogènes tels
que les virus et certains parasites.
Références bibliographiques
A. Fabiani, E. Gamalero, M. Castaldini, G.P. Cossa, C.
Musso, M. Pagliai, G. Berta (2009): Microbiological polyphasic
approach for soil health evaluation in an Italian polluted site Science of the
Total Environment 407 4954-4964.
A. Hatimi et S. Tahrouch 2007 :
Caractérisations chimique, botanique et microbiologique du sol
des dunes littorales du Souss- Massa Biomatec Echo, Vol 2, (5) pp
85-97
Ali Boularbah, Christophe Schwartz, Gabriel Bitton,
Jean Louis Morel (2006): Heavy metal contamination from mining sites
in South Morocco: 1. Use of a biotest to assess. Chemosphere 63
802-810
Antoine F. (2001) : la pollution des sols :
impact sur l'environnement et la santé : Note rapide sur l'environnement
et la santé, 26p.
APHA, AWWA et WEF APHA. (1998): Standard methods
for the examination of water and wastewater, 20 eme edition. 201p.
Archibald F., (2000): The presence of coliform
bacteria in candian pulp and paper mill water systems cause dor concern? Water
Qual Res J.Canada, 35p.
Barthe C., Perron J. et Perron T.M.R ., (1998)
: Guide d'interprétation des paramètres microbiologiques
d'intérêt dans le domaine de l'eau potable. Document de travail
(version préliminaire), ministère de l'environnement du
Québec, 155 p.
Bulletin de LAAGRIMA (juin 2002) :
Laboratoire d'Analyse Agricoles Marocain ; l'analyse du sol, un outil
incontournable de la gestion de la fertilité des sols.
Centre d'expertise en analyse environnementale du
Québec (2010) : Guide d'échantillonnage à des
fins d'analyses environnementales.
Centre technologique des résidus industriels du
CANADA (1998) : guide, critères et méthode
d'échantillonnage des sols.
COURDE Laurent, VALLAEYS Tatiana, NOUAÏM Rachida,
LAMY Isabelle, DUCAROIR Jacques, LINERES Monique 1971 : Aspects
microbiologiques de la contamination d'un sol par le cuivre.
Davenport C. V., Sprarrow and Gordo R. C.,
(1976): Fecal indicator bacteria persistence under conditions in an
ice covered river. App. Env. Microbial., 32(4), 527-536.
Earth Sciences for Society Foundation, leyde, Pays-Bas
(Octobre 2007): Le sol : Épiderme vivant de la terre. Les
géosciences au service de l'humanité.
Edberg, SSCEW. Rice, RJKarlin et MJ Allen
(2000): Escherichia coli: the best biological drinking water indicator
for public health protection. Journal of Applied Microbiology, 88:
106S-116S.
Habib Ben Hassine;Direction des sols, minist~re de
l'Agriculture et des Ressources hydrauliques, 2080 Ariana, Tunisie
(2006) : Nature minéralogique et rôle nutritionnel des
argiles de sols céréaliers en région subhumide à
semi-aride (Tunisie).
Hart T. et Shears P., (2002): Atlas de poche de
microbiologie. 3eme tirage. 253p.
Hicham El Khalil & Ouafae El Hamiani & Gabriel
Bitton & Naaila Ouazzani & Ali Boularbah (2008): Heavy metal
contamination from mining sites in South Morocco: Monitoring metal content and
toxicity of soil runoff and groundwater. Environ Monit Assess
136:147-160
Ime R. Udotong, Ofonime U. M. John, and Justina I. R.
Udotong (2008): Microbiological and Physicochemical Studies of Wetland
Soils in Eket, Nigeria World Academy of Science, Engineering and
Technology 44.
Institut national de santé publique du
Québec (Mai 2003) : Groupe scientifique sur l'eau Fiche
Coliformes fécaux.
Institut national de santé publique du
Québec (Mai 2003) : Groupe scientifique sur l'eau Fiche
Coliformes totaux.
Khamar M., (2002) : Étude de la charge
en métaux lourds dans les eaux usees, les sédiments, les sols et
les productions agricoles irriguées par les eaux usees de la ville de
Fès. Thèse de Doctorat, U.S.M.B.A.Fac. S.D.MFès. 15-20.
Knner B.A., Clark H.F. and Kabler P .,(1970):
Fecal streptococci cultivation and enumeration of streptococci in
surface water. App. Microbial., 9, 15-20.
Matthieu THOMAS, Lysia MBINA (Mars 2007) :
Microbiologie appliquée aux géosciences. Analyse microbienne du
sol et de l'eau de la Vallée Dorma.
Mekki I., Lberge I.J., Ben Mechlia N. and Voltz M.,
(2006): Assessement
of overland flow variation and blue water
production in a farmed semi-arid
water harvesting catchment. Physics and chemistry of
Earth, 31 (17), 1048- 106.
Merzouki M., (1992) : Épuration des
eaux usées de la ville de Ouarzazate dans les bassins de stabilisation
et leur réutilisation en irrigation Aspects bactériologiques.
Thèse de 3éme cycle. Fac des sciences. Meknès. 141p.
P. Roger Institut pasteur (septembre 1968) :
cours de microbiologie de sol et compte rendu des résultats des travaux
pratiques.
Pochon J. et Tardieux P., (1962) : Technique
d'analyse de microbiologique du sol. Edition de la Tourelle, Saint
Mandé., 108p.
Powell K. L. et Taylor R. G., (2003): Microbial
contamination of two urban sandstone aquifers in UK. Water research
37: 339-352.
R. Galvez-Cloutier et Pierre Jacques Lefrançois
(Mai 2005) : Les sols contaminés par des métaux lourds :
Distribution géochimique et techniques de restauration (partie 1 et 2)
VECTEUR ENVIRONNEMENT
· VOLUME 38
· NUMÉRO 3
·
Rodier J., (1996): L'analyse de l'eau: eaux
naturelles, eaux résiduaires et eaux de mer.8Ed.Dunod Paris 1365p.
Zmirou D, Beausoleil, de coninck P, Deportes I, Dor F,
EmpreurBissonet P, Hours M, Keck G, Lefebvre L, Rouisse L (2003) :
Déchets et sol pollues. In : environnement et sante public -
Fondement et pratiques, 99. 397-440.
Annexe1
Liste des Milieux de culture utilisés Milieu du
Tergitol
- Lactose : 20,0 g/l
- Peptone : 10,0 g/l
- Extrait de levure : 6,0 g/l - Extrait de viande : 5,0 g/l -
Agar-agar: 12, 7 g/l
- Eau: 1000 ml
- Tergitol 7 : 0,1 g/l
- TTC : 0,025 g/l
Milieu de Slanetz et Bartley
- Peptone de caséine : 15,0 g/l
- Peptone de farine de soja : 5,0 g/l - Extrait de levure : 5,0
g/l
- D(+)- glucose : 2,0 g/l
- Hydrogénophosphate dipotassique : 4,0 g/l
- Agar-agar : 10,0 g/l
Milieu PCA
-Tryptone : 5,0 g
- Extrait autolytique de levure :2,5 g
- Glucose :1,0 g
- Agar agar bactériologique :12,0 g
Milieu CHAPMAN
- Peptone : 10,0 g/l
- Extrait de viande : 1,0 g/l - D (-) mannitol : 10,0 g/l -
Agar-agar : 12,0 g/l
- Eau : 1000ml
Milieu CETREMIDE
- Peptone de gélatine : 20,0 g/l
- Chlorure de magnésium : 1,4 g/l - Sulfate de potassium :
10,0 g/l
- Agar-agar : 13,0 g/l
- Eau : 1000 ml
Milieu HEKTOEN
-Protéose-peptone-extrait de levure : 3,0 g
-Lactose : 12,0 g
-Saccharose : 12,0 g
-Salicine : 2,0 g
-Citrate de fer III et d'ammonium 1,5 g
-Sels biliaires : 9,0 g
-Fuchsine acide : 0,1 g
-Bleu de bromothymol : 0,065 g -Chlorure de sodium :5,0 g
-Thiosulfate de sodium : 5,0 g -Agar : 14,0 g
Annexe 2
Méthode de manipulation pour les analyses
bactériologiques:
(Coliformes totaux et fécaux, streptocoques, pseudomonas,
staphylocoque)
Préparation des échantillons
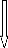
Préparation des dilutions
1 ml de l'échantillon + couler le milieu
approprié
Incubation a une température spécifique pour
chaque germe et pendant un
temps bien précis
Dénombrement bactéries
Annexe 3 :
Méthode de manipulation pour les analyses
bactériologiques: (suite) (Salmonella)
Étape de pré-enrichissement
(10 ml de
l'échantillon dans 100 ml de l'eau peptone cc)
Incubation pendant 24 h a 37 °c
1 ml de
l'échantillon pré-enrichi coulé dans des tubes contenant
le rappaport
Incubation pendant 24h a 37 °C
Ensemencement des tubes dans de l'Hektoen
Dénombrement bactéries
Annexe 4
Coloration de Gram
- Préparation et fixation d'un frottis a partie d'une
colonie bien isolée; - Coloration avec le Crystal violet pendant une
minute;
- Lavage de la lame avec de l'eau courant;
- Mordançage avec la solution de lugol pendant 90
secondes; - Décoloration avec la solution d'alcool acétone;
- Lavage sous le robinet;
- Faire un trait épais au crayon gras au milieu de la
lame;
- Coloration avec la fuscine pendant 60 secondes;
- Rincer à l'eau courante et sécher sur papier
filtre;
- Observation au microscope optique à l'objectif ×
100 à immersion.
| 


