|


Association Méditerranéenne
Francophone d'Imagerie et de
Cytométrie
Colloque PHC Volubilis
Comité Mixte
Inter-universitaire Franco-Marocain
Ambassade de France au
Maroc
Service de Coopération et d'Action Culturelle
Atelier de Cyométrie en flux
Mr. Mohamed Boumhras, Dr Ouafaa El Maataoui, Dr. Brahim
Farouqi et Pr. Gérard Lizard
Le 6 Décembre 2001
Au Laboratoire d'immunologie
Centre Hospitalier
Universitaire Ibn Rochd
Casablanca-Maroc

Programme
- 15 :00 - 15 :15 Instrumentation : Cytométrie en
flux
- 15:15 - 15:45 Stress oxydant : mesure de radicaux
oxygénés
- 15:45 - 16:30 Stress et organites cellulaires :
perméabilité membranaire et potentiel mitochondrial
- 16:30 - 17:15 Apoptose et cycle cellulaire
- 17 :15 - 18h Discussion : applications des techniques
présentées aux programmes de recherche des
participants
CYTOMETRIE EN FLUX (CMF)
(Mohamed
Boumhras)
1. Généralités
La CMF est une technologie qui permet la mesure simultanée
de plusieurs caractéristiques physiques d'une cellule. Les informations
apportées sur la cellule analysée par CMF sont :

Sa taille relative (Forward Scatter),
Sa granularité ou sa complexité interne relative
(Side Scatter),
Son intensité relative de fluorescence.
Le principe de fonctionnement d'un cytomètre en flux est
résumé dans la figure 1.
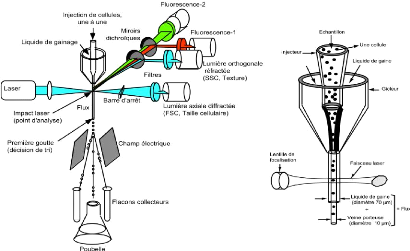
Figure 1: Principes de fonctionnement d'un
cytomètre en flux analyseur / trieur de cellules.
2- Domaines d'application de la CMF:
2-1 Analyses cellulaires:
Les cellules injectées au centre d'une veine liquide
indépendante (le liquide de gaine) adoptent une progression
particulière en file indienne (hydrofocalisation et écoulement
laminaire). Le flux tombe à l'air libre et croise un faisceau laser qui
illumine une à une les cellules durant quelques us , les cellules
défilant à la cadence moyenne de 1000 cellules / s. Suite
à cette excitation lumineuse,
chaque cellule diffuse une partie de la lumière
incidente et émet simultanément une ou plusieurs fluorescences en
fonction des sondes fluorescentes qu'elle porte. Les signaux lumineux
captés par une optique appropriée sont transmis à des
détecteurs photoélectriques puis à un ordinateur qui
mémorise toutes les données individuelles et dans l'ordre de
passage de chaque cellule.
2.3 Tri cellulaire: une fragmentation
contrôlée du flux liquide en 30.000 gouttes / s conduit à
l'emprisonnement de chaque cellule dans une goutte peu après l'analyse
dans un délai parfaitement connu par la machine durant lequel elle
décidera de charger électrostatiquement chaque goutte contenant
une seule cellule intacte et viable répondant à des
critères désignés par le chercheur. Les gouttes
chargées sont déviées de leur chute initiale par un champ
électrique constant et dirigées vers des flacons
récolteurs.
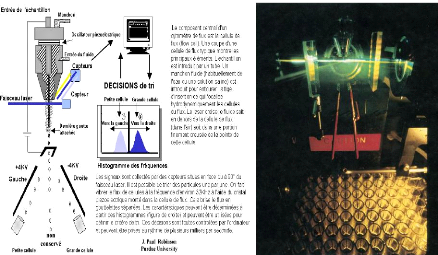
Figure 2 : Principe du tri cellulaire dans l'air
par gouttelettes
2. Applications abordées lors de l'atelier
2.1 Détection des anions superoxydes (O. - 2) et
des radicaux oxygénés par coloration à la Dihydroethidine
(DHE)
L'anion superoxyde (O. - 2) intracellulaires
et d'autres radicaux oxygénés peuvent être
détecté par le Dihydroethidine (DHE). La DHE est
un composé non fluorescent pouvant
diffuser a travers la membrane
cytoplasmique et qui, sous l'action d'anions superoxydes
O.- 2, s'oxyde rapidement (figure 2) en
éthidium Fluorescent (ëexcitation= 488 nm;
ëemission = 575nm). L'éthidium va ensuite se fixer de façon
non covalente en s'intercalant au niveau des bases azotés de l'ADN
nucléaire. Ceci permet sa rétention dans la cellule, et donc la
détection par cytométrie en flux est réalisable.
L'utilisation de cette sonde a l'avantage d'être simple et rapide.
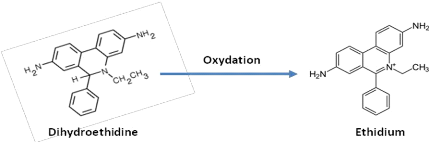
Figure 3 : Oxydation de la Dihydroethidine en
Ethidium.
2.2. Evaluation du stress cellulaires et de
l'activité d'organites cellulaires : 2.2.1 Evaluation de la
viabilité cellulaire et de l'intégrité de membrane
cytoplasmique par coloration a l' Iodure de Propidium (IP) par CMF
La viabilité cellulaire et l'intégrité
membranaire peuvent être évaluées par coloration a l'IP et
analyse en CMF. L'IP qui diffuse à travers une membrane
dégradée est exclu par une membrane intacte. L'IP ne colore que
les cellules mortes (nécrose primaire ou secondaire).
L' IP (ëexcitation= 538 nm ;
ëémission= 617 nm) est un fluochrome qui s'intercale dans les
acides nucléiques en émettant une fluorescence rouge.
2.2.2. Evaluation du potentiel trans-membranaire
mitochondriale avec le DiOC6(3) et analyse en CMF
Le potentiel de membrane mitochondriale (ÄØm) est
essentiel pour maintenir la fonction physiologique de la chaîne
respiratoire pour produire l'ATP. La détermination de son état
est largement utilisée pour caractériser le métabolisme,
l'apoptose et la viabilité cellulaire. La valeur relative de
ÄØm peut être mesurée par l'utilisation du DiOC6(3) et
analyse par CMF. Le DiOC6(3)
(ëexcitation= 488 nm ; ëemission= 501 nm) est un
fluochrome cationique, lipophile, son accumulation dans la mitochondrie
dépend du ÄØm et la fluorescence due à cette
accumulation est fonction du potentiel ÄØm : plus ce potentiel est
élevé plus la fluorescence associée au DiOC6(3) est forte
; vis versa quand le potentiel ÄØm diminue la fluorescence
associée au DiOC6(3) diminue.
2.3 Etude du cycle cellulaire et de
l'apoptose
Le cycle cellulaire représente l'intégralité
de la période de division, il inclus plusieurs évènements
biochimiques et morphologiques associés à la prolifération
cellulaire.
La mesure du cycle cellulaire par des méthodes
classiques de CMF divise le cycle en trois phases: G0/G1, phase d'activation
des cellules, S, phase de synthèse de l'ADN, G2/M phase de mitose. La
distinction entre G0 (phase quiescente) et G1 (phase de préparation a la
synthèse d'ADN) ainsi que G2 (préparation de la mitose) et M
(mitose) est impossible avec une méthode utilisant un fluorochrome
intercalant comme l'iodure de propidium (IP).
La CMF offre une méthodologie rapide et simple pour
l'analyse du cycle cellulaire. Elle permet de suivre la distribution des
cellules dans les différentes phases du cycle en fonction de divers
stimuli ou de l'ajout de certaines drogues. Elle permet aussi de voir la
présence de cellules avec des contenus anormaux d'ADN (étude de
la ploïdie).
Au cours de l'apoptose, l'analyse du cycle cellulaire permet
de mettre en évidence un pic Sub-G1 (localisé juste avant le pic
G0/G1). Ce pic permet de déterminer la proportion de cellules en
apoptose. Cette méthode de détection des cellules en apoptose
peut souvent s'avérer difficile en raison de la présence de
débris cellulaires. Par conséquent, l'analyse des cellules en
Sub-G1 sera obligatoirement complétée par une analyse
morphologique des noyaux après coloration au Hoechst 33342 (les noyaux
des cellules apoptotiques apparaissent condensés et/ou
fragmentés).
L'IP (ëexcitation= 538 nm ;
ëémission= 617 nm) est un fluochrome qui s'intercale dans les
acides nucléiques en émettant une fluorescence rouge. En
présence de RNAse, la quantité d'IP est proportionnelle à
la quantité d'ADN . L'IP permettant une analyse stochiométrique
de l'ADN, il est bien adapté a l'étude du cycle cellulaire et de
la ploïdie.
| 


