|
UNIVERSITE DE LUBUMBASHI
FACULTE DES SCIENCES
AGRONOMIQUES
DEPARTEMENT DE PHYTOTECHNIE

Quantification de la symbiose mycorhizienne des
essences de la forêt claire
(Miombo) du Katanga : Application au
reboisement.
« Cas de Pteocarpus angolensis, P. tinctoruis,
Uapaka
kirkiana et U. pilosa »
Par : BONDONGA MAMBOMA Hervé
Mémoire présenté et défendu
pour l'obtention du
grade d'ingénieur agronome
UNIVERSITE DE LUBUMBASHI
FACULTE DES SCIENCES
AGRONOMIQUES
DEPARTEMENT DE PHYTOTECHNIE

Quantification de la symbiose mycorhizienne des
essences de la forêt claire
(Miombo) du Katanga : Application au
reboisement.
« Cas de Pteocarpus angolensis, P. tinctoruis,
Uapaka
kirkiana et U. pilosa »
Par : BONDONGA MAMBOMA Hervé
Mémoire présenté et défendu
pour l'obtention du
grade d'ingénieur agronome
Directeur: Pr. Dr. Ir. BABOY LONGANZA Louis Encadreur :
C.T. Ir. KAUMBU Jean-Marc.

La forêt est partie essentielle de notre héritage
humain.
Michel Tournier
I
EPIGRAPHIE
II
DEDICACE
A l'Eternel Dieu tout puissant et miséricordieux, qui
par son amour incommensurable et sa grâce qui dure toute la vie a
opté que le jour tant attendu puisse connaître sa
réalisation et que nous soyons en vie pour témoigner ses
merveilles accomplies dans notre vie intellectuelle.
A mon père Justin Fabien BONDONGA LIKBENGBA A ma
mère Antoinette OMEKENGE OKAKO
A mes compagnons biologiques frères et soeurs qui ne
sont que des fragments d'ADN parental, dont nous citerons : Patrick BONDONGA,
Nono MABUKA, Dady BONDONGA, Haty BONDONGA, Natacha BONDONGA, Laeticia BONDONGA,
Geurda BONDONGA, Landry BONDONGA, Tania BONDONGA, Sarra BONDONGA, Cynthia
BONDONGA, Age BONDONGA, Brayane KIMOINGA et Samira OMEKENGE.
A Maman Alphonsine, Micheline ILUNGA, Papa Israël
MUTOMBO, Papa Eli TSHUMBU, Papa CHARLES, Papa Jules NKULU, Papa Franc LUWEMBO,
Ir Elie Parfait JAV, Papa Emeri NZALA YALA et sa Femme MADO sincèrement
et particulièrement pour votre main forte prêtée moralement
et financièrement.
Nous ne saurons clore cette page sans pour autant penser et
nous remémorer le bon moment passé ensemble avec tant des
camarades , amis que de compagnons de la voie épineuse tel que : Saintia
KANZUNDU, Youri KHENE, Charly LUMASA, Cédric LUTHALA, Venant KOMBE,
Patrick LUTALA, Trésor MANGAKA, David KAMASEKE, Freddy KAPENDA,
Christian MUTEBA, Osey PIA, Trésor BELENSAMA, Bibiche MWAMA, Ernest
MAYANDA, Bobo MASAMBA, Régis MOLA, Dieu Donné TAKONDE .
Aux cousins, Oncles et Tantes, Amis et connaissances.
HERVE BONDONGA MAMBOMBA
III
AVANT PROPOS
Nous voici au terme de notre deuxième cycle
d'études en sciences agronomiques couronné des succès par
la présentation du travail qui est bâti sur le roc et les
épines est le fruit de tous ceux qui, de près ou loin ont
contribué à y apporter leurs soutiens matériels et
moraux.
Qu'il nous soit permis d'exprimer toute notre gratitude à
l'endroit de toutes les personnes qui ont été d'un apport
remarquable dans la mise en oeuvre de ce travail.
A cet effet nous remerciements vont à tout le corps
enseignant qui a assuré notre formation tout au long de nos cinq
années d'études passées à la faculté des
sciences agronomies, et en particulier au Professeur Dr Ir NGONGO Luhembwe
Michel, Doyen de la Faculté des Sciences Agronomiques, et au Professeur
Dr Ir BABOY LONGANZA Louis, qui malgré ses multiples occupations a
accepté d'assurer la direction de ce mémoire.
Nos sentiments de gratitudes s'adressent à Monsieur le
Chef des Travaux Master Ir Jean Marc KAUMBU, qui nous a conduits à
parfaire notre travail.
Nos sincères remerciements à Ir Bill KASONGO pour
son assistance.
C'est aussi pour nous, un agréable plaisir d'exprimer
notre gratitude à nos chers amis, sans lesquels nous aurions
été privé de l'ambiance de camaraderie, nécessaire
au maintien de notre équilibre.
Nous citons : Rodrigue MWENGE, Célestin MWAMBA, Grace
MBAYA, Héritier MOBENGI, Billy MOBENGI, Yvonne DARCI, Freddy KAPENDA,
Kenedi NZAMBA, et Texas KAPIA.
Tous ceux dont nous avons omis le nom, trouvez ici notre
reconnaissance car seul Dieu n'oublie personne, étant humain, notre
mémoire est faillible, nous vous portons tous dans notre coeur.
Hervé BONDONGA MAMBOMBA
Résume
Notre travail avait pour but de quantifier la mycorhization
des essences du Miombo et d'établir une corrélation entre le taux
d'ectomycorhization en nature et certains paramètres physicochimiques du
sol. Le niveau d'infection des plantules en pépinière et le taux
de mycorhization des racines dans la rhizosphère des arbres adultes ont
été mis en évidence par l'examen de manteau mycorhizien du
système racinaire, à la loupe de 8 à 10 fois de
grossissement.
Les résultats montrent pour les plantules en
pépinière que la mycorhization est en début d'initiation
à 9 mois d'âge. Seuls des petits filaments mycéliens,
caractéristiques d'un début de l'infection ectomycorhizien
étaient visibles à la loupe.
En nature, le taux de mycorhization de Uapaka
kirkiana et U. pilosa a varié respectivement entre 52
à 70 % et 41,4 à 70,1 %. Mais les différences entre
échantillon ne sont pas significatives. Les estimations du pourcentage
de mycorhization des racines du sol étudiées sont de 78,5 %
(moyenne de 15,7 racines pour 20 g de sol) et 100 % (moyenne 20 racines pour 20
g de sol) respectivement à la profondeur de 0-10 cm et 10-20 cm, pour le
sol de la rhizosphère de U. kirkiana (échantillon de
février). Et le pourcentage des racines mycorhizées de sol
prélevés en juin 2012 , est compris entre 61,5 à 96,5 % (
moyenne de 12,3 à 19,3 racines mycorhizés pour 20 g de sol) et ;
40 à 80 % (moyenne de 8 à 16 racines mycorhizés pour 20 g
de sol) respectivement pour U. kirkiana et U. pilosa.
Le pH est compris entre 5,01 et 5,12. La
propriété physique du sol est dominée par une forte charge
caillouteuse qui est comprise entre 40 et 70 %. La relation linéaire est
significative et positive entre le nombre des racines mycorhizées et le
nombre des racines totales.
Mots-clés : Quantification - Manteau -
Mycorhizes - U. kirkiana - U. pilosa - Miombo
Abstrat
VI
Table de matière
EPIGRAPHIE I
DEDICACE II
AVANT PROPOS III
Résume IV
Abstrat V
Table de matière VI
Liste des abréviations IX
Liste des tableaux X
Liste des photos XI
Liste des figures XI
Introduction 1
Chapitre 1. La symbiose mycorhizienne en forêt claire
(Miombo) 4
1.1. Concept général sur la forêt claire
4
1.2. Variantes de la forêt claire 5
1.2.1. La forêt claire de type Miombo 5
1.2.2. La forêt claire à dominance de
Marquesia macroura 5
1.2.3. Les forêts claires de hautes termitières 6
1.3. Variantes écologique 6
1.3.1. Climat 6
1.3.2 Sol 7
1.4. Type de mycorhize en forêt claire 7
1.4.1. Les ectomycorhizes 8
1.4.2. Les endomycorhizes arbusculaires 10
1.5. Rôle des mycorhizes dans la nutrition organo-
minérale des végétaux. 11
1.5.1. Nutrition azotée 12
1.5.2. Nutrition phosphatée 13
1.5.3. Nutrition hydrique 15
1.5.4. Intérêt de mycorhize dans la lutte biologique
16
1.5.5. Caractérisation de mycorhize 17
Chapitre 2. Milieu, Matériels et Méthodes 19
2.1. Milieu 19
2.1.1. Localisation du site expérimentale 19
2.1.2. Conditions climatique 20
2.1.3. Le sol 20
2.1.4. Végétation 21
2.2. Matériels 21
2.2.1. Matériel biologique 21
2.2.2. Pterocarpus angolensis D.C 22
2.2.3. Pterocarpus tinctorius WELW 22
2.2.4. Uapaca kirkiana 23
2.4.5 Uapaka pilosa 24
2.2.5. Autres matériels 25
2.3. Méthodes 26
2.3.1. Contrôle de la mycorhization en
pépinière 26
2.3.2. Quantification des manteaux des champignons
ectomycorhiziens dans le sol de la rhizosphère de U. kirkiana
et U. pilosa. 26
2.3.3. Procédure utilisé pour la
caractérisation des paramètres physiques et chimiques du sol
28
2.3.3.1. Paramètres physiques 28
2.3.3.2. Paramètres chimiques 28
2.3.4. Paramètres observés et traitements des
donnés 28
Chapitre 3. Présentation des Résultats 30
3.1. Contrôle de la mycorhization en
pépinière pour un semis en pleine terre, à 10 mois de
semis
30
3.1.1. Etat de la mycorhization des plantules de U. kirkiana
30
3.1.2. Croissance et mycorhization des plantules de P.
angolensis et P. tinctorius 31
3.1.3. Comportement des plantules transférées de la
pépinière en pleine terre vers les sachets en
polyéthylène 33
3.2. Quantification de mycorhizes inféodés à
U. kirkiana 36
3.2.1. Potentiel mycorhizien du sol de la rhizosphère de
plantule de U. kirkiana pour un échantillonnage
réalisé en saison de pluie, en nature 36
3.2.2.1. Uapaka kirkiana 37
3.3.2. Uapaka pilosa 38
3.3.3. Propriétés physico-chimiques 39
3.3.3.1. Propriétés physiques du sol de la
rhizosphère d'U. kirkiana 39
3.3.3.2. Propriétés physiques du sol de la
rhizosphère d'Uapaka pilosa 41
3.3.3.3. Propriétés chimiques de
l'échantillon composite du sol de la rhizosphère de U. kirkiana
et U.
pilosa 43
Chapitre 4. Discussions 45
4.1. Etat de la mycorhization des plantules de U. kirkiana,
P. angolensis et P. tinctorius 45
4.2. Mycorhization des arbres de Uapaca kirkiana et U. pilosa
en nature. 46
4.4. Propriétés physico-chimiques 47
Conclusion 49
Bibliographie 50
Annexes 53
IX
Liste des abréviations
% : pourcentage
°C : degré Celsius
ANOVA : analyses de la variance
C/N : relation carbone sur azote
cm : centimètre
CRC : circonférence de l'arbre à 1,30 m
DBH : hauteur au diamètre de la poitrine
c'est-à-dire à 130 cm Dia_ rac : diamètre racinaire
Dia_col : diamètre au collet
DM : début de la mycorhization
INEAC : Institut National pour l'Etude Agronomique au Congo Km:
kilomètre
M : mycorhization
P. tenctoruis. : Pterocarpus tenctoruis
SD : standard deviation (écart type)
TMM : Taux moyen de mycorhization.
U. pilosa : Uapaka pilosa
X
Liste des tableaux
Tableau1 Famille et espèces ectomycorhizien en
région zambézienne dans la Page 9
forêt claire (Miombo)
Tableau 2 Famille et espèces endomycorhiziennes en
région zambézienne dans Page 11
la forêt claire (Miombo)
Tableau 3 Mensuration des différentes variables de
croissance de U. kirkiana Page 30
Tableau 4 Mensuration de différentes variables de
croissance de P. angolensis Page 31
Tableau 5 Mensuration des différentes variables de
croissance de P. tenctoruis Page 32
Tableau 6 ANOVA pour la comparaison spécifique de la
croissance des Page 33
plantules lors de la reprise
Tableau 7 Reprise et survivance de plantules repiquées
à 9 mois Page 34
Tableau 8 Indice de la mycorhization de quelques essences du
Miombo Page 37
katangais
Tableau 9 Biomasse d'un plant récoltée dans la
rhizosphère Page 37
Tableau 10 L'Anova Etat de la mycorhization en nature de U.
kirkiana à juin Page 38 2012
Tableau 11 L'ANOVA Etat de la mycorhization en nature de U.
pilosa à juin Page 39 2012
Tableau 12 Propriétés physiques pour de sol de la
rhizosphère de U. kirkiana Page 40
Tableau 13 Corrélations entre Echantillon; Racine Totale;
Racines mycorhizées Page 41 pour le sol de la rhizosphère de
U. kirkiana
Tableau 14 Propriétés physique de sol de la
rhizosphère de U. pilosa Page 42
Tableau 15 Corrélations entre Echantillon; Racine Totale;
Racine mycorhizées Page 43 pour le sol de la rhizosphère de
U. pilosa
Tableau 16 Résultat de l'analyse chimique au laboratoire
du Centre de Recherche Page 44 Agro -Alimentaire (CRAA)
XI
Liste des photos
Photo 1 Coupe schématique de deux types principaux de
mycorhizes Page 8
Photo 2 Végétation de la zone d'étude ou de
la forêt claire Miombo Page 21
Photo 3 Illustration de plantule en pépinière de
Mikembo Page 27
Photo 4 Illustration du mycélium ectomycorhizien Page
28
Photo 5 Transplant de U. kirkiana à Novembre 2011
et Mai 2012 Page 34
Photo 6 Transplant de P. tenctoruisà Novembre
2011 et Mai 2012 Page 35
Photo 7 Transplantation de P. angolensis à
Novembre 2011 et Mai 2012 Page 35
Liste des figures
Figure 1 Localisation de la ville de Lubumbashi dans la carte
d'Afrique Page 19
Figure 2 Image satellitaire du Game Parc Mikembo Page 20
Introduction
Depuis quelques décennies, la problématique de
la déforestation, en particulier sous les Tropiques, suscite une
attention internationale considérable. Les conséquences de la
déforestation sont la réduction de la biodiversité, la
diminution de l'offre des bois tropicaux sur les marchés, la destruction
des bassins-versants, la détérioration des sols forestiers et la
menace sur la survie culturelle des populations autochtones et riveraines des
forêts. Aussi, la Conférence de Rio en 1992 avait-elle
préconisé la gestion durable des forêts comme moyen le plus
efficace contre leur dégradation accélérée
(Nerée Onguene Awana, 1995).
Le fonctionnement des massifs forestiers dans la région
zambézienne dépend étroitement des relations mutuellement
bénéfiques entre les racines de la plupart des plantes et
certains types de champignons, formant ainsi des mycorhizes (Högeberg,
1986). Il en résulte donc des associations mycorhiziennes,
impliquées dans la facilitation de l'absorption minérale, surtout
en sols pauvres qui dominent nos forêts. Ainsi, les associations
mycorhiziennes rendraient efficacement leur productivité aux sols
tropicaux, réputés déficients en éléments
nutritifs majeurs.
Par ailleurs, les associations mycorhiziennes sont à la
base de la biodiversité floristique et fongique des forêts, car
certaines essences n'existent que dans certains secteurs de forêt
grâce à la présence de champignons mycorhiziens (Thoen,
1974).
Dans la mise en pratique de la
régénération naturelle préconisée pour la
gestion durable des forêts, les associations mycorhiziennes occupent une
place prépondérante dans l'enrichissement de portions de
forêt. Dans ces cas, il lui faudra connaître les exigences
mycorrhizienne de ces essences ainsi que le statut mycorhizien des sites
à reboiser (Catinot, 1997).
En Afrique le statut mycorhizien des bois couramment
exploités ainsi que leur distribution restent mal connus (Khasa et
al., 1990).
Les études sur les symbioses mycorhiziennes des
essences de la forêt claire n'ont jusqu'à ces jours identifier les
types de mycorhizes (ectomycorhizes, endomycorhizes ou les deux à la
fois) et leurs hôtes. Högberg (1986) a pu établir une liste
de 15 espèces ectomycorhiziennes et 10 endomycorhiziènnes, pour
les essences communes de la forêt claire. En plus l'auteur trace un
gradient de dominance mycorhizien selon les groupes écologiques
définis par Lawton (1978) comme phases typiques de succession. Il
ressort de ce gradient que
les endomycorhizes dominent dans les forêts claires
dégradées (Chipya) et les ectomycorhizes dans les groupes du
Miombo. Les ectomycorhizes de Uapaca spp. colonisent la forêt
claire Chipya et servent plus tard du couvert pour la
régénération des genres ectomycorhiziens formant le Miombo
(Högberg, 1986).
Deux études faites en République
Démocratique du Congo (RDC ex Zaïre) sur les symbioses
mycorhiziennes ont mises en évidence, l'ectomycorhization et ses
applications pour les exotiques du Haut Shaba (Thoen, 1974) d'une part ; et
l'importance relative des différents types de symbioses racinaires chez
les principales essences présentes dans trois sites écologiques
à potentiel économiques de la région de Kinshasa (Khasa
et al., 1990).
Dans le Haut Shaba (Haut Katanga actuel), des champignons
ectomycorhiziens allochtones ont été identifiés sous les
pins et les Eucalyptus exotiques. Et une expérimentation, dans
une pépinière âgée d'une dizaine d'année, a
permis de montrer l'influence bénéfique de l'inoculation sur la
taille des plantules, par apport de la litière riche en mycorhizes de
plantations de pins âgés de 13 ans (Thoen, 1974). Pour les trois
sites écologiques à potentiels économiques de la
région de Kinshasa, les résultats des investigations obtenus par
analyse qualitative des racines fines révèlent une dominance des
endomycorhizes (89 %) par rapport aux ectomycorhizes (10 %) (Khasa et al.,
1990).
En plus il existe pour les forêts indigènes du
Katanga, une liste de 39 taxons de champignons comestibles. Une séquence
phénologique de 26 de ces champignons et la valeur alimentaire de 9
espèces communément consommées sont connues (Degreef
et al., 1997). Hormis les habitats présentés, cette
liste ne montre pas les groupes écologiques (saprophyte, symbiote et
parasite) et les hôtes fongiques. Ceci limite l'utilisation des
champignons symbiotiques du Miombo Katanga dans le but de reboisement
De ce fait, les mycorhizes de la forêt claire ou des
communautés végétales de la République
Démocratique du Congo (RDC) n'ont été
étudiées que partiellement. Ces résultats posent des bases
incomplètes pour un usage dans la reforestation des
écorégions. Il est pertinent de définir le niveau
d'infectivité en nature et identifier les mycorhizes plus infectieux
à isoler pour l'inoculation contrôlée.
L'objectif de cette recherche vise à quantifier
l'ectomycorhization des essences dominantes dans le Miombo Katangais. Et
spécifiquement, les études cherchent à :
· contrôler l'état de la mycorhization des
plantules en pépinière ;
· définir le potentiel d'ectomycorhization des
racines fines dans la rhizosphère des essences du Miombo ;
· établir une corrélation entre le taux
d'ectomycorhization et certains paramètres physicochimiques du sol ;
Notre étude se base sur les espèces Uapaka
kirkiana, U. pilosa, Pterocarpus angolensis et le P.
tenctoruis.
Nous avons débuté notre travail au mois de
septembre 2011 et a pris fin au mois de juin 2012. Le travail est
subdivisé en 4 chapitres hormis l'introduction et la conclusion,
à savoir :
· Chapitre I : La symbiose mycorrhizienne en forêt
claire du Miombo
· Chapitre II : Milieu, Matériels, et
Méthodes
· Chapitre III : Présentation des résultats
et interprétations
· Chapitre IV : Discussion
Chapitre 1. La symbiose mycorhizienne en forêt
claire (Miombo)
1.1. Concept général sur la forêt
claire
La forêt claire peut être définie comme
une formation végétale mixte, avec une strate herbacée peu
dense sous un peuplement forestier de 15 à 20 m de haut. Les arbres y
ont les cimes jointives le plus souvent étalées en parasol mais
les feuillages sont légers, de sorte que l'ensemble est clair voire
lumineux. Le Katanga doit sa physionomie propre à la dominance
très large de la forêt claire (Malaisse, 1979).
Pour le Katanga méridional, à l'exclusion des
Hauts-Plateaux, la couverture est approximativement de 80 % de la superficie
total. Dans la région de Lubumbashi, cette formation
végétale couvre plus de 87 % du territoire. Trois facteurs
principaux contribuent à la périodicité de la forêt
claire. La fin des froids nocturnes déclenche une reprise assez
générale de la végétation, vers la mi-août.
Ce déclenchement est parfois décalé de plusieurs semaines
après la date à laquelle a sévi l'incendie. Le passage du
feu paraît donc mettre en oeuvre les réserves grâce
auxquelles la plante reverdit et, souvent, fleurit et fructifie (Malaisse 1997
; Schmitz, 1952). Enfin, la reprise de la végétation
s'échelonne selon les espèces. Deux grands types de cycles
végétatifs sont admis, aussi bien chez les arbres que parmi les
plantes basses (strate herbacée).Certaines espèces fleurissent
avant le retour des pluies et les graines se dispersent et germent au
début de la saison des pluies. D'autres plantes fleurissent plus tard,
engendrant une maturation des fruits en fin de saison des pluies. Les semences
restent alors en attente, sur la plante ou à même le sol. Leur
pouvoir germinatif pourra être accru par le passage du feu (Malaisse,
1993).
C'est la forêt claire qui remplace la forêt dense
sèche climacique lorsque le feu la détruit et en entrave le
rétablissement. Il s'ensuit une parfaite adaptation des espèces
à l'action du feu (épaisseur des écorces et
coriacité des bourgeons, conservation souterraine comme pour les
géophytes ou les chaméphytes) (Malaisse, 1993).
Cette végétation est aussi appelée
forêt décidue microphylle ouvert, rain green forest, forêt
tropophile, forêt hétéro thermique. C'est le Wood land des
auteurs Anglo saxons ou encore l'open Forest dans le colloque C.C.T.A / C.S.A
de Ndola en 1959 (Malaisse, 1979).
1.2. Variantes de la forêt claire
La forêt claire peut être subdivisée en
trois types dans la région du Katanga, à savoir la forêt
claire du type Miombo, la forêt claire à dominance de
Marquesia macroura et la forêt claire des hautes
termitières (Malaisse, 1993).
1.2.1. La forêt claire de type Miombo
Le Miombo est une des varient de la forêt claire
zambézienne caractérisé par la dominance des
espèces du genre Brachystegia spp., Julbernardia
spp. et Isoberlinia spp. ;
toutefois nous pouvons aussi trouver d'autres espèces du genre
Uapaka, Ficus, Mucuna, Erythrophleum, Alibiza, Pterocarpus, Afzelia,
Monotes, Acacia, Terminalia...
Sous la strate dominante, la végétation
arbustive est claire ou parfois inexistante. Ce sont quelques Raphia
de formes ramassées, de jeunes rejets de souches, des
Pterocarpus bas branchus ou encore des Combretum. La strate
herbacée, par contre, est un tapis continu qui le sol dès la
reprise des pluies pour disparaitre avec l'incendie (Duvigneaud et Dewit,
1950).
Cette espèce peut dépasser 15 m de hauteur et
possède de fûts rectilignes souvent appréciés comme
bois d'oeuvre. Les Isoberlinia montrent une forte dominance sans
concurrence spéciale de l'un ou l'autre élément de futaie.
Après une période d'occupation massive, les derniers sujets
vieillissent sans être remplacés par de nouveaux pieds. Là
où le sol est plus humide, la strate herbacée se compose
d'Hibiscus radanthus, de Thonningiasanguinea ou encore de
Sphenostylis (Malaisse 1997, Schmitz et al., 1952).
1.2.2. La forêt claire à dominance de
Marquesia macroura
Il s'agit d'une forêt semi caducifoliée
très caractéristique tant par l'allure des arbres que par leur
répartition en classe d'âge peu nombreux. Marquesia
macroura est caractérisé par de profondes cannelures sur le
tronc. Suivant le sens de l'évolution, le sous bois est formé de
reliques ou d'éléments pionniers du « Muhulu ». Cette
phytocénose se développe aussitôt après la
destruction du peuplement dense. La vie normale de ce type de peuplements, en
cas d'évolution régressive favorisée par le passage annuel
du feu, n'est que de quelques générations (150 à 250 ans).
L'abondance et l'envergure des Marquesia est donc un indice permettant
de juger de l'ancienneté de disparition du « muhulu »
(Malaisse, 1973).
1.2.3. Les forêts claires de hautes
termitières
Les hautes termitières font partie intégrante
du Miombo katangais. Elles apparaissent çà et là comme de
véritables tumuli et présentent des conditions écologiques
spécifiques. C'est la raison pour laquelle leur composition floristique
est, en général, différente de celle de la forêt
claire ou de la savane environnante (Streel, 1963, Malaise et al.,
1976).
Elles constituent des sous écosystèmes
particuliers et peuvent être classées selon les espèces de
termites bâtisseurs, mais une distinction est également à
faire dans la présence ou l'absence d'insectes au sein du monticule.
Elles sont construites par le Macrotermes falciger. Leur distribution
est large dans l'élément soudano zambézienne. Au Katanga
on les nomme « kiulu » ou « kisukulu ». Toutefois, c'est la
xérophilie qui reste le caractère le plus répandu chez les
espèces constituant la forêt de termitières (Streel 1963,
Malaise et al., 1976).
1.3. Variantes écologique
1.3.1. Climat
Un élément majeur du climat katangais est
l'alternance d'une saison humide et d'une saison sèche. La durée
moyenne de la saison sèche varie de 5 à 7. Elle est plus longue
et caractérisée par des périodes froides plus intenses au
Sud. Cette alternance imprime à la végétation un rythme
saisonnier très marqué (Malaisse et al., 1973).
La température y varie plus en fonction du relief, de
la latitude et de la longitude que de la pluviosité. Sur l'année
entière, on enregistre des températures minimales absolues
variant entre 2 et 11°C et des températures maximales absolues
variant entre 34,5 et 36°C selon les sites. On peut également
ajouter que l'éloignement de l'équateur s'accompagne d'une
diminution progressive des températures minimales indépendamment
de l'influence possible de l'altitude et que le climat est plus
tempéré à l'ouest du Katanga (Malaisse et al.,
1973).
En général, le minimum d'humidité
relative est observé en juillet pour les régions basses et
septentrionales. Par contre, les Hauts-Plateaux ne connaissent pas de grande
sécheresse de l'air car la température moyenne y reste peu
élevée.
La pluviosité moyenne annuelle varie entre 650 et 1550
mm selon les sites, mais ce sont les variations mensuelles qui jouent un
rôle prépondérant dans le rythme phénologique. C'est
la sévérité de la saison sèche qui marque la
variabilité au sein du territoire (Thoen, 1974).
1.3.2 Sol
Les sols ou sont établies la forêt claire du
type Miombo sont des latosols zonaux pour lequel on distingue trois
séries correspondant à une teneur décroissante en oxyde de
fer, à savoir les terres rouges les terre ocre rouge et les terre jaune.
Les premières s'observent sur les roches carbonatées et
dolomitiques, les autres sont issues de roches argileuses ou siliceuses ; la
nappe phréatique est peu profonde pour les terres jaune. Ces sols sont
généralement pauvres. L'horizon A1 est mince, inférieur
à 3 cm d'épaisseur en général. Le pH est bas (4,5
à 5,5), le rapport C/N de l'ordre de 10 à 15. Les analyses
granulométriques réalisées à divers niveaux de
profondeur révèlent une large dominance des
éléments fins (Malaisse et al., 1973).
1.4. Type de mycorhize en forêt claire
Les associations symbiotiques entre des phanérogames
et certains champignons, qui se rencontrent chez 90 % des taxons
végétaux, engendrent deux types principaux d'organes mixtes
racine-mycélium. En forêt claire, treize espèces d'arbres
zambéziens sont ectomycorhiziennes et dix endomycorhiziennes (Hogberg
& alexander, 1986).
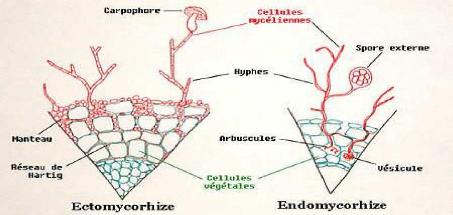
Photo 1. Coupe schématique de deux types
principaux de mycorhizes (
www. wikipedia.com)
1.4.1. Les ectomycorhizes
Elles sont caractérisées par la présence
d'un manteau fongique qui entoure la racine courte. Simultanément, le
mycélium pénètre entre les cellules du cortex racinaire de
la plante-hôte, au niveau de la lamelle moyenne, sans jamais traverser la
paroi des cellules vivantes (Tisdall et Oades, 1979).
Ce mycélium intercellulaire est dénommé
«réseau de Hartig». La morphologie des racines est
modifiée par l'infection ectomycorhizienne. Les ectomycorhizes ont des
formes simples, dichotomes, coralloïdes, pyramidales ou nodulaires. Un
réseau mycélien extramatriciel, qui comprend des hyphes
individuels, des cordons mycéliens (agrégats ramifiés
d'hyphes) et des rhizomorphes (hyphes organisés en canaux) pouvant
pénétrer dans le sol sur des distances plus longues que les
hyphes individuels, se développe à partir du manteau fongique
(Högerbeg, 1986).
Les cordons mycéliens, qui sont capables d'absorber
les nutriments par la quasi-totalité de leur surface, jouent donc un
rôle essentiel dans les sols pauvres en facilitant l'absorption des ions
peu mobiles. Ces cordons augmentent le volume de sol exploité par le
système plante-mycorhize qui est économique car la croissance du
mycélium dans le sol
requiert beaucoup moins d'énergie que la production de
racines explorant le même volume de sol (Björkman, 1949).
Les ectomycorhizes sont présentes quasi exclusivement
sur des espèces ligneuses des genres Brachystegia, Isoberlinia,
Julbernardia, Monotes, Uapaca, etc. ; qui ne représentent pas
plus de 70 % des taxa, mais forment l'essentiel de la couverture ligneuse dans
la forêt claire du type Miombo. Les champignons ectomycorhiziens
appartiennent principalement aux Homobasidiomycètes mais ils comprennent
aussi des Ascomycètes (Högeberg, 1986).
Le tableau 1 ci-dessous reprend les familles et espèces
ectomycorhiziennes de la région zambézienne
répertoréiées dans la forêt claire (Miombo)
(Högerbeg, 1986).
Tableau N°1. Familles et espèces
ectomycorhiziennes de la région zambézienne -
répertoriées dans la forêt claire (Miombo)..
Familles
|
Espèces
|
Caesalpiniaceae
|
Brachystegia floribunda Benth B. longifolia
Benth
B. spiciformis Benth
B. utilis Burtt Davy & Hutch Julbernardia
paniculata (Benth.) Isoberlinia angolensis
|
Diptérocarpaceae
|
Marquesia macroura Gilg. Monotes africanus
(Welw.)
|
Phyllanthaceae (Euphorbiaceae)
|
Uapaca kirkiana Muell. Arg. U. nitida Muell. Arg.
U. sansibarica ou U. pilosa
|
Papilionaceae
|
Pericopsis angolensis (Bak.) van Meeuwen
|
Proteaceae
|
Faurea saligna Harv.
|
|
1.4.2. Les endomycorhizes arbusculaires
Ces microorganismes ne présentent pas de manteau
fongique ni de modification morphologique. Le mycélium
pénètre entre les cellules du cortex des racines ou franchit les
parois de ces cellules en repoussant leur plasmalemme sans le traverser. Ces
mycorhizes se caractérisent par la présence constante
d'arbuscules intracellulaires qui sont un lieu d'échange entre la
plante-hôte et le champignon. Le mycélium intramatriciel est
connecté avec un réseau d'hyphes externes dont le
développement est souvent considérable (Tisdall et Oades,
1979).
Les endomycorhizes (ou mycorhizes internes) sont les formes
les plus répandues. Ce sont des mycorhizes qui pénètrent
à l'intérieur des racines pour mieux s'y associer.
Il existe plusieurs types d'endomycorhizes :
· Les endomycorhizes à arbuscules ou
arbusculaires (AM): c'est le cas le plus répandu. Les champignons
mycorhiziens arbusculaires colonisent environ 80 % des plantes vasculaires
terrestres, c'est-à-dire plus de 400 000 espèces. Il existe
cependant moins de 200 espèces de champignons endomycorhiziens. Ces
champignons ne sont donc pas très spécifiques dans leurs
relations de symbiose (Khasa et al., 1990). Ils sont associés
avec les plantes herbacées et ligneuses (aussi appelés mycorhizes
à vésicules et arbuscules), tirent leur nom des structures
formées à l'intérieur des cellules rappelant un petit
arbre. Ils sont aussi uniques au point de vue génétique puisque
leursspores possèdent plusieurs noyaux génétiquement
différents (Matumoto-Pintro, 1996).
· Les endomychorizes à pelotons intracellulaires
: les hyphes forment des amas dans les cellules corticales. Elles impliquent
des basidiomycètes, en symbiose avec les Orchidacées. Les hyphes
pénètrent à travers la paroi des cellules à
l'intérieur des cellules du cortex racinaire en repoussant la membrane
plasmique (Matumoto-Pintro, 1996).
· Les endomycorhizes éricoïdes : les hyphes
forment des pelotons dans des racines transitoires de faible diamètre.
Elles impliquent des Ascomycètes ou Basidiomycètes (en symbiose
avec les Ericales).
Quelques familles et espèces endomycorhiziènnes
des forêts claires de la région zambézienne
répertoriées par Högerbeg (1986) sont reprises au tableau 2
ci-dessous.
Tableau N° 2. Familles et espèces
endomycorhiziènnes des forêts claires de la région
zambéziennes.
Familles
|
Espèces
|
Caesalpiniaceae
|
Baikiaea plurijuga Harms
Colophospermum mopane (Kirk ex Benth.)
Erythrophleum africanum (Benth.) Harms Guibourtia coleosperma
(Benth.)
|
Euphorbiaceae
|
Ricinodendron rautanenii Schinz
|
Mimosaceae
|
Albizia adianthifolia (Schum.)
|
Papilionaceae
|
Baphia bequaertii de Wild Pterocarpus
angolensis
P. antunesii (Taub.)
|
Stilaginaceae
|
Antidesma venosum (E. Mey. ex) Tul
|
|
1.5. Rôle des mycorhizes dans la nutrition
organo- minérale des végétaux.
Le système racinaire des arbres à
ectomycorhizes présente une morphologie particulière très
hiérarchisée : des racines longues plus ou moins ramifiées
s'allongent par des apex en croissance continue (bouts blancs ou mâchon
mychorizien) et portent des racines courtes à croissance limitée
à quelques millimètres qui seules sont le siège de la
symbiose ectomycorhizienne (Hogberg & Alexander, 1986).
L'eau et les minéraux sont essentiellement
absorbés au niveau des Bouts Blancs et des racines courtes
mycorhizées ou non. Comme les ectomycorhizes sont réparties tout
le long des racines longues et sont beaucoup plus nombreuses que les Bouts
Blancs (George et Marschner, 1995). L'explication est naturellement que l'eau
et les minéraux transitent par le champignon. Ceci explique
déjà en partie pourquoi la symbiose ectomycorhizienne joue un
rôle-clé dans l'alimentation des arbres (George et Marschner,
1995).
Mais le champignon n'est pas réduit au seul manteau et
à ses extensions intercellulaires dans le cortex de la racine. Il en
émane de nombreux filaments (les hyphes mycéliens) qui explorent
le sol à grande distance de la racine (de quelques centimètres
à
plusieurs décimètres selon le sol,
l'espèce de champignon et l'état physiologique du couple
symbiotique). Le champignon symbiotique, incapable de photosynthèse,
reçoit de l'arbre le carbone nécessaire à sa croissance
sous forme de sucres et vitamines. En échange, le champignon absorbe les
éléments minéraux et les transfère à la
plante-hôte (Mousain, 1998 ; Plassard et al., 2000).
La symbiose peut donc s'interpréter en terme de bilan,
et il est prévisible que le bénéfice qu'en retire la
plante pour sa croissance sera d'autant plus grand que le champignon
détourne moins de sucres ou que les «services» qu'il procure
en retour (éléments minéraux, eau, protection contre les
pathogènes, etc.) seront importants par rapport à la
quantité de carbone consommée (Mousain, 1993).
Les mycorhizes stimulent généralement la
croissance des plantes-hôtes, en particulier dans des sols où la
disponibilité en éléments minéraux est faible
(Mousain, 1989 ; Bolan, 1991). L'association symbiotique mycorhizienne
apparaissent comme une stratégie importante développée par
les arbres afin d'assurer leur survie et leur croissance (Harley et Smith,
1983).
1.5.1. Nutrition azotée
L'azote organique peut se trouver principalement sous deux
formes : insoluble (les protéines) ou soluble (les petits peptides et
les acides aminés solubles). Dans le cycle de l'azote, les acides
aminés issus de la protéolyse vont être utilisés par
différents microorganismes du sol pour produire de l'ammonium
(ammonification) qui peut être à son tour oxydé par la
microflore pour produire le nitrate (nitrification), forme ultime de l'azote
minéral. Ces deux sources d'azote minéral vont ensuite être
absorbées par les racines, assimilées et incorporées dans
des squelettes carbonés produits par la photosynthèse, pour
réaliser la synthèse des protéines. Pour bien mettre en
évidence et bien comprendre le rôle que peuvent avoir les
champignons mycorhiziens dans l'utilisation de l'azote minéral par les
plantes (Georges et Marschner, 1995).
Après absorption par les cellules fongiques et/ou
racinaires, les deux formes d'azote minéral vont être
assimilées par différents systèmes enzymatiques. Le
nitrate va être réduit en ammonium et l'ammonium provenant de la
réduction du nitrate ou du milieu extérieur va être
incorporé à des squelettes carbonés pour produire les
acides aminés nécessaires à la synthèse
protéique (Alexander, 1983).
Il est clair que le partenaire fongique est capable de
mobiliser de l'azote à partir de sources azotées organiques
(protéines, peptides, acides aminés) ou minérales
(nitrate, ammonium) et qu'il possède généralement tout
l'équipement enzymatique nécessaire pour absorber et assimiler
l'azote provenant de ces différentes sources qui vont être
disponibles soit au niveau du mycélium extra radiculaire, soit au niveau
des ectomycorhizes (Mousain, 1998 ; Plassard et al., 2000)
Et finalement, l'efficacité d'un partenaire fongique
dépendra en grande partie de sa capacité à
transférer à sa plante-hôte l'azote qu'il aura
préalablement mobilisé, prélevé et/ou
assimilé. Cette capacité de transfert est sans aucun doute un des
éléments «clef» de la compréhension du
fonctionnement symbiotique (Mousain, 1998 ; Plassard et al., 2000).
1.5.2. Nutrition phosphatée
Les mycorhizes apparaissent comme des sites
privilégiés d'absorption et d'accumulation de phosphore. Les
phosphatases des mycosymbiotes jouent un rôle dans la mobilisation du
phosphore interne des hyphes mycéliens et dans le recyclage du phosphore
immobilisé dans le sol sous forme organique par hydrolyse des esters
phosphorylés. Le phosphore des composés organiques peu solubles
passe ainsi sous forme d'orthophosphate. (Hatch, 1937 ; Mousain, 1989 ; Bolan,
1991).
L'absorption du phosphore par les racines des plantes se fait
essentiellement sous la forme d'orthophosphate (H2PO4 -, HPO42-, et
PO43-) dont la concentration dans la solution du sol est très
faible (un micro molaire = 1 uM). Les échanges entre les formes solubles
et insolubles de phosphore dans le sol sont lents (Bhat et Nye, 1973).
L'absorption de phosphore par les racines étant plus
rapide que la diffusion de phosphore dans le sol, il se forme très
rapidement une zone d'épuisement autour de la racine. D'importantes
réserves de phosphates, organiques ou minéraux, sont toutefois
immobilisées dans le sol (Bhat et Nye, 1973).
Parmi elles, les phosphates organiques,
représentés par les phosphates d'inositol, les phospholipides,
les acides nucléiques et d'autres formes difficilement identifiables,
constituent une fraction très importante du phosphore des horizons
superficiels du sol (Anderson, 1967). Les phosphates d'inositol
représentent parfois plus de 50 % des phosphates organiques du sol
(Dalal, 1977). Ces phosphates sont susceptibles d'être
dégradés
par des phosphatases, enzymes qui catalysent l'hydrolyse de
liaisons organiques en libérant de l'orthophosphate.
La carence en phosphore du milieu stimule les
activités phosphatases (Mousain, 1989). Elle traduit une adaptation
à un environnement limitant en phosphore soluble que l'on rencontre dans
la plupart des sols forestiers (Calleja et al., 1980).
L'effet de la carence en phosphore soluble est
considérablement plus marqué sur les activités
phosphatases des Mycelia des champignons ectomycorhiziens que sur
celles des racines de leurs plantes-hôtes (Doumas et al.,
1984).
Le marquage cytochimique des phosphatases montre une
localisation essentiellement à la surface externe des filaments (Lacaze,
1983 ; Dexheimer et al. 1986 ; Mourer et al., 1994). Une
variabilité importante, inter- et intraspécifique, est
observée dans le niveau des activités phosphatases des
champignons ectomycorhiziens (Mousain et al., 1988 ; Meyselle et
al., 1991 ; Matumoto-Pintro, 1996) ; cette variabilité pourrait
être mise à profit pour sélectionner des associations
mycorhiziennes efficaces dans l'utilisation des phosphates organiques du
sol.
En effet, les activités phosphatases mesurées
dans les racines mycorhizes sont très supérieures à celles
des racines non infectées (Williamson et Alexander, 1975 ; Mousain,
1989).
Au voisinage de la racine par l'excrétion d'enzymes
(phosphatases) dégradant les phosphates organiques, ou par la mise en
oeuvre de divers mécanismes modifiant les conditions physico-chimiques
de la rhizosphère (excrétion de H + ou HCO3- , et
d'acides ou d'anions organiques ayant des propriétés
complexantes,...) et la présence d'une microflore synergique,
solubilisatrice de phosphates minéraux (Matumoto-Pintro, 1996).
L'augmentation de l'ortho phosphate absorbé par les
racines mycorhizées, qui résulte principalement de
l'accroissement du volume de sol exploré par ces systèmes et de
la translocation du phosphore du sol vers la racine via le
réseau mycélien extramatriciel, ainsi que de la présence
de transporteurs d'ortho phosphate plus efficaces dans les racines
mycorhizées que dans les racines non infectées (Mousain,
1989).
L'acidification du milieu augmente la disponibilité en
ortho phosphate de la rhizosphère ; elle favorise le passage du
phosphore sous la forme H2PO4 ; Cette forme semble être plus facilement
absorbée par les champignons que la forme HPO4.
La signification écologique des activités
phosphatases des champignons mycorhiziens ne peut toutefois être
réellement établie que dans la mesure où elles s'exercent
vis-à-vis de phosphates organiques réellement présents
dans les sols forestiers.
La solubilisation des phosphates minéraux complexes
résulterait des actions chimiques exercées dans la
rhizosphère par les champignons mycorhiziens et les plantes-hôtes
par excrétion de H+ ou de HCO3 - (Mousain et al.,
1989 ).Ces polyphosphates constituent une réserve de phosphore
mobilisable dans le manteau des ectomycorhizes (Harley et Mc Cready, 1981).
1.5.3. Nutrition hydrique
Comme chez toutes les plantes vasculaires terrestres, l'eau
nécessaire aux processus vitaux des arbres forestiers est puisée
dans le sol par les racines et la plus grande partie est évaporée
(transpirée) dans l'atmosphère à travers les stomates des
feuilles après avoir transité par les vaisseaux ligneux des
racines, du tronc et des branches sous forme de sève brute. Une
très faible proportion seulement de cette eau est incorporée
à la biomasse ou redistribuée dans les différents organes
de l'arbre sous forme de sève élaborée (Mousain, 1998 ;
Plassard et al., 2000).
L'arbre fonctionne donc grossièrement comme une
mèche conduisant l'eau du sol vers l'atmosphère, la force motrice
du flux étant la différence de potentiel de l'eau entre le sol
(négatif) et l'atmosphère (très fortement
négatif).
La disponibilité de l'eau est le premier facteur de
l'environnement qui limite la production forestière. Or, les
associations ectomycorhiziennes, qui impliquent des modifications profondes des
caractéristiques structurales et fonctionnelles des racines, sont
à priori susceptibles de modifier l'efficacité
d'acquisition et d'utilisation de l'eau par les arbres. (George et Marschner,
1995).
Les champignons ectomycorhiziens, intimement associés
aux tissus du végétal au niveau des racines, contribuent
indirectement à cette régulation en modifiant la nutrition
minérale de l'arbre ou son équilibre hormonal (Matumoto-Pintro,
1996).
Le premier mécanisme par lequel la symbiose est
favorable à la régulation hydrique des arbres est donc son effet
sur leur nutrition minérale. Si un champignon est
particulièrement efficace pour la fourniture de phosphore
(élément-clé des métabolismes
énergétiques impliqués dans les ajustements actifs) ou de
potassium (impliqué dans les changements osmotiques rapides), il
permettra indirectement à l'arbre de mieux gérer l'eau.
La symbiose contribue donc, à partir des racines,
à déterminer les concentrations en régulateurs hydriques
dans l'arbre entier, jusqu'aux feuilles qui sont le siège de la
régulation stomatique. Dans beaucoup d'expériences, on remarque
d'ailleurs que la fertilisation phosphatée a le même effet que les
ectomycorhiziennes pour améliorer le comportement hydrique de jeunes
plants (Guehl et Garbaye, 1990 ; Coleman et al., 1990).
Le but de ce point est de comprendre comment la symbiose
ectomycorhizienne l'utilisation de l'eau par les arbres et les
conséquences pour la conservation et la gestion des forêts.
Cependant, lorsque l'eau est facilement disponible dans le sol, que la demande
transpiratoire existe et que les apex et les ectomycorhizes sont temporairement
inactifs (George et Marschner, 1995).
1.5.4. Intérêt de mycorhize dans la lutte
biologique
En conditions naturelles, la très grande
majorité des végétaux, y compris les arbres forestiers,
vivent en association symbiotique avec des champignons mycorhiziens qui, non
seulement, approvisionnent leurs hôtes en eau et en
éléments minéraux, mais assurent une protection des
racines contre les champignons pathogènes (Smith et Read, 1997).
Le premier symptôme d'une maladie des racines est
souvent une perte de vigueur suivie d'une chlorose. Ces premiers
symptômes peuvent être suivis de flétrissement puis de la
mort des semis. Les attaques de racines peuvent parfois être
sous-estimées en raison du fait que les dommages ne sont
visualisés que par les symptômes affectant les parties
aériennes. Beaucoup de ces champignons sont opportunistes. Ce sont
souvent des composants normaux de la rhizosphère. Ils deviennent
pathogènes seulement lorsque les semis subissent un stress : pH
élevé, mauvais drainage, basse température, lumière
insuffisante, etc. (Read, 1997).
Les maladies dues aux pathogènes des racines sont
habituellement traitées par la mise en oeuvre de pratiques culturales
adéquates ou par la désinfection des sols. Les champignons
ectomycorhiziens peuvent protéger les racines par différentes
voies (Zak, 1964).
· Le manteau des ectomycorhizes agit comme une
barrière mécanique contre les pathogènes qui tenteraient
de pénétrer dans la racine. De plus, la partie active du manteau
agit aussi comme une barrière physiologique en dégradant les
toxines et les enzymes produites par les pathogènes pour dégrader
les tissus des racines (Damm et Unestam, 1997a).
· Les champignons mycorhiziens peuvent produire des
substances antibiotiques.
· Les champignons ectomycorhiziens agissent contre les
pathogènes par compétition dans l'utilisation des substances
carbonées exsudées par la racine. La plupart des exsudats de la
racine doivent passer par le réseau de Hartig et le manteau Marx
(1972).
· Les mycorhizes pourraient stimuler le
développement d'une microflore protectrice dans la
rhizosphère.
· Après la colonisation des racines par les
champignons mycorhiziens, l'hôte peut produire des inhibiteurs contre les
pathogènes (Sampangi et Perrin, 1986).
1.5.5. Caractérisation de mycorhize
La caractérisation des mycorhizes est d'un
intérêt fondamental. Elle nous permet d'identifier et
sélectionner les souches infectieuses, à utiliser pour la
mycorhization contrôlée de plantes en pépinière,
pour le reboisement. Dans ce cas il faut faire, avant la mise en place des
plants, un contrôle soigné des systèmes racinaires pour
vérifier que la symbiose se soit produite avec le champignon
inoculé. Par exemple le Laccaria laccata est un des
premiers champignons ectomycorhiziens qui apparaissent sur les jeunes plantes
dans un milieu naturel, comme en pépinière. Ceci est
confirmé aussi par les études sur la succession des champignons
ectomycorhiziens (Ford et al., 1980 ; Mason et al., 1983).
Pour la caractérisation des mycorhizes, il est
important de considérer la forme, la couleur, la présence de
cystides ou de spinules, le mycélium présent sur la surface et le
dessin formé par les parois des cellules extérieures du manteau
fongique. La forme, les dimensions et les ramifications des mycorhizes, sont en
grande partie déterminées par la plante symbiote et de
façon plus réduite par le milieu, tandis que les
caractères microscopiques extérieurs dépendent de
l'espèce fongique. Le réseau de Hartig peut
pénétrer plus ou moins profondément entre les cellules du
parenchyme cortical, selon la plante-hôte et l'espèce fongique
(Garbaye et Guehl,1997).
La caractérisation morphologique et anatomique des ECM
est très importante à des études, par exemple, visant
à vérifier la mycorhization contrôlée et les
performances du champignon inoculé dans la pépinière et
même dans la forêt (Baar et de Vries, 1995 ; Jackson et al.,
1995). II est très important dans le cas des champignons
comestibles, comme les truffes, avec lesquels il y a aussi un
intérêt économique et commercial particulier (Meotto et
al., 1995). Pour les études écologiques, la
caractérisation des ECM est aussi très intéressante, pour
quantifier le potentiel mycorhizien des sols (Roth et Berch, 1992), pour
étudier le
changement saisonnier des populations de champignons
mycorhizés (Wu et al., 1993), et même pour connaitre la
diversité morphologique des ECM et finalement la diversité
fongique.
Chapitre 2. Milieu, Matériels et
Méthodes
2.1. Milieu
2.1.1. Localisation du site expérimentale
La présente étude a été menée
au Game Park de Mikembo situé à plus ou moins 36 km de la ville
Lubumbashi (Figure 1).
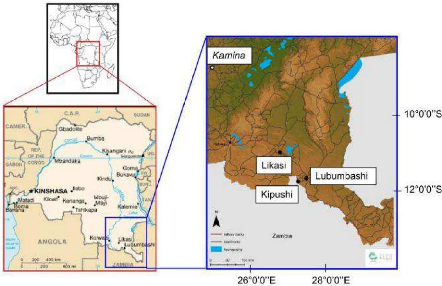
Figure 1. Localisation de la Ville de Lubumbashi dans la
carte d'Afrique et du Congo RD (Banza et al., 2008).
La réserve forestière de Mikembo est
située au Nord-est de Lubumbashi, sur la route qui mène vers
Kasenga. Elle est caractérisée par les coordonnées
géographique ciaprès : altitude 1202 m ; S11°28,003' et EO
27°39,607' (Figure 3). Elle est une entité du District du haut-
Katanga, province du Katanga (République Démocratique du
Congo).

Figure2. Image Satellitaire du Game parc Mikembo 2.1.2.
Conditions climatique
Le Game Park Mikembo est situé dans la province du
Katanga, et particulièrement dans le district du haut Katanga. Ce
district est caractérisé par un climat tropical sec, du type CW 6
selon la classification de Köppen. Le climat de cette sous régions
est reconnu par l'alternance de deux saisons (pluvieuse et sèche), qui
le confère un caractère tempéré et continental
lié à l'altitude (1200 m environ) et à
l'éloignement par rapport aux masses océanique (Mbeza, 1973).
La saison pluvieuse va de novembre à mars tandis que
la saison sèche va de mai à septembre. Les mois d'avril et
octobre sont des mois de transition entre ces deux saisons. La
sévérité de la saison sèche est fonction de
l'importance de la latitude, c'est-à-dire qu'elle augmente au fur et
à mesure que l'on s'éloigne de l'équateur. La saison
sèche est de 6 mois au sud Katanga et de 4 mois au nord-ouest avec
présence sporadique de pluie. L'humidité relative varie avec la
précipitation au cours de l'année (Bruneau, 1992).
2.1.3. Le sol
Les sols du Katanga sont ferralitiques
dénaturés de la classification de l'INEAC, de couleur rouge ocre
et jaune caractérisés par une texture qui a pour
conséquence un faible développement de la structure et
présente la dominance de la macroporosité (Ngongo, 2006).
2.1.4. Végétation
La végétation de la zone d'études est
composée de plusieurs variantes des forêts claires,
protégée à l'abri de coupe (Photo 2). Dans ce site, on
rencontre des taches de forêt intacte et d'autres en
régénération. La végétation est
dominée par les espèces végétales ligneuses
comme Albiziia adiantifolia, Brachystegia spp., Julbernadia spp.,
Ptérocapus angolensis, P. tintoruis, Terminalia spp., Uapaca kirkiana,
Uapaca spp., et des herbacées de divers genres.

Photo 2. Deux de variantes des forêts claires
dans la concession du Game Park Mikembo ; à gauche, forêt claire
à U. kirkiana et à droite, Miombo à
Brachystegia boemii et B. longifolia (Crédit Kaumbu
Jean-Marc, Avril 2012).
2.2. Matériels
2.2.1. Matériel biologique
Le contrôle de la mycorhization en
pépinière a été effectué sur les plantules
semées en décembre 2010 et en février 2011. Le
prélèvement des sols en guise de la quantification de la
mycorhization, a été conduit dans la rhizosphère des
espèces d'arbres de la famille de Fabaceae (genre
Pterocarpus) et Phyllanthaceae (genre Uapaca). Les
espèces
étudiées dans ces deux expérience sont
les suivantes: Pterocarpus angolensis, P. tinctorius, U. kirkiana et U.
pilosa. Les caractéristiques morphologiques, écologiques et
biologiques sont présentées dans les sections ci-dessous.
2.2.2. Pterocarpus angolensis D.C
Nom vernaculaire : Mutondo mashi, Mulombwa
C'est une espèce qui appartient à la famille de
Fabaceae ; tribu de Dalbergiae. Elle atteint jusqu'à
25 m de hauteur, exige la lumière et domine les savanes et la
forêt claire (Kasai et Katanga) jusqu'à 1250 m d'altitude. Dans
les bonnes conditions du sol, le Pterocarpus angolensis est abondant.
Voir même dominant. Il fleurit de janvier à octobre, ces fruits
sont des gousses orbiculaires entièrement recourbées sur
elle-même de 6 à 15 cm de diamètre et donne
Le Mulombwa se reproduit par semence difficilement dont la
faculté germinative des graines est très faible et la germination
des graines va jusqu'à une année après de semis (Delevoy,
1928). Au champ, on observe un taux de germination de 25 % (Chidumayo, 1997).
Vu les difficultés rencontrées en culture par semis, on exploite
très fructueusement le bouturage qui est la propriété qu'a
le Pterocarpus de rejeter les souches. L'arbre atteint 8 mètres
à 14 ans environ (Salumu, 1970).
Cette espèce est bien distribuée au Bas-Congo,
bas Katanga, haut Katanga, Lualaba et Angola. Le Mulombwa est un excellent bois
rouge, très dur, pour sciage et ébénisterie, et est
utilisé en menuiserie fine. Il est très recherché comme
bois de mine, et traverse de chemin de fer (Salumu, 1970). Il est
apprécié pour son charbon dans la forêt claire katangaise.
Son écorce secrète un latex abondant de couleur rouge. Ses fleurs
sont très mellifères, et ses racines aphrodisiaques fournissent
un remède contre la blennorragie.
2.2.3. Pterocarpus tinctorius WELW
Nom vernaculaire : Mukula, Mutondo mashi.
C'est un arbre atteignant 30 m de haut avec fut de 12 m et
tronc de 30 cm de diamètre, à rhytidonne fissuré et
abondante sécrétion de résine rouge, à feuilles
parfois très grandes, se distinguant du type de l'espèce par les
axes de l'inflorescence couverts d'un revêtement de poils
hérissés, les uns très élargies à la base,
les autres aciculaires, sécrétant un
liquide visqueux odorant. Gousse à noyau central
restant couvert d'un velours de poils bruns, sécréteurs des
résines, parmi lesquels existent le plus souvent quelques longues soies
dorées non rigides, de 6-10 cm de diamètre.
Les graines sont solitaires en forme de haricot, de 10 mm de
long, 8 mm de large et 3 mm d'épaisseur, brunes brillantes et plus ou
moins mamelonnées, plantule à racine pivotante, presque nue, de
12 cm de long ; cotylédons épigés,
P. tinctorius se trouve en forêt
remaniée ou non, emplacement des villages, galeries forestières,
savane arborée, forêt claire, sur termitières
jusqu'à 1800 m d'altitude dans l'est. Il fleurit en Mars-Mai. Le
Pterocarpus tinctorius donne un bois rouge, très dur. Il sert
aussi à préparer une teinture dont les indigènes
s'enduisent le corps (Delevoy, 1928).
2.2.4. Uapaca kirkiana
Nom vernaculaire : Masoku, Musuku, Chilundu, Muhaka
Uapaca kirkiana ou de sucre de prune est une
espèce de plante de la famille Phyllanthaceae ; Tribu :
Antidesmeae ; Sous-tribu : Uapacinae Genre : Uapaca
; Espèce : U. kirkiana.
Uapaca kirkiana est une petite ou moyenne taille
à feuilles persistantes ou semi-décidue ;arbre avec des branches
étalées multiples formant une couronne dense arrondie. Le tronc
est court et trapu, atteignant une hauteur de 5-12 m et le diamètre de 5
- 25 cm. L'écorce est gris foncé ou gris-brun, épais et
profondément fissurée. Rameaux courts, épais avec des
cicatrices foliaires proéminentes.
Les jeunes pousses sont recouvertes de crème de poils
brun. Les feuilles sont simples et alternativement disposées en grappes
concentrées à la extrémités des rameaux, 7-36 x
4-24 cm, les nerfs secondaires parallèles et sous éminents, en
12-16 paires. Les jeunes feuilles sont couvertes de chevelus bouclés sur
la face inférieure. Borgeons floraux globuleux, fleurs jaune pâle,
de garder à et des pédoncules axillaires.
Le fruit est rond, la peau dure, jaune-brun, jusqu'à
3,3 cm de diamètre, la chair jaunâtre, dégustation de
comestibles et doux, avec une saveur de poire. Les fruits contiennent 3-4
graines. Graines blanc, jusqu'à 2 cm de long, 1,3 cm d'épaisseur.
La floraison a lieu en pleine saison des pluies.
L'espèce est dioïque. On mentionne seulement
occasionnellement le signe d'insectes et le vent en tant que vecteurs de
pollinisation possibles. Le développement du fruit prend 5-8 mois, il
commence durant la saison des pluies et s'étend à la saison
sèche. L'arbre se trouve dans les forêts de plaine, secondaire
Miombo tels que la compensation et les lacunes, et les forêts claires, en
escarpements bien drainés, avec du sable stérile ou sols
graveleux de la réaction acide. Les sites sans gel sont les plus
idéaux.
U. kirkiana pousse sur des sols ferrugineux ou
ferrallitiques dérivés du métamorphisme et des types de
roches ignées.
Tolère les sols pauvres et peu profonds limoneux, gravier
et de sable. Le sol est acide, le pH 4-6 (Kalenga Saka et al,.
2000).
C'est l'un des fruits les plus populaires sauvages dans la
zone où se réunit l'Afrique orientale Afrique australe. Encore
une plante alimentaire traditionnelle en Afrique, ce fruit peu connu a le
potentiel pour améliorer la nutrition, renforcer la
sécurité alimentaire, favoriser le développement rural et
conservation des sols soutien durable.
Le bois est léger avec aubier blanc et
brun-rougeâtre, figuré coeur. Il est dur et durable et peut
être raboté à une finition lisse. Il est résistant
aux termites.
L'épithète spécifique kirkiana
était donnée en l'honneur de Sir John Kirk, explorateur et
naturaliste (1832-1922).
2.4.5 Uapaka pilosa
Nom vernaculaire : Kikokolo ou Makokolo
Le Uapaka pilosa appartient à la famille de
Phyllanthaceae sous famille de
Antidesmatoideae, tribu de Antidesmateae
le genre Uapaca Baillon, 1858.
Le kikokolo est un arbuste ouvert, ramifiée ou petit
arbre pouvant atteindre 4,5 m de haut, avec vigoureux, linéaire à
étroitement lancéolées, pubescentes.
Les feuilles courtement pétiolées, ou des
pétioles jusqu'à 7 cm de long (var. Petiolata). Le limbe
des feuilles jusqu'à 40 cm × 25 cm, largement ovales, arrondies au
sommet, cunéiforme-atténuée à la base, finement
coriaces, surtout le long de la nervure médiane et les nerfs principaux,
plus tard #177; glabrescentes sur la face supérieure des feuilles,
finement glanduleuses l'épidote entre les poils sur la surface
inférieure des feuilles, les
feuilles vertes virant de vert pâle au jaune avec le
temps; nerfs latéraux dans un maximum de 15 paires, la partie
supérieure faiblement à fortement brochidodromous, non
proéminents cidessus, en dessous de premier plan. Des nerfs des
inflorescences habituellement supportés juste en dessous de
pédoncules.
Fruits pâles 3 x 4-5 cm,
déprimé-globuleux, légèrement (3) 4
(5)-lobé, lisse, glabre, vert pomme avec des marques brunâtres; 3
mm d'épaisseur de couleur verte virant de jaune à la
maturité.
En plus de produits ligneux et non ligneux, le makokolo est
une plante utilisée dans la pharmacopée traditionnelle pour les
traitements de la diarrhée, plaies, cancéreuses, amibes, douleurs
abdominales...
Kikokolo est une plante que l'on retrouve en région
zambézienne dans la communauté de Brachitegea boemii,
Julbernadia globiflora et au Madagascar.
2.2.5. Autres matériels
Des matériels de mesure de longueur, de poids, de
diamètre ainsi que les outils pour la récolte
d'échantillon de sols sont listés ci -dessous :
· Tarière et Houe pour le prélèvement
d'échantillon de sol ;
· Pied à coulisse ;
· Caisson iso thermique et sachet ;
· Crayons, Stylos, Carnet et latte;
· Tamis de maille de 1 et 2 mm ;
· Et la balance électronique de
précision...
2.3. Méthodes
2.3.1. Contrôle de la mycorhization en
pépinière
Dix plantules ont été prélevées en
pépinière, à 9 mois de semis. Au
prélèvement, l'on signale la présence ou l'absence de la
mycorhization. Les espèces d'arbres ciblés sont celles
sevrées en pépinière à Mikembo : Pterocarpus
angolensis, P. tinctorius, U. kirkiana. Les plantules proviennent d'un
semis en pleine terre, dont le semis a été effectué en
décembre 2010.

Photo 3. Illustration des plantules des espèces
indigènes de la forêt claire (Miombo), produites en
pépinière dans l'enceinte de la concession Mikembo (Crédit
Kaumbu, septembre 2011). De gauche à droite: P. angolensis,
P. tinctorius et U. kirkiana (semis en pleine terre).
2.3.2. Quantification des manteaux des champignons
ectomycorhiziens dans le sol de la rhizosphère de U. kirkiana et U.
pilosa.
La réserve forestière de Mikembo
localisée sur la route Kasenga (Nord- Est de la ville de Lubumbashi) a
servi comme site expérimental. Deux espèces d'arbres de la
famille de Phyllanthaceae ont été
étudiées, à savoir : U. kirkiana et U. pilosa. La
quantification de la mycorhization de P. angolensis et P.
tinctorius n' a pas été étudiée du fait de
l'absence des réactifs pour colorer les racines et faire ressortir les
endomycorhizes.
Les caractéristiques physico-chimiques du sol qui ont
été analysées dans la station d'études sont
citées ci-dessous : charge caillouteuse, sables, particules fines (limon
et argile), matière organique, pH (H2O) et (KCl), P2O5
total.
En fin février 2012, des prélèvements des
sols ont été effectués dans la rhizosphère des
arbres du Miombo, à la proximité des individus de moins 80 cm de
hauteur. Ces échantillons préliminaires ont été
prélevés à des endroits, où un grattage superficiel
à la houe détecte les mycéliums ectomycorhiziens (Voir
Photo 3). D'autres ont été effectués en juin 2012, pour
compléter la liste. Dans ce dernier cas, les prélèvements
ont été réalisés à deux profondeurs (0-10 et
10-20 cm). La circonférence à la hauteur de la poitrine a
été mesurée pour caractériser les individus
échantillonnés.

Photo 4. Illustration du mycélium ectomycorhiziens
(Crédit Kaumbu, mai 2012)
De chaque échantillon, on a pris 20 g de sol pour
quantifier
l'ectomycorhization. Cette quantité de sol (20 g) a
été immergée dans l'eau et lavé soigneusement sur
deux tamis de 1 et 2 mm de maille, pour l'élimination de la
matière organique et des débris. Les racines ont
été récupérées, et un tri à la loupe
de 8 à 10 fois de grossissement a été effectué pour
séparer les racines ectomycorhizées. Le nombre de racines
ectomycorhizées servira à la quantification de
l'ectomycorhization du sol.
2.3.3. Procédure utilisé pour la
caractérisation des paramètres physiques et chimiques
du
sol
2.3.3.1. Paramètres physiques
Dans chaque échantillon, 20 g de sol de la
rhizosphère a été prélevé et tamisé
aux mailles de 2 et 1 mm. Les particules grossières (charge
caillouteuse) sont celles récupérées à la maille de
2 mm et le sable à la maille de 1 mm. Les particules fines (argile et
limon) sont recueillies après passage au tamis de 1mm de maille. Ces
éléments ou particules retenus à chaque maille sont
pesés à l'aide d'une balance électronique de
précision, puis converti en pourcentage.
2.3.3.2. Paramètres chimiques
Les analyses ont été réalisées au
laboratoire du Centre de Recherche AgroAlimentaire (CRAA) de Lubumbashi, selon
les méthodes de Mujinga (2010). Il s'agit des analyses suivante : pH
eau, pH KCl ; matière organique ; et le phosphore total.
2.3.4. Paramètres observés et traitements des
donnés
En pépinière, les mensurations ont
été prélevées sur les plantules pour une
comparaison interspécifique de la croissance. La taille (cm), le nombre
des feuilles, le diamètre au collet (mm), le diamètre de la
racine principale (mm) et la longueur de la racine principale (cm) ont
été mesurées en septembre 2011, à 9 mois
d'âge des plantules.
En nature, le nombre des racines mycorhizées et le taux
de mycorhization (ou indice de mycorhization = Nombre racine mycorhizées
sur le nombre total des racines dans 20g de sol) ont permis de quantifier le
potentiel mycorhizien du sol de la rhizosphère des espèces du
Miombo, particulièrement chez U. kirkiana et U.
pilosa. Ce taux va déterminer l'intensité de l'infection des
racines par le champignon mycorhizien présent dans le sol de la
forêt claire Katangaise.
L'ANOVA à seul critère a été
utilisée pour ressortir les différences entre les
échantillons des sols, prélevés dans la
rhizosphère. Lorsque les différences entre échantillon
sont significatives, les comparaisons des moyennes par la méthode de
Tukeys HSD ont été effectuées pour montrer les classes
similaires. Enfin, les analyses multi variées seront
effectuées pour établir une corrélation
entre l'intensité de mycorhization et les variables physicochimiques.
Chapitre 3. Présentation des
Résultats
3.1. Contrôle de la mycorhization en
pépinière pour un semis en pleine
terre, à 10 mois de
semis
3.1.1. Etat de la mycorhization des plantules de U.
kirkiana
Il ressort du tableau 3 qu'à 9 mois d'âge, les
plants de U. kirkiana ne sont pas mycorhizés. Deux plants sur
onze (11) montrent un début de mycorhization, mais il est difficile de
confirmer cela, car le manteau n'est pas bien visible. A la loupe de 8 à
10 fois de grossissement, on observe que de petits filaments mycéliens,
caractéristiques d'un début de l'infection ectomycorhiziens.
Tableau 3. Mensuration des différentes variables
de croissance, 9 mois après semis (Septembre 2011) pour les plantules de
U. kirkiana.
|
U. kirkiana
|
|
Variables observées
|
|
Plantules
|
Hauteur
(cm)
|
Elong_ rac
(cm)
|
Dia_col
(mm)
|
Dia_ rac
(mm)
|
Nom_ feuil
(nombre)
|
Mycorhize
|
|
P1
|
8
|
26
|
5
|
5
|
7
|
DM
|
|
P2
|
10
|
24
|
6
|
6
|
13
|
|
|
P3
|
7
|
24
|
2,5
|
4
|
8
|
|
|
P4
|
8
|
25
|
6
|
5
|
6
|
|
|
P5
|
6
|
26
|
5
|
4
|
4
|
|
|
P6
|
6
|
44
|
5,5
|
5,5
|
5
|
|
|
P7
|
6
|
22
|
4
|
4
|
4
|
|
|
P8
|
9
|
21
|
6
|
6
|
6
|
|
|
P9
|
5
|
31
|
4
|
4
|
2
|
|
|
P10
|
8
|
29
|
5
|
5
|
6
|
DM
|
|
P11
|
11
|
29
|
7
|
8
|
13
|
|
|
Moyenne
|
7,6
|
27,4
|
5,3
|
5,1
|
6,7
|
|
|
Eca_type
|
1,9
|
6,3
|
1
|
1,3
|
3,5
|
|
Légende : P1....P11 : plantules prises
pour échantillon; Elong_rac : élongation racinaire ; Dia_col :
diamètre au collet ; Dia_rac : diamètre de la racine ; Nom_feuil
: nombre des feuilles ; DM : début de mycorhization ; Eca_type :
écart type et + : au-delà de cette valeur.
Pour les paramètres de croissance de U.
kirkiana, l'élongation racinaire est très prononcée
par rapport à la taille des plantules, dans un rapport de 3 fois. Par
contre le diamètre au collet est identique au diamètre de la
racine (Tableau 3).
3.1.2. Croissance et mycorhization des plantules de P.
angolensis et P. tinctorius
La mycorhization des plantules de deux espèces n'a pas
été réalisée du fait de l'absence des
réactifs nécessaires dans la coloration des racines, et faciliter
ainsi l'observation au microscope. Dans cette section, nous présentons
les mesures prélevées sur les plantules de 9 mois d'âges
pour un semis en pleine terre.
Tableau 4. Mensuration des différentes variables
de croissance, 9 mois après semis (Septembre 2011) pour les plantules de
P. angolensis.

P. angolensis
Variables observées
Plantules
P1
P2
P3
P4
P5
P6
P7
P8
P9
P10
Moyenne
Ecart type
31
43
22
38
44
32
14
30
28
18
Dia_rac
(mm)
18 8
18 7
13 4
18 9
17 7
15 8,5
13 8
14 7
16,5 7
11 4
15,4 6,95
2,5 1,7
Hauteur
(cm)
Dia_col
(mm)
16
8
25
9
10
6
15
12
15
7
18
6
20
5,5
11
5
18
8
12
4
16
7,1
4,5
2,3
30
10,01
Elong_ rac
(cm)
Légende : P1....P11 : plantules prises
pour échantillon ; Elong_rac : élongation racinaire ; Dia_col :
diamètre au collet ; Dia_rac : diamètre de la racine ; Nom_feuil
: nombre des feuilles ; DM : début de mycorhization ; SD : standard
deviation (écart type).
Il ressort du tableau 4 ci-dessus que les plantules de P.
angolensis ont données une taille moyenne, une élongation
racinaire, un diamètre moyen au collet respectifs de 16 cm (SD = 4,5),
30 cm (SD = 10,01) et 7,1 cm (SD = 2,3). La racine à une forme de la
carotte.
Elle est plus grosse juste après le collet, soit 15,4 mm
(SD = 2,5) et s'amoindrit à la longueur de 10 à 15 cm du collet
pour devenir égale à 6,95 mm (SD = 1,7) (Tableau 4).
Au regard du tableau 5 ci-dessous, on observe des valeurs
moyenne de 14,4 cm (SD = 6,8) ; 40,9 cm (SD = 11,9) ; 5,6 mm (SD = 1,6)
respectivement pour la hauteur des plantules, la longueur de la racine et le
diamètre au collet. La racine prend un grossissement de 14,3 mm (SD =
3,5) juste après le collet et s'épaissit à plus ou moins
15 cm du collet, pour avoir 8 mm (SD = 1,5) de diamètre (Tableau 5).
Tableau 5. Mensuration des différentes variables
de croissance, 9 mois après semis (Septembre 2011) pour les plantules de
P. tinctorius.
|
Plantules
|
P. tinctorius
|
|
Variables observées
|
|
Hauteur
(cm)
|
Elon_rac
(cm)
|
Dia_ col
(mm)
|
Dia_rac
(mm)
|
Nom_feuil
(nombre)
|
|
P1
|
11
|
60
|
6
|
15 9
|
7
|
|
P2
|
4
|
40
|
3
|
10 7
|
3
|
|
P3
|
10
|
24
|
4
|
13 10
|
8
|
|
P4
|
16
|
30
|
5
|
15 10
|
12
|
|
P5
|
13
|
45
|
6
|
12 8
|
10
|
|
P6
|
11
|
34
|
5
|
14 8
|
6
|
|
P7
|
26
|
46
|
8
|
21 9
|
8
|
|
P8
|
13
|
32
|
5
|
15 6
|
11
|
|
P9
|
26
|
56
|
8
|
16 6
|
14
|
|
P10
|
14
|
42
|
6
|
12 7
|
10
|
|
Moyenne
|
14,4
|
40,9
|
5,6
|
14,3 8
|
8,9
|
|
Ecart type
|
6,8
|
11,9
|
1,6
|
3,45 1,5
|
2,9
|
Légende : P1....P11 : plantules prises
pour échantillon ; Elong_rac : élongation racinaire ; Dia_col :
diamètre au collet ; Dia_rac : diamètre de la racine ; Nom_feuil
: nombre des feuilles ; DM : début de mycorhization ; SD : standard
deviation (écart type).
33
3.1.3. Comportement des plantules transférées
de la pépinière en pleine terre vers les
sachets en
polyéthylène
A la lumière du Tableau 6 ci-dessous, il ressort des
différences entre espèces pour la hauteur, le diamètre au
collet, l'élongation racinaire, le diamètre de la racine et le
ratio de la tige sur la racine respectivement au seuil de p = 0,001 ; p =
0,03 ; p = 0,01 ; p = 0,000 et p = 0,01.
Pour la taille et le diamètre au collet des plantules,
les deux Pterocarpus s'égalent et donnent des valeurs
supérieures à U. kirkiana. Quant au diamètre au
collet et le ratio de la taille sur la racine, P. angolensis est seule
en tête suivie de P. tinctorius qui donne des valeurs identiques
à celles de U. kirkiana. Enfin l'élongation racinaire
est plus élevée pour P. tinctorius, et que P.
angolensis et U. kirkiana ont des longueurs des tiges identiques
(Tableau 6).
Tableau 6. ANOVA pour la comparaison
interspécifique de la croissance des plantules lors du repiquage en
sachets de polyéthylène.
|
|
Paramètres de croissance
|
|
|
Espèces
|
Hauteur
|
Dia_col
|
Elong_rac
|
Dia_rac
|
Ratio_Tig/rac
|
|
P. angolensis
|
16a
|
7,05a
|
30b
|
15,2a
|
0,6a
|
|
(4,5)
|
(2,3)
|
(10,0)
|
(2,5)
|
(0,3)
|
|
P. tinctorius
|
14,4a
|
5,6ab
|
40,9a
|
14,3a
|
0,4b
|
|
(6,9)
|
(1,6)
|
(11,4)
|
(2,9)
|
(0,1)
|
|
U. kirkiana
|
7,4b
|
4,9b
|
27,2b
|
4,9b
|
0,3b
|
|
(1,4)
|
(1,2)
|
(6,6)
|
(0,8)
|
(0,1)
|
|
Effet espèces
|
P = 0,001
|
P = 0,03
|
P = 0,01
|
P = 0,000
|
P = 0,01
|
Légende : Elong_rac :
élongation racinaire ; Dia_col : diamètre au collet ; Dia_rac :
diamètre de la racine ; Nom_feuil : nombre des feuilles ; Ratio_Tige/rac
: rapport de la valeur de la tige sur celle de la racine. Entre
parenthèse : écart type (SD : standard
déviation).
Le taux de reprise de deux espèces du genre
Pterocarpus (91,3 et 93,8 %) est largement supérieur à
celui de l'espèce U. kirkiana (40 %). Et le taux de survie des
plantules est dans l'ensemble de trois espèces supérieur à
60 %. Néanmoins, les deux Pterocarpus ont une survivance
supérieure comprise entre 90,4 et 97,3 % (Tableau 7).
Tableau 7. Reprise et survivance des plantules
repiquées à 9 mois d'âge.
|
Espèces
|
Plantules
repiquées
|
Plantules en
Décembre
2011
|
Taux de
reprise
12/2011
|
Plantules en
Mai 2012
|
Taux de
survie en
05/2012
|
|
P. angolensis
|
80
|
73
|
91,30%
|
66
|
90,4 %
|
|
P. tinctoruis
|
80
|
75
|
93,80%
|
73
|
97,3 %
|
|
U. kirkiana
|
70
|
28
|
40%
|
18
|
64,3 %
|
Légende : Taux de reprise de
décembre 2011 = nombre des plantules à cette date divisé
par le nombre des plantules transplantées, multiplié par 100.
Taux de survie de mai 2012 = nombre des plantules à cette date
divisé par le nombre des plantules de décembre 2011,
multiplié par 100.
Comme la reprise, la croissance des plantules de U.
kirkiana est médiocre comparée à celle de deux
Pterocarpus (Voir Photos 5, 6 et 7). A la photo 5, on observe une
mauvaise croissance avec des plantules chétives dès la reprise
constatée en décembre 2011 jusqu'en mai 2012, sept mois
après repiquage.

Photo 5. Transplant de U. kirkiana, à
gauche novembre 2011, à droite mai 2012.
Au vue des photos 6 et 7, il apparait très net que les
transplants de P. angolensis et P. tinctorius
présentent une forte vigueur de croissance à la reprise en
décembre 2011 comparés à ceux de U. kirkiana.
Mais en mai 2012, le costume foliaire semble être affecté par les
facteurs du milieu ; et les plantules de P. angolensis en sont
très affectées. Les plantules de cette dernière
espèce ont perdu toutes les feuilles et présentent une
physionomie foliaire desséchée comparée à celle
verdâtre et luxuriante du mois de décembre (Photo 6).

Photo 6. Transplant de P. tinctorius, à
gauche novembre 2011, à droite mai 2012.

Photo 7. Transplant de P. angolensis, à
gauche novembre 2011, à droite mai 2012. 3.2. Quantification de
mycorhizes inféodés à U. kirkiana
3.2.1. Potentiel mycorhizien du sol de la
rhizosphère de plantule de U. kirkiana pour un
échantillonnage
réalisé en saison de pluie, en nature
L'intensité de mycorhization tel que repris dans le
tableau 8 ci-dessous, montre un taux de mycorhization comprise entre 48 (SD =
12,7) et 77,8 (SD = 7,04)%, respectivement pour les deux profondeurs (10 et 20
cm) d'échantillonnage. Le test t effectué pour comparer les deux
moyennes montre que le taux de mycorhization à la profondeur de 20 cm
est plus élevé comparé à celui de 10 cm (p =
0,03)
Le nombre des racines mycorhizées et totales dans 20 g
de sol varie respectivement entre 15,7 (SD = 15,7) et 20 (SD = 7,6) et ; 25,7
(SD = 7,8) et 32,7 (SD = 5,5). L'analyse de la variance montre qu'il n'y a pas
une différence entre les deux profondeurs (10 et 20 cm) pour les deux
variables (P > 0,05 ; Tableau 6, Colonnes 7 et 8).
Tableau 8. Indice de mycorhization de quelques essences
du Miombo Katangais
|
Espèces
|
Echantillon1
|
Echantillon2
|
Echantillon3
|
Moyenne
Rm Rt
|
Taux (%) de
Mycorhization
|
|
Rm
|
Rt
|
Rm
|
Rt
|
Rm
|
Rt
|
|
U. kirkiana (1)
|
21
|
38
|
15
|
27
|
11
|
33
|
15,7 a
|
32,7 a
|
48,1 b
|
|
|
|
|
|
|
|
(5)
|
(5,5)
|
(12,7)
|
|
U. kirkiana (2)
|
27
|
32
|
12
|
17
|
21
|
28
|
20 a
|
25,7 a
|
76,7 a
|
|
|
|
|
|
|
|
(7,6)
|
(7,8)
|
(7,04)
|
|
Effet espèces
|
|
|
|
|
p=0,46 ;
|
p=0,27
|
* ; p=0,03
|
Légende : Dans les colonnes (7 et 8),
les moyennes affectées d'une même lettre sont identiques au seuil
de probabilité de 0,05. Les chiffres entre parenthèse expriment
l'écart type, symbolisé par SD (standard deviation = écart
type). N = 3 échantillons par espèces. Rm : racines
mycorhizées ; Rt : nombre total des racines par 20 g de sol.
kantangensis, B. spiciformis et B. wangermeana. La
biomasse et les mensurations sur la taille et la racine sont contenues dans le
tableau 9 ci-dessous.
Cette plante est caractérisée par une racine
longue de plus de 80 cm, un diamètre au collet de 5,5 mm et 5 feuilles.
La biomasse fraiche totale est 190 g. Dans cette biomasse, la partie
souterraine est sur représenté avec 170 g contre 20 g pour la
biomasse aérienne (Tige et feuille) (Tableau 9). Ces
caractéristiques illustrent sans faille l'adaptation des arbres des
forêts claires Zambézienne, qui consiste à
développer une forte élongation racinaire au dépend de la
partie aérienne.
Tableau 9. Biomasse d'un plant récoltée
dans la rhizosphère

Variables mesurées
Valeurs observées
Longueur de la racine
Nombre des feuilles
Diamètre au collet
Biomasse totale
Biomasse aérienne
Biomasse foliaire
Biomasse de la tige
Biomasse racinaire
TMM
+ 80 cm
5
5,5 mm
190 g
15 g
10 g
5 g
170 g
62,9
Légende : TMM : Taux moyen de
mycorhization.
3.2.2. Potentiel mycorhizien du sol de la
rhizosphère des arbres de U. kirkiana et U.piosa pour un
échantillonnage réalisé en saison sèche (juin
2012), en nature
3.2.2.1. Uapaka kirkiana
Il ressort du tableau 10 ci-dessous que le taux de
mycorhization varie de 52,91 % #177; 19,53 à 70 % #177; 10,58 pour
l'espèce U. kirkiana. Le taux de mycorhization ne
diffère pas statistiquement entre échantillons de sol de la
rhizosphère (p- value = 0,44).
La moyenne des racines mycorhizées est comprise entre
10,3 #177; 2,3 et 19,3 #177; 5,7. L'analyse de variance montre des
différences non significatives entre échantillon (p- value = 0,3)
(Tableau 10).
Tableau 10. Tableau résumé de l'état
de la mycorhization en nature, des racines dans la rhizosphère d'U.
Kirkiana pour les échantillons prélevés en juin
2012.
|
Echantillon de sol
|
Rac_tot
|
Rac myco
|
Taux de myco
|
Type de végétation
|
|
CRC 37, 0-10
|
22,67 a
|
12,333 a
|
58,7 a
|
U.kirkiana
|
|
(6,11)
|
(3,215)
|
(14,9)
|
|
|
CRC 37, 10-20
|
15,667 a
|
10,333 a
|
67,1 a
|
U.kirkiana
|
|
(4,726)
|
(2,309)
|
(10,6)
|
|
|
CRC 62, 0-10
|
27,000 a
|
19,333 a
|
70,5 a
|
U.kirkiana
|
|
(4,359)
|
(5,686)
|
(10,6)
|
|
|
CRC 62, 10- 20
|
28,333 a
|
15,667 a
|
52,9 a
|
U.kirkiana
|
|
(8,386)
|
(9,018)
|
(19,5)
|
|

Différence entre échantillon NS,
p : 0,12 NS, p : 0,30 NS, p : 0,44
Légende : Dans les colonnes, les
moyennes affectées d'une même lettre sont identiques au seuil de
probabilité. Les chiffres entre parenthèse expriment
l'écart type, symbolisé par SD (standard deviation = écart
type). Rac_tot : racines totale ; Rac myco : racines mycorhizées ; et
taux de myco : taux de mycorhization. CRC : circonférence de l'arbre
à 1,30 m. Les valeurs sont les moyennes de trois
répétitions. 0-10 et 10-20 sont les profondeurs de
prélèvement du sol, en cm.
3.3.2. Uapaka pilosa
Les résultats présentés dans le tableau
11 ci-dessous montrent que le taux moyen de mycorhization varie de 41,41 #177;
8,34 et 70, 13 #177; 19,87 %. Le taux de mycorhization ne diffère pas
statistiquement pour entre échantillons de sol de la rhizosphère
(p- value = 0,067).
La moyenne la plus élevée de racine
mycorhizée a été de 16,3 #177; 10,9 % et le plus faible a
été de 8 #177; 1 %. L'analyse de la variance montre un effet non
significatif entre les échantillons (p- value = 0,38) (Tableau 11).
Tableau 11. Tableau résumé de l'état
de la mycorhization en nature, des racines dans la rhizosphère d'U.
pilosa pour les échantillons prélevés en juin
2012.
|
Echantillon de sol
|
Rac_tot
|
Rac myco
|
Taux de myco
|
Type de végétation
|
|
CRC 22, 0- 10
|
26,33a
|
16,333 a
|
64,37 a
|
B. spiciformis
|
|
(19,66)
|
(10,970)
|
(6,33)
|
|
|
CRC 22, 10-20
|
19,67 a
|
8,000 a
|
41,41 a
|
B. spiciformis
|
|
(3,21)
|
(1,000)
|
(8,34)
|
|
|
CRC 28, 0-10
|
23,67 a
|
12,000 a
|
50,26 a
|
B. spiciformis
|
|
(2,08)
|
(3,000)
|
(8,55)
|
|
|
CRC 28, 10-20
|
21,67 a
|
14,333 a
|
70,13 a
|
B. spiciformis
|
|
(6,66)
|
(1,528)
|
(19,87)
|
|
|
Différence entre échantillon
|
NS, p: 0,881
|
NS, p : 0,383
|
NS,p : 0,067
|
|
Légende : Dans les colonnes, les
moyennes affectées d'une même lettre sont identiques au seuil de
probabilité. Les chiffres entre parenthèse expriment
l'écart type, symbolisé par SD (standard
deviation). Rac_tot : racines totale ; Rac_myco : racine
mycorhizées ; et taux de myco : taux de mycorhization. CRC :
circonférence de l'arbre à 1,30 m. 0-10 et 10-20 sont les
profondeurs de prélèvement du sol, en cm. Les moyennes sont des
valeurs de trois répétitions.
3.3.3. Propriétés physico-chimiques
3.3.3.1. Propriétés physiques du sol de
la rhizosphère d'U. kirkiana
Les résultats obtenus lors de l'analyse
granulométriques du sol de la rhizosphère montrent que les
individus de l'espèce d'U. kirkiana sont installés sur
le sol à forte charge caillouteuse. Le pourcentage le plus
élevé de la charge caillouteuse a été de 70 %, et
la plus faible de 45 %. La charge caillouteuse de sol augmentait avec la
profondeur du sol. Elle est faible (45 %) à la profondeur de 0-10 cm et
élevée à la profondeur de 10-20 cm (70 %) (Tableau 12).
Tableau 12. Propriétés physique du sol
(teneur en particules fines, en sable et cailloux) pour le sol de la
rhizosphère d'U. kirkiana.
|
CRC et Profondeur
|
% argile et limon
|
% de sable
|
% cailloux
|
|
CRC37, 0-10
|
25
|
20
|
45
|
|
CRC37, 10-20
|
20
|
15
|
60
|
|
CRC62, 0-10
|
20
|
15
|
65
|
|
CRC62, 10- 20
|
15
|
10
|
70
|
Légende : Les valeurs sont les moyennes
de trois répétitions. CRC : circonférence de l'arbre
à 1,30 m. 0-10 et 10-20 sont les profondeurs de
prélèvement du sol, en cm.
Au vue du tableau 13 ci-dessous, on observe que la relation
linéaire entre couples de variable n'est significative qu'entre le
nombre des racines mycorhizées et les racines totales (p = 0,001),
toutes les variables physiques du sol et l'échantillon et enfin entre la
charge caillouteuse et la teneur en sable (p = 0,000).
La relation linéaire est positive entre le nombre des
mycorhizées et le nombre des racines totales d'une part, et entre la
charge caillouteuse et les échantillons d'autre part. Par contre, elle
est négative entre les restes de variable physique et les
échantillons d'un côté ; et entre la charge caillouteuse et
la teneur en sable de l'autre (Tableau 13).
Tableau 13. Corrélations entre Echantillon; Racine
Totale; Racine mycorhizées; Taux de mycorhization; Argile limon et Sable
; pour le sol de la rhizosphère de U. kirkiana.
|
Echantillon
|
Rac_Tot
|
Rac_myco
|
Taux_myco
|
Arg_limo
|
|
Rac_Tot
|
0,496
0,101
|
|
|
|
|
|
Rac_myco
|
0,368
|
0,844
|
|
|
|
|
0,239
|
0,001
|
|
|
|
|
Taux_myco
|
-0,117
|
-0,015
|
0,519
|
|
|
|
0,716
|
0,963
|
0,084
|
|
|
|
Arg_limo
|
-0,949
|
-0,334
|
-0,204
|
0,154
|
|
|
0,000
|
0,289
|
0,524
|
0,632
|
|
|
Sable
|
-0,949
|
-0,334
|
-0,204
|
0,154
|
1,000
|
|
0,000
|
0,289
|
0,524
|
0,632
|
*
|
|
Char_caill
|
0,956
|
0,353
|
0,317
|
0,002
|
-0,945
|
|
0,000
|
0,260
|
0,316
|
0,994
|
0,000
|
|
Sable
|
|
|
|
|
Char_caill -0,945
0,000
Contenu de la cellule : Corrélation de
Pearson
Valeur de P
Légende : Rac_tot : racines totale ;
Rac_myco : racine mycorhizées ; taux_myco : taux de mycorhization ;
Arg_limo : % en particules fines (argile et limon); char_caill : % en
particules grossières (charge caillouteuse) ; sable : % en sable. Les
valeurs brutes ayant servi pour les calculs proviennent de trois
répétitions.
3.3.3.2. Propriétés physiques du sol de
la rhizosphère d'Uapaka pilosa
Les résultats obtenus lors de l'analyse
granulométrique dans tableau 14 cidessous de la rhizosphère de
sol montrent que les espèces d'Uapaka pilosa sont
installées sur le sol à forte charge caillouteuse. Le pourcentage
le plus élevé de la charge caillouteuse a été de
60, et la plus faible a été de 40.
Tableau 14. Propriétés physique du sol
(teneur en particules fines, en sable et cailloux) pour le sol de la
rhizosphère U. pilosa
|
CRC et Profondeur
|
% argile et limon
|
% de sable
|
% cailloux
|
|
CR2, 0- 10
|
25
|
20
|
55
|
|
CR2, 10-20
|
15
|
10
|
60
|
|
CR8, 0-10
|
35
|
20
|
40
|
|
CR8, 10-20
|
25
|
15
|
50
|
Légende : Les valeurs sont les moyennes
de trois répétitions. CRC : circonférence de l'arbre
à 1,30 m. 0-10 et 10-20 sont les profondeurs de
prélèvement du sol, en cm.
A la lumière du tableau 15 ci-dessous, il ressort que
la relation linéaire entre couples de variable est significative
qu'entre le nombre des racines mycorhizées et les racines totales (p =
0,000), entre la teneur en sable et celle en particules fines (argile et limon,
p = 0,000) et enfin entre la charge caillouteuse et la teneur en particules
fines (argile et limon, p = 0,000).
La relation linéaire est positive entre le nombre des
mycorhizées et le nombre des racines totales d'une part, et entre la
teneur en sable et celle en particules fines (argiles et limon). Par contre,
elle est négative entre la charge caillouteuse et la teneur en
particules fines (argile et limon) de l'autre (Tableau 15).
Tableau 15. Corrélations entre Echantillon; Racine
Totale; Racine mycorhizées; Taux de mycorhization; Argile limon et Sable
; pour le sol de la rhizosphère de U. pilosa.
|
Echantillon Rac_Tot
|
Rac_myco
|
Taux_myco
|
Arglimo
|
|
Rac_Tot
|
|
-0,125
0,699
|
|
|
|
|
Rac_myco
|
|
-0,040 0,884
|
|
|
|
|
|
0,903 0,000
|
|
|
|
|
Taux_myco
|
|
0,195 -0,182
|
0,294
|
|
|
|
|
0,544 0,572
|
0,354
|
|
|
|
Arglimo
|
|
0,316 0,158
|
0,251
|
0,209
|
|
|
|
0,317 0,624
|
0,431
|
0,515
|
|
|
Sable
|
|
-0,135 0,252
|
0,410
|
0,335
|
0,853
|
|
|
0,676 0,429
|
0,185
|
0,287
|
0,000
|
|
Char_caill
|
|
-0,529 -0,085
|
-0,130
|
-0,111
|
-0,956
|
|
|
0,077 0,793
|
0,687
|
0,731
|
0,000
|
|
|
Sable
|
|
|
|
|
Char_caill
|
|
-0,663
|
|
|
|
|
|
0,019
|
|
|
|
|
Contenu de
|
la
|
cellule : Corrélation de
|
Pearson
|
|
|
|
|
Valeur de P
|
|
|
|
Légende : Rac_tot : racines totales ;
Rac_myco : racines mycorhizées ; taux_myco : taux de mycorhization ;
Arg_limo :% en particules fines (argile et limon) ; char_caill :% en particules
grossières (charge caillouteuse) ; sable : % en sable. Les valeurs
brutes ayant servies pour les calculs proviennent de trois
répétitions.
3.3.3.3. Propriétés chimiques de
l'échantillon composite du sol de la rhizosphère de U. kirkiana
et U. pilosa
Les échantillons de sol de la rhizosphère ont
été analysé pour déterminer les
caractéristiques suivantes : pH eau, pH KCl, la matière organique
et le phosphore total. Ces analyses ont été effectuées au
laboratoire du Centre de Recherche Agro-Alimentaire (CRAA), Lubumbashi, selon
les méthodes décrites par Mulaji (2010) et les résultats
obtenus sont présentés dans le tableau N° 16 ci-dessous.
Tableau N° 16. Résultat de l'analyse chimique
au laboratoire du centre de recherche agro -alimentaire (CRAA)
|
Echantillons
|
pH eau
|
pH KCl
|
Matière organique (%)
|
Phosphore total (ppm)
|
|
U. kirkiana
|
5,01
|
3,58
|
9,55
|
0,030
|
|
U. pilosa
|
5,12
|
3,95
|
10,81
|
0,024
|
Il ressort du tableau 16 ci-dessus que le pH eau est voisin de
5 et le pH KCl compris entre 3,58 et 3,95. La teneur en matière
organique et en phosphore total varie respectivement entre 9,55 et 10,9% et ;
0,024 et 0,03 ppm.
Chapitre 4. Discussions
4.1. Etat de la mycorhization des plantules de U.
kirkiana, P. angolensis et P. tinctorius
Les plants de U. kirkiana ne sont pas mycorhizes
à 10 mois d'âge (Tableau 2). On observe deux plants sur onze (11)
un début de mycorhization, mais il est difficile de confirmer cela, car
le manteau n'est pas encore développé. Seuls de petits filaments
mycéliens, caractéristiques d'un début de l'infection
ectomycorhiziens sont visibles à la loupe de 8 à 10 fois de
grossissement. L'examen macroscopique montre l'absence des racines
secondaires.
Un intense développement de la racine principale est
signalé à 10 mois d'âge des plantules semées sur un
sol du Miombo dégradé au détriment des autres
paramètres ; à savoir hauteur des plants, nombre des feuilles,
diamètre au collet et diamètre de la racine (Tableau 5). En plus,
l'examen macroscopique de la racine montre peu ou pas des racines secondaires
ectomycorhizables.
L'absence de l'ectomycorhization des plantules de U.
kirkiana dans les conditions de la pépinière serait
expliquée par trois facteurs majeurs, à savoir : (1) l'adaptation
éco-génétique entraînant une forte élongation
racinaire dans les premières années de croissance, (2) un
très faible développement des racines secondaires et (3)
l'exposition des plantules à un fort ensoleillement pour une
pépinière non ombragée. Pour l'élongation
racinaire, notre observation est en accord avec les recherches de Chidumayo
(1997) sur la croissance des arbres du Miombo en général.
L'auteur montre que dans les premières années de croissance, les
arbres du Miombo présentent une forte élongation racinaire
(racine principale) aux dépens de la biomasse aérienne
(Chidumayo, 1997). En plus la mycorhization ne s'effectue qu'aux racines
latérales qui participent efficacement dans le développement de
la racine principale (Munyanziza, 1994). Ce système racinaire (racines
latérales ou secondaires) était absent lors de l'examen
macroscopique des plantules de U. kirkiana de notre
pépinière, ce qui justifie la non mycorhization de ces
plantules.
L'exposition des plantules à un ensoleillement
affecterait le développement de l'hôte ectomycorhizien et pourrait
être un facteur qui justifierait l'absence de la mycorhization de U.
kirkiana.
4.2. Mycorhization des arbres de Uapaca kirkiana et U.
piosa en nature.
Les résultats du potentiel mycorhizien du sol
prélevé en février 2012 dans la rhizosphère de
U. kirkiana, montrent que le taux de racines mycorhizées est
compris entre 48,1 et 76,7 %. Le test à deux échantillons
appliqué pour les deux moyennes montre que le taux de mycorhization
à la profondeur de 10 à 20 cm est plus élevé et
diffère statistiquement de celui obtenu à 0-10 de profondeur (p =
0,03, tableau 8).
En saison sèche (juin 2012), le taux de mycorhization
du sol de la rhizosphère des arbres de U. kirkiana et U.
pilosa dont la moyenne du taux de mycorhization est respectivement compris
entre une moyenne de 52 à 70 % et 41,4 à 70,1 %. Pour les deux
espèces, les différences entre échantillon ne sont pas
significatives (p ? 0,05, tableaux 10 et 11).
Les estimations du pourcentage de mycorhization des racines du
sol étudié sont de 78,5 % (moyenne de 15,7 racines pour 20 g de
sol) et 100 % (moyenne 20 racines pour 20 g de sol) respectivement à la
profondeur de 0-10 cm et 10-20 cm, pour le sol de la rhizosphère de
U. kirkiana (échantillon de février).
Ce pourcentage baisse légèrement pour les
échantillons prélevés en début de la saison
sèche (juin 2012). A cette date, le pourcentage des racines
mycorhizées est compris entre 61,5 à 96,5 % (moyenne de 12,3
à 19,3 racines mycorhizées pour 20 g de sol) et ; 40 à 80
% (moyenne de 8 à 16 racines mycorhizées pour 20 g de sol)
respectivement pour U. kirkiana et U. pilosa (Tableaux 10 et
11).
Le pourcentage de mycorhization des racines (nombre des
racines mycorhizées divisé par le poids du sol, multiplié
par 100) de deux stations d'une forêt de région
tempérée est de 7,7 % et 17,2 % respectivement pour la station de
Foz de Calanda et celle de Vallivana (Diaz et al., 1994).
Le pourcentage des racines mycorhizées de nos
résultats est largement supérieur à celui obtenu par Diaz
et al. (1994) dans la forêt de pins. Ces observations
préliminaires montrent que les deux espèces de la sous famille de
Phyllanthaceae seraient plus ectomycorhizées.
4.4. Propriétés physico-chimiques
Il ressort de l'analyse granulométrique du sol de la
rhizosphère que le pourcentage de la charge caillouteuse est
élevé (70 %). Nos résultats montrent en plus que le sol de
la rhizosphère de U. pilosa a un pourcentage de 40 à 60
%. Ces conditions sont favorables à la croissance des espèces du
genre Uapaka. Des études réalisées sur Uapaka
kirkiana rapportent que cette espèce s'installe sur le sol avec une
moyenne de 50 à 60 % de la charge caillouteuse (Chidumayo, 1988 ;
Kalenga et al., 2000). En outre les espèces de Uapaka
poussent sur des sols ferrugineux ou ferralitiques dérivés
du métamorphisme et des types de roches ignées et tolèrent
les sols pauvres et peu profonds (Kalenga et al., 2000).
A la lumière des résultats de
l'analyse chimique du sol de la rhizosphère de U. kirkiana et U.
pilosa, il ressort que le pH eau et KCl sont respectivement rangés
dans la gamme de 5,01 et 5,12. Ce pH est convenable pour la mycorhization, et
peut être l'une des raisons de la forte mycorhization des espèces
étudiées. Nos observations sont en accord avec les études
de Thoen (1974) dans la station de l'INERA Kipopo. Dans cette station, l'auteur
a montré qu'avec le pH eau de 4 à 5, la mycorhization est
très satisfaisante pour l'épanouissement et les
développements des ectomycorhizes des essences exotiques.
L'acidité et la pauvreté du sol sont de facteurs
favorisant le développement des mycorhizes selon Hogeberg (1986) et
Khasa et al. (1990) qui soulignent l'importance de bien connaitre les
caractéristiques physiques et chimiques du sol, qui peuvent ou non
favoriser le développement des mycorhizes (fertilité du sol et
humidité...). De même, Kalenga et al. (2000) ont
confirmé dans leurs études que U. kirkiana et U. pilosa
poussent bien dans un sol où le pH eau est acide, autour de 4
à 6.
Dans la région tempérée, les
résultats de l'analyse des sols montrent que le pH est de 7 à 7,5
(Diaz et al., 1994). Dans ces conditions, le pourcentage de
mycorhization est faible comparée à celui obtenu dans notre
milieu d'étude. Ce propos vient de plus confirmer l'impact du pH acide,
pour une mycorhization optimale.
L'analyse statistique effectuée pour mettre en
évidence une relation linéaire entre les paramètres de la
mycorhization (nombre des racines mycorhizées, nombre des racines
totales et le taux de mycorhization) et les paramètres physiques du sol
révèle des tendances positives et négatives.
Pour les échantillons prélevés dans la
rhizosphère de U. kirkiana, la relation linéaire est
significative et positive entre le nombre des racines mycorhizées et le
nombre des racines totales d'une part, et entre la charge caillouteuse et les
échantillons d'autre part. Par contre, elle est négative entre
les restes des variables physiques et les échantillons d'un
côté ; et entre la charge caillouteuse et la teneur en sable de
l'autre (Tableau 13).
Pour les échantillons récoltés dans la
rhizosphère de U. pilosa, la relation linéaire est
positive et significative entre le nombre des racines mycorhizées et le
nombre des racines totales d'une part, et entre la teneur en sable et celle en
particules fines (argiles et limon). Par contre, elle est négative entre
la charge caillouteuse et la teneur en particules fines (argile et limon) de
l'autre (Tableau 15).
Ces deux observations conduisent à un constat tel que
l'augmentation des racines mycorhizées dans la rhizosphère de ces
deux espèces est due, au vu de nos résultats par l'augmentation
du nombre des racines. Le taux de mycorhization n'est pas corrélé
avec aucun des paramètres mesurés à cet essai. Ce dernier
constat est surprenant du fait que ce paramètre est calculé par
la division du nombre des racines mycorhizées par celui des racines
totales. Néanmoins la taille de l'échantillon (trois)
expliquerait en partie ce comportement. En plus, le pH acide est favorable
à la mycorhization. Mais l'absence de l'analyse de la corrélation
entre ce paramètre (voir aussi d'autres paramètres du sol)
masquerait la tendance réelle de la mycorhization.
Conclusion
Les essences qui ont fait l'object de notre étude sont
des espèces dont divers produits sont commercialisés, ainsi que
d'une grande importance pour les populations locales en produisant les produits
ligneux et non ligneux. Ces espèces forment des associations
mycorhiziennes, intervenant efficacement dans la nutrition
hydrominérale.
Une connaissance scientifique des associations mycorhiziennes
indigènes est capitale pour apporter les pratiques culturales
appropriées dans le reboisement. Le présent travail a
été entrepris pour étudier la caractérisation et
quantification des essences indigène cas de Uapaka kirkiana et
U. pilosa, Pterocarpus angolensis et P. tintoruis
dans les conditions édapho-climatiques du Game Park Mikembo,
réserve forestière de la forêt claire de Miombo.
Les résultats sur les plantules montrent un faible
potentiel de mycorhization. L'état mycorhizien des plantules de U.
kirkiana n'est pas effectif à 9 mois d'âge. Seuls des petits
filaments mycéliens, caractéristiques d'un début de
l'infection ectomycorhizienne était visible à la loupe
binoculaire de 8 à 10 fois de grossissement.
Les résultats obtenus en nature montre que le taux de
mycorhization du sol de la rhizosphère de U. kirkiana et U.
piolosa varie de 48,1 à 76,7 %. Et le pourcentage des racines
mycorhizées est situé dans la gamme de 40 à 100 %. Ce
potentiel ectomycorhizien de la rhizosphère de ces deux espèces
est excellent comparé à celui d'une forêt en région
tempérée. La forte teneur en cailloux (40 à 70 %) et le pH
acide (5,01 et 5,12) sont favorables pour le développement de ces deux
espèces, ainsi que leurs hôtes ectomycorhiziens. La relation
linéaire est positive et significative entre le nombre des racines
mycorhizées et le nombre des racines totales, et entre la teneur en
sable et celle en particules fines (argiles et limon). Par contre, elle est
négative entre la charge caillouteuse et la teneur en particules fines
(argile et limon).
Nos études suggèrent que les études du
genre soient conduites pour raffiner la quantification de la mycorhization des
arbres du Miombo. Ces recherches tiendront compte de la taille de
l'échantillon qui devrait nécessairement être
supérieure à cinquante, pour l'applicabilité de tous les
tests statistiques. En plus une caractérisation
morphogénétique devra être réalisée pour
aboutir à des types de mycorhizes bien définis, ainsi qu'aux
analyses d'ADN.
Bibliographie
1. Akinnifesi F.K., Chilanga T.G., Mkonda A., Kwesiga F.,
Maghembe J., La
domestication de Uapaca kirkiana dans le sud
Afrique: résultats préliminaires de provenances de
dépistage au Malawi et en Zambie, Actes de l'agroforesterie
régionale conférence sur les impacts agro forestiers sur les
moyens de subsistance dans le sud de l'Afrique. mettre la recherche en
pratique, vol 21, n° 16, pp 85-92.
2. Alexander, 1983. A study of ageing of spruce
Piceasitchensis (Bong) Carr. ectomycorrhizas.
3. Anderson, 1967. Nucleic acids, derivates, and organic
phosphates. In :Soil Biochemistry, vol 33, n° 7,pp 16-21.
4. Calleja M., Mousain D., Lecouvreur B., Auzac, 1980.
Influence de la carence phosphatée sur les activités phosphatases
acides de trois champignons mycorhiziens. Hebelomaedurum Metrod.,
Suillusgranulatus (L. ex Fr.)
5. Chidumayo E.N., 1997. Miombo ecology and management an
introduction. Stockholm environement institute (SEI). southampton Row,
londo, WC 1B HH, UK, pp 166.
6. Chidumayo F.R. 1988. Une nouvelle évaluation des
effets du feu sur la régénération du Miombo dans le
Copperbelt du Zambien. Journal of tropical Ecology 4(4), 361- 372.
7. Chidumayo, 1997. Fruit production and seed predation in two
Miombo woodland trees in Zambia. Biotroca, vol 29, n°4,
452-458.
8. Degree et al., 1997. Edition mushrooms of the
zambezian woodland a nutritional and ecological approach. Biotechnol,
agron. Sco. Environ. (3), 2221- 2231.
9. Delwaulle J.C., Diangawa D., Garbaye J., 1987.
Augmentation de la production du spinaibes dans la région
côtière du Congo pour introduction du champignon ectomycorhizien
Pisolithius tinctorius. Revue forestière
française, 39, 1, p 409-417.
10. FAO, 2010. http:// www.fao.org/ docrep
/W4442F/W4442f06.htmn. domaine Zambézien, consulté le 24
février 2012.
11. Garbaye J., 1988. Augmentations de la production du pin
des caraïbes dans la région côtière du Congo par
l'introduction du champignon ectomycorhizien Pisolithus tinetorius.
Revue Forestier Française 39, (5), 409- 417.
12. Garbaye J., De lwaulle J.C., Dianganda D., 1993. Growth
response of Enculyptrus to ectomycorrhizal inoculation in the Congo.
Forest ecology and mamagement 24, pp 151-157.
13. Harley, Cready M.C., 1981. Mycorrhizal symbiosis. London,
New-York. Academic Press, 1983. pp 123-133.
14. Harrison M.J., Van Buuren M.L., 1995. A phosphate
transporter from the mycorrhizal. Fungus Glomus versiforme. Nature,
vol. 378, pp. 626-629.
15. HM Stationery Office, 1900: Bulletin information divers.
Royal Botanic Gardens, Kew 1912 à Londres. pp. 102 .
16. Hogberg, 1986. La disponibilité des nutriments du
sol, symbioses racinaires et la composition des espèces d'arbres en
Afrique tropicale. revue journal of tropical Ecology 2 (4) ; 359-
379.
17. Hogberg, Alexander, 1986. Roles of root symbioses in African
woodland and forest: evidence from 15 N abundance and folian analysis.
Journal of Ecology 83, 217-224.
18. Hogeberg, 1982. Mycorrhizal association in some woodland
forest trees and shrubs in Tanzania new phytologist, revue journal of
tropical Ecology, 92, pp 407- 415.
19. Hogerg P.P.,. Piearce G. D., 1986. Mycorhization in
Zambia tres in relation to host taxonomy, vegetation type and successional
patterns. Journal of ecology vol. 74, N° 3, PP 775- 7785.
20.
http://
worldagroforestry.org/af/ treedb/ consulté le 20 mars 2012
à 10 heures
21. Caractéristiques physico-chimiques et
organoleptiques de Uapaca kirkiana et Strychnos produits
Cocculoides. Papier présenté à
l'Université, in 6ème Malawi sénat de
recherche et de publications conférence annuelle, 21-24 Février,
2000. 12 p.
22. Khasa et al., 1990. Symbioses racinaires chez
quelques essences forestières importées au Zaïre.
Contribution N° 382, station de recherches, agriculture Canada, Sainte
Foy. Québec. 27 - 33.
23. Küntze O., Coker, Couch, 1980. Physiologie
végétale, 18, n° 9, pp. 489-504.
24. Malaisse F., 1973. Contribution à l'étude
de l'écosystème forêt claire (Miombo). Note 8. Le
projet Miombo. Annales Université Abidjan, série E
(Ecologie) tome VI. 227- 250.
25. Malaisse F., 1997. Se nourrir en forêt Claire
Africaine. Approche écologique et nutritionnelle. Presses
agronomiques de Gembloux, n° 11, pp 32 - 47.
26. Malaisse F., Mousset, Schrochoff G., 1973.
Université Nationale du Zaïre Campus de Lubumbashi, l'homme dans la
forêt claire zambézienne. Contribution à l'étude de
l'écosystème forêt claire (Miombo).
27. Malaisse, F. 1973. L'homme dans la forêt clair
zambézienne. Contribution à l'étude de
l'écosystème foret claire (Miombo). African Economic
history, N° 7 pp 38- 64.
28. Matumoto-Pintro P., 1996. Rôle des phosphatases
dans l'utilisation du phosphore organique par les champignons ectomycorhiziens
et leurs associations avec le Pin laricio de Corse. Influence des surfaces
adsorbantes sur l'activité des phosphatases. Thèse doctorat,
Montpellier : École Nationale Supérieure Agronomique.
29. Mousain, 1989. Étude de la nutrition
phosphatée de symbiotes ectomycorhiziens. Thèse de Doctorat
d'État en Sciences, Montpellier. Université des Sciences et
Techniques du Languedoc.
30. Mousain, Meyselle et al., 1991. La Symbiose
mycorrhizienne : résultats obtenus avec l'Hebeloma cylindrosporum
et le Pisolithus tinctorius, et perspectives d'application
agronomique. In Mushroom Science X (Part I), Proceedings of the 10th
International Congress on the Science and Cultivation of Edible Fungi.
31. Ngongo M.L., Van Ranst, Baert G., Kasongo L. E., Versoodt
A., Mujinya B.B., Mukalay J. M., 2009. Guide des sols en RDC tome I.
étude et gestion.
32.
33. Selosse, Marc André, François Le Tacon F.,
1999. La stratégie de la symbiose : science et avenir, N°
633, pp. 72-73.
34. Thoen (D), 1974. Premières indications sur les
mycorhizes et champignons mycorhiziques des plantations exotiques du haut Shaba
(République du Zaïre). Bulletin de recherche agronomique,
Gembloux, 9, p 215-227.
35. Thoen D., 1993. Looking for ectomycorrhizal trees and
ectomycorrhizal fungi in tropical.
36. Trapnell C. G., 1959. Ecological resultants of woolland
burning experiment in northenn Rhodesia . J ecd 47 pp 129-168.
37. Trapnnell, C.G., 1953. The soils, vegetation and agriculture
of northeastern Rhodesia. Second impression, gort. Printer, Lusaka,
146pp.
38. Williamson B., Alexander I.J., Année 2002. Acid
phosphatases localized in the sheath of beech mycorrhiza. Soil bid.
Biochenn, vd. 7, pp 195-198.
Annexes
Résultats d'analyses du sol
|
CAILOUX, SABLE, LIMON ET ARGILE
|
|
Espèces DBH en cm et profondeur
|
Argile+limon
|
% argile
limon
|
Sable
|
% sable
|
Cailloux
|
% cailloux
|
|
U. kirkiana DBH 37, 0-10
|
5
|
25
|
4
|
20
|
9
|
45
|
|
U. Kirkiana DBH 37, 10-20
|
4
|
20
|
3
|
15
|
12
|
60
|
|
U.kirkiana DBH 62, 0-10
|
4
|
20
|
3
|
15
|
13
|
65
|
|
U. kirkiana DBH 62, 10- 20
|
3
|
15
|
2
|
10
|
14
|
70
|
|
U. pilosa DBH 22, 0- 10
|
5
|
25
|
4
|
20
|
11
|
55
|
|
U. pilosa DBH 22, 10-20
|
3
|
15
|
2
|
10
|
12
|
60
|
|
U. pilosa DBH 28, 0-10
|
7
|
35
|
4
|
20
|
8
|
40
|
|
U.pilosa DBH 28, 10-20
|
5
|
25
|
3
|
15
|
10
|
50
|
Les taux de mycorhyzation
|
Arbres en nature
|
Echantillon
|
Rac total
|
Rac myco
|
Taux de myco
|
|
Espèces
|
|
U. kirkiana DBH 37, 0-10
|
1
|
23
|
10
|
43,4782609
|
|
U. kirkiana DBH 37, 0-10
|
2
|
15
|
11
|
73,3333333
|
|
U. kirkiana DBH 37, 0-10
|
3
|
27
|
16
|
59,2592593
|
|
U. Kirkiana DBH 37, 10-20
|
1
|
14
|
9
|
64,2857143
|
|
U. Kirkiana DBH 37, 10-20
|
2
|
12
|
9
|
75
|
|
U. Kirkiana DBH 37, 10-20
|
3
|
21
|
13
|
61,9047619
|
|
U.kirkiana DBH 62, 0-10
|
1
|
29
|
21
|
72,4137931
|
|
U.kirkiana DBH 62, 0-10
|
2
|
22
|
13
|
59,0909091
|
|
U.kirkiana DBH 62, 0-10
|
3
|
30
|
24
|
80
|
|
U. kirkiana DBH 62, 10- 20
|
1
|
24
|
15
|
62,5
|
|
U. kirkiana DBH 62, 10- 20
|
2
|
23
|
7
|
30,4347826
|
|
U. kirkiana DBH 62, 10- 20
|
3
|
38
|
25
|
65,7894737
|
|
Espèces
|
Echantillon
|
Rac total
|
Rac myco
|
Taux de myco
|
|
U. pilosa DBH 22, 0- 10
|
1
|
14
|
10
|
71,4285714
|
|
U. pilosa DBH 22, 0- 10
|
2
|
49
|
29
|
59,1836735
|
|
U. pilosa DBH 22, 0- 10
|
3
|
16
|
10
|
62,5
|
|
U. pilosa DBH 22, 10-20
|
1
|
16
|
8
|
50
|
|
U. pilosa DBH 22, 10-20
|
2
|
21
|
7
|
33,3333333
|
|
U. pilosa DBH 22, 10-20
|
3
|
22
|
9
|
40,9090909
|
|
U. pilosa DBH 28, 0-10
|
1
|
26
|
15
|
57,6923077
|
|
U. pilosa DBH 28, 0-10
|
2
|
22
|
9
|
40,9090909
|
|
U. pilosa DBH 28, 0-10
|
3
|
23
|
12
|
52,173913
|
|
U.pilosa DBH 28, 10-20
|
1
|
26
|
16
|
61,5384615
|
|
U.pilosa DBH 28, 10-20
|
2
|
14
|
13
|
92,8571429
|
|
U.pilosa DBH 28, 10-20
|
3
|
25
|
14
|
56
|
|
|







