|
REPUBLIQUE DE COTE D'IVOIRE
UNION-DISCIPLINE-TRAVAIL
Ministère de l'Enseignement Supérieur
et de la Recherche Scientifique

Université de Bouaké Centre d'Entomologie
Médicale Institut Pierre Richet
2011-2012 et Vétérinaire
Mémoire
Présenté pour l'obtention du
DIPLOME D'ETUDES APPROFONDIES
D'ENTOMOLOGIE MEDICALE
ET VETERINAIRE
THEME
|

Aspects parasito-cliniques de l'épidémiologie
du paludisme dans les districts sanitaires
d'Adzopé et de Grand-Bassam avant et après
distribution de moustiquaires imprégnées
|
|
Présenté par:
KOUADIO Léonce

1
Directeur Scientifique Co-Directeur Scientifique
Dr ASSI Serge-Brice Dr TIA Emmanuel

2
DEDICACE
Je dédie ce mémoire à :
- Notre Seigneur Jésus-Christ, celui qui
est au début et à la fin de toutes choses, pour les grâces
dont il ne cesse de me combler.
- Mes parents pour leur soutien permanent tout
au long de ma vie scolaire et universitaire.

AVANT-PROPOS
La formation au DEA d'Entomologie Médicale et
Vétérinaire au CEMV s'étend sur deux années
universitaires.
La première année réservée aux
enseignements théoriques permet aux auditeurs d'acquérir des
connaissances sur la biologie, l'écologie, le mode de transmission et la
lutte antivectorielle des maladies tropicales humaines et animales. Cette
formation théorique est assortie d'évaluations académiques
afférentes à l'Attestation d'Etudes Approfondies (AEA). La
deuxième année est consacrée par contre aux stages
pratiques. C'est dans ce cadre que nous avons mené des travaux de
recherche supervisés par l'Institut Pierre Richet (IPR) et le Centre
d'Entomologie Médicale et Vétérinaire (CEMV).
Ce travail a été possible grâce au soutien et
au concours de personnes physiques et morales à qui nous voudrions
exprimer notre vive reconnaissance :
Pr KADJO K Alphonse, Directeur du CEMV ;
votre rigueur scientifique et votre grandeur d'esprit ont facilité notre
formation au CEMV. Nous profitons de cette occasion pour vous témoigner
notre infinie reconnaissance.
Feu le Pr KONE Moussa, ex-Directeur de l'IPR
; c'est un immense plaisir et un grand honneur que vous nous avez fait en nous
ouvrant les portes de l'IPR et en acceptant d'être la caution
scientifique de ce mémoire.
Dr ASSI Serge - Brice,
Médecin-Chercheur à l'IPR, Chargé d'Etudes, Chargé
de la Recherche au Programme National de Lutte Contre le Paludisme (PNLP) ;
vous nous avez fait confiance en nous confiant ce travail que vous avez
assidument suivi. Nous avons eu la chance de vous côtoyer et cela nous a
permis de découvrir en vous un maître dont la sollicitude, la
courtoisie et l'humilité forcent l'admiration. Nous avons appris
à vos côtés à travailler dans la bonne humeur.
Dr TIA Emmanuel, Responsable de la Recherche
au CEMV ; vous n'avez ménagé aucun effort pour mener à
bien ce travail que vous avez suivi de très près du début
à la fin. Nous vous en sommes très reconnaissants.
Pr YAVO Williams, Responsable du Centre de
Recherche et de Lutte contre le Paludisme (CRLP) de l'Institut National de
Santé Publique (INSP) ; ce fut un grand honneur et un grand plaisir de
travailler dans votre service. Vous vous êtes montré
compréhensif et nous vous en sommes très reconnaissants. Nous
vous remercions sincèrement pour l'aide et les moyens que vous nous avez
apportés pour la réalisation de ce travail.
Dr YAPI Yapi Grégoire, Responsable de la
Formation et des stages au CEMV ; votre disponibilité et vos conseils
nous ont été utiles tout au long de notre formation au CEMV.
Les Enseignants Chercheurs du CEMV ; nous avons
eu le privilège de bénéficier de vos enseignements de
qualité. Nous vous exprimons notre profonde gratitude.
Tous les auditeurs de la 14e promotion, en
général et en particulier GBALEGBA Constant et
ETILE Augustin, les moments passés ensemble ont fini
par faire de nous de véritables amis. Je n'oublierai jamais ces moments
de chaleureuses convivialités.
Messieurs KONAN Guillaume, KOFFI
Bernard et KONE Moussa, Techniciens au laboratoire de
lutte contre le paludisme (CEMV) ; pour votre inestimable contribution à
la réalisation de ce travail.
Tout le personnel administratif et technique
du CEMV ; vous avez facilité notre intégration au Centre. Votre
sollicitude et votre courtoisie nous ont permis de travailler dans de bonnes
conditions.
Tout le personnel de l'Institut Pierre Richet
(IPR) et du Centre de Recherche et de Lutte contre le
Paludisme (CRLP) de l'INSP ; votre disponibilité et votre
hospitalité nous ont permis de mener à bien ce travail. Merci
pour tout.

4
Tous mes amis du club " African Queen ", ce
club constitue une famille soudée. Nous sommes fiers de votre
amitié.
Les membres des chorales grégoriennes des
paroisses Saint Jean de Cocody et Sainte Famille de la Riviera II ;
vos prières nous ont toujours accompagnés. Nous prions en retour
pour vous afin que le Seigneur vous fortifie dans la foi et fassent de vous des
messagers de son évangile.
Notre tante KOFFI Virginie ; votre
générosité et votre courtoisie sont sans égale.
Nous avons trouvé chez vous des conditions idéales pour
étudier en toute quiétude et nous vous en serons
éternellement reconnaissants.
KOUASSI Wa Roland et DJIWONOU Jean
Baptiste ; votre soutien ne nous ont jamais fait défaut. Que le
Seigneur vous le rende au centuple.
Nos parents, nous ne saurons jamais vous témoigner notre
amour et notre reconnaissance. Que Dieu vous accorde longue vie et santé
pour que vous puissiez être fiers de nous.
SIGLES ET ABREVIATIONS

An
CEMV CRLP CAP CTA DDT DPM GE
IC
ICRMT INSP
IP
IPR
MII MILDA OCCGE
OMS ORSTOM PCR
PNDS PNLP RBM
: Anopheles
: Centre d'Entomologie Médicale et
Vétérinaire
: Centre de Recherche et de Lutte contre le Paludisme :
Connaissances, Aptitudes et Pratiques
: Combinaison Thérapeutique à base
d'Artémisinine : Dichloro-Diphényl-Trichloroéthane
: Densité Parasitaire Moyenne
: Gouttes Epaisses
: Intervalle de Confiance
: Ivory Coast Relief Medical Team
: Institut National de la Santé Publique
: Indice Plasmodique
: Institut Pierre Richet
: Moustiquaires Imprégnées d'Insecticides
: Moustiquaires Imprégnées de Longue Durée
d'Action
: Organisation de Coopération et de Coordination pour la
lutte contre les Grandes Endémies en Afrique de l'Ouest
: Organisation Mondiale de la Santé
: Office de la Recherche Scientifique et Technique Outre-Mer :
Polymerase Chain Reaction
: Plan National de Développement Sanitaire
: Programme National de Lutte contre le Paludisme
: Roll Back Malaria

6
Liste des figures
Figure 1 : Cycle de vie de Plasmodium
falciparum 7
Figure 2 : Photo d'Anopheles gambiae
12
Figure 3 : Répartition des espèces
du complexe Anopheles gambiae en Afrique 14
Figure 4 : Gîtes larvaires d'Anopheles
gambiae 16
Figure 5 : Cycle biologique du moustique
.19
Figure 6 : Stades pré-imaginaux des
anophèles .20
Figure 7 : Localisation des sites d'étude
28
Figure 8 : Goutte épaisse
35
Figure 9 : Microscope optique
35
Figure 10 : Vue du matériel
utilisé pour les tests de sensibilité 37
Figure 11 : Moustiquaire de type Permanet
37
Figure 12 : Capture des moustiques à
l'aide d'aspirateur 41
Figure 13 : Moustiques disposés dans les
gobelets en plastique 41
Figure 14 :Traitement des moustiquaires
imprégnées d'insecticide (MII) par la
population : a) Nombre
de lavage b) Fréquence du lavage c) Savon
utilisé 59

Liste des tableaux
Tableau I : Description de l'échantillon
de l'étude selon les villages et les aires
de la 1ère enquête
45
Tableau II : Description de
l'échantillon de l'étude selon les villages et les aires
de la 2e enquête
..45
Tableau III : Répartition de
l'échantillon d'étude en fonction de la possession de
Moustiquaires imprégnées par département
pendant la 1ére
enquête 46
Tableau IV
: Répartition des enfants en fonction de la possession de
moustiquaires
Imprégnées par département pendant la
2e enquête 46
Tableau V
: Répartition de la prévalence plasmodiale chez les
enfants de 0 à 14 ans
dans les deux départements pendant la
1ère enquête 48
Tableau VI
: Répartition de la prévalence plasmodiale des enfants
dans les deux
départements pendant la 2e enquête.
49
Tableau VII : Variation des
densités parasitaires moyennes en fonction des tranches
d'âge et des départements pendant la
1ère enquête 50
Tableau
VIII : Variation des densités parasitaires moyennes en fonction
des tranches
d'âge et des départements pendant la 2e
enquête 50
Tableau IX :
Répartition des cas de fièvres dans les départements
d'Adzopé et de
Grand-Bassam lors de la 1ère enquête
52
Tableau X : Répartition des cas de
fièvres dans les départements d'Adzopé et de
Grand-Bassam pendant la 2ème enquête
.52
Tableau XI : Répartition des
accès palustres simple à Plasmodium falciparum
dans les départements d'Adzopé et de Grand-Bassam
dans notre
échantillon de 432 enfants et chez les enfants
présentant
un accès palustre 53
Tableau XII : Répartition des
accès palustres simple à Plasmodium falciparum dans
les
deux départements notre échantillon de 399 enfants
et chez les enfants
Présentant un accès palustre 54
Tableau
XIII : Répartition des Fièvres en général
et des Fièvres palustres lors
des deux enquêtes 56
Tableau XIV :
Répartition des Fièvres selon les enquêtes dans le
département
d'Adzopé 57

8
Tableau XV : Répartition des
Fièvres selon les enquêtes dans le département de
Grand- Bassam 57
Tableau
XVI : pourcentages de mortalité des populations naturelles
d'An. Gambiae
Kisumu dans les 2 départements au test cône - OMS
60
Tableau XVII : Temps de Knockdown en
minutes des populations naturelles
d'An. gambiae Kisumu dans les 2
départements au test cône - OMS 60

Liste des annexes
Annexe I : Fiche d'enquête CAP
Annexe II : Fiche de test de cônes des
moustiques femelles adultes aux insecticides
LISTE DES SIGLES ET ABREVIATIONS iLISTE DES FIGURES
iiLISTE DES TABLEAUX iiiLISTE DES ANNEXES v
SOMMAIRE
INTRODUCTION 1
CHAPITRE PREMIER : GENERALITES 4
1.1. Paludisme 5
1.2. Agents pathogènes 5
1.3. Signes cliniques 8
1.4. Diagnostic biologique 9
1.5. Vecteurs 11
1.6. Moyens de lutte antipaludique 21
1.7. Moustiquaire Imprégnée d'insecticide 23
1.8. Aspects économiques du paludisme 24
CHAPITRE II : PRESENTATION DE LA ZONE D'ETUDE
26
2.1. Critères de choix 27
2.2. Présentation des zones d'étude 27
CHAPITRE III : MATERIEL ET METHODES 33
3.1. Matériel 34
3.2. Méthodes 36
CHAPITRE I: RESULTATS ET DISCUSSION 43
4.1. Résultats 44
4.2. Discussion 61
CONCLUSION ET PERSPECTIVES 65

10
REFERENCES BIBLIOGRAPHIQUES 67
ANNEXES 73

INTRODUCTION


12
Endémie parasitaire majeure, le paludisme est une
maladie tropicale due à des hématozoaires du genre Plasmodium
et transmis par la piqûre d'un moustique, l'anophèle femelle
infectée (Gentilini, 1993). Connu depuis l'antiquité, le
paludisme demeure, par sa fréquence, son ampleur et sa
répartition, l'endémie parasitaire majeure des zones tropicales.
C'est une maladie complexe et mortelle menaçant quelques 3,3 milliards
de personnes dans 109 pays et territoires à travers le monde. En 2000,
entre 350 et 500 millions de cas de paludisme et au minimum 1 million de
décès ont été recensés à travers le
monde, essentiellement chez les enfants africains (OMS, 2008). Quatre vingt dix
pour cent (90%) des cas cliniques du paludisme se situent en Afrique
sub-saharienne.
La situation actuelle est très préoccupante du
fait de la résistance des plasmodies à la plus part des
antipaludiques et le développement de la résistance des
anophèles aux insecticides à base de
pyréthrinoïde.
En Côte d'Ivoire, le paludisme est un problème
majeur de santé publique et de développement, car il
représente la première cause de consultations et
d'hospitalisations dans les formations sanitaires (57% des motifs de
consultations) et la première cause de mortalité chez les enfants
de moins de 5 ans (33% de toutes les causes de mortalité
hospitalière). Concernant les enfants, ils sont victimes d'une à
trois attaques de paludisme par an (RMB, 2008). Il constitue également
la première cause d'absentéisme sur les périmètres
agricoles et en milieu scolaire (Girardin et al., 2004).
La volonté du gouvernement de parvenir à une
maîtrise de la maladie s'est-elle concrétisée par
l'inscription de l'endémie au tableau des maladies prioritaires du Plan
National de Développement Sanitaire (PNDS) et la création du
Programme National de Lutte contre le Paludisme (PNLP) en 1996. Le PNLP a
identifié deux axes stratégiques prioritaires que sont la prise
en charge des cas et la prévention qui se résume en la promotion
de l'utilisation de moustiquaires imprégnées d'insecticides (MII)
et autres matériaux, la chimioprophylaxie chez la femme enceinte et la
gestion du cadre de vie.
L'analyse de la situation de la réponse nationale face
au paludisme révèle entre autres un faible taux de couverture de
la population en moustiquaires imprégnées d'insecticide. En
effet, selon le rapport de l'enquête à indicateurs multiples
(MICS, 2006), seulement 27% des ménages enquêtés
disposaient d'une moustiquaire parmi lesquels 7% possédaient au moins
une MII. Ces taux indiquent que la Côte d'Ivoire est loin d'atteindre
l'objectif fixé par le sommet d'Abuja en Avril 2000 qui est de 60% de
couverture par les populations vulnérables.

Ainsi, tous les efforts concourant à
l'amélioration de la couverture en moustiquaires
imprégnées de longue durée d'action (MILDA) des
populations sont encouragés. C'est donc pour contribuer à
l'amélioration de la couverture en moustiquaires
imprégnées en Côte d'Ivoire que le Centre d'Entomologie
Médicale et Vétérinaire (CEMV) en collaboration avec l'ONG
"Ivory Coast Relief Medical Team (ICRMT)" des Etats-Unis a lancé le
projet « promotion et distribution de moustiquaires
imprégnées d'insecticides en milieu rural en Côte
d'Ivoire». Ce projet a permis de distribuer gratuitement des MILDA aux
populations démunies en milieu rural et de sensibiliser cette population
à l'utilisation effective de ces MILDA dans le cadre de la
prévention du paludisme.
La mise en évidence du bénéfice sanitaire
lié à l'utilisation des MILDA dans la prévention du
paludisme nécessite entre autre, une évaluation d'une part des
indices paludométriques et d'autre part l'efficacité des MILDA,
avant et après la campagne de distribution.
Notre étude a été réalisée
dans les villages d'Ayalo et de N'guessankoi dans le département
d'Adzopé et dans les villages de Gbamblé et d'Azuretti dans le
département de Grand-Bassam.
Elle a pour objectif général d'évaluer la
transmission du paludisme par les indices parasitologiques et cliniques dans
les villages suscités avant et après la distribution de
moustiquaires imprégnées d'une part et l'efficacité
résiduelle de celles-ci d'autres part. Les objectifs spécifiques
sont les suivants :
> estimer le taux de couverture initiale en moustiquaire
chez les enfants de 0 à 14 ans des sites d'étude ;
> déterminer le niveau de prévalence de
l'infestation plasmodiale et du paludisme chez les enfants de 0 à 14 ans
;
> évaluer l'efficacité résiduelle des
moustiquaires imprégnées d'insecticide (MII) après trois
(3) années d'utilisation.
Dans le présent mémoire, nous présentons,
successivement les généralités sur le paludisme, la
méthodologie de travail utilisée, les résultats, les
commentaires. Nous tirerons enfin une conclusion et dégagerons les
perspectives.


14
CHAPITRE PREMIER :
GENERALITES
|

1.1. Paludisme
Le paludisme ou malaria tiré de l'italien
«mal-aria» ou mauvais air, est une parasitose due au
développement et à la multiplication chez l'homme d'un
hématozoaire du genre Plasmodium inoculé à
l'homme par la piqûre d'un moustique femelle du genre
Anopheles.
Le Plasmodium a été décrit pour la
première fois, en 1880, par Alphonse Laveran à Constantine
(Mouchet et al., 2004).
L'épidémiologie implique quatre acteurs notamment
le parasite, l'insecte vecteur, l'homme et l'environnement dans lequel se
trouvent les 3 premiers acteurs.
Le principal mode de transmission se fait par piqûre
d'un moustique vecteur du genre Anopheles (transmission vectorielle).
Cependant, deux autres modes de transmission accidentelle ont été
décrits. Il s'agit de la :
> transmission par transfusion sanguine ;
> transmission trans-placentaire.
Au cours de cette étude, nous ne nous intéresserons
qu'à la transmission vectorielle.
1.1.1. Agents pathogènes
1.1.1.1. Position systématique
Le Plasmodium est un protozoaire parasite
intracellulaire dont plus de 140 espèces infectent les hématies
de leurs hôtes. Sa position systématique d'après Wery
(1995) est la suivante :
- Règne : Animal ;
- Embranchement : Sporozoa ;
- Classe : Coccidea ;
- Sous classe : Haematozea ;
- Ordre : Haemasporidae ;
- Sous ordre : Haemosporina ;
- Famille : Plasmodidae ;
- Genre Plasmodium.
Quatre espèces plasmodiales sont pathogènes pour
l'homme, à savoir :

Plasmodium falciparum (Welch, 1897), espèce la
plus pathogène et responsable des cas mortels. Elle est présente
dans les zones tropicales d'Afrique, d'Amérique latine et d'Asie et est
dominante en Afrique ;

16
> Plasmodium vivax (Grassi et Felleti, 1980),
coexiste avec P.falciparum dans de nombreuses parties du monde et est
présente dans certaines régions tempérées. Les
mélanoafricains sont exempts de ce parasite (Mouchet et al.,
2004). En effet, ils présentent une résistance naturelle due
à l'absence de l'antigène DUFFY sur la paroi de leurs
hématies ;

Plasmodium ovale (Stephens, 1922), principalement
trouvé en Afrique de l'Ouest, ne tue pas mais peut entrainer des
rechutes 4 à 5 ans après la primo-invasion ;

Plasmodium malariae (Laveran, 1881), cette espèce
ne tue pas. Elle provoque un paludisme de type quarte avec des rechutes
à distance allant de 4 à 20 ans après la phase de
primo-invasion (Mouchet et al., 2004).
Une autre espèce, Plasmodium knowlesi, parasite
habituel du singe et morphologiquement identique à P. malariae,
a été décrite comme parasitant l'homme (Singh et
al., 2004).
1.1.1.2. Cycle biologique des plasmodies
Les Plasmodiums sont des protozoaires intracellulaires
de la classe des sporozoaires ayant un cycle dixène c'est-à-dire
qui se déroule chez deux hôtes (Figure1) :
> une phase asexuée ou schizogonie ayant lieu chez
l'homme ;
> une phase sexuée ou sporogonique se déroulant
chez le moustique du genre Anopheles.
a. Phase asexuée chez l'homme
Le cycle du Plasmodium chez l'homme débute par
l'inoculation du sporozoïte (stade infectant pour
l'homme) lors de la piqûre du moustique, qui en une heure passe dans le
foie. Après une phase de division dans les hépatocytes, le
Plasmodium produit des schizontes hépatiques ;
c'est la phase pré-érythrocytaire (avant
l'invasion du globule rouge) ou exo- érythrocytaire
(hors du globule rouge) du parasite. Arrivé à
maturité après 8 à 10 jours, le schizonte éclate,
libérant plusieurs milliers de mérozoïtes
dans la circulation sanguine. Ces mérozoïtes
pénètrent dans les hématies où ils se transforment
en trophozoïtes puis en schizontes
érythrocytaires dont chacun comporte 16 ou 32 noyaux-fils.
Chaque noyau donne un mérozoïte lorsque le globule éclate.
Ce mérozoïte va ensuite parasiter une hématie saine et le
cycle schizogonique recommence. C'est la phase érythrocytaire
du cycle qui dure 48 heures. Plusieurs cycles se succèdent,
mais environ après 1 semaine, certains mérozoïtes se
différencient en gamétocytes sexués
mâles et femelles (Mouchet et al., 2004).
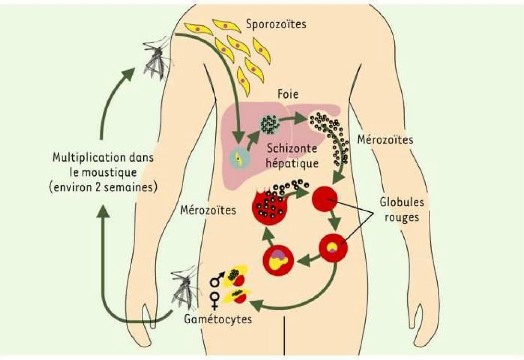

Figure 1 : Cycle de vie du Plasmodium
falciparum chez l'homme (Silvie et al., 2003)

18
b. Phase sexuée chez l'anophèle
Les parasites au stade gamétocytes
ingérés par le moustique lors du repas sanguin, se transforment
en gamètes dans l'estomac de l'insecte. Les
gamètes mâle et femelle, issus des gamétocytes mâle
et femelle, s'unissent pour former un zygote mobile
appelé ookinète. L'ookinète
pénètre la paroi de l'estomac et devient un oocyste
sphérique.
A l'intérieur de l'oocyste, le noyau se divise à
répétition, un grand nombre de sporozoïtes est formé
et l'oocyste grossit. Quand les sporozoïtes sont
complètement développés, l'oocyste se rompt,
libérant les sporozoïtes dans la cavité
générale du corps du moustique. Ils migrent alors vers les
glandes salivaires. La durée du cycle sporogonique varie pour chaque
parasite suivant la température (Mouchet et al., 2004).
1.1.2. Signes cliniques
1.1.2.1. Accès palustre simple
On distingue les accès de primo-invasion et les
accès de la phase d'état à fièvre
périodique. Le tableau clinique des accès de primo-invasion est
celui d'un embarras gastrique fébrile associé à des
céphalées et des myalgies. Une hépatomégalie peut
parfois être retrouvée ; elle est succédée par la
phase d'état avec une périodicité des accès
thermiques. Ces accès palustres sont caractérisés par la
succession de 3 phases à rythme régulier : frissons, chaleur,
sueurs (Brenier-Pinchart et Pelloux, 2005).
.
1.1.2.2. Accès palustre grave
L'OMS a proposé depuis 2000 une définition du
paludisme grave à P. falciparum à partir des
critères cliniques et biologiques ci-dessous :
- Neuropaludisme (score de Glasgow < 9) ;
- Trouble de la conscience (score de Glasgow < 15 et > 9)
;
- Convulsions répétées (< 1/24 heures)
;
- Prostration ;
- Syndrome de détresse respiratoire ;
- Ictère (clinique) ;
- Acidose métabolique (bicarbonate plasmatique < 15
mmol/l) ;
- Anémie grave (Hg < 5 g/dl ou Ht < 15 %) ;
- Hyperparasitémie (> 4 % chez les sujets non immuns ou
> 20 % chez les sujets immuns) ; - Hypoglycémie (< 2.2 mmol/l)
;
- Hémoglobinurie macroscopique ;

- Insuffisance rénale :
o adulte : diurèse < 400 ml/kg/24 h ou
créatinémie > 265 umol/l ;
o enfant : diurèse < 12 ml/kg/24h ou
créatinémie élevée pour l'âge ;
- Collapsus circulatoire (TAS < 50 mmHg avant 5 ans, TAS <
80 mmHg après 5 ans) ; - Hémorragie anormale ;
- OEdèmes pulmonaires (radiologique).
On parle de paludisme grave lorsqu'un seul de ces signes est
présent et avec une goutte épaisse positive (WHO, 2000).
Le neuropaludisme ou paludisme cérébral est une
des formes les plus fréquentes du paludisme grave à
côté de l'anémie sévère. Il se manifeste par
une fièvre (qui peut atteindre 40 °C), des troubles neurologiques
divers pouvant aller de la simple obnubilation au coma et des manifestations
viscérales. L'évolution du paludisme grave dépend de la
rapidité et de la qualité du traitement. Non traité, il
est le plus souvent fatal en deux ou trois jours. Quand il est traité
avec retard, la mortalité peut atteindre 30% à 50% des cas.
Lorsqu'il est rapidement et correctement traité, la guérison
survient sans séquelles (Sene, 2005).
1.1.2.3. Paludisme viscéral évolutif
Il survient chez des sujets insuffisamment prémunis et
exposés à des infestations répétées (enfants
autochtones, adultes expatriés sous chimioprophylaxie insuffisamment
efficace). Il associe une anémie, une dyspnée, une
splénomégalie, une fièvre modérée et un
retard staturo-pondéral chez l'enfant (Brenier-Pinchart et Pelloux,
2005).
1.1.3. Diagnostic biologique
Un diagnostic rapide et un traitement correct des cas sont les
principaux objectifs des programmes de lutte dans les zones d'endémie
palustre car une erreur de diagnostic entraîne une morbidité et
une mortalité accrues. Aussi, l'accès à une
détection rapide et précise des parasites du paludisme contribue
à la promotion d'un usage rationnel des médicaments qui sont de
plus en plus coûteux dans la plus part des zones d'endémie.
Différentes méthodes diagnostiques sont
actuellement disponibles. Ce sont : le diagnostic direct et le diagnostic
indirect.
1.1.3.1. Diagnostic direct : frottis et goutte
épaisse
L'examen microscopique d'un frottis sanguin et d'une goutte
épaisse demeure la méthode de référence en termes
de sensibilité et de spécificité. Il permet de confirmer
la

20
maladie, d'identifier l'espèce plasmodiale en cause et
d'évaluer la parasitémie, ce qui conditionne à la fois le
pronostic et la conduite thérapeutique (Siala et al., 2010).
Le diagnostic biologique en pratique courante est toujours un
diagnostic direct. Iiconsiste à rechercher les formes
asexuées du parasite (trophozoïtes, schizontes, rosaces et
mérozoïtes) dans les hématies. C'est un
diagnostic d'urgence et les résultats doivent être obtenus dans
les 2 heures qui suivent la réception du prélèvement. Les
techniques utilisées sont le frottis sanguin et la goutte épaisse
colorés par la méthode de Giemsa qui teinte le cytoplasme en bleu
et le noyau en rouge et qui permettent respectivement le diagnostic de
l'espèce et la quantification des parasites (Gachot et al.,
2004).
La goutte épaisse réalise une concentration,
elle permet d'examiner une plus grande quantité de sang et donc de
dépister une parasitémie faible. Cependant, l'identification de
l'espèce est difficile. Le délai de plusieurs heures qu'elle
nécessite est un inconvénient pour un diagnostic qui doit
être porté d'urgence. Le frottis, au contraire, peut être
coloré immédiatement et permet un diagnostic précis
d'espèce. L'association frottis-goutte épaisse doit être
systématique. Elle se pratique volontiers sur la même lame lors
d'enquêtes épidémiologiques.
1.1.3.2. Diagnostic indirect
La technique traditionnelle de diagnostic basée sur la
coloration par le Giemsa, permet un diagnostic de certitude mais
nécessite de posséder un microscopiste qualifié. C'est
pour tenter de pallier ces inconvénients que des techniques de
diagnostic indirect ont été mises au point. Ce sont :
> la sérologie (Immunofluorescence indirecte) ;
> la microscopie de fluorescence (Quantitative Buffy Coat)
;
> la recherche d'antigènes (tests diagnostiques rapides
ou TDR) ;
> la recherche d'acides nucléiques spécifiques
(PCR).
Concernant les tests diagnostiques rapides du paludisme,
parfois appelés " bandelettes réactives " ou " systèmes de
diagnostic rapide " détectent les antigènes spécifiques
(protéines) produits par les parasites du paludisme. Ces
antigènes sont présents dans le sang des personnes
infectées, que l'infection soit récente ou non. Le test
diagnostique rapide signale leur présence par un changement de couleur
sur une bandelette de nitrocellulose. Certains de ces tests ne peuvent
détecter qu'une seule espèce (Plasmodium falciparum),
habituellement en repérant la protéine riche en histidine (HRP2)
ou la lactate-déshydrogénase (pLDH) spécifique au
parasite. D'autres détectent une ou plusieurs des trois autres
espèces de parasites du paludisme qui infectent l'homme, en
décelant divers autres antigènes. Les tests

diagnostiques rapides se trouvent couramment dans trois
formats. La forme la plus simple est celle d'une bandelette qui est
placée dans des puits contenant du sang et/ou une solution tampon. La
bandelette de nitrocellulose peut être placée dans une
cassette en plastique ou sur une carte. Les cassettes et les
cartes coûtent souvent plus chères mais sont plus simples
d'utilisation. Les TDR ont une sensibilité (affirmer le paludisme)
excellente car dépassant les 95% (OMS, 2004).
1.1.4. Vecteurs
1.1.4.1. Position systématique
Les vecteurs du paludisme sont des moustiques du genre
Anopheles (Figure 2). Leur position systématique d'après
Rodhain et Pérez (1985), est la suivante :
- Règne : Animal ;
- Embranchement : Arthropodes ;
- Sous-embranchement : Antennates ou Mandibulates ;
- Classe : Insectes ;
- Sous-classe : Ptérygotes ;
- Section : Oligonéoptères ;
- Super ordre : Mécoptéroïdes ;
- Ordre : Diptères ;
- Sous-ordre : Nématocères ;
- Famille : Culicidés ;
- Sous-famille : Anophélinés ;
- Genre Anopheles.
Plus de 140 espèces d'anophèles sont connues
dans la région afrotropicale (Brunhes et al., 1998), mais
seulement une douzaine d'espèces sont impliquées dans la
transmission du paludisme (Fontenille et al., 2005). Ces
espèces appartiennent majoritairement aux complexes Anopheles
gambiae, An. funestus et An. nili. Ces trois complexes
sont les plus représentatifs parmi les espèces anopheliennes
vectrices du paludisme dans la zone ivoiro-voltaïque (AmatRoze et
Rémy, 1982).
Un complexe d'espèces est un ensemble d'espèces
jumelles morphologiquement très voisines voir indifférenciables
et dont l'identification demande souvent l'utilisation de critères
mixiologiques, cytogénétiques, biochimiques ou
moléculaires. Chaque espèce présente des

3 mm

22
Figure 2: Femelle d'Anopheles
gambiae (Anonyme, 2007 a)

comportements, une écologie et des compétences
vectorielles spécifiques (Mouchet et al., 2004).
a. Espèces du complexe Anopheles
gambiae
Ces espèces ont une morphologie très identique.
La détermination à l'intérieur du complexe est
basée sur des critères cytogénétique, biochimique
ou moléculaire. Il comprend sept espèces retrouvées en
Afrique. Ce sont:
- Anopheles gambiae s.s. (Giles, 1902);
- Anopheles arabiensis (Patton, 1905);
- Anopheles bwambae (White, 1985);
- Anopheles melas (Theobald, 1903);
- Anopheles merus (Donitz, 1902);
- Anopheles quadriannulatus A (Theobald, 1911);
- Anopheles quadriannulatus B (Hunt et al.,
1998).
An. gambiae s.s est le vecteur de
référence. Il représente avec An. arabiensis les
meilleurs vecteurs du paludisme ; An. arabiensis moins anthropophile
et plus exophile, possède une capacité vectorielle plus faible
(Coluzzi, 1984).
An. gambiae et An. arabiensis ont une
grande variété de types de gîtes mais les plus communs sont
les collections d'eau temporaires peu profondes et ensoleillées sans
végétation (Akogbeto, comm pers). Leur zone de
recouvrement est très large (Figure 3).
An. melas rencontrée sur les côtes Ouest
est peu anthropophile, endophage mais exophile ; ses larves vivent dans les
eaux saumâtres.
An. merus est son équivalent sur la
côte Est. Ces deux espèces interviennent peu dans la transmission
et assurent par contre la transmission d'un paludisme dit côtier
(Akogbeto, 2000).
An. bwambae et An. quadriannulatus sont
uniquement zoophiles et n'interviennent pas dans la transmission du paludisme
(Mouchet et al., 2004). An. bwambae est rencontrée en
Ouganda tandis qu'An. quadriannulatus a une distribution discontinue
de l'Ethiopie à l'Afrique du Sud.
b. Espèces du complexe Anopheles
funestus
Principal vecteur après An. gambiae et An.
arabiensis, An. funestus est très répandue dans
toute l'Afrique subsaharienne et à Madagascar. Le complexe est
composé de six espèces




24
Figure 3 : Répartition des
espèces du complexe Anopheles gambiae en Afrique (Danis et
Mouchet ,1991), actualisé.

génétiquement différentes dont An.
funestus s.s, An. vaneedeni, An. rivolorum, An. leesoni et An.
parensis (Koekeemoer et al., 2002) et An. rivolorum-like
(Cohuet et al., 2003).
An. funestus est moins abondante en zone de forêt
et beaucoup plus présente en zone de savane (Danis et Mouchet, 1991).
Son développement pré-imaginal se fait dans les gîtes plus
ou moins permanents d'eaux douces profondes et claires ombragées par la
végétation (bordures de lacs, bords creux de rivières). Ce
vecteur est anthropophile et très endophile.
c. Espèces du complexe Anopheles
nili
Les larves d'An. nili vivent dans les anses calmes
des cours d'eau rapides, en bordure du courant. Ce complexe est composé
de quatre espèces à savoir : An. nili (Theobald,
1904), An. somalicus (Mouchet et Gariou, 1961), An. carnevalei
(Brunhes et al.,1998) et
An. ovenegensis (Kengne et al.,2003).
1.1.4.2. Biologie et écologie des
anophèles
a. Bio-écologie des stades
pré-imaginaux
La bio-écologie des stades pré-imaginaux (oeufs,
larves et nymphes) est essentiellement dominée par la nature des
gîtes larvaires (collections d'eau dans lesquelles ont lieu la ponte, les
développements larvaire et nymphale). L'oviposition et le
développement larvaire sont influencés par divers facteurs plus
ou moins interdépendants, ce sont ; la végétation, la
faune prédatrice , les parasites, la turbulence de l'eau,
l'ensoleillement, l'ombre, la température, la tension de surface, le pH,
la salinité, la pollution et les éléments nutritifs. Les
gîtes larvaires d'Anopheles gambiae sont habituellement des
collections d'eau peu profondes, ensoleillées sans ou à faible
végétation souvent temporaires. On peut citer entre autres
gîtes, les flaques d'eau, les casiers rizicoles préparés
pour le repiquage du riz etc (Figure 4).
An. nili est essentiellement localisé le long des
cours d'eau permanents ou semi permanents où se développent ses
larves.
Les larves d'An. funestus se rencontrent dans les
collections d'eau profondes et claires, permanentes ou semi permanentes
à végétation dressée (herbes, riz,
végétation flottante) tels que les mares, les marécages,
les rizières (Robert, 1989).

Figure 4a : Flaque d'eau
Figure 4b : Mare temporaire
Figure 4c : Canaris usagé
Figure 4d : Bas-fond

26
Figure 4 : Quelques gîtes larvaires
(Photos d'archives, CEMV)

b. Bio-écologie des adultes
La biologie des adultes est orientée vers la fonction
de reproduction qui requiert à la fois des comportements et une
nutrition appropriée. L'essentiel de la biologie du stade imaginal
portera sur la femelle en raison de son rôle dans la transmission du
paludisme.
Le mâle non hématophage se nourrit de sucs
végétaux fournisseurs d'éléments
énergétiques. Il se déplace peu et sa
longévité est relativement faible. Son rôle
épidémiologique est de féconder la femelle.
> Comportement trophique
Les femelles se nourrissent essentiellement de sang
nécessaire à la maturation des oeufs. Elles sont attirées
par différents stimuli tels que le CO2, la sueur etc.
dégagés par l'hôte. > Cycle
gonotrophique
C'est la succession des phénomènes
physiologiques qui se produisent entre deux repas de sang successifs. Il
comprend la recherche de l'hôte, la prise du repas de sang, sa digestion
concomitante à la maturation ovarienne, la recherche d'un lieu de ponte
et l'oviposition. La durée du cycle chez les vecteurs d'Afrique
tropicale varie de 2 à 3 jours pour les pares et jusqu'à 5 jours
pour les nullipares.
> Rythme d'activité et lieu de
repos
En général, les anophèles piquent toute
la nuit avec un pic d'activité qui se situe entre 23 heures et 03 heures
(Mouchet et al., 2004). Après le repas de sang qui peut
être pris à l'intérieur (espèces endophages) ou
à l'extérieur des habitations (espèces exophages),
l'anophèle cherche un lieu de repos pour la maturation ovarienne. Les
espèces endophages peuvent se reposer à l'intérieur des
maisons (elles sont dites endophages et endophiles) ou sortir pour les abris
extérieurs (elles sont dites endophages et exophiles). Les
anophèles exophages sont en général exophiles.
> Longévité des
anophèles
Elle conditionne les chances du moustique à atteindre
l'âge épidemiologiquement dangereux. On l'apprécie en
déterminant l'âge physiologique de la population
c'est-à-dire la proportion des femelles pares. Le développement
et la longévité des anophèles dépendent de la
température avec un optimum entre 20 et 30°C pour une durée
de vie de l'ordre de 30 jours.
> Dispersion
Il existe deux modes de dispersion chez les anophèles et
chez les moustiques en général (Akogbeto, comm pers). Il
s'agit de la dispersion active et de la dispersion passive.
La dispersion active ou distance de vol des anophèles
adultes est réduite (environ 2 Km). Ces moustiques ne s'éloignent
généralement pas de leur lieu de reproduction. La dispersion

28
passive est assurée par les vents et les moyens de
transport, ce qui peut donner lieu à une exportation du paludisme en
dehors des zones d'endémie (cas du paludisme d'aéroport).
1.1.4.3. Cycle biologique du développement de
l'anophèle
Le cycle de développement des moustiques se déroule
en deux phases (Figure 5) : > une phase aquatique ou pré-imaginale
;
> une phase aérienne ou imaginale.
a. Phase aquatique
Les anophèles femelles pondent
séparément, à la surface de l'eau, 40 à 100 oeufs,
de 0,5 mm de long munis de flotteurs latéraux (Figure 6a) qui
éclosent 24 à 48 heures selon la température.
L'éclosion de chaque oeuf va donner une larve de stade1 (Figure 6b) qui
après 3 mues devient une larve de stade 4. Les larves, apodes, au repos
sont parallèles à la surface de l'eau grâce aux soies
palmées situées sur la face ventrale de l'abdomen. Elles se
nourrissent de micro-organismes de surface qu'elles attirent vers leur
cavité buccale en provoquant un courant d'eau grâce aux vibrations
des brosses buccales. La durée de vie larvaire dépend de
l'espèce, de la disponibilité du site en nourriture et de la
température.
La mue de la larve de stade 4 ou mue nymphale donne une nymphe
(Figure 6c). Elle a une forme de grosse virgule, très mobile, elle ne
s'alimente pas, mais elle respire l'air atmosphérique grâce aux
trompettes respiratoires situées sur le céphalothorax. Ce stade
dure souvent 48 heures. Il constitue un stade intermédiaire pendant
lequel les organes propres au stade larvaire (appareil buccal filtreur-broyeur,
système digestif de détritiphage) sont détruits suivi de
l'apparition des organes caractéristiques de l'adulte présents
à l'état d'ébauche dans la larve (ailles, pattes, appareil
buccal piqueur-succeur, système digestif d'hématophage). La
durée de la phase aquatique dure en moyenne 7 à 10 jours pour
Anophèle gambiae (Robert et Carnevale, 1984). Elle s'allonge
quant la température diminue et se raccourcit quand elle augmente.


Figure 5 : Cycle biologique du moustique
(Anonyme, 2011)


30
Figure 6 a : OEuf d'anophèle
(Anonyme, 2008)

Figure 6 b : Larve d'anophèle
(Anonyme, 2008)

Figure 6 c : Nymphe d'anophèle
(Anonyme, 2007 b)
Figure 6 : Stades (aquatiques) de
développement des anophèles

b. Phase aérienne
L'adulte émerge à partir de la nymphe et
s'envole aussitôt. L'accouplement est unique chez la femelle ; il a lieu
10 à 24 heures après l'émergence. Ce temps est
nécessaire au durcissement de la cuticule et à la mise en place
des organes génitaux mâles. Les stades adultes jouent un
rôle capital dans la régulation de la population. Les fluctuations
des populations adultes selon la pluviométrie sont davantage le
résultat des chances de survie des oeufs, des larves et des nymphes que
des chances de survie des adultes.
1.1.5. Moyens de lutte contre le paludisme
L'objectif de la lutte est d'éviter la
mortalité, de réduire la morbidité et les pertes
socio-économiques dues au paludisme. Elle consiste à
empêcher la transmission du parasite du vecteur à l'homme en
luttant contre le vecteur d'une part, et d'empêcher le
développement du parasite chez l'homme infesté d'autre part.
1.1.5.1. Lutte contre le parasite
On utilise à cet effet des médicaments actifs sur
le Plasmodium en chimioprophylaxie ou en traitement curatif.
a. Chimioprophylaxie
Elle consiste à prendre un antipaludique pour
prévenir l'expression clinique de la maladie ou ses conséquences
graves chez un individu qui pourrait être infesté. Elle est
réservée en zone d'endémie aux groupes à risques
notamment les femmes enceintes et les sujets non immunisés provenant des
zones indemnes (Mouchet et Carnevale, 1991a).
b. Traitement curatif ou
Chimiothérapie
Il vise à éviter la létalité
paludéenne. La stratégie préconisée est le
traitement du paludisme-maladie, ce qui suppose un diagnostic de certitude de
la présence du Plasmodium dans le sang humain avant le
traitement. Il utilise des antipaludiques actifs contre les stades sanguins
asexués du parasite.
Actuellement, le traitement des accès palustres simples
passe par l'utilisation des combinaisons thérapeutiques à base
d'artémisinine (CTA).

32


34
En Côte d'Ivoire, les CTA préconisées sont
l'association artésunate plus amodiaquine en première intention
et l'association artéméther plus luméfantrine en
deuxième intention.
Pour le paludisme grave, le traitement se fait à base de
quinine ou d'Artéméther injectable.
1.1.5.2. Lutte contre les vecteurs
Elle est essentiellement préventive et a pour objectif
de réduire la densité de la population vectrice à un
niveau très bas ou de limiter le contact homme-vecteur (Robert, 1984 ;
Carnevale et Mouchet, 1990). Elle peut se faire soit au stade aquatique soit au
stade de la vie adulte du moustique.
Les stratégies et les méthodes employées
doivent tenir compte de l'épidémiologie de la maladie, de la
biologie des vecteurs, de la qualification du personnel et des moyens
logistiques disponibles. La lutte antivectorielle fait appel aux
méthodes physiques, chimiques, physico-chimiques et biologiques (Mouchet
et al., 2004).
a. Méthodes physiques
Les méthodes physiques sont basées sur
l'aménagement de l'environnement, la construction des habitats loin des
gîtes larvaires, l'interposition de barrières mécaniques
(grillages aux portes et fenêtres) entre l'homme et les vecteurs,
l'hygiène péri-domestique, etc (Warrell, 1993).
b. Méthodes chimiques
Elles consistent à utiliser des insecticides chimiques
pour le traitement des gîtes larvaires et les pulvérisations
intradomiciliaires. Ces pulvérisations sont réservées aux
habitations qui se trouvent là où le risque de transmission est
maximal, par exemple, à proximité des grands gîtes
larvaires. Dans ce cas, il faudrait que les vecteurs soient endophiles,
sensibles à l'insecticide choisi et que les surfaces des murs soient
facilement traitables. On peut aussi avoir recours à l'utilisation de
bombes insecticides, de serpentins et de répulsifs.
c. Méthodes physico-chimiques
Elles se résument essentiellement en l'utilisation de
moustiquaires imprégnées d'insecticides (MII) qui restent
actuellement le moyen le plus répandu pour prévenir la
transmission du paludisme (OMS, 2006). Des études menées par
l'OMS confirment que les MII peuvent réduire la mortalité
infantile jusqu'au tiers dans les régions impaludées d'Afrique
(RBM, 2006). La mise sur le marché de moustiquaires
imprégnées de longue durée d'action (MILDA) avec un
insecticide efficace pendant 3 à 5 ans a permis de régler les
contraintes liées à la ré-imprégnation des MII.
Leur faible prix de revient par rapport aux autres moyens de lutte permet leur
utilisation à grande échelle. Les contraintes demeurent son
acceptation par certaines populations et le risque de développement de
la résistance aux pyréthrinoïdes chez certaines populations
d'An. gambiae (Akogbeto et Yacoubou, 1999).
+ Historique
Le mot moustiquaire n'est apparu qu'au XIXe siècle,
mais la moustiquaire est d'un usage très ancien. Elle était
déjà connue des Egyptiens qui la fabriquaient à partir de
filet de pêche et l'utilisaient pour se protéger contre les
mouches. Sans doute préfiguraient-elles les moustiquaires
imprégnées d'aujourd'hui, du moins dans leur composante
répulsive. Cléopâtre, dit-on, dormait et sans doute
même voyageait sous moustiquaire. Des récits chinois attestent de
son utilisation régulière, du moins chez les riches, sous la
dynastie Jin au IIIe siècle après Jésus-Christ (Darriet,
2007).
En Afrique, probablement importée par les Arabes au XIe
siècle, la moustiquaire semble également être
utilisée depuis longtemps, du moins par une élite. Dans le rituel
songhaï du XVIe siècle, l'intronisation du roi, qui durait huit
jours, se déroulait sous une moustiquaire. Le coeur de ce royaume se
situait dans le delta intérieur du Niger, justement réputé
pour l'agressivité de ses insectes. Les moustiquaires
imprégnées d'une substance toxique pour les insectes ont
été essayées dès 1930 avec, semble-t-il, un
succès partiel. Des moustiquaires imprégnées de DDT furent
utilisées à une relative grande échelle par les troupes de
la marine américaine pendant la guerre du pacifique, à la fin de
la seconde guerre mondiale.
Les Chinois reproduisirent cette tentative au cours des
années 1960, toujours avec du DDT. C'est à la fin des
années 1970 que l'OMS, sous l'impulsion de deux chercheurs de l'Orstom,
Jacques Hamon et Guy Quelennec, recommanda de remplacer le DDT par un
pyréthrinoïde de synthèse, groupe de substances nouvellement
découvertes comme insecticide utilisable en santé publique. A
l'inverse du DDT, les pyréthrinoïdes présentent l'avantage
d'être peu toxiques pour les mammifères, ce qui favorise leur
emploi à l'intérieur des maisons tout en conservant une grande
efficacité contre les arthropodes et une bonne rémanence.
Dès 1975, des essais expérimentaux
d'imprégnation de tissus entrant dans la confection des moustiquaires
ont été effectués, d'abord avec des
organophosphorés et un carbamate puis avec des
pyréthrinoïdes. Avec l'appui financier de l'OMS, plusieurs essais
de terrain ont été réalisés en Afrique, en
Amérique latine et en Asie. Les tout premiers résultats
entomologiques après imprégnation par trempage de moustiquaires
intactes et trouées, d'emblée probants,
furent obtenus dans une station expérimentale du Centre
Muraz OCCGE (Organisation de Coopération et de Coordination pour la
lutte contre les Grandes Endémies en Afrique de l'Ouest) en 1983 en
Haute-Volta (le Burkina Faso actuel) par une équipe de l'Orstom
dirigée par Pierre Carnevale dont le nom reste incontestablement
lié à la découverte de l'efficacité des
moustiquaires imprégnées. Simultanément, des
résultats cliniques positifs ont été obtenus au Mali. Les
premiers résultats parasitologiques positifs ont été
obtenus peu après en Gambie, Chine, Tanzanie, au Burkina Faso etc
(Darriet, 2007).
+ Moustiquaires Imprégnées d'Insecticide
à Longue Durée d'action (MILDA)
Selon l'OMS, une moustiquaire imprégnée
d'insecticide à longue durée d'action (MILDA) est une
moustiquaire traitée en usine et fabriquée à partir d'un
matériau tissé qui prévoit l'incorporation d'un
insecticide dans les fibres ou sa liaison autour desdites fibres. La
moustiquaire doit conserver son action biologique effective sans nouveau
traitement à la suite d'au moins 20 lavages standards OMS dans les
conditions de laboratoire et après trois ans d'usage conforme aux
recommandations d'utilisation dans des conditions de terrain (OMS, 2009 a).
PermaNet® est une moustiquaire prétraitée
à la deltamethrine à effet prolongé. Son
procédé d'imprégnation est appliqué sur des
moustiquaires en polyester, parfaitement conformes aux spécifications et
aux exigences des organisations internationales dont le domaine d'action est
l'aide et la santé. Elle a été conçue par un
laboratoire de référence internationale appliquant les protocoles
de l'OMS. Grâce aux produits antisalissures appliqués,
PermaNet® n'a pas besoin d'être lavée aussi souvent que
d'autres moustiquaires. C'est une moustiquaire peu polluante puisque la
dilution de l'insecticide dans l'eau est réduite au minimum. Elle est
résistante à l'usure, solide et ininflammable.
d. Méthodes biologiques
La lutte biologique consiste à utiliser les germes
pathogènes, les parasites et / ou les ennemis naturels des larves de
moustiques dans les gîtes de reproduction de ceux-ci, ou des moustiques
mâles stériles (Darriet, 1998). Les poissons larvivores tels que
Gambusia affinis se sont révélés efficaces dans
les foyers circonscrits en zone de paludisme instable où les gîtes
sont limités et facilement repérables.
Outre les poissons larvivores, on peut évoquer
l'utilisation avec succès d'insectes prédateurs
de moustiques
(Toxorynchites, Odonates, Notonectes), de nématodes parasites

(Romanomermis culicivorax), de champignons, de virus et
de bactéries (Bacillus sphaericus et Bacillus
thuringiensis) (Darriet, 1998).
Des lâchers de mâles stériles dans la nature
ont été entrepris mais sans succès (Mouchet et Carnevale,
1991b).
1.2. Aspects économiques du paludisme
Le paludisme affecte la santé et la richesse des pays
et des personnes. Aujourd'hui, en Afrique, on reconnaît que le paludisme
est à la fois une maladie due à la pauvreté et une cause
de pauvreté (RBM, 1999). Les économistes attribuent au paludisme
un déficit de croissance annuelle pouvant atteindre 1,3% dans certains
pays d'Afrique.
Le coût direct du paludisme recouvre les dépenses
individuelles et publiques pour la prévention et le traitement de la
maladie.
Les dépenses individuelles incluent les moustiquaires
imprégnées entre autre d'insecticide, les honoraires
médicaux, les antipaludiques, le transport jusqu'aux services de
santé, le soutien au malade et parfois à un membre de la famille
qui l'accompagne pendant son hospitalisation. Les dépenses publiques
incluent l'entretien des services de santé et des infrastructures
sanitaires, la lutte antivectorielle, l'éducation et la recherche
relevant du secteur public. Dans certains pays fortement impaludés, les
dépenses peuvent représenter jusqu'à 40% des
dépenses de santé publique, 30 à 50% des admissions
hospitalières et jusqu'à 50% des consultations externes (Jampy et
Badji, 2003).
Le coût indirect du paludisme inclut la perte de
productivité ou de revenu associée à la maladie ou au
décès. Il peut s'exprimer en termes de coût des
journées de travail perdues ou de l'absentéisme et de valeur du
travail non rémunéré accompli à domicile par les
hommes et par les femmes. En cas de décès, le coût indirect
comprend le revenu futur escompté du défunt. En Afrique, un
simple accès palustre occasionne 10 jours d'arrêt de travail ou
d'école. On peut estimer à 12 milliards de dollars le coût
imputable au paludisme dans les pays africains, soit 6000 milliards de F CFA
(RBM, 2005).
L'effet du paludisme sur les ressources humaines en Afrique ne
se limite pas à une simple perte de revenu. La douleur et les
souffrances humaines causées par la maladie sont un autre coût
indirect du paludisme, difficile à chiffrer en dollars. Le paludisme
entrave également la scolarisation et le développement social des
enfants en raison de l'absentéisme et des atteintes neurologiques
permanentes et autres conséquences des accès palustres graves.


36
CHAPITRE II :
PRESENTATION DE
LA ZONE D'ETUDE
|

2.1 Critères de choix
Les villages ont été sélectionnés
par l'équipe du CEMV en tenant compte de leur proximité
d'Abidjan, de leur accessibilité en toutes saisons et de l'absence de
centre de santé, de la prévalence élevée du
paludisme et de la disponibilité lors de la première visite de
prise de contact.
2.2. Présentation des zones d'étude
Notre étude a été menée à la
fois dans les départements d'Adzopé et de GrandBassam,
situés au Sud de la Côte d'Ivoire.
2.2.1. Département d'Adzopé
2.2.1.1. Situation géographique
Adzopé est situé à 108 km au Nord
d'Abidjan dans la région de l'Agnéby dont il est le chef lieu de
département (Figure 7). Il est situé entre le 06°10' de
latitude Nord et le 03°87' de longitude Ouest.
Le département d'Adzopé est limité au
Nord par celui de Bongouanou, au Sud par celui d'Alépé, à
l'Est par celui d'Abengourou et à l'Ouest par celui d'Agboville. Ce
département s'étend sur une superficie de 5.190 Km2 et
compte sept chefs-lieux de Sous-préfecture à savoir
Adzopé, Affery, Agou, Akoupé, Assikoi, Bécédi
Brignan et Yakassé Attobrou.
Deux sites d'étude ont été choisis dans la
Sous-préfecture d'Agou : il s'agit des villages de N'guessankoi et
d'Ayalo situés respectivement à 9 et 10 Km d'Agou.
2.2.1.2. Climat, végétation et
hydrographie
Le climat de type Attiéen a quatre saisons. La grande
saison des pluies va de mi-mars à Juin et la petite saison, de
mi-septembre à novembre. La grande saison sèche s'étend de
décembre à mi-mars et la petite saison, de juillet à
mi-septembre. La pluviométrie annuelle est de 1789 mm. Le
département est caractérisé par une
végétation de forêt dense et est traversé par le
fleuve "la Mé". Le relief est constitué de vallées
à fonds plats très larges et souvent marécageuses.
2.2.1.3. Population et activités
socio-économiques
Au recensement de 1998, le département d'Adzopé
comptait 280 346 habitants, soit une densité de 55
habitants/Km2. La population autochtone est constituée
essentiellement

Légende : sites d'étude
Figure 7 : Localisation des sites
d'étude

38

d'Attié. On y rencontre aussi des allogènes et
des étrangers venus de divers horizons. La population est
majoritairement orientée vers l'agriculture dont les produits sont
essentiellement écoulés en direction de la ville d'Abidjan. L'on
y cultive au delà des produits industriels (café, cacao et
hévéa), de la banane, du manioc, de l'igname et des
maraîchers.
2.2.1.4. Particularités des sites
d'études
a. Environnement
Ayalo et N'guessankoi sont électrifiés. Ils sont
situés en bordure d'une route internationale et sont faciles
d'accès en toute saison. Leur habitat est en général de
type traditionnel fait de mur en terre et de toit en paille. Ils sont
entourés, à moins de 200 m, de bas-fonds, lieu
privilégié de la reproduction des moustiques, sources de nuisance
et de pullulation de vecteurs du paludisme.
b. Infrastructures
Les deux villages n'abritent pas de centre de santé et
leurs populations sont contraintes, en cas de maladie, de parcourir environ 6
km pour se rendre dans le centre de santé urbain d'Agou. N'guessankoi
possède une école primaire alors qu'Ayalo n'en possède
pas. Les élèves fréquentent l'école primaire de
N'guessankoi.
c. Activités de lutte antipaludique
Deux activités ont été menées
à savoir l'éducation sanitaire et la distribution de MII.
> L'éducation sanitaire a consisté à
rassurer les populations sur l'innocuité de l'insecticide utilisé
pour l'imprégnation et à donner des conseils d'entretien des
moustiquaires. Le message relatif à l'entretien des MII consiste
à ne pas les laver plus de 4 fois dans l'année, les sécher
à l'ombre après chaque lavage. Le lavage devrait être fait
avec du savon de Marseille à l'exclusion de tout savon traditionnel.
> Dans chaque village, tous les habitants ont
été recensés afin de connaître le nombre exact de
moustiquaires à distribuer dans le cadre d'une couverture totale de la
population. Le nombre de moustiquaires à distribuer dans une famille
donnée équivaut au nombre de groupes de sommeil (personnes
dormant ensemble). Au total, 536 et 664 moustiquaires imprégnées
d'insecticide ont été respectivement distribuées à
Ayalo et à N'guessankoi.

40
2.2.2. Département de Grand-Bassam
2.2.2.1. Situation géographique
Situé à 50 Km à l'Est d'Abidjan,
Grand-Bassam est le chef lieu du département de la région du Sud
Comoé (Figure 7). Il est situé entre 09° 32' de latitude
Nord et le 06° 29' de longitude Ouest, il comprend deux
Sous-préfectures que sont Grand-Bassam et Bonoua.
Le département s'étend sur une superficie de
940,5 Km2 et est limité au Nord par le département
d'Abengourou, au Sud par le Golf de Guinée (Océan Atlantique),
à l'Est par les départements d'Aboisso et d'Adiaké et
à l'Ouest par le district d'Abidjan et le département
d'Alépé.
Azuretti et Gbamblé, villages situés
respectivement à 1 Km et 4 Km de Grand-Bassam ont aussi
été choisis dans ce département pour cette
étude.
2.2.2.2. Climat, végétation et
hydrographie
Le climat, de type attiéen, avec une
pluviométrie abondante, est caractérisé par une grande et
une petite saison des pluies et une grande et une petite saison sèche.
Toute l'année, la ville reçoit des brises de mer chaudes et
humides. La végétation est faite de savane arborée
dominée par des plantations de cocotiers sur tout le cordon littoral.
Situé sur la route côtière, le département de
Grand-Bassam se caractérise par la présence de l'océan
atlantique. Il est arrosé par trois cours d'eau que sont la lagune
Ebrié, la lagune Ouladine qui est un bras de la lagune Ebrié et
le fleuve Comoé. Le relief est fait de sol plat et sableux, des
bas-fonds plus ou moins marécageux avec présence par endroit
d'îlots forestiers.
2.2.2.3. Population et activités
socio-économiques
La population de la ville de Grand-Bassam est estimée
en 2000 à 73.772 habitants vivant sur une superficie de 940,5
Km2, soit une densité moyenne de 79 habitants par
Km2. La population autochtone du territoire Bassamois se compose
d'Abourés et de N'zimas. La population allochtone est composée
majoritairement par contre de malinkés et une forte colonie
étrangère constituée de Béninois, de Togolais et de
Ghanéens. L'activité dominante est la pêche.

2.2.2.4. Particularités des sites
d'étude
a. Environnement et habitat
Azuretti et Gbamblé sont entourés de la lagune
Ebrié, d'un lac et de la mer (Océan Atlantique). Ces trois points
d'eau naturels constituent de permanents lieux de reproduction des moustiques.
En outre, des pirogues usagées abandonnées au bord de ces points
d'eau et contenant de l'eau de pluie pendant plusieurs jours constituent aussi
des gîtes naturels. Pour faciliter l'acquisition d'eau, les populations
ont creusé des puits dans les cours et conservent de l'eau dans des
bassines, les seaux et divers récipients. Ces puits et récipients
ne sont pas généralement couverts et constituent aussi des
gîtes de reproduction des vecteurs du paludisme. Ces villages sont
faciles d'accès en toute saison. Leur habitat est en
général de type traditionnel, fait de murs en bois, de toit en
paille et de clôture faite de palmes de cocotier. L'environnement des
villageois est très insalubre.
Azuretti a deux quartiers relativement modernes, les
quartiers Fanti et N'zima pourvus en eau courante, en électricité
et ayant un habitat moderne. La plupart des habitations sont en brique de
ciment avec un toit en tôle. Les concessions sont ornées de fleurs
dont les aisselles et les vases conservent de l'eau après la pluie. En
perspective de nouvelles constructions, de nombreuses briques ont
été moulées çà et là dans le village.
Les trous de ces briques retiennent aussi de l'eau de pluie et favorisent le
développement des moustiques. Azuretti a aussi cinq autres quartiers
précaires, avec un habitat en bois entouré de palissade faite de
palmes de cocotiers, sans électricité ni eau courante. Il s'agit
des quartiers béninois, ghanéens 1 et 2, alladian et
ébrié où jonchent des pirogues abandonnées, des
bassines et seaux de conservation d'eau.
b. Infrastructures
Les deux villages n'abritent pas de centre de santé et
leurs populations sont contraintes, en cas de maladie, de se rendre à
Grand-Bassam. Contrairement à Azuretti, Gbamblé ne
possédant pas d'école primaire, les élèves
fréquentent celle d'Azuretti.
c. Activités de lutte antipaludique
Les populations d'Azuretti et de Gbamblé ont
bénéficié de la même éducation sanitaire que
celles d'Adzopé. Elles ont reçu respectivement 1136 et 164
moustiquaires imprégnées d'insecticide.


42
CHAPITRE III :
MATERIEL ET
METHODES
|

3.1. Matériel
3.1.1. Matériel biologique
Le Matériel biologique est constitué de gouttes
épaisses (Figure 8) confectionnées à partir de
prélèvements de sang effectués sur les enfants
âgés de 0 à 14 ans et des moustiques de souche Kisumu
élevés à l'insectarium du CEMV.
3.1.2. Matériel technique
3.1.2.1. Matériel de terrain
Le matériel utilisé pour la confection des gouttes
épaisses (GE) (Figure 8) comprend :
- des fiches d'enquête ;
- des thermomètres à mercure ;
- du coton hydrophile ; - de l'alcool à 90° ;
- des gants ;
- des microlances stériles à usage unique ;
- des lames ;
- des étiquettes ;
- une boîte à ranger les lames ;
- du papier lotus ;
- des boîtes de transport des lames.
3.1.2.2 Matériel de laboratoire
Ce matériel comprend :
- des bacs de coloration ;
- une solution tampon phosphate PH 7,2 ;
- du Giemsa ;
- des plaques en bois (pour le séchage des lames) ; - de
l'huile à immersion ;
- des aspirateurs en plastique ;
- des cônes OMS en plastique ;
- des gobelets plastiques ;
- un microscope optique (Figure 9) ;
|
Référence
Goutte de sang Lame de verre
|

44
Figure 8 : Goutte épaisse (Source
: Kouadio)

Figure 9 : Microscope optique (Source :
Kouadio)

- des chronomètres ;
- un marker ;
- du scotch ;
- du coton hydrophile;
- de l'alcool à 90° ;
- des bracelets plastiques (Figure 10) ;
- des moustiquaires (PermaNet® 2.0). Elles sont de couleur
vert foncé, de forme rectangulaire (168×180×150 cm) faites de
polyester et pré-imprégnées de deltaméthrine
à la concentration de 30 g/m2 avec une maille de 25
trous/cm2 (Figure 11).
3.1.2.3. Matériel utilisé pour la
réalisation de l'enquête CAP
Il s'agit :
- d'une fiche d'enquête ; - de crayon ;
- d'une gomme.
3.2. Méthodes
3.2.1. Echantillonnage de la population
3.2.1.1. Effectif de la population
L'effectif de la population d'étude a été
sélectionné de manière raisonnée. Nous avons pris
en compte tous les enfants de 0 à 14 ans. L'effectif retenu est d'au
moins 100 enfants dans les grands villages (Azuretti et N'guessankoi). Dans les
villages où le nombre d'enfants est bas (Gbamblé et Ayalo), nous
avons inclus tous les enfants présents au moment du passage des
enquêteurs.
Le consentement éclairé des parents ou de la
personne en charge de l'enfant est demandé avant toute inclusion dans
l'étude.
3.2.1.2. Récolte des données
démographiques
Les données recueillies auprès de chaque enfant
enquêté, les données recueillies sont les suivantes :
l'âge, le sexe, l'utilisation ou non de moustiquaires non
imprégnées et de moustiquaires imprégnées
d'insecticide.

Aspirateur Chronomètre
Scotch
Gobelet en plastique
Cône OMS
Bracelet en plastique
Toile de moustiquaire

46
Figure 10 : Vue du matériel
utilisé pour les tests de sensibilité (Source : Kouadio)

Figure 11 : Moustiquaire de type
PermaNet® (Source : Kouadio)

3.2.2. Enquêtes parasito-ciniques
Les données parasitologiques et cliniques ont
été collectées à partir prélèvement
d'une goutte de sang pour la confection d'une goutte épaisse (GE) et la
prise de la température axillaire. A cet effet, deux enquêtes
parasito-cliniques ont été réalisées. La
première enquête s'est déroulée de 07 au 21 Octobre
2008 au moment de la distribution des MILDA aux populations. La deuxième
enquête a été réalisée un an après la
distribution des MILDA, du 04 au 13 Décembre 2009.
3.2.2.1. Détection passive des
fièvres
Les fièvres sont détectées passivement dans
la population cible. Cette détection est assurée par un
médecin accompagné d'un infirmier qui a séjourné
dans les villages d'étude. Tous les enfants venus en consultation ont
bénéficié d'une prise de la température avec
remplissage d'une fiche d'enquête et d'un prélèvement d'une
goutte de sang pour la réalisation de la goutte épaisse. Si une
personne présente de la fièvre, le médecin l'examine. S'il
s'agit d'un paludisme simple, il le traite selon les recommandations du
Programme National de Lutte contre le Paludisme (PNLP) avec l'association
artésunate plus amodiaquine.
3.2.2.2. Confection de la goutte épaisse
La confection de la goutte épaisse consiste à
piquer avec un vaccinostyle la pulpe d'un doigt préalablement
nettoyé avec un tampon d'alcool et séché avec du coton. La
première goutte de sang est nettoyée avec un bout de coton sec,
la deuxième goutte de sang est recueillie sur une lame
préalablement étiquetée, numérotée et
essuyée avec du papier Lotus®. A l'aide du coin d'une
autre lame, cette goutte est défibrinée et étalée
sur un diamètre d'environ un centimètre. Après
séchage à l'air libre, nous avons emballé les lames dans
du papier Lotus® puis classé dans une boite
confectionnée à cet effet. Les lames sont ensuite ramenées
au laboratoire d'épidémiologie parasitaire de l'IPR où
elles ont été colorées et lues par un technicien
spécialisé.
3.2.2.3. Techniques de coloration
La coloration des gouttes épaisses a été
faite par série de 20 lames dans une solution de Giemsa à 10%
diluée dans l'eau tamponnée à PH 7,2 (tampon phosphate)
pendant 22 minutes. Elles sont ensuite rincées par trempage dans deux
bains de tampon phosphate.
Les lames sont ensuite séchées en position
inclinée sur des plaques en bois.

48
3.2.2.4. Lecture des gouttes épaisses
Elle est faite au microscope optique au grossissement 1000
(oculaire x 10 et objectif x 100) dans une goutte d'huile à immersion.
Elle permet l'identification de l'espèce parasitaire et la
détermination de la densité parasitaire en fonction de
l'espèce plasmodiale identifiée.
La densité parasitaire a été
déterminée en tenant compte du rapport parasites et leucocytes. A
cet effet, l'opérateur est muni d'un compteur à trois touches ;
la première pour le nombre de champs, la deuxième pour les
leucocytes et la troisième pour les parasites.
La numération des parasites s'est faite sur 200 champs
microscopiques. Sur chaque champ, le nombre de leucocytes (globules blancs) et
le nombre de parasites pour chaque espèce a est compté. Cette
numération est ensuite ajustée au nombre de parasites /uL de sang
en admettant 8000 globules blancs / uL. On procéde de la manière
suivante :
Nombre de trophozoïtes
pour 200 champs
Nombre de parasites par ìL de
sang = X 8000
Nombre de globules blancs
pour 200 champs
Un contrôle de qualité des numérations
parasitaires a été fait sur 10% des préparations prises au
hasard.
3.2.2.5. Détermination des indices
parasitologiques
Les indices parasitologiques sont présentés en
terme d'indice plasmodiale et de densité parasitaire.
> L'indice plasmodique (ou prévalence plasmodiale)
est le pourcentage de porteurs de Plasmodium dans la population
examinée. L'estimation de la prévalence parasitaire chez les
enfants de 2 à 9 ans permet d'évaluer le niveau
d'endémicité palustre d'une région donnée.
L'endémicité est faible lorsque l'indice plasmodique est
inférieur à 10% (Hypo endémicité), elle est
intermédiaire lorsque l'indice plasmodique est compris entre 10 % et 50%
(mesoendémicité). Lorsque l'indice plasmodique est compris entre
50% et 75% le niveau est fort (hyperendémicité). Enfin,
l'endémie est très forte (holoendémicité) lorsque
l'indice plasmodique est supérieur à 75% ;
> La densité parasitaire moyenne (DPM)
représente le nombre moyen de parasites par microlitre de sang. Compte
tenu du fait que les comptages de parasites suivent rarement la loi normale,
nous avons « normalisé » les comptages en les transformant en
logarithme naturel.

Tous nos résultats sont donc exprimés en moyennes
géométriques des densités parasitaires assorties de leur
indice de dispersion (MGDP #177; Ecart-type).
3.2.2.6. Morbidité palustre
Elle est mesurée par la détection passive des
accès palustres chez les enfants de moins de 15 ans avant et
après la distribution des MILDA.
L'accès palustre est défini par l'association d'une
fièvre (température axillaire = 37,5°C) et de
symptômes liés à la fièvre et de la présence
du parasite quelque soit la densité parasitaire.
3.2.3. Enquêtes CAP (connaissances, attitudes et
pratiques) sur l'utilisation des moustiquaires
Une enquête relative à l'utilisation des MII a
est réalisée auprès des habitants des sites
d'étude. Ces personnes sont interrogées sur la base d'un
questionnaire relatif au lavage ou non, à la fréquence de lavage
et au savon utilisé pour le lavage (Annexe 1).
3.2.4. Tests d'efficacité
Les bio-essais visent à contrôler
l'efficacité résiduelle des MII. Pour chaque test, on
prélève à l'aide d'un aspirateur (Figure 12) des
anophèles femelles âgées de 2 à 4 jours repartis en
des lots de 5 à 15 dans des gobelets plastiques (Figure 13). Ces
moustiques sont mis en observation pendant une heure dans des gobelets, afin de
s'assurer qu'il n'y a pas d'anophèles tués ou affaiblis par la
manipulation. Les moustiques affaiblis sont remplacés. On les transfert
ensuite dans les cônes en matière plastique confectionnés
par l'OMS. Le cône est ouvert à la base et perforé au
sommet. On recouvre la base avec la moustiquaire imprégnée
d'insecticide dont on veut déterminer l'efficacité. Cinq
cônes sont placés sur les diverses faces de chaque moustiquaire
à tester. On y introduit par le sommet 5 à 10 anophèles et
on ferme l'orifice avec du coton. Les moustiques sont ainsi mis en contact
pendant trois minutes avec l'insecticide avant d'être retirés et
placés dans des gobelets d'observation en plastique d'environ 250 ml
recouverts par un voile en tulle moustiquaire percé d'un trou. Ce trou
est bouché par du coton. L'action des insecticides induit un effet de
choc ou Knock-down (Kd). Ce Kd est relevé à 5-
10-15-20-25-30-40-50 et 60 minutes. Ensuite, on place un tampon de jus
sucré sur chaque gobelet et on laisse les anophèles en
observation. La lecture de la mortalité s'effectue 24 heures plus tard
(Annexe 2).


50
Figure 12 : Capture des moustiques
à l'aide d'aspirateur pour les tests de rémanence (Source :
Kouadio)

Figure 13 : Moustiques disposés
dans les gobelets en plastique pour les tests de rémanence (Source :
Kouadio)
Un lot témoin de la souche Kisumu est soumis
simultanément aux mêmes conditions de test, sauf qu'il ne sont pas
en contact avec la moustiquaire imprégnée.
Le test est validé lorsque la mortalité dans le
lot témoin est inférieure à 5 % ; en cas de
mortalité comprise entre 5 % et 20 %, elle est corrigée par la
formule d'Abbott (1925). Cependant, si la mortalité dans le lot
témoin est supérieure à 20 %, le test est à
refaire.
La formule d'Abbott (1925) est la suivante :
|
% de mortalité corrigée =
|
(% mortalité observée - % mortalité
témoin) 100
(100 - % mortalité témoin)
|
Selon l'OMS, une moustiquaire répond aux
critères de performance des MIILD si après plusieurs lavages,
elle induit une mortalité > 80% après 24 heures d'observation
et / ou un taux de KD > 95% après 60 minutes d'exposition (WHO,
2005).
3.2.5. Analyse statistique des données

Les données résultant des enquêtes
parasitologiques sont saisies au moyen du logiciel Excel et
transférées pour analyse par le logiciel Epi Info Version 3.4.3.
Pour la comparaison des proportions, nous avons utilisé le test de
CHI-DEUX au seuil á = 5%. La comparaison des moyennes
géométriques des densités parasitaires est
réalisée à l'aide du test de l'écartréduit
au seuil á = 5%.


52
CHAPITRE IV :
RESULTATS ET
DISCUSSION
|

4.1. Résultats
4.1.1. Données démographiques
4.1.1.1. Première enquête
L'enquête a permis de questionner au total 432
enfants âgés de 0 à 14 ans (Tableau I) dont 256
dans le département d'Adzopé (107 à N'guessankoi et 149
à Ayalo) et 176 dans le département de Grand-Bassam (143 à
Azuretti et 33 à Gbamblé). De même, la répartition
des enfants en fonction du sexe montre que le sexe ratio est de 1 (216/216)
pour l'ensemble de l'échantillon : il y a donc autant de garçons
que de filles dans notre échantillon dans les deux départements
étudiés.
4.1.1.2. Deuxième enquête
A la deuxième enquête, 399
enfants ont été retenus (Tableau II) avec un total de
199 enfants dans le département d'Adzopé (99 à
N'guessankoi et 100 à Ayalo) contre 200 enfants dans le
département de Grand-Bassam (30 à Gbamblé et 170 à
Azuretti). La répartition selon le sexe montre qu'il y a 1,4 fille pour
1 garçon.
4.1.2. Couverture en moustiquaires imprégnées
d'insecticide
4.1.2.1. Première enquête
Le taux de couverture en moustiquaires de tout genre dans les
deux départements est de 16,9%. Ce taux est de 38,6%
dans le département de Grand-Bassam et de 2 % dans le département
d'Adzopé (Tableau III).
Dans le département d'Adzopé, aucune
moustiquaire imprégnée d'insecticide n'a été
trouvée. Les moustiquaires imprégnées (4,01 % des
moustiquaires) ont été obtservées dans le
département de Grand-Bassam.
4.1.2.2. Deuxième enquête
La couverture en moustiquaires imprégnées
d'insecticide est de 91% dans l'ensemble, 97% à
Adzopé et 86% à Grand-Bassam (Tableau IV). Le département
d'Adzopé est donc plus couvert en MII que celui de Grand-Bassam
(÷2 = 9,65 et p = 0,0019).
Dans les deux départements, les taux de couverture en
moustiquaires imprégnées ont augmenté.

107 149 256 143 33 176 432
Nombre d'enfants de 0 à 14 ans
N'guessankoi Ayalo Total Azuretti Gbamblé Total
Adzopé Grand-Bassam Total
Sexe
Masculin 49 81 130 67 19
86 216
Féminin 58 68 126 76 14
90 216
Tableau II : Structure
démographique des villages d'étude lors de la
2ème enquête
Adzopé Grand-Bassam Total
|
N'guessankoi
|
Ayalo
|
Total
|
Azuretti
|
Gbamblé
|
Total
|
|
|
Nombre d'enfants de 0 à 14 ans
|
99
|
100
|
199
|
170
|
30
|
200
|
399
|
|
Sexe
|
|
|
|
|
|
|
|
|
Masculin
|
46
|
40
|
86
|
14
|
68
|
82
|
168
|
|
Féminin
|
53
|
60
|
113
|
16
|
102
|
118
|
231
|
54
Tableau I : Structure
démographique des villages d'étude lors de la
1ère enquête
Tableau III : Répartition de
l'échantillon d'étude en fonction de la possession
de
moustiquaires par département pendant
la1èreenquête.
Adzopé Grand-Bassam Total
N'guessankoi Ayalo Total Azuretti Gbamblé Total
Nombre d'enfants 107 149 256
143 33 176 432
de 0 à 14 ans
73
(16,9%)
Possession de Moustiquaires de tout genre Oui
1
(0,1%)
4 5 40 28 68
(2,7%) (2,0%) (28,0%) (84,8%)
(38,6%)
Non 106 145 251
(99,1%) (97,3%) (98,0%)
103
(72,0%)
5
(15,2%)
108
(61,4%)
359
(83,1%)
Possession de MII
Oui 00 00 00 2 1 3 3
(0%) (0%) (0%) (1,4%) (3,0%) (1,7%)
(0,7%)
Non 107 149 256 141 32 173
429
(100%) (100%) (100%) (98,6%) (97,0%)
(98,3%) (99,3%)
Tableau IV : Répartition des
enfants en fonction de la possession de moustiquaires imprégnées
par département pendant la 2ème enquête
Adzopé Grand-Bassam Total
N'guessankoi Ayalo Total Azuretti Gbamblé Total
Oui 94 99 193 148 24 172 365
(94,9%) (99%) (97%) (87,1%) (80%) (86%)
(91%)
Non 05 01 06 22 06 28 34
(5,1%) (01%) (03%) (12,9%) (20%) (14%)
(09%)
TOTAL 99 100 199 170 30 200 399
4.1.3. Prévalence parasitaire
4.1.3.1. Première enquête
Sur les 432 enfants de moins de 15 ans inclus dans
l'étude, 384 sont porteurs de Plasmodium (Tableau V) soit une
prévalence parasitaire globale de 88,9%. Cette
prévalence est de 89,5% dans le département d'Adzopé et de
88,1% dans le département de GrandBassam.
Chez les enfants âgés de 2 à 9 ans, la
prévalence parasitaire globale est de 87,9%. En
fonction des départements, cette prévalence est de 89% à
Adzopé et de 86,2% à GrandBassam.
4.1.3.2. Deuxième enquête
Sur les 399 enfants de moins de 15 ans inclus dans notre
étude, 391 enfants sont porteurs de P. falciparum soit une
prévalence parasitaire globale de 98 % (Tableau
VI). Cette prévalence est de 96 % dans le
département d'Adzopé et 100 % dans le département de
Grand-Bassam.
4.1.4. Densité parasitaire
4.1.4.1. Première enquête
La densité parasitaire moyenne globale est de
259 parasites / uL. En considérant les
départements, elle est de 273 et de 239 respectivement à
Adzopé et à Grand-Bassam (Tableau VII).
4.1.4.2. Deuxième enquête
La densité parasitaire moyenne globale est de
214 parasites / uL. En considérant les
départements, elle est de 207 et de 200 respectivement à
Adzopé et à Grand-Bassam (Tableau VIII).
Nous constatons qu'il y a eu une baisse significative de la
densité parasitaire moyenne (DPM) de la première à la
seconde enquête (p=0,0117)
Tableau V : Répartition de la
prévalence plasmodiale chez les enfants de 0 à 14 ans dans les
deux départements pendant la 1ère enquête
|
N'guessankoi
|
Adzopé
Ayalo
|
Total
|
Azuretti
|
Grand-Bassam Gbamblé
|
Total
|
Total
|
|
Nombre d'enfants de 0 à 14 ans
|
107
|
149
|
256
|
143
|
33
|
176
|
432
|
|
Prévalence de l'infection à P.f ( %)
|
97,2
|
83,9
|
89,5
|
85,3
|
100
|
88,1
|
88,9
|
|
(IC 95%)
|
(94,1-100,3)
|
(78,0-89,8)
|
(85,7-93,2)
|
(79,5-91,1)
|
(89,4-100)
|
(83,3-92,9)
|
(85,9-91,9)
|
|
Prévalence de l'infection à P.f
chez les 2 à 9 ans ( %)
|
97,4
|
82,9
|
89,0
|
83,3
|
100
|
86,2
|
87,9
|
|
(IC 95%)
|
(93,8-100,9)
|
(75,7-90,1)
|
(84,4-93,5)
|
(75,6-91,0)
|
(82,4-100)
|
(79,7-92,7)
|
(82,9-92,9)
|
P.f : Plasmodium falciparum IC : Intervalle de
confiance
Tableau VI : Répartition de la
prévalence plasmodiale des enfants dans les deux départements
pendant la 2ème enquête
|
N'guessankoi
|
Adzopé Ayalo
|
Total
|
Azuretti
|
Grand-Bassam Gbamblé
|
Total
|
Total
|
|
Nbre enfants de 0 à 14 ans
|
99
|
100
|
199
|
170
|
30
|
200
|
399
|
|
Prévalence de l'infection à Pf
|
|
|
|
|
|
|
|
|
Nombre de GE (+)
|
95
|
96
|
191
|
170
|
30
|
200
|
391
|
|
Prévalence de l'infection à P.f
|
96,0
|
96,0
|
96,0
|
100 ,0
|
100,0
|
100,0
|
98,0
|
|
(IC 95%)
|
(92,1-99,9)
|
(92,2-99,8)
|
(93,3-98,7)
|
-
|
-
|
-
|
(96,6-100,4)
|
P.f : Plasmodium falciparum IC : Intervalle de confiance
GE : goutte épaisse
Tableau VII : Variation des
densités parasitaires moyennes dans les départements
d'Adzopé et de Grand-Bassam pendant la 1ère
enquête.
Adzopé Grand-Bassam Total
N Positifs DPM IC 95% N Positifs DPM IC 95% N
Positifs DPM IC 95%
256 229 273 (242-309) 176 155 239
(211-271) 423 384 259 (237-283)
N : effectif DPM : densité parasitaires moyennes IC :
intervalle de confiance
Tableau VIII : Variation des
densités parasitaires moyennes dans les départements
d'Adzopé et de Grand-Bassam pendant la 2eme enquête.
Adzopé Grand-Bassam Total
N Positifs DPM IC 95% N Positifs DPM IC 95% N
Positifs DPM IC 95%
199 191 207 (169-253) 200 200 221
(194-251) 399 391 214 (190-241)
N : effectif DPM : densité parasitaires moyennes IC :
intervalle de confiance
4.1.5. Morbidité
4.1.5.1. Fièvres en général
a- Première enquête
Sur 432 sujets infantiles, 96 enfants soit 22,2%
ont une température axillaire supérieure ou égale
à 37,5°C.
L'analyse selon les départements montre que 76 (29,7 %)
et 20 (11,4%) enfants sont fébriles respectivement dans les
départements d'Adzopé et de Grand-Bassam (Tableau IX). Les
enfants de Grand-Bassam sont moins touchés que ceux d'Adzopé
(÷2 = 20,26 et
p ? 0,00000).
b- Deuxième enquête
Sur les 399 sujets infantiles, 53 enfants soit 13,3%
sont une température axillaire supérieure ou
égale à 37,5°C.
En considérant les départements, l'analyse
révèle que 31(15,6%) et 22(11%) enfants sont fébriles
respectivement à Adzopé et à Grand-Bassam (Tableau X).
Les enfants de Grand-Bassam sont autant touchés que ceux
d'Adzopé (÷2 =1,81 et p = 0,17793).
4.1.5.2. Fièvres palustres
a- Première enquête
La prévalence du paludisme chez les enfants est de
19,7 % (85/432). Dans le département d'Adzopé,
nous observons une prévalence de 26,2%. Dans le département de
Grand-Bassam, la prévalence du paludisme est de 10,2%. L'analyse
statistique de l'infection selon le département montre que Adzopé
est significativement plus touché que Grand-Bassam (÷2 =
16,7 et P < 0,00001). Sur 96 enfants fébriles, 85 ont le paludisme
soit une prévalence de 88,5% (Tableau XI).
b- Deuxième enquête
La prévalence du paludisme est de 12%
avec des taux de 13,1% et 11,0% respectivement à Adzopé
et à Grand-Bassam.
La prévalence globale des fièvres palustres
parmi l'ensemble des enfants fébriles est de 90,6%.
L'analyse selon les départements indique une proportion de 83,9 % et de
100 % respectivement à Adzopé et à Grand-Bassam (Tableau
XII).
Tableau IX: Répartition des
fièvres chez les enfants de moins de 15 ans dans les départements
d'Adzopé et de Grand-Bassam pendant de la 1ère
enquête
Adzopé Grand-Bassam Total
|
N'guessankoi
|
Ayalo
|
Total
|
Azuretti
|
Gbamblé
|
Total
|
|
|
Nombre d'enfants
|
107
|
149
|
256
|
143
|
33
|
176
|
432
|
|
Nombre de fièvre
|
22
|
54
|
76
|
20
|
0
|
20
|
96
|
|
%
|
20,6
|
36,2
|
29,7
|
14,0
|
0,0
|
11,4
|
22,2
|
|
IC 95%
|
(12,9-28,3)
|
(28,5-43,9)
|
(24,1-35,3)
|
(8,3-19,7)
|
(0,0-10,6)
|
(6,7-16,1)
|
(18,3-26,1)
|
IC : intervalle de confiance
Tableau X : Répartition des
fièvres chez les enfants de moins de 15 ans dans les départements
d'Adzopé et de Grand-Bassam pendant la 2ème
enquête
Adzopé Grand-Bassam Total
|
N'guessankoi
|
Ayalo
|
Total
|
Azuretti
|
Gbamblé
|
Total
|
|
|
Nombre d'enfants
|
99
|
100
|
199
|
170
|
30
|
200
|
399
|
|
Nombre de fièvre
|
15
|
16
|
31
|
19
|
3
|
22
|
53
|
|
%
|
15,2
|
16,0
|
15,6
|
11,2
|
10,0
|
11,0
|
13,3
|
|
IC 95%
|
(8,1-22,3)
|
(8,8-23,2)
|
(10,6-20,6)
|
(6,5-15,9)
|
(-0,7-20,7)
|
(6,7-16,7)
|
(10,0-16,6)
|
Tableau XI : Répartition des
accès palustres simples à Plasmodium falciparum dans les
départements d'Adzopé et de Grand-Bassam chez les enfants
âgée de 0 à 14 ans présentant un accès
palustre pendant la 1ère enquête.
Adzopé Grand-Bassam Total
N'guessankoi Ayalo Total Azuretti Gbamblé Total
Nombre d'enfants de 0 à 14 ans
Nombre de cas de paludisme simple %
(IC95%)
nombre de cas de fièvres
Nombre de cas de paludisme simple
%
(IC95%)
|
107
|
149
|
256
|
143
|
33
|
176
|
432
|
|
22
|
45
|
67
|
18
|
00
|
18
|
85
|
|
20,6
|
36,2
|
26,2
|
14,0
|
0,0
|
10,2
|
19,7
|
|
(12,9-28,3)
|
(28,5-43,9)
|
(20,8-31,6)
|
(8,3-19,7)
|
(0,0-10,6)
|
(5,7-14,7)
|
(15,9-23,5)
|
|
22
|
54
|
76
|
20
|
20
|
96
|
96
|
|
22
|
45
|
67
|
18
|
00
|
18
|
85
|
|
100
|
83,3
|
88,2
|
90,0
|
0,0
|
90,0
|
88,5
|
|
(84,6-100)
|
(73,4-93,2)
|
(80,9-95,5)
|
(76,9-103,1)
|
(0,0-10,6)
|
(76,9-103,1)
|
(82,1-94,9)
|
IC : intervalle de confiance
Tableau XII : Répartition des
accès palustres simple à Pf dans les deux
départements
chez les enfants âgée de 0 à 14 ans
présentant un accès palustre pendant la 2ème
enquête
Adzopé Grand-Bassam Total
N'guessankoi Ayalo Total Gbamblé Azuretti Total
nombre de cas de fièvres
Nombre d'enfants de 0 à 14 ans Nombre de cas de paludisme
simple %
(IC95%)
99
|
100
|
199
|
30
|
170
|
200
|
399
|
|
13
|
13
|
26
|
3
|
19
|
22
|
48
|
|
13,1
|
13,0
|
13,1
|
10,0
|
11,2
|
11,0
|
12,0
|
|
(6,5-19,7)
|
(6,4-19,6)
|
(8,4-17,5)
|
(-0,7-20,7)
|
(6,5-15,9)
|
(6,7-15,3)
|
(8,8-15,2)
|
15 16 31 3 19 22 53
Nombre de cas de paludisme simple %
(IC95%)
13
|
13
|
26
|
3
|
19
|
22
|
48
|
|
86,7
|
81,3
|
83,9
|
100
|
100
|
100
|
90,6
|
|
(69,5-103,9)
|
(62,2-100,4)
|
(71,0-96,8)
|
-
|
-
|
-
|
(82,8-98,4)
|
IC : Intervalle de confiance
4.1.6. Etude des Morbidités générales
et palustres selon les enquêtes
4.1.6.1. Répartition des cas de fièvres
selon les enquêtes
L'analyse selon les enquêtes indique que les enfants de
la deuxième enquête sont significativement moins fébriles
que ceux de la première (÷2 =11,27 et p = 0,00079). De
même, le paludisme sévit faiblement chez les enfants de la seconde
enquête que chez ceux de la première (Tableau XIII).
4.1.6.2. Répartition des cas de fièvres
selon les départements et selon les enquêtes
A Adzopé, la proportion globale d'enfants
fébriles est de 23,5 %. Les données selon les enquêtes
indiquent que 29,7 % et 15,6 % ont fait des fièvres respectivement
à la première et à la seconde enquête (Tableau
XIV).
Les enfants fébriles de la première
enquête sont significativement plus nombreux que ceux de la
deuxième (÷2 =12,4 et p = 0,0004).
Les cas de paludisme s'élèvent à une
proportion de 20,4% dans les deux enquêtes avec 26,2% et 13,1%
respectivement à première et deuxième enquête. Les
enfants de la deuxième enquête ont moins fait la maladie que ceux
de la première (÷2 =11,82 et p=0,0006).
A Grand-Bassam, la fièvre générale
représentait 11,2% des cas. En considérant les enquêtes, ce
taux est de 11,4% pour la première enquête contre 11 % à la
seconde (Tableau XV). Les enfants recensés à la première
enquête sont autant fébriles que ceux de la deuxième
enquête (÷2 = 0,012 et p=0,911).
La prévalence globale des fièvres palustres est
de 10,6 %. Les données selon les enquêtes donnent des taux de 10,6
% et 11 % respectivement à la première et à la seconde
enquête. La prévalence n'a donc pas varié d'une
enquête à l'autre (÷2 =0,058 et p=0,808).
Tableau XIII : Répartition des
fièvres en général et des fièvres palustres lors
des deux enquêtes chez les enfants âgée de 0 à 14
ans
|
Enquête 1
|
Enquête 2
|
Total
|
P
|
|
Nombre d'enfants
|
432
|
399
|
831
|
|
|
Nombre de cas
de fièvre en général
|
96
|
53
|
149
|
|
|
%
|
22,2
|
13,3
|
17,9
|
0,00079
|
|
IC95%
|
(18,3-26,3)
|
(10,0-16,6)
|
(15,3-20,5)
|
|
|
Nombre de cas
de fièvres palustres
|
85
|
48
|
133
|
|
|
%
|
19,7
|
12,0
|
16,0
|
0,0026
|
|
IC95%
|
(16,0-23,4)
|
(8,8-15,2)
|
(13,5-18,5)
|
|
IC : intervalle de confiance
Tableau XIV: Répartition
des fièvres chez les enfants âgée de 0 à 14 ans
dans
|
le département d'Adzopé
|
|
|
|
|
Enquête 1
|
Enquête 2
|
Total
|
P
|
|
Nombre d'enfants
|
256
|
199
|
455
|
|
|
Nombre de cas
de fièvres en général
|
76
|
31
|
107
|
|
|
%
|
29,7
|
15,6
|
23,5
|
0,0004
|
|
IC95%
|
(21,6-32,7)
|
(10,6-20,16)
|
(19,6-27,4)
|
|
|
Nombre de cas
de fièvres palustres
|
67
|
26
|
93
|
|
|
%
|
26,2
|
13,1
|
20,4
|
0,0006
|
|
IC95%
|
(20,8-31,6)
|
(8,4-17,8)
|
(17,6-24,1)
|
|
IC : Intervalle de confiance
Tableau XV : Répartition des
fièvres chez les enfants âgée de 0 à 14 ans dans
|
le département de Grand-Bassam
|
|
|
|
Enquête 1
|
Enquête 2
|
Total
|
P
|
|
Nombre d'enfants
|
176
|
200
|
376
|
|
|
Nombre de cas
de fièvres en général
|
20
|
22
|
42
|
|
|
%
|
11,4
|
11,0
|
11,2
|
0,911
|
|
IC95%
|
(6,7-16,1)
|
(6,7-15,3)
|
(8,0-14,4)
|
|
|
Nombre de cas
de fièvre Palustres
|
18
|
22
|
40
|
|
|
%
|
10,2
|
11,0
|
10,6
|
0,808
|
|
IC95%
|
(5,7-14,7)
|
(6,7-15,3)
|
(7,1-13,7)
|
|
|
IC : intervalle de confiance
|
|
|
|
|
4.1.7. Enquête CAP
L'enquête a permis de recenser 75 et 63 personnes
respectivement à Adzopé et à Grand-Bassam soit un total de
138 personnes.
La proportion globale des enquêtés ayant
déjà lavé leurs moustiquaires est 82,1 %
avec un taux de 76, 2% à Adzopé contre 88% à
Grand-Bassam (Figure 13 a). Concernant le rythme de lavage, seuls 19,3 %
respectent les normes de l'OMS avec 13 ,6 % et 25 % respectivement à
Adzopé et à Grand-Bassam (Figure 13 b).
L'analyse révèle que plusieurs types de savons
sont utilisés pour le lavage des MII. Nous retenons que 64,4%
des MILDA sont lavées avec des savons qui respectent les normes
OMS (Figure 13 c).
4.1.8. Tests d'efficacité
Un total de 2665 moustiques femelles d'An. gambiae
Kisumu a été testé dans les 2 départements soit
1396 à Grand-Bassam et 1269 à Adzopé. Ces moustiques sont
testés à la deltametrine avec 182 moustiques témoins
à Grand-Bassam et 222 à Adzopé. Les taux de
mortalité chez les témoins étant supérieur à
5% (6,3% et 6,6%), la correction par la formule d'Abott a été
appliquée. Le taux de mortalité obtenu après correction
(Tableau XVI) à GrandBassam (91,87%) est significativement faible par
rapport à celui obtenu à Adzopé (99,91%)
(÷2 = 104,6 ; ddl = 1 ; p = 0,00000).
Les taux moyen du KD à 60 mn (KD 60) obtenus sont de 99
,76 et 93,27 % respectivement à Adzopé et à Grand
Bassam.

Tableau XVI : Pourcentages de
mortalité des populations naturelles d'An. gambiae
Kisumu dans les 2 départements au test cône - OMS.
|
Adzopé
|
Grand-Bassam
|
|
Témoins
|
222
|
182
|
|
Morts après 24h
|
14
|
12
|
|
Vivants après 24h
|
208
|
170
|
|
Mortalité (%)
|
6,3
|
6,60
|
|
Total testé
|
1269
|
1396
|
|
Morts après 24h
|
1268
|
1290
|
|
Vivants après 24h
|
1
|
106
|
|
Mortalité (%)
|
99,92
|
92,41
|
|
Mortalité corrigée (%)
|
99,91
|
91,87
|
Tableau XVII : Temps de Knockdown en
minutes des populations naturelles d'An. gambiae
|
Kisumu dans les 2 départements au test cône -
OMS.
|
|
|
Départements
|
Effectifs
|
KdT 50 (mn)
|
KdT 95 (mn)
|
Kd 60 (%)
|
|
Adzopé Grand-Bassam
|
1269
1396
|
2,55
5,6
|
9,78
45,5
|
99,76
93,27
|
Taux du knockdown à 60 mn
4.2. DISCUSSION
4.2.1. Taux de couverture en moustiquaires
Le taux initial d'enfants ayant dormi sous une moustiquaire
avant la distribution moustiquaires imprégnées est de 16,7%. Il
est identique au taux obtenu pour les enfants de moins 5 ans lors de
l'enquête à indicateurs multiples réalisée en 2006
qui a décrit un taux de 17,1% (MICS, 2006). Le taux le plus
élevé est observé dans le département de
Grand-Bassam avec un taux de 38,6% contre un taux de 8,0% observé dans
le département d'Adzopé.
Parmi ces moustiquaires, seulement 4 % sont
imprégnées d'insecticide. Nos résultats ne
différent pas de celui de l'enquête à indicateurs multiples
qui avait mis en évidence un taux de couverture en moustiquaires
imprégnées d'insecticide de 3%.
Dans le département d'Adzopé, aucune des
moustiquaires utilisées n'étaient imprégnée
d'insecticide. Les seules moustiquaires imprégnées (4%)
observées proviennent uniquement du département de Grand-Bassam.
Ce taux de couverture en moustiquaire relativement élevé du
département de Grand-Bassam par rapport à celui d'Adzopé
pourrait s'expliquer par sa proximité d'Abidjan (capitale
économique).
Le taux de couverture globale en moustiquaires
imprégnées à longue durée d'action (MILDA) un an
après leur distribution est de 91%. Le taux le plus élevé
est observé dans le département d'Adzopé avec un taux de
97% contre un taux de 86% observé dans le département de
Grand-Bassam. Ces taux sont largement supérieurs au taux minimum
recommandé par l'OMS dans les essais contrôlés et
randomisés (OMS, 2009 b). En effet, selon l'OMS, pour obtenir une
protection des moustiquaires en matière de lutte antipaludique, il faut
un taux de couverture de la population d'au moins 80%. Ainsi, les taux de
couverture enregistrés au cours de cette étude se situant au
delà des normes OMS, nous pouvons affirmer que la distribution de MILDA
initiée par l'ONG ICMRT et le CEMV a été bien menée
et suivie.
Ce fort taux de couverture en MILDA du département
d'Adzopé par rapport à celui de Grand -Bassam s'explique par le
fait que certaines personnes ayant reçu les moustiquaires ont soit,
quitté les villages au profit de la ville (Grand-Bassam) soit les ont
remis à leurs parents vivant en ville.
4.2.2. Prévalence parasitaire.
La seule espèce plasmodiale rencontrée avant et
après la distribution et la pose de moustiquaires est Plasmodium
falciparum. Cela s'explique par deux faits :
- c'est la principale espèce rencontrée en
Côte d'Ivoire (Assi et al., 2004 ; Tia et al., 2006)
;
- nous avons effectué uniquement des gouttes
épaisses et non des frottis sanguins. En effet, c'est le frottis sanguin
qui permet l'identification exhaustive des espèces plasmodiales.
La prévalence parasitaire globale avant et après la
distribution des MII varie de 88,9 % à 98%. On constate une augmentation
de 9,3 % de la prévalence.
En considérant les départements et les
enquêtes, nous constatons que la prévalence est passée de
89,5 % à 96 % soit une augmentation de 6,7 % à Adzopé. A
Grand-Bassam, la prévalence est passée de 88,9 % à 100 %,
soit une augmentation de 11,5 %.
Nos données indiquent que l'utilisation des MII dans
nos zones d'étude n'a aucun impact sur la prévalence de
l'infestation. Cette situation a été évoquée par
Mouchet et al (2004) qui affirmaient que dans beaucoup d'essais
où les MII ont été distribuées aux
communautés, la prévalence parasitaire n'a pas été
sensiblement abaissée. De même, Assi (2001) affirmait que les MII
n'influençaient pas les taux de prévalence des infestations
à P. malariae.
Dans la 1ère enquête, nous avons
observé que les enfants de 2 à 9 ans ont un indice plasmodique de
89% et de 87% respectivement dans les départements d'Adzopé et de
GrandBassam. Ainsi, nos sites d'étude sont des zones
d'holoendémicité palustre. Nos travaux corroborent l'ensemble des
observations faites en zone de forêt de Côte d'Ivoire par Bleu
(2000). Ces prévalences en zones forestière (Adzopé) et
lagunaire (Bassam) de la Côte d'Ivoire sont plus élevées
que celles observées par Assi (2001) en région de savane, au Nord
de la Côte d'Ivoire qui varient de 49% à 68%. Cela pourrait
s'expliquer par la faible maîtrise de l'utilisation des moustiquaires
dans nos sites d'étude.
4.2.3. Morbidité
Au cours des deux enquêtes réalisées, sur
un échantillon de 831 enfants, 149 (17,9%) ont une température
axillaire supérieure ou égale à 37,5°C; avec 107
enfants fébriles soit 23,5% ont été recensé
à Adzopé et 42 enfants fébriles (11,2%) dans le
département de GrandBassam. Ainsi, environ 1 enfant sur 6 a
présenté une fièvre lors de nos passages.
Toutes les fièvres n'étant pas d'origine
palustre, nous avons défini les fièvres attribuables au paludisme
comme la présence d'une hyperthermie (température axillaire =
37,5°C) associée à la présence de P.
falciparum. La prévalence globale du paludisme est de 16%
avec 20,3% et 10,6% respectivement dans les départements
d'Adzopé et de Grand-Bassam.
En considérant les enfants fébriles, la
prévalence du paludisme est de 89,3%.
Dans le département d'Adzopé, environ 9
fièvres sur 10 sont attribuables au paludisme ; et dans le
département de Grand-Bassam, environ 10 fièvres sur 10 sont
d'origine palustre. Le paludisme représente ainsi la première
cause de fièvre chez les enfants de moins de 15 ans. Ces
résultats montrent que le paludisme est un véritable
problème de santé publique au Sud de la Côte d'Ivoire.
En raisonnant selon les enquêtes, nous avons
observé:
- dans le département d'Adzopé, une baisse
significative des fièvres en général et des fièvres
palustres en particulier de la première à la deuxième
enquête. Ce qui confirme l'impact sanitaire de l'utilisation des MILDA
avec une réduction significative de la densité parasitaire
moyenne et des fréquences des accès palustres. Cela s'explique
par le taux de couverture élevé dans cette localité
associé au respect assez strict du mode d'utilisation du meilleur moyen
de lutte du moment contre le paludisme. Ces résultats corroborent les
observations de Henry et al (2005) qui ont enregistré une
réduction de 50% des fièvres palustres chez les enfants
protégés par des MILDA dans la région de savane au Nord de
la Côte d'Ivoire ;
- dans le département de Grand-Bassam, une
invariabilité des résultats. Cela s'explique par une mauvaise
utilisation des MII.
4.2.4. Test d'efficacité
Les bio-essais ont permis de juger l'efficacité
opérationnelle des MII après 3 ans
d'utilisation. Nos résultats montrent une
efficacité de longue durée (3-4 ans) des moustiquaires
pré-imprégnées (PermaNet®) sur la souche Kisumu de
référence sensible.
En effet, les moustiquaires imprégnées des deux
zones ont un effet létal acceptable au regard des normes
d'efficacité de l'OMS (mortalité >80%) avec 91,87 % à
Grand-Bassam et
99,91 % à Adzopé.
Ces résultats concordent avec ceux de Lindblade et
al. (2005) au Kenya et Kilian et al. (2008) en Ouganda
qui ont montré une efficacité des MII (PermaNet®)
au-delà de 2 et 3 ans avec des taux de mortalité
supérieurs à 80%. Carnevale et al. (1998) , en
Côte d'Ivoire ont affirmé par contre que les MII conservaient leur
effet létal sur plus de 3 ans avec 100% de mortalité.
Toutefois, en tenant compte du pourcentage de Kd obtenu (>
95%), seules les moustiquaires distribuées à Adzopé
présentent une efficacité résiduelle après 3 ans
d'utilisation tandis que celles de Grand-Bassam (93,3%) est proche de la norme
de l'OMS. Le faible taux relatif de Kd observé à Grand Bassam par
rapport à celui d'Adzopé s'explique par le fait qu'à
Grand- Bassam, 54,5 % de la population utilisent lors du lavage des
moustiquaires
des savons (kabakourou, OMO etc..) qui ont un impact
négatif sur l'efficacité de celles-ci. En outre, ces populations
qui, en majorité, dorment à la belle étoile du fait de la
chaleur, y laissent en permanence leurs moustiquaires dressées toute la
journée parfois sous la pluie et le soleil.
Au total, après 4 ans d'utilisation, les MILDA
testées conservent leur efficacité même si l'on constate
une légère baisse de celles-ci à Grand-Bassam par rapport
au pourcentage de KD. La conservation relative de cette efficacité est
certainement due aux dispositions préalablement prises par les donateurs
avant la distribution des MILDA: distribution active, aide à la fixation
des moustiquaires dans les ménages, éducation sanitaire des
populations locales sur la gravité du paludisme et les vertus des MILDA,
formation à l'entretien de cellesci (rythme de lavage, séchage),
contrôle de l'utilisation effective par les agents de santé
communautaire (ASC) (Tia, comm pers). Il est important d'adopter cette
stratégie pour tout programme de distribution des MILDA afin d'en
assurer l'efficacité et la "pérennité".
CONCLUSION
ET
PERSPECTIVES
|
A l'issue de ces travaux réalisés dans les
départements d'Adzopé et de Grand-Bassam, nous pouvons affirmer
que :
- les départements d'Adzopé et de
Grand-Bassam sont des zones de forte transmission palustres
(holoendémie) ;
- le paludisme est la première cause des
accès fébriles chez les enfants de moins de 15 ans ;
- les moustiquaires imprégnées
à longue durée d'action (MILDA) ont un impact réel sur la
prévention du paludisme infestation et du paludisme maladie
malgré l'invariabilité des incidences de fièvres palustres
à Grand-Bassam. Elles restent donc de très bons moyens de lutte
contre la transmission du paludisme.
Cependant, une étude cas-témoin avec comme cas
les enfants malades et témoins (les enfants non malades) vivant dans le
même environnement, nous permettra de mieux affiner les résultats
sur l'efficacité des MILDA sur la réduction du paludisme
maladie.
Les bio-essais nous ont permis d'affirmer que les MILDA
utilisées dans de bonnes conditions conservent leur efficacité
durant de longues années avec un taux de mortalité de près
de 100%.
A la fin de cette étude, nous suggérons en termes
de perspectives, les recommandations suivantes :
- organiser des séances de
sensibilisation de la population sur la nécessité
d'utilisation
rationnelle des moustiquaires imprégnées
d'insecticide de longue durée ;
- poursuivre les tests de bio-essais avec les
souches naturelles des vecteurs du paludisme ;
- réaliser l'étude de
l'efficacité résiduelle des MILDA par le test tunnel ;
- faire des tests physiques de durabilité
sur les moustiquaires imprégnées ; - mesurer la
concentration de l'insecticide sur les MII ;
- préconiser à l'attention des
donateurs, des enquêtes entomologiques avant toute campagne de
distribution de moustiquaires mais aussi le choix des moustiquaires de grandes
tailles.
Abbott, W. S., 1925. A method for computing the
efficacy of insecticide. J. Econ. Entomol. 18: 265-267.
Akogbeto M., 2000. Impact des modifications
de l'environnement et du degré de salinité des gîtes d'eau
saumâtre sur la dynamique de population d'An. melas, vecteur du
paludisme dans le milieu côtier lagunaire du Benin. Cahier
d'étude de recherches francophones/Agriculture. Colloque international
« Eau et
Santé »,9 (5): 422-427.
Akogbéto M. et Yacoubou
S., 1999. Résistance des vecteurs du paludisme
vis-à-vis des pyrétrhinoïdes utilisés pour
l'imprégnation des moustiquaires au Bénin, Afrique de l'Ouest.
Bull Soc Path Exot., 92 : 123-130.
Amat-Roze J M. et Remy G.,
1982. Paysage épidémiologique du paludisme dans l'espace
ivoiro-voltaïque. Med. Trop., 42: 383-92.
Anonyme, 2007 a . Anopheles
quadriannulatus.
http://www.nd.edu/~frank/frank/Anopheles%20quadriannulatus/MosqBF1
An qa HR. Accès le 15 décembre 2008.
Anonyme, 2007 b. Anopheles
puppe.
http://fr.wikipedia.org/wiki/fichierAnopheles.
Consulté le 01 Aout 2011
Anonyme, 2008. Larves et nymphes
d'anophèles.
http://en.impact-malaria.com/iml/cx/fr/layout.jsp?cnt=6EA67B54-94A1-454CB115-724FF943E706
. Consulté le 01 Aout 2011
Anonyme, 2011. Cycle du moustique.
http://pagesperso-orange.fr/SVT.ocean-Indien/cyclemoustique/
cycle moustique.htm. Consulté le 04 juillet
2011.
Assi S-B., 2001. Evaluation parasito-clinique de
l'impact des moustiquaires imprégnées de
pyréthrinoïdes sur la morbidité du paludisme dans les zones
de résistance des vecteurs aux pyréthrinoïdes, en
région de savane. C.E.S de parasitologie, 48 p.
Assi S-B., Henry M-C., Rogier C., Nzeyimana I.
et Koné M., 2004. Evaluation de la
sensibilité de Plasmodium falciparum à la chloroquine
dans la région de savane
au Nord de la Côte d'Ivoire. Bull Soc Path Exot ;
97 (3) : 177-179.
Bleu Monné Thérèse.,
2000.Riziculture et paludisme dans l'Ouest forestier
de la Cote d'Ivoire : indices parasitologiques. Thèse
de Doctorat d'état en Médecine.
Brenier-Pinchart
M-P. et
Pelloux H., 2005. Paludisme (99),
http://www-sante.ujf-
grenoble.fr/SANTE.9p.
Brunhes J., Henry J-P., Camicas
J-L. et
Geoffroy B., 1998. Computerised identification of the
afrotropical anophelines. Research and reviews in parasitology.,
58 (3-4): 197-201.
Carnevale P & Mouchet
J.,1990. Lutte anti vectorielle et lutte antipaludique.
Méd.Trop., 50 : 392-398.
Carnevale P., N'guessan R & Darriet
F., 1998. Long-lasting anti-mosquito efficacy of commercially
impregnated bednets.Trans. Roy. Soc.Trop.Med.hyg.,
92:379-380.
Cohuet A., Simard F., Toto J.C et al., 2003.
Species identification within Anopheles funestus group of
malaria vector in Cameroon and evidence for new species.
American Journal of tropical Medecine and hygiene.
69: 20-200.
Coluzzi M., 1984. Heterogeneities of the
malaria vectorial system in tropical Africa and their significance in malaria
epidemiology and control. Bull. W.H.O. 62: 107-113
(SUPPI.).
Danis M. et Mouchet J.,
1991. Paludisme. Paris, Université francophone
UREF. 240p. Darriet F., 1998. La lutte
contre les moustiques nuisants et les vecteurs de maladies.
Karthala-ORSTOM, Paris, 114p.
Darriet F., 2007. Moustiquaires
imprégnées et résistance des moustiques aux insecticides.
IRD Éditions, Paris, France, 116 p.
Finney D.J., 1971. Probit analysis.
Cambridge Univ Press, UK, 333 p.
Fontenille D., Cohuet A., Awono-Ambene P., Kengne P.,
Antonio-Nkondjio C. et
Wondji C., 2005. Vecteurs du
paludisme : du terrain à la génétique
moléculaire, recherches en Afrique. Rev Epidemiol
Sante Publique ;
53 : 283-90.
Gachot B., Brunell F et Pays J.F., 2004.
Paludisme. Dom Groupe Liaison S.A. 110 p. Gentilini
M., 1993. Paludisme. In medecine tropicale,
Paris, 94 P.
Girardin O., Dao D., Koudou B. G., Essé C.,
Cissé G., Tano Y., N'Goran E. K., Tschannen A. B., Bordmann G., Lehmann
B., N'Sabimana C., Keiser J., Killeen G. F., Singer B. H., Tanner M.
et Utzinger J., 2004. Opportunities
and limiting factors of intensive vegetable farming in malaria endemic
Côte d'Ivoire. Acta Trop. 89: 109-123.
Henry M-C., Assi S-B., Rogier C., Dossou-Yovo J., Chandre
F., Guillet P. et
Carnevale P., 2005. Protective efficacy of
lambda-cyhalothrin treated nets in Anopheles gambiae pyrethroid
resistance areas of Cote d'Ivoire. American Journal of Tropical Medicine
& Hygiene., 73, 859-864.
Jampy V. et Badji M ., 2003.
Paludisme : Première cause de mortalité et de morbidité
au Sénégal,
http://www.santetropicale.com/actualites/0403/0403
23.htm. 1p. Kengne P., Awono-Ambene P., Antonio-Nkondjo C., Simard
F et Fontenille D., 2003.
Molecular identification of Anopheles nili group of
African malaria vectors.
Med Vet Entomol., 17: 67-74.
Kilian A., Byamukama W., Pigeon O., Atieli F., Duchon
S. and Phan C., 2008. Long-term field performance of
a polyester-based long-lasting insecticidal mosquito net in rural Uganda
.Malaria Journal, 7:49.
Koekemoer L.L., Kamau L., Hunt R.H et
Coetzee M., 2002. A cocktail polymerase chain reaction assay to
identify members of the Anopheles funestus (Diptera:
Culicidae) Group. American Journal of Tropical Medicine &
Hygiene. 66: 804-811.
Lindblade K A., Ellen D., Wiliam A., Hawley A., Nabie
B., John W., Dwight M., George O., John V., Laurence S. and
John G., 2005. Evaluation of long lasting
insecticidal nets after 2 years household use.Tropical Medicine &
International Health 10, S1141-1150.
MICS, 2006. Enquête nationale
à indicateurs multiples, rapport préliminaire, INS / UNICEF,
http://www.unicef.org/infobycountry/cotedivoire.
Mouchet J. et Carnevale P.,
1991a. Les vecteurs de la transmission. In Danis M.
et Mouchet J, le paludisme. Ed. Marketing Ellipse / Aupelf. Paris, 35-58.
Mouchet J. et Carnevale P.,
1991b. Répartition et classification écologique
In : le paludisme, Ed. Marketing Ellipse / Aupelf, Paris,
77-79.
Mouchet J., Carneval P., Coosemans M., Julvez J., Manguin
S., Richard-Lenoble D.et Sircoulon J.,
2004. Biodiversité du paludisme dans le monde.
Edition John Libbey Eurotext, Paris, France,428 p.
Mouchet J. et Gariou J.,
1961. Répartition géographique et
écologique des anophèles au Cameroun. Bull Soc Pathol
Exot., 54 : 102-118.
Tia E., Akogbeto M., Koffi A., Toure M., Adja A. M,.
Moussa K., Yao T., Carnevale P. & Chandre F.,
2006. Situation de la résistance d'Anopheles gambiae
s.s. (diptera : culicidae) aux pyrethrinoïdes et au
DDT dans cinq écosystèmes
agricoles de Côte- d'Ivoire. Bull Soc Pathol Exot,
99 (4) 278-282.
OMS, 2004. L'utilisation des Tests
Diagnostiques Rapides du paludisme. 1. Paludisme -
diagnostic. 2. Techniques
et procédures diagnostiques.17 p.
OMS, 2006. Paludisme : lutte
antivectorielle et protection individuelle. Série de rapports
techniques, 71 p
OMS, 2008. Rapport mondial sur
le paludisme de l'Organisation mondiale de la Santé, 125p OMS,
2009 a. Informations clés relatives à
l'approvisionnement en moustiquaires imprégnées
d'insecticide longue durée. Doc Fonds mondial de
lutte contre le SIDA, la
tuberculose et le paludisme, 2p.
OMS, 2009 b. World Malaria
Report, 1.Malaria - prevention and control. 2. Malaria - drug therapy.
3.Antimalarials. 4. National health programs. 5.Statistics. 66p
RBM, 1999. Aspects économiques du
paludisme - Roll Back Malaria
www.rbm.who.int/cmc upload/0/000/015/363/infosheet10
fr.pdf.
RMB, 2005. Plan
stratégique mondial 2005-2015, 52p.
RMB, 2006. Coalition contre le
paludisme : sortir du silence et vaincre le paludisme. Dossier de
presse, 15p.
RMB, 2008. Needs Assessment Côte d'Ivoire
: évaluation des besoins, 103p.
Robert V., 1984. Lutte contre les vecteurs du
paludisme, In : Mouchet J., lutte contre les vecteurs et nuisance en
santé publique. Encycl. Méd. Chir. Paris. Maladies infectieuses,
8120, B10 :3-19.
Robert V. et Carnevale P.,
1984. Les vecteurs des paludismes en Afrique subsaharienne.
Etudes médicales., 2 :79-90.
Rodhain F. et Perez C.,
1985. Precis d'entomologie médicale et
vétérinaire. Maloine, Ed Paris. 458 p.
Sene A., 2005. Pertinence du traitement de
l'accès palustre non compliqué aux urgences. Thèse de
doctorat. Université Cheick Anta Diop, Dakar, 78 p.
Siala E., Ben Abdallah R. et Bouratbine
K., 2010. Actualités du diagnostic biologique du paludisme.
Revue Tunisienne d'Infectiologie, Vol.4: 5 - 9.
Silvie O., Mazier D., Rubinstein E. et
Boucheix C., 2003. CD81: une tétraspanine
impliquée dans l'infection par Plasmodium :
Médecine Sciences., 19 (2) : 169- 171.
Singh B., Kim Sung L., Matusop A., Radhakrishnan A.,
Shamsul S.S., Cox-Singh J., Thomas A. and Conway DJ, 2004.
A large focus of naturally acquired Plasmodium knowlesi
infections in humanbeings.Lancet. 27; 363(9414):1017-
1024.
Warrell D A ., 1993. Treatment
and prevention of malaria, In : Bruce-Watt, essentiel marialogy.
Third edition. Edward Arnold. Adivision of stoughton london, melbourne,
Auckland, 196-321.
Werry M., 1995. Protozoologie médicale.
(ED) De Boek et Larcier, New York: 137- 176. WHO,
2000. Severe falciparum malaria, third edition. Transactions of
The Royal Society of Tropical Medicine and hygiene
94:1-90.
WHO, 2005. Guidelines for laboratory and field
testing of long lasting insecticidal mosquito nets.
WHO/CDS/WHOPES/GCDPP/2005.11.

ANNEXES
ANNEXE I : Fiche d'enquête CAP
|
ETUDE CEMV : Enquête DE REMANENCE
|
VILLAGE: /
N° Maison (de trois
chiffres) /____/ Nombre de Moustiquaire présentes dans le
ménage (de deux chiffres) : /_____/
Nombre de Moustiquaire récupérées
dans le ménage : /_____/
INFORMATIONS SUR LA MOUSTIQUAIRE
/ /

MOUSTIQUAIRE NUMERO* /
Q1 : Lieu où était la MILDA :
Maison en Dur /__/ Maison en banco /__/ Autres à préciser
|
/ /
|
|
Q2 : La moustiquaire a-t-elle été
lavée ? oui /___/ non /___/ Si
oui,aller à la question Q3
|
|
Q3 : Combien de fois a-t-elle été
lavée : (de deux chiffres) /___/
|
|
Q4 : Avec quel type de savon elle a été
lavée ?
- Avec de l'eau uniquement : oui /___/
non /___/ Si oui préciser nb de fois (de
deux chiffres) /___/
- Savon de marseille : : oui /___/
non /___/ Si oui préciser nb de fois (de
deux chiffres) /___/
- Savon parfumé autre que marseille : :
oui /___/ non /___/ Si oui préciser nb
de fois (de deux chiffres) /___/
- Savon noir : : oui /___/
non /___/ Si oui préciser nb de fois (de
deux chiffres) /___/
- Savon kabakourou : : oui /___/
non /___/ Si oui préciser nb de fois (de
deux chiffres) /___/
- Eau de javel : : oui /___/
non /___/ Si oui préciser nb de fois (de
deux chiffres) /___/
- Savon en poudre : : oui /___/
non /___/ Si oui préciser nb de fois (de
deux chiffres) /___/ - Autres savon : : oui /___/
non /___/ Si oui, à préciser / / et
préciser nb
|
|
de fois (de deux chiffres)
/___/
|
ANNEXE II : Fiche de test de cônes des
moustiques femelles adultes aux insecticides
|
Souche :
|
Test n° :
|
Insecticides :
|
Temps de contact :
|
|
Espèce :
|
Date de test :
|
Dosage :
|
Temps d'observation :
|
|
Forme de prélèvement :
|
Lieu de test :
|
Lieu d'imprégnation :
|
Température :
|
|
Lieu de prélèvement :
|
Nature du support :
|
Date d'imprégnation :
|
Hygrométrie
|
|
Age des adultes testés :
|
Opérateurs :
|
Rang d'utilisation :
|
|
|
Observations :
|
|
Remarque :
|
|
|
|
Temps (min)
|
24 heures après
|
|
N°
des cônes
|
Effectif à To
|
5
|
10
|
15
|
20
|
25
|
30
|
40
|
50
|
60
|
Vivants
|
Mortalité
|
|
Brute
|
Fonctionnelle
|
Totale
|
|
Témoin
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
%
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Support
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
%
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TABLES DES MATIERES
LISTE DES SIGLES ET ABREVIATIONS iLISTE DES FIGURES
iiLISTE DES TABLEAUX iiiLISTE DES ANNEXES v
INTRODUCTION 1CHAP
ITRE PREMIER : GENERALITES 4
1.1. Paludisme 5
1.1.1. Agents pathogènes 5
1.1.1.1. Position systématique 5
1.1.1.2. Cycle biologique des plasmodies 6
a. Phase asexuée chez l'homme 6
b. Phase sexuée chez l'anophèle 8
1.1.2. Signes cliniques 8
1.1.2.1. Accès palustre simple 8
1.1.2.2. Accès palustre grave 8
1.1.2.3. Paludisme viscéral évolutif 9
1.1.3. Diagnostic biologique 9
1.1.3.1. Diagnostic direct : frottis et goutte épaisse
10
1.1.3.2. Diagnostic indirect 10
1.1.4. Vecteurs 11
1.1.4.1. Position systématique 11
a. Espèces du complexe Anopheles gambiae 13
b. Espèces du complexe Anopheles funestus 13
c. Espèces du complexe Anopheles nili 15
1.1.4.2. Biologie et écologie des anophèles 15
a. Bio-écologie des stades pré imaginaux 15
b. Bio-écologie des adultes 17
1.1.4.3. Cycle biologique du développement de
l'anophèle 18
a. Phase aquatique 18
b. Phase aérienne 21
1.1.5. Moyens de lutte antipaludique 21
1.1.5.1. Lutte contre le parasite 21
a. Chimioprophylaxie 21
b. Traitement curatif ou Chimiothérapie 21
1.1.5.2. Lutte contre les vecteurs 22
a. Méthodes physiques 22
b. Méthodes chimiques 22
c. Méthodes physico-chimiques 22
d. Méthodes biologiques 24
1.2. Aspects économiques du paludisme 25
CHAPITRE 2 : PRESENTATION DE LA ZONE D'ETUDE
26
2.1. Critères de choix 27
2.2. Présentation des zones d'étude 27
2.2.1. Département d'Adzopé 27
2.2.1.1. Situation géographique 27
2.2.1.2. Climat, végétation et hydrographie 27
2.2.1.3. Population et activités socio-économiques
27
2.2.1.4. Particularités des sites d'études 29
d. Environnement 29
e. Infrastructures 29
f. Activités de lutte antipaludique 29
2.2.2. Département de Grand-Bassam 30
2.2.2.1. Situation géographique 30
2.2.2.2. Climat, végétation et hydrographie 30
2.2.2.3. Population et activités socio-économiques
30
2.2.2.4. Particularités des sites d'études 31
d. Environnement 31
e. Infrastructures 31
f. Activités de lutte antipaludique 31
CHAPITRE 3 : MATERIEL ET METHODES 32
3.1. Matériel 33
3.1.1. Matériel biologique 33
|
3.1.2. Matériel technique
3.1.2.1. Matériel de terrain
3.1.2.2. Matériel de laboratoire
3.1.2.3. Matériel utilisé pour la
réalisation de l'enquête CAP
3.2. Méthodes
3.2.1. Echantillonnage de la population
3.2.1.1. Effectif de la population
3.2.1.2. Récolte des données démographiques
3.2.2. Enquêtes parasito-cliniques
3.2.2.1. Détection passives des fièvres
3.2.2.2. Confection de la goutte épaisse
3.2.2.3. Techniques de coloration
3.2.2.4. Lecture des gouttes épaisses
3.2.2.5. Détermination des indices parasitologiques
3.2.2.6. Morbidité palustre
3.2.3. Enquêtes CAP (Connaissances, Attitudes et Pratiques)
sur l'utilisation des
Moustiquaires
3.2.4. Tests d'efficacité
3.2.5. Analyse statistique
CHAPITRE 4 : RESULTATS ET DISCUSSION
Résultats 43
4.1.1. Données démographiques
4.1.1.1. Première enquête
4.1.1.2. Deuxième enquête
4.1.2. Couverture en moustiquaires Imprégnées
4.1.2.1. Première enquête
4.1.2.2. Deuxième enquête
4.1.3. Prévalence parasitaire
4.1.3.1. Première enquête
4.1.3.2. Deuxième enquête
4.1.4. Densité parasitaire
4.1.4.1. Première enquête
4.1.4.2. Deuxième enquête
|
33 33 33 35 35 35 35 35
37
37
37
38
38
38
39
39
39
41
42
43 43 43 43 43 43 46 46 46 46 46 46
|
4.1.
|
4.1.5. Morbidité 50
4.1.5.1. Fièvres en général 50
a- Première enquête 50
b- Deuxième enquête 50
4.1.5.2. Fièvres palustres 50
a-Première enquête 50 b-
Deuxième enquête 50
4.1.6. Etude des Morbidités générales et
palustres selon les enquêtes 54
4.1.6.1. Répartition des fièvres selon les
enquêtes 54
4.1.6.2. Répartition des fièvres selon les
enquêtes et selon
les départements 54
4.1.7. Enquête CAP 57
4.1.8. Tests d'efficacité 57
4.2. Discussion 60
4.2.1. Taux de couverture en moustiquaires 60
4.2.2. Prévalence parasitaire 60
4.2.3. Morbidité 61
4.2.4. Test d'efficacité 62
CONCLUSION ET PERSPECTIVES 64
REFERENCES BIBLIOGRAPHIQUES 66
ANNEXES 72
| 


