|
RÉPUBLIQUE
DÉMOCRATIQUE DU CONGO
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET
UNIVERSITAIRE
UNIVERSITE DE KINSHASA

FACULTÉ DE MÉDECINE
DÉPARTEMENT DE MÉDECINE PHYSIQUE ET DE
RÉADAPTATION
BP. 834 Kinshasa XI
INFLUENCES DES SEQUELLES NEURO-ORTHOPEDIQUES SUR LA
CAPACITE FONCTIONNELLE DES ADULTES CEREBRO-LESES SUIVIS EN READAPTATION
FONCTIONNELLE
Écrit Par
Homer TSHIBANDA MBOTO
Gradué en Médecine Physique et de
Réadaptation
Mémoire présenté en vue de
l'obtention du Diplôme de Licencié en MédecinePhysique
et de Réadaptation
Direteurr: Professeur Docteur Boniface KAMANGA MUAMBA
Encadrant : Assistant PatientNGEREZA KIBIMBI
Année Académique 2022-2023
TABLE DES
MATIRERES
TABLE DES MATIRERES
I
IN MEMORIAM
IV
ÉPIGRAPHE
V
DÉDICACES
VI
REMERCIEMENTS
VII
LISTE DES SIGNES ET SYMBOLES
VIII
LISTE DES ABREVIATIONS
IX
LISTE DES FIGURES
X
LISTE DES TABLEAUX
XI
RESUME
XII
0. INTRODUCTION
1
0.1. CONTEXTE ET JUSTIFICATION
1
0.2. QUESTION DE RECHERCHE
3
0.3. HYPOTHÈSE
3
0.4. OBJECTIFS D'ÉTUDE
3
0.4.1. Objectif principal
3
0.4.2. Objectifs spécifiques
3
0.5. SUBDIVISION DU TRAVAIL
4
CHAPITRE 1. GENERALITES
5
1.1. DÉFINITION
5
1.1.1. Classifications des lésions
cérébrales
5
1.1.2. Prévalence et impact sur la
population adulte
5
1.2. LA SPASTICITÉ
6
1.2.1. Définition
6
1.2.2. Mécanismes physiopathologiques
de la spasticité
6
1.2.3. Évaluation de la
spasticité
7
1.3. LA CAPACITÉ FONCTIONNELLE
9
1.3.1. Définition de la
capacité fonctionnelle
9
1.3.2. Facteurs influençant la
capacité fonctionnelle chez les adultes
cérébrolésés
9
1.3.3. Mesure de la capacité
fonctionnelle
9
1.3.4. Impact de la spasticité sur la
capacité fonctionnelle
9
1.3.5. Conséquences de la
spasticité sur la qualité de vie
10
1.4. LA DOULEUR
10
1.4.1. Définition et
types de douleur
10
1.4.2. Mécanismes de la Douleur dans
les Lésions Cérébrales
10
1.4.3.
Évaluation de la Douleur
10
1.4.4. Impact de la Douleur sur la Fonction
Motrice et l'Autonomie
10
1.5. LA RAIDEUR ARTICULAIRE
10
1.5.2. Définition et Causes de la
Raideur Articulaire
10
1.5.3. Raideur Articulaire dans les
Lésions Cérébrales
11
1.5.4. Évaluation de la Raideur
Articulaire
11
1.5.5. Impact de la Raideur Articulaire sur
la Capacité Fonctionnelle
11
1.6. TROUBLE MUSCULAIRE
11
1.6.1. Types de Troubles Musculaires
Observés dans les Lésions Cérébrales
11
1.6.2. Mécanismes Physiopathologiques
des Troubles Musculaires
11
1.6.3. Evaluation des Troubles
Musculaires
12
1.6.4. Impact sur la Fonction
Motrice et l'Autonomie
13
1.7. APPROCHES THÉRAPEUTIQUES
13
1.7.1. La rééducation:
13
1.7.2. Les médicaments:
15
CHAPITRE 2. MATERIEL ET METHODES
19
2.1. NATURE ET PÉRIODE DE L'ÉTUDE
19
2.2. CADRE DE L'ÉTUDE
19
2.3. POPULATION DE L'ÉTUDE
19
2.4. ECHANTILLONNAGE ET ÉCHANTILLON
19
2.5. CRITÈRES DE SÉLECTION
19
2.5.1. Critères d'inclusion
19
2.5.2. Critères d'exclusion
19
2.6. VARIABLES DE L'ÉTUDE
19
2.6.1. Variable dépendants :
19
2.6.2. Variables indépendants :
20
2.7. COLLECTE DES DONNÉES
22
2.7.1. Équipe de recherche et
démarche administrative
22
2.7.2. Matériels utilisés :
22
2.7. 2. Collectes proprement dites ou
déroulement de l'éthique
24
2.8. DÉFINITIONS OPÉRATIONNELLES
26
2.9. CONSIDERATIONS ETHNIQUES
26
2.10. ANALYSES STATISTIQUES
26
CHAPITRE 3. LES RESULTATS
27
3.1. CARACTÉRISTIQUES
SOCIODÉMOGRAPHIQUES
27
3.1.1. Le sexe
27
3.1.2 Niveau d'étude
27
3.1.3. Profession
28
3.1.4. L'âge
29
3.2. CARACTÉRISTIQUES CLINIQUES
30
3.2.1. Les antécédents, type de
lésion et mobilité
30
3.2.2. Évaluation articulaires
31
3.3. PARAMÈTRES LIÉS AUX
COMPLICATIONS NEURO-ORTHOPÉDIQUES
34
3.4. PARAMÈTRES LIÉS À LA
CAPACITÉ FONCTIONNELLE
35
3.4.1. Évaluation de la
préhension
35
3.4.2. Évaluation de la Marche
36
3.4.3.Évaluation de l'autonomie
37
CHAPITRE 4. DISCUSSION
40
LIMITES DE L'ÉTUDE
43
LA FORCE DE CETTE ÉTUDE
43
CONCLUSION
44
? PERSPECTIVES
44
? RECOMMANDATIONS
44
BIBLIOGRAPHIE
45
ANNEXES
51
IN MEMORIAM
À l'être que je n'eus connu que pendant mes 4
premières année; à vous que j'aurais tant voulu montrer de
quoi je suis capable et comment je définis la vie, notre regretté
Papa, KAMBA pierre, que Dieu a rappelé très tôt;
Cher papa, j'aurais aimé que vous soyez là,
présent pour me voir terminer ce que tu n'aurais jamais cru possible.
Aujourd'hui, me voir finir ce cursus et atteindre cette nouvelle étape
importante de ma vies sans toi, me fait encore mal Papa. L'amour qui nous a
liés restera à jamais plus fort que la mort qui nous a
séparés.
ÉPIGRAPHE
« Les véritables progrès de la
médecine sont ceux qui redonnent aux hommes la possibilité de
recouvrer leur autonomie. »
Dr Pierre Paul Emile
DÉDICACES
A ma famille pour leur amour et leur soutien sans faille,
A mes encadrants pour leur patience et leurs conseils
précieux ;
A mes amis pour leurs compréhensions et encouragement
tout au long de ce parcours ;
A mes patients, dont les histoires m'ont appris bien plus que
je n'aurais pu imaginer ;
A ma petite amie, pour son attachement et soutien pendant ce
dur moment ;
Ainsi qu'à toutes les personnes qui, par leurs luttes,
leurs résiliences, m'ont inspiré dans l'élaboration de ce
mémoire.
A toutes et à tous, je dédie ce mémoire
REMERCIEMENTS
A Dieu, le Tout-Puissant, Maître des temps et de
circonstance, pour ses bontés qu'il ne cesse de renouveler chaque jour
dans notre vie.
Nous tenons à exprimer notre profonde gratitude
à toutes les personnes qui ont contribué à la
réalisation de ce travail et nous ont accompagné tout au long de
notre parcours, nous citons :
Mes Grands-Parents BOWA KAKONKA YACOUB, MWANJI MACHOURA
PAULINE et LUENDU KADUNYI PAULIN pour leur soutien inconditionnel et leur
encouragement constant. Leur foi en nous nous ont permis de surmonter de
nombreux défis et de continuer à avancer, même dans les
moments les plus difficiles.
Notre mère BOWA NGALULA SAFIATOU, même si la
distance physique nous sépare depuis de nombreuses années, ton
amour et ton soutien ont toujours été présents et nous ont
permis d'aller de l'avant, malgré les obstacles. Nous sommes infiniment
reconnaissants pour tout ce que tu nous as transmis.
Professeur Dr BONIFACE KAMANGA, directeur de ce
mémoire, pour ses conseils avisés, son expertise et son
accompagnement à chaque instant. Sa rigueur scientifique et sa
bienveillance ont grandement contribué à l'élaboration de
ce travail.
Au Dr NGEREZA Patient, le co-directeur de ce travail, pour son
soutien inestimable et ses précieux conseils. Votre aide nous a
été essentielle pour mener à bien ce projet. Nous vous
sommes profondément reconnaissant, un Grand merci à vous.
A tous les enseignants et chercheurs de la Faculté de
Médecine, dont les enseignements et les orientations ont
été des sources d'inspiration continues.
Mes collègues et amis pour leur soutien, leur
disponibilité et leurs encouragements, car nos discussions et
échanges m'ont permis de voir les choses sous un autre angle et ont
enrichi ma réflexion.
Que Dieu vous bénisse tous !
LISTE DES SIGNES ET SYMBOLES
% : Pourcentage
#177; : Plus ou moins
? : Point d'interrogation
[] : Accolade
() : Parenthèses
= : Égal
< : Inférieur à
> : Superieur à
= : Superieur ou égal à
= : Inférieur ou égal
à
LISTE DES ABREVIATIONS
ACH : Anticholinergique
AMM : Autorisation de Mise sur le Marché
ATCD : Antécédents
AVC : Accident Vasculaire Cérébral
AVQ : Activités de la Vie Quotidienne
CIF : Classification Internationale du Fonctionnement, du
Handicap et
de la Santé
CRHP : Centre de Rééducation pour
Handicapés Physiques
CUK : Cliniques Universitaires de Kinshasa
EVA : Échelle Visuelle Analogique
MRC : Medical Research Council
MS : Membre Supérieur
OMS : Organisation Mondiale de la Santé
PH : Potentiel d'hydrogène
SNP : Système Nerveux Périphérique
SOFMER : Société Française de
Médecine Physique et de Réadaptation
SPSS : Statistical Package for the Social Sciences (logiciel
d'analyse
statistique)
TA : Tension Artérielle
TCC : Traumatisme Crânio-Cérébral
VDRSA : Vice-Décanat chargé de la Recherche
Spécialisation et Agrégation
LISTE DES FIGURES
Figure 1. Répartition des participants
selon le sexe
2
Figure 2. Répartition des participants
selon leur niveau d'étude
27
Figure 3. Répartition des participants
selon leur profession
28
LISTE DES TABLEAUX
Tableau I. Répartition des patients selon
l'âge
2
Tableau II. Répartition selon les
antécédents, le type de lésion et la mobilité
30
Tableau III. Répartition des participants
selon l'évaluation articulaire des MS
31
Tableau IV. Répartition selon
l'évaluation articulaires des MI
33
Tableau V.Les complications
neuro-orthopédiques des participants
34
Tableau VI. Répartition des participants
selon le type de préhension et de prise
35
Tableau VII. Répartition des participants
selon les différents type de Marche et la mesure de la fonction
motrice.
36
Tableau VIII. Évaluation de l'autonomie
selon l'indice de Barthel
37
Tableau IX.Impact des complications
neuro-orthopédiques sur la préhension
38
Tableau X. Répartition des participants
selon l'impact des complications neuro-orthopédiques sur la marche
39
RESUME
Contexte : Les déformations
neuro-orthopediques sont des complications fréquentes, des pathologies
neurologiques centrales (accidents vasculaires cérébrale,
sclérose en plaques, maladie de Parkinson) ou
périphériques. Ces séquelles ont un impact sur les
capacités fonctionnelles du patient, sur son état cognitif, sur
le nursing, sur la qualité de vie du patient et sur celle des aidants.
Dans notre milieu hospitalier, l'influence de ces séquelles est
très peu documentée chez les personnes ayant subis une
lésion cérébrale.
Objectif : Analyser l'influence des
séquelles neuro-orthopédiques sur la capacité
fonctionnelle des cérébro-lésés adultes.
Méthode: Il s'agit d'une étude
analytique menée auprès des 30 patients
cérébro-lesés présentant des sequelles
neuro-orthopédiques des CUK et de CRHP recrutés par convenance
dans la période allant du 20 Novembre 2024 au 20 Janvier 2025. Le test
de Chicarré de Pearson a été utilisé à cet
effet. Le seuil de significativité statistique a été
fixé à 5%.
Résultats : Nous avons noté
quela préhension est significativement affectée par les
contractures (p=0,049), les déformations (p=0,000) et la douleur
(p=0,007). En revanche, les complications neuro-orthopédiques n'ont pas
d'influence significative sur la marche, les contractures (p=0,225), les
déformations (p=0,386) ni la douleur (p=0,115). Par ailleurs, concernant
le niveau de dépendance des patients, 2 (6,7%) présentent une
dépendance totale, 8 (26,7%) une dépendance sévère,
12 (40%) une dépendance modérée, 7 (23,3%) une
indépendance légère, et 1 (3,3%) une indépendance
totale.
Conclusion : Les complications
neuro-orthopédiques ont une influence statistiquement très
significtive au niveau des membres supérieurs tandisqu'aux membres
inférieurs, cette influence n'est pas statistiquement significative.
Mots-clés : Séquelles
neuro-orthopediques, AVC, spasticité, douleur, raideur articulaire,
fonction motrice.
INTRODUCTION
0.1. Contexte et justification
Selon l'organisation mondiale de la santé (OMS),
environ 15 million de personnes font un accident vasculaire
cérébral (AVC) : 5 millions d'entre elles meurent et 5 millions
souffrent d'une incapacité permanente, ce qui représente un poids
pour la famille et la communauté [1], et est l'une des principales
causes de déficience partout dans le monde [2]. En Suisse, on
comptabilise approximativement 150 AVC par 100000 habitants chaque
année, dont 80% sont de nature ischémique [3].
En Afrique du sud, sur 434 autopsies d'hypertendus, il a
été noté 51% d'AVC ; parmi ces AVC, 212 (95%)
étaient d'origine hémorragique et 11 (5%) étaient
liés à une thrombose [4].
Au Mali, la fréquence hospitalière d'accident
vasculaire est de 13,54% [4] avec une mortalité de 22,5% [5].
Cette incidence est probablement croissante en raison de
l'allongement de la durée de vie moyenne de la population. De plus, la
durée des soins après un AVC est longue et le coût social
est très lourd, que ce soit financièrement ou en termes de
qualité de vie [3].
Le nombre de traumatismes cranio-cérébraux (TCC)
est aussi élevé. On compte chaque année entre 235 et 538
TCC par 100000 habitants. Ils sont la première cause de
décès avant 45 ans. Aux Etats-Unis, ils entraînent des
coûts s'élevant à 9,2 milliards de dollars pour les soins
et à plus de 51,2 milliards de pertes de productivité.
Les progrès de la médecine d'urgence ont des
répercussions très importantes sur la prise en charge des
patients cérébraux lésés et tout
particulièrement sur la mortalité [3].
Une diminution de la capacité à l'effort est en
général reconnue dans les suites d'accidents vasculaires
cérébraux en raison, de l'alitement et l'immobilisation, du
déficit moteur, et des atteintes vasculaires associées [6].
Plusieurs études ont été menées
sur les déformations cliniques neuro-orthopédiques des
cérébrolésés.
Celles-ci mettent l'accent sur les plus communes, au membre
supérieur, l'adduction/rotation interne d'épaule, la flexion du
coude, la pronation de l'avant-bras, la flexion du poignet, des doigts et
l'adduction/opposition du pouce [7], [8]. Et Au membre inférieur Chez
l'adulte cérébrolésé, les déformations les
plus communes, au membre inférieur, sont l'adductum/flexum de hanche et
le pied varus équin [9].
Les déformations neuro-orthopediques sont des
complications fréquentes, des pathologies neurologiques centrales
(accidents vasculaires cérébrale, sclérose en plaques,
maladie de Parkinson) ou périphériques [10].
De plus en plus de patients avec des lésions
cérébrales très graves survivent en gardant des
séquelles fonctionnelles importantes [3].
Ces séquelles ont un impact sur les capacités
fonctionnelles du patient, sur son état cognitif, sur le nursing, sur la
qualité de vie du patient et sur celle des aidants [10].
La prévention de la survenue des troubles et
l'évaluation de ces déformations, étape clé dans la
prise en charge thérapeutique, nécessite des connaissances
solides d'anatomie, d'analyse du mouvement, de biomécanique et des
compétences thérapeutiques médico-physique [10].
En République Démocratique du Congo, depuis
2015, il a été révélé une recrudescence de
l'AVC suite aux mauvaises conditions hygiéniques du point de vue
environnemental et alimentaire, lesquels entraînent des risquent
prédisposant à cet accident, notamment l'obésité,
l'hypertension artérielle, l'excès de cholestérol, le
trouble du sommeil, le diabète, le stress.
Pour Malemba M et all, la rééducation se doit
d'être la plus précoce possible pour assurer une bonne
récupération fonctionnelle et malgré que la
rééducation soit de plus en plus précoce, il s'observe
chez certains patients un retard ou manque de la récupération
fonctionnelle [11].
Des études en notre connaissance, ayant abordé
cette thématique se faisant rarissime dans nos milieux, nous avons
résolu de mener cette étude pour contribuer de manière
préventif à l'amélioration de la prise en charge des
patients cérébrolésés en milieu hospitalier de
Kinshasa, en vue d'une meilleure récupération fonctionnelle et
afin d'apprécier l'impact des complications ou troubles
neuro-orthopédiques sur la récupération fonctionnelle et
l'autonomie des cérébrolésés en milieu hospitalier
de Kinshasa.
0.2. Question de recherche
Pour y parvenir nous nous sommes posé les questions de
recherche suivantes :
Ø Les lésions cérébrales
entrainent-elles des séquelles neuro-orthopédiques ?
Ø Les complications neuro-orthopédiques
influencent-elles la capacité fonctionnelle des adultes
cérébrolésés ?
Ø L'autonomie du
cérébrolésés est-elle influencée par les
séquelles neuro-orthopédiques ?
0.3. Hypothèse
Les hypothèses suivantes ont été
formulées :
Ø Les lésions cérébrales
provoquent les complications neuro-orthopédiques.
Ø Les séquellesneuro-orthopédiques
influencent la capacité fonctionnelle des adultes
cérébrolésés.
Ø Les séquelles neuro-orthopédiques
influencent la qualité de vie des
cérébrolésés.
0.4. Objectifs d'étude
0.4.1. Objectif principal
L'objectif général assigné à la
présente étude est de montrer l'influence desséquelles
neuro-orthopédiques sur la capacité fonctionnelle des
cérébrolésés adultes.
0.4.2. Objectifs
spécifiques
Pour atteindre notre objectif général, les
objectifs spécifiques suivants ont été retenus:
Ø Déterminer les types de séquelles
neuro-orthopédiques les plus fréquentes
Ø Évaluer l'influence des séquelles sur
la capacité fonctionnelle des membres inférieurs et
supérieurs des cérébrolésés adultes.
Ø Établir l'influence des séquelles sur
l'autonomie des lésés cérébraux
0.5. Subdivision du
travail
Hormis l'introduction et la conclusion, ce travail comporte 4
chapitres:
Chapitre 1. Revue de la recherche;
Chapitre 2. Matériel et Méthodes;
Chapitre 3. Résultats;
Chapitre 4. Discussion
CHAPITRE 1. GENERALITES
1.1. Définition
Une lésion cérébrale acquise est un
endommagement du cerveau qui a lieu après la naissance et n'est pas
lié à des maladies congénitales ni
dégénératives[12].
1.1.1. Classifications des lésions
cérébrales
Il y a deux types de lésions cérébrales
acquises:
Les lésions cérébrales non-traumatiques
sont causées par un facteur interne (quelque chose qui se passe dans le
corps) ou par une substance introduite dans le corps, qui endommage le tissu
cérébral. Ces lésions peuvent être classées
en lésion non- traumatiques (par exemple: Accidents ischémiques
cérébraux, AVC hémorragique, Anévrismes,troubles
convulsifs, Tumeurs cérébrales, Empoisonnement, Abus de
substances médicinal, Overdose d'opioïdes, Méningite
Encéphalite, Hydrocéphalie Vascularite et Hématome)
etlésions cérébrales traumatiques qui sont causées
par des facteurs extérieurs, tels les coups, les secousses ou les chocs.
Le résultat peut être une lésion temporaire du cerveau ou
un endommagement plus sérieux, à long terme. Elles peut inclurent
les Accidents routiers, Chutes, Agressions, Blessures par balle, Violence
domestique, Étranglement, Suffocation, Syndrome du bébé
secoué, Blessuressportives, Explosions et blessures de combat[13].
1.1.2. Prévalence et impact sur la population
adulte
Chaque année, entre 3.000 et 5.000 personnes en Suisse
souffrent d'une lésion cérébrale à la suite d'un
accident. Parmi elles, 60 - 70 % sont victimes d'un accident de la route.
D'autres causes sont les accidents de sport, du travail ou dans le
ménage.
80 % des personnes concernées sont des hommes dont 50 %
ont moins de 30 ans au moment de l'accident, avec des conséquences
significatives sur leur autonomie et leur qualité de vie. Selon les
statistiques, des millions de personnes vivent avec des séquelles
liées à des lésions cérébrales, ce qui
souligne la nécessité d'une recherche approfondie dans ce domaine
[14].
Leurs causes les plus fréquentes sont les accidents de
la voie publique et les chutes [3].
Les lésions cérébrales entraînent
plusieurs complications, et séquelles notamment :
1.2. La spasticité
1.2.1.
Définition
La spasticité est un
trouble moteur caractérisé par une augmentation sensible de la
vitesse des réflexes d'étirement toniques (hypertonie
musculaire), associée à uneexagération des réflexes
tendineux, lié à l'hyperexcitabilité de l'arc
réflexe myotatique, formant une composante dusyndrome pyramidal. »
On considère que le muscle est soumis à une tension de base
appelée tonus musculaire. L'augmentation de cette tension de repos est
appelée hypertonie musculaire. La spasticité est une
variété particulière d'hypertonie musculaire. En pratique,
cette hypertonie se manifeste par une augmentation de la résistance du
muscle à l'étirement. La spasticité est une co-contraction
des agonistes et des antagonistes, ce que rappelle l'étymologie en grec:
spao (spaw) signifie: "je contracte"[15].
1.2.2. Mécanismes
physiopathologiques de la spasticité
Lors d'un AVC, on retrouve uniquement des lésions au
niveau du cortex cérébral. Pourtant, la spasticité est
induite à cause d'un dérèglement au niveau du
réflexe d'étirement, qui se déroule dans la moelle spinale
et par conséquent ne met pas en jeu le cerveau dont le faisceau
pyramidal est lésé. La spasticité pourrait être
causée par une réorganisation anarchique après une
lésion cérébrale [16].
Cette réorganisation causerait une augmentation des
réflexes par perturbation de la
régulation du réflexe d'étirement. On
retrouve 3 facteurs possibles d'augmentation du tonus musculaire chez des
patients ayant de la spasticité :
- Des modifications de l'apport afférent aux
motoneurones spinaux.
- Des modifications des circuits réflexes qui affectent
l'excitabilité des motoneurones.
- Des modifications des propriétés
intrinsèques des motoneurones[17].
Il existe aussi des modifications intrinsèques du
muscle secondairement à la spasticité.
L'augmentation du tonus musculaire résulte initialement
d'une augmentation excessive du réflexe d'étirement, et par la
suite de changements viscoélastiques dans le muscle [18]. En effet,
lorsqu'un muscle paralysé est maintenu dans une position raccourcie, il
perd des sarcomères: Il « s'ajuste » pour produire une force
optimale à la longueur musculaire raccourcie [17]. Ce processus peut
aboutir à une perte permanente de la mobilité articulaire ainsi
que des contractures, Il existe une réelle adaptation du muscle selon
son utilisation. Dans le cadre d'une spasticité sévère, le
muscle est en permanence dans une position raccourcie, il s'adapte, perd des
sarcomères et perd sa capacité à s'étirer. C'est un
véritable cercle vicieux car plus le muscle perd sa capacité
à s'étirer, plus il reste dans une position courte, et donc plus
il s'adapte et perd de nouveau sa capacité d'étirement[18].
1.2.3. Évaluation
de la spasticité
L'évaluation de la spasticité permet de
déterminer la gêne qu'elle entraîne.
Différents moyens d'évaluation:
Ø Évaluation analytique du tonus
musculaire
Plusieurs échelles cliniques permettent
l'évaluation clinique de la spasticité. Il s'agit de
l'échelle d'Ashworth modifiée par Bohannon en 1986[19] de
l'échelle de fréquence des spasmes de Penn et de l'échelle
de Tardieu[20].
L'échelle de spasmes de Penn (1985) a été
mise au point pour évaluer l'effet du baclofène
intra-thécal chez des patients spastiques [21]:
· 0 Absence de spasmes
· 1 Spasmes induits par des stimulations sensorielles ou
mobilisation passive
· 2 Spasmes spontanés occasionnels
· 3 Nombre de spasmes spontanés compris entre 1 et
10/ heure
· 4 Plus de 10 spasmes/heure
L'échelle de Tardieu est une échelle ordinale
qui tient compte de la posture et de la vitesse
d'étirement.L'évaluation est toujours
réalisée à la même heure du jour, dans une
même posture corporelle constante pour un membre donné. Les autres
articulations au niveau du corps doivent rester immobiles durant le test et
dans la même position d'un test à l'autre. La résistance
à la mobilisation est évaluée à deux vitesses: la
plus lente et la plus rapide possible.
L'angle d'apparition ainsi que l'intensité de la
résistance sont notés. Cette échelle française a
fait l'objet d'une validation en anglais[19].
Ø Évaluation des amplitudes articulaires
passives
Cette mesure est un élément fondamental de
l'évaluation des patients spastiques. Elle
permet de faire la part de spasticité et de
rétractions musculaires. Dans certains cas de
spasticités sévères (mobilisation passive
difficile), la mesure ne permet pas d'évaluer les parts respectives de
chacun des mécanismes. Il est alors nécessaire de pratiquer des
tests pharmacologiques. Il s'agit essentiellement des blocs moteurs
périphériques par un agent anesthésique [22].
Ø Évaluation des amplitudes articulaires
actives
Elle est primordiale dans l'évaluation du
retentissement fonctionnel de la spasticité. Elle permet de
connaître la gêne que représente la spasticité au
cours du mouvement volontaire. Cette évaluation des amplitudes
articulaires peut se faire soit cliniquement, soit à l'aide de
goniomètres électroniques [22].
Ø Évaluation des conséquences de
la spasticité :
- La douleur
La méthode d'évaluation la plus répandue
de la douleur est l'échelle visuelle analogique. Cependant, de nombreux
patients spastiques cérébro-lésés sont incapables
d'utiliser cette échelle en raison de troubles neuropsychologiques
[23].
- L'examen de la motricité
Il doit être réalisé minutieusement. En
effet, le traitement de la spasticité peut être suivi par une
perte de fonction chez un patient ayant une commande motrice trop
déficitaire. Ce déficit moteur est parfois masqué par la
spasticité qui donne une impression erronée de commande motrice
correcte[23].
Il faut rechercher également des troubles
proprioceptifs, un syndrome cérébelleux et tout autre
élément pouvant majorer la gêne fonctionnelle
occasionnée par la spasticité.
Le plus souvent, la paralysie après un accident
vasculaire cérébral est dite flasque au
début avec l'absence de reflexe ostéo-tendineux
et l'absence d'hypertonie à la mobilisation[23].
Ces manifestations spastiques, généralement
absentes à la phase aigüe s'installent dans les semaines qui
suivent l'accident vasculaire cérébral. Elles touchent
déjà 27% des patients à 1 mois et 23% à 6 mois
selon une étude suédoise récente. Lesréflexe
ostéo-tendineux réapparaissent ensuite progressivement et
deviennent exagérés par rapport au côté sain. Ils
sont vifs, poly-cinétiques et diffusés. Le réflexe
bicipital et le réflexe rotulien sont les premiers à
réapparaître.
L'hypertonie apparaît progressivement et n'est au
début qu'à peine palpable. Elle apparaît habituellement
d'abord sur les fléchisseurs des doigts, du poignet et du pied. Elle
restera toujours plus forte sur les muscles où elle est apparue en
premier. Elle prédomine habituellement sur les muscles
fléchisseurs au membre supérieur.
Il s'agit des rotateurs internes du bras, des
fléchisseurs du coude, des pronateurs, des
fléchisseurs de poignet et des fléchisseurs des
doigts. La spasticité prédomine sur les
extenseurs au membre inférieur, elle intéresse
les fessiers, le quadriceps et le triceps sural. La spasticité est
sujette à de nombreuses variations liées à
différents facteurs tel que la position du malade. Elle prédomine
sur les muscles anti-gravidiques et l'orthostatisme l'accentue fortement. Elle
est aggravée par le stress, la fatigue, les émotions, la douleur,
l'effort physique, les changements de température extérieure
ainsi que les grands froids et les grandes chaleurs[21].
1.3.La capacité fonctionnelle
1.3.1. Définition
de la capacité fonctionnelle
La capacité fonctionnelle évalue la
possibilité d'un patient à réaliser un effort. Elle
dépend notamment de la fonction cardio-pulmonaire et musculo-squeletique
[24].
1.3.2. Facteurs
influençant la capacité fonctionnelle chez les adultes
cérébrolésés
Plusieurs facteurs peuvent influencer la capacité
fonctionnelle chez les adultes ayant subi une lésion
cérébrale, notamment:
· La gravité de la lésion
· La présence de spasticité ou d'autres
troubles moteurs
· Les comorbidités (ex.: douleurs chroniques,
troubles cognitifs)
· Le soutien social et familial [25].
1.3.3. Mesure de la
capacité fonctionnelle
La capacité fonctionnelle peut être
mesurée à l'aide d'outils standardisés tels que:
Ø L'interrogatoire du patient (évaluation
subjective)
Ø Un questionnaire auto-administré au patient
Ø Les tests de Marche, que ce soit le test de marche
de 6 minutes ou les tests de marche incrémentiels. Ces tests de Marche
n'évaluent pas les échanges gazeux, mais procurent une
évaluation de la forme physique facile à réaliser et peu
onéreuse.
Ø Les tests cardiopulmonaires d'exercice ou d'effort.
Ces tests cardiopulmonaires analysent les échanges gazeux et
représentent le moyen le plus fiable pour évaluer la
capacité fonctionnelle [26].
1.3.4. Impact de la
spasticité sur la capacité fonctionnelle
Relations entre spasticité et limitations
fonctionnelles:
La spasticité a un impact direct sur la capacité
fonctionnelle, rendant certaines activités difficiles voire impossibles
à réaliser. Par exemple, une spasticité
sévère au niveau des membres inférieurs peut limiter la
Marche ou l'équilibre [27].
1.3.5. Conséquences
de la spasticité sur la qualité de vie
L'impact de la spasticité sur la capacité
fonctionnelle a des répercussions sur la qualité de vie globale
des individus, affectant leur bien-être psychologique et social [28].
1.4. La douleur
1.4.1. Définition
et types de douleur
La douleur est une expérience sensorielle et
émotionnelle désagréable associée à des
lésions tissulaires réelles ou potentielles. Elle peut être
aiguë, survenant de manière soudaine après une
lésion, ou chronique, persistant longtemps après la
guérison initiale du tissu. Chez les patients
cérébrolésés, la douleur peut résulter de
lésions nerveuses, de raideurs musculaires, ou de blessures secondaires
causées par une mauvaise posture ou un mauvais alignement corporel
[29].
1.4.2. Mécanismes
de la Douleur dans les Lésions Cérébrales
Les lésions cérébrales,
particulièrement celles affectant le cortex moteur, peuvent
altérer la perception et le traitement de la douleur. Par exemple, des
lésions du cortex somatosensoriel peuvent entraîner une
hypersensibilité à la douleur, un phénomène
appelé allodynie. Les lésions des voies motrices peuvent
également perturber le contrôle moteur, provoquant des douleurs
musculaires dues à des compensations incorrectes ou une utilisation
excessive de certains muscles [30].
1.4.3.
Évaluation de la Douleur
L'évaluation de la douleur dans les lésions
cérébrales se fait souvent à l'aide de questionnaires
standardisés, tels que l'Échelle Visuelle Analogique (EVA) ou
l'Échelle de Douleur de McGill. Ces outils permettent de quantifier la
douleur perçue et de déterminer son impact sur la vie quotidienne
du patient [31].
1.4.4. Impact de la
Douleur sur la Fonction Motrice et l'Autonomie
La douleur limite considérablement la capacité
fonctionnelle des individus, en réduisant leur amplitude de mouvement,
leur capacité à exécuter des tâches quotidiennes et
leur niveau d'activité physique. Chez les
cérébrolésés, la douleur persistante est un
obstacle majeur à la réadaptation, influençant
négativement l'engagement dans les exercices de
rééducation et affectant la motivation à améliorer
la condition physique et psychologique [32].
1.5. La raideur articulaire
1.5.2. Définition
et Causes de la Raideur Articulaire
La raideur articulaire fait référence à
une réduction de la mobilité d'une articulation, souvent
causée par des anomalies musculaires ou une spasticité.
Après un AVC, la raideur articulaire est courante, en particulier au
niveau des membres supérieurs et inférieurs, en raison de la
perte de contrôle neuromusculaire et de la tendance à maintenir
une posture non fonctionnelle [33].
1.5.3. Raideur Articulaire
dans les Lésions Cérébrales
Chez les cérébrolésés, la raideur
articulaire est généralement secondaire à la
spasticité. Les muscles peuvent devenir rigides et moins flexibles en
raison de l'activation excessive des réflexes spinaux, limitant ainsi la
capacité à réaliser des mouvements coordonnés et
fonctionnels [34].
1.5.4. Évaluation
de la Raideur Articulaire
L'évaluation de la raideur se fait souvent par
l'analyse des symptômes cliniques, examen physique, mesure de l'amplitude
des mouvements articulaires à l'aide d'appareils
spécialisés, ainsi que des tests fonctionnels et examens
complémentaire [35].
1.5.5. Impact de la
Raideur Articulaire sur la Capacité Fonctionnelle
La raideur articulaire peut nuire à la
mobilité, affectant la capacité d'une personne à marcher,
à saisir des objets, ou à réaliser des gestes du
quotidien. Elle peut également limiter l'efficacité des
thérapies physiques, augmentant ainsi le risque de contractures
permanentes si elle n'est pas traitée de manière
appropriée [36].
1.6. Trouble musculaire
1.6.1. Types de Troubles
Musculaires Observés dans les
Lésions Cérébrales
Les troubles musculaires post-AVC incluent la faiblesse
musculaire, l'atrophie et la spasticité. L'atrophie survient souvent en
raison de l'immobilité ou de l'inefficacité des mouvements
musculaires post-AVC, tandis que la faiblesse musculaire est courante dans les
muscles qui ne sont plus contrôlés efficacement en raison des
lésions cérébrales [37].
1.6.2. Mécanismes
Physiopathologiques des Troubles Musculaires
Les lésions cérébrales altèrent
les voies motrices du cerveau, provoquant une perte de contrôle
musculaire et entraînant des troubles de la contraction et de la
relaxation musculaires. Cette perte de contrôle, en particulier au niveau
des muscles moteurs distaux, est un facteur majeur de la faiblesse musculaire
chez les patients cérébrolésés [38]. Les principaux
mécanismes d'un déficit moteur sont donc un dysfonctionnement
des:
Ø Motoneurones centraux (lésions des voies
corticospinale et corticobulbaire)
Ø Motoneurones inférieurs (p. ex., au cours
d'une polynévrite périphérique ou par atteinte des
cellules de la corne antérieure de la moelle)
Ø Jonction neuromusculaire
Ø Musculaire (p. ex., dues à des myopathies)
Certains signes cliniques permettent de situer le niveau des
lésions:
Ø L'atteinte de la voie
pyramidale désinhibe les motoneurones inférieurs,
entraînant une augmentation du tonus musculaire (spasticité) et
une exagération des réflexes d'étirement
(hyperréflexie). Un réflexe cutané plantaire en extension
(signe de Babinski) est spécifique d'une atteinte de la voie
corticospinale. Cependant, une dysfonction du motoneurone supérieur peut
réduire le tonus et les réflexes si la paralysie motrice est
soudaine et sévère (p. ex., en cas de transection de la moelle,
dans laquelle le tonus diminue d'abord, puis augmente progressivement au cours
des jours à quelques semaines suivantes) ou en cas de lésions du
cortex moteur du gyrus précentral et non des régions
d'association motrices situées à proximité.
Ø L'atteinte du motoneurone
inférieur interrompt l'arc réflexe du
réflexe myotatique, provoquant une hyporéflexie et une diminution
du tonus musculaire (flaccidité), peut provoquer des fasciculations; et,
avec le temps, une atrophie musculaire (amyotrophie).
Ø Les polynévrites
périphériques peuvent atteindre
préférentiellement les nerfs les plus longs (c'est-à-dire,
le déficit est alors à prédominance distale et aux membres
inférieurs) et se manifestent par un dysfonctionnement des motoneurones
inférieurs (p. ex., une diminution des réflexes et hypotonie).
Ø La cause la plus
fréquente d'atteinte de la jonction
neuromusculaire, la
myasthénie,
provoque typiquement un déficit fluctuant qui s'aggrave à
l'effort et s'atténue au repos.
Ø Les déficits musculaires
diffus (p. ex., en cas de myopathies) tendent à
prédominer sur les groupes musculaires les plus gros (muscles
proximaux)[38].
1.6.3. Evaluation des
Troubles Musculaires
L'évaluation des troubles musculaires se fait par des
tests fonctionnels, l'évaluation du tonus musculaire, et l'analyse de la
force musculaire. Des outils comme le test de force musculaire de Medical
Research Council (MRC) et les tests de préhension peuvent fournir des
informations sur la gravité des troubles musculaires [39].
1.6.4. Impact sur la
Fonction Motrice et l'Autonomie
Les troubles musculaires, en particulier la faiblesse et
l'atrophie, affectent directement la fonction motrice et l'autonomie. Les
patients peuvent éprouver des difficultés à se
déplacer, à se lever d'une position assise, à marcher, ou
même à effectuer des activités de la vie quotidienne comme
se nourrir, s'habiller ou se laver [40].
1.7. Approches thérapeutiques
Il existe plusieurs approches pour gérer les
complications neuro-orthopédiques, notamment:
1.7.1. La
rééducation:
Les experts réunis lors de la conférence de
consensus de la SOFMER ont conclu au rôle bénéfique de la
rééducation dans l'amélioration de la marche, de
l'activité gestuelle, de l'héminégligence et de
l'autonomie [41].
De plus, de nombreuses études ont permis de montrer un
bénéfice global réel sur les incapacités, d'autant
plus net que la rééducation est commencée tôt et
qu'elle concerne des malades jeunes [42]. Mais tous les patients, quels que
soient leur âge ou la gravité de lésion
cérébrale, doivent bénéficier d'une prise en charge
spécialisée et multidisciplinaire dès la phase initiale
[43].
Les bénéfices de la rééducation
reposent sur une prise en charge globale, interdisciplinaire, coordonnée
et attentive au projet de vie du patient. Il reste cependant parfois difficile
d'obtenir un transfert de ce qui a été acquis en
rééducation aux activités de la vie quotidienne (AVQ). La
rééducation doit impliquer l'entourage du patient, si cela est
possible, et l'informer sur la pathologie, l'importance de l'organisation de
l'environnement du patient en termes de stimulationset surtout le laisser faire
un maximum de choses: en l'aidant trop, on ne l'aide pas. En fonction des
conclusions du bilan établies sous la classification CIF [44], le
programme de rééducation doit être adapté à
chaque patient et réévalué à chaque séance
afin d'obtenir le meilleur niveau d'autonomie possible pour le patient, en
fonction de son environnement familial, social et matériel.
La rééducation devra se faire en trois grandes
phases:
1. Phase initiale
Les patients se trouvent en hospitalisations. Des
études menées par Whitte, Ottenbacher et Jannell montrent une
réduction significative du handicap en rapport avec l'intensité
et la précocité de la prise en charge. Il faut toutefois rester
prudent car une activité intense trop précoce peut être
à l'origine de l'augmentation du volume de l'ischémie [45].
Le déficit neurologique lié à un AVC peut
très rapidement entraîner des troubles qui aggraveront
l'état du patient et limiteront sa capacité de
récupération, si la prévention des complications n'est pas
faite précocement.
v Les precautions a respecter dans la
rééducation
Ø Respecter la fatigue du patient.
Ø Faire attention à la subluxation de
l'épaule.
Ø Prendre en compte les troubles associés:
fonctions supérieures, atteinte sensitive.
Ø Respecter les amplitudes physiologiques
articulaires lors des mobilisations
Ø Vérifier la tension artérielle (TA).
Ø Utiliser de nombreux stimuli: visuels, tactiles,
sonores.
Ø Associer la respiration aux exercices.
Ø Autoriser le patient à s'asseoir au lit ou
au fauteuil si la TA et les paramètres hémodynamiques le
permettent.
v Moyens
La prise en charge du patient est multidisciplinaire et fait
intervenir les médecins, les kinésithérapeutes, les
ergothérapeutes, les infirmières spécialisées et
les orthophonistes.
Ø Pour la prévention des complications
en phase aiguë:
- Installation du patient au lit en décubitus dorsal
avec bas de contention, sur un matelas anti-escarre, buste incliné de
30° pour favoriser la perfusion cérébrale et
l'oxygénation du tissu cérébral. L'hémicorps
hémiplégié doit être positionné en
antéposition avec des coussins;
- Retournements en sécurité sur les deux
côtés pour quelques minutes et prise de conscience de l'appui sur
le côté hémiplégique;
- la première mise au fauteuil, qui dure de 15 à
20 minutes, est assurée par le MK, qui surveille la TA; elle doit
être précédée la veille d'un test au bord du lit;
- Mobilisations articulaires douces de toutes les
articulations sans oublier la scapula;
- Étirements musculaires dans toutes les amplitudes en
veillant bien à stabiliser l'épaule lors des mobilisations du
MS;
- Kinésithérapie respiratoire [46].
Ø Initiation de la commande
motrice:
- Stimuler la motricité analytique et globale;
- Stimuler la sensibilité en donnant plus
d'informations;
- Apprentissage du pont fessier;
- Apprentissage des retournements et transferts;
- Apprentissage du maniement du fauteuil roulant [46].
2. Phase de récupération
Les objectifs poursuivis sont les suivants:
Ø Prévention des complications: subluxation de
l'épaule, escarres, rétractions musculaires, phlébite,
etc.
Ø Stimulation de la motricité.
Ø Stimulation de l'équilibre postural.
Ø Acquisition d'une marche fonctionnelle.
Ø Acquisition d'indépendance fonctionnelle
(proposer des aides' techniques).
Ø Réadaptation à l'effort.
Ø Éducation thérapeutique.
v Moyens
Ø Proposer des aides techniques.
Ø Privilégier les exercices fonctionnels
concernant: les transferts, la marche, l'équilibre debout et assis.
Ø Les moyens de prévention des complications
sont identiques à ceux en phase flasque.
Ø Exercice de Bobath en chevalier servant
3. Phase séquellaire
Après leur sortie de l' hôpital, les patients
poursuivent leur rééducation en libéral: au cabinet ou
à domicile. La rééducation à domicile permet de
jouer sur les incapacités du patient dans son environnement quotidien
mais, au cabinet, elle permet de diversifier les exercices proposés et
de faire sortir le patient de chez lui. Les patients vont continuer leur
rééducation suivant les mêmes objectifs que ceux de la
phase de recuperation [46].
1.7.2. Les
médicaments:
Ø La toxine botulique:La toxine
botulique est un traitement de première intention de la
spasticité chez l'hémiplégique vasculaire[47].
Elle est proposée dès la phase initiale, lorsque
la spasticité compromet l'acquisition de la marche stable[48].
La toxine botulinique est un complexe multimoléculaire
comprenant une part neuro-active (neurotoxine botulique) et des
protéines associées non neuro-actives[49].
Au PH plasmatique, la toxine botulique se dissocie rapidement
et libère la neurotoxine. Seule cette dernière est
capturée par les terminaisons nerveuses[50]. Dans le système
nerveux périphérique (SNP), elle inhibe la libération
d'acétylcholine(ACH). Son action provoque la paralysie des fibres
musculaires. Les actions de la toxine botulique sont réversibles[51].
Sept sérotypes de toxine botulique ont
été identifiés à ce jour (de A à G), mais
seuls 2 types (A et B) ont une application thérapeutique
approuvée. Les formations de type A sont utilisées pour le
traitement de la spasticité[48].
Le traitement consiste en des injections intramusculaires.
Concernant la technique
d'injection, il est recommandé de ne pas utiliser le
repérage anatomique seul. L'utilisation du repérage par
électrostimulation ou échographie est fortement conseillée
afin de cibler au mieux les muscles. Elle se pratique de
préférences sous repérage électromyographique, sous
électrostimulation ou sous échographie. Il s'agit d'une
thérapie dont l'effet est réversible[48].
Les effets secondaires et les contre-indications de la toxine
botulique concernent l'existence de pathologies de la jonction neuromusculaire,
l'allaitement et la grossesse, la prescription concomitante d'aminosides. Les
effets secondaires sont essentiellement locorégionaux. Le plus souvent
rapporté est la possibilité de faiblesse des muscles adjacents au
muscle injecté.
Au cours du traitement du pied équin, une faiblesse de
la jambe source de chutes est
rapportée dans 10% des cas. Rarement une incontinence
urinaire ou fécale a été décrite au décours
d'injections proximales des membres inférieurs. Ces effets secondaires
sont transitoires et régressent en 2 à 8 semaines suivant le
cas[48]. On retrouve également, la possibilité de douleurs
locales au point d'injection. Des effets systémiques bénins tels
que fièvre, syndromes grippale, nausées, asthénie, ont
été aussi signalés. Rarement, ont décrit la
survenue d'un syndrome botulism-like avec faiblesse [50].
Ø Les phénol et
alcool:L'alcoolisation ou la phénolisation ne
représentent pas le traitement local de première intention, sauf
dans certains cas de spasticité diffuse et gênante où ils
peuvent alors être utilisés en complément de la toxine.
L'alcool et le phénol agissent sur la spasticité par une action
de neurolyse chimique (destruction irréversible du nerf). Même si,
l'effet de ce traitement devrait être définitif, on constate
souvent une récidive de l'hypertonie après 6 à 12 mois, en
raison du bourgeonnement collatéral possible sur les axones indemnes du
nerf périphérique, établissant de nouveaux contacts
synaptiques et de nouvelles plaques motrices [51].
Cette situation peut conduire à la décision
d'une réinjection de phénol au contact du même nerf. Il
faut noter que ni le phénol, ni l'alcool n'ont une AMM car ils n'ont pas
fait l'objet d'évaluations. Le phénol glycériné
doit être préféré au phénol aqueux, qui
diffuse plus et donc moins bien toléré. L'injection locale doit
être effectuée sous électrostimulation ou repérage
échographique. Les nerfs ayant un faible contingent sensitif et une
large prédominance motrice peuvent être traités
(obturateur, musculo-cutané, anse pectorale...).
Ces traitements sont fortement déconseillés sur
les nerfs mixtes (tronc du nerf schiatique, tibial postérieur fibulaire
du membre inferieur, médian et ulnaire au membre supérieur), du
fait du risque sensitif et de douleurs très gênantes[51].
Ø Le baclofène
intrathécal:Il trouve son indication dans les cas de
spasticité diffuse des membres inférieurs [52].
Le baclofène intrathécal a néanmoins
été testé par quelques équipes chez des patients
hémiplégiques présentant une spasticité
sévère touchant l'ensemble du membre inférieur
parétique[53]. L'équipe rééducative du centre
hospitalier d'Aix- les-bains a publié en 2007 le cas d'un patient
hémiplégique amélioré sur le plan analytique (score
d'Ashworth) et fonctionnel (schéma et périmètre de marche)
après une injection intrathécale de 50 à 75ìgr de
baclofène[48].
Ø Traitements oraux de la
spasticité:Le traitement médicamenteux de la
spasticité est personnalisé et réévalué de
manière périodique. Des associations thérapeutiques sont
souvent nécessaires pour optimiser la prise en charge des gênes
induites par la spasticité[48].
Plusieurs molécules ont une AMM dans la
spasticité. Il s'agit du baclofène et du dantrolène
sodique[48]. Cependant, seules 2 molécules ont fait la preuve de leur
efficacité sur la réduction de la spasticité,
évaluée par le score d'Ashworth: le baclofène et
tizanidine[51].Le dantrolène a une AMM, mais l'ancienneté des
études et leur niveau de preuve insuffisant ne permettent pas de le
recommander sur les données de la littérature.
Ø La tizanidine est recommandée en cas
d'inefficacité, d'effet indésirable ou de contreindication au
baclofène[51].
L'introduction et l'adaptation des doses de ces traitements
oraux doivent se faire de façon progressive, en fonction de
l'efficacité et des effets indésirables. Il est
préconisé que tout traitement prescrit de façon
prolongée soit réévalué
régulièrement. En fonction de la situation, cette
réévaluation peut comporter une fenêtre
thérapeutique par diminution progressive.
Le baclofène peut avoir un effet
délétère sur la plasticité post lésionnelle
et peut entrainer des troubles cognitifs, ce qui incite à une grande
précaution chez les patients en phase de récupération (AVC
à la phase aigüe)[51].Le baclofène est actif au niveau des
récepteurs GABA pré-synaptiques et post-synaptiques augmentant
l'inhibition pré-synaptique. Son efficacité est
avérée dans la spasticité d'origine spinale, les effets
secondaires les plus fréquents sont de la somnolence, des vertiges et
une diminution du seuil de l'épilepsie.
Des effets secondaires sont la sédation, la
sécheresse buccale, l'hypotension et les
perturbations de la fonction hépatique (3% des cas)
motivant une surveillance biologique de la fonction hépatique[51].
Ø Le dantrolène sodique est le
seul antispastique d'action périphérique. Il agit directement sur
les fibres musculaires par inhibition des mouvements calciques
générant une diminution de la force musculaire par
découpage excitation-contraction. Il agit également sur le muscle
cardiaque ce qui contre indique l'utilisation concomitante de toute autre
thérapeutique anticalcique à visée cardiaque. Son effet
secondaire principal est la faiblesse musculaire. Elle est directement
liée à son mode d'action. Le plus des important des effets
secondaires est cependant l'hépatotoxicité dont l'incidence est
de 1,8%[51]. Une surveillance biologique tous les deux mois est donc
indispensable.
Les antidépresseurs et les antidouleurs peuvent
être prescrits lorsqu'il y a une répercussion sur la marche[51].
Ø Les interventions chirurgicales dans
certains cas sévères.
Ils s'adressent à la spasticité elle-même
et/ou à ses complications musculo-tendineuses. Les indications
retiennent des objectifs fonctionnels.
CHAPITRE 2. MATERIEL ET METHODES
2.1. Nature et période de l'étude
Nous avons mené une étude analytique, ayant
couvert la période allant du 20 novembre 2024 au 20 janvier 2025, soit
deux mois.
2.2. Cadre de l'étude
Le Centre de Rééducation pour Handicapé
Physique(CRHP)et les Cliniques Universitaires de Kinshasa (CUK) ont servi de
cadre à la présente étude, le choix porté à
ces deux Hôpitaux était motivé par la fréquence des
malades hémiplégiques qui viennent régulièrement
suivre des séances de rééducation.
2.3. Population de l'étude
La population cible de cette étude comprend des
patients adultes ayant subi une lésion cérébrale
présentant des séquelles neuro-orthopédiques.
2.4. Echantillonnage et échantillon
Nous avons recouru à un échantillonnage
aléatoire de convenance, qui nous a permis de retenir un
échantillon de 30 patients cérébrolésés.
2.5. Critères de sélection
2.5.1. Critères d'inclusion
Sont inclus à l'étude les patients ayant remplis
les critères suivants :
- Être âgé d'au moins 18 ans,
- Avoir subi une lésion cérébrale,
- Avoir présenté de complications
neuro-orthopédiques tels que les plus commun la triple flexion du membre
supérieur, l'équinisme au niveau de la cheville et avoir
présenté ou pas une spasticité.
2.5.2. Critères
d'exclusion
Était exclus de notre étude, tout patient ne
répondant aux critères d'inclusion.
2.6. Variables de l'étude
2.6.1. Variable dépendants :
Dans cette étude, les variables dépendantes sont
des facteurs influencés par les séquelles neuro-orthopediques.
- Complication neuro-orthopédique:
Les complications neuro-orthopédiques incluent les
troubles musculosquelettiques qui résultent de lésions
neurologiques, comme les contractures, déformations, ou douleurs. Ces
complications ont un impact majeur sur la capacité fonctionnelle des
patients cérébro-lésés, affectant leur autonomie et
leur qualité de vie. Les contractures et déformations peuvent
limiter le mouvement et la mobilité, compromettant ainsi la
rééducation et la réadaptation
- Mobilité:
La mobilité fait référence à la
capacité du patient à se déplacer indépendamment ou
avec une aide partielle. C'est une variable essentielle pour évaluer
l'indépendance fonctionnelle des patients
cérébro-lésés. Les troubles de la mobilité
(tels que la difficulté à marcher) sont souvent dus à des
séquelles de l'AVC, de la spasticité ou des déformations
articulaires.
- Fonction:
La fonction est liée à la capacité du
patient à accomplir des activités quotidiennes de manière
autonome. Cela inclut des tâches comme s'habiller, manger ou se
déplacer. La fonction est étroitement liée à
l'étendue des lésions cérébrales et à la
rééducation suivie. Le suivi de la fonction permet
d'évaluer l'impact des séquelles neurologiques sur les
compétences motrices globales.
- Autonomie:
L'autonomie est un indicateur fondamental de la qualité
de vie des patients cérébro-lésés. Elle
dénote la capacité à effectuer des activités sans
assistance extérieure, telles que l'hygiène personnelle, se
déplacer dans son environnement ou gérer ses besoins quotidiens.
L'autonomie peut être altérée par les complications
neuro-orthopédiques, la spasticité et les troubles
musculaires.
2.6.2. Variables indépendants :
Jouent un rôle crucial dans l'analyse des
résultats fonctionnels chez les individus affectés par des
lésions cérébrales, permettant ainsi d'identifier les
facteurs qui influencent leur prise en charge.
- Âge:
L'âge des patients peut influencer la
récupération fonctionnelle après une lésion
cérébrale. En général, les jeunes adultes peuvent
avoir une meilleure plasticité cérébrale et des
capacités de récupération plus rapides que les personnes
âgées. Cependant, l'âge n'est pas le seul facteur
déterminant, car d'autres variables, comme la gravité de la
lésion et le traitement suivi, jouent également un rôle.
- Genre:
Les différences de genre peuvent influencer la
réponse du corps à la rééducation, ainsi que
l'intensité et la nature des complications post-lésion
cérébrale. Les études suggèrent que les femmes et
les hommes peuvent vivre l'AVC ou d'autres lésions
cérébrales de manière différente, avec des facteurs
hormonaux et physiologiques pouvant affecter la récupération
fonctionnelle.
- Profession:
La profession d'un patient peut influencer son
rétablissement fonctionnel, car certains métiers
nécessitent un certain niveau de mobilité ou de coordination. Un
patient travaillant dans un environnement demandant une activité
physique intense pourrait avoir des objectifs rééducatifs
différents d'un patient ayant un travail de bureau. De plus, l'emploi
peut aussi être une source de stress ou de motivation, influençant
la rééducation.
- Niveau d'étude:
Le niveau d'étude peut avoir un impact sur la prise en
charge et la récupération, car un patient ayant un niveau
d'éducation plus élevé pourrait mieux comprendre le
processus de rééducation et être plus impliqué dans
sa propre récupération. L'éducation peut aussi influencer
l'accès aux soins et l'adhésion aux recommandations
thérapeutiques.
- Type de
lésion cérébrale:
Le type de lésion cérébrale (par exemple,
AVC, traumatisme crânien, etc...) détermine la nature et
l'étendue des déficits neurologiques. Certaines lésions
cérébrales, comme les AVC, affectent des zones spécifiques
du cerveau et peuvent entraîner des complications telles que la paralysie
d'un côté du corps, des troubles du langage ou des
problèmes de coordination.
- Lieu d'hospitalisation:
Le lieu d'hospitalisation peut avoir un impact significatif
sur la qualité de la prise en charge. Les établissements offrant
des soins spécialisés en neurologie et en
rééducation peuvent améliorer les résultats
fonctionnels par rapport à d'autres établissements moins
spécialisés. Le lieu peut également affecter la
rapidité de l'accès aux soins et la qualité du suivi.
- Délai de prise en charge médicale (en
jours):
Le délai de prise en charge médicale,
c'est-à-dire le temps écoulé entre la survenue de la
lésion cérébrale et la première consultation
médicale, peut influencer la gravité des séquelles
à long terme. Une prise en charge précoce est
généralement associée à une meilleure
récupération fonctionnelle. Un retard dans le traitement peut
entraîner des complications supplémentaires et ralentir la
réadaptation.
- Délai de prise en charge
rééducation (en jours):
Le délai de prise en charge en
rééducation est crucial pour la récupération
fonctionnelle. Une rééducation précoce et intensive est
souvent associée à une meilleure récupération des
capacités motrices et fonctionnelles. En revanche, un retard dans le
début de la rééducation peut limiter la
récupération et augmenter les risques de complications à
long terme.
2.7. Collecte des données
2.7.1. Équipe de recherche et démarche
administrative
L'équipe de recherche était composée de
l'encadrant et moi-même.Nous avons obtenu l'autorisation de recherche au
Vice Décanat Chargé de la Recherche (VDRSA) de la Faculté
de Médecine de l'université de Kinshasa, puis l'avons
déposé dans les Hôpitaux choisie de notre étude en
vue de faciliter le contact avec notre population cible de la présente
étude, avant l'administration du questionnaire conçu par
nous-mêmes.
2.7.2. Matériels utilisés :
Pour notre collecte nous avons utilisé des fiches de
collecte des données conçues par nous-mêmes, ayant
nécessité l'usage de :
² Échelle d'arshworth
modifié
L'échelle d'Ashworth utilisée aujourd'hui dans
sa version modifiée. Elle avait été mise
au point pour évaluer l'effet d'un traitement anti-spastique chez des
patients atteints de SEP. Il s'agit de l'échelle la plus utilisée
en pratique quotidienne et dans la littérature scientifique. Sa
variabilité intra-juge est correcte. Sa variabilité inter-juge ne
l'est pas. La forme modifiée de cette échelle est plus sensible.
· 0: le tonus musculaire normal
· 1: l'augmentation discrète du
tonus musculaire se manifestant par un ressaut suivi d'un relâchement ou
par une résistance minime en fin de mouvement
· 1 +: l'augmentation discrète du
tonus musculaire se manifestant par un ressaut suivi d'une résistance
minime perçue sur moins de la moitié de l'amplitude articulaire
· 2: l'augmentation plus marquée
du tonus musculaire touchant la majeure partie de l'amplitude articulaire,
l'articulation pouvant être mobilisée facilement
· 3: l'augmentation importante du tonus
musculaire rendant la mobilisation passive difficile
· 4: l'articulation concernée est
fixée en flexion ou extension, abduction ou adduction[20].
² Échelle numérique à la
douleur
L'échelle numérique est une méthode
d'évaluation subjective de l'intensité de la douleur ou de la
gêne ressentie par un patient. Il s'agit d'une échelle allant
généralement de 0 à 10, où 0 signifie "pas de
douleur" et 10 indique "la pire douleur possible". L'échelle
numérique est largement utilisée dans les contextes cliniques
pour évaluer la douleur de manière rapide et simple.
² Indice de Barthel
L'indice de Barthel est une échelle
d'évaluation de l'autonomie fonctionnelle des patients, en particulier
ceux atteints de troubles neurologiques, comme les personnes ayant subi un AVC.
Elle mesure l'aptitude du patient à accomplir des activités de la
vie quotidienne telles que manger, se laver, s'habiller, se déplacer,
etc. L'échelle attribue des scores allant de 0 à 100, en fonction
du niveau d'indépendance du patient dans chaque activité.
Elle est utilisée pour évaluer le niveau
d'autonomie des patients cérébro-lésés et observer
l'évolution de leur capacité fonctionnelle après la
rééducation.
² Échelle de force de préhension
de Jamar modifié
L'échelle de force de préhension de Jamar est
un test de la force de préhension manuelle, mesurant la force des
doigts, de la main et de l'avant-bras. L'échelle modifiée permet
d'évaluer la force de préhension des patients dans
différentes positions de la main (par exemple, en position ouverte ou
fermée). Elle est couramment utilisée pour évaluer la
fonction du membre supérieur et la force musculaire dans les troubles
neurologiques.
Elle est utilisée pour mesurer la force de
préhension chez les patients cérébro-lésés
et évaluer l'impact des complications neuro-orthopédiques (comme
la spasticité ou les contractures) sur la fonction du membre
supérieur.
² Ruban métrique
Le ruban métrique est un outil de mesure flexible,
généralement utilisé pour mesurer les dimensions
corporelles, telles que les circonférences des articulations, des
membres. Il est également utilisé pour évaluer les
changements dans la morphologie corporelle.
Il peut être utilisé pour mesurer des
déformations articulaires, la circonférence des membres
affectés ou les éventuelles modifications corporelles
liées aux complications neuro-orthopédiques (comme les
gonflements ou les contractures).
² Échelle de Mesure de la fonction
motrice
L'échelle de mesure de la fonction motrice est une
évaluation détaillée des capacités motrices du
patient, en se concentrant sur l'amplitude de mouvement, la force musculaire,
la coordination et la stabilité des articulations. Elle peut être
utilisée pour mesurer l'impact de la spasticité, des troubles
musculaires et des déformations sur la fonction motrice globale du
patient.
Elle permet d'évaluer la fonction motrice des patients
cérébro-lésés en fonction de leurs capacités
physiques et fonctionnelles après une rééducation.
² Goniomètre
Le goniomètre est un outil utilisé pour mesurer
l'amplitude des mouvements articulaires. Il permet de quantifier l'angle des
articulations lorsqu'un patient exécute un mouvement spécifique,
par exemple, la flexion ou l'extension du genou, du coude, etc. Il est
essentiel dans le suivi de la progression de la rééducation
articulaire et dans l'évaluation de la raideur articulaire.
Il permet de mesurer les amplitudes de mouvement des
articulations touchées par les séquelles neurologiques (comme le
genou, le coude ou l'épaule), permettant ainsi de suivre la progression
de la mobilité des patients.
² Papier diplicateur
Le papier duplicateur est utilisé pour faire des
copies rapides de documents ou de formulaires. Dans un cadre clinique, il peut
être utilisé pour enregistrer des informations importantes sur
l'état des patients ou pour obtenir des consentements
éclairés.
² Stylo
Le stylo est un outil standard de rédaction et de
prise de notes.
² Ordinateur portable
L'ordinateur portable est un outil informatique utilisé
pour entrer, analyser et stocker des données. Il permet également
de créer des rapports, de rédiger des documents et d'effectuer
des recherches médicales ou scientifiques
2.7. 2. Collectes proprement dites ou déroulement de
l'éthique
Après toutes les formalités administratives, un
contact avec la population cible a été établi, une
étape très importante qui nous a permis d'expliquer aux
concernés ce que nous voulions et ceux-ci ont accepté de faire
partie de notre étude.
Après cette étape de prise de contact et
d'explication, nous les avons administré un questionnaire conçu
par nous-mêmes, dont le contenu en variables de l'étude.
Nous avons collecté chaque variable de manière
à éviter le biais, notamment:
Une évaluation clinique était faite chez les
patients à la recherche de différentes complications neuro
orthopédiques et était axée sur:
v Les plus communes, au membre supérieur, sont
l'adduction/rotationinterne d'épaule, la flexion du coude, la pronation
de l'avant-bras, la flexion du poignet, des doigts et l'adduction/opposition du
pouce.
v Les plus communes, au membre inférieur, sont
l'adductum/flexum de hanche et le pied varus équin.
v Trouble musculaire
Nous avons évalué ici la composante trophique
des troubles musculaires par
la mesure des différents périmètres
segmentaires à l'aide d'un ruban
métrique et ce, de manière comparative.
v Raideur articulaire
Nous avons évaluer d'une manière cliniques la
présence ou pas d'une limitation d'amplitude articulaire à l'aide
du goniomètre. Nous avons également recherché la
présence de rétractions musculo-tendineuses.
v Spasticité
Nous avons recherché le degré du tonus a l'aide
de l'ashworth.
v Douleur
Nous avons grâce à l'échelle
numérique évalué la douleur et son impact sur la
réalisation fonctionnelle.
v Autonomie
Nous avons grâce à l'indice de barthel
évalué la capacité qu'ont nos patient a gérer leurs
autonomie.
2.8. Définitions opérationnelles
n Complications
neuro-orthopédiques:Sont des problèmes
musculo-squelettiques qui résultent de l'interaction entre des troubles
neurologiques et le système musculo-squelettique [54].
n Impact:C'est l'effet produit par quelque
chose; contrecoup, influence [55].
n Capacité fonctionnelle:est la
possibilité qu'a un patient de réaliser un effort pour une
fonction corporelle [56].
n
Cérébro-lésés:La lésion
cérébrale acquise désigne tout dommage au cerveau survenu
après la naissance qui peut être d'origine traumatique,
infectieuse, inflammatoire ou tumoral [57].
n Autonomie:la capacité a
gérer des dépendances dans la vie de tous les jours [58].
2.9. Considerations ethniques
L'étude a été conduite en respectant les
Principes éthiques, en veillant à la confidentialité
sur la recherche Biomédicales, dans le respect de
déclaration de Helsinki.
2.10. Analyses statistiques
Les données ontété saisie sur Excel puis
rapportées au logiciel SPSS 22.0 for Windows en vue des analyses
statistiques.
Les variables quantitatives étant normalement
distribuées, étaient synthétisées à l'aide
des mesures de tendance centrale et de dispersion des données telles que
la moyenne et l'écart type.
Les variables qualitatives ont été
présentées dans les figures sous forme de pourcentages et
regrouper en tests statistiques du Chi carré de Pearson avec un seuil de
signification de p=0,05
Et les autres variables qualitatives sont
présentées dans les tableaux sous forme de fréquence et
pourcentage.
CHAPITRE 3. LES RESULTATS
Dans ce chapitre, nous présenterons nos
résultats de la manière suivante:
3.1. Caractéristiques sociodémographiques
3.1.1. Le sexe
60%
40%
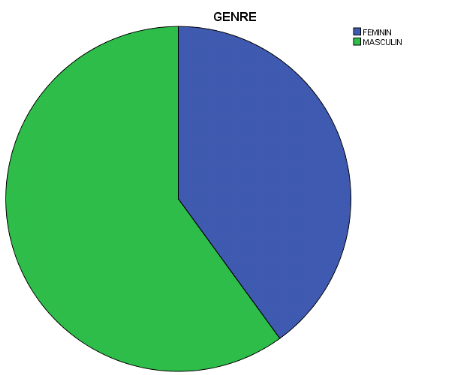
Figure1. Répartition
des participants selon le sexe
Cette figure montre une prédominance masculine avec 60%
contre 40% pour le sexe féminin.
3.1.2 Niveau d'étude
10%
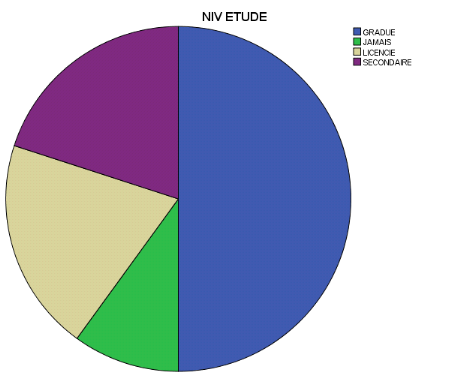
50%
20%
20%
Figure2. Répartition
des participants selon leur niveau d'étude
Cette figure révèle que la majorité (50%)
des participants était des gradués, suivis respectivement des
licenciés (20,0%), du niveau secondaire (20,0%) et de ceux qui n'ont
jamais été scolarisés (10%).
3.1.3. Profession
13,3%
10%
20,0%
3,3%
23,3%
30%
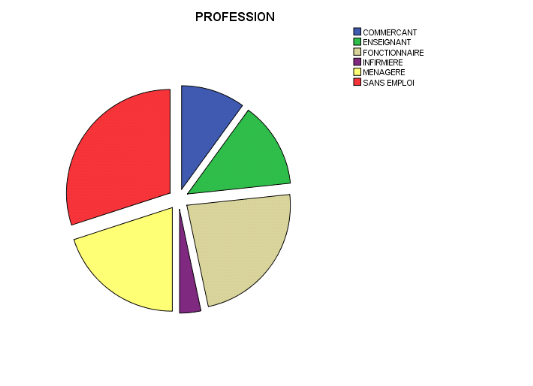
Figure3. Répartition
des participants selon leur profession
Cette figure montre que la majorité des participants
était sans emploi 30%, 23,3% parmi eux était des fonctionnaires
de l'état, 20,0% était des ménagères et 13,3% sont
des enseignants et 10% sont des commerçants.
3.1.4. L'âge
Tableau I. Répartition
des patients selon l'âge
|
Tranche d'âge
|
Fréquence
|
Moyenne #177;ET Min-Max
|
|
< 30 ans
30 à 39 ans
40 à 49 ans
50 à 59 ans
60 ans et plus
|
2(6,7%)
4(13,4%)
6(20,0%)
8(26,6%)
10 (33,3%)
|
52,70#177;14,7 28-86
|
Il ressort de ce tableau que 33,3% des participants
étaient âgés de 60 ans et plus, suivis par ceux de 50
à 59 ans (26,6%), puis les tranches de 40 à 49 ans (20,0%) et
enfin les tranches d'âge plus jeunes avec seulement 6,7% pour les moins
de 30 ans et 13,4% pour les 30-39 ans.
3.2. Caractéristiques cliniques
3.2.1. Les antécédents, type de lésion et
mobilité
Tableau II.
Répartition selon les antécédents, le type de
lésion et la mobilité
|
Variables
|
Fréquence (%)
Homme (n=18) Femme (n=12)
|
|
Ø Antécédents
- Aucun
- Alcool
- Cardiopathie
- Diabète
- HTA
- Obésité
- Tabac
Ø Type de lésion
- Non traumatique
- Traumatique
Ø Mobilité
- Alité
- Canne
- Fauteuil roulant
- Seul (Sans aide technique)
|
1(5,6%) 0(0%)
3(16,7%) 0(0%)
0(0%) 1(8,3%)
3(16,7%) 2(16,7%)
14(77,8%) 9(75%)
2(11,1%) 1(8,3%)
0(0%) 1(8,3%)
0(0%) 1(8,3%)
17(94,4%) 12(100%)
1(5,6%) 0(0%)
1(5,6%) 1(8,3%)
5(27,8%) 0(0%)
6(33,3%) 4(33,3%)
6(33,3%) 7(58,3%)
|
Ce tableau révèle que la majorité (84%)
des participants avait un antécédent d'hypertension
artérielle, 96,7% de lésion était d'origine non
traumatique, 43,3% des participants se déplacent seul, 33,3% se
déplace sur fauteuil roulant, 16,7% se déplace avec canne et 6,7%
était alité.
3.2.2.Évaluation articulaires
Ø Membres supérieurs
TableauIII.
Répartition des participants selon l'évaluation articulaire des
MS
|
Segments/Articulations
|
Fréquence (%)
Gonflement Douleur Crépitation
Mobilité
|
|
Mains
Ø Flexion-extension doigts
- Non
- Oui
Ø Abduction-adduction doigts
- Non
- Oui
Poignets
Ø Flexion-extension
- Non
- Oui
Ø Inclinaison
- Non
- Oui
Coude
Ø Flexion-extension
- Non
- Oui
Ø Pronation-supination
- Non
- Oui
Epaule
Ø Antépulsion-retropulsion
- Non
- Oui
Ø Abduction-adduction
- Non
- Oui
Ø Rotation
- Non
- Oui
Ø Circumduction
- Non
- Oui
|
20(66,7%) 10(33,3%) 17(56,7%) 4(13,3%)
10(33,3%) 20(66,7%) 13(43,3%) 26(86,7%)
18(60%) 12(40%) 20(66,7)
4(13,3)
12(40%) 18(60%) 10(33,3%) 26(86,7%)
18(60%) 14(46,7%) 21(70%)
7(23,3%)
12(40%) 16(53,3%) 9(30%)
23(76,7%)
18(60%) 13(43,3%) 22(73,3%) 4(13,3%)
12(40%) 17(56,7%) 8(26,7%)
26(86,7%)
20(66,7%) 14(46,7%) 18(60%)
3(10%)
10(33,3%) 16(53,3%) 12(40%)
27(90%)
20(66,7%) 15(50%) 19(63,3%)
7(23,3%)
10(33,3%) 15(50%) 11(36,7%)
23(76,7%)
19(63,3%) 9(30%) 18(60%)
6(20%)
11(36,7%) 21(70%) 12(40%)
24(80%)
21(70%) 13(43,3%) 22(73,3%)
4(13,3%)
9(30%) 17(56,7%) 8(36,7%)
26(86,7%)
20(66,7%) 16(53,3%) 22(73,3%)
7(23,3%)
10(33,3%) 14(46,7%) 8(26,7%)
23(76,7%)
21(70%) 15(50%) 21(70%)
4(13,3%)
9(30%) 15(50%) 9(30%)
26(86,7%)
|
Ce tableau montre que l'évaluation articulaire des
membres supérieurs a révélé que plusieurs
articulations présentent une prévalence élevée de
symptômes fonctionnels. En particulier, la douleur et la restriction de
mobilité semblent être les plus fréquentes. Pour les mains,
66,7% des participants ont rapporté des douleurs lors de la
flexion-extension des doigts et 56,7% pour l'abduction-adduction des doigts.
Concernant les poignets, 86,7% des participants ont signalé des douleurs
lors de l'inclinaison, ce qui met en évidence une limitation importante
de la fonction de cette articulation.
Au niveau des coudes, la flexion-extension a montré que
60% des participants avaient des douleurs, tandis que pour l'épaule, des
limitations de mouvement importantes ont été observées,
avec 86,7% des participants montrant des restrictions dans
l'antépulsion-rétropulsion et la rotation.
Ø Membres inférieurs
TableauIV. Répartition
selon l'évaluation articulaires des MI
|
Segments/Articulations
|
Fréquence (%)
Gonflement Douleur Crépitation
Mobilité
|
|
Hanche Flexion-extension
- Non
- Oui
Abduction-adduction
- Non
- Oui
Rotation interne-rotation externe
- Non
- Oui
Genou Flexion-extension
- Non
- Oui
ChevilleDorsiflexion-flexion plantaire
- Non
- Oui
Inversion-éversion
- Non
- Oui
|
24(80%) 13(43,3%) 24(80%)
5(16,7%)
6(20%) 17(56,7%) 6(20%)
25(83,3%)
23(76,7%) 15(50%) 24(80%)
7(23,3%)
7(23,3%) 15(50%) 6(20%)
23(76,7%)
23(76,7%) 15(50%) 24(80%)
4(13,3%)
7(23,3%) 15(50%) 6(20%)
26(86,7%)
22(73,3%) 15(50%) 23(76,3%) 6(20%)
8(26,7%) 15(50%) 7(23,3%)
24(80%)
21(70%) 15(50%) 23(76,3%)
8(26,7%)
9(30%) 15(50%) 7(23,3%)
22(73,3%)
21(70%) 15(50%) 23(76,3%)
8(26,7%)
9(30%) 15(50%) 7(23,3%)
22(73,3%)
|
Ce tableau révèle que la majorité des
participants présentes des symptômes notables au niveau des
hanches, genoux et chevilles. A la hanche, 80% des participants
présentent un gonflement, tandis que 43,3% ressentent de la douleur lors
de la flexion-extension, et 80% des participants sont affectés par
l'abduction-adduction et la rotation interne-externe. Concernant le genou,
76,7% rapportent des douleurs et des restrictions lors de la flexion-extension.
Pour les chevilles, 76,3% des participants montrent des gonflements, 50%
ressentent de la douleur lors de la dorsiflexion-flexion plantaire, et 73,3%
présentent des limitations de mobilité lors de
l'éversion-inversion.
Ces résultats révèlent une
prévalence significative de la douleur, du gonflement et des
restrictions de mobilité dans les articulations des membres
inférieurs.
3.3. Paramètres liés aux complications
neuro-orthopédiques
Tableau V.Les complications
neuro-orthopédiques des participants
|
Types de complications
|
Fréquence (%)
Homme (n=18) Femme (n=12)
|
|
Ø Contractures
- Non
- Oui
Ø Déformations
- Non
- Oui
Ø Ashworth modifié
- 0
- 1
- 1+
- 2
- 3
- 4
Ø Douleur (EN)
- 0-3
- 4-6
- 7-9
- 10
|
6(33,3%) 6(50%)
12(66,7%) 6(50%)
6(33,3%) 5(41,7%)
12(66,7%) 7(58,3%)
6(33,3%) 6(50%)
7(38,9%) 4(33,3%)
5(27,8%) 1(8,3%)
0(0%) 1(8,3%)
0(0%) 0(0%)
0(0%) 0(0%)
3(16,7%) 5(41,7%)
8(44,4%) 7(58,3%)
6(33,3%) 0(0%)
1(5,6%) 0(0%)
|
Ce tableau révèle que 12(40%) n'avais pas de
contracture et 18(60%) d'entre eux en avais, 11(36,7%) présenter une
déformation orthopédique et 19(63,3%) n'en présenter pas,
12(40%) de ce même patient présenter un Ashworth modifié
coté a 0, 11(36,7%) coté a 1, 6(20,0%) coté a 1+, 1(3,3%)
coté a 2, 0(0%) coté a 3, 0(0%) coté a 4, 8(26,7%) de
l'échantillon représenter une échelle numérique
compris entre 0-3, 15(50,0%) compris entre 4-6, 6(20,0%) compris entre 7-9 et
1(3,3%) coté a 10.
3.4. Paramètres liés à la capacité
fonctionnelle
3.4.1.Évaluation de la préhension
Tableau VI.
Répartition des participants selon le type de préhension et de
prise
|
La préhension
|
Fréquence (%)
Homme (n=18) Femme
(n=12)
|
|
Ø Préhension
- Non
- Oui
Ø Préhension Globale
- Non
- Oui
Ø Préhension Fine
- Non
- Oui
Ø Prise en pince
- Non
- Oui
Ø Prise en poing
- Non
- Oui
Ø Prise à deux mains
- Non
- Oui
Ø Prise latérale
- Non
- Oui
Ø Force de préhension
- Très faible
- Faible
- Moyenne
- Bonne
- Excellente
|
0(0%) 2(16,7%)
18(100%) 10(83,3%)
0(0%) 2(16,7%)
18(100%) 10(83,3%)
6(33,3%) 5(41,7%)
12(66,7%) 7(58,3%)
5(27,7%) 6(50%)
13(72,3%) 6(50%)
1(5,5%) 2(16,7%)
17(94,5%) 10(83,3%)
0(0%) 2(16,7%)
18(100%) 10(83,3%)
2(11,1%) 5(41,7%)
16(88,9%) 7(58,3%)
0(0%) 2(16,7%)
5(27,7%) 3(25%)
6(33,3%) 4(33,3%)
6(33,3%) 3(25%)
1(5,5%) 0(0%)
|
Ce tableau nous révèle que 2(6,7%)
n'arrivaient pas a faire une préhension globale et 28(93,3%) y parvenez,
11(36,7%) pouvez pas faire une préhension fine et 19(63,3%) pouvais,
11(36,7%) pouvais pas faire uneprise en pince et 19(63,3%) pouvais, 3(10%) ne
pouvez pas faire une prise en point et 27(90%) le pouvais, 2(6,7%) ne pouvais
pas faire une prise à deux mains et 28(93,3%) le pouvais, 2(6,7%) avais
une force de préhension très faible, 8(26,7%statistique) avais
une force de préhension faible, 10(33,3%) avais une force de
préhension moyenne, 9(30%) avais une bonne force de préhension
et 1(3,3%) une excellente force de préhension.
3.4.2.Évaluation de la Marche
Tableau VII.
Répartition des participants selon les différents type de Marche
et la mesure de la fonction motrice.
|
La marche
|
Fréquence (%)
Homme (n=18) Femme (n=12)
|
|
Ø Type de marche
- Fauchante
- Steppante
- Normale
Ø Mesure de la fonction motrice
- 0
- 1
- 2
- 3
|
11(61,1%) 6(50%)
4(22,2%) 2(16,7%)
3(16,7%) 4(33,3%)
2(11,1%) 0(0%)
3(16,7%) 6(50%)
10(55,6%) 4(33,3%)
3(16,7%) 2(16,7%)
|
Ce tableau révèle que 17(56,7%) avaient une
marche fauchante, 7(23,3%) une marche stepante et 6(20%) avaient une marche
normale.
Dans le même tableau nous notons au niveau de la
fonction motrice que 2(6,7%) n'étais pas capable de se déplacer,
9(30%) essayer quand même mais sans pourtant y arriver 14(46,7%)
pouvaient se déplacer mais seulement avec aide et 5(16,7%) entaient
capable de se déplacer sans aide.
3.4.3.Évaluation de l'autonomie
Tableau VIII.
Évaluation de l'autonomie selon l'indice de Barthel
|
Autonomie (Indice de Barthel)
|
Fréquence (%)
Homme (n=18) Femme (n=12)
|
|
Ø Dépendance totale
Ø Dépendance sévère
Ø Dépendance modérée
Ø Dépendance légère
Ø Indépendance totale
|
2(11,1%) 0(0%)
1(5,5%) 7(58,3%)
8(44,4%) 4(33,3%)
7(38,9%) 0(0%)
0(0%) 1(8,3%)
|
Ce tableau révèle que 2(6,7%) ont une
Dépendance totale, 8(26,7%) une dépendance sévère,
12(40%) une dépendancemodérée,7(23,3%) Indépendance
légère et 1(3,3%) ont une Indépendance totale.
Rélation entre les variables
1.
Pour la préhension
Tableau IX.Impact des
complications neuro-orthopédiques sur la préhension
|
Variables
|
Préhension
NON OUI Total
p
|
|
Contractures
Non
Oui
Total
Déformation
Non
Oui
Total
Douleur
Non
Oui
Total
|
2 10 12
0 8 18
0,049
2 18 30
1 1 2
10 18 28
0,000
1 19 30
1 1 2
16 12 18
0,007
17 13 20
|
Ce tableau révèle que la préhension a
été significativement influencée par les contractures
(p=0,049), les déformations (p=0,000) et la douleur (p=0,007).
2.
Pour la Marche
Tableau X. Répartition
des participants selon l'impact des complications neuro-orthopédiques
sur la marche
|
Variables
|
Marche
Fauchante Steppante Normale Total p
|
|
Contractures
Non
Oui
Total
Déformation
Non
Oui
Total
Douleur
Non
Oui
Total
|
5(16,7%) 4(13,3%) 3(10%) 12(40%)
12(40%) 3(10%) 3(10%) 18(60%)
0,225
17(56,7%) 7(23,3%) 6(20%) 30(100%)
4(13,3%) 4(13,3%) 3(10%) 11(36,7%)
13(43,3%) 3(10%) 3(10%) 19(63,3%)
0,386
17(56,7%) 7(23,3%) 6(20%) 30(100%)
7(23,3%) 5(16,7%) 5(16,7%) 17(56,7%)
10(33,3%) 2(6,7%) 1(3,3%) 13(43,3%)
0,115
17(56,6%) 7(23,3%) 6(20%) 30(100%)
|
Ce tableau montre que les complications
neuro-orthopédiques n'influencent pas significativement la marche, ni
les contractures (p=0,225), ni les déformations (p=0,386) ni encore la
douleur (p=0,115).
CHAPITRE 4. DISCUSSION
La présente étude a été
menée auprès des 30 patients présentant des
séquelles post lésion cérébrale au cours de leur
prise en charge en réadaptation fonctionnelle.
Elle a visé à évaluer l'impact des
complications neuro-orthopédiques sur la capacité fonctionnelle
des adultes cérébro-lésés suivis en
rééducation, et a determiner leur autonomie.
Concernant le sexe des patients
Une prédominance masculine avec 60% de cas des patients
cérébrolésés, ce résultat se rapproche de
celui de Longo M et al. [59], qui a aussi trouvé une prédominance
masculine avec 65% et celui ABRAHAM G avec 62% [60], et même celui de
TOUZANI R. qui dans son étude les hommes représentaient 57,72%
[61].
Cette convergence s'explique par le fait que toutes ses
études sont menées dans les hôpitaux de Kinshasa où
les facteurs de risque sont presque les mêmes, et surtout qu'en Afrique
en général et en République Démocratique du Congo
en particulier, c'est l'homme qui est la pièce maîtresse du foyer
augmentant le stress et le risque de succomber à une lésion
cérébrale.
Relatif auniveau d'études des
patients
Quant au niveau d'étude 50% des participants
étaient des gradués ce résultat déferre celui de
TOUZANI R. qui parmi les 127 cas d'AVC, 116 cas n'ont pas dépassé
le niveau scolaire primaire [61].
Cette divergence peut s'expliquer par le taux
d'éducation qui ne cesse de croître dans la ville province de
Kinshasa, mais aussi par le stress et les responsabilités dont sont
victimes ceux qui ont un niveau d'études universitaires vis-à-vis
de leur famille.
En rapport avecla profession des patients
Notre
Est-ce qu'être ménagères est un employ?Vu que
c'est rémunéré ont peut considerer ca d'emploi
étude a montré que près de 70 % des
participants étaient employés bien que ce soit des emplois moins
rémunérés et 30% étaient sans emploi.
Ce résultat se diverge avec celui de l'étude de
Mbelesso P, et al. Qui avait montré que 64,5 % étaient sans
profession [62].
Cette divergence pourrait s'expliquer par des
différences dans les contextes socio-économiques de
l'échantillon, les critères de sélection des participants,
il est également possible que les fluctuations économiques
locales et l'accès aux emplois dans les zones étudiées
aient influencé ces résultats.
A propos de l'âge des patients
La majorité des patients était âgé
de 50 ans et plus, avec une moyenne d'âge de 52,70 ans.
Ce résultat se diverge avec celui de Sagui E. dont les
constituants de son échantillonavaient un age compris entre
60,8#177;12,14 ans [63].
La différence d'age moyenne peut refléter des
variations liées a des facteurs contextuels ou démographiques
spécifiques, comme le cadre géographique, les conditions de vie,
ou les différences dans les pratiques de prévention et de prise
en charge.
Quant aux antécédents
Cette étude montre que 77,8% des hommes et 75% des
femmes soit 45,84% des participants sont hypertendus. Ce qui se rapproche de
celui d'AUBRY P. qui a trouvé 53% des accidents vasculaires
cérébraux, au sein de la population de Kinshasa [64].
Ce rapprochement s'explique aussi par le fait que
l'hypertension artérielle demeure l'un des facteurs de risque majeur des
AVC pourvoyeurs des hémiplégies à Kinshasa.
En ce qui concerne le type des
lésions
Cette étude montre que 94,4% des hommes et 100% des
femmes soit 96,7 % des participants avaient une lésion d'origine non
traumatique. Ce qui se rapproche de l'étude réalisée par
l'institut national de santé public du Quebec. Qui a montré que
80-96% de ses participants présentaient une lésion non
traumatique de nature ischémique [65].
Cela s'explique par le fait que la plupart des
hémiplégies sont d'origine vasculaire (non traumatiques),
d'où sa fréquence élevée dans notre milieu
hospitalier.
Portant sur l'évaluationarticulaire
Cette étude montre que 81,1% des participant
n'étais pas capable de réalisé une fonction motrice sans
aide externe ce qui se s'éloigne un peu d'étude faite par Daviet
J.C. et al. Quireprésente 60% des sont échantillons
présente des déficits moteurs [66]. La différence entre
notre étude et celle de Daviet J.C. et al. Pourrait être
liée aux variations dans les protocoles d'évaluation, à la
nature des lésions ou aux caractéristiques de
l'échantillon. Dans notre étude, un pourcentage plus
élevé de patients ne peut pas réaliser une fonction
motrice sans aide externe, ce qui pourrait refléter des déficits
moteurs plus sévères ou une prise en charge moins précoce
par rapport à l'échantillon de Daviet J.C. et al. Cela souligne
l'importance d'une approche personnalisée et continue dans la
rééducation pour améliorer les capacités
fonctionnelles des patients.
L'impact des complications neuro-orthopédiques
sur la préhension
Nos résultats montrent que la préhension est
significativement influencée par les
contractures (p = 0,049), les déformations (p = 0,000) et
la douleur (p = 0,007)
Malgré cela, 51,3% des patients étaient capables
d'effectuer une préhension. Ce résultat est en accord avec
l'étude de Nabile B. (2018), qui a démontré que ces
complications réduisent la fonction manuelle des patients
cérébro-lésés [67].
Cette influence peut aussi s'expliquer par le fait que la
préhension exige une certaine précision dans son
exécution, alors que les contractures, les déformations et la
douleur empêchent aux groupes musculaires de gagner ou
récupérer la force nécessaire permettant ainsi d'obtenir
une préhension.
En lien avec l'Impact des complications
neuro-orthopédiques sur la marche
Notre étude montre que 56,7 % des patients avaient une
marche fauchante, 23,3 % une marche steppante et 20 % une marche normale.
Cependant, aucune association statistiquement significative
n'a été trouvée entre la marche et les complications
neuro-orthopediques:
- Les contractures (p = 0,225)
- Les déformations (p = 0,386)
- La douleur (p = 0,115)
Ce résultat peut être expliqué par le fait
que certains patients parviennent à développer des
mécanismes compensatoires pour la marche, malgré leurs
complications neuro-orthopédiques.
Concernant l'autonomie des patients
Nous avons trouvé que 44,4% des hommes et 33,3% des
femmes avaient une dépendance modérée selon l'indice de
Barthel.
Ce résultat est similaire à l'étude de
Malemba A. et al., qui a trouvé un score moyen de 43 #177; 26,6,
indiquant une dépendance partielle [11].
Cette convergence indique qu'une proportion significative de
patients présente une dépendance modérée
nécessitant une assistance régulière. Cependant, la
classification de l'autonomie peut varier selon l'échantillon et le
contexte de chaque étude.
Limites de l'étude
Nous avons été limité par le temps, qui
nous a semblait relativement court, ce qui a influencé notre faible
échantillon,
Et surtout que, nous n'avons pas recherché les
techniques ou méthodes utilisés ainsi que le nombre des
séances bénéficiés par chaque patient.
La force de cette étude
La force de cette étude réside dans le fait qu
'elle est:
- La première étude menée à
Kinshasa qui s'intéresse spécifiquement aux séquelles
neuro-orthopédiques chez les patients ayant subi une
lésion cérébrale.
- Elle rapporte que les troubles neuro-orthopédiques
ont un impact négatif sur la préhension.
CONCLUSION
Cette étude qui avait pour objectif de montrer
l'influence des séquelles neuro-orthopédiques sur la
capacité fonctionnelle des cérébrolésés
adultes, a révélé que:
- 44,4% des hommes et 33,3% des femmes avaient une
dépendance modérée,
- Les complications neuro-orthopédiques influencent
négativement la préhension de manière significative
(p=0,049 pour les contractures, p=0,000 pour les déformations et p=0,007
pour la douleur).
- Ces complications n'influencent pas de manière
significative la marche (p=0,225 pour les contractures, p=0,387 pour les
déformations et p=0,115 pour la douleur).
Ø Perspectives
En perspective, nous souhaitons mener une étude
prospective avec cas-témoins afin de ressortir les facteurs
associés à la récupération fonctionnelle des
patients.
Une analyse plus approfondie des facteurs associés
comme la rééducation, l'âge et la comorbidité
seraient nécessaires pour mieux comprendre
ces différences.
Ø Recommandations
Nos recommandations se feront à deux niveaux:
- Aux formateurs: de bien mettre l'accent sur
les complications neuro-orthopédiquess dans le programme des cours des
étudiants ou des apprenants en Rééducation
fonctionnelle,
- Aux rééducateurs:de tenir
compte des complications neuro-orthopediques dans les objectifs
thérapeutiques en vue d'une meilleure récupération
fonctionnelle.
BIBLIOGRAPHIE
1. Organisation mondiale de la santé. Accidents
vasculaires cérébraux.
https://www.emro.who.int/fr/health-topics/stroke-cerebrovascular-accident/index.html.2025
Mar 16.
2. Médiacongo.net. Recrudescence de l'AVC en RDC en
général et à Kinshasa en particulier. 2015 May 27;
santé. Disponible sur
https://www.mediacongo.net/article-actualit-10311_recrudescence_de_l_avc_en_general_et_a_kinshasa_en_particulier.html.
3. Muhl A, Vuadens P. Intérêt et coût de
la réhabilitation neurologique des patients
cérébrolésés. Rev Med Suisse. 2011; 7:948-51.
4. Bertrand E. Accidents vasculaires cérébraux,
Hypertension artérielle des populations originaires d'Afrique noire.
Pradel P, éditeur. Paris: 1995. p. 62-69.
5. Gakou Y. Prise en charge des accidents vasculaires
cérébraux en unité de soins intensifs à
l'hôpital du point G. Thèse de médecine, FMPOS, Bamako,
2001; 01-M-78.
6. Courbon A, Calmels P, et al. Relation entre les
capacités de marche et les capacités maximales à l'effort,
les capacités musculaires et la déficience motrice après
hémiplégie vasculaire chez l'adulte. Ann Réhab
Médecine Physique. 2006 Nov; 49:614-620.
7. Coulibaly T, Mamadou K, Touré M, Moussa T.
Étude des accidents vasculaires cérébraux du sujet jeune
dans les services de cardiologie et de neurologie au Mali. Thèse de
médecine, FMPOS, Bamako, 2001; 01-M-132.
8. Skoff H, Woodbury DF. Management of the upper extremity in
cerebral palsy. J Bone Joint Surg Am. 1985; 67:500-503.
9. Rayan GM, Young BT. Arthrodesis of the spastic wrist. J
Hand Surg. 1999; 24:944-952.
10. Perry J, Waters RL, Perrin T. Electromyographic analysis
of equinovarus following stroke. Clin Orthop Relat Res. 1978; 131:47-53.
11. Malemba M, Lofuta G, Dilu M, Ngereza KP, et al. Effets de
la rééducation précoce et régulière sur
l'évolution et récupération fonctionnelle à court
terme en post-accident vasculaire cérébral à Kinshasa. J
Afr Clin Res. 2023; 7.
12. Bouniol D. Lésions cérébrales.
Clinalliance France; 2023. p. 45-47.
13. Baun M, et al. Macroscopic changes in aquaporin-4
underlie blast traumatic brain injury-related imprairement in glymphatic
function. Brain. 2024 jun ; 147(6) : 2214-2229. Doi : 10.1093/brain/awae065.
14. Le Covarsin P. Pharmacologie de la spasticité
musculaire; Faculté de Médecine de Rennes. 2023, p. 45.
15. Decq P. Physiopathologie de la spasticité.
Neurochirurgie. 2003.
16. Thibaut A, Chatelle C, Ziegler E, Bruno MA, Laureys S,
Gosseries O. Spasticity after stroke: physiology, assessment and treatment.
Brain Inj. 2013;27(10):1093-105.
17. Burke D, Wissel J, Donnan GA. Pathophysiology of
spasticity in stroke. Neurology. Jan 2013;80: S20-6.
18. Hagbarth KE, Wallin G, Löfstedt L. Muscle spindle
responses to stretch in normal and spastic subjects. Scand J Rehabil Med.
1973;5(4):156-9.
19. Wilson LR, Gandevia SC, Inglis JT, Gracies JM, Burke D.
Muscle spindle activity in the affected upper limb after a unilateral stroke.
Brain. Nov 1999;122(11):2079-88.
20. Achache V, Katz R. Dysfonctionnement de circuits
neuronaux spinaux impliqués dans la motricité chez des patients
présentant une paralysie cérébrale spastique.
ElsevierMasson;2013Disponiblesur:
https://www.emconsulte.com/article/836472/dysfonctionnement-de-circuits-neuronaux-spinaux-im.
21. Kuo CL, Hu GC. Post-stroke spasticity: A review of
epidemiology, pathophysiology and treatments. Int J Gerontol. Dec
2018;12(4):280-4.
22. Azulay JP. Locomotion: Physiologie, méthodes
d'analyse et classification des principaux troubles. Neurologie. Elsevier SAS;
2009.
23. Kheder A, Nair KPS. Spasticity: pathophysiology,
evaluation and management. Pract Neurol. Oct 2012;12(5):289-98.
24. Bensmail D, Kiefer C, Bussel B. Évaluation
clinique de la spasticité: Neurochirurgie, 2003;49(2-3):190-198.
25. Lucas C, et al. Accidents vasculaires
cérébraux; Encyclopédie pratique de médecine.
Paris: Elsevier; 1998.
26. Deltombe T, Gustin T, De Cloedt P, De Wislspelaere J-F,
Laloux P. La prise en charge interdisciplinaire du traitement de la
spasticité. Louvain Med. 2000; 121:3516363.
27. Urimubenshi G. Activity limitations and participation
restrictions experienced by people with stroke in Musanze district in Rwanda.
Afr Health Sci. 2015;15(3):917-924.
28. Bohannon EW, Smith MB. Interrater reliability of a
modified Ashworth scale of muscle spasticity. Phys Ther. 1986; 67:206-207.
29. Delpont B, Blanc C, Osseby GV, Hervieu-Bègue M,
Giroud M, Béjot Y. Pain after stroke. Rev Neurol (Paris). 2018
Dec;174(10):671-674. DOI: 10.1016/j.neurol.2017.11.011. Epub 2018 Jul 24.
30. Garcia-Larrea L, Magnin M. Physiopathologie de la douleur
neuropathique. Presse Med. 2008 Feb;37(2 Pt 2):315-40. DOI:
10.1016/j.lpm.2007.07.025. Epub 2008 Jan 11.
31. Rosas S, Paço M, Lemos C, Pinho T. Comparaison
entre l'Echelle visuelle analogique et l'echelle numerique dans la perception
de l'esthétique et de la douleur. Int Orthod. 2017 Dec;15(4):543-560.
DOI: 10.1016/j.ortho.2017.09.028. Epub 2017 Nov 13.
32. Nicholson Perry K, Nicholas MK, Middleton J. Spinal cord
injury-relatrd pain in rehabilitation: a cros-sectional study of relationships
with cognitions, mood and physical function. Eur J Pain. 2009 May;13(5):511-7.
DOI: 10.1016/j.ejpain.2008.06.003. Epub 2008 Jul 23.
33. Codine P, Brun V, Herisson C, Pelissier J, Simon L. La
raideur articulaire. Paris: Masson; 1995.
34. Decq P, Roujeau T, Filipetti P. Membre supérieur
spastique: principes et indications de la neurochirurgie fonctionnelle
périphérique. La Préhension, 2000;91.
35. MSD Manuals. Évaluation des patients qui
présentent des symptômes articulaires. [Internet]. 2025
[cité 2025 mars 16]. Disponible sur:
https://www.msdmanuals.com/fr/professional/troubles-musculosquelettiques-et-du-tissu-conjonctif/prise-en-charge-du-patient-souffrant-de-sympt%C3%B4mes-articulaires/%C3%A9valuation-des-patients-qui-pr%C3%A9sentent-des-sympt%C3%B4mes-articulaires
36. Schnitzler A. Handicap dans les suites d'un accident
vasculaire cérébral: étude de prévalence et impact
des filières de soins. Université de Versailles-Saint Quentin en
Yvelines; 2015.
37. Npochinto Moumeni I, Njankouo Mapoure Y, Gracies JM,
Moyse E, Temgoua M, Moulangou JP, et al. Plasticité musculaire et
traitement physique dans la parésie spastique déformante:
physiopathologie de la sous-utilisation et réversibilité par le
réentrainement intensif. Muscle plasticity and physical therapy in
deforming spastic paresis: physiopathology of underuse and reversibility by
intensive retraining. ScienceDirect.
2021.Disponiblesur:https://www.sciencedirect.com/science/article/pii/S1627483021000301.
38. Mark F. Faiblesse musculaire. In: Manuel MSD -
Professionnel [Internet]. [cité2025mars25].Disponiblesur:
https://www.msdmanuals.com/fr/professional/troubles-neurologiques/sympt%C3%B4mes-des-troubles-neurologiques/faiblesse-musculaire.
39. Rousseaux M, Daveluy W, Kozlowski. Évaluation,
rééducation et traitement. Paris: Books.google.com; 2010.
40. Schnitzler A, Woimant F, Nicolau J, Tuppin P, de Peretti
C. Évolution de l'autonomie des patients en post-AVC aigu pris en charge
en soin de suite spécialisé ou polyvalent: les résultats
de l'exploitation des données PMSI en 2009. Ann Med Phys
Réhabilit. 2012 Oct;55(Suppl 1): e16-e17.
41. Aurélien B. Étude des systèmes
instrumentaux d'exploration de la marche chez les patients
hémiplégiques: Analyse des paramètres spatio-temporels sur
le locomètre. IFPEK; 2011.
42. Yelnik A, Breton F, Bonan I, Pérennou D, Bussel B.
Spasticité après accident vasculaire cérébral; La
spasticité; Paris: Masson; 2001:219-225.
43. Penn RD, Savoy Corcos SM, Latash M, Gottlieb G, et al.
Intrathecal baclofen for severe spinal spasticity. N Engl J Med. 1989;
320:1517-1554.
44. Marque P, Maupas E, Boitard D, Roques C.F.
Évaluation clinique, analytique et fonctionnelle de la
spasticité. Problèmes en médecine de
rééducation; Paris: Masson; 2001, p33-41.
45. Sengler J. Rééducation et
réadaptation de l'hémiplégie vasculaire: Revue de
littérature. Encycl Med Chir (Elsevier SAS, Paris),
Kinésithérapie-Médecine physique-Réadaptation;
2006:26-455-D-10.
46. Azouvi P. Rééducation de
l'hémiplégie vasculaire; Paris: Frison-Roche; 2003.
47. Horn SD, De Jong G, Smout RJ, Gassaway J, James R, Conroy
B. Stroke rehabilitation patients, practice and outcomes: is earlier and more
aggressive therapy better? Arch Phys Med Rehabil. 2005;86(12):101-14.
48. Aboiron H. La classification internationale du
fonctionnement, du handicap et de la santé: de la CIH1 à la CIF.
Kinésithérapie scientifique; 2002:426:35-40.
49. Ottenbacher KJ, Jannell S. The results of clinical trials
in stroke rehabilitation research. Arch Neurol. 1993; 50:37-44.
50. Daviet JC, Dudognon PJ, Salle JY, Munoz M, Lissandre JP,
Rebeyrotte I, Borie MJ. Rééducation des accidentés
vasculaires cérébraux: Bilan et prise en charge. Encycl Med Chir
(Elsevier SAS, Paris), Kinésithérapie-Médecine physique et
réhabilitation; 2002:26-455-A-10.
51. Le patient hémiplégique. Pratique de la
rééducation neurologique. Paris: Elsevier Masson SAS; 2014.
52. Mow VC, Ratcliff A, Woo S. Biomechanics of diarthrodial
joints. Vol I et III. New York: Springer-Verlag; 1990.
53. Bohannon EW, Smith MB. Interrater reliability of a
modified Ashworth scale of muscle spasticity. Phys Ther. 1986; 67:206-207.
54. CHU de Montpellier, Institut de neuro-orthopédie.
Consulté le 12/10/2024. Disponible sur:
https://www.chu-montpelier.fr/fr/institut-de-neuro-orthopedie.
55.
https://www.elseviermasson.fr/media/s3/France/SampleChapter/08.2021/Muller477102-min.pdf
56. Wijeysundera DN, Pearse RM, Shulman MA, et al. METS Study
investigators: Assessment of functional capacity before major non-cardiac
surgery: an international, prospective cohort study. Lancet. 2018;
391:2631-2640.
57. La Braise asbl. Les besoins et attentes des personnes
présentant une lésion cérébrale acquise [Internet].
2019 [cité 2025 mars 16]. Disponible sur :
https://s8e300c4866f86a1c.jimcontent.com/download/version/1484127698/module/3835073155/name/LES%20BESOINS%20ET%20ATTENTES%20DES%20PERSONNES%20PRESENTANT%20UNE%20LESION%20CEREBRALE%20ACQUISE%20-%20La%20Braise%20asbl.pdf.
58. Meynet S, Beaudoin M, Smeding A. Post-stroke depression
in Africa: myth or reality? Can J Aging. 2021 Jun;40(2):224-237.
59. Longo Mbeza B, Phanzu Mbele LB, Mbuyi Amba Kabangu Jr, et
al. Hématocrite and stroke in black Africans under tropical climate and
meteorological influence. Anales de médecine interne. 1999;
150:171-177.
60. Abraham G, Abdoulkadir J. Cerebrovascular accidents in
Ethiopians: a review of 48 cases. East Afr Med. 1981; 58:431-437.
61. Touzani R. Étude des maladies à risque et
analyse des déterminants du degré d'handicap. Mémoire
[Internet]. 2013 [cité 2025 mars 16]. Disponible sur:
https://www.memoireonline.com/05/13/7162/m_Les-avc-au-maroc-etude-des-maladies-a-risque-et-analyse-des-determinants-du-degreacu22.html.
Maroc.Touzani R. Étude des maladies à risque et analyse des
déterminants du degré d'handicap. Mémoire [Internet]. 2013
[cité 2025 mars 16]. Disponible sur:
https://www.memoireonline.com/05/13/7162/m_Les-avc-au-maroc-etude-des-maladies-a-risque-et-analyse-des-determinants-du-degreacu22.html.
Maroc.
62. Mbelesso P, Senekian VP, Yangatimbi E, Tabo A,
Zaoro-Kponsere AJ, Kette GC, Oundagnon. Dépression post-accident
vasculaire cérébral en Afrique: mythe ou réalité?
Bull Soc Exot. 2014; 107:350-355.
63. Sagui E. Les accidents vasculaires
cérébraux en Afrique subsaharienne. Médecine tropicale.
2007; 67:596-600.
64. Aubrey P. Évolution des maladies
cardio-vasculaires dans les pays en développement.Disponible sur :
http://www.médecinetropicale.free.Fr.
65. Institut national de santé publique du
Québec (2009). La prévention des chutes dans un continuum de
services pour les aînés vivant à domicile. Consulté
à:
https://www.inspq.qc.ca/pdf/publications/643-PreventChutesAinesVivantDomicile2eEdi1.pdf
66. Daviet JC, Compagant M, Berkinikiet D, Salle J-Y.
Réadaptation après accident vasculaire cérébral:
retour et maintien à domicile, vie quotidienne. Sci Direct. 2022 May;
206:616-622.
67. Nabile B. Récupération motrice du membre
supérieur post-AVC: recherche de mesures adaptées pour
l'évaluation et étude de l'efficacité de stratégies
thérapeutiques. Médecine humaine et pathologie. Université
Paul Sabatier-Toulouse III; 2018.
ANNEXES
FICHE DE COLLECTE DE DONNEES
Sujet : « INFLUENCE DES SEQUELLES NEURO
ORTHOPEDIQUE SUR LA CAPACITE FONCTRIONNELLE DES ADULTES CEREBROLESES SUIVIS EN
READAPTATION FONCTIONNELLE ».
I. Paramètres
sociodémographiques
§ Code : ..................
§ notre connaissance
notre connaissance
Genre: Masculin
Féminin
§ Age:..
§ notre connaissance
notre connaissance
notre connaissance
notre connaissance
Niveau d'étude : Jamais Secondaire
Gradué Licencié
§ notre connaissance
notre connaissance
Profession : Sans emploi fonctionnaire
Enseignant
Ménagère Commerçant
Autres
notre connaissance
II. Paramètres Cliniques
§ notre connaissance
notre connaissance
ATCD: HTA Diabète sucré
Alcool
notre connaissance
notre connaissance
Tabac Obésité
notre connaissance
Cardiopathie
§ notre connaissance
Type de lésion cérébrale : Traumatique
Non traumatique
§ notre connaissance
notre connaissance
notre connaissance
État de conscience : Lucide cohérent
collaborant
§ Mobilité:Alité Fauteuil roulant
Canne Seul
III. Mouvement articulaire actif
A. Membre supérieurs
1. Articulations des doigts
Articulations métacarpo-phalangiennes :
Ø Flexion/extension
0-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Abduction/adduction
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaireOui Non
- Mobilité articulaire Oui Non
2. Articulations du poignet (radio-carpienne)
Ø Flexion/extension
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Inclinaison radiale (abduction)/inclinaison ulnaire
(adduction).
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaireOui Non
- Mobilité articulaire Oui Non
3. Articulation du coude
Ø
Flexion/extension
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø
Pronation/supination
-Gonflement articulaire ou tuméfactionOui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
4. Articulation de l'épaule
(scapulo-humérale)
Ø Flexion/extension
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Abduction/adduction
-Gonflement articulaire ou tuméfactionOui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Rotation interne/externe
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Circumduction.
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
B. Membres Inférieurs
1. Articulation de la hanche (coxofémorale)
Ø
Flexion/extension
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Abduction/adduction
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Rotation interne/externe
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø
Circumduction
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaireOui Non
- Mobilité articulaireOui Non
2. Articulation du genou
Ø Flexion/extension
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
3. Articulation de la cheville (tibiotalaire)
Ø Dorsiflexion (élévation du pied vers
le tibia)/flexion plantaire (abaissement du pied vers le sol)
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Inversion/Eversion se produisent au niveau des
articulations subtalaires
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
4. Articulations des orteils
Articulations métatarso-phalangiennes:
Ø Flexion/extension
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Ø Abduction/adduction
-Gonflement articulaire ou tuméfaction Oui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaire Oui Non
Articulations interphalangiennes des orteils:
Ø Flexion/extension. Oui Non
-Gonflement articulaire ou tuméfactionOui
Non
- Douleur articulaire Oui Non
- Crépitation articulaire Oui Non
- Mobilité articulaireOui Non
IV. Complication Neuro-orthopediques
Type de complications observées
Ø Contracture
Oui Non
Échelle d'Ashworth modifier
0.
Pas d'augmentation du tonus musculaire
1.
Légère augmentation du tonus avec simple
sensation d'accrochage ou minime résistance en fin de course.
1+. Légère augmentation du tonus musculaire
avec simple sensation d'accrochage suivi d'une minime résistance au
cours de la première moitié de la course musculaire.
2.
Augmentation importante du tonus musculaire durant toute la
course musculaire mais le segment du membre reste facilement mobilisable.
3.
Augementation considerable du tonus musculaire. Le mouvement
passif est difficile.
4. Hypertonie majeure. Mouvement passif impossible.
Ø Déformation
Oui Non
Douleurs musculo-squelettiques
Ø
Échelle numérique :0 1 2 3 4
5 6 7 8 9 10
V. Évaluation de la fonction
Ø Évaluation de la préhension:
A)
Préhension Oui Non
· Globale :
Oui Non
· Fine:Oui Non
B) Prises
· Prise en pince:Oui Non
· Prise en poing:Oui Non
· Prise à deux mains:Oui Non
· Prise latérale:Oui Non
Ø Capacités de préhension (notes de 1
à 5 Selon l'échelle de force de préhension de Jamar
modifier):
1 - Très faible
2 - Faible
3 - Moyenne
4 - Bonne
5 - Excellente
Ø Évaluation de la marche:
notre connaissance
notre connaissance
notre connaissance
- Type de Marche: Steppante Fauchante
Normale
Ø Mesure de la fonction motrice
0.
Aucune activité motrice n'est réalisée
1
1.
Fonction motrice tentée mais impossible à
être réalisée
2
2.
Fonction motrice est difficilement réalisée,
nécessitant parfois une aide
3
3.
Fonction motrice bien réalisé
VI. Évaluation de l'autonomie
Ø Échelle de Barthel :
Alimentation
10: indépendant. Capable de se servir des instruments
nécessaires. Prend ses repas en
notre connaissance
notre connaissance
un temps raisonnable.
notre connaissance
5: a besoin d'aide par exemple pour couper.
0: dépendance.
Contrôle sphinctérien
notre connaissance
notre connaissance
10: continence.
notre connaissance
5: fuites occasionnelles.
0: incontinence ou prise en charge personnelle si sonde
vésicale à demeure.
notre connaissance
Anorectal
10: continence. Capable de s'administrer un lavement ou un
suppositoire.
notre connaissance
5: accidents occasionnels. A besoin d'aide pour un lavement ou un
suppositoire si
notre connaissance
nécessaire.
0: incontinence.
W.C.
notre connaissance
notre connaissance
10: indépendance.
5: intervention d'une tierce personne.
0: dépendance.
notre connaissance
Soins personnels
notre connaissance
5: possible sans aide.
0: dépendance complète.
notre connaissance
Bain
5: possible sans aide.
0: dépendance complète.
Habillage
notre connaissance
10: indépendance (pour boutonner un bouton, fermer une
fermeture éclaire, lacer ses
notre connaissance
lacets, mettre des brettelles).
notre connaissance
5: a besoin d'aide, mais fait la moitié de la tâche
en un temps correcte.
0: dépendance complète.
notre connaissance
Transfert du lit au fauteuil
notre connaissance
15: indépendant, y compris pour faire fonctionner un
fauteuil roulant.
notre connaissance
10: peut s'asseoir mais doit être installé.
notre connaissance
5: capable de s'asseoir, mais nécessite une aide maximale
pour le transfert.
0: incapacité totale.
notre connaissance
Déplacement
notre connaissance
15: marche avec soutient ou pas pour plus de 50 mètres.
notre connaissance
10: marche avec aide pour 50 mètres.
notre connaissance
5: indépendant pour faire 50 mètres en fauteuil
roulant.
0: dépendance complète.
notre connaissance
Escalier
notre connaissance
10: indépendant, peut se servir de cannes.
5: a besoin d'aide ou de surveillance.
notre connaissance
0: incapacité totale.
Merci pour avoir participé à cette
étude!
| 


