|
ÉPIGRAPHE
« Tout ce que ta main
trouve à faire avec ta force, fais-le ; car il n'y a ni oeuvre, ni
pensée, ni science, ni sagesse dans le séjour des morts où
tu vas. »
Ecclésiaste 9:10
DEDICACE
A Dieu Tout Puissant, pour son immense amour
et sa Grace infinie dont je suis bénéficiaire ; pour la
sagesse et la force qu'il m'a accordées tout au long de ce parcours.
À mon père, KAUMBA KAYOMBO Charles,
Ce travail est le fruit de l'éducation que j'ai
reçue de vous, cher papa, ainsi que de vos conseils spirituels,
matériels et moraux. Votre détermination, contre vents et
marées, à voir votre fils réussir porte aujourd'hui ses
fruits. Soyez fier de l'éducation et de la rigueur que vous nous avez
transmises, tant dans la vie que dans votre travail.
Que Dieu vous bénisse, papa, ainsi que votre oeuvre.
À ma mère LUNDA Yvette,
Vous avez toujours été présente à
nos côtés, mettant tout en oeuvre pour assurer notre
réussite. Vous nous avez transmis les valeurs de moralité,
d'honnêteté et de bonne conduite.
Je prie le Tout-Puissant de vous accorder une longue vie afin
que vous puissiez récolter les fruits de votre dévouement et que
nous soyons votre fierté.
Merci pour les immenses sacrifices que vous avez consentis.
Soyez honorée, maman.
À mes pères dans la foi Pasteur Dr Billy G.
Kikudi ; Prophète Jérémie BATUNZI ;
Prophète Alpha KALOMBO
Merci pour votre soutien constant et vos prières
précieuses qui m'ont accompagné tout au long de ce parcours. Que
Dieu vous bénisse.
A mon Oncle Simplice RIKATA MUYEMBE pour vos conseils, votre
soutien morale, matériel et spirituel. Que le très haut vous
bénisses.
A mes frères François KAYOMBO et Charles KAYOMBO
pour leur soutien affectif et leurs encouragements.
À ma bien-aimée,Nathalie CILANDApour sa
présence rassurante, son amour, sa patience et ses mots d'encouragements
dans les moments difficiles.
À mes loyaux amis Franck KISULA, Franck KAYEMB, Josh
MUKALAY, Faraja MUKAZ, Yannick ILUNGA, John YAV, Gardel MBUYU et Beata KAZADI,
Je vous dédie ce travail en signe de gratitude pour avoir su
m'épauler, me motiver, et me faire garder le cap.
Au CT Paul Tshibangu, au Doyen YUMBA MWANABUTE, et la Doyenne
Titine KAMWANG.
À tout le personnel de l'Hôpital
Général de Référence de Panda à Likasi, Aux
Cliniques Universitaires de Lubumbashi,
Recevez toute ma reconnaissance pour votre accompagnement
professionnel et votre encadrement.
À mes mentors et ainés Dr Kevin MULOLO, Dr Jimmy
MWAMBA, Dr KAMBU, et Dr Emmanuel MUTONKOLE,
Merci pour vos conseils, votre inspiration et vos
encouragements tout au long de ma formation.
REMERCIEMENT
Nous tenons à exprimer notre profonde gratitude :
Au Professeur Ordinaire Dr Claude MWAMBA MULUMBA, Doyen de la
Faculté de Médecine, pour son leadership et son engagement dans
la formation des futurs médecins,
Au Secrétaire Facultaire de Médecine et à
tout le personnel administratif, pour leur accompagnement tout au long de notre
parcours,
À l'ensemble du corps professoral, pour la transmission
de leur savoir et leur dévouement,
Aux autorités de l'Université de Likasi, pour
les efforts fournis en faveur d'un encadrement académique de
qualité.
À notre Directeur de mémoire, Professeur
Ordinaire Dr Claude MWAMBA MULUMBA,
Et à notre Co-directeur, CT Dr MULEKA,
Nous vous exprimons notre profonde gratitude pour avoir
accepté d'encadrer ce travail de recherche.
Merci de nous avoir proposé ce sujet pertinent, de nous
avoir accompagnés avec rigueur et bienveillance tout au long de sa
réalisation. Votre disponibilité, vos conseils avisés et
votre exigence nous ont poussés à donner le meilleur de
nous-même, même lorsque le doute s'installait. Soyez-en
sincèrement remerciés.
À tous nos collègues de promotion et amis,
En particulier à Franck Kisula, Mbuyu-el-Maumbo Gardel,
NgoyKimbaWakadilo Maurice,MpulumbaBakenga Yaya,KidindweYengaEvens,
CilandaLubanda Nathalie, Mande Kapend Freddy, ainsi qu'à tous les autres
avec qui nous avons partagé ces huit années d'études, dans
la solidarité, l'objectivité et malgré les
intempéries du parcours.
À tous nos frères et amis qui nous ont soutenus
sans relâche : que la grâce de Dieu abonde dans vos vies.
LISTE DES
ABRÉVIATIONS
ACD : Acidocétose diabétique
ADA : American Diabetes Association
ADO : Antidiabétiques oraux
CUL : Cliniques Universitaires de Lubumbashi
DRC / RDC : République Démocratique du Congo
ECBU : Examen cytobactériologique des urines
ET : Écart-type
HbA1c:Hémoglobineglyquée
IDF: International Diabetes Federation
ISPAD: International Society for Pediatric and Adolescent
Diabetes
IV : Intraveineux
K+ : Potassium
NaCl : Chlorure de sodium
OMS / WHO:OrganisationMondiale de la Santé / World
Health Organization
SPSS: Statistical Package for the Social Sciences
INTRODUCTION
1. État de la question
Le diabète sucré est une maladie
métabolique chronique caractérisée par une
hyperglycémie persistante, résultant d'un déficit absolu
ou relatif en insuline, dû à une anomalie de
sécrétion, d'action ou des deux à la fois [OMS, 2024 ;
ADA, 2024].
Il constitue un problème majeur de santé
publique dans le monde. Selon l'International DiabetesFédération
(IDF), en 2021, plus de 537 millions de personnes vivaient avec le
diabète, un chiffre qui pourrait atteindre 643 millions d'ici 2030 [1].
Cette progression rapide est attribuée à l'urbanisation, à
la sédentarité et à la transition nutritionnelle.
En Afrique, 24 millions d'adultes sont atteints de
diabète, un nombre appelé à doubler d'ici 2045 [2]. On
distingue une prévalence plus importante dans l'Afrique subsaharienne
que dans l'Afrique du Nord [3]. Cette augmentation est liée, entre
autres, à l'urbanisation rapide, à l'obésité
croissante et à l'insuffisance de dépistage.
En République Démocratique du Congo (RDC), bien
que les données soient limitées, plusieurs études
rapportent une croissance inquiétante des cas de diabète, en
particulier dans les milieux urbains comme Lubumbashi. Selon M'Buyamba-Kabangu
et al. (2022), la prévalence du diabète en RDC atteint 5,2 % dans
certaines zones urbaines [4].
Parmi les complications aiguës du diabète,
l'acidocétose diabétique (ACD) occupe une place centrale. Il
s'agit d'une urgence métabolique grave, mettant en jeu le pronostic
vital. Elle est causée par un déficit sévère en
insuline, souvent déclenchée par une infection, un stress aigu,
une mauvaise observance thérapeutique ou un arrêt du traitement
[5,6].
L'ACD se manifeste par une hyperglycémie
sévère, une acidose métabolique et une
cétonémie ou cétonurie importante. Elle survient
principalement chez les diabétiques de type 1, mais peut
également toucher ceux de type 2 dans certaines conditions [3,4].
La mortalité liée à l'ACD varie fortement
selon les contextes : inférieure à 1 % dans les pays
développés, elle peut atteindre jusqu'à 26 % en Afrique
subsaharienne, en raison de diagnostics tardifs, du manque de personnel
qualifié et d'infrastructures inadaptées [7,8].
En plus de ses implications pronostiques, l'ACD soulève
également la question de la prise en charge thérapeutique : les
protocoles d'intervention, leur application pratique, ainsi que la
prévention des récidives nécessitent une attention
particulière dans les milieux à ressources limitées.
2. Problématique
Dans de nombreux hôpitaux africains, y compris à
Lubumbashi, l'ACD représente une cause fréquente d'admission en
médecine interne et en soins intensifs [6,8]. Cependant, plusieurs
défis persistent :
· Une sous-estimation de la fréquence
réelle de cette complication ;
· Une prise en charge parfois empirique, non
standardisée et sans protocoles clairs [5,6] ;
· Un retard diagnostique dû au manque de moyens
rapides ;
· Une éducation insuffisante des patients
diabétiques.
En l'absence d'une base de données fiable et
structurée, certains patients arrivent aux urgences dans un état
comateux ou avec des complications avancées, mettant en évidence
les lacunes du système de soins.
Aux Cliniques Universitaires de Lubumbashi (CUL), cette
problématique est d'autant plus préoccupante qu'il n'existe pas
de données récentes sur la fréquence de l'ACD ni sur la
qualité de sa prise en charge.
3. Question de recherche
Quelle est la fréquence de l'acidocétose
diabétique et quelles sont les modalités de sa prise en charge
chez l'adulte aux Cliniques Universitaires de Lubumbashi durant la
période d'avril 2024 à avril 2025 ?
4. Objectif général
Déterminer la fréquence et les modalités
de prise en charge de l'acidocétose diabétique chez l'adulte aux
Cliniques Universitaires de Lubumbashi, entre avril 2024 et avril 2025.
5. Objectifs spécifiques
· Déterminer la fréquence des cas d'ACD
enregistrés pendant la période d'étude ;
· Décrire les caractéristiques
sociodémographiques et cliniques des patients adultes admis pour ACD
;
· Décrire les principales causes et facteurs
déclenchants de l'ACD ;
· Décrire les modalités
thérapeutiques utilisées dans la prise en charge ;
· Déterminer les issues cliniques après
traitement (guérison, complications, décès).
6. Délimitation du travail
Ce travail portera uniquement sur les patients adultes
(âgés de 18 ans et plus) admis pour acidocétose
diabétique aux Cliniques Universitaires de Lubumbashi, sur une
période d'un an, allant du 1er avril 2024 au 31 mars 2025.
CHAPITRE 1.
GÉNÉRALITÉS SUR L'ACIDOCÉTOSE DIABÉTIQUE
1.1. Épidémiologie mondiale, africaine et
nationale du diabète et de l'ACD
En 2021, la prévalence mondiale du diabète
était estimée à 10,5 %, avec une prédominance du
type 2 (environ 90 % des cas). Ce chiffre devrait atteindre 12,2 % d'ici 2045,
selon l'IDF [1].
En Afrique, la situation est préoccupante : plus de 24
millions d'adultes vivent avec cette pathologie, et ce nombre pourrait
dépasser 55 millions d'ici 2045 [2]. L'Afrique subsaharienne est
particulièrement touchée, avec une croissance
accélérée liée à l'urbanisation, à la
malnutrition, à la sédentarité et au vieillissement de la
population [7].
En RDC, les études sont encore limitées, mais la
prévalence nationale du diabète est estimée à 5,2 %
dans les zones urbaines, avec une augmentation nette dans les grandes villes
comme Kinshasa et Lubumbashi [8].
L'acidocétose diabétique (ACD) constitue l'une
des principales causes d'hospitalisation et de mortalité aiguë chez
les patients diabétiques en Afrique [6]. Elle reste
sous-documentée en RDC, ce qui complique la mise en place de
stratégies adaptées.
1.2. Facteurs étiologiques de l'acidocétose
diabétique.
Les facteurs déclenchants de l'ACD sont nombreux. Les
plus fréquents incluent [3, 4,5] :
· L'interruption ou la mauvaise observance de
l'insulinothérapie ;
· Les infections (urinaires, pulmonaires,
cutanées, etc.) ;
· Le stress physique (chirurgie, traumatisme, infarctus)
ou émotionnel ;
· Les erreurs alimentaires ou thérapeutiques ;
· L'usage de certains médicaments
(corticostéroïdes, diurétiques, bêtabloquants,
etc.).
Chez certains patients, aucun facteur déclenchant clair
n'est retrouvé on parle alors d'ACD idiopathique.
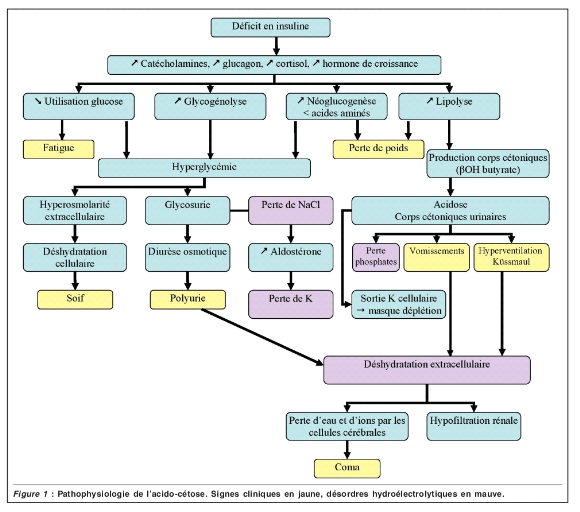
1.3. Physiopathologie de l'ACD [12]
L'acidocétose diabétique (ACD) résulte
d'un déficit partiel ou complet en insuline, combiné à une
augmentation des hormones de contre-régulation, catécholamines,
glucagon, cortisol et hormone de croissance.
Soit le déficit complet en insuline survient chez un
patient lors de la présentation inaugurale du diabète, soit chez
un patient diabétique connu, sous-dosé en insuline,
volontairement ou non. Par exemple, en cas de stress (infection, traumatisme,
troubles gastro-intestinaux), lors d'oubli (fortuit ou non) d'injection
d'insuline.
Les omissions volontaires d'injection d'insuline sont plus
fréquentes dans l'insulinothérapie par injections multiples et
chez les utilisateurs de pompes à insuline. Chez ces derniers, une ACD
peut se développer rapidement en cas de panne.
La conséquence d'une combinaison d'une
insulinémie basse et d'un taux élevé des hormones de
contre-régulation est un catabolisme accéléré, avec
augmentation de production hépatique et rénale de glucose,
diminution de l'utilisation périphérique de glucose
(phénomène de résistance à l'insuline).
Il en résulte hyperglycémie,
hyperosmolalité, lipolyse augmentée et cétogenèse.
En l'absence d'administration d'insuline, de fluides et d'électrolytes,
l'issue peut être fatale par acidose métabolique et
déshydratation. L'ACD peut être aggravé par une acidose
lactique, secondaire à une hypo perfusion tissulaire ou un sepsis.
L'ACD est caractérisée par une perte
sévère en eau et électrolytes provenant des compartiments
intra- et extracellulaires, le degré de pertes fluctuant selon la
durée et la sévérité, mais aussi d'après la
capacité du patient à maintenir des apports en liquides et
électrolytes.
3 stades se succèdent :
1. La cétose (présence de corps
cétoniques dans le sang et les urines)
2. L'acidocétose: cétose entraînant une
baisse du pH au-dessous de 7,30 ou un bicarbonate < 15 mmol/l
3. Le coma acidocétosique: acidocétose avec
troubles de la conscience.
On a également décrit le coma diabétique
hyperosmolaire (glycémie > 600 mg/dl ; osmolarité plasmatique
> 350 mmol/l ; pH > 7,30 ; cétonurie faible ou absente).
Le coma hyperosmolaire survient essentiellement chez l'adulte
âgé qui présente un syndrome polyuro-dipsique de longue
durée. Chez l'enfant, le coma hyperosmolaire est rare.
L'hyperglycémie hyperosmolaire peut inaugurer un
diabète de type 2, mais aussi rarement un diabète de type 1.
La cétonurie se positivera dès que la
diurèse augmentera.
La physiopathologie de l'ACD est résumée dans la
figure 1.
1.4. Manifestations cliniques de l'ACD
Les signes cliniques de l'ACD sont polymorphes et parfois non
spécifiques. On retrouve classiquement [13] :
· Signes généraux : polyurie, polydipsie,
amaigrissement, asthénie ;
· Signes digestifs : douleurs abdominales,
nausées, vomissements ;
· Signes respiratoires : respiration de Kussmaul
(profonde et rapide), haleine cétonique (odeur de pomme) ;
· Signes neurologiques : confusion, agitation, voire
coma.
L'apparition brutale et l'intensité des signes
dépendent du degré d'acidose et de déshydratation.
1.5. Examens complémentaires
Les examens biologiques clés pour le diagnostic de
l'ACD incluent [4,14] :
Les
premiers examens de laboratoire doivent inclure la glycémie, les
électrolytes, les cétones sériques (si elles ne sont pas
disponibles, des cétones urinaires peuvent être obtenues), une
numération formule sanguine complète et des gaz sanguins initiaux
artériels (ou veineux).
L'ACD
est caractérisé par une hyperglycémie, la présence
de corps cétoniques et d'acidose. La glycémie plasmatique est
généralement élevée à -13,9 mmol/L (250
mg/dL). Cependant, un large éventail de taux de glucose plasmatique peut
être présent, ce qui est indépendant de la
sévérité de l'ACD. [10]
Des
taux de glucose normaux ou inférieurs ont été
rapportés, une affection appelée « AK euglycémique
», chez environ 10 % des patients présentantune acidocétose
diabétique. [14]
Les
patients traités par un traitement par inhibiteur du SGLT2 peuvent
développer une affection euglycémique et le diagnostic d'ACD peut
être oublié ou retardé dans ces cas ; par
conséquent, le médecin doit présenter un niveau
élevé de suspicion lors de l'évaluation de ces
patients.
La deuxième caractéristique de l'ACD est la
présence de cétones dans les urines et/ou le sérum. Il
existe trois types de cétones: le bêta-hydroxy butyrate,
l'acétoacétate et l'acétone. Il est recommandé de
mesurer le bêta-hydroxy butyrate sérique (normal, -0,6 mmol/L) si
les cétones urinaires sont négatives en cas de suspicion de
diagnostic d'ACD. La mesure du bêta-hydroxy butyrate capillaire à
pointe a
été trouvée à la fois sensible et spécifique
pour l'ACD par rapport aux tests de la cétone en utilisant la
méthode du nitroprusside. [15]
Le troisième aspect diagnostique de l'ACD est la
présence d'acidose, définie comme un taux de bicarbonate de
bicarbonate de plus de 18 mmol/L et/ou un pH artériel inférieur
à 7,30. La mesure des gaz sanguins veineux peut être
utilisée en particulier chez les patients stables, tandis que la mesure
artérielle est réservée aux patients plus malades. La
mesure du pH veineux fournit une évaluation adéquate du
degré d'acidose et de la réponse au traitement et aide à
éviter la douleur et les complications possibles associées
à des perforations artérielles répétées. pH
veineux est habituellement inférieur de 0,015 à 0, 00,3 % au pH
artériel. L'accumulation d'acétoacides entraîne une acidose
métabolique à forte variole d'anion ; l'écart d'anion est
calculé selon la formule suivante : [Na - (Cl - HCO 33). Une
plage normale pour l'écart d'anions dépend de l'intervalle de
référence du laboratoire et est généralement de 6
à 10 mmol/L (6-10 mEq/L) et une valeur d'écart d'anion de plus de
10 mmol/L indique la présence d'une acidose métabolique à
l'écart anionique élevé. [10]
Un système de notation développé par
l'American Diabetes Association a été proposé pour
évaluer la sévérité de l'ACD, qui classe l'ACD en
ACD en légère, modérée ou sévère sur
la base du degré d'acidose métabolique (niveaux de pH sanguin et
de bicarbonate) et de la présence d'un état mental
altéré [
Tableau
1]
Tableau 1.
Classification de l'acidocétosediabétique
|
Paramètre
|
Léger
|
Moyenne
|
Sévère
|
|
Bicarbonate sérique (mmol/L)
|
15 - 18
|
10 à 15
|
10
|
|
pH artériel
|
7,25-7,30
|
7.0 -7,24
|
7,0
|
|
Écartd'anion
|
10
|
12
|
12
|
|
État mental
|
Alerte
|
Alerte/demence
|
Stupeur/coma
|
Kitabchiet al.
3
1.6. Critères diagnostiques de l'ACD
Les critères diagnostiques selon l'ADA (2023) et les
recommandations ISPAD (2022) sont [9] :
La résolution de l'ACD est définie par les
critères suivants [9] :
· pH artériel > 7,3,
· Bicarbonates plasmatiques > 18 mmol/L,
· Cétonémie ou cétonurie
négative ou fortement diminuée,
· Reprise de l'alimentation possible.
Il est essentiel de différencier l'ACD des autres
états hyper glycémiques aigus comme le syndrome hyperosmolaire ou
l'acidose lactique.
CHAPITRE 2 : PRISE EN
CHARGE DE L'ACIDOCÉTOSE DIABÉTIQUE
L'ACD est une urgence médicale qui nécessite une
prise en charge rapide en milieu hospitalier. Les piliers de sa prise en charge
comprennent la restauration du volume circulatoire, la correction des anomalies
électrolytiques, le traitement de l'hyperglycémie et le
diagnostic et le traitement de la cause précipitée. [15]
2.1.Traitement des fluides
Les patients atteints d'ACD sont constamment
déshydratés. En moyenne, les patients atteints d'ACD
présentent un déficit en eau libre d'environ 100 mL/kg de poids
corporel. [3]
La thérapie par fluide intraveineux (IV) augmente le
volume intravasculaire, améliore la perfusion rénale et
réduit la résistance périphérique à
l'insuline en réduisant les taux d'hormones de contrerégulation ;
le résultat net sera une réduction des taux de glucose dans le
sang. [16]
À l'heure actuelle, la plupart des documents
disponibles concernant la thérapie par fluide sont fondés sur des
directives consensuelles et des avis d'experts.
Le sérum physiologique (0,9 %) est recommandé en
tant que produit initial de remplacement du liquide IV dans l'ACD. Le
remplacement initial du liquide IV commence avec le chlorure de sodium à
0,9 % à un débit de 15 à 20 ml/kg (environ 1 à 1,5
L) sur la 1 ère h. Par la suite, la vitesse et le type de
fluides sont déterminés par évaluation de l'état
clinique. Les patients présentant un choc hypovolémique sont
poursuivis avec du chlorure de sodium à 0,9 % à un débit
de 1 à 2 L/h jusqu'à ce que leur état devienne stable,
tandis que les patients atteints d'hypovolémie légère ou
modérée reçoivent du chlorure de sodium à 0,9 %
à un débit de 500 ml/h pendant 4 h, suivis de 250 à 500
ml/h, selon l'état clinique. [17]
Une fois que les patients présentant une
hypovolémie sévère deviennent stables, la prise en charge
des liquides IV est modifiée en fonction de celles atteintes
d'hypovolémie légère ou modérée. Une fois
l'hypovolémie corrigée, le type de fluides IV est
déterminé par le taux de sodium sérique corrigé ;
si le taux est faible (- 135 mmol/L), le chlorure de sodium à 0,9 % est
poursuivi et si le taux est normal ou élevé (- 135 mmol/L), les
liquides IV doivent être changés à 0,45 % de chlorure de
sodium. [18]
La vitesse des liquides IV dans les deux groupes sera de 250
à 500 ml/h, en fonction de son statut clinique, tel que le poids, les
signes vitaux, la production d'urine et la présence d'affections Co
morbidiques. Une fois que le taux de glucose dans le sang atteint plus de 11,1
mmol/L (200 mg/dl), le dextrose à 5 % doit être ajouté avec
0,45 % de chlorure de sodium à un débit de 150 à 250 ml/h
pour maintenir la concentration de glucose dans le sang à 8,3-11,1
mmol/L (150-200 mg/dl). [3]
2.2. Traitement électrolytique [19]
L'ACD est associé à un déficit corporel
total significatif d'électrolytes sériques, en particulier de
sodium, de chlorure et de potassium. En moyenne, les patients atteints d'ACD
présentent les déficits suivants d'électrolytes par
kilogramme de poids corporel : sodium, 7-10 mEq/kg; potassium, 3-5 mEq/kg et
chlorure, 3-5 mmol/kg. Le remplacement du sodium et du chlorure suivra les
directives susmentionnées.
La quantité et l'heure de substitut du potassium
dépendent de la concentration de potassium sérique. Aucun
supplément n'est nécessaire si la concentration de potassium
sérique est supérieure à 5,2 mmol/L (5,2 mEq/L), mais les
taux doivent être étroitement surveillés car
l'entrée de potassium dans les cellules serait facilitée par
l'expansion du volume, la résolution de l'acidose et du traitement par
l'insuline, ce qui, à son tour, entraînerait une diminution de la
concentration de potassium sérique. Une fois que le taux de potassium
sérique est supérieur à 5,2 mmol/L, le remplacement du
potassium doit être mis au point pour atteindre un objectif de maintien
à 4-5 mmol/L.
Pour les taux compris entre 3,3 et 5,2 mmol/L, le remplacement
doit être débuté en utilisant 20 à 30 mEq de
potassium dans chaque litre de liquide IV. Si la kaliémie est
supérieure à 3,3 mmol/L, l'insuline ne doit pas être
débutée, car elle peut encore diminuer la kaliémie et le
remplacement du potassium à 20-30 mEq/h doit être
administré jusqu'à ce que le taux de potassium sérique
augmente jusqu'à 3,3 mmol/L.
Dans les essais contrôlés randomisés,
l'utilisation du bicarbonate de sodium pour traiter l'acidose dans l'ACD n'a
pas montré d'impact sur les résultats cliniques. L'acidose est
généralement corrigée avec le traitement de l'ACD, car les
liquides IV améliorent la perfusion tissulaire et la fonction
rénale, augmentant ainsi l'excrétion des acides organiques, et
l'insulinothérapie arrête la synthèse des cétones et
permet de métaboliser les acétoacides en excès,
entraînant la régénération du bicarbonate.
D'autre part, le traitement par bicarbonate augmente le risque
d'hypokaliémie et d'oedème cérébral et ralentit la
vitesse de récupération après la cétose. Dans une
revue systématique, aucun signe d'efficacité clinique n'a
été trouvé lors de l'utilisation d'un traitement par
bicarbonate dans l'ACD et il a été conclu que son utilisation
n'est pas justifiée et peut plutôt être nocive. Par
conséquent, il est recommandé que le bicarbonate ne soit pas
utilisé chez les patients dont le pH est inférieur ou égal
à 6,9.
Bien qu'aucune étude randomisée n'ait
été réalisée concernant l'utilisation du bicarbonate pour la prise en charge de
l'ACD avec des valeurs de pH inférieures à 6,9, l'American
Diabetes Association recommande qu'il soit basé sur l'avis d'experts. Le
sérum potassium doit être surveillé car le traitement par
bicarbonate peut abaisser le taux de potassium, et donc le potassium doit
être complété par des liquides IV, comme indiqué
ci-dessus.
2.3. Traitement de l'insuline [18]
L'inversion thérapeutique est un pilier de la prise en
charge de l'ACD car elle réduit la production de glucose
hépatique, augmente l'utilisation du glucose périphérique
et inhibe la lipolyse, la kétogénèse et la
sécrétion de glucagon, entraînant une diminution de la
glycémie plasmatique et une diminution de la production
d'acidocétose.
L'insuline est généralement administrée
par voie IV, en commençant par un bolus d'insuline
régulière à la dose de 0,1 unité/kg de poids
corporel, puis, en 5 min, suivie d'une perfusion continue d'insuline
régulière de 0,1 unité/kg/h. Il n'y a pas eu de
différence dans les résultats si la perfusion d'insuline par voie
intraveineuse est débutée sans dose en bolus mais à un
débit d'insuline plus élevé à 0, 14,1
unité/kg de poids corporel/h.
Chez les enfants, une dose en bolus d'insuline avant la
perfusion IV n'est pas recommandée, car elle n'améliore pas les
résultats cliniques et peut contribuer au développement d'un
oedème cérébral.
Avec l'insulinothérapie, les taux plasmatiques de
glucose devraient être réduits d'environ 3,8,5-3,9 mmol/L (50-70
mg/dL)/h ou de 10 % de la concentration initiale de glucose après la 1
ère h Si les taux de glucose ne diminuent pas en fonction de
ces taux, l'état d'hydratation et les taux de fluides IV doivent
être évalués et optimisés si nécessaire. Une
fois que cela est assuré, et si les taux plasmatiques de glucose
continuent de ne pas baisser comme souhaité, le débit de
perfusion d'insuline peut être augmenté de 1 unité/h
jusqu'à ce qu'une diminution régulière de la
glycémie sérique par les taux décrits ci-dessus soit
atteinte.
Lorsque la glycémie plasmatique atteint 11,1 mmol/L
(200 mg/dl), la perfusion d'insuline doit être réduite à
0,02 à 0,05 unité/kg/h et 5 % de dextrose doit être
ajoutée aux liquides IV afin de permettre la poursuite de l'insuline
jusqu'à ce que l'acidocétose soit contrôlée et afin
d'éviter l'hypoglycémie.
Le débit de perfusion d'insuline IV et la concentration
de dextrose sont ajustés (10 % de dextrose peuvent être
utilisés si nécessaire) en vue de maintenir les taux de glucose
dans le sang à 8,3-111,1 mmol/L (150-200 mg/dL).
Chez les patients atteints d' devions un cancer du choc
léger ou modéré, l'utilisation d'insuline d'action rapide
sous-cutanée s'est avérée sûre et efficace et peut
être utilisée en remplacement de la perfusion IV d'insuline
régulière. Chez ces patients, l'insulinothérapie doit
être débutée avec un bolus initial de 0,2 à 0,3
unité/kg suivi de 0,1 à 0,2 unité/kg toutes les 1 à
2 h.
La dose peut ensuite être réduite à 0,05
unité/kg toutes les 1 h ou 0,01 unités/kg toutes les 2 h
jusqu'à la résolution de l'ACD. Une étude portant sur un
petit nombre de patients a examiné l'utilisation de l'insuline glulisine
d'action rapide IV dans la prise en charge de l'ACD et l'a trouvée aussi
efficace que l'insuline régulière IV.
L'insuline régulière est toujours
recommandée dans la prise en charge de l'ACD, compte tenu de ses
études bien établies et de son coût inférieur
à celui de l'insuline d'action rapide. Un algorithme de gestion de l'ACD
est présenté à la figure 2
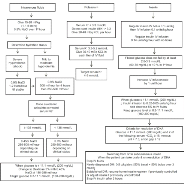
Évaluation clinique initiale :
· Conscience (score de Glasgow),
· Signes de choc : hypotension, tachycardie,
extrémités froides,
· Respiration de Kussmaul (signe de compensation
respiratoire d'une acidose),
· Poids corporel (pour le calcul des doses d'insuline et
du volume de réhydratation).
2.4. Surveillance et
prévention des complications
La prévention des incidents futurs d'ACD et des
admissions à venir est un élément très important de
sa gestion. [19]
Un facteur essentiel dans la planification de la
prévention de l'ACD est la reconnaissance de la cause qui
précipite. Une mauvaise observance de l'insulinothérapie s'est
avérée être un facteur de causalité majeur pour les
hospitalisations pour l'ACD. L'omission d'insuline s'est avérée
être associée à un manque d'éducation des patients,
à un accès limité aux soins de santé, à des
limitations économiques, à des affections psychiatriques
sous-jacentes et à des troubles de l'alimentation. En outre, des
facteurs sociaux et psychiatriques tels que la dépression, les troubles
de l'alimentation, le faible statut socioéconomique et la violence
sexuelle ou physique ont été impliqués dans la survenue
d'admissions répétées pour un achat d'ACD. Un autre
facteur associé aux hospitalisations récurrentes pour l'ACD est
la consommation de substances toxiques, en particulier la drogue. [20]
2.5. Critères de sortie
de l'ACD
La résolution de l'ACD est définie par les
critères suivants [9] :
· pH artériel > 7,3,
· Bicarbonates plasmatiques > 18 mmol/L,
· Cétonémie ou cétonurie
négative ou fortement diminuée,
· Reprise de l'alimentation possible.
À ce stade, on peut passer à l'insuline
sous-cutanée selon un schéma basal-bolus.
2.6. Prévention de la
récidive
La récidive de l'ACD est fréquente si les causes
déclenchantes ne sont pas corrigées.
Les mesures à mettre en place incluent :
· Éducation thérapeutique renforcée
(gestion des oublis, stress, alimentation),
· Plan d'action en cas de maladie aiguë (ajuster les
doses, maintenir l'hydratation),
· Amélioration de l'adhésion au
traitement,
· Traitement optimal des pathologies intercurrentes (ex.
infections urinaires, tuberculose, etc.).
2.7. Stratégies
éducatives chez le patient diabétique
L'éducation thérapeutique constitue un pilier de
la prévention des décompensations :
L'éducation des patients est un élément
essentiel de la prévention des futures admissions à
l'hôpital pour l'ACD. Les programmes éducatifs devraient
comprendre des directives sur la prise en charge du diabète pendant les
périodes de maladie (gestion de la journée malade). Ces
programmes doivent inclure des informations claires sur :
· l'importance de la poursuite de l'insuline,
· la reconnaissance précoce des manifestations de
l'ACD,
· une surveillance plus fréquente de la
glycémie à domicile et de la présence de cétones
(urine ou sang),
· l'ajustement des doses d'insuline et l'utilisation
d'insuline supplémentaire, selon les besoins et
· cas où le prestataire de soins de santé
doit être contacté.
L'auto surveillance des cétones sanguines, par rapport
aux tests urinaires de la cétone, facilite l'identification et le
traitement plus précoces de la cétose et peut diminuer les
visites et les hospitalisations dans les services d'urgence liés au
diabète. La fréquence de récurrence de l'ACD peut
être réduite grâce à une éducation
structurée des patients, à une intervention comportementale,
à fournir un soutien aux patients et aux familles, à
améliorer l'accès des patients aux prestataires de soins
médicaux, à la disponibilité d'un accès
étendu aux services téléphoniques et à la
télémédecine. De plus,
il a
été constaté que les campagnes de sensibilisation du
public axées sur l'éducation précoce des signes
précoces du diabète réduisent considérablement la
fréquence des ACD chez les patients atteints de nouveau diabète.
[21,22]
L'intégration d'une équipe multidisciplinaire
(diabétologue, infirmier éducateur, nutritionniste, psychologue)
est recommandée pour un accompagnement efficace.
CHAPITRE III : MATERIEL ET
MÉTHODES
3.1. Cadre et période de
l'étude
Les Cliniques Universitaires de Lubumbashi comprennent
plusieurs services spécialisés, mais l'étude s'est
déroulée dans le service de Médecine interne, où
les cas d'hypertension artérielle sont le plus fréquemment
diagnostiqués et suivis.
Les Cliniques universitaire de Lubumbashi (C.U.L) en sigle se
situent au croisement des avenues Kasaï et Ndjamena, au Sud-est de
l'école de Santé Publique, du lycée Tuendelee ; l'avenue
Kambove et l'Institut Imara l'encerclent au Nord-ouest.
3.2. Type d'étude
Il s'agira d'une étude observationnelle, descriptive et
transversale avec un volet analytique.
3.3. Population
d'étude
La population cible comprend tous les patients adultes (= 18
ans) hospitalisés pour acidocétose diabétique
confirmée aux Cliniques Universitaires de Lubumbashi durant la
période d'étude.
3.4. Critères
d'inclusion
· Patients âgés de 18 ans ou plus ;
· Patients hospitalisés avec un diagnostic d'ACD
retenu selon les critères de l'ADA (glycémie > 250 mg/dL,
cétonémie ou cétonurie positive, pH < 7,3 et/ou HCO3
< 18 mmol/L) ;
· Patients ayant un dossier médical
exploitable.
3.5. Critères de non
inclusion
· Patients de moins de 18 ans ;
· Patients hospitalisés pour d'autres urgences
métaboliques (syndrome hyperosmolaire, acidose lactique) sans
critère d'ACD ;
· Dossiers incomplets ou inexploitables.
· Acdicocétose euglycémique.
3.6. Taille de
l'échantillon
La taille de l'échantillon sera exhaustive : tous les
cas répondant aux critères d'inclusion durant la période
d'étude seront inclus.
3.7. Variables
étudiées
a) Variables
sociodémographiques :
Âge, sexe, profession, niveau d'instruction,
antécédents familiaux.
b) Variables cliniques :
Type de diabète, ancienneté du diagnostic, mode
de révélation, symptômes à l'admission, état
de conscience, facteurs déclenchants (infection, arrêt de
traitement, autres).
c) Variables biologiques :
Glycémie, cétonémie/cétonurie, pH
sanguin, bicarbonates, kaliémie, natrémie, créatinine,
urines, créatinine, albumine.
d) Variables
thérapeutiques:
Modalités de réhydratation, doses et protocoles
d'insuline, correction du potassium, recours aux soins intensifs.
e) Variables évolutives
:
Durée d'hospitalisation, complications survenues, issue
(guérison, transfert, décès).
3.8. Sources et collecte des
données
Les données seront recueillies à partir :
· des registres d'hospitalisation des services de
médecine interne et de réanimation,
· des dossiers médicaux individuels,
· des rapports de laboratoire et d'imagerie.
Un questionnaire standardisé sera utilisé pour
la collecte, afin d'assurer l'homogénéité et la
fiabilité des informations.
3.9. Analyse des
données
Les données seront saisies et analysées à
l'aide du logiciel SPSS (version 25.0) ou R.
Les variables quantitatives seront exprimées en moyenne
#177; écart-type ou médiane (avec intervalle interquartile),
selon leur distribution.
Les variables qualitatives seront présentées en
fréquences et pourcentages.
Les comparaisons entre groupes se feront à l'aide du
test de Chi² ou du test exact de Fisher pour les variables qualitatives,
et du test de Student ou Mann-Whitney pour les variables quantitatives.
Le seuil de significativité statistique sera
fixé à p < 0,05.
CHAPITRE IV :
RÉSULTATS
4.1. Fréquence de
l'acidocétose aux C.U.L
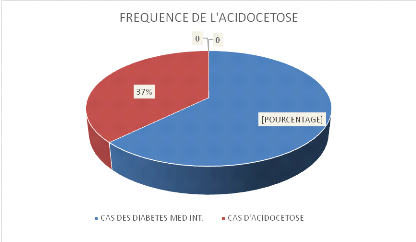
Figure 1 fréquence de l'acidocétose
diabétique
4.2. Caractéristiques
sociodémographiques des patients
Tableau 1 : Répartition des patients selon
l'âge et le sexe (N = 109)
|
TRANCHE D'ÂGE (ANS)
|
HOMMES N (%)
|
FEMMES N (%)
|
TOTAL N (%)
|
|
18 - 29
|
8 (7,3 %)
|
10 (9,2 %)
|
18 (16,5 %)
|
|
30 - 44
|
14 (12,8 %)
|
18 (16,5 %)
|
32 (29,4 %)
|
|
45 - 59
|
15 (13,8 %)
|
20 (18,3 %)
|
35 (32,1 %)
|
|
= 60
|
12 (11,0 %)
|
12 (11,0 %)
|
24 (22,0 %)
|
|
TOTAL
|
49 (45,0 %)
|
60 (55,0 %)
|
109 (100 %)
|
La moyenne d'âge était de 47 #177; 15 ans avec
des extrêmes de 18 à 76 ans. La tranche d'âge la plus
représentée était celle des 45-59 ans (32,1 %). Une
légère prédominance féminine a été
observée (55 % contre 45 % d'hommes). Ces résultats
suggèrent que l'ACD touche principalement l'adulte d'âge moyen
dans notre contexte.
4.2. Antécédents
et traitement reçu
Tableau 2 : Répartition selon
l'antécédent de diabète et le traitement reçu
(N = 109)
|
VARIABLES
|
N
|
%
|
|
DIABÈTE CONNU
|
83
|
76,1 %
|
|
- TYPE 1
|
22
|
20,2 %
|
|
- TYPE 2
|
55
|
50,5 %
|
|
- INCONNU
|
6
|
5,5 %
|
|
DIABÈTE NON CONNU (RÉVÉLÉ PAR
ACD)
|
26
|
23,9 %
|
|
|
|
|
TRAITEMENT RÉCU
|
|
|
|
- INSULINE
|
37
|
33,9 %
|
|
- ADO
|
28
|
25,7 %
|
|
- AUCUN
|
44
|
40,4 %
|
|
OBSERVANCE THÉRAPEUTIQUE
|
|
|
|
- BONNE
|
29
|
26,6 %
|
|
- IRRÉGULIÈRE
|
38
|
34,9 %
|
|
- MAUVAISE
|
42
|
38,5 %
|
La majorité des patients (76,1 %) avaient un
diabète déjà connu, surtout de type 2 (50,5 %). Toutefois,
près d'un quart (23,9 %) des cas correspondaient à une
découverte du diabète par l'ACD. Concernant le traitement, 40,4 %
n'étaient pas suivis, et l'observance était insuffisante chez
plus de 70 % des patients. Ces données montrent l'importance des lacunes
dans le suivi du diabète.
4.3. Facteurs
déclenchants
Tableau 3 : Facteurs déclenchants
identifiés de l'ACD (N = 109)
|
FACTEUR DÉCLENCHANT
|
N
|
%
|
|
INFECTION
|
57
|
52,3 %
|
|
OUBLI OU ARRÊT DU TRAITEMENT
|
28
|
25,7 %
|
|
CHIRURGIE / TRAUMATISME
|
6
|
5,5 %
|
|
MÉDICAMENTS (CORTICOÏDES, SGLT2I)
|
3
|
2,8 %
|
|
INFARCTUS DU MYOCARDE / AVC
|
2
|
1,8 %
|
|
PANCRÉATITE AIGUË
|
1
|
0,9 %
|
|
ALCOOL / DROGUES
|
0
|
0,0 %
|
|
NON IDENTIFIÉS
|
12
|
11,0 %
|
|
TOTAL
|
109
|
100 %
|
Les infections demeurent les principaux déclencheurs de
l'ACD (52,3 %), suivies par l'arrêt ou l'oubli du traitement (25,7 %).
Les autres causes incluaient la chirurgie ou un traumatisme (5,5 %), certains
médicaments comme les corticoïdes ou inhibiteurs de SGLT2 (2,8 %),
les complications cardiovasculaires aiguës telles que l'infarctus du
myocarde ou l'AVC (1,8 %), et plus rarement une pancréatite aiguë
(0,9 %). Dans 11 % des cas, aucun facteur déclenchant n'a pu être
identifié.
4.4. Manifestations
cliniques
Tableau 4 : Symptômes cliniques observés
à l'admission (N = 109)
|
SYMPTÔMES
|
N
|
%
|
|
POLYURIE / POLYDIPSIE
|
81
|
74,3 %
|
|
DOULEURS ABDOMINALES
|
52
|
47,7 %
|
|
NAUSÉES / VOMISSEMENTS
|
69
|
63,3 %
|
|
TROUBLES DE LA CONSCIENCE
|
31
|
28,4 %
|
|
RESPIRATION DE KUSSMAUL
|
44
|
40,4 %
|
Les signes les plus fréquents étaient la
polyurie/polydipsie (74,3 %) et les nausées/vomissements (63,3 %). Les
troubles de la conscience concernaient près de 30 % des cas, soulignant
la gravité de certaines présentations.
4.5. Données biologiques
à l'admission
Tableau 5 : Paramètres biologiques des patients (N
= 109)
|
PARAMÈTRES
|
MOYENNE #177; ET
|
EXTRÊMES
|
|
GLYCÉMIE (MG/DL)
|
442 #177; 96
|
276 - 720
|
|
PH SANGUIN
|
7,12 #177; 0,12
|
6,85 - 7,28
|
|
BICARBONATES (MMOL/L)
|
13,4 #177; 4,2
|
5 - 18
|
|
CÉTONURIE
|
Positive : 100 %
|
-
|
|
KALIÉMIE (MMOL/L)
|
3,6 #177; 0,9
|
2,5 - 6,2
|
|
NATRÉMIE (MMOL/L)
|
134 #177; 6,5
|
121 - 147
|
|
CHLOREMIE (MMOL/L)
|
101 #177; 4,8
|
92 - 112
|
|
URÉE (MG/DL)
|
52 #177; 18
|
25 - 110
|
|
CRÉATININE (MG/DL)
|
1,4 #177; 0,6
|
0,8 - 3,2
|
|
OSMOLARITÉ SÉRIQUE (MOSM/L)
|
294 #177; 12
|
278 - 315
|
Tous les patients présentaient une cétonurie
positive. La glycémie moyenne dépassait largement le seuil
diagnostique (> 250 mg/dL). L'acidose métabolique était
marquée (pH moyen 7,12 et bicarbonates effondrés).
Une hyponatrémie relative était observée (Na
moyen 134 mmol/L), probablement secondaire à l'hyperglycémie.
L'élévation de l'urée et de la
créatinine traduit une déshydratation sévère.
L'osmolarité sérique était également
augmentée, confirmant la sévérité du
déséquilibre métabolique.
4.6. Traitement reçu
Tableau 6 : Répartition des modalités
thérapeutiques (N = 109)
|
MODALITÉ THÉRAPEUTIQUE
|
N
|
%
|
|
INSULINOTHÉRAPIE IV
|
109
|
100 %
|
|
RÉHYDRATATION IV
Sérum salé isotonique (NaCl 0,9 %)- Ringer
lactate- Sérum glucosé 5 % (après correction)
|
109
109
24
68
|
100 %
100 %
22,0 %
62,4 %
|
|
|
|
|
|
|
|
|
|
|
CORRECTION ÉLECTROLYTIQUE
|
77
|
70,6 %
|
|
ANTIBIOTHÉRAPIE
|
51
|
46,8 %
|
Tous les patients ont reçu une insulinothérapie
intraveineuse associée à une réhydratation initiale par
sérum salé isotonique (NaCl 0,9 %). Le Ringer lactate a
été utilisé comme alternative dans 22 % des cas.
Après la baisse de la glycémie en dessous de 250 mg/dL, du
sérum glucosé à 5 % a été administré
dans 62,4 % des cas, conformément aux protocoles internationaux. La
correction électrolytique, principalement avec du chlorure de potassium,
a concerné 70,6 % des patients. Une antibiothérapie a
été prescrite à 46,8 % des patients, en lien avec la forte
prévalence des infections comme facteurs déclenchants.
4.7. Évolution
clinique
Tableau 7 : Issue des patients hospitalisés pour
ACD (N = 109)
|
ISSUE
|
N
|
%
|
|
GUÉRISON
|
85
|
78,0 %
|
|
COMPLICATIONS
|
14
|
12,8 %
|
|
DÉCÈS
|
10
|
9,2 %
|
|
DURÉE MOYENNE SÉJOUR
|
6,8 #177; 3,4 jours
|
Extrêmes : 2 - 18 jours
|
La majorité des patients (78 %) ont
évolué favorablement. Le taux de mortalité (9,2 %) reste
préoccupant mais inférieur à certaines séries
africaines. La durée moyenne de séjour (6,8 jours) reflète
la gravité du tableau et la nécessité d'un suivi
hospitalier prolongé.
CHAPITRE V : DISCUSSION
5.1. Considérations
générales
Notre étude, menée aux Cliniques Universitaires de
Lubumbashi, avait pour objectif de déterminer la
fréquence et la prise en charge de l'acidocétose
diabétique (ACD) chez l'adulte. Nous avons colligé 109
cas d'ACD sur 292 hospitalisations en médecine interne, soit une
fréquence hospitalière de 37,3 %.
Ce taux est
élevé par rapport à certaines séries africaines :
Mbanya et al. (2023) rapportaient 26 % au Cameroun, tandis que
Amour et al. (2022) en Tanzanie décrivaient 32 %. En
revanche, il reste très supérieur aux données des pays
industrialisés où la fréquence de l'ACD en hospitalisation
est généralement inférieure à 10 %
(Kitabchi et al., 2024). Cela reflète le poids du
diabète mal contrôlé et les difficultés
d'accès aux soins dans notre contexte.
5.2. Profil
sociodémographique
L'âge moyen des patients était de 47 ans, avec une
prédominance de la tranche 45-59 ans (32,1 %). Cela traduit la
fréquence croissante de l'ACD chez les diabétiques de
type 2 adultes, contrairement aux pays occidentaux où l'ACD
survient surtout chez les jeunes diabétiques de type 1
(Wolfsdorf et al., 2022).
Le sexe féminin était légèrement
dominant (55 %). Ce constat rejoint les observations de Mbanya et al.
(2023) en Afrique centrale, qui attribuent cette différence
à la fois aux inégalités d'accès aux soins et aux
facteurs hormonaux augmentant le risque d'hyperglycémie chez les
femmes.
5.3. Antécédents
et traitement antérieur
Dans notre série, 76,1 % des patients avaient un
diabète connu, principalement de type 2 (50,5 %). L'ACD a
révélé le diabète dans 23,9 % des cas, ce qui
concorde avec les chiffres de Wolfsdorf et al. (2022) (20-25
%).
L'absence de traitement antérieur concernait 40,4 % des patients,
et l'observance était
jugée mauvaise dans près de 38,5 %. Cette mauvaise
observance est un déterminant majeur de l'ACD, déjà
souligné par Kitabchi et al. (2024) et confirmé
par Gosmanov et al. (2021), qui insistent sur l'importance de
l'éducation thérapeutique et du suivi rapproché des
diabétiques.
5.4. Facteurs
déclenchants
L'infection était le facteur déclenchant principal
(52,3 %), ce qui rejoint les données de Krinsley et al.
(2020) et de Gosmanov et al. (2021), qui placent
l'infection au premier plan dans plus de 50 % des cas.
L'arrêt ou l'oubli du traitement était
retrouvé dans 25,7 % des cas, confirmant le rôle central de
l'inobservance thérapeutique déjà souligné par
Atun et al. (2021).
Parmi les autres facteurs
identifiés, on note la chirurgie/traumatisme (5,5 %), les
médicaments comme les corticoïdes et les inhibiteurs de SGLT2 (2,8
%), les complications cardiovasculaires aiguës telles que l'infarctus du
myocarde ou l'AVC (1,8 %), et la pancréatite (0,9 %).
Ces résultats mettent en lumière la
diversité des contextes déclencheurs, ce que Kitabchi et
al. (2024) considèrent comme un défi diagnostique et
thérapeutique.
5.5. Manifestations
cliniques
La polyurie et la polydipsie (74,3 %), les
nausées/vomissements (63,3 %) et les douleurs abdominales (47,7 %)
étaient les signes les plus fréquents. Ces symptômes sont
typiques et rejoignent ceux décrits par Wolfsdorf et al.
(2022).
Les troubles de la conscience concernaient 28,4 % des cas,
proportion légèrement inférieure à celle
rapportée par Amour et al. (2022) (35 %).
La respiration de Kussmaul était observée chez 40,4
% des patients, traduisant une acidose métabolique
sévère.
5.6. Données
biologiques
Les valeurs biologiques confirmaient l'ACD : glycémie
moyenne de 442 mg/dL, pH moyen de 7,12, bicarbonates de 13,4 mmol/L et
cétonurie positive à 100 %.
Les troubles
électrolytiques étaient marqués, notamment une
hypokaliémie (moyenne 3,6 mmol/L) et une hyponatrémie relative
(134 mmol/L). Ces désordres sont bien décrits dans la
littérature comme conséquences de l'hyperglycémie et de la
diurèse osmotique (Kitabchi et al., 2024 ; Gosmanov et al.,
2021).
L'élévation de l'urée (52 mg/dL) et de la
créatinine (1,4 mg/dL) reflétait l'insuffisance rénale
fonctionnelle secondaire à la déshydratation. L'osmolarité
sérique moyenne (294 mOsm/L) confirmait la sévérité
du déséquilibre métabolique.
5.7. Prise en charge
thérapeutique
Tous les patients ont reçu une insulinothérapie IV
et une réhydratation par sérum salé isotonique
(NaCl 0,9 %). Comme recommandé par l'ADA
(2024), le sérum glucosé 5 % a été
introduit dans 62,4 % des cas une fois la glycémie < 250 mg/dL. Le
Ringer lactate a été utilisé dans 22 % des cas comme
alternative.
La correction électrolytique a concerné 70,6 % des
patients, principalement par chlorure de potassium. Ce chiffre reste
insuffisant, probablement en raison de la disponibilité limitée
du potassium dans notre contexte, alors que les recommandations internationales
insistent sur son apport systématique (Kitabchi et al., 2024 ;
Wolfsdorf et al., 2022).
L'antibiothérapie a été prescrite dans 46,8
% des cas, ce qui correspond à la forte proportion d'infections comme
facteurs déclenchants.
5.8. Évolution
clinique
L'évolution a été favorable dans 78 % des
cas. Le taux de mortalité était de 9,2 %, inférieur
à certaines séries africaines (15-26 % chez Amour et al.,
2022), mais largement supérieur aux taux des pays
développés (< 1 %, Kitabchi et al., 2024).
La durée moyenne d'hospitalisation était de 6,8
jours, comparable à celle décrite par Gosmanov et al.
(2021) (5-7 jours).
Ces résultats témoignent à
la fois des progrès réalisés dans la prise en charge aux
CUL et des défis persistants, notamment la disponibilité des
électrolytes et la détection précoce des complications.
5.9. Limites et forces de
l'étude
Cette étude est limitée par son caractère
monocentrique et la dépendance aux données des dossiers
médicaux, pouvant comporter des biais d'information. L'absence de suivi
post-hospitalisation limite aussi l'évaluation des récidives.
Cependant, elle représente l'une des rares études
récentes sur l'ACD en RDC, avec une collecte exhaustive des cas et une
analyse détaillée des aspects cliniques, biologiques et
thérapeutiques, permettant une comparaison pertinente avec les standards
internationaux.
CONCLUSION ET
RECOMMANDATIONS
Conclusion
Cette étude menée aux Cliniques Universitaires de
Lubumbashi sur une période d'un an (avril 2023 - avril 2025) a permis de
dresser un état des lieux de la fréquence et de la prise
en charge de l'acidocétose diabétique (ACD) chez
l'adulte.
Les principaux enseignements sont :
· La fréquence hospitalière de
l'ACD était de 37,3 % parmi les admissions en
médecine interne, un chiffre préoccupant et supérieur
à celui rapporté dans plusieurs séries africaines.
· L'ACD touchait principalement les adultes
d'âge moyen (45-59 ans), avec une légère
prédominance féminine.
· Le diabète de type 2 connu
était le contexte le plus fréquent, mais près d'un quart
des patients ont découvert leur diabète à l'occasion d'un
épisode d'ACD.
· Les facteurs déclenchants majeurs
étaient les infections (52,3 %), suivies de l'arrêt ou de l'oubli
du traitement (25,7 %). Les autres causes incluaient la chirurgie, certains
médicaments (corticoïdes, SGLT2i), les événements
cardiovasculaires aigus et la pancréatite.
· Sur le plan biologique, tous les patients
présentaient une cétonurie positive, une hyperglycémie
sévère, une acidose métabolique, et fréquemment des
troubles hydro-électrolytiques associés à une atteinte
rénale fonctionnelle.
· La prise en charge thérapeutique
reposait sur l'insulinothérapie IV et la réhydratation par
sérum salé isotonique, complétée dans certains cas
par du Ringer lactate et du sérum glucosé. La correction du
potassium restait insuffisante (70,6 %).
· L'évolution clinique était
favorable dans 78 % des cas, avec une mortalité hospitalière de
9,2 %, nettement plus élevée que dans les pays
industrialisés (< 1 %).
Ces résultats mettent en évidence à la fois
les progrès réalisés dans la gestion de
l'ACD aux CUL et les défis persistants liés
à la prévention, au suivi des diabétiques et à la
disponibilité des moyens thérapeutiques.
Recommandations
Aux
autoritéssanitaires
· Renforcer les programmes nationaux de lutte contre
le diabète avec un accent sur la prévention des
complications aiguës comme l'ACD.
· Faciliter l'accès aux médicaments
essentiels (insuline, solutions électrolytiques, bandelettes
urinaires pour cétonurie).
· Développer des protocoles
standardisés de prise en charge de l'ACD dans les structures
hospitalières de référence.
Aux CliniquesUniversitaires de
Lubumbashi
· Améliorer la disponibilité du
potassium et des liquides adaptés pour la correction des
désordres hydro-électrolytiques.
· Mettre en place une filière de triage et de
suivi rapproché des patients diabétiques admis pour
ACD.
· Renforcer la collaboration entre les services de
médecine interne, de réanimation et de laboratoire pour une prise
en charge multidisciplinaire.
Aux professionnels de
santé
· Sensibiliser les patients sur l'importance de
l'observance thérapeutique et du suivi
régulier.
· Dépister et traiter rapidement les facteurs
déclenchants, notamment les infections et l'inobservance.
· Promouvoir l'éducation
thérapeutique pour aider les patients à
reconnaître précocement les signes annonciateurs d'une ACD.
Aux patients
diabétiques et leurs familles
· Respecter rigoureusement le traitement prescrit et les
rendez-vous de suivi.
· Consulter sans délai devant tout signe d'alerte
(polyurie, polydipsie, douleurs abdominales, nausées/vomissements).
· Maintenir une bonne hygiène de vie (alimentation
équilibrée, activité physique adaptée, limitation
de l'alcool et du stress).
BIBLIOGRAPHIE
1. International Diabetes Federation. IDF Diabetes Atlas.
10th ed. Brussels, Belgium: IDF; 2021. https://diabetesatlas.org
2. Mbanya JC, Motala AA, Sobngwi E, Assah FK, Enoru ST.
Diabetes in sub-Saharan Africa. Lancet. 2010;375(9733):2254-66.
doi:10.1016/S0140-6736(10)60550-8
3. Atun R, Davies JI, Gale EA, et al. Diabetes in sub-Saharan
Africa: from clinical care to health policy. Lancet Diabetes Endocrinol.
2021;9(7):475-91. doi:10.1016/S2213-8587(21)00105-2
4. M'Buyamba-Kabangu JR, Kayembe-Kitenge T, et al. Prevalence
and determinants of diabetes in urban and rural Democratic Republic of Congo.
Pan Afr Med J. 2022;41:176. doi:10.11604/pamj.2022.41.176.27190
5. Kitabchi AE, Umpierrez GE, Miles JM, Fisher JN.
Hyperglycemic crises in adult patients with diabetes. Diabetes Care. 2020;
43(7):1689-95. doi:10.2337/dci20-0023
6. Wolfsdorf J, Craig ME, Daneman D et al. : ISPAD Clinical
Practice Consensus Guidelines 2024. Diabetic ketoacidosis. Pediatr Diabetes
2024; 10 (suppl12): 118-33
7. Krinsley JS, Preiser JC. Diabetic ketoacidosis in
low-resource settings: outcomes and challenges. J Crit Care. 2020;35:250-254.
doi:10.1016/j.jcrc.2020.03.009
8. Amour AA, Bile EB, et al. Diabetic ketoacidosis outcomes
in Africa: A systematic review. BMC EndocrDisord. 2022; 22(1):57.
doi:10.1186/s12902-022-00903-2
9. Wolfsdorf JI, Glaser N, Agus M, et al. ISPAD Clinical
Practice Consensus Guidelines 2022: Diabetic ketoacidosis and hyperglycemic
hyperosmolar state. PediatrDiabetes. 2022;23(6):696-714.
doi:10.1111/pedi.13377
10. Tang H, Li D, Wang T, Jai S, Song Y. Effet des inhibiteurs
du cotransporteur de sodium-glucose 2 sur l'acidocétose
diabétique chez les patients atteints de diabète de type 2:
méta-analyse des essais contrôlés randomisés.
Diabetes Care. 2016;39:e123-4. doi: 10.2337/dc16-0885. [
DOI[
PubMed[
Google
Scholar-
11. Al Khaja KA, Sequeira RP, Mathur VS. Insulin therapy and
clinical outcomes in diabetic ketoacidosis: a comparative study. J Clin Pharm
Ther. 2023;48(2):233-240. doi:10.1111/jcpt.13748
12. American Diabetes Association (ADA). Standards of Medical
Care in Diabetes--2024. Diabetes Care. 2024; 47(Suppl.1):S1-S286. Doi:
10.2337/dc24-S001
13. World Health Organization (WHO). Definition and diagnosis
of diabetes mellitus and intermediate hyperglycemia: Report of a WHO/IDF
consultation. Geneva: WHO; 2024.
https://www.who.int
14. Banting FG, Best CH, Collip JB, Campbell WR, Fletcher AA.
Extraits pancréatiques dans le traitement du diabète. Can Med
Assoc J. 2022;12:141-6.
15. Brooke J, Stiell M, Ojo O. Evaluation de la
précision de la mesure de l'hydroxybutyrate capillaire par rapport
à d'autres mesures dans le diagnostic de l'acidocétose
diabétique: Examen systématique. Int J. Environ Res Public
Health. 2024; 13:837. Doi: 10.3390/ijerph13090837.
16. Nyenwe EA, Kitabchi AE. Prise en charge des urgences
hyperglycémiques en cas de diabète sucré. Diabète
Res Clin Pract. 2023;94:340-51. doi: 10.1016/j.diabres.2023.09.012.
17. Kitabchi AE, Umpierrez GE, Miles JM, Fisher JN. Crises
hyperglycémiques chez les patients adultes diabétiques. Soins du
diabète. 2025:32:1335-43. doi: 10.2337/dc09-9032.
18. Savage MW, Dhatariya KK, Kilvert A, Rayman G, Rees JA,
Courtney CH, et al. Joint British DiabetesSocieties directives pour la prise en
charge de l'acidocétose diabétique. Diabet Med. 201128:508-15.
doi: 10.1111/j.1464-5491.2011.03246.x.
19. Eledrisi MS, Alshanti MS, Shah MF, Brolosy B, Jaha N.
Aperçu du diagnostic et de la prise en charge de l'acidocétose
diabétique. Am J. M. Sci. 2024; 331:243-51?Doi:
10.1097/00000441-202405000-00002.
20. yenwe EA, Loganathan RS, Blum S, Ezuteh DO, Erani DM, Wan
JY, et al. L'usage actif de la cocaine est une maladie : facteur de risque
indépendant d'acidocétose diabétique récurrente
dans un hôpital de ville. EndocrPract. 2007; 13:22-9. Doi:
10.4158/EP.13.1.22.
21. Wagner DV, Barry S, Teplitsky L, Sheffield A, Stoeckel M,
Ogden JD, et al. D'exposer les adolescents en ré répète
DKA et leurs aidants. J Diabète SciTechnol. 2016;10:831-9. Doi:
10.1177/1932296816639610.
22. King BR, Howard NJ, Verge CF, Jack MM, Govind N, Jameson
K, et al. Une campagne de sensibilisation au diabète prévient
l'acidocétose diabétique chez les enfants lors de leur
présentation initiale avec le diabète de type 1. Pediatr
Diabète. 2012:13:647-51. doi: 10.1111/j.1399-5448.2012.00896.x.
Table des matières
ÉPIGRAPHE
Erreur ! Signet non
défini.
« Tout ce que ta main trouve à faire
avec ta force, fais-le ; car il n'y a ni oeuvre, ni pensée, ni
science, ni sagesse dans le séjour des morts où tu vas.
»
1
DEDICACE
2
REMERCIEMENT
4
LISTE DES ABRÉVIATIONS
5
INTRODUCTION
6
1. État de la question
6
2. Problématique
7
3. Question de recherche
7
4. Objectif général
7
5. Objectifs spécifiques
8
6. Délimitation du travail
8
CHAPITRE 1. GÉNÉRALITÉS SUR
L'ACIDOCÉTOSE DIABÉTIQUE
9
1.1. Épidémiologie mondiale,
africaine et nationale du diabète et de l'ACD
9
1.2. Facteurs étiologiques de
l'acidocétose diabétique.
9
1.3. Physiopathologie de l'ACD [12]
10
1.4. Manifestations cliniques de l'ACD
11
1.5. Examens complémentaires
12
1.6. Critères diagnostiques de
l'ACD
13
CHAPITRE 2 : PRISE EN CHARGE DE
L'ACIDOCÉTOSE DIABÉTIQUE
14
2.1. Traitement des fluides
14
2.2. Traitement électrolytique [19]
15
2.3. Traitement de l'insuline [18]
16
2.4. Surveillance et prévention des
complications
18
2.5. Critères de sortie de l'ACD
18
2.6. Prévention de la récidive
19
2.7. Stratégies éducatives chez le
patient diabétique
19
CHAPITRE III : MATERIEL ET MÉTHODES
21
3.1. Cadre et période de l'étude
21
3.2. Type d'étude
21
3.3. Population d'étude
21
3.4. Critères d'inclusion
21
3.5. Critères de non inclusion
22
3.6. Taille de l'échantillon
22
3.7. Variables étudiées
22
a) Variables sociodémographiques :
22
b) Variables cliniques :
22
c) Variables biologiques :
22
d) Variables thérapeutiques
22
e) Variables évolutives :
23
3.8. Sources et collecte des données
23
3.9. Analyse des données
23
CHAPITRE IV : RÉSULTATS
24
4.1. Fréquence de l'acidocétose aux
C.U.L
24
4.2. Caractéristiques
sociodémographiques des patients
24
4.2. Antécédents et traitement
reçu
25
4.3. Facteurs déclenchants
26
4.4. Manifestations cliniques
26
4.5. Données biologiques à
l'admission
27
4.6. Traitement reçu
28
4.7. Évolution clinique
28
CHAPITRE V : DISCUSSION
29
5.1. Considérations
générales
29
5.2. Profil sociodémographique
29
5.3. Antécédents et traitement
antérieur
29
5.4. Facteurs déclenchants
30
5.5. Manifestations cliniques
30
5.6. Données biologiques
30
5.7. Prise en charge thérapeutique
31
5.8. Évolution clinique
31
5.9. Limites et forces de l'étude
31
CONCLUSION ET RECOMMANDATIONS
32
Conclusion
32
Recommandations
33
Aux autorités sanitaires
33
Aux Cliniques Universitaires de Lubumbashi
33
Aux professionnels de santé
33
Aux patients diabétiques et leurs
familles
33
BIBLIOGRAPHIE
34
| 


