|
République Algérienne Démocratique et
Populaire
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
Université Ibn Khaldoun -
Tiaret
Faculté des Sciences et des Sciences de
l'Ingénieur
Département de Génie
Mécanique
Laboratoire de Recherche des Technologies Industrielles
MÉMOIRE
pour obtenir le Diplôme
d'Ingénieur
Spécialité : Génie Mécanique Option :
Energétique
Thème
Simulation et optimisation de la combustion isobare
des
hydrocarbures saturés CnH2n+2 par
deux approches de
résolution
Présenté par:
Monsieurs KHERRIS Sahraoui et
KHARROUBI Ahmed
Soutenu le : 07 /07 / 2002
Devant le jury: MM.
|
SAD CHEMLOUL Noureddine
|
Chargé de Cours
|
Université de Tiaret
|
Président
|
|
GUERRI Mohamed
|
M. A. C. de Cours
|
Université de Tiaret
|
Examinateur
|
|
ABED Belkacem
|
M. de Conférences
|
Université de Tiaret
|
Examinateur
|
|
ASNOUN Ahmed
|
Chargé de Cours
|
Université de Tiaret
|
Rapporteur
|

Nous tenons à présenter nos vifs remerciements
à Monsieur ASNOUN Ahmed pour l'honneur qu'il nous a accordé de
proposer ce projet de fin d'étude et de nous avoir encadré et
prodigué ses précieux conseils durant toute la période de
notre étude.
Nous tenons aussi à lui exprimer notre profonde et
gratitude respect pour sa sympathie; sa modestie et son encouragement lors de
la réalisation de ce travail.
Nous remercions très sincèrement tous les nombres
de jury d'avoir accepté de juger ce travail.
Nous adressons nos vifs remerciements à tous nos
professeurs qui ont contribués à notre formation sur tous:
Chemloul.S, Haddouche.K, Abed.B, Madani.A,
particulièrement Monsieur M.Guerri et Mzad.H; ainsi qu'à
l'ensemble de personnel de l'institut.
Nous adressons aussi nos remerciements à tout le personnel
de la bibliothèque de l'institut de Génie Mécanique.
Nous adressons nos remerciements à tout le personnel de la
boite informatique (HIDHEB Computer) en particulier:
Khaled. Miloudi et Mustapha. Akermi pour leurs gentillesses et
leurs encouragements.
En fin, nous n'oublions pas de remercier tout nos amis:
Selam.Laid, Mekroussi .s, debeh.M, safa.A, rabeh.H, Bendbiza.H,
chatouane.M, Guetaf.AEK, Mahrouz.AEK, Deouiyeb.H, Belabass.S ects.
A toutes les personnes qui, de prés ou de loin nous ont
soutenu lors de ce travail, nous adressons nos sincrères
remerciements.

Je dédie cette oeuvre à mes très
chers parents qui m'ont soutenu au cours de mes études.
Je la dédie également à mes
frères et mes soeurs surtout Mansour et Bendhiba.
Je la dédie à:
ZIAINA. Ahmed NOUAR. Lakhdar MIL YANI. Habchi ZIAINA.
Aissa
FETEH. Benaissa GAÂMOUCI.
Lakhdar
HADJI. Brahime AKERMI.Maidi
ainsi, qu'a mes amis sans exception.
Également je la dédie à tous les
étudiants et les étudiantes de l'institut de Génie
Mécanique.
Et en particulier à une personne qui m'est
très chère et qui a toujours su m'aider.
KHERRIS. Sahraoui

Je dédie cette oeuvre
à:
Mes très chers parents qui m'ont soutenu au
cours de mes études. Mes frères et mes soeurs.
Mes amis:
KRAKRIA. Ahmed, B.AEK, G.Sassi, B.Abderrahmane,
B.Kadoure, B.Mohamed, B.Mohamed, BOUDJLALE. Mohamed, K.Mohamed, MORDJANI.M,
K.Hassane, Rachdi.B, B.Sâad, Mostfaoui.A ..ect.
Mes professeurs.
A tous mes camarades de la promotion Génie
Mécanique.
KHARROUBI. Ahmed

|
Introduction
CHAPITRE I : potentiel chimique
|
.1
|
|
I-1 - Notion de potentiel chimique
|
2
|
|
I-2- Potentiel chimique d'un gaz parfait
|
4
|
|
I-3- Potentiel chimique d'un mélange
|
6
|
|
I-4- Mélange comporte plusieurs phases
|
7
|
|
I-5- Degré d'avancement d'une réaction
|
7
|
|
I-5-1- Expression de la condition d'équilibre
|
...8
|
|
I-6- Affinité des réactions chimiques
|
.9
|
|
I-6-1- Définition
|
...9
|
|
I-6-2- Expression de la condition d'équilibre
|
...9
|
CHAPITRE II: Calcul de la composition chimique d'un
mélange gazeux
II-1- Introduction 10
II-2- 1ere méthode « annulation des
affinités » .10
II-2-1-Méthode de résolution 11
II-2-2-Calcul de l'affinité chimique 13
II-2-3-Algorithme 14
II-2-4-Déterminationde la chaleur molaire à
pression constante, de l'enthalpie,
|
de l'entropie, et par suite de l'enthalpie libre des produits de
combustion
|
.15
|
|
I-3-2eme Méthode « constante
d'équilibre »
|
...15
|
|
II-3-1-Constante d'équilibre de réactionë*R
|
....17
|
|
II-3-2-Expression logarithmique de la constante
d'équilibre
|
17
|
|
II-3-3- Variation de la constante d'équilibre avec la
température
|
..17
|
|
II-3-4- Méthode de résolution
|
20
|
|
II-3-5-Méthode de newton
|
...22
|
|
II-3-5-1- Principes
|
.22
|
|
II-3-5-2-Algorithme de résolution du système(S)
|
..24
|
|
II-4-Calcul de la température de flamme adiabatique
|
.25
|
|
II-4-1-Hypothèses générales
|
25
|
|
II-4-2- Principe de calcul de la température adiabatique
|
..26
|
|
CHAPITRE III: Résultats et
interprétations
|
|
|
III-1- Influence de la richesse
|
29
|
III-1-1- La variation de la composition des produits de
combustion en fonction de la richesse 29
III-1-2- La variation de la
température de flamme adiabatique en fonction de la
richesse 34
Conclusion 35
Listes des symboles.
Listes des symboles :
|
Symboles
|
Nomenclatures
|
Unité
|
|
U
|
Energie interne
|
J
|
|
S
|
Entropie
|
J/K°
|
|
H
|
Enthalpie
|
J
|
|
G
|
Enthalpie libre
|
J
|
|
F
|
Énergie libre
|
J
|
|
ii
|
Potentiel chimique
|
J/ mole
|
|
y
|
Coefficient stoechiométrique
|
mole
|
|
xi
|
Fraction molaire
|
/
|
|
Aff
|
Affinité des réactions chimiques
|
J/ mole
|
|
d)r
|
Degré d'avancement
|
mole
|
|
K
|
Constante thermodynamique d'équilibre
|
/
|
|
Cp f
|
Chaleur massique isobare des gaz frais
|
J / K° Kg
|
|
R
|
Constante des gaz parfaits
|
J/ K° mole
|
|
Mf
|
Masse molaire des gaz frais
|
Kg / mole
|
|
Hf
|
Enthalpie de formation
|
J/ mole Kg
|
|
P
|
Pression
|
Atm
|
|
Hm
|
Enthalpie de mélange
|
J
|
|
G ~
|
Grandeur molaire
|
/ mole.
|
|
ù
|
Nombre de mole de N2
|
mole
|
Introduction
Introduction
INTRODUCTION
Il y a des millénaires, l'homme acquérait
«l'art du feu ». Ce n'est qu'au cours de l'essor industriel du
19éne siècle que la combustion vive commençait
à être valablement utilisée dans des machines pour
répondre aux besoins énergétiques.
De notre jour, la combustion occupe une place
prépondérante pour satisfaire aux besoins énormes de notre
monde économique, dans des domaines aussi divers que:
La production d'énergie électrique;
Le chauffage des locaux;
L'élaboration des matériaux de combustion;
La sidérurgie;
Les transports terrestres, aériens, cosmiques;
La production des hydrocarbures à partir du
pétrole brut dans les raffineries etc.
L'importance de notre étude portera sur
l'élaboration d'un programme pour le calcul de certains
paramètres de la combustion isobare et adiabatique des hydrocarbures
saturés.
Dans le premier chapitre, on fera une étude sur le
potentiel chimique. Ce paramètre est essentiel dans l'étude des
équilibres chimiques des mélanges réactifs.
Le second chapitre sera consacré au calcul de la
composition chimique d'un mélange gazeux, dans ce chapitre, nous
exposeront les deux méthodes de calcul des concentrations des
espèces chimiques dans la zone de combustion.
La première méthode est basée sur
l'annulation des affinités chimiques et la seconde sur le calcul des
constantes d'équilibres des réactions chimiques.
Les différents paramètres entrant en jeu dans les
réactions chimiques et les relations qui les relient, seront
présentés dans chaque méthode.
L'analyse et l'interprétation des résultats feront
l'objet de notre dernier chapitre.
En fin, on donnera une conclusion générale sur
notre étude.
Chapitre I
Potentiel chimique
I-1- Notion de potentiel chimique
:[1J
Soit un système à n composants en une phase, par
exemple un mélange de gaz ou une solution liquide ou solide.
Si l'on introduit ou si l'on enlève une petite
quantité de l'un des composants, l'énergie interne de la phase va
varier.
Considérons alors l'expression de la
différentielle dU de l'énergie interne obtenue par application
simultanée des deux principes à un système fermé,
soit:
dU = TdS - PdV (I-1)
Si m1,m2,... ,mi,... ,mn
représentent les masses respectives des différents composants
présents dans la phase, il faut écrire:
dU = TdS-PdV+a U dm ... U
? ? a dm ... U
i + ? a
1dmn
a m 1 a m i a m n
Ou plus simplement:
dU = TdS - PdV +i
?a a (I-2)
U idm
i i
m
|
Les quantités telles que? ? ij
a U ?lu
ami s,v,mj
composants dans le système.
|
sont les potentiels chimiques des
|
Le potentiel chimique interne, défini par
«GIBBS », est une mesure de l'influence de
l'énergie interne de la phase considérée, sur l'influence
de la masse du constituant (i).
Si l'on envisage maintenant l'enthalpie, l'énergie
libre et l'enthalpie libre de la phase considérée et comme on a
par définition respectivement:
H = U+ PV
F = U-TS
G = H- TS
Leurs différentielles sont:
dH = dU+ d(PV)
D'où dH = dU+PdV+VdP (I-3)
dF = dU- d(TS)
D'où dF= dU- TdS- SdT ....(I-4)
dG= dU+ PdV+ VdP- d(TS)
D'où: dG= dU+ PdV+ VdP- TdS- SdT (I-5)
En substituant, la nouvelle expression de dU:
dU= TdS- PdV+ ?
i
Il vient:
dH= TdS+ VdP+ ?
i
dF= -SdT- PdV+ ?
i
dG= -SdT+ VdP+ ?
i
Et par conséquent:
tidmi ..(I-6)
ti dmi ..(I-7)
ti dmi (I-8)
ti dmi ..(I-9)
v,mj
,p, mj
?
v,mj
? aU ?
ti
? ?
? ami s ,
)
? a H ?
? ?
? a m i )s
? a F ?
? ? ?
? ami t ,
)
? aG ?
? ?
mj
? a m i t ,p ,
)
Il est souvent commode de définir la composition d'un
mélange par le nombre de moles ni des composants. Les
dérivées partielles à introduire sont alors :
? a U ? a H ? ? a F ? ? a G
?
? ? ? ? ? ? ? ?
? ? ?
? a n n n n
i s , v,nj
,p , nj
) a
i s ,p ,nj
) a i t , v,nj
) a i ) t
On les désigne sous le nom de potentiels chimiques
molaires ? ~ i, ou
|
~
encore de quantités molaires partielles (Ui
|
~
, H i
|
~
,G i
|
, Ui
~). Elles sont liées
|
aux potentiels chimiques définis
précédemment par la relation: ? ~ i =Mi ? i
Ou Mi est la masse molaire du composant i.
I-2- Potentiel chimique d'un gaz parfait:
[2]
Soit un système homogène constitué par un
mélange de gaz. On peut caractériser la composition du
mélange par les nombres de moles n1,... ,ni.,...
,nn des différents composants. Dans ces conditions on
utilisera, pour mesurer l'influence d'une variation de la quantité d'un
composant présent dans le mélange sur l'énergie interne,
l'enthalpie, l'énergie libre ou l'enthalpie libre de celui-ci, les
potentiels molaires ? ~ i et l'on écrira:
|
dU=TdS-PdV+ ?
i
dH = TdS+ VdP+ ?
i
dF = -PdV- SdT+ ?
i
dG = VdP- SdT+ ?
i
|
? ~ i dni (I-10)
? ~ i dni .(I-11)
?~ i dni ..(I-12)
?~ i dni (I-13)
|
Alors que les fonctions (U,H,F,G) dépendent des nombres
de moles des différents composants, les potentiels chimiques ne sont
fonction que des rapports de ces nombres entre eux, autrement dit que de la
composition et sont indépendants des constituants du mélange.
Considérons d'abord un gaz parfait à l'équilibre ; la
formule de Massieu:
??? a
G ?
a = V (I-14)
P )? T
donne pour une évolution isotherme du gaz entre un
état de référence de pression P0 et un état de
pression P, en désignant par g l'enthalpie libre d'une mole de gaz:
P
g~ -- J
g~ 0 VdP
P0
Soit, compte tenu de l'équation d'état: PV=RT
~ -- P

~
g dp
g RT
0 P
RTln P
P0 0
p
Ou:
~ + .(I-15)
~
g g RT ln P
0
P 0
Où,g0
~ fonction de la température seulement,
représente l'enthalpie libre d'une mole de gaz dans l'état de
référence, sous la pression P0 et a la température T.
Si l'état de référence choisi est un
état de pression unité : P0=1 (atm) on peut écrire :
~ = g0
g ~ +RT ln Pi (I-16)
L'enthalpie libre, comme l'énergie interne ou
l'énergie libre, est une grandeur extensive, l'enthalpie libre d'un
mélange de gaz parfaits est la somme des enthalpies libres des
composants, chacun d'eux étant toutefois pris sous sa pression
partielle, soit:
G n (g RT ln (I-17)
P
~ 0 i )
i i+
i P 0
La différentielle de cette fonction G calculée
à pression totale et température constantes, a pour
expression:
dG (g RT ln
~ 0 i
~~ ~~~
P i
)dn n RT dP (I-18)
ii i
P
i 0 i i
P
D'après l'équation d'état: PiV n
i RT ,V étant le volume total, on a:
dP i
dP
~ ~ ~
n RT
i VdP V
i
i
P
i i
i i
|
Puisque la pression totale ~
P
i
|
Pi a été supposée constante.
|
P
RT ln i )dn i
P 0
L'expression (I-18) s'écrit donc
dG (g
= -
0i
i
Soit en comparant avec l'expression générale:
|
d= ?
G ~
i
|
J1~ i dni .(I-19)
|
J1 ~ i =0
~ + RT ln (Pi/P0)
gi
que l'on peut écrire aussi :
J1 + RT ln (Pi/P0) ou encore:
~ 0
i
~
J1 i =
~
J1 ~ i = 0
J1+RTlnPi (I-20)
i
J1 , Désignant alors le potentiel chimique d'une mole de
gaz Gi à l'état
~ 0
i
pur sous la pression d'une atmosphère et à la
température actuelle T, identique à l'enthalpie libre molaire et
à cette température seulement.
I-3- Potentiel chimique d'un
mélange:
Soit un système constitué par un mélange
de gaz; on a vu que le potentiel chimique molaire de l'un des constituants du
mélange, dans l'hypothèse où ceux-ci sont assimilables
à des gaz parfaits, est relié à sa pression partielle Pi =
Xi P par la relation:
J1 (T)+ RT ln(Pi/P0)
~ 0
i
~
J1 i=
Ou Xi=ni/nT (fraction molaire), avec nT le nombre
total des moles. J1 (ou 0
~ 0 ~ ) désigne le potentiel chimique d'une mole du
gaz(i)à l'état pur
gi
i
sous la pression de référence Pi0 (ou P0
) pression prise le plus souvent égale à une
atmosphère;0
J1 est une fonction de la température T ~
i
seulement.
En remplaçant Pi par Xi P, il vient:
~i= 0
P (T)+ RT ln(P/P0)+RT ln Xi (I-2 1)
P
~
i
I-4- Mélange comporte plusieurs
phases:
La variation de l'enthalpie libre G de la phase j ; dans la
quelle le nombre du constituant i est ni j et son potentiel chimique
ìij, pour des transformations élémentaires
isobares et isothermes est:
dG
~ dGj
j
Soit:
dG= ij
.. ijdn .(I-22)
ij
Il y a égalité du potentiel chimique de i dans
chaque phase à l'équilibre si le système est globalement
fermé dG=0, c'est-à-dire :
~P~ ij (I-23)
ij
dnij 0
I-5- Degré d'avancement d'une
réaction:
Considérons une phase déterminée d'un
système homogène et supposons qu'une réaction chimique
soit susceptible de s'y produire.
Au cours d'une telle réaction certains corps
disparaissent, d'autre apparaissent et les variations des nombres de moles des
corps sont liées par l'équation stoechiométrique de la
réaction.
Par exemple pour la réaction d'équation
VAA+VBB ? VCC+VDD
Le degré d'avancement élémentaire de la
réaction est:
r dn dn dn dn dn
A B C
d O D i (I-24)
D D D D D
A B C D i
Où les íi sont les coefficients
stoechiométriques négatifs pour les corps réagissants,
positifs pour les produits de la réaction.
Par exemple Soit la réaction d'équilibre :
CO2 ? CO + 1/2O2
à t=t1 XCO2 XCO XO2
à t=t2 XCO2 - î XCO+ î XO2+1/2
î
|
donc: ?
|
XCO2 =XCO2 (t2)- XCO2 (t1)
|
?XCO2 =XCO2 - î -XCO2 ?XCO2 =-î
Alors : AX CO 2 ?
U
de même:
? XO2= î
? XO2= 1/2 î
-î/-1= î
AXCO î /1= î
?
U co
? ? ?
? X (1 / 2)
O2 =
UO 2 1/2
I-5-1- Expression de la condition
d'équilibre:
D'après l'équation (I-24) et par
conséquent
r
dn i =?v d X
r r
i
i
C'est-à-dire, la variation du nombre de moles du
constituant i dans la réaction r est la somme des produits des
coefficients stoechiométriques par le degré d'avancement de la
réaction r.
De l'équation (I-13) on trouve:
? ?? ?
~ r
dG VdP SdT
= _ + r ?? ? v ? r
?? i i d .(I-26)
i
Nous savons qu'un système fermé et en
équilibre thermodynamique interne s'il est en équilibre
thermique, mécanique et chimique, donc:
Finalement une nouvelle expression de la condition
d'équilibre (I-26):
|
G= ?r
|
(:JI ~
i
|
i
|
v i )dër. (I-27)
r
|
I-6- Affinité des réactions
chimiques:
I-6-1- Définition:
Par définition, la quantité [-?? ~ r
v i ] est appelée affinité chimique
i
i
(introduite en 1922 de DONDER [5]) de
la réaction chimique r.
|
Aff=-?JI ~
i
|
v i ..(I-28)
r
i
|
II-6-2 Expression de la condition
d'équilibre:
D'où la nouvelle expression de la condition
d'équilibre (I-27):
(dG)p ,t=-? Affd)r (II-29).
Chapitre II
Calcul de la composition
chimique d'un mélange
gazeux
II-1- Introduction:
Deux méthodes illustrent le calcul de la composition.
La première est fondée sur l'annulation des
affinités des réactions chimiques considérées au
sein des produits de combustion [4], quant à la deuxième, elle
est basée sur le calcul des constantes d'équilibre.
Considérons le cas d'un hydrocarbure de formule
CnHm dont la combustion est effectuée dans l'air sous
pression constante; les produits de la combustion comprennent essentiellement
du:
(CO2, H2O, O2, N2 ,CO, H2 , OH, NO, H, O, NO2, N).
A haute température, le mélange sera le
siège des réactions d'équilibre: R[0]= 2CO2 ?
2CO+O2
R[1]= 2H2O ? 2OH+H2
R[2]= 2H2O ? 2H2+O2
R[3]=H2? 2H R[4]= O2? 2O
R[5]=N2+ O2 ? 2NO
R[6]=N2? 2N
R[7]= NO+ 1/2 O2 ? NO2
II-2- 1ére méthode -
annulation des affinités:
Pour un mélange constitué de N composants et M
espèces atomique (C,H,N,O, on a ici M= 4); il faut compléter les
M équations de conservation des espèces atomiques par (N-M)
réactions d'équilibre dont l'affinité Affj peut
s'écrire :
Affj =-? v ijt i (j= 1,... ,N-M) (II-1)
Où v ij représente le coefficient
stoechiométrique du ième composant dans la
jème réaction et ti le potentiel chimique de ce
composant.
ti est définit par:
|
ti
|
?
|
G (T
0
|
)
+
|
ln
|
? P ?
? ?
? P 0 ?
|
+
|
ln
|
? n ?
i
? ?
1nb ?
|
(II-2)
|
|
RT
|
RT
|
Où G0 (T) est l'enthalpie libre à
température T.
G 0 (T)
i =
RT
H 0 (T)S0 (T)
i - i
RT R
D'où:
(II-3)
avec: ni : le nombre de moles du composant i.
nb : le nombre total de moles du mélange. P0 : la pression
de référence égale à 1 atm.
II-2-1- Méthode de résolution
:
Soit [M] la matrice des espèces atomiques et [D] celle
de la composition initiale d'un mélange quelconque d'hydrocarbure et
d'air de richesse Ri.
On a l'équation suivant:
Ri CncHnh+Zst (O2+ù N2)
ù est le nombre de mole de N2.
Avec : Zst = nc +nh/4 (coefficient
stoechiométrie).
|
C
|
nR
c i
|
|
Donc: [M] =
|
H
O
|
et [D] =
|
n R
h i
2Z st
|
|
N
|
2 Z
w st
|
Dans le cas d'un mélange pauvre, les 4 premiers ( CO2,
H2O, O2, N2); dits de base sont affectés de l'indice O et les autres
composants non de base sont affectés de l'indice 1.
Ces composants, représentés par des matrices
[R0] et [R1], s'expriment respectivement en fonction des espèces
atomiques à l'aide des matrices [A0] et [A1], et ont des nombres de
moles [Xo] et [X1] et des potentiels chimiques [Go] et
[G1].
On a:

1
?
?
?
?
J
2
1
?
?
?
?
J
H
CO
O2
N2
[Ro]=
H O
2
= [R0]=[A0][M] éléments de base
1
?
?
?
?
J
C
O
N
[ ]
R 1
? CO1
? ?
H
? 2 ?
? OH ?
? ?
NO
? ? ? ?
? NO ?
2
? ?
? H ?
? O ?
?? ??
? N J
|
?
?
?
?
?
?
|
? 0110
? 0011
? 0021
? 0100
? 0010
?? 0001
|
|
|
?
?
? = [R1]=[A1][M]éléments non de base
?
?
?
1
?
?
?
?
?
?
?
?
?
?? J
C
H
N
O
1
?
?
?
?
J
Dans le cas d'un mélange riche, on permute O2 avec CO
entre [RO] et [R1] ; Soit [Xn] la matrice des coefficients
stoechiométriques qui relie la masse molaire des éléments
non de base à celle des composants de base.
[R1]=[Xn][R0] (II-4)
avec:
[Xn]=[A1][A0]-1 (II-5)
[ ]
Xn
1 ?
?
?
?
?
?
?
?
?
?? J
2
1 0 1 2 0
--
0 1 1 2 0
--
40
001
?
0 0 1 12
01
21
21
0 12 1 4 0
--
0
00
00
12 0
12
La conservation du nombre de moles s'exprime:
t[A0][X0]+t[A1][X1]=[D] (II-6).
que nous
écrivons:
[X0]= t[A0]-1([D]-t[A1] [X1])
(II-7)
D 'ou: [X0]= t[A0]-1
[D]-t[Xn] [X1] .(II-8)
II-2-2- Calcul de
l'affinité chimique:
Soient [G0] la matrice des potentiels chimiques des
éléments de base et [G1] celle des éléments non de
base.

? J-tCO21
?J-tH2O ?? ? [G1
? J-tO2 ?? ? J-tN2?J
[G0
J-t
J-t
CO
H2
J-t
OH
J-t
NO
1=
NO2
J-t
H
J-t
O
J-t
1 ?
?
?
?
?
?
? J
N
J-t
donnent pour l'affinité des réactions la matrice
[Aff]: [Aff]=[Xn][G0]-[G1] (II-9)
Où l'indice
supérieur t désigne la transposition de la matrice.
III-2-3- Algorithme:
Pour déterminer la composition, on suit l'algorithme
suivant:
1- on initialise les matrices: [A0], [A1], [Xn]
2- on se donne les valeur de nc, nh et Ri ce qui
permet le calcul de [D].
3- on calcule successivement: [A0]-1,
t[A0]-1 , [Xn],t[A1].
4- Si le mélange est riche (Ri>1),
[A0]-1 et [Xn] seront recalculées, à partir
de leurs valeurs initiales données et en tenant compte de la permutation
de O2 avec CO.
G 0 (T) P
5- calcul de [A0]-1 et i +ln
RT P0
6- on initialise [X1] (X1(i)=0.001, i=1.....8)
7- on commence alors le cycle itératif:
a- on calcule [X0] à partir de l'équation (II-8)
avec la condition Suivante: Si X0(i) < 0 Alors X0(i) = 1 0-8
b- on calcule nb le nombre de moles total,[G0] et [G1]
c- on déduit: [Aff]= [Xn]-[G1]
d- on effectue le test de convergence:
Si [Aff] <0.01
Alors la composition est donnée par [X1] et [X0]
Si non, on recommence une nouvelle itération
e- On calcule les nouveaux nombres de moles [X1] à l'aide
de la loi empirique:
[ ] [ ] [ ] ?
' ?
x x 1 exp
1 .(II-10)
p ? 1 = ?_
p ff i
?
i i ? ? ?
Où p désigne le numéro de
l'itération.
a: est un paramètre empirique que l'on
doit diminuer au cours du calcul pour accélérer la
convergence.
a varie de(2~100) [3]
II-2-4- Détermination de la chaleur molaire
à pression constante, de l'enthalpie, de l'entropie et par suite de
l'enthalpie libre des produits de combustion:
Pour des températures comprises entre 1000 et 5000
K°, les polynômes de GORDON et
MAC BRIDE [3], permettant le calcul de ces grandeurs
sans dimension pour chaque composant.
Cp 0 (T)
i =a1+a2T+a3T2+ a4T3+
a5T4
R
H0(T)
i = a1+ T
a 2 ? 3 2 ? 4 3 ? 5 4 ? 6
a a a a
T T T T
RT 2 3 4 5
S0 (T)
i =a1 ln T+ a2T +7
a + + +
3 2 4 3 5 T 4 a
a a
T T
R 2 3 4
Par suite:
|
G 0 (T)
i =
|
H 0 (T)
i
|
-
|
S0 (T)
i
|
|
|
|
RT
|
RT
|
|
R
|
Les valeurs des coefficients ai, des principaux produits de
combustion d'hydrocarbures sont données dans l'annexe (A).
II-3- 2ème méthode -
Constante d'équilibre: [4]
Soit la réaction d'équilibre R sous la forme
générale suivante:
R: í1A1+ + ínAn ? w1B1+ + wmBm
Avec : (íi, i=1.... n,wi= 1 m) sont les coefficients
stoechiométriques ;
(Ai ,i=1 n ; Bi ,i=1 m) constituants chimiques.
On définit la constante d'équilibre K:
m
?
wi
P Bi
K (II-11)
1
?
? P Di
Ai
Avec : ( PBi , PAi ) les pressions
partielles des constituants Bi, Ai
respectivement.
L'équation (II-11) devient:
m
w
wim
n
wi
Bi
rI
1
i ?
? V )?
?
( n RT ?
? ?
?
? V )
m Bi ( RT ? 1
K ?
1
D
n ( n RT ? rI ?
Ai
'
1 ? V )
n
? D
?? V )?
i
( RT ? 1
i n
i
D
n
Ai
rI
1
On à : PTV = nT RT
P Ai
1
avec : = ?
1
P T P Bi + ?
et ? ?
n T n Bi + ?
n
1
Ai
1
et donc: ?
( RT (
P ?
? )? ? ?
V ? nT )
|
m n ( m
I ? ??
n wi ?
wi i ? ?
? ?? ? Bi ?
K
? ?
P 1 1 1
n n
T n
?? 1I i
Ai
? 1 )
|
(II-12)
|
Exemple :
Soit la réaction d'équilibre :
3 ?
0. 5
CO O2
?? )? ?? ??
n n
?
( P ? ( n n ?
? CO2 )
CO2 ? CO+ 2 1 O2.
K ?
1
n
( P ? ( ?
2 CO O2
n
?? )? ?? ??
n CO
n 2 )
avec: n = nCO2 + nO2 + nCO
II-3-1- Constante d'équilibre de
réaction ë*R avec ë R La
réaction ë*R s'écrit sous la forme:
ë*R:ë í1A1+ + ë
ínA n ? ë ù1B1+ + ë wmBm
D'après l'équation (II-12) :
m
m n ? wi
wi ? r' n ?
i
= ??
( ? ? ?
? - ?? Bi
P
K ? 1 1 1
n n
T n
?? i
?
r' Ai 1 D'où:
m n
E ?V
wi -
1 1
??
?
?
P
=
K ?
n
T
?
?
i
m
r'
1
i
n
n
r'
1
Ai
V
??
wi
Bi
n
Donc:..
K ? = K (II-13)
II-3-2- Expression logarithmique de la constante
d'équilibre: D'après l'équation (II-12) :
m( '\ m
= ?? V - ?
n n
P
ln K w ln
?
?? ) ? I I - ? - ?V ...(II-14)
i i w ln(n ) ln(n )
1 i Bi 1 i Ai
1 1 1 n T )
II-3-3- Variation de la constante d'équilibre
avec la température : [1] La constante K est
définie par:
Ses variations avec la température s'étudient
grâce à la formule de Van't Hoff obtenue en appliquant la formule
de Gibbs Helmholtz à l'équation stoechiométrique de la
réaction, chacune des espèces étant prise dans
l'état de référence.
( A
d( G 0 ) 0 0
? ( A ? A
G H "
La relation ? ? ? ? ?
s'écrit aussi :
? dT ? ? T ?
( A (II-16)
G 0 0
? ( A H ?
?
d 2
? = _ ? ? dT
? T ? ? T ?
D'où en tenant compte de : ?G0= -RT lnK
( d(ln K) ?
?? ??
dT
0
? ?
(A H ?
? RT 2 ?
(II-17)
On en déduit aisément l'influence d'une
augmentation de température sur l'équilibre :
a- AH >0, la réaction est
endothermique et la constante d'équilibre
0
augmente avec la température ; la réaction
progresse de gauche à droite lorsqu'on augmente la
température.
b- 0 AH <0, la réaction est
exothermique. La réaction régresse de
droite à gauche pour une élévation de
température.
c- AH =0, la constante d'équilibre K est
indépendante de la
0
température. La réaction elle-même est
indifférente à une variation de température.
On notera que dans le cas d'une réaction entre gaz
parfaits, AH ne dépend que de la température.
où: AG0 = AH0 -
TAS0 .(II-18)
T
AH , est la chaleur de réaction dans les
conditions correspondant à l'état
0
de référence; 0
ASest la différence des entropies des produits de la
réaction et des corps initiaux, avec les nombres de moles figurant dans
l'équation stoechiométrique, chacun d'eux étant pris dans
l'état de référence, soit à l'état pur, et
sous la pression d'une atmosphère, en général, pour les
gaz, la température étant la température actuelle
T.
La constante d'équilibre résulte alors de
l'équation:
= -- .(II-19)
H 0 A 0
A S
ln K .
RT R
En introduisant la température T0 pour
laquelle sont données les enthalpies et les entropies dans les tables,
il vient, d'après la formule de Kirchhoff:

A ? A +
H 0T H (Cp) dT
0 n Jv i Xi
T0
T0 1
De même, pour la variation d'entropie :
T ( \î ?
S S
0 0 i Xi
(Cp)
A = A + n J ?
I dT
T T0 1 T0 ? T ?
on en déduit:
0 0
A H A S
T0 T0
+
RT R
T n 1 T n ? ? (Cp)
(Cp) dT ?
i Xi
J J
v +
i Xi
RT T0 1 R T0 1 ? T
lnK
?
dT
?
?
1
(II-20)
Les deux derniers termes sont de signes contraires, et se
compensent plus ou moins. C'est pourquoi, en première approximation, on
prend souvent :
RT
R
lnK =
A H
T0 A
0
?
S 0
T0
II-3-4- Méthode de
résolution:
Les chaleurs absorbées par les réaction R[i] (i= 0
7), obtenues
à partir des chaleurs de formation.
Les réactions R[i] ne sont pas indépendantes et
influent les unes sur les autres. C'est ce qui rend relativement difficile la
détermination de la composition du mélange de gaz
brûlés dans des conditions données de température et
de pression.
Désignons les nombres de moles dans le mélange en
équilibre par:
(
n , n , n , n , n , n , n , n , n , n , n , n . )
CO2 H2O O2
N2 CO H2 OH NO H O NO2 N La détermination de ces 12 inconnues s'effectue
au moyen des 12
équations obtenues en exprimant, d'une part
l'équilibre pour les réactions R[i], et d'autre part, les bilans
du carbone, de l'hydrogène, l'oxygène et d'Azote.
Pour le carbone, on doit avoir:
nCO2+nCO= nc*Ri
pour l'hydrogène:
nH2O+nOH+2nH2+nH=nh Ri
Pour l'oxygène:
2nCO2+nH2O+2nO2+nCO+nOH+2nO+nO+2nNO2=2Zst
Pour l' azote:
2nN2+nN0+nNO2+nN=ù .Zst
le nombre total de moles est:
N=nco2+nH2o+no2+nN2+nco+nH2+noH+nNo+nH+no+nNo2+nN
Désignons par K[i] (i=0,7), les constantes
d'équilibre des réactions R[i] (i=0... 7), et par P la pression
totale dans l'hypothèse de gaz parfaits, généralement
justifiée.
D'après l'équation (II-12) :
L
KI-0b P N n no2 => lnK[0]= ln P
+2ln(nco)+ln(no2)-2ln(nco2).
-- nL2 N
K1-i N = P n2OHnH2
lnK»ln P +2ln(nOH)+ln(H2)-2ln(nH2O).
-I nî,2O N
|
K?2?= P n?-12nH2 N
lnK[2bln P +2ln(nH2)+ln(nO2)-2ln(nH2O)
n2N H2O
|
.
|
KI-3'1= P nîï lnK[3ln P
+2ln(nH)-ln(nH2)
' N nH2 N
KI-4'1 = P n° lnK[4]ln
P +2ln(nO)-ln(nO2)
' N nO2 N
145]=(P 2 nNO
lnK[52ln(nNO)-ln(nN2)-ln(nO2)
N nN2nO2
K[6]= P n?"' lnK[6ln P
+2ln(nN)-ln(nN2)
N
' N nN2
,_1
KM = V ) 3 nNO2
lnK[7-- 1 ln P
+ln(nNO2)-ln(nNO)-- 1 ln(nO2) N nNOnm 2 N 2
On pose les symboles suivants:
1°- f(i):est le vecteur de la composition X2[i], (i =
0...11)
2°-X2:(nCO2 ,nH2O,nO2
,nN2,nCO,nH2,nOH,nNO,nH,nO,nNO2,nN.)
Alors le système d'équation (S) obtenue: ( f(i) i=
0...11) est :
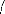
f(0)= X2 (0)+ X2(4)-nc Ri =0
f(1)= X2 (1)+2 X2 (5)+ X2 (6)- X2 (8) -nhRi =0
f(2)=2X2(0)+X2( 1 )+2X2(2)+X2(4)+X2(6)+2X2(7)+X2(9)+ 2X2( 1
0)-2Zst=0
f(3)=2 X2 (3)+ X2 (7)+ X2 (10)+ X2 (11)- ù Zst=0
f (4)=ln N P +2 ln X2 (4)+ ln X2 (2)-2 ln X2 (0)- ln K[0] =0
f(5)= ln N P +2 ln X2 (6)+ln X2 (5)-2 ln X2 (1)- ln K[1] =0 f(6)= ln N P +2 ln
X2 (5)+ ln X2 (2)-2 ln X2 (1)- ln K[2] =0 f(7)= ln N P +2 ln X2 (8)- ln X2 (5)-
ln K[3] =0
(S)
f(8)= ln N P +2 lnX2 (9)- lnX2 (2)- ln K[4] =0
f(9)=2 ln X2 (7)- ln X2 (3)- ln X2 (2)- ln K[5] =0 f(10)= ln N P
+2 ln X2 (11)- ln X2 (3)- ln K[6] =0

f (11)=- 2 1ln N P +lnX2(10)-lnX2(7)-
2 1lnX2(2)-ln K[7] =0
La résolution du système d'équations
précédentes n'est possible que pour une méthode
d'approximations successives; en effet la valeur des constantes
d'équilibre K dépend de la température, on utilise la
méthode de Newton pour résoudre ce système
II-3-5- Méthode de Newton : [6] II-3-5-1-
Principes:
Notons x*= [x*1,x*2, x*n]t le vecteur
solution du système
non linéaire :
fi(x) =0 (i= 1,...,n.) .(II-21)
Si chaque fonction fi est continue et continûment
différentiable, alors, par développement en série de
Taylor dans le voisinage d'un estimé xK proche de x* on
obtient:
fi( x*) = fi [ xK+ (x*-xK)]
fi(x*)=fi(xK)+
0 f (x )
K
n ? i ? n n
? J -- + ??
1
? (x x )
K
*j (x
j
0 x 2
j 1
= = = =
j
? ? j 1 r 1
x x K
2
+.... 0......(II-22)
= x K
? 0 f (x)
i ?
0 0
x x
j r
? ? x
) ? J
Pour i=1,....,n.
Si xK est un estimé proche de x*, les
éléments ( x*i- xj K)2 sont
négligeables, ainsi que les termes de degré supérieur.
Le système (II-22) s'écrit donc:
? i ?J -- =--
n ? 0 f (x) K
? (x x ) f (x )
K K
j j i
j 1 j
x
= ?? .(II-23)
0 x x K
=
Définition la matrice EK des
dérivées premières telles que : ? 0 f (x)
i ?
E K ij x
= (II-24)
?? 0 ?J
i x x K
=
Le vecteur d'erreur ?xK par:
A x j = x -- x (II-25)
K K
*j j
Puis le vecteur FK par
Fi K=-fi(xK) (II-2 6)
Alors la Relation matricielle (III-23) s'écrit:
EK. ?xK = FK (II-2 7)
?x' =F' 1
E ? (II-28)
(')
La méthode de newton présentée ci- dessus
génère souvent une correction
?x' telle que l'approximation de
(II-22),par (II-23) n'est pas valable dans
[x', x' + ?x' ].
Toutefois, on se satisfait souvent de trouver une correction
?x' telle que:
|
f(x('+1)) < (f(x)') (
|
est une norme quelconque)
|
C'est pourquoi on choisit souvent de se déplacer dans la
direction ?x' de Newton d'un pas:
(x('+1)) = (x)') + ë ' ?x'
.(II-29)
ouë' < 1 est choisi tel que:
f(x('+1)) < f(x)'
II-3-5-2- Algorithme de résolution du
système (s):
Pour le calcul de la composition on adopte l'algorithme
suivant:
1. On se donne la matrice Ei j (x),(i=1... .1
1,j=1.....11 )
2. On se donne le vecteur des constantes d'équilibre :
K[i](en fonction de la température)
3. On se donne le vecteur Fi(x),( i = 0.....11 )
4. On initialise le vecteur de la composition estimée X
2[i] ,(i = 0... 1 1),proche de la solution
5. On commence le cycle itératif.
6. On calcule la matrice E(X2) à partir de
l'équation (II-24).
7. On calcule le vecteur K(T) à partir de
l'équation (II-14).
8. On calcule le vecteur F(x) à partir du système
(S).
9. On calcule le nouveau vecteur X2[i] à partir de
l'équation (II-28).
Si X2 [i] ~0 on prend X2 [i] =||X2[i] ||, On effectue le test de
Convergence.
> Si Äxk <1 0-2; la valeur de
Äxk est calculée à partir de l'équation
(II-29).
> Si non, on calcule les nouveaux nombres des moles X2
à partir de la loi:
X2K=X2K? 1 +Ax
Et on effectue une nouvelle itération avec X2K
où K désigne le numéro de l'itération.
II-4- Calcul de la température de flamme
adiabatique:
II-4-1- Hypothèses générales :
[3]
Les hypothèses fondamentales sur les quels seront
basés nos calculs sont:
1°- Le mélange de gaz frais est assimilable
à un gaz calorifiquement parfait, c'est-à-dire, si U et H
représentent respectivement l'énergie interne et l'enthalpie, on
à:
PV=nRT
dU=nCvdT
dH=nCpdT
Avec: Cp- Cv= R= 8.32 (j/mole K°)
CP ??? ( Constante des gaz parfait )
1 .4
CV
2°- Les mélanges des réactifs et les
produits de combustion sont assimilables à des gaz parfaits. Cette
hypothèse est valable tant que les pressions ne soient pas très
élevées
.
3°- La combustion est isobare et adiabatique donc les
échanges thermiques ne sont pas pris en considération.
4°- On suppose que la composition T
nfi d'un constituant i du mélange frais à une
température et une pression donnée, est égale à sa
composition nf0i aux conditions de référence (P0=1
atm, T0=298 K°),
nfi = nf0i .(II-30)
T
5°- Les chaleurs spécifiques d'un constituant i du
mélange frais ont été supposées
indépendantes de la température.
Cp fi =Cp .(II-31)
T 0
fi
et par suite on a pour le mélange
? n Cp
T 0
fi fi
Cp (II-32)
T
f n
= i
? T fi
i
6°- L'enthalpie des gaz frais à la température
T est donnée par:
|
H f H Hà
T
T 0
= ? fi +? fi
i i
|
(II-33)
|
H0 fi est l'enthalpie de formation du constituant (i) du
mélange, au conditions de référence;
HàTfi est l'enthalpie sensible à la
température T.
à T 0fi 0fi ( 0)
fi = n Cp T -- T
(II-43)
H
7°- On a tenu compte que de 12 éléments
chimiques
Les enthalpies de formation et la chaleur spécifique des
constituants sont données par les tableaux (voir annexes B et C).
Le calcul détaillé de l'enthalpie des gaz frais est
donné en annexe E. II-4-2-principe du calcul de la
température adiabatique:
Lors d'une combustion isobare et adiabatique l'enthalpie des gaz,
avant et après leur combustion, se conserve.
H H Tb
f = (II-34)
Tf
b
L'enthalpie Tf
Hfest déterminée à partir de Tf et de
l'équation (II-32).
La pression dans la chambre étant connue, on cherche
ensuite la température Tb qui donne la composition et les enthalpies des
composants de produits de combustion, conduisant à
l'égalité des enthalpies des gaz avant et après
combustion.
-Il faut d'abord choisir la méthode de calcul.
-Cette méthode permet pour une température et une
pression donnée des gaz brûlés, de déterminer leur
composition.
-La composition étant évaluée, on peut
alors, en utilisant les polynômes de GORDEN et MAC BRIDE [3], calculer
l'enthalpie de chaque constituant et par suite l'enthalpie totale des produits
de combustion.
-Enfin, on évalue la température Tb des gaz
brûlés, en utilisant la méthode itérative des
sécantes, qui permet dans ce cas une convergence rapide et dont le
principe est le suivant:
-On se donne alors deux températures T1 et T2
arbitraires et à l'aide de la méthode choisie, on
déterminer les compositions et par suites les enthalpies
H et H T2
f correspondantes à T1 et T2.
T 1
b
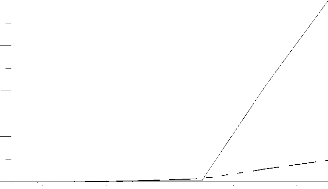
L'intersection de la droite joignant les points A1(T1, T1
H ) et A2 (T2, T2
Hb )
b
avec la droite Tf
Hf= constante: (Fig :II-1) donne une première
température Tb que l'on considère comme étant acceptable
si :
Tb-T < æ Si non, on pose T1=T et T2=Tb et
on recommence. T étant la température correspondante à
l'enthalpie, ( H ou H T 2
b ) dont la valeur
T1
b
algébrique est la plus proche de celle de T 1
Hf .
H
T1 TfT2 T
(Fig :II-1): principe du calcul de la
température adiabatique
Chapitre III
Résultats et interprétations
Dans ce chapitre, on va représenter les différents
résultats obtenus par les deux méthodes, essayer de les
interpréter et de les comparer.
III-1- Influence de la richesse:
III-1-1- La variation de la composition des produits
de combustion en fonction de la richesse:
Les figures [(III-1), (III-8)], représentent la variation
de la composition
des produits de combustion isobare du méthane et du
propane, (CO2, H2O, CO, N2, O2, H2, OH et NO). Deux cas sont à
distinguer:
1er Cas : Ri<1
On constate, qu'en milieu pauvre la quantité de O2 produit
est inversement proportionnelle à la richesse ceci est dû à
la quantité d'air exedante.
L'excès de comburant diminue nettement l'intensité
des réactions d'équilibres (dissociation).
D'autre part, il implique la décroissance du nombre de
moles des gaz CO2 et H2O. Aussi, on note que la proportion négligeable
du CO, OH, NO et le H2, est le résultat de l'activité trop faible
des réactions d'équilibres.

2émeCas
:Ri>1
Dans ce cas, on a un défaut d'air, l'oxygène
disponible étant insuffisant, ce qui explique sa quantité
négligeable. Cette dernière est produite par les réactions
d'équilibres (dissociation), devenues très vives à cause
du manque de comburant. Cette vivacité des réactions
d'équilibres dissocie un nombre important des molécules du (CO2,
H2O), en (CO, H2) ce qui explique la décroissance des premières
et l'augmentation des dernières.
Remarque:
Pour les gaz (NO, NO2, OH, H, O et N), leurs réactions
d'équilibre sont intenses, seulement à des hautes
températures, qu'on ne peut pas les atteindre avec les hydrocarbures
saturés, ce qui indique leur faible quantité et par
conséquent, la quantité d'azote N2 reste pratiquement
constante.

Chapitre III Résultats et
interprétations
3.00
----- CH4 ___ C3H8
0.00
2.00
1.00
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri


Fig III.1: Variation de la composition de CO2 en fonction
de la richesse
4.00
----- CH4
___ C3H8
3.00
2.00

1.00
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.2: Variation de la composition de H2O en fonction
de la richesse
0.25
0.20
0.05
0.00
----- CH4
___ C3H8
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.3: Variation de la composition de CO en fonction
de la richesse
20.00
----- CH4 ___ C3H8
16.00
8.00


4.00
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.4: Variation de la composition de N2 en fonction
de la richesse

1.00
----- CH4 ___ C3H8
0.80
0.00
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.5: Variation de la composition de O2 en fonction
de la richesse
3.00
----- CH4 ___ C3H8

0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.6: Variation de la composition de H2 en fonction
de la richesse
0.12
----- CH4
___ C3H8
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.7: Variation de la composition de OH en fonction
de la richesse

0.16
----- CH4 ___ C3H8
0.12
0.04
0.00
0.08
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.8 Variation de la composition de NO en fonction
de la richesse
|
Ri / ni
|
nCO2
|
nH2O
|
nCO
|
nN2
|
nO2
|
nH2
|
nOH
|
nNO
|
|
0.8
|
0.739
|
1.477
|
0
|
7.463
|
0.318
|
0.054
|
0.093
|
0.112
|
|
0.9
|
0.831
|
1.676
|
0.0001
|
7.492
|
0.173
|
0.08
|
0.066
|
0.062
|
|
1
|
0.996
|
1.887
|
0.0012
|
7.511
|
0.025
|
0.092
|
0.04
|
0.025
|
|
1.1
|
0.082
|
1.791
|
0.0035
|
7.521
|
0.017
|
0.399
|
0.018
|
0.005
|
|
1.2
|
0.066
|
1.623
|
0.0141
|
7.523
|
0.033
|
0.772
|
0.008
|
0.001
|
|
1.3
|
0.049
|
1.445
|
0.0238
|
7.523
|
0.05
|
1.152
|
0.004
|
0.001
|
Tableau III.1 a : La variation de la composition des
produits de combustion
pour le méthane CH4
|
Ri / ni
|
nCO2
|
nH2O
|
nCO
|
nN2
|
nO2
|
nH2
|
nOH
|
nNO
|
|
0.8
|
2.45
|
3.093
|
0
|
18.73
|
0.8077
|
0.045
|
0.106
|
0.144
|
|
0.9
|
2.515
|
3.465
|
0.0001
|
18.738
|
0.446
|
0.059
|
0.1
|
0.136
|
|
1
|
2.998
|
3.881
|
0.0013
|
18.795
|
0.026
|
0.099
|
0.039
|
0.029
|
|
1.1
|
2.535
|
3.422
|
0.001
|
18.805
|
0.064
|
0.962
|
0.031
|
0.008
|
|
1.2
|
2.27
|
2.913
|
0.105
|
18.809
|
0.129
|
1.879
|
0.0129
|
0.0024
|
|
1.3
|
2.198
|
2.394
|
0.2
|
18.815
|
0.201
|
2.802
|
0.005
|
0.0008
|
Tableau III.1 b : La variation de la composition des
produits de combustion pour le Propane C3H8
III-1-2- La variation de la température de
flamme adiabatique en fonction de la richesse:
· a) première
méthode
La figure (III-2- a) représente la variation de la
température de fin de combustion du méthane et du propane en
fonction de la composition initiale des gaz frais.
- On remarque que les courbes présentent un maximum au
voisinage du mélange stoechiométrique, cette constatation se
rencontre chez la plupart des hydrocarbures.
- En milieu pauvre (Ri<1), la décroissance de Tf
s'explique comme nous l'avons vu précédemment, par l'augmentation
de la quantité (nombre de moles) des produits
gazeux au sein desquels va se dissiper l'enthalpie initiale ?H
i.
- En milieu riche (Ri>1), la décroissance de Tf
quand la richesse augmente est due à l'activité importante et
accrue des réactions d'équilibres, dont le caractère
endothermique arrive à l'emporter sur l'échauffement des produits
formés
· b) deuxième
méthode
La comparaison des graphes III.2.a et III.2.b et des tableaux
III.1.a et III.1.b montre que les résultats obtenus par la
méthode des constantes d'équilibres sont très proches de
ceux calculés par la première méthode pour les
mélanges pauvres. L'écart relatif maximal de deux valeurs
correspondantes ne dépasse pas les 7% pour le méthane et reste
inférieur à 4% pour le propane. Par contre, au-delà de la
richesse stoechiométrique, les valeurs obtenues par les deux
méthodes divergent, et ce sont les résultats de la seconde
méthode qui sont incompatibles avec la réalité. Cette
incompatibilité est due peut être à une erreur dans notre
programme. Il faut noter aussi que pour avoir une bonne convergence de la
seconde méthode il faut que les valeurs initiales des racines soient
proches de la solution.
2500.00
2400.00

2300.00
2200.00
2100.00
2000.00
0.60 0.80 1.00 1.20 1.40
Richesse Ri
Fig III.2.a: La variation de la température de
flamme adiabatique (1ère méthode).
3000.00
2800.00
2200.00
2000.00
----- C3H8
___ CH4

0.60 0.80 1.00 1.20 1.40
Richesse Ri
Fig III.2.b: La variation de la température de
flamme adiabatique ( 2ème méthode).
|
Ri
|
Tf (CH4)
|
Tf (C3H8)
|
|
0.7
|
2037.09
|
201 6.12
|
|
0.75
|
2115.39
|
2093.66
|
|
0.8
|
2151.73
|
2119.54
|
|
0.85
|
2260.85
|
2149.34
|
|
0.9
|
2329.17
|
2241.22
|
|
0.95
|
2394.72
|
2407.34
|
|
1
|
2455
|
2470.33
|
|
1.05
|
2515.49
|
2532.07
|
|
1.1
|
2573.63
|
2617
|
|
1.15
|
2629.65
|
2692.76
|
|
1.2
|
2683.63
|
2704.28
|
|
1.25
|
2735.7
|
2757.51
|
|
1.3
|
2785.95
|
2809.05
|
|
Ri
|
Tf(CH4)
|
Tf(C3H8)
|
|
0.7
|
2063.53
|
2063.22
|
|
0.75
|
2080.73
|
21 00.09
|
|
0.8
|
2151.73
|
2192.33
|
|
0.85
|
2193.91
|
2197.18
|
|
0.9
|
2213.42
|
2245.82
|
|
0.95
|
2233.84
|
2271 .72
|
|
1
|
2426.17
|
2430.93
|
|
1.05
|
2420.27
|
2423.46
|
|
1.1
|
2416.5
|
2406.62
|
|
1.15
|
2386.83
|
2373.79
|
|
1.2
|
2359.4
|
2341.04
|
|
1.25
|
2326.9
|
2305.73
|
|
1.3
|
2063.34
|
2272.16
|
Tableau (III.1 .b) la variation de la Température Tableau
(III.1 .a) la variation de la Température
de flamme adiabatique de flamme adiabatique
deuxième méthode première méthode
Conclusion
Conclusion
CONCLUSION
Notre étude est une initiation aux calculs par ordinateur
des paramètres d'un phénomène physico-chimique très
complexe qui est la combustion.
Dans le temps qui nous a été alloué, on n'a
pas pu tenir compte de tous les phénomènes influents sur le
déroulement de la combustion, d'ou l'utilisation de certaines
hypothèses simplificatrices pour nous faciliter la tâche.
Les résultats obtenus restent des valeurs
approchées.la première
méthode donne des résultats quantitatifs conformes à la
réalité quelque soit la richesse du mélange.
Pour la seconde méthode si les valeurs obtenues pour les
mélanges pauvres sont valables dans l'ensemble, celles des
mélanges riches sont en contradiction avec la réalité.
Nous pensons qu'il y a une erreur qu'on n'a pas pu déceler à
temps pour palier à cet inconvénient.
Notre programme peut calculer à la demande en plus de la
température de flamme et de la composition, d'autres paramètres
tel que: les chaleurs spécifiques, l'enthalpie, l'entropie et
l'enthalpie libre.
En fin dans cette étude nous avons amélioré
nos connaissances dans le domaine de la combustion et appris à manipuler
le logiciel de la
programmation avancé qui est le «DELPHI».
Annexes
Annexe A-1: [3]
|
CO2
|
H2O
|
N2
|
O2
|
|
Hf(298)
So(298)
|
-94.054
+51.070
|
-57.798
+45.106
|
+0.000
+45.770
|
+0.000
+49.000
|
|
a1
|
+4.460041E+00
|
+2.7167633E+00
|
+2.8963194E+00
|
+3.6219535E+00
|
|
a 2
|
+3.0981719E-03
|
+2.9451374E-03
|
+1.5154866E-03
|
+7.3618264E-04
|
|
a 3
|
-1.239257 1E-06
|
-8.0224374E-07
|
-5.7235277E-07
|
-1 .965222E-07
|
|
a 4
|
+2.2741325E-10
|
+1.022666E-10
|
+9.907393E-11
|
+3.620155E-11
|
|
a5
|
-1.5525954E-14
|
-4.8472146E-15
|
-6.5223555E-15
|
-2.8945627E+15
|
|
a6
|
-4.8961442E+04
|
-2.9905826E+04
|
-9.0586184E+02
|
1.2019825E+03
|
|
a7
|
-9.8635982E-01
|
+6.6305671E+00
|
+6.1615148E+00
|
+3.6150960E+00
|
Annexe A-2:
|
CO
|
H2
|
OH
|
NO
|
|
Hf(298)
So(298)
|
-26.420
+47.210
|
+0.000
+31.210
|
+9.432
+43.880
|
+21.580
+50.347
|
|
a 1
|
+2.9840696E+00
|
+3.1001901E+00
|
+2.9106427E+00
|
+3.1890000E+00
|
|
a 2
|
+1.4891390E-03
|
+5.1119464E-04
|
+9.5931650E-04
|
+1.3382280E-03
|
|
a 3
|
-5.7899684E-07
|
+5.2644210E-08
|
-1.9441702E-07
|
-5.2899318E-07
|
|
a 4
|
+1.0364577E-10
|
-3.4909973E-11
|
+1.3756646E-11
|
+9.5919332E-11
|
|
a5
|
-6.9353550E+15
|
+3.6945345E-15
|
+1.4114542E-16
|
-6.4847932E-15
|
|
a 6
|
-1.4245228E+04
|
-8.7738042E+02
|
+3.935315E+03
|
+9.8283290E+03
|
|
a 7
|
+6.34791 56E+00
|
-1.962942 1E+00
|
+5 .4423445E+00
|
+6.74581 26E+00
|
Annexe A-2:
|
H
|
O
|
NO2
|
N
|
|
Hf(298)
So(298)
|
+52.100
+27.392
|
+59.559
+3.470
|
+7.910
-57.340
|
+113.000
+36.610
|
|
a 1
|
+2.5000000E+00
|
+2.5420596E+00
|
+4.6240771E+00
|
+2.4502682E+00
|
|
a2
|
+0.0000000E+00
|
-2.7550619E-05
|
+2.5260332E-03
|
+1.0661458E-04
|
|
a 3
|
+0.0000000E+00
|
-3.1028033E-09
|
-1.0609498E-06
|
-7.4653373E-08
|
|
a4
|
+0.0000000E+00
|
+4.5510674E-12
|
+1.9879239E-10
|
+1.8796524E-11
|
|
a5
|
+0.0000000E+00
|
-4.3680515E-16
|
-1.3799384E-14
|
-1.0259839E-15
|
|
a6
|
+2.5471627E+04
|
+2.9230803E+04
|
+2.2899900E+03
|
+5.6116040E+04
|
|
a7
|
-4.6011763E-01
|
+4.9203080E+00
|
+1.332413E+00
|
+4.448758E+00
|
Remarque : Hf et SO en (cal/mole).
Annexe B: [7]
Les enthalpies de formation de diverse substance dans
l'état standard de référence, [Hf] 298 0
K
|
Substance
|
[Hf]298 0 K
(Kcal/mole)
|
|
Substance
|
0
[Hf] 298 K
(Kcal/mole)
|
|
O(g)
|
59.148
|
|
CH1(g) .
|
-17.889
|
|
O2(g) .....
|
0
|
|
C2H6(g) ...
|
-20.236
|
|
H(g)
.
|
52.082
|
|
C3H8(g) .
|
-24.820
|
|
H2(g)
|
0
|
|
C4H12(g)... .
|
-29.812
|
|
OH(g)
|
9.402
|
|
C5H14(g)
|
-35.00
|
|
N(g) ...
|
112.482
|
|
C6H14((g) .
|
-39.96
|
|
N2(g)
|
0
|
|
C7H16(g)
|
-44.89
|
|
NO(g) .
|
21.595
|
|
C8H18(g) ..
|
-49.82
|
|
NO2(g) ...
|
8.090
|
|
C6H6(g) .
|
19.820
|
|
CO(g)
|
-26.412
|
|
C2H2(g)
|
54.194
|
|
CO2(g) .
|
-94.040
|
|
C2H4(g)...
|
12.496
|
|
H2O(g)
|
-57.790
|
|
|
|
|
H2O(l) .
|
-68.309
|
|
|
|
Légende: (g): gaz.
(l): liquide.
Annexe C: [7]
C-1-Chaleur Spécifique à Pression Constante
Cp Des Gaz
|
Température
|
|
t
|
T
|
|
C°
|
K°
|
|
0
|
273
|
|
100
|
373
|
|
200
|
473
|
|
300
|
573
|
|
400
|
673
|
|
500
|
773
|
|
600
|
873
|
|
700
|
973
|
|
800
|
073
|
|
900
|
1173
|
|
1000
|
1273
|
|
1100
|
1373
|
|
1200
|
1473
|
|
CH4
|
C2H6
|
C3H8
|
|
CP
|
CP
|
CP
|
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
|
0.5172
|
2.1654
|
0.3934
|
1.6471
|
0.3701
|
1.5495
|
|
0.5848
|
2.4484
|
0.493
|
2.0674
|
0.4817
|
2.0168
|
|
0.6704
|
2.8068
|
0.5947
|
2.4899
|
0.5871
|
2.4581
|
|
0.7584
|
3.1753
|
0.6814
|
2.8696
|
0.6770
|
2.8345
|
|
0.8430
|
3.5295
|
0.7676
|
3.2138
|
0.7550
|
3.1610
|
|
0.9210
|
3.8560
|
0.8405
|
3.5190
|
0.8237
|
3.4487
|
|
0.9919
|
4.1529
|
0.9045
|
3.770
|
0.8831
|
3.6974
|
|
1.0560
|
4.4213
|
0.3607
|
4.0223
|
0.9357
|
3.9159
|
|
1.1129
|
4.6595
|
1.0069
|
2.2157
|
0.9175
|
4.0926
|
|
1.1638
|
4.8726
|
1.0483
|
4.3890
|
1.0151
|
4.2500
|
|
1.2089
|
5.0614
|
1.0863
|
4.5481
|
1.0495
|
4.3945
|
|
1.2483
|
5.2264
|
1.1209
|
4.6930
|
1.0811
|
4.5263
|
|
1.2820
|
5.3675
|
1.1521
|
4.8236
|
1.1094
|
4.6448
|
C-2-
|
Température
|
|
t
|
T
|
|
C°
|
K°
|
|
0
|
273
|
|
100
|
373
|
|
200
|
473
|
|
300
|
573
|
|
400
|
673
|
|
500
|
773
|
|
600
|
873
|
|
700
|
973
|
|
800
|
073
|
|
900
|
1173
|
|
1000
|
1273
|
|
1100
|
1373
|
|
1200
|
1473
|
|
CH4
|
C2H6
|
C3H8
|
|
CP
|
CP
|
CP
|
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
|
0.3486
|
1.4395
|
0.38447
|
1.6007
|
0.2253
|
0.9433
|
|
0.4363
|
1.267
|
0.44669
|
1.8702
|
0.3189
|
1.3352
|
|
0.5197
|
2.1759
|
0.48817
|
2.0439
|
0.4003
|
1.6760
|
|
0.5918
|
2.4777
|
0.51928
|
2.1714
|
0.4673
|
1.9565
|
|
0.6334
|
2.7357
|
0.54501
|
2.2818
|
0.5213
|
2.1826
|
|
0.7065
|
2.9580
|
0.56756
|
2.3763
|
0.5659
|
2.3693
|
|
0.7532
|
3.1535
|
0.58784
|
2.4612
|
0.6029
|
2.5242
|
|
0.7942
|
3.3252
|
0.60643
|
2.5390
|
0.6342
|
2.6553
|
|
0.8295
|
3.4730
|
0.62337
|
2.6099
|
0.6609
|
2.7671
|
|
0.8609
|
3.6044
|
0.63881
|
2.6746
|
0.6834
|
2.8613
|
|
0.8887
|
3.7208
|
0.65279
|
2.7331
|
0.7029
|
2.9429
|
|
0.9126
|
3.8209
|
0.66542
|
2.7860
|
0.7196
|
3.0128
|
|
0.9336
|
3.9088
|
0.67672
|
2.8333
|
0.7340
|
3.0731
|
|
Température
|
|
T
|
T
|
|
C°
|
K°
|
|
0
|
273
|
|
100
|
373
|
|
200
|
473
|
|
300
|
573
|
|
400
|
673
|
|
500
|
773
|
|
600
|
873
|
|
700
|
9731
|
|
800
|
073
|
|
900
|
1173
|
|
1000
|
1273
|
|
1100
|
1373
|
|
1200
|
1473
|
|
1300
|
1573
|
|
1400
|
1673
|
|
1500
|
1773
|
|
1600
|
1873
|
|
1700
|
1973
|
|
1800
|
2073
|
|
1900
|
2173
|
|
2000
|
2273
|
|
2100
|
2373
|
|
2200
|
2473
|
|
2300
|
2573
|
|
2400
|
2673
|
|
2500
|
2773
|
|
2600
|
2873
|
|
2700
|
2973
|
|
2800
|
3073
|
|
2900
|
3173
|
|
3000
|
3273
|
|
O2
|
N2
|
|
CP
|
CP
|
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
Kcal/Kg°K
|
|
0.2185
|
0.9148
|
0.2482
|
1.0392
|
|
0.2230
|
0.9337
|
0.2489
|
1.0421
|
|
0.2300
|
0.9630
|
0.2512
|
1.0517
|
|
0.2376
|
0.9948
|
0.2554
|
1.0693
|
|
0.2445
|
1.0237
|
0.2607
|
1.0915
|
|
0.2504
|
1.0484
|
0.2664
|
1.1354
|
|
0.2533
|
1.0869
|
0.2721
|
1.1392
|
|
0.2593
|
1.0856
|
0.2774
|
1.1614
|
|
0.2627
|
1.0999
|
0.2822
|
1.1815
|
|
0.2656
|
1.1120
|
0.2864
|
1.1991
|
|
0.2682
|
1.1229
|
0.2902
|
1.2150
|
|
0.2703
|
1.1317
|
0.2935
|
1.2280
|
|
0.2723
|
1.1401
|
0.2964
|
1.2410
|
|
0.2743
|
1.1484
|
0.2989
|
1.2514
|
|
0.2762
|
1.1564
|
0.3011
|
1.2606
|
|
0.2780
|
1.1639
|
0.3030
|
1.2686
|
|
0.2797
|
1.1710
|
0.3048
|
1.2761
|
|
0.2815
|
1.1786
|
0.3063
|
1.2824
|
|
0.2832
|
1.1857
|
0.3077
|
1.281
|
|
0.2849
|
1.1928
|
0.3089
|
1.2933
|
|
0.2867
|
1.2004
|
0.3100
|
1.2979
|
|
0.2884
|
1.2075
|
0.3110
|
1.3021
|
|
0.2900
|
1.2142
|
0.3120
|
1.3063
|
|
0.2917
|
1.2213
|
0.3128
|
1.3096
|
|
0.2933
|
1.2280
|
0.3136
|
1.3130
|
|
0.2948
|
1.2343
|
0.3143
|
1.3150
|
|
0.2964
|
1.2410
|
0.3155
|
1.3209
|
|
0.2979
|
1.2472
|
0.3162
|
1.3239
|
|
0.2984
|
1.2493
|
0.3170
|
1.3272
|
|
0.2997
|
1.2548
|
0.3173
|
1.3285
|
|
0.3010
|
1.2602
|
0.3180
|
1.3314
|
C-3-
Annexe D: [1] Constantes d'équilibres.
|
T(°K) K[i]
|
H2 = 2H
|
O2=2O
|
O2= 2N
|
N2+ O2 = 2NO
|
2CO2= 2CO +O2
|
2H2O= 2H2+O2
|
2H2O=2OH+H2
|
|
1000
|
5.121 10-18
|
3.63 10-20
|
8.2 10-32
|
7.3 10 -9
|
4.00 10-21
|
7.5 10-21
|
1.310-23
|
|
1100
|
6.682 10-18
|
8.8 10-18
|
2.26 10-28
|
5.3 10 -8
|
1.92 10-18
|
1.71 10-18
|
710-21
|
|
1200
|
3.889 10-14
|
8.6 10-16
|
1.67 10-26
|
2.77 10 -7
|
3.28 10-16
|
1.59 10-16
|
1.410-18
|
|
1300
|
1.221 10-12
|
4.19 10-14
|
4.50 10-24
|
1.11 10-6
|
2.52 10-14
|
7.46 10-15
|
1.210-16
|
|
1400
|
2.361 10-11
|
1.17 10-12
|
5.5 10-21
|
3.68 10-6
|
1.00 10-12
|
2.02 10-13
|
610-15
|
|
1500
|
3.090 10-10
|
2.11 10-11
|
5.610-19
|
1.04 10-5
|
2.58 10-11
|
3.54 10 -11
|
1.610-13
|
|
1600
|
2.956 10-9
|
2.66 10-10
|
1.3 10-17
|
2.58 10 -5
|
4.26 10-10
|
4.35 10 -11
|
3.010-12
|
|
1700
|
2.166 10-8
|
2.48 10 -9
|
3.40 10-16
|
5.76 10-5
|
5.05 10 -9
|
3.98 10-10
|
410-11
|
|
1800
|
1.279 10 -7
|
1.82 10-8
|
6.0 10-15
|
1.17 10 -4
|
4.5 10 -8
|
2.8 10 -9
|
410-10
|
|
1900
|
6.287 10 -7
|
1.08 10 -7
|
7.8 10-14
|
2.22 10 -4
|
3.2 10 -7
|
1.7 10-8
|
3.010-9
|
|
2000
|
2.634 10-6
|
5.38 10 -7
|
7.8 10-13
|
3.93 10 -4
|
1.9 10-6
|
8.2 10-8
|
1.910-8
|
|
2100
|
9.684 10-6
|
2.31 10-6
|
6.4 1012
|
6.6 10 -4
|
9 10 -6
|
3.4 10 -7
|
110-7
|
|
2200
|
3.163 10 -5
|
8.7 10-6
|
4.26 10-10
|
1.06 10 -3
|
3.8 10 -5
|
1.3 10-6
|
4.510-7
|
|
2300
|
8.367 10 -5
|
2.90 10 -5
|
2.45 10-11
|
1.63 10 -3
|
1.4 10 -4
|
4.2 10-6
|
1.810-6
|
|
2400
|
2.512 10-4
|
8.8 10-5
|
1.20 10-9
|
2.42 10-3
|
4.8 10-4
|
1.3 10-5
|
610-6
|
|
2500
|
6.295 10-4
|
2.43 10-4
|
5.20 10-8
|
3.48 10-3
|
1.4 10-3
|
3.5 10-5
|
2.110-5
|
|
2600
|
1.468 10-3
|
6.24 10-4
|
7.11 10-7
|
4.86 10-3
|
3.9 10-3
|
8.9 10-5
|
610-5
|
|
2700
|
3.216 10 -3
|
1.48 10 -3
|
2.28 10 -7
|
6.62 10 -3
|
1 10-2
|
2.1 10 -4
|
1.610-4
|
|
2800
|
6.668 10-3
|
3.36 10-3
|
6.80 10-7
|
8.8 10-3
|
2.2 10-2
|
4.7 10-4
|
4.210-4
|
|
2900
|
1.256 10-2
|
7.14 10-3
|
1.88 10-6
|
1.15 10-2
|
4.8 10-2
|
1.0 10-2
|
110-3
|
|
3000
|
2.483 10-2
|
1.44 10-2
|
2.44 10-6
|
1.48 10-2
|
0.11
|
2.0 10 -3
|
2210-3
|
Annexe E: [7]
Calcul de l'enthalpie du mélange
frais:
L'enthalpie HT fdu mélange frais à la
température T est donnée par:
à
T
fi
H f H H
T = ? 0 fi +?
i i
Hf0i , est l'enthalpie de formation du constituant i
aux conditions de référence. à
?fi H T
? ? n T fi
Cp(T T 0 )
T --
fi
i i
Compte tenu des relations (II-3 0) - (II-31) - (II-32) on
à: à
?fi H T
? ? n 0 fi
Cp(T T 0 )
0 --
fi
i i
Si on considère le mélange suivant:
Ri CncHnh +Zst (O2 + ù N2) avec Zst = nc+(
nh/4) Sachant que: H (O ) H (N 2 ) 0
0 f = =
0
2 f
On aura:
H H (C H ) (R 4.762 Z ) Cp (T T )
T 0 0
f ? + + --
f nc nh i st 0
f
l'enthalpie massique du mélange frais devient:
H T
h T f
f (R 4. 762 Z ) .M --
i st
f
+
Organigramme

H1
Méthode 1 Méthode2
T1
H2
Méthode 1
Méthode2
T2
Initialisation T1 et T2
Calcul de la température de flamme par la
méthode de la
sécante

Procédure graphe ( Tb , Xb , Hx )
Début
Tf =T1
Température de flamme

T1=T2 T2 = Tb
Non
Non
| T1 -T2 | < 1
|H2-Hf | > |H1-Hf|
Oui
Oui
T2 = T1 T1=Tb
Fin
|
T (H H ) T (H H )
2 1 f 1 2 2
-- -- --
Tb =
H H
1 2
--
|


METHODE (1)
Procédure matrice Xb (T , Xb
, Hb)

I=0

Début
X1(I)=0.0 1
I=I+1
Oui Non
I<7
A0


Inverse

Transpose
|
At n
, At ,
i Xt
0
|
|
A t ,
0
|
D
|

Produit M.V
Rs= * D
A t
0

T
GrTT

GrT0=G0+ln GrT1= G1+ln
p

p 0
p
p 0



Produit M-V



DC


D

C
Rs -Rsi

DIFFRENCE

|
GrT0 , GrT1
|
X0= R s - Rs1
|
|
|
|
|
|
|
Calcul G
|
|
|
|
|
|
( ) ( )
X 0 i
G 0 ~ G r T 0 i + ln Xb
( ) ( )
X 1 i
G 1 ~ G r T 1 i + ln Xl
|
|
|
|
|
|
|
|
|
|
G0 , G1
|
|
Aff
|
|
|
Test 2

bool
Faux

bool
Vrai

Prod HK


Fin
Hb

Fin
CALCUL DE L'AFFINITE CHIMIQUE
Procédure Aff (Go , G1 , Aff )
Xn, G0


Début
Prod M-V

G1,Xn G
XnG= X n *G0
DiffAff
Aff= G1-XnG
TEST DE CONVERGENCE
Procédure test 2(Aff,bool )

Bool=Faux


i=0
Non
Er<0.01
Non
Er=Er+Aff(i)
I<7
Oui
Oui
Bool = vrai
i=i+1

X1(i) = x1 (i)* exp (-Aff (i) /2)
Non
Oui
i=i+1
I<7
Fin
Er = 0
I=0

? Méthode (2)
Début
Initialisation X2
E(X2) ,
F(X2) , K(T)
prod HK
Prod M-V
Calcul E
Faux
Const K
Calcul f
Inverse
Test 3
bool
X2
K,X2
E-1,f(i)
T
test
Vrai
E(X2)
bool
K(T)
f(i)
E-1
dx i
Hm
Fin
Enthalpie du mélange
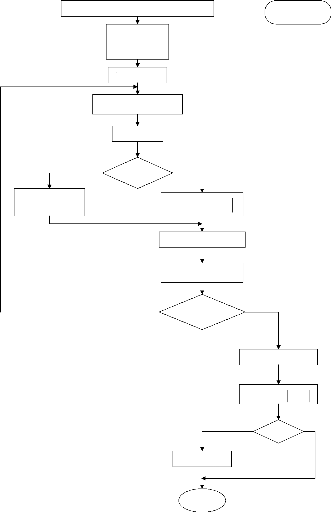
Procédure (nor ,V1,V2,V3, bool)
P=1
Bool = false
SV=0
V(i)=V1(i)
V2(i)=V1 (i)-V(i)
V3(i)=V1(i)
non
V(i)=V1(i) +PV2(i)
X1(i)~ 0
non
P=P-0, 1
V1(i)=
Norm (f,norm2)
calcul f(V3 ,K,f)
oui
norm2 <nor
oui
V1(i
)
V2(i)
SV=SV+
oui non
SV<0,1
bool = true
FIN
TEST 3
Bibliographie
Bibliographie
[1] : Thermodynamique générale et
applications Par:R.KLING (1980);
[2] : Cours de sciences physiques
thermodynamiques Par: R. Annequin et Boutigny (1979);
[3] : Simulation de la combustion dans un
moteur alternatif à combustion interne Par: P. BANER et O. HEUZE
(1986);
[4] : La combustion industrielle Par: E.
PERTHUIS (1983);
[5] : Thermodynamique (6ème
édition) Par : A. KASTLER (2000);
[6] : Méthodes Numériques
Appliquées Par : A. GOURDIN et M. BOUMAHRAT (1988);
[7] : Simulation de la Combustion Interne :
Modélisation et Expérémentation Par : ASNOUN AHMED,
Thèse de doctorat (1997);
[8] : Thermodynamique et Equilibre Chimique Par
: ALAIN GRUGE (1997);
[9] : Thermodynamique, Physique et Chimique
Par: PAUL Roux et JEAN Robert (1998).
| 


