Chapitre III
Résultats et interprétations
Dans ce chapitre, on va représenter les différents
résultats obtenus par les deux méthodes, essayer de les
interpréter et de les comparer.
III-1- Influence de la richesse:
III-1-1- La variation de la composition des produits
de combustion en fonction de la richesse:
Les figures [(III-1), (III-8)], représentent la variation
de la composition
des produits de combustion isobare du méthane et du
propane, (CO2, H2O, CO, N2, O2, H2, OH et NO). Deux cas sont à
distinguer:
1er Cas : Ri<1
On constate, qu'en milieu pauvre la quantité de O2 produit
est inversement proportionnelle à la richesse ceci est dû à
la quantité d'air exedante.
L'excès de comburant diminue nettement l'intensité
des réactions d'équilibres (dissociation).
D'autre part, il implique la décroissance du nombre de
moles des gaz CO2 et H2O. Aussi, on note que la proportion négligeable
du CO, OH, NO et le H2, est le résultat de l'activité trop faible
des réactions d'équilibres.

2émeCas
:Ri>1
Dans ce cas, on a un défaut d'air, l'oxygène
disponible étant insuffisant, ce qui explique sa quantité
négligeable. Cette dernière est produite par les réactions
d'équilibres (dissociation), devenues très vives à cause
du manque de comburant. Cette vivacité des réactions
d'équilibres dissocie un nombre important des molécules du (CO2,
H2O), en (CO, H2) ce qui explique la décroissance des premières
et l'augmentation des dernières.
Remarque:
Pour les gaz (NO, NO2, OH, H, O et N), leurs réactions
d'équilibre sont intenses, seulement à des hautes
températures, qu'on ne peut pas les atteindre avec les hydrocarbures
saturés, ce qui indique leur faible quantité et par
conséquent, la quantité d'azote N2 reste pratiquement
constante.

Chapitre III Résultats et
interprétations
3.00
----- CH4 ___ C3H8
0.00
2.00
1.00
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri


Fig III.1: Variation de la composition de CO2 en fonction
de la richesse
4.00
----- CH4
___ C3H8
3.00
2.00

1.00
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.2: Variation de la composition de H2O en fonction
de la richesse
0.25
0.20
0.05
0.00
----- CH4
___ C3H8
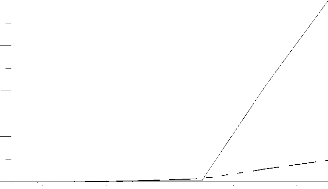
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.3: Variation de la composition de CO en fonction
de la richesse
20.00
----- CH4 ___ C3H8
16.00
8.00


4.00
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.4: Variation de la composition de N2 en fonction
de la richesse

1.00
----- CH4 ___ C3H8
0.80
0.00
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.5: Variation de la composition de O2 en fonction
de la richesse
3.00
----- CH4 ___ C3H8

0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.6: Variation de la composition de H2 en fonction
de la richesse
0.12
----- CH4
___ C3H8
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.7: Variation de la composition de OH en fonction
de la richesse

0.16
----- CH4 ___ C3H8
0.12
0.04
0.00
0.08
0.80 0.90 1.00 1.10 1.20 1.30
Richesse Ri
Fig III.8 Variation de la composition de NO en fonction
de la richesse
|
Ri / ni
|
nCO2
|
nH2O
|
nCO
|
nN2
|
nO2
|
nH2
|
nOH
|
nNO
|
|
0.8
|
0.739
|
1.477
|
0
|
7.463
|
0.318
|
0.054
|
0.093
|
0.112
|
|
0.9
|
0.831
|
1.676
|
0.0001
|
7.492
|
0.173
|
0.08
|
0.066
|
0.062
|
|
1
|
0.996
|
1.887
|
0.0012
|
7.511
|
0.025
|
0.092
|
0.04
|
0.025
|
|
1.1
|
0.082
|
1.791
|
0.0035
|
7.521
|
0.017
|
0.399
|
0.018
|
0.005
|
|
1.2
|
0.066
|
1.623
|
0.0141
|
7.523
|
0.033
|
0.772
|
0.008
|
0.001
|
|
1.3
|
0.049
|
1.445
|
0.0238
|
7.523
|
0.05
|
1.152
|
0.004
|
0.001
|
Tableau III.1 a : La variation de la composition des
produits de combustion
pour le méthane CH4
|
Ri / ni
|
nCO2
|
nH2O
|
nCO
|
nN2
|
nO2
|
nH2
|
nOH
|
nNO
|
|
0.8
|
2.45
|
3.093
|
0
|
18.73
|
0.8077
|
0.045
|
0.106
|
0.144
|
|
0.9
|
2.515
|
3.465
|
0.0001
|
18.738
|
0.446
|
0.059
|
0.1
|
0.136
|
|
1
|
2.998
|
3.881
|
0.0013
|
18.795
|
0.026
|
0.099
|
0.039
|
0.029
|
|
1.1
|
2.535
|
3.422
|
0.001
|
18.805
|
0.064
|
0.962
|
0.031
|
0.008
|
|
1.2
|
2.27
|
2.913
|
0.105
|
18.809
|
0.129
|
1.879
|
0.0129
|
0.0024
|
|
1.3
|
2.198
|
2.394
|
0.2
|
18.815
|
0.201
|
2.802
|
0.005
|
0.0008
|
Tableau III.1 b : La variation de la composition des
produits de combustion pour le Propane C3H8
III-1-2- La variation de la température de
flamme adiabatique en fonction de la richesse:
· a) première
méthode
La figure (III-2- a) représente la variation de la
température de fin de combustion du méthane et du propane en
fonction de la composition initiale des gaz frais.
- On remarque que les courbes présentent un maximum au
voisinage du mélange stoechiométrique, cette constatation se
rencontre chez la plupart des hydrocarbures.
- En milieu pauvre (Ri<1), la décroissance de Tf
s'explique comme nous l'avons vu précédemment, par l'augmentation
de la quantité (nombre de moles) des produits
gazeux au sein desquels va se dissiper l'enthalpie initiale ?H
i.
- En milieu riche (Ri>1), la décroissance de Tf
quand la richesse augmente est due à l'activité importante et
accrue des réactions d'équilibres, dont le caractère
endothermique arrive à l'emporter sur l'échauffement des produits
formés
· b) deuxième
méthode
La comparaison des graphes III.2.a et III.2.b et des tableaux
III.1.a et III.1.b montre que les résultats obtenus par la
méthode des constantes d'équilibres sont très proches de
ceux calculés par la première méthode pour les
mélanges pauvres. L'écart relatif maximal de deux valeurs
correspondantes ne dépasse pas les 7% pour le méthane et reste
inférieur à 4% pour le propane. Par contre, au-delà de la
richesse stoechiométrique, les valeurs obtenues par les deux
méthodes divergent, et ce sont les résultats de la seconde
méthode qui sont incompatibles avec la réalité. Cette
incompatibilité est due peut être à une erreur dans notre
programme. Il faut noter aussi que pour avoir une bonne convergence de la
seconde méthode il faut que les valeurs initiales des racines soient
proches de la solution.
2500.00
2400.00

2300.00
2200.00
2100.00
2000.00
0.60 0.80 1.00 1.20 1.40
Richesse Ri
Fig III.2.a: La variation de la température de
flamme adiabatique (1ère méthode).
3000.00
2800.00
2200.00
2000.00
----- C3H8
___ CH4

0.60 0.80 1.00 1.20 1.40
Richesse Ri
Fig III.2.b: La variation de la température de
flamme adiabatique ( 2ème méthode).
|
Ri
|
Tf (CH4)
|
Tf (C3H8)
|
|
0.7
|
2037.09
|
201 6.12
|
|
0.75
|
2115.39
|
2093.66
|
|
0.8
|
2151.73
|
2119.54
|
|
0.85
|
2260.85
|
2149.34
|
|
0.9
|
2329.17
|
2241.22
|
|
0.95
|
2394.72
|
2407.34
|
|
1
|
2455
|
2470.33
|
|
1.05
|
2515.49
|
2532.07
|
|
1.1
|
2573.63
|
2617
|
|
1.15
|
2629.65
|
2692.76
|
|
1.2
|
2683.63
|
2704.28
|
|
1.25
|
2735.7
|
2757.51
|
|
1.3
|
2785.95
|
2809.05
|
|
Ri
|
Tf(CH4)
|
Tf(C3H8)
|
|
0.7
|
2063.53
|
2063.22
|
|
0.75
|
2080.73
|
21 00.09
|
|
0.8
|
2151.73
|
2192.33
|
|
0.85
|
2193.91
|
2197.18
|
|
0.9
|
2213.42
|
2245.82
|
|
0.95
|
2233.84
|
2271 .72
|
|
1
|
2426.17
|
2430.93
|
|
1.05
|
2420.27
|
2423.46
|
|
1.1
|
2416.5
|
2406.62
|
|
1.15
|
2386.83
|
2373.79
|
|
1.2
|
2359.4
|
2341.04
|
|
1.25
|
2326.9
|
2305.73
|
|
1.3
|
2063.34
|
2272.16
|
Tableau (III.1 .b) la variation de la Température Tableau
(III.1 .a) la variation de la Température
de flamme adiabatique de flamme adiabatique
deuxième méthode première méthode
| 


