i
DEDICACE
A mes chers parents, A ma grand-mère,
A mes frères et soeurs, A mes amis et amies
C'est avec une émotion profonde et sans cesse
renouvelée que je vous dédie ce mémoire.
ii
REMERCIEMENTS
Plus par conviction personnelle que par l'esprit de
conformisme, nous saisissons cette précieuse opportunité pour
exprimer notre profonde gratitude aux personnes qui ont contribué
à notre formation et à la réalisation du présent
travail.
Professeur GASOGO Anastasie, vous avez dirigé ce
travail avec bienveillance malgré vos multiples obligations. Grâce
à vos multiples efforts et remarques pertinents ce travail a pu voir le
jour. Votre disponibilité et votre dévouement nous ont permis de
travailler dans un climat de confiance et d'harmonie. Chère directrice,
je vous prie de trouver ici notre profonde gratitude.
Notre profonde gratitude s'adresse à Dr. Gaspard NTAKI
MAZI qui a accepté de lire notre travail.
Nous remercions également Dr. Véronique GOSSAILAIN
de nous avoir inspiré sur le sujet de notre travail.
Tous nos vifs remerciements vont à Mr Védaste
NDAYISABA étudiant en cinquième année pharmacie qui nous a
accompagné durant l'analyse des échantillons au laboratoire. Nos
remerciements s'adressent également à Mr ISUMBISHO Pascal,
Georges ALUNGA tous de l'ISP Bukavu, à l'équipe de terrain du
projet ECOSYKI/UNR : Sylvain, Antoine, Marie France, Angélique et
à tout le personnel de la station piscicole de Rwasave pour leur
collaboration.
Nous remercions vivement tous les enseignants de la
faculté des sciences en particulier ceux du département de
Biologie qui se sont donnés jour et nuit durant notre formation
académique à l'UNR, nous vous serons toujours reconnaissant pour
vos efforts.
Nous devons notre profonde reconnaissance aux agents du
service météorologique au sein du ministère des
infrastructures de nous avoir procuré des données
météorologiques. Que Soeur Directrice du Collège Sainte
Marie de Kibuye trouve ici nos vifs remerciements.
Que dirons-nous des familles Martin HABIMANA, Boniface SEMINEGA
et Damien
DUSENGE, des collègues de classe, des frères et
soeurs, des amis et camarades, vos
efforts n'ont pas été
vains. Que Oreste, Onesphore, Joyeuse et Vincent trouvent ici notre
profonde
gratitude pour leur aide si importante. Du fond de notre coeur nous
disons
grand merci à tous ceux qui de près ou de loin ont
contribué à la réalisation de ce
travail.
Théoneste NZAYISENGA
iii
TABLE DES MATIERES
DEDICACE i
REMERCIEMENTS ii
TABLE DES MATIERES iii
LISTE DES ABREVIATIONS ET SIGLES v
LISTE DES TABLEAUX vi
LISTE DES FIGURES vii
LISTE DES ANNEXES viii
SOMMAIRE ix
ABSTRACT x
INTRODUCTION GENERALE 1
1. PROBLEMATIQUE 1
2. HYPOTHESES DU TRAVAIL 2
3. OBJECTIFS DU TRAVAIL 3
4. SUBDIVISION DU TRAVAIL 3
CHAPITRE I. REVUE BIBLIOGRAPHIQUE SUR LE LAC KIVU 4
I.1 SITUATION GEOGRAPHIQUE, ORIGINE ET STRUCTURE DU LAC KIVU 4
I.2 LES FACTEURS ABIOTIQUES DU LAC KIVU 6
I.2.1 Le climat 6
I.2.2 Les facteurs physico-chimiques 6
I.3 LES FACTEURS BIOTIQUES 7
I.3.1 La flore 7
I.3.2 La faune 8
CHAPITRE II. REVUE BIBLIOGRAPHIQUE SUR LE ZOOPLANCTON
... 14
II.1 GENERALITES SUR LES COMMUNAUTES ZOOPLANCTONIQUES 14
II.2 LES CARACTERISTIQUES CLES DES DIFFERENTS GROUPES 15
ZOOPLANCTONIQUES 15
II.2.1 LES ROTIFERES 15
II.2.2 LES CLADOCERES 16
II.2.3 LES COPEPODES 18
II.3 BIOLOGIE ET REPARTITION DU ZOOPLANCTON 19
II.3.1 BIOLOGIE DU ZOOPLANCTON 19
II.3.2 REPARTITION MONDIALE DU ZOOPLANCTON 21
II.4 INFLUENCE DE LA PREDATION SUR LA TAILLE ET LA STRUCTURE DU
ZOOPLANCTON 22
II. 5 MIGRATION VERTICALE ET DISTRIBUTION SPATIALE DES
CLADOCERES
ET COPEPODES 23
II.6 VARIATIONS SAISONIERE ET ANNUELLE DE LA BIOMASSE 24
ZOOPLANCTONIQUE AU LAC KIVU 24
CHAPITRE III. MATERIEL ET METHODES 26
III.1 SITE ET PROGRAMME D'ECHANTILLONNAGE 26
III. 2 LE MATERIEL 26
III. 3 METHODOLOGIE 28
III. 3. 1 TECHNIQUES D'ECHANTILLONNAGE 28
III. 3. 2 TECHNIQUES D'ANALYSE 30
CHAPITRE IV. PRESENTATION DES RESULTATS ET DISCUSSION 32
IV. 1 PRESENTATION DES RESULTATS 32
IV.1.1 DONNEES METEOROLOGIQUES 32
IV.1.2 DONNEES LIMNOLOGIQUES 34
IV.1.3 COMPOSITION ET TAILLE DU ZOOPLANCTON 39
IV.1.4 VARIATION TEMPORELLE DU ZOOPLANCTON 40
IV.1.5. ABONDANCE RELATIVE DE DIFFERENTS GROUPES DE 41
ZOOPLANCTON 41
IV. 2 DISCUSSION ET INTERPRETATION 49
CONCLUSION ET RECOMMANDATIONS 52
REFERENCE BIBLIOGRAPHIQUE 54
ANNEXES 60
LISTE DES ABREVIATIONS ET SIGLES
ug : microgramme
ugMS : microgramme de matière sèche
chla : chlorophylle a Ca2+: Ion calcium Cr: Ion
chrome
ECOSYKI : Etude du fonctionnement de l'écosystème
du lac Kivu en vue de son exploitation durable (projet entre UNR, ISP/Bukavu,
et l'Université de Namur)
EJC : Ecole de Journalisme et Communication
FS : Faculté des Sciences
gMS : Gramme de Matière Sèche
GIS : Geographic Information System
GPS: Global Positioning System
HPLC: High Performance Liquid Chromatography
ISP : Institut Supérieur Pédagogique
K+ : Ion potassium
LS : Longueur Standard
LT : Longueur Totale Mg2+ : Ion magnésium
MININFRA : Ministère de l'Infrastructure
Na+ : Ion sodium
pH : Potentiel d'Hydrogène
REA : Rift Est Africain
RDC : République Démocratique du Congo
SO4 2- : Ion sulfate
UNR : Université Nationale du Rwanda
vi
LISTE DES TABLEAUX
Tableau I : Caractéristiques limnologiques des lacs Kivu,
Tanganyika, Mobutu (Albert) et Idi
Amin (Edouard) [HECKY et KLING, 1987 ; VANDEN BOSSCHE et
al., 1990 et
MARSHALL, 1993] 7
Tableau II : Tableau synthétique du
zooplancton du lac Kivu avant et après l'introduction de L.
miodon (MASILIYA, 2001) 9
Tableau III :
Espèces de zooplancton signalées au lac Kivu de 1937 à
1990 (tiré de
KANINGINI et al., 1999) 10
Tableau IV : Les espèces zooplanctoniques du lac Kivu
d'après FOURNIRET (1992). 11
Tableau V : Biomasse totale du zooplancton pélagique du
lac Kivu bassin de Kibuye (d'avril à octobre 2005) 40
LISTE DES FIGURES
Figure I : Localisation géographique du lac Kivu
(ISUMBISHO, 2006) 5
Figure II: Exemples de formes de rotifères (Brachionus
calyciflorus, Brachionus falcatus)
Photos prises par Isumbisho (ISUMBISHO, en prép.)
16
Figure III: Exemples des formes de Cladocères (Moina micrura,
Diaphanosoma excisum,
Alona sp.) Photos prises par Isumbisho (ISUMBISHO, en
prép.) 17
Figure IV : Exemples des formes de Copépodes
(Thermocyclops sp. (F. ad.), Mesocyclops sp.
(F.ad.)) Photos prise par Isumbisho (ISUMBISHO, en prép.)
19
Figure V : Variation de la biomasse du zooplancton et du phytoplancton en
fonction de la
profondeur de la zone de mélange au lac Kivu ( de
février.2002 au juin 2005)
[ISUMBISHO et al., 2006] 25
Figure VI : Localisation du site d'échantillonnage (centre
GIS, 2005) 27
Figure VII : Évolution de la température moyenne
mensuelle (source : MININFRA station
météorologique de Gisenyi) 32
Figure VIII : Les
moyennes mensuelles de la précipitation (source : MININFRA station
météorologique de Gisenyi) 33
Figure IX : Les
moyennes mensuelles de l'humidité de l'air (source : MININFRA station
météorologique de Gisenyi) 33
Figure X : Les
moyennes mensuelles de la fréquence des vents forts (source :
MININFRA
station météorologique de Gisenyi) 34
Figure XI
: Exemple de la variation de la zone de mélange indiquée par la
température de
l'eau du lac Kivu bassin de Kibuye 36
Figure XII : Profondeur de la zone de mélange au lac Kivu
bassin de Kibuye 37
Figure XIII : Variation de la limite de la zone euphotique dans
le lac Kivu bassin de Kibuye.
39
Figure XIV : Variation de la densité totale du
zooplancton pélagique du lac Kivu bassin de
Kibuye (avril - octobre 2005) 41
Figure XV : Variation de
l'abondance relative des grands groupes du zooplancton pélagique
du lac Kivu basin de Kibuye 42
Figure XVI : Distribution
verticale du zooplancton pélagique du lac Kivu bassin de Kibuye
(d'avril en octobre 2005) 42
Figure XVII : Relation entre la
transparence de l'eau du lac Kivu et la moyenne mensuelle de
la densité du zooplancton 43
Figure XVIII : Variation
de la biomasse du zooplancton et du phytoplancton pélagique au lac
Kivu bassin de Kibuye (juin-octobre 2005) 44
Figure XIX :
Migration verticale des copépodes du lac Kivu basin de Kibuye en pleine
lune
(le 25/10/2005) 45
Figure XX : Migration verticale des Nauplii
du lac Kivu basin de Kibuye en pleine lune (le
25/10/2005) 45
Figure XXI : Migration verticale des
Cladocères du lac Kivu basin de Kibuye en pleine lune
(le 25/10/2005) 45
Figure XXII : Migration verticale des
Rotifères du lac Kivu basin de Kibuye en pleine lune (le
25/10/2005) 46
Figure XXIII : Migration verticale des
Copépodes adultes du lac Kivu bassin de Kibuye en
période de nuit sans lune (le 08/11/2005) 46
Figure
XXIV : Migration verticale des Nauplii du lac Kivu bassin de Kibuye en
période de
nuit sans lune (le 08/11/2005) 47
Figure XXV : Migration
verticale des Cladocères du lac Kivu bassin de Kibuye en période
de
nuit sans lune (le 08/11/2005) 47
Figure XXVI : Migration verticale des Rotifères du lac
Kivu bassin de Kibuye en période de nuit sans lune (le 08/11/2005) 48
LISTE DES ANNEXES
Annexe 1 : Le profil vertical de la
température
Annexe 2 : Le profil vertical de l'oxygène dissous
Annexe 3 : Le profil vertical du pH
Annexe 4 : Le profil vertical de la conductivité de
l'eau
Annexe 5 : Données météorologiques
Annexe 6 : Fiche de résultats de la transparence de l'eau
du lac Kivu
Annexe 7 : Résultats sur de la profondeur euphotique au
lac Kivu bassin de Kibuye Annexe 8 : Fiche de collecte des données de la
densité du Zooplancton
Annexe 9 : Le Matériel de Laboratoire
Annexe 10 : Dates de collecte des échantillons et type
d'échantillonnage
SOMMAIRE
Des échantillons d'eau pour l'analyse de zooplancton
ont été prélevés dans la zone pélagique du
bassin est du lac Kivu durant la période d'avril à novembre 2005.
Les résultats de cet échantillonnage montrent que la
communauté zooplanctonique de la zone pélagique du lac Kivu est
pauvre en espèces ; elle est constituée essentiellement par trois
espèces de copépodes :Mesocyclops aequatorialis KIEFER
(1929), Thermocyclops consimilis KIEFER (1929), Tropocyclops
confinis KIEFER (1930), trois espèces de cladocères ;
Alona rectangula SARS (1862), Diaphanosoma excisum SARS
(1886), et Moina micrura KURZ (1874) et deux espèces de
rotifères ; Brachionus quandrientatus HERMANN (1783) et
Keratella sp.
Le zooplancton du lac Kivu bassin de Kibuye est
numériquement dominé par les copépodes (plus de 85 %)
suivis des cladocères (légèrement moins de 15 %) et en
dernier lieu viennent les rotifères (qui représentent moins de 2
%). La majeure partie de la densité de ce zooplancton se trouve dans la
couche de 0-20 m à partir de la surface de l'eau. En dessous de 60 m de
profondeur les eaux deviennent anoxiques et la vie aérobie devient ainsi
impossible. La migration verticale du zooplancton est influencée par la
lumière et la disponibilité de la nourriture.
ABSTRACT
Samples of water for zooplankton analysis were collected in the
pelagic zone of eastern basin in Lake Kivu during the period from April to
November 2005.
Results of this sampling show that the zooplankton community
of this lake is species poor. This community is made by; three species of
copepods (Mesocyclops aequatorialis,Thermocyclops consimilis, Tropocyclops
confines) three species of claodocers (Alona rectangula, Diaphanosoma
excisum and Moina micrura) and by two species of rotifers
(Brachionus quandrientatus, and Keratella sp.).
In Kibuye basin the zooplankton community is dominated in
numbers by Copepods (more than 85%) followed by cladocers (less than 15%) and
the last group is that of rotifers (less than 2%). The large quantity of
zooplankton density is present in the top layer. In the bottom, more than 60m
of depth water became anoxic and the oxic life is impossible. The vertical
migration of zooplankton in the water column is light and food availability
influenced.
INTRODUCTION GENERALE
1. PROBLEMATIQUE
Le lac Kivu, d'origine volcanique (CAPART, 1960 ; POUCLET,
1978 et BEADLE, 1981), compte environ 26 espèces de poissons (SNOEKS
et al., 1997). Une importante quantité de gaz méthane et
de gaz carbonique occupe la zone profonde du lac (TIETZE et al.,
1980). Cependant ce lac n'a pas attiré l'attention des
scientifiques comparativement aux autres grands lacs du rift Est africain.
Dans le but d'occuper la niche planctonique pélagique
(empty niche hypothesis, SIMBERLOFF, 1995), COLLART a introduit en
1959 un poisson pélagique et planctonophage du lac Tanganyika :
Limnothrissa miodon (COLLART, 1960).
Même si cette introduction est considérée
comme une réussite du point de vue des pêcheries et donc sur le
plan socio-économique, elle a entraîné des changements
écologiques qui ont affecté spécialement la
communauté zooplanctonique (ISUMBISHO et al., 2006). En 1953,
le zooplancton était dominé par de grands cladocères et
des copépodes avec très peu de Rotifères. En 1981, vingt
ans après l'introduction de la sardine, ce sont les Rotifères qui
occupent le lac en plus grande quantité.
Après analyse des échantillons de 1984, DUMONT
(1986) a rapporté d'importantes perturbations écologiques et
parle d'un «désastre écologique » car la plus grande
espèce de zooplancton, Daphnia curvirostris (EYLEMANN, 1887), a
disparu. En 1992, la dominance numérique des rotifères a
été confirmée (FOURNIRET, 1992) mais dès 1995 ce
sont les copépodes qui sont désormais numériquement
abondants (KANINGINI et al., 2003)
Selon ISUMBISHO et al. 2006, la domination
numérique du zooplancton par les copépodes est une
caractéristique importante du zooplancton non seulement du lac
Tanganyika (NARITA et al., 1986 ; MULIMBWA et BWEBWA, 1987 ; MULIMBWA,
1987, 1988, 1991) où le L. miodon est endémique, mais
aussi des autres lacs où il a été introduit. Le lac Kariba
est un exemple type des lacs où les copépodes dominent
numériquement la communauté zooplanctonique (BEGG,
1976 ; GREEN, 1985, 1990, GLIWICZ, 1986 et MARSHAL, 1991).
En effet, la prédation du L. miodon, qui est
un prédateur visuel sur les communautés zooplanctoniques, joue un
rôle essentiel dans le développement de l'abondance des petits
crustacés. Les copépodes, qui sont capables de résister
à la filtration des poissons planctonophages (SZLAUER, 1965 et DRENNER
et al., 1978) en accélérant leur vitesse de 10 à
35 cm.s-1 (STRICKLER, 1997), sont donc favorisés par rapport
aux cladocères.
Dans le passé, excepté les travaux de VERBEKE
(1957) et ceux de KISS (1959) qui couvrent un cycle annuel, les études
sur le zooplancton du lac Kivu ont souvent été ponctuelles.
Toutefois, ISUMBISHO effectue depuis 2000 des travaux qui s'étendent sur
plusieurs années, dans le bassin d'Ishungu, ainsi que spatialement
à l'occasion de 4 croisières d'échantillonnage sur la
totalité du lac Kivu. C'est dans cette perspective que nous avons
mené, d'avril à novembre 2005, le travail intitulé «
Contribution à l'étude du zooplancton du lac Kivu : Cas du bassin
Est au large de Kibuye ». Cette étude a été
menée dans le but d'évaluer l'abondance relative et la biomasse
des grands taxons du zooplancton, leur distribution et leurs migrations
verticales dans cet écosystème, ainsi que les relations existant
entre les facteurs environnementaux et la dynamique du zooplancton.
2. HYPOTHESES DU TRAVAIL
· L'abondance du zooplancton du lac Kivu au large de Kibuye
aurait une variation en fonction des saisons et de la profondeur.
· Le zooplancton pélagique du lac Kivu au large
de Kibuye se trouverait en grande partie dans les 20 premiers mètres de
la colonne d'eau (KANINGINI et al., 2003 ; ISUMBISHO, 2006).
· Le zooplancton pélagique du lac Kivu au large de
Kibuye serait numériquement dominé par les copépodes.
3. OBJECTIFS DU TRAVAIL
A. Objectif général
Détermination de la composition qualitative et
quantitative et de la distribution dans la colonne d'eau du zooplancton
pélagique du lac Kivu.
B. Objectifs spécifiques
· Déterminer la qualité (composition
spécifique) et la quantité (abondance relative et absolue ;
biomasse) du zooplancton dans le bassin de Kibuye.
· Mettre en évidence la distribution
saisonnière et verticale du zooplancton dans la colonne d'eau.
· Mettre en évidence les migrations verticales du
zooplancton au cours du nycthémère pendant la pleine lune et
l'obscurité totale.
4. SUBDIVISION DU TRAVAIL
Hormis l'introduction et la conclusion, ce travail est
subdivisé en 4 chapitres. Le premier chapitre est un exposé sur
les caractéristiques du lac Kivu, alors que le deuxième chapitre
parle des généralités sur les communautés
zooplanctoniques. Le troisième chapitre décrit le matériel
et les méthodes utilisées pour la collecte des
échantillons, leur analyse et les traitements de données. Le
quatrième chapitre présente les résultats obtenus et leur
interprétation.
CHAPITRE I. REVUE BIBLIOGRAPHIQUE SUR LE LAC KIVU
I.1 SITUATION GEOGRAPHIQUE, ORIGINE ET STRUCTURE DU LAC KIVU
Le lac Kivu est l'un des 4 grands lacs de la branche
occidentale du rift Est Africain (REA). Il est situé à 1463 m
d'altitude entre 1°34' 30» et 2°30' de latitude sud. D'ouest
à l'Est, il est compris entre 28°50' et 29°25' de longitude
Est (CAPART, 1960) (fig.I).
Ce lac a été formé suite aux
éruptions volcaniques des Monts Virunga (CAPART, 1960 ; BEADLE, 1981) et
couvre une superficie de 2699 Km2 dont 2384 Km2 pour la
surface du plan d'eau et 315 Km2 couverts par les îles qui
sont au nombre de 150 (WELCOMME, 1972 cité par BANA, 2005). Le lac Kivu
forme une grande partie de la frontière naturelle entre le Rwanda et la
RDC.
La zone littorale est très réduite par rapport au
milieu pélagique qui couvre 90% de la surface du lac et qui
s'étend jusqu'à proximité des rives (BEADLE, 1981).
A l'extrémité sud du bassin de Bukavu se forme la
rivière Rusizi, exutoire qui déverse les eaux du lac Kivu dans le
lac Tanganyika.

Figure I : Localisation géographique du lac Kivu
(ISUMBISHO, 2006)
I.2 LES FACTEURS ABIOTIQUES DU LAC KIVU
I.2.1 Le cimat
Le lac Kivu se trouve sous un climat de type tropical humide
qui est influencé par des chaînes de montagnes qui dominent le lac
à l'Est et à l'Ouest, des vents alizés du sudest et du
nord-est et par l'altitude. De cette influence résulte des microclimats
dans les différents bassins du lac Kivu, ce qui influerait sur la
biologie du lac (KANINGINI, 1995).
I.2.2 Les facteurs physico-chimiques
Le mélange des eaux ne concerne qu'une couche
superficielle limitée. C'est donc un lac méromictique. Il
présente une teneur élevée en sels dissous qui se
manifestent par une conductivité élevée, une
stratification thermique verticale des eaux et la présence d'importantes
quantités de gaz méthane qui était estimées
à 63 milliards de m3 en 1978 (TIETZE, 1978, cité par
ISUMBISHO, 2000 et par BANA, 2005).
Tableau I : Caractéristiques
limnologiques des lacs Kivu, Tanganyika, Mobutu (Albert) et Idi Amin (Edouard)
[HECKY et KLING, 1987 ; VANDEN BOSSCHE et al., 1990 et MARSHALL,
1993]
Caractéristiques
|
Lac Kivu
|
Lac Tanganyika
|
Lac Mobutu (Albert)
|
Lac Idi
Amin
(Edouard)
|
Altitude (m)
|
1463
|
773
|
618
|
914
|
Surface (km2)
|
2370
|
32900
|
6800
|
2325
|
Volume (km3)
|
583
|
18800
|
140
|
78,2-90
|
Profondeur maximale (m)
|
489
|
1470
|
58
|
117
|
Profondeur moyenne (m)
|
240
|
570
|
25
|
40
|
Température épilimnion
|
23-
|
23,2-27,3
|
26-29
|
26
|
(°c)
|
24,5
|
|
|
|
pH
|
9,1-9,5
|
8,0-9,0
|
8,9-9,5
|
8,8-9,1
|
Transparence (m)
|
3,5-6,0
|
15-20
|
-
|
-
|
Limite oxygène (m)
|
70
|
100-200
|
58
|
-
|
Conductivité (us /cm à
|
1240
|
520-610
|
735
|
925
|
20°C)
|
|
|
|
|
Salinité (g/l)
|
1,115
|
0,53
|
0,597
|
0,789
|
Temps de séjour (années)
|
226
|
1000
|
-
|
-
|
Ion (milliéquivalents /l)
|
|
|
|
|
Na+
|
5,22
|
2,74
|
4,79
|
3,96
|
K+
|
1,74
|
0,82
|
2,30
|
1,66
|
Ca++
|
0,30
|
0,52
|
0,62
|
0,49
|
Mg++
|
7,15
|
3,29
|
3,93
|
2,64
|
SO4 2-
|
0,67
|
0,05
|
0,64
|
0,71
|
Cr
|
0,80
|
0,76
|
1,01
|
0,93
|
Alcalinité
|
13,15
|
6,67
|
9,85
|
7,33
|
|
I.3 LES FACTEURS BIOTIQUES
Le lac Kivu étant méromictique, sa biozone
s'étend au maximum jusqu'à 60 m de profondeur au-delà de
laquelle toute vie aérobie est impossible et seulement 12% de son volume
total est habitable par les poissons (BEADLE, 1981 ;TIETZE et
al.,1980).
I.3.1 La flore
Les connaissances sur le phytoplancton et le plancton en
général du lac Kivu, sa
biomasse, sa production et son
évolution temporelle sont très fragmentaires.
Cependant,
quelques études faites par HECKY et KLING (1987) et par
DESCY (1990) nous
renseignent sur le fait que le phytoplancton du lac Kivu est
dominé par les Cyanophytes et les Chlorophytes qui représentent
à eux seuls 70 à 90% de la biomasse phytoplanctonique. L'autre
groupe qui est significativement représenté est celui des
Péridiniens.
En mars 1972, HECKY et KLING (1987), ont constaté que
le phytoplancton du lac Kivu était beaucoup plus abondant que dans les
lacs Malawi et Tanganyika à la même époque. SARMENTO et
al., (2006) souligne que le phytoplancton du lac Kivu est dominé
par les Diatomées et des Cyanobactéries. Les espèces
pélagiques les plus communes étant :
· Les Diatomés : -Nitzschia bacata
Hust.
-Fragilaria danica Lange-Bert
· Les Cyanobactéries :- Planktalyngbya limnetica
Lemm.
-Synechococcus sp.
· Les Diatomés centriques :-Urosolenia
sp. Et quelques Microcystis sp. (SARMENTO
et al., 2006).
Il existe une grande différence de concentration en
chlorophylle-a (chla) et de biomasse phytoplanctonique en général
entre le lac Kivu (76,9mg/m2 au bassin sud) et le lac Tanganyika
(37,4mg/m2 à Kigoma ; SARMENTO et al., 2006).
I.3.2 La faune
I.3.2.1 Le zooplancton
Le zooplancton du lac Kivu est composé des
Copépodes, des Cladocères et des Rotifères. D'après
ISUMBISHO et al, (2004) la composition spécifique du
zooplancton du lac Kivu a connue des modifications au cours du temps suite
à l'introduction de Limnothrissa miodon pour lequel il est un
aliment de haute importance. La composition du zooplancton du lac Kivu avant et
après cette introduction est reprise dans le tableau II.(MASILIYA,
2001).
Tableau !! : Tableau synthétique du
zooplancton du lac Kivu avant et après l'introduction de L.
miodon (MASILIYA, 2001)
TAXON
|
Avant introduction
|
Après introduction
|
|
1981
|
1990
|
1995
|
Copépodes
|
++
|
+
|
+
|
+++
|
Cladocères
|
+++
|
-
|
-
|
+
|
Rotifères
|
+
|
+++
|
+++
|
-
|
|
- = très peu nombreux, + = peu nombreux, ++ = nombreux,
+++ = très nombreux
Selon VERBEKE (1957), en 1953 le zooplancton du lac Kivu
était dominé par de grands cladocères et copépodes
avec très peu de rotifères. Il y avait très peu
d'espèces en milieu pélagique et la taille moyenne du zooplancton
était de 0,6mm. Cependant, en 1981 ; REYNTJENS a constaté un
grand changement dans la composition et dans la biomasse du zooplancton dü
probablement à l'introduction de Limnothrissa miodon. Ainsi,
les rotifères dominaient le lac Kivu avec 8 espèces et les
cladocères n'étaient représentés que par 4
espèces de petite taille. La taille des cyclopoïdes a
été diminuée de moitié, et il y'a eu la disparition
de l'espèce la plus grande des cladocères, Daphnia
curvirostris, et le cilié Stentor coerulens est devenu
l'espèce la plus abondante REYNTJENS (1982, cité par KANINGINI,
1995).
Tableau III : Espèces de zooplancton
signalées au lac Kivu de 1937 à 1990 (tiré de KANINGINI
et al., 1999)
|
1937
|
1953
|
1983
|
1990
|
CLADOCERA
|
|
|
|
|
Daphnia curvirostris
|
+
|
+
|
-
|
|
Ceriodaphnia cornuta (SARS, 1988)
|
+
|
+
|
-
|
+
|
Moina micrura (KURZ, 1974)
|
+
|
+
|
-
|
+
|
Diaphanosoma excisum (SARS, 1886)
|
+
|
+
|
+
|
+
|
Alona cambouei
|
+
|
|
+
|
|
Alona rectangula (SARS, 1862)
|
|
|
|
+
|
COPEPODA
|
|
|
|
|
Mesocyclops aequatorialis
|
+
|
+
|
+
|
+
|
Thermocyclops consimilis
|
+
|
+
|
+
|
+
|
Tropocyclops confines
|
+
|
+
|
-
|
+
|
ROTATORIA
|
|
|
|
|
Brachionus quadridentatus
|
-
|
-
|
-
|
+
|
Brachionus calyciflorus
|
-
|
-
|
-
|
|
Anuraeopsis fissa
|
-
|
-
|
-
|
+
|
Polyarthra remata
|
-
|
-
|
-
|
|
Trichocerca ruttneri
|
-
|
-
|
-
|
+
|
Ascomorpha saltans
|
-
|
-
|
-
|
+
|
Hexarthra intermedia
|
-
|
-
|
-
|
|
Lecane bulla
|
-
|
-
|
-
|
|
Conochilus sp.
|
-
|
-
|
+
|
|
Lecane sp.
|
-
|
-
|
|
+
|
CILIATA
|
|
|
|
|
Stentor coeruleus
|
|
|
|
|
|
En plus de cette baisse de la taille du zooplancton, une
colonisation du milieu pélagique
par les espèces littorales a
été observée. De l'augmentation de la
diversité
zooplanctonique et de la diminution de leur taille moyenne
en est résultée une baisse de
biomasse qui est tombée de 0,75 g MS/m2 en
1953 à 0,15 g MS/m2 en 1992 FOURNIRET (1992).
En 1982, deux ans seulement après les études de
REYNTJENS, celles de DUMONT (1986) ont démontré que la situation
était alarmante ; les tendances à la baisse de la biomasse et de
la taille du zooplancton s'étaient amplifiées, le zooplancton
n'était plus long que de 0,2 mm et la biomasse n'était que de 0,5
g MS/m2. La disparition du Daphnia curvirostris est encore
constatée, ce qui a amené DUMONT à qualifier cette
situation de "désastre écologique". Les travaux de
FOURNIRET (1992) confirment le changement dans la composition spécifique
du zooplancton après 1953 : la disparition du D. curvirostris,
la dominance numérique des Rotifères, le changement de la
biomasse et de la taille moyenne du zooplancton depuis l'introduction de L.
miodon qui est passé de 0,6mm en 1990 à 0,211mm #177;
0,001mm en mai et juin 1992 soit 35% de diminution de taille qui est
néanmoins supérieure à celle observée par DUMONT en
1983 (DUMONT, 1983 cité par BANA 2005).
Tableau IV : Les espèces
zooplanctoniques du lac Kivu d'après FOURNIRET (1992).
Groupe
|
Espèces
|
Parrains
|
Cladocères
|
Ceriodaphnia cornuta Moina micrura
Diaphanosoma excisum Alona rectangular
|
SARS, 1886 KURZ, 1874 SARS, 1886 SARS, 1862
|
Copépodes
|
Mesocyclops aequatorialis Thermocyclops consimilis
Tropocyclops confines
|
KIEFER, 1929 KIEFER,
KIEFER, 1930
|
Rotifères
|
Ascomorpha saltans
Trichocerca ruttneri
Brachionus quadriedentatus Anuraeopsis fissa
Lecane spp.
|
BARTSCH, 1850 DONNER, 1950 HERMANN, 1783 GOSSE, 1851
-
|
|
Cependant, ISUMBISHO (1995) et KANINGINI et al.
(1999) affirment que le zooplancton est de nouveau numériquement
dominé par des Copépodes et leur nauplii avec très peu de
Cladocères et de Rotifères.
Selon KISS (1966), MAHY (1979), KANINGINI et al.
(2003) et ISUMBISHO et al., (2006), le zooplancton subit des
fluctuations saisonnières qui atteignent le pic vers août-
septembre après le brassage des eaux de la saison sèche.
I.3.2.2 / 'iFhtyI11un!
Comparativement aux autres lacs du REA, la
biodiversité du lac Kivu est pauvre en espèces avec seulement 26
espèces de poissons dont 15 espèces endémiques appartenant
au genre Haplochromis [SNOEKS et al., 1997, cité par
ISUMBISHO et al., 2006]. Actuellement, la faune ichtyologique du lac
Kivu est dominée par une sardine planctonophage introduite, le L.
miodon.
Cette pauvreté ichtyologique s'expliquerait par la
formation récente du lac Kivu, sa forte salinité relative et son
isolement, résultats des éruptions volcaniques [SNOEKS, 1994
cité par BANA, 2005] ainsi que le caractère spécial de ses
eaux trop riches en produits sulfureux (MAHY, 1979 cité par BANA,
2005).
Au lac Kivu, à l'exception de L. miodon, de
Raiamas moorii et de quatre espèces de Haplochromis
qui vivent en milieu pélagique, la faune piscicole est
inféodée à la zone littorale (Tableau V).
Tableau V : Ichthyofaune du lac Kivu
(légèrement modifié par SNOEKS, 1994 tiré de
KANINGINI et al., 1999).
Famille
|
Espèces
|
Longueur (mm)
|
Habitat
|
Clupeidae
|
Limnothrissa miodon BOULENGER, 1906 (intr.)
|
175 (LT)
|
Littoral + pélagique
|
Clariidae
|
Clarias liocephalus BOULENGER, 1898 Clarias
gariepinus BURCHELL, 1822
|
380 (LT) 1500 (LT)
|
Littoral
Littoral
|
Cyprinidae
|
Riaamas moorei BOULENGER, 1900
Barbus kerstenii PETERS, 1868
B. pellegrini POLL, 1939
B. apleurogamma BOULENGER, 1911 B.
altianalis BOULENGER, 1900
|
270 (LT)
90
90
540
560
|
Littoral + pélagique
Littoral Littoral Littoral Littoral
|
Cichlidae
|
Oreochromis niloticus LINNAEUS, 1758
O. macrochir BOULENGER, 1912(intr.) Tilapia
rendalli BOULENGER, 1896 (intr.) Haplochromis vittatus
BOULENGER, 1901 H. adolphifrederici BOULENGER, 1914
H. gracilior BOULENGER, 1914
H. graueri BOULENGER, 1914
H. astatodon REGAN, 1921
H. paucidens REGAN, 1921
H. nigroïdes PELLEGRIN, 1928
H. kamiranzovu SNOEKS, COENEN et THYS
VAN DEN AUDENAERDE, 1984 H.scheffersi SNOEKS, COENEN et
THYS VAN
DEN AUDENAERDE, 1987
H. occultidens SNOEKS, 1988
H. olivaceus SNOEKS, COENEN et THYS VAN DEN AUDENAERDE,
1990
H. crebridens SNOEKS, COENEN et THYS
VAN DEN AUDENAERDE, 1990 H. microchrysomelas sp. n
SNOEKS, 1924 H. insidae sp. n SNOEKS, 1924
H. rubescens sp. n SNOEKS, 1924
|
335 (LS)
270 (LS) 250 (LS) 200 (LS) 120 (LS)
84 et 103,5 (LS) 120 (LS)
76,5 (LS)
77,5 et 132,5(LS) 70 (LS)
95 (LS)
100 (LS)
125 (LS)
66 et 89 (LS)
105 (LS)
85 (LS) 95 (LS) 115 (LS)
|
Littoral
Littoral Littoral
Littoral + pélagique Littoral
Littoral + pélagique Littoral
Littoral Littoral Littoral
Littoral + pélagique
Littoral
Littoral
Littoral
Littoral + pélagique
Littoral
Littoral
Littoral
|
|
Intr.=Introduit
CHAPITRE II. REVUE BIBLIOGRAPHIQUE SUR LE ZOOPLANCTON II.1
GENERALITES SUR LES COMMUNAUTES ZOOPLANCTONIQUES
Par définition, le zooplancton est le plancton animal,
constitué de petits organismes aquatiques parfois microscopiques. Dans
tout milieu aquatique, le zooplancton constitue un maillon important dans la
chaîne alimentaire. Il est une source de nourriture pour certaines
espèces de poissons, surtout au stade jeune (AMOROS, 1984).
La notion de plancton est liée à la taille et au
mouvement propre du plancton. Selon la taille corporelle, le zooplancton peut
être divisé en trois groupes:
- le microzooplancton constitué des
stades nauplii des copépodes et des protozoaires, plus la plupart des
rotifères, la longueur de leur corps étant de 10 à
15um,
- le mésozooplancton constitué
par des stades copépodites et des adultes des copépodes, plus la
plupart des cladocères, la longueur de leur corps varie de 0,5 à
5mm,
- le macrozooplancton comprenant les
méduses et les crevettes, la longueur de leur corps varie de 1 à
2 cm (KURKI, 1993 cité par NYINAWAMWIZA, 1998).
BOUGIS (1974) distingue seulement deux groupes de zooplancton
suivant la taille : Celui du macrozooplancton (de quelques mm
de longueur) et celui du microzooplancton (de plus ou moins
50um).
Suivant les mailles du filet employé dans
l'échantillonnage du zooplancton, on distingue :
- l'ultraplancton (< à 2um),
- le nanoplancton (2 à 20um),
- le microplanton (20 à 200um),
- le macroplancton (200 à 2000um) et
- le mégaplancton (plus de 2000um)
(DUSSART, 1966 cité par HARWANIMBAGA, 1987).
Des trois groupes qui composent l'essentiel du plancton
animal, deux appartiennent aux crustacés (cladocères et
copépodes) et un aux Rotifères. A ces trois groupes majeurs
viennent s'adjoindre épisodiquement :
· Un Chaoborus (15mm), dont les larves des
3e et 4 e stades surtout, sont planctoniques, au moins
pendant la partie de la journée où elles se nourrissent de
zooplancton et benthiques le reste du temps.
· Des protozoaires :
1) Ciliés, essentiellement représentés
par un groupe, les Tintinnidés.
2) Testacés. Quelques espèces du genre
Difflugia présentent un stade pélagique estival avec une
cyclomorphose (POURRIOT, 1982).
II.2 LES CARACTERISTIQUES CLES DES DIFFERENTS GROUPES
ZOOPLANCTONIQUES
II.2.1 LES ROTIFERES
Les Rotifères constituent une classe largement
importante comprenant plus ou moins 100 espèces. En
général, la forme de leur corps est allongée. Ils sont
couverts d'une cuticule généralement flexible. Ils ont de
flagelles leur permettant de se déplacer dans l'eau (fig. II). Ils sont
pélagiques et leur taille varie entre 0,1 et 1mm (POURRIOT, 1982).
Concernant l'alimentation, les Rotifères sont omnivores ; ils se
nourrissent des particules sestoniques sédimentées grâce au
mouvement de pulsation de leurs cils (WETZEL, 1983, cité par
NYINAWAMWIZA, 1998).

Brachionus calyciflorus
Brachionus falcatus
Figure II: Exemples de formes de rotifères
(Brachionus calyciflorus, Brachionus falcatus) Photos prises
par Isumbisho (ISUMBISHO et al., 2006)
II.2.2 LES CLADOCERES
Les Cladocères sont des petits crustacés
très fréquents dans les eaux douces à l'exception des eaux
courantes rapides où on ne les trouve que lorsqu'ils sont
entraînés par les courants à partir de zones plus calmes
(AMOROS, 1984).
Ils ont une longueur variant de 0,2 à 3 mm et
atteignent exceptionnellement 15mm. Le corps est transparent, translucide ou
parfois coloré ; la segmentation n'est pas visible, sauf exception. Ils
présentent une tête distincte pourvue de deux antennes dont la
seconde est grande sert d'organe de locomotion.
Chez la plupart des espèces, le thorax et l'abdomen
sont couverts d'une carapace bivalve dont l'ouverture ventrale et
postérieure laisse sortir les appendices thoraciques et abdominaux. En
vue latérale, les valves sont de formes variées : ovales,
sphériques, allongées (AMOROS, 1984). De plus, ils peuvent
présenter des striations, des réticulations ou une
pilosité plus ou moins développée à leur surface,
des soies ou des épines marginales et une épine caudale. La
tête qui n'est pas comprise entre les valves est protégée
par une capsule céphalique.
Les antennes sont insérées sur la face ventrale
de la tête, près du bord postérieur, les
antennes bien
développées sont insérées sur les
côtés de la tête parfois sous une
expansion (AMOROS, 1984). Ces antennes sont des appendices
natatoires et constituent l'organe le plus important de locomotion (KURKI, 1993
cité par NYINAWAMWIZA, 1998).
Les pièces buccales consistent en :
· De larges mandibules pour broyer les particules de
nourriture sélectionnées par filtration,
· Une paire de plus petits maxillaires utilisés pour
passer la nourriture entre les mandibules (AMOROS, 1984).
On ne distingue généralement pas de
véritable abdomen, mais un post-abdomen constitué par
l'extrémité du corps très mobile. Le plus souvent, ce
post-abdomen est replié ventralement vers l'avant et l'anus s'ouvre sur
le bord dorsal de celui-ci.

Moina micrura
Diaphanosoma excisum Alona sp.
Figure III: Exemples des formes de
Cladocères (Moina micrura, Diaphanosoma excisum, Alona sp.)
Photos prises par Isumbisho (ISUMBISHO et al., 2006)
II.2.3 LES COPEPODES
Les copépodes planctoniques peuvent être
aisément séparés en Calanoïdes, Cyclopoïdes et
Harpactinoïdes (KURKI, 1993). Ces trois sous-ordres peuvent être
distingués les uns des autres par la structure générale de
la première paire d'antennes, l'urosome et la cinquième paire de
pattes. Leur corps est généralement fusiforme, constitué
de trois parties plus ou moins distinctes :
· Le céphalosome sur lequel s'insèrent les
5 paires d'appendices : les antennes généralement longues, les
mandibules, les maxilles et les maxillipèdes. Tous les appendices sauf
les antennes servent à une fonction commune qui est la nutrition
(DUSSART, 1969 cité par NYINAWAMWIZA, 1998).
· Le métasome ou thorax qui comprend
essentiellement cinq segments portant chacun une paire d'appendices assurant la
natation. Le premier segment thoracique est souvent intégré par
soudure au céphalosome d'où le nom de céphalothorax.
· L'urosome ou abdomen n'ayant, en
général, pas d'appendice et comprenant primitivement cinq
segments pouvant être soudés pour n'en former que trois ou deux
(DUSSART, 1969 cité par NYINAWAMWIZA, 1998).
Chez les Calanoïdes, il existe une séparation
nette entre le corps antérieur (composé du céphalosome et
du métasome) et le corps postérieur constitué uniquement
de l'abdomen. Chez les cyclopoïdes, le corps est plus globuleux dans sa
partie antérieure. Le cinquième segment thoracique est
séparé du corps antérieur. Il est à peu près
intégré dans le corps postérieur.
Quant aux Harpacticoïdes, les segments abdominaux ont le
plus souvent une taille analogue à celles des segments thoraciques et il
est souvent difficile de distinguer les deux parties chez ce groupe. Ce
caractère particulier fait de ce groupe le plus primitif des
Copépodes. L'urosome se termine par une furca qui est
considérée comme un ultime segment abdominal et non comme une
paire d'appendices (DUSSART, 1966, 1969 cité par NYINAWAMWIZA, 1998).
En ce qui concerne la nutrition chez les Copépodes, il
faut distinguer les formes
planctoniques et les formes benthiques ; les
premières étant plus ou moins omnivores,
les secondes
plutôt détritiphages ou carnivores. Sans tout à fait
choisir leur nourriture,
ces animaux la tiennent dans la région buccale
grâce aux mouvements très rapides de leurs maxillaires et de leurs
palpes mandibulaires, les maxilles jouant le rôle de filtre et de
sélecteurs (LOWNDES, 1935 cité par NYINAWAMWIZA, 1998).
Thermocyclops sp. (F. ad.)
Mesocyclops sp. (F.ad.)
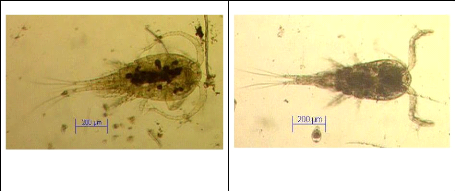
Figure IV : Exemples des formes de Copépodes
(Thermocyclops sp. (F. ad.), Mesocyclops sp. (F.ad.)) Photos
prise par Isumbisho (ISUMBISHO et al., 2006)
II.3 BIOLOGIE ET REPARTITION DU ZOOPLANCTON
II.3.1 BIOLOGIE DU ZOOPLANCTON
Les trois grands groupes zooplanctoniques ont, dans l'ensemble,
développé des stratégies de reproduction assez
différentes.
Les Rotifères sont les plus rapides à coloniser
un milieu, leur très court temps de génération compensant
largement leur faible fécondité relative. Ils apparaissent donc
comme les plus opportunistes, de même que les petites espèces de
Cladocères telles que Bosmina longistris.
La reproduction des Rotifères s'effectue
essentiellement par parthénogenèse améiotique. Celle-ci
peut être périodiquement entrecoupée d'une phase de
reproduction sexuée « parthénogenèse cyclique »,
principalement dans les populations d'étangs et de mares. Dans les lacs,
où règne un volume suffisamment important d'eau pour amortir les
variations des conditions du milieu, la reproduction sexuée peut
disparaître totalement.
Celle ci semble donc avoir pour but essentiel d'assurer la
survie des populations dans des conditions instables.
La reproduction sexuée apparaît sous l'influence
des facteurs externes (photopériode, température, densité
de population, alimentation, etc.) et endogènes (âge) (STROSS,
1971 ; HEBERT, 1978 ; POURRIOT et CLEMENT, 1981 cités par POURRIOT,
1982). Chez les Rotifères, la ponte est continue; une femelle pond entre
10 et 40 oeufs en moyenne au cours de sa vie (POURRIOT, 1982).
Les Cladocères ont une fécondité
élevée comme les Copépodes, mais affichent une
durée de vie et un temps de génération plus court que ces
derniers. Leur reproduction est parthénogénétique pendant
la plus grande partie de l'année. Elle est en suite interrompue par une
reproduction sexuée lorsque les conditions du milieu deviennent
défavorables (diminution de la température, assèchement,
surpopulation, etc.). Le nombre d'oeufs par ponte varie de 2 à 40. Les
oeufs sont portés par la femelle et protégés dans une
cavité dorsale. Il n'y a pas de stade larvaire libre. La
longévité varie selon les espèces, la température
et l'alimentation.
Les Copépodes, en revanche, ont davantage tendance
à développer une stratégie de type K (c'est á dire
que leur population est peu sujette aux variations de l'environnement et subie
la régulation densité dépendante) et sont également
plus aptes à échapper à la prédation (POURRIOT,
1982). La reproduction des copépodes est généralement
sexuée bien qu'il y ait quelques cas de parthénogenèse
chez certaines espèces. Les copépodes passent par 11 stades
larvaires avant d'atteindre le stade adulte : 6 stades nauplii (N1-N6),
morphologiquement très différents des adultes, suivis de 5 stades
copépodites (C1-C5) ; la dernière mue donnant l'adulte qui ne mue
plus (POURRIOT, 1982).
Outre l'influence primordiale de la température, la
qualité et la quantité de nourriture influent sur la croissance
et la fécondité quotidiennes des Copépodes, mais non sur
le temps de développement embryonnaire (POURRIOT, 1982).
WATTIEZ (1979), cité par POURRIOT (1982), souligne
l'interaction températurenourriture sur les variables biologiques ;
l'influence de la température étant soit tempérée,
soit accentuée par les conditions nutritives. D'autres facteurs tels que
la densité de la population peuvent agir aussi sur ces variables
(POURRIOT, 1982).
En outre, le cosmopolitisme est nettement plus marqué
chez les Rotifères que chez les Crustacés qui présentent
néanmoins une large répartition géographique. La
répartition latitudinale de quelques espèces paraît
être due à un gradient thermique et à la distribution des
ressources nutritives (POURRIOT, 1982).
On distingue les espèces eurythermes, se satisfaisant
d'une large gamme de température et des espèces
sténothermes d'eau chaude (thermophiles) ou d'eau froide
(psychrophiles). Outre la température, la salinité et
l'oxygène dissous apparaissent clairement comme des facteurs limitants.
Ainsi, le rotifère Filinia terminalis peut vivre dans une zone
où la concentration en oxygène dissous est comprise entre 0,2 et
1mg/l tandis que le cladocère Leptodora ne vit que dans les
strates bien oxygénées (POURRIOT, 1982).
La composition du peuplement zooplanctonique ne dépend
probablement des caractères chimiques des eaux douces que dans la mesure
où ceux-ci conditionnent la qualité et la quantité des
réserves nutritives disponibles. Ainsi, la plupart des espèces de
Rotifères du genre Brachionus montrent une
préférence pour les eaux alcalines et eutrophes; le rôle de
la prédation et de la compétition est alors primordial (POURRIOT,
1982).
II.3.2 REPARTITION MONDIALE DU ZOOPLANCTON
Les communautés herbivores des lacs tropicaux
présentent des similarités dans la composition
générale avec celles des lacs tempérés (RUTTNER,
1952, cité par WILLIAM, 1996).
Il existe pour le zooplancton, plusieurs endémismes
particulièrement parmi les Calanoïdes que parmi le
phytoplancton qui est caractérisé par un nombre important
d'espèces. Aussi sont présentes certaines espèces
cosmopolites qui sont familières aux zones tempérées,
particulièrement parmi les Rotifères (DUSSART, 1980 ; DUMONT et
MAAS, 1988, cités par WILLIAM, 1996).
La diversité des communautés zooplanctoniques
des latitudes tropicales n'est probablement pas plus élevée que
celle des latitudes tempérées (WILLIAM, 1996). Les lacs tropicaux
sont très similaires, pour ce qui concerne le nombre total
d'espèces et la distribution des espèces parmi les
Copépodes, les Cladocères et les Rotifères (LEWIS, 1979 ;
FERNANDO, 1980 a, b ; cités par WILLIAM, 1996). Ils sont aussi distincts
dans la rareté de groupes (taxa) zooplanctoniques (FERNANDO, 1980a, b,
cité par WILLIAM, 1996).
Les caractères chimiques des eaux douces
n'interviennent dans la répartition géographique du zooplancton
que dans la mésure où elles conditionnent la qualité et la
quantité des ressources nutritives disponibles (POURRIOT, 1982).
Ansi, les raisons qui expliqueraient les différences
de répartition géographique des communautés
zooplanctoniques à travers les latitudes seraient en relation avec la
température, le pH du système, la nature et la profondeur du lac,
la transparence et la couleur des eaux, la présence des
vertébrés et invertébrés prédateurs ou les
poissons, la salinité et l'oxygène dissous (POURRIOT, 1982).
II.4 INFLUENCE DE LA PREDATION SUR LA TAILLE ET LA STRUCTURE
DU ZOOPLANCTON
Les interactions compétitives entre les populations
zooplanctoniques se traduisent par des différences de distribution
spatiale (horizontale et verticale), temporelle et des exigences alimentaires
qui permettent la coexistence dans un même lac. Le succès de la
compétition et de la succession des populations de zooplancton peut
être influencé par la prédation des planctonophages tels
que les poissons (MICHA, 1992).
Ainsi, en Tchécoslovaquie, les lacs peu profonds
abondaient en petits Cladocères (Bosmina, Ceriodaphnia) et
Rotifères. Empoissonnés avec des Cyprinidés, la
transparence de l'eau, augmente, favorisant le développement de petites
algues planctoniques. Après enlèvement sélectif des
poissons, sont apparus soudainement de plus grands Cladocères
(Daphnia longispina) et la densité des Rotifères a
diminuée (MICHA, 1992).
Un autre exemple concerne l'introduction d'une Alose
(Clupeidae) poisson planctonophage à branchiospines fines et nombreuses
dans le lac Grystal. Avant cette introduction, le zooplancton était
représenté par deux grands Calanoïdes,
Epischura et Daphnia ; un Cyclopoïde,
Mesocyclops, ainsi que de nombreux petits Copépodes,
Diaptomus et Cyclops. Quelques dix années après
l'introduction d'une Alose dans ce lac, les grandes formes de zooplancton ont
été remplacées par les petites formes de
Cladocères, Bosmina, et de Copépodes,
Tropocyclops et Cyclops. La longueur modale des formes
numériquement dominantes a baissé de 0,8 à 0,3mm (MICHA,
1992).
Du comportement alimentaire des poissons planctonophages, on
peut retenir qu'en général les cladocères, en particulier
les Daphnidés, sont plus souvent attaqués car, ils sont
bien visibles et incapables d'échapper aux prédateurs, ils sont
plus aisément
capturés. Une prédation intense élimine
les grandes formes (herbivores ou prédateurs) permettant aux petites,
non attaquées, de dominer en profitant de la biomasse nanoplanctonique
laissée disponible par la disparition des grands herbivores. Une
prédation modérée permet la coexistence des deux groupes.
En l'absence de prédation, les herbivores planctoniques entrent en
concurrence pour les petites particules alimentaires (POURRIOT, 1982).
II. 5 MIGRATION VERTICALE ET DISTRIBUTION SPATIALE DES
CLADOCERES ET COPEPODES
La migration verticale de ces petits organismes s'effectue
quotidiennement sur des distances importantes sous le stimulus de la
lumière. Ces mouvements dont la signification adaptative n'est pas
claire, varient selon les conditions lacustres, la saison, l'âge et le
sexe des espèces (MICHA, 1992).
Toutefois, la plupart des espèces migrent vers la
surface lorsque la nuit tombe. Selon les cas, on constate un seul maximum de
densité atteint entre le coucher et le lever du soleil, ou deux maxima,
l'un à la pointe du jour et l'autre au crépuscule. Quelques
espèces présentent une migration inverse avec un seul maximum de
densité en surface pendant la journée. L'amplitude de cette
migration (1,5 à 7,6m) varie selon l'espèce et la transparence du
lac, de même que la vitesse de déplacement ascendante (1,4
à 4 m/h) ou descendante (1,4 à 4,8 m/h) (MICHA, 1992).
Une des explications de ces variations entre espèces
résulterait de leur vision différente. Par exemple,
Daphnia a une vision trichromatique avec des pics de
sensibilité plus élevée dans l'ultraviolet (3,700
Å), le bleu - violet (4,350 Å) et le jaune (5,700 Å). Chaque
espèce rechercherait sa photo - environnement optimum.
Une autre caractéristique des mouvements des
Cladocères et des Copépodes pélagiques se manifeste par
l'évitement de la zone littorale. Ainsi des individus capturés en
zone pélagique puis relâchés en zone littorale migrent
horizontalement vers le large.
La direction de la migration coïncide avec le plan de
symétrie des stimuli lumineux et l'angle de la lumière sous
l'eau. A proximité du littoral, ce plan de symétrie dépend
principalement de la position de la ligne de l'horizon. Avec
l'éloignement du littoral, l'effet de la ligne de l'horizon sur l'angle
de distribution de la lumière diminue et finalement devient
insignifiant. A ce moment, les organismes n'effectuent plus de
mouvement directionnel d'évitement du littoral. Plus
la ligne de l'horizon est élevée, cas des lacs de montagnes, plus
large est la zone proche du littoral dépourvue de crustacés
pélagiques (MICHA, 1992).
II.6 VARIATIONS SAISONIERE ET ANNUELLE DE LA BIOMASSE
ZOOPLANCTONIQUE AU LAC KIVU
Au lac Kivu, les variations saisonnières de la
biomasse zooplanctonique sont probablement dues à la variation de la
biomasse phytoplanctonique (ISUMBISHO et al., 2006). Ainsi, la
biomasse totale des crustacés zooplanctoniques atteint son maximum
pendant la saison sèche (août-septembre), bien que d'autres pics
soient observables en saison pluvieuse, spécialement en mai et en
décembre. Chaque fois, on remarque que le pic de la biomasse
zooplanctonique suit celui de la biomasse phytoplanctonique à peu
près deux à quatre semaines après (fig.V).
Quant au pic phytoplanctonique, il correspond à
l'accroissement de la zone de mélange des eaux du lac suite aux vents
forts qui soufflent sur le lac Kivu pendant la saison sèche. Les
nutriments qui étaient enfermés en profondeur reviennent vers la
couche superficielle où ils sont accessibles à l'exploitation du
phytoplancton (SARMENTO et al., 2006).

25
Figure V : Variation de la biomasse du zooplancton et du
phytoplancton en fonction de la profondeur de la zone de mélange au lac
Kivu (de février.2002 au juin 2005) [ISUMBISHO et al.,
2006]
CHAPITRE III. MATERIEL ET METHODES
III.1 SITE ET PROGRAMME D'ECHANTILLONNAGE
Notre étude a été menée au lac
Kivu dans le bassin Est au large de Kibuye. La prise des échantillons
régulière a couvert la période allant du 12/04/2005 au
25/10/2005. Elle a été effectuée à un rythme
bimensuel, soit 2 fois par mois entre 11h et 13h. Deux cycles de 24h ont
également été réalisés en
échantillonnage ponctuel le 25/10/2005, en période de pleine
lune, et le 08/11/2005, en période de nuit sans lune. Le site
d'échantillonnage a été choisi dans la zone
pélagique aux cordonnées suivantes : 02°03'10,7» de
latitude Sud et 29°18'50,7» de longitude Est. Les différentes
dates de nos sorties sur le terrain et les types d'échantillons
collectés sont repris dans l'annexe 10.
III. 2 LE MATERIEL
Le matériel utilisé est composé de :
· Filet à plancton (100u de maille) ;
· Disque de Secchi ;
· Bouteille de Van Dorn de 4 L
· Profileur multisonde (Hydrolab ® datasonde 4A) ;
· Microscope optique (marque WARD'S) ;
· Bouteilles en verre de 250 ml ;
· Flacons en plastique de 20ml ;
· Pipette pasteur graduée ;
· Cellule à numération (fabrication locale)
;
· Seringue
· GPS
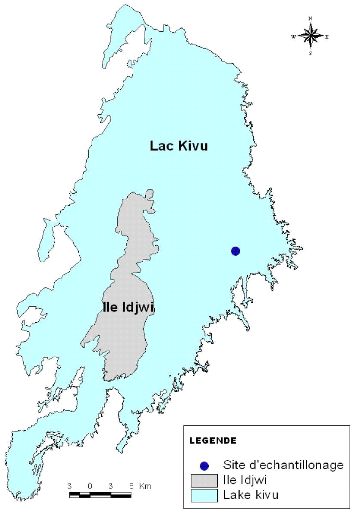
Figure VI : Localisation du site
d'échantillonnage (centre GIS, 2005)
III. 3 METHODOLOGIE
III. 3. 1 TECHNIQUES D'ECHANTILLONNAGE III.3.1.1 LE
ZOOPLANCTON
a) Echantillonnage de routine
A chaque sortie, un trait au filet à plancton (maille
de 100um, surface d'ouverture de 0,18 m2) a été
effectué verticalement sur une colonne d'eau de 60m de hauteur. Cette
colonne d'eau a été subdivisée en trois strates de 20 m
chacune (c'est-à-dire 0-20 m, 20- 40 m, 40-60 m). De cette façon,
la strate supérieure (0-20 m) correspond toujours à la zone de
mélange, la strate intermédiaire (20-40 m) correspond au
métalimnion durant la saison des pluies ou couvre une partie de la zone
de mélange durant la saison sèche, la strate profonde est
rarement incluse dans la zone de mélange (ISUMBISHO et al.,
2006). Lors de chaque prélèvement, un volume de 3,62
m3 était filtré.
En effet :
· L'ouverture du filet (diamètre ; D) est de 0,48
m
· La surface ainsi décrite est égale à
: S = (D/2)2 x 3, 14 = 0,180864 m2 La hauteur d'eau parcourue (h)
est de 20 m pour chaque strate
· Le volume filtré est donc égal à : V
= S x h = 0,180864 m2 x 20 m = 3, 61728 m3 L'échantillon
était recueilli dans un pot de 250ml.
Pour prélever le zooplancton, le filet était
descendu verticalement à l'aide d'une corde graduée, l'ouverture
vers le haut, jusqu'à la profondeur voulue. Nous le relevions ensuite
jusqu'à balayer une couche de 20m de hauteur. A cette deuxième
profondeur, un messager était envoyé pour fermer le filet qui
était ensuite remonté jusqu'à la surface de l'eau (dans la
pirogue). Après rinçage de la toile du filet,
l'échantillon contenu dans le collecteur (environ 150 ml) était
recueilli dans une bouteille en verre bien étiquetée (date et
strate de provenance) puis nous y ajoutions du formol 40% jusqu'à une
concentration finale de 4%, comme proposé par HANEY et HALL (1973), pour
la conservation.
Ainsi, à chaque sortie 3 échantillons de
zooplancton, correspondant aux trois strates de la colonne d'eau,
étaient collectés pour être analysés
ultérieurement au laboratoire sous le microscope.
b) cycles de 24h
A part l'échantillonnage régulier, deux cycles
de 24h ont été réalisés pour caractériser le
rythme de migration verticale du zooplancton au cours du
nycthémère, pendant la pleine lune et à l'obscurité
totale (respectivement à la fin du mois d'octobre et au début de
novembre). Cette fois ci, les strates échantillonnées par sortie
sont : 0-10m, 10-20m, 20-30m, 30-40m, 40-50m et 50-60m. Nous avons fait au
total quatre prélèvements au cours de chaque cycle de 24 heures
avec un intervalle de six heures entre deux prélèvements
successifs (par exemple à 12h00, à 18h00, à 24h00 et
à 6h00) ce qui fait au total 24 échantillons par cycle.
III. 3.1.2 LA LIMNOLOGIE
La transparence de l'eau a été mesurée
à l'aide d'un disque de Secchi. Ce dernier est un disque en
métal, de 20cm de diamètre, peint en cadrans noirs et blancs
alternatifs.
Pour mesurer la transparence de l'eau, ce disque est descendu
dans l'eau en position verticale à l'aide d'un fil calibré. On
note la moyenne entre la profondeur de la disparition et la profondeur de
réapparition à la remontée du disque. Les
échantillons d'eau pour l'analyse de la chlorophylle a ont
été pris également au même site. Cette fois ci nous
avons échantillonné sur une colonne d'eau de 90m à l'aide
d'une bouteille de Van Dorn de 4 L. Les échantillons étaient
collectés tous les 10 m et occasionnellement à une profondeur de
5m pour obtenir les détails de la distribution verticale des algues.
Le phytoplancton dans l'eau du lac est concentré par
filtration à travers un filtre en membrane de cellulose. Un volume d'eau
du lac, entre 3 et 4 litres, était filtré pour chaque profondeur
échantillonnée. Les pigments contenus dans le phytoplancton sont
extraits dans une solution d'acétone à 90%. Après une
double sonication de 15 minutes séparées par une nuit
entière, l'extrait était conservé au congélateur
avant d'être transporter en Belgique pour analyse en HPLC (dans le cadre
du projet ECOSYKI).
La température, la conductivité,
l'oxygène dissout et le pH de l'eau ont été mesurés
le long d'un profil de 100 m de profondeur à l'aide du profileur
multisonde HYDROLAB ® DATASONDE 4A.
III. 3. 2 TECHNIQUES D'ANALYSE
III. 3. 2. 1 PREPARATION DES ECHANTILLONS
Au laboratoire, les échantillons de zooplancton
étaient déposés sur une surface plane pour
décantation pendant au moins 48 heures avant l'aspiration du surnageant
au moyen d'un tuyau en plastique ou l'ajout du formol à 4% de
concentration pour ne garder que 100 ml de l'échantillon
concentré.
III. 3. 2. 2 PROFONDEUR DE LA ZONE EUPHOTIQUE
La limite de la zone euphotique est estimée en utilisant
la calibration faite par SARMENTO et al., (2006).
Zeu= =
Zeu : la profondeur euphotique
ZDs : la profondeur de Secchi.
å : Coefficient d'extinction ou coefficient
d'atténuation vertical de la lumière
III. 3. 2. 3 COMPTAGE DU ZOOPLANCTON ET CALCUL DES DENSITES
Après homogénéisation de
l'échantillon par agitation, 3 sous-échantillons de 1 ml chacun
ont été prélevés et observés
séparément et entièrement sur la cellule à
numération sous microscope optique (marque WARD'S) au grossissement
100x. Chaque individu rencontré a été identifié et
comptabilisé. Vu le nombre important d'échantillons à
observer, nous nous sommes limités aux grands groupes ou taxa.
La densité zooplanctonique de chaque strate a
été calculée à partir de la moyenne
arithmétique du nombre d'individus rencontrés dans les 3
sous-échantillons : cette moyenne est multipliée par 100 pour
donner le nombre d'individus de la strate, soit dans 3,61728 m3.
Pour toute la colonne d'eau (60 m de hauteur), nous avons additionné les
nombres d'individus observés dans les 3 strates; ce qui nous donne le
nombre d'individus contenus dans 10,85184 m3. La densité est
exprimée par unité de surface en divisant le nombre d'individus
ainsi obtenu par la surface d'ouverture du filet qui est de 0,180864m2.
III. 3. 2. 4 CALCUL DES BIOMASSES
La biomasse (en ug de poids sec) du zooplancton a
été estimée en utilisant la relation poids-longueur
tiré de DUMONT et al., (1975) cité par FOURNIRET (1992).
La longueur du corps des individus zooplanctoniques a été
mesurée en utilisant le microscope à oculaire gradué du
laboratoire de Biologie de l'UNR. Les individus mesurés se
répartissent comme suit : 300 Copépodes dont 100 Adultes, 100
Nauplii et 100 Copépodites; 200 Cladocères dont 50
Diaphanosoma excisum, 50 Alona rectangula et 100 Moina
micrura. Les Rotifères n'ont pas été mesurés
à cause de leur petite taille. Les relations poids-longueur
utilisées sont les suivantes :
Cyclopoïdes adultes (femelles ovigères incluses): W =
4, 9 x 10-8 L 2, 75
Avec L= longueur en um
W= poids en ug
Copépodites et Nauplii : W=1, 17 x 10-6 L 2,
20
Avec L= longueur en um
W= poids en ug
Diaphanosoma excisum : W = 1, 76 x 10 -6 L
2,11
Avec W = poids en ug
L = longueur en um
Moina micrura : W = 6, 61 L 2,37
Avec W = poids en ug
L = longueur en mm
III. 3. 2. 5 IDENTIFICATION DU ZOOPLANCTON
La détermination des espèces et
différents stades de développement des Copépodes a
été basée sur des caractères morphologiques
spécifiques observables. Pour l'identification du zooplancton,
différentes clés de détermination ont été
utilisées : (KORINEK, 1999), (AMOROS, 1984), (PONTIN, 1978), (DUSSART,
1982) et (DUSSART, 1967b).
III.3.3 DONNEES METEOROLOGIQUE
Les données météorologiques ont
été collectées à la station
météorologique du Ministère des
Infrastructures station
de Gisenyi puisque la station du projet ECOSYKI qui se trouve
à
Kibuye n'était pas encore opérationnelle. Il s'agit
de données de température de l'air (en °C),
pluviosité (en mm), fréquence des vents forts (en %
d'observations) et d'humidité relative (en % d'observations).
CHAPITRE IV. PRESENTATION DES RESULTATS ET
DISCUSSION
IV. 1 PRESENTATION DES RESULTATS
Le zooplancton du lac Kivu subit des variations importantes suit
aux différents facteurs tels que la limnologie, et les facteurs
environnementaux. Dans ce chapitre seront présentés : les
résultats des données météorologiques, des
données limnologiques, la biomasse du phytoplancton et le zooplancton
(densité, biomasse, composition spécifique et la migration
verticale).
IV.1.1 DONNEES METEOROLOGIQUES
Ces données montrent que la moyenne mensuelle de la
température de l'air atmosphérique à la station de Gisenyi
a varié entre 20 et 22°C durant la période d'avril à
octobre 2005 (fig. VII). Le pourcentage de l'humidité relative de l'air
oscillait autour de 70% avec un minimum au mois de juillet (60%) (fig.IX). Les
données des précipitations montrent un minimum des
précipitations au mois de juillet où la pluviosité
était en dessous de 25 mm par mois et un maximum au mois d'aoft (plus de
190 mm de pluie) (fig.VIII).
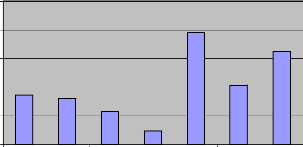
Figure VIII : Les moyennes mensuelles de la
précipitation (source : MININFRA station météorologique de
Gisenyi)
U
A

Figure IX : Les moyennes mensuelles de l'humidité
de l'air (source : MININFRA station météorologique de
Gisenyi)
L'analyse de la figure IX montre que la période d'avril,
mai et juin était la plus humide (entre 70 et 75%) tandis que le mois de
juillet était le plus sec (moins de 70%) et que l'humidité a
augmente progressivement d'aoft jusqu'en octobre.
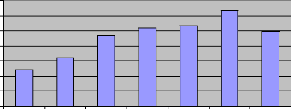
Figure X : Les moyennes mensuelles de la fréquence
des vents forts (source : MININFRA station météorologique de
Gisenyi)
L'analyse de la figureX montre que la fréquence des
vents forts a augmenté progressivement depuis le mois d'avril et a
atteint son maximum au mois de septembre puis redescend en octobre. Ce maximum
de la fréquence des vents forts qui est observable au mois de septembre,
peut justifier en partie le pic zooplanctonique observé en octobre
(fig.XIV) puisque ce dernier suit d'habitude, le passage des vents forts
(SARMENTO et al., 2006).
IV.1.2 DONNEES LIMNOLOGIQUES IV.1. 2.1 La température de
l'eau
Les profils verticaux de la température de l'eau sont
présentés à l'annexe 1. Durant la saison pluvieuse, la
température mesurée a la surface de l'eau du lac Kivu
était comprise entre 24,5 et 25,5 °C tandis qu'elle était
comprise entre 23,7 et 24,6 °C pendant la saison sèche. Ainsi,
l'eau du lac Kivu était un peu plus froide pendant la saison
sèche que pendant la saison des pluies.
La température de l'eau du lac Kivu diminue au fur et
à mesure qu'on descend en
profondeur. Cette diminution de la
température avec la profondeur dépend des
mouvements de mélange de l'eau du lac. Les profils
verticaux de la température permettent de déterminer la
profondeur de la zone de mélange (fig.XI).
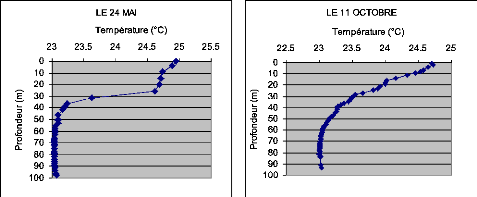

tu °C) T
24
Figure XI : Exemple de la variation de la zone de
mélange indiquée par la température
23.03
23.03
de l'eau du lac Kivu bassin de Kibuye
23.03 23.03
La figure XII montre l'évolution de la zone de
mélange au lac Kivu (bassin de Kibuye)
23.03 2303
2
C
C
i
4 5 6
Cg
C
C
(
It
g
!
F
0
I
·
C
It
(
C
tout au long de notre travail. A notre site d'étude dans
le bassin de Kibuye, la
profondeur de la zone de mélange a varié entre 30 m
et 70 m de profondeur durant la période d'échantillonnage.
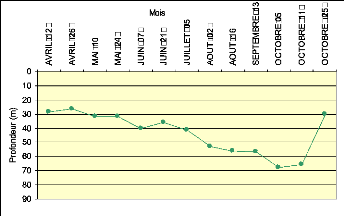
Figure XII : Profondeur de la zone de mélange au
lac Kivu bassin de Kibuye
IV.1.2.2 L'oxygène dissous
Les profils verticaux d'oxygène dissout durant toute la
période de notre échantillonnage sont présentés
à l'annexe 2. Au cours de notre travail l'oxygène dissous dans
l'eau de surface a varié entre 10mg/l et 6mg/l.
116.
5
LL
Comme la température, l'oxygène dissous diminue
progressivement avec la profondeur
-
·
=-1
dans la colonne d'eau suite á l'absence des mouvements de
brassage de l'eau. Ces mouvements sont influencés par les vents qui
soufflent sur le lac.
IV.1.2.3 La conductivité
Les profils verticaux de la conductivité de l'eau du
lac Kivu durant toute la période de notre échantillonnage sont
présentés à l'annexe 4. Contrairement aux autres
paramètres, la conductivité ne montre pas d'importantes
variations. Dans l'eau de surface, les valeurs de la conductivité
mesurée étaient comprises entre 1000 et 1500 us/cm. Cependant, la
conductivité croît dans les couches les plus profondes de l'eau du
lac Kivu (à partir de 60 m) suite à des concentrations
importantes en sels dissous.
IV.1.2.4 Le pH
Les profils verticaux du pH dans la colonne d'eau du lac Kivu
sont présentés à l'annexe 3. L'observation de la figure en
annexe montre que le pH de l'eau du lac Kivu ne varie pas beaucoup. Les valeurs
de pH mesuré dans l'eau de surface étaient de 8 unités de
pH et diminue progressivement pour devenir légèrement acide (6,6
unités de pH) à 100m de profondeur suite à l'augmentation
de la concentration en ions H+ d'après la réaction
suivante :
CO2 + H2O ? H2CO3 ? H+ + HCO3 -
- Si la concentration en CO2 est élevée ;
l'équilibre sera déplacé vers la droite : H+
augmente, donc le pH diminue.
- Si la concentration en CO2 est faible ; l'équilibre
sera déplacé vers la gauche : H+ diminue, donc le pH
augmente et HCO3 - (bicarbonates) joue le rôle de réserve de
CO2.
IV.1.2.5 Profondeur de la zone euphotique
L'absorption du rayonnement solaire est rapide dans l'eau. La
profondeur pour la quelle l'intensité de la lumière incidente est
réduite à 1% de sa valeur à la surface (zone euphotique)
varie de 17.4 à 33,7 m suivant les cas. La figure XIII montre les
différentes valeurs prises par ce facteur durant la période de
notre étude. Au lac Kivu, la limite de la zone euphotique se trouve en
moyenne à 22.6m ; elle présente un maximum au mois d'aoüt
(33.7 m) et un minimum en octobre (17.4 m) après le passage des vents
forts qui ont occasionné le brassage des eaux du lac. Suite à de
fortes vagues, la transparence n'a pas été mesurée lors de
certaines sorties d'échantillonnage ; il s'agit du 12/04/05, 05/07/05,
02/08/05 et du 05/10/05.
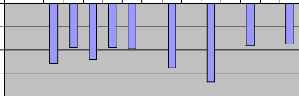
Figure XIII : Variation de la limite de la zone
euphotique dans le lac Kivu bassin de Kibuye.
IV.1.3 COMPOSITION ET TAILLE DU ZOOPLANCTON IV.1.3.1 Composition
du Zooplancton
Le zooplancton pélagique du lac Kivu, bassin Est au large
de Kibuye, est Dt
17:3
principalement composé de trois espèces de
Copépodes, Tropocyclops confinis
-
)
(KIEFER, 1930), Thermocyclops consimilis (KIEFER,
1934) et Mesocyclops aequatorialis (KIEFER, 1929) ; de trois
espèces de Cladocères, Diaphanosoma excisum (SARS, 1886)
Alona rectangula (SARS, 1862) et Moina micrura (KURZ, 1874)
ainsi que des Rotifères comprenant, Keratalla
spp. et Brachionus
quadridentatus (HERMANN, 1783).
IV.1.3.2 Taille du Zooplancton
Les échantillons du zooplancton mesuré montrent
que la taille moyenne du zooplancton du lac Kivu bassin de Kibuye est de 0,4
mm. La plus grande moyenne se rencontre chez les copépodes où la
taille moyenne est de 0,59 mm et leur nauplii présentent la plus petite
moyenne 0,16.

Dates
12-Apr-05 1.01
26-Apr-05 0.49
10-May-05 1.37
24-May-05 0.71
7-Jun-05 0.92
21-Jun-05 0.54
5-Jul-05 1.24
19-Jul-05 0.44
2-Aug-05 0.42
16-Aug-05 0.33
13-Sep-05 1.44
5-Oct-05 3.80
25-Oct-05 0.64
Biomasse totale du zooplancton (gMSm-2)
IV.1.4 VARIATION TEMPORELLE DU ZOOPLANCTON
La densité totale du zooplancton (tous les taxons
confondus), de même que la biomasse totale, varie
considérablement. L'examen de la figure XIV et du tableau VII montre que
le zooplancton pélagique du lac Kivu bassin de Kibuye a atteint son
maximum le 4 octobre 2005, avec une densité totale estimée
à 500*104 Ind./m2 et une biomasse estimée
à 3.80gMs/m2. La plus faible densité s'observe le 16
aofit où elle est estimée à 44*104
Ind./m2. La plus faible biomasse est observée le même
jour et elle est estimée à 0.33gMs/m2.
Tableau V : Biomasse totale du zooplancton
pélagique du lac Kivu bassin de Kibuye liSipillq
ITENTEMEEE5)

Figure XIV : Variation de la densité totale du
zooplancton pélagique du lac Kivu bassin de Kibuye (avril - octobre
2005)
IV.1.5. ABONDANCE RELATIVE DE DIFFERENTS GROUPES DE
ZOOPLANCTON
P.% 7"4
(17
$
i
L'abondance relative des différents groupes du
zooplancton du lac Kivu durant toute la période de notre
échantillonnage régulier sur toute la colonne d'eau (60 m) est
reprise dans la figure XV. Les copépodes dominent largement les autres
groupes, avec un pourcentage d'abondance qui varie entre 84% et 92%, les
cladocères viennent en 2eme position avec les pourcentages qui varient
entre 7% et 16% , les rotifères était très peu
représentés (moins de 2%). La faible représentation des
rotifères pourrait être expliquer par le fait que la maille du
filet à plancton utilisé était trop large par rapport
à la taille des rotifères (100um).



|
le 12 A
le 26 A
le 10 M
le 24 M,
le
7ju
le 21 ju
le 5 ji
le 19 ji
I ')
·m
|
20 m a4 c`Jm
|

Figure XV 1 9 DUDAioQ 01 O'DEoQ0DQE1111ODABH0IK ILDQ0s
OLIXSIs 0X IIRSODQcAoQ pélagique du lac Kivu bassin de
Kibuye
V.1.6 DISTRIBUTION VERTICALE DU ZOOPLANCTON
L'observation de la figure XVI, montre que la densité
du zooplancton du lac Kivu varie considérablement dans la colonne d'eau
et que le zooplancton est plus concentré dans la couche de 0 à
20m de profondeur.
Le pic zooplanctonique suit immédiatement le pic du
phytoplancton et les deux pics apparaissent lorsque la zone de mélange a
été la plus grande (c'est-à-dire atteignant une grande
profondeur); après le brassage des eaux du lac Kivu.
Tout au long des mois d'avril, mai et début de juin, la
densité du zooplancton était estimée entre
80.104 et 180.104 individus par m2. C'est au
cours de la période des mois de juillet et août que la
densité du zooplancton a été la plus faible (entre
50.104 et 60.104 indim2). Durant les mois de
septembre et octobre, la densité du zooplancton a largement
augmenté, variant de 70.104 indim2 à
500.104 indim2. La densité du zooplancton a
atteint son minimum en période de saison sèche (mois
d'aoüt), période pendant laquelle le zooplancton atteignait son
maximum de densité normalement. Ceci pourrait être expliqué
par les changements climatiques qu'a connu la sous région. Par exemple
les données météorologiques collectées à la
station de Gisenyi montrent que c'est au mois d'aoüt qu'on a
enregistré plus de pluies (fig.IX).
Signalons qu'au début du mois d'octobre, la couche
allant de 40 à 60 m de profondeur qui était d'habitude la moins
peuplée par le zooplancton (KANINGINI, 2003) s'est retrouvée avec
plus de 100.104 indim2 en date du 4 octobre 2005.

Figure XVII : Relation entre la transparence de l'eau du
lac Kivu et la moyenne mensuelle de la densité du
zooplancton
L'examen de la figure XVII révèle qu'en moyenne,
aux valeurs les plus élevées de la
de leau du lac
densité zooplanctonique correspondent les valeurs les
plus basses de la transparence de
0 12
l'eau du lac Kivu et inversement ; la valeur la plus
élevée de la densité zooplanctonique
0 8 D tot
0 s'observe au mois d'octobre où la transparence se trouve
à son minimum. Le coefficient
V
Transparence
4
de corrélation négatif (R= -0,71) indique une
relation négative entre les deux variables.
0
Cependant, seul le zooplancton ne peut pas justifier la
transparence de l'eau du lac, si
A M J J A S O
non la transparence trouvée au mois de septembre et
octobre ne serait pas au même
niveau que celle trouvée au mois
de juin. Bref, la transparence de l'eau est influencée
par les
matières en suspension ; phytoplancton, zooplancton, détritus,
etc. et le

tion des
se (/C
co
5'
3
0. CD CP
0
0
CD4
a.
zooplancton augmente sa densité lorsqu'il y a plus de
nourriture (le phytoplancton majoritairement) disponible pour lui. La figure
XVIII reprend une comparaison entre la variation de la biomasse zooplanctonique
et celle phytoplanctonique durant une partie de notre travail sur le train.
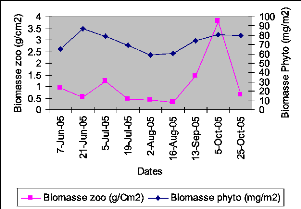
Figure XVIII : Variation de la biomasse du zooplancton et
du phytoplancton pélagique au lac Kivu bassin de Kibuye de 0 à
100m de profondeur (juin-octobre 2005)
V.1.7 MIGRATIONS VERTICALES DU ZOOPLANCTON
Les migrations verticales du zooplancton ont été
analysées à la fin du mois d'octobre et
au début de
novembre lors de deux cycles de 24h, l'un en pleine lune, le 25 octobre,
90
l'autre durant l'obscurité totale, le 11 novembre 2005.
La migration de chaque taxon a
70
été suivie et les copépodes adultes et leurs
nauplii ont été suivis séparément.
50
40
v
a. Cycle de 24 heures du 25 octobre 2005 (pleine
lune)
0
Figure XIX : Migration verticale des copépodes du
lac Kivu basin de Kibuye en pleine lune (le 25/10/2005)
La fig. XIX montre que les copépodes adultes, toujours
présents en grande quantité dans la couche superficielle,
augmentent leur densité dans la couche de 0 à 10 m et le pic de
migration verticale de ces copépodes adultes se manifeste à 18H
en période de pleine lune.

Figure XX : Migration verticale des Nauplii du lac Kivu
basin de Kibuye en pleine lune (le 25/10/2005)
L'observation de la fig. XX montre que la migration verticale
des nauplii n'est pas orientée vers la surface comme le faisaient les
adultes, au contraire les nauplii migrent en profondeur est présentent
le pic de leur migration à 6H du matin à une profondeur de
30m.
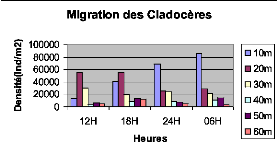
Figure XXI : Migration verticale des Cladocères du
lac Kivu basin de Kibuye en pleine
40m
lune (le 25/10/2005)
12H 18H
L'observation de la fig. XXI montre que les Cladocères
migrent vers la surface le matin à 6H et présentent le pic de
migration dans la couche de 10m de profondeur.
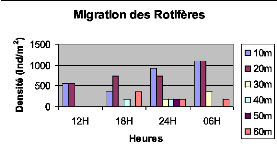
Figure XXII : Migration verticale des Rotifères du
lac Kivu basin de Kibuye en pleine lune (le 25/10/2005)
L'observation de la fig. XXII montre que les Rotifères
migrent vers la surface le matin à 6H et présentent le pic de
migration dans la couche de 0 à 20m de profondeur.
b. Cycle de 24H du 08 novembre 2005 (nuit sans
lune)
20m

ion des
8H 24H 06
50m
Figure XXIII : Migration verticale des Copépodes
adultes du lac Kivu bassin de Kibuye
40m
en période de nuit sans lune (le
08/11/205)
50m
0
L'examen de cette fig. XXIII montrent que les Copépodes
adultes migrent vers la surface et manifestent leur pic de migration dans la
couche de 0 à 10m de profondeur à 19H en période de nuit
sans lune.

Figure XXIV : Migration verticale des Nauplii du lac Kivu
bassin de Kibuye en période de nuit sans lune (le
08/11/2005)
La fig. XXIV montrent que les nauplii migrent en profondeur et
présentent le pic dans la couche de 20 à 30m de profondeur
pendant la nuit 19H et 01H en période de nuit sans lune.

Figure XXV : Migration verticale des Cladocères du
lac Kivu bassin de Kibuye en
30m
période de nuit sans lune (le
08/11/2005)
40m
L'examen de la fig. XXV montre que les Cladocères
restent présentes en grande quantité dans
60m
Dates
la couche de 0 à 10m. Les mouvements migratoires des
Cladocères en période de nuit sans
lune ne sont pas remarquables puisqu'ils sont stimulés
par la lumière. Donc la migration des Cladocères du lac Kivu
bassin de Kibuye varie suivant la position de la lune. C'est-à-dire
qu'en pleine lune ils migrent et au crépuscule ils ne migrent pas.
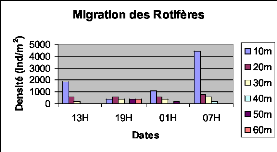
Figure XXVI : Migration verticale des Rotifères du
lac Kivu bassin de Kibuye en période de nuit sans lune (le
08/11/2005)
L'observation de la fig. XXVI, montre qu'en période de
nuit sans lune les Rotifères migrent vers la surface le matin à
7H.
D'une façon générale la migration du
zooplancton du lac Kivu bassin de Kibuye (à
l'exception des
cladocères) ne serait pas influencée par la lumière
lunaire, car le pic de
10m
densité pour les copépodes se manifeste à
18H en pleine lune et à 19H en période de
20m
nuit sans lune. Nous pouvons conclure que les copépodes du
lac Kivu bassin de Kibuye
4
migreraient vers la surface pendant la nuit. Quant au nauplii,
ils se concentreraient en
50m
13
profondeur à 30m surtout pendant la nuit. Les
cladocères eux migreraient vers la surface
60m
Dates
le matin en pleine lune mais en période de nuit sans
lune ils semblent ne pas migrer de façon significative. Les
rotifères eux migreraient vers la surface le matin sans toutefois
être influencés par la position de la lune.
IV. 2 DISCUSSION ET INTERPRETATION
Les échantillons du zooplancton et des
paramètres physico-chimiques de l'eau du lac Kivu bassin de Kibuye ont
été collectés d'avril à novembre 2005.
La transparence moyenne de l'eau du lac Kivu bassin de Kibuye
était estimée à 6,8m. La limite de la zone euphotique
variait entre 17 et 34m de profondeur. Cette zone est plus large au mois de
juillet et août, tandis qu'en septembre et octobre elle est la plus
petite.
La grandeur de la zone euphotique varie avec la concentration
des matières en suspension tel que le plancton. La remontée des
nutriments est due aux vents forts qui provoquent les mouvements de brassage
dans la colonne d'eau, et occasionne un bloom planctonique. Ce qui provoque une
diminution de la transparence de l'eau.
Au bassin de Bukavu, KANINGINI et al., 2003 ont
trouvé une transparence inférieure à celle trouvée
à Kibuye parce que au bassin de Bukavu les eaux du lac se
mélangent complètement jusqu'à une profondeur de 100 m
tandis qu'à Kibuye la zone de mélange ne dépasse pas 70m
de profondeur. C'est la morphologie du bassin versant qui est à
l'origine de cette petite taille de la zone de mélange à Kibuye,
pourtant la profondeur maximale du lac est plus large à Kibuye
qu'à Bukavu. Ainsi, la plus grande quantité des nutriments reste
enfuie en profondeur et ne remonte jamais à la surface où elle
pourrait être exploitée par le plancton et influencer la
transparence de l'eau.
Le zooplancton pélagique du lac Kivu, bassin de Kibuye,
connaît des fluctuations mensuelles variables suivant la
disponibilité de la nourriture. La plus forte densité a
été observée en octobre puisque les vents forts ont
été plus intenses en septembre. En 1959, KISS a dit que le
zooplancton du lac Kivu subit des fluctuations saisonnières qui
atteignent un pic vers août - septembre après le brassage des eaux
pendant la grande saison sèche. MAHY (1979) signale que le zooplancton
du lac Kivu augmente deux fois par an : après le brassage de la grande
et de la petite saison sèche respectivement. En réalité,
on peut dire que l'abondance du zooplancton du lac Kivu suit le passage des
vents forts qui provoquent le brassage. Nous avons observé la plus
grande densité du zooplancton au début d'octobre ce qui suit le
pic des vents forts observés en septembre. La plus faible densité
observée au mois d'aoüt pourrait être justifiée par la
diminution de la biomasse phytoplanctonique (fig. XVII).
Concernant la distribution verticale du zooplancton
pélagique au bassin de Kibuye ; c'est la
couche de 0 à 20m de
profondeur qui est la plus peuplée. La densité du zooplancton
diminue
avec la profondeur, suivant les paramètres physico-chimiques
tels que l'oxygène dissous, la
température et la lumière et les
paramètres biologiques tel que le phytoplancton. Cette distribution ne
dépasse jamais la limite de l'oxygène dissous (60m), puisque le
zooplancton est aérobie.
FOURNIRET, 1992, ISUMBIHO et al., 2006 et KANINGINI
et al. 2003 ont trouvé la même chose dans la partie nord
du lac, à Ishungu et à Bukavu respectivement. La couche
superficielle remplit toutes les conditions nécessaires à la vie
du zooplancton; dans cette couche se trouvent la zone de mélange et la
zone euphotique ainsi le phytoplancton trouve les nutriments et réalise
la photosynthèse, l'oxygène dissous y est plus concentré
que dans d'autres couches, le pH est légèrement basique, la
température est favorable etc.
Les copépodes dominent d'autres groupes du zooplancton
au lac Kivu, puisque l'introduction du L. miodon a
entraînée les modifications dans la composition zooplanctonique de
ce lac. Il y a eu la disparition du Daphinia curvirostris qui est une
espèce de cladocères et la domination numérique du
zooplancton par les copépodes. SZLAUER, 1965 et DRENNER et al.
1978 soulignent que les copépodes sont capables de résister
à la prédation des poissons planctonophages par leurs mouvements
migratoires.
STRICKLER, 1997 précise que les copépodes sont
favorisés par rapport aux cladocères, puisque le L
.miodon est un prédateur visuel. ISUMBISHO et al., (2006)
précisent que la domination numérique des copépodes est
une caractéristique importante des lacs habités par le L.
miodon. Avant l'introduction du L. miodon au lac Kivu, le
zooplancton était dominé par les cladocères. Mais
après cette introduction, les rotifères ont succédé
aux cladocères jusqu'à 1995 oü KANINGINI a trouvé la
domination numérique des copépodes.
Toute chose étant égale par ailleurs, la maille
du filet à plancton utilisé (100um) dans l'échantillonnage
pourrait laisser échapper certains rotifères et cladocères
de très petite taille. Toutefois, les résultats qu'a
trouvé ISUMBISHO et al., 2006 avec un filet à plancton
de 55 um confirment la domination numérique des copépodes dans le
lac Kivu. Ce qui fait que la faible représentativité des
rotifères et des cladocères dans nos échantillons n'a rien
à voir avec le vide des mailles du filet à plancton que nous
avons utilisé. Néanmoins, nous ne pourrons pas ignorer que la
composition spécifique des rotifères pourrait être plus
grande si le filet été de plus petite maille.
Dans la zone pélagique du bassin de Kibuye, les
copépodes sont représentés par 3 espèces qui sont
toutes les cyclopoïdes. Les cladocères étaient
représentés aussi par 3 espèces. Les rotifères eux
étaient représentés par 2 espèces seulement. A
Ishungu, ISUMBISHO et al., 2006 ont trouvé aussi 3
espèces de copépodes, 4 espèces de cladocères et 11
espèces de
rotifères. Les rotifères pourraient être
représentés par beaucoup plus d'espèces si le filet
à plancton que nous avons utilisé au bassin de Kibuye
n'était pas de 100 um de maille puis que certaines espèces sont
de plus petite taille.
Au bassin du nord, à l'aide d'un filet de 50 um
FOURNIRET, 1992 a trouvé 4 espèces de cladocères, 3
espèces de copépodes et 5 espèces de rotifères.
Les crustacés pélagiques du lac Kivu bassin de
Kibuye (copépodes et cladocères), migrent vers la surface la nuit
et descendent en profondeur le jour. La migration verticale des
copépodes adultes n'est pas influencée par le cycle lunaire comme
l'a précisé ISUMBISHO et al., 2003. Par contre, les
cladocères ne migrent pas de façon significative en
période des nuits sans lune. Cette migration verticale des
crustacés pélagiques au bassin de Kibuye serait motivée
par la lumière solaire, la recherche de la nourriture et l'esquive
à la prédation des planctonophages.
Les profiles verticales de la conductivité sont les
mêmes durant toute la période qu'a couvert notre travail. La
structure de la colonne d'eau est influencée par les facteurs
météorologiques puisque la profondeur de la zone de
mélange (mixolimnion) augmente et atteint 60-70m de profondeur à
même temps que le passage des vents forts sur le lac. Lorsque la
fréquence des vents forts n'était pas encore plus grande la zone
de mélange ne dépassait pas 40m de la profondeur. En
réalité, la vitesse des vents forts augmente dans le rift valley
pendant la saison sèche.
Ainsi, l'augmentation de la vitesse du vent et la diminution
de la température de l'eau de surface sont à la base de
l'augmentation de la zone de mélange, mais cette dernière ne
pourra pas dépasser 70m de profondeur.
Au lac Kivu bassin de Kibuye, la chimiocline est stable et sa
stabilité résulte d'une importante augmentation de la
densité de l'eau à partir de 70m de profondeur comme l'ont
signalé [DEGENS et al., 1973 cité par ISUMBISHO et
al., 2006].
Au bassin de Kibuye, la stratification verticale de la colonne
d'eau est bien visible sur le profil
vertical de l'oxygène dissous,
de la température et du pH. Cependant, cette stratification n'est
pas
stable et elle disparaît en période de brassage et
réapparaît après le passage des vents forts.
52
CONCLUSION ET RECOMMANDATIONS
D'avril à novembre 2005, des échantillons d'eau
et de zooplancton ont été prélevés dans la zone
pélagique du bassin de Kibuye (partie Est du lac Kivu). Les
résultats obtenus indiquent ce qui suit :
- Le zooplancton du lac Kivu (Bassin de Kibuye) comprend 3 grands
taxa ; les Copépodes, les Cladocères et les Rotifères.
- Numériquement, les Copépodes
(Thermocyclops consimilis, Mesocyclops aequatorialis,
Tropocyclops confinis, copépodites et Nauplii) sont les plus
abondants suivis des Cladocères (Diaphanosoma brachyurum,
Alona rectangula et Moina micrura) et des Rotifères
(Brachionus quadridentatus et Keratella spp.) qui sont les
moins abondants.
- Le zooplancton est concentré dans les eaux
superficielles où les conditions favorables (l'abondance algale,
l'oxygène dissous, la température...) à leur survie
semblent être réunies.
- La plus grande densité du zooplancton
pélagique du lac Kivu s'observe jusqu'à une profondeur de 20m et
diminue progressivement dans la colonne d'eau jusqu'à 60m de
profondeur.
- La migration verticale du zooplancton pélagique du lac
Kivu bassin de Kibuye n'est pas influencée par la lune, à
l'exception des cladocères.
L'examen des fluctuations de la densité du zooplancton
ont révélé que les périodes de forte abondance sont
en relation avec les vents violents qui soufflent sur le lac. Ces
périodes de forte abondance se produisent quelques semaines après
le passage des vents violents sur le lac dont la périodicité et
la fréquence entretiennent les mécanismes de productivité
biologique du lac Kivu. Les vents saisonniers paraissent donc être les
principaux facteurs qui provoquent une diminution de la transparence des eaux
de surface comme c'est le cas dans le lac Tanganyika.
A la fin de ce travail nous trouvons que nos hypothèses
ont été vérifiées et que nos objectifs ont
été atteints.
Après cette étude nous recommandons ce qui suit
:
- Une étude comparative entre le zooplancton de la zone
pélagique et celui de la zone littorale permettrait de bien mettre en
évidence la distribution
horizontale des différentes espèces du zooplancton
au lac Kivu, bassin de l'Est.
- L'opportunité de poursuivre cette étude sur
une longue période en combinaison avec une étude du
phytoplancton, de la production primaire, de l'abondance des nutriments et des
paramètres physico-chimiques permettrait de bien élucider le
fonctionnement biologique du lac Kivu.
- Une étude génétique visant
l'identification plus précise des espèces du zooplancton du lac
Kivu s'avère aussi nécessaire.
- Une étude de l'abondance relative et de la migration
verticale de chaque espèce s'avère aussi nécessaire.
54
REFERENCE BIBLIOGRAPHIQUE
1. AMOROS, C., 1984, Introduction pratique à la
systématique des organismes des eaux continentales françaises.
Crustacés Cladocères. Bulletin de la société
Linnéenne de Lyon 53(3):72-107;
53(4):120-144
2. BANA, M., 2005, La faune ichtyologique du lac Kivu:
Relations interspécifiques entre proies et prédateurs.
Mémoire présenté en vue de l'obtention du grade de
Licencié en Biologie. UNR. 184p.
3. BEADLE, L.C., 1981, The inland waters of tropical Africa, an
introduction to tropical limnology. 2nd ed. Longman, London. 475
p.
4. BEGG, G., 1976, The relationship between the diurnal
movement of some of the zooplankton and the sardine Limonothrissa
miodon in Lake Kaliba. Limnology and Oceanography
21:529-539.
5. BOUGIS, P., 1974, Ecologie du plancton marin I. Le
phytoplancton. Masson, Paris, 200p
6. BWEBWA, D., 1996, Variations saisonnières et
spatiale dans l'abondance de la communauté pélagique du
zooplancton, l'extrémité nord du lac Tanganyika. FAO/FINNIDA
Recherche pour l'Aménagement des péches au lac Tanganyika.
GCP/RAF/271/FIN-TD/50 (Fr): 17p.
7. CAPART, A., 1960, Le lac Kivu. Les naturalistes belges,
41 : 397-417.
8. COLLART, A., 1960, L'introduction du Stolothrissa
tanganyikae (Ndagara) au Lac Kivu. Bulletin Agriculture Congo Belge,
60 : 975-985
9. COMPERE, P., 1974, Algues de la région du lac Tchad
II. 198p.
10. DEGENS, E. T., HERZEN R. P. V., WONG H. K., DEUSE W. G.
& JANNASCH H. W., 1973, Lake Kivu: Structure, Chemistry and Biology. Geol.
Rundschau, 245- 75.
11. DE IONGH, H. H., P. C. SPLIETHOFF & V. G. FRANK.,
1983, Food preferences and feeding habitats of the clupeid Limonothrissa
miodon (Boulenger), in Lake Kivu. Hydrobiologia 102:
113-122.
12. DESCY, J. P., 1990, Etude de la production planctonique au
lac Kivu. Projet PNUD/FAO-RWA/87/012. Rapport de mission (26/09/90-08/10/90),
34 p.
13. DESCY, J. P., 1992, Ecologie des eaux continentales. Notes
de cours Facultés Universitaires NOTRE-DAME de la Paix NAMUR.
14. DRENNER, R. W., J. R. STRICKLER & W. J. O'BRIEN.
1978, Capture probability: the role of zooplankton escape in the selective
feeding on planktivorous fish. J. Fish. Res. Bd. Con.,
35:1370-1373.
15. DUMONT, H. J., I. VAN DE VELDE & S. DUMONT., 1975,
The Tanganyika Sardine in Lake Kivu: another ecodisaster for Africa?
Environmental conservation 13:143-148.
16. DUMONT, H. J., 1986, The Tanganyika Sardine in Lake Kivu:
another Ecodisaster for Africa? Environmental Conservation, 13, 143-148
17. DUSSART, B., 1966, Limnologie : l'étude des eaux
continentales, Gautier-villars, Paris 678 p.
18. DUSSART, B., 1967b, Les copépodes des eaux
continentales d'Europe occidentale.II. Cyclopoïdes et Biologie.
Boubée & Cie, Paris, 292p.
19. DUSSART, B., 1969, Les copépodes des eaux
continentales d'Europe occidentale, Tome II : Cyclopoïdes et Biologie,
Edition boubée et cie, Paris -- France 264 p.
20. DUSSART, B., 1982, Faune de Madagascar: Crustacés
Copépodes des eaux intérieures. ORSTOM-CNRS, Paris, 146pp.
21. EYELMANN, F., 1887. Beitrag zur systematik der
europäischen Daphniden. Ber. Naturf. Ges. Freiburg 887 :1-88.
22. FOURNIRET, Y., 1991, Analyse du zooplancton du lac Kivu.
Echantillonnage d'octobre 1990. Rapport interne UNECED: 14pp.
23. FOURNIRET, Y., 1992, Etude du zooplancton du lac Kivu et
relations avec son prédateur : Limonothrissa miodon
(échantillonnage de mai juin 1990). Rapport scientifique UNECED
(FUNDP/Namur), 16p.
24. GLIWICZ, Z. M., 1986, A lunar cycle in zooplankton.
Ecology 67:883-897.
25. GREEN, J., 1985, Horizontal variations in associations of
zooplankton in lake Kariba. Journal of zoology,
206:225-239.
26. GREEN, J., 1990, Zooplankton associations in Zimbabwe.
Journal of zoology, 222:259-283.
27. HANEY, J. F. & HALL D. J., 1973, Sugar-coated Daphnia: A
preservation technique for Cladocera. Limnol. Oceanogr., 18,
331-333.
28. HARWANIMBAGA, C., 1987, Etude préliminaire de la
population planctonique de quelques étangs piscicoles de Rwasave: Une
contribution à l'étude du régime alimentaire de
Tilapia nilotica (T). Mémoire, Fac. des Sciences UNR 94p
29. HECKY, R. E. & KLING, J., 1987, Phytoplancton ecology
of the great Lakes in the rift valleys of Central Africa. Archive für
Hydrobiologie Beihefte Ergebnisse der Limnologie 25:
197-228.
30. ISUMBISHO, M., 2000, Régime alimentaire des larves
et juvéniles de Limnothrissa miodon (Boulenger, 1906) dans le
lac Kivu, R. D. Congo. Mémoire présenté en vue du DES en
aquaculture. Université de Liège, Faculté des sciences,
31p.
31. ISUMBISHO, P., KANINGINI; DESCY, J.P et BARAS, E., 2004,
Seasonal and diel variations in diet of The youngstages of the fish
Limonothrissa miodon in Lake Kivu, Eastern Africa. Jour. Trop. Ecol.,
20: 73-83.
32. ISUMBISHO et al., (2006), Composition, abundance
and spatial distribution of zooplankton in Lake Kivu, Eastern Africa. Jour. of
plankton research., 28:1-15
33. KANINGINI, M., 1995, Etude de la croissance, de la
reproduction et de l'exploitaton de Limnothrissa miodon du lac Kivu,
Bassin de Bukavu (Zaïre). Thèse de doctorat, UNECED, Namur,
211p.
34. KANINGINI, M., J. C. MICHA, J. VANDENHAUTE, J. P.
PLATTEAU, H. WATONGOKA, C. MELARD, M. K. WILONDJA & M. ISUMBISHO, 1999,
Pêche du Sambaza au filet maillant dans le lac Kivu. Rapport final du
Projet ONG/219/92/Zaïre. Presses universitaires de Namur, Namur, 187 p.
35. KANINGINI, M., ISUMBISHO, P., NDAYIKE N., & MICHA, J.
C., 2003, Etude du zooplancton du lac Kivu : Composition, variation d'abondance
et distribution. Bull. Séanc. Acac. R. Sci. Outre-mer49 :
145-160.
36. KISS, R., 1959, Analyse quantitative du zooplancton du lac
Kivu. Fol. Scient. Afr. Centr. 5: 78-80.
37. KISS, R., 1966, Le lac Kivu. Chronique de l'I. R. S. A. C,
Tome 1 n°1, 20-28.
38. KORINEK, V., 1999, A guide to limnetic species of
cladocera of Africa inland waters (Crustacea, Branchiopoda) (using the
morphology of parthenogenetic females). International Association of
Theoretical and Applied Limnology, no1, Geneva, 57p.
39. MAHY, G., 1979, Etude Rwandaise. Vol. XII, n°3:
Biologie et écologie du lac Kivu. UNR, 108p.
40. MANDIMA, J. J., 1999, The food and feeding behavior of
Limnothrissa miodon [Boulenger, 1906] in Lake Kariba, Zimbabwe.
Hydrobiologia 407:175-182.
41. MANDIMA, J. J., 2000, Spatial and temoral variations in
the food of the Sardine Limnothrissa miodon [Boulenger, 1906] in Lake
Kariba, Zimbabwe. Fisheries Research 48:197-203
42. MARSHALL, B. E., 1991, The impact of the introducted
Sardine Limnothrissa miodon on the ecology of Lake Kariba, Zimbabwe,
Biological Conservation 55:151- 648.
43. MARSHALL, B. E., 1993, Biology of the African
Limnothrissa miodon with reference to its small size in artificial
lakes. Reviews in Fish Biology and fisheries 3: 17-38.
44. MASILIYA, P., 2001, Contribution à l'étude du
zooplancton du lac Kivu. Mémoire, ISP Bukavu, 45p.
45. MICHA, J. C., 1992, Ecologie des eaux continentales. Notes
de cours Facultés Universitaires NOTRE-DAME de la Paix NAMUR.
46. MIZUNO, T., 1986, Vertical distribution of Plankters in
the northern part of Lake Tanganyika. Research on the Population Ecology of
Aquatic Organisms in Lake Tanganyika. I: 25-27.
47. MUKANKOMEJE, R., 1984, Etude de la biologie de
Tilapia (Sarotherodon) nilotica L., Comparaison avec
Tilapia (Sarotherodon) Microchir Blgr., deux espèces
commercialement exploitées dans le lac Ihema (RWANDA). Mémoire
FUNDP. 148 p.
48. MULIMBWA, N., 1987, Vertical distribution of zooplankters
in lake Tanganyika from september 1983 to august 1984. Ecological and
limnological study on Lake Tanganyika and its adjacent regions.
IV: 59-61.
49. MULIMBWA, N., 1988, Seasonal changes in abundance of
plankters in the northwestern end of Lake Tanganyika during 1987, Ecological
and Limnological study on Lake Tanganyika and its adjacent regions.
V: 57-60.
50. MULIMBWA, N., 1991, Seasonal changes in abundance of
plankters in the northwestern end of Lake Tanganyika. Ecological and
Limnological study on Lake Tanganyika and its adjacent regions.
VII: 96-97.
51. MULIMBWA, N. & BWEBWA, D., 1987, Seasonal changes in
vertical distribution of zooplankters in Lake Tanganyika. Ecological and
Limnological study on Lake Tanganyika and its adjacent regions.
IV: 119-121.
52. NARITA, T. T., MULIMBWA, N., & MUZUNO, T., 1986,
Vertical distribution and seasonal abundance of zooplankters in Lake
Tanganyika. African Study Monographs 6:1-16.
53. NYINAWAMWIZA, L., 1998, Effet de la fertilisation des
étangs avec Azolla sur la production du zooplancton et d'Oreochromis
niloticus à la Station Piscicole de Rwasave. Mémoire UNR.
97p.
54. PONTIN, R. M., 1978, A key to British freshwater
Planktonic Rotifera. Scientific publications 38, Freshwater Biological
Association. Titus Wilson & Son Ltd, Kendal, 178pp.
55. POUCLET, A., 1978, Les communications entre les grands
lacs de l'Afrique Centrale. Implication sur la structure du rift occidental.
Mus. Roy. Afr. Centr; Dept Geol. Min; Rapp. Ann.1977,
145-155.
56. POURRIOT, R., 1982, Ecologie du plancton des eaux
continentales Massons, Paris, 198p.
57. REYNTJENS, D., 1982, Bijdrage tot limnolobie van het
Kivu-meer. Werk van einde studien voorgedragen tot het behalen van de graad van
landbouwheendig Ingenieur, Rijksuniversiteit Gent, 89 p.
58. SIMBERLOFF, D., 1995, Why do introduced species appear to
devastate islands more than mainland areas? Pacific Science
49:87-97.
59. SNOEKS, J., 1994, The Haplochromines (Teleostei,
Cichlidae) of lake Kivu (East Africa): a taxonomic revision with notes on their
ecology. Ann. Mus. Roy. Afr. Centr., Sc. Zool. 270:221p.
60. SNOEKS, J., DE VOS, L. & THYS VAN DEN AUDENAERDE, D.,
1997, The ichtyogeography of Lake Kivu. South African Journal of Science,
93:579-584.
61. STRICKLER, R. J., 1997, Observations of swimming
performances on planktonic Copepods. Limnol. Oceanogr., 22
:165-170.
62. SZLAUER, L., 1965, The refuse ability on plankton animals
before plankton eating animals. Pol. Arch. Hydrobiol.,
13:89-95.
63. TALLING, J. F., and LEMOALLE, J., 1998, Ecological dynamics
of tropical inland waters. Cambridge Univ. Press, Cambridge, 271p.
64. TIETZE, K., GEYH, M., MULLER H., SCHRODER, L., STAHL, W.
& WEHNER, M., 1980, The genesis of the methane in Lake Kivu (Central
Africa). Geologische Rundschau 69:452-472.
65. VANDEN BOSSCHE, J. P. & BERNACSEK, G. M., 1990,
Source book for the inland fishery resources of Africa, 1. CIFA Technical
paper, N°18.1, Rome, FAO, 240 p.
66. VERBEKE, J., 1957, Recherches écologiques sur la
faune des grands lacs de l'Est du Congo Belge. Exploration Hydrobiologique des
Lacs Kivu, Edouard et Albert 1952-54. Institut Royal des Sciences Naturelles de
Belgique, Bulletin 3:1-177.
67. WETZEL, R. G., 1983, Limnology, 2nd edition.
Sanders collège publishing, USA, 753 p.
68. WILLIAM, M., 1996, Tropical lakes: how latitude makes a
difference. SPB, Academic publishing by, Amsterdam, the T. Neyherlands, 7p.
ANNEXES



