I.3 LES FACTEURS BIOTIQUES
Le lac Kivu étant méromictique, sa biozone
s'étend au maximum jusqu'à 60 m de profondeur au-delà de
laquelle toute vie aérobie est impossible et seulement 12% de son volume
total est habitable par les poissons (BEADLE, 1981 ;TIETZE et
al.,1980).
I.3.1 La flore
Les connaissances sur le phytoplancton et le plancton en
général du lac Kivu, sa
biomasse, sa production et son
évolution temporelle sont très fragmentaires.
Cependant,
quelques études faites par HECKY et KLING (1987) et par
DESCY (1990) nous
renseignent sur le fait que le phytoplancton du lac Kivu est
dominé par les Cyanophytes et les Chlorophytes qui représentent
à eux seuls 70 à 90% de la biomasse phytoplanctonique. L'autre
groupe qui est significativement représenté est celui des
Péridiniens.
En mars 1972, HECKY et KLING (1987), ont constaté que
le phytoplancton du lac Kivu était beaucoup plus abondant que dans les
lacs Malawi et Tanganyika à la même époque. SARMENTO et
al., (2006) souligne que le phytoplancton du lac Kivu est dominé
par les Diatomées et des Cyanobactéries. Les espèces
pélagiques les plus communes étant :
· Les Diatomés : -Nitzschia bacata
Hust.
-Fragilaria danica Lange-Bert
· Les Cyanobactéries :- Planktalyngbya limnetica
Lemm.
-Synechococcus sp.
· Les Diatomés centriques :-Urosolenia
sp. Et quelques Microcystis sp. (SARMENTO
et al., 2006).
Il existe une grande différence de concentration en
chlorophylle-a (chla) et de biomasse phytoplanctonique en général
entre le lac Kivu (76,9mg/m2 au bassin sud) et le lac Tanganyika
(37,4mg/m2 à Kigoma ; SARMENTO et al., 2006).
I.3.2 La faune
I.3.2.1 Le zooplancton
Le zooplancton du lac Kivu est composé des
Copépodes, des Cladocères et des Rotifères. D'après
ISUMBISHO et al, (2004) la composition spécifique du
zooplancton du lac Kivu a connue des modifications au cours du temps suite
à l'introduction de Limnothrissa miodon pour lequel il est un
aliment de haute importance. La composition du zooplancton du lac Kivu avant et
après cette introduction est reprise dans le tableau II.(MASILIYA,
2001).
Tableau !! : Tableau synthétique du
zooplancton du lac Kivu avant et après l'introduction de L.
miodon (MASILIYA, 2001)
TAXON
|
Avant introduction
|
Après introduction
|
|
1981
|
1990
|
1995
|
Copépodes
|
++
|
+
|
+
|
+++
|
Cladocères
|
+++
|
-
|
-
|
+
|
Rotifères
|
+
|
+++
|
+++
|
-
|
|
- = très peu nombreux, + = peu nombreux, ++ = nombreux,
+++ = très nombreux
Selon VERBEKE (1957), en 1953 le zooplancton du lac Kivu
était dominé par de grands cladocères et copépodes
avec très peu de rotifères. Il y avait très peu
d'espèces en milieu pélagique et la taille moyenne du zooplancton
était de 0,6mm. Cependant, en 1981 ; REYNTJENS a constaté un
grand changement dans la composition et dans la biomasse du zooplancton dü
probablement à l'introduction de Limnothrissa miodon. Ainsi,
les rotifères dominaient le lac Kivu avec 8 espèces et les
cladocères n'étaient représentés que par 4
espèces de petite taille. La taille des cyclopoïdes a
été diminuée de moitié, et il y'a eu la disparition
de l'espèce la plus grande des cladocères, Daphnia
curvirostris, et le cilié Stentor coerulens est devenu
l'espèce la plus abondante REYNTJENS (1982, cité par KANINGINI,
1995).
Tableau III : Espèces de zooplancton
signalées au lac Kivu de 1937 à 1990 (tiré de KANINGINI
et al., 1999)
|
1937
|
1953
|
1983
|
1990
|
CLADOCERA
|
|
|
|
|
Daphnia curvirostris
|
+
|
+
|
-
|
|
Ceriodaphnia cornuta (SARS, 1988)
|
+
|
+
|
-
|
+
|
Moina micrura (KURZ, 1974)
|
+
|
+
|
-
|
+
|
Diaphanosoma excisum (SARS, 1886)
|
+
|
+
|
+
|
+
|
Alona cambouei
|
+
|
|
+
|
|
Alona rectangula (SARS, 1862)
|
|
|
|
+
|
COPEPODA
|
|
|
|
|
Mesocyclops aequatorialis
|
+
|
+
|
+
|
+
|
Thermocyclops consimilis
|
+
|
+
|
+
|
+
|
Tropocyclops confines
|
+
|
+
|
-
|
+
|
ROTATORIA
|
|
|
|
|
Brachionus quadridentatus
|
-
|
-
|
-
|
+
|
Brachionus calyciflorus
|
-
|
-
|
-
|
|
Anuraeopsis fissa
|
-
|
-
|
-
|
+
|
Polyarthra remata
|
-
|
-
|
-
|
|
Trichocerca ruttneri
|
-
|
-
|
-
|
+
|
Ascomorpha saltans
|
-
|
-
|
-
|
+
|
Hexarthra intermedia
|
-
|
-
|
-
|
|
Lecane bulla
|
-
|
-
|
-
|
|
Conochilus sp.
|
-
|
-
|
+
|
|
Lecane sp.
|
-
|
-
|
|
+
|
CILIATA
|
|
|
|
|
Stentor coeruleus
|
|
|
|
|
|
En plus de cette baisse de la taille du zooplancton, une
colonisation du milieu pélagique
par les espèces littorales a
été observée. De l'augmentation de la
diversité
zooplanctonique et de la diminution de leur taille moyenne
en est résultée une baisse de
biomasse qui est tombée de 0,75 g MS/m2 en
1953 à 0,15 g MS/m2 en 1992 FOURNIRET (1992).
En 1982, deux ans seulement après les études de
REYNTJENS, celles de DUMONT (1986) ont démontré que la situation
était alarmante ; les tendances à la baisse de la biomasse et de
la taille du zooplancton s'étaient amplifiées, le zooplancton
n'était plus long que de 0,2 mm et la biomasse n'était que de 0,5
g MS/m2. La disparition du Daphnia curvirostris est encore
constatée, ce qui a amené DUMONT à qualifier cette
situation de "désastre écologique". Les travaux de
FOURNIRET (1992) confirment le changement dans la composition spécifique
du zooplancton après 1953 : la disparition du D. curvirostris,
la dominance numérique des Rotifères, le changement de la
biomasse et de la taille moyenne du zooplancton depuis l'introduction de L.
miodon qui est passé de 0,6mm en 1990 à 0,211mm #177;
0,001mm en mai et juin 1992 soit 35% de diminution de taille qui est
néanmoins supérieure à celle observée par DUMONT en
1983 (DUMONT, 1983 cité par BANA 2005).
Tableau IV : Les espèces
zooplanctoniques du lac Kivu d'après FOURNIRET (1992).
Groupe
|
Espèces
|
Parrains
|
Cladocères
|
Ceriodaphnia cornuta Moina micrura
Diaphanosoma excisum Alona rectangular
|
SARS, 1886 KURZ, 1874 SARS, 1886 SARS, 1862
|
Copépodes
|
Mesocyclops aequatorialis Thermocyclops consimilis
Tropocyclops confines
|
KIEFER, 1929 KIEFER,
KIEFER, 1930
|
Rotifères
|
Ascomorpha saltans
Trichocerca ruttneri
Brachionus quadriedentatus Anuraeopsis fissa
Lecane spp.
|
BARTSCH, 1850 DONNER, 1950 HERMANN, 1783 GOSSE, 1851
-
|
|
Cependant, ISUMBISHO (1995) et KANINGINI et al.
(1999) affirment que le zooplancton est de nouveau numériquement
dominé par des Copépodes et leur nauplii avec très peu de
Cladocères et de Rotifères.
Selon KISS (1966), MAHY (1979), KANINGINI et al.
(2003) et ISUMBISHO et al., (2006), le zooplancton subit des
fluctuations saisonnières qui atteignent le pic vers août-
septembre après le brassage des eaux de la saison sèche.
I.3.2.2 / 'iFhtyI11un!
Comparativement aux autres lacs du REA, la
biodiversité du lac Kivu est pauvre en espèces avec seulement 26
espèces de poissons dont 15 espèces endémiques appartenant
au genre Haplochromis [SNOEKS et al., 1997, cité par
ISUMBISHO et al., 2006]. Actuellement, la faune ichtyologique du lac
Kivu est dominée par une sardine planctonophage introduite, le L.
miodon.
Cette pauvreté ichtyologique s'expliquerait par la
formation récente du lac Kivu, sa forte salinité relative et son
isolement, résultats des éruptions volcaniques [SNOEKS, 1994
cité par BANA, 2005] ainsi que le caractère spécial de ses
eaux trop riches en produits sulfureux (MAHY, 1979 cité par BANA,
2005).
Au lac Kivu, à l'exception de L. miodon, de
Raiamas moorii et de quatre espèces de Haplochromis
qui vivent en milieu pélagique, la faune piscicole est
inféodée à la zone littorale (Tableau V).
Tableau V : Ichthyofaune du lac Kivu
(légèrement modifié par SNOEKS, 1994 tiré de
KANINGINI et al., 1999).
Famille
|
Espèces
|
Longueur (mm)
|
Habitat
|
Clupeidae
|
Limnothrissa miodon BOULENGER, 1906 (intr.)
|
175 (LT)
|
Littoral + pélagique
|
Clariidae
|
Clarias liocephalus BOULENGER, 1898 Clarias
gariepinus BURCHELL, 1822
|
380 (LT) 1500 (LT)
|
Littoral
Littoral
|
Cyprinidae
|
Riaamas moorei BOULENGER, 1900
Barbus kerstenii PETERS, 1868
B. pellegrini POLL, 1939
B. apleurogamma BOULENGER, 1911 B.
altianalis BOULENGER, 1900
|
270 (LT)
90
90
540
560
|
Littoral + pélagique
Littoral Littoral Littoral Littoral
|
Cichlidae
|
Oreochromis niloticus LINNAEUS, 1758
O. macrochir BOULENGER, 1912(intr.) Tilapia
rendalli BOULENGER, 1896 (intr.) Haplochromis vittatus
BOULENGER, 1901 H. adolphifrederici BOULENGER, 1914
H. gracilior BOULENGER, 1914
H. graueri BOULENGER, 1914
H. astatodon REGAN, 1921
H. paucidens REGAN, 1921
H. nigroïdes PELLEGRIN, 1928
H. kamiranzovu SNOEKS, COENEN et THYS
VAN DEN AUDENAERDE, 1984 H.scheffersi SNOEKS, COENEN et
THYS VAN
DEN AUDENAERDE, 1987
H. occultidens SNOEKS, 1988
H. olivaceus SNOEKS, COENEN et THYS VAN DEN AUDENAERDE,
1990
H. crebridens SNOEKS, COENEN et THYS
VAN DEN AUDENAERDE, 1990 H. microchrysomelas sp. n
SNOEKS, 1924 H. insidae sp. n SNOEKS, 1924
H. rubescens sp. n SNOEKS, 1924
|
335 (LS)
270 (LS) 250 (LS) 200 (LS) 120 (LS)
84 et 103,5 (LS) 120 (LS)
76,5 (LS)
77,5 et 132,5(LS) 70 (LS)
95 (LS)
100 (LS)
125 (LS)
66 et 89 (LS)
105 (LS)
85 (LS) 95 (LS) 115 (LS)
|
Littoral
Littoral Littoral
Littoral + pélagique Littoral
Littoral + pélagique Littoral
Littoral Littoral Littoral
Littoral + pélagique
Littoral
Littoral
Littoral
Littoral + pélagique
Littoral
Littoral
Littoral
|
|
Intr.=Introduit
CHAPITRE II. REVUE BIBLIOGRAPHIQUE SUR LE ZOOPLANCTON II.1
GENERALITES SUR LES COMMUNAUTES ZOOPLANCTONIQUES
Par définition, le zooplancton est le plancton animal,
constitué de petits organismes aquatiques parfois microscopiques. Dans
tout milieu aquatique, le zooplancton constitue un maillon important dans la
chaîne alimentaire. Il est une source de nourriture pour certaines
espèces de poissons, surtout au stade jeune (AMOROS, 1984).
La notion de plancton est liée à la taille et au
mouvement propre du plancton. Selon la taille corporelle, le zooplancton peut
être divisé en trois groupes:
- le microzooplancton constitué des
stades nauplii des copépodes et des protozoaires, plus la plupart des
rotifères, la longueur de leur corps étant de 10 à
15um,
- le mésozooplancton constitué
par des stades copépodites et des adultes des copépodes, plus la
plupart des cladocères, la longueur de leur corps varie de 0,5 à
5mm,
- le macrozooplancton comprenant les
méduses et les crevettes, la longueur de leur corps varie de 1 à
2 cm (KURKI, 1993 cité par NYINAWAMWIZA, 1998).
BOUGIS (1974) distingue seulement deux groupes de zooplancton
suivant la taille : Celui du macrozooplancton (de quelques mm
de longueur) et celui du microzooplancton (de plus ou moins
50um).
Suivant les mailles du filet employé dans
l'échantillonnage du zooplancton, on distingue :
- l'ultraplancton (< à 2um),
- le nanoplancton (2 à 20um),
- le microplanton (20 à 200um),
- le macroplancton (200 à 2000um) et
- le mégaplancton (plus de 2000um)
(DUSSART, 1966 cité par HARWANIMBAGA, 1987).
Des trois groupes qui composent l'essentiel du plancton
animal, deux appartiennent aux crustacés (cladocères et
copépodes) et un aux Rotifères. A ces trois groupes majeurs
viennent s'adjoindre épisodiquement :
· Un Chaoborus (15mm), dont les larves des
3e et 4 e stades surtout, sont planctoniques, au moins
pendant la partie de la journée où elles se nourrissent de
zooplancton et benthiques le reste du temps.
· Des protozoaires :
1) Ciliés, essentiellement représentés
par un groupe, les Tintinnidés.
2) Testacés. Quelques espèces du genre
Difflugia présentent un stade pélagique estival avec une
cyclomorphose (POURRIOT, 1982).
II.2 LES CARACTERISTIQUES CLES DES DIFFERENTS GROUPES
ZOOPLANCTONIQUES
II.2.1 LES ROTIFERES
Les Rotifères constituent une classe largement
importante comprenant plus ou moins 100 espèces. En
général, la forme de leur corps est allongée. Ils sont
couverts d'une cuticule généralement flexible. Ils ont de
flagelles leur permettant de se déplacer dans l'eau (fig. II). Ils sont
pélagiques et leur taille varie entre 0,1 et 1mm (POURRIOT, 1982).
Concernant l'alimentation, les Rotifères sont omnivores ; ils se
nourrissent des particules sestoniques sédimentées grâce au
mouvement de pulsation de leurs cils (WETZEL, 1983, cité par
NYINAWAMWIZA, 1998).

Brachionus calyciflorus
Brachionus falcatus
Figure II: Exemples de formes de rotifères
(Brachionus calyciflorus, Brachionus falcatus) Photos prises
par Isumbisho (ISUMBISHO et al., 2006)
II.2.2 LES CLADOCERES
Les Cladocères sont des petits crustacés
très fréquents dans les eaux douces à l'exception des eaux
courantes rapides où on ne les trouve que lorsqu'ils sont
entraînés par les courants à partir de zones plus calmes
(AMOROS, 1984).
Ils ont une longueur variant de 0,2 à 3 mm et
atteignent exceptionnellement 15mm. Le corps est transparent, translucide ou
parfois coloré ; la segmentation n'est pas visible, sauf exception. Ils
présentent une tête distincte pourvue de deux antennes dont la
seconde est grande sert d'organe de locomotion.
Chez la plupart des espèces, le thorax et l'abdomen
sont couverts d'une carapace bivalve dont l'ouverture ventrale et
postérieure laisse sortir les appendices thoraciques et abdominaux. En
vue latérale, les valves sont de formes variées : ovales,
sphériques, allongées (AMOROS, 1984). De plus, ils peuvent
présenter des striations, des réticulations ou une
pilosité plus ou moins développée à leur surface,
des soies ou des épines marginales et une épine caudale. La
tête qui n'est pas comprise entre les valves est protégée
par une capsule céphalique.
Les antennes sont insérées sur la face ventrale
de la tête, près du bord postérieur, les
antennes bien
développées sont insérées sur les
côtés de la tête parfois sous une
expansion (AMOROS, 1984). Ces antennes sont des appendices
natatoires et constituent l'organe le plus important de locomotion (KURKI, 1993
cité par NYINAWAMWIZA, 1998).
Les pièces buccales consistent en :
· De larges mandibules pour broyer les particules de
nourriture sélectionnées par filtration,
· Une paire de plus petits maxillaires utilisés pour
passer la nourriture entre les mandibules (AMOROS, 1984).
On ne distingue généralement pas de
véritable abdomen, mais un post-abdomen constitué par
l'extrémité du corps très mobile. Le plus souvent, ce
post-abdomen est replié ventralement vers l'avant et l'anus s'ouvre sur
le bord dorsal de celui-ci.

Moina micrura
Diaphanosoma excisum Alona sp.
Figure III: Exemples des formes de
Cladocères (Moina micrura, Diaphanosoma excisum, Alona sp.)
Photos prises par Isumbisho (ISUMBISHO et al., 2006)
II.2.3 LES COPEPODES
Les copépodes planctoniques peuvent être
aisément séparés en Calanoïdes, Cyclopoïdes et
Harpactinoïdes (KURKI, 1993). Ces trois sous-ordres peuvent être
distingués les uns des autres par la structure générale de
la première paire d'antennes, l'urosome et la cinquième paire de
pattes. Leur corps est généralement fusiforme, constitué
de trois parties plus ou moins distinctes :
· Le céphalosome sur lequel s'insèrent les
5 paires d'appendices : les antennes généralement longues, les
mandibules, les maxilles et les maxillipèdes. Tous les appendices sauf
les antennes servent à une fonction commune qui est la nutrition
(DUSSART, 1969 cité par NYINAWAMWIZA, 1998).
· Le métasome ou thorax qui comprend
essentiellement cinq segments portant chacun une paire d'appendices assurant la
natation. Le premier segment thoracique est souvent intégré par
soudure au céphalosome d'où le nom de céphalothorax.
· L'urosome ou abdomen n'ayant, en
général, pas d'appendice et comprenant primitivement cinq
segments pouvant être soudés pour n'en former que trois ou deux
(DUSSART, 1969 cité par NYINAWAMWIZA, 1998).
Chez les Calanoïdes, il existe une séparation
nette entre le corps antérieur (composé du céphalosome et
du métasome) et le corps postérieur constitué uniquement
de l'abdomen. Chez les cyclopoïdes, le corps est plus globuleux dans sa
partie antérieure. Le cinquième segment thoracique est
séparé du corps antérieur. Il est à peu près
intégré dans le corps postérieur.
Quant aux Harpacticoïdes, les segments abdominaux ont le
plus souvent une taille analogue à celles des segments thoraciques et il
est souvent difficile de distinguer les deux parties chez ce groupe. Ce
caractère particulier fait de ce groupe le plus primitif des
Copépodes. L'urosome se termine par une furca qui est
considérée comme un ultime segment abdominal et non comme une
paire d'appendices (DUSSART, 1966, 1969 cité par NYINAWAMWIZA, 1998).
En ce qui concerne la nutrition chez les Copépodes, il
faut distinguer les formes
planctoniques et les formes benthiques ; les
premières étant plus ou moins omnivores,
les secondes
plutôt détritiphages ou carnivores. Sans tout à fait
choisir leur nourriture,
ces animaux la tiennent dans la région buccale
grâce aux mouvements très rapides de leurs maxillaires et de leurs
palpes mandibulaires, les maxilles jouant le rôle de filtre et de
sélecteurs (LOWNDES, 1935 cité par NYINAWAMWIZA, 1998).
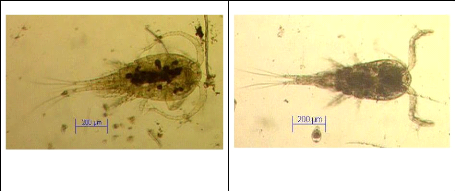
Thermocyclops sp. (F. ad.)
Mesocyclops sp. (F.ad.)
Figure IV : Exemples des formes de Copépodes
(Thermocyclops sp. (F. ad.), Mesocyclops sp. (F.ad.)) Photos
prise par Isumbisho (ISUMBISHO et al., 2006)
II.3 BIOLOGIE ET REPARTITION DU ZOOPLANCTON
II.3.1 BIOLOGIE DU ZOOPLANCTON
Les trois grands groupes zooplanctoniques ont, dans l'ensemble,
développé des stratégies de reproduction assez
différentes.
Les Rotifères sont les plus rapides à coloniser
un milieu, leur très court temps de génération compensant
largement leur faible fécondité relative. Ils apparaissent donc
comme les plus opportunistes, de même que les petites espèces de
Cladocères telles que Bosmina longistris.
La reproduction des Rotifères s'effectue
essentiellement par parthénogenèse améiotique. Celle-ci
peut être périodiquement entrecoupée d'une phase de
reproduction sexuée « parthénogenèse cyclique »,
principalement dans les populations d'étangs et de mares. Dans les lacs,
où règne un volume suffisamment important d'eau pour amortir les
variations des conditions du milieu, la reproduction sexuée peut
disparaître totalement.
Celle ci semble donc avoir pour but essentiel d'assurer la
survie des populations dans des conditions instables.
La reproduction sexuée apparaît sous l'influence
des facteurs externes (photopériode, température, densité
de population, alimentation, etc.) et endogènes (âge) (STROSS,
1971 ; HEBERT, 1978 ; POURRIOT et CLEMENT, 1981 cités par POURRIOT,
1982). Chez les Rotifères, la ponte est continue; une femelle pond entre
10 et 40 oeufs en moyenne au cours de sa vie (POURRIOT, 1982).
Les Cladocères ont une fécondité
élevée comme les Copépodes, mais affichent une
durée de vie et un temps de génération plus court que ces
derniers. Leur reproduction est parthénogénétique pendant
la plus grande partie de l'année. Elle est en suite interrompue par une
reproduction sexuée lorsque les conditions du milieu deviennent
défavorables (diminution de la température, assèchement,
surpopulation, etc.). Le nombre d'oeufs par ponte varie de 2 à 40. Les
oeufs sont portés par la femelle et protégés dans une
cavité dorsale. Il n'y a pas de stade larvaire libre. La
longévité varie selon les espèces, la température
et l'alimentation.
Les Copépodes, en revanche, ont davantage tendance
à développer une stratégie de type K (c'est á dire
que leur population est peu sujette aux variations de l'environnement et subie
la régulation densité dépendante) et sont également
plus aptes à échapper à la prédation (POURRIOT,
1982). La reproduction des copépodes est généralement
sexuée bien qu'il y ait quelques cas de parthénogenèse
chez certaines espèces. Les copépodes passent par 11 stades
larvaires avant d'atteindre le stade adulte : 6 stades nauplii (N1-N6),
morphologiquement très différents des adultes, suivis de 5 stades
copépodites (C1-C5) ; la dernière mue donnant l'adulte qui ne mue
plus (POURRIOT, 1982).
Outre l'influence primordiale de la température, la
qualité et la quantité de nourriture influent sur la croissance
et la fécondité quotidiennes des Copépodes, mais non sur
le temps de développement embryonnaire (POURRIOT, 1982).
WATTIEZ (1979), cité par POURRIOT (1982), souligne
l'interaction températurenourriture sur les variables biologiques ;
l'influence de la température étant soit tempérée,
soit accentuée par les conditions nutritives. D'autres facteurs tels que
la densité de la population peuvent agir aussi sur ces variables
(POURRIOT, 1982).
En outre, le cosmopolitisme est nettement plus marqué
chez les Rotifères que chez les Crustacés qui présentent
néanmoins une large répartition géographique. La
répartition latitudinale de quelques espèces paraît
être due à un gradient thermique et à la distribution des
ressources nutritives (POURRIOT, 1982).
On distingue les espèces eurythermes, se satisfaisant
d'une large gamme de température et des espèces
sténothermes d'eau chaude (thermophiles) ou d'eau froide
(psychrophiles). Outre la température, la salinité et
l'oxygène dissous apparaissent clairement comme des facteurs limitants.
Ainsi, le rotifère Filinia terminalis peut vivre dans une zone
où la concentration en oxygène dissous est comprise entre 0,2 et
1mg/l tandis que le cladocère Leptodora ne vit que dans les
strates bien oxygénées (POURRIOT, 1982).
La composition du peuplement zooplanctonique ne dépend
probablement des caractères chimiques des eaux douces que dans la mesure
où ceux-ci conditionnent la qualité et la quantité des
réserves nutritives disponibles. Ainsi, la plupart des espèces de
Rotifères du genre Brachionus montrent une
préférence pour les eaux alcalines et eutrophes; le rôle de
la prédation et de la compétition est alors primordial (POURRIOT,
1982).
II.3.2 REPARTITION MONDIALE DU ZOOPLANCTON
Les communautés herbivores des lacs tropicaux
présentent des similarités dans la composition
générale avec celles des lacs tempérés (RUTTNER,
1952, cité par WILLIAM, 1996).
Il existe pour le zooplancton, plusieurs endémismes
particulièrement parmi les Calanoïdes que parmi le
phytoplancton qui est caractérisé par un nombre important
d'espèces. Aussi sont présentes certaines espèces
cosmopolites qui sont familières aux zones tempérées,
particulièrement parmi les Rotifères (DUSSART, 1980 ; DUMONT et
MAAS, 1988, cités par WILLIAM, 1996).
La diversité des communautés zooplanctoniques
des latitudes tropicales n'est probablement pas plus élevée que
celle des latitudes tempérées (WILLIAM, 1996). Les lacs tropicaux
sont très similaires, pour ce qui concerne le nombre total
d'espèces et la distribution des espèces parmi les
Copépodes, les Cladocères et les Rotifères (LEWIS, 1979 ;
FERNANDO, 1980 a, b ; cités par WILLIAM, 1996). Ils sont aussi distincts
dans la rareté de groupes (taxa) zooplanctoniques (FERNANDO, 1980a, b,
cité par WILLIAM, 1996).
Les caractères chimiques des eaux douces
n'interviennent dans la répartition géographique du zooplancton
que dans la mésure où elles conditionnent la qualité et la
quantité des ressources nutritives disponibles (POURRIOT, 1982).
Ansi, les raisons qui expliqueraient les différences
de répartition géographique des communautés
zooplanctoniques à travers les latitudes seraient en relation avec la
température, le pH du système, la nature et la profondeur du lac,
la transparence et la couleur des eaux, la présence des
vertébrés et invertébrés prédateurs ou les
poissons, la salinité et l'oxygène dissous (POURRIOT, 1982).
II.4 INFLUENCE DE LA PREDATION SUR LA TAILLE ET LA STRUCTURE
DU ZOOPLANCTON
Les interactions compétitives entre les populations
zooplanctoniques se traduisent par des différences de distribution
spatiale (horizontale et verticale), temporelle et des exigences alimentaires
qui permettent la coexistence dans un même lac. Le succès de la
compétition et de la succession des populations de zooplancton peut
être influencé par la prédation des planctonophages tels
que les poissons (MICHA, 1992).
Ainsi, en Tchécoslovaquie, les lacs peu profonds
abondaient en petits Cladocères (Bosmina, Ceriodaphnia) et
Rotifères. Empoissonnés avec des Cyprinidés, la
transparence de l'eau, augmente, favorisant le développement de petites
algues planctoniques. Après enlèvement sélectif des
poissons, sont apparus soudainement de plus grands Cladocères
(Daphnia longispina) et la densité des Rotifères a
diminuée (MICHA, 1992).
Un autre exemple concerne l'introduction d'une Alose
(Clupeidae) poisson planctonophage à branchiospines fines et nombreuses
dans le lac Grystal. Avant cette introduction, le zooplancton était
représenté par deux grands Calanoïdes,
Epischura et Daphnia ; un Cyclopoïde,
Mesocyclops, ainsi que de nombreux petits Copépodes,
Diaptomus et Cyclops. Quelques dix années après
l'introduction d'une Alose dans ce lac, les grandes formes de zooplancton ont
été remplacées par les petites formes de
Cladocères, Bosmina, et de Copépodes,
Tropocyclops et Cyclops. La longueur modale des formes
numériquement dominantes a baissé de 0,8 à 0,3mm (MICHA,
1992).
Du comportement alimentaire des poissons planctonophages, on
peut retenir qu'en général les cladocères, en particulier
les Daphnidés, sont plus souvent attaqués car, ils sont
bien visibles et incapables d'échapper aux prédateurs, ils sont
plus aisément
capturés. Une prédation intense élimine
les grandes formes (herbivores ou prédateurs) permettant aux petites,
non attaquées, de dominer en profitant de la biomasse nanoplanctonique
laissée disponible par la disparition des grands herbivores. Une
prédation modérée permet la coexistence des deux groupes.
En l'absence de prédation, les herbivores planctoniques entrent en
concurrence pour les petites particules alimentaires (POURRIOT, 1982).
II. 5 MIGRATION VERTICALE ET DISTRIBUTION SPATIALE DES
CLADOCERES ET COPEPODES
La migration verticale de ces petits organismes s'effectue
quotidiennement sur des distances importantes sous le stimulus de la
lumière. Ces mouvements dont la signification adaptative n'est pas
claire, varient selon les conditions lacustres, la saison, l'âge et le
sexe des espèces (MICHA, 1992).
Toutefois, la plupart des espèces migrent vers la
surface lorsque la nuit tombe. Selon les cas, on constate un seul maximum de
densité atteint entre le coucher et le lever du soleil, ou deux maxima,
l'un à la pointe du jour et l'autre au crépuscule. Quelques
espèces présentent une migration inverse avec un seul maximum de
densité en surface pendant la journée. L'amplitude de cette
migration (1,5 à 7,6m) varie selon l'espèce et la transparence du
lac, de même que la vitesse de déplacement ascendante (1,4
à 4 m/h) ou descendante (1,4 à 4,8 m/h) (MICHA, 1992).
Une des explications de ces variations entre espèces
résulterait de leur vision différente. Par exemple,
Daphnia a une vision trichromatique avec des pics de
sensibilité plus élevée dans l'ultraviolet (3,700
Å), le bleu - violet (4,350 Å) et le jaune (5,700 Å). Chaque
espèce rechercherait sa photo - environnement optimum.
Une autre caractéristique des mouvements des
Cladocères et des Copépodes pélagiques se manifeste par
l'évitement de la zone littorale. Ainsi des individus capturés en
zone pélagique puis relâchés en zone littorale migrent
horizontalement vers le large.
La direction de la migration coïncide avec le plan de
symétrie des stimuli lumineux et l'angle de la lumière sous
l'eau. A proximité du littoral, ce plan de symétrie dépend
principalement de la position de la ligne de l'horizon. Avec
l'éloignement du littoral, l'effet de la ligne de l'horizon sur l'angle
de distribution de la lumière diminue et finalement devient
insignifiant. A ce moment, les organismes n'effectuent plus de
mouvement directionnel d'évitement du littoral. Plus
la ligne de l'horizon est élevée, cas des lacs de montagnes, plus
large est la zone proche du littoral dépourvue de crustacés
pélagiques (MICHA, 1992).
II.6 VARIATIONS SAISONIERE ET ANNUELLE DE LA BIOMASSE
ZOOPLANCTONIQUE AU LAC KIVU
Au lac Kivu, les variations saisonnières de la
biomasse zooplanctonique sont probablement dues à la variation de la
biomasse phytoplanctonique (ISUMBISHO et al., 2006). Ainsi, la
biomasse totale des crustacés zooplanctoniques atteint son maximum
pendant la saison sèche (août-septembre), bien que d'autres pics
soient observables en saison pluvieuse, spécialement en mai et en
décembre. Chaque fois, on remarque que le pic de la biomasse
zooplanctonique suit celui de la biomasse phytoplanctonique à peu
près deux à quatre semaines après (fig.V).
Quant au pic phytoplanctonique, il correspond à
l'accroissement de la zone de mélange des eaux du lac suite aux vents
forts qui soufflent sur le lac Kivu pendant la saison sèche. Les
nutriments qui étaient enfermés en profondeur reviennent vers la
couche superficielle où ils sont accessibles à l'exploitation du
phytoplancton (SARMENTO et al., 2006).

25
Figure V : Variation de la biomasse du zooplancton et du
phytoplancton en fonction de la profondeur de la zone de mélange au lac
Kivu (de février.2002 au juin 2005) [ISUMBISHO et al.,
2006]
| 


