BURKINA FASO
UNITE-PROGRES-JUSTICE
MINISTERE DES ENSEIGNEMENTS
SECONDAIRE,
SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
---------------------------
UNIVERSITE POLYTECHNIQUE DE
BOBO-DIOULASSO
---------------------------
INSTITUT DU
DEVELOPPEMENT RURAL

MEMOIRE
en vue de l'obtention
du
DIPLOME DE MASTER RECHERCHE EN ANALYSE DES POPULATIONS
DES ESPACES FAUNIQUES ET HALIEUTIQUES (MFH2)
SPECIALITE : Analyse des populations des espaces
halieutiques
THEME : Dynamique d'exploitation du Mugil
cephalus (Linnaeus, 1758, Mugilidés) dans l'estuaire du
Fleuve Sénégal en pêche artisanale
Présenté par :
Serigne Modou SARR
Devant le jury composé de :
· Pr André T. KABRE
· Pr Wendeingoudi GUENDA
· Dr Sado TRAORE
Décembre 2010
N° : /MFH2 (Halieutique,
Faune)
DEDICACES
Je dédie ce travail à
ü Mon Père feu Alé SARR
ü Ma mère Sokhna DIOP
ü Ma chère épouse Mme SARR née
Aïda FALL
ü A mes frères et soeurs germains de la famille
feu Alé SARR
ü Mes soeurs utérines Momy et Khady DIOUF
ü A mon beau père Atoumane FALL et son
épouse Coumba NDAO
ü A mes amis, mes collègues de service et mes
promotionnaires au Master Recherche M2 en Analyse des Populations des Espaces
Fauniques et Halieutiques de l'IDR/UPB
REMERCIEMENTS
Nous rendons grâce à DIEU LE TOUT PUISSANT.
J'adresse mes remerciements à l'Agence
Universitaire de la Francophonie (AUF) qui m'a octroyé une
subvention pour financer une partie de mon inscription. Je remercie toutes les
autorités de l'Institut du Développement Rural (IDR)
de l'Université Polytechnique de Bobo-Dioulasso
(UPB) notamment le Directeur, le Président de
l'assemblée de l'Université, le corps professoral et tous les
enseignants chercheurs qui nous ont dispensés des cours.
A travers Simon MERIAUX, je remercie la
Fondation Internationale du Banc d'Arguin qui m'a
octroyé une bourse d'études pour ce master MFH2
Je remercie Cl Mame Balla GUEYE, Directeur
des Parcs Nationaux du Sénégal qui a autorisé mon
inscription au niveau de l'IDR
Une mention particulière est adressée à mes
encadreurs. Ils m'ont tous témoigné de leurs
disponibilités et apporté les corrections idoines pour mon
travail. Il s'agit :
· Pr André T. KABRE, Enseignant-
Chercheur à l'IDR, Directeur de mon
mémoire et membre du jury ;
· Pr Hassan EL OUIZGANI, Enseignant
-Chercheur, Codirecteur de mon mémoire ;
· Dr Amath Diaw DIADHIOU, Directeur du
CRODT /Sénégal ;
· Dr Charlotte KARIBUHOYE,
Coordonnatrice Programme AMP/FIBA ;
Je remercie vivement les membres du jury qui ont accepté
d'évaluer mon travail. Il s'agit :
· Pr Wendeingoudi GUENDA, Président
du jury, Enseignant - Chercheur à l'Université
Ouagadougou
· Dr Sado TRAORE, Rapporteur du jury,
Enseignant-Chercheur IDR/UPB
Une mention spéciale est réservée au
Doyen Mbarack FALL technicien au CRODT sans oublier ses
enquêteurs notamment Bouna GNING, Pape Ahmadou GUEYE, Doudou SY
et Pathé FALL qui m'ont beaucoup
impressionné de par leur savoir faire et à Mme Bineta Ba
DIAW pour la confection des cartes.
Je remercie aussi tous les toutes qui ont contribuées
de près ou de loin à ce travail de même que toutes les
personnes enquêtées et les pêcheurs qui nous ont fourni des
échantillons pour les mensurations.
TABLE DES MATIERES
DEDICACES
i
REMERCIEMENTS
ii
TABLE DES MATIERES
1
LISTE DES FIGURES
4
LISTE DES CARTES
5
LISTE DES PHOTOS
5
LISTE DES SCHEMAS
5
LISTES DES SIGLES ET ABREVIATIONS
6
RESUME
7
ABSTRACT
8
PREMIERE PARTIE :
INTRODUCTION, PROBLEMATIQUE, OBJECTIFS ET GENERALITES
9
INTRODUCTION
11
I. 1. PROBLEMATIQUE ET JUSTIFICATIFS
13
I. 2. OBJECTIFS
14
I.2.1. Objectif général
14
I.2.2. Objectifs spécifiques
14
I.3. Généralités sur
l'espèce étudiée
15
I.3.1. Caractéristiques taxonomiques et
morphologiques
15
I.3.1.1. Caractéristiques
taxonomiques : Mugil cephalus
15
I.3. 2. Distribution géographique et
habitat
17
I. 3.2.1. Distribution géographique
17
I.3.2.2. Ecologie de l'espèce
18
DEUXIEME PARTIE :
PRESENTATION DE LA ZONE D'ETUDE, MATERIEL ET METHODE
20
II.1. Présentation de la zone
d'étude
21
II.1.1. Le milieu Physique
21
II.1.2. L'hydrologie
22
II.1.3. Caractéristiques
socio-économiques
23
II.1.3.2. Les activités
économiques
24
II.2. Présentation de l'estuaire du Fleuve
Sénégal
25
II.2.1. Dynamique marine au large de l'estuaire
27
II.2.2. La Dynamique fluviale interne
27
II.3. Présentation des Aires Marines
Protégées du Nord
28
II.3.1. Aire Marine Protégée de Saint
Louis
28
II.3.2. Parc National de la Langue de Barbarie
28
II. 4. MATERIEL
31
II.4.1. Les outils de collectes de
données
31
II.4.1.1. Le questionnaire d'enquête et guide
d'entretien
31
II.4.1.2. Le Traitement des données
31
II.5. METHODE
33
II.5.1 La recherche documentaire et observation sur
le terrain
33
II.5.2. Choix de la zone d'étude
33
II.5.3. L'échantillonnage
33
TROISIEME PARTIE :
RESULTATS ET DISCUSSIONS
35
III. 3.1. ANALYSES STATISTIQUES
36
III. 3.2. ANALYSES BIOMETRIQUES
37
III. 3.2.1. Détermination de la croissance
à partir des structures tailles
37
III. 3.2.2. Les paramètres de croissance
39
III. 3.2.3. Etude de la croissance par analyse de
structures de taille
39
III. 3.2.3.1. Méthode de Powell- Wetherall
(1986)
41
III. 3.2.3.2. Taille maximale par la méthode
des prévisions
42
III. 3.2.6. Les paramètres
d'exploitation
43
III. 3.2.6.1. Estimation de la mortalité
(Z)
43
III. 3.2.6.2. Mortalité naturelle (M)
47
III. 3.2.7. Analyse de population virtuelle
52
III. 3.2.7.1. Analyse de population virtuelle
fondée sur l'âge
52
III. 3.2.7.2. Analyse de population virtuelle
fondée sur la longueur
53
III. 3.2.8. Les Captures Par Unités
d'Exploitation (CPUE)
53
III. 3.3. ANALYSES ECOLOGIQUES
54
III. 3.3.1. Les profondeurs pour capturer Mugil
cephalus
54
III. 3.3.2. Les migrations sur la grande Côte
au Sénégal et en Mauritanie
54
III. 3.3.2.1. La migration des adultes
54
III. 3.3.2.2. La migration des immatures
55
III. 3.3.3. Les milieux fréquentés
par l'espèce
55
III. 3.4. LES TECHNIQUES DE PECHES AU MULET
JAUNE
55
III. 3.4.1. Les engins de pêches
55
III. 3.4.1.1. Les filets de pêche
55
III. 3.5. Contribution des aménagements dans
la gestion des stocks de mulets jaunes
56
III. 3.5.1. Les Aires Marines
Protégées du Nord
56
III. 3.5.2. Les aspects réglementaires
57
CONCLUSION ET RECOMMANDATIONS
58
BIBLIOGRAPHIE
60
WEBOGRAPHIQUES
63
Annexe n°1 : Echantillon
collecté (relation taille-poids)
64
Annexe n°2 : Variation du stock en
fonction de la mortalité par pêche
65
Annexe 3 : Fiche de Collecte
Débarquement
66
Annexe 4 : Questionnaire
d'enquête
67
LISTE DES TABLEAUX
Tableau 1: Taxonomie de l'espèce Mugil
cephalus
15
Tableau 2 : Durée moyenne de
l'upwelling sur la côte ouest africaine
23
LISTE DES FIGURES
Figure 1: Evolution du poids Mugil
cephalus dans le fleuve Sénégal en fonction de sa taille
37
Figure 2: Augmentation de la longueur du mulet
jaune en fonction de l'âge
38
Figure 3: Histogramme fréquence taille
M. cephalus capturés dans le fleuve Sénégal
(04/05/2010)
39
Figure 4 : Histogramme fréquence taille
M. cephalus capturés dans le fleuve Sénégal
(05/06/2010)
40
Figure 5: Histogramme fréquence taille
M. cephalus capturé dans le fleuve Sénégal
(05/07/2010)
40
Figure 6: Fréquence taille des mulets jaunes
dans le fleuve Sénégal
41
Figure 7 : Estimation des valeurs de la
longueur asymptotique et de Z/K du M. cephalus
42
Figure 8 : Taille maximale prévue pour
le mulet jaune dans l'estuaire du fleuve Sénégal
43
Figure 9: Détermination de Z selon la courbe
de Jones & van Zalinge
44
Figure 10: Courbe de capture des mulets jaunes du
Sénégal fondée sur la longueur
44
Figure 11: Les paramètres de
sélectivités M. cephalus de l'estuaire du fleuve
Sénégal
45
Figure 12: Valeur de la mortalité
instantanée des mulets jaunes de l'estuaire du fleuve
Sénégal selon la longueur moyenne
46
Figure 13 : Estimation des rythmes de
recrutement des mulets jaunes dans le fleuve Sénégal .
49
Figure 14 : Probabilité de capture des
mulets jaunes de l'estuaire du fleuve Sénégal
50
Figure 15 : Courbe de
sélectivité des mulets jaunes de l'estuaire du fleuve
Sénégal par filet maillant
51
Figure 16 :
Courbe de la méthode « knife-edge
Selection » pour M. cephalus dans le fleuve
Sénégal
51
Figure 17 : Histogramme des populations
virtuelles de M. cephalus dans l'estuaire du fleuve
Sénégal fondées sur l'âge
52
Figure 18 : Histogramme des populations
virtuelles de M. cephalus dans l'estuaire du fleuve
Sénégal fondées sur la longueur
53
Figure 19 : Types de pêche dans la
région de Saint Louis
56
LISTE DES CARTES
Carte 1: Distribution géographique du mulet
source (http://www.aquamaps.org)
18
Carte 2 : Localisation de la Région de
Saint Louis dans le Sénégal
21
Carte 3 : Localisation du Fleuve
Sénégal et des Aires Marines Protégées du Nord
29
Carte 4 : Représentation
schématique des pêcheries dans et autour des AMP du Nord
30
LISTE DES PHOTOS
Photo 1 : Mugil cephalus dans
l'estuaire du fleuve Sénégal(sarr, 2010)
16
LISTE DES SCHEMAS
Schéma 1: Anatomie externe Mugil
cephalus (source : FAO, 1985)
16
LISTES DES SIGLES ET ABREVIATIONS
AUF : Agence Universitaire de la Francophonie
AMP/SL : Aire Marine Protégée / Saint-
Louis
CNRST : Centre National de la Recherche Scientifique et
Technologique/Burkina Faso
CRODT : Centre de Recherche Océanographique
Dakar-Thiaroye
FAO : Organisation des Nations Unies pour l'Alimentation
et l'Agriculture
FIBA : Fondation Internationale du Banc d'Arguin
IDR : Institut du Développement Rural
INERA : Institut National de l'Environnement et des
Recherches Agricoles/Burkina Faso
IMROP : Institut Mauritanien des Recherches
Océanographiques et des Pêches
IRD : Institut de Recherche pour le Développement
ex ORSTOM
MRFH2 : Master Recherche M2 en Analyse des
Populations des Espaces Fauniques et Halieutiques
ORSTOM : Institut Français de Recherche
Scientifique pour le Développement en Coopération
PNBA : Parc National du Banc d'Arguin
PNLB : Parc National de la Langue de Barbarie
RGPH : Recensement Général de la Population
et de l'Habitat
UPB : Université Polytechnique de
Bobo-Dioulasso
UICN : Union Internationale pour la Conservation de la
Nature
ZEE : Zone Economique Exclusive
RESUME
Mugil cephalus (Linnaeus, 1758, Mugilidés) est
une espèce pélagique côtière qui peut remonter les
estuaires et les rivières. C'est un poisson grégaire qui vit sur
les fonds sableux ou vaseux, souvent à moins de 10 m de profondeur.
Les mulets jaunes occupent une place importante en pêche
artisanale dans la région de Saint-Louis. Il procure des revenus
substantiels aux différents acteurs de la filière. En raison de
la forte demande sur le marché international, la pêche de cette
ressource ne cesse de se développer avec comme conséquence une
surexploitation de l'espèce dans l'estuaire du fleuve
Sénégal. L'objectif de ce travail est d'apporter le maximum
d'information sur la dynamique d'exploitation du Mugil cephalus dans
l'estuaire du fleuve Sénégal qui est notre zone d'étude.
La structure démographique des mulets jaunes est composée de
jeunes individus qui grandissent plus vite qu'ils ne grossissent. Les
résultats relation taille -poids ont montré une allométrie
minorante. Les paramètres de croissance et d'exploitation estimés
à l'aide de l'équation de Von Bertalanffly sont :
L8=50.33cm, K=0.37, t0=0. La mortalité instantanée Z
varie entre 0.38 à 1.671 selon les méthodes utilisées et
la mortalité naturelle est M=0.618. L'analyse des populations virtuelles
a montré que les mulets jaunes sont très exploités dans la
zone.
La migration est observée de la Grande Côte du
Sénégal vers la Mauritanie. Et les aires marines
protégées du nord constituent des lieux de ponte pour
l'espèce. Par conséquent les plans d'aménagement des
ressources naturelles doivent tenir compte de l'exploitation du mulet
jaune.
Mots clés : Mugil
cephalus, mulet jaune, dynamique, croissance, estuaire, fleuve
Sénégal
ABSTRACT
Mugil cephalus (Linnaeus, 1758, Mugilidae) is a
coastal pelagic species that can trace the
estuaries and rivers. It is a gregarious fish that lives on sandy
or muddy bottoms, often at less than 10 m deep.
The yellow mules are
important in artisanal fisheries in the region of Saint-Louis. It provides
substantial active income to the various industry players. Due to high demand
on the international market, the fishing of this resource continues to grow
with a consequent over-exploitation of the species Mugil cephalus in
the Senegal River Estuary. The objective of this work is to provide maximum
information on the dynamics of Mugil cephalus operating in the estuary
of the Senegal River, our study area. The demographic structure of yellow mules
is young people who grow up faster than they grow. The results of length-weight
relationship showed a lower bound allometry. Growth parameters and exploitation
estimated using the equation of Von Bertalanffly are L 8 = 50.33cm, K = 0.37,
t0 = 0 and the mortality ranges from 0.38 to 1.671 by the methods used and
natural mortality M = 0618 one virtual population analysis showed that the
yellow mules are heavily exploited in the area.
The migration is observed
in the Grande Côte in Senegal to Mauritania. And marine protected areas
are the northern spawning grounds for the species. Plans for natural resource
management must take into account the operation of the yellow mules.
Keywords: Mugil cephalus, yellow
mulle, dynamic, growth, estuary, river Senegal
PREMIERE PARTIE :
INTRODUCTION, PROBLEMATIQUE, OBJECTIFS ET GENERALITES
INTRODUCTION
Les pêcheries mondiales ont considérablement
décliné depuis le début des années 70, en raison
notamment de la surexploitation des principaux stocks d'intérêt
économique. L'Organisation des Nations Unies pour l'Alimentation et
l'Agriculture (FAO,2000) annonce que 47 % des stocks mondiaux de poissons
commercialisés sont exploités à leur maximum,
18 % sont surexploités, 10 % sont épuisés
ou en repeuplement lent. Ils restent 25 % des stocks sont
modérément sous exploités (FAO, 2000). Sur le plan
bioécologique, des modifications qualitatives et quantitatives de
l'abondance des ressources halieutiques consécutives à une
exploitation abusive des ressources biologiques et à des mutations
environnementales importantes sont apparues. Des menaces et des agressions sous
des formes multiples, d'origine anthropique, se développent dans les
zones côtières avec un impact négatif sur les ressources
halieutiques (FAO, 2008).
Selon KANE et al (2008) avec la Mauritanie, le
Sénégal est de loin le plus grand producteur de produits de
pêche de la sous région1(*). Parallèlement à la forte demande en
produits halieutiques et en l'absence de politiques adéquates et
cohérentes de gestion durable des ressources exploitables, une situation
de surexploitation des ressources halieutiques s'est installée au
Sénégal (SENE, 1985). Certaines espèces pélagiques
comme le mulet jaune deviennent de plus en plus rares.
Les mulets jaunes à la différence des autres
espèces halieutiques présentes sur le littoral
sénégalais ne font pas l'objet d'évaluation des
ressources, encore moins d'un suivi adéquat de leur exploitation (DEME,
2007).
Au Sénégal, sur la Grande Côte,
le mulet jaune est capturé par différents engins de pêche
utilisés principalement par les communautés de pêcheurs
autochtones. Il s'agit de filets maillant dérivant de surface, de filet
épervier, de sennes de plage et de sennes tournantes à mulets.
Dans notre zone d'étude, les pêcheurs utilisent le mono filament
qui est un engin prohibé. L'étude s'intéresse à la
biologie et à l'écologie de l'espèce Mugil
cephalus notamment les tailles des captures, la relation taille- poids,
l'habitat, les engins de pêches entre autres. C'est une espèce
côtière qui peut remonter les estuaires et les rivières.
C'est un poisson grégaire qui vit sur les fonds sableux ou vaseux,
souvent à moins de 10 m de profondeur.
Et face à cette crise que traverse la filière
mulet, l'Institut Mauritanien de Recherche Océanographique et des
Pêches (IMROP), l'Union Internationale pour la Conservation de la Nature
(UICN) en Mauritanie, la Direction de la Pêche Maritime (DPM) du
Sénégal et le Centre de Recherche Océanographique
Dakar-Thiaroye (CRODT) ont mis en place en 2003 un projet conjoint sur les
ressources partagées de mulets, de courbine et de tassergal entre ces
deux pays. Les objectifs sont entre autres la gestion concertée, la
recherche et la valorisation des produits. Selon DEME (2007), pour une gestion
partagée de la ressource, il a été demandé au
Sénégal et à la Mauritanie de dresser l'état des
connaissances sur les pêcheries de mulet. En Mauritanie des recherches on
été menées sur l'écobiologie de l'espèce. Au
Sénégal, le CRODT mène des travaux de recherche sur la
biologie du mulet jaune. C'est dans ce contexte que notre étude
s'intéresse à la « Dynamique d'exploitation du
Mugil cephalus (Linnaeus, 1758, Mugilidés) dans
l'estuaire du fleuve Sénégal » qui est une contribution
aux différentes études menées dans le cadre du projet
conjoint sur les ressources partagées de mulets, de courbine et de
tassergal entre ses deux pays.
Ainsi pour les besoins de la recherche, le CRODT a
instauré un système de suivi scientifique des ressources
halieutiques en général et du mulet jaune en particulier,
basé sur la collecte des données pour évaluer les
débarquements annuels (DEME, 2007).
Nous avons utilisé les logiciels : R pour les
analyses statistiques et FISATII pour calculer les paramètres
biologiques notamment la fréquence des tailles et poids, la relation
taille-poids, la croissance, la mortalité, le taux d'exploitation entre
autres. Nous nous sommes intéressés aussi aux engins de
pêche et à l'habitat.
L'intérêt pratique de l'étude est
d'apporter des éléments de réponse sur la dynamique
d'exploitation du mulet jaune dans la Langue de Barbarie.
Afin d'explorer toute la problématique du sujet, le
plan suivant est adopté :
ü Première partie : problématique,
justificatifs, objectifs et généralités sur
l'espèce Mugil cephalus ;
ü Deuxième partie : présentation de
la zone d'étude, matériel et méthode ;
ü Troisième partie : résultats et
discussions
I. 1. PROBLEMATIQUE ET JUSTIFICATIFS
Depuis de nombreuses années les stocks de Mugil
cephalus de la zone ont fait l'objet d'une surpêche. Les
exploitations artisanales se font à partir de grands points de
débarquement (dans les quartiers de Guet Ndar et Goxu mbathie). Quatre
grands types d'engins sont utilisés pour l'exploitation des
Mugilidés. Les filets maillants dérivant de surface et la senne
tournante sont les principaux, tandis que les filets dormants et la senne de
plage ont une importance moindre. La palangre et la ligne sont aussi
utilisées dans la localité pour capturer les mulets.
En effet,
la surpêche, les captures illégales et la destruction des zones de
reproduction ont largement détruit les ressources halieutiques de
l'estuaire du fleuve Sénégal particulièrement le mulet
jaune. Ainsi, la quantité de poissons à valeur commerciale
pêchée dans les eaux territoriales sénégalaises a
diminué de plus de 80% pour cette espèce depuis les années
cinquante (CAMARA, 2008). Pourtant, la pêche est vitale pour le pays.
Elle produit l'équivalent d'un quart du budget national, crée de
nombreux emplois et constitue une importante source de protéines pour
les populations côtières et les régions intérieures.
Selon OULD MOHAMED VALL (2004) au stade actuel des
connaissances, la recherche sur les Mugilidés, le mulet jaune en
particulier, soulève un ensemble de problèmes en matière
d'écobiologie et de dynamique des populations. Ces problématiques
liées à la migration, et même l'identification de stocks
sont autant de zones d'ombre pour une étude d'ensemble et une
utilisation fiable des connaissances déjà acquises vers le niveau
appliqué (gestion et aménagement).
La création de l'aire marine protégée de
Saint Louis et du Parc National de la Langue de Barbarie, pourrait beaucoup
contribuer à l'aménagement de la pêche artisanale dans
cette localité. Dans ce contexte et compte tenu du manque d'informations
précises surtout, sur l'aire de distribution de ces ressources, la
problématique centrale concerne essentiellement l'étude de la
dynamique d'exploitation du mulet jaune dans l'estuaire du fleuve
Sénégal.
Les tendances actuelles de l'évolution des stocks de
l'espèce Mugil cephalus montrent des signes inquiétants
: diminution de la taille moyenne des poissons capturés,
réduction des Prises par Unité d'Effort de pêche.
Il apparaît donc indispensable de réactualiser les tailles de
première maturité indiquées dans le code de la pêche
et d'accroître les moyens de contrôle pour le respect de la
réglementation. Il urge aussi d'observer un repos biologique pour
permettre aux juvéniles d'atteindre l'âge de la maturité
sexuelle avant d'être capturées.
Le problème central de la dynamique d'exploitation du
mulet jaune dans la localité est la diminution des stocks.
Les principales causes du problème sont :
· Augmentation de l'effort de pêche :
exploitation intensive de l'espèce par la pêche artisanale et
industrielle par l'utilisation d'engins et techniques de pêches à
performance croissante (sennes tournantes et coulissantes, filets maillant
dérivants mono filaments, sennes de plage) ;
· Absence d'un plan de gestion et
d'aménagement : la réglementation sur les types de filets et
les mailles autorisés n'est pas appliquée et en plus il n'y
a pas de repos biologique dans la localité à l'instar de la
Mauritanie.
· Modification des facteurs climatiques, hydrologiques et
destructions des habitats : la construction du barrage de Diama, les
pollutions urbaines, le développement de l'agro-business et les
variations sur le climat et les températures ;
· Forte demande extérieure : ciblage des
femelles gravides pour la production de poutargue, sachant que c'est le
potentiel reproducteur de ces espèces qui est gravement
menacé.
Les conséquences sont :
· Réduction des capacités des prises par
unités d'effort de pêche
· Intensification de la pauvreté chez les
pêcheurs et les jeunes empruntent le chemin de l'émigration
clandestine ;
· La diminution des tailles des captures
· La rareté de l'espèce dans la
localité pousse certains à aller vers les îles Bidjagos
(Guinée Bissau) et Nouadhibou (Mauritanie) pour la recherche de produits
halieutiques avec comme conséquence des conflits avec les populations
autochtones et les gardes côtes de ces pays.
I. 2. OBJECTIFS
I.2.1. Objectif général
L'objectif global de l'étude consiste à
déterminer la dynamique d'exploitation de l'espèce
Mugil cephalus dans l'estuaire du fleuve
Sénégal.
I.2.2. Objectifs spécifiques
De manière spécifique, les objectifs
recherchés par cette étude visent à :
§ Déterminer et analyser les paramètres
biologiques et écologiques de l'espèce : la fréquence
taille, les relations taille-poids ;
§ Montrer l'évolution de l'espèce dans la
localité avec le temps notamment les stocks, la mortalité, le
recrutement entre autres ;
§ Analyser l'impact des aménagements notamment la
contribution de l'Aire Marine Protégée de Saint Louis et le Parc
National de la Langue de Barbarie dans la gestion durable des ressources
halieutiques.
I.3. Généralités sur l'espèce
étudiée
I.3.1. Caractéristiques taxonomiques et morphologiques
I.3.1.1. Caractéristiques taxonomiques : Mugil
cephalus
Six espèces de mulets sont répertoriées
dans la Grande Côte du Sénégal (DEME et al., 2007). Il
s'agit de : Mugil cephalus, Mugil bananensis, Mugil capurii,
Liza aurata, Liza grandisquamis et Liza falcipinnis. Une partie
de ces espèces se trouve aussi bien en mer que dans la vallée du
fleuve Sénégal.
Mugil cephalus est connu sous le nom courant de mulet
jaune en français, Diabaï en Wolof2(*). Dans la classification elle occupe la place suivante
(voir tableau 1) :
Tableau 1:
Taxonomie de l'espèce Mugil cephalus
|
CLASSIFICATION
|
|
Règne
|
Animalia
|
|
Embranchement
|
Chordata
|
|
Sous-embranchement
|
Vertebrata
|
|
Super-Classe
|
Osteichtyes
|
|
Classe
|
Actinopterygii
|
|
Sous-classe
|
Neopterygii
|
|
Infra-class
|
Teleostei
|
|
Super-ordre
|
Acanthopterygii
|
|
Ordre
|
Mugiliformes
|
|
Famille
|
Mugilidae
|
|
Genre
|
Mugil
|
|
Nom binominal : Mugil cephalus
(Linnaeus, 1758)
Statut de Conservation UICN : LC= Préoccupation
mineure autrement l'espèce n'est pas dans la liste rouge de l'UICN
|
Source :
http://www.aquamaps.org
I.3.1.2.
Caractéristiques morphologiques
Le corps est gris olive sur le dos. Les flancs sont
argentés. Le ventre est blanc. Des rayures sont parfois présentes
sur les flancs. Les lèvres sont fines. Les
nageoires
pectorales sont courtes. Elles n'atteignent pas l'oeil lorsqu'elles sont
retournées vers l'avant. Les yeux sont protégés par une
paupière adipeuse. La taille maximale rapportée est de 120 cm
pour 12 kg mais demande à être confirmée.

Photo
1 : Mugil cephalus dans l'estuaire du fleuve
Sénégal(sarr, 2010)
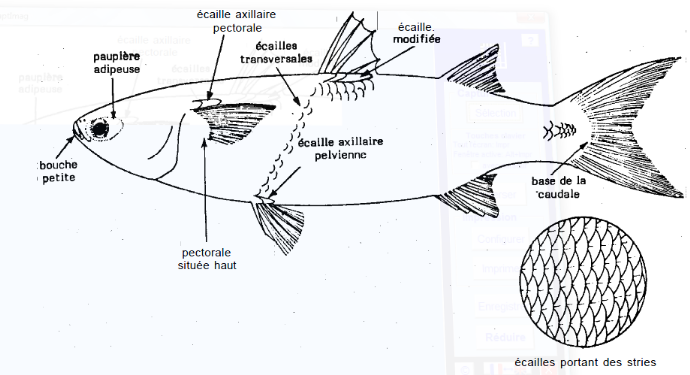
Schéma
1: Anatomie externe Mugil cephalus (source : FAO,
1985)
Le corps est cylindrique et robuste. La tête est large.
La largeur dépasse celle de la fente buccale.
Il a une paupière adipeuse bien
développée, couvrant la majeure partie de la pupille avec
une lèvre supérieure mince, sans papilles. Les dents labiales de
la mâchoire supérieure sont petites, droites, denses, et en
plusieurs rangées. La fente buccale se termine au-dessous de la narine
postérieure. Le mulet jaune a deux nageoires dorsales. La
première contient 4 épines et la seconde 8-9 rayons mous. Le
début de la première nageoire dorsale est plus près de la
pointe du museau que de la base de la nageoire caudale. Le début de la
deuxième nageoire dorsale est à la verticale entre la
moitié et un quart le long de la base de la nageoire anale. La nageoire
anale a 8 rayons mous. Les nageoires pectorales contiennent 16-19 rayons. La
pectorale axillaire mesure environ le tiers de la longueur de la nageoire. Les
deux cæca pyloriques présentent 36 à 45 écailles des
séries latérales. La couleur arrière est bleu vert. Celle
des flancs et du ventre est pâle ou argentée. Les écailles
sur le dos et les flancs forment habituellement des raies longitudinales. On
note la présence d'une tache sombre sur l'axillo-pectoral (FAO,
1985).
I.3. 2. Distribution géographique et habitat
I. 3.2.1. Distribution géographique
Mugil cephalus (Linnaeus, 1758) est connu encore
sous le nom de Mugil ashanteensis,
(BLEEKER, 1863). Sa répartition irait du Maroc à
l'Angola (OULD MOHAMED VALL, 2004). L'espèce ne se
différencie du Mugil cephalus d'Europe que par: la
coloration jaune de ses nageoires, le nombre d'écailles en ligne
latérale toujours inférieur à 40 et une distribution plus
large dans les mers tempérées.
Elle est cosmopolite dans les eaux côtières de la
plupart des zones tropicales et subtropicales. Dans l'Océan atlantique
occidental, on le trouve à partir de la Nouvelle-Écosse, Canada
en allant au sud jusqu'au Brésil, y compris le Golfe du Mexique. Il est
absent en Bahamas et en mer dans les Caraïbes. Dans l'Océan
Atlantique oriental, le mulet jaune se trouve dans le Golfe de Gascogne
(France) et jusqu'en Afrique du Sud, y compris la Méditerranée et
la Mer Noire. La chaîne orientale de l'Océan Pacifique comprend la
Californie du sud vers le sud jusqu'au Chili.
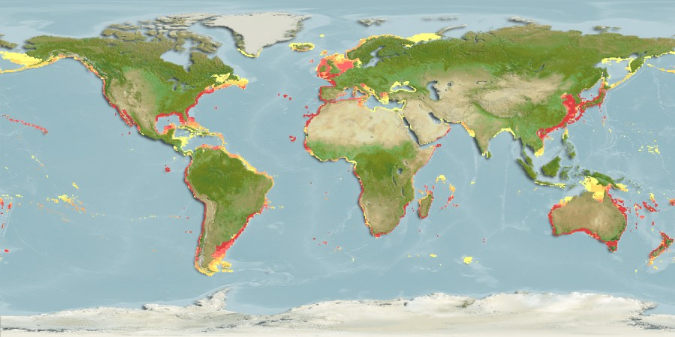
 Habitats : Mugil cephalus
Habitats : Mugil cephalus
Carte
1: Distribution géographique du mulet source (
http://www.aquamaps.org)
I.3.2.2. Ecologie de l'espèce
Mugil cephalus est une espèce pélagique
côtière qui peut remonter les estuaires et les rivières.
C'est un poisson grégaire qui vit sur les fonds sableux ou vaseux,
souvent à moins de 10 m de profondeur. De moeurs diurnes, il se nourrit
de
zooplancton, de larves,
de déchets, d'
algues, d'organismes
benthiques, ainsi que de petits poissons. Il est
présent fréquemment sur les côtes dans les estuaires et les
environnements d'eau douce. Les mulets jaunes ont un gésier
possédant une paroi épaisse à l'intérieur de leur
estomac avec un long appareil gastro-intestinal qui leur permet de s'alimenter
sur les détritus. Ils jouent un rôle de lien écologique
important dans l'écoulement d'énergie au sein des
communautés vivant dans les estuaires. Ils s'alimentent par succion de
la couche supérieure de sédiments. Ils prennent également
du sédiment qui aide dans la digestion de la nourriture dans le
gésier. Les mulets jaunes se nourrissent également sur les
épiphytes et l'épifaune des herbes marines. Ils ingèrent
l'écume extérieure contenant des micro-algues se trouvant
à l'interface air-eau. Les larves du mulet jaune se nourrissent
principalement sur des micro-crustacés. Des copépodes, des larves
de moustiques et des débris de plantes ont été
trouvés dans le contenu stomacal. Les quantités de sable et de
détritus dans le contenu de l'estomac augmentent avec sa longueur. Au
fur et à mesure que le poisson grandit il ingère plus de
nourriture provenant des substrats du fond.
I.3.2.2.1. La
salinité du milieu
Les adultes sont trouvés dans les eaux dont la
salinité s'étend de 0 à 75%o, alors que les
juvéniles ne peuvent tolérer de telles variations de
salinité qu'après avoir atteint des longueurs de 4-7 cm (FAO,
1985). Les adultes forment des bancs énormes près des surfaces
sur les fonds sableux ou boueux et de la végétation dense. Ils
émigrent en groupes vers la mer ouverte pour le frai. Les larves se
déplacent vers la côte dans les eaux extrêmement peu
profondes qui procurent une protection contre les prédateurs ainsi qu'un
environnement riche en nourriture. Après avoir atteindre 5 cm de
longueur, ces jeunes mulets se déplacent vers les eaux
légèrement plus profondes. L'espèce peut atteindre une
longueur maximale de 120cm et un poids de 12kg pour une durée de vie de
15ans.
I. 3.2.2.2. La
température
La température et la salinité des eaux
estuariennes sont soumises à des variations saisonnières. Les
eaux issues de la mer ont une température variant entre 16 °C et 30
°C. Par contre l'eau douce issue des crues du fleuve a des
températures sensiblement plus élevées que les
précédentes.
Quand les vannes du barrage de Diama restent fermer en saison
sèche, le taux de salinité dans l'estuaire est sensiblement
égal à celui de l'eau de mer (35 g/l). Par contre quand ces
vannes sont ouvertes pour évacuer la crue, il y a une dilution de la
masse d'eau et les taux de salinité naguère élevés
baissent. Cette baisse connaît également une variabilité
spatiale car il est démontré que les taux de salinité les
plus élevés sont enregistrés à l'embouchure et les
plus faibles en amont (barrage de Diama).
DEUXIEME PARTIE : PRESENTATION DE LA ZONE D'ETUDE,
MATERIEL ET METHODE
II.1. Présentation de la zone d'étude
II.1.1. Le milieu Physique
Le département de Saint-Louis est situé dans la
région du même nom, qui occupe le nord du Sénégal et
constitue une zone tampon entre l'Afrique arabo-berbère et l'Afrique
noire. Il est localisé entre les latitudes 15°45' et 16°30'
nord et les longitudes 15°40' et 1 6°35'ouest (Seck, 2004). La
région est au carrefour de l'océan Atlantique, du désert
du Sahara et des régions soudano-sahéliennes. Elle est
traversée par le fleuve Sénégal sur toute sa longueur. La
ville de Saint-Louis est située dans un site amphibie du Delta du fleuve
Sénégal et dans une zone de formation quaternaire
particulièrement basse et plate. La forme du site résulte d'un
alignement dunaire peu élevé, orienté du nord-est au
sud-ouest sur la partie continentale. A l'ouest, nous avons un cordon littoral
constituant la Langue de Barbarie3(*), qui donne une forme générale au relief
et à l'hydrographie.
Carte 2 :
Localisation de la Région de Saint Louis dans le
Sénégal
Le climat est du type sahélien avec une saison des
pluies, une saison sèche froide et une saison sèche chaude. La
ville est néanmoins constamment balayée par les alizés
maritimes. Les températures moyennes annuelles sont respectivement
16°C pour les mois les plus froids et 30°C pour les mois les plus
chauds. La pluviométrie est faible, mal répartie dans le temps et
est de l'ordre de 250 mm en moyenne annuelle, avec une saison des pluies courte
de trois mois (mi-juillet à mi-octobre) selon Seck (2004).
Deux types de sols existent dans le territoire
communal :
· les sols du « Waalo » plus ou moins argileux
d'origine alluvionnaire, ce sont des sols allomorphes, contenant des sels
solubles ;
· les sols dunaires dans la zone des
« Niayes 4(*)».
La végétation est composée
d'espèces diverses et variées qui sont souvent résistantes
à la forte salinité des terres, avec Casuarina
equisetifolia (filao) comme espèce dominante sur le
littoral. Le réseau hydrographique est déterminant dans
l'architecture de la cité. Le plan d'eau naturel du fleuve est soumis
aux fluctuations saisonnières. Les crues peuvent atteindre une
côte de 1,8m en saison des pluies. Pendant la saison sèche, le
débit du fleuve est presque nul et son niveau moyen correspond à
celui de la mer. Un canal de délestage du trop plein fluvial est
creusé depuis 2003 sur la Langue de Barbarie pour parer aux inondations
constatées au niveau de certains quartiers de la ville pendant
l'hivernage. L'ouverture de ce canal a engendré de graves
problèmes écologiques dans la localité notamment la
salinisation des terres, l'accélération de l'érosion
côtière entre autres.
II.1.2. L'hydrologie
a) - Les remontées d'eaux
froides
Les côtes sénégalaises sont
baignées par d'importantes remontées d'eaux profondes ou
"upwellings" qui proviennent des eaux centrales du sud de l'Océan
Atlantique. Par définition, l'upwelling est le phénomène
de remontées d'eaux profondes froides. Il est
généré par les alizés en saison froide. Il assure
un enrichissement en éléments nutritifs du milieu et favorise le
développement du plancton qui constitue la base de l'alimentation des
poissons pélagiques. Les variations de l'alizé, de l'upwelling
ont des conséquences sur la pêche en particulier sur la survie des
larves, le recrutement et les captures.
Selon le modèle V.W. Ekman cité par CURY et
ROY(1991), le vent met en mouvement les couches superficielles de
l'Océan qui sont alors déviés par la force de Coriolis. Le
transport résultant au sein de la masse est orientée non pas dans
la direction du vent mais vers la droite dans l'hémisphère nord.
La couche superficielle soumise à l'action du vent est appelée
couche d'Ekman, l'auteur qui a décrit pour la première fois
l'effet du vent sur les courants. Selon la théorie d'Ekman dans
l'hémisphère nord, un vent qui souffle du pôle vers
l'équateur le long d'une côte orientée Nord-Sud va
entrainer un déplacement vers le large (pour une côte
située sur le bord Est d'un Océan) de la masse d'eau comprise
entre la surface et le bas de la couche d'Ekman.
Et le long des côtes sénégalaises, la
saison des alizés, vents de secteurs N-NW à NW-N favorables
à l'upwelling, s'étend du mois de décembre au mois de mai.
Ces eaux recouvrent progressivement le plateau continental
où l'on peut alors observer des températures de l'ordre de 16
à 18°C et des salinités de 35,5 à 36,0 %o (SENE &
NDIAYE, 2009). La durée moyenne de la saison froide
varie en fonction de la latitude comme le montre celle de l'upwelling (Tableau
n°2). L'action fertilisante de ces remontées d'eaux profondes
résulte d'un apport à la surface d'eaux riches en sels nutritifs
généralement issues de la minéralisation de la
matière organique que l'on trouve sur le fond. A Saint-Louis, elle se
fait sentir à partir du mois de novembre au mois de mai. C'est la
période où les petits pélagiques sont abondants au niveau
de la Langue de Barbarie.
Selon DOMAIN (1978) quand l'upwelling sénégalais
se déclenche, les espèces à affinité saharienne ou
espèces d'eaux froides localisées dans les eaux mauritaniennes
migrent vers le sud. Ces espèces sont : Dentex gibbossus, Mugil
cephalus, Sparus coerusleostictus, Pagellus bellotti, Epinephelus aenus,
Pomatomus saltator... La migration débute au mois d'août
entre 20 et 30°N et se stabilise vers 10 et 16°N au mois de
février.
Tableau 2: Durée moyenne de
l'upwelling sur la côte ouest africaine
|
Zones
|
Latitude Nord
|
Périodes d'Upwelling
|
Durée moyenne (mois)
|
|
Cap Blanc
|
23°
|
toute l'année
|
12
|
|
Nouakchott
|
17°50
|
octobre à juin
|
9
|
|
Saint-Louis
|
16°
|
novembre à mai
|
7
|
(Source : Schemainda et Nehring,
1975citée par Sène et Ndiaye, 2009)
b)-
Les eaux de surface
Les eaux de surface dans la région de Saint-Louis
découlent de l'estuaire du fleuve Sénégal. En effet,
l'Aire Marine Protégée (AMP) de Saint-Louis et le Parc National
de la Langue de Barbarie (PNLB) sont sous l'influence directe du fleuve
Sénégal. Ils sont reliés par le canal de délestage
creusé en 2003, devenu par la suite la nouvelle embouchure avec
l'ensablement et la fermeture progressive de l'ancienne embouchure
située en aval de Gandiole.
II.1.3. Caractéristiques socio-économiques
Le contexte socio-économique de Saint-Louis en
général, celui de la Langue de Barbarie en particulier est
fortement marqué par la présence de l'océan qui
conditionne quasi totalement l'ensemble des activités de ce cordon
littoral.
La Langue de Barbarie est caractérisée par une
présence humaine appartenant à la communauté des
pêcheurs de Guet-Ndar, pionnière de la pêche artisanale
maritime.
Les wolofs de Guet Ndar forment avec les Lébous du
Cap-Vert5(*) et les Nyominka
des îles du Saloum, les trois communautés de pêcheurs les
plus importantes du Sénégal (KEBE, 1986 cité par SENE et
NDIAYE, 2009). L'histoire des populations de la Langue de Barbarie est
intimement liée à la pêche, à la fois comme source
alimentaire et activité génératrice de revenus. C'est une
activité qui a longtemps joué un rôle moteur dans
l'économie de la ville de Saint-Louis. Le peuplement de la Langue de
Barbarie a été et reste essentiellement dominé par les
wolofs autochtones et les maures.
II.1.3.1. Démographie
La ville de Saint-Louis connaît une forte croissance
démographique dès la première décennie de
l'indépendance, bien qu'elle ait perdu dès le milieu des
années 1950 l'essentiel des attributs (transfert de la Capitale à
Dakar) qui ont justifié pendant de longues décennies sa position
de pôle administratif et économique.
Selon les résultats provisoires du Recensement
Général de la Population et de l'Habitat (RGPH) de 2002, la
population de la région de Saint-Louis était estimée
à 695 720 habitants.
Le taux de croissance entre 1976 et 1988 est passé de
2,1 % à 3,2 %. Il a atteint 3,7% en 2002 (Bureau Régional de la
Prévision Statistique). Aujourd'hui, la population est estimée
à 799 105 habitants. Les femmes représentent 51,38 % au
niveau régional.
II.1.3.2. Les activités économiques
La pêche artisanale maritime constitue l'activité
économique phare dans la localité. Cependant l'agriculture,
l'élevage, le tourisme entre autres contribuent fortement au
développement socio-économique de cette région.
La pêche à Saint-Louis est une activité
très ancienne qui a connu bien des mutations.
q Des origines à la moitié du
20ème siècle
L'utilisation des pirogues par les pêcheurs de la ville
de Saint-Louis date du 16e siècle (SENE et NDIAYE, 2009). Les
produits de la mer à l'époque faisaient l'objet de troc entre ces
populations et les maures en échange de dattes et de sel.
L'abondance du poisson dans le fleuve, la difficulté de
franchir la barre et la saisonnalité de la pêche en mer
n'incitaient pas les pêcheurs à entreprendre la pêche dans
l'océan.
Cependant, l'administration coloniale avait imposé une
série de restrictions à la fois sur les techniques et les lieux
de pêche dans un souci de sauvegarder les ressources (SENE & NDIAYE,
2009).
Cette nouvelle donne a eu comme corollaire, la baisse des
revenus des pêcheurs, victimes de la législation coloniale
(interdiction partielle de pêcher dans le fleuve). Les pêcheurs ont
commencé donc à s'orienter peu à peu vers la mer à
partir du 19e siècle malgré les risques qu'ils
encouraient. Au niveau de Guet-Ndar, l'orientation vers la mer relève
plus d'un choix socio-économique forcé, que d'une simple
activité traditionnelle.
Par ailleurs, les difficultés de sortie en mer,
l'immobilisation prolongée des embarcations par suite de mauvais temps,
la courte durée des campagnes de pêche avec des sorties souvent
pauvres, sont des contraintes majeures à la survie des populations dont
l'activité était réduite à la pêche.
q De 1950 à nos jours
La principale alternative qui s'est offerte à
l'époque aux pêcheurs est l'émigration vers les centres de
pêches aux conditions naturelles moins hostiles avec des
débouchés commerciaux plus importants. Les migrants s'installent
d'abord à Cayar au Sénégal, ensuite vers le sud du pays
avant de sillonner toute l'Afrique Occidentale Française.
A la fin des années 50, 3000 des 5000 pêcheurs
que compte la périphérie partent en migration loin de Saint-Louis
pendant plusieurs mois chaque année (HATHIE, 1985) cité par SENE
et NDIAYE (2009).
Au plan national, la pêche artisanale a connu bien des
évolutions depuis les années 50. Quelques industriels de
transformation des produits de la mer ont essayé avec beaucoup de
difficultés de s'implanter au Sénégal, fondant leurs
espoirs sur la seule production artisanale (KANE, 1985) cité par SENE et
NDIAYE (2009). A cette époque, les captures pour la pêche
artisanale étaient trop limitées au regard de la demande des
industries de transformation.
Ils pêchaient surtout avec modération pour
l'autoconsommation, l'approvisionnement en frais du marché local. Ils
n'arrivaient pas à satisfaire la demande. Les services techniques de la
pêche ont incité les piroguiers à intensifier leurs efforts
de pêche avec comme conséquence une surexploitation des produits
halieutiques.
Ainsi un projet de « modernisation de la
pêche » est engagé par les services des pêches en
1951. Son premier objectif était la motorisation des pirogues. A
Saint-Louis, l'introduction de moteurs hors bord date de 1952.
II.2. Présentation de l'estuaire du Fleuve
Sénégal
Né des régions montagneuses guinéennes,
le fleuve Sénégal parcourt 1.700km avant de se jeter en mer au
sud de la ville de Saint Louis par une embouchure unique. Dans sa partie
terminale communément appelée estuaire, le bassin fluvial est
envahi par les eaux marines qui remontent son lit naturel en saison
sèche jusqu'au barrage de Diama avant d'être refoulées par
les eaux de crue en hivernage. I1 faut dire que l'utilisation de la notion
d'estuaire pour le cas spécifique du fleuve Sénégal est
trop controversée.
Selon PRITCHARD (1955) cité par DIA (2000), l'estuaire
est "une zone de mélange entre l'eau douce et l'eau salée".
I1 convient d'ajouter à cette définition trop
simple que le terme d'estuaire recouvre une grande diversité
d'interfaces qui ne sont en aucune façon comparables entre elles.
D'après JOUANNEAU (1981) cité par DIA (2000), la classification
des estuaires se base sur trois critères principaux que sont :
le rapport de compétence du fleuve sur l'énergie
de la marée, la plus ou moins grande maturité de
l'écosystème et la charge solide.
En ce qui concerne le fleuve Sénégal, il faut
signaler que la notion d'estuaire y est discutée par certains
spécialistes en géomorphologie littorale. La controverse
réside en effet sur la nature de la partie terminale du fleuve :
s'agit-il d'un delta ? d'un pseudo-delta ? d'un delta fossile ? ou tout
simplement d'un estuaire ?
DUBOIS (1955) cité par DIA (2000),
défendait la thèse d'un pseudo-delta en soulignant notamment
l'unicité de l'embouchure du fleuve, la présence d'une côte
à peu prés rectiligne, l'intrication entre les dunes
parallèles à la direction générale de
l'écoulement et les bras qui se faufilent dans leurs intervalles et
enfin l'importante remontée de l'eau salée dans le cours du
fleuve.
Pour ce dernier le fleuve Sénégal se termine par
un véritable delta en raison d'une construction alluviale de niveau de
base édifiée dans une nappe d'eau, du colmatage de l'ancien golf
nouackchottien fermé en lagune et l'arrivée des alluvions
jusqu'au au niveau de la côte.
Toutefois nous convenons avec KANE (1997) que le cours
inférieur du Sénégal se termine par un véritable
estuaire. Les raisons pour lesquelles le fleuve se déverse en mer par un
chenal unique sont à rechercher dans le régime hydrologique et
dans le jeu de la dynamique littorale.
Avant l'aménagement du barrage hydro agricole de Diama,
la marée remontait le cours du fleuve jusqu'au village de Diouldé
Diabé à 450 km de l'embouchure, et la langue
salée jusqu'à Podor. La zone estuarienne était alors plus
vaste qu'aujourd'hui. Depuis 1986, elle est limitée en amont par le
barrage de Diama, et en aval par son embouchure caractérisée par
une
extrême mobilité. Ce milieu est constitué
de deux marigots en rive droite en aval du barrage, du Djeuss barré au
niveau de Dakar-Bango, de petits affluents comme le Khor et le Marméal
qui recoupent le Sénégal en amont de Gandiole, du petit bras du
fleuve entre la Langue de Barbarie et l'île de Saint-Louis et enfin du
complexe lagunaire situé entre Saint Louis et Gandiole.
II.2.1. Dynamique marine au large de l'estuaire
La dynamique marine au large de l'estuaire du fleuve
Sénégal est essentiellement dominée par la présence
de houles de NW, engendrant une dérive littorale de même
direction. Cette dérive littorale provoque un important transport de
sable qui a fini par édifier le cordon littoral sableux de la Langue de
Barbarie. Les houles du SW exercent une faible influence sur l'évolution
du littoral au large de Saint Louis. Elles perdent une bonne partie de leur
énergie par suite d'une diffraction au niveau de la presqu'île du
Cap Vert qui constitue un véritable écran dont l'abri englobe
toute la Langue de Barbarie.
Le transit sédimentaire assuré par la
dérive littorale aux larges des côtes saint louisiennes est soumis
à des périodes d'accélération et de ralentissement
facilement observables sur les profils de plages. Les estimations de ce transit
sédimentaire varient entre 223 000 à 550 000
m3/an (BARRUSSEAU, 1981) cités par SALL (1982).
II.2.2. La Dynamique fluviale interne
La dynamique interne de l'estuaire est contrôlée
par le fleuve en coordination avec les actions de la marée qui ne sont
pas des moindres. Les apports fluviaux ont plutôt tendance à
façonner le rivage interne de la Langue de Barbarie. Si, à
l'heure actuelle, le fleuve Sénégal ne joue pas un rôle
essentiel dans l'édification de la flèche littorale, il peut en
revanche contribuer à son érosion au cours de la crue. Ceci peut
aboutir à sa rupture complète et à la création
d'une nouvelle embouchure.
Le barrage de Diama est le facteur clé qui
détermine à l'heure actuelle l'hydrodynamisme estuarienne par le
phénomène d'ouverture et de fermeture des vannes. Ainsi deux
périodes peuvent être décrites : une période longue
de 7 à 8 mois pendant laquelle l'estuaire est soumis à la
présence des eaux issues de la marée océanique et une
période plus courte de 3 mois au cours de laquelle l'estuaire est envahi
par les eaux de crue.
II.3. Présentation des Aires Marines
Protégées du Nord
II.3.1. Aire Marine Protégée de Saint Louis
L'AMP est à cheval entre la commune de Saint-Louis et
les Communautés rurale de Ndiébène Gandiole et de Gandon.
Elle a une superficie de 49 600 ha. C'est la plus grande
aire marine protégée du pays.
En effet, la Langue de Barbarie est caractérisée
par une forte présence de populations de pêcheurs dans la
localité. L'histoire de cette population est intimement liée
à la pêche, à la fois comme source alimentaire et
activité génératrice de revenus. Mais la surexploitation
de la biodiversité marine et côtière suite à
l'augmentation de l'effort de pêche et de l'usage des engins de
pêche peu respectueux des normes de gestion durable, a eu pour
conséquence, une baisse de la productivité des ressources
halieutiques et une dégradation des habitats (DIONE et NDIAYE, 2010).
Par conséquents certains habitats vulnérables
ont été identifiés et sont en cours de protection en vue
d'améliorer leur productivité. L'AMP dispose d'un organe de
gestion (personnel administratif et comité de gestion). Toutefois, la
matérialisation des limites et l'élaboration d'une charte locale
de bonne gestion entérinée par l'autorité administrative,
restent à réaliser
II.3.2. Parc National de la Langue de Barbarie
Le PNLB a une superficie de 2.000 ha et est
créé en 1976. Il est situé au nord-ouest dans l'estuaire
du fleuve Sénégal dans la région de Saint-Louis à
300km de Dakar (DIONE et NDIAYE, 2010). Il constitue un site de nidification
d'oiseaux : environ 3000 couples de mouettes à tête grise
(Larus cirrocephalus), 2000 couples de goélands railleurs
(Larus genei), de nombreux autres Laridea (sternes royales-Sterna
maxima, sternes caspiennes-Sterna caspia, sternes
fuligineuses-Sterna fuscata). C'est aussi un site de nidification des
tortues marines : genres Dermochelys , Caretta et Chelonias. Selon
DIONE et NDIAYE (2010), le parc est menacé par le changement du
régime de l'estuaire, suite à l'ouverture d'un canal de
délestage en amont, en 2003. Ces mêmes auteurs ont
décelé d'autres problèmes :
- l'existence d'un disfonctionnement de l'axe hydraulique avec
la tendance du fleuve à se transformer en lagune ;
- l'intensification de l'érosion des berges, la
disparition de la végétation ligneuse ; -
l'augmentation de la salinité, la variation spécifique et la
diminution de la faune ichthyenne.
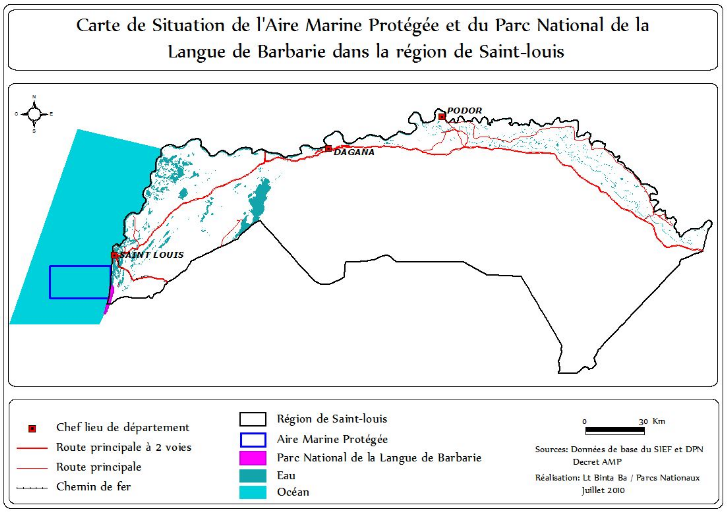
Carte 3 :
Localisation du Fleuve Sénégal et des Aires Marines
Protégées du Nord
AMP/SL
PNLB
Lieux de pêche
Langue de Barbarie
Villages environnants
 Gandiolais
Gandiolais
Aires Marines Protégées
Canal de délestage
Zonage participatif
Vers Louga
Vers Guet-Ndar
Niari miles
Pikeurgui (recif)
Mboumbaye
Mouit
Tassinéree
Pilote
K Bernard
Xerwureywi
Le fleuve
Fonds vaseux(bintt)
Mouit
Buturail
Guent
Fonds sablo-vaso-coquillés(JOXOR)
Assane
Océan Atlantique
Bossyi
Doune BABA
Dégouniaye
K Bernard

Carte 4 :
Représentation schématique des
pêcheries dans et autour des AMP du Nord
(Source modifiée de Google Earth ,
juin 2010)
II. 4. MATERIEL
II.4.1. Les outils de collectes de données
Les outils de collectes de données sont
constitués :
- un ichtyo mètre : pour la mensuration des
individus ;
- d'un peson pour déterminer le poids de
l'espèce ;
- un appareil photo numérique pour collecter des
images ;
- d'une fiche collecte pour enregistrer les données.
II.4.1.1. Le questionnaire d'enquête et guide
d'entretien
Le questionnaire est utilisé pour recueillir des
informations auprès des populations de pêcheurs, des mareyeurs,
des femmes transformatrices et autres personnes intervenant dans la
filière mulet jaune. Il est basé sur les aspects
suivants :
- Les unités et types d'engin de pêche
utilisé dans la localité pour capturer le mulet jaune ;
- Les lieux et les profondeurs pour la pêche au
mulet ;
- L'effort de pêche ;
- Les difficultés rencontrées dans le secteur de
la pêche ;
- L'écologie de l'espèce et les
conséquences de la modification des habitats....
Cependant le guide d'entretien est adressé aux
personnels des services de la pêche, de la capitainerie du port de
Saint-Louis, des techniciens du CRODT, les gestionnaires des aires marines
protégées de la localité (AMP/SL et PNLB) etc.
II.4.1.2. Le Traitement des données
Les données collectées sont traitées
d'abord à l'aide du tableur Excel. Nous avons utilisé deux
logiciels différents pour les analyses statistiques et
biométriques. Il s'agit du logiciel R.2.10.1 qui nous a permis de
calculer la relation taille-poids. Ensuite le logiciel FISATII (FAO and ICLARM
Stocks Assessment Tools) est utilisé pour l'analyse des
paramètres biologiques des populations étudiées.
L'évaluation des taux d'exploitation de
l'espèce Mugil cephalus a pour but de
renseigner sur l'utilisation optimale de cette ressource halieutique. Le taux
d'exploitation et la notion de stock sont étroitement liés aux
notions de paramètres de croissance et de mortalité. Ces
paramètres sont des valeurs numériques d'une équation par
laquelle on peut prédire la taille corporelle de l'espèce
Mugil cephalus lorsque celle-ci atteint un certain
âge.
A ce niveau nous avons utilisé l'équation de
croissance de von Bertalanffy (L(t)=L8× [1-exp
(-k×(t-t0))]) qui envisage la longueur corporelle en
fonction de l'âge.
Lt : Longueur du poisson au temps t
K : Coefficient de croissance.
to : Temps (âge
théorique du poisson) où la longueur est supposée
nulle,
L8 : Longueur asymptotique quand t
tend vers l'infini (taille asymptotique du poisson)
L'équation de capture de Baranoy (taux d'exploitation),
les taux de mortalités naturelles entre autres paramètres seront
déterminés dans le traitement des données.
II.5. METHODE
La méthodologie mise en oeuvre comprend essentiellement
quatre parties : la recherche documentaire, les observations directes, les
enquêtes de terrain, la collecte de données (mensurations des
captures) ainsi que le traitement et l'analyse des informations.
II.5.1 La recherche documentaire et observation sur le
terrain
La recherche documentaire a permis de passer en revue les
statistiques et les documents disponibles sur la pêche artisanale pour
l'espèce étudiée. Elle est menée au niveau de
certains centres de documentation et d'information notamment le Centre de
Recherche Océanographique Dakar Thiaroye, l'Inspection Régionale
des Services de Pêche de Saint Louis, la bibliothèque de
l'Université Gaston Berger et sur l'internet. Pour élargir
l'éventail du recueil de données, nous avons interrogé des
personnes ressources qui évoluent dans le secteur de la pêche
artisanale.
Sur le terrain, les observations nous ont permis d'avoir un
bref aperçu au niveau de la filière mulet. Des photos
numériques ont été prises sur le site de
débarquement lors des différentes sorties effectuées.
II.5.2. Choix de la zone d'étude
L'étude est menée au niveau de l'estuaire du
fleuve Sénégal particulièrement dans la ville de Saint
Louis du Sénégal. La délimitation de la zone
d'étude est effectuée à l'aide des techniciens du CRODT.
Les critères suivants ont permis de délimiter la zone
d'étude :
· Les lieux de débarquements ou quais de
pêche situés dans les quartiers de Goxu mbathie, Sor Diagne et
Guet ndar ;
· Les lieux de pêche à la ligne : le
pont situé sur la route nationale n°2 traversée par un bras
du fleuve Sénégal et le canal de délestage au niveau du
village de Keur Ibra Dièye.
Ces lieux sont fréquentés par les
différentes catégories socioprofessionnelles du secteur de la
pêche artisanale. Il s'agit de pêcheurs, de femmes
transformatrices, de mareyeurs, de vendeurs de denrées alimentaires ou
de petits articles entre autres.
II.5.3. L'échantillonnage
Les individus enquêtés sont des pêcheurs,
des chefs de ménages détenteurs de pirogues, des techniciens du
secteur de la pêche, des mareyeurs, des femmes transformatrices et autres
personnes ressources. Nous avons utilisé un échantillon
aléatoire simple issu d'une population finie. Les éléments
sont choisis un à un de telle sorte que les individus restants dans la
population aient la même probabilité d'être
sélectionné. C'est une méthode d'échantillonnage
probabiliste qui entraîne la sélection d'un échantillon
à partir d'une population. Cette sélection repose sur le
principe de la randomisation ou la chance.
Cette démarche méthodologique, nous a permis
d'avoir un échantillon représentatif pour les acteurs de la
filière mulet jaune autrement dit toutes les différentes
catégories socioprofessionnelles sont interrogées. Notre
échantillon porte sur un effectif de quarante deux (42) individus
enquêtés suivant plusieurs critères :
- La disponibilité de la personne
enquêtée : avec les techniciens du CRODT, nous avons
identifié et localisé ces individus ;
- La connaissance de l'espèce : les personnes
interrogées sont soit des pêcheurs, des femmes transformatrices
soit des techniciens qui ont une bonne connaissance de l'espèce
étudiée.
Sur le terrain nous avons pris un échantillon de
poisson (Mugil cephalus) pour différentes
captures suivants les débarquements pour les mensurations, les
pesées entre autres. Le même principe est utilisé pour la
sélection et la mensuration des mulets jaunes. Avec les enquêteurs
de CRODT, nous avons sillonné les quartiers de Goxu mbathie, Sor Diagne
et de Guet ndar pour collecter des échantillons de différentes
espèces capturées dans la localité. Le travail consistait
à mesurer la longueur des poissons capturés en particulier les
mulets jaunes. Nous avons réalisé l'étude entre le
début du mois de mai et la fin du mois de juillet 2010. Les
résultats suivants ont été obtenus :
ü 822 mulets jaunes collectés et mesurés
pour le mois de mai 2010 ;
ü 782 individus Mugil cephalus collectés
et mesurés pour le mois de juin 2010 ;
ü 660 mulets jaunes collectés et mesurés
pour le mois de juillet 2010.
Au total nous avons collecté et travaillé sur
un échantillon de 2 264 poissons de tailles et de poids
différents. Après mensurations ces échantillons ont
été remis à leur propriétaire.
Pour chaque semaine nous avons effectué 03 sorties sur
une période de trois mois. Au total nous nous sommes rendus 36 fois sur
le terrain. Notre taux d'échantillonnage avoisine les 42.85%.
TROISIEME PARTIE : RESULTATS ET DISCUSSIONS
III. 3.1. ANALYSES STATISTIQUES
Les mensurations sont effectuées sur place au niveau
des différents débarcadères à l'aide d'un ruban
métrique. Les données sont consignées sur une fiche de
collecte. Elles concernent la longueur totale pour chaque individu. Cependant
le poids d'un individu est calculé à partir de l'équation
W=aLtb
a : Ordonnée à l'origine qui
dépend de la densité de l'individu et de ses proportions ;
b : Coefficient d'allométrie.
W= poids d'un individu, Lt= Longueur totale
L'utilisation d'une relation taille-poids permet d'atteindre
deux objectifs : la conversion d'une taille en poids théorique et
inversement et le passage de la croissance linéaire à la
croissance pondérale.
La forme originelle de cette relation (b = 3) suppose que la
croissance est isométrique, c'est-à-dire que la forme et la
densité du corps ne varient pas avec l'âge. Par contre si b > 3
il y a une allométrie majorante et elle est minorante dans le cas de b
< 3.
Plusieurs relations du type y = ax + b liant les longueurs
entre elles et aussi les poids entre eux, selon que les individus sont
éviscérés ou non, ont été établies.
Pour notre cas les poissons ne sont pas éviscérés. Nous
n'avons pas fait une différenciation entre les sexes. Les
échantillons pris sont mesurés puis remis aux
propriétaires.
Les valeurs de a et b sont déterminées par
ajustement de la fonction au nuage des points observés, après
linéarisation de la courbe par transformation logarithmique.
Log W = Log a + b Log L
Des relations taille-poids ont été
établies sur des individus non éviscérés à
partir de l'équation
W= aLb ; a et b sont
des constantes appelées paramètres de croissance. On a pour les
valeurs : a= 0.00717 et b= 2.9510. Cette conversion des tailles des prises
en poids est effectuée grâce à des relations taille/poids
(par individu) obtenues à partir du site :
www.fishbase.org. Donc
l'équation devient :
W= 0.00717L2.9510
Pour les différentes valeurs de W voir annexe
n°1
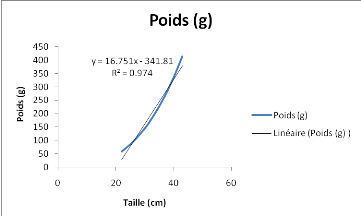
Figure 1:
Evolution du poids Mugil cephalus dans le fleuve Sénégal
en fonction de sa taille
Entre L= 22cm et L=34cm, le poids augmente d'une
manière exponentielle. Mais au-delà de L=35cm, l'augmentation en
poids pour l'espèce Mugil cephalus ne suit pas celle de sa
longueur. Ici l'allométrie est minorante, donc le poids croit
relativement moins vite que la longueur. Le coefficient de corrélation
obtenu est proche de 1 (R=0.986), montrant ainsi une très bonne
corrélation entre les deux paramètres
étudiés : la taille et le poids des individus
III. 3.2. ANALYSES BIOMETRIQUES
D'après l'encyclopédie Universalis :
« la biométrie désigne la science des variations
biologiques, des phénomènes qui s'y attachent et des
problèmes qui en découlent ». Donc l'analyse
biométrique est une interprétation mathématique des
caractéristiques biologiques d'une espèce, destinée
à déterminer son identité de manière
irréfutable. Les paramètres biologiques étudiés
concernent la croissance, la taille, le poids, la naissance, la
mortalité entre autres.
La croissance d'une espèce consiste à
établir une corrélation entre une variable mesurable (taille,
poids) caractérisant un individu et l'âge de cet individu. Cette
relation est obtenue par un modèle mathématique dont les
paramètres, nécessaires en dynamique des populations, sont
obtenus par analyse de structure d'âge ou de taille.
III. 3.2.1. Détermination de la croissance à
partir des structures tailles
Le modèle mathématique de croissance
individuelle élaboré par Von Bertalanffy (1934) envisage la
longueur corporelle en fonction de l'âge (SPARRE & VENEMA, 1996)
cités par (BEDDA & BOUFERSAOUI, 2009)
Ce modèle est représenté par
l'équation : Lt=L8
(1-e-K(t-t0))
Lt : Longueur du poisson au temps t
K : Coefficient de croissance.
to : Temps (âge
théorique du poisson) où la longueur est supposée
nulle,
L8 : Longueur asymptotique quand t
tend vers l'infini (taille asymptotique du poisson)
La taille des individus augmente progressivement en fonction
de son âge. A t0 jusqu'à t=1an, la croissance en
longueur des individus suit l'allure de la courbe tracée (figure
n°2). Cette croissance est celle d'une fonction logarithmique. Mais
au-delà de 2ans la croissance en taille ne suit plus les
années.
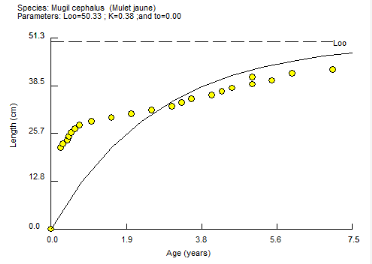
Figure 2:
Augmentation de la longueur du mulet jaune en fonction de
l'âge
Pour un coefficient de croissance K=0.38 la valeur de la
taille a atteint une valeur asymptotique L8= 50. 33cm.
Théoriquement cela signifie que la taille maximale pour Mugil
cephalus dans l'estuaire du fleuve Sénégal ne dépasse
pas 51cm. Ces réultats peuvent être comparés avec ceux de
OULD MOHAMED VALL (2004) qui a trouvé L8=54cm en Mauritanie, pays
frontalier avec le Sénégal. Pour notre échantillon nous
avons enrégistré un seul individu qui mesure 43cm dans la zone
d'étude. En Mauritanie contrairement au Sénégal, chaque
année l'Etat instaure un repos biologique pour restaurer les ressources
halieutiques. Cette différence de taille asymptotique notée
entre ces deux pays pourrait s'expliquer par l'interdiction temporarire de
capturer l'espèce dans les côtes mauritanniennes. Cepandant en
plus du repos biologique, l'habitat et la nourriture constituent des facteurs
déterminants dans la croissance des indiviudus. Le Parc National du Banc
d'Arguin est un exemple d'aménagement qui a beaucoup contribué
à la qualité des ressources halieutiques de la Mauritanie.
III. 3.2.2. Les paramètres de croissance
III. 3.2.3. Etude de la croissance par analyse de structures
de taille
Les Figures n°3,4 et 5
représentent les histogrammes des fréquences tailles chez
l'espèce Mugil cephalus. Elles sont obtenues par la
méthode de Bhattacharya dans FISATII.
Pour la figure n°3, dans la distribution fréquence
taille, nous remarquons la présence de 4 modes successifs : 24.5cm,
28.5cm et 32.5cm. Cette figure n°3 représente la taille des
captures pour le mois de mai 2010. La fréquence est plus
élevée dans la classe de 32.5 cm.
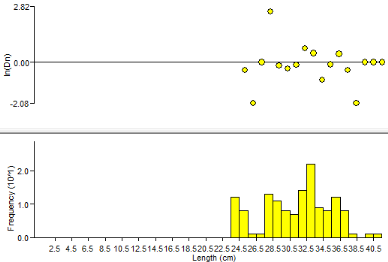
Figure
3: Histogramme fréquence taille M. cephalus
capturés dans le fleuve Sénégal (04/05/2010)
Pour la figure n°4 qui représente la distribution
des fréquences tailles au mois de juin 2010, il y'a 2 modes
successifs : 24.5cm et 34.5cm. La fréquence taille est plus
élevée au niveau de la classe 34.5cm. Les individus de cette
taille sont souvent capturés par le filet des pêcheurs. Il
semblerait qu'ils ont atteint l'âge de la maturité sexuelle.
Cependant nous n'avons pas pu éviscérer les poissons pour
déterminer le sexe et voir la corrélation taille gonade.
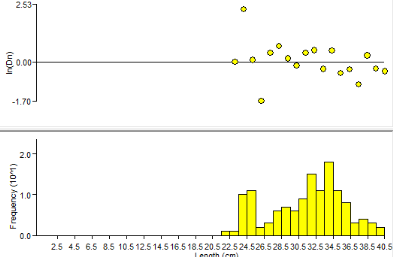
Figure 4 :
Histogramme fréquence taille M. cephalus
capturés dans le fleuve Sénégal (05/06/2010)
La figure n°4, il y'a une présence de deux
modes : le premier est de 22.5 cm et le second est de 32.5cm. La
distribution fréquence taille est plus élevée pour la
classe 32.5cm pour le mois de juillet 2010. Le premier mode semble être
celui des juvéniles ou recrus.
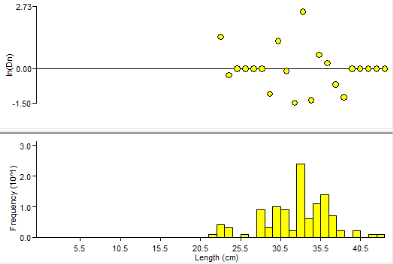
Figure 5:
Histogramme fréquence taille M. cephalus
capturé dans le fleuve Sénégal (05/07/2010)
La comparaison entre ces trois figures (3,4 et 5) fait sortir
des différences et des similitudes sur la distribution des
fréquences tailles.
Les fréquences les plus élevées sont
situées entre 32.5 et 34.5 cm. Cependant les figures 3 et 4 ont presque
la même allure contrairement à la figure n°5 même si le
second est bimodal.
Figure
6: Fréquence taille des mulets jaunes
dans le fleuve Sénégal
La fréquence taille la plus élevée est
notée au mois de juillet voir figure n°6.
III. 3.2.3.1. Méthode de Powell- Wetherall (1986)
Selon BEDDA et BOUFERSAOUI (2009), la méthode de Powell
(1979), dont les travaux ont été réalisés par
WETHERALL et al. (1986) qui ont développé une
méthode mathématique rigoureuse pour l'estimation de L8 et de Z/K
à partir des fréquences de longueurs représentatives d'une
population à l'équilibre.
Cette méthode analyse donc les structures de taille,
c'est-à-dire qu'elle ne nécessite pas d'informations sur
l'âge (HEMIDA, 2005).
Cette méthode propose une application de
l'équation de BEVERTON et HOLT (1956) cité par BEDDA et
BOUFERSAOUI (2009).
Z=K*(Lm-L')
Lm : la longueur moyenne des
poissons de longueur L' et plus
L' : la longueur au-delà de laquelle
tous les poissons sont pleinement exploités.
Ainsi, en portant sur un graphique Lm-L'
en fonction de L', on obtient une régression linéaire
à partir de laquelle on peut estimer a et b et par conséquent L8
et Z /K (Sparre et Venema, 1996).
Le programme informatique FISAT II permet directement
l'application de la méthode pour l'estimation de L8 et Z/K voir figure
n°7
Chez Mugil cephalus, la valeur de la longueur
asymptotique obtenue par la méthode de Powell-Wetherall (1986) (L8=
45.08cm) est supérieure à la taille maximale observée qui
est égale à L=43cm. La valeur de Z/K est de 2.85. Autrement, il
serait rare de voir un pêcheur capturer un mulet jaune dans l'estuaire du
fleuve Sénégal avec une taille supérieure à
50cm.
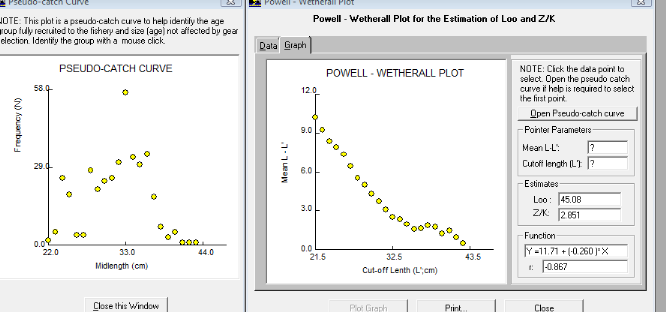
Figure
7 : Estimation des valeurs de la longueur asymptotique
et de Z/K du M. cephalus
III. 3.2.3.2. Taille maximale par la méthode des
prévisions
La taille maximale observée sur le terrain lors des
mensurations est de L= 43cm. Avec le logiciel FiSATII, nous avons
déterminé la valeur asymptotique de la taille L8=50.33cm. La
figure n°8 montre que la taille peut augmenter progressivement
jusqu'à atteindre une valeur extrême de L= 92cm. Cette valeur peut
être inférieure ou légérement supérieure
à 92cm. Elle est appélée la taille maximale par
prévision. Selon OULD MOHAMED VALL (2004), dans la littérature,
des auteurs ont indiqué que la taille maximale du mulet jaune peut
atteindre 120 cm pour 12 kg. Cette hypothèse reste à être
confirmée. La différence de taille peut être
expliquée par les facteurs écologiques mais aussi par la
présence ou non de pressions anthropiques. Autrement, dans les milieux
protégés, il est probable d'y trouver des mulets de cette
taille.
Figure
8 : Taille maximale prévue pour le mulet jaune
dans l'estuaire du fleuve Sénégal
III. 3.2.6. Les paramètres d'exploitation
III. 3.2.6.1. Estimation de la mortalité (Z)
Z est défini comme le coefficient instantané de
mortalité totale, avant d'estimer séparément la
mortalité par pêche et la mortalité naturelle, il est
commode d'évaluer la mortalité totale (Gulland, 1969). Nous avons
utilisé plusieurs méthodes pour déterminer la
mortalité (Z)
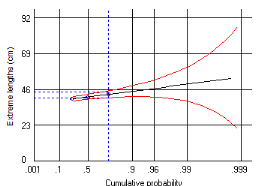
III. 3.2.6.1.1.
Méthode de Jones et Van Zalinge (1981, in Sparre et Venema, 1996)
Les logarithmes népériens des captures
cumulées par le bas (Nicum) sont portés sur
un graphique en fonction des logarithmes népériens de la
différence (L8 - Li). La distribution de fréquences de taille est
utilisée avec un intervalle de classe constant.
L'équation s'écrit :
Ln (Ni cum) = Z/K Ln (L8- Li) +
b
Dans cette expression Li représente la limite
inférieure de la classe de rang i. Pour notre étude
Li= 22cm. Les paramètres de cette droite de pente Z/K, sont
déduits du calcul de la régression linéaire. La
mortalité instantanée Z est de 1.671 (voir figure
n°9).
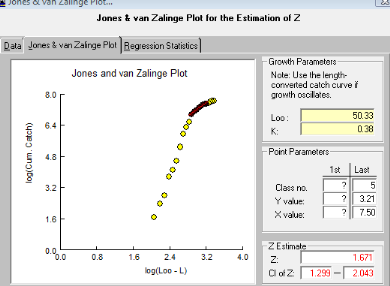
Figure 9:
Détermination de Z selon la courbe de Jones & van
Zalinge
III. 3.2.6.1.2.
Méthode de la Courbe de capture fondée sur la longueur
La courbe de capture fondée sur la longueur (figure
n°10) dans FISATII, donne une valeur de Z qui est égale à
0.38. La courbe fournit une valeur de M=0.62.
Cette valeur Z trouvée est différente de celle
au niveau de la courbe de Jones et Van Zalinge.
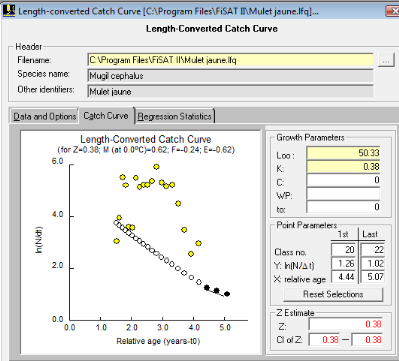
Figure
10: Courbe de capture des mulets jaunes du
Sénégal fondée sur la longueur
La figure n°11 représentant les variations de la
probabilité (P) en fonction des centres de classe de tailles (Li),
permet d'estimer graphiquement la taille de sélection Lc, correspondant
à l'abscisse au point d'ordonnée 50%. La taille moyenne de
première capture déterminée ainsi est de
L25=20.67 cm. Elle est relative à un groupe d'âge moyen
de première capture environ égale à 1.02 ans. La taille de
la sélection est L50= 21.75cm. Elle semble être la
taille à la première maturité sexuelle. Pour
déterminer la véritable taille à la première
maturité sexuelle des mulets jaunes, il faut une étude
simultanée de la structure histologique des ovaires et des Rapports
Gonado-Somatiques(R.G.S).
Autrement, tous les mulets jaunes ayant cette taille sont
susceptibles d'être capturés par les engins de pêche
utilisés dans la zone. Pour L75=22.06 cm, cela signifie que
tous les poissons de l'espèce Mugil cephalus ayant cette taille
seront sûrs d'être capturés s'ils rencontrent les engins de
pêche. Sur la figure 11, la probabilité de sélection pour
un individu va de L25=20.67cm à L=41cm.
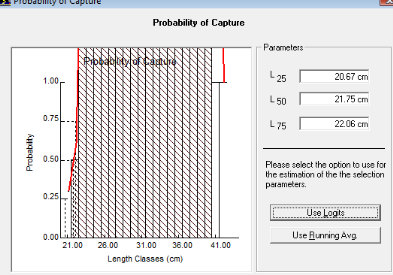
Figure
11: Les paramètres de sélectivités M.
cephalus de l'estuaire du fleuve Sénégal
III. 3.2.6.1.2.
Méthode de Beverton et Holt (1956) à partir des longueurs
moyennes
Berveton et Holt ont montré que :
Z= K ( L8 -Lmoy)/(Lmoy -
L')
L moy : La longueur moyenne du poisson
traité dans la distribution de fréquence,
L' : la longueur minimale du poisson
traité dans la distribution de fréquence ou plus petite limite
des classes (CADIMA, 2002).
Lmoy = 32.5cm
L'=22cm
Cette méthode nous a permis de déterminer une
autre valeur de Z=0.645 qui est différente des autres valeurs qui sont
respectivement Z= 1.671 pour la méthode de Jones et Van Zalinge et
Z=0.38 pour la méthode de la Courbe de capture fondée sur la
longueur.
Ces différentes valeurs pourraient s'expliquer par :
· la qualité de l'échantillon ;
· la différence des méthodes
utilisées pour l'estimation des paramètres de
croissance ;
· les fluctuations des conditions du milieu
(température, salinité,...) influencent directement sur la valeur
de K et L8 donc sur la croissance
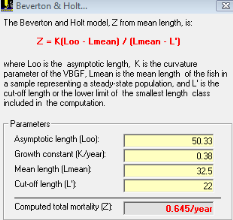
Figure
12: Valeur de la mortalité instantanée des
mulets jaunes de l'estuaire du fleuve Sénégal selon la longueur
moyenne
Selon BEDDA et BOUFERSAOUI (2009), plusieurs
auteurs s'accordent sur la méthode de Jones et Van Zalinge. Pour les
déterminations du taux d'exploitation, nous avons choisi
Z= 1.671 pour le reste de notre étude.
III. 3.2.6.2. Mortalité naturelle (M)
III. 3.2.6.2.1.
Méthode de Pauly (1985)
Pour déterminer la mortalité naturelle (M), nous
avons utilisé l'équation empirique de Pauly :
Log(M)= -0.0066-0.279Log(L8) + 0.6543Log(K) + 0.4634Log(T)
avec
L8= 50.33cm pour notre étude
K= 0.38
T= 15°C est la température moyenne annuelle du
milieu pour les mois les plus froids.
M= 0.61 an-1
III. 3.2.6.2.2.
Méthode de Djabali et al. (1993)
L'équation de Djabali et al. (1993),
déduite de régressions linéaires multiples, est
basée sur les paramètres de croissance et de mortalité de
56 stocks de poissons vivants en Méditerranée.
Log10 M = - 0,0278 - 0,1172 Log10 L8+
0,5092 Log10 K
Pour L8= 55.33cm et K=
0.38
M= 0.64
Nous avons utilisé le logiciel FiSATII pour ces
différentes méthodes.
III. 4.2.6.2. Estimation de
la mortalité par pêche (F)
Connaissant M et Z, le taux de mortalité par
pêche peut être déduit de la relation :
Z=M+F
F= Z-M pour Z=1.32/an et M= 0.618 F= 0.702/an
III. 3.2.6.3. Estimation du
taux d'exploitation (E)
Le taux d'exploitation (E) est défini par Pauly (1985)
comme étant la quantité :
E = F / (F + M) = F / Z E=0.531
Ce taux permet à lui seul d'estimer
(grossièrement) si un stock est surexploité ou non, à
partir de l'hypothèse que la valeur optimale de E (Eopt) est
voisine de 0,5. Cette hypothèse, E 0,5 = taux d'exploitation optimal,
repose elle-même sur une autre hypothèse, à savoir que la
prise équilibrée potentielle est optimisée quand F= M
(Gulland 1971, In Pauly,1985).
Pour notre étude le taux d'exploitation E=0.531 nous
permet de conclure que le milieu semble être surexploité. La
valeur de E est voisine de sa valeur d'équilibre dynamique.
Malgré pour les pêches croissantes, l'espèce Mugil
cephalus parvient à proliférer et maintenir son rythme de
croissance. Cette situation s'explique par la disponibilité des
ressources alimentaires. La zone est très riche en plancton et
phytoplancton.
Cependant les pêcheurs ont tendance à utiliser
des filets monofilaments de petites mailles souvent inférieures à
50 cm de diamètre. Les alvins sont souvent les plus capturés
entre les mois de juin jusqu'au mois d'août. Cette période
coïncide avec la migration des bancs vers les côtes mauritaniennes.
Il semblerait que l'espèce n'est pas
surexploitée mais il se pose un problème d'aménagement des
ressources halieutiques dans la localité.
III. 3.2.6.4. Recrutement
et sélection
Les poissons de tailles ou d'âges divers ne subissent
pas tous la même mortalité par pêche : les petits
peuvent s'échapper à travers les mailles d'un filet, ou ne pas se
trouver dans la principale zone exploitée. Il est utile de distinguer
l'élément provenant uniquement du comportement (au sens le plus
large) des animaux mêmes - recrutement - et celui qui est dû
à la sélectivité de l'engin de pêche (FONTANA,
1983).
Le recrutement est le processus par lequel un groupe
d'âge arrive pour la première fois dans une pêcherie. La
sélection est le phénomène d'entrée progressive du
poisson dans les captures (FONTANA, 1983).
III. 4.2.6.4.1. Estimation
des tailles des recrues
L'estimation du rythme de recrutement est divisée en
deux groupes (voir figure n°13).
Pour le premier groupe le niveau maximum de recrues est
atteint au niveau du 4ème sous groupe. A ce niveau 10% des
individus sont remplacés par les nouvelles recrues.
Pour le second groupe, le niveau maximum de recrues est
atteint aussi au niveau du 4ème sous groupe. Le taux de
recrutement est de 25%, largement supérieur à celui du premier
groupe.
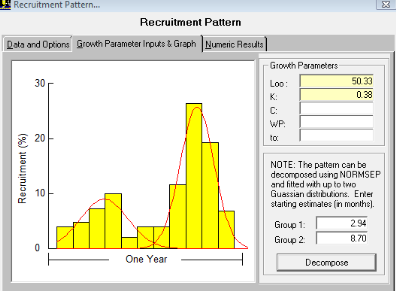
Figure
13 : Estimation des rythmes de recrutement des mulets
jaunes dans le fleuve Sénégal
L'arrivé de nouvelles recrues dans la biomasse va
permettre de compenser les pertes dues à la mortalité naturelle
et à la mortalité par pêche. La figure n°13 montre que
seulement le quart des individus exploités est remplacé au
deuxième groupe. Il est judicieux de diminuer le taux d'exploitation
pour équilibrer la biomasse.
III. 3.2.6.4.2. Estimation
de la taille de sélection
Les individus de la classe de taille L=31.5cm ont une
probabilité de capture plus élevée que les autres. Pour la
sélectivité des engins par rapport à la classe des
longueurs des poissons, nous avons utilisé le logiciel FISATII.
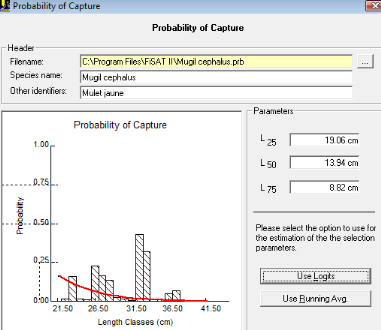
Figure
14 : Probabilité de capture des
mulets jaunes de l'estuaire du fleuve Sénégal
Les résultats montrent que les classes de tailles les
plus capturées sont respectivement 21.50cm, 26.50cm et 31.50cm. De rares
individus sont capturés dans les classes de taille de 41.50cm. Ce
résultat est en conformité avec les données des
mensurations sur le terrain car nous avons un seul poisson mesurant 41cm.
Plusieurs engins de pêche sont utilisés pour la
capture des mulets jaunes. Les filets maillants dérivant de surface sont
les plus utilisés dans la zone avec des mailles de Ø= 54mm et de
Ø=60cm.
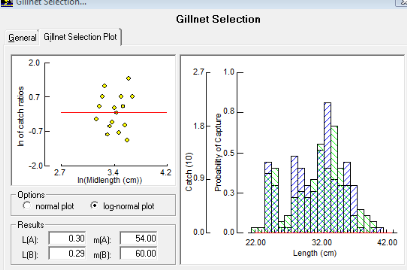
Figure 15 :
Courbe de sélectivité des mulets jaunes de
l'estuaire du fleuve Sénégal par filet maillant
La figure n°15 montre que la probabilité qu'un
individu soit capturé est plus élevée pour L=33cm. La
sélectivité des filets maillant de Ø= 32cm est plus
importante chez les mulets jaunes surtout avec des tailles inférieures
ou égales à 32cm. En plus pour les gros poissons il faut utiliser
des filets maillant de Ø=60cm.
III. 3.2.6.4.3. Estimation
du niveau d'exploitation
Pour les différentes tailles de première capture
Lc et en fonction du taux d'exploitation E,
le rendement relatif par recrue Y'/R augmente jusqu'à
un maximum puis diminue. Les valeurs du taux d'exploitation (E) qui apportent
un meilleur rendement varient de 0.45 à 0.52 (voir figure n°16).
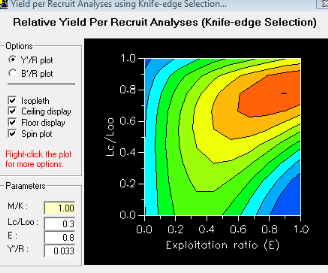
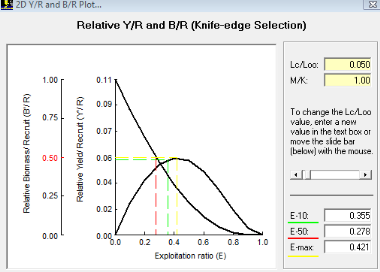
Figure 16 :
Courbe de la méthode « knife-edge
Selection » pour M. cephalus dans le fleuve
Sénégal
Le taux d'exploitation E-10 est le taux
d'exploitation actuel qui est égal à 0.355. Pour ce stock,
l'exploitation se trouve sur la partie ascendante de la courbe. Ce taux est
proche du rendement optimum (E-max=0.421). Donc l'exploitation est
au niveau du plateau de leur courbe correspondant ainsi à un
rendement optimal car le E-max reste
supérieur au E actuel. Pour notre étude la partie
exploitée correspond à la partie ascendante de la courbe (figure
n°16).
Le niveau optimum du rendement relatif par recrue est atteint.
Mais l'espèce n'est pas surexploitée. Les pêcheries ne sont
pas bien aménagées dans la région de Saint-Louis.
III. 3.2.7. Analyse de population virtuelle
III. 3.2.7.1. Analyse de population virtuelle fondée
sur l'âge
Les paramètres de croissances et d'exploitation nous
ont permis d'établir les histogrammes des populations virtuelles avec le
logiciel FISATII (figures n°17 et 18) ;
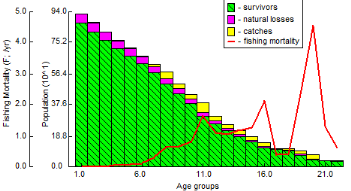
Figure
17 : Histogramme des populations virtuelles de M.
cephalus dans l'estuaire du fleuve Sénégal fondées sur
l'âge
La mortalité par pêche est faible au temps t=1an
jusqu'à t=6ans, puis elle a augmenté rapidement avec l'âge
jusqu'à atteindre un pic de 3.75%o à t=16ans. Par contre la
mortalité naturelle est plus importante chez les juvéniles que
chez les adultes. Les captures aussi augmentent avec le temps contrairement au
stock qui diminue avec l'âge des individus. Ce phénomène
s'explique par un taux de recrutement faible inférieur à 50%. Le
stock diminue à cause de la prédation, de la mortalité
naturelle et de la mortalité par pêche.
III. 3.2.7.2. Analyse de population virtuelle fondée
sur la longueur
La mortalité naturelle est plus importante chez les
juvéniles (L=22cm) que chez les adultes L=32cm. La mortalité
naturelle a diminué progressivement et ce phénomène
pourrait s'expliquer par le fait que les jeunes individus sont plus
vulnérables.
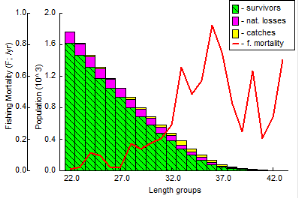
Figure 18 :
Histogramme des populations virtuelles de M. cephalus dans
l'estuaire du fleuve Sénégal fondées sur la
longueur
La mortalité par pêche augmente progressivement
contrairement à la mortalité naturelle. Plus les individus
deviennent matures, plus ils sont capturés. La probabilité de
capture des mulets jaunes augmente en fonction la taille de l'espèce.
III. 3.2.8. Les Captures Par Unités d'Exploitation
(CPUE)
La biomasse de l'échantillon de la population est la
somme des biomasses de chacun des groupes d'âge qui constituent cet
échantillon (Ricker, 1968 In FAO, 2002).
Nous avons utilisé une fiche de collecte pour connaitre
la quantité débarquée en moyenne et le temps passé
en mer.
La CPUE est définie comme le poids des prises par
unité d'effort, exprimée en g /pêcheur / heure de
pêche.
Pour la période de notre enquête, l'effort de
pêche au mulet a fortement diminué à cause de la migration
des espèces vers les côtes mauritaniennes. Les pêcheurs ont
en moyenne 25kg pour une durée de 8 heures. Le plus souvent ils vont en
mer à partir de 19h et débarquent vers 6h le matin. Ils font 3
heures de route pour arriver aux débarcadères. Ils sont en
moyenne 4 pêcheurs par pirogues. Donc la cpue est de
718.25g /pêcheur/heure. La CPUE traduit l'abondance réelle du
stock total. Autrement les mulets jaunes existent en quantité dans la
zone.
III. 3.3. ANALYSES ECOLOGIQUES
III. 3.3.1. Les profondeurs pour capturer Mugil cephalus
Le mulet jaune est une espèce pélagique qu'on
trouve dans les côtes à moins de 10m de profondeur. Les
résultats des enquêtes ont révélé
que :
-88.46% des pêcheurs pratiquent la pêche au mulet
dans les zones non profondes comprises entre 0 et 4 mètres. Ils
utilisent des filets maillants dérivant de surface.
- 11.54% vont au delà de 10 mètres de
profondeurs et ils utilisent des sennes tournantes.
III. 3.3.2. Les migrations sur la grande Côte au
Sénégal et en Mauritanie
Selon Ould Mohamed Vall (2004), les premiers migrants des
mulets jaunes venant du sud rentrent dans le Banc d'Arguin par l'ouest
dès la fin de la saison froide (mai). Vraisemblablement, ils doivent
être principalement attirés par les températures plus
élevées permettant un métabolisme plus efficace
malgré le stress d'une salinité plus élevée.
Les courants jouent un rôle important dans la migration,
plus particulièrement des juvéniles. C'est ainsi qu'après
la ponte dans la partie sud du littoral, les oeufs et les larves
pélagiques dérivent avec le courant vers l'aire de croissance
dans le bas delta du fleuve. Ils doivent rester jusqu'à l'âge de
deux ans avant de regagner à nouveau la mer en sortant par la langue de
barbarie. Il semblerait qu'ils reprennent le cycle de migration des adultes en
remontant la plage de façon plus côtière vers Nouakchott
avant de rentrer au Banc d'Arguin en suivant les premiers reproducteurs.
III. 3.3.2.1. La migration des adultes
A partir d'Octobre apparaissent dans la pêcherie
piroguière de Saint-Louis, des vagues successives de mulets jaunes
composés de cohortes d'âges différents.
Les plus jeunes de taille comprise entre 19
et 24cm et âgés de moins de 3ans arrivent les premiers.
Les classes d'âge intermédiaire (taille L=24
à 29cm, âgés de 4 à 6 ans) apparaissent en
Décembre. Leurs déplacements vers le nord se stabilisent entre
décembre - février entre Saint Louis et les côtes
mauritaniennes.
Les mulets jaunes de plus de 6 ans (taille supérieure
à 30cm) présents au nord de Saint Louis, apparaissent en
Mauritanie entre avril-juin. Il s'agit vraisemblablement d'une phase de
concentration liée à la maturité sexuelle d'individus
jusque là dispersés au dessus des fonds de moins de 10 m
où la nourriture est abondante. A partir du mois de juin ces bancs
quittent la Grande Côte d'autant plutôt que le réchauffement
des eaux est précoce et rapide.
Ils ne sont que peu capturés à Saint-Louis
où l'effort de pêche est encore réduit fin juin et
début juillet. Ils disparaissent lorsque la température des eaux
de surface dépasse 24°C.
III. 3.3.2.2. La migration des immatures
Leurs déplacements sont moins bien connus parce qu'ils
ne font pas l'objet d'une exploitation particulière et qu'ils sont donc
plus difficiles à échantillonner. Il est vraisemblable qu'une
partie importante des individus nés au large du Banc d'Arguin se
développent dans les baies et chenaux avoisinant celui-ci et y restent
de 1 à 2 ans. Ils se concentrent dans des secteurs
privilégiés où les eaux sont calmes et la nourriture
abondante, notamment dans le complexe estuarien du Fleuve
Sénégal particulièrement dans le Parc National de la
Langue de Barbarie, dans l'Aire Marine Protégée de Saint Louis
côté Sénégal et dans le Parc National du Banc
d'Arguin côté Mauritanie. Ils rejoignent la population migrante
entre 2 et 3 ans.
III. 3.3.3. Les milieux fréquentés par
l'espèce
Les résultats de nos enquêtes ont
révélé que :
- 56,72% des pêcheurs affirment que les mulets pondent
dans des zones réputées calmes dans la mer. Pour eux ces zones
peuvent êtres des aires marines protégées, des
récifs naturels ou artificiels. Ils pensent que les mulets migrent vers
les côtes et rejoignent parfois le fleuve
- 43,28% des personnes interrogées pensent que les
mulets pondent dans le fleuve. Ils rejoignent après la mer.
Cependant ils affirment à l'unanimité que
l'espèce Mugil cephalus préfère les eaux
saumâtres. L'espèce vit à la fois dans les zones maritimes
et fluviales.
III. 3.4. LES TECHNIQUES DE PECHES AU MULET JAUNE
III. 3.4.1. Les engins de pêches
III. 3.4.1.1. Les filets de pêche
Dans la localité, les pêcheurs au mulet jaune
utilisent souvent 3 filets de natures différentes. Les types de
pêches sont :
- Filets maillants dérivant de surface (FMDS) :
65% des individus interrogés l'utilisent avec des mailles de
diamètre allant de 56 à 60mm ;
- Sennes tournantes (ST) : utilisés par 18 % des
pêcheurs de la localité. Les mailles de ces filets vont de 09
à 12mm selon les personnes enquêtées ;
- Sennes de place (SP) utilisés par 13% des
pêcheurs pour capturer le mulet jaune.
- Eperviers (EP) qui représentent 4% de notre
échantillon. Les utilisateurs des éperviers sont localisés
dans le fleuve mais aussi dans l'estuaire du fleuve Sénégal.
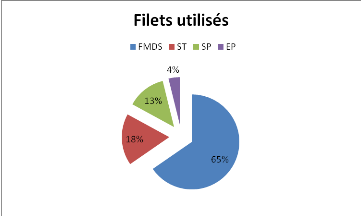
Figure 19 :
Types de pêche dans la région de Saint Louis
III. 3.5. Contribution des aménagements dans la gestion
des stocks de mulets jaunes
III. 3.5.1. Les Aires Marines Protégées du
Nord
L'aménagement des pêcheries consiste à
mettre en place un ensemble de mécanismes qui permettent non seulement
l'adéquation des moyens d'exploitation mis en oeuvre avec les
capacités de production des stocks, mais en plus, la maîtrise de
l'exploitation afin de garantir un développement durable pour le bien
être socio-économique des populations sans préjudice
à l'environnement. Cependant il est nécessaire pour le
Sénégal d'élaborer un plan d'aménagement
côtier pour la pêche artisanale. Il faut observer pour chaque
année un arrêt biologique pour restaurer certains
écosystèmes dégradés.
La création des aires marines protégées
du nord notamment le Parc National de la Langue de Barbarie et l'Aire Marine
Protégée de Saint-Louis ont pour objectifs la conservation et
l'exploitation rationnelle des ressources naturelles en général
et des espèces halieutiques en particulier pour un développement
durable. Ces aires protégées vont permettre :
- la reconstitution des habitats du mulet jaune grâce
à l'utilisation de méthodes de pêche non destructives des
environnements marins, surtout des fonds rocheux ou des herbiers marins qui
constituent des habitats pour de nombreuses espèces halieutiques.
Cependant il faut appliquer la réglementation sur l'utilisation des
filets mono filaments.
- la reconstitution des dynamiques naturelles des populations
de Mugil cephalus. La dégradation des habitats et la
surpêche pourraient enclencher une dynamique de colonisation des
écosystèmes marins et fluviaux par des espèces plus
résistantes ou à reproduction plus rapide. Cela s'est
également traduit par une réduction de la biomasse et par une
diminution de la taille des mulets jaunes. L'application de méthodes de
gestion des stocks dans les Aires Marines Protégées du nord,
devrait signifier un retour à des conditions biologiques naturelles
favorables à l'augmentation de la biomasse des mulets jaunes et à
une plus grande diversité des espèces ;
- la reconstitution des stocks de mulet jaune due à
l'amélioration des habitats, l'utilisation de méthodes de
pêche responsables et l'instauration de règles d'accès
à la ressource pour une exploitation durable et consensuelle.
III. 3.5.2. Les aspects réglementaires
A l'instar des autres pays de la sous-région, le
Sénégal dispose d'un code de la pêche pour mieux
gérer ses ressources halieutiques. Il est défini par la loi 76-89
du 21 juillet 1976 abrogée et remplacée respectivement par la loi
87-27 du 18 août 1987 et la loi 90-32 du 14 avril 1988 et ses
décrets d'application. Les droits d'usage et les normes d'utilisation
des ressources halieutiques sont définis dans ce code. Cependant il
n'existe pas de dispositions spécifiques pour la pêche au mulet
jaune. Mais les engins de pêche ciblant spécifiquement ou
accessoirement le mulet jaune sont régis par le code de la
pêche.
Les articles 28 et 29 du décret 98-498 ont fixé
les mailles des filets. Sur le terrain de telles dispositions ne sont pas
appliquées car nous avons constaté que les pêcheurs
utilisent souvent des filets de petites mailles en raclant tout sur leur
passage.
L'article 30 du décret 98-498 interdit l'utilisation de
filets maillants fabriqués à partir d'éléments mono
filaments et multi filaments. Et pourtant la plupart des pêcheurs les
utilisent sans être inquiétés par les techniciens en charge
de la réglementation de la pêche dans la région de
Saint-Louis.
La taille marchande des espèces
débarquées est définie par l'article 27 du décret
98-498 pour pérenniser les ressources halieutiques. Sur avis
scientifique, la taille minimale de capture des individus doit
impérativement être supérieure à la taille de
première maturité sexuelle. A ce stade de développement,
l'individu assure sa première ponte et contribue au renouvellement du
stock par la venue de nouveaux recrus. L'immatriculation des pirogues pose
beaucoup de problèmes car certains n'adhèrent pas à cette
politique initiée par le gouvernement du Sénégal.
CONCLUSION ET RECOMMANDATIONS
L'exploitation du mulet jaune dans l'estuaire du
fleuve Sénégal occupe une place privilégiée dans le
secteur de la pêche dans le Département de Saint Louis. Les
difficultés rencontrées dans la pêche au mulet sont
liées à une augmentation de l'effort de pêche, aux facteurs
environnementaux et socio-économiques.
Les résultats de l'étude ont montré que
les juvéniles sont souvent capturés par les pêcheurs de la
localité. La fréquence taille est une parfaite illustration de
cette mauvaise pratique de la pêche. Elle montre que la plupart des
individus capturés ont des tailles comprises entre 24 et 33cm de
longueur. Il est très rare d'observer sur le terrain des mulets jaunes
qui ont des tailles qui dépassent 38cm.
L'étude a montré une corrélation positive
entre les paramètres taille-poids avec une allométrie minorante,
autrement dit le poids croit relativement moins vite que la longueur.
Cependant les paramètres d'exploitation ont
révélé que :
- une mortalité instantanée faible
Z=0.38an-1 selon la méthode de la Courbe de capture
fondée sur la longueur ;
- un taux d'exploitation équilibrée
E=0.531 ;
De ces résultats, nous pouvons déduire que
l'espèce n'est pas surexploitée dans la zone. Mais la
rareté des mulets jaune entre juin et août est liée
à la migration de l'espèce.
L'arrivée des nouvelles recrues a permis de maintenir
les stocks à un niveau satisfaisant.
Les pêcheurs continuent à utiliser des filets
mono filaments jugés dangereux et qui sont interdits par la
réglementation. La migration de l'espèce Mugil cephalus
se fait à partir de la Grande Côte au Sénégal vers
les côtes mauritaniennes.
Les aires marines protégées du nord constituent
des lieux de ponte pour l'espèce étudiée. Il est
évident que l'augmentation des stocks de mulets jaunes dans l'estuaire
du fleuve Sénégal, dépend, en grande partie, des efforts
qui seront déployés pour un aménagement et une
préservation durable des écosystèmes marins et
côtiers. Le Sénégal et la Mauritanie ont mis en place un
projet concerté sur la gestion des ressources halieutiques en
particulier pour le mulet jaune, le tassergal et la courbine.
Pour meilleure gestion des pêcheries de mulets jaune
dans l'estuaire du fleuve Sénégal, l'étude
recommande :
ü une diminution de l'effort de pêche pour le mulet
jaune par l'amélioration de la production halieutique avec le
développement de la pisciculture dans la zone ;
ü une gestion efficace et concertée des
pêcheries du mulet par une redéfinition des conditions
d'accès aux ressources en instaurant une taxe sur le mulet jaune.
ü Faire respecter les articles 28 et 29 du décret
98-498 fixant le maillage des filets ;
ü Décréter une période de repos
biologique sur la pêche au Sénégal ;
ü Mettre des moyens pour aménager les zones de
pêche en mettant des balises et récifs artificiels dans les aires
marines protégées du nord. Mais aussi il faut doter les parcs
nationaux des moyens logistiques et d'un personnel qualifié pour une
meilleure gestion de ces aires marines protégées.
BIBLIOGRAPHIE
1. ANDERSEN, P., 2008. Diagnostic national
sur la situation sociale du travail et de l'emploi dans secteur de la
pêche au Sénégal. Project pour le développement
rationnel et durable du secteur de la pêche (INT/07/16M/SPA),
Organisation Internationale du Travail, 208p.
2. ANONYME, 2005. Profil environnemental de
la ville de Saint Louis, Commune de Saint Louis. Agence du Développement
Communal de Saint Louis, 220 p.
3. BARRUSSEAU J., P., et al., 1985.
Mise en évidence du fonctionnement inverse de certains estuaires
tropicaux. Conséquences géomorphologiques et
sédimentologiques In: Sedimentology, 32(4), 543-552.
4. BEDDA, M. et BOUFERSAOUI, S., 2009.
Croissance et exploitation de deux espèces de poissons plats
pleuronectiformes des eaux algériennes : Citharus
linguatula (Linnaeus, 1758) et Dicologlossa cuneata (Moreau,
1881). Mémoire de fin d'études pour l'obtention du titre
Ingéniorat d'Etat, Université Houari Boumediene, 48p.
5. BERTALANFFY, L., V., 1938.
A quantitative theory of organic growth. (Inquiries on growth laws
II). Hum. Biol. 10: 181-213.
6. BEVERTON R., J., H. et HOLT, S.,
J., 1956. A review of methods for estimating mortality rates in
exploited fish populations, with special reference to sources of bias in catch
sampling. Rapp.P.-V.Réun. CIEM, 140:67-83.
7. BHATTACHARYA, C., G.,
1967. A simple method of resolution of a distribution
into Gaussian components. Biometrics, (23): 115-135.
8. CADIMA E. L., 2002.
Manuel d'évaluation des ressources halieutiques.
F.A.O. Doc. Tech.Pêches. (393): 160 p.
9. CURY , P. et ROY , C., (1991).
Pêcheries Ouest -Africaine. Variabilité, instabilité et
changement climatique. ORSTOM/France 525p.
10. DEME, M., et al., 2007. Diagnostic des
Pêcheries de Mulets sur la Grande Côte du Sénégal.
Rapport d'études du Projet d'appui à la gestion concertée
des stocks de Mulets, Courbine et Tassergal au Sénégal et en
Mauritanie. CRODT, 25p.
11. DIA, A.M., 2000. Ecoulements et
inondations dans l'estuaire du Fleuve Sénégal : cas de la
ville côtière de Saint- Louis. Mémoire de fin
d'études pour l'obtention DEA Géographie, Université
Cheikh Anta Diop, Sénégal, 58p.
12. DIONE, B., NDIAYE, B et al. 2010.
Stratégie Régionale de Gestion des Aires Protégées.
Document introductif de l'atelier régional de Saint Louis, DEFCCS,
Inspection régionale de Saint Louis, 32p.
13. DIOP, A., 1998. Salinité des sols
de la Moyenne Vallée du fleuve Sénégal : zone de mboyo,
aspects morphologiques et géochimiques. Mémoire pour l'obtention
du Diplôme d'Etudes Approfondies, Université Cheikh Anta
DIOP/Sénégal, 54p.
14. DJABALI, F., et al., 1993.
Empirical equations for the estimation of natural mortality in
Mediterranean teleosts. Naga ICLARM Q. 16(1):35-39
15. DOMAIN, F., 1978. Potentialités
comparées des différentes zones de pêche d'espèces
démersales du Golfe de Guinée (19°N-6°S). In
Recueil des communications présentées par le CRODT au symposium
sur le courant des Canaries : upwelling et ressources vivantes (Las
Palmas, 11-14 avril 1978). Document scientifique, CRODT/ISRA
16. DUBOIS, J., 1955 : Les sols du delta du
Sénégal. Bull. de la MAS, 77p.
17. FAILLER, P., DIOP, M., et al.
2006. Évaluation des stocks et
Aménagement des pêcheries de la ZEE mauritanienne. Rapport du
cinquième Groupe de travail IMROP Nouadhibou, Mauritanie, 9-17
décembre 2002, FAO, 191p.
18. FAO, 1985. Species identification
sheets: MUGIL vala 3, fishing area 51(W. Indian Ocean), 8p.
19. FAO, 2000. Situation des pêches et
de l'aquaculture (SOFIA). Rapport annuel, Département des pêches
et de l'aquaculture, FAO, Rome, 138p.
20. FAO, 2002. Evaluation des stocks et
aménagement des pêcheries de la ZEE mauritanienne. Rapport du
cinquième groupe de travail IMROP, Mauritanie, 191p.
21. FAO, 2008. Vue générale du
Secteur des pêches National/La République du
Sénégal. Rapport Profils des Pêches et de l'Aquaculture par
Pays, Rome, 27p.
22. FERRARIS, J. et SAMBA, A., année
non précisée .Variabilité de la pêche artisanale
sénégalaise et statistique exploratoire, ORSTOM, 22p.
23. FONTANA, A. et al. ,1983.
Pêche, Biologie et Dynamique du Tassergal (Pomatomus
saltator, Linneaeus, 1776) sur les côtes
Sénégalo-mauritaniennes. Travaux et documents de l'ORSTOM,
193.
24. HATHIE, I., 1985. Le GIE des
pêcheurs piroguiers comme stratégie d'adaptation à une
conjoncture défavorable : cas de Guet-Ndar-Saint-Louis.
Mémoire de fin d'études : ENEA, Dakar, 114 p.
25. JOUANNEAU, J., M., 198 1.The girond
estaury. Contributions to sedimentology, no 10,118 p.
26. KANE, A., 1985. Le bassin du fleuve
Sénégal à l'embouchure, flux continentaux dissous et
particulaires, invasion marine dans la vallée du fleuve
Sénégal. Thèse de doctorat de 3e cycle de
géographie physique. Université de Nancy II. 205 p
27. KANE, A., 1997. L'après barrage
dans la vallée du fleuve Sénégal : Modifications
hydrologiques, géochimiques et sédimentologiques.
Conséquences sur le milieu naturel et les aménagements
hydro-agricoles. Thèses de doctorat d'Etat, Univ. Dakar.55 1p.
28. KANE, A., 1999. Les crues à Saint
Louis d'hier à d'aujourd'hui. Malgré deux siècles
d'endiguement, tout est à refaire. In Sud week-end du Samedi 27 novembre
1999
29. KANE, A., T., DIOP, O. et THIAM, P., S.,
2008. Monographie de la pêche artisanale et de la forêt.
Rapport final sur la pêche artisanale. Agence Nationale de la Statistique
et de la Démographie, 28p.
30. KEBE et al., 1991.
Problématique des relations entre la pêche artisanale et la
pêche industrielle : cas des ressources démersales » in
La recherche face à la pêche artisanale. Documents
scientifiques, Symposium, éditions de l'ORSTOM, 933-941
31. NDIAYE, G., BA, B., et FAYE, A.,
2003. Contribution a l'atelier sur les reformes
fiscales pour les pêches à FAO/ROME. Ministère de la
Pêche/ Sénégal, 22p.
32. OULD MOHAMED VALL, M., 2004. Etude de la
dynamique des systèmes d'exploitations et de l'éco biologie de la
reproduction, de trois mugilidés : mugil cephalus (linnaeus,
1758), liza aurata (perugia, 1892) et mugil capurrii (risso,
1810), analyse de leurs stratégies d'occupations des secteurs littoraux
mauritaniens et de leurs possibilités d'aménagement. Thèse
de Doctorat en Sciences, Université de Nice- Sophia Antipolis, 120p.
33. Pauly D., 1985. Quelques
méthodes simples pour l'estimation des stocks de poissons tropicaux.
FAO Doc. Tech. Pêches, (234) : 56p.
34. PRITCHARD, D., W., 1955. Estuarine
circulation patterns. Proc. Am. Soc. Engin., New York, vol.
81, pp.1-11.
35. SALL, M., 1982 - Dynamique et
morphogenèse actuelles au Sénégal occidental. Thèse
de doctorat d'Etat, Univ. Louis Pasteur, Strasbourg, 604 p.
36. SECK, M., 2004. Inondation à
l'embouchure du fleuve Sénégal : hydraulique fluviale et
aménagements. Mémoire pour l'obtention du DESS en Hydraulique et
aménagement. Ecole Inter Etats des Ingénieurs de l'Equipement
Rural/ Burkina Faso, 69p.
37. SENE A., 1985. Les transformations
sociales dans la pêche maritime piroguière : conditions de
travail et modes de vie des pêcheurs de Guet-Ndar de Saint-Louis du
Sénégal. Thèse de doctorat : Université de
Toulouse le Mirail. 706 p.
38. SENE, C. et NDIAYE, A., A., 2009. Plan
d'Aménagement de Gestion de l'Aire Marine Protégée de
Saint Louis. Rapport d'étude, version provisoire. Fonds Mondial pour la
Nature (WWF),73p.
39. SPARRE, P. et VENEMA S. C., 1996.
Introduction à l'évaluation des stocks de poissons
tropicaux. Première partie : Manuel FAO. Document technique sur les
pêches numéro 306/2 Rev.1, Rome : 106p. Deuxième
partie : exercice
40. SPARRE P. et VENEMA S. C., 1996.
Introduction à l'évaluation des stocks de poissons
tropicaux. Première partie : Manuel FAO. Document technique sur les
pêches numéro 306/1 Rev.1, Rome : 420p.
WEBOGRAPHIQUES
www.fao.Org/fi/statist/fisoft/fisat/index.htm,
consulté le à12/04/2010 à 08h09
http://www.isra.sn , consulté le
18/04/ 2010 à 10h20
http://www.fishbase.org ,
consulté le 19/04/2010 à 11h25
www.memoireonline.org
consulté, le 18/04/2010 à 11h23
http://oregonstate.edu/dept/oird/temp/irn/senegal/Crodt.htm,
consulté le 06/06/2010 à 15h00
http://www.fao.org/fishery/fr,
consulté, le 12/06/2010 à 12h00
www.prcm.org , consulté, le
22/06/2010 à 16h09
http://auf-foad.org/moodlefaune
, consulté le 03/07/2010 à 08h32
www.bf.refer.org/peche,
consulté, le 07/07/2010 à 15h12
http://www.aquamaps.org ,
consulté, le 08/07/2010 à 17h27
http://www.oceandocs.org ,
consulté le 10/07/2010 à 12h57
Annexe n°1 : Echantillon collecté (relation
taille-poids)
|
|
Taille (cm)
|
Effectifs
|
Poids (g)
|
|
L1
|
22
|
12
|
58.73
|
|
L2
|
23
|
30
|
66.86
|
|
L3
|
24
|
150
|
75.69
|
|
L4
|
25
|
114
|
85.25
|
|
L5
|
26
|
24
|
95.57
|
|
L6
|
27
|
24
|
106.68
|
|
L7
|
28
|
168
|
118.61
|
|
L8
|
29
|
126
|
131.38
|
|
L9
|
30
|
144
|
145.02
|
|
L10
|
31
|
150
|
159.57
|
|
L11
|
32
|
186
|
175.04
|
|
L12
|
33
|
342
|
191.46
|
|
L13
|
34
|
198
|
208.87
|
|
L14
|
35
|
180
|
227.28
|
|
L15
|
36
|
204
|
246.73
|
|
L16
|
37
|
108
|
267.24
|
|
L17
|
38
|
42
|
288.84
|
|
L18
|
39
|
18
|
311.56
|
|
L19
|
40
|
30
|
335.42
|
|
L20
|
41
|
6
|
360.45
|
|
L21
|
42
|
6
|
386.68
|
|
L22
|
43
|
6
|
414.13
|
Source
(sarr, 2010)
Annexe n°2 : Variation du stock en fonction de la
mortalité par pêche
|
Taille (cm)
|
Captures (nombre)
|
Population (N)
|
Mortalité par pêche (F)
|
Biomasse à l'équilibre (t)
|
|
22.0
|
2.00
|
1765.13
|
0.0083
|
0.02
|
|
23.0
|
5.00
|
1615.05
|
0.0219
|
0.02
|
|
24.0
|
25.00
|
1468.96
|
0.1161
|
0.02
|
|
25.0
|
19.00
|
1310.90
|
0.0944
|
0.02
|
|
26.0
|
4.00
|
1167.49
|
0.0212
|
0.02
|
|
27.0
|
4.00
|
1046.63
|
0.0225
|
0.02
|
|
28.0
|
28.00
|
932.54
|
0.1697
|
0.02
|
|
29.0
|
21.00
|
802.58
|
0.1396
|
0.02
|
|
30.0
|
24.00
|
688.64
|
0.1762
|
0.02
|
|
31.0
|
25.00
|
580.48
|
0.2056
|
0.02
|
|
32.0
|
31.00
|
480.32
|
0.2917
|
0.02
|
|
33.0
|
57.00
|
383.65
|
0.6569
|
0.02
|
|
34.0
|
33.00
|
273.03
|
0.4871
|
0.02
|
|
35.0
|
30.00
|
198.15
|
0.5723
|
0.01
|
|
36.0
|
34.00
|
135.76
|
0.9235
|
0.01
|
|
37.0
|
18.00
|
79.01
|
0.7500
|
0.01
|
|
38.0
|
7.00
|
46.17
|
0.4258
|
0.01
|
|
39.0
|
3.00
|
29.01
|
0.2494
|
0.00
|
|
40.0
|
5.00
|
18.58
|
0.6321
|
0.00
|
|
41.0
|
1.00
|
8.69
|
0.2070
|
0.00
|
|
42.0
|
1.00
|
4.71
|
0.3386
|
0.00
|
|
43.0
|
1.00
|
1.88
|
0.7020
|
0.00
|
Source : Résultats simulation dans FISATII pour
l'analyse des populations virtuelles fondées sur la longueur (sarr,
2010)
Annexe 3 : Fiche de Collecte Débarquement
Zone :
Port : Enquêteur :
Date : / /
|
PE
|
DATE
|
F
|
T
|
LSM
|
LSNM
|
FDS
|
FDF
|
LPG
|
ST
|
FME
|
SP
|
LR
|
LCS
|
LTR
|
PAL
|
LPO
|
TM
|
FMDS
|
KILI
|
FF
C
|
EP
|
PSM
|
Nbenq
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Numéro : Nbre Pêcheurs :
Temps de route :
Unité pêche : Port d'origine :
Lieu :
Type de pêche : Départ :
Profondeur :
Puiss. Moteur : Retour : Ess.
Achetée :
|
|
ENQ
|
PE
|
DATE
|
NUM
|
UP
|
TR
|
PM
|
Nbp
|
PO
|
TR
|
DR
|
Lieu
|
PF
|
Ess_
achetée
|
Nbenq
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Espèces débarquées
|
Nbre indivi
|
Débarquement
(Kg)
|
Rejet (Kg)
|
ESP
|
UE
|
QTDB
|
RJT
|
L1
|
L2
|
L3
|
L4
|
L5
|
L6
|
L7
|
L8
|
L9
|
L10
|
L11
|
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 4 : Questionnaire d'enquête
Quartier :
Date : Fiche
n°.............
I. Informations Personnelles
|
N°
|
Age
|
Sexe
|
Ethnie
|
Situation matrimoniale
|
Statut social
|
Profession
|
|
|
|
|
|
|
|
II. La pêche au mulet
A. Les unités et types de pêche
a/ Quels sont les unités de pêche que vous avez
utilisé pour capturer le mulet jaune ?
? Pirogue motorisée ? Pirogue non motorisée
? autres à préciser :
b/ Quels sont les types d'engins de pêche que vous avez
utilisés pour capturer le mulet jaune ?
? Filets maillants dérivants de surface ? Filets
maillants dérivant de fonds ?Kili ?Senne de
plage ?Palangre ?Epervier ?Filet dormant de surface ?Senne tournante
?Ligne à traine ?Ligne ou palangre glacière
?Trémail ?Filets maillants encerclant
c/ Quelles sont les dimensions des mailles utilisées
pour le mulet ?
?<30mm ?30 mm ?40 mm ?50 mm ?60 mm
?>60 mm
B. Lieux et profondeurs pour la pêche au mulet
1/Quels sont les lieux de pêche pour le mulet
? Tank ?Kellou ?Tank ?Gop ? Kherou mame Mory
?Beulba ? Praïa ?Mouit ?Here Ourey ?Bop Here Ourey ?Gueti
?autres lieux à préciser :................
2/ A quelles profondeurs partez vous pour capturer les
mulets ?
? 1 : 0 à 10 mètres soit 0 à 6
brasses ?2 : 10 à 25 mètres soit 6 à14 brasses
?3 : 25 à 50 mètres soit 14 à 28
brasses ?4 : 50 à 75 mètres soit 28 à 42
brasses
?5 : 75 à 120 mètres soit 42 à 67
brasses ?6 : 120 à 180 mètres soit 67 à 100
brasses
?7 : 180 à 250 mètres soit 100 à 140
brasses ?8 : 250 à 500 mètres soit 140 à 250
brasses
?9 : > à 500 mètres soit > à
250brasses
3/ Combien de temps vous passez à la mer ?
?1h à 10h ?10h à 15h ?15h à 24h
?2j à 3j ?3jà 5j ?5j à 6j
?1Semaine 2 semaine ? 3 semaine à 4semaine ? >à 4 semaine
4/ Quel est le nombre de pêcheurs embarqués
à bord de votre pirogue ?
?..................pêcheurs
5/ A quelle période avez-vous l'habitude de capturer
les mulets ?
? novembre à mars ? mars à juin
?juillet à octobre
6/Quelle quantité avez vous l'habitude de
capturer pendant les périodes d'abondance ?
?.... Caisses ?.... Caisses
?.... Caisses ?.... Caisses
7/ Où trouve t-on le mulet jaune ?
?fleuve ?mer ?
embouchure
8/ Quel est le lieu de ponte des mulets jaunes ?
? Fleuve ?mer
? embouchure
9/ Ils grandissent dans quel milieu ?
? Fleuve ?mer
?embouchure ?autre à préciser :
10/ Comment s'effectuent la migration des mulets
jaunes ?
?fleuve-mer ?mer-fleuve ?autre à
préciser :
? ?
12/ quelles sont les types d'eau préférés
par les mulets ?
? Eau salée ?Eau douce
?Eau saumâtre
13/ Quelles sont les destinations du produit ?
? Poisson frais pour le marché intérieur
?poisson pour le marché extérieur ?transformé en poutargue
? produit séché et salé (gonade)
14/ Quelles sont les difficultés observées pour
la pêche au mulet ?
15/ Quelles sont les solutions locales
préconisées ?
16/ Comment les aménagements peuvent -ils contribuer
à la gestion rationnelle des mulets ?

* 1 Sous-région :
Sénégal, Gambie, Guinée Bissau, Guinée Conakry, Cap
Vert, Mali et Mauritanie.
* 2 Dialecte parlée par
les Wolofs ethnie majoritaire au Sénégal
* 3 cordon littoral situé
à l'ouest de l'île de Saint Louis qui sépare le petit bras
du fleuve de l'océan.
* 4 Bande de terre fertile,
située le long du littoral au Sénégal
* 5 Ancienne appellation de la
ville de Dakar



