|
|
MINISTERE
|
INSTITUT
REPUBLIQUE DEMOCRATIQUE
DE L'ENSEIGNEMENT SUPERIEUR
SUPERIEUR DES TECHNIQUES
I.S.T.M. /KINSHASA
B.P. 774 KINSHASA
|
DU CONGO
XI
laboratoire
|
ET UNIVERSITAIRE MEDICALES
|
|
|
Section : Techniques de
|
|
|
|
EVALUATION DU RISQUE
HYPERCHOLESTEROLEMIQUE CHEZ
LES
MEMBRES DES FAMILLES DE DIABETIQUES.
(Cas de centre diabétologique
Boyambi).
|
|
Par
SYAUSWA MUSAVULI Géry-Germain.
Gradué
en techniques de laboratoire
Mémoire présenté et défendu en
vue de l'obtention du titre de
Licencié en Techniques
Médicales. Option : Biologie médicale Directeur
: Prof. MPONA MINGA Co-Directeur : Ass.
IYOMBE
|
|
|
|
|
|
|
Année Académique 2009/2010
|
|
|
|
|
i
PLAN DE TRAVAIL.
Dédicace.
Remerciements.
INTRODUCTION.
I ère PARTIE : NOTIONS THEORIQUES.
CHAPITRE I : BREF APERCU SUR LE DIABETE.
CHAPITRE II : BREF APERCU SUR LES LIPIDES ET SUR LES FACTEURS DE
RISQUES.
II è PARTIE : PARTIE EXPERIMENTALE.
CHAPITRE III : MATERIEL ET METHODES.
III.1. MATERIEL.
III.2. METHODES.
III.3. TEST STATISTIQUE UTILISE POUR L'ANAL<SE DES
RESULTATS.
CHAPITRE IV : RESULTATS ET DISCUSSION.
IV.1. ANALYSE DES RESULTATS.
IV.2. DISCUSSION DES RESULTATS.
CONCLUSION.
ANNEXES
REFERENCES BIBLIOGRAPHIQUES
TABLE DES MATIERES.

DEDICACE
A Dieu Tout-Puissant, notre Père Céleste
;
Au Seigneur et Sauveur Jésus-Christ, pour son sang versé
pour moi ;
A mon papa SYAUSWA HANGI NZANZU et à ma maman Alphonsine
KAVUNGA ;
A ma très chère épouse KOBI BASILWANGO
Jacqueline ;
A mes fils et filles Agradie NZANZU, Raïssa MUYISA,
Exaucée NDEMERE, Emeraude
MULWAHALI, Françoise KAHUMULA, Stéphanie
WASINGYA ; en mémoire de Steves
KYAVU.
A tous ceux qui m'ont aidé dans la vie ;
A tous
les amis du savoir et de l'excellence ;
Je dédie ce
mémoire.
iii
REMERCIEMENTS.
Au terme de ce travail, nous tenons à adresser nos vifs
et sincères remerciements au Professeur Docteur MPONA MINGA, promoteur
de ce travail, qui nous a constamment guidé et disposé de son
temps dans nos différentes démarches pendant toute la
durée de nos recherches. Sa rigueur scientifique, son esprit ouvert et
critique ainsi que sa grande disponibilité ont permis la
matérialisation de ce travail.
Nos sincères remerciements s'adressent également
à tous nos professeurs, nos chefs des travaux et nos assistants qui se
sont donnés tant de sacrifices pour assurer avec rigueur notre
formation.
Que l'expression de notre profonde gratitude atteigne
particulièrement l'assistant I<OMBE pour son souci perpétuel
de perfection scientifique, qu'ils trouvent dans ce travail l'expression de nos
considérations distinguées.
Nous saluons l'efficace soutient et collaboration des
biologistes médicaux Henri MAKOMBANI et Chance MWISHA LUBANGO qui se
sont surpassés pour que nos études ne pèsent pas trop sur
le bon déroulement du travail au service médical de la commission
électorale indépendante.
Nos remerciements s'adressent aussi aux biologistes
médicaux Claudine Buse, José Mukanga, Pasteur Ngandu, José
Kitenge, Angèle, Nadine et aux collègues de la dixième
promotion de la licence option biologie médicale : Manda Mawanika,
Francklin Mutomboko, Jules Muzama, Tanziambi, et tous les autres.
Nous sommes extrêmement reconnaissants à la
grande famille SYAUSWA KYAVU, à nos amis Kahimba Clément, Mike
Kakule, Okenge Georges, Omoy Pauline, Kabeya Georges, Solange Makaya, Bilonda
Rose, Marc Amouroux, Sylvie Tridat, Dr Le Roux, Dr Mosikwa, Dr Sinamuli, Dr
Katangi Lucien, Dr Romain, Prophète Joël Mukuza, Jacques Ngesera et
toutes les grandes familles New Medicis Clinic , Centre de biologie
médicale de Périgueux (Dordogne-France) et le service
médical de la Commission Electorale Indépendante pour leurs
assistances affective, morale, matérielle et financière.
Enfin, à ceux dont les noms ne sont pas cités,
qu'ils soient rassurés de notre vive reconnaissance.
INTRODUCTION
Le diabète sucré est défini par
l'élévation chronique de la concentration de glucose dans le sang
(Hyperglycémie) et regroupe, dans un véritable syndrome,
plusieurs maladies de pathogénie différente (trouble de la
sécrétion et/ou de l'action de l'insuline).
L'hyperglycémie chronique est la cause principale de la survenue des
complications dégénératives de la maladie
diabétique mais celles-ci sont néanmoins susceptibles d'tre
évitées ou tout au moins retardées par un traitement
adéquat (54). Aujourd'hui le diabète et les autres maladies
métaboliques qui partagent les mêmes facteurs de risque
représentent un danger majeur pour la santé et le
développement humain. On estime que 8 à 14 millions de personnes
meurent prématurément chaque année dans les pays en voie
de développement de cause de maladies métaboliques pouvant faire
l'objet de prévention (11).
En effet, ces gens meurent trop jeunes à la suite d'une
exposition accrue aux facteurs de risque courants pour les maladies
métaboliques: une alimentation déséquilibrée, la
sédentarité, le tabagisme et l'usage nocif de l'alcool.
A moins d'tre prise à bras le corps, la
mortalité et la morbidité liée au diabète et autres
maladies métaboliques continueront d'augmenter. L'Organisation Mondiale
de la Santé (OMS) prévoit que, globalement, les
décès causés par ces problèmes de santé
augmenteront de 17% au cours de la prochaine décennie, avec la plus
grande augmentation dans les pays à faible et moyen revenu, surtout dans
les pays d'Afrique (27%) et de la Méditerranée orientale (25%).
On estime que 80% de la mortalité due aux maladies non-transmissibles
surviennent dans des pays en développement (4).
Nous avons la bonne perception et les connaissances
nécessaires pour traiter le diabète. Bien que des
stratégies au rapport coût-efficacité positif existent, un
haut niveau d'engagement et des actions concrètes font encore
cruellement défaut au niveau mondial et national. Malgré le fait
d'imposer un lourd fardeau sur la santé ainsi que sur le
développement socio-économique, la prévention du
diabète et autres maladies métaboliques reste dramatiquement
sous-financés (4).
Lorsque les gens développent un diabète, les
services de santé de notre pays sont limités pour fournir des
soins efficaces destinés au contrôle et à la
prévention de ses complications et des décès
prématurés.
Malgré l'importance du problème du
diabète, les demandes d'assistance technique pour la prévention
en provenance des pays en développement restent largement sans
réponse de la part de la communauté internationale,
principalement parce que le diabète et autres maladies
métaboliques se situent au-delà de celles visées par les
Objectifs de Développement du Millénaire (ODM) (55).
Notons que, l'intégration des soins liés au
diabète dans les soins de santé primaires assure la couverture
universelle des interventions de base sur la santé qui devraient donc
être des priorités absolues.
Les données disponibles indiquent clairement qu'une
proportion importante du revenu des ménages parmi les populations
pauvres est consacrée au soin de santé d'un membre de la famille
touché par le diabète (54).
Dans nos milieux, les descendants de diabétiques sont
une population à risque du point de vue génétique, du
point de vue environnemental et du point de vue social et d'hygiène
alimentaire pour développer le diabète sucré.
De tous ce qui précède, une question nous
préoccupe à savoir, le risque hyperlipémique existe-t-il
chez les membres de famille de diabétiques kinois ?
Le diabète a de nombreuses facettes, mais très
peu de voix. Et c'est pourquoi nous nous sommes permis « d'évaluer
le risque hypercholestérolémique chez les membres des familles de
diabétiques ».
Partant de l'hypothèse à laquelle, les facteurs
tels qu'une alimentation déséquilibrée, la
sédentarité, le tabagisme, l'usage nocif de l'alcool, l'Ige, le
sexe, le diabète, l'obésité ... nous pensons que les
descendants de diabétiques seraient très exposés aux
risques aggravés de développer le diabète et la maladie
cardiovasculaire.
L'objectif poursuivi par cette étude est d'estimer le
risque de maladies cardiovasculaires du a une
hypercholestérolémie dans la population ayant des
antécédents familiaux diabétiques dans notre pays en
général et dans la population de Kinshasa en particulier.
L'intérit de cette étude prospective est
essentiellement orienté sur les points suivants :
- Identifier et prendre en charge les personnes
présentant un risque hyperlipémique élevé pour
éviter la survenue du diabète et/ou des maladies
cardiovasculaires ;
- Obtenir les données qui confirment que la population
cible issue des familles diabétiques présente un risque
significatif. L'attention particulière sera portée aux sujets non
diabétiques dont les proches sont diabétiques afin de
prévenir les maladies cardiovasculaires.
- Evaluer le risque cardiovasculaire chez la population cible
issue des familles diabétiques par rapport aux sujets non
diabétiques sans antécédent majeur au diabète.
Pour tenter de répondre à la question
posée, nous avons dosé quelques lipides notamment le
cholestérol total, le HDL-cholestérol et le
LDL-cholestérol. Les résultats obtenus dans la population
à risque seront comparés avec ceux d'un groupe témoin
constitué des sujets se réclamant en bonne santé et
n'ayant pas un membre de famille proche diabétique.
Hormis l'introduction et la conclusion, notre travail est
subdivisé en quatre chapitres. Les deux premiers chapitres s'occupent
des généralités sur le diabète sucré et sur
les lipides sériques, le troisième chapitre traite de
matériel et méthodes, enfin le dernier chapitre s'occupe de la
présentation des résultats, de leurs analyses et discussion.
CHAPITRE I : BREF APERCU SUR LE DIABETE.
I.1 DEFINITION
Le diabète est une maladie métabolique
caractérisée par une sécrétion inadéquate
(insuffisant) d'insuline, ou par une absence de réponse biologique (cas
des obèses, ou les quelques rares cas connus à ce jour-de
résistance auto-immune à l'insuline) c'est-àdire que les
diabètes sucrés sont des troubles caractérisés
principalement par l'hyperglycémie et par la glucosurie. Ils sont dus au
manque d'insuline ou à une inefficacité de l'action de l'insuline
(43).
Le plus souvent, l'hyperglycémie modérée
est asymptomatique. On peut constater parfois une discrète perte de
poids (1 à 3 kg) et une asthénie, mais le malade peut se sentir
parfaitement bien. Le syndrome cardinal diabétique, qui comporte
polyuropolydipsie, amaigrissement, hyperphagie, n'existe que pour des
glycémies supérieures à 3 g/l. Il existe alors une
glycosurie importante, responsable de polyurie osmotique, entraînant
à son tour une polydipsie.
I.2 HISTOIRE
Les médecins égyptiens avaient
déjà découvert que cette maladie à l'époque
d'Amenhotep III entre le XVe siècle et le XVIe siècle avant notre
ère (date variable selon les égyptologues). La maladie est
décrite à la section vases d'eau du corps, dans le Papyrus Ebers
conservé à Leipzig, rédigé sous le règne
d'Amenhoptep III ou (Aménophis III en grec), où se trouvent
toutes les sources de la médecine égyptienne. Les médecins
grecs de l'école d'Hippocrate de Cos, qui ont donné son nom
à la maladie (dia baïno, en grec ancien : äé~
ìð~ïvo, ou äéEâ~ïõù), ont
ensuite observé vers le IIIe siècle av. J.-C. ou le IIe
siècle av. J.-C. (selon les sources) « que les malades
étaient frappés d'une soif continuelle, et qu'ils semblaient
uriner aussitôt ce qu'ils venaient de boire, comme s'ils étaient
« traversés par l'eau » sans pouvoir la retenir. » C'est
Praxagoras de Cos 384-322 av.J.C. disciple d'Hippocrate, qui évoqua pour
la première fois la nocivité des humeurs sucrées. Dans
certains cas les urines n'avaient pas de goût (diabète insipide)
dans d'autres les urines étaient sucrées (diabète
sucré ou hyperglycémie). Au VIIe siècle après. J-C,
les Chinois faisaient part de leurs observations et de leur
interprétation concernant les urines sucrées et proposaient un
traitement proche des méthodes modernes qui recommandent aux
diabétiques de s'abstenir de consommer de l'alcool et de l'amidon
(49).
I.3 EPIDEMIOLOGIE
Le terme diabète se rapporte au diabète
sucré. Le diabète est un dysfonctionnement du système de
régulation de la glycémie, qui peut avoir des causes diverses
(sécrétions d'insuline, réponse à l'insuline...).
Le diabète sucré est une pathologie fréquente (qui, par
exemple, affecte près de 20% de la population adulte aux
États-Unis d'Amérique). L'anomalie principale en cause dans le
diabète sucré est une pathologie de la sécrétion de
l'insuline, qui reconnaît de multiples causes (51).
Le diabète, sans être véritablement
classé dans les maladies émergentes, est une maladie non
contagieuse qui se développe de manière épidémique
depuis quelques décennies, et dont la prévalence augmente
fortement et rapidement dans tous les pays, laissant supposer qu'outre une
composante génétique, cette maladie ait un ou plusieurs facteurs
environnementaux (51).
La maladie s'est d'abord développée dans les
pays riches ou dits « développés », mais de nombreux
indices indiquent qu'elle se développe rapidement dans les pays pauvres
et/ou dits « en cours de développement ».
La prévalence était en 2003 la plus
élevée en Amérique du nord (7,9 % de la population
nord-américaine) et en Europe (7,8 % de la région Europe). La
prévalence est croissante en Asie du sud-est, elle pourrait d'ici 20 ans
devenir la zone où le risque de diabète serait le plus
élevé (13,2 % de la population y est déjà victime
d'intolérance au glucose (IGT)).
L'Organisation mondiale de la santé évoque une
véritable épidémie avec un nombre de cas estimé
passé de 30 millions en 1985 à 135 millions en 1995, 10 ans plus
tard et 177 millions en 2000, puis 194 millions en 2003, L'OMS s'attend
à un nombre de diabétiques d'environ 300 millions d'ici à
2025 (330 selon la fédération mondiale du diabète qui
estime qu'en 2003, il y a 194 millions de diabétiques dans le monde,
c'està-dire 5,1 % des adultes en moyenne, et qu'ils seront 6,3 %, d'ici
2025).
On compte en France 2 .106 diabétiques : 15
% sont diabétiques insulinodépendants, 85 % non
insulinodépendants. Le diabète est un problème de
santé publique aussi bien en France, où l'on dénombre
environ 3,5 % de diabétiques (soit 1,6.106 diabétiques
connus et 4.105 diabétiques qui s'ignorent), mais aussi en
Europe où le nombre de diabétiques est évalué
à 30 millions, et aux Etats-Unis où il y a 15 millions de
diabétiques pour moitié méconnus. Dans le monde entier, on
dénombre 100 millions de diabétiques (50).
Le terme de diabète recouvre en fait deux maladies
différentes :
- le diabète insulino-dépendant (type I), qui
survient le plus souvent avant l'âge de 20 ans et représente 10
à 15 % des diabètes.
- le diabète non insulino-dépendant (type II), qui
survient le plus souvent après l'âge de 40 ans et
représente 85 à 90 % des diabètes.
C'est le diabète non insulino-dépendant qui
pose un problème de santé publique. Sa prévalence augmente
parallèlement au vieillissement, à l'urbanisation, à la
sédentarisation et au développement de l'obésité
dans les populations des pays industrialisés. Cette maladie
n'épargne pourtant pas les pays sous développés où
le diabète non insulino-dépendant atteint parfois une
prévalence de 20 à 30 %, en raison d'une prédisposition
génétique couplée à une modification rapide du mode
de vie : urbanisation brutale, sédentarisation et alcoolisation des
populations (50).
Le diabète représente un coût financier
important en raison du taux élevé de complications
dégénératives. Treize pour cent des dialysés en
France sont diabétiques tandis que ce taux dépasse 30 % aux Etats
Unis. Il en est de même dans les pays Scandinaves et dans l'Ile de la
Réunion. De fait, 50 à 75 % des diabétiques
dialysés sont des diabétiques non insulino-dépendants. Le
diabète reste la première cause médicale de
cécité avant 50 ans dans les pays développés
(38).
Cinq à 10 % des diabétiques subiront un jour
une amputation d'orteil, de pied ou de jambe, 4/5 d'entre eux sont des
diabétiques non insulinodépendants. En France, on compte environ
3000 à 5 000 amputés par an chez les diabétiques. Le quart
des journées d'hospitalisation pour le diabète est dû
à des problèmes podologiques. Le coût du diabète est
estimé à 35 milliards de francs. Pour lutter contre ce
coût, la déclaration de Saint Vincent adoptée en 1989 par
les représentants de l'Organisation Mondiale de la Santé (OMS),
les gouvernements européens et des organisations de malades, a
rappelé les bonnes pratiques médicales en diabétologie.
Elle a fixé pour objectif, dans les cinq ans, une réduction d'un
tiers à la moitié des complications du diabète. Plusieurs
études ont en effet montré que la modification de l'organisation
des soins visant à obtenir une formation des patients eux-mêmes
permet de réduire de 50 % le taux des amputations (35).
Le diabète est devenu la quatrième ou
cinquième cause de mortalité dans la plupart des pays
développés. Il a d'abord touché essentiellement des pays
riches ou développés, mais s'étend maintenant dans les
pays pauvres ou nouvellement industrialisés. Son incidence est difficile
à mesurer, notamment dans les pays pauvres et ce par manque
d'études spécifiques. L'OMS estime que vers l'an 2000, quatre
millions de personnes
en mourraient par an dans le monde, ce qui correspond à
un taux de létalité de 9 % environ.
Les complications oculaires et cardiovasculaires de cette
maladie qui surviennent souvent chez des gens jeunes ou encore en
activité poussent les services de santé et organismes de
sécurité sociale à dépenser de plus en plus pour
lutter contre le diabète dont les causes restent incomprises. Le nombre
de cas continue néanmoins d'augmenter (32).
I.4 ETIOLOGIE ET DIFFERENTS TYPES DE DIABETE
Les diabètes insipides sont des maladies rares, dont
la cause est une anomalie de la sécrétion ou de la reconnaissance
de l'hormone antidiurétique (ADH) ou arginine vasopressine (AVP).
L'hyperglycémie est associée à d'autres
perturbations importantes du métabolisme des glucides, des
protéines, et des graisses (1).
L'étiologie du diabète est une évidence
dans quelques rares cas comme l'ablation chirurgicale de la queue du
pancréas ou sa destruction par l'une ou l'autre maladie comme une
pancréatite chronique, une hémochromatose (dépôts de
fer au niveau de la glande, qui empêchent son fonctionnement correct), ou
encore un cancer. Cependant dans la plupart des cas l'étiologie est
difficile à mettre en évidence.
Le diabète de type I (sécrétion
insulinique quasi-nulle) pourrait être associé à
l'hérédité (les systèmes HLA entre autres), mais le
code de transmission n'est pas encore connu ; il pourrait s'agir de la
transmission d'une plus grande susceptibilité aux agents
pathogènes comme par exemple le virus ourlien (36).
Le diabète de type II dit diabète gras ou de
maturité, correspond plutôt à une insuffisance de la
sécrétion insulinique suite à une demande accrue.
Différentes formes de diabètes sont
répertoriées, en fonction de leur étiologie : Les
données essentielles pour le diagnostic étiologique sont
cliniques : âge, poids, existence d'une cétonurie,
hérédité familiale de diabète.
I.4.1 Diabète de type I
Il est remarquable par son début brutal : syndrome
cardinal associant polyuropolydipsie, polyphagie, amaigrissement et
asthénie chez un sujet jeune, mince, avec cétonurie
associée à la glycosurie. On ne retrouve
d'antécédent familial que dans un cas sur dix. Il survient
essentiellement avant 20 ans, mais connaît deux pics d'incidence vers
12ans et 40 ans. Il peut être associé à d'autres maladies
auto-immunes (vitiligo, maladie de Basedow, thyroïdites, maladie de
Biermer) (34).
I.4.2 Diabète de type II
A l' opposé, il se caractérise typiquement par
la découverte fortuite d'une hyperglycémie chez un sujet de plus
de 40 ans avec un surpoids ou ayant été obèse, avec
surcharge pondérale de prédominance abdominale (rapport taille /
hanche supérieur à 0,8 chez la femme, supérieur à
0,95 chez l'homme). Le plus souvent, on retrouve une
hérédité familiale de diabète non
insulinodépendant.
Le diabète de type II est souvent associé
à une hypertension artérielle essentielle et/ou à une
hypertriglycéridémie. Le diagnostic se fait le plus souvent lors
d'un examen systématique. En effet, le diabète de type 2 est
asymptomatique. Le retard au diagnostic est d'environ 5 ans. Ainsi, dans 20 %
des cas, il existe une complication du diabète au moment du diagnostic
(18).
I.4.3 Diabètes iatrogènes
Ils correspondent aux hyperglycémies provoquées
par des : - corticoïdes (sous toutes les formes)
- B bloquants non cardio-sélectifs
- diurétiques hypokaliémiants
- progestatifs de synthèse de type
norstéroïdes - sympathicomimétiques (Salbutamol)
- anti protéases (traitement du SIDA)
I.4.4 Les autres étiologies du diabète
Elles ne sont pas à rechercher
systématiquement. En cas de doute diagnostic uniquement (diabète
n'ayant pas les caractères habituels du type I ou du type II) on
évoquera une autre étiologie en fonction du contexte clinique
:
> Pancréatite chronique
calcifiante:
La découverte d'un diabète chez un homme de
plus de 40 ans, dénutri, avec des
antécédents d'alcoolisme doit la faire suspecter. La
pancréatite chronique calcifiante associe au déficit endocrine,
une insuffisance pancréatique externe avec stéatorrhée et
parfois malabsorption dont le traitement relève des extraits
pancréatiques. Le traitement de ces malades par insulinothérapie
comporte un risque majeur d'hypoglycémies sévères en
raison d'une carence associée en glucagon. Des calcifications
pancréatiques peuvent être mises en évidence sur le
cliché d'abdomen sans préparation, voire le scanner abdominal. On
observe également des pancréatites chroniques calcifiantes
familiales ou pancréatites calcifiantes nutritionnelles, chez les
immigrés africains en particulier (11).
> Hémochromatose :
Elle peut également s'accompagner d'un diabète.
Le dosage du fer sérique et du coefficient de saturation de la
transferrine permet le diagnostic confirmé par la mise en
évidence de la mutation HFE. Le seul traitement efficace de la surcharge
ferrique consiste en des saignées initialement hebdomadaires mais le
diabète est irréversible (12).
> Diabètes endocriniens :
Ils sont associés à l'hyperthyroïdie, au
phéochromocytome, au syndrome de Cushing, à l'acromégalie,
à la maladie de Conn, au glucagonome, au somatostatinome. Seuls les
signes cliniques évocateurs de ces différentes pathologies
doivent amener à pratiquer des dosages hormonaux nécessaires au
diagnostic (7).
> Cancer du pancréas :
L'échographie et le scanner du pancréas ne
doivent pas être systématiques lors de la découverte d'un
diabète non insulinodépendant. Si le tableau clinique est
évocateur (amaigrissement, vitesse de sédimentation
accélérée, fièvre, ictère...) chez un sujet
de plus de 40 ans sans antécédent familial de diabète, on
pourra demander des examens d'imagerie pancréatique ou des marqueurs
biologiques à la recherche d'un cancer du pancréas (1).
> Diabète de type 3 :
Il doit être suspecté chez les africains et les
indiens. Ce diabète apparaît entre 30 et 40 ans. Son début
est aigu, généralement avec cétose. L'évolution se
fait secondairement vers un mode non insulino-dépendant. Il n'y a pas de
marqueur d'autoimmunité, pas d'insuffisance pancréatique externe.
Ce diabète associe carence insulinique et insulinorésistance
(1).
> Diabète MODY (Maturity Onset Diabetes of the
Young) :
C'est un diabète d'hérédité
autosomale dominante. Il s'agit d'un diabète non
insulinodépendant, survenant avant l'âge de 25 ans, parfois
même dans l'enfance. Le diabète MODY II réalise une
hyperglycémie bénigne familiale due à une mutation de la
glucokinase, enzyme dont le métabolisme régule la
sécrétion d'insuline. Tout se passe comme si le « lecteur de
glycémie » de la cellule B du pancréas était
déréglé, lisant 1 g/l lorsque la glycémie est en
réalité à 1,20 ou 1,40 g/l. Les diabètes MODY I,
III et IV sont dus à des mutations de facteur de transcription
nucléaire (HNF) retrouvés au niveau du foie et du
pancréas. Ils s'accompagnent d'une carence
insulino-sécrétoire et leur évolution est souvent plus
sévère que celle du MODY II, avec nécessité parfois
d'une insulinothérapie (5).
> Diabète secondaire à une mutation de
l'acide désoxyribonucléique (ADN) mitochondrial :
Il associe une surdité de perception et se
caractérise par une hérédité maternelle. Il peut
s'associer à des atteintes tissulaires diverses, musculaires,
neurologiques, cardiaques, rétiniennes. Ce diabète est parfois
d'emblée insulino-dépendant (34).
> Diabète lipoatrophique :
Congénital ou acquis, il est caractérisé
par la disparition du tissu adipeux. Il existe une insulino-résistance
majeure avec hyperlipidémie et stéatose hépatique. A
l'examen clinique, on peut retrouver un acanthosis nigricans (pigmentation
brunâtre avec aspect épaissi et velouté de la peau et
nombreux papillomes au niveau du cou, des aisselles, de l'ombilic)
témoin de l'insulino-résistance (14).
I.4.5 Autres étiologies rares :
- Pancréatectomie totale.
- Mucoviscidose.
- Cirrhose hépatique.
- Insuffisance rénale sévère.
I.5 PHYSIOPATHOLOGIE I.5.1 Action de l'insuline
(14).
L'insuline est une hormone endocrinienne qui est produite par
les îlots de Langhérans du pancréas qui sont elles mrmes
réceptrices et sensibles à l'élévation de la
glycémie. La molécule d'insuline se combine avec le
récepteur spécifique sur la membrane plasmique. Ce complexe
d'hormone récepteur déclenche alors un second message et cette
modification chimique intracellulaire déclenche une cascade
d'événements notamment :
- Action hypoglycémiante qui s'exerce par la
stimulation de la synthèse de la glucose-kinase. L'insuline agit aussi
sur la glycogène-synthétase, indirectement par la glucose-kinase
ou directement en favorisant la synthèse de la
glycogènesynthétase. Des modifications membranaires provoquent
l'accroissement de l'entrée du glucose et des acides amines.
- Action sur le métabolisme lipidique par l'inhibition
de la lipolyse et par l'activation de la lipogenèse, en fournissant par
la voie des pentose-phosphates, le NADPH nécessaire à la
synthèse des acides gras, et en apportant par la glycolyse, la
dihydroxyacétonephosphate qui donnera le glycérophosphate,
précurseur des glycérides.
- Action sur le métabolisme des protéines car
l'entrée dans les cellules des muscles striés des acides
aminés favorise la formation des ribosomes et l'initiation de la
synthèse des chaînes peptidiques.
I.5.2 Action du glucagon
Le glucagon est un polypeptide sécrété
par les cellules I des îlots de Langhérans, stimule la
glycogénolyse hépatique. Cet hormone est hyperglycémiant
mais aussi lipolytique en ce sens qu'il accélère la
libération des acides gras. En plus de la déficience absolue ou
relative de l'action de l'insuline, un excès relatif ou
absolu de glucagon caractérise également certains diabètes
sucrés (43).
I.6 CLINIQUE
Tableau I : Symptômes cliniques et
différentiels de diabète de type I et de type II.
Diabète de type I
|
Diabète de type II
|
Début brutal
|
Découverte fortuite
|
Syndrome cardinal
|
Asymptomatique
|
Sujet mince
|
Sujet avec surpoids
|
Avant 20 ans
|
Après 40 ans
|
Pas d'hérédité familiale
|
Hérédité familiale
|
Cétonurie
|
HTA, Hypertriglycéridémie
|
|
Le tableau ci-dessus nous donne les caractères
différentiels ainsi que des symptômes cliniques entre le
diabète de type I et le diabète de type II.
Formes cliniques atypiques
Diabète de type I d'évolution lente.
Il s'observe chez les personnes de plus de 40 ans avec ou
sans surpoids, présentant un diabète non
insulino-dépendant non cétonique mais associé à une
maladie auto-immune (dysthyroïdie, maladie de Biermer, vitiligo). Chez ces
patients, l'existence d'une insuline auto-immune mise en évidence par la
positivité de marqueurs d'autoimmunité [anticorps anti
îlots de Langhérans, anticorps anti GAD (Glutamate Acide
Décarboxylase)] est un argument en faveur d'une insulinothérapie
dès le diagnostic. Le diabète est alors facile à
équilibrer avec de petites doses d'insuline.
I.7 DIAGNOSTIC (34).
Les examens de laboratoire nécessaires au diagnostic du
diabète sont : la glucosurie, la mesure de la glycémie et le test
de tolérance au glucose.
- Une glucosurie positive est une indication du
dépassement de la capacité de la réabsorption tubulaire
proximale survenant entre 130 et 180 mg/dl de glucose par dl de plasma.
Cependant la glucosurie est un test de présomption car elle n'infirme ni
ne confirme un diabète de façon certaine. D'une part le
«diabète rénal» donne une glucosurie positive, et
d'autre part dans certains états pathologiques, notamment ceux dans
lesquels la filtration glomérulaire est abaissée (âge
avancé, avec débit cardiaque abaissé +
artériosclérose rénale) la glucosurie peut ne pas survenir
même avec une glycémie aussi élevée que 300 mg/dl.
Donc, en plus de la glucosurie, le dosage sérique du glucose dans le
sérum ou dans le plasma est vivement recommandé.
- Mesure de la glycémie à jeun (70 à 105
mg/dl) ou non à jeun deux fois en deux jours différents, les
résultats ne doivent pas dépasser 200 mg/dl.
- L'épreuve d'hyperglycémie provoquée.
Les diabétologues considèrent que toute glycémie à
jeun, supérieure à 100 mg/dl doit retenir l'attention. De ce qui
précède, toutes les glycémies à jeun situées
entre 105 et 126 mg/dl doivent faire l'objet d'investigations plus approfondies
parmi lequel le test de tolérance au glucose, objectivée par
l'épreuve d'hyperglycémie provoquée dont le mode
opératoire est :
4 On donne par voie orale, après une première
détermination de la glycémie à jeun ; 0,75 g de glucose
par kg de poids, sans dépasser 75g.
4 On dose ensuite le glucose plasmatique toutes les 30 minutes
pendant 3 heures.
Les résultats observés sont les suivants nonobstant
les cas particuliers : maladie du foie, hypothyroïdie ou
hyperthyroïdie,« :
1) non diabétique, la concentration maximale est
atteinte entre 30 et 60 minutes, très souvent sous forme d'un court
plateau entre les 30e et 60e minutes, mais sur le
graphique l'image est celle d'un pic aux environs de la 45e minute.
La glycémie revient à la valeur normale de départ vers la
120e minute, ensuite vient une légère
hypoglycémie, la glycémie remonte au taux de départ
à la troisième heure. Le pic hyperglycémique ne doit pas
dépasser 160 mg/dl.
2) Chez le pré-diabétique, le pic est plus
élevé et survient plus tôt (décalé vers la
gauche), le retour au taux de départ est plus lent et n'est pas suivi
d'hypoglycémie.
3) Chez le diabétique, le pic est beaucoup plus haut
et décalé vers la gauche. L'éventuel retour au taux de
départ dépend de la gravité du diabète. Dans un
diabète sévère, la glycémie ne revient au taux de
départ que par un hypoglycémiant ou alors après plusieurs
jours si un autre événement ne s'y greffe pas.
I.8 COMPLICATIONS DU DIABETE (34)
La pathogénie du diabète se caractérise
souvent sous trois aspects :
- les complications vasculaires ;
- l'acidocétose ;
- et le coma hyperosmolaire.
I.8.1 Les complications vasculaires
Ces complications sont consécutives à la
déficience des métabolismes des lipides et des glucides.
L'insuline est lipogénétique, le manque de ce dernier laisse les
hormones lipolytiques qui sont GH (hormone de croissance), TSH
(thyréostimuline ou thyrotrophine), T4 (tétra-iodothyronine) et
les catécholamines (dont l'adrénaline), agir sans contrainte.
Ceci implique donc une mise en circulation de grandes quantités de
lipides qui vont occasionner des maladies diverses : néphropathie,
rétinopathie, neuropathie, athérosclérose et ses
conséquences variées comme l'hypertension artérielle,
cardiopathie, etc.
Les infections à répétition et les
gangrènes qui peuvent aboutir aux amputations.
I.8.2 La céto-acidose
L'acidocétose se caractérise par deux
composantes : d'une part, il y a manque d'insuline (et avec probablement un
taux élevé de glucagon) qui occasionne une hyperglycémie
et un manque de glycolyse, ce qui entraine un manque de production
d'énergie ; d'autre part la carence ou manque d'énergie oblige
l'organisme à dégrader abondamment les acides gras pour produire
de l'énergie. Conséquence, les acétyl-CoA produits en
excès ne peuvent pas être totalement consommés par le cycle
de Krebs défaillant du fait de la pauvreté en coenzymes
d'oxydoréduction qui auraient dû être apportés par la
glycolyse. D'où la conséquence sera une cétogenèse
accrue et accentuée par le déficit en NADPH qui aurait dû
être apporté par la glycolyse par shunt des pentoses phosphates.
La conjugaison de tous ces facteurs aboutit à l'accumulation des corps
cétoniques (acétone, ß-hydroxybutyrate,
acétoacetate), qui sont acides, il y aura donc acidose.
I.8.3 Le coma hyperglycémique hyperosmolaire (non
cétonique)
Quasiment absente dans le diabète de type I, le coma
hyperosmolaire est une complication aigue typique du diabète du type II.
Le coma hyperosmolaire est conséquent à une hyperglycémie
élevée, accompagnée d'une forte diurèse. Il y a
ainsi déséquilibre entre la volémie et les concentrations
plasmatiques des particules osmotiquement actives. Les cellules doivent se
déshydrater pour tenter de fournir l'eau nécessaire jà
l'extracellulaire, d'où coma.
CHAPITRE II : BREF APERCU SUR LES LIPIDES ET SUR
LES
FACTEURS DE RISQUES.
II.1 DEFINITION
Les lipides forment un groupe hétérogène
de composés apparentés davantage par leurs
propriétés physiques que chimiques. Ils ont une
propriété commune, celle d'tre relativement insolubles dans l'eau
et (38) solubles dans les solvants non polaires tels l'éther, le
chloroforme et le benzène. Ainsi les lipides comprennent : les graisses,
les huiles, les cires et certaines substances qui leur sont
apparentées.
Les lipides sont d'importants constituants du régime
alimentaire, non seulement à cause de leur grande valeur
énergétique, mais aussi à cause de leur association avec
les vitamines liposolubles et les acides gras essentiels (acides
linoléique et linolénique) contenus dans les aliments
naturels.
La biochimie pourrait compléter cette
définition en ajoutant que les lipides peuvent provenir, en
totalité ou en partie, de condensations de thioesters basées sur
des carbanions et/ou de condensations d'unités d'isoprène
basées sur des carbocations. Ceci fait référence à
la manière dont les êtres vivants synthétisent les lipides.
Il existe plusieurs voies de synthèse qui peuvent se regrouper en deux
catégories selon la « brique de base » utilisée : un
thioester ou un isoprène. Cependant, il n'existe pas encore de
définition unique d'un lipide reconnue par l'ensemble de la
communauté scientifique. Ceci tient probablement au fait que les lipides
forment un ensemble de molécules aux structures et aux fonctions
extrêmement variées dans le monde du vivant (36).
Les principaux lipides plasmatiques corporels sont les
triglycérides, le cholestérol et ses esters, les phospholipides
et les glucolipides. Les triglycérides des tissus adipeux sont la
principale réserve d'énergie de l'organisme. Les autres lipides
sont des constituants importants de la structure des membranes. Quant au
cholestérol, il est également le précurseur des hormones
stéroïdes (cortisol, cortisone, aldostérone,
°oestrogène, progestérone, testostérone) et des
acides biliaires (36).
Les lipides sont transportés dans la circulation
sanguine sous forme des particules complexes appelées les
lipoprotéines. Les acides gras non estérifiés sont
également transportés dans la circulation mais, sont
véhiculés par l'albumine plutôt que par les
lipoprotéines.
II.2 ORIGINE
En dehors du cholestérol dont 90% proviennent de la
synthèse hépatique, la majorité des lipides circulant dans
le milieu sanguin est d'origine alimentaire néoformée. Les
lipides alimentaires les plus importants sont les triglycérides. La
digestion des lipides a lieu dans l'intestin grfle sous l'action des enzymes
lipolytiques que sont : la lipase, les
phospholipides-estérases,~qui les réduisent en
glycérol, monoglycérides, cholestérol, acides gras
libres,~
Rappelons que l'action de ces enzymes exige que les lipides
soient dans une forme liquide, en l'occurrence dans une émulsion, ce qui
nécessite les émulsionnants qui sont les sels biliaires.
Le mélange issu de la dégradation des lipides
est résorbé et passe dans les cellules de bordure de la muqueuse
intestinale. Les composés solubles passent directement par la veine
porte et atteigne le foie. Le reste du mélange est transformé sur
place dans les cellules de la paroi intestinale en nouveaux
triglycérides, phospholipides, esters de cholestérol, qui
s'agglomèrent en petites particules appelées chylomicrons. Ces
derniers empruntent le réseau lymphatique et parviennent dans la
circulation sanguine par le canal lymphatique thoracique. Un tiers des
chylomicrons est capté par le foie, un tiers par les tissus adipeux et
un tiers restant par les autres organes pouvant utiliser les lipides circulant.
Dans les tissus autres que le foie, la captation des chylomicrons est sous la
dépendance de lipoprotéine-lipase, enzyme
insulinodépendant, qui catalyse des triglycérides contenus dans
les chylomicrons.
Dans le foie, les chylomicrons sont phagocytés par les
hépatocytes et les lipides y contenus rapidement hydrolysés : une
partie, comprenant en outre les acides gras synthétisés ou
allongés, servira à constituer de nouveaux lipides. Ces lipides
repassent dans le sang véhiculés par les lipoprotéines.
Les lipides circulant (4,5 #177; 7,5g/l) sont globalement répartis comme
suit :
- 40% pour le cholestérol total
- 35% pour les phospholipides surtout la lécithine
- 10 à 25% pour les triglycérides
- 5% pour les acides gras
Des variations importantes dans cette composition s'observent en
fonction de l'ge, du sexe, de l'alimentation et des facteurs
héréditaires.
II.3 CLASSIFICATION
Les lipides peuvent être classés selon la
structure de leur squelette carboné (atomes de carbone
chaînés, cycliques, présence d'insaturations, etc.).
Toutefois, du fait de leur diversité et de la difficulté à
adopter une définition universelle, il n'existe pas de classification
unique des lipides (32).
Selon l'IUPAC (union internationale de chimie pure et
appliquée), par exemple, sont inclus dans la catégorie «
lipides » les acides gras et dérivés, ainsi que leurs esters
respectifs :
- les acides gras
- les glycérides
- les phospholipides (essentiellement les
phosphoglycérides et les sphingolipides)
- les glycolipides.
Les lipides sont classés en lipides simples ou complexes.
La présente classification des lipides est une modification de celle de
Bloor (32):
II.3.1 Les lipides simples : Esters d'acides gras et de
divers alcools.
a. Les graisses sont des esters d'acides gras et du
glycérol. Une graisse qui est à l'état liquide aux
températures ordinaires est une huile.
b. Les cires qui sont des esters d'acides gras et d'alcools
monohydriques à poids moléculaire plus élevé.
II.3.2 Les lipides complexes : Esters d'acides gras
contenant divers groupes en plus de l'acide gras et de l'alcool.
a. Les phospholipides sont des lipides contenant, en plus des
acides gras et d'un alcool, un résidu d'acide phosphorique. Ils
possèdent fréquemment des bases azotées et d'autres
substituants. Notons que dans les glycérophospholipides, l'alcool est le
glycérol et dans les sphingophospholipides, l'alcool est la
sphingosine.
b. Les glycolipides ou glycosphingolipides sont des lipides
formés d'un acide gras, de la sphingosine et de sucre.
c. Autres lipides complexes tels que les sulfolipides et les
aminolipides. Les lipoprotéines peuvent être classées dans
cette catégorie.
II.3.3 Les précurseurs des lipides et les lipides
dérivés :
Nous avons dans cette catégorie tous les acides gras,
le glycérol, les stéroïdes, des alcools autres que le
glycérol et les stérols, les aldéhydes gras et les corps
cétoniques, les hydrocarbures, les vitamines liposolubles et les
hormones (30).
Il y a de nombreux termes redondants ou ayant plusieurs
significations. Par exemple, dans la classification ci-dessus, les
stérols sont une. La catégorie des lipides définie par
l'IUPAC n'inclut pas le cholestérol, classé dans les
terpénoïdes, soit :
- les stéroïdes (dont le cholestérol)
- les terpènes
- les rétinoïdes
Or, les composés tel que le cholestérol sont
effectivement considérés comme des lipides depuis longtemps, y
compris dans la définition faite par l'IUPAC (39). Différentes
études ont donc été faites pour intégrer les
lipides de type acide gras et de type cholestérol dans un même
système de classification. La dernière en date définit
huit catégories, et dérive en partie de la classification faite
par l'IUPAC :
- les acides gras
- les acylglycérols (ou glycérides)
- les phosphoacylglycérols (ou phosphoglycérides)
- les sphingolipides
- les stérols
- les prénols
- les polykétides
- les saccharolipides (ou glycolipides)
Catégorie qui inclut les stéroïdes. Dans
la classification de l'IUPAC, les stéroïdes sont une
catégorie incluant les stérols. Cette remarque est aussi valable
pour les prénols et les terpénoïdes.
II.3.4 Classe des acides gras
Les acides gras sont des acides carboxyliques
caractérisés par une répétition de groupements
méthylène -CH2- formant une chaîne carbonée
généralement constituée d'un nombre pair d'atomes de
carbone. C'est cette chaîne carbonée qui confère aux acides
gras leur caractère hydrophobe.
La classe des acides gras peut se diviser en treize sous-classes
dont les principales sont :
Les acides gras et leurs dérivés :
- Cette sous-classe très riche comprend en premier lieu
les acides gras à chaîne linéaire (fig. 1) de formule
semi-développée :
CH3-[CH2] n-COOH avec n > 1
- Les acides à chaîne linéaire sont des
acides gras saturés dont dérivent les autres sous-classes,
notamment celle des acides gras insaturés (fig. 2).
CH3-CH=CH-(CH2) n-COOH
II.3.5 Classe des acylglycérols
CH2-O-CO-R1 CH-O-CO-R2 CH2-O-CO-R3
Avec R1, R2 et R3 un hydrogène H ou une chaîne
acyl.
Les groupes hydroxyl -OH libres du glycérol chez les
monoglycérides et diacylglycérols peuvent aussi être
substitués par des sucres via une liaison glycosidique.
II.3.6 Classe des phosphoacylglycérols
Les phosphoacylglycérols, encore appelés
phosphoglycérides ou
glycérophospholipides, sont les lipides les plus
abondants dans les membranes biologiques. Ils ont naturellement tendance
à s'organiser en double couche. Leur structure de base est formée
d'un ester de diacylglycérol et de phosphate. Dans la plupart des cas,
le phosphate est également lié à un composé polaire
hydroxylé (
ex. la choline, la sérine,
l'éthanolamine). Un exemple bien connu de phosphoacylglycérol est
la lécithine, souvent utilisée comme additif alimentaire.
La formule générale semi développée
des phosphoglycérides est :
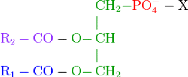
avec R1 et R2 des chaînes acyles et X un composé
hydroxylé.
Lorsque -X est un atome d'hydrogène H, le composé
est appelé acide phosphatidique.
II.3.7 Classe des sphingolipides
Les sphingolipides sont dérivés des
sphingosines ou des sphing-4-ènines, plus connus sous le nom de
sphingosines. Ces deux derniers composés dérivent eux-mêmes
de la condensation d'un acide gras et de la sérine.
La formule générale semi-développée
des sphingonines et des sphingosines est :
OH
R-CH-CH2-CH2-OH NH2
avec R, une chaîne acyl, saturée ou non.
Les sphingololipides peuvent se répartir en neuf
sous-classes :
- les sphing-4-ènines ou sphingosines - Les
céramides
- Les phosphosphingolipides
- les phosphonosphingolipides
- les glycosphingolipides neutres - les glycosphingolipides
acides
- les glycosphingolipides basiques
- les glycosphingolipides amphotères - les
arsénosphingolipides
La sous-classe la plus importante est sans doute celle des
céramides. Il s'agit de sphingonines ou de sphingosines liées
à un acide gras par une liaison amide. Un exemple bien connu de
céramide est la sphingomyéline, impliquée dans la
transmission nerveuse chez les mammifères (15).
La formule générale semi-développée
des céramides est :
OH
R1-CH-CH2-CH2-OH
R2-CO-NH
avec R1 et R2 deux chaînes acyl, saturées ou
non.
II.3.8 Classe des stérols
Les stérols sont des lipides dérivant du noyau
cyclopentanophénanthrénique. Les différents types de
stérols se distinguent selon le nombre et la position d'insaturation
et/ou de chaînes latérales.
Les stérols se divisent en six sous-classes :
- les stérols et dérivés :
cholestérol, phytostérol et dérivés
- les stéroïdes : °\troU qne\,
androgènes, glucocorticoïdes et minéralocorticoïdes -
les secostéroïdes
- les acides biliaires
- les stéroïdes conjugués
- les hopanoïdes
Deux exemples bien connus de stérols sont le
cholestérol et les hormones stéroïdiennes.
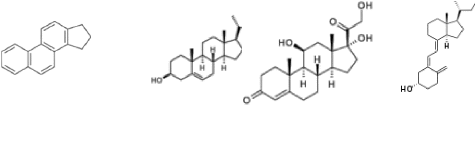
Fig.1
Le cyclo pentanophénantrène
Fig. 2
Un stérol : le cholestérol
Fig.3 Un glucocorticoïde: le cortisol
Fig.4 Un sécostéroïde:la
vitamine D3, ou cholécalciférol
II.3.9 Classe des prénols
Fig.5 : Un isoprénoïde, le
â-carotène.
La structure de base des prénols est
l'isoprène. Les prénols sont synthétisés à
partir de précurseurs à cinq atomes de carbones,
l'isopentènyl-diphosphate et le diméthylallyldiphosphate, issus
de la voie de l'acide mévalonique.
Les prénols peuvent se diviser en trois sous-classes :
- Les isoprénoïdes (ou terpènes)
- Les quinones et hydroquinones : ubiquinones, vitamine E et
vitamine K - Les polyprénols
II.3.10 Classe des polykétides
Fig. Un macrolide, le
6-désoxyérythronolide B
Les polykétides proviennent de la condensation de
groupe acétyl et/ou propionyl (23). Ils forment une gamme très
vaste de composés naturels dont sont dérivés de nombreux
antibiotiques (exemple : les macrolides).
Les polykétides peuvent se répartir en trois
sous-classes :
- Les macrolides
- Les polykétides aromatiques
- Les hybrides peptide-polykétide non ribosomaux
II.3.11 Classe des saccharolipides
Les saccharolipides résultent de
l'estérification ou de l'amidification d'acides gras par des sucres ou
des sucres aminés. Les saccharolipides peuvent se répartir en
quatre catégories :
- Les acylaminosucres
- Les polysaccharides d'acylaminosucres
- Les acyltréhaloses
- Les polysaccharides d'acyltréhaloses
II.4 LE CHOLESTEROL SERIQUE
II.4.1 Définition et structure
Le cholestérol est une molécule grasse
(stérol) essentielle pour le bon fonctionnement de l'organisme, il joue
un rôle dans la construction de la membrane cellulaire et dans la
fabrication d'hormones. Ces stérides sont des esters du
cholestérol et d'acides gras dont les plus
fréquents sont les acides linoléique et oléique. On trouve
aussi du cholestérol libre dans la circulation sanguine (23).
Structure du cholestérol
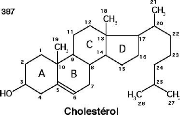
II.4.2 Origine du cholestérol
Le cholestérol est pour l'essentiel produit par le
foie à raison de 70%, les 30% restant proviennent de l'alimentation
(dans les produits d'origine animal : viandes, abats, produits laitiers,
crustacés, oeufs). L'excès prolongé de cholestérol
sanguin entraine l'apparition d'athérosclérose qui est à
l'origine de troubles tels que : l'angine de poitrine, l'infarctus de myocarde,
l'infarctus cérébral et l'artérite (24).
II.4.3 Transport de cholestérol dans l'organisme
(24).
Les lipides (graisses) circulant dans le sang (dont le
cholestérol) ne sont pas solubles dans l'eau. Ils sont donc
transportés par des protéines qui elles sont solubles. Ces
protéines sont nommées lipoprotéines. On distingue deux
types de lipoprotéines :
Les lipoprotéines à haute densité ou HDL
(high density protein en anglais) qui représente le "bon
cholestérol" qui ne se dépose pas sur les parois des
artères et qui possède un pouvoir protecteur puisqu'il " nettoie
" les artères. Plus le taux sanguin HDL-cholestérol est
élevé, plus le risque d'athérosclérose sera faible.
Les HDLcholestérol récupèrent le cholestérol
déposé dans les vaisseaux sanguins et le ramène au foie.
Le taux normal de HDL-cholestérol (bon cholestérol) est de :
o 0,4 à 0,65 g/l pour l'homme
o 0,5 à 0,80 g/l pour la femme
Les lipoprotéines à basse densité ou LDL
(low density protein en anglais) qui représente le "mauvais
cholestérol". On comprendra aisément que son taux doit être
le plus faible possible. Plus le taux de LDL sera élevé, plus la
probabilité d'athérosclérose sera forte. Le taux de LDL
doit être inférieur à 1,6 g/l.
En conclusion : le transporteur HDL (bon cholestérol)
permet de diminuer la fixation du cholestérol sur la paroi des
artères et inversement le transporteur LDL (mauvais cholestérol)
favorise les dépôts de cholestérol sur les
artères.
II.4.4 Métabolisme des lipoprotéines
(51).
Les lipoprotéines sont de grands complexes de
protéines et de lipides, hydrosolubles, qui transportent massivement les
lipides dans tout l'organisme. La coque externe est une monocouche de
phospholipides contenant du cholestérol libre et une ou plusieurs
molécules protéiques appelées apolipoprotéines (par
exemple Apo-A, Apo-B, etc.) ; la partie centrale contient des
triglycérides, des esters de cholestérol et de petites
quantités d'autres substances hydrophobes, comme des vitamines
liposolubles. Les lipoprotéines sont hydrolysées par la
lipoprotéine-lipase.
Les lipoprotéines sont des protéines qui se
lient spécifiquement aux lipides pour les transporter (solubiliser). On
leur attribue une structure tertiaire sphérique et une structure
quaternaire. Les liaisons qui les unissent aux lipides sont mal
définies, et en tout cas des liaisons mixtes : physiques (hydrophobes,
force des Van der Waal) et chimiques (ioniques entre fonctions polaires des
phospholipides et des aminoacides).
La topographie des lipoprotéines serait la suivante :
- Au centre de la sphère, sont concentrés les
lipides neutres : triglycérides, cholestérol et
cholestérides;
- Les lipides neutres sont liés aux phospholipides par
leurs groupements hydrophobes respectifs ;
- Par leurs groupements polaires (phosphates), les
phospholipides sont liés aux chaînes polypeptidiques. Ainsi les
phospholipides constituent le ciment qui unit les lipides neutres à la
protéine.
Il existe une grande variété de
lipoprotéines. Leur hétérogénéité
provient de la diversité des apoprotéines constitutives et des
lipides véhiculés.
A. Les apolipoprotéines
Les apolipoprotéines sont des protéines
constitutives des lipoprotéines, structures chargées de
transporter des molécules hydrophobes (triglycérides,
cholestérol) dans le sang, milieu aqueux. Elles assurent la
cohésion et la solubilisation des lipoprotéines dans le sang.
Elles ont aussi un rôle dans la régulation métabolique
(activateur/inhibiteur d'enzymes plasmatiques ou ligands des récepteurs
membranaires). Selon les lipoprotéines, les apolipoprotéines ne
sont pas les mêmes. Certaines sont transférables d'une
lipoprotéine à une autre (comme les Apo-E et Apo-C).
On distingue:
- L'Apo-A présente à la surface des chylomicrons
et des HDL.
- L'Apo-B-48 présente à la surface des
chylomicrons.
- L'Apo-B-100 présente à la surface des VLDL, des
IDL et des LDL.
- L'Apo-C présente à la surface des chylomicrons,
des HDL et des VLDL.
- L'Apo-E présente à la surface des chylomicrons,
des HDL, des IDL et des
VLDL.
Ainsi en fonction des apolipoprotéines
présentes à leur surface, les lipoprotéines seront
capturées par des cellules différentes (possédant des
récepteurs aux apolipoprotéines différents).
Les apolipoprotéines diffèrent entre eux par la
constitution des chaînes polypeptidiques (séquence des AA).
B. Les classes des lipoprotéines
En fonction de leur constitution (diverses
apolipoprotéines associées à divers lipides), on distingue
trois grandes classes de lipoprotéines. La classification se base sur
deux paramètres : la densité, étudiée au moyen de
l'ultracentrifugation de la flottaison et la mobilité
électrophorétique.
Les chylomicrons : sont des lipoprotéines qui
se forment en période de digestion. Elles sont responsables du transport
des lipides de l'intestin grêle vers les tissus adipeux
périphériques où ils sont retraités.
Lors de l'absorption, les divers lipides provenant de
l'alimentation, et transportés par les micelles, pénètrent
à l'intérieur des entérocytes de
l'épithélium intestinal par le plateau strié, par
diffusion simple. Une fois à l'intérieur, acides gras et
glycérol se regroupent pour former des triglycérides qui se
retrouvent enveloppés par des protéines de la membrane du
réticulum endoplasmique. Cet ensemble lipides-protéines forme les
chylomicrons. Les chylomicrons peuvent alors quitter les cellules de la paroi
intestinale, mais de par leur taille, ils ne peuvent pas rejoindre les
capillaires sanguins. Ils passent alors par la voie lymphatique.
Ces chylomicrons natifs sortent par la lymphe intestinale et
rejoignent la circulation sanguine par la veine Valeurs cave via le canal
thoracique et sont maturés par un échange d'apoprotéines
avec les HDL, ils acquièrent de l'apoE et de l'apoC en cédant
leur apoAI. Leur dégradation dans le tissu adipeux par la LPL les
transforme en restants de chylomicrons par déplétion du volume
central qui seront ensuite captés par le foie, puis
dégradés.
- Densité (par rapport à l'eau) :
inférieure à 0,94.
- Diamètre : entre 20 et 1000 nm.
- Composition : 98 % de lipides (dont 88 % Triglycérides,
8 % de Phospholipides et 1 % de cholestérol estérifié), 2
% de protéines
Ces protéines ne jouent pas un rôle de
véhicule, de ce fait, les chylomicrons, quoique
généralement classés avec les lipoprotéines, ne
sont pas à vrai dire des lipoprotéines.
Les lipoprotéines de forte densité
(High Density lipoprotein HDL) : sont des lipoprotéines
responsables du transport du cholestérol vers le foie où il
pourra être éliminé. Cette fonction permet d'éviter
l'accumulation de cholestérol dans les vaisseaux sanguins et donc
d'éviter les risques d'athérosclérose. C'est pour cela que
les HDL sont qualifiées de bon cholestérol par rapport aux LDL
qui sont appelées mauvais cholestérol.
- Densité (par rapport à l'eau) : comprise entre
1,063 et 1,210.
- Diamètre : entre 6 et 10 nm.
- Composition : 48 % de lipides, 52 % de protéines.
Un taux élevé de HDL serait protecteur contre
certaines maladies cardio-vasculaires (angine de poitrine, infarctus du
myocarde).
Le dosage se fait classiquement par une prise de sang
après 8 h de jeun. Sa valeur est cependant normalisée à
moins de cinq heures après la prise d'un repas normal(22).
Tableau II : Valeurs de référence de
HDL-cholestérol.
|
|
Taux en mg/dl
|
Taux en mmol/L
|
Interprétation
|
<
|
40
|
(< 50 pour les femmes)
|
< 1,03
|
Faible taux de cholestérol HDL, risque accru de maladie
cardiaque.
|
|
|
40-59
|
1,03-1,52
|
Taux moyen d'HDL
|
|
|
> 60
|
> 1,55
|
Taux élevé d'HDL, condition optimale censée
protéger contre les maladies cardiaques.
|
|
Les lipoprotéines de basse densité (ou
LDL pour Low density lipoprotein) sont un groupe de lipoprotéines de
tailles variables (18 à 25 nm de diamètre), qui transportent le
cholestérol, libre ou estérifié, dans le sang et à
travers le corps pour les apporter aux cellules. Les LDL sont produites par le
foie à partir des lipoprotéines de très basse
densité (ou VLDL, very low density lipoprotein). Elles portent des
apolipoprotéines B-100 et des vitamines antioxydantes (vitamine F et
caroténoïdes).
Un défaut de captation des LDL par les cellules des
tissus demandeurs augmente le taux de cholestérol dans les vaisseaux
sanguins : elles s'y déposent ce qui entraîne
l'athérosclérose. Pour cette raison, le LDL est souvent
qualifié de mauvais cholestérol, par opposition au HDL
qui, lui, est appelé bon cholestérol.
- Densité (par rapport à l'eau) : entre 1,006 et
1,063.
- Diamètre : entre 15 nm et 25 nm.
- Composition : 78 % de lipides, 22 % de protéines.
Les LDL (VLDL maturés) permettent de transporter le
cholestérol jusqu'aux organes périphériques. Ce
cholestérol sera récapté par la suite par les HDL
maturés.
Les LDL sont susceptibles d'être oxydés. Ce
phénomène se produit au niveau de l'endothélium vasculaire
lésé, présentant son tissu sous endothélial. Les
LDL oxydés ne sont plus reconnus par les LDL-R, mais par les
récepteurs éboueurs ("scavenger"). Ces derniers sont
présents à la surface des macrophages et des cellules musculaires
lisses ; et ne sont pas régulés par le contenu intracellulaire en
cholestérol, ils peuvent donc se surcharger. L'accumulation en
cholestérol dans les macrophages conduit à des cellules
spumeuses, caractéristiques de la plaque d'athérome.
Le dosage se fait classiquement par une prise de sang
après 8 h de jeûne. Sa valeur est cependant normalisée
à moins de cinq heures après la prise d'un repas normal.
La valeur des LDL est considérée comme normale si
elle est comprise entre 0,9 g/l et 1,58 g/l. En fait, la valeur souhaitable
doit être la plus basse possible et chez un patient ayant fait
déjà un accident cardio-vasculaire, l'idéal est qu'il soit
inférieur à 1 g/litre.
La pertinence de ces valeurs doit cependant être
nuancée : le traitement de référence chez ces patients
reste l'administration d'un médicament de la classe de statines. Or ces
derniers semblent efficaces quel que soit le niveau du LDL initial ce qui fait
penser à un effet propre de ceux-ci, indépendamment de leur
action sur le cholestérol
Les lipoprotéines de très basse
densité (Very Low Density Lipoprotein, VLDL) sont des
lipoprotéines responsables du transfert des lipides endogènes de
leur lieu de synthèse, le foie, vers les tissus.
- Densité (par rapport à l'eau) : comprise entre
0,94 et 1,006.
- Diamètre : entre 30 et 70 nm.
- Composition : 90 % de lipides, 10 % de protéines.
Tableau III: Composition moyenne des
lipoprotéines.
Désignation
|
Fraction lipidique
|
% des protéines
|
|
Triglycérides
|
Phospholipides
|
|
5 %
|
90 %
|
3 %
|
2 %
|
HDL
|
17 %
|
8 %
|
25 %
|
50 %
|
VLDL
|
15 %
|
60 %
|
15 %
|
10 %
|
LDL
|
45 %
|
10 %
|
20 %
|
25
|
|
II.5. BIOCHIMIE PATHOLOGIQUE (38)
Les pathologies en rapport avec les lipides ont pour
étiologie :
- Une hyperproduction des apolipoprotéines ;
- Une métabolisation anormale des lipoprotéines,
par manque d'une enzyme, par défaut d'un transporteur ou par
défaut d'un récepteur ;
- Une mauvaise métabolisation des lipides.
Etant donné le lien étroit qui unit les lipides aux
lipoprotéines, le niveau du danger présenté par un lipide
donné va dépendre de l'association
"lipide-lipoprotéine".
II.5.1. Maladies génétiques
a) L'hypercholestérolémie essentielle
Elle se caractérise par une élévation
anormale du taux du cholestérol et des phospholipides sanguins qui se
trouvent respectivement dans les taux de 350 ~ 750mg/dl et 200 #177; 600mg/dl.
Le cholestérol se dépose dans les tissus.
(V.N. cholestérol : 140 #177; 250 mg/dl ; phospholipides
: 175 #177; 275 mg/dl).
b) Les hyperlipémies essentielles ou
hyperlipoprotéinémies familiales C'est un syndrome qui regroupe
différentes affections héréditaires
caractérisées par une mauvaise métabolisation des lipides
et une augmentation des taux plasmatiques des lipoprotéines.
Les hyperlipémies essentielles sont plus
fréquentes chez la femme que chez l'homme. Le symptôme
extérieur des hyperlipémies, notamment dans les cas
avancés est la présence des xanthomes (éruption
cutanée infiltrée de cellules riches en graisse).
II.5.2. Les lipidoses
Maladies rares caractérisées par une accumulation
tissulaire généralisée de sphingomyéline, de
cholestérol ou de cérébroside.
> Les hyperlipoprotéinémies
secondaires
Un nombre important d'affection s'accompagnent, d'un moment
à un autre de leur évolution, d'une augmentation du taux des
lipides circulants :
- Hyperlipoprotéinémie secondaire au
diabète, caractérisé par l'hyper-VLDL ;
- Hyperlipoprotéinémie secondaire aux affections
thyroïdiennes : augmentation de LDL donc de cholestérol.
- Hyperlipoprotéinémie secondaire à prise
de contraceptifs oraux, due à l'induction de la synthèse de VLDL
dans les hépatocytes ;
- Hyperlipoprotéinémies secondaires aux affections
hépatobiliaires :
a) Certaines glycogénoses s'accompagnent d'une
augmentation de VLDL ;
b) Les obstructions biliaires ou extra hépatiques
entrainent l'augmentation des phospholipides et de cholestérol non
estérifiés ;
- Hyperlipoprotéinémies secondaires aux
affections rénales. Le syndrome néphrotique s'accompagne d'une
augmentation des VLDL et surtout des LDL. Il ya donc une forte augmentation de
triglycérides et de cholestérol.
> L'athérosclérose et
l'évaluation du risque athérogene
a) L'athérosclérose
Maladie des parois des artères due, d'une part,
à la prolifération des cellules graisseuses dans la paroi
vasculaire et, d'autre part, au dépôt de lipides (surtout
cholestérol) sur l'épithélium artériel. Les deux
phénomènes aboutissent Jà l'épanouissement et
à la perte d'élasticité de la paroi vasculaire, en m~me
temps qu'à la diminution du calibre de l'artère.
C'est donc un état pathologique consécutif aux
hyperlipémies. La diminution de la lumière de vaisseaux peut, aux
endroits critiques, aboutir à une thrombose. Une thrombose qui se
produirait dans une branche du système coronaire peut occasionner un
infarctus du myocarde. La même étiologie peut également
amener à un accident vasculaire cérébral. L'un et l'autre
étant cause de mort brusque.
L'athérosclérose ne doit pas rtre confondue avec
l'artériosclérose qui désigne l'ensemble des troubles des
artères provoqué par l'induration (accroissement anormal de la
dureté d'un tissu) et par la sclérose (destruction lente et
progressive d'un tissu qui devient dur) des parois des vaisseaux sanguins.
L'artériosclérose n'est pas nécessairement
due aux lipides, mais l'athérosclérose est une
artériosclérose.
b) Evaluation du risque athérogène
Le principal lipide responsable d'athérosclérose
est le cholestérol. L'évaluation du risque
athérogène consistera donc à mesurer les paramètres
qui objectivent le métabolisme du cholestérol. Il s'agira
notamment de doser les apolipoprotéines A et B, le cholestérol
plasmatique total, le cholestérol incorporé dans les HDL et dans
le LDL, et d'estimer le rapport cholestérol total sur le
cholestérol-HDL.
L'information fournie par le dosage séparé du
cholestérol-HDL et du cholestérol-LDL est particulièrement
précieuse. En effet, il est bien établi aujourd'hui que :
- Le cholestérol incorporé dans les HDL est
transporté des tissus périphériques vers le foie pour y
être métabolisé. On le dit bon cholestérol ;
- Tandis que le cholestérol des LDL est
transporté du foie vers les tissus, avec risque de dépôt
athérogène. C'est donc le mauvais cholestérol. Sa
concentration doit être la plus faible possible.
Tableau IV: Valeurs indicatives du risque
athérogène (en mg/dl).
Niveau du risque
|
Cholestérolémie (mg/dl)
|
HDL- Cholestérol (mg/dl)
|
HDL- Phospholipide (mg/dl)
|
LDL- cholestérol (mg/dl)
|
LDLphospholipide (mg/dl)
|
Risque faible
|
< 200
|
35 #177; 54 (H)
45 #177; 64 (F)
|
75 -120
|
<130
|
< 80
|
Risque modéré
|
200 #177; 250
|
Si < 35
|
Ou < 75
|
130 #177; 160
|
80 #177; 100
|
Risque élevé
|
> 250
|
Si < 35
|
Ou < 75
|
> 160
|
> 100
|
|
Rapport cholestérolémie/HDL-cholestérol :
3,5 #177; 4,5 (H) et 3,39 #177; 4,39 (F)
Au niveau du métabolisme lipidique nous observons deux
aspects importants :
- Les acides gras repris par le foie est remis en circulation
sous forme de lipoprotéines, il y aura donc hyperlipémie qui peut
aller jusqu'à 20 a 30 g/l au lieu de 4,5 #177; 7,5 g/l. Il faut craindre
alors l'athérosclérose.
- Les cellules ne pouvant plus utiliser le glucose comme
source d'énergie, vont cataboliser abondamment les acides gras. Cette
dégradation aboutit à l'acétylCoA mais, le cycle de Krebs
étant défaillant par manque de coenzyme d'oxydoréduction,
l'acétyl-CoA va suivre la voie de la cétogenèse ou de la
formation de cholestérol. Cependant, la formation du cholestérol
sera limitée, car nécessite beaucoup de NADPH, qui manque
justement. Il s'en suivra une cétogenèse accrue. L'accumulation
des corps cétoniques (acide acétoacétique, acide
hydroxyacétone), conduit à l'acidose métabolique. Cette
situation pouvant amener au coma diabétique. Les corps cétoniques
éliminés par les urines augmentent la polyurie.
II.6. BREF APERÇU SUR LES FACTEURS DE RISQUE
Il est utile de préciser certaines définitions
nécessaires à la compréhension des concepts.
II.6.1. Concept de risque
Les facteurs de risque constituent un ensemble de termes
modernes qui englobe le concept classique d'association causale directe de la
maladie, des concepts récents de probabilité de prédiction
et de pronostic. C'est la base même de la pensée clinique et de la
bonne médecine préventive.
Dans chaque population, il existe de groupes de familles et
d'individus qui sont plus enclins que d'autres à présenter une
maladie. Cette inclinaison ou chance s'appelle risque. Certaines strates de
populations constituent donc de groupes à haut risque. Le risque est une
probabilité conditionnelle qu'un sujet ou une couche d'une population
présente une modification spécifique de son état de
santé pendant un intervalle de temps déterminé(12). Le
risque mesure le changement statistique et varie entre zéro (sans
risque) et un (avec risque).
II.6.1.1. Facteur de risque
Le facteur de risque est une variable associée à
la probabilité de survenue d'une maladie. Le facteur de risque peut
être modifiable par des interventions cliniques,
épidémiologiques ou écologiques (tabagisme, alcoolisme,
sédentarité, inactivité physique) ou non modifiable:
âge, sexe.
Par contre, le marqueur de risque est une variable
associée à la probabilité d'incidence de la maladie sans
être modifié par l'homme.
II.6.1.2. Mesure du risque
Le risque est mesuré et exprimé en risque absolu,
risque étiologique, mesure de cote (Odds ratio et risque relatif) et
fraction attribuable.
A. Risque absolu
Il est quantifié par l'incidence cumulative ou la
prévalence. Malheureusement, il est insuffisant pour déterminer
l'étiologie d'un tel risque. Le terme risque absolu et le taux sont
souvent utilisés de façon interchangeable. Les deux types de
taux, les plus couramment utilisés l'incidence et la prévalence,
ne sont que de proportions(4).
B. Risque étiologique
Le risque étiologique est souvent estimé par des
mesures d'associations et d'impacts potentiels. Plusieurs indices mesurent
cette association. Une catégorie comprend la mesure de cote (deux
rapports: Odds ratio (OR) et risque relatif (RR)) et l'autre catégorie,
la différence de risque. Malheureusement, dans les pays francophones, le
terme risque relatif est utilisé pour les deux rapports OR et RR. Dans
le monde anglophone, on distingue Risque ratio (risque relatif) et Odds ratio
(risque de produits croisés).
> Mesure de cote
C'est le ratio entre la probabilité de survenue de la
maladie et celle de survenue d'une autre maladie.
a. Risque relatif
C'est le ratio du risque absolu dans le groupe exposé
(R.E) par le risque absolu chez les non exposés (RNE) dans une
étude de cohorte (prospective, longitudinale).
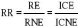
Donc: C'est le rapport de la probabilité de devenir
malade chez les exposés sur la probabilité de devenir malade chez
les non exposés. Résumé dans le tableau de contingence
à quatre cases ou tableau croisé 22 dans une étude de
cohorte (Tableau V).
Tableau V: Tableau de contingence résume une
enquête de cohorte.
|
Malades
|
Non malades
|
Total
|
Exposés
|
|
A
|
C
|
a + b
|
Non exposés
|
|
|
B
|
D
|
b + d
|
Total
|
|
a + b
|
c + d
|
a+b+c+d
|
|
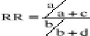
b. Odds ratio
Il est impossible de calculer le ratio de risque absolu dans
une étude cas-témoin. Il faut approcher l'estimation du risque
relatif par le calcul du risque de produits croisés (RPC) tel que
résumé par le tableau de contingence de l'enquête cas
témoins.
Tableau VI: Tableau de contingence dans une enquête
cas témoins.
|
Cas
|
Témoins
|
Total
|
Exposés
|
|
A
|
C
|
a + b
|
Non exposés
|
|
|
B
|
D
|
b + d
|
Total
|
|
a + b
|
c + d
|
a+b+c+d
|
|
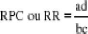
> Différence de risque (O-R)
La différence de risque est égale au risque de
personnes exposées (R.PE) moins le risque de personnes non
exposées(R.PNE).
D.R = R.PE - R.PNE
Elle est utile dans les enquêtes de cohorte.
II.6.1.3. Mesures d'impact potentiel
Ces mesures sont nécessaires pour refléter les
faits attendus d'un changement dans la répartition d'un facteur de
risque dans une population donnée.
a. Fraction étiologique du risque (FER)
La FER est obtenue par la formule suivante : Où :
|
|
|
RE: risque absolu des exposés; RNE: risque absolu des non
exposés.
b. Fraction attribuable dans la population (FAP)
L'importance du rôle de la F.A.P a été
donnée par la planification de programme de santé. Elle est
calculée par la formule suivante:
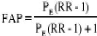
Où :
PE= fraction de la population exposée au risque.
II.6.2. Concept de causalité
Si pour les maladies infectieuses, une cause unique est
l'agent infectieux, il n'est pas la même chose pour les maladies
cardio-vasculaires qui sont multifactorielles. Il est difficile donc de parler
d'une association causale dans les maladies cardio-vasculaires. La notion de
facteur de risque (FR) a remplacé le concept de causalité. La
causalité d'un facteur de risque se réfère à
l'association entre l'individu et la maladie dans une population. Les essais
cliniques peuvent expérimenter cela. Pour déterminer si une
association est causale. Sr Bradford Hill(6) a proposé les
critères suivants :
o La temporalité: la relation temporelle exige
que l'exposition aux facteurs de risque précède la survenue de la
maladie.
o L'effet-dose dépendant signifie que le risque
augmente avec l'augmentation de l'exposition ou de la dose par un gradient
biologique.
o La plausibilité biologique se
réfère au degré de connaissance scientifique actuelle.
o La force et la consistance de l'association
sont éprouvées par la signification statistique retrouvable dans
d'autres circonstances.
o La spécificité et
l'indépendance de l'association montrent qu'un facteur de
risque est plus spécifique pour une maladie donnée et plus
indépendante vis-à-vis d'autres facteurs plus vraisemblables de
l'association causale.
o La cohérence met en évidence la
congruence des études observationnelles (descriptives) et
expérimentales en vue d'une inférence causale.
o L'effet d'une intervention empêche la survenue
de la maladie ou atténue la gravité de la maladie.
o L'analogie permet de confirmer les données
obtenues ailleurs.
II.6.3. Facteurs de risque cardio-vasculaire
Des études épidémiologiques menées
dans les pays développés (17,29) et en Afrique (36, 46, 34) ont
identifié des éléments de comportements de la vie courante
déclenchant, entretenant ou aggravant le risque cardio-vasculaire d'un
sujet ou d'une communauté. Certains facteurs de risque cardio-vasculaire
sont dits classiques (traditionnels ou majeurs) et d'autres reconnus nouveaux
ou mineurs.
Trois facteurs de risque dominent
l'hypercholestérolémie, l'hypertension artérielle et le
tabac (9,45). A côté de ces trois facteurs, il ne faut pas
négliger d'autres facteurs de risque indiscutables que sont: le
diabète sucré, l'obésité abdominale(38), les
facteurs nutritionnels, l'inactivité physique, le stress, les facteurs
de thrombose et de coagulation et certaines anomalies de
l'électrocardiogramme (hypertrophie du ventricule gauche (H.V.G),
trouble de conduction intra ventriculaire et des anomalies
de la repolarisation). Il ne faut pas oublier non plus le sexe
(l'homme et la femme après ménopause) et l'âge qui sont des
facteurs non modifiables.
a. Cholestérol sanguin et dyslipidémie
Des nombreuses études ont montré le rôle
indiscutable du cholestérol plasmatique et des ses fractions dans les
maladies cardio-vasculaires par athérosclérose (50,55).
Le rôle péjoratif de ses différentes
fractions s'exprime selon qu'on a une augmentation du LDL-cholestérol,
une diminution de HDL-cholestérol et un rapport cholestérol
total/HDL-cholestérol > 4,5 (51,53). Le risque lié aux
triglycérides reste discutable (19) sauf dans certains groupes de
population: diabétique et féminine avant la ménopause et
dans certaines conditions telles que l'association à un taux bas de
cholestérol et une anomalie de coagulation.
Le taux bas de HDL-cholestérol constitue en soi un
facteur de risque indépendant de maladie coronaire(51). Certaines
études ont montré cependant un gradient direct entre le taux de
cholestérol et la classe sociale(51). Les valeurs idéales
recommandées sont triglycérides < 200 mg/dl;
cholestérol total < 200 mg/dl; HDL-cholestérol > 35 mg/dl;
cholestérol-LDL < 150 mg/dl (10).
b. Le diabète sucré
La fréquence des maladies cardio-vasculaires
paraît en plus nette augmentation depuis des siècles chez les
diabétiques que dans la population générale. On sait
cependant que c'est par le biais d'hyperinsulinisme et de
l'insulinorésistance qu'apparaissent les maladies cardio-vasculaires
(coronaropathie, HTA, cardiopathie diabétique) (10).
Chez les coronariens africains, le diabète est souvent
associé à d'autres facteurs de risque athérogène
tels que l'hypertension artérielle,
l'hypercholestérolémie, le tabagisme, l'hyperglycémie et
la sédentarité (38, 19 et 33).
c. Tabagisme
Qu'il soit actif ou passif, le tabagisme à la
cigarette, intervient comme facteur de risque majeur et indépendant des
artériopathies de membres et des maladies cardiovasculaires(44,48).
Des études épidémiologiques ont
montré une forte relation entre le tabac et les accidents myocardiques
aigus (infarctus, mort subite) (53,47), l'existence d'une réduction
efficace des récidives d'accidents coronaires en cas d'arrêt de
tabac (pratiquement de moitié) (48) et son gradient social important aux
dépens des ouvriers (52,15).
En Afrique noire, dans une étude faite en
Algérie, le tabagisme à la cigarette apparaît comme le
premier facteur de risque (70%) de l'infarctus du myocarde avec une
consommation de plus de 20 cigarettes/jour exclusivement par les hommes
(18).
d. L'hypertension artérielle
Considérée comme facteur de risque majeur (15),
elle occupe la première place parmi les autres facteurs de risque
cardio-vasculaire en Afrique (10,3) et est citée comme étiologie
principale de la déviation axiale gauche au Congo oü sa
fréquence augmenterait avec l'âge, sans différence de sexe
(25).
Des études ont démontré que le type de
l'atteinte vasculaire était corrélé au degré de
l'hypertension artérielle: les types d'hypertension artérielle
légère et modérée prédisposent aux accidents
ischémiques (coronaires et AVC) tandis que la forme sévère
aux accidents hémorragiques (43,16 ,2).
e. Obésité
L'augmentation de la masse grasse (obésité et
surcharge pondérale oü l'index de masse corporelle 25
kg/m2) constitue un problème de santé publique aux
États-Unis et en Europe (14,52).Des études ont montré
cependant que la répartition de tissu graisseux fournissait un meilleur
reflet de risque de complications que le poids corporel (38).
Ainsi l'obésité centrale (androïde ou
abdominale) donnait une valeur prédictive importante du risque
d'infarctus du myocarde, d'affection coronarienne et de mort subite (28, 53,24)
chez l'homme et indépendamment du poids corporel. Cette association
agirait par le biais de l'hyperinsulinisme et de l'insulinorésistance.
Tandis que pour l'obésité de type périphérique ou
gynoïde, le risque est celui de l'intolérance au glucose, du
diabète sucré, de goutte et d'athérosclérose
(11).
f. Alcoolisme
Plusieurs études rétrospectives et prospectives
dans le monde, ont fait état du rôle protecteur de l'alcoolisme
modéré (1 à 3 verres de vin) dans les maladies
cardiovasculaires ainsi que dans les autres maladies comme le cancer
(23,22).
En Afrique, Kacou et Monken supposent que les coronariens
consomment plus d'alcool que les groupes témoins (50).
g. Inactivité physique
Il parait difficile de lui attribuer un rôle
indépendant dans les maladies cardiovasculaires sans tenir compte des
autres facteurs de risque qui lui sont souvent associés.
Des études épidémiologiques montrent la
place de l'activité physique dans l'effet préventif
vis-à-vis de la survenue des accidents coronariens en Afrique (50,44) et
dans le monde (44). Il s'avère que les coronariens africains marchent
moins (50).
h. Ethnicité
Dans certains regroupements humains, de structures
familiales, économiques et sociales homogènes, de langues et de
cultures communes, existent des facteurs de risque diabétique et
cardio-vasculaire prédominants (50).
Ainsi dans l'HTA du noir africain, on note quelques
particularités: elle se complique plus de cardiopathies, de
rétinopathies, de néphropathies et d'AVC; et se retrouve chez les
sujets en âge d'activité et l'insuffisance coronarienne est
exceptionnelle, à l'inverse de ce qui est décrit en Occident
(37).
i. Facteurs nutritionnels
· . Consommation excessive de graisse
Des études épidémiologiques ont
démontré une relation nette et positive entre la mortalité
par cardiopathie ischémique et le pourcentage moyen d'énergie
apportée par les lipides saturés et une relation négative
par les lipides polyinsaturés de l'alimentation (28,48).Le rapport acide
gras monoinsaturé/acide gras saturé constitue les meilleurs
prédicteurs de la rentabilité des maladies ischémiques
(47).
Dans une étude africaine, les coronariens consommaient
peu ou pas des lipides d'origine animale (saturés) mais plus des lipides
d'origine végétale (insaturés: monoinsaturé (huile
d'arachide) et polyinsaturé (huile de soja, olive) (50).
· . Consommation excessive de sel
Certaines populations primitives ne présentent pas de
risque d'hypertension artérielle à cause de leur faible
consommation en Na+ (8).
Par contre d'autres études africaines démontrent
la grande différence de pression artérielle liée à
des différences de consommation de sel(47).
Les résultats de l'étude multicentrique Intersalt
ont renforcé le rôle on ne peut plus important du Na+
dans la genèse de l'hypertension artérielle (52).
· . Niveau socio-économique
Il apparaît que les sujets aisés sont plus
souvent atteints par les maladies cardiovasculaires et le diabète que
les sujets de niveau modeste en pays en voie de développement, ce qui
est inversé dans les pays développés (40). En Afrique
noire, c'est la classe moyenne qui est la plus touchée.
·
· Age et sexe
L'âge a été retenu comme facteur de risque
non modifiable dans les maladies cardiovasculaires, le diabète, et
particulièrement dans l'HTA (15).
Des études contradictoires suggèrent que la
pression artérielle (P.A) ainsi que la prévalence de l'HTA
accroissent avec l'âge dans les sociétés
industrialisées (3). Mais d'autres par contre ne montrent que peu ou pas
de variation avec l'âge (41).
Les populations primitives africaines et celles de la
société rurale sont caractérisées par un mode de
vie traditionnel sans acculturation où la pression artérielle
augmente peu ou pas avec l'âge et qu'il n'existe peu ou pas
d'hypertension artérielle (17,37).Des études antérieures
réalisées en Afrique de l'Est, du Sud, de l'Ouest et du centre
notent l'augmentation de la P.A et de l'HTA avec l'âge (40,8).
Dans les pays développés, le risque de
décès par AVC et maladies coronaires est multiplié par
trois à quatre fois dans chaque décade de sujets
âgés de 45-74 ans (14). Le sexe masculin au-delà de 55 ans
et le sexe féminin au-delà de 65 ans ont aussi été
cités comme facteur de risque cardio-vasculaire. Mais
l'obésité est beaucoup plus prévalent chez la femme dans
plusieurs études (13, 36).
·
· Migration
La migration un des phénomènes courants de la
société en voie de développement a été
incriminé indirectement dans la genèse des maladies
cardio-vasculaires comme facteur de risque environnemental (40). En effet, la
population rurale qui rue vers le milieu urbain, se voit obliger de changer son
comportement et ses habitudes alimentaires par le biais du tabagisme,
alcoolisme, sédentarité, alimentation riche en graisse animale et
sel qui sont des facteurs directs dans la genèse des maladies
cardiovasculaires et du diabète sucré.
·
· Association des facteurs de risque
Des études prospectives et rétrospectives ont
souligné le caractère multifactoriel du diabète et des
maladies cardio-vasculaires et la dépendance d'un certain nombre de
paramètres biocliniques dans leur apparition.
CHAPITRE III : MATERIEL ET METHODES.
III.1 MATERIEL.
III.1.1 Les spécimens biologiques.
Les échantillons de sérums sanguins des
individus non diabétiques issus de familles dont un proche parent est
diabétique connu et déclaré, ont été obtenus
au centre diabétologique BOYAMBI (Armée du Salut) sis croisement
des avenues Rwakadingi et Kasaï dans la commune de Gombe à Kinshasa
soit 67 échantillons dont 33 femmes et 34 hommes.
Les échantillons sanguins d'un groupe des sujets
témoins dont le proche parent n'a pas le diabète sucré ont
été fournis par le laboratoire du service médical de la
commission électorale indépendante. Nous avons totalisé 40
échantillons repartis comme suit :
- 20 échantillons des femmes non diabétiques sans
proche parent diabétique connu ni déclaré.
- 20 échantillons des hommes non diabétiques sans
proche parent diabétique connu ni déclaré.
- Les sérums frais ont été repartis en
aliquotes puis gardés dans le congélateur dans les cas oû
les analyses ne sont pas faites le même jour.
III.1.2 Matériel et équipements du
laboratoire.
- Spectrophotomètre : Spectrum SAFAS monaco.
R
- Vortex de marque Cyan CL001. R
- Bain marie : Memmert type, W B-7 .R
- Centrifugeuse électrique : Selecta centro-8.
R
- Frigo : Apollo Brandt. R
- Poupinel : Memmert .R
- Micropipettes Huawei R de 10-200ìl,
100-1000ìl.
- Micropipettes Humapette R de 500ìl.
- Embouts bleus et jaunes Cypress R de 1000ìl
et de 1-200ìl.
- Pissette de 1000ml.
- Portoir pour tubes à essai.
- Tubes à essai.
- Papier Joseph .R
- Aiguilles Vacutainer R G21.
- Pipettes graduées en verre de 5 ml, 10ml.
III.1.3 Réactifs.
Nous avons utilisé spécialement des réactifs
prêts jà l'emploi de la firme FORTRESS diagnosticsR,
présentés sous forme de kits dont voici les compositions :
a. Cholestérol total : CHOD-PAP
(lyophilisé).
FORTRESS diagnosticsR, kit référence :
BXC0261D.
Le kit comprend :
R1solution tampon :
· Pipes buffer «« ~ 50mmol/l
· Phénol K «««« «« ~
6.0mmol/l
R2 Réactif lyophilisé :
·
4-amino-antipyrine«««««««««««~
0.3mmol/l
· Cholestérol
oxydase««««««««««~.. >
100UI
· Cholestérol
Estérase««««««««««~..
> 150UI
· Cholestérol
Estérase««««««««««~..
> 150UI
·
Peroxydase««««««««««««««~
> 800UI R4 Standard :
· Etalon de cholestérol K « ~. 200mg/dl ou
5.17mmol/l
b. HDL-Cholestérol : précipitant.
FORTRESS diagnostics R, kit référence :
BXC0422A.
Pour obtenir la séparation des lipoprotéines de
haute densité et dosage du cholestérol et des phospholipides
liés à ces fractions.
Le kit comprend :
Réactif précipitant(R1) :
· Acide phosphotungstique ««««
««««~.. 0.55mmol/l (40g/l)
· MgCl2.6H2O pH 6,2 ~«««
««««~...25mmol/l (100g/l)
Réactif 2(R4) :
Standard HDL-Cholestérol
· Cholestérol libre +cholestérol
estérifié «« ~. 1,3mmol/l ou 0,5g/l.
c. LDL-Cholestérol : précipitant.
FORTRESS diagnostics R, kit référence :
BXC0432A.
Le kit comprend :
Réactif (R1) : précipitant
· Citrate de sodium pH
5,04«««««««««««««
0,064mmol/l Standard (R4) :
· LDL-Cholestérol. ««««
«« ~.5.17mmol /l (soit 200mg/dl)
III.2 METHODES.
III.2.1 Dosage du cholestérol total.
Le cholestérol est déterminé selon les
réactions suivantes : Principe :
Cholestérol estérase
Cholestérol estérifié + H2O
Cholestérol + acides gras
|
Cholestérol + O2
|
Cholestérol oxydase
|
|
Cholestérol +O2
|
|
|
Peroxydase
|
2H 2O2 + 4-aminophenazone + phénol
|
|
quinonéimine + 4H2O
|
On mesure au photomètre l'intensité de la
coloration de la molécule formée, le quinonéimine, qui est
directement proportionnelle à la quantité de cholestérol
présente.
Mode opératoire :
Préparation des réactifs : reprendre le contenu
d'un flacon de réactif R2 par le volume correspondant contenu du flacon
de réactif R1. Bien mélanger et attendre 15 minutes avant de
travailler. Stabilité : 21 jours à + 4° C ;
Réalisation du test :
- Longueur d'onde : 546nm.
- Température : 37 0C, 30°C ou
25°C.
- Cuvette (trajet optique) : 1 cm.
- Calibration de zéro du spectrophotomètre : Blanc
réactif.
TABLEAU VII: Résumé du mode
opératoire de dosage du cholestérol total.
|
Blanc réactif
|
Echantillon
|
Eau distillée
déminéralisée
|
10ul
|
-
|
Etalon (200mg/dl)
|
-
|
10ul
|
Réactif de travail
|
1000ul
|
1000ul
|
|
Bien mélanger et incuber pendant 10 minutes à
370C. Lire l'absorbance de l'échantillon ou de
l'étalon contre le blanc réactif à 546nm. Cette
réaction est stable pendant une heure.
Calcul de la concentration du cholestérol total
: C. Ech. ~ ~~ ~
~ ~ ~ ~ ~ ~ ~
Tableau VIII : Valeurs attendues.
Cholestérolémie
|
Evaluation du risque
|
< 2 g/l
< 200 mg/dl < 5,18 mmol/l
|
Risque faible, en particulier si :
|
Cholestérol #177; HDL < 0,60 g/l
< 60 mg/dl
1,55 mmol/l
|
|
III.2.2 Dosage du HDL-Cholestérol.
Principe :
Les chylomicrons et les lipoprotéines de très
faible densité( VLDL) et de faible densité(LDL) contenus dans
l'échantillon sont précipité par addition d'acide
phosphotungstique en présence d'ions magnésium. Le surnageant
obtenu contient les lipoprotéines de haute densité(HDL) dont le
cholestérol est dosé comme vu pour le cas de cholestérol
total.
Mode opératoire :
Préparation des réactifs :
Réactif R1 et Standard HDL-cholestérol R4 sont
prts à l'emploi. Réalisation du test :
- Longueur d'onde : 500nm.
- Température : 37 0C, 30°C ou
25°C.
- Cuvette (trajet optique) : 1 cm.
- Calibration de zéro du spectrophotomètre : Blanc
réactif.
Tableau IX : Procédure de
précipitation.
|
Macro-méthode
|
Semi micro-méthode
|
Echantillon
|
50011l
|
20011l
|
HDL précipitant R1
|
100011l
|
-
|
Diluted Precipitant
|
-
|
50011l
|
|
Bien mélanger et incuber pendant 10 minutes à
la température ambiante. Puis, centrifuger pendant 10 minutes à
4000 TPM. Reprendre le surnageant limpide qui est stable pendant deux heures
pour déterminer le HDL-cholestérol avec la solution de travail du
cholestérol total et le HDL- standard de 50mg/dl.
Tableau X : Mode opératoire pour le dosage du
HDL-cholestérol.
|
Blanc réactif
|
Etalon
|
Echantillon
|
Eau distillée
déminéralisée
|
10011l
|
-
|
-
|
Etalon R4 (50mg/dl)
|
-
|
10011l
|
-
|
Surnageant
|
-
|
-
|
10011l
|
Solution de travail
(Cholestérol total)
|
100011l
|
100011l
|
1000 11l
|
|
Bien mélanger et incuber pendant 5 minutes à
37°C. Lire l'absorbance de l'échantillon ou de l'étalon
contre le blanc réactif à 500nm. Cette réaction est stable
pendant une heure.
Calcul D. 0 echantillonul de la concentration du
HDL-cholestérol : C. Ech. = x Conc. etalon.
D. 0 etalon
Tableau XI : Valeurs attendues.
HDL-cholestérolémie
|
Valeurs basses
|
Valeurs hautes
|
mg/dl
|
< 40
|
= 60
|
mmol/l
|
< 1,04
|
= 1,55
|
|
III.2.3 Dosage du LDL-Cholestérol.
Principe du dosage :
Les lipoprotéines de basse densité sont
précipitées par addition d'héparine à leur point
isoélectrique (pH 5.04). Les HDL et les VLDL restent dans le surnageant
et peut être déterminée par des méthodes
enzymatiques.
LDL Cholestérol = Cholestérol total #177;
Cholestérol du surnageant.
Mode opératoire :
Préparation des réactifs : Réactif
précipitant R1 et Standard LDL-cholestérol R4 sont priJts
à l'emploi.
Réalisation du test :
- Longueur d'onde : 500nm.
- Température : 37 0C, 30°C ou
25°C.
- Cuvette (trajet optique) : 1 cm.
- Calibration de zéro du spectrophotomètre : Blanc
réactif.
Tableau XII : Procédure de
précipitation.
|
Macro-méthode
|
Semi micro-méthode
|
Echantillon
|
100ul
|
50ul
|
LDL précipitant R1
|
1000ul
|
500ul
|
|
- Bien mélanger et incuber pendant 10 minutes à la
température ambiante. - centrifuger pendant 15 minutes à 4000
TPM.
- Reprendre le surnageant limpide qui est stable pendant une
heure pour déterminer le cholestérol dans le surnageant avec la
solution de travail du cholestérol total et son standard de 200mg/dl.
Tableau XIII : Mode opératoire pour le dosage du
LDL-cholestérol.
|
Blanc réactif
|
Etalon
|
Echantillon
|
Eau distillée
déminéralisée
|
50ul
|
-
|
-
|
Etalon R4 (200mg/dl)
|
-
|
50ul
|
-
|
Surnageant
|
-
|
-
|
50ul
|
Solution de travail
(Cholestérol total)
|
1000ul
|
1000ul
|
1000 ul
|
|
- Bien mélanger et incuber pendant 5 minutes à
37°C.
- Lire l'absorbance de l'échantillon ou de
l'étalon contre le blanc réactif à 500 nm. Cette
réaction est stable pendant une heure.
Calcul de la concentration du cholestérol dans le
surnageant :
D. O echantillon
C. éch. ' D. O etalon x Conc. etalo
ou
La concentration du cholestérol dans le surnageant=
D.OECH. x 1920 à 546nm (ou D.OECH.x 1265 à
500nm). Le résultat est exprimé en mg/dl.
LDL cholestérol= cholestérol total #177;
cholestérol dans le surnageant. Tableau XIV : Valeurs
attendues.
|
Conc. de LDL-Cholestérol
|
mg/dl
|
mmol/l
|
|
Optimale
|
< 100
|
< 2,59
|
|
Limite moyenne
|
100 #177; 129
|
2,59 #177; 3,35
|
|
Limite haute (alarme)
|
130 #177; 159
|
3,36 #177; 4,12
|
|
Risque élevé
|
160 #177; 189
|
4,13 #177; 4,89
|
|
Risque très élevée
|
>190
|
>4,90
|
III.3 TESTS STATISTIQUES UTILISE POUR L'ANALYSE DE
RESULTATS.
En rapport avec l'analyse des données, nous avons
utilisé les méthodes statistiques suivantes :
III.3.1 Calcul de différentes moyennes,
écarts types.
La moyenne et l'écart type s sont obtenus par les
équations suivantes :
i et s = i - ~
n
n - 1
Ou : ? = sommation.
Xi= données observées. n = taille de
l'échantillon.
III.3.2 Comparaison des moyennes par la loi de Student.
La loi de Student consiste à calculer le variable
aléatoire utilisée dans les tests de paramètres comme la
moyenne, selon le protocole de calcul suivant :
Prenons deux échantillons A et B, qui contiennent des
valeurs XA et XB, nous calculons successivement :
> La variance commune : r
)= C C B
B-
=
L'écart type commun : = C C B
B-
> L'écart type de la différence entre les
moyennes : = B
. B
> Le ½ t½ est obtenu par : t
= - B
½t½ tabulaire au seuil de signification de
probabilité de 5%, avec nA+nB-2 degré de liberté. La
probabilité de 5% est le seuil de signification
généralement utilisé en biologie expérimentale
c'est-à-dire une probabilité de 95% que l'hypothèse nulle
soit rejetée et 5% de chance qu'elle ne soit pas rejetée.
III.3.3 Comparaison des moyennes par le test d'écart
réduit "å".
Nous nous intéressons aux valeurs que prendra la
différence d= -- de nos deux
populations de grands échantillons nA et nB dont
l'écart type de la différence est :
~=
~ B
L'écart réduit est obtenu par : å = - ~
Cette formule n'est utilisable que pour de grands
échantillons nA = 30 et nB = 30.
CHAPITRE IV : RESULTATS ET DISCUSSION.
IV.1. ANALYSES DES RESULTATS.
Notre étude a pour objet d'estimer le risque
hypercholestérolémique par comparaison des taux sériques
du cholestérol total, de HDL-cholestérol et de
LDL-cholestérol chez les personnes non diabétiques issues des
familles diabétiques, avec ceux des sujets non diabétiques issus
des familles non diabétiques. Nous avons ainsi travaillé sur un
échantillon total de 107 individus dont 53 femmes et 54 hommes.
A cet effet, nous avons dosé le cholestérol
total, le HDL-cholestérol et le LDLcholestérol dans le
sérum de deux populations. Les résultats sont
présentés en annexes I, II, III, IV, V, VI, VII de ce travail.
IV.1.1. Elimination des valeurs extrêmes.
Nous avons vérifié, conformément à
la pratique statistique habituelle (5), si les résultats se limitent au
delà de la valeur trois écart-type (= 3 S) par rapport à
la moyenne des résultats considérés comme non
pathologiques. La moyenne des résultats non pathologiques est de :
119,25 mg/dl et écart type de 80,95 mg/dl. 3 écart-types
équivalent à 242,85 mg/dl. Donc, les résultats 433,4 ; 333
; 389,6 ; 396,7 mg/dl s'éloignent de la moyenne de plus de 242,85 mg/dl,
nous les écartons donc de l'ensemble des résultats
pathologiques.
Tableau XV: Limites de référence
annoncée par la littérature.
|
Référence
|
Limites de référence en mg/dl
|
|
Cholestérol total
mg/dl
|
HDL-cholestérol
mg/dl
|
LDL-cholestérol
mg/dl
|
|
FORTRESS
DIAGNOSTICS
|
140 #177; 200
|
> 40
|
130 - 159
|
|
LABORATOIRE HUMAN
|
180 #177; 200
|
> 35
|
> 130
|
De ce qui précède, certains résultats de
LDL-cholestérol des femmes et des hommes non diabétiques issus
des familles diabétiques apparaissent nettement écartés de
l'ensemble. Comparés aux limites de référence qui sont
présentées dans Tableau XV, ces résultats apparaissent
hautement pathologiques. Ils étaient 433,4 ; 333 ; 389,6 et
397,7mg/dl.
IV.1.2. Comparaison des moyennes entre les deux sexes dans
la population à risque issue de familles diabétiques.
Nous avons comparé les moyennes des résultats
obtenus dans la population cible pour vérifier s'il y aurait une
différence statistiquement significative jà
l'écart-réduit de å = 0,05 entre les femmes et les hommes
en ce qui concerne les paramètres dosés.
Tableau XVI : Comparaison des moyennes (mg/dl) des
concentrations sériques du cholestérol total, du
HDL-cholestérol et du LDLcholestérol entre les sexes dans la
population à risque. Par le test "å" de l'écart
réduit.
|
Paramètres
|
~ o
|
~ f
|
d
|
å
|
å .
|
Signification
|
|
Cholestérol total
|
151,7
|
141,7
|
12,35
|
0,81
|
1,96
|
NS
|
|
HDL-cholestérol
|
26,10
|
22,70
|
3,44
|
1,00
|
1,96
|
NS
|
|
LDL-cholestérol
|
101,10
|
100,20
|
8,20
|
0,11
|
1,96
|
NS
|
Légende :
? o : Concentrations moyennes chez les hommes.
n
f : Concentrations moyennes chez les femmes.
d Ecart type de la différence.
å : Ecart réduit calculé.
å . : Ecart réduit à 0,05 %.
NS : différence statistiquement non significative.
Les résultats de la comparaison des moyennes entre les
sexes dans la population à risque nous révèlent que les
moyennes entre les deux sexes pour les concentrations sériques du
cholestérol total, de HDL cholestérol et de LDL
cholestérol ne présentent pas de différences
statistiquement significatives. Ceci nous conduit à combiner les deux
données concernant les deux sexes pour ne faire qu'un seul
échantillon d'individus non diabétiques issus des familles
diabétiques pour chacun des paramètres étudiés.
Tableau XVII : comparaison des moyennes (mg/dl) des
concentrations sériques du cholestérol total, du
HDL-cholestérol et du LDL-cholestérol entre les sexes dans la
population témoin par le test "t" de Student.
|
Paramètres
|
~ o
|
~ f
|
|
d
|
|
.
|
Signification
|
|
Cholestérol total
|
139,60
|
140,75
|
38,85
|
12,43
|
0,09
|
2,02
|
NS
|
|
HDL-cholestérol
|
24,30
|
23,40
|
15,26
|
4,88
|
0,18
|
2,02
|
NS
|
|
LDL-cholestérol
|
83,60
|
84,93
|
33,07
|
10,58
|
0,13
|
2,02
|
NS
|
ddl=37
Légende :
? o : Concentrations moyennes chez les hommes.
n
f : Concentrations moyennes chez les femmes.
Ecart type commun.
d Ecart type de la différence.
: t calculé.
·
: t à 0,05 %
NS : différence statistiquement non significative.
Les résultats de la comparaison des moyennes entre les
sexes dans la population témoin nous révèlent que les
moyennes entre les deux sexes pour les concentrations sériques du
cholestérol total, de HDL cholestérol et de LDL
cholestérol ne présentent pas de différences
statistiquement significatives. Dès lors, nous combinons les
résultats concernant les deux sexes pour ne faire qu'un seul
échantillon d'individus non diabétiques issus des familles non
diabétiques pour chacun des paramètres étudiés.
IV.1.3. Comparaison des moyennes des concentrations
sériques du cholestérol total, du HDL-cholestérol et du
LDL-cholestérol entre les individus non diabétiques issus des
familles diabétiques et les individus non diabétiques issus des
familles non diabétiques.
Pour évaluer les différences des taux
sériques des lipides étudiés entre les deux populations,
nous avons comparé par le test d'écart- réduit å,
les moyennes des concentrations de ces différents lipides dans la
population à risque et la population témoin. Dans le tableau
suivant, nous présentons les statistiques de ces comparaisons:
Tableau XVIII : Comparaison des moyennes (mg/dl) des
concentrations sériques du cholestérol total, du
HDL-cholestérol et du LDLcholestérol entre les individus issus
des familles diabétiques et la population témoin par le test
½å½ de l'écart réduit.
|
Paramètres
|
~
|
~ T
|
d
|
å
|
å
|
å
|
Signification
|
|
Cholestérol total
|
146,875
|
140,2
|
8,69
|
0,768
|
1,96
|
2,326
|
NS
|
|
HDL-cholestérol
|
24,45
|
23,82
|
2,97
|
0,21
|
1,96
|
2,326
|
NS
|
|
LDL-cholestérol
|
100,63
|
84,31
|
6,6
|
2,47
|
1,96
|
2,326
|
S*
|
Légende :
~ : Concentrations moyennes chez les individus issus des familles
diabétiques.
~ P : Concentrations moyennes chez la population
témoin.
d Ecart type de la différence. å : Ecart
réduit calculé.
å ~ : Ecart réduit à 0,05 %. å ~ :
Ecart réduit à 0,02 %.
NS : différence statistiquement non significative.
S* : différence statistiquement significative au seuil de
5%.
Nous obtenons en définitif des effectifs de :
- Pour la population à risque : 64 résultats de
chaque paramètre dosé.
- Pour la population témoin : 39 résultats de
chaque paramètre dosé.
Les résultats de la comparaison des moyennes entre la
population à risque et la population témoin nous
révèlent que les moyennes entre les deux groupes pour les
concentrations sériques du cholestérol total, de HDL
cholestérol ne présentent pas de différences
statistiquement significatives. Par contre, les concentrations sériques
de LDL-cholestérol entre les deux groupes nous révèlent
une différence statistiquement significative au seuil de
l'écart-réduit de 5 %.
51 IV.2. DISCUSSION DES RESULTATS.
De cette étude prospective effectuée
après comparaisons des concentrations sériques des
paramètres lipidiques (cholestérol total, HDL-cholestérol
et du LDL-cholestérol) entre les individus non diabétiques issus
des familles diabétiques et les individus non diabétiques issus
des familles non diabétiques, nous pouvons tirer des renseignements
suivant :
> De l'allure générale des
résultats chez la population à risque et la population
témoin.
Nonobstant les quatre résultats de dosage des
LDL-cholestérol, l'étude concordent avec les résultats
annoncés dans la littérature et inclus dans les zones de
référence. Nous avons remarqué que le HDL-
cholestérol est effondré dans la majorité et ceux dans la
population à risque mais aussi dans la population témoin.
Le tableau XV reprend quelques valeurs rencontrées dans la
littérature.
> De la différence des concentrations
sériques entre les sexes.
Un grand nombre d'auteurs indiquent de différences des
concentrations des lipides étudié entre les sexes. Nous avons
également étudié ces différences en ce qui concerne
les individus non diabétiques issus des familles diabétiques.
Nous avons trouvé que ces différences qui sont
visuellement réelle ne sont pas statistiquement significatives. Il est
très probable qu'un échantillon plus important aurait
confirmé les données de la littérature.
> De la comparaison entre la population à
risque et la population témoin :
Les différences entre les femmes et les hommes n'ayant
pas été statistiquement significatives dans tous les trois
paramètres (cholestérol total, HDL-cholestérol et
LDL-cholestérol), nous avons regroupé les deux sexes et ne faire
qu'un seul échantillon pour chacun des paramètres. Aussi bien
pour la population cible que pour la population témoin.
Nous avons remarqué qu'il n'avait pas de
différences statistiquement significatives entre les individus non
diabétiques issus des familles diabétiques et les individus non
diabétiques issus des familles non diabétiques.
En outre, la littérature nous renseigne que, en ce qui
concerne le HDL-cholestérol, la prédestination au diabète
de type II, de mrme que la présence d'un diabète de type II se
traduisent par des taux faibles. Nous avons observé de taux
sériques effondrés dans notre étude prospective. Cette
observation appelle une étude ultérieure plus enrichie sur les
taux sériques de HDL-cholestérol chez les individus non
diabétiques issus des
familles non diabétiques pour rechercher les limites de
référence réelles pour notre population congolaise sur
base de nos us, coutumes et habitudes
hygiéno-diététiques.
> De l'évolution de la
prédisposition au diabete de type II.
Nous avons acquis la confirmation que, tout comme dans la
littérature, que les diabétiques de type II ont des HDL
#177;cholestérol faible et des LDL-cholestérol > 160 mg/dl.
Ceci explique le fait qu'ils sont plus exposés aux attaques cardiaques
à répétition.
Nous avons rencontré dans notre étude quatre
individus dont les taux sériques lipidiques sont de loin plus
au-delà de la moyenne générale dans la population à
risque.
Mais on ne peut se limiter à ces simples facteurs
extérieurs. En effet, on remarque que l'on retrouve souvent des
individus diabétiques dans une même famille, alors que d'autres
familles semblent totalement épargnées par la maladie.
L'existence de "familles de diabétiques" permet de mettre en cause une
origine génétique du diabète de type II (7).
CONCLUSION
L'objectif dans l'élaboration de cette étude
prospective était d'infirmer ou de confirmer l'éventualité
d'une relation de cause à effet entre de risques aggravant d'une
hyperlipémie et la survenue du diabète sucré surtout de
type II, et la maladie cardiovasculaire.
De ce qui précède, les résultats
d'analyses observés indiquent clairement que les individus non
diabétiques avec un proche parent diabétique connu et
déclaré sont toute fois plus exposés que les individus non
diabétiques issus des familles non diabétiques en se basant sur
les paramètres les plus élevés dans les deux
populations.
Pour ce faire, nous avons comparé les concentrations
sériques du cholestérol total, de HDL-cholestérol et de
LDL-cholestérol de 67 individus non diabétiques issus des
familles diabétiques avec celles de 40 individus non diabétiques
sans un proche parent diabétique connu ni déclaré.
Les résultats observés ont été :
- Il existe de différences statistiquement non
significatives en ce qui concerne les taux sériques du
cholestérol total et du HDL-cholestérol entre la population
à risque et la population témoin. En effet, il n'est
renseigné que les individus non diabétiques âgés de
moins de 30 ans avec un taux sérique de HDL-cholestérol >
35mg/dl présentent un risque important d'éclosion d'un
diabète de type II.
- Nous avons trouvé également dans la
population à risque, des personnes présentant des taux
sériques des lipides nettement plus élevés que la moyenne
générale de l'ensemble des individus non diabétiques avec
un proche parent diabétique connu et déclaré.
- Nous avons remarqué, en ce qui concerne le
HDL-cholestérol des valeurs faibles à la différence
annoncée par la littérature.
Nul ne pouvant prévoir l'évolution de ces
paramètres lipidiques, il est souhaitable que cette population à
risque veille sur son régime alimentaire pour éviter un surpoids
(obésité), éviter de se sédentariser, pratiquer des
exercices physiques au quotidien et surveille la santé par un check-up
annuel de sa glycémie et de son bilan lipidique.
ANNEXES
ANNEXE I : Résultats de dosage du
cholestérol total, du HDL-cholestérol et du LDL-
Cholestérol chez 33 femmes non diabétiques issues des familles
diabétiques.
|
No
|
Cholestérol total (mg/dl)
|
HDL-Cholestérol (mg/dl)
|
LDL-Cholestérol (mg/dl)
|
|
1
|
128
|
24
|
90,2
|
|
2
|
97
|
12
|
73,7
|
|
3
|
126
|
18
|
88,7
|
|
4
|
134
|
18
|
99,1
|
|
5
|
94
|
17
|
66,2
|
|
6
|
104
|
11
|
76,1
|
|
7
|
132
|
14
|
109,3
|
|
8
|
213
|
26
|
174,58
|
|
9
|
112
|
10
|
87,2
|
|
10
|
149
|
16
|
122,1
|
|
11
|
102
|
14
|
71
|
|
12
|
158
|
17
|
129,1
|
|
13
|
138
|
14
|
104,6
|
|
14
|
113
|
23
|
74
|
|
15
|
100
|
18
|
69,5
|
|
16
|
103
|
22
|
66,4
|
|
17
|
144
|
14
|
104,8
|
|
18
|
108
|
13
|
83,6
|
|
19
|
123
|
12
|
102
|
|
20
|
160
|
22
|
122,4
|
|
21
|
138
|
21
|
107,4
|
|
22
|
185
|
28
|
119,1
|
|
23
|
275
|
55
|
135
|
|
24
|
456
|
11
|
433,4
|
|
25
|
438
|
20
|
396,7
|
|
26
|
192
|
19
|
124,7
|
|
27
|
85
|
12
|
59,7
|
|
28
|
172
|
41
|
98,8
|
|
29
|
83
|
35
|
108,9
|
|
30
|
196
|
48
|
112,3
|
|
31
|
164
|
47
|
123,6
|
|
32
|
86
|
27
|
56,3
|
|
33
|
279
|
36
|
144,7
|
ANNEXE II : Résultats de dosage du
cholestérol total, du HDL-cholestérol et du LDL-
chlestérol chez 34 hommes non diabétiques issus des familles
diabétiques.
|
No
|
Cholestérol total (mg/dl)
|
HDL-Cholestérol (mg/dl)
|
LDL-Cholestérol (mg/dl)
|
|
1
|
92
|
17
|
62,8
|
|
2
|
108
|
19
|
79,7
|
|
3
|
107
|
16
|
76,2
|
|
4
|
79
|
12
|
40,8
|
|
5
|
89
|
11
|
61,6
|
|
6
|
157
|
19
|
129,1
|
|
7
|
152
|
16
|
127,5
|
|
8
|
117
|
16
|
88,6
|
|
9
|
173
|
15
|
147,4
|
|
10
|
125
|
13
|
107,7
|
|
11
|
164
|
17
|
132,4
|
|
12
|
164
|
18
|
133,9
|
|
13
|
199
|
15
|
143,6
|
|
14
|
110
|
20
|
75,6
|
|
15
|
146
|
12
|
115,4
|
|
16
|
117
|
12
|
90,2
|
|
17
|
132
|
15
|
104,5
|
|
18
|
128
|
16
|
90,4
|
|
19
|
150
|
62
|
17
|
|
20
|
189
|
56
|
164
|
|
21
|
273
|
25
|
44
|
|
22
|
249
|
46
|
130
|
|
23
|
223
|
56
|
59
|
|
24
|
75
|
35
|
90
|
|
25
|
196
|
44
|
131
|
|
26
|
181
|
43
|
120,5
|
|
27
|
355
|
17
|
333
|
|
28
|
211
|
19
|
114
|
|
29
|
176
|
20
|
135,9
|
|
30
|
161
|
21
|
130,4
|
|
31
|
83
|
43
|
30
|
|
32
|
161
|
21
|
130
|
|
33
|
189
|
56
|
126
|
|
34
|
131
|
35
|
106
|
ANNEXE III : Résultats de dosage du
cholestérol total, du HDL-cholestérol et du LDLcholestérol
chez 20 femmes non diabétiques issues des familles non
diabétiques.
|
No
|
Cholestérol total (mg/dl)
|
HDL-Cholesterol (mg/dl)
|
LDL-Cholesterol (mg/dl)
|
|
1
|
62
|
3
|
29,9
|
|
2
|
175
|
24
|
123,7
|
|
3
|
141
|
20
|
94,3
|
|
4
|
142
|
16
|
98,7
|
|
5
|
169
|
14
|
118,3
|
|
6
|
146
|
19
|
93,6
|
|
7
|
113
|
13
|
80,1
|
|
8
|
116
|
18
|
82,6
|
|
9
|
134
|
24
|
62,8
|
|
10
|
148
|
26
|
103,1
|
|
11
|
146
|
21
|
102,4
|
|
12
|
146
|
16
|
111,1
|
|
13
|
114
|
20
|
68,4
|
|
14
|
131
|
14
|
76
|
|
15
|
117
|
21
|
42,2
|
|
16
|
207
|
26
|
90,8
|
|
17
|
183
|
50
|
68
|
|
18
|
107
|
32
|
17,6
|
|
19
|
223
|
44
|
71
|
|
20
|
95
|
47
|
164
|
ANNEXE IV : Résultats de dosage du
cholestérol total, du HDL-cholestérol et du LDLcholestérol
chez 20 hommes non diabétiques issus des familles non
diabétiques.
|
No
|
Cholestérol total (mg/dl)
|
HDL-Cholesterol (mg/dl)
|
LDL-Cholesterol (mg/dl)
|
|
1
|
91
|
16
|
65,6
|
|
2
|
187
|
12
|
140,4
|
|
3
|
130
|
12
|
88,9
|
|
4
|
142
|
16
|
95,6
|
|
5
|
136
|
20
|
102,7
|
|
6
|
156
|
16
|
116,2
|
|
7
|
169
|
21
|
130,6
|
|
8
|
140
|
30
|
81,1
|
|
9
|
138
|
14
|
86,7
|
|
10
|
108
|
15
|
65,9
|
|
11
|
197
|
76
|
76,5
|
|
12
|
123
|
5
|
95,4
|
|
13
|
130
|
20
|
58,6
|
|
14
|
167
|
20
|
50,8
|
|
15
|
230
|
57
|
146,8
|
|
16
|
417
|
13
|
389,6
|
|
17
|
57
|
1
|
47,6
|
|
18
|
127
|
34
|
40
|
|
19
|
94
|
41
|
42
|
|
20
|
131
|
35
|
58
|
ANNEXE V : Résultats définitifs de dosage
du cholestérol total, du HDL-cholestérol et du
LDL-cholestérol des personnes non diabétiques issues des familles
diabétiques.
|
Cholestérol total (mg/dl)
|
HDL-Cholestérol (mg/dl)
|
LDL-Cholestérol (mg/dl)
|
|
1
|
92
|
17
|
62,8
|
|
2
|
108
|
19
|
79,7
|
|
3
|
107
|
16
|
76,2
|
|
4
|
79
|
12
|
40,8
|
|
5
|
89
|
11
|
61,6
|
|
6
|
157
|
19
|
129,1
|
|
7
|
152
|
16
|
127,5
|
|
8
|
117
|
16
|
88,6
|
|
9
|
173
|
15
|
147,4
|
|
10
|
125
|
13
|
107,7
|
|
11
|
164
|
17
|
132,4
|
|
12
|
164
|
18
|
133,9
|
|
13
|
199
|
15
|
143,6
|
|
14
|
110
|
20
|
75,6
|
|
15
|
146
|
12
|
115,4
|
|
16
|
117
|
12
|
90,2
|
|
17
|
132
|
15
|
104,5
|
|
18
|
128
|
16
|
90,4
|
|
19
|
150
|
62
|
17
|
|
20
|
189
|
56
|
164
|
|
21
|
273
|
25
|
44
|
|
22
|
249
|
46
|
130
|
|
23
|
223
|
56
|
59
|
|
24
|
75
|
35
|
90
|
|
25
|
196
|
44
|
131
|
|
26
|
181
|
43
|
120,5
|
|
27
|
355
|
17
|
333
|
|
28
|
211
|
19
|
114
|
|
29
|
176
|
20
|
135,9
|
|
30
|
161
|
21
|
130,4
|
|
31
|
83
|
43
|
30
|
|
32
|
161
|
21
|
130
|
|
33
|
189
|
56
|
126
|
|
34
|
131
|
35
|
106
|
|
35
|
128
|
24
|
90,2
|
|
36
|
97
|
12
|
73,7
|
|
37
|
126
|
18
|
88,7
|
|
38
|
134
|
18
|
99,1
|
|
39
|
94
|
17
|
66,2
|
|
40
|
104
|
11
|
76,1
|
|
41
|
132
|
14
|
109,3
|
|
42
|
213
|
26
|
174,58
|
|
43
|
112
|
10
|
87,2
|
|
44
|
149
|
16
|
122,1
|
|
45
|
102
|
14
|
71
|
|
46
|
158
|
17
|
129,1
|
|
47
|
138
|
14
|
104,6
|
|
48
|
113
|
23
|
74
|
|
49
|
100
|
18
|
69,5
|
|
50
|
103
|
22
|
66,4
|
|
51
|
144
|
14
|
104,8
|
|
52
|
108
|
13
|
83,6
|
|
53
|
123
|
12
|
102
|
|
54
|
160
|
22
|
122,4
|
|
55
|
138
|
21
|
107,4
|
|
56
|
185
|
28
|
119,1
|
|
57
|
275
|
55
|
135
|
|
58
|
456
|
11
|
433,4
|
|
59
|
438
|
20
|
396,7
|
|
60
|
192
|
19
|
124,7
|
|
61
|
85
|
12
|
59,7
|
|
62
|
172
|
41
|
98,8
|
|
63
|
83
|
35
|
108,9
|
|
64
|
196
|
48
|
112,3
|
|
65
|
164
|
47
|
123,6
|
|
66
|
86
|
27
|
56,3
|
|
67
|
279
|
36
|
144,7
|
ANNEXE VI : Résultats définitifs de dosage
du cholestérol total, du HDL-cholestérol et du
LDL-cholestérol des personnes non diabétiques issues des familles
non diabétiques.
|
No
|
Cholestérol total (mg/dl)
|
HDL-Cholestérol (mg/dl)
|
LDL-Cholestérol (mg/dl)
|
|
1
|
91
|
16
|
65,6
|
|
2
|
187
|
12
|
140,4
|
|
3
|
130
|
12
|
88,9
|
|
4
|
142
|
16
|
95,6
|
|
5
|
136
|
20
|
102,7
|
|
6
|
156
|
16
|
116,2
|
|
7
|
169
|
21
|
130,6
|
|
8
|
140
|
30
|
81,1
|
|
9
|
138
|
14
|
86,7
|
|
10
|
108
|
15
|
65,9
|
|
11
|
197
|
76
|
76,5
|
|
12
|
123
|
5
|
95,4
|
|
13
|
130
|
20
|
58,6
|
|
14
|
167
|
20
|
50,8
|
|
15
|
230
|
57
|
146,8
|
|
16
|
417
|
13
|
389,6
|
|
17
|
57
|
1
|
47,6
|
|
18
|
127
|
34
|
40
|
|
19
|
94
|
41
|
42
|
|
20
|
131
|
35
|
58
|
|
21
|
62
|
3
|
29,9
|
|
22
|
175
|
24
|
123,7
|
|
23
|
141
|
20
|
94,3
|
|
24
|
142
|
16
|
98,7
|
|
25
|
169
|
14
|
118,3
|
|
26
|
146
|
19
|
93,6
|
|
27
|
113
|
13
|
80,1
|
|
28
|
116
|
18
|
82,6
|
|
29
|
134
|
24
|
62,8
|
|
30
|
148
|
26
|
103,1
|
|
31
|
146
|
21
|
102,4
|
|
32
|
146
|
16
|
111,1
|
|
33
|
114
|
20
|
68,4
|
|
34
|
131
|
14
|
76
|
|
35
|
117
|
21
|
42,2
|
|
36
|
207
|
26
|
90,8
|
|
37
|
183
|
50
|
68
|
|
38
|
107
|
32
|
17,6
|
|
39
|
223
|
44
|
71
|
|
40
|
95
|
47
|
164
|
66
REFERENCES BIBLIOGRAPHIQUES
1. ABOA E.A. C. Facteurs de risque chez les coronariens Noirs
Africains : étude pilote cas témoins réalisée en
Côte-d'Ivoire. Msc Thesis, IMTA, ANTMERSPEN, 1996.
2. ADIGUN S.A. , DAWODU F.R.. The effect of age on blood
pressure and urinary, plasma and intraerytrocytaire levels of sodium and K in
normotensive Nigeria. Card. Trop. 1992; 18(69).
3. AKINGKUGBE O. Hypertension researh in Africa: past, present
and future. Trop Cardiol 1987; 13 (suppl): 195-201.
4. American Heart Association. Human in preventive cardiology.
Amer Heart Association, Dallas, 1994.
5. ANDERSON K.M., CASTELLI W.P., LEVY D. Cholesterol and
mortality 30 years of follow-up Framigham study. JAMA 1987; 257: 2176-80.
6. BERTRAND ED., COULIBALY AO., TICOLAT R. Statistiques 1988,
1989 et 1990 de l'Institut de Cardiologie d'Abidjan (I.C.A). Cardiol trop.
1991; 17 (68): 151-155.
7. BERTRAND Ed., KACOU GM., MONKAM-M.. Maladie coronaire,
sous développement et développement: Comment le
développement économique favorise-til les maladies coronaires?
Cardiol Tropical, 1984; 10 (n° spécial) : 51-64
8. BERTRAND Ed.. Hypertension artérielle des populations
originaires d'Afrique noire. Ed. Pradel, Paris 1995: 2-6.
9. BEYET P. ET DUFRESNE A.. Les déviations axiales
gauches de Q.R.S au Zaïre. Cardiol Trop. 1979; 5: 165-175.
10. BOFFETTA P., GARFINKEL L.. Alcohol drinking and mortality
among men enrolled in an American cancer society prospective study. Epidem.
1990; 1: 342-348.
11. BRUCKERT E., EMMERICH J., DELA HAYE F. et al.
Rôle des triglycérides dans les maladies cardio-vasculaires. Arch.
Mal Coeur 1992, 85 (111): 29-35.
12. CHARLES D., BARABE P. et TALBI D.. Infarctus du myocarde en
Algérie. Cardiol. Trop. 1982; 8:13-19.
13. COLHOUN H.M., HEMINGWAY H., POULTERNE. R. Socio-economic
status and blood pressure an overview analysis. J Hum hypertens, 1998; 12:
91-110.
14. COLLART F. Insulino-résistance et hypertension
artérielle. Pathologie cardiovasculaire XWII, 3, Medisearch 1991, (50);
5-9
15. DOCHERTY. Cardiovascular responses in ageing: a review.
Pharmacol. Rev., 1990; 42: 104-124.
16. DONNISON C.P. Blood pressure in the African native. Lancet.
1929; (i): 6-7.
17. ELANDT-JOHNSON RC. Définition of rates: some remarcks
on they use and misure. Am J Epidem. 1975; 102: 267 - 271.
18. FLETCHER A., BULPITT C. Epidemiology of hypertension in the
eldery. J Hum. Hypertens. 1994, 12 (suppl.6): S3-S5.
19. FREIDMAN M., THORESEN CE., GILL J.Y, et al.
Determination of type A behavior and its effect on cardiac recurrences in
post myocardial infarctus patients: Summary results of the recurent coronary
prevention project. Am Heart J., 1986; 112: 653-64.
20. GUIZE L., ILIOU .L.Le traitement de facteurs de risque de
l'athérosclérose coronaire. Arch. mal coeur 1992; 85: 1687-93.
21. HOLME I, HELGELAND A., HJERMANN I., LUND-LARSEN P.G,
LEREN P. Coronary risk factors and socio-economic status, the Oslo study
Lancet. 1976; ii, 1396-1398.
22. IKEME A.C., Hypertension studies in developping countries.
Clin Exp. Hypertens. 1989, ALL: 825-839.
23. Joint National commitee on detection, evaluation and
treatment of high blood pressure Arch Intern Med. 1988; 148: 1023-38.
24. KEIL Julian, Saunders Donald E. Urban and rural difference
in cardiovascular disease in black. 1991, 2: 17-27.
25. KEYS A. MENOTTI A., ARAVORIS C. et al. The seven
countries study 30 years of follow up from Framingham study. JAMA 1987; 257:
2176-80.
26. KEYS A., MENOTTI A., ANAVAIRS, C. et al. The seven
countries study: 2289 deaths in 15 years. Prev. Med. 1984; 13: 141-154
27. KHOSLA T., LOWE C.R, Obesity and smoking habitts by social
class .Br J Prev Soc Med. 1972; 26: 249-256.
28. KLATSKY Al., ARMOSTRONG MA, FRIEDMAN GO. Risque of
cardiovascular mortality in alcohol drunkers, ex-drinkers and non drinkers. Am
J Cardiol. 1990; 66:1237-1242.
29. KORMITZER M., DRAMAIX M., KITTEL F., de BACKER G.. Classe
sociale et risque de cardiopathie ischémique. Rev. prat. 1981; 31 (53) :
3805-3822
30. KULBERTUS HE., The hemiblocks. The years experience 1980.
31. LONGO-MBENZA B., Diabète sucré et maladie
cardio-vasculaires. Cardiol Trop, 1995; 21 (82): 37-44.
32. MANN G.V., ROELS A.A., PRICE D.L., MERRIL J.M.
Cardiovascular disease in Pygmies. J .chronic Dis. 1962; 15: 341-71.
33. MBALA M.. Obésité, distribution des
graisses, pression artérielle et prévalence de L'HTA dans une
population active. Mémoire de spécialisation, Université
de Kinshasa, 1996.
34. MBUYAMBA K. Blood pressure and hypertension in blacks. Ph
.D. Thesis, KUL, Leuven, 1986.
35. MELICHAR F. Plasma cholesterol and phospholipids in various
occupationnal groups. J atheroscl. Res, 1965; 5: 432-435.
36. MORGENSTER H.. The changing association between status and
coronaires heart diseases in rural population. Soc. Med. 1981; 14 A:
191-201.
37. MUGAMBI M.. Migration, salt consumption and blood pression
in African population. Tropical cardiol, 1987; XIII (suppl): 167-169.
38. MUNYCK A., EPRISTAT.. Institut de Médecine tropicale
Princes Léopard. Anvers, 1996-1997.
39. POULLEN N.R., KHAW K.T., HOPWOOD B., MUGAMBI M., PEART
W.S., ROSE G.. Blood pressure and associated factors in a Kenyan community.
Hypertens. 1984; 6 (6 part 1): 810-3.
40. PYORALA K., SAVOLAINE N.E, KAUKOLAS S., HAAPAKOSKI J..
Plasma insulin as coronary heart disease risk factors: relation ship to other
risk factors and predictive values during 91/2 year follow-up of the helsinski
policeman population. Acta Med scand (suppl), 1985; 710 : 38 - 82.
41. Qualité de la vie dans les affections
cardio-vasculaires en pratique quotidienne, Information médicale et
pharmaceutique 1987. CIBA-GEIGY S.A. Bâle Suisse. Ed. F.B. Buirdwood.
42. Report et a WHO consultation. Part 1, Diagnosis and
classification of diabetes mellitus. World Heart Organization. Department of
non communicable disease surveillance, Geneva 1999: 59.
43. RICHARD JL, BURCKERT E., DELA HAYE F. et al. Taux
de cholestérol sanguin et mortalité Arch. Mal. 1992; 85(III):
11-20.
44. ROSE G., STAMLER J. The intersalt study: Background, methods
and main results. J. Hum Hypertens. 1980; 3: 283-288.
45. SEEDAT YK.. Race, environnement alcohol pressure: the South
African experience. J. Hypertens 1983; 1: 7-12.
46. SROLE L., FISCHER A.K. The social epidemiology of smoking
behavior 1993 and 1970. The Midtown Manhattan study Soc Sc Med, 1973; 7:
341-358.
47. TICOLAT P., BERTRAND
ED.et al. Aspects
épidémiologiques de la maladie coronaire chez le Noir Africain:
à propos de 103 cas. Résultats de l'enquête multicentrique
prospective Coronatric. Card Trop. 1991, n° spécial, 1991, 17:
7-20.
48. VAN GAAL L. Obésité: physiopathologie, risques
et traitement. Endocrinologie IX 1/Nutrition 1:18-32
49. WADSWORTH. Calcium and vascular reactivity in ageing and
hypertension. J Hypertens. 1990, 8 (11): 975-983.
50. WELBORN T., WEARNE K. Coronary heart desease incidence
and cardiovascular mortality in Busselton with reference to glucose and insulin
concentrations. Diabetes Care 1979; 2: 154-60.
51. WILSON PWF, ABBOT R.D., CASTELLI WP. High density
lipoprotein cholesterol and mortality. The Framigham heart study,
Arterosclerosis, 1988; 8: 737-41.
52. World Health Organization/International Society of
Hypertension. Practice guidelines for primary caire physicians. J. hypertens.
1999; 17: 151-8.
53.
http://cholesterolfr.blogspot.com/search/label/cholesterol%20et%20maladies%20cardiovasculaire
54.
http://www.chups.jussieu.fr/polys/biochimie/LLbioch/llbioch.pdf
55.
http://www.docteurclic.com/encyclopedie/metabolisme-des-lipides.aspx
TABLE DES MATIERES
DEDICACE ii
REMERCIEMENTS. iiii
CHAPITRE I : BREF APERCU SUR LE DIABETE. 4
I.1 Définition 4
I.2 Histoire 4
I.3 Epidémiologie 5
I.4 Etiologie et différents types de diabète 7
I.4.1 Diabète de type I 7
I.4.2 Diabète de type II 8
I.4.3 Diabètes iatrogènes 8
I.4.4 Les autres étiologies du diabète 8
I.4.5 Autres étiologies rares : 10
I.5 Physiopathologie 10
I.5.1 Action de l'insuline . .. 10
I.5.2 Action du glucagon 11
I.6 Clinique 11
I.7 Diagnostic 12
I.8 Complications du diabète 13
I.8.1 Les complications vasculaires 13
I.8.2 La céto-acidose 14
I.8.3 Le coma hyperglycémique hyperosmolaire (non
cétonique) 14
CHAPITRE II : BREF APERCU SUR LES LIPIDES ET SUR
LES
FACTEURS DE RISQUES. 15
II.1 Définition 15
II.2 Origine 15
II.3 Classification 16
II.4 Le cholestérol serique 22
II.5 Biochimie pathologique 28
II.5.1 Maladies génétiques 28
II.5.2 Les lipidoses 28
II.6 Bref aperçu sur les facteurs de risque 31
II.6.1 Concept de risque 31
II.6.2 Concept de causalité 34
II.6.3 Facteurs de risque cardio-vasculaire 34
CHAPITRE III : MATERIEL ET METHODES 39
III.1 Matériel 39
III.2 Méthodes 41
III E 0T1-\t\ 0\NAi\tiIN1-\ 0uLNi\é\ 0SRu20lID)14\1-0d1-\
02é\urIN\ 46
CHAPITRE IV : RESULTATS ET DISCUSSIONS 47
IV.1 Analyses des résultats 47
IV.2 Discussion des résultats. 51
CONCLUSION 53
ANNEXES 54
REFERENCES BIBLIOGRAPHIQUES 66
TABLE DES MATIERES 70
| 


