|
REPUBLIQUE DE COTE-D'IVOIRE
Union-Discipline-Travail
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
|
|
Institut National Polytechnique
|
|
Félix Houphouët-Boigny
|
|
Ecole Supérieure
d'Agronomie
|
Département de Formation et de Recherche
Agriculture
et Ressources Animales
|
(DFR ARA)

Pour l'obtention du Diplôme d'Ingénieur
des Techniques Agricoles
Option : Agriculture
Générale
THEME :
|
Etude comparée de l'efficacité des
extraits aqueux de graines de
neem (Azadirachta indica Juss) et de
feuilles d'eucalyptus
(Eucalyptus camaldulensis) dans la lutte
contre les insectes
du gombo (Abelmoschus esculentus L).
|
Présenté par :
EKRA Kouassi Armand
Promotion 34
JURY DE SOUTENANCE
Présidente : Dr AGNEROH née
Thérèse ATCHAM, Enseignant-chercheur à l'INP-HB
Membres
Accesseur : M. ADJA Nahoulé Armand
Enseignant-chercheur à l'INP-HB
Encadreur pédagogique : M. FOFANA Ibrahim
Kalyl, Enseignant-chercheur à l'INP-HB
Maîtres de stage : Dr GNAGO Ayekpa Jean,
Enseignant-chercheur à l'INP-HB M. YAO N'goran Denis,
Ingénieur Agronome au DFR-ARA
RESUME
La présente étude réalisée
à la ferme de l'INP-HB de Yamoussoukro s'inscrit dans le cadre de la
recherche de nouvelles alternatives aux pesticides chimiques, en particulier
les insecticides. Elle a consisté à tester l'efficacité
des extraits aqueux de graines de neem (Azadirachta indica Juss) et
des feuilles d'eucalyptus (Eucalyptus camaldulensis) ayant
respectivement pour matière active, l'azadirachtine et le cinéol
sur les insectes ravageurs du gombo (Abelmoschus esculentus L.). Nous
avons comparé sur des parcelles expérimentales (en blocs
aléatoires) de gombo, quatre traitements. Ils comprennent : un
témoin (T0), un insecticide chimique homologué « K-OPTIMAL
» (T1) dont les matières actives sont la Lambda-cyhalotrine 15g/l
et l'Acétamipride 20g/l, un extrait aqueux de graines de neem (T2) et un
autre extrait aqueux de feuilles d'eucalyptus (T3). L'extrait de graine est
obtenu après broyaye des amandes contenues dans les fruits du neem puis
mélangé à l'eau pendant 24 heures. L'extrait d'eucalyptus
est quant à lui, obtenu après avoir grossièrement
broyées les feuilles puis bouillies dans de l'eau. Les traitements sont
appliqués par intervalle de six jours et les observations trois jours
après chaque traitement. Les observations ont porté sur les
insectes vivants et la production des fruits. Après analyse des
résultats, il ressort que le produit chimique contrôle
parfaitement les altises, les pucerons, les punaises rouges du cotonnier et la
chenille Anomis flava mais n'arrive pas à dompter les aleurodes
et les jassides. L'extrait aqueux de graines de neem contrôle les
aleurodes, les jassides, les pucerons, les punaises rouges du cotonnier, la
chenille Anomis flava mais n'a pas pu contrôler les altises.
L'extrait aqueux de feuilles d'eucalyptus a eu un effet moyen sur les
aleurodes, les jassides et les pucerons mais n'a pas eu d'effet sur les autres
insectes observés. De tous les traitements appliqués, seules les
parcelles traitées avec le produit chimique ont enregistré le
plus grand nombre de fruits n'ayant pas fait l'objet d'attaque des insectes
ravageurs.
II
ABSTRACT
The present study conducted at the farm of INP-HB Yamoussoukro
is part of the search for new alternatives to chemical pesticides, especially
insecticides. It was to test the efficacy of aqueous extracts of neem seeds
(Azadirachta indica Juss) and eucalyptus leaves (Eucalyptus
camadulensis) having respectively active ingredient, azadirachtin and
cineol on insect pests of okra (Abelmoschus esculentus L.). We
compared on experimental plots (randomized block) okra, four treatments. They
include: a check (T0), a registered chemical insecticides "K-OPTIMAL" (T1)
whose contents are lambda-cyhalothrin 15 g / l and Acetamiprid 20 g / l, a neem
seed extract (T2 ) and another aqueous extract of eucalyptus leaves (T3). The
neem seed extract is obtained after grinding almonds in fruits of neem and then
mixed with water for 24 hours. The eucalyptus extract was in turn, obtained
after the leaves crushed and then boiled in water. Treatments were applied at
intervals of six days and observations three days after each treatment.
Observations were made on live insects and fruit production. After analyzing
the results, it appears that the chemical insecticide control flea beetles,
aphids, red cotton bugs and Anomis flava but does not control
whiteflies and jassids. The aqueous extract of neem seed control whiteflies,
jassids, aphids, red cotton, Anomis flava but do not control flea
beetles. The aqueous extract of eucalyptus leaves has had a moderate impact on
whiteflies, aphids and jassids but has not effet on other insects observed. Of
all the applied treatment, only plots treated with chemicals insecticide
recorded the highest number of fruits that have not been attacked insect
pests.
Key words: aqueous extract of plants,
neem, eucalyptus, okra.
III
SOMMAIRE
RESUME I
ABSTRACT II
AVANT PROPOS VII
REMERCIEMENTS VIII
LISTE DES TABLEAUX IX
LISTE DES FIGURES X
SIGLES ET ABREVIATIONS XII
LISTE DES ANNEXES XIII
DEDICACE XIV
INTRODUCTION 1
PARTIE I: GENERALITES
I.PRESENTATION DE LA ZONE D'ETUDE 3
1. Situation géographique 3
2. Milieu physique. 3
2.1. Climat 3
2.2. Végétation 4
2.3. Sol 4
2.4. Hydrographie 4
3. Présentation du site d'expérimentation
4
3.1. Situation géographique 4
3.2. Végétation et hydrographie locale 5
II.GENERALITES SUR LES PESTICIDES ET LES CULTURES
MARAICHERES 5
1. Pesticides 5
1.1. Définition de pesticides . 5
1.2. Insecticides chimiques 6
1.2.1. Regroupement selon l'origine 6
1.2.2. Regroupement selon le type d'activité et le mode
d'action 7
1.2.3. Interaction ou synergie des polluants 7
1.2.4. Phénomène de résistance aux
pesticides 7
1.3. Biopesticides 9
1.3.1 Spécificité 9
1.3.2 Biodégradabilité 9
1.2.3 Résistance 9
1.4. Cas du neem (Azadirachta indica
Juss) 10
1.4.1. Description 10
1.4.2. Composition et propriété chimique 11
1.4.3. Mode d'action sur les insectes 11
1.4.4. Utilisations 11
1.5. Cas de l'eucalyptus (Eucalyptus
camaldulensis) 12
1.5.1. Historique 12
1.5.2. Description 13
1.5.3. Composition chimique 14
1.5.4. Mode d'action de composés terpéniques 15
1.5.5. Utilisations 15
2. Cultures maraichères 15
2.1. Principaux groupes 15
2.2. Classification 16
2.3. Intérêts de la culture des plantes
maraîchères 16
2.3.1. Intérêt nutritionnel 16
2.3.2. Intérêt économique 16
2.3.3. Intérêt social 17
2.3.4. Intérêt environnemental 17
2.4. Gombo 17
2.4.1. Origines 17
2.4.2. Description 17
2.4.3. Ecologie 18
2.4.4. Utilisations 19
2.4.5. Maladies et ennemis 20
2.4.5.1. Principaux ravageurs 20
2.4.5.2. Agents de maladies foliaires 22
PARTIE II : ETUDE EXPERIMENTALE
I.OBJECTIF 24
1. Objectif général 24
2. Objectif spécifique 24
II.MATERIEL ET METHODES 24
1. Matériel 24
1.1. Matériel végétal 24
1.2. Pesticides utilisés 24
1.3. Matériel de mesure et de travail 25
2. Méthodes 26
2.1. Dispositif expérimental 26
2.2. Techniques culturales 27
2.2.1. Préparation du sol 27
2.2.2. Mise en place de la culture 27
2.2.3. Entretien des parcelles 28
3. Traitements appliqués . 28
3. 1. Mode d'extraction 28
3.2. Doses appliquées 29
3.3. Application des traitements 29
4. Paramètres étudiés .
30
4.1. Insectes ravageurs 30
4.2. Production 30
5. Analyse des données 30
III. RESULTATS ET DISCUSSION 31
1. Résultats 31
1.1. Différents types d'insectes rencontrés
sur le gombo 31
1.2. Principaux insectes ravageurs du gombo
observés 31
1.3. Evaluation de l'effet des traitements sur les
insectes 32
1.4. Production 42
1.4.1. Influence des traitements sur la production de bons fruits
42
1.4.2. Relations entre les populations d'insectes et la
production 43
2. Discussion 45
IV. SUGGESTIONS 47
CONCLUSION 48
REFERENCES BIBLIOGRAPHIQUE 49
ANNEXES 52
AVANT-PROPOS
A travers son système de formation, L'Ecole
Supérieure d'Agronomie (ESA) combine la théorie et la pratique.
Cette alternance permet à l'Elève-Ingénieur de
s'imprégner des réalités du monde professionnel. C'est
ainsi que des stages sont initiés durant la formation. A la fin de la
troisième année du cycle des Ingénieurs des Techniques
Agricoles (ITA), les élèves- Ingénieurs effectuent trois
stages dont un représente le Mémoire de Fin de Cycle à
l'issu duquel un rapport est rédigé et soutenu devant un jury
pour l'obtention du diplôme. C'est dans ce cadre que nous avons
été accueillis du 08 septembre 2011 au 31 janvier 2012 au
Laboratoire de Zoologie Agricole et Entomologie du DFR-ARA de l'Institut
National Polytechnique Félix Houphouët-Boigny pour y effectuer
notre stage de fin d'études, portant sur le thème :
«Etude comparée de l'efficacité des extraits aqueux
de graines de neem (Azadirachta indica Juss) et de feuilles
d'eucalyptus (Eucalyptus camaldulensis) dans la lutte contre les
insectes du gombo (Abelmoschus esculentus L.)».
Ce stage pratique nous a permis non seulement de consolider les
acquis de notre formation, mais aussi de nous familiariser aux
réalités du monde de la recherche scientifique.
REMERCIEMENTS
Au terme de ce stage, nous voudrions adresser nos sincères
remerciements à :
- Dr. N'GUESSAN Kotchi, ex-Directeur par intérim de l'ESA
pour sa disponibilité et son intérêt porté sur une
formation de haut niveau au sein de l'école;
- Dr. OUATTARA Zana, Directeur des Etudes du cycle de formation
des Elèves-Ingénieurs des Techniques Agricoles (ITA) pour sa
disponibilité et ses conseils avisés;
- Dr. DANHO Mathias, Directeur du Département de Formation
et Recherche Agriculture et Ressources Animales (DFR-ARA) de nous avoir
accueillis au département;
- Dr. GNAGO Ayékpa Jean et M. FOFANA Ibrahim Kalyl,
Enseignants-Chercheurs au DFR-ARA pour l'effort consenti lors de
l'élaboration de ce document ;
- Monsieur YAO N'goran Denis, Ingénieur Agronome au
DFR-ARA, pour son implication effective dans les tâches accomplies tout
le long de notre stage ;
- Monsieur ADJA Nahoulé Armand, Enseignant-Chercheur au
DFR-ARA,
- Madame GOGOUA, Ingénieur des Techniques Agricoles
(Laboratoire de Zoologie Agricole et Entomologie) pour leurs conseils et avis
pertinents lors de la rédaction de ce document.
- Monsieur BENIE BI Isidore, Technicien au Laboratoire de
Zoologie Agricole et Entomologie pour son aide lors de l'identification des
insectes.
Notre gratitude va à l'endroit du personnel de la ferme de
l'ESA pour leur hospitalité, leur disponibilité et leur franche
collaboration durant le stage.
Nos pensées vont enfin, à l'endroit de toutes ces
personnes de bonne volonté qui ont contribué au succès de
ce stage.
Ix
LISTE DES TABLEAUX
TABLEAU I : Risque suspecté de l'effet de
l'azadirachtine A sur la santé humaine 12
TABLEAU II : Principales espèces de
légumes et leurs familles botaniques 16
TABLEAU III : Caractéristiques du
matériel végétal 24
TABLEAU IV : Caractéristiques du produit
chimique 25
TABLEAU V : Liste du matériel
utilisé 25
TABLEAU VI : Récapitulatif des
différentes doses de pesticides utilisés 29
TABLEAU VII : Contribution (poids factoriel) des
variables à la formation des facteurs;
valeurs propres et
variances. 43
X
LISTE DES FIGURES
Figure 1 : Présentation de la zone de
Yamoussoukro 3
Figure 2 : Végétation et point
d'eau 5
Figure 3 : Croissance d'adaptation à des
pesticides chez les insectes, les pathogènes de
plantes (parasites et
champignons) et les adventices 8
Figure 4 : Fruits du neem 10
Figure 5 : Formule de l'azadirachtine 11
Figure 6 : Feuilles et fleurs d'Eucalyptus
camaldulensis 14
Figure 7 : Formule du cinéol 15
Figure 8 : Feuilles, fleurs et fruits du gombo
18
Figure 9 : Gants, pulvérisateurs shogun,
marmite et réchaud, balance électronique 26
Figure 10 : Dispositif expérimental 26
Figure 11 : Vu d'ensemble de la parcelle
expérimentale 27
Figure 12 : Disposition des plants sur une
parcelle élémentaire 28
Figure 13a : Comptage des insectes 29
Figure 13b : Echantillonnage par parcelle
élémentaire 30
Figure 14 : Répartition des principaux
insectes ravageurs du gombo 31
Figure 15 : Principaux insectes ravageurs
observés sur le gombo 32
Figure 16 : Période d'observation des
différents groupes d'insectes sur le gombo 33
Figure 17a : Evolution des populations d'Altises
au cours du cycle 34
Figure 17b : Population moyenne d'Altises par
traitement 34
Figure 18a : Evolution des populations de
Mouches blanches au cours du cycle 35
Figure 18b : Population moyenne de Mouches
blanches par traitement 35
Figure 19a : Evolution des populations de
Jassides au cours du cycle 36
Figure 19b : Population moyenne de Jassides par
traitement 36
Figure 20a : Evolution des populations de
Pucerons au cours du cycle 37
Figure 20b : Population moyenne de Pucerons par
traitement 37
Figure 21a : Evolution des populations de
Dysdercus sp au cours du cycle 38
Figure 21b : Population moyenne de Dysdercus
sp par traitement 38
Figure 22a : Evolution des populations des
autres types de punaises au cours du cycle 39
Figure 22b : Population moyenne des autres types
de punaises par traitement 39
Figure 23a : Evolution des populations de
Syllepte derogata au cours du cycle 40
Figure 23b : Population moyenne de Syllepte
derogata par traitement 40
Figure 24a : Evolution des populations
d'Anomis flava au cours du cycle 41
Figure 24b : Population moyenne d'Anomis
flava par traitement 41
Figure 25a : Evolution de la production de bons
fruits au cours du cycle 42
Figure 25b : Production moyenne des fruits en
fonction des traitements 42
Figure 26 : Représentation des insectes
ravageurs et des différentes productions sur le plan
F1xF2 44
Figure 27 : Projection des différents
traitements dans le plan F1xF2 44
SIGLES ET ABREVIATIONS
ACP : Analyse des Composantes Principales
ACTA : Association de Coordination Technique
Agricole ANOVA : Analyse de variance
BNETD: Bureau National d'Etude Technique et de
Développement cm : centimètre
CTA : Centre Technique de Coopération
Agricole et Rurale
DFR-ARA : Département de Formation et de
Recherche Agriculture et Ressources Animales
DPVCQ : Direction de Protection des
Végétaux et Contrôle
QualitéEFCPC : Ecole de Formation Continue
et de Perfectionnement des Cadres
ENSA : Ecole Nationale Supérieure
Agronomique ESA: Ecole Supérieure d'Agronomie
g : gramme
g/l : gramme/litre
I A B : Institut Agricole de
BouakéINP-HB: Institut National
Polytechnique Félix Houphouët-Boigny
ITA : Ingénieur des Techniques Agricoles
JAS: Jours Après Semis
Km: kilomètre
OLCV: Okra leaf curl virus
OMV: Okra mosaic virus
PE : Parcelle élémentaire
RGPH : Recensement Général de la
Population et de l'Habitat SNK: Student Newman Keuls
LISTE DES ANNEXES
ANNEXE 1 : Fiche de notation des insectes du gombo
ANNEXE 2 : Fiche de pesage des fruits du
gombo
ANNEXE 3 : Evolution des populations
d'insectes
ANNEXE 4 : Résultats du test de
comparaison de SNK avec les moyennes et écart-types ANNEXE 5
: Tableau récapitulatif des moyennes d'insectes par bloc
ANNEXES 6 : Tableau récapitulatif des
moyennes des trois répétitions (poids (g) des bons
fruits/traitement)
ANNEXE 7 : Rendement du gombo par traitement
(g)
XIV
DEDICACE
A
mes parents
INTRODUCTION
Pays à vocation essentiellement agricole, la Côte
d'Ivoire a depuis plusieurs années opté pour la diversification
des cultures dont les cultures maraîchères. De toutes les plantes
maraîchères cultivées en Côte d'Ivoire, le gombo est
probablement celle qui, avec la tomate, paient le plus lourd tribut aux
maladies et aux déprédateurs : fontes de semis,
altérations du feuillage et des fruits (Déclert, 1990). La
production mondiale est estimée à six millions de tonne par an.
La contribution de l'Afrique de l'ouest et centrale est d'environ 10% (CTA,
2004).
Malheureusement, l'on constate que ces cultures
pratiquées à proximité des points d'eau (lacs, bas-fonds,
rivières etc.) font l'objet d'utilisation massive et non
contrôlée de produits chimiques en particulier les pesticides.
D'ailleurs, une étude menée par Houenou et al. (1996) de
l'Université d'Abobo-Adjamé en Côte d'Ivoire
révèle que l'abus d'engrais et de pesticides dans les champs
cultivés nuit à la qualité de l'eau du lac Buyo et de son
bassin hydrographique. De même, hors de nos frontières, notamment
en France, les travaux menés ces dernières années font en
effet, apparaître une forte augmentation des malformations
congénitales chez les enfants exposés aux pesticides. Des
observations montrent également une explosion de cancers génitaux
(prostates et testicules) avec une hausse de 300% chez les personnes
âgées de 25 à 35 ans et une diminution de moitié de
la spermatogénèse depuis les années 50, à causes
des pesticides (Anonyme, 2012).
Vu les effets négatifs, des insecticides chimiques
classiques sur la santé humaine, la faune et la flore, il est
impérieux de proposer de nouvelles alternatives, non seulement
respectueuses de l'environnement mais aussi efficaces pour la lutte contre les
ennemis des cultures (Regnault-Roger, 2008).
Pour se protéger contre les insectes, de nombreuses
plantes produisent diverses substances à effets toxiques ou
anti-appétant ou des composés intervenant dans la
régulation de la croissance des insectes. La présente
étude qui porte sur le thème « Etude comparée
de l'efficacité des extraits aqueux de graines de neem (Azadirachta
indica Juss) et de feuilles d'eucalyptus (Eucalyptus
camaldulensis) dans la lutte contre les insectes du gombo (Abelmoschus
esculentus L). » a pour objet de tester en plus des
performances d'extraits aqueux de graines de neem (étude menée
les années précédentes), celles des feuilles d'eucalyptus
et d'en évaluer l'efficacité contre les insectes ravageurs du
gombo.
Dans cette étude, nous présenterons dans une
première partie quelques généralités sur la zone
d'étude, les pesticides et les cultures maraîchères. Nous
aborderons dans une deuxième partie l'étude expérimentale
avec le matériel et les méthodes utilisés, les
résultats qui nous amènerons à une discussion et à
des recommandations.
PARTIE I :
GENERALITES
I. PRESENTATION DE LA ZONE D'ETUDE
1. Situation géographique
Le département de Yamoussoukro est situé à
245 km au nord d'Abidjan sur l'axe international Abidjan- Ouagadougou et couvre
une superficie de 2 157 km2. Il a pour coordonnées
géographique 6°49'de latitude nord puis 5°16'de longitude
ouest. Depuis mars 1983, Yamoussoukro est la capitale politique et
administrative de la Côte d'Ivoire. Il est chef lieu de la Région
du Bélier, regroupant les départements de Didievi, Tiebissou et
Toumodi (figure 1). La population du département de Yamoussoukro
était estimée en 1998 à 299 243 habitants (RGPH, 1998).
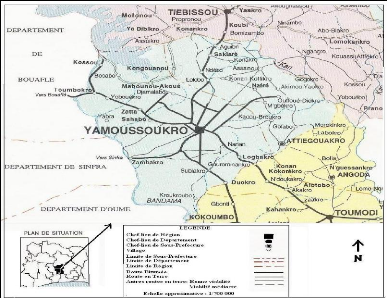
Figure1 : Présentation de la zone de
Yamoussoukro (BNETD, 2009)
2. Milieu physique
2.1 Climat
Situé dans une zone de transition entre la forêt et
la savane, le département de Yamoussoukro jouit d'un climat de type
équatorial de transition entre les climats soudanien et guinéen
appelé climat baouléen. Il est caractérisé par deux
saisons des pluies (mars à juin et septembre à octobre) et deux
saisons sèches (juillet à août et novembre à
février) avec présence de l'harmattan.
Les précipitations sont moyennement abondantes (en
moyenne 1200 mm/an). L'humidité relative varie entre 75 et 85% avec des
chutes allant jusqu'à 40% en période d'harmattan. Les
températures annuelles quant à elles varient de 23°C
à 33°C.
Deux grandes périodes sont à définir au
niveau de l'insolation: la période la moins éclairée se
situe de juin à septembre avec une duré d'éclairement
comprise entre 93 et 127 heures puis d'octobre à mai où la
durée de l'éclairement varie entre 93 et 212 heures/an avec une
moyenne de 160 heures (Anonyme, 2011).
2.2 Végétation et faune
La végétation est celle de la zone de transition
des forêts et des savanes (savanes boisées, arborées et
arbustives). Elle comporte à cet effet des zones forestières
occupant les bas-fonds le long des marigots. Ces différentes
végétations sont habitées par une faune diversifiée
renfermant des ennemis de cultures tels que les rongeurs, les herbivores, les
granivores, les insectes, les nématodes, etc.
2.3 Sol
Les sols de la zone d'étude sont de type ferralitique
moyennement désaturés. Ces sols peu profonds et légers
sont propices aussi bien aux cultures de rente (café, cacao, coton et
anacarde) qu'aux cultures vivrières de toutes sortes.
2.4 Hydrographie
Le réseau hydrographique de la région de
Yamoussoukro est marqué par une présence remarquable du fleuve
Bandama, les rivières N'zi, Kan puis leurs affluents. Aussi, la
présence du fleuve a permis la construction du barrage
hydroélectrique de Kossou et des barrages hydro-agricoles sur chaque
rivière et leurs affluents (Anonyme, 2011).
3. Présentation du site
d'expérimentation
L'expérimentation s'est déroulée sur la
ferme de l'INP-HB. 3.1 Situation géographique
Suite à la fusion des deux précédentes
fermes de production, d'expérimentation et de formation
pédagogique de l'ex-Ecole Nationale Supérieure Agronomique (ENSA)
et de l'Institut Agricole de Bouaké (IAB), la présente
dénomination « ferme de l'INP-HB » a vu le jour en 1996. Elle
est située à environ 15 km du centre ville sur l'axe conduisant
aux villages d'Allangoua et N'gbessou. Elle se trouve entre la rivière
« Djè-N'zué » au nord et à environ 100
mètres au sud des locaux de l'ESA.
3.2 Végétation et hydrographie locale
La parcelle ayant abrité notre culture est une
jachère. Elle était constituée entre autre d'Imperata
cylindrica, de Chromolaena odorata et aussi de Pueraria
sp, etc. (figure 2).
Les cultures étaient arrosées grace à un
puits d'une profondeur de 2m environ, situé à l'entrée de
la parcelle et de deux (2) retenues d'eau aménagées à cet
effet.

a) b)
Figure 2 : Végétation (a) et
point d'eau (b)
II. GENERALITES SUR LES PESTICIDES ET LES CULTURES
MARAICHERES
1. Pesticides
1.1. Définition de pesticide
Un pesticide est une substance qui est sensée
prévenir, détruire, repousser ou contrôler tout ravageur
animal et toute maladie causée par des microorganismes ou encore des
mauvaises herbes indésirables (Jeroen Boland et al., 2004).

1.2. Insecticides chimiques
La lutte contre les ravageurs, notamment les insectes, est
réalisée essentiellement par l'utilisation d'insecticides
chimiques. Il est courant de désigner les pesticides selon des
regroupements qui tiennent compte de l'origine du produit, de sa façon
d'agir sur la cible et de son lieu d'action etc...
1.2.1 Regroupement selon l'origine
Les insecticides peuvent être classés selon leur
origine en deux groupes distincts que sont : les insecticides inorganiques et
les insecticides organiques.
v' Insecticides inorganiques de
synthèse
Ils sont essentiellement dérivés de
minéraux et ne contiennent du carbone que sous forme de carbonate ou de
cyanure. Ils sont principalement des dérivés à base
d'arsenic, de mercure, de fluor, de soufre, de cuivre et de cyanure.
v' Insecticides organiques de synthèse
La plupart des produits organiques synthétisés
sont dérivés chimiquement des produits pétroliers et
contiennent du carbone. On retrouve principalement quatre grands groupes : les
organochlorés qui ne sont plus très utilisés, les
organophosphorés, les carbamates et les pyréthrinoïdes
(ACTA, 2010).

Organochlorés
Ces pesticides ont été très
utilisés, pendant les trois décennies qui ont suivi la 2nde
guerre mondiale, à cause de leur bonne efficacité et leur longue
rémanence. En effet, certains de leurs métabolites peuvent
persister très longtemps dans le sol, les tissus végétaux
et les graisses. Du fait de cette caractéristique, les risques
d'accumulation et les conséquences qui peuvent en résulter pour
la santé de l'homme et pour l'environnement font que leur utilisation
est interdite ou restreinte à des situations très
limitées. Leur structure est variée mais ils ont en commun un ou
plusieurs atomes de chlore. Ce groupe renferme le DDT
(dichloro-diphényltrichloroétane), l'HCH
(hexa-chlorocyclo-hexane), le HCB (hexa-chloro-benzène) et l'endosulfan,
le pesticide le plus représentatif. Ils agissent par contact et par
ingestion.

Organophosphorés
Le premier organophosphoré (parathion) a
été commercialisé dès 1944. On peut distinguer deux
catégories : les insecticides de contact et les insecticides
systémiques. Ils sont généralement utilisés contre
les aleurodes, les thrips, les punaises et les pucerons. Ils agissent par
inhibition du site de l'acétylcholinestérase.
triallates, etc.). Mais quelques uns sont des insecticides
intéressants. Ils sont très actifs contre de nombreux insectes
(chenilles, capsides, pucerons, mouches blanches...). Ils sont moins persistant
(2 à 3 semaines) et agissent par contact et par ingestion en inhibant
l'acétylcholinestérase.

Pyréthrinoïdes
Les pyréthrinoïdes de synthèse sont
apparues plus récemment. Leur composition se rapproche de celle du
pyrèthre naturel, mais ce sont en réalité des pesticides
chimiques comme les autres. C'est aujourd'hui la famille d'insecticides la plus
utilisée (ACTA, 2010).
1.2.2 Regroupement selon le type d'activité et
le mode d'action
v' Selon le type d'activité
On peut ainsi distinguer les insecticides :
De contact qui agissent lorsque l'insecte entre en contact avec
le produit ; D'inhalation qui agissent lorsque l'insecte respire le produit
;
D'ingestion qui agissent lorsque l'insecte se nourrit du
produit.
v' Selon le site ou mode d'action
Plusieurs sites ou modes d'action sont connus pour les
insecticides. Ils insecticides contrôlent les insectes en
interférant sur leur système nerveux, ou en empêchant leur
mue etc. (ACTA, 2010).
1.2.3 Interaction ou synergie des polluants
Les risques d'association des pesticides avec d'autres
substances sont très peu considérés par les industriels
lors des études toxicologiques ou d'impacts avant leur homologation.
Lorsqu'on associe des produits, l'impact toxicologique ou
éco-toxicologique peut être bien important qu'avec un seul des
produits ; on parle alors de synergie positive.
Par contre, les molécules peuvent inhiber les effets
toxiques d'autres molécules ; dans ce cas on parle de synergie
négative. C'est ce qu'on retrouve avec :
- les organophosphorés qui inhibent la dégradation
des pyréthrinoïdes ;
- le pipéronyllbutoxide qui inhibe la dégradation
des organophosphorés ;
- l'endosulfan (organochloré) qui inhibe la
détoxication du malathion.
1.2.4 Phénomène de résistance aux
pesticides
La résistance est définie par l'OMS comme «
l'apparition dans une population d'individus possédant la faculté
de tolérer des doses de substances toxiques qui exerceraient un effet
létal sur la majorité des individus composant une population
normale de la même espèce ». Elle résulte de la
sélection, par un pesticide, de mutants qui possèdent un
équipement enzymatique ou physiologique leur permettant de survivre
à des doses létales de ce pesticide.
Les Diptères présentent le plus grand nombre de
cas de résistance, suivi par les Hémiptères (pucerons et
punaises). Les Coléoptères et Lépidoptères
représentent chacun 15 % des cas de résistance. Les facteurs
favorisant l'apparition d'une résistance sont classés en 3
groupes :
- les facteurs génétiques : fréquence,
nombre et dominance des gènes de résistance,
expression et interaction de ces gènes, sélection
antérieure par d'autres matières actives, degré
d'intégration du gène résistant et de la valeur adaptative
;
- les facteurs biologiques : temps de génération,
descendance, monogamie ou polygamie, parthénogénèse et
certains facteurs comportementaux (mobilité, migration, polyphagie, zone
refuge) ;
- les facteurs opérationnels : structure chimique du
produit et son rapport avec les
produits antérieurs, persistance des
résidus, dosage, seuil de sélection,
stade
sélectionné, mode d'application,
sélectivité du produit, sélection alternative.
Les cultures les plus concernées par les
phénomènes de résistance sont le coton qui fait partie de
la même famille que le gombo et l'arboriculture fruitière. On peut
citer le cas de la mouche blanche, Bemisia tabaci dans les cultures de
coton de la plaine de Gézira au Soudan au début des années
1980 ou celui des cicadelles du riz en Extrême Orient et dans le Sud Est
asiatique. La figure 3 est une parfaite illustration de l'évolution de
la résistance des insectes, parasites et mauvaises herbes aux pesticides
au fil des années (Holt et Lebaron, 1990).
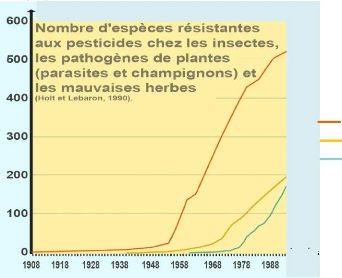
Nombre d'espèces
Années
Insectes
Parasites et champignons Mauvaises herbes
1.3 Biopesticides
Il est possible d'utiliser des organismes vivants et des
plantes naturelles (moisissures, bactéries, virus et nématodes,
composés chimiques dérivés de plantes ainsi que des
phéromones d'insectes) afin de lutter efficacement contre les insectes
et les maladies. Les avantages des biopesticides incluent la lutte effective
contre les insectes, les maladies de plantes et les mauvaises herbes, aussi
bien que la sécurité au niveau de l'homme / la femme et de son
environnement (Jeroen Boland et al., 2004 ; Philogène et
al., 2008). Par contre certains pesticides biologiques, comme la
nicotine, peuvent être fort toxiques et leur utilisation est tout aussi
risquée que celle de beaucoup de pesticides inorganiques ou
synthétiques (Jeroen Boland et al., 2004).
1.3.1 Spécificité
Les études sur l'efficacité des fractions des
plantes aromatiques montrent qu'il existe une grande variation dans la
sensibilité des espèces pour une même huile essentielle
(Shaaya et al., 1991). Regnault-Roger (2005a) a également
observé qu'une meme molécule allélochimique n'exerce pas
forcément la même activité aux différents stades du
cycle reproductif d'un insecte, c'est-à-dire que la sensibilité
d'un insecte peut évoluer en fonction de son développement
physiologique.
1.3.2 Biodégradabilité
Ces composés sont facilement biodégradés
par voie enzymatique. La durée de demivie des composés
végétaux est particulièrement courte, allant de quelques
heures à quelques jours (Isman, 2005 et Kleeberg, 2006).
1.2.3 Résistance
Comme les antibiotiques, un insecticide phytochimique peut
générer des cas de résistance si des applications de ce
composé sont faites de manière systémique,
répétée et sans discernement (Regnault-Roger, 2008).
1.4 Cas du neem
1.4.1 Description
Le neem peut être classé comme suit :
Règne Plantae
Division Magnoliophyta
Classe Magnoliopsida
Sous-classe Rosidae
Ordres Sapindales
Famille Meliaceae
Genre Azadirachta
Espèce Azadirachta indica Juss
Feuilles
Le neem est un arbre tropical, à feuillage persistant,
de la famille des Méliacées. Le feuillage est caduc et les
feuilles sont doublement pennées. Les folioles sont pointues et
légèrement dentées.
Fleurs
Les fleurs de couleur violettes sont en grappe et très
odorantes.
Fruits et graines
Le fruit est une drupe de 1 à 2 cm, jaune à
maturité (figure 4).

Figure 4 : Fruits de neem
1.4.2 Composition et propriété
chimique
Les extraits de graines de neem renferment un mélange
de plus de 168 composés constitués d'un groupe de 7 substances
proches incluant l'azadirachtine (figure 5) qui en constitue la matière
active. Il s'agit de terpénoïdes (structures multi cycliques).
L'azadirachtine A est considéré très largement comme le
principal composé à propriétés insecticides du neem
(Bernard et al., 2008). Un autre produit important du neem est son
huile dont les composants actifs sont: Acide oléique, acide
stéarique, acide palmitique, acide linoléique et l'acide
myristique. Il est très peu persistant dans l'environnement en raison de
sa forte photolabilité (demi-vie de 20h après un épandage
à la surface d'un feuillage) et d'une
hydrolyse dans l'eau (la moitié est
dégradée en 105 h à pH 7 et à 37°C et en 20 h
à pH 8) ainsique la participation active des micro-organismes
dans sa dégradation dans les sols : sa demi-
vie dans un sol standard
y est de 20 jours et de 31,5 jours dans un sol autoclavé (Isman,
1997).
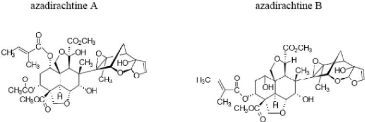
C35H44O16 C33H42O16
Figure 5 : Formules de l'azadirachtine
1.4.3 Mode d'action sur les insectes
Il agit comme anti-appètent et inhibiteur de croissance
des insectes. Sans les tuer immédiatement, il modifie leur croissance et
les empêche de se reproduire. Ils ne peuvent plus se nourrir et finissent
par mourir. L'azadirachtine est rapidement absorbée par les tissus
végétaux, ce qui lui assure une action systémique efficace
(Bernard et al., 2008 ; kleeberg 2008).
1.4.4 Utilisations
- Pour les plantes
En émulsion avec de l'eau et par pulvérisation,
l'huile de neem sert de fertilisant, de stimulateur de défenses
naturelles, d'insecticide et de répulsif dans des cultures
légumières, fruitières et forestières. Les
composants naturels du neem permettent des applications très diverses.
Dans la production agricole ou forestière, l'huile de neem permet la
mise en place de procédés efficaces et respectueux de
l'environnement pour les cultures nécessitant des pesticides
(parasites), des fongicides (champignons) et des insecticides (insectes).
L'action biologique des extraits du neem permet de lutter contre plus de 300
espèces d'insectes ravageurs, dont certaines sont résistantes aux
pesticides chimiques (Bernard et al., 2008).
- Pour les hommes
En médecine allopathique, homéopathique et dans
la médecine traditionnelle d'Inde, les extraits de neem sont
utilisés pour un grand nombre de pathologies, soins dermatologiques,
respiratoires, digestifs, etc. Elle a également des
propriétés antiseptiques. Dans l'industrie cosmétologique,
l'huile de neem est incorporée dans des crèmes, huiles
corporelles, shampooings, répulsifs, protections solaires et dentifrices
(Anonyme, 2011). L'azadirachtine A selon des chercheurs n'aurait pas d'effet
nocif sur la santé humaine (tableau I).
Tableau I : Risque suspecté de l'effet de
l'azadirachtine A sur la santé humaine.
|
Carcinogene
|
Mutagène
|
Pertuba- tion de l'endocri- ne
|
Reproduction / effects sur le development
|
inhibition de l'Acetyl cholinester ase
|
Neuro- toxique
|
Irritation
des voies respiratoires
|
Irritation de la
peau
|
irritant pour les yeux
|
|
|
|
|
|
|
|
|
|

: Oui
: Non Source : (Anonyme, 2012).
- Pour les animaux
Dans l'hygiène et les soins vétérinaires
: l'huile de neem vaporisée permet de désinfecter les
étables et les écuries par son action fumigatoire. En shampooing,
elle sert de répulsif et de soin pour le poil (Anonyme, 2011).
1.5 Cas de l'eucalyptus
1.5.1 Historique
Les eucalyptus forment un groupe très riche d'arbres du
genre Eucalyptus, de la famille des Myrtaceae et qui regroupait
jusqu'en 1995 le genre Corymbia. Les eucalyptus sont originaires de
Tasmanie en Australie, où ils dominent d'ailleurs 95 % des forêts
avec plus de six cents espèces.
Certaines espèces, notamment E. globulus, ont
été introduites en Europe, où elles se sont très
bien acclimatées sur les rivages méditerranéens, ainsi
qu'au Portugal, où d'immenses forêts d'eucalyptus ont
été plantées pour la production de pâte à
papier. En Afrique occidentale, seuls Eucalyptus camaldulensis et
E. microtheca résistent à la secheresse jusqu'à
l'isohyète 600 mm mais avec des productivités très basses.
En Côte d'Ivoire, l'on a assisté à la création
d'immenses plantations d'Eucalyptus au nord du pays ; notamment à
Korhogo au début des années 80 dont les besoins en bois
étaient estimés en 1991 à plus de 63.000 tonnes (Kidiera,
1991) dans le but de produire à cout terme la pâte à
papier, du bois d'énergie et de service puis la reforestation des
espaces dégradés.
1.5.2 Description
La classification botanique de l'eucalyptus est comme suit :
Règne Plantae
Sous-règne Tracheobionta
Division Magnoliophyta
Classe Magnoliophyta
Sous-classe Rosidae
Ordre Myrtales
Famille Myrtaceae
Genre Eucalyptus
Espèce Eucalyptus camaldulensis
Taille et port
Un eucalyptus adulte peut, selon l'espèce, se
présenter comme un petit buisson ou comme un arbre de très haute
stature. On dit que les eucalyptus sont:
|
petits s'ils mesurent moins de dix mètres de haut ;
de taille moyenne s'ils font entre dix et trente mètres
;
grands s'ils mesurent entre trente et soixante mètres ;
très grands s'ils atteignent plus de soixante
mètres (certaines espèces atteignant 90 mètres de
hauteur).
|
Tronc
L'écorce est très utile pour l'identification et
la distinction entre les nombreuses espèces, car elle peut
présenter de grandes différences dans son apparence. Soit elle
est dure, fibreuse, floconneuse, lisse, ou possède de profonds
sillons.
Feuilles
La plupart des eucalyptus ont des feuilles persistantes, mais
quelques espèces tropicales perdent leurs feuilles à la fin de la
saison sèche. Elles sont couvertes de glandes à huile. Sur les
jeunes arbres, elles sont opposées, sessiles, ovales et glauques, et
quand l'arbre grandit, elles deviennent alternes, pétiolées,
très allongées, parfois un peu courbées comme des lames de
faux. Cependant, beaucoup d'espèces comme E. melanophloia et
E. setosa gardent toute leur vie le même type de feuilles.
L'orientation des feuilles d'eucalyptus est verticale. Les feuilles
possèdent une couche de cellules palissadiques sur chacune de leurs
faces. L'eucalyptus peut donc capter de l'énergie lumineuse sur chacun
des deux côtés de ses feuilles pour tirer meilleur parti de la
photosynthèse.
Fleurs
Les fleurs sont très variées. Elles ont de
très nombreuses étamines qui peuvent être de couleur
blanche, crème, jaune, rose ou rouge. Au départ, les
étamines sont dans un étui fermé par un opercule,
formé par la fusion des pétales et/ou des sépales. Pour un
même sujet, les opercules peuvent avoir différentes formes.
Lorsque les étamines grandissent, elles soulèvent l'opercule et
s'étalent pour former la fleur. La pollinisation des fleurs se fait
principalement par les insectes, attirés par le nectar (figure 6).

Figure 6 : Feuilles et fleurs d'Eucalyptus
camaldulensis
Fruits et graines
Les fruits d'eucalyptus sont formés par le
développement du réceptacle ainsi que de l'ovaire qui s'y
attache. Ils contiennent un nombre important d'ovules. Une partie de ces ovules
seront fécondés par des grains de pollen distincts, lors de la
pollinisation, mais ils ne le seront jamais en totalité. Après la
fécondation, les graines vont se développer et faire grossir le
fruit. Les fruits à maturité ont la forme d'un cône, ils
sont secs et de couleur brune. Ils ont également des valves qui se
soulèvent pour laisser échapper les graines lors de leur chute
sur le sol. La plupart des espèces ne fleurissent pas avant l'apparition
du feuillage adulte, sauf pour Eucalyptus cinerea et Eucalyptus
perriniana (Anonyme, 2011).
1.5. 3 Composition chimique
Les feuilles de l'Eucalyptus globulus renferment des
tanins, de l'alcool cérylique, un diphénol
(pyrocatéchine), une résine acide et, surtout, 5 à 7%
d'huile essentielle aux composants multiples, le plus notable étant
l'eucalyptol (ou le 1,8-cinéol). Tout comme les autres huiles
essentielles, il se distingue des autres huiles végétales par sa
volatilité. Les constituants des huiles essentielles appartiennent, de
façon quasi exclusive, à deux familles chimiques : les
terpénoïdes et les phénylpropanoïdes (Bruneton, 1999).
L'essence et l'eucalyptol, principes actifs, sont antiseptiques et balsamiques
aux doses thérapeutiques, toxiques à forte dose.

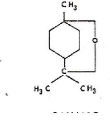
C10H18O
Figure 7 : Formule du cinéol
1.5.4 Mode d'action de composés
terpéniques
Les monoterpènes contenus dans les huiles essentielles
sont des neurotoxiques qui agissent sur différentes cibles en fonction
de leur nature chimique. Le terpinène -4-ol et le 1,8-cinéol
contenus dans l'huile essentielle extraite des feuilles du thé
provoquent une inhibition de l'acétylcholinestérase (Mills et
al., 2004). Ces neurotoxiques sont utilisés dans la lutte
contre les poux dans le traitement de la pédiculose (Huignard et
al., 2008).
1.5.5 Utilisations
Éliminés par l'appareil respiratoire et les
voies urinaires (l'urine prend une odeur d'iris ou de violette), ces principes
ont un effet bénéfique dans les bronchites aiguës et
chroniques, la tuberculose pulmonaire, l'asthme (ils modifient les
sécrétions, favorisent l'expectoration, calment la toux). La
simple infusion des feuilles est efficace. L'eucalyptus est aussi
fébrifuge, tonique de l'appareil digestif et vermifuge (vin à
3%). En usage externe, antiseptique et cicatrisant, il s'emploie sur les
plaies, les brûlures, les ulcères (décoction ou teinture
étendue) et en injections dans la vaginite, la leucorrhée, la
blennorragie (Lieutaghi, 2007).
L'eucalyptus (E. globulus) est aussi utilisé par
beaucoup d'industriel pour la fabrication de pâte à papier.
2. Cultures maraichères
2.1 Principaux groupes
On distingue deux grands groupes :
les légumes tropicaux : l'aubergine
local, la tomate, le piment, etc. ;
les légumes introduits : le chou, la
carotte, la laitue, le melon, le concombre qui ont été
importés d'autres continents et qui ont été
acclimatés à travers différentes
expérimentations.
2.2 Classification
On dénombre plus de 10.000 espèces
consommées dont seulement 50 espèces ont un intérêt
économique. Les principales espèces de légume sont
réparties en 11 familles botaniques regroupées dans le tableau II
(Fofana, communication personnelle).
Tableau II : Principales espèces de
légumes et leurs familles botanique.
|
Ordre
|
Famille
|
Cultures
|
|
Les Tubiflorales
|
Les Solanacées
|
La tomate, l'aubergine, le piment, la pomme de terre
|
|
Les Rosales
|
Les Légumineuses
|
Les pois et les haricots
|
|
Les Rhaeadales
|
Les Crucifères
|
Le chou, le radis, le navet (sorte de carotte blanche)
|
|
Les Cucurbitales
|
Les Cucurbitacées
|
Le concombre, la courge, la courgette, les
pastèques, le melon
|
|
Les Synanthérales
|
Les Composées ou Astéracées
|
La laitue, la chicorée
|
|
Les Ombélliflores
|
Les Ombellifères ou
Apiacées
|
La carotte, le céleri et fenouil (plante des zones
tempérées), le persil
|
|
Les Liliales
|
Les Liliacées
|
L'oignon, l'ail, l'échalote, la ciboule, la ciboulette
|
|
Les Centrospermales
|
Les Chénopodiacées
|
L'épinard, la betterave
|
|
Les centrospermales
|
Les Amarantacées
|
L'amarante
|
|
Les Arales
|
Les Aracées
|
Le taro
|
|
Les Malvales
|
Les Malvacées
|
Le gombo et les oseilles dont l'espèce qui fait les fleurs
rouge est utilisée pour le « bissap »
|
2.3 Intérêts de la culture des plantes
maraîchères
2.3.1 Intérêt nutritionnel
Le mode de consommation des légumes le plus courant en
Afrique est sous la forme de sauce. Mais la consommation sous la forme de
salade est bien meilleure. En effet les légumes contiennent beaucoup de
sels minéraux et de vitamines. Ils constituent la source quasi exclusive
de vitamine C pour l'organisme.
Cependant les légumes graines de haricot et les
légumes feuilles ont une très grande teneur en protéines.
Selon la recherche de certains nutritionnistes dans 100g de légumes
frais on a détecté :
6g de glucides, 0g de lipides, 3g de protides, 1g de sels
minéraux, des vitamines C, B1, B2 Soulignons que lorsque les
légumes sont cuits ces teneurs diminuent : Il est conseillé :
75g/ jour pour les légumes crus ; 250 à 300g/jour lorsque c'est
cuit.
2.3.2 Intérêt économique
Ce secteur constitue un véritable facteur de
développement car il offre des opportunités d'emploi dans les
zones rurales et périurbaines. En effet la culture des légumes
nécessite beaucoup de main-d'oeuvre. Aujourd'hui ce secteur doit son
développement rapide à la croissance démographique et
à l'urbanisation accélérée. En Côte d'Ivoire
si selon le rapport provisoire sur la filière horticole, les revenus
paraissent faibles (beaucoup gagne au moins 500.000F/an), ceux-ci sont quand
même au dessus du seuil de pauvreté.
2.3.3 Intérêt social
Il est à considérer sous l'approche genre. En
effet, lorsque des possibilités d'irrigation existent, la pratique du
maraîchage permet aux femmes et aux jeunes d'avoir des revenus propres.
Des surfaces de 10 à 20 ares bien maîtrisées avec des
régimes variés sont largement suffisantes.
2.3.4 Intérêt environnemental
En général les exploitations
légumières se retrouvent sur des sites délaissés
qui souvent regorgent d'innombrables immondices (déchets...). Une
exploitation rationnelle de ces lieux donne des aires dégagés,
aérées tout en limitant le taux d'insalubrité ; ce qui
concours à une hygiène saine des populations.
2.4 Gombo
Le gombo (Abelmoschus esculentus) est le fruit d'une
plante tropicale à fleurs, appartenant à la famille botanique des
malvacées. Il est récolté vert et employé comme
légume et comme condiment.
2.4.1 Origines
Le gombo est originaire d'Afrique, des rives alluviales du Nil
en Ethiopie, où on le trouve encore à l'état sauvage. Il
s'est répandu sur tous les continents, après sa découverte
il y a environ 4 000 ans. Ce sont les Égyptiens qui en firent les
premiers la culture dans le bassin du Nil. Il se propagea ensuite à
travers l'Afrique du nord jusqu'aux Balkans, via le bassin
méditerranéen, et on le trouve rapidement jusqu'en Inde. Le gombo
fut introduit en Europe par les Maures espagnols au XIIe siècle. Il
arriva ensuite au Brésil au XVIIe siècle, grâce aux
esclaves africains qui en apportèrent des semences, en Guinée
hollandaise (actuelles Indonésie et Papouasie) et à la Nouvelle
Orléans avant de s'étendre en 1781 à l'ensemble des
Etats-Unis. Aujourd'hui on cultive le gombo dans plusieurs régions
tropicales et subtropicales.
2.4.2 Description
Le gombo se classe comme suit :
Règne Plantae
Sous-règne Tracheobionta
Division Magnoliophyta
Classe Magnoliopsida
Sous-classe Dilleniidae
Ordre Malvales
Famille Malvaceae
Genre Abelmoschus
Espèce Abelmoschus esculentus L.
Taille et port
La plante de gombo est un buisson haut, pouvant atteindre
jusqu'à 2m50. Il existe des variétés naines qui
n'excèdent pas 90 cm.
Feuilles
Les feuilles ont des formes différentes selon les
variétés (en forme de coeur, lobées ou divisées).
Ses fleurs jaunes au coeur pourpre ressemblent à celles de l'hibiscus
auquel elles sont apparentées (figure 8).
Fruits et graines
Les botanistes appellent capsules, les fruits du gombo. Ces
capsules de forme conique et allongée sont terminées par une
extrémité pointue, et un bourrelet près du
pédoncule. Elles mesurent, selon la variété, entre 4 et 15
cm de long. On consomme les gombos jeunes (quand ils ont la grosseur d'un
doigt) crus en salade ou cuits en ragout, soupe, sauce ou frits. La peau ferme,
recouverte d'un fin duvet soyeux semblable à celui d'une péche,
est généralement de couleur vert foncé. On trouve
toutefois quelques variétés jaunes voire blanches et même
rouges dont la couleur disparaît à la cuisson. Sa section
transversale montre des cavités, pentagonale ou hexagonale et
jusqu'à octogonale remplies de graines molles, elles sont aussi
comestibles. Il existe des variétés sans aucunes
aspérités, semblables à de petites courgettes
duveteuses.

Figure 8 : Feuilles, fleurs et fruits du
gombo
Nom
Le mot gombo est originaire d'Angola où on le nomme
"ngumbo". Le gombo introduit en Amériques par les esclaves
désigne aussi dans cette partie du monde un ragoût ou un potage
à base de gombos. Le gombo est aussi appelé okra.
Ce terme quant à lui vient de la "Côte d'Or"
où les autochtones l'appelaient "nkruman," dont la déformation a
donné beaucoup plus tard le mot "okra"(Anonyme, 2011).
2.4.3 Ecologie
Le plant de gombo est très exigeant en chaleur,
lumière et humidité et doit être cultivé à
l'abri dans nos pays. Toutefois, la germination est très facile et
rapide (3 à 4 jours). C'est une plante annuelle qui s'auto-pollinise.
Elle produit de très nombreux fruits à récolter de Juillet
jusqu'en Novembre. La récolte commence deux ou un mois et demi
après le semis, selon la variété et concerne les fruits
jeunes de 3 à 5 jours après la floraison, les fruits trop
mûrs étant fibreux. Il faut, chaque jour, cueillir les gombos, et
enlever les vieilles cosses sinon
le plant arrêtera de produire. Il est nécessaire
de porter des gants de caoutchouc, des pantalons longs et une chemise à
longues manches car ses piquants peuvent provoquer des démangeaisons.
Fragile, le gombo se conserve deux à trois jours au
réfrigérateur dans un sac de papier, sans avoir été
lavé.
Variétés
Il existe de nombreuses variétés annuelles ou
pluriannuelles. Elles sont réparties en deux groupes de
variétés: les variétés à courtes tiges ayant
un cycle de vie court dont les fruits arrivent à maturité au bout
de trois mois et celles à hautes tiges dont le cycle est plus long, 6
à 9 mois.
2.4.4 Utilisations
Le gombo est un légume diététique. Il est
cependant très nutritif, riche en calcium ainsi qu'en vitamine A, C et P
et en minéraux.
Dans 100g de gombo, on trouve :
7,5 g de glucides, 5,76 g hydrate de carbone, 2 g de fibres,
1,52 g de protéines, 1,7 g de lipides, 256,6 mg de potassium, 50,4 mg de
Calcium, 46 mg de magnésium, 13,04 mg de vitamine C, 0,4 mg de Fer, 36,5
micro grammes d'acides foliques (Siemonsma et Kouamé, 2004).
Riches en fibres, le Gombo facilite la digestion. Mangé
régulièrement sous forme de soupe, il combat la constipation.
Consommé cru, il soigne l'incontinence urinaire. Les feuilles tonifient
(écrasées dans l'eau du bain) et soignent (le jus) la peau
irritée. En complément avec les fleurs et préparées
en bain-marie, elles soulagent les ampoules aux pieds et aux mains. En tisane
prise matin, midi et soir, les feuilles facilitent l'accouchement. Il faut
néanmoins faire attention à ne prendre cette tisane que durant
les derniers jours de la grossesse car sinon elle est abortive. En friction sur
le ventre, elles diminuent les douleurs de l'enfantement.
La tige est constituée de fibres très
résistantes dont on fait de la pâte à papier.
Les graines séchées et grillées peuvent
être utilisées comme un substitut au café. Après le
pressage des graines, le tourteau contient environ 30 % de protéines et
servent de compléments alimentaires aux animaux.
2.4.5 Maladies et ennemis

2.4.5.1 principaux ravageurs Les insectes ravageurs des
organes aériens Syllepte derogata (Lepidoptera,
Tortricidae)
Les chenilles sont vertes claires, souvent translucides avec
une tête noire brillante. Leur longueur atteint 2 à 3 cm. S.
derogata est encore appelé chenille enrouleuse. Elle s'attaque aux
feuilles qu'elle enroule sous forme de cigare, à l'aide de fils soyeux.
L'intérieur de la feuille enroulée est souillé par de
nombreux excréments noirs. Les attaques de S. derogata sont
souvent localisées dans le champ et peuvent entraîner une
défoliation spectaculaire. Un labour de qualité détruit
les chenilles en diapause (Appert et Deuse, 1988).
Anomis flava (Lepidotera, Noctuidae)
La chenille est vert clair, parfois même vert
jaunâtre. Elle porte cinq lignes blanches très fines sur le dos.
La tête est vert-jaune. Sa taille maximale est d'environ 35 mm. Elle se
déplace d'une manière très caractéristique. Elle ne
s'alimente que du feuillage et son alimentation est essentiellement
limitée aux malvacées. La chrysalide est fixée au
feuillage dans un cocon. Les dégâts des chenilles se
présentent comme des perforations circulaires de 1 à 3 cm de
diamètre dans les feuilles (Appert et Deuse, 1988).
Spodoptera littoralis (Lepidoptera,
Noctuidae)
Les chenilles de cette espèce ont une coloration
très variable (brune, jaunâtre ou grise). Elles sont
caractérisées par deux rangées de triangles noirs sur le
dos et une ligne claire de chaque côté. Mais ces triangles peuvent
être présents seulement à l'avant ou à
l'arrière du corps. Les jeunes chenilles naissent à la face
inférieure des feuilles qu'elles rongent. Lorsqu'elles sont
âgées, elles se dispersent sur les plants dont elles consomment le
feuillage. En cas de fortes attaques, seules les nervures peuvent subsister.
Très vorace, ce ravageur peut aussi attaquer fleurs et capsules. Son
statut de ravageur de feuillage n'est donc pas strict et en cas de fortes
infestations S. littoralis, peut provoquer d'importants
dégâts aux organes fructifères (Appert et Deuse, 1988).
|
Ravageurs des organes fructifères
|
Diparopsis watersi (Lepidoptera,
Gelechiidae)
La chenille jaunâtre, devient ensuite vert pâle
avec des traits transversaux rouges plus rapprochés vers la tête.
Elle atteint à son complet développement 2,5 à 3 cm. Elle
attaque en perforant boutons floraux, fleurs et capsules, qui restent parfois
suspendus au plant par des fils de soie. Ce dégât typique est
caractéristique de la présence de D.watersi dans la
culture (Appert et Deuse, 1988).
Earias sp. (Lepidoptera, Noctuidae)
La chenille de forme trapue est facile à
reconnaître, car elle porte de nombreuses épines : c'est la
chenille épineuse. Elle attaque les jeunes plants en les écimant.
La chrysalide est formée dans un cocon de couleur crème-ivoire
fixé sur les tiges. Les trous d'entrée sont assez grands et bien
visibles. Elle cause également des dégâts sur boutons
floraux, fleurs et capsules (Appert et Deuse, 1988).
Dysdercus völkeris (Heteroptera,
Pyrrochoridae)
Grosse punaise de 1 à 1,5 cm, rouge et noir qui vit en
colonie et dont les larves sont rouge vif. Elle pique les capsules vertes ou
celles ouvertes pour se nourrir de graines. Elle déprécie la
valeur germinative des semences et la fibre qu'elle colore. Des excroissances
typiques des piqûres de punaises apparaissent dans les capsules.
Les Dysdercus se développent essentiellement sur
les plantes de la famille du cotonnier (les malvacées). Cependant, ils
peuvent aussi effectuer leur cycle sur le sorgho et le maïs.
Nezara viridula (Heteroptera,
Pentatomidae)
C'est une punaise à bouclier qui est très
polyphage. L'adulte est de couleur verte. Il a environ 14 à 15 mm de
long et 8 mm de large. Les larves ressemblent aux adultes. C'est une punaise
qui attaque les fruits en développement (Appert et Deuse, 1988).
|
Ravageurs de tous les organes (feuilles, fleurs et
fruits)
|
Nisotra sp et Podagrica sp
(Coleoptera, Chrysomelidae)
Ces petits insectes très mobiles ont plusieurs couleurs.
Podagrica sp est une altise de couleur
brun-jaunâtre clair et l'adulte a 3 à 4 mm de long. L'adulte de
Nisotra sp a le pronotum de couleur
brun-jaunâtre et les élytres bleu-noir à reflets brillants.
Il atteint une longueur de 3 à 4 mm. Cette altise a les fémurs
postérieurs renflés et peut sauter assez loin.
Ils font de nombreux trous dans les feuilles des jeunes plants,
ils s'attaquent également aux fleurs et aux fruits. Les
dégâts sont surtout dangereux sur jeune plantule.
Aphis gossypii (Homoptera,
Aphididae)
Des colonies sont présentes sur les feuilles, les
fleurs et les fruits de gombo. C'est un puceron de couleur vert-noirâtre,
d'environ 1 à 2 mm de long. Les siphunculi et la cauda (la queue) sont
de couleur noire (Appert et Deuse, 1988).

Les vecteurs de virus
Jacobiasca lybica et Jacobiella
facialis (Homoptera, Jasside)
Jacobiasca lybica est un petit
insecte très actif de couleur vert clair à vert-jaunâtre,
dont les ailes sont transparentes et brillantes. Les adultes ont environ 2,5 mm
de long. L'adulte de Jacobiella facialis, long de 3,0
à 3,5 mm, est de couleur vert-jaunâtre. Les larves de ces deux
types d'insectes se déplacent latéralement. Les adultes et les
larves infestent le feuillage et sucent les feuilles. Ils provoquent une
décoloration des feuilles et peuvent transmettre des virus.
Bemisia tabaci ou Mouche blanche
(Homoptera, Aleurodidae)
Les larves, de couleur vert clair, sont translucides et
ressemblent à des cochenilles. Elles sont fixées sur la face
inférieure des feuilles. Les adultes, blancs et de petite taille (1 mm),
se mettent à voler pendant quelques instants si l'on secoue la plante.
Ce ravageur, surtout important pendant la saison sèche, est un vecteur
de virus appelé Okra leaf curl virus (OLCV). Il peut causer aussi des
dégâts mécaniques par ses piqûres et intoxiquer la
plante par sa salive (Appert et Deuse, 1988).
Nisotra dilecta (Coleoptera,
Chrysomelidae)
L'adulte de ce coléoptère est capable de
transmettre l'Okra mosaic virus (OMV).
2.4.5.2. Les agents de maladies foliaires
Leveillula taurica, (Oidiopsis
blanc)
Le blanc affecte principalement les feuilles et moins
fréquemment les fleurs, les tiges ou les pétioles. Le plus
souvent, des taches d'un jaune vif apparaissent sur la face supérieure
des feuilles tandis qu'un revétement poudreux se développe sur la
face inférieure. Généralement, les feuilles se
dessèchent et restent sur les plantes. Pour lutter contre cette maladie,
il faut éviter de semer à proximité de sources d'infection
telles que d'autres cultures.
Cercospora abelmoschi,
(Cercosporiose du gombo)
Rien n'est visible sur la face supérieure des feuilles;
par contre, sur la face inférieure, des zones mal
délimitées sont couvertes d'une moisissure noire, épaisse,
constituée par les fructifications du parasite. Aucune tache
n'apparaît. La face inférieure est entièrement couverte de
ces fructifications si bien que la feuille jaunit et tombe. Les attaques
débutent par les feuilles de la base, puis tout le feuillage est envahi.
La lutte consiste à la destruction des débris infectés,
afin de réduire les germes nuisibles.
PARTIE II :
ETUDE
EXPERIMENTALE
I. OBJECTIF
1.Objectif général
L'objectif visé à travers cette étude est
l'utilisation de plantes pouvant servir d'insecticides biologiques, afin de
limiter l'utilisation de produits chimiques classiques.
2. Objectif spécifique
L'étude consiste à tester l'efficacité des
extraits aqueux de graines de neem et des feuilles d'eucalyptus sur les
ravageurs des cultures maraîchères à travers le cas du
gombo.
II. MATERIEL ET METHODES
1. Matériel
1.1 Matériel végétal
Le matériel végétal choisi est le gombo
(Abelmoschus esculentus L.) dont les caractéristiques sont
consignées dans le tableau III :
Tableau III: Caractéristiques du
matériel végétal
Matériel végétal
Gombo Nom
|
vernaculaire de la variété
|
Djonan-djonan Origine
Top Grain Faculté germinative
Forte (99%) Autres caractéristiques
Plante précoce, rustique.
1.2 Pesticides utilisés

Produit chimique
Nous avons utilisé le K-OPTIMAL, qui est un insecticide
faisant partie de la liste actualisée des pesticides homologués
et autorisés en Côte d'Ivoire (Anonyme e, 2009) dont les
caractéristiques sont consignées dans le tableau 4. Les
matières actives contenues dans ce produit sont la Lambda-cyhalotrine
15g/l et l'Acétamipride 20g/l.
La Lambda-cyhalotrine est un insecticide de la famille des
pyréthrinoïdes. Il agit en perturbant le fonctionnement du
système nerveux des insectes, il peut entraîner une paralysie ou
la mort de l'animal en modulant les canaux sodiques en partie responsable de la
transmission de l'influx nerveux. Il est cependant dégradé
rapidement par la lumière du soleil.
C'est un irritant des voies respiratoires, de la peau et des
yeux. Il est nocif s'il est avalé, inhalé ou en contact avec la
peau.
L'Acétamipride est quant à lui un insecticide de
la famille chimique des néonicotinoïdes. Il agit sur la
région post-synaptique en bloquant les récepteurs à
l'acétylcholine. Cette molécule agit majoritairement par
ingestion mais également par contact. L'acétamipride est peu
toxique pour les insectes pollinisateurs (abeilles, bourdons). Pur, ce produit
est nocif en cas d'ingestion. D'autre part il est irritant pour les yeux et la
peau. Les
Caractéristiques du produit chimique sont
consignées dans le tableau IV.
Tableau IV: Caractéristiques du produit
chimique
|
Nom
|
Matières
|
Classe
|
N°
|
Distributeur
|
Culture/usage
|
|
commercial
|
actives
|
FAO /OMS
|
homologation
|
agréé
|
autorisé
|
|
Lambda-
|
|
|
|
|
|
K-OPTIMAL
|
cyhalotrine
|
II
|
09 0877 ln
|
STEPC
|
GOMBO
|
|
35 EC
|
15g/l
|
|
|
|
AUBERGINE
|
|
Acétamipride
|
|
|
|
TOMATE
|
|
20g/l
|
|
|
|
|
Source : (DPVCQ, 2009)

Extraits végétaux
Pour cette catégorie de produit, nous avons utilisé
deux extraits aqueux: - les extraits de graines de neem ;
- les extraits de feuilles d'eucalyptus.
1.3 Matériel de mesure et de travail
Nous avons utilisé plusieurs matériels de travail
regroupés dans le tableau V et certains illustrés à la
figure 9.
Tableau V : Liste du matériel
utilisé
Matériel de défrichement et
Machette, lime, daba, râteau, brouette de travail du
sol
Matériel d'établissement des Mètre ruban,
piquets, gabarit, grosse daba, machette
planches et de semis
Matériel d'entretien des Machette, binette, houe, pelle,
arrosoir
cultures
|
Matériel de préparation des Cailloux à
écraser, balance électronique, seaux, marmite, rechaud
insecticides et de récolte électrique (500W),
éprouvette, passoir, gant, tissu, cache-nez,
pulvérisateurs Shogun (1litre), sachet en
polyéthylène
|
Matériel de collecte et Stylo, papier rame, logiciels WORD
2007, EXCEL 2007,
d'analyse des données STATISTICA 7.1

26
a) b) c) d)

Figure 9: Quelques matériel de travail ;
gants (a), pulvérisateurs Shogun (b), marmite et réchaud (c),
balance électronique (d).
2. Méthode
2.1 Dispositif expérimental
Nous avons retenu le dispositif en blocs aléatoires
complets (randomized complete blocs). Le dispositif est constitué de
trois blocs (répétitions) ayant reçu chacun quatre
traitements distincts en randomisation totale. Chaque bloc comprend quatre (4)
parcelles élémentaires (figures 10 et 11).
La superficie totale de la parcelle d'expérimentation
est de 330m2. Les blocs sont distants de 1,5m et les parcelles
élémentaires de 1m avec pour dimensions 6m de long et 1,6m de
large. Les traitements appliqués sont :
T0 : parcelle témoin, non traitée ;
T1 : parcelle traitée avec le produit chimique ;
T2 : parcelle traitée avec l'extrait aqueux de graines de
neem ;
T3 : parcelle traitée avec l'extrait aqueux de feuilles
d'eucalyptus. N
30 m
11 m
Bloc 1
Bloc 2
Bloc 3
1m
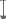
|
, T2
|
|
T0
|
|
T3
|
|
T1
|
|
|
T1
|
|
T3
|
|
T0
|
|
T2
|
|
Figure 10 : Dispositif expérimental

Bloc 2
Bloc 3 Bloc 1
Figure 11 : Vue d'ensemble de la parcelle
expérimentale
2.2 Conduite de la parcelle
2.2.1. Préparation du sol
Elle a consisté d'abord à désherber la
végétation existante à l'aide de machette, ensuite
à préparer les planches en commençant par un
pseudo-labour. La préparation des planches a coïncidé avec
la petite saison des pluies ; ce qui a naturellement facilité la
confection des planches.
2.2.2. Mise en place de la culture
Nous avons procédé à un semis direct. La
densité de semis retenue est celle des essais précédents,
soit un écartement de 130 cm entre les lignes et 25 cm sur les lignes.
On obtient alors 5 lignes avec 6 plants par ligne sur chaque parcelle
élémentaire (figure 12).

130 cm
25 cm
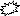
: Plant de gombo
Figure 12 : Disposition des plants sur une
parcelle élémentaire.
2.2.3. Entretien des parcelles
Cette opération est essentiellement basée sur
l'arrosage, le sarclage, le binage, l'apport de poudrette de parc et la
construction d'une clôture à partir de matériel
végétal (bois d'Albizzia lebec et de branches de
Borassus aethiopum), contre les boeufs en pâture. L'arrosage des
parcelles s'est fait à l'aide des arrosoirs avec l'eau de puits tous les
jours. Le sarclage et le binage ont été faits respectivement avec
une houe et une binette toutes les deux semaines.
3. Traitements appliqués
3. 1 Mode d'extraction

Extrait à base de graines de neem
Les graines ont été recueillies et stockées
au moins deux semaines avant le début des traitements. Le processus
d'extraction suit les étapes suivantes :
- Etape 1 : ramassage des graines sous les arbres ;
- Etape 2 : séchage à l'ombre pendant deux à
trois semaines ;
- Etape 3 : pesage des graines ;
- Etape 4 : broyage des graines pour obtenir la poudre fine ;
- Etape 5 : macérage du broyat (envelopper dans une toile
fine) pendant 24 h dans de l'eau simple ;
- Etape 6 : filtrage et obtention du produit final.

Extrait à base de feuilles
d'eucalyptus
Les feuilles sont récoltées le même jour et
la préparation se fait comme suit : - Etape 1 : pesage des feuilles ;
- Etape 2 : rinçage ;
- Etape 3 : broyage grossier à la main ;
- Etape 4 : faire bouillir le broyat dans de l'eau pendant 30 mn
;
- Etape 5 : laisser refroidir et filtrer avant de
pulvériser (Anonyme, 2011).
3.2 Doses appliquées
Les différentes doses d'insecticides utilisés sont
consignées dans le tableau VI. Tableau VI :
Récapitulatif des différentes doses de pesticides
utilisés
|
Caractéristiques
|
K-optimal
|
Graine de neem
|
Feuilles d'eucalyptus
|
|
Traitements
|
T1
|
T2
|
T3
|
|
Surface à traiter recommandée
|
400 m2
|
400 m2
|
-
|
|
Quantité de produit prescrite
|
40 ml
|
800 g
|
150 g
|
|
Quantité d'eau recommandée
|
15 L
|
10 L
|
5 L
|
|
Surface essai
|
30 m2
|
30 m2
|
30 m2
|
|
Quantité de produit, feuilles ou amandes
|
3 ml
|
60 g
|
33,75 g
|
|
Quantité d'eau à diluer
|
1,125 L
|
0,75 L
|
1,125 L
|
|
Quantité de bouillie à traiter
|
1,125 L
|
0,75 L
|
1,125 L
|
3.3 Application des traitements
Pulvérisation : elle s'est faite avec des
pulvérisateurs manuels de 1 litre de marque Shogun.
Les pulvérisateurs étaient au nombre de trois.
Les buses des pulvérisateurs étaient réglées de
sorte que toutes les parties des feuilles du gombo, puissent
bénéficier des différents produits appliqués.
Délai d'application : les traitements ont
commencé le 19è jour après le semis.
L'intervalle de temps entre deux traitements était de 6 jours sur tout
le cycle de la culture.
Méthode de collecte des données et
échantillonnage : les observations ont commencé 3 jours
après le premier traitement et cela chaque six jours. Le comptage a
porté sur les insectes vivants sur toutes les feuilles de
l'échantillon (figure 13a).
L'échantillonnage s'est fait en éliminant les
plantes de bordure. Les observations ont été effectuées
sur 10 plants parmi les 30 que comptaient les parcelles
élémentaires. Le choix des plants et le sens des observations
changeaient toutes les deux observations consécutives (figure 13b).

Figure 13a : Comptage des insectes
b1) Première observation b2) Deuxième
observation

: Plants observés : Plant non observé
Figure 13b : Echantillonnage par parcelle
élémentaire
4. Paramètres étudiés
4.1. Populations d'insectes
Elle concerne les principaux ravageurs du gombo. Ces
différents types d'insectes ont été identifiés au
Laboratoire de Zoologie et Entomologie du Département Agriculture et
Ressources Animales de l'INP-HB et à l'aide d'autres documents (Appert
et deuse,...).
4.2. Production
Nous avons estimé la production en nous basant sur le
poids moyen des bons fruits et des fruits attaqués par les insectes car
ils diffèrent en fonction des dégâts causés par les
insectes. Les pesées de chaque récolte ont permis de
déterminer la production de chaque parcelle élémentaire en
fonction des traitements.
5. Analyse des données
Les données ont été traitées à
l'aide du logiciel Microsoft Excel 2007.
Le logiciel STATISTICA Version 7.1 for Windows a permis de
faire l'analyse de variance (ANOVA) des populations d'insectes et de la
production de bons fruits. En cas de différence significative au seuil
de 5 %, le test de STUDENT NEWMAN et KEULS a permis de dégager les
différents groupes homogènes. Ainsi, si la probabilité
P>0,05, alors les moyennes ne sont pas significativement différentes.
Par contre, si P<0,05 alors, les moyennes sont significativement
différentes.
III. RESULTATS ET DISCUSSION
1. Résultats
1.1 Inventaire des insectes rencontrés sur le
gombo
Durant l'expérimentation, nous avons noté la
présence de plusieurs insectes appartenant à différents
ordres : Ce sont les Coléoptères ( Chrysomelidae, Coccinelles),
les Hémiptères ( Pucerons, Mouches blanches, Jassides, Punaises
et Cochenilles), les Hyménoptères (Fourmis, Abeilles,
Guêpes), les Orthoptères ( Criquets puants, Sauterelles et
Grillons) et les Lépidoptères (Syllepte derogata, Anomis
flava, Spodoptera littoralis). Parmi ceux-ci, certains de par leur nombre
et aptitude peuvent causer des dégats importants aux plants du gombo.
1.2 Principaux insectes ravageurs du gombo
observés
Les principaux insectes ravageurs observés sont les
Altises (Podagrica decolorata), les Mouches blanches (Bemisia
tabaci), les Jassides (Jacobiasca sp), les Pucerons (Aphis
gossypii et Myzus persicae), les Punaises rouges du cotonnier
(Dysdercus spp.), Syllepte derogata et Anomis flava
(chenille arpenteuse). Les différents insectes et leurs effectifs
après comptage sont présentés aux figures 14 et 15. La
répartition s'est faite à partir du nombre total d'insectes
comptés sur toutes les parcelles après les traitements (Annexe
5).
Syllepte derogata
0,40%
Autres punaises
0,48%
Anomis flava
0,80%
Dysdercus sp
0,55%
podagrica sp
39,36%
Aphis gossipii
22,9%
Jassides
11,76%
Bemisia tabaci
23,73%
Figure 14: Répartition des principaux
insectes ravageurs du gombo

Altise (Podagrica decolorata) Bemisia tabaci (mouche
blanche) Jacobiasca sp (jasside)
Aphis gossypii (puceron)
Syllepte derogata
Dysdercus sp
Anomis flava
Figure 15 : Principaux insectes ravageurs
observés sur le gombo
1.3 Evaluation de l'effet des traitements sur les
insectes
Les périodes d'apparition de ces différents types
de ravageurs en fonction des stades phénologiques du gombo sont
résumées par la figure 16.

Types d'insectes
|
|
|
|
|
|
Dysdercus sp
|
|
|
|
|
|
|
|
|
Syllepte derogata
|
|
|
|
|
|
|
Autre type de punaise
|
|
|
|
|
|
Anomis flava Pucerons
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Jassides
|
|
|
|
|
|
|
|
|
|
Mouches blanches
|
|
|
|
|
|
|
|
Altises
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 28 34 40 46 52 58 64 70 76 JAS
Phase végétative phase de floraison phase de
fructification
Période d'observation
JAS : Jours Après Semis
Figure 16 : Période d'observation des
différents groupes d'insectes sur le gombo
Selon la figure 15, il ressort que les insectes qui ont
été observés en première position sont
respectivement les Altises, les Mouches blanches, les Pucerons, les Jassides,
les chenilles Anomis flava et Syllepte derogata puis viennent
enfin les punaises rouge du cotonnier (Dysdercus sp).
1.3.1 Effet des traitements sur les Altises (Podagrica
sp)
Ce groupe d'insectes a constitué 39,36% du nombre total
d'insectes observés. L'évolution des insectes sur les
différentes parcelles est quasiment identique puisqu'ils atteignent leur
pic au 52è jour après semis, sauf au niveau de T1
où ils ont un nombre très faible et constant jusqu'à la
fin du cycle (figure17a).
|
250 200 150 100 50
0
|
|
|
|
22 28 34 40 46 52 58 64 70 76
|
Population moyenne d'Altises/10
plants
J.A.S
T0: parcelle non traitée
T1: produit chimique
T2: graines de neem
T3: feuilles d'eucalyptus

Figure 17a : Evolution des populations
d'Altise au cours du cycle
JAS : Jours Après
Semis
L'analyse de variance révèle une
différence hautement significative entre les traitements
(p=0,0002<0,05). Le test post-hoc de SNK regroupe les traitements en deux
classes. La classe 1 comprend le traitement T1 et la classe 2 regroupe les
traitements T2, T3 et T0. Les parcelles traitées avec le produit
chimique ont enregistré une faible population d'altises avec une moyenne
de 2,96 individus/10plants. Par contre les parcelles traitées avec
l'extrait aqueux de graine de neem, de feuilles d'eucalyptus et les parcelles
non traitées ont quant à elles abrité un nombre important
d'altises à tous les stades de développement du gombo avec
respectivement en moyenne 113,6 ; 103,83 et 120,8 individus/10 plants (figure
17b).
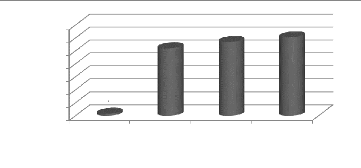
population moyenne d'Altises
140
120
100
80
40
60
20
0
T1 T3 T2 T0
a
b b
b
Traitements
Les histogrammes portant au moins une lettre en commun ne sont
pas significativement différents selon le test de
SNK au seuil de
5%
Figure 17b : Population moyenne d'Altises par
traitement
1.3.2 Effet des traitements sur les Mouches
blanches
Elles constituent 23,73% des insectes observés sur les
différentes parcelles. Leur évolution sur les différentes
parcelles est remarquable à partir du 52è jour
après semis sauf au niveau de T2 (figure 18a).
|
300 250 200 150 100 50
0
|
|
|
|
22 28 34 40 46 52 58 64 70 76
|
population moyenne de
mouche blanche/10
plants
J.A.S
T0: parcelle non traitée
T1: produit chimique
T2: graines de neem
T3: feuilles d'eucalyptus

Figure 18a : Evolution des populations de
Mouches blanches au cours du cycle
L'analyse de variance a révélé une
différence significative entre les traitements (p=0,0023<0,05). Le
test post-hoc de SNK regroupe les traitements en trois classes. La classe 1
avec les traitements T2 et T3, la classe 2 comportant T3 et T0 puis la classe 3
regroupant les traitements T0 et T1. Les parcelles traitées avec
l'extrait aqueux de graines de neem sont celles qui abritent moins de Mouches
blanches avec une moyenne de 14,23 individus/10 plants, ensuite viennent les
parcelles traitées avec les feuilles d'eucalyptus avec une moyenne de
37,90 individus/10 plants. Les parcelles traitées avec le produit
chimique ont abrité le plus grand nombre de Mouches blanches, soit en
moyenne 82,53 individus/10 plants durant toutes les observations (figure
18b).
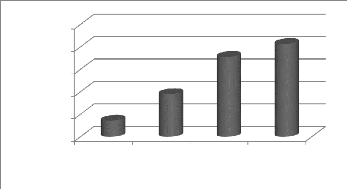
population moyenne de mouche
blanche
100
80
40
60
20
0
T2 T3 T0 T1
a
ab
bc
c
Traitements
Les histogrammes portant au moins une lettre en commun ne sont
pas significativement différents selon le test de
SNK au seuil de
5%
Figure 18b : Population moyenne de Mouches
blanches par traitement
1.3.3 Effet des traitements sur les Jassides
Les Jassides représentent 11,76% des groupes d'insectes
observés sur les différentes parcelles. Les populations
étaient croissantes au fur et à mesure que la plante
évoluait (figure 19a).
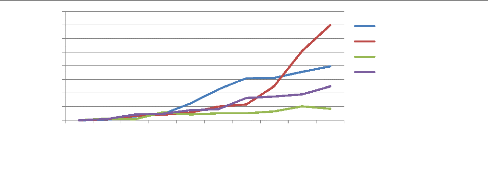
Population moyenne de
Jassides/10 plants
160
140
120
100
40
80
60
20
0
22 28 34 40 46 52 58 64 70 76 J.A.S
T0: parcelle non traitée
T1: produit chimique
T2: graines de neem
T3: feuilles d'eucalyptus
Figure 19a : Evolution des populations de
Jassides au cours du cycle
L'analyse de variance a révélé qu'il
existe une différence significative entre les traitements
(p=0,0033<0,05). Le test post-hoc de SNK regroupe les traitements en deux
classes. La classe 1 les traitements T2 et T3 et la classe 2 avecT3, T0 et T1.
Les parcelles traitées avec l'extrait aqueux de graines de neem ont une
population relativement constante durant tout le cycle du gombo. Celles
traitées avec les feuilles d'eucalyptus ont également
abrité moins de mouches blanches avec en moyenne 20,50 individus/10
plants mais un peu plus que T2 qui a une moyenne de 9,36 individus/10 plants.
Par contre les parcelles traitées avec T1 et T0 sont celles qui ont
abrité le plus grand nombre de Jassides avec une moyenne de 36,16 et
35,86 individus/10 plants (figure 19b).
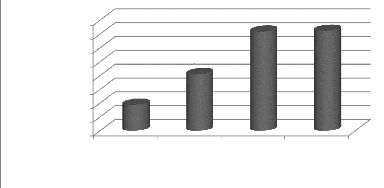
population moyenne de Jassides
40
35
30
25
20
15
10
5
0
T2 T3 T0 T1
a
ab
b b
Traitements
Les histogrammes portant au moins une lettre en commun ne sont
pas significativement différents selon le test de
SNK au seuil de
5%
Figure 19b : Population moyenne de Jassides par
traitement
1.3.4 Effet des traitements sur les Pucerons
Ce groupe d'insectes constitue 22,9% de l'effectif total des
insectes observés sur les parcelles. On constate que les parcelles
traitées avec le produit chimique n'abritent pratiquement pas de
pucerons ainsi que celles traitées avec l'extrait aqueux de graines de
neem où la population qui apparait au début du cycle chute et
tend vers zéro à la fin des traitements. Celles traitées
avec les feuilles d'eucalyptus comptent également un peu moins de
pucerons par rapport à T0 (figure 20a).
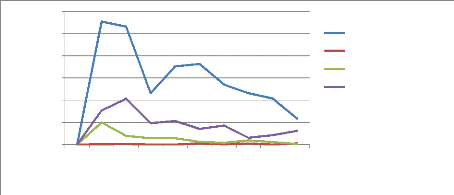
Population moyenne de
pucerons/10 plants
300
250
200
150
100
50
0
22 28 34 40 46 52 58 64 70 76
J.A.S
T0: parcelle non traitée
T1: produit chimique
T2: graines de neem
T3: feuilles d'eucalyptus
Figure 20a : Evolution des populations de
Pucerons au cours du cycle
L'analyse de variance révèle qu'il y a une
différence significative entre les traitements (p=0,000002<0,05). Le
test post-hoc de SNK regroupe les traitements en trois classes. La classe 1
comprend les traitements T1 et T2, la classe 2 avec le traitement T3 puis la
classe 3 avec le traitement T0 (figure 20b).
population moyenne de pucerons
160
140
120
100
40
80
60
20
0
T1 T2 T3 T0
a
a
b
c
Traitements
Les histogrammes portant au moins une lettre en commun ne sont
pas significativement différents selon le test de
SNK au seuil de
5%
Figure 20b : Population moyenne de Pucerons
par traitement
1.3.5 Effet des traitements sur les populations de
Dysdercus
Ces insectes qui ont été observés
à partir du 52è jour après semis et
représentent 0,55% du nombre total d'insectes observés.
Après avoir atteint leur pic douze jours après le début de
leur observation, le nombre de Dysdercus diminue
considérablement au niveau des parcelles traitées avec T1 et T2.
Par contre sur les parcelles traitées avec T3 et T0, les populations de
ces insectes n'ont fait qu'augmenter (figure 21a).
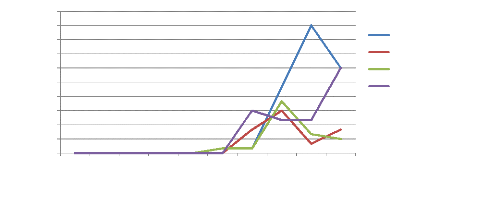
9
8
7
6
5
4
3
2
Population moyenne de
Dysdercus/10
plants
1
0
10
J.A.S
22 28 34 40 46 52 58 64 70 76
T0: parcelle non traitée
T1: produit chimique
T2: graines de neem
T3: feuilles d'eucalyptus
Figure 21a : Evolution des populations de
Dysdercus au cours du cycle
L'analyse de variance révèle qu'il y a une
différence significative entre les traitements (p=0,0231<0,05). Le
test de SNK regroupe les traitements en deux classes. La classe 1 avec les
traitements T2, T1 et T3 et la classe 2 comportant les traitements T3 et T0
(figure 21b).
population moyenne de Dysdercus
0,5
0,0
2,5
2,0
1,5
1,0
T2 T1 T3 T0
a a
a b
b
Traitements
Les histogrammes portant au moins une lettre en commun ne sont
pas significativement différents selon le test de
SNK au seuil de
5%
Figure 21b : Population moyenne de
Dysdercus par traitement
1.3.6 Effet des traitements sur les autres punaises
Nous avons constaté la présence d'un groupe de
punaises à partir du 40 è jours après semis que
nous avons regroupé ; il s'agit d'Asparvia armigera, Nezara
viridula, Clétsus spp, la Grande punaise noire et un genre
de punaise non identifiée. Elles ont évolué en dents de
scie pendant tout le cycle (figure 22a).
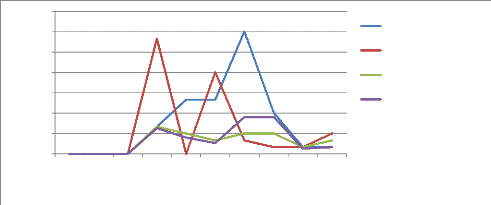
Population moyenne des autres
punaises/10
plants
4
7
6
5
3
0
2
1
22 28 34 40 46 52 58 64 70 76
J.A.S
T0: parcelle non traitée
T1: produit chimique
T2: graines de neem
T3: feuilles d'eucalyptus
Figure 22a : Evolution des populations des
autres types de punaise au cours du cycle
population moyenne des autres types
de punaises/10
plants
8,0
7,0
6,0
5,0
4,0
3,0
a
2,0
a a
a
1,0
0,0
T2 T3 T1 T0
Traitements
L'analyse de variance indique qu'il n'y a pas de
différence significative entre les traitements (p=0,6091 > 0,05)
(figure 22b).
1.3.7 Effet des traitements sur Syllepte derogata
Contrairement aux Altises, Pucerons, Jassides et Mouches
blanches, ces chenilles ont étéobservées
à partir du 46è jour après semis (figure
23a).
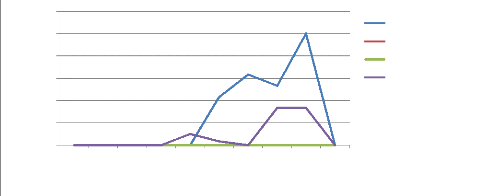
Population moyenne de Syllepte
derogata/10
plants
12
10
4
8
0
6
2
22 28 34 40 46 52 58 64 70 76
J.A.S
T0: parcelle non traitée
T1: produit chimique
T2: graines de neem
T3: feuilles d'eucalyptus
Figure 23a : Evolution des populations de
Syllepte derogata au cours du cycle
L'analyse de variance indique qu'il n'y a pas de
différence significative entre les traitements
(p=0,1644 > 0,05)
(figure 23b).
population moyenne de Syllepte
drogata/10
plants
a
a
Traitements
T1 T2 T3 T0
14,0
12,0
10,0
8,0
6,0
4,0
2,0
0,0
a a
Figure 23b : Population moyenne de Syllepte
derogata par traitement
1.3.8 Effet des traitements sur Anomis flava
Ce type de chenille arpenteuse a été
observée le 34è jour après semis (figure 24a).
Elles constituaient 0,80% de l'ensemble des insectes observés sur les
parcelles. Les pics au niveau de T0 et T3 sont atteints à partir du
58è jour avant de connaître une forte
régression. Par contre avec T1 et T2 les populations de ces chenilles
sont restées constantes.
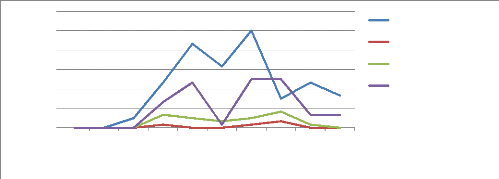
Population moyenne d'Anomis
flava/10
plants
12
10
4
8
0
6
2
22 JAS 28 34 40 46 52 58 64 70 76
J.A.S
T0: parcelle non traitée
T1: produit chimique
T2: graines de neem
T3: feuilles d'eucalyptus
Figure 24a : Evolution des populations
d'Anomis flava en fonction des traitements au cours
du cycle
L'analyse de variance montre qu'il y a une différence
significative entre les traitements (p=0,000085<0,05). Le test post-hoc de
SNK regroupe les traitements en trois classes :
Classe 1 (T1 et T2), classe 2 (T3) puis classe 3 (T0). En
effet les parcelles traitées avec T1 et T2 abritent en moyenne moins
d'une chenille de type Anomis flava, soit respectivement en moyenne
0,13 et 0,60 Anomis flava / 10 plants. Ensuite viennent celles
traitées avec T3 dont les plantes abritent 2 fois moins de chenilles par
rapport à T0 soit en moyenne deux (2) Anomis flava / 10 plants
contre quatre (4) / 10 plantes observée (figure 24b).
population moyenne d'Anomis
(lava/10
plants
4
0
5
3
2
1
T1 T2 T3 T0
a
a
b
c
Traitements
Les histogrammes portant au moins une lettre en commun ne sont
pas significativement différents selon le test de
SNK au seuil de
5%
Figure 24b : Population moyenne d'Anomis
flava par traitement
poids moyen des fruits (g) par
parcelle
elementaire
350
300
250
200
150
100
50
0
T0 T1 T2 T3
a
bon fruits mauvais fruits
b
a a
traitements
1.4. Production
1.4.1 Influence des traitements sur la production de
bons fruits
La production a connu une phase de croissance
régulière à tous les niveaux jusqu'à atteindre un
pic au 58è jours après semis, puis a progressivement
baissé jusqu'au 70è jours après semis (figure
25a).
poids moyen de bon fruits obtenus
(g)/parcelle
elementaire
450
400
500
350
300
250
200
150
100
50
0
49JAS 52JAS 55JAS 58JAS 61JAS 64JAS 67JAS 70JAS
T0
T1
T2
T3
Figure 25a : Evolution de la production de
bons fruits au cours du cycle
L'analyse de variance révèle qu'il y a une
différence significative entre les productions de chaque traitement
(p=0,016348<0,05). Le test post hoc de SNK regroupe les traitements en deux
classes. La classe 1 avec le traitement T1 et la classe 2 comportant les
traitements T3, T2 et T0. En effet, la production obtenue sur les parcelles
traitées avec le produit chimique T1 vaut environ deux fois celle
obtenue sur les parcelles traitées avec T2, de même que sur les
parcelles traitées avec T3 et T0 (figure 25b).
1.4.2 Relations entre les variables : les populations
d'insectes, la production de bons fruits et des mauvais fruits.
L'analyse en composante principale (ACP) a permis de
constituer 3 facteurs principaux qui représentent 84,39% de variance
totale; soient 49,77%; 26,14% et 8,48% respectivement pour F1, F2 et F3. Le
facteur 1 est fortement corrélé avec les Altises, les Pucerons,
les Dysdercus et la chenille Anomis flava, alors que le
facteur 2 est fortement corrélé avec les Aleurodes et les
Jassides. Le facteur 3 présente une faible corrélation avec
toutes les variables (Tableau VII).
Tableau VII: Contribution (poids factoriel) des variables
à la formation des facteurs; valeurs propres et variances.
|
Variables / Facteurs
|
F 1
|
F 2
|
F 3
|
|
Altises
|
0,805877
|
0,538944
|
-0,099106
|
|
Aleurodes
|
-0,001494
|
-0,847925
|
0,408336
|
|
Jassides
|
0,123318
|
-0,907655
|
-0,057652
|
|
Pucerons
|
0,877404
|
-0,270659
|
-0,065752
|
|
Dysdercus sp
|
0,806757
|
-0,331450
|
0,215682
|
|
Autres type de punaises
|
0,247313
|
-0,528360
|
-0,717217
|
|
Syllepte derogata
|
0,775651
|
-0,363283
|
0,163300
|
|
Anomis flava
|
0,901501
|
-0,220384
|
-0,075838
|
|
Poids de bons fruits
|
-0,663944
|
-0,556728
|
-0,242455
|
|
Poids de mauvais fruits
|
0,651617
|
0,648707
|
-0,108377
|
|
|
|
|
|
Valeur propre cumulée
|
4,977
|
7,591
|
8,439
|
|
Variance (%) cumulée
|
49,77
|
75,91
|
84,39
|
Par projection des variables dans le plan I (F1x F2), nous avons
des corrélations positives entre les différents groupes
d'insectes (Altises, Anomis flava, Pucerons et Dysdercus) et
la production de mauvais fruits. Cependant, les corrélations sont
négatives entre toutes les autres variables et la production de bons
fruits (Figure 26). Par conséquent, au fur et à mesure que les
insectes augmentent, la production de bons fruits diminue.
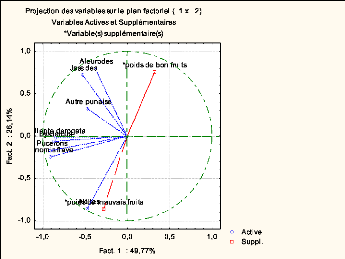
Figure 26 : Représentation des insectes
ravageurs et des différentes productions sur le plan
F1xF2
Lorsque nous projetons dans un même plan I (F1x F2) les
traitements (T0, T1, T2, T3), il ressort que les quatre traitements
appliqués sont distincts les uns des autres (figure 27).
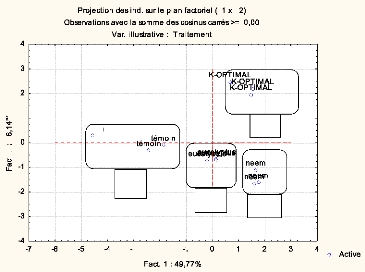
er
cu
ns
av
Ose
ustratv
T0
ept
a ly
S
T3
T2
T1
Figure 27 : Projection des différents traitements dans le
plan F1xF2
2. Discussion
+ Produit chimique
Le produit chimique a montré son efficacité sur
plus de la moitié des insectes pouvant causer de véritable danger
à la culture. Ces résultats nous amènent à dire que
les différentes matières actives contenues dans ce produit
(Lambda-cyhalotrine 15g/l et l'Acétamipride 20g/l) qui agissent en
perturbant le fonctionnement du système nerveux des insectes, sur la
région post-synaptique en bloquant les récepteurs à
l'acétylcholine ont certainement entraîné une paralysie ou
la mort de ces derniers (Altise, Pucerons, Dysdercus, Anomis
flava). Par contre, pour ce qui concerne la non efficacité du
produit sur les jassides et les mouches blanches, l'on pourrait l'expliquer par
le nombre croissant d'insectes qui ont développé une certaine
résistance face aux différents groupes d'insecticides comme
indiquée par la figure présentant le nombre croissant
d'adaptation à des pesticides chez les insectes, les pathogènes
de plantes et les adventices (Holt et Lebaron, 1990). Aussi, il est bien de
rappeler que ces cas de résistance de ces deux types d'insectes ont
été rencontrés sur le coton au Soudan au début des
années 1980 et sur le riz en Extrême Orient et dans le Sud Est
asiatique (Anonyme, 2012).
+ Extrait aqueux de graine de neem
L'extrait aqueux de neem s'est également montré
efficace sur plus des 2/3 des insectes observés ; plus
précisément sur les mouches blanches, les jassides, les pucerons,
les Dysdercus sp, Syllepte derogata et Anomis flava.
Par contre il s'est montré inefficace sur les altises. Des
résultats similaires ont été rapportés par To Bi en
2006, Bodji et Yao en 2007, Kodro en 2008, Yao en 2010 et Gnago et al
en 2010. Selon Youdeowei (2004), les feuilles et graines de neem contiennent
une substance (l'azadirachtine) qui est efficace sur les insectes à
corps mou à l'exemple des jeunes chenilles, des pucerons et des
aleurodes. Et plus encore, nous savons qu'il agit comme inhibiteur de
croissance des insectes. Sans les tuer immédiatement, il modifie leur
croissance et les empêche de se reproduire. Ils ne peuvent plus se
nourrir et finissent par mourir. Ceci pourrait expliquer l'impact de l'extrait
aqueux de graines de neem sur ces différents groupes d'insectes lors de
nos expérimentations (les mouches blanches, les Jassides, les Pucerons,
les Dysdercus sp, Syllepte derogata et Anomis flava). Par
contre il n'a pas d'effet sur les Altises ; ceci peut s'expliquer par le fait
que contrairement aux autres insectes à corps mou ce type d'insecte est
un coléoptère possédant des ails très durs donc
l'extrait n'a certainement pas pu entrer en contact avec les parties sensible
de l'insecte. Il peut également être dû au fait que
l'azadiractine a un effet résiduaire très court (Regnault-Roger,
2008).
+ Extrait aqueux de feuilles d'eucalyptus
L'extrait aqueux de feuilles d'eucalyptus a une influence
très peu remarquée sur l'ensemble des groupes d'insectes
observés.
Cependant, les populations de mouches blanche et de jassides
sont restées relativement moins denses sur les parcelles traitées
avec les feuilles d'eucalyptus par rapport à celles traitées avec
le produit chimique et aux parcelles non traitées (T0) durant tout le
cycle. Les populations d'altise, de Dysdercus sp, de Syllepte
derogata et d'Anomis flava n'ont pu être
contrôlées par cet extrait. Le cinéol ou eucalyptol,
principe actif contenu dans les feuilles d'eucalyptus à la dose de 150 g
de feuilles pour 5 l d'eau semble ne pas contrôler les principaux
insectes ravageurs du gombo. La majorité des études menées
sur le cinéol ou eucalyptol, principe actif de l'eucalyptus montre qu'il
a des effets sur les insectes à forte dose (Anonyme, 2012). Par ailleurs
son efficacité est plus montrée sur les affections respiratoires
chez l'homme (sinusite, asthme etc.).
+ Production de bons fruits
Selon les résultats obtenus, seules les parcelles
traitées avec le produit chimique marquent la différence en
termes de production de bons fruits, soit deux fois la production moyenne de
bons fruits obtenue sur les parcelles traitées avec les autres produits.
Ce résultat pourrait s'expliquer par le fait qu'au cours des
traitements, seul le produit chimique s'est avéré efficace contre
les principaux insectes ravageurs des organes fructifères du gombo
(Dysdercus sp, Altise) observé lors de
l'expérimentation.
+ Limite de l'étude
La présente étude s'est heurtée à
quelques difficultés que nous avons énumérées.
- Le manque d'information sur la surface à traiter, selon
la dose recommandée pour les feuilles d'eucalyptus (150 g de feuilles
pour 5 l d'eau) ;
- Le manque d'information par rapport à une étude
similaire, c'est-à-dire qui a traité de l'utilisation d'extrait
aqueux de feuilles d'eucalyptus ;
- Le manque de moyen technique ne nous a pas permis de
contrôler l'état sanitaire des graines de neem vu que ces graines
étaient séchées à l'air libre ;
- L'étude n'a pas pris en compte le niveau de
fertilité du sol avant de commencer les travaux de mise en place et
d'entretien de la culture.
IV. SUGGESTIONS
Pour l'amélioration des résultats au prochain
essai, nous suggérons :

Une analyse des différentes quantités de bouillies
pour la détermination de leurs compositions chimiques et leur indice de
toxicité ;
Une extension du champ d'action des tests, en prenant en
compte certains insectes utiles, afin de voir la sélectivité et
l'absence de toxicité sur les espèces non visées ; La
reprise de l'essai avec plusieurs doses d'extraits aqueux d'eucalyptus, ou
plutôt s'intéresser à l'huile essentielle puisque des
études ont été menées avec cette composante de la
plante ;
Une analyse du sol, afin de rendre encore plus claire les
résultats et analyses de la production ;
Le compostage de la poudrette de parc et de la litière
quelques mois avant l'apport en plantation ;
La recherche de sites sûrs, pour la récolte des
graines de neem et des feuilles d'eucalyptus ;
L'amélioration des techniques d'extraction des
produits.
CONCLUSION
L'initiative qu'a eu le laboratoire d'entomologie, dans la
recherche d'alternative aux insecticides chimique, nous a permis de tester
l'efficacité des extraits aqueux de graines de neem et des feuilles
d'eucalyptus sur les insectes ravageurs du gombo en comparaison avec un
insecticide chimique que l'on retrouve sur nos marchés.
Cette étude a montré que l'insecticide chimique
qui a pour substance active la Lambdacyhalotrine 15g/l et l'Acétamipride
20g/l, contrôle la majorité des insectes observés,
principalement les altises, les pucerons, les punaises rouges du cotonnier et
la chenille Anomis flava. Mais certains insectes tels les mouches
blanches et les jassides n'ont pas pu être contrôlés par ce
produit.
L'extrait aqueux de graines de neem qui contient en son sein
l'azadirachtine contrôle luiaussi la majeur partie des
insectes à l'exception des altises.
L'extrait aqueux de feuilles d'eucalyptus a lui, une
légère influence sur les mouches blanche, les jassides et
très faible sur les pucerons. Mais de manière
générale, il n'a pas d'influence remarquée sur l'ensemble
des groupes d'insectes observés.
Comme l'ont préconisées les études
antérieures, la dose efficace de graines de neem pour contrôler
les insectes serait de 800 g dans 10 l d'eau pour une superficie de 400
m2.
Pour les feuilles d'eucalyptus, il serait peut être
souhaitable d'augmenter la dose pour voir son effet dans les études
à venir étant donné que la dose utilisée (150 g / 5
l) a montré quelques effets, plus où moins positifs.
La plus grande production de bons fruits a été
obtenue sur les parcelles traitées avec le produit chimique. Ce qui veut
dire que, des efforts restent à faire concernant la recherche
d'alternative aux produits chimiques classique. Il serait peut être
souhaitable de tester d'autres plantes capables d'éliminer les
principaux insectes ravageurs du gombo afin que la lutte avec les extraits
à base de végétaux soit effective.
REFERENCES BIBLIOGRAPHIQUES ACTA, 2010. Index
phytosanitaire ACTA 2010, 46e édition, pp136 -142.
Anonyme a :
www.neemfoundation.org,
consulté le 21/08/2011.
Anonyme b : www. Propriété du
neem : azadirachtine A, consulté le 13 /02/2012.
Anonyme c : http: //
fr.Wikipedia.org/eucalyptus,
consulté le 24/11/2011. Anonyme d :
http://www.cnrtl.fr/definition/gombo
, consulté le 22/08/2011.
Anonyme e : Ministère de l'Agriculture,
2009. Liste actualisée des pesticides homologués et
autorisés en Côte d'Ivoire.
Anonyme f : www. Insecticide bio contre tous
les insectes, consulté le 22/08/2011.
Appert J., Deuse J., 1988. Insectes nuisibles
aux cultures vivrières et maraîchères, volume 1 et 2,
Editions Maisonneuve et Larose. Paris, pp16-27 et pp117-134.
Bernard J.R. Philogène, Cathérine
Regnault-Roger et Charles Vincent, 2008. Biopesticides d'origine
végétale : bilan et perspectives. In
WlSh-tIPIOI-TOWLIJICITYpJpOl,
2e édition, Edition Tec & Doc, pp1-24.
Bodji
J-L. et Yao K.
A., 2007. Etude de l'efficacité des extraits
végétaux de neem (Azadirachta indica Juss) et de papayer
(Carica papaya L.) dans la lutte contre les ravageurs des cultures
maraîchères. Mémoire de fin de cycle pour l'obtention du
diplôme d'Ingénieur des Techniques Agricoles, Ecole
supérieure d'Agronomie de Yamoussoukro, 56p.
Bruneton J., 1999. Pharmacognosie. 3e
édition, Editions Tec & Doc - Lavoisier, Paris.
Declert C., 1990. Manuel de phytopathologie
maraîchère tropicale : cultures de Côte d'Ivoire (le gombo),
Edition DIDACTIQUE, p123.
Gnago J. A., Danho M., Atcham Agneroh T., Fofana I. K.
et Kohou A.G., 2010. Efficacité des extraits de neem
(Azadirachta indica) et de papayer (Carica papaya) dans la
lutte contre les insectes ravageurs du gombo (Abelmoschus esculentus)
et du chou (Brassica oleracea) en Côte d'Ivoire. Int. J.
Biol. Chem. Sci.4(4): 953-966, August 2010.
Houenou P., 1996. De la forêt aux
champs en Côte d'Ivoire : améliorer la gestion des ressources,
améliorer la santé.
« http ://
www.crdi.ca/uploads/user-S/10789323781Ecosante1CotedIvoiref.pdf.
», consulté le 22/08/2011.
Hubertus Kleeberg, 2008. Le neem, un agent de
contrôle biologique à base d'extraits végétaux
in Biopesticides d'origine végétale, 2e
édition, Editions Tec & Doc, p14.
Isman M.B., 1997. Neem insecticides.
Pesticide outlook, 8p.
Isman M.B., 2005. Botanical insecticides,
deterrents and repellents in modern agriculture and increasingly regulated
world. Annu Rev Entomol, 50p.
Huignard, Lapied, Dugravot, Magnin-Robert et
Kétoh, 2008. Modes d'actions neurotoxiques des
dérivés soufrés et de certaines huiles essentielles et
risques liés à leur utilisation. In Biopesticides d'origine
végétale, 2e édition, Editions Tec &
Doc, p225.
Jeroen B., Koomen I., Joep.V.L de Jeude. et
Oudejans.J., 2004. Les pesticides :
composition, utilisation et risques. In serie Agrodok 29, 1 ere
édition. Editions Digigrafi & wageningen, Pays Bas. 124p.
Kidiera M., 1991. Evaluation des peuplements
d'eucalyptus en milieu rural dans la région de Korhogo. Mémoire
de fin de cycle pour l'obtention du diplôme d'Agronomie Approfondie,
Ecole supérieure d'Agronomie de Yamoussoukro, 56p + annexes.
Kleeberg H., 2006. Demands for plants protection
products-Risk assessment botanicals and semiochemicals. REBECA workshop.
fin de cycle pour l'obtention du diplôme d'Ingénieur
des Techniques Agricoles, Ecole supérieure d'Agronomie de Yamoussoukro,
56p.
Lieutaghi P., Eucalyptus in
Encyclopédie Universalis 2008, version 13.
Mills C, Cleary B.J, Gilmer J.F. et Walsh J.J.,
2004. Inhibition of acetylcholinesterase by tea tree oil. J Pharm Pharmacol,
56p (pp375-379).
Regnault-Roger C., 2008. Recherche de
nouveaux biopesticides d'origine végétale à
caractère insecticide : démarche méthodologique et
application aux plantes aromatiques méditerranéennes. In
Biopesticides d'origine végétale, 2e
édition, Edition Tec & Doc, pp25- 49.
Regnault-Roger C., 2005a. Molécules
allélochimiques et extraits végétaux dans la protection
des plantes : nature, rôle et bilan de leur utilisation au XXe
siècle. In Regnault-Roger C. enjeux phytosanitaires pour
l'agriculture et l'environnement, Editions Tec & Doc - Lavoisier,
Paris, 625-650.
Shaaya E, Ravid U, Paster N, Juven B, Lisman U et
Pissarev V., 1991. Fumigant toxicity of essential oils against four
majors stored-products insects. J Chem Ecol, 173p (pp499-504).
Siemonsma J.S. et Kouamé C., 2004.
Abelmoschus esculentus (L) Moench in Ressources
végétales de l'Afrique Tropicale, tome 2 : Légumes.
Grubben, G.J.H & Denton O.A. Eds pp25-30.
Siemonsma J.S., 1982. La culture du gombo
(Abelmoschus spp), légume fruit tropical avec
référence spéciale à la Côte d'Ivoire,
297p.
To Bi T. J-L., 2006. Contribution à
l'étude de l'efficacité des extraits végétaux en
culture maraîchères : cas d'Azadirachta indica Juss et de
Carica papaya L. Mémoire de fin de cycle pour l'obtention du
diplôme d'Ingénieur des Techniques Agricoles, Ecole
supérieure d'Agronomie de Yamoussoukro, 66p.
Yao N. D., 2010. Etude de l'efficacité
des extraits de feuilles et graines de neem (Azadirachta indica Juss)
sur les insectes du gombo (Abelmoschus esculentus L.) : Altises,
chenilles et Punaises. . Mémoire de fin de cycle pour l'obtention du
diplôme d'Ingénieur Agronome, EFCPC de l'INP-HB (Yamoussoukro),
60p.
ANNEXES
i
ANNEXE 1
|
DATE.
|
FICHE DE NOTATION DES INSECTES DU GOMBO
|
|
|
~~~~~~~~~~~~~~~
|
BLOC~~~~~ ~~~~ OBSERVATION
|
|
punaise
|
chenilles
|
|
TRAIT
|
POQ
|
ALTI
|
MB
|
JASS
|
PUC
|
Dysder
|
Aspar
|
Nez
|
autr
|
Anom
|
sylep
|
autr
|
cocc
|
saut
|
coch
|
ZV
|
|
TO
|
P1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1
|
P1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2
|
P1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T3
|
P1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ii
ANNEXE 2
FICHE DE PESAGE DES FRUITS DU GOMBO
DATE. Récolte
|
TRAITEMENTS
|
MASSE (g)
|
|
BLOC 1
|
BLOC 2
|
BLOC 3
|
TOTAL
|
|
T 0
|
|
|
|
|
|
T 1
|
|
|
|
|
|
T 2
|
|
|
|
|
|
T 3
|
|
|
|
|
|
TOTAL
|
|
|
|
|
DATE. Récolte
|
TRAITEMENTS
|
MASSE (g)
|
|
BLOC 1
|
BLOC 2
|
BLOC 3
|
TOTAL
|
|
T 0
|
|
|
|
|
|
T 1
|
|
|
|
|
|
T 2
|
|
|
|
|
|
T 3
|
|
|
|
|
|
TOTAL
|
|
|
|
|
ANNEXE 3 :
III
EVOLUTION DES POPULATIONS D'INSECTES DANS LE TEMPS
ALTISE
Traitement 22 28 34 40 46 52 58 64 70 76 JAS
|
T0: parcelle non
|
|
|
|
|
|
|
|
|
|
|
|
traitée
|
35,33
|
44
|
96,66
|
122,33
|
143
|
230,33
|
208
|
152
|
95
|
82,33
|
T1: produit chimique
|
2,33
|
1,33
|
6,33
|
4,66
|
1,33
|
1
|
4
|
3
|
4,33
|
1,33
|
T2: graines de neem
|
26
|
54
|
114,66
|
140
|
165,33
|
193,33
|
142
|
96,33
|
97
|
107,33
|
T3: feuilles d'eucalyptus
|
|
30
|
52,66
|
114,33
|
122
|
133,66
|
182,33
|
136,66
|
108,66
|
82
|
76
|
|
MOUCHE BLANCHE
Traitement 22 28 34 40 46 52 58 64 70 76 JAS
|
T0: parcelle non traitée
|
0
|
23
|
24
|
24
|
42,66
|
100,33
|
77,66
|
165,33
|
154,66
|
99
|
T1: produit chimique
|
0
|
22,66
|
21,66
|
18,33
|
17,33
|
85,66
|
60
|
142,33
|
212
|
245,33
|
T2: graines de neem
|
0
|
0,66
|
16,33
|
14,66
|
19
|
23,66
|
20,33
|
22,66
|
17,66
|
7,33
|
T3: feuilles d'eucalyptus
|
|
0
|
16,33
|
36,66
|
22
|
40,33
|
54,33
|
62,33
|
46,66
|
68
|
32,33
|
|
JASSIDE
Traitement 22 28 34 40 46 52 58 64 70 76 JAS
|
T0: parcelle non traitée
|
0
|
0,66
|
5,66
|
9
|
24,66
|
45,33
|
61,33
|
62
|
71
|
79
|
T1: produit chimique
|
0
|
1,33
|
6,33
|
8
|
11,33
|
20
|
23,33
|
50
|
101,66
|
139,66
|
T2: graines de neem
|
0
|
2,33
|
1,33
|
11,66
|
8,33
|
10
|
10
|
13
|
20,33
|
16,66
|
T3: feuilles d'eucalyptus
|
|
0
|
1,66
|
8,33
|
9,33
|
14,66
|
16
|
32,66
|
34,66
|
38
|
49,66
|
|
PUCERON
Traitement 22 28 34 40 46 52 58 64 70 76 JAS
|
T0: parcelle non traitée
|
0
|
277,33
|
265,66
|
115,33
|
175,66
|
181,33
|
134,66
|
115,33
|
103,33
|
58,66
|
T1: produit chimique
|
0
|
0,66
|
1,33
|
0
|
0
|
2,33
|
0,33
|
2
|
0
|
2,66
|
T2: graines de neem
|
0
|
49,66
|
19,66
|
14,33
|
14
|
6
|
4
|
9,33
|
5,33
|
1,33
|
T3: feuilles d'eucalyptus
|
|
0
|
77
|
103,33
|
48,33
|
53
|
35
|
42,66
|
15
|
21
|
30,66
|
|
DYSDERCUS
Traitement 22 28 34 40 46 52 58 64 70 76 JAS
|
T0: parcelle non traitée
|
0
|
0
|
0
|
0
|
0
|
0,33
|
0,33
|
4,66
|
9
|
6
|
T1: produit chimique
|
0
|
0
|
0
|
0
|
0
|
0
|
1,66
|
3
|
0,66
|
1,66
|
T2: graines de neem
|
0
|
0
|
0
|
0
|
0
|
0,33
|
0,33
|
3,66
|
1,33
|
1
|
T3: feuilles d'eucalyptus
|
|
0
|
0
|
0
|
0
|
0
|
0
|
3
|
2,33
|
2,33
|
6
|
|
AUTRE TYPE DE PUNAISE
Traitement 22 28 34 40 46 52 58 64 70 76 JAS
|
T0: parcelle non
|
|
|
|
|
|
|
|
|
|
|
|
traitée
|
0
|
0
|
0
|
1,33
|
2,66
|
2,66
|
6
|
2
|
0,33
|
0,33
|
T1: produit chimique
|
0
|
0
|
0
|
5,66
|
0
|
4
|
0,66
|
0,33
|
0,33
|
1
|
T2: graines de neem
|
0
|
0
|
0
|
1,33
|
1
|
0,66
|
1
|
1
|
0,33
|
0,66
|
T3: feuilles d'eucalyptus
|
|
0
|
0
|
0
|
1,26
|
0,8
|
0,53
|
1,8
|
1,8
|
0,26
|
0,33
|
|
SYLEPTA
Traitement 22 28 34 40 46 52 58 64 70 76 JAS
|
T0: parcelle non
|
|
|
|
|
|
|
|
|
|
|
|
traitée
|
0
|
0
|
0
|
0
|
0
|
4,33
|
6,33
|
5,33
|
10
|
0
|
T1: produit chimique
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
T2: graines de neem
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
T3: feuilles d'eucalyptus
|
|
0
|
0
|
0
|
0
|
1
|
0,33
|
0
|
3,33
|
3,33
|
0
|
|
Altise
|
Traitement
|
Moyenne
|
1
|
2
|
|
T1
|
2,9667
|
|
****
|
|
T3
|
103,8333
|
****
|
|
|
T2
|
113,6000
|
****
|
|
|
T0
|
120,8000
|
****
|
|
|
N
|
moyenne
|
ecartype
|
|
total
|
12
|
85,3000
|
52,52871
|
|
T0
|
3
|
120,8000
|
21,05137
|
|
T1
|
3
|
2,9667
|
0,81445
|
|
T2
|
3
|
113,6000
|
28,97464
|
|
T3
|
3
|
103,8333
|
10,83990
|
|
Mouche blanche
|
|
Traitement
|
Moyenne
|
1
|
2
|
3
|
|
T2
|
14,23333
|
****
|
|
|
|
T3
|
37,90000
|
****
|
****
|
|
|
T0
|
71,06667
|
|
****
|
****
|
|
T1
|
82,53333
|
|
|
****
|
|
Mouche blanche
|
|
Niv.
Facteur
|
|
|
N
|
Moyenne
|
Ecart-Ty
|
|
TOTAL
|
12
|
51,43333
|
32,18931
|
|
T0
|
3
|
71,06667
|
21,56394
|
|
T1
|
3
|
82,53333
|
27,77091
|
|
T2
|
3
|
14,23333
|
1,67730
|
|
T3
|
3
|
37,90000
|
8,96047
|
ANOMIS
Traitement 22 JAS 28 34 40 46 52 58 64 70 76 JAS
|
T0: parcelle non traitée
|
0
|
0
|
1
|
4,66
|
8,66
|
6,33
|
10
|
3
|
4,66
|
3,33
|
T1: produit chimique
|
0
|
0
|
0
|
0,33
|
0
|
0
|
0,33
|
0,66
|
0
|
0
|
T2: graines de neem
|
0
|
0
|
0
|
1,33
|
1
|
0,66
|
1
|
1,66
|
0,33
|
0
|
T3: feuilles d'eucalyptus
|
|
0
|
0
|
0
|
2,66
|
4,66
|
0,33
|
5
|
5
|
1,33
|
1,33
|
|
ANNEXE 4
TEST DE SNK MOYENNE ET ECART-TYPE
vi
|
Niv.
Facteur
|
Jasside
|
|
N
|
Moyenne
|
Ecart-Ty
|
|
12
|
25,47500
|
13,11197
|
|
T0
|
3
|
35,86667
|
7,28858
|
|
T1
|
3
|
36,16667
|
8,91871
|
|
T2
|
3
|
9,36667
|
1,77858
|
|
T3
|
3
|
20,50000
|
7,06824
|
|
Jasside
|
|
|
traitement
|
moyenne
|
1
|
|
2
|
|
|
T2
|
9,36667
|
|
|
|
****
|
|
T3
|
20,50000
|
|
****
|
|
****
|
|
T0
|
35,86667
|
|
****
|
|
|
|
T1
|
36,16667
|
|
****
|
|
|
|
Puceron
|
|
traitement
|
Moyenne
|
1
|
2
|
3
|
|
T1
|
0,9333
|
****
|
|
|
|
T2
|
12,3667
|
****
|
|
|
|
T3
|
42,6000
|
|
****
|
|
|
T0
|
142,7333
|
|
|
****
|
|
Dysdercus
|
|
|
traitement
|
Moyenne
|
1
|
|
2
|
|
|
T2
|
0,666667
|
|
****
|
|
|
|
T1
|
0,700000
|
|
****
|
|
|
|
T3
|
1,366667
|
|
****
|
|
****
|
|
T0
|
2,033333
|
|
|
|
****
|
|
Niv.
Facteur
|
Puceron
|
|
N
|
Moyenne
|
Ecart-Ty
|
|
TOTAL
|
12
|
49,6583
|
59,27096
|
|
T0
|
3
|
142,7333
|
9,34897
|
|
T1
|
3
|
0,9333
|
0,35119
|
|
T2
|
3
|
12,3667
|
8,36082
|
|
T3
|
3
|
42,6000
|
21,16530
|
|
Niv.
Facteur
|
Dysdercus
|
|
N
|
Moyenne
|
Ecart-Ty
|
|
Total
|
12
|
1,191667
|
0,711539
|
|
T0
|
3
|
2,033333
|
0,802081
|
|
T1
|
3
|
0,700000
|
0,173205
|
|
T2
|
3
|
0,666667
|
0,251661
|
|
T3
|
3
|
1,366667
|
0,404145
|
|
AUTRE TYPE DE PUNAISE
|
|
|
|
Moyenne
|
1
|
|
T2
|
0,600000
|
****
|
|
T3
|
0,866667
|
****
|
|
T1
|
1,200000
|
****
|
|
T0
|
1,533333
|
****
|
|
Niv.
Facteur
|
AUTRE TYPE DE PUNAISE
|
|
N
|
Moyenne
|
Ecart-Ty
|
|
Total
|
12
|
1,050000
|
0,831756
|
|
T0
|
3
|
1,533333
|
0,378594
|
|
T1
|
3
|
1,200000
|
1,646208
|
|
T2
|
3
|
0,600000
|
0,360555
|
|
T3
|
3
|
0,866667
|
0,288675
|
|
SYLEPTA
|
|
traitement
|
Moyenne
|
1
|
|
T1
|
0,000000
|
****
|
|
T2
|
0,000000
|
****
|
|
T3
|
0,800000
|
****
|
|
T0
|
2,600000
|
****
|
|
ANOMIS
|
|
traitement
|
Moyenne
|
1
|
2
|
3
|
|
T1
|
0,133333
|
****
|
|
|
|
T2
|
0,600000
|
****
|
|
|
|
T3
|
2,033333
|
|
****
|
|
|
T0
|
4,166667
|
|
|
****
|
|
Niv.
Facteur
|
ANOMIS
|
|
N
|
Moyenne
|
Ecart-Ty
|
|
Total
|
12
|
1,733333
|
1,706849
|
|
T0
|
3
|
4,166667
|
0,850490
|
|
T1
|
3
|
0,133333
|
0,057735
|
|
T2
|
3
|
0,600000
|
0,264575
|
|
T3
|
3
|
2,033333
|
0,665833
|
|
Niv.
Facteur
|
SYLEPTA
|
|
N
|
Moyenne
|
Ecart-Ty
|
|
Total
|
12
|
0,850000
|
1,647312
|
|
T0
|
3
|
2,600000
|
2,787472
|
|
T1
|
3
|
0,000000
|
0,000000
|
|
T2
|
3
|
0,000000
|
0,000000
|
|
T3
|
3
|
0,800000
|
0,624500
|
ANNEXE 5
TABLEAU RECAPITULATIF DES MOYENNES D'INSECTES PAR BLOC
|
Traitement
|
Répétition
|
Altise
|
Mouche blanche
|
Jasside
|
Puceron
|
Dysdercus
|
AUTRE
|
SYLEPTA
|
ANOMIS
|
|
T0
|
R1
|
114,8
|
47,7
|
37,5
|
149,1
|
1,2
|
1,7
|
1,8
|
5
|
|
T0
|
R2
|
144,2
|
90,2
|
42,2
|
132
|
2,8
|
1,8
|
5,7
|
4,2
|
|
T0
|
R3
|
103,4
|
75,3
|
27,9
|
147,1
|
2,1
|
1,1
|
0,3
|
3,3
|
|
T1
|
R1
|
2,6
|
69,7
|
35,5
|
0,6
|
0,9
|
3,1
|
0
|
0,1
|
|
T1
|
R2
|
3,9
|
63,5
|
45,4
|
1,3
|
0,6
|
0,2
|
0
|
0,2
|
|
T1
|
R3
|
2,4
|
114,4
|
27,6
|
0,9
|
0,6
|
0,3
|
0
|
0,1
|
|
T2
|
R1
|
85,9
|
12,3
|
9
|
7
|
0,9
|
0,9
|
0
|
0,5
|
|
T2
|
R2
|
143,7
|
15,3
|
11,3
|
22
|
0,4
|
0,7
|
0
|
0,4
|
|
T2
|
R3
|
111,2
|
15,1
|
7,8
|
8,1
|
0,7
|
0,2
|
0
|
0,9
|
|
T3
|
R1
|
111,3
|
29,2
|
25,9
|
66,2
|
0,9
|
1,2
|
0,6
|
2,8
|
|
T3
|
R2
|
108,8
|
37,4
|
23,1
|
36,3
|
1,6
|
0,7
|
0,3
|
1,6
|
|
T3
|
R3
|
91,4
|
47,1
|
12,5
|
25,3
|
1,6
|
0,7
|
1,5
|
1,7
|
ANNEXES 6
TABLEAU RECAPITULATIF DES MOYENNES DES TROIS REPETITIONS (POIDS
(g) DES BONS FRUITS/TRAITEMENT)
|
Traitements
|
49JAS
|
52JAS
|
55JAS
|
58JAS
|
61JAS
|
64JAS
|
67JAS
|
70JAS
|
MOY
|
|
|
T0
|
87,67
|
79,99
|
129,15
|
239,58
|
226,85
|
140,65
|
115,77
|
20,56
|
130,0275
|
|
|
T1
|
165,7
|
149,12
|
347,31
|
462,66
|
431,56
|
307,43
|
284,885
|
256,91
|
300,696875
|
|
|
T2
|
100,3
|
108,43
|
232,24
|
235,86
|
140,12
|
100,04
|
104,56
|
37,55
|
132,3875
|
|
|
T3
|
91,73
|
98,11
|
264,93
|
290,19
|
160,67
|
127,69
|
112,95
|
53,47
|
149,9675
|
|
ix
ANNEXE 7
|
Rendement du gombo par traitement (g)
|
|
T0
|
T1
|
T2
|
T3
|
total
|
pourcentage
|
|
bon fruits
|
130,0275
|
300,696875
|
132,3875
|
149,9675
|
713,079375
|
0,81753153
|
|
mauvais fruits
|
54,5324167
|
1,99208333
|
62,76375
|
39,8670833
|
159,155333
|
0,18246847
|
|
total
|
184,559917
|
302,688958
|
195,15125
|
189,834583
|
872,234708
|
1
|
|
|



