|

***********
LABORATOIRE DE PHYSICO-CHIMIE DES MATÉRIAUX
MINÉRAUX
PHYSICO-CHEMISTRY OF MINERAL MATERIALS
LABORATORY
UNIVERSITÉ DE YAOUNDÉ I
THE UNIVERSITY OF YAOUNDE I
DÉPARTEMENT DE CHIMIE
INORGANIQUE
DEPARTMENT OF INORGANIC
CHEMISTRY
FACULTÉ DES
SCIENCES
FACULTY OF SCIENCE
COMPORTEMENT THERMIQUE DES
GÉOPOLYMÈRES OBTENUS A
PARTIR D'UNE ARGILE KAOLINITE
Mémoire présenté et soutenu
publiquement en vue de l'obtention du
Diplôme de Master en
chimie
Spécialité : Chimie Inorganique Option :
Physico-Chimie des Matériaux Minéraux
Par :
TCHADJIE NOUMBISSIE
Léonel
Licencié en chimie
Année académique 2011-2012
ELIMBI Antoine Maître de
Conférences Université de Yaoundé I
Sous la direction de :
Matricule : 05U035
DÉDICACE
Je dédie ce mémoire à mes parents,
M. NGOUZE Pierre
et
Mme NGOUZE née EMADE
Elisabeth.


REMERCIEMENTS
Ce travail a été effectué dans le
laboratoire de Physico-chimie des Matériaux Minéraux de la
Faculté des Sciences de l'Université de Yaoundé I que
dirige le Pr. Njopwouo Daniel. Il a été mené sous la
direction du Pr. Elimbi Antoine. Il entre dans le cadre de la valorisation des
matériaux naturels.
Je voudrais exprimer ma profonde gratitude à tous ceux
qui de près ou de loin ont contribué à la
réalisation de ce travail. Mes sincères remerciements :

Au Seigneur DIEU Tout Puissant qui m'a accordé la grace de
réaliser ce travail ;
A mon Directeur de mémoire, Pr. Elimbi Antoine pour
avoir accepté de diriger ce travail : votre rigueur scientifique, votre
disponibilité, votre esprit de travail et vos nombreux conseils ont
contribué à l'amélioration de ce travail. Veuillez trouver
ici l'expression de ma profonde reconnaissance ;

Au corps enseignant du Département de Chimie Organique
et Inorganique de la Faculté des Sciences, pour les connaissances qu'ils
nous ont permis d'acquérir à travers les enseignements
dispensés ;

A notre partenaire du Laboratoire de Démo-Center de
l'Université de Modena (Italie) pour avoir accepté d'analyser nos
matériaux ;

A mes frères: Massom Théocryte, Tchokossa Alex,
Pougoué Eric, Gatcho Modeste, Dacko Gabriel, Kamagou Joël et
Kouedjou Marcellin, pour tout l'amour dont vous me comblez ;

A mes cousins : Chokossa Pierre-Marie, Dyougmeni Honorine,
Deutou Doris, Choukoua Aurore et Ngako Michèle. Vos encouragements et
vos prières m'ont été d'un grand soutien et
réconfort ;

Aux familles, Ditchou, Ketchemen, Moukam, Touko, Youmbissi,
Mvom et Njouken pour leurs encouragements et conseils ;

A ma feue grand-mère Kamagou Martine et ma feue cousine
Kamagou Félicité. Pour l'attention qu'elles avaient à
l'égard de mon éducation. Reposez en paix ;

A mes aînés du laboratoire, Tchakouté
Hervé, Kenne Beauderic et Sovi prudence, pour vos conseils et votre
disponibilité ;


A mes camarades de laboratoire, Bakary Djouli, Kondoh Marcel,
Ebongue Herman et Lele Alexandre, pour le climat chaleureux qu'ils ont
entretenu au laboratoire durant tout notre travail ;

A mes collègues et amis, Kenne Rodrigue, Ngansop Jerry,
Dongmo Nathalie, Magne Sylviane, Wokam Hermione, Kengni Mireille et Chenda
Laurice, pour leurs conseils et soutiens ;

A mes camarades de la promotion 2010-2011 de Master 2 en
Chimie Inorganique, pour leur sympathie et les moments passés ensemble
;

A mes Amis, Sonkoué Christian, Djeuteu Cédric,
Kouakam landry, Tchunguia Eric, Kouakam Christel, Sop Berthelot, Kamno
Isabelle, Tengou Elodie, Leukeu Fernandaise, Tchagang Claudia, Djaleu Julie,
Mbeuhaté Eliane, Djeukam Stelle, Deutou Laure, Liegui Sandrine et Mballa
Carrel, pour vos conseils et votre soutien.

Enfin, à tous ceux ou celles que nous avons
involontairement omis de citer. Qu'ils trouvent ici l'expression de ma profonde
reconnaissance.


TABLE DES MATIÈRES
DÉDICACE I
REMERCIEMENTS II
LISTE DES ABRÉVIATIONS VII
LISTE DES FIGURES VIII
LISTE DES TABLEAUX IX
RÉSUMÉ XI
ABSTRACT XII
INTRODUCTION 1
CHAPITRE 1 : REVUE BIBLIOGRAPHIQUE 3
1. Généralités sur les
géopolymères 3
1.1 Définition et Historique 3
1.2 Terminologie et chimie des géopolymères 4
1.3 Matières premières utilisées pour
élaborer les géopolymères 7
1.3.1 Matériaux aluminosilicates 7
1.3.2 Solutions alcalines 8
1.4 Méthodes de caractérisation des
géopolymères 8
1.5 Structure des géopolymères 9
1.6 Propriétés des géopolymères 10
1.7 Facteurs influençant les propriétés des
géopolymères 11
1.8 Utilisations des géopolymères 12
CHAPITRE 2 : MATÉRIAUX UTILISÉS ET
MÉTHODES EXPÉRIMENTALES 14
2.1 Matériaux utilisés 14
2.1.1 Matériau argileux 14
2.1.2 Solution alcaline 14
2.2 Méthodes expérimentales 14
2.2.1 Enrichissement du kaolin en phase minéralogique
argileuse 14
2.2.2 Caractérisation de la fraction argileuse 15
iv

2.2.2.1 Analyse chimique 15
2.2.2.2 Analyses thermiques 15
2.2.2.2.1 Analyse thermique différentielle 15
2.2.2.2.2 Analyse thermogravimétrique 15
2.2.3 Spectrométrie Infrarouge par Transformée de
Fourier 16
2.2.4 Analyse par diffraction de rayons X 16
2.2.5 Préparation des solutions alcalines 17
2.2.6 Formulation pour géopolymères et
façonnage des éprouvettes 17
2.2.7 Traitement thermique des éprouvettes
géopolymères 19
2.2.8 Caractérisation des géopolymères 19
2.2.8.1 Spectrométrie Infrarouge par Transformée de
Fourier 19
2.2.8.2 Analyse par diffraction de rayons X 19
2.2.8.3 Microscopie électronique à balayage 20
2.2.8.4 Retrait linéaire de cuisson 20
2.2.8.5 Pourcentage d'absorption d'eau 20
2.2.8.6 Analyses thermiques 21
2.2.8.6.1 Analyses thermiques différentielle et
thermogravimétrique 21
2.2.8.6.2 Analyse dilatométrique 21
2.2.8.6.2.1 Principe 21
2.2.8.6.2.2 Mode opératoire 21
2.2.8.7 Résistance à la compression 23
CHAPITRE 3 : RÉSULTATS ET DISCUSSION
25
3.1 Caractérisation de la fraction argileuse 25
3.1.1 Analyse chimique 25
3.1.2 Analyse par diffraction de rayons X 25
3.1.3 Analyses thermiques différentielle et
thermogravimétrique 26
3.1.4 Spectrométrie Infrarouge par Transformée de
Fourier 28
3.2 Caractérisation des géopolymères 29
3.2.1 Aspect des éprouvettes 29
3.2.2 Spectrométrie Infrarouge par Transformée de
Fourier 31
3.2.3 Analyse par diffraction de rayons X 32
3.2.4 Microscopie électronique à balayage 35
3.2.5 Analyses thermiques 37

3.2.5.1 Analyses thermiques différentielle et
thermogravimétrique 37
3.2.5.2 Analyse dilatométrique 38
3.2.6 Retrait linéaire de cuisson 42
3.2.7 Pourcentage d'absorption d'eau 43
3.2.8 Résistance à la compression 44
CONCLUSION 46
RÉFÉRENCES BIBLIOGRAPHIQUES 47
ANNEXES 50
vi

LISTE DES ABRÉVIATIONS
ASTM : American Society for Testing Materials
ATG : Analyse Thermique Gravimétrique
ATD : Analyse Thermique Différentielle
DRX : Diffraction de Rayons X
3D : Réseau tridimensionnel
EDX : Energy Dipersive X-ray
EN : European Norm
ICP-AES : Inductively Coupled Plasma-Atomic Emission
Spectrometry
IRTF : Infrarouge par Transformée de Fourier
MEB : Microscopie Electronique à Balayage
MET : Microscopie Electronique à Transmission
PVC : Polychlorure de Vinyle
MPa : Méga Pascal
RMN-MAS : Résonance Magnétique Nucléaire -
(Magic Angle Spinning)
vii

LISTE DES FIGURES
Figure 1 : Structure de base du réseau sialate
(tétraèdres SiO4 et AlO4) 4
Figure 2 : Structure des poly(sialates) 5
Figure 3 : Structure de base tridimensionnelle de la notation
Qn(mAl). 6
Figure 4 : Diffractogramme de matériaux
géopolymériques. 9
Figure 5 : Structure proposée pour le
géopolymère K-Poly(sialate-siloxo). 10
Figure 6: Applications des géopolymères en fonction
du ratio Si/Al dans la structure
poly(sialate). 13
Figure 7 : Malaxeur de marque M & O, modèle N50-G
18
Figure 8 : Table vibrante électrique de marque M &
O, type 202, N° 106 18
Figure 9 : Four programmable de marque Nabertherm 19
Figure 10 : Dilatomètre mécanique type Chevenard,
modèle D.M. 15 simple. 22
Figure 11 : Presse électro-hydraulique M & O, type
11.50, N° 21. 24
Figure 12 : Diffractogramme de rayons X de la fraction argileuse.
26
Figure 13 : Thermogrammes d'ATD et d'ATG de la fraction argileuse
27
Figure 14 : Spectre Infrarouge par Transformée de Fourier
de la fraction argileuse. 28
Figure 15 : Les éprouvettes GPM (a) et GPE (b)
thermiquement non traitées. 29
Figure 16 : Les éprouvettes GPM et GPE traitées
à 90 °C (a) ou 500 °C (b) ; éprouvettes
GPD
traitées à 90 °C (c). 30
Figure 17 : Spectres IRTF : (a) matériau argileux, (b)
géopolymère traité à 90 °C,
(b)
géopolymère traité à 300 °C, (d)
géopolymère traité à 500 °C. 32
Figure 18 : Diffractogrammes de rayons X : (a) matériau
argileux, (b) géopolymère traité à
90 °C,
(b) géopolymère traité à 300 °C, (d)
géopolymère traité à 500 °C. 34
Figure 19 : Micrographes des géopolymères: (a)
géopolymère traité à 90 °C, (b)
géopolymère
traité à 300 °C, (c)
géopolymère traité à 500 °C. 36
Figure 20 : Thermogrammes d'ATD et d'ATG/ TGD du
géopolymère traité à 90 °C. 37
Figure 21 : Thermodilatogrammes des géopolymères
traités à : 90 °C (a) ; 300 °C (b); 400 °C
(c)
et 500 °C (d). 41
Figure 22 : Retrait linéaire de cuisson . 43
Figure 23 : Pourcentage d'absorption d'eau. 44
Figure 24 : Résistance à la compression. 45
ix

LISTE DES TABLEAUX
Tableau 1 : Composition
chimique de la fraction argileuse. 25
Tableau 2 : Récapitulatif des
phénomènes observés au cours de l'analyse
dilatométrique. .... 38
x

RESUMÉ
L'objet de ce travail est l'étude du comportement
thermique des géopolymères à base d'une argile kaolinite.
Les produits obtenus ont été caractérisés au moyen
de plusieurs techniques : analyses thermiques (ATD, ATG et
dilatométrie), microscopie électronique à balayage (MEB),
analyse par diffraction de rayons X (DRX), analyse infrarouge par
transformée de Fourier (IRTF). Certaines propriétés
physiques des produits obtenus ont également été
déterminées : retrait linéaire de cuisson, pourcentage
d'absorption d'eau et résistance à la compression. Les
résultats obtenus montrent qu'après le séchage et à
la fin du traitement thermique, les éprouvettes des produits conservent
leur forme initiale mais présentent une variation de couleur en fonction
de la température de traitement. Les produits obtenus à 90, 300
et 500 °C contiennent de l'hydroxysodalite. La réaction de
synthèse géopolymere n'est pas encore terminée au moins
à 300 °C (présence de kaolinite dans le matériau)
mais les produits obtenus sont assez consolidés. Les
géopolymères obtenus présentent de faibles valeurs de
retrait linéaire de cuisson (inférieure à 0,6 %) et une
résistance à la compression qui augmente de la température
ambiante (4,9 MPa) jusqu'à 400 °C (8,9 MPa) puis devient constante
entre 400 et 500 °C. L'ensemble de ces résultats permet de mettre
en exergue l'efficacité du paramètre « température
» au cours de la synthèse des géopolymères à
base de kaolinite.
Mots dles : Géopolymère ;
kaolinite ; température ; résistance à la compression.
xi

ABSTRACT
The aim of this work is to study the thermal behavior of
geopolymers derived from kaolinite (clay). The geopolymers were characterized
by various technics: Thermal analysis (DTA, TGA and dilatometer), X-ray
diffractography (XRD), scanning electron microscopy (SEM) and Fourier transform
infrared spectroscopy (FTIR). Certain physical properties of the products were
equally determined: linear shrinkage of curing, percentage of water absorption
and compressive strength. The results obtained after drying and thermal
treatment showed that the products preserved their initial forms, but showed
variable colours based on the temperatures they were treated at. The products
obtained at 90, 300 and 500 °C contained hydroxysodalite. The synthesis of
geopolymers is not complete at 300 °C (presence of kaolinite in the
material) but the products obtained are quite consolidated. The geopolymers
obtained have weak values of linear shrinkage of curing (less than 0.6 %) and
the compressive strength increases from room temperature (4.9 Mpa) up to 400
°C (8.9 MPa) then becomes constant between 400 and 500 °C. The
combination of results demonstrates the efficiency of the temperature parameter
during the synthesis of geopolymers based on kaolinite.
Key words: Geopolymer; kaolinite; temperature;
compressive strength.


INTRODUCTION
Le globe terrestre regorge d'une grande diversité de
matériaux que l'homme utilise à des fins diverses : construction,
production d'énergie, alimentation, médecine, etc. Les
géopolymères sont une classe de matériaux
synthétiques obtenus à partir de certains matériaux du
globe terrestre (aluminosilicates) au cours de leur interaction avec un milieu
très fortement basique. L'homme utilise ces géopolymeres dans des
domaines divers : génie civil, automobile, aérospatiale,
métallurgie, fonderie non-ferreuse, plastiques, gestion des
déchets, architecture, restauration des bâtiments, etc. (Herman,
1999 ; Davidovits, 2002 ; Liew et al., 2011).
Introduit pour la première fois en 1979 par Davidovits,
le terme géopolymère désigne des polymères
inorganiques à structure tridimensionnelle constitués par des
tétraèdres de SiO4 et de AlO4 liés entre eux par des
atomes d'oxygene (Davidovits, 1991). La charge négative portée
par le tétraèdre AlO4 (où Al est en coordination IV) est
compensée par un cation, tel que : Na+, K+,
Li+, Ca2+, Ba2+ NH4 + ou H3O+
(Davidovits, 1991). Ces matériaux présentent une bonne
stabilité thermique, résistent aux attaques acides et sont
dotés de bonnes propriétés mécaniques (Muniz-V et
al., 2011; Davidovits, 2011).
Plusieurs auteurs ont synthétisé les
géopolymères à partir de diverses sources
d'aluminosilicates : les argiles kaolinites, la métakaolinite, les
cendres volantes, les scories volcaniques, les laitiers des hauts fourneaux,
les pouzzolanes, etc. (Sabir et al., 2001 ; Van Jaarsveld et
al., 2002 ; Cheng et Chiu 2003 ; Davidovits, 2011 ; Lemougna et
al., 2011 ; Tchakoute et al., 2012). Au cours de cette
géosynthese, la plupart des travaux jusqu'ici effectués ont
utilisé comme source d'aluminosilicate la métakaolinite qui
résulte de la deshydroxylation de la kaolinite (Duxson, 2006 ; Buchwald
et al., 2009 ; Rovnanik, 2010 ; Elimbi et al., 2011 ; Muniz-V
et al.,2011). Le choix de la métakaolinite tient de la faible
réactivité de la kaolinite, particulièrement à la
température ambiante (Liew et al., 2011). Toutefois la
kaolinite peut présenter une certaine réactivité qui
permet d'obtenir dans certaines conditions, des matériaux de
construction par synthèse géopolymère (Boutterin et
Davidovits, 2003 ; Alshaaer et Tair, 2009 ; Rahier et al., 2010 ;
Yousef et al., 2010 ; Khoury et al., 2011).
1

Au Cameroun, les matériaux argileux kaolinitiques sont
assez représentés (Njopwouo, 1984 ; Njoya et al., 2006).
Cependant les recherches sur leur valorisation dans le domaine de
la synthèse géopolymère sont à
peine amorcées (Lemougna, 2008 ; Akono, 2009). Or, la production des
matériaux de construction par géopolymérisation peut
être d'un avantage économique évident.
L'objet de ce travail porte sur le comportement thermique des
géopolymères obtenus à partir d'une argile kaolinite. Le
plan de notre travail s'articule autour de trois chapitres. Le premier chapitre
est consacré aux généralités sur les
géopolymères. Dans le second chapitre nous présentons les
matériaux utilisés et décrivons les différentes
techniques de préparation des géopolymères ainsi que les
méthodes employées pour les caractériser. Le
troisième chapitre rapporte les résultats obtenus et leurs
discussions. Enfin une conclusion dans laquelle nous présentons nos
principaux résultats ainsi que les perspectives de cette étude
met un terme à ce travail.
2

CHAPITRE 1 : REVUE BIBLIOGRAPHIQUE
1. Généralités sur les
géopolymères
1.1 Définition et Historique
Le terme « Géopolymère »,
désigne des polymères minéraux synthétiques
à structure tridimensionnelle de la famille des aluminosilicates. (
Muniz-V. et al., 2011). Cette
expression a été introduite pour la première fois, en 1979
par Joseph Davidovits (Delatte et Facy, 1993 ; Prud'homme et al.,
2011).
En effet, suite aux multiples incendies catastrophiques
survenus en France dans la période allant de 1970 à 1973 et dont
la gravité est attribuée pour la plupart aux matériaux de
décoration de type polyester utilisés (Delatte et Facy, 1993 ;
Davidovits, 2011), il est devenu impératif de produire sur le
marché de nouveaux matériaux plastiques qui résistent au
feu, des matériaux ininflammables et incombustibles. C'est dans ce
contexte que Davidovits décide d'orienter ses travaux vers la conception
de nouveaux matériaux. Dans cette quête, il remarque une
similarité dans les conditions de synthèse de certains
matériaux plastiques organiques d'une part, et de minéraux
feldspathoïdes et zéolites résistants au feu d'autre part.
Ces deux types de synthèse se déroulent en milieu alcalin
concentré, à la pression atmosphérique et à une
température inférieure à 150° C (Delatte et Facy,
1993 ; Davidovits, 2002). Enfin, la revue de la littérature montre
qu'à cette période, l'exploitation de la géochimie de ces
minéraux pour l'élaboration de liants et des polymères
minéraux n'est pas encore assez investiguée (Davidovits,
1991).
Ceci a conduit à l'élaboration, dans la
période allant de 1973 à 1976, aux premiers
géopolymères et leur application dans le domaine des
matériaux de construction (Davidovits, 2011). Ce sont des panneaux
géopolymères agglomérés résistants au feu,
sorte de matériau composite constitué d'une matrice de copeaux de
bois recouverte par un géopolymère. Ce géopolymère
était synthétisé à partir d'un mélange de
kaolinite, de quartz et d'une solution d'hydroxyde de sodium, à une
température variant de 130 à 200° C (Davidovits, 2002).
3

La stabilité thermique des géopolymères a
amené l'équipe de recherche de Davidovits à orienter ses
travaux dans le domaine de l'aéronautique et de la transformation des
thermoplastiques (Delatte et Facy, 1993). Par souci d'innovations, les
recherches s'orientent vers l'élaboration d'une nouvelle gamme de
ciment. En 1983 ceci a abouti à l'élaboration d'un ciment
possédant des propriétés mécaniques
intéressantes et résistant aux acides. Ce
ciment présente notamment une résistance
à la compression de 20 MPa, quatre heures après un maintien
à 20° C (Davidovits, 2011).
Les propriétés intéressantes des
géopolymères ont dès lors suscité de nombreux
travaux scientifiques pour leur potentielle application industrielle (Xu et Van
Deventer, 2002). Ces matériaux sont actuellement
considérés comme des alternatifs aux matériaux
traditionnels (plastiques, céramiques, ciment portland) et des efforts
croissants de recherche sont entrepris à travers le monde pour leur
possible utilisation dans divers domaines. (Yunsheng et al., 2010 ;
Rovnanik, 2010 ; Liew et al., 2011).
1.2 Terminologie et chimie des
géopolymères
Les géopolymères résultent d'une
réaction chimique entre les matériaux aluminosilicates et les
solutions alcalines concentrées ; encore appelées solutions
activantes. Le nom chimique utilisé pour désigner les
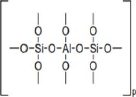
géopolymères est poly(sialate). Sialate est une
abréviation de silicon-oxo-aluminate et le réseau sialate est
constitué des tétraèdres SiO4 et AlO4 liés
alternativement par la mise en commun de tous les atomes d'oxygene (Davidovits,
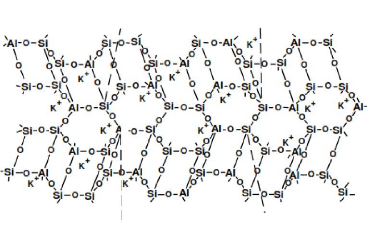
1991). La figure 1 présente la structure de base du réseau
sialate.
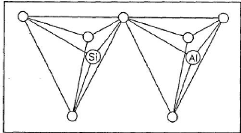
Figure 1 : Structure de base du
réseau sialate (tétraèdres SiO4 et AlO4).
Les poly(sialates) ont pour formule empirique :
Mp{(SiO2)zAlO2}p.wH2O où M désigne un cation, P est le
degré de polycondensation, z valant 1, 2 ou 3 et w décrivant
l'hydratation du composé. Les poly(sialates) sont décrits comme
étant des chaînes et des anneaux de polymères avec des
cations Si4+ et Al3+ en coordination IV, avec des anions
O2- (Davidovits, 1991). La figure 2 présente la structure de ces
polymères.
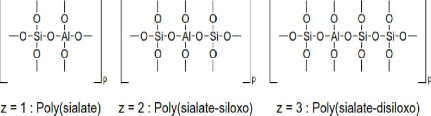
Figure 2 : Structure des
poly(sialates)
La structure sialate comporte une charge négative qui
est compensée par un cation, tels que : Na+, K+,
Li+, Ca2+, Ba2+ NH4 + ou H3O+
(Davidovits, 1991). Les poly(sialates) n'autorisent pas la formation des
liaisons Al-O-Al. Bien qu'elles soient thermodynamiquement défavorables
; elles ne sont pas impossibles (Duxson, 2006).
Quelque temps après que Davidovits ait utilisé
la nomenclature poly(sialates) pour décrire la structure des
géopolymères, de nombreuses études sur les zéolites
et les minéraux aluminosilicates ont été menées.
Une nouvelle notation a été introduite par Engelhardt, pour
décrire les squelettes des aluminosilicates alcalins : la notation
Qn(mAl), où n est le nombre de coordination de l'atome
central de silicium (Si) avec des atomes de Si ou d'aluminium (Al) comme
seconds voisins, m étant le nombre de Al second voisin, avec 0 = m = n =
4. (Duxson, 2006). La figure 3 présente la structure de base
tridimensionnelle de la notation Qn(mAl) où n est égal
à 4, correspondant à la valeur observée dans la matrice
géopolymère.
5

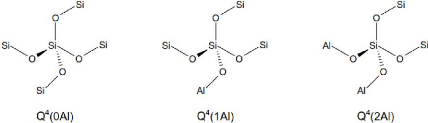
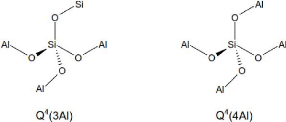
Figure 3 : Structure de base
tridimensionnelle de la notation Qn(mAl) (Duxson, 2006).
Le mécanisme de la réaction de
géopolymérisation n'est pas encore entièrement
élucidé, les travaux sur le processus de cette réaction
étant encore récents par rapport à la découverte
des géopolymères. La majorité des mécanismes
proposés dans un premier temps consistait en deux étapes : une
dissolution du minéral d'aluminosilicate dans la solution alcaline
activatrice, suivie d'une polycondensation conduisant à un gel amorphe
(Xu et Van Deventer, 2000).
Des études plus récentes proposent un
mécanisme de réaction selon trois étapes (Xiao et
al., 2009) :
La déconstruction : il s'agit de la
dissolution de l'aluminosilicate dans la solution alcaline, c'est-à-dire
la rupture des liaisons Si-O-Si et Si-O-Al pour former des précurseurs
réactifs Si(OH)4 et Al(OH)4 - dans la solution ;
La polymérisation : les monomères
Si(OH)4 et Al(OH)4 - réagissent entre eux pour donner les
oligomères AlSi2O2(OH)8 - d'aluminosilicates qui se condensent en un gel
;
La stabilisation : le gel formé subit
probablement une réorganisation pour donner un grand réseau.
La réaction de géopolymérisation peut
être illustrée par les équations suivantes (Rovnanik, 2010)
:

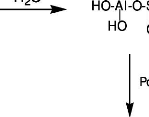
1.3 Matières premières utilisées
pour élaborer les géopolymères
Les matières premières utilisées pour
synthétiser les géopolymères sont de deux types : les
matériaux aluminosilicates et les solutions alcalines.
1.3.1 Matériaux aluminosilicates
La kaolinite et la métakaolinite ont été
les premières à être utilisées comme sources
d'aluminosilicate pour la synthèse des géopolymères
(Davidovits, 2011). Les travaux de Xu et al. ont montré qu'en
plus de la kaolinite ou de la métakaolinite, un grand nombre de
matériaux naturels aluminosilicates peuvent être potentiellement
utilisés pour la synthèse des géopolymères. Nous
pouvons citer entre autres : la stilbite, la sodalite, l'augite, l'andalusite,
l'illite, et l'anorthite (Xu et Van Deventer, 2000). En plus de ces
minéraux naturels, de nombreux autres matériaux riches à
la fois en oxydes de silice (SiO2) et en alumine (Al2O3) peuvent être
utilisés : les cendres volantes, les scories volcaniques, les laitiers
des hauts fourneaux, les pouzzolanes et les cendres des cosses du riz (Van
Jaarsveld et al., 2002 ; Lemougna et al., 2011 ; Cheng et
Chiu 2003 ; Sabir et al., 2001 ; Wongpa et al., 2006).
Notons qu'il reste impossible de prédire quantitativement
si un matériau aluminosilicate est indiqué pour la
géopolymérisation (Xu et Van Deventer, 2000).
1.3.2 Solutions alcalines
Les solutions alcalines (solution activatrice)
utilisées pour la synthèse des géopolymeres, sont des
mélanges d'hydroxydes alcalins (NaOH ou KOH) avec le silicate de sodium
ou de potassium (Na2SiO3, K2SiO3). Des travaux ont montré que la
réaction de géopolymérisation est plus rapide lorsque la
solution alcaline contient le silicate de sodium ou de potassium
comparée à celle ne contenant que l'hydroxyde alcalin
(Davidovits, 1991). De même l'utilisation d'une solution d'hydroxyde de
sodium par rapport à celle d'hydroxyde de potassium favorise la
géopolymérisation et améliore la résistance
à la compression des géopolymères (Xu et Van Deventer,
2000).
1.4 Méthodes de caractérisation des
géopolymères
Les principales méthodes de caractérisation des
géopolymères utilisent les informations tant sur le plan de la
structure que de la microstructure.
Sur le plan structural, le premier moyen de
caractérisation utilisé est la DRX (Diffraction de Rayons X) ;
ainsi, les diffractogrammes des géopolymères présentent
généralement un halo diffus (tel que 2 èmax compris entre
18 et 40° sur anticathode de cuivre) plutôt que des raies pointues
de diffractions (Davidovits, 1991). L'utilisation de cette méthode de
caractérisation aboutit à la conclusion que les
géopolymères sont des matériaux semi amorphes. Ainsi toute
discussion sur la structure des géopolymères basée sur la
DRX n'est pas précise, car elle offre une faible résolution pour
les matériaux amorphes et elle n'est pas capable de détecter les
cristaux d'une taille de 5-10 nm (Duxson, 2006). La figure 4 présente le
diffractogramme de quelques géopolymères.


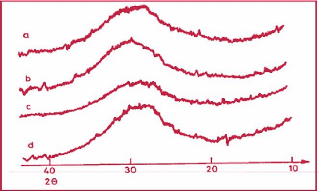
Figure 4 : Diffractogramme de
matériaux géopolymériques (Davidovits, 1994).
La DRX est désormais associée à d'autres
méthodes spectroscopiques tels que : l'infrarouge par transformée
de Fourier (IRTF), qui permet de définir les différentes liaisons
dans le matériau et la résonance magnétique
nucléaire RMN-MAS (Magic-Angle-Spinning) qui fournit des
données structurales utiles sur les matériaux d'aluminosilicates
( zéolites, argiles, céramiques, ciments,
géopolymères) et en particulier la RMN-MAS du silicium
(29Si) et de l'aluminium (27Al) (Davidovits, 1991).
Sur le plan microstructural, les techniques microscopiques
principalement utilisées pour l'analyse des géopolymères
sont : la microscopie électronique à balayage (MEB) et la
microscopie électronique à transmission (MET) (Duxson, 2006).
En plus des méthodes d'analyse citées
précédemment, plusieurs autres méthodes sont
utilisées complémentairement pour la caractérisation des
géopolymères ; il s'agit des analyses thermiques (ATD, ATG et
analyses dilatométriques) et des mesures mécaniques (Lemougna et
al., 2011 ; Zeng et al., 2012 ; Duxson et al.,
2006).
1.5 Structure des Géopolymères
9

La majorité des géopolymères
synthétisés à partir des diverses sources de
matières premières, sont des mélanges de particules
cristallines et/ou semicristallines d'aluminosilicates avec un gel amorphe
d'aluminosilicate (Xu et Van Deventer, 2002). Selon Davidovits, les
géopolymères ont une structure macromoléculaire semblable
à celle des zéolites ; mais sans un ordre régulier sur une
grande distance. (Davidovits, 1991 ; Rovnanik, 2010).
| Mémoire de Master en chimie rédigé et
présenté par Tchadjié Noumbissié Léonel
(2012).
En se référant au modèle poly(sialate)
proposé par Davidovits, le rapport atomique Si/Al influence la structure
des géopolymères. Un ratio faible de Si/Al (1, 2, 3)
confère un réseau 3D qui est tres rigide. L'augmentation du
rapport Si/Al fournit un caractère polymérique au matériau
(Institut Géopolymère, 2012). La figure 5 présente la
structure proposée par Davidovits pour le géopolymère
K-Poly(sialate-siloxo). Dans cet édifice, les tétraèdres
SiO4 et AlO4 s'enchaînent de façon aléatoire en offrant une
structure désordonnée qui possède des cavités
occupées par des cations alcalins (Davidovits, 1994).
Q4(1Al)
Q4(3Al)
Q4(2Al)
Figure 5 : Structure proposée pour
le géopolymère K-Poly(sialate-siloxo) (Davidovits, 1994).
1.6 Propriétés des
géopolymères
La synthèse des géopolymères à
partir de diverses sources de matières premières aluminosilicates
offre la possibilité d'obtenir des matériaux possédant des
propriétés physiques et/ou chimiques variables.
10

En effet la réaction de géopolymérisation
a lieu à une température inférieure à 100 °C.
En fonction des conditions de synthèse, les produits obtenus peuvent
acquérir 70% de leurs propriétés mécaniques finales
durant les quatre premières heures (Van Jaarsveld et Van Deventer,
1996). En particulier, certains ciments géopolymères
présentent une résistance à la compression de l'ordre de
20 MPa après 4 heures de maintien à 20°C. Après 28
jours, l'on
obtient une résistance à la compression de
l'ordre de 70 à 100 MPa (Davidovits, 1994). Par ailleurs les
géopolymères résistent assez au feu et aux attaques
acides, présentent un faible retrait et une bonne résistance aux
cycles gel-dégel (Liew et al., 2011).
Plusieurs travaux (Herman, 1999 ; Van Jaarseld et
al., 1996) montrent que la structure des géopolymères
présente une faible perméabilité, favorisant leur
utilisation pour l'immobilisation des métaux toxiques. D'après
Davidovits, l'utilisation du ciment géopolymère dans le
génie civil pourrait réduire les émissions de CO2 de
l'industrie cimentière actuelle de 80 % (Davidovits, 1994).
1.7 Facteurs influençant les
propriétés des géopolymères
Ces dernières années, dans le souci de
comprendre le mécanisme de la géopolymérisation, plusieurs
études ont été menées sur les facteurs
influençant les propriétés des
géopolymères.
Xu et Van Deventer, ont étudié la
géopolymérisation de 15 minéraux naturels
d'aluminosilicates. Il ressort de ces travaux qu'une solubilité accrue
de ces minéraux dans la solution alcaline, améliore la
résistance à la compression des géopolymères
obtenus. Par ailleurs, cette étude montre que la résistance
à la compression des géopolymères est influencée
par des facteurs tels que : le pourcentage de CaO et de K2O, le rapport molaire
Si/Al dans le minéraux ; le type de solution alcaline (NaOH ou KOH) et
le ratio Si/Al de la solution activatrice (Xu et Van Deventer, 2000).
Les travaux de Davidovits ont montré que la
réaction de géopolymérisation est plus rapide lorsque la
solution activatrice contient le silicate de sodium ou de potassium
comparée à celle ne contenant que de l'hydroxyde alcalin
(Davidovits, 1991).
Rovnanik a étudié l'effet de la
température sur les propriétés des
géopolymères à base de métakaolinite. Il ressort de
ses travaux que l'augmentation de la température de synthèse des
géopolymères améliore leur propriété
mécanique et augmente la taille et le volume total des pores (Rovnanik,
2010). Une étude similaire réalisée par Muniz-V et
al., a montré qu'il existe une température optimale de
traitement (60°C) à laquelle les géopolymères
présentent de meilleures propriétés mécaniques et
physiques (Muniz-V et al., 2011).
11

Shindhunata et al. ont montré que
l'augmentation de la température de traitement accroit la dissolution
des précurseurs et le taux de polycondensation dans la réaction
de géopolymérisation (Shindhunata et al., 2006).
Van Jaarseld et al. ont montré qu'une vitesse
de chauffe et/ou une température élevée font
apparaître des craquelures et ont un effet négatif sur les
propriétés physiques des géopolymères à base
du mélange cendres volantes/kaolinite (Van Jaarseld et al.,
2002).
Duxson a étudié l'évolution des
propriétés mécaniques et de la microstructure des
géopolymères à base de métakaolinite pour des
rapports Si/Al compris entre 1,15 et 2,15. Il obtient une meilleure
résistance à la compression pour un rapport Si/Al égale
1,90. Les analyses microstructurales montrent que les matériaux
présentent une porosité importante et sont peu structurés
pour Si/Al = 1,40, tandis que pour Si/Al = 1,65 les matériaux ont des
pores de l'ordre du micron et sont plus homogenes (Duxson, 2006).
De Silva et al. ont étudié le
rôle de la silice (SiO2) et de l'alumine (Al2O3) dans la cinétique
de la géopolymérisation. Ils ont remarqué que le temps de
prise augmente avec le ratio SiO2/Al2O3 (De Silva et al., 2007).
1.8 Utilisations des géopolymères
Compte tenu des propriétés physiques et
chimiques des géopolymères, des progrès technologiques ont
été faits dans le sens du développement de leurs
applications : génie civil, automobile, aérospatiale,
métallurgie, fonderie non-ferreuse, plastiques, gestion des
déchets, architecture, restauration des bâtiments, etc. (Herman,
1999 ; Davidovits, 2002 ; Liew et al., 2011).
Dans le génie civil, on note l'élaboration de
nouveaux ciments géopolymeres à l'instar du ciment
américain PYRAMENT ultra rapide et à haute performance,
commercialisé aux États-Unis depuis 1988. Il est un produit
idéal pour la réparation et la construction des pistes
d'atterrissage en bétons (Davidovits, 2002).
Dans l'aérospatiale, on note l'utilisation des moules
et des outils en géopolymeres réfractaires pour le coulage en
toute sécurité des alliages très corrosifs
Aluminium/Lithium à l'état liquide ((Institut
Géopolymère, 2012).
Dans le domaine automobile, on note l'utilisation des
composites carbone/ géopolymères pour la protection thermique des
voitures de courses ((Institut Géopolymère, 2012).
12

Dans le domaine du traitement des déchets, on note
l'utilisation des ciments géopolymeres pour l'encapsulation des
déchets toxiques et radioactifs (Herman, 1999).
La figure 6 résume les applications des
géopolymères en fonction du ratio Si/Al dans la structure
poly(sialate).
| Mémoire de Master en chimie rédigé et
présenté par Tchadjié Noumbissié Léonel
(2012).
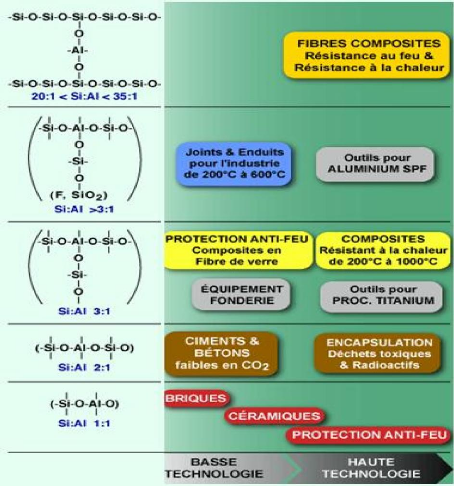
Figure 6 : Applications des
géopolymères en fonction du ratio Si/Al dans la
structure
poly(sialate) ( Institut Géopolymère, 2012).
13

CHAPITRE 2 : MATÉRIAUX UTILISÉS ET
MÉTHODES EXPÉRIMENTALES
2.1 Matériaux utilisés
Notre étude a utilisé deux matières
premières : une argile kaolinite et une solution alcaline (solution
activatrice).
2.1.1 Matériau argileux
Le matériau argileux est un kaolin qui nous a
été fourni par le groupe NUBRU Holding (partenaire) ; travaillant
pour la valorisation de certaines matières premières
camerounaises.
2.1.2 Solution alcaline
La solution alcaline (solution activatrice) utilisée
est le mélange d'une solution aqueuse d'hydroxyde de sodium et d'une
solution de silicate de sodium. La solution d'hydroxyde de sodium a
été obtenue par dissolution dans l'eau distillée des
pastilles de soude ayant une pureté de 99%. La solution de silicate de
sodium a pour composition chimique massique : 28,7% SiO2, 8,9% Na2O et 62,4%
H2O. La solution de silicate de sodium a une masse volumique égale 1350
Kg / m3.
2.2 Méthodes expérimentales
2.2.1 Enrichissement du kaolin en phase
minéralogique argileuse
Les matériaux argileux contiennent des aluminosilicates
plus ou moins hydratés. Ces derniers sont caractérisés par
une faible granulométrie (inférieure à 2 ìm) et le
quartz est généralement l'une des impuretés majeures dans
les kaolins. L'enrichissement de notre kaolin en phase minéralogique
argileuse a été effectué par tamisage humide.
En effet le matériau argileux a été
trempé dans un récipient contenant de l'eau permutée
à laquelle on a ajouté quelques gouttes de défloculant
(Dolaflux à 5%o) puis l'ensemble est
homogénéisé par agitation mécanique. Le
mélange obtenu a été laissé au repos pendant 24
heures. Pour la suite, il a été tamisé avec un tamis
d'ouverture de maille 100 ìm.
14

Le filtrat a été laissé au repos pour la
décantation. Après élimination de l'eau surnageante, la
fraction argileuse obtenue est d'abord séchée dans l'air
atmosphérique puis à 105 °C dans une étuve de marque
Heraeus jusqu'à poids constant. L'argile séchée
est broyée dans un mortier en porcelaine puis tamisée
jusqu'à passage intégral à travers un tamis d'ouverture de
maille 80 ìm.
2.2.2 Caractérisation de la fraction argileuse
2.2.2.1 Analyse chimique
La détermination de la composition chimique de la phase
minéralogique argileuse a été effectuée par ICP-AES
(Inductively Coupled Plasma-Atomic Emission Spectrometry). Cette
méthode permet la détermination des éléments
majeurs du matériau sous forme de pourcentages massiques de leurs oxydes
les plus stables. Ces analyses ont été effectuées dans le
Laboratoire de Démo-Center à l'Université de Modena
(Italie).
2.2.2.2 Analyses thermiques
2.2.2.2.1 Analyse thermique
différentielle
L'analyse thermique différentielle (ATD) met en
évidence les réactions exothermiques ou endothermiques qui ont
lieu lors des différentes transformations pouvant se produire au cours
du chauffage d'un échantillon de matériau. En ATD, on enregistre
la différence de température (DT) entre l'échantillon
étudié et une substance de référence qui ne
manifeste aucun accident thermique dans la zone de température
explorée. D'une manière générale, aux
réactions endothermiques (DT<0) peuvent correspondre successivement
le départ de l'eau absorbée, interfoliaire ou de constitution.
Aux réactions exothermiques (DT>0), il peut correspondre la formation
de nouveaux composés comme par exemple, la phase spinelle à
partir du métakaolin à 980°C (Rollet et Bouaziz, 1972).
L'appareil utilisé est un analyseur de marque SDT 2960
Simultaneous DSC-TGA thermal analysis Instruments. Les
matériaux sont mis à chauffer de la température ambiante
jusqu'à 1100°C à une vitesse de 10°C/min soit sous un
flux d'azote. La vitesse d'écoulement du gaz porteur étant de 100
mL. min-1. Ces analyses ont été effectuées dans
le Laboratoire de DémoCenter à l'Université de Modena
(Italie).
2.2.2.2.2 Analyse thermogravimétrique
15

L'analyse thermogravimétrique (ATG) consiste à
enregistrer les pertes de masse d'un échantillon de matériau en
fonction de la température, liées à des réactions
chimiques ou à des départs de constituants volatils
adsorbés ou combinés dans un matériau. Les
températures où interviennent ces pertes de masses constituent
des informations complémentaires à celles obtenues par ATD pour
l'identification des phénomènes
physico-chimiques impliqués, les deux
caractérisations étant souvent effectuées
simultanément dans le même appareil.
Pour cette analyse, la masse d'échantillon à
analyser est comprise entre 10 et 20 mg. Le matériau est placé
dans un porte-échantillon en céramique d'une balance de
précision. Ce porte échantillon est introduit dans un four
permettant de soumettre le matériau à des cycles de
températures (montées, descentes, isothermes) tout en mesurant
l'évolution de sa masse en fonction de la température de
manière continue. Les diagrammes qui sont présentés
correspondent à la perte de masse en fonction de la température,
et à la courbe dérivée de cette première. Ces
analyses ont été effectuées dans le Laboratoire de
Démo-Center à l'Université de Modena (Italie).
2.2.3 Spectrométrie Infrarouge par
Transformée de Fourier
La spectrométrie infrarouge par transformée de
Fourier (IRTF) permet de déterminer les différents types de
liaisons chimiques d'un échantillon de matériau. Les
différents groupements chimiques constitutifs de la matière
possèdent des niveaux de vibrations qui correspondent à des
énergies précises. Lorsque l'on excite une molécule
à son énergie de vibration propre, celle-ci absorbe
l'énergie incidente. Ce phénomène physique est
utilisé dans l'étude par la spectrométrie infrarouge par
transformée de Fourier.
Pour cette analyse, les échantillons de matériau
ont été finement broyés à une granulométrie
inférieure ou égale à 80 ìm, un faisceau incident
infrarouge est envoyé à travers le spécimen que l'on
souhaite analyser, seules les longueurs d'onde correspondant à une
énergie égale aux niveaux de vibration des molécules de
l'échantillon sont absorbées. Les spectres obtenus
présentent des bandes qui correspondent aux absorptions
caractéristiques de différentes liaisons présentes dans
l'échantillon de matériau.
Les analyses IRTF ont été effectuées dans
le Laboratoire de Chimie Analytique de l'Université de Yaoundé I
(Cameroun). L'analyse a été effectuée en mode absorbance
dans un domaine de nombre d'onde compris entre 4000 et 400 cm-1
à l'aide d'un spectromètre de type Bruker Alpha-P.
2.2.4 Analyse par diffraction de rayons X
16

La diffraction de rayons X (DRX) est l'une des techniques
couramment utilisées pour l'identification des phases
cristallisées contenues dans un matériau. Nos diagrammes de
diffraction des rayons X ont été obtenus à l'aide d'un
diffractomètre de marque Philip PW
3050/60, opérant par réflexion du
rayonnement Ká1 du cuivre (ë= 1,5405 Å). Le domaine angulaire
balayé est 5° = 2è< 80°. Le dépouillement des
diffractogrammes obtenus passe par plusieurs étapes : les pics sont
identifiés ainsi que les valeurs des angles de diffraction 2è ;
à l'aide de la relation de Bragg (ë = 2dhklsinè), les
valeurs des équidistances des plans réticulaires hkl
(dhkl) sont calculées et l'utilisation des données
fournies par la littérature permet l'identification des pics. Pour
l'identification d'une phase cristalline, il faut rechercher d'abord les trois
raies principales ensuite confirmer son existence par comparaison avec celles
des fichiers ASTM de la dite phase.
Les analyses par DRX ont été
réalisées au Laboratoire Démo-Center à
l'Université de Modena (Italie).
2.2.5 Préparation des solutions alcalines
Pour nos travaux, la solution alcaline utilisée
résulte du mélange d'une solution aqueuse de soude (10 M) avec la
solution de silicate de sodium. La quantité de silicate de sodium
équivaut à 7 % de la masse de la solution de soude. La liqueur
liante obtenue a été laissée à la
température ambiante (25 #177; 3 °C) du laboratoire pendant au
moins 24 heures avant son utilisation.
2.2.6 Formulation des pâtes pour
géopolymères et façonnage des éprouvettes
Pour élaborer les pates des géopolymeres,
l'argile est mélangée à la liqueur liante dans un rapport
massique (solution alcaline / argile) égal à
1,1.
En effet, les masses d'argile et de liqueur liante sont
mélangées dans le rapport massique 1,1 pendant 10 minutes (4 min
à vitesse lente et 6 min à vitesse rapide) dans un malaxeur de
marque M & O, modèle N50-G (Figure 7). La
pâte obtenue est utilisée pour le façonnage des
éprouvettes d'expérimentation. Pour nos travaux, trois types
d'éprouvettes ont été élaborés : ceux pour
l'étude dilatométrique, ceux pour les mesures du pourcentage
d'absorption d'eau et ceux pour les mesures mécaniques.
· Pour l'étude dilatométrique, les
éprouvettes dénommées GPD ont été
façonnées à l'aide de moules
parallélépipédiques en plastiques (71 x 5 x 5 mm).
·
17

Pour les mesures mécaniques, les éprouvettes
dénommées GPM ont été élaborées
grâce aux moules cylindriques en PVC (diamètre = 30 mm et hauteur
= 60 mm). Une fois moulé, l'ensemble est vibré pendant 10
minutes
sur une table vibrante électrique de marque M &
O, type 202, N° 106 (Figure 8) pour expulser l'air
emprisonné par les particules des matériaux lors du malaxage.
· Pour les mesures du pourcentage d'absorption d'eau,
les éprouvettes dénommées GPE ont été
élaborées à l'aide de moules cylindriques en PVC
(diamètre = 20 mm et hauteur = 18 mm).
Après le moulage, les trois types d'éprouvettes
(GPD, GPM, GPE) sont laissés pendant 24 heures à la
température ambiante du laboratoire (25 #177; 3 °C) puis à
90 °C dans une étuve de marque Heraeus (VT 50.42 Ek)
pendant 24 heures pour accélérer le durcissement. Le
démoulage est effectué après les opérations
précédentes et les éprouvettes sont ensuite
conservées dans un endroit sec pendant 28 jours.

Figure 7 : Malaxeur de marque M
& O, modèle N50-G

Figure 8 : Table vibrante
électrique de marque M & O, type 202, N°
106
18

2.2.7 Traitement thermique des éprouvettes
géopolymères
Après le démoulage au 28ième
jour, les trois types d'éprouvettes (GPD, GPM, GPE), après
refroidissement à la température ambiante du laboratoire, sont
traités thermiquement pendant 2 heures aux températures suivantes
: 200, 300, 400 et 500 °C. La cuisson a été
effectuée dans un four programmable de marque Nabertherm
(Figure 9), selon une montée en température de 2 °C / min pour
éviter les fissures dans le matériau (Van Jaarseld et
al., 2002). Cette manipulation a été
réalisée dans le laboratoire de Physico-chimie des
Matériaux Minéraux de l'Université de Yaoundé I.

Figure 9 : Four programmable de marque
Nabertherm
2.2.8 Caractérisation des
géopolymères
Les propriétés des matériaux obtenus ont
été évaluées à l'aide des analyses et
mesures suivantes : DRX, MEB, IRTF, pourcentage d'absorption d'eau, retrait
linéaire de cuisson, dilatométrie et résistance à
la compression.
2.2.8.1 Spectrométrie Infrarouge par
Transformée de Fourier
Cette analyse a été effectuée à
partir des tessons d'éprouvettes géopolymères issus des
mesures mécaniques. Ces derniers ont été
pulvérisés dans un mortier en porcelaine puis tamisés
jusqu'à passage intégral au travers d'un tamis d'ouverture de
maille 80 ìm. Seuls les tessons géopolymères
d'éprouvettes traités à 90, 300 et 500°C ont
été soumis à l'analyse IRTF.
19

2.2.8.2 Analyse par diffraction de rayons X
Cette analyse a été effectuée sur les
tessons d'éprouvettes géopolymères résultant des
mesures mécaniques. Ces derniers ont été
broyés dans un mortier en porcelaine puis tamisés
jusqu'à passage intégral à travers un tamis
d'ouverture de maille 80 ìm. Seuls les tessons d'éprouvettes
géopolymères traités à 90, 300 et 500°C ont
été soumis à l'analyse DRX.
2.2.8.3 Microscopie électronique à
balayage
La microscopie électronique est un moyen de produire
une image avec un signal détectable et résultant de l'interaction
entre un faisceau d'électrons et un échantillon cible.
Le principe du balayage consiste à explorer la surface
de l'échantillon par lignes successives et à transmettre le
signal du détecteur à un écran cathodique dont le balayage
est exactement synchronisé avec celui du faisceau incident. Les
microscopes à balayage utilisent un faisceau très fin qui balaie
point par point la surface de l'échantillon. La microscopie
électronique à balayage donne des informations sur les
caractéristiques microstructurales d'un matériau. Ces
caractéristiques permettent de prédire le comportement
mécanique du matériau.
Pour nos travaux, seules les éprouvettes GPE
traitées thermiquement à 90, 300 et 500°C ont
été soumises à la MEB. L'appareil d'expérimentation
utilisé est un Philip XL 30. Ces analyses ont été
menées dans le Laboratoire de Demo-Center à l'Université
de Modena (Italie).
2.2.8.4 Retrait linéaire de cuisson
Les mesures du retrait linéaire de cuisson sont
effectuées à l'aide d'un pied à coulisse qui permet de
déterminer les variations de longueur des éprouvettes GPM
âgées de 28 jours et traitées à 200, 300, 400 et 500
°C. Pour chaque éprouvette, la longueur avant et après la
cuisson a été mesurée.
En désignant respectivement par Lo et L les longueurs de
l'éprouvette avant et après le traitement thermique, le retrait
linéaire de cuisson est donné par la relation (1) :
RL= (1)
2.2.8.5 Pourcentage d'absorption d'eau
20

Les mesures ont été effectuées selon la
norme ASTM C 20 - 74 (ASTM, 1979). Pour effectuer un essai, la masse
ms de l'éprouvette GPE ayant subi un
séchage à 105 °C dans une étuve jusqu'à poids
constant est déterminée. L'éprouvette est ensuite
immergée dans un bécher contenant de l'eau distillée. Le
mélange est porté à ébullition pendant 2 heures.
Après un refroidissement de 24 heures, l'éprouvette
est retirée de l'eau et essorée, sa masse humide
(ma) est déterminée.
Le pourcentage d'absorption d'eau (A) de chaque éprouvette
est exprimé par la relation (2) :
A = (2)
Ces essais ont été réalisés dans le
laboratoire de Physico-chimie des Matériaux Minéraux de
l'Université de Yaoundé I.
2.2.8.6 Analyses thermiques
2.2.8.6.1 Analyses thermiques différentielle et
thermogravimétrique
Les analyses ATD et ATG ont été effectuées
sur les poudres des éprouvettes GPM traitées à 90 °C,
après un broyage et un tamisage à 80 ìm.
2.2.8.6.2 Analyse dilatométrique 2.2.8.6.2.1
Principe
L'analyse thermodilatométrique consiste à
étudier les variations de longueur d'une éprouvette de
matériau à analyser en fonction de la température. En
effet, lorsqu'aucune transformation ne se produit dans le matériau quand
varie la température, la variation de longueur se fait de façon
linéaire et régulière ; si par contre une transformation
se produit à une certaine température, il en résulte une
modification de dimension traduite par une variation sensible du coefficient de
dilatation et il apparaît une anomalie sur la courbe de variation de
longueur. La dilatation par unité de longueur (dilatation
spécifique) est donnée par la relation (3).
Ä= (3)
L0 = longueur du matériau à la température
ambiante T0 et LT = longueur du matériau à la température
T.
21

2.2.8.6.2.2 Mode opératoire
L'appareil utilisé dans le cadre de nos travaux est un
dilatomètre mécanique de type Chevenard, modèle D.M. 15
simple (Figure 10). Il permet l'enregistrement mécanique de la courbe
dilatation-retrait en fonction de la température jusqu'à 1100
°C.
| Mémoire de Master en chimie rédigé et
présenté par Tchadjié Noumbissié Léonel
(2012).

Figure 10 : Dilatomètre
mécanique type Chevenard, modèle D.M. 15 simple.
Pour la réalisation d'un thermodilatogramme,
l'éprouvette de matériau préalablement dimensionnée
à une longueur de 65 mm (L0) est introduite dans l'un des tubes
cylindriques du dispositif d'enregistrement et l'étalon est mis dans
l'autre tube ; une tige poussoir est accolée à chacune des
éprouvettes et le bloc formant l'ensemble est adapté à la
partie du trépied amplificateur.
Après la mesure de température initiale dans le
four du dilatomètre (20 - 24 °C), les tubes contenant les
éprouvettes sont introduits dans le four, puis thermiquement
isolés.
Un papier d'enregistrement est fixé sur le cadre du
chariot mobile ; sur ce papier la tige à plume permet de repérer
la température initiale du four. Pendant que la température
s'élève dans le four, la variation de longueur de
l'échantillon est enregistrée. Le même programme de chauffe
est adopté pour toute l'étude (5 °C/ min)
22

Sur le thermodilatogramme obtenu, l'on trace les axes de
coordonnées Ä (dilatations spécifiques) et T
(Températures) correspondant respectivement aux abscisses (mm) et aux
ordonnées (mm). Le type de montage utilisé est tel que suivant
les axes des coordonnées nous mesurons les quantités : x
= K1L0( Äð - ÄSiO2) et y = K2L0Äéch
avec K1 et K2 coefficients d'amplification donnés par le
constructeur ( K1 = 87, 8 et K2 = 75 ) . Äð , ÄSiO2 ,
Äéch sont respectivement les dilations spécifiques de
l'étalon en pyros et les tiges poussoirs en silice amorphe vitreuse. L0
est la longueur de l'éprouvette de matériau
expérimentée (65 mm) à la température de
référence T0 (22 °C).
| Mémoire de Master en chimie rédigé et
présenté par Tchadjié Noumbissié Léonel
(2012).
L'étalon est un alliage de type pyros 56 de forme
parallélépipédique et de dimensions (65 x 5 x 5 mm) ; les
lois de dilatation de l'étalon pyros et la silice amorphe vitreuse entre
0 et 1150 ° C sont consignées en annexes.
Cette analyse a été réalisée dans le
laboratoire de Physico-chimie des Matériaux Minéraux de
l'Université de Yaoundé I.
2.2.8.7 Résistance à la compression
La résistance à la compression est
mesurée au cours de l'écrasement des éprouvettes GPM
âgées de 28 jours, respectivement non traitées
thermiquement et sur celles traitées à 90, 200, 300, 400 et 500
°C.
L'essai consiste à soumettre l'éprouvette GPM
à une charge continue et progressive à l'aide d'une presse
électro-hydraulique M& O, type 11.50, N° 21 (Figure
11) jusqu'à écrasement. La résistance à la
compression est le rapport entre la charge de rupture et la section
transversale de l'éprouvette, calculée d'après la relation
(4) :
4
(4)
: Résistance à la compression de
l'éprouvette en MPa. F : charge maximale
supportée par l'éprouvette en kN.
d : diamètre de l'éprouvette en
mm
Ces essais ont été effectués suivant la
norme EN 196-1 (EN, 2004) dans le Laboratoire de Physico-chimie des
Matériaux Minéraux de l'Université de Yaoundé 1.
23


Figure 11 : Presse
électro-hydraulique M& O, type 11.50, N° 21.
24

CHAPITRE 3 : RÉSULTATS ET DISCUSSION
3.1 Caractérisation de la fraction argileuse
3.1.1 Analyse chimique
La composition chimique de la fraction argileuse est
consignée dans le tableau 1. De cette analyse, il ressort que la
fraction argileuse contient d'importantes quantités de silice (43,45%)
et d'alumine (37,6%). L'oxyde de fer a un titre égal à (1,98%),
tandis que les autres oxydes sont présents avec des teneurs peu
élevées. La perte au feu est de (13,8%), valeur pas très
éloignée de celle de la kaolinite (13,9%).
Ces résultats laisseraient penser que le quartz et les
aluminosilicates sont
prédominants dans cette fraction argileuse. Le rapport
massique SiO2/Al2O3 est voisin de 1, ce qui indiquerait une forte teneur en
kaolinite (Figure 12).
Tableau 1 : Composition chimique de la
fraction argileuse (P.F. = perte au feu).
|
Oxydes
|
SiO2
|
Al2O3
|
Fe2O3
|
TiO2
|
K2O
|
Na2O
|
SO3
|
V2O5
|
Cl
|
P.F.
|
Total
|
|
%
|
43,45
|
37,60
|
1,98
|
0,93
|
0,70
|
0,51
|
0,06
|
0,04
|
0,01
|
13,8
|
99,17
|
3.1.2 Analyse par diffraction de rayons X
Le dépouillement du diffractogramme de rayons X de la
phase minéralogique argileuse (figure 1) permet de mettre en
évidence la présence de :
- la kaolinite [Si2O5Al2(OH)4] dont les raies
sont observées à ( en ?) 7,21; 1,49 ; 3,58 ; 4,47 ; 4,37 ; 4,17 ;
3,88 ; 3,35 ; 2,56 ; 2,53 ; 2,49 ; 2,38 ; 2,33 ; 2,30 ; 2,19 ; 2 ; 2,12 ; 1,99
; 1,97 ; 1,94 ; 1,89 ; 1,84 ; 1,82 ; 1,78 ; 1,68 ; 1,66 ; 1,62 ; 1,58 et 1,54
(fiche ASTM 14-164) ;
- quartz (SiO2), raies à (en ?) 3,35 ;
4,25 ; 2,12 ; 1,82 ; 2,45 ; 2,30 ; 2,12 ; 1,99 ;
1,97 ; 1,78 ; 1,68 ; 1,66 ; 1,62 ; 1,54 ; 1,45 et 1,43 (fiche
ASTM 5-490) ;
- l'illite (Kx+y
[(Si4-xAlx)O10(Al2-yFeIIY) (OH)2] avec les raies à ( en ?)
9,96 ; 4,47 ; 3,35 ; 4,99 ; 3,21 ; 2,53 ; 2,49 ; 2,45 ; 2,19 ; 1,99 ; 1,97 ;
1,66 ; 1,54 ; 1,45 et 1,43 (fiche ASTM 9-343) ;
25
- la lepidocrocite [?-FeO(OH)] dont les raies
sont à (en ?) 3,35 ; 2,38 ; 2,86 ; 2,33 ;

2,12 ; 1,94 ; 1,49 ; 1,58 ; 1,54 à 1,44 (fiche ASTM
8-98).
- l'anatase (TiO2) dont les raies sont
à (en ?) 3, 58 ; 1,89 ; 2,38 et 1,68 (fiche ASTM 4-447).
Le diffractogramme de rayons X montre que la fraction
argileuse est constituée majoritairement de kaolinite. Le quartz,
l'illite, la lepidocrocite et l'anatase sont dans de faibles proportions.
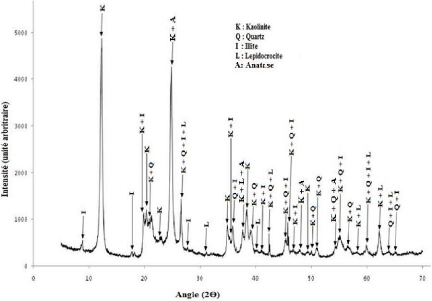
Figure 12 : Diffractogramme de rayons X
de la fraction argileuse.
3.1.3 Analyses thermiques différentielle et
thermogravimétrique
Dans le but d'obtenir des informations complémentaires
avec celles provenant de l'analyse minéralogique donnée par la
diffraction de rayons X, les analyses thermiques différentielle (ATD) et
thermogravimétrique (ATG) ont été effectuées sur
notre matériau argileux.
26
La figure 13 présente les thermogrammes d'ATD et d'ATG de
la fraction argileuse.

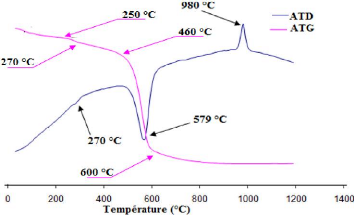
Figure 13 : Thermogrammes d'ATD et d'ATG
de la fraction argileuse. L'exploitation du thermogramme d'ATD permet de mettre
en évidence trois phénomènes thermiques :
- Un pic endothermique autour de 270 °C qui correspond
à la deshydroxylation de la
lepidocrocite (?-FeO(OH)) selon l'équation de
réaction (1) (Rollet et Bouaziz, 1972) ;
2[?-FeO(OH)] ?-Fe2O3 + H2O (1)
270-300°C
Lepidocrocite maghémite eau
- Un important pic endothermique autour de 579 °C qui
correspond à la deshydroxylation de la kaolinite en métakaolinite
selon l'équation de réaction (2) 570-580 °C
(Rollet et Bouaziz, 1972) :
mt
- un pic exothermique autour de 980 °C relatif à la
réorganisation structurale de la métakaolinite selon
l'équation de réaction (3) (Rollet et Bouaziz, 1972) :
27

Pour ce qui concerne le thermogramme d'ATG, deux
phénomènes thermiques sont révélés :
- une faible perte de masse entre 250 et 270 °C qui
correspond bien à la deshydroxylation de la lepidocrocite.
- Une importante perte de masse entre 460 et 600 °C
correspondant à la deshydroxylation de la kaolinite.
3.1.4 Spectrométrie Infrarouge par
Transformée de Fourier
Le spectre infrarouge par transformée de Fourier (Figure
14) de la fraction argileuse présente quatre domaines d'absorption.
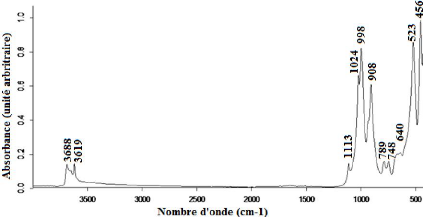
Figure 14 : Spectre infrarouge par
transformée de Fourier de la fraction argileuse.
Dans le premier domaine, les bandes à 3688 et 3619
cm-1 sont attribuables à la vibration de la liaison O-H des
groupements hydroxyles de la kaolinite (Qtaitat et AlTrawneh, 2005 ; Saikia et
al., 2010).
28
Le second domaine comprend quatre bandes d'absorption. La
bande à 1113 cm-1 correspond à la vibration de la
liaison Si-O de la kaolinite. Les bandes à 998 et 1024 cm-1
sont respectivement attribuables aux vibrations d'élongations
symétriques et asymétriques de la liaison Si-O-Si dans la
kaolinite (Qtaitat et Al-Trawneh, 2005). La vibration à 908
cm-1est attribuable à la déformation de la liaison
Al-OH dans la kaolinite (Saikia et al., 2010).

Dans le troisième domaine, les bandes à 789 et 748
cm-1correspondent aux différents modes de vibration de la
liaison Si-O-AlIV (où Al est tétracoordonné)
dans la kaolinite. La
29
bande à 640 cm-1 est attribuable à la
vibration de la liaison Si-O-Si dans la kaolinite (Bich, 2005 ; Saikia et
al., 2010).
Le quatrième domaine comprend deux bandes d'absorption.
Les vibrations à 523 et à 456 cm-1 attribuables
respectivement aux déformations des liaisons Si-O-AlVI
(où Al est hexacoordonné) et Si-O-Si dans la kaolinite (Bich,
2005 ; Saikia et al., 2010).
3.2 Caractérisation des
géopolymères
3.2.1 Aspect des éprouvettes
La figure 15 présente les grandes et les petites
éprouvettes cylindriques (GPM et GPE) thermiquement non traitées.
A la température ambiante du laboratoire, le façonnage a permis
leur démoulage 7 jours après le coulage de leur pâte. A
leur sortie des moules, ces éprouvettes conservent leur forme pendant
tout le temps de séchage. Elles présentent toutefois
l'efflorescence. Cette efflorescence résulte de la réaction
chimique entre l'excès d'hydroxyde de sodium dissous dans le
matériau avec le gaz carbonique contenu dans l'air atmosphérique
(Komnitsas et Zaharaki, 2007). A la fin du séchage, les
éprouvettes ont la même couleur que le matériau argileux de
départ.
Les éprouvettes cylindriques (GPM et GPE) et
parallélépipédiques (GPD) maintenues préalablement
à 90 °C pendant 24 heures ou traitées à 500 °C
sont présentées sur la figure 16. A la fin du séchage et
du traitement, les éprouvettes ne subissent ni déformation, ni
écornure mais seulement une variation de couleur qui est fonction de la
température.

Figure 15 : Les éprouvettes GPM
(a) et GPE (b) thermiquement non traitées.


30
Figure 16 : Les éprouvettes GPM
et GPE traitées à 90 °C (a) ou 500 °C (b) ;
éprouvettes
GPD traitées à 90 °C (c).

3.2.2 Spectrométrie Infrarouge par
Transformée de Fourier
La comparaison entre les spectres infrarouges par
transformée de Fourier (IRTF) des géopolymères
traités à 90, 300 ou 500 °C (Figure 17 b-d) avec celui de la
fraction argileuse (Figure 17-a), montre des différences importantes.
En effet, sur les spectres IRTF des matériaux
traités à 90 ou à 300 °C, il apparait encore les
bandes à 3693 et 3619 cm-1 caractéristiques de la
liaison (O-H) des groupements hydroxyle de la kaolinite. Ceci montre que pour
un traitement thermique atteignant 300 °C la réaction de
géopolymérisation est encore incomplète au sein du
matériau. Ce résultat permet de mettre en exergue
l'efficacité du paramètre « température » au
cours de cette synthèse. Ainsi la comparaison des spectres des
géopolymères traités à 90 et 300 °C (Figure 17
b et c) avec celui du produit obtenu à 500 °C (Figure 17-d) montre
que ce dernier ne contient plus la kaolinite, minéral précurseur
de synthèse. Les bandes entre 3432-3405 cm-1 et entre 1651-
1646 cm-1 sont respectivement attribuables aux vibrations
d'élongation (H-O) et de déformation (H-O-H) dans les
molécules d'eau absorbées ou présentes dans les
cavités de la structure des géopolymères (Fernandez et
Palomo, 2005 ; Rovnanik, 2010). Les bandes entre 1477 et 1415 cm-1
sont attribuables à la vibration d'élongation de la liaison
O-C-O, ceci traduit la présence de carbonate de sodium (Barbosa et
Mackenzie, 2003). La large bande intense entre 951 et 965 cm-1
obtenue pour les traitements à 90, 300 ou à 500 °C, indique
bien que les produits correspondant sont différents du matériau
argileux de départ. En effet, cette bande est attribuable à la
vibration d'élongation asymétrique des liaisons Si-O et Al-O dans
les tétraèdres SiO4 et AlO4 des géopolymères
(Rovnanik, 2010 ; Youssef et al., 2010). Les petites bandes entre 657
et 720 cm-1 représentent les vibrations d'élongation
symétrique des liaisons Si-O-Si et Al-O-Si dans les
géopolymères (Panias et al., 2007).
31

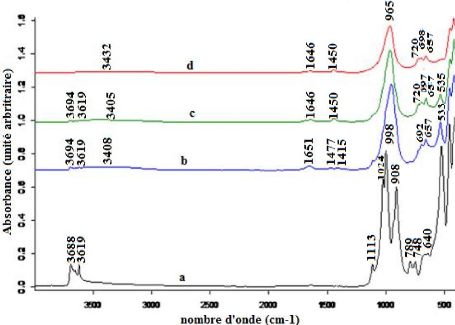
Figure 17 : Spectres IRTF : (a)
matériau argileux, (b) géopolymère traité à
90 °C, (b) géopolymère traité à 300 °C,
(d) géopolymère traité à 500 °C.
3.2.3 Analyse par diffraction de rayons X
32

La figure 18 présente les diffractogrammes de rayons X
de la fraction argileuse et des produits de synthèse par
géopolymérisation, suivi du traitement thermique. Une comparaison
entre le diffractogramme de la fraction argileuse (Figure 18-a) avec ceux des
produits obtenus (Figure 18 b-d) indique l'importance de la température
au cours de cette synthèse. En effet, bien que de nouvelles phases
cristallines soient formées au cours de la synthèse
géopolymère, l'évolution quantitative de la kaolinite
(intensité de sa raie principale à 7,14-7,23 ?), minéral
fortement impliqué au cours de ce processus, est sensible à la
température. Ainsi les produits géopolymères
traités à 90 ou à 300 °C contiennent de la kaolinite.
Cependant, la teneur en kaolinite dans le produit traité à 300
°C est moins importante que celle contenue dans le produit obtenu à
90 °C, ce qui confirme la sensibilité de la synthèse
géopolymère vis-à-vis de la température.
Le diffractogramme du produit traité à 500
°C indique que la kaolinite n'est plus présente (Figure 18-d). Ce
minéral a été totalement consommé dans le processus
de géopolymérisation. L'implication de ce minéral dans la
synthèse géopolymère sous l'effet de la température
est donc en accord avec les résultats obtenus en analyse infrarouge par
transformée de Fourrier (Figure 17 et 18-d). Les diffractogrammes des
matériaux traités à 90, 300 et 500 °C montrent la
formation de l'hydroxysodalite (Na4Al3Si3O12OH), composé
aussi observé par Zaharaki et al. (2010) au cours de la
synthèse géopolymère du mélange scories/kaolin.
Il faut enfin noter la présence du quartz et de nombreuses
raies sur ces diffractogrammes dont l'identité des phases cristallines
n'a pas encore pu être révélée.
33

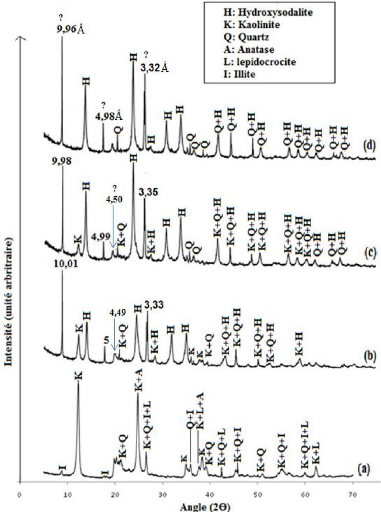
34
Figure 18 : Diffractogrammes de rayons
X : (a) matériau argileux, (b) géopolymère traité
à
90 °C, (b) géopolymère traité à
300 °C, (d) géopolymère traité à 500
°C.

3.2.4 Microscopie électronique à balayage
La figure 19 présente les micrographes des
géopolymères maintenus respectivement à 90, 300 et
500°C. Pour ces différentes températures, les micrographes
obtenus indiquent que les produits se composent de particules ayant la forme de
plaquettes qui rappellent celles de la kaolinite (Figure 19-a), de plaquettes
de kaolinite qui ont une taille amoindrie (Figure 19-b) du fait de la
synthèse géopolymère ou comme des feuillets qui
s'interpénètrent tout en semblant se coller les uns sur les
autres (Figure 19-c).
Au cours du traitement thermique, il apparaît une phase
blanchâtre ou vitreuse dont la teneur est plus importante pour les
produits traités à 90 et à 500°C. Les spectres EDX de
ces matériaux n'ont pas été effectués, cependant la
phase blanchâtre et peu étendue qui est observée sur le
micrographe du géopolymère traité à 90°C
serait de l'hydrogénocarbonate de sodium (NaHCO3), produit
résultant de la réaction chimique (4) qui se produit entre
l'hydroxyde de sodium (aqueux) résiduel et le dioxyde de carbone de
l'air. La présence de cette phase a par ailleurs été
révélée sur le spectre IRTF (figure 17-b) de ce
produit.
NaOH + CO2 ? NaHCO3. (4)
Pour ce qui est de la phase apparemment vitreuse à la
figure 19-c, elle résulterait de la fusion de la soude
résiduelle. Tous ces produits laissent apparaître quelques pores
résultant de l'élimination des molécules d'eau contenues
dans ces matériaux.
Les produits obtenus à 90 ou à 300°C semblent
apparemment plus consolidés, ce qui indique l'importance de la
température au cours du processus de géopolymérisation.
35


36

Figure 19 : Micrographes des
géopolymères: (a) géopolymère traité
à 90 °C, (b)
géopolymère traité à
300 °C, (c) géopolymère traité à 500
°C.
3.2.5 Analyses thermiques
3.2.5.1 Analyses thermiques différentielle et
thermogravimétrique
La figure 20 présente les thermogrammes de l'analyse
thermique différentielle (ATD), de l'analyse thermogravimétrique
(ATG) et sa courbe dérivée (TGD) pour le
géopolymère traité à 90 °C.
La courbe d'ATD met en évidence quatre
phénomènes endothermiques qui correspondent aux
températures de 45, 126, 215 et 473 °C. Le phénomène
observé à 45 °C correspond à l'élimination de
l'eau hygroscopique. A 126 °C, il se produit probablement le départ
d'une eau zéolitique alors qu'à 215 °C, il s'agirait de
l'élimination d'une eau adsorbée. Le phénomène
endothermique important à 473 °C correspond à
l'élimination de l'eau de constitution de la kaolinite (Rollet et
Bouaziz, 1972) résiduelle contenue dans ce produit comme en
témoignent ses spectres IRTF (Figure 17-b) et DRX (Figure 18-b).
Les courbes d'ATG et de sa dérivée corroborent les
phénomènes observés en ATD.
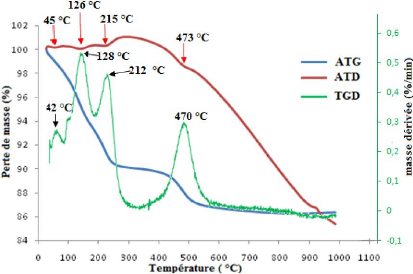
37
Figure 20 : Thermogrammes d'ATD et d'ATG/
TGD du géopolymère traité à 90 °C.

|
Température
initiale de
traitement
du
géopolymère
(°C)
|
Température de rupture de pente
(°C)
|
|
T1
|
T2
|
T3
|
T4
|
Observations
|
|
90
|
308
|
526
|
572
|
702
|
-T1 est observée dans les
géopolymères traités à 90, 300 et 500 °C. Elle
correspond à la deuxième rupture de pente consécutive
à la deuxième dilatation.
- T2 est observée dans les
géopolymères traités à 90, 300, 400 et 500 °C.
Elle correspond à la fin de la troisième dilatation et au
début d'un grand retrait.
- T3 est observée seulement dans les
géopolymères traités à 90, 300 et
400°C. Elle correspond à une inflexion consécutive au grand
retrait à partir de T2 et à une nouvelle dilatation qui finit
à T4.
- T4 est observée dans les
géopolymères traités à 90, 300, 400 et 500 °C.
Elle correspond à une rupture de pente.
|
|
300
|
331
|
521
|
577
|
730
|
-T1 est observée dans les
géopolymères traités à 90, 300 et 500 °C. Elle
correspond à la deuxième rupture de pente consécutive
à la deuxième dilatation.
- T2 est observée dans les
géopolymères traités à 90, 300, 400 et 500 °C.
Elle correspond à la fin de la troisième dilatation et au
début d'un grand retrait.
- T3 est observée seulement dans les
géopolymères traités à 90, 300 et
400°C. Elle correspond à une inflexion consécutive au grand
retrait à partir de T2 et à une nouvelle dilatation qui finit
à T4.
- T4 est observée dans les
géopolymères traités à 90, 300, 400 et 500 °C.
Elle correspond à une rupture de pente.
|
38

3.2.5.2 Analyse dilatométrique
La figure 21 présente les résultats du
comportement dilatométrique des géopolymères
traités initialement à 90, 300, 400 et 500 °C, alors que le
tableau 2 en donne le récapitulatif des différentes
températures qui expriment les phénomènes
observés.
Tableau 2 : Récapitulatif des
phénomènes observés au cours de l'analyse
dilatométrique.
|
|
|
|
|
- T1 est observée dans les
géopolymères traités à
90, 300 et 500 °C.
Elle correspond à la deuxième
|
|
400
|
|
|
|
|
rupture de pente consécutive à la deuxième
dilatation.
|
|
|
|
|
|
-T2 est observée dans les
géopolymères traités à
|
|
349
|
516
|
557
|
-
|
90, 300, 400 et 500 °C. Elle correspond à la fin de
la dilatation et au début d'un grand retrait.
|
|
|
|
|
|
-T3 est observée dans les
géopolymères traités à
|
|
|
|
|
|
90, 300 et 400°C. Elle correspond à première
rupture de pente au cours du grand retrait.
|
|
|
|
|
|
-T1 est observée dans les
géopolymères traités à
|
|
|
|
|
|
90, 300 et 500 °C. Elle correspond à la
deuxième
rupture de pente consécutive à la
deuxième
|
|
500
|
|
|
|
|
dilatation.
|
|
|
|
|
|
- T2 est observée dans les
géopolymères traités à
|
|
320
|
521
|
-
|
707
|
90, 300, 400 et 500 °C. Elle correspond à la fin
de la troisième dilatation et au début d'un grand retrait.
|
|
|
|
|
|
- T4 est observée dans les
géopolymères traités à
|
|
|
|
|
|
90, 300, 400 et 500 °C. Elle correspond à une rupture
de pente.
|
Toutes ces courbes (Figure 21) se caractérisent par les
températures T1, T2 et T4. La température T3 est une
spécificité du comportement dilatométrique des
matériaux traités à 90, 300 et 400 °C. Cette
température est absente sur le thermodilatogramme du
géopolymère initialement traité à 500 °C.
39

La température T1 exprime la fin de la deuxième
dilatation et le commencement de la troisième dilatation. Cette
dilatation résulterait probablement de l'expansion des phases contenues
dans ces produits jusqu'à cette température. Pour les
géopolymeres initialement traités à 90, 300 et 400
°C, la température T2 est voisine de 525 °C. Elle est en
relation avec l'effondrement du réseau de la kaolinite. En effet, l'eau
de constitution de la kaolinite s'élimine tout en produisant une
contraction de l'éprouvette de matériau. Ce résultat est
étayé par l'existence de ce minérale sur les spectres DRX
(Figure 18 b et c) et IRTF (Figure 17 b et c) des géopolymères
traités à 90 et à 300 °C. Quant au
géopolymère initialement traité à 500 °C, le
comportement thermodilatométrique après la température T2
est différent de celui observé pour les matériaux
initialement traités à 90, 300 et 400 °C. En effet, le
matériau initialement traité à 500 °C ne contient
plus de minérale kaolinite (Figures 17 et 18), sur cet intervalle de
température, la dilatation du matériau est régie par les
phases déjà présentes
jusqu'à 500 °C (phases de transformation de
géopolymères, quartz, anatase, etc.). Ceci est donc traduit par
une certaine résistance à l'effondrement de l'éprouvette
jusqu'à la température T4 où le frittage commence à
prédominer.
Le phénomène exprimé par la
température T3 est en relation avec le polymorphisme quartz á
quartz â qui se manifeste généralement sur les courbes
dilatométriques des matériaux argileux kaolinitiques entre 557 et
585 °C (Elimbi, 1991).
La température T4 est traduite par un important retrait
qui est en relation avec le frittage devenu très élevé
comparé à la dilatation des différentes phases contenues
dans le matériau.
40

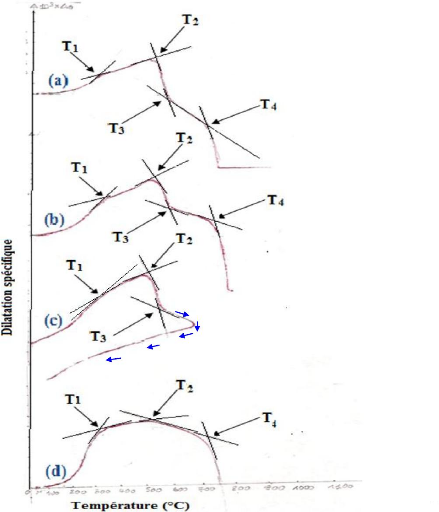
41

Figure 21 : Thermodilatogrammes des
géopolymères traités à : 90 °C (a) ; 300
°C (b);
400 °C (c) et 500 °C (d).
3.2.6 Retrait linéaire de cuisson
Les résultats de ces mesures sont consignés en
annexes. La figure 22 présente les variations du retrait linéaire
de cuisson en fonction de la température pour les
géopolymères traités à 200, 300, 400 et 500
°C. Il ressort de cette figure que la plus faible valeur de retrait
linéaire de cuisson (0,42 %) est obtenue pour le
géopolymère traité à 200 °C. En revanche la
plus grande valeur (0,57 %) correspond au géopolymère maintenu
à 300 °C. Par ailleurs, le retrait linéaire de cuisson
augmente du géopolymère traité à 200 °C
à celui maintenu à 300 °C. Après cette
température, le retrait linéaire de cuisson diminue faiblement
lorsqu'augmente la température.
Le retrait est une traduction des transformations
physico-chimiques qui se produisent au sein du matériau soumis à
un traitement thermique. Ainsi au cours du traitement thermique, les
transformations telles que l'élimination des eaux (hygroscopique et de
constitution) ou la fusion de la soude résiduelle dans le
géopolymère, provoquent une variation de dimensions de
l'éprouvette expérimentée. L'augmentation de retrait entre
200 °C et les autres températures plus élevées est la
conséquence des transformations physicochimiques à un niveau plus
élevé au sein des matériaux maintenus à 300, 400 ou
500 °C. A 300 °C le retrait linéaire de cuisson est plus
élevé qu'à 200 °C probablement parce qu'il se
produirait un début d'apparition de phase vitreuse, (soude
résiduelle associé au phénomène d'eutectique) au
sein du premier matériau. Après l'apparition de la phase vitreuse
; le retrait linéaire des matériaux traités à 300,
400 ou 500 °C présente de faibles écarts. Ceci serait
dû au fait que ces derniers matériaux subissent des
transformations physico-chimiques assez voisines.
La valeur du retrait linéaire de cuisson à 90
°C n'a pas pu être obtenue parce que lors du traitement à
cette température, les matériaux sont encore dans les moules.
42

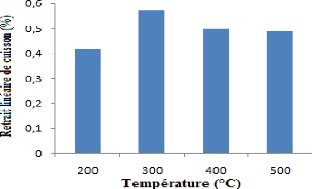
Figure 22 : Retrait linéaire de
cuisson en fonction de la température de traitement
des
géopolymères.
3.2.7 Pourcentage d'absorption d'eau
Les résultats de mesures effectuées sont
consignés en annexes. La figure 23 présente
les variations du pourcentage d'absorption d'eau en fonction
de la température de traitement des géopolymères. Il
ressort de cette figure que pour un maintien des matériaux à 90,
200 et 300 °C, le pourcentage d'absorption d'eau accuse une augmentation.
Entre 300 et 400 °C cette caractéristique diminue puis croît
à 500 °C.
43

Pour ce qui concerne les températures de 90, 200 et 300
°C, l'augmentation du pourcentage d'absorption d'eau peut résulter
de l'élimination des eaux hygroscopiques, zéolitiques,
d'absorption des géopolymères (Figure 17) et de constitution de
la kaolinite au cours du traitement thermique. L'élimination de ces eaux
provoque une modification de la microstructure du matériau, ce qui
probablement fait apparaître des pores. Evidemment au voisinage de 300
°C, il peut apparaître une faible quantité de phase vitreuse
résultant de la fusion de la soude résiduelle contenue
initialement dans le matériau. Cependant, jusqu'à cette
température, la quantité de phase vitreuse a un impact mineur
vis-à-vis des transformations liées à l'élimination
des eaux. A 400 °C, une phase vitreuse un peu plus abondante,
consécutive à la fusion de la soude résiduelle contenue
dans le géopolymère, participe à la diminution des pores
contenus dans ce matériau, ce qui provoque une faible diminution du
pourcentage d'absorption d'eau. A 500 °C, bien que le magma vitreux
apporté par la fusion de la soude résiduelle soit plus important
dans le matériau, il apparaît subitement de gros
pores et de petites fentes au sein du produit, ce qui a pour
conséquence une augmentation du pourcentage d'absorption d'eau.
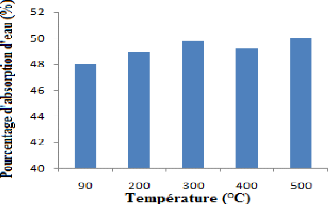
Figure 23 : Pourcentage d'absorption
d'eau en fonction de la température de traitement
des
géopolymères.
3.2.8 Résistance à la compression
Les résultats des mesures effectuées sont
consignés en annexes. La figure 24 présente les variations des
essais en compression en fonction de la température de traitement des
géopolymères. Cette figure montre que la résistance
à la compression accuse une augmentation depuis la température
ambiante jusqu'à 400 °C puis devient constante entre 400 et 500
°C. La plus petite valeur (4,9 MPa) est obtenue pour le
géopolymère maintenu à la température ambiante
alors que la plus grande valeur (8,9 MPa) est obtenue pour les
températures de 400 et 500 °C.
44

L'augmentation de la résistance à la
compression, de la température ambiante jusqu'à 400 °C
résulte de l'augmentation du degré de réaction de
géopolymérisation consécutive, ce qui conduit aux
matériaux plus consolidés. Entre 400 et 500 °C, la constance
de la résistance à la compression peut résulter de
l'augmentation de pores et de la formation de petites fissures au sein du
matériau obtenu à 500 °C. Ceci ne permet pas d'optimiser ses
propriétés mécaniques (Lemougna et al., 2011).
Ces résultats sont en accord avec les observations de l'analyse
microstructurale de ces géopolymères (Figure 19).
L'évolution des propriétés
mécaniques des géopolymères avec la
température varie dans le même sens que les observations Khoury et
al. (2011) sur les géopolymères à base de
kaolinite et obtenus à basse température.
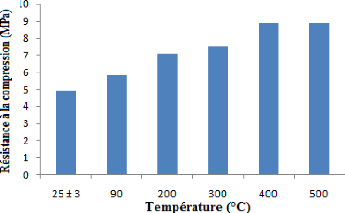
Figure 24 : Résistance à
la compression en fonction de la température de traitement
des
géopolymères.
45

CONCLUSION
Ce travail a consisté à étudier le
comportement thermique des géopolymères à base de
kaolinite. Les géopolymères ainsi synthétisés ont
d'abord subi un séchage à 90 °C pendant vingt-quatre heures
puis un maintien de durée de 28 jours à la température
ambiante du laboratoire. Enfin ils ont été traités
à 200, 300, 400, et 500 °C durant 2 heures. Il ressort de cette
étude que :
- A la fin du séchage et du traitement thermique, les
éprouvettes conservent leur forme
initiale mais présentent une variation de couleur qui est
fonction de la température ;
- Les géopolymères traités à 90,
300 et 500 °C contiennent l'hydroxysodalite comme phase cristalline
résultant de la synthèse géopolymère.
L'augmentation de la température de traitement diminue la proportion de
kaolinite à la faveur de la phase géopolymère ;
- La réaction n'est pas encore terminée pour les
géopolymères obtenus après un
traitement atteignant 300 °C. Néanmoins, les produits
obtenus sont assez consolidés ; - Le produit obtenu à 500 °C
étale une assez bonne stabilité dimensionnelle entre 300
et
700 °C ;
- Les géopolymères traités à, 200,
300, 400 et 500 °C présentent de faibles valeurs de
retrait linéaire de cuisson (inférieure à
0,6 %) ;
- Les géopolymères traités à, 90,
200, 300, 400 et 500 °C sont poreux et ont une valeur
de pourcentage d'absorption d'eau qui est comprise entre 48 et 50
% ;
- La résistance à la compression des
géopolymères augmente de la température
ambiante (4,9 Mpa) jusqu'à 400 °C (8,9 Mpa) puis
devient constante entre 400 et 500 °C.
L'ensemble de ces résultats permet de mettre en exergue
l'efficacité du paramètre température au cours de la
synthèse des géopolymères à base de kaolinite. Les
propriétés mécaniques des géopolymères
semblent commencer à se dégrader pour un traitement atteignant
500 °C. Ces matériaux peuvent être utilisés pour la
production des briques de terre cuite. Pour une cuisson comprise entre 300 et
400 °C.
46

Pour la suite de nos travaux, nous comptons axer notre
étude sur l'identification des phases cristallines contenues dans les
géopolymères. Nous comptons aussi explorer le comportement
thermique des géopolymères obtenus à partir du
mélange kaolinite/sable afin d'améliorer certaines
propriétés des produits obtenus.
| Mémoire de Master en chimie rédigé et
présenté par Tchadjié Noumbissié Léonel
(2012).
REFÉRENCES BIBLIOGRAPHIQUES
- Akono M. A., (2009). Etude
géotechnique des matériaux alluvionnaires argileux de Nkolondom
(Yaoundé) - comparaison de leurs produits de cuisson obtenus par la
méthode traditionnelle et par géopolymérisation.
Mémoire de D.E.A, Faculté des Sciences, Université de
Yaoundé I, 81 p.
- Alshaaer M. and Tair A. A., (2009).
Proceedings of the 11th International Conference on Non-conventional Materials
and Technologies: Production of low cost building materials using local
resources for possible use in disaster situation. 6-9 September 2009, Bath
(United Kingdom), 8 p.
- American Society for Testing Materials (ASTM),
(1979). Standard test methods for apparent porosity, water absorption,
apparent specific gravity, and bulk density of burned refractory brick by
boiling water. ASTM C 20 -74, 3p.
- Barbosa F. F. V. and Mackenzie J. D. K.,
(2003). Thermal behaviour of inorganic geopolymers and composites derived from
polysialate. Materials Research Bulletin, 38,
319-331.
- Bich C., (2005). « Contribution
à l'étude de l'activation thermique du kaolin: Evolution de la
structure cristallographique et activité pouzzolanique »,
Thèse de doctorat Ph.D., Institut National des Sciences
Appliquées de Lyon, Spécialité : Génie civil, 255
p.
- Bourlon A., (2010). « Physico-chimie
et rhéologie de géopolymères frais pour la cimentation des
puits pétroliers », Thèse de Doctorat,
Spécialité Physique et Chimie des Matériaux,
Université Pierre et Marie Curie, 203 p.
- Bouterin C., Davidovits J., (2003).
Réticulation géopolymérique (LTGS) et matériaux de
construction. Géopolymère, 1, 79-88.
- Buchwald A., Vicent M., Kriegel R., Kaps C., Monzo
M., Barba A., (2009). Geopolymeric binders with different fine fillers
- phase transformations at high temperatures. Applied Clay Science,
45, 190-195.
- Cheng T. W. and Chiu J. P., (2003).
Fire-resistant geopolymer produced by granulated blast furnace slag.
Minerals Engineering, 16, 205-210.
- Davidovits J., (1991). Geopolymers:
Inorganic polymeric new materials. Journal of Thermal Analysis,
37, 1633-1656.
- Davidovits J., (1994). First international
conference of alkaline cements and concretes: Properties of geopolymer cements.
Kiev (Ukraine), 131-149.
- Davidovits J., (2002). Geopolymer
Conference: 30 years of successes and failures in geopolymer applications.
Market trends and potential breakthroughs. October 28-29, Melbourne
(Australia), 16 p.
- Davidovits J., (2011). « Geopolymer
Chemistry and Applications », 3e éd., Institut
Géopolymère, France, p. 3-32.
47

- De Silva P., Sagoe-Crenstil K. and Sirivivatnanon
V., (2007). Kinetic of géopolymérisation: role of
Al2O3 and SiO2. Cement and Concrete Research,
37, 512- 518.
- Delatte J. et Facy G., (1993). Des
bétons antiques aux géopolymères. Arts et
Métiers Magazine, 180, 8-16
- Duxson P., (2006). « The structure and
thermal evolution of metakaolin geopolymers», Thèse de Doctotat
Ph.D., Department of chemical and biomolecular engineering, The University of
Melbourne, 355 p.
- Duxson P., Lukey G. C. and Van Deventer J. S.
J., (2006). Thermal evolution of
metakaolin geopolymers. Journal of Non-crystalline
Solids, 352, 5541-5555.
- Elimbi A., (1991). Etude
dilatométrique du comportement thermique des argiles
kaoliniques de Bomkoul (Cameroun). Thèse de doctorat
3e cycle, Faculté des
Sciences, Université de Yaoundé I, 162 p.
- Elimbi A., Tchakoute K. H. and Njopwouo D.,
(2011). Effects of calcination temperature of kaolinite clays on the properties
of geopolymer cements. Construction and Building Materials,
25, 2805-2812.
- European Norm (EN), (2004). Methods of
testing cement: part I determination of strength. EN 191-1, 19 p.
- Fernandez J. A., Monzo M., Vicent M., Barba A. and
Palomo A., (2008). Alkaline activation of metakaolin-fly ash mixtures:
Obtain of Zeoceramics and Zeocements. Microporous and Mesoporous Materials,
108, 41-49.
- Fernandez-J. A. and Palomo A., (2005).
Composition and microstructure of alkali activated fly ash binder: effect of
the activator. Cement and Concrete Research, 35,
1984-1992.
- Hermann E., Kunze c., Gatzweiler R., Kiebig G. and
Davidovits J., (1999). Solidification de différents
résidus radioactifs avec le géopolymère pour une
stabilité à long-terme. Géopolymère 99
Proceedings, 1-15.
- Institut des Géopolymères.
Articles sur les géopolymères (consulté le 10.01.2012)
[en ligne]. http: //
www.geolypolymer.org/fr/
Article sur les géopolymère
- Kakali G., Perraki T., Tsivilis S. and Badogiannis
E., (2001). Thermal treatment of
kaolin: the effect of mineralogy on the pozzolanic activity.
Applied Clay Science, 20,
73-80.
- Khoury H., Salhah Y. A., Dabsheh I. A, Slaty F.,
Alshaaer M., Rahier H., Esaifan M. and Wastiels J., (2011). Geopolymer
products from Jordan for sustainability of the environment. Advances in
Materials Science for Environmental and Nuclear Technology II,
227, 289-300.
- Komnitsas K. and Zaharaki D., (2007).
Geopolymerisation: a review and prospects for minerals industry. Minerals
Engineering, 20, 1261-1277.
- Lemougna N. P., (2008). Réticulation
géopolymérique à basse température de quelques
aluminosilicates. Mémoire de D.E.A., Faculté des Sciences,
Université de Yaoundé 1, 75 p.
48

- Lemougna N. P., Mackenzie D. J. K. and Melo C. U.
F., (2011). Synthesis and thermal properties of inorganic polymers
(geopolymer) for structural and refractory applications from volcanic ash.
Ceramics International, 37, 3011-3018.
- Liew Y. M., Kamarudin H., Mustafa Al Bakri A. M.,
Luqman M., Khairul Nizar I. and Heah C. Y., (2011). Investigating the
possibility of utilization of kaolin and the
potential of metakaolin to produce green cement for
construction purposes. Australian Journal of Basic and Applied
Sciences, 5, 441-449.
- Muniz-V. M. S., Manzano-R. A., Sampieri-B. S., Ramon
G-T. J., Reyes-A. J. L., Perez-B. J. J., Apatiga L. M., Zaldivar-C. A. and
Amigo-B. V., (2011). The effect of temperature on the geopolymerizaion
process of a metakaolin-based geopolymer. Materials Letters,
65, 995-998.
- Njopwouo D., (1984). Minéralogie et
physico-chimie des argiles de Bomkoul et de Balengou (Cameroun). Utilisation
dans la polymérisation du styrène et dans le renforcement du
caoutchouc naturel. Thèse de doctorat, Faculté des Sciences,
Université de Yaoundé I, 300 p.
- Njoya A., Nkoumbou C., Grosbois C., Njopwouo D.,
Njoya D., Courtin-Nomade A., Yvon J. and Martin F., (2006). Genesis of
Mayouom kaolin deposit (Western Cameroon). Applied Clay Science,
32, 125-140.
- Panias D., Giannopoulou P. I. and Perraki
T., (2007). Effect of synthesis parameters on the mechanical
properties of fly ash-based geopolymers. Colloids and Surfaces A:
Physicochem. Eng. Aspects, 301, 246-254.
- Prud'homme E., Michaud P., Joussein E., Peyratout
C., Smith A. and Rossignol S., (2011). In situ inorganic foams
prepared from various clays at low temperature. Applied Clay Science,
51, 15-22.
- Qtaitat A. M. and Al-Trawneh N. I., (2005).
Characterization of kaolinite of the Baten EL-Ghoul region/south Jordan by
infrared spectroscopy. Spectrochimica Acta Part A,
61, 1519-1523.
- Rahier H., Slatyi F., Aldabsheh I., Alshaaer M.,
Khoury H., Esaifan M. and Wastiels J., (2010). Use of local raw
materials for construction purposes. Advances in Science and
Technology, 69, 152-155.
- Rollet A.-P. et Bouaziz R., (1972).
L'analyse Thermique : l'examen des processus chimique, tome 2, GAUTHIER-VILLAS,
Paris, 571p.
- Rovnanik P., (2010). Effect of curing
temperature on the development of hard structure of metakaolin-based
geopolymer. Construction and Building Materials, 24,
1176-1183.
- Sabir B. B., Wild S. and Bai J., (2001).
Metakaolin and calcined clays as pozzolans for concrete. Cement and
Concrete Composites, 23, 441-454.
- Saikia J.B. and Parthasarathy G.,
(2010). Fourier transform infrared spectroscopic characterization of
kaolinite from Assam and Meghalaya, Northeastern India. Journal
of Modern Physics, 1, 206-210.
- Sindhunata, Van Deventer J. S. J., Lukey G. C. and
Xu H., (2006). Effect of curing temperature and silicate concentration
on fly-ash-based geopolymerization. Industrial and Engineering Chemistry
Research, 45, 3559-3568.
49

- Tchakoute K. H., Elimbi A.,Mbey A. J., Sabouang N.
J. C., and Njopwouo D., (2012). The effect of adding alumina-oxide to
metakaolin and volcanic ash on geopolymers products: A comparative study.
Construction and Building Materials,
http://dx.doi.org/10.1016
/j.conbuildmat.2012.04.023.
- Van Jaarsveld J. G. S. and Van Deventer J. S. J.,
(1996). The potential use of geopolymeric materials to immobilise
toxic metals: Part I Theory and applications. Minerals Engineering,
10, 659-669.
- Van Jaarsveld J. G. S., Van Deventer J. S. J. and
Lukey G. C., (2002). The effect of composition and temperature on the
properties of fly ash and kaolinite-based geopolymers. Chemical Engineering
Journal, 89, 63-73.
- Wongpa J., Kiatttikomol K. and Jaturapitakkul C.,
(2006). International Conference on Pozzolan, Concrete and Geopolymer:
New geopolymer from rice husk-bark ash. May 24-25, Khon Kaen (Thailand),
299-304.
- Xiao Y., Zhang Z., Zhu H. and Chen Y.,
(2009).Geopolymerization process of alkali-metakaolinite characterized by
isothermal calorimetry. Thermochimica Acta, 493,
49-54.
- Xu H. and Van Deventer, J. S. J., (2000).
The geopolymerisation of alumino-silicate minerals. International Journal
of Mineral Processing, 59, 247-266.
- Xu H. and Van Deventer, J. S. J., (2002).
Microstructural characterization of geopolymers synthesized from
kaolinite/stilbite mixtures using XRD, MAS-NMR, SEM/EDX, TEM/EDX, and HREM.
Cement and Concrete Research, 32, 1705-1716.
- Youssef I. R., El-Eswed B., Alshaaer M., Khalili F.
and Rahier H., (2010). Degree of reactivity of two minerals in alkali
solution using zeolitic tuff and silica sand filler. Ceramics
International, doi: 10.1016/j.ceramint.2012.03.008.
- Yunsheng Z., Wei S. and Zonglin L., (2010).
Composition design and microstructural characterization of calcined
kaolin-based geopolymer cement. Applied Clay Science,
47, 271-275.
- Zaharaki D., Komnitsas K. and Perdikatsis
V., (2010). Use of analytical techniques for identification of
inorganic polymer gel composition. Journal of Materials Science,
45, 2715-2724.
- Zeng Q., Li K., Fen-Chong T. and Dangla P.,
(2012). Effect of porosity on thermal expansion coefficient of cement
pastes and mortars. Construction and Building Materials,
28, 468-475.
50

|
Température
(°C)
|
200
|
300
|
400
|
500
|
|
Retrait linéaire de
cuisson (%)
|
0,42
|
0,57
|
0,5
|
0,49
|
51

ANNEXES
Annexe 1 : Lois de dilatation de
l'étalon pyros 56 et de la silice vitreuse entre 0 et 1150 °C
|
T (°C)
|
1O 3(Äð - ÄSiO2)
|
|
22
|
0,285
|
|
50
|
0,63
|
|
100
|
1,27
|
|
150
|
1,92
|
|
200
|
2,60
|
|
250
|
3,28
|
|
300
|
3,99
|
|
350
|
4,75
|
|
400
|
5,54
|
|
450
|
6,34
|
|
500
|
7,18
|
|
550
|
8,03
|
|
600
|
8,91
|
|
650
|
9,81
|
|
700
|
10,73
|
|
750
|
11,67
|
|
800
|
12,63
|
|
850
|
13,61
|
|
900
|
14,60
|
|
950
|
15,61
|
|
1000
|
16,63
|
|
1050
|
17,67
|
|
1100
|
18,72
|
|
1150
|
19,80
|
Annexe 2 : Retrait linéaire de
cuisson des géopolymères en fonction de la température de
traitement.
Annexe 3 : Pourcentage d'absorption d'eau
des géopolymères en fonction de la température de
traitement.
|
Température
(°C)
|
90
|
200
|
300
|
400
|
500
|
|
Pourcentage
d'absorption
d'eau
|
48
|
48,9
|
49,81
|
48,9
|
50
|
Annexe 4 : Résistance à la
compression des géopolymères en fonction de la température
de traitement.
|
Température
(°C)
|
25 #177; 3
|
90
|
200
|
300
|
400
|
500
|
|
Résistance à
la
compression
(MPa)
|
4,9
|
5,8
|
7,1
|
7,5
|
8,9
|
8,9
|
52

| 


