|
|
UNIVERSITE DE OUAGADOUGOU
|
N0 d'ordre
|
|
|
|
|
|
|
UFR/SCIENCES DE LA VIE ET DE LA TERRE
|
|
Laboratoire de Biologie et Écologie
Végétales
|
Etude des potentialités mellifères de deux
zones du Burkina Faso: Garango (Province du Boulgou) et Nazinga (Province du
Nahouri)

T hèse
Présentée pour obtenir le titre de
DOCTEUR DE L'UNIVERSITÉ D E
OUAGADOUGOU
Spécialité : Sciences Biologiques
Appliquées
Option : Biologie et Ecologie
Végétales
Par
NOMBRÉ Issa
Soutenue le 18 décembre 2003, devant le jury :
P résident : Koffi AKPAGANA, Professeur,
Université de Lomé
Membres : Joseph Issaka BOUSSIM, Maître de
Conférences, Université de Ouagadougou Laurent AKÉ ASSI,
Professeur, Université de Cocody-Abidjan
Mahamane SAADOU, Professeur, Université Abdou
Moumouni de Niamey
Moussa SAWADOGO, Chargé de Recherche, IRSAT/CNRST
Ouagadougou, Invité 1 Sita GUINKO, Professeur,
Université de Ouagadougou
Ce travail a été réalisé grâce
à l'appui du projet danois n0 104. Dan. 8L/203, Danida
Illustration de la couverture et de la page de garde
- A gauche : Activité de butinage d'Apis mellifera
adansonii Latreille sur Cochlospermum planchoni. - A droite :
Ruche kenyane améliorée en expérimentation aux ruchers du
Laboratoire de Biologie et
Ecologie Végétales de l'UFR/Sciences de la Vie et
de la Terre, Université de Ouagadougou.
Avant-propos
A la fin de ce travail, il est un réel plaisir pour
nous de rendre hommage et de témoigner notre profonde reconnaissance
à toutes les personnes qui nous ont accompagnés sur ce chemin
parfois périlleux. Les nombreux appuis ne permettent pas de citer
nommément chaque personne dans ces quelques pages ; mais que chacun
sache que nous avons été sensibles à son aide. Nous
voudrions cependant remercier particulièrement :
- Le professeur Sita GUINKO, responsable du troisième
cycle Sciences Biologiques Appliquées et Directeur du laboratoire de
Biologie et Ecologie Végétales de l'Université de
Ouagadougou, pour le plaisir qu'il nous a faits en nous accueillant dans son
laboratoire et en acceptant d'être notre Directeur de thèse.
Après avoir travaillé avec des groupements d'apiculteurs
traditionnels, nous avons découvert combien est grande la
nécessité de mettre à leur disposition des données
sur la flore mellifère tel que recommandé par le professeur
GUINKO et ses collègues en 1989 et qu'il n'a cessé de le
répéter tout le temps qu'a duré le cours d'apiculture en
D.E.A. C'est lui qui nous a confiés ce thème, en a assuré
l'encadrement et n'a cessé de nous encourager, de nous prodiguer des
conseils et ce malgré ses multiples fonctions. Il a mis à notre
disposition une importante bibliographie sur l'apiculture. Avec lui nous avons
appris la rigueur dans le travail scientifique. Il nous a permis de
bénéficier de plusieurs stages de formation hors du pays qui nous
ont été d'un apport inestimable dans la réalisation de ce
travail. Que le professeur GUINKO trouve dans ce document toute notre profonde
reconnaissance.
- Le professeur Issaka Joseph BOUSSIM qui, malgré ses
multiples occupations nous a très souvent accompagnés sur le
terrain. Il nous a apportés des conseils, des suggestions et
corrigé le manuscrit de ce document. Il a été pour nous
d'un soutien moral considérable.
- Le Docteur Moussa SAWADOGO nous a initiés au monde
merveilleux des abeilles. Il nous a donnés des conseils, une importante
bibliographie et un soutien moral. Malgré ses multiples occupations il a
tenu à visiter le rucher de Nazinga. Il a corrigé le manuscrit de
ce document.
- Le professeur Jeanne F. C. MILLOGO/RASOLODIMBY nous a
initiés dès le D.E.A. à l'étude des grains de
pollen. Elle nous a donnés des conseils, de la bibliographie sur le
pollen et a assuré la correction de ce manuscrit malgré ses
multiples occupations. Qu'elle trouve ici l'expression des notre
sincères remerciements.
- Le Docteur Adjima THIOMBIANO pour ses conseils et son aide dans
la détermination de certaines espèces végétales.
- Le Docteur Frédéric ZONGO pour ses conseils et
son soutien moral.
- Le Docteur Makido OUEDRAOGO et Monsieur Robert BAMBARA
Inspecteur de français ont contribué à la correction du
manuscrit et fait des suggestions pour l'améliorer. Mais malgré
leur travail combien appréciable, ce document reste une oeuvre humaine
et donc susceptible de toutes perfections.
- Le personnel de l'Institut de Botanique de
l'Université de Aarhus au Danemark et particulièrement le
professeur Ivan NIELSEN, les Docteurs Jens Eldgaard MADSEN et Anne Mette LYKKE
pour leur assistance et leur constante disponibilité durant tous nos
séjours au Danemark. Le Docteur MADSEN nous a permis d'avoir une
importante bibliographie apicole en nous communiquant son numéro
d'abonnement à la bibliothèque de l'Université d'Aarhus.
Nous sommes particulièrement reconnaissant à Madame Anni SLOTH
qui a assuré notre formation au logiciel photoshop, et aux
microphotographies (microscopie photonique et électronique) des grains
de pollen.
- Le Docteur Akpovi AKOEGNINOU du département de
biologie végétale de l'Université d'Abomey Calavi du
Bénin pour nous avoir accueillis dans son laboratoire. Il nous a
prodigués beaucoup de conseils et a corrigé notre document. Il
nous a permis de scanner les photographies des grains de pollen.
stage sur la description morphologique des grains de pollen. Elle
a mis à notre disposition une bibliographie sur les pollens.
- Tous les membres du laboratoire de botanique de
l'Université d'Abomey Calavi du Bénin pour leur accueil
chaleureux lors de notre séjour.
- Le professeur Roch DOMEREGO Vice-Président d'APIMONDIA
pour ses conseils et encouragements lors de sa visite à la miellerie et
au CPFRA/Lergo.
- Tous les membres du jury pour avoir accepté juger ce
travail malgré les multiples occupations inhérentes à leur
rang et à leur fonction.
- Nous sommes reconnaissant aux Professeurs Koffi AKPAGANA de
l'université de Lomé au Togo, Mahamane SAADOU de
l'université Abdou Moumouni de Niamey au Niger, Amadou Tidiane BA de
l'université Cheikh Anta Diop de Dakar au Sénégal et
Jeanne F. C. MILLOGO/RASOLODIMBY de l'Université de Ouagadougou pour
avoir accepté de rapporter notre thèse.
- L'ensemble des étudiants de troisième cycle en
Sciences Biologiques Appliquées, les techniciens, les ouvriers et
gardiens, l'administration et les enseignant-chercheurs du Département
de Biologie et Physiologie Végétales en particulier et de
l'UFR/Sciences de la Vie et de la Terre de l'Université de Ouagadougou
en général pour leurs aides multiformes et les enseignements
reçus lors de nos différents cycles de formations.
- Les Directeurs, le personnel et les chercheurs de l'IRSAT/CNRST
pour leur accueil et leur collaboration franche.
- L'organisme « ENRECA/botanique » sans lequel ce
document ne verrait certainement pas le jour. Qu'il trouve ici les fruits de
son investissement.
- Les populations des villages riverains du ranch, de Lergo,
des villages de la zone de Garango qui nous ont acceptés tout le temps
qu'a duré cette étude. Nous remercions particulièrement
Néti NAMA et Boukaré GUINKO qui nous ont servis
d'interprètes lors de nos enquêtes « ethnoapicoles ».
- Wonko GUINKO, technicien apicole au Centre de Production, de
Formation et de Recherches en Apiculture de Lergo et Soumaïla KINDA nous
ont été d'un soutien considérable lors de la pesée
des ruches et surtout l'entretien et la surveillance des ruchers. Qu'ils
trouvent dans ce document le fruit de leur effort quotidien.
- Enfin, nous exprimons nos plus vifs remerciements et notre
profonde gratitude à tous nos parents (Issaka, Boubacar, Léandre,
Jules, Edouard...) qui nous ont apportés des soutiens moral, financier
et matériel. A notre épouse Sylvie TIEBYENGA et notre fille
Mouniratou pour leur compréhension pendant nos longues absences.
Résumé
L'apiculture est une pratique séculaire au Burkina
Faso. Cependant le matériel utilisé, les techniques apicoles et
l'absence d'informations sur les potentialités mellifères
entraînent une production de miel en quantité et en qualité
faibles. C'est pour pallier à cela que cette étude fut entreprise
sur le thème <<Etude des potentialités mellifères de
deux zones du Burkina Faso : Garango dans la province du Boulgou et Nazinga
dans la province du Nahouri ». Elle a pour but de déterminer
à partir de ruchers d'une dizaine de ruches installées dans
chaque zone, la richesse en espèces mellifères et leur
«Importance Value Index» (IVI) ; de dresser un calendrier de
floraison des espèces mellifères et de visites des ruchers ; de
recenser les pratiques apicoles traditionnelles.
La richesse en espèces mellifères, leur
intensité de butinage et la durée de disponibilité de
leurs nutriments sont déterminées par des observations directes
de butinage de Apis mellifera adansonii Latreille autour des ruchers
sur un rayon de 2 km. L'IVI des espèces butinées est
appréciée par une analyse quantitative de la
végétation. Parallèlement aux observations de butinage,
cinq ruches par rucher sont pesées mensuellement pour suivre les
variations pondérales. Des lames de référence sont
constituées par acétolyse des grains de pollen des espèces
mellifères. Les pratiques apicoles traditionnelles sont
inventoriées par des enquêtes <<ethnoapicoles»
Les observations de butinage ont permis de recenser quatre
vingt seize (96) et quatre vingt dix sept (97) espèces qui sont
butinées respectivement dans la zone de Garango et de Nazinga. Parmi ces
espèces, certaines présentent un intérêt apicole par
leur abondance, leur IVI, leur période de floraison et leur
intensité de butinage. Ce sont : Vitellaria paradoxa,
Sclerocarya birrea, Parkia biglobosa, Lannea
microcarpa, Eucalyptus camaldulensis, Balanites
aegyptiaca, Acacia dudgeoni pour la zone de Garango et,
Vitellaria paradoxa, Xeroderris stuhlmannii,
Pseudocedrela kotschyi, Terminalia avicennioides,
Pterocarpus erinaceus, Afzelia africana, Lannea
acida, Daniellia oliveri, Isoberlinia doka et Lannea
kerstengii pour celle de Nazinga. Deux périodes de miellées
sont déterminées. Une miellée principale en saison
sèche dominée par la floraison d'espèces ligneuses et une
miellée secondaire en saison de pluies où la floraison est
dominée par celle des herbacées. Les miellées de la zone
de Nazinga précèdent chacune d'un mois celles de la zone de
Garango. A la fin de chaque miellée intervient une période de
disette plus ou moins longue.
Une collection de lames de référence de grains
de pollen de quarante cinq (45) espèces a été
constituée. La description des grains de pollen montre que les abeilles
visitent les plantes sans tenir compte de la morphologie des grains de pollen.
L'attraction des abeilles semble être exercée par le pollen
coat.
Le matériel utilisé et les techniques apicoles
traditionnelles sont similaires dans les deux zones et dans les autres pays
africains en général. Des organes de plantes sont utilisés
pour enfumer les ruches. Les produits de la ruche sont utilisés aussi
bien en alimentation humaine que dans le traitement de certaines maladies.
Mots dlés : Espèce
mellifère, abeille domestique, potentialité mellifère,
grain de
pollen, etnoapicole, Nazinga, Garango, Burkina Faso.
Abstract
Apiculture is a centennial practice in Burkina Faso. However
the material used, the beekeeping techniques and the absence of information on
the melliferous potentialities entail a low honey production in quantity and in
quality. It is to palliate to it that this study was undertaken on the theme
"Study of the melliferous potentialities of two zones of Burkina Faso: Garango
in the province of Boulgou and Nazinga in the province of Nahouri". It aims to
determine from apiaries of about ten hives installed in every zone, the
richness in melliferous species and their «Importance Value Index»
(IVI); to raise a flowering calendar of melliferous species and of apiaries
visits; to inventory the traditional beekeeping practices.
The richness in melliferous species, their foraging intensity
and the length of their nutriments availability are determined by direct
observations of Apis mellifera adansonii Latreille foraging on a ray
of 2 km around the apiaries. The IVI of foraged species is appreciated by a
quantitative analysis of vegetation. In the same way to the observations of
foraging, five hives per apiary are weighed monthly to follow the weight
variations. Slides reference are constituted by acetolysed pollen grains of the
melliferous species. The traditional beekeeping practices are inventoried by
"ethnoapicoles" investigations. The observations of foraging permitted to
inventory ninety six (96) and ninety seven (97) species that are respectively
foraged in the zone of Garango and Nazinga. Among these species, some present
an interest for beekeeping by their abundances, their IVI, their flowering
period and their foraging intensity. These are: Vitellaria paradoxa,
Sclerocarya birrea, Parkia biglobosa, Lannea
microcarpa, Eucalyptus camaldulensis, Balanites aegyptiaca,
Acacia dudgeoni for the zone of Garango and, Vitellaria paradoxa,
Xeroderris stuhlmannii, Pseudocedrela kotschyi,
Terminalia avicennioides, Pterocarpus erinaceus, Afzelia
africana, Lannea acida, Daniellia oliveri,
Isoberlinia doka and Lannea kerstengii for the one of
Nazinga.
Two honey flow periods are determined. A main honey flow in
dry season dominated by the flowering of woody species and a secondary honey
flow in raining season where flowering is dominated by the one of the
herbaceous. The honey flows of Nazinga zone precede of one month the ones of
the zone of Garango. At the end of each honey flow period, takes place more or
long scarcity period.
A collection of pollen grains slides reference from forty five
(45) species have been constituted. The description of the pollen grains shows
that bees visit the plants without taking into account the morphology of the
pollen grains. The attraction of the bees seems to be exercised by the pollen
coat. The material used and the traditional beekeeping are similar in the two
zones and in the other African countries in general. Organs of plants are used
to smoke out hives. The products of the hive are used as well as in human food
and in the treatment of some illnesses.
Key words: Melliferous species, honeybee,
melliferous potentiality, pollen grain, «ethnoapicole», Nazinga,
Garango, Burkina Faso.
PRINCIPALES ABREVIATIONS
FAO : Organisation des Nations Unies pour l'Alimentation et
l'Agriculture. PNUD : Programme des Nations Unies pour le
Développement.
R.G.N. : Ranch de Gibier de Nazinga.
BU.NA.SOL. : Bureau National des Sols.
D.D.T. : Dichloro-Diphényl Trichloroéthane
D.H.P. : Diamètre à Hauteur de Poitrine.
UV. : Ultra Violet
A. m. : Apis mellifera
I.N.S.D. : Institut National de la Statistique et de la
Démographie
I.V.I. : Importance Value Index
U.F.R./S.V.T. : Unité de Formation et de Recherche en
Sciences de la Vie et de la Terre
LISTE DES FIGURES
Figure 1 : Schéma de la classification systématique
d'Apis mellifera 9
Figure 2 : Différents individus d'une colonie d'abeilles
13
Figure 3 : Naissance et développement des trois
lignées d'Apis mellifera 15
Figure 4 : Morphologie de l'abeille domestique 17
Figure 5 : Localisation des sites d'étude 21
Figure 6 : Moyennes mensuelles de la pluviométrie
(1980-2000) 23
Figure 7 : Evolution de la pluviosité (1980-2000) 24
Figure 8 : Moyennes mensuelles des températures
(1990-2000) 25
Figure 9 : Moyennes mensuelles de la vitesse du vent (1995-2000)
27
Figure 10 : Schéma des différents types de ruches
utilisées 36
Figure 11 : Disponibilité florale des deux zones 55
Figure 12 : Calendrier de floraison des espèces
mellifères dans la zone
de Garango 57
Figure 13 : Calendrier de floraison des
espèces mellifères dans la zone
de Nazinga 58
Figure 14 : Variation mensuelle du poids des
ruches des zones de Garango et
Nazinga 62
Figure 15 : Succession des périodes de
miellée et de disette des zones
de Nazinga et de Garango 64
Figure 16 : Répartition des principales espèces en
classes de diamètre .68
Figure 17 : Disponibilité florale et évolution du
poids des ruches 71
Figure 18 : Droite de régression de la variation mensuelle
du poids des ruches
en fonction du nombre d'espèces mellifères en
fleurs 72
Figure 19 : Droite de régression de la variation mensuelle
du poids des ruches en
fonction de l'IVI 74
Figure 20 : Droite de régression
de la variation mensuelle du poids des ruches en
fonction de l'abondance 75
LISTE DES TABLEAUX
Tableau I : Principales activités d'une ouvrière
à la belle saison 14
Tableau II : Dimensions internes des différents types de
ruches 35
Tableau III : Liste des espèces visitées par
Apis mellifera dans la zone
de Garango 46
Tableau IV : Liste des espèces visitées par
Apis mellifera dans la zone
de Nazinga 50
Tableau V : Plantes utilisées pour attirer les essaims
d'Apis mellifera dans la zones
de Garango ou de Nazinga 84
Tableau VI : Utilisations des produits de l'abeille dans la
thérapeutique locale .89
Tableau VII : Quantité de miel obtenu et les
difficultés d'utilisations par type de Ruche et le taux d'extraction
92
LISTE DES ANNEXES
Annexe 1 : Fiche d'enquête
«ethnoapicole»
Annexe 2 : Fiche descriptive des grains de pollen
Annexe 3 : Listes des espèces végétales
constituant les lames de référence Annexe 4 : Index des
espèces représentées dans l'atlas
Annexe 5 : Atlas descriptif des grains de pollen
Annexe 6 : Analyse quantitative de la végétation
Annexe 7 : Liste générale des espèces
citées dans le texte
Annexe 7 : Planches photographiques
Annexe 8 : Publications
SOMMAIRE INTRODUCTION 5
Chapitre I. GENERALITES
I. Généralités sur l'abeille
domestique 9
1.1. Classification 9
1.2. Vie et organisation sociale ... 11
1.2.1. Reine 11
1.2.2. Mâles ou faux-bourdons 12
1.2.3. Ouvrières 12
1.2.4. Couvain 13
1.3. Morphologie 16
1.3.1. Tête 16
1.3.2. Thorax 16
1.3.3. Abdomen . 17
1.4. Essaimage, désertion, migration et
supersédure 18
1.4.1. Essaimage 18
1.4.2. Désertion ou abandon 18
1.4.3. Migration 19
1.4.4. Supersédure ou rémerage naturel 19
II. Généralités sur les milieux
d'étude 20
2.1. Situation géographique 20
2.2. Climat et hydrologie 20
2.2.1. Climat 20
2.2.1.1. Pluviométrie 22
2.2.1.2. Température 24
2.2.1.3. Vent 26
2.2.2. Hydrologie 27
2.3. Géomorphologie et pédologie
28
2.3.1. Géomorphologie ... 28
2.3.2. Pédologie 28
2.4. Végétation 29
2.5. Population 30
Chapitre II. MATERIEL ET METHODES
I. Introduction 32
II. Matériel 33
2.1. Ruches 33
2.1.1. Ruche Dadant ou ruche à hausse 33
2.1.2. Ruche kenyane 34
2.1.3. Ruche rectangulaire à cadres 34
III. Méthodes 37
3.1. Observation du mécanisme de butinage de
l'abeille
domestique 37
3.2. Suivi de l'évolution du poids des ruches
38
3.3. Comparaison de la productivité de
différents types de
ruches 38
3.4. Analyse quantitative de la végétation
39
3.5. Traitements des données 40
3.5.1. Fréquence relative 41
3.5.2. Densité relative 41
3.5.3. Dominance relative 41
3.5.4. Abondance 41
3.5.5. Classes de diamètre 42
3.6. Lames de référence et description des
grains de pollen 42
3.6.1. Prélèvement des grains de pollen 42
3.6.2. Acétolyse des grains de pollen 42
3.6.3. Description et microphotographies des grains de pollen
43
3.7. Enquête
«ethnoapicole» 43
Chapitre III. RESULTATS et DISCUSSION
I. Flore mellifère des zones de Garango et de
Nazinga 45
1.1. Composition de la flore mellifère
45
1.1.1. Zone de Garango 45
1.1.2. Zone de Nazinga 49
1.1.3. Discussion 53
1.2. Disponibilité florale dans les deux zones
55
1.2.1. Calendrier floral 56
1.2.2. Discussion 59
II. Variation du poids des ruches...... 61
2.1. Variation du poids des ruches dans la zone de
Garango . 61
2.2. Variation du poids des ruches dans la zone de
Nazinga 61
2.3. Succession des miellées et des disettes
63
2.4. Discussion 65
2.5. Comparaison des miellées des deux zones
66
2.6. Conclusion sur la variation du poids des ruches
66
III. Analyse quantitative de la végétation
67
3.1. Abondance 67
3.2. Importance Value Index (IVI) 67
3.3. Classes de diamètre 68
IV. Facteurs influençant la variation du poids
des ruches 70
4.1. Nombre d'espèces mellifères en fleurs
70
4.2. Abondance et IVI des espèces
mellifères 73
4.3. Conclusion 76
V. Etude des grains de pollen d'espèces
mellifères 77
5.1. Lames de référence 77
5.2. Description des grains de pollen 77
VI. Matériel et techniques apicoles
traditionnelles dans les zones de Garango et de Nazinga 80
6.1. Matériel apicole traditionnel 80
6.1.1. Ruches 80
6.2. Techniques utilisées en apiculture
traditionnelle 82
6.2.1. Préparation de ruches pour le piégeage des
essaims 82
6.2.1.1. Techniques utilisées 82
6.2.1.2. Produits végétaux utilisés 84
6.2.2. Récolte du miel 85
6.2.3. Extraction du miel 87
6.3. Utilisation des produits de la ruche 88
6.4. Conclusion sur les techniques apicoles
traditionnelles 90
VII. Productivité de différents types de
ruches 92
CONCLUSION GENERALE ET PERSPECTIVES 95
REFERERENCES BIBLIOGRAPHIQUES 98
ANNEXES 109
Introduction
La pratique de l'apiculture est une tradition séculaire
en Afrique et plus particulièrement au Burkina Faso. En effet, il existe
de nombreuses familles d'apiculteurs traditionnels et de chasseurs ou
cueilleurs de miel. Les matériaux utilisés pour la confection des
ruches varient d'une zone à une autre et comprennent des vanneries et
des poteries. Cependant, les produits de l'apiculture traditionnelle ont un
faible impact dans l'économie du pays, car non seulement la production
est faible, mais aussi les produits sont de qualités insuffisantes (miel
et cire souvent brûlés et impurs). Les techniques de
récolte et de traitement restent rudimentaires. De plus, la perte des
abeilles responsables de la pollinisation d'un grand nombre de plantes et, la
dégradation des sols liée aux feux de brousse qui sont
provoqués par les pratiques apicoles traditionnelles ont des
répercussions négatives sur l'économie et la
sécurité alimentaire. Pour un pays qui possède de
réelles potentialités en espèces apiaires et
mellifères, une longue tradition apicole et, qui peut assurer ses
besoins en miel et en cire, une pareille situation reste
incompréhensible. Face à toutes ces réalités et
à la dégradation des conditions sociales dans les zones rurales,
il est apparu aux autorités la nécessité de
développer une apiculture améliorée comme alternative pour
valoriser et préserver les ressources naturelles. Ainsi en 1980, des
actions de prospections ont été entreprises dans la zone Quest du
Burkina Faso. Elles ont abouti en 1985 à la mise en place d'un projet
conjoint PNUD/FAQgouvernement du Burkina Faso de ``développement et de
vulgarisation de l'apiculture améliorée en milieu paysan½.
Pour mieux maîtriser les facteurs influençant la production de
miel, l'exécution du projet a nécessité des études
scientifiques sur la flore mellifère et sur l'éthologie de
l'abeille locale Apis mellifera
adansonii Latreille. Ainsi une collaboration a
été établie entre le projet et l'Université de
Quagadougou à travers le Laboratoire de Biologie et Ecologie
Végétales. L'exécution de ce projet a favorisé la
vulgarisation de l'apiculture moderne au Burkina Faso et l'installation de
projets apicoles dans plusieurs provinces du pays. Mais, l'analyse de la
plupart de ces projets de développement de l'apiculture débouche
sur un constat d'échec. Ces échecs seraient dus à la
méconnaissance du fonctionnement des sociétés
traditionnelles et plus particulièrement des rapports qu'elles
entretiennent avec le monde des abeilles (Villières, 1987 a), à
une inadaptation du matériel et des techniques apicoles introduites, aux
conditions climatiques et surtout à l'absence d'informations sur les
potentialités mellifères de la plupart des zones
agroécologiques du Burkina Faso.
En effet, si dans les pays tempérés de nombreux
travaux ont été réalisés sur les relations plantes
abeilles, dans les zones tropicales en général et dans les pays
africains en particulier, très peu de travaux ont été
réalisés car le rôle des interrelations plantes et abeilles
dans la dynamique des écosystèmes a longtemps été
négligé (Lobreau-Callen et al., 1986). Des travaux comme
ceux de Gadbin (1980) pour le Tchad, de Lobreau-Callen et al. (1986)
et de Villières (1987 a) pour le Togo et le Bénin, de Hertz
(1994) pour la Gambie, de Molès (2000) pour le Bénin, de Damblon
(1986) et de Schweitzer (2002) pour le Maroc constituent des
références.
Au Burkina Faso, les travaux de recherches apicoles ont
été réalisés par Guinko et al. (1992),
Sawadogo (1993) et Nombré (1998). Ces recherches qui se sont
déroulées dans les zones Quest et Centrale du pays ont permis d'y
identifier les principales espèces végétales
visitées par l'abeille domestique, de mieux connaître la biologie
et l'éthologie de l'abeille locale et enfin de dresser un calendrier de
visite des ruches pour la zone Quest. Nous n'avons pas connaissance de travaux
de
recherches menés dans d'autres zones du Burkina Faso.
Pourtant, il est important de développer l'activité apicole dans
ces différentes zones car cela présente des avantages et peut
être bénéfique aussi bien pour l'apiculteur que pour la
collectivité (Hetz, 1994 ; Adjaré, 1990 ; Sosu,1993 et Carrol,
1997). Pour ces auteurs, l'apiculture peut se pratiquer dans les zones
impropres à l'agriculture et être source de revenus. Elle peut se
pratiquer en saison sèche et de ce fait complète l'agriculture.
Elle peut surtout améliorer les productions agricoles à travers
les actions pollinisatrices des abeilles.
Ces constats justifient le choix de notre sujet
«Etude des potentialités mellifères de deux zones du
Burkina Faso : Garango (Province du Boulgou) et Nazinga (Province du Nahouri)
» dont les objectifs sont :
* contribuer à la connaissance du potentiel
mellifère du Burkina Faso en général et surtout des deux
zones en particulier. Cela à travers un inventaire qualitatif et
quantitatif des espèces de plantes butinées par les abeilles ;
* établir un calendrier de visites des ruchers par un
suivi de la variation du poids des ruches ;
* recenser les pratiques apicoles traditionnelles dans ces deux
zones grâce à des enquêtes ethnoapicoles ;
* constituer des lames de référence et un atlas de
pollen des espèces mellifères outils indispensables pour les
analyses polliniques des miels.
Le choix de ce sujet entre aussi dans le cadre
général de la conservation de la biodiversité. En effet
les abeilles jouent un rôle dans la conservation du patrimoine
génétique qui résulte de la fécondation
croisée des plantes cultivées.
Cette étude s'articule autour de trois points.
Après une introduction, nous
abordons dans un premier chapitre les
généralités sur l'abeille domestique et les zones
d'études. Le matériel et les méthodes utilisés sont
abordés dans le deuxième chapitre. Les résultats auxquels
nous sommes parvenus seront discutés dans le troisième chapitre.
Suivront ensuite une conclusion générale et des perspectives.
I. Généralités sur l'abeille
domestique
1.1. Classification
Insecte social vivant en colonie, la classification de l'abeille
domestique est la suivante (Fig. 1) :
Arthropodes
Embranchement :
Apoidae
Super-Famille : Pompiloidae
Vespoidae Sphecoidae Scolioidae Formicoidae
Classe : Crustacés
Hexapodes ou Insectes
Arachnides Myriapodes
Sous-Ordre : Symphytes
Apocrites
Infra-Ordre : Térébrants
Aculéates
Apidae supérieurs
Sous-Famille : Apinae
Tribu : Apini Bombini
Melliponini Euglossini
Genre : Apis
Espèce : Apis
mellifera
Sous-embranchement : Chélicérates
Antennates ou Mandibulates
Paranéoptères
Super-Ordre : Coléoptères
Névroptèroïdes
Hyménoptèroïdes
Mécoptéroïdes
Hyménoptères
Ordre :
Famille : Mellitidae
Apidae primitifs Megachilidae
sous-classe : Aptérigotes
Ptérigotes
Oligonéoptères
Section : Paléoptères
Polynéoptères
Figure 1 : Schéma de la classification
systématique d'Apis mellifera (Leconte,
2002)
Les abeilles mellifiques sont parmi les sociétés
les plus évoluées du règne animal, les
sociétés vraies ou Eusociétés
caractérisées notamment par la présence d'individus
sexués et d'individus stériles morphologiquement
différents et, par la coexistence de deux générations
successives (Léoncini et al., 2002). Neuf (9) espèces
d'abeilles sont répertoriées dans le genre Apis par
Buttel-Reepen in Rutner (1968 a) et Leconte (2002). Ces espèces
sont réparties en trois groupes en fonction de leur taille :
* Le premier groupe constitué par Apis florea
Fabricius et Apis andreniformis. Ce sont les plus petites abeilles.
* Le second groupe comprend Apis mellifera Linnaeus,
Apis cerana Fabricius, Apis koschevnikovi Buttel-Reepen,
Apis nigrocincta Smith et Apis nuluensis Tinget. Elles sont
de taille moyenne.
* Le troisième groupe est constitué par Apis
dorsata et Apis laboriosa Smith. Ce sont deux espèces de
grande taille, avec deux sous-espèces d'Apis dorsata que sont
Apis benghami Cockerell et Apis breviligula Maa.
Cette classification peut encore évoluer avec
l'utilisation d'outils performants dont disposent les systématiciens, en
particulier les outils moléculaires pour l'étude du génome
(Leconte, 2002).
Parmi ces différents groupes, Apis mellifera
Linnaeus est la plus utilisée pour la production de miel. Elle se
repartit en une vingtaine de sous espèces ou races géographiques.
Apis mellifera adansonii Latreille est la race rencontrée dans
notre zone. Elle est jugée très mal connue avec en Afrique, une
aire géographique floue (Louveaux, 1990 a) qui s'étend du Sahara
au Nord jusqu'au Kalahari au Sud en englobant des forêts très
humides, des savanes sèches, des vallées désertiques et
des régions de hautes montagnes (Ruttner, 1968 a et Sheppard, 1997).
1.2. Vie et organisation sociale
La vie et l'organisation sociale de l'abeille domestique ont
été décrites par de nombreux auteurs (Chauvin, 1968 a;
Jean-Prost, 1987; Adjaré, 1990; Phillipe, 1988; Hertz, 1994; Seregen,
1997 ; Carroll, 1997 ; Arnold, 2000 ; Azzouz et DéchaumeMoncharmont,
2000). Selon ces auteurs, elle mène une vie sociale
sophistiquée.
Il y a deux groupes d'individus (les femelles et les
mâles) regroupés en trois catégories aux
caractéristiques et fonctions nettement différentes mais
complémentaires (Anchling, 2001 a) (Fig. 2). Dans une colonie moyenne,
il y a une seule reine, 300 à 800 mâles ou faux-bourdons, 20 000
à 80 000 ouvrières, 5 000 oeufs et 25 000 à 30 000
abeilles immatures se trouvant à différents stades de leur
développement et constituant le couvain.
1.2.1. Reine (figure 2, c)
Elle se développe au bout de 14 à 16 jours
après la ponte des oeufs (Fig. 3) et vit en moyenne 3 à 5 ans.
Seule femelle sexuellement fertile de la ruche, elle est morphologiquement plus
volumineuse que les autres membres de la colonie. Nourrie et entretenue par les
ouvrières, elle assure la pérennité de la colonie à
travers la ponte de 1 500 à 2 000 oeufs par jour en fonction de son
âge, de la force de la colonie, de l'espace disponible et des conditions
extérieures. Elle assure aussi la cohésion de la colonie par
l'émission de phéromones spéciales. Une phéromone
(phéromone I ou acide 9-ceto-2-décénoïque) attire les
mâles lors du vol nuptial, empêche la construction de cellules
royales. Une autre (phéromone II ou acide 9-
hydroxy-2-décénoïque) inhibe le développement des
ovaires des ouvrières.
La fécondation de la reine s'effectue au cours du vol
nuptial qui a lieu ordinairement 6 à 7 jours après sa naissance
et par beau temps (conditions
climatiques favorables). En cas de mauvais temps (vent,
pluie), ce vol ne peut plus avoir lieu après le 10eme jour et
la reine devient bourdonneuse. Le vol nuptial a lieu entre 14 h et 16 h et dure
5 à 15 mn. Au cours de ce vol, la reine est fécondée par
plusieurs mâles (8 à 10) jusqu'à ce que sa
spermathèque soit remplie de liquide séminal.
1.2.2. Mâles ou faux-bourdons (figure 2, b)
Issus d'oeufs non fécondés, ils éclosent
au bout de 24 à 25 jours (Fig. 3). Leur seul rôle est d'assurer la
fécondation de la reine lors du vol nuptial. Considérés
comme inutiles après la fécondation de la reine, ils sont souvent
éliminés par les ouvrières pendant les périodes de
pénurie. Leurs yeux et leurs antennes sont très
développés, ce qui leur permet de repérer les reines
vierges à une très grande distance.
1.2.3. Ouvrières (figure 2, a)
Plus nombreuses et de petite taille, elles se
développent au bout de 18 à 22 jours (Fig. 3). Elles sont issues
d'oeufs fécondés comme la reine mais leurs ovaires restent
atrophiés à cause de la phéromone royale qui inhibe leurs
fonctionnement. La vie de l'abeille ouvrière se compose de plusieurs
périodes auxquelles correspondent des changements de certains organes
(Maurizio, 1968). Dans une colonie, le genre d'activités auxquelles
s'adonne une ouvrière dépend essentiellement de son
développement physiologique (Philippe, 1991). Le polyéthisme des
abeilles les conduit à changer d'activités au cours de leur vie
en fonction de leur âge. Ainsi elles accomplissent les activités
suivantes : nettoyeuse, nourrice, cirière, ventileuse, gardienne,
butineuse etc. (Tab. I). Elles vivent 6
semaines en période d'intense activité et plus de 6
mois en période de moindre activité.
(a) (b)
|
Les ailes couvrent
tout le corps
es ailes cou
Plus petite que la reine et le mâle
p
|
|
Gros yeux
Abdomen carré
|
(c)
Long abdomen Les ailes cou rent
v
Figure 2 : Différents individus d'une colonie
d'abeilles
(a) : Une ouvrière ; (b) : Un mâle ; (c) :
Une reine (Carroll, 1997)
1.2.4. Couvain
On appelle couvain l'ensemble des oeufs, larves et nymphes
d'une colonie. Il est constitué de cellules ouvertes pour les oeufs et
les larves et, de cellules operculées par une pellicule de cire pour les
nymphes. La durée d'évolution du couvain peut varier en
fonction du mauvais temps et s'étendre sur 1 à 3
jours supplémentaires (Anchling, 2000 a).
Tableau I : Les principales activités d'une
ouvrière à la belle saison (Donadieu et Marchiset,
1984)
|
AGE (jours)
|
ACTIVITES
|
|
0
· Eclosion
|
- Nettoyeuse des cellules vides et des
ouvrières plus âgées.
|
|
|
1
·
|
|
|
|
2
·
|
|
|
|
3
·
|
- Nourrice des larves âgées avec de
la bouillie à base de miel,
|
|
|
4
·
|
de pollen et d'eau.
|
|
|
5
·
|
|
|
|
6
·
|
- Nourrice des jeunes larves (et de la reine)
avec de la gelée
|
|
|
7
·
|
royale qu'elle secrète exclusivement pendant cette
|
|
|
8
·
|
période.
|
|
|
9
·
|
|
d'i
|
|
10
·
|
|
|
|
11
·
|
- Soins appropriés à la reine.
|
|
|
12
·
|
|
|
|
13
·
|
- Cirière - Bâtisseuse - Ventileuse -
Gardienne.
|
|
|
14
·
|
|
|
|
15
·
|
- Magasinière : réception et
concentration du nectar ; réception
|
|
|
16
·
|
et stockage pollen, propolis.
|
|
|
17
·
|
|
|
|
18
·
19
·
|
- Travaux d'entretien divers : nettoyage de la
ruche,
calfeutrage, etc.
|
|
|
20
·
|
|
|
|
Activites d'exterieur
|
|
21
·
22
·
|
- Butineuse à la recherche de :
|
|
23
·
.
|
· eau
|
.
|
· nectar
|
·
|
ou miellat
|
|
· pollen
|
·
|
· propolis
|
·
|
Arrêt
Reine
Ouvrière
Alimentation
OEuf fécondé
OEuf non fécondé
Larve mâle
Larve ouvrière
Cellule royale
Cellule ordinaire
Début gelée royale Début gelée
royale
Arrêt gelée royale Arrêt gelée
royale
Début bouillie simple Début bouillie simple
Cellule ordinaire
Reine
Accouplement
Mâle
Quand les circonstances
('exigent, transformation
c. ordinaire en c. royale
Larve royale
Début gelée
Royale
Mâle
Vol nuptial
Ruche
0
· Ponte
1
·
2
·
3
·
4
· Eclosion larve
5
·
6
·
7
·
8
·
9
· Operculation
10
·
11
·
12
·
13
·
14
·
15
·
16
· Eclosion reine
17
·
18
·
19
·
20
·
21
·
22
· Eclosion ouvrière 23
·
24
·
25
· Eclosion mâle (Jours)
Figure 3 : Naissance et développement des trois
lignées d'Apis mellifera (Crane, 1990)
c. : cellule
1.3. Morphologie
La morphologie de l'abeille domestique a fait l'objet de
travaux de nombreux auteurs tels que Chauvin (1968 b), Jung-Hoffman (1968),
Maurizio (1968), Rutner (1968 b). Le corps de l'abeille comprend trois parties
(Fig. 4) :
1.3.1. Tête
De forme variable selon les groupes d'individus, elle porte :
* une paire d'antennes située de chaque
côté de la tête. Chaque antenne est formée de 12
segments articulés et joue un rôle important dans l'orientation,
le toucher, l'odorat et l'ouïe.
* deux sortes d'yeux : deux yeux composés situés
de chaque côté de la tête et qui ont pour rôle la
vision lointaine, la distinction des couleurs et la détection de la
direction des UV du soleil ; trois yeux simples ou ocelles disposés en
triangle en haut de la tête et qui ont pour principal rôle la
vision rapprochée ou faible.
* un appareil buccal bien développé chez les
ouvrières comprenant la lèvre supérieure, la lèvre
inférieure, les deux mandibules et la langue.
1.3.2. Thorax
Formé de trois segments (prothorax, mésothorax,
métathorax), le thorax porte deux paires d'ailes situées de part
et d'autre du mésothorax et du métathorax et, trois paires de
pattes à cinq segments chacune. Les pattes antérieures
fixées au prothorax sont pourvues de peignes qui servent à
nettoyer les antennes ; les pattes médianes fixées au
mésothorax sont une sorte de main au moyen de laquelle l'abeille
dépose ses pelotes de pollen ; enfin les pattes postérieures
fixées au métathorax portent chez les ouvrières une
structure spécialisée de collecte du pollen appelée
corbeille.
1.3.3. Abdomen
Formé de sept segments, il porte, chez les
ouvrières, une poche à venin qui se termine par un aiguillon en
forme de harpon et quatre paires de glandes cirières. Chez les
mâles il se termine par un organe copulateur. Chez la reine, en plus de
l'aiguillon et de l'organe copulateur, on observe la glande de Nasanov
responsable de la sécrétion de la phéromone de
cohésion. L'abdomen se termine par un anus.
Figure 4 : Morphologie de l'abeille domestique
(Apis mellifera L.) (Jean-Prost, 1987)
1.4. Essaimage, désertion, migration et
supersedure
1.4.1. Essaimage
L'essaimage naturel consiste en une division de la colonie
mère en deux ou plusieurs colonies filles. La vieille reine, aux ovaires
atrophiés car elle n'est plus nourrie par les ouvrières, quitte
la colonie avec quelques ouvrières et des mâles pour constituer un
essaim primaire. Les ouvrières restées à la ruche
s'activent à élever d'autres reines. Après leur
éclosion, une première peut quitter à son tour la ruche
avec une seconde fraction de la colonie pour constituer l'essaim secondaire,
une seconde reine formera un essaim tertiaire etc.
Le principal signe précurseur de l'essaimage est la
construction d'ébauches de cellules royales généralement
en bordure du couvain (Jean-Prost, 1987; Philippe, 1988; Weiss, 1989;
Adjaré, 1990; Crane, 1990; Bruneau, 1993; Anchling, 2000 b et 2002,
Cartel 2001). Pour ces auteurs, les facteurs biologiques qui déclenchent
l'essaimage naturel sont : la faible production de phéromone royale
liée à l'âge de la reine ou à sa mort,
l'augmentation du nombre des ouvrières entraînant une congestion
et une mauvaise répartition de la phéromone de cohésion,
la tendance chez la colonie à essaimer, les conditions
environnementales.
1.4.2. Désertion ou abandon
Occasionnellement, toutes les abeilles adultes d'une colonie
quittent brusquement la ruche abandonnant derrière elles le couvain et
les réserves de nourriture (FAO, 1986; Crane, 1990). Dans ce cas, il n'y
a pas de construction de cellules royales. Les causes de la désertion
sont : le manque de nourriture ou d'eau, la perturbation de la colonie par les
fourmis, les termites, les guêpes, les maladies,
l'apiculteur lui-même, enfin les caractères
génétiques des abeilles.
Ce comportement de désertion est une stratégie
de survie qui permet aux colonies d'échapper à une mort soudaine
en migrant vers de meilleures zones de butinage (Hertz, 1994, Seregen, 1997 et
Carroll, 1997). La désertion est un véritable problème
surtout pour les apiculteurs (Villières, 1987 a) et selon Darchen
(1993), capturer facilement des essaims n'a que peu d'intérêts si
ceux-ci désertent à la première occasion.
1.4.3. Migration
Elle est définie par Crane (1990) comme un mouvement
saisonnier régulier des colonies qui résulte de la
réplique aux conditions géophysiques qui déterminent la
disponibilité en ressources alimentaires.
1.4.4. Supersedure ou remerage naturel
La supersedure est le phénomène de remplacement
naturel de la reine sans essaimage (Philippe, 1988 ; Weiss, 1989 et Darchen,
1993). L'insuffisance de substance royale ou phéromone produite par la
reine est la seule cause immédiate de la supersedure. En effet,
lorsqu'une reine, à cause de l'âge ou de malformation
génétique, secrète une quantité insuffisante de
phéromone inhibitrice de l'élevage royal, des ouvrières
vont construire des cellules royales non pas en bordure du couvain mais au
milieu des rayons et y élever des reines. La première à
éclore éliminera les autres larves royales. La vieille reine sera
étouffée par les ouvrières. La supersedure se rencontre
généralement dans les essaims primaires.
II. Généralités sur les milieux
d'étude
2.1. Situation géographique
Les études sont réalisées dans la zone de
Nazinga et de Garango (Fig. 5). Nazinga est dans le Sud du Burkina Faso entre
11o 01' et 11o 08'de latitude Nord et 1o 18'et
1o43'de longitude Quest. Situé entre les provinces du Nahouri
et de la Sissili dont les chefs-lieux respectifs sont Pô et Léo,
il répond administrativement de la première. Nazinga est surtout
connue grâce au Ranch de Gibier de Nazinga (R.G.N.) qui couvre une
superficie de 940 km2.
Garango est situé au Sud-Est du Burkina Faso dans la
province du Boulgou avec comme chef lieu Tenkodogo. Il s'étend entre
11° et 12° de latitude Nord et 0° et 1° de longitude Quest
(Kéré, 1998).
2.2. Climat et hydrologie
Les données météorologiques proviennent des
stations synoptiques de Pô et de Tenkodogo.
2.2.1. Climat
Le climat est un déterminant important des relations
plantes/abeilles. Il caractérise l'état de la flore et de la
végétation dont va dépendre celui de la colonie
d'abeilles. Les éléments du climat agissent directement ou
indirectement sur les relations plantes/abeilles. Par exemple, une
température se situant entre 13° c et 14° c ou un vent de 30
km/h (5,4 m/s) limitent considérablement l'activité de butinage
des abeilles sur les fleurs (Louveaux, 1984 et Crane, 1990).
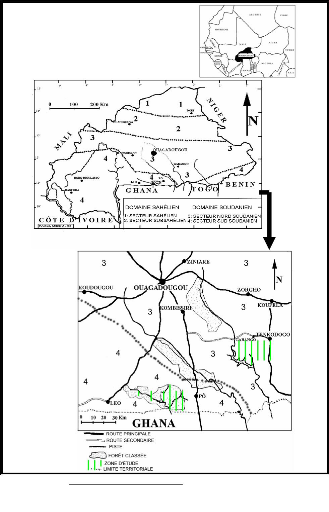
Figure 5 : Localisation des sites d'études
23
2.2.1.1. Pluviométrie
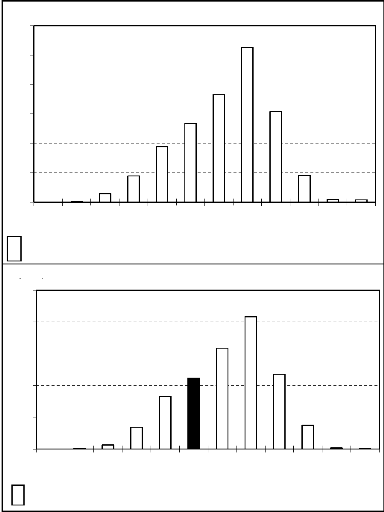
Les quantités de pluie varient dans le temps et dans
l'espace au niveau des deux zones. Les variations dans le temps montrent que
l'essentiel des pluies est enregistré entre mai et octobre, avec un
maximum de précipitation en août (Fig. 6). Cette différence
mensuelle est doublée d'une variation inter annuelle. Les
quantités d'eau enregistrées montrent un maximum en 1991 pour les
deux zones, un minimum en 1989 pour la zone de Garango et en 1981 pour celle de
Nazinga (Fig. 7).
La variation spatiale montre que les précipitations
présentent un gradient Nord-Sud. Entre les deux zones la
différence des cumuls des précipitations annuelles de1980
à 2000 avoisine 3804 mm.
Les pluies ont un effet direct et indirect sur le butinage de
l'abeille domestique. L'action directe se résume à
l'impossibilité pour les abeilles de sortir, la dilution de la
concentration du nectar, le lessivage des nutriments (pollen, nectar). L'action
indirecte se manifeste sur l'abondance des espèces à butiner, la
durée de leur floraison, la quantité et la qualité du
nectar sécrété. En plus l'excès d'eau est un
facteur qui limite le plus souvent la sécrétion du nectar (Shuel
in Crane, 1990).
P. (mm)
250
200
300
150
100
250
200
150
100
a
50
b
50
P.
0
0
(mm)
Janvier
Janvier
Fevrier
Fevrier
Mars
Mars
Avril
Avril
Mai
Mai
Juin
Juin
Juillet
Juillet
AoCit
Aout
Septembre
Septembre
Octobre
Octobre
Novembre
Novembre
Mois
Mois
Decembre
Decembre
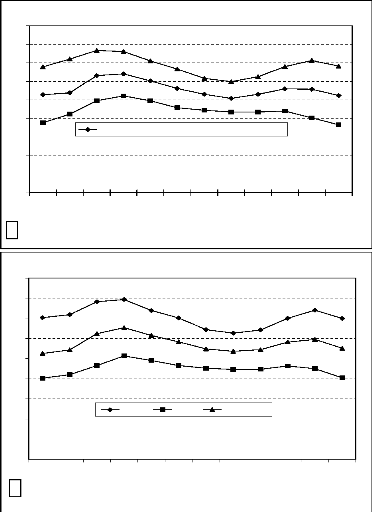
Figure 6 : Moyennes mensuelles de la
pluviométrie (1980-2000)
a : Station de
Pô ; b : Station de Tenkodogo
1400
1200
1000
400
800
600
200
0
P. (mm)
1980
Tenkodogo Pô
1982
1984
1986
1988
1990
1992
1995
1997
Années
1999
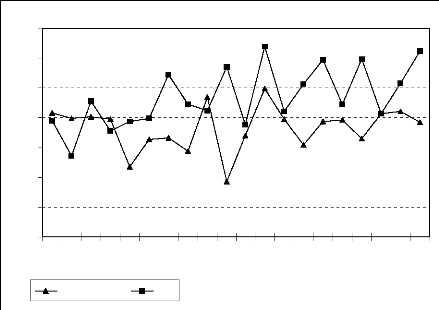
Figure 7 : Evolution de la pluviosité des deux
stations synoptiques (1980-2000)
2.2.1.2. Température
L'évolution des températures suit la
saisonnalité climatique. Au niveau des deux zones, il y a deux
régimes thermiques qui marquent deux périodes différentes
(Fig. 8). - une première période de juin à février
pendant laquelle les températures moyennes mensuelles sont
inférieures à 30o C.;
- une seconde période de mars à mai où
les températures moyennes mensuelles sont supérieures à
30o C. On note de fortes variations thermiques entre les maxima et
les minima (Fig. 8). Dans les deux zones, les maxima de mars et d'avril
avoisinent 40o C., tandis que leurs minima oscillent autour de
25o C.
T. °C.
45
40
25
20
35
30
45
40
a
35
30
25
20
15
10
15
10
b
5
0
5
0
T. °C.
Janvier
Janvier
Fevrier
Fevrier
Mars
Mars
Avril
Avril
Maxi Mini Moyenne
Mai
Mai
Juin
Juin
Juillet
Juillet
Aout
Aoat
Septembre
Septembre
Octobre
Octobre
Novembre
Novembre
Mois
Mois
Decembre
Decembre
Figure 8 : Moyennes mensuelles des
températures (1990-2000)
a : Station de
Pô ; b : Station de Tenkodogo
D'une manière générale, la moyenne
mensuelle des températures maximales est de 34o C. tandis que
celle des minima se situe à 22o C., soit une amplitude de
12o C. Les températures sont faibles entre juillet et
août puis entre décembre et février ; elles sont surtout
élevées entre mars et mai.
Cet intervalle de température (22° C. - 34°
C.) est favorable à une activité de butinage presque sans
interruption des abeilles dans ces deux zones contrairement à leurs
soeurs européennes soumises à des températures très
basses qui limitent leur activité de butinage pendant une certaine
période (Crane,1990).
2.2.1.3. Vent
Dans les Zones de Garango et de Nazinga soufflent deux types
de vents qui diffèrent par leurs origines, leurs parcours et leurs
structures aérologiques. Ce sont, selon, Monnier in Guinko,
(1984), les vents de saison sèche et les vents de saiso n de pluies.
Le vent de saison sèche ou harmattan est de direction
Nord-Est, Sud-Ouest. C'est une masse d'air sec issu du Sahara et dont le
principal effet est la chute de l'hygrométrie accompagnée par une
évaporation active. Les conséquences sur la
végétation sont surtout le dessèchement des
herbacées, l'assèchement du nectar, voire la chute des fleurs,
réduisant ainsi les quantités de nectars disponibles pour les
abeilles.
Le vent de saison des pluies ou vent de mousson souffle du
Sud-Ouest vers le Nord-Est.
L'analyse de la courbe des moyennes mensuelles de la vites se du
vent (Fig. 9) montre deux tendances
- une période de vents forts allant de décembre
à mai, correspondant à la
période d'harmattan. La vitesse est
généralement supérieure à 1,5 m/s.
- une période de vents faibles allant de juin à
novembre, de vitesse inférieure à 1,5 m/s ; elle correspond
à la période de mousson.
En somme les vents restent suffisamment faibles tout au long de
l'année pour ne pas gêner l'activité des abeilles.
Vitesse (m/s)
2,5
0,5
1,5
2
0
1
Janvier
Fevrier
Mars
Garango Pô
Avril
Mai
Juin
Juillet
AoCit
Septembre
Octobre
Novembre
Mois
Decembre
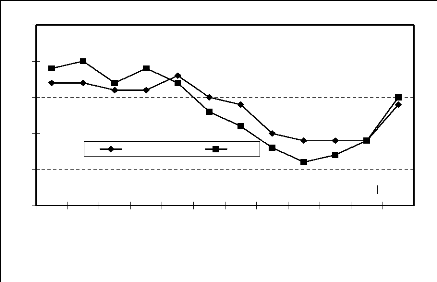
Figure 9 : Moyenne mensuelle de la vitesse du
vent (m/s) (1995-2000)
2.2.2. Hydrologie
Le réseau hydrographique est relativement dense dans la
zone de Garango. Deux principaux cours d'eau (le Nakambé et la Nouhao)
et trois cours d'eau secondaires (le Tcherbo, le Dougoulamoundi et le
Doubèguè) parcourent la zone.
Au niveau de Nazinga, le principal cours d'eau est la Sissili
avec des affluents te ls que le Nazinga, la Dawevelé.
Ces cours d'eau ont un régime hydrologique tropical pur
(Guinko, 1984) avec
un maximum en septembre et un minimum en avril, période
au cours de laquelle on observe dans le lit une succession de marules dont
certaines se dessèchent totalement entre mars et avril.
2.3. Géomorphologie et pédologie
2.3.1. Géomorphologie
L'allure générale de la géomorphologie de
Garango est marquée par des interfluves et des milieux granitiques de
forme convexe (
BU.NA.SOL, 1989). De nombreuses collines et
buttes rocheuses (granite, mylonites leucocrates, roches vertes) ou
cuirassées sont disséminées dans la zone rompant avec la
monotonie du paysage. On peut citer les chaos granitiques de Garango, de
Boussouma, de Lenga et de Ounzéogo.
Nazinga a dans l'ensemble un relief plat. L'altitude moyenne
se situe entre 300 et 320 m. Le lit de la Sissili descend parfois à 260
m (Bakyono, 1988) alors que quelques affleurements rocheux vont jusqu'à
380 m.
2.3.2. Pédologie
Les sols de Garango sont caractérisés par une
très grande hétérogénéité des
formations lithologiques. Cette
hétérogénéité qui se caractérise par
une structure, une granulométrie et une composition minéralogique
diversifiées, a conduit à une relative diversité des sols.
Cinq classes de sols ou cinq unités majeures ont été
distinguées par
BU.NA.SOL (1989) lors de l'étude
morpho-pédologique de la province du Boulgou. Ce sont: les sols
brunifiés, les sols hydromorphes, les vertisols, les sols sodiques et
les sols à minéraux bruts.
Trois classes de sols sont distinguées dans la zone de
Nazinga (Ouédraogo, 1985 ; Fournier, 1991 et Kaloga in Hien,
2001). Ce sont: les sols minéraux bruts, les sols peu
évolués et les sols hydromorphes.
2.4. Végétation
Les zones de Garango et de Nazinga sont situées
respectivement dans les secteurs phytogéographiques nord soudanien et
sud soudanien (Guinko, 1984 ; Guinko et Fontès, 1995) (Fig. 6). Selon
ces auteurs, la végétation du secteur nord soudanien est
caractérisée par :
- des sa vanes présentant partout l'allure de paysages
agrestes où dominent des espèc es protégées telles
Vitellaria paradoxa, Tamarindus indica, Parkia
biglobosa, Lannea microcarpa, Adansonia digitata,
Faidherbia albida. Les jachères, les bords de s sentiers et les
sols fortement érodés sont colonisés par de nombreuses
espèce s sahélienne s ubiquistes dont Cassia tora,
Ctenium elegans, Cymbopogon schoenanthus subsp . proximus,
Sida cordifolia, Echinochloa colona, Schoenefeldia
gracilis, Ziziphus mauritiana ;
- des groupements à Anogeissus leiocarpus et
des boisements installés sur de s sols drainés de plateau
présentant la physionomie d'une forêt dense sèche haute de
1 5 à 20 m. En hivernage la strate arborescente présente un
couvert fermé et compact constitué de 80% de feuillages de
Anogeissus leiocarpus et de quelques cimes de Khaya
senegalensis ainsi que de Celtis integrifolia émergeant
ça et là ;
- de s espèces plantées telles Mangifera
indica, Eucalyptus camaldulensis, Azadirachta indica,
Khaya senegalensis ;
- des espèces culti vées dont les principales
sont Pennisetum glaucum,
Sorghum bicolor, Zea
mays, Arachis hypogaea, Oryza sativa, Solanum
melongena,
Lycopersicum esculentus, Lagenaria siceraria,
Allium cepa.
La zone de Nazinga est située dans le District Est Mouhoun
du Secteur sud soudanien. La végétation est composée :
* de savanes arbustives à strate herbacée
constituée de Andropogon ascinodis , Schizachyrium
sanguineum, Cten ium newtonii, Loudetia togoensis,
Andropogon pseudapricus et Microchloa indica. La strate
ligneuse comprend Vitellaria paradoxa , Gardenia erubescens,
Acacia dudgeoni, Pteleopsis suberosa, Combretum
glutinosum et Terminalia avicennioides ;
* de savanes arborées dont la strate herbacée
est constituée de Hyparrhenia smithiana, Hyparrhenia
subplumosa, Andropogon gayanus, Andropogon ascinodis .
Les strate arborée est représentée par Vitellaria
paradoxa, Detarium microcarpum, Afzelia africana,
Anogeissus leiocarpus et Lannea acida.
2.5. Population
L'ethnie autochtone de Garango est le Bissa, celle de Nazinga
est le Gourounsi. Ces deux ethnies sont d'ailleurs liées par la
«parenté à plaisanterie». D'autres ethnies
(allochtones) telles les Peulhs et les Mossis se rencontrent aussi dans ces
deux zones.
La population est estimée à 2642 habita nts pour
Nazinga et 19 534 pour Garango (I.N.S.D., 1996).
Les principales activités sont l'agriculture et
l'élevage. La chasse, la pêche, le maraîchage et
l'apiculture sont des activités secondaires qui se déroulent
généralement en saison sèche. L'agriculture,
activité de subsistance, est de type extensif avec l'aménagement
perpétuel de nouveaux champs détruisant ainsi les
écosystèmes. Les principales cultures de subsistance sont : le
sorgho, le mil, le maïs, l'arachide, l'igname, le manioc et la patate
douce. Le coton et le sésame sont des
cultures de rente. L'élevage est également
extensif et concerne surtout les volailles, les ovins et caprins, les bovins.
La pêche, la chasse, l'apiculture, sont des activités collectives
qui revêtent une importance économique et sociale pour les
populations locales. Le matériel utilisé était
rudimentaire et la production jadis faible était destinée
à la consommation familiale. Mais avec la recherche
effrénée de l'argent, on constate des changements de com
portements avec l'utilisation des armes modernes pour le braconnage, des
produits chimiques ou biologiques pour la pêche et l'apiculture. Ces
pratiques conduisent à la destruction importante de la faune (apiaire,
aquatique, sauvage) et cela peut conduire à long terme, si on n'y prend
garde, à des changements des équilibres biologiques voire de
l'écosystème.
I. Introduction
Trois ruchers d'une dizaine de ruches ont été
installés dans les zones de Garango et Nazinga. Dans la première
zone, les ruchers sont placés dans le village de Lergo situé
à la lisière d'une savane boisée qui s'étend sur
plus de 20 km de profondeur. Dans la seconde, le premier rucher a
été installé à Walème (entrée Est du
Ranch), le deuxième à 500 m au Nord du campement forestier et le
troisième à Sia (sortie Quest du Ranch). Malgré les soins
nécessaires (gaufrage, nettoyage, utilisation
|
de charme abeille et de parfum d'Aristée),
|
nous n'avons pas pu obtenir à temps assez
|
de colonies dans nos deux premiers ruchers. Après une
année d'observations, nous
avons décidé de concentrer
l'essentiel de nos observations sur le rucher de Sia où
toutes les
dix ruches ont été colonisées. Par souci
d'uniformité, nous avons également
|
concentré nos observations autour d'un
|
rucher dans la zone de Garango où par
|
contre aucun problè me de peuplement des ruches n'a
été noté. Toutes les ruches ont été
colonisées avec des essaims naturels. Cela permet d'évaluer le
potentiel apière des différentes zones.
Les observations ont été réalisées
sur un rayon de 2 km autour de chaque rucher. Cette distance, selon Crane
(1980), Seeley (1985), Briane (1991) et Kepaletswe (1997) corres pond à
l'aire de butinage de l'abeille Apis mellifera adansonii ; de plus,
elle est supérieure au 500 m préconisée par Pechhacker
(1997) et, est comprise entre la distance de 1,5 km utilisée par
Louveaux (1984) et Philippe (1988) et de 3 km utilisée par Sawadogo
(1993), FAQ (1986) et Caroll (1997). Cependant il faut noter que l'aire de
butinage reste avant tout tributaire de la qualité du nectar. En effet
les abeilles peuvent aller à 3 km, parfois plus, pour butiner une plante
à teneur en sucre supérieure à 15 % en laissant dans les
environs immédiats
du rucher les espèces ayant une teneur en sucres
inférieure à 15 % (Philippe, 1991).
Les observations ont porté sur les mécanismes de
butinage de l'abeille domestique, la floraison des espèces
visitées, le suivi de l'évolution du poids des ruches et
l'étude quantitative de la végétation.
II. Matériel
Le matériel utilisé se compose principalement de
ruches modernes, de peson de 50 kg de portée avec une précision
de 200 g, d'un support trépied, de cordes, d'un compact forestier, de
rubans mètre, des grains de pollen, une pa ire de jumelles et des
produits et matériel de laboratoire (centrifugeuse, hotte, bain-marie,
lames et lamelles, béchers et pipettes, tubes à centrifuger
coniques, acide sulfurique concentré, acide anhydride, acide
acétique glacial, eau distillée, éthanol 50, 70 et
96°, acétone, paraffine ou verni à ongle, huile de silicone,
gants).
2.1. Ruches
Trois types de ruches ont été utilisés (Fig.
10 ; et Annexe 3, planche. 4).
2.1.1. Ruche Dadant (ruche à hausse)
Elle a été inventée par Charles Dadant
(FAQ, 1986 ; Anchling, 2000 c). Sa conception est basée sur deux faits :
la tendance des abeilles à installer leur couvain près de
l'entrée et le stock de miel au fond de la ruche d'une part et d'autre
part à maintenir un égal espace appelé
«bee-space» entre les rayons. D'ou l'idée qu'il était
possible de diviser une ruche en deux parties (Fig. 10, a) : le corps de ruche
en bas et la hausse en haut. Le corps de ruche abrite la reine, le couvain et
la quantité de
réserves alimentaires nécessaires aux besoins de
la population d'abeilles, tandis que la hausse est censée recevoir
l'excédent de miel. Les cadres de 33 mm de large sont
séparés par un «bee-space» de 7 mm. On compte dix
cadres dans le corps de ruche et dix dans la hausse. Mais le corps de ruche (35
litres) est en général plus volumineux que la hausse (20 litres)
(Tab. II).
2.1.2. Ruche kenyane
C'est une longue caisse à section
trapézoïdale (Fig. 10, c). Elle a été inventée
en 1976 par le Pr G. F. Townsend (Villieres, 1987 a ; Adjaré, 1990;
Crane, 1990). Les barrettes larges de 33 mm avec des cannelures, sont jointives
et cela fait que le «bee-space» est seulement interne. Son volume
intérieur est de 62,5 litres (Tab II).
2.1.3. R uche rectangulaire à cadres
Elle est une modification de la longue ruche transitoire
africaine (FAO,1986 ; Adjaré, 1990; Crane, 1990). Elle est
intermédiaire entre la ruche Langstroth et la ru che kenyane. C'est une
longue caisse rectangulaire de 55,5 litres de volume (Tab. II). Les cadres et
les «bee-space» sont recouverts de planchettes large de 13 cm. Les
cadres soutenus par des fils de fer fins reposent sur la ruche grâce
à des pointes dont la longueur constitue le «bee-space» entre
le cadre et les parois de la ruche (Fig. 10, b).
Tableau II : Dimensions internes des différents
types de ruches
|
Type de ruche
|
Dimensions
|
Nombre de cadres ou de barrettes
|
|
Mesure (cm)
|
Volume (l)
|
|
Dadant
|
L = 42,6 cm
Corps de ruche l = 35,6 cm
H = 23,3 cm
L = 42,6 cm
Hausse l = 35,6 cm
H = 13,3 cm
|
35 Litres
20 Litres
|
12
10
|
|
Rectangulaire à cadres
|
L = 73,8 cm l = 35,5 cm H = 21,2 cm
|
55,5 Litres
|
24
|
|
kenyane
|
B = 44 cm b = 22,5 cm
H = 23,5 cm L = 80 cm
|
62,5 Litres
|
24
|
L: Longueur; l: largeur; H: Hauteur; B: grande Base: b: petite
base
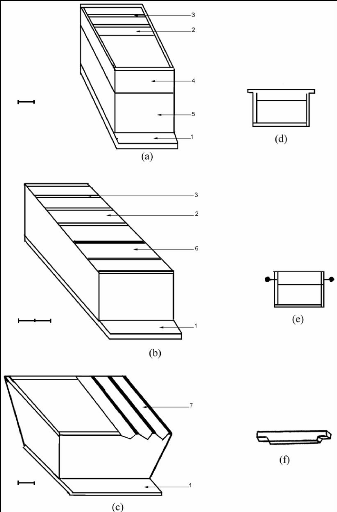
Figure 10 : Schéma des différents types
de ruches utilisées.
(a): Ruche Dadant ; (b) : Ruche rectangulaire ; (c) :
Ruche kenyane. (d) : Cadre rectangulaire sans pointe ; (e) :
Cadre rectangulaire avec pointes ; (f) : Barrette.
1 : Planche d'envol ; 2 : cadre ; 3 : « Bee-space
» ; 4 : Hausse ;
5 : Corps de ruche ; 6 : Planchette de recouvrement ; 7 :
Barrette.
III. Méthodes
3.1. Observations de l'activité de butinage des
abeilles
L'observation directe du butinage permet d'identifier les
plantes visitées par les abeilles et les nutriments (nectar, pollen,
miellat, résine) qu'elles prélèvent. Ces observations ont
été réalisées à l'oeil nu pour les herbes et
les arbustes et à l'aide d'une paire de jumelles (Leica 10X50 BA) pour
les arbres. Lorsqu'une plante est visitée par des abeilles, elle est
dite mellifère. La nature mellifère d'une plante est basée
principalement sur sa production de nectar ou de pollen. Si elle fournit aux
abeilles uniquement du nectar, elle est dite nectarifère,
pollinifère si elle fournit du pollen, enfin mixte (nectarifère
et pollinifère) si elle fournit le nectar et le pollen.
Un échantillon fleuri des espèces
visitées est prélevé, mis à sécher sous
presse pour servir à la constitution des lames de
référence. Ces espèces ont été
déterminées in situ ou à l'aide de flores telles
Berhaut (1967) et Hutchinson et Dalziel (1963).
La connaissance des plantes fournissant le nectar et/ou le
pollen est insuffisante si elle n'est pas accompagnée de la
période de disponibilité des nutriments (FAQ, 1986). Le suivi
phénologique permet d'apprécier la durée de la floraison
des plantes mellifères et donc la durée de la
disponibilité en nectar et/ou en pollen (Crane, 1980 ; Guinko et
al., 1992). Des fiches phénologiques ont été
conçues pour enregistrer la floraison (fl.) parmi les différentes
phénophases. Chaque phase a été codifiée comme
suit: fl1 = début de floraison, fl2 = optimum de floraison, fl3 = fin de
floraison.
L'importance mellifère d'une plante est
appréciée à travers la fréquence de butinage des
abeilles, laquelle est fonction de la qualité et de la quantité
des
nutriments fournis. Cette fréquence permet de
connaître les préférences alimentaires des abeilles (Guinko
et al. 1987). Nous avons, à l'instar de Pion et al.
(1983) compté le s abeilles visitant la fleur ou l'inflorescence pendant
10 mn.
Les esp ces intensément visitées +++, les esp
è sont notées èces
moyennement
visitées ++ et les espèces faiblemen t visitées +.
Un coefficient de ressemblance de Jaccard ( Pj) a
été a liqué
pp pour déterminer
le degré de similitude entre les espèces
mellifères e
d s deux zones.
c) x 100 c = nombre d'esp èces communes aux deux zones
b = nombre d'esp ces spécifi s à
è que la zone une
a = nombre d'espèces spéc ifiques à la
deuxième zone
|
3.2. Suivi de
|
l'
|
évolution du poids des ru hes
c
|
La pesée des ruches est essentielle pour la conduite d'un
rucher (Lavie, 1968) e t le suivi régulie r de la variation du poids des
c
ru hes permet de déterminer avec
précision les pér iodes de miellées et les
périodes de disette ( awa
S dogo, 1993). Le
suivi du p oids p ermet d'établir une
corrélation entre la productivité mellifère des plantes et
la production réelle des ruches (Guinko et al., 1987). Cinq
ruches par ru cher, choisies de manière aléatoire, sont
pesées mensuellement à l'aide d'un peson de 50 kg ayant une
précision de 200 g et d'un trépie d métallique. Une
moyenne mensuelle est établie par rucher.
3.3. Comparaison de la productivité de
différents types de ruches Parallèlement au suivi
de l'évolution du poids, nous avons voulu comparer la
productivité de trois types de ruches (kenyane, Dadant, rectangulaire
à cadres)
installés dans le rucher expérimental de Lergo.
Ainsi pour chaque type, trois ruches choisies de manière
aléatoire parmi cinq installées ont été
régulièrement suivies.
Des récoltes de miel ont été
effectuées essentiellement pendant la g rande miellée (mi-mars
déb ut mai) pendant deux ans. Le miel brut (avec les rayons) obtenu a
été pesé et une moyenne partielle a été
établie par type de ruche. Les données ainsi obtenues ont
été statistiquement analysées selon le test de Fisher ou
test de comparaison de plusieurs moyennes. Un taux a été
calculé pour cha cune des deux méthodes d'extraction :
égouttage et centrifugation.
Les difficultés de manipulation liées au fait
que la ruche permet une sortie massive des abeilles ou des constructions des
rayons en travers, ont été graduées comme suit : +++ :
très difficile, ++ : moyen, + : facile.
3.4. Analyse quantitative de la
végétation
Elle permet d'apprécier la stratégie de butinage
de l'abeille domestique, notamment le choix qu'elle exerce sur les plantes
à butiner. Ce choix est fonction de la diversité et de
l'abondance de ces plantes (Louveaux, 1990 b ; Lobreau-Callen et Damblon,
1994). Elle a consisté à apprécier l'indice de valeur
d'importance ou Importance Value Index (IVI) des différentes
espèces mellifères autour de chaque rucher. Cet indice est la
somme de trois valeurs que sont : la fréquence relative, la
densité relative et la dominance relative (Curtis et Macinthos, 1951 ;
Spichiger et al., 1996). L'IVI des espèces butinées dans
une zone permet de connaître la contribution de chaque espèce au
potentiel mellifère. Elle constitue avec la richesse floristique en
espèces mellifères les principaux critères
d'évaluation du potentiel mellifère d'une zone La somme des IVI
de toutes les espèces d'un échantillon considéré
est inférieure à 300.
Nous nous sommes intéressés particulièrement
aux espèces ligneuses des deux zones qui sont productrices d'importantes
miellées.
La méthode de Braun-Blanquet (1932) a été
utilisée. Cette méthode a été appliquée avec
succès par Guinko et al., (1987), Sawadogo (1993) dans
l'étude de la flore mellifère de la zone Quest du Burkina Faso et
par Debbagh (1988) pour étudier la flore mellifère du Sud du
Maroc. Des zones homogènes correspondant à des groupements
végétaux ont été définies et des placettes
de 20 m de côté ont été établie s dans chaque
zone. A l'intérieur de chaque placette, toutes les espèces
ligneuses à Diamètre à Hauteur de Poitrine (D.H.P.)
supérieur o u égal à 5 cm ont été
mesurées. Ces mesures ont été faites à 1,30 m du
sol pour les arbres et à 20 cm pour le s lianes ligneuses et les
arbrisseaux, cela parce que la plupart d'entre eux présentent un D.H.P.
à 1,30 m inférieur à 5 cm et pourtant ils fournissent des
nutriments aux abeilles. Les espèces à D.H.P. in férieur
à 5 cm ont été comptées p armi s ind idus e la
géné
le iv d ré ration. Lorsque le diamètre est
supérieur à 50 cm, la
circonférence est mesurée et le diamètre
calculé par la relation d = c/ð. Prenant en compte le
caractère sélectif du butinage d'Apis mellifera
adansonii Lat., les espèces mellifères environnant les
placettes sur 2 m ont été mesurées. L'évaluation
des peuple ments artificiels (plantations) s'est faite sur la base de leur
écartement (distance entre les pieds). Cela permet d'avoir une
expression de leur densité moyenne par hectare (Guinko et al.,
1987).
3.5. Traitement des données
L'ensemble des données de terrain a été
traité avec le logiciel Excel. Des droites de régression, des
coefficients de corrélation linéaire et des coefficients de
détermination ont été appliqués entre l'abon dance
des principales espèces mellifères
en fleurs par mois et la variation mensuelle du poids des
ruches d'une part et entre leur IVI et le poids des ruches d'autre part. Les
premières donnent une idée de la maniè re dont les poids
varient en fonction de l'abondance ou de l'IVI. Les deuxièmes encore
appelés corrélation de Bravais-Person mesurent le degré de
liaison liné aire entre deux variables. Enfin les troisièmes
expriment le pourcentage de la variation des poids qui est dû à
l'abondance ou à l'IVI.
3.5.1. Fréquence relative
C'est le quotient de la fréquence spécifique (ou
absolue) d'une espèce par la somme des fréquences
spécifiques de toutes les espèces rencontrées dans un
échantillon. Elle s'exprime en pourcentage.
3.5.2. Densité relative
C'est le quotient de la densité absolue d'une
espèce par la somme des densités absolues de toutes les
espèces rencontrées. Elle s'exprime en pourcentage.
3.5.3. Dominance relative (m2/ha)
C'est le quotient de la dominance absolue d'une espèce
par la somme des dominances absolues de toutes les espèces. Elle
s'exprime en pourcentage. La dominance absolue (ou aire basale) d'une
espèce est la somme de ses aires basales présentes dans
l'échantillon (Stutz De Ortega, 1987). L'aire basale ou surface
terrière est la somme des sections (S) au DHP. S (m /ha)= ?ðDi /4 (S
: Surface
2 2
terrière ; D : Diamètre à 1,30 m) ;
3.5.4. Abondance
L'abondance est le nombre d'individus d'une espèce
donnée rencontrés dans l'ensemble des relevés. Elle
correspond aux espèces très communes selon la classification de
Adam (1958).
3.5.5. Classes de diamètre
La répartition des espèces en classes de
diamètres permet d'étudier la structure horizontale de la
végétation. Quatre classes de diamètre ont
été distinguées : D = 50 cm; 25 cm = D < 50 cm ; 10 cm
= D < 25 cm ; 5 cm = D < 10 cm.
3.6. Lames de référence et description
des grains de pollen
Elles permettent de constituer une collection de
référence des grains de pollen des espèces
mellifères. Cette collection est indispensable pour la
détermination des pollens présents dans le miel qui permet de
mieux comprendre les relations plantes/abeilles et de déterminer
l'origine géographique et botanique des produits de la ruche (Louveaux
et al, 1978 ; Damblon, 1987 et 1988). L'étude du pollen
présent dans le miel permet aussi de déterminer
d'éventuelles pollutions chimiques de l'environnement (Voget, 1989 et
Fleché et al., 1997).
3.6.1. Prélèvement des grains de pollen
Les grains de pollen sont prélevés sous une
loupe binoculaire à partir d'échantillons fleuris
récoltés et mis à sécher dans une presse. Ces
échantillons sont prélevés avec de nombreux boutons
floraux juste avant leur ouverture pour éviter toute contamination avec
les pollens d'e spèces anémophiles ou entomophiles (R icciardelli
D'Albore, 1997 et Schweitzer, 2001).
3.6.2. Acétolyse des grains de pollen
Les grains de pollen sont acétolysés selon la
méthode d'acétolyse d'Erdtman (1969). Cette méthode permet
d'avoir une meilleure vision de la surface des grains de pollen (Gadbin, 1979 ;
Lieux, 1980, Louveaux et al., 1978).
3.6.3. Description et microphotographie des grains de
pollen
La description des grains de pollen et la terminologie
utilisée sont celles de la palynologie descriptive (Faegri et
al., 1964 ; Nilson et Muller,1978 ; Punt et al.,1994). Les
mensurations ont porté sur 30 grains de pollen et concernent l'axe
polaire (L) et l'axe équatorial (E) du grain de pollen en vue
meridienne, ou le diamètre (D) pour les pollens circulaires. En fonction
des dimensions de l'axe polaire, les pollens sont classés selon Sawyer
(19 88). Les photographies sont réalisées au microscope
photonique à objectif 100x à immersion (Samuelsson, 1969) et au
microscope électronique à balayage (Dunbar, 1969 et Lynch et
al. 1975). Pour chaque espèce, nous indiquons le numéro de
la lame de référence, le lieu de récolte, l'aire de
distribution selon Von Maydell (1990) et Arbonnier (2000) et sa nature
mellifère.
Parallèlement aux observations sur le terrain relatives
à l'activité de butinage des abeilles, à la description de
la végétation et au suivi de l'évolution du poids des
ruches, des e nquêtes «ethnoapicoles » ont été
menées auprès des apiculteurs détenteurs de ruches
traditionnelles dans les deux zones.
3.7. Enquête «ethnoapicole»
Une enquête «ethnoapicole» a été
réalisée dans les dix villages riverains du Ranch de Gibier de
Nazinga et dans treize villages de la zone de Garango. Le but
est de recueillir des informations sur l'apiculture
traditionnelle et de mieux connaître la situation apicole dans ces deux
zones. Cent trois (103) apiculteurs ayant une moyenne d'âge de 33 ans,
propriétaires de ruches traditionnelles, ont été
interrogés. A l'aide de questionnaires (annexe 1), nous avons
échangé sur les points suivants : * les différents ty pes
de ruches utilisées et les matériaux entrant dans leur confection
;
* les techniques de préparation des ruches avant leur
installation pour attirer les essaims ;
* les techniques de récolte, d'extraction et de
conditionnement du miel ; * les usages des produ its de la ruche.
I. Flore mellifère des zones de Garango et de
Nazinga
1.1. Composition de la flore mellifère
Les observations directes de butinage d'Apis mellifera
adansonii Lat. autour des différents ruchers ont permis de recenser
les espèces mellifères dans les deu x zones et d'identifier les
nutriments prélevés par les abeilles. Les résultats sont
consignés dans les tableaux III et IV.
1.1.1. Zone de Garango
a) Quatre vingt seize (96) espèces mellifères
réparties en 72 genres et 36 familles ont été
recensées (Tab. III). Les Légumineuses avec 21 espèces,
soit 21,86%, sont les plus visitées, suivies par les
Combretaceae et les Rubiaceae avec chacune 8 espèces ,
soit 8,33%, les Malvaceae 6 espèces (6,25%) et les
Anacardiaceae 5 espèces (5,21%).
b) Suivant les nutriments prélevés par les
abeilles, les espèces nectarifères au nombre de 59 (61,46%) sont
les plus visit ; les pollinifères représentent 14,58%
ées
et les mixtes 23,96%. Les espèces nectarifères
sont les plus abondantes et appartiennent pour l'essentiel à la famille
des Mimosaceae (15,25%), des Combretaceae (13,56%) et des
Anacardiaceae (8,47%).
c) La répartition des espèces recensées
suivant le type biologique indique 52,08% d'espèces ligneuses et 47,92%
d'herbacées.
d) Dans la zone de Garango, les espèces
intensément butinées, avec 48,96%, dominent la flore
mellifère (Tab. III). Les espèces moyennement et faiblement
butinées représentent respectivement 20,83% et 30,20% de la flore
mellifère.


|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Celastraceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Maytenus senegalensis
|
Ar
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cochlospermaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cochlospermum planchoni
|
h
|
+++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cochlospermum tinctorium h +++ N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Malvaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Abelmoschus esculentus
|
H
|
+++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hibiscus cannabinus
|
H
|
++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hibiscus sabdariffa
|
H
|
++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sida acuta
|
H
|
++
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sida a lba
|
H
|
++
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wissadula amplissima
|
H
|
++
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Meliaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Khaya senegalensis
|
A
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mimosaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Acacia pennata
|
L l
|
+ ++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Acacia polyacantha subsp.
|
A r
|
+ ++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Acacia sieberiana
|
A
|
+ ++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Acacia seyal
|
A
|
++ +
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dichrostachys cinerea
|
Ar
|
++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Faidherbia albida
|
A
|
+++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Parkia biglobosa
|
A
|
++ +
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Eucalyptus camaldulensis
|
A
|
+ ++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Psidium guajava
|
Ar
|
++ +
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Boerhavia diffusa
|
H
|
++ +
|
P
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Boerhavia erecta
|
H
|
+ ++
|
P
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ximenia americana
|
Ar
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ludwigia senegalensis
|
H
|
+
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Andropogon gayanus
|
H
|
+ ++
|
P Js
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pennisetum glaucum
|
H
|
+++
|
P
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sorghum bicolor
|
H
|
+ ++
|
P
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zea mays
|
H
|
+++
|
P
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ziziphus mauritiana
|
Ar
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ziziphus mucronata
|
Ar
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Borreria filifolia
|
H
|
+++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Borreria scabra
|
H
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Borreria stachydea
|
H
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Feretia apodanthera
|
Ar
|
+++
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gardenia erubescens
|
Ar
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gardenia ternifolia
|
Ar
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mitracarpus scaber
|
H
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mitragyna inermis
|
A
|
++
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sapotaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vitellaria paradoxa
|
A
|
+ ++
|
N PJ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Familles et espèces
|
T.B
|
I.B.
|
Nut.
|
J
|
F
|
M
|
A
|
M
|
J
|
J
|
A
|
S
|
O
|
N
|
D
|
|
Sterculiaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Waltheria indica
|
H
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tiliaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Grewia bicolor
|
Ar
|
+
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Triumfetta lepidota
|
H
|
+
|
P
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Verbenaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gmelina arborea
|
A
|
++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vitex doniana
|
A
|
+++
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
A : Arbre ; Ar : Arbuste ;
H : Herbe : Liane ligneuse ; h : hémicryptophyte
; Ll
T.B. : Type Biolog ique ; I.B.
: Intensité de Butinage ; : N t e t
N t. u rim n
u
N: Nectar, P: Pollen
;Js : Jus sucré
NB : les espèces Acacia
seyal, Ma ife
ng ra in dica, omba c t um et
B x os at Khaya
senegale nsis fleurissent de dé em re à
janv r.
c b ie
1.1.2. Zone de Naz a
ing
a) Quatre vin
gt dix huit (98) espèces mellifères
réparties en 72 genres et 33 familles ont été recen
sées autour ru r N zi a Ta . ). e lé um
du che de a ng ( b IV L s g ineuses sont les plus nombreuses avec
21 è
esp ces, so 1 3 ; iv n es
it 2 ,4 % su e t l Rubiaceae ve
a c
11 espèces (11,22%), les Combretaceae p c (9,18%)
et les Malvaceae 7
représentant
9 es è es
espèces (7,14%).
b) Ces 98 e spèces mellif n
ères so t répar es e 5 ligne x
ti n 7 u
58,18%, en 3 9 herbacées, soit 42, ic p p te (
27% et en 2 hém ry to hy s 2, % .
04 )
c) Soixante de u x (62) espèc (6
es 3,27%) fournissent aux abeilles du nectar, 13 du pollen et
23 du nectar et du pollen. Ces deux derniers représentent 13,27% et
23,47%.
d) Dans la zone de Nazinga, 47 espèces soit 47,96%
sont intensément visitées par les abeilles, 27 espèces
(27,55)% moyennement visitées et 24 espèces (24,49%) faiblement
visitées (Tab. IV).
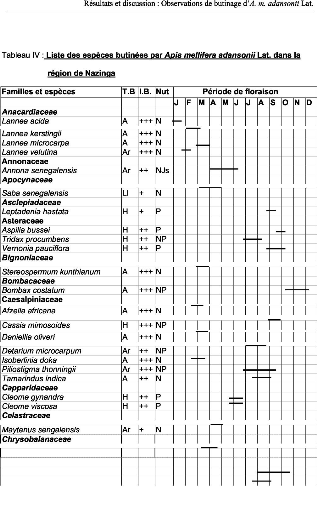
54
Parinari curatellifolia
Cochlospermaceae
Cochlospermum planchonii
Cochlospermum tinctorium
A
h
h
++
+++ N
+++ N
N
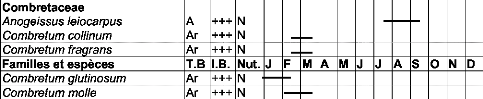
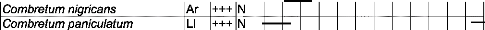
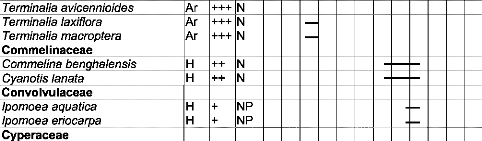


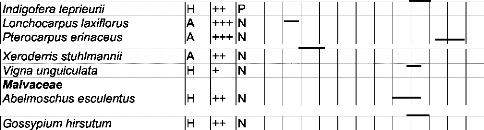

Pseudocedrela kotschyi
A
+++ N
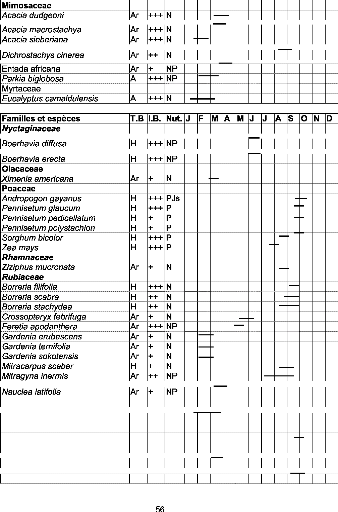
Sapotaceae
Vitellaria paradoxa
Solanaceae
Datura innoxia
Sterculiaceae
A
H
+++
NP
+++ NP
Sterculia setigera A +++ N
+
NP
H
Waltheria indica

57
H
+++ N
Cissus populnea
|
Tiliaceae
|
|
|
|
|
Grewia cissoides
|
Ar
|
+
|
N
|
|
Grewia bicolor
|
Ar
|
+
|
N
|
|
Triumfetta lepidota
|
H
|
+
|
NP
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Verbenaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gmelina arborea
|
A
|
++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vitex doniana
|
A
|
+++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vitex simplicifolia
|
A
|
+++
|
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vitaceae
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A : Arbre, Ar : Arbuste ;
H : Herbe : l :Liane ligneuse ; h
h
; L liane ; L : émic pt
h te
ry op y
T.B. : Type Biologique ; I.B. :
Intensité de Butinage ; : N tr e t
N . u im n
ut
N : Nectar ; P : Pollen ; r et
olle ; Js
NP : Necta p n : Jus sucré.
NB : Les espèces Combretum pan
a
icul tum et Khay s e al s fleurissent de a
en g en is
décembre à janvier.
1.1.3. Discussio n
La présenc e d'espèces mellifère s dans une
zone est l'un des premiers critères d'évaluation de son potentiel
mellifère.
Les tableaux III et IV montrent une di er té in on le d
v si tra z a es e è s
sp ce
butinées. Cette diversité floristique a
été constatée par Guinko e a
t l. (1992) et
Sawadogo (1993) dans la région e t aussi par Latham (2000)
en République
Ou st e
Démocratiq ue du Congo. Elle est due à la
sélection des espèce s à butiner r s
pa le abeilles (Lobreau-Ca llen et Damblon, 1994). Cette
sélection est influencée par la morphologie florale, la
phénologie et la composition floristique (M T ll a, 9
c e ri 1 93 et
a
Lobreau-Callen, 199 4). Cette dive é s e st g le en in r
on le C q
rsit flori tiqu e é a m t te z a . e ui corrobore
l'idée de D e Layens et Bonnier (1997) qui disent qu'une plante peut
être mellifère dans une zone et ne pas l'être da une autre
zone. De plus le co
ns efficient
de Jaccard appliqué aux flores lli s s e x zon s montre un
degré de
me fère de d u e
similitude de 51,59%. Ce degré est beaucoup plus
marqué chez les herbacées (68,75%) que chez les ligneux (4 %) Cet
différence s'explique par les activités
1 . te
anthropiques de l'H omme dans la zone de Garango. En effet, de
vastes peuplement
s
|
boisés sont tra nsformés par l'hom e p d lt es
monospéc
m en cham s e cu ur
|
ifiques ne
|
laissant que les es pèces utiles co e
mm Parkia l o , bax costatum Lannea
big ob sa Bom ,
microcarpa etc. Tandis que la Zone de Nazinga est
toujours une savane boisée. La
réduction du nombre d'espèces ligneuse m s bi
é de sélection des
s li ite la po si lit
abeilles surtout en saison sè che, période de
floraison de celles-ci. Cela a été constaté par
Lobreau-Callen (1987 P e le ab il s ti en pr tiq emen su
). our lle, s e le bu n t a u t r
toute espèce e n fleurs en saison s e
èch .
L'intensité de visites des abeilles sur les
différentes espèces est variable. Certaines sont int
ensément butiné d
es, 'autres y en n m nt u ib m n u é s.
mo e e o fa le e t b tin e Près de 50% des
espèces mellifères sont intensément butinées dans
les deux zones. Cette intensité de butinage est fonction de la
qualité du nectar. En effet, les abeilles ne butinent que les fleurs
dont la teneur en sucre est supérieure à 15% (Philippe, 1991).
En plus de la qualité du nectar, il faut que celui-ci
soit produit en qu antité. L'un des critères de production du
nectar en quantité est sans doute la durée de floraison bien que,
selon Philippe (1988 et 1991), Crane (1990), O'Toole et Raw (1991), De layens
et Bonnier (1997), Fluri (2001 a et b) la quantité de nectar produite
dépend aussi du climat, du sol, de l'état sanitaire de la plante,
de l'altitude, de la latitude et des facteurs héréditaires de la
plante. Un autre critère de production abondante du nectar est
l'activité de butinage des abeilles elle-même car la production du
nectar est un processus actif, stimulé chaque fois que le nectar est
enlevé (Jean-Prost, 1987 et Crane, 1990), d'où la
nécessité d'avoir de fortes colonies.
L'étude de la diversité floristique et de
l'intensité de visites mettent en évidence le fait que :
- La présence d'espèces mellifères est un
indicateur d'évaluation du potentiel mellifère.
- Les abeilles sélectionnent les espèces à
visiter en fonction de leur diversité
- La majorité des espèces mellifères des
deux zones est intensément butinée.
1.2. Disponibilité florale dans les deux
zones
Le suivi de la période de floraison montre une
disponibilité en fleurs pendant toute l'année avec cepen dant des
périodes d'abondantes floraisons qui alternent avec des périodes
de faibles floraisons dans les deux zones (Fig. 11).
Dans la zon e de Garango, les périodes d'abondantes
floraisons vont de janvier à mars et correspondent à la floraison
des espèces ligneuses et, de juillet à
septembre où la floraison des herbacée s annuelles
est dominante. Les périodes de
faibles floraisons vont d'avril à juin et d'octobre
à décembre.
45
40
25
20
50
35
30
15
10
5
0
d'espèces en
N o m b re
fleurs
Janvier
Nazinga Garango
Fevrier
Mars
Avril
Mai
Juin
Juillet
AoCit
Septembre
tobre
Oc
Novembre
Decembre
Mois
Figure 11 : Disponibilité florale dans les deux
zones
Dans la zone de Nazinga, les pics de floraisons vont de
février à avril et sont dominés par la floraison des
espèces ligneuses et, de juillet à septembre où la
floraison des herbacées est abondante. Les périodes de faible
floraison vont de mai à juin et d'octobre à janvier.
D'une manière générale, le nombre
d'espèces herbacées en fleurs est plus importante que celui des
ligneux dans les deux zones.
1.2.1. Calendrier floral
Le suivi phénologique des différentes
espèces mellifères a permis de dresser pour chaque zone un
calendrier de leurs floraisons (Fig. 12 et Fig. 13). Ces figures montrent que
la saison des pluies est dominée par la floraison des herbacées
annuelles, spontanées ou cultivées.
56,04% des espèces fleurissent en saison de pluies dans la
zone de Nazinga et 65,96% dans celle de Garango.
Cependant quelques espèces ligneuses fleurissent aussi
en saison pluvieuse. Ce sont : 39,37% de la flore mellifère pour la zone
de Garango et 11,84% pour celle de Nazinga.
La saison sèche coïncide avec la floraison
d'espèces ligneuses. 43,96% dans la zone de Nazinga et 34,04% dans celle
de Garango.

Figure 12: Calendrier de floraison des espèces
mellifères de la zone de Garango
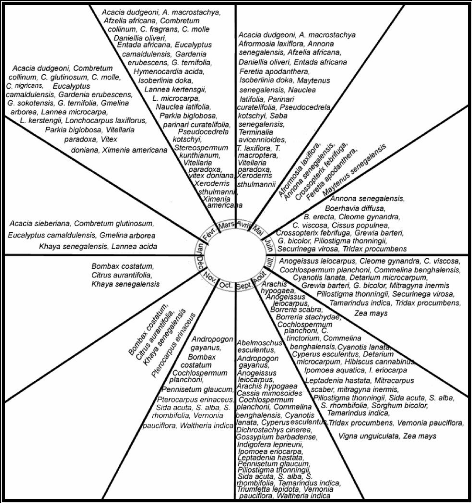
Figure 13 : Calendrier de floraison des espèces
mellifères de la zone de Nazinga
1.2.2. Discussion
Les périodes de floraison sont importantes dans
l'étude des potentialités mellifères. Elles indiquent les
périodes de disponibilité des nutriments pour les abeilles dans
chaque zone car les plantes ne fleurissent pas simultanément d'une zone
à une autre. Selon les travaux de Guinko (1984), lorsqu'une
espèce est répartie sur tout le territoire, du Sud au Nord, les
individus ne fleurissent pas de façon simultanée. De plus la
période de floraison peut varier dans le temps, dans l'espace et d'une
année à une autre. En effet, la floraison d'une même
espèce ne se produit pas toujours à la même date d'une
année à l'autre (Guinko, 1984) et suivant des conditions
d'humidité exceptionnelle, elle peut fleurir en faible quantité
(FAQ, 1986).
Le suivi de la floraison des espèces dans les deux
zones a montré une disponibilité en nutriments pour les abeilles
pendant toute l'année avec des périodes d'abondance couvrant
pratiquement sept mois. Les abeilles ne connaissent donc pas des
périodes de manque de nutriments à l'instar de leurs consoeurs
européennes qui doivent être nourries pendant l'hiver.
Cependant cette disponibilité florale ne se traduit pas
forcément par une disponibilité constante et importante des
ressources alimentaires pour les abeilles (Crane, 1990 ; Sawadogo, 1993). En
effet, les mois d'août et de septembre qui présentent un grand
nombre d'espèces mellifères en fleurs conduisent paradoxalement
à une faible production de miel. Cette situation est due d'une part
à la sélection des espèces à butiner par les
abeilles, laquelle s'exerce beaucoup plus en saison pluvieuse où la
diversité floristique est importante (Lobreau-C allen et Damblon, 1994)
et d' autre part, au fait que cette période est dominée par la
floraison d'herbacées à petites fleurs productrices plus de
pollen que de nectar et surtout qui
ont une durée de vie qui ne dépasse
généralement pas deux semaines. Elle peut aussi s'expliquer par
l'action des pluies qui empêchent la sortie des abeilles, diluent le
nectar. Enfin cette période est selon Sawadogo (1993) consacrée
à l'élevage du couvain.
La variation de floraison va se répercuter donc sur la
disponibilité des nutriments et par conséquent sur la production
de miel, entraînant des fluctuations au niveau de deux miellées
successives par exemple (Jean-Prost, 1987).
Le calendrier floral qui indique la succession des floraisons
des espèces mellifères permet de suivre la disponibilité
en nutriments. Il est un outil indispensable pour les aménagements
apicoles car il indique les périodes d'abondantes floraisons des
espèces mellifères susceptibles de conduire à une
accumulation de miel dans les ruches et aussi les périodes de faibles
floraisons. Il donne une idée précise des espèces qui
fleurissent dans un mois. Enfin il est un outil indispensable dans
l'identification des grains de pollen lors des analyses polliniques des
produits de la ruche.
Cependant le calendrier floral d'une zone n'est pas
figé ; il est susceptible de variations liées au fait que la
floraison des espèces suit la variation climatique, notamment le
début, la durée et la quantité de pluies tombées au
cours de l'année. Ce n'est donc pas un guide infaillible dans les
aménagements apicoles (FAQ, 1986).
En conclusion on retiendra que la végétation met
à la disposition des abeilles des fleurs toute l'année avec
cependant deux pics de floraison pour chaque zone. Cette disponibilité
florale ne traduit pas forcement une disponibilité en nutriments
à cause de la sélection exercée par les abeilles et
l'action de facteurs externes tels que la pluie. La plupart des espèces
fleurissant en saison sèche sont des ligneux alors
que ce sont les herbacées qui fleurissent plus en saison
des pluies.
II. Variation du poids des ruches
Le poids d'une ruche est fonction de celui de la colonie et
des réserves de miel ou de pollen. Mais sa variation est plus
liée à celle des quantités de réserves alimentaires
qui y sont accumulées (Crane, 1980).
Une hausse du poids de la ruche correspond à la
période de miellée et une baisse du poids à la
période de disette.
2.1. Variation du poids des ruches dans la zone de
Garango
L'évolution du poids des ruches (Fig. 14) montre des
périodes de hausse allant de février à avril et de juillet
à novembre alternant avec des périodes de baisse entre mai et
juin et entre décembre et janvier.
- Deux pics de poids de 40,24 kg et de 27 kg sont notés
respectivement en avril et novembre. Ils correspondent à un
accroissement de 20,84 kg et 7,6 kg du poids des ruches.
- Les baisses de poids sont de 16 kg et de 7,28 kg.
2.2. Variation du poids des ruches dans la zone de
Nazinga
Les variations du poids des ruches (Fig. 14) se présentent
comme suit :
- Deux pics respectivement de 38,4 et 28,66 kg en mars et
octobre. Ils correspondent à une hausse de 19 kg et 9,26 kg du poids des
ruches.
- Les baisses de poids sont de l'ordre de 16,75 kg d'avril
à mai et de 7,6 kg de novembre à janvier.
D'une manière générale, les
périodes de hausse de poids correspondant à une accumulation de
réserves dans les ruches couvrent neuf mois dans les deux zones. Les
quantités de miels effectivement récoltés
pendant ces périodes de hausse de poids des ruches sont de 8 kg de miel
extrait pendant la première hausse et 4 kg pendant la deuxième,
soit un total de 12 kg de miel/ruche/an.
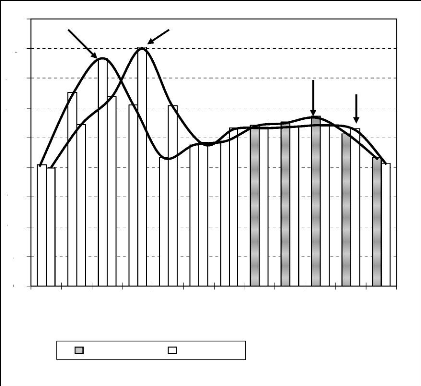
P oids (K g) 45
40
25
20
35
30
15
10
5
0
Janvier
Fevrier
Nazinga Garango
Mars
Avril
Mai
Juin
Juillet
Aoat
Septembre
Octobre
Novembre
Decembre
Mois
Figure 14 : Variation mensuelle du poids des ruches des
zones de Garango et Nazinga (moyenne des années 1999, 2000 et
2001)
2.3. Succession des miellées et disettes
Les figures (15 A et 18 B) montrent que la première
période de miellée intervient en saison sèche : elle est
dite miellée de saison sèche ou grande miellée ou enc re
miellée principale et, la deuxième période de
miellée intervenant en saison
o
des p luies est appelée miellée de saison pluvieuse
ou petite miellée ou encore miellée secondaire.
- Dans la zone de Nazinga, la grande miellée débute
en fin janvier, atteint son maxim um en mars et prend fin en début
avril.
- Dans la zone de Garango, elle commen ce en début
février, atteint son maximum en avril et s'achève en début
mai.
La petite miellée commence en fin juin avec l'installation
des pluies ; e lle se poursuit jusqu'au début de novembre, avec un
maximum du poids des ruches
en octobre.
Les périodes de disettes ou de pénurie vont de :
- début avril à fin juin et début novembre
à début février pour la zone de Nazinga.
- début mai à fin juin et début novembre
à fin janvier pour la zone de Garango.
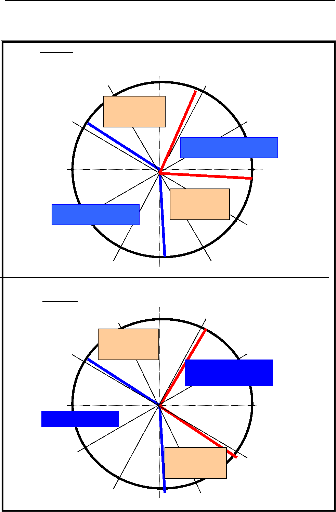
Décembre
Janvier
Février
Octobre
Mars
Avril
Août
Mai
Janvier
Décembre
Octobre
Mars
Avril
Période
Mai
Juillet
Juin
Septembre
Septembre
A : Nazinga
B : Garango
Novembre Février
Petite miellée
Petite miellée
Période De disette
Période
isette
de disette
Grande miellée
Grande miellée
Figure 15: Succession des périodes de
miellée et de disette des zones de Nazinga et de Garango
2.4. Discussion
Le poids d'une ruche prend en compte celui des abeilles
adultes, du couvain, de la cire, et des réserves de miel et pollen
(Crane, 1990 ; Marceau et al., 1990). Mais sa variation est due plus
à la différence entre ce qui est apporté à la ruche
et ce qui est utilisé par les abeilles. Cependant le stock de miel
pesant au moins dix fois le poids des abeilles et contribuant pour plus de 50%
au poids total d'une ruche (Crane, 1980), le gain pondéral d'une ruche
serait donc un indicateur de la production d e miel. Les autres
éléments (quantité de couvain, population d'abeilles
adultes, réserve de pollen) contribuent pour 10% de ce poids total
(Mclellan, in Crane, 1990).
La quantité de miel effectivement
récoltée par ruche et par an dans les deux zones se rapproche de
celle trouvée par Villières (1987 a) pour l'Afrique tropicale et
qu'il situe entre 8 et 12 kg de miel. Par contre elle est différente de
celle trouvée par Sawadogo (1993) qui est de 16,80 kg pour la zone Quest
du Burkina Faso et par Castag né (1983) qui a trouvé une moyenne
de 20 kg de miel au Congo-Brazzaville produi t par la même race
d'abeille.
Cep endant il convient de noter que la production de miel des
ruches peut être améliorée par des aménagements
apicoles spécifiques (notamment en détruisant les colonies
faibles). En effet selon De Layens et Bonnier (1997), les poids des ruches sont
différents ; une différence liée à
l'intensité du travail de chaque colonie.
Les successions de miellées et disettes établies
pour les deux zones (Fig. 15) montrent que celles de la zone de Nazinga se
rapproche de celles de la zone Quest du Burkina établies par Sawadogo
(1993). Ce qui n'est pas étonnant car ces deux zones appartiennent au
même secteur phytogéographique Sud soudanien (Guinko et
Fontès 1995). Par contre le calendrier de la zone de Garango qui
appartient au
secteur Nord soudanien, est différent de celui de la zone
de Nazinga et de la zone Quest surtout au niveau des pics de
miellées.
2.5. Comparaison des miellées des deux zones
La courbe d'évolution du poids des ruches dans les deux
zones à la figure 14 montre que le pic de poids des ruches de saison
sèche de la zone de Nazinga précède celui de la zone de
Garango, ainsi que ceux des pics de miellées de saison pluvieuse. Les
pics de poids des ruches de saison sèche sont supérieurs à
ceux de la saison pluvieuse.
Cela s'explique par la différence entre les espèces
visitées, leurs périodes de floraison et aussi par d'autres
facteurs comme le feu d'aménagement ou feu précoce utilisé
surtout dans la zone de Nazinga pour aménager le ranch ; ce feu provoque
un début précoce de floraison chez certaines espèces.
2.6. Conclusion sur la variation du poids des
ruches
Une moyenne annuelle de 12 kg de miel extrait par ruche a
été trouvée pour les deux zones. C'est une moyenne proche
de celle généralement admise en Afrique tropicale. La
miellée couvre sept mois au cours desquels les colonies stockent des
quantités excédentaires de miel dans les ruches ; les autres mois
de l'année (5 mois) correspondent à des périodes de
pénuries dues au nombre peu élevé d'espèces
mellifères ou aux facteurs climatiques.
III. Analyse quantitative de la
végétation
Les résultats des études quantitatives de la flore
mellifère des deux zones sont résumés en Annexe 6
3.1. Abondance
Les espèces abondantes (N>100) de la zone de Garango
sont Vitellaria paradoxa, Sclerocarya birrea, Lannea microcarpa, Combretum
glutinosum, Balanites aegyptiaca, Anogeissus leiocarpus et Acacia
dudgeoni. En outre, une plantation d'Eucalyptus camaldulensis
avec une densité de près 700 individus à l'hectare, est
rencontrée dans le voisinage du rucher.
Dans la zone de Nazinga, les espèces abondantes sont :
Anogeissus leiocarpus , Pseudocedrela kotschyi,
Piliostigma thonningii, Terminalia avicennioides et
Vitellaria paradoxa.
Les espèces abondantes sont peu représentées
dans les deux zones.
3.2. « Importance Value Index » (IVI)
Les espèces mellifères présentant un IVI
au niveau de la flore sont : Sclerocarya birrea, Vitellaria
paradoxa, Parkia biglobosa, Lannea microcarpa, B
alanites aegyptiaca, Anogeissus leiocarpus, Acacia dudgeoni
dans la zone de Garango et, Vitellaria paradoxa,
Pseudocedrela kotschyi, Piliostigma thonningii,
Anogeissus leiocarpus, Terminalia avicennioides,
Pterocarpus erinaceus, et Combretum glutinosum dans la zone
de Nazinga.
3.3. Classes de diamètre
L'analyse des classes de diamètre (Fig. 16) permet de
noter la prédominance des individus appartenant à la classe
10<D<25 cm dans la zone de Garango tandis que ce sont les individus de la
classe 5<D<10 cm qui domin ent au niveau de Nazinga. Elle in dique une
structure horizontale homogène de la végétation avec
cependant peu de jeunes individus dans la zone de Garango. Cela est lié
aux difficultés de régénération et à leur
coupe lors des aménagements culturaux.
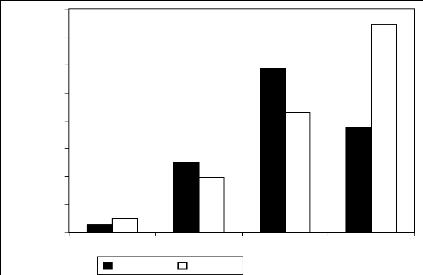
Nombre d'individus
4 0 0
2 0 0
8 0 0
7 0 0
6 0 0
5 0 0
3 0 0
1 0 0
0
D > 5 0 2 5 < D < 5 0 1 0 < D < 2 5 5 < D <
1 0
G a ra ng o N a zing a
Classes
Figure 16 : Répartition des principales
espèces mellifères en classe de diamètre
Les zones de Garango et de Nazinga malgré le nombre peu
élevé d'espèces abonda ntes, ont de réelles
potentialités mellifères car ces espèces sont non
seulement des ligneux intensément butinés avec une floraison
abondante s'étalant sur au moins un mois et, surtout, représen
tées par une centaine d'individus. Ces espèces abondantes peuvent
ains i servir d'appellation ou d'identification des miels. Les classes de diam
ètre et les IVI montrent le manque de régénération
dans la zone de Ga rango. Cela constitue un problème que si on n'y prend
garde peut avoir à long terme des répercussions négatives
sur le potentiel mellifère.
IV. Facteurs influençant la variation du poids
des ruches
Plusieurs facteurs en plus de ceux intrinsèques aux
colonies peuvent avoir une influence sur la variation du poids des ruches
4.1. Nombre d'espèces mellifères en
fleurs
Si les périodes de disettes coïncident en
général avec une diminution du nombre d'espèces
mellifères en fleurs (Fig. 17), il n'en est pas toujours de même
pour les périodes de miellées où l'on devrait s'attendre
à un nombre élevé d'espèces mellifères en
fleurs. En effet, en saison s èche le nombre d'espèces
mellifères en fleurs précédant le pic de poids des ruches
est faible, alors que le poids des ruches est élevé. Cela
s'explique par le fait que ces pics succèdent la floraison
d'espèces de haute valeur mellifère (Guinko et al 1992)
présentant une abondante floraison (Nombré et al., 2001)
que sont : Eucalyptus camaldulensis, Vitellaria paradoxa,
Lannea microcarpa, Lannea acida, Lannea kerstengii, Sclerocarya
birrea, Daniellia oliveri, Afzelia africana,
Isoberlinia doka, Pterocarpus erinaceus, Parkia biglobosa,
Acacia sieberiana, Acacia dudgeoni, Vitex doniana, Gmelina
arborea et Xeroderris stuhlmannii. Par contre la saison des
pluies avec un nombre élevé d'espèces en fleurs conduit
à une miellée secondaire.
En plus du nombre peu élevé d'espèces
mellifères en fleurs, les périodes de disettes peuvent aussi
s'expliquer par l'action des facteurs climatiques notamment les vents
d'harmattan qui gênent le butinage des abeilles pendant les mois de
novembre, de décembre et de janvier ; et qui de plus assèche le
nectar.
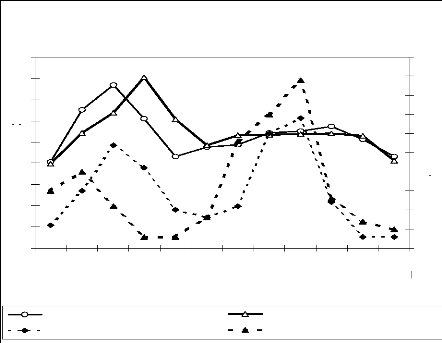
ruches (k g )
P o id s des
4 5
4 0
3 5
3 0
2 5
2 0
1 5
1 0
5
0
Janvier
P o id s des ruches (N a zin g a ) P o id s des ruches (G a ra n
g o )
N o m b re d 'e s p è c e s e n fle u rs (N a zin g a ) N
o m b re d 'e s p è c e s e n fle u rs (G a ra n g o )
Fevrier
Mars
Avril
Mai
Juin
Juillet
AoOt
Septembre
Octobre
Novembre
N o m b re
d 'e s p è c e s
m e
llifè re s e n
fle u rs
Decembre
M o is
4 5
4 0
5 0
3 5
3 0
2 5
2 0
5
0
1 5
1 0
Figure 17 : Disponibilité florale et
évolution du poids des ruches
Les droites de régression de la variation mensuelle du
poids des ruches en fonction du nombre d'espèces mellifères en
fleurs par mois se présentent sous la forme d'une équation de
droite y = 0,3056 x + 21,818 pour la zone de Nazinga et
y = 0,1049 x + 23,02 pour la zone de Garango.
La représentation graphique de ces deux
équations nous donne des courbes croissantes avec des pentes faibles,
une répartition des nuages de point autour des droites de
régressions non uniformes (Fig. 18). Le coefficient de
détermination R2 indique que seulement 23,88% de la variation mensuelle
du poids des ruches sont expliquées par le nombre d'espèces
mellifères en fleurs par mois dans la zone de
Garango alors qu'il est de 39,01% pour la zone de Nazinga.
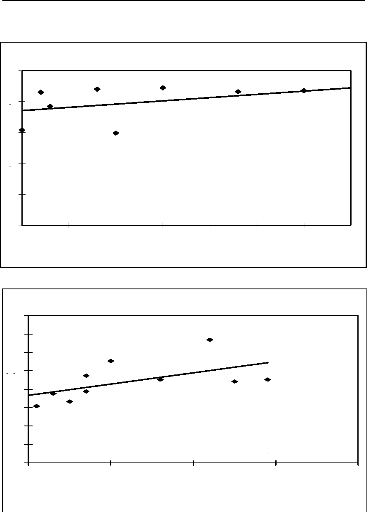
30
25
20
15
P o id s des ru ch es
5 10 15 20 25 30 35 40
N o m b re d 'esp èces en fleu rs
y = 0,1049x + 23,02
R 2 = 23,88%
P o i d s des
r u c h e s
4 5
y = 0 ,3 0 5 6 x + 2 1 ,8 1 8
R = 3 9 , 0 1 %
2
4 0
3 5
3 0
2 5
2 0
1 5
n o m b r e d ' e s p è c e s e n f l e u r
s
1 0
5 1 5 2 5 3 5 4 5
N A Z I N G A
Figure 18 : Droites de régression de la
variation du poids des ruches en
fonction du nombre d'espèces
mellifères en fleurs
4.2. Abondance et IVI des espèces
mellifères
Les droites de régression de la variation mensuelle du
poids des ruches en fonction de l'IVI (Fig. 19) ou de l'abondance (Fig. 20)
présentent des pentes variables.
Dans la zone de Garango, 78,65% de la variation du poids en
saison des pluies sont dues à la floraison des espèces ligneuses
(Fig. 19, G. c). Cela peut s'expliquer par les activités anthropiques de
l'Homme qui transforme la végétation en champs de cultures
surtout de Graminées (Pennisetum glaucum, Sorghum
bicolor, Zea mays) qui sont pollinifères et surtout
anémogames (Valdeyron, 1984 et Fohouo et al., 2002). La
variation du poids est plus due à la floraison des quelques
espèces ligneuses (39,37%) et dont certaines sont abondantes (Annexe 6)
comme le confirme la droite G. c' avec un R2 = 51,02%. Pendant la
miellée principale, la variation du poids des ruches est due plus
à l'abondance des individus des espèces mellifères
qu'à leur IVI. En effet, 74,32% de la variation du poids son t
expliquées par l'abondance de ces espèces (Fig. 20, G. b') contre
35,11% par leur IVI (Fig. 19, G. b).
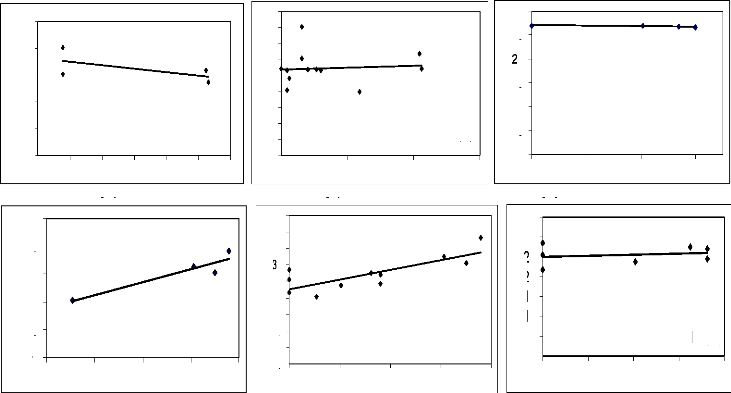
3
2
2
1
P_P 4 s Ng( Eli
45
40
35
10
0
5
0
5
5
0
0 50 100 150
y = 0,0114x + 26,954
R2 = 0,65%
IVI (%)
Poids (kg)
25
30
15
10
0
5
0
0 10 20 30
y = -0,0115x + 27,035
R2 = 78,56%
IVI (%)
G. b G. a G. c
Poids_(kg)
45
40
35
25
20
15
10
0
5
0
0 10 20 30 40
y = 0,2945x + 22,653
R2 = 64,21%
IVI (%)
2
2
1
1
Poids Ocsaj
35
30
5
0
5
0
5
0
0 5 10 15 20
y = 0,0507x + 25,084
R2 = 3,35%
IVI (%)
IVI (%)
y = -0,0637x + 36,251
R2 = 35,11%
0 2 0 40 60 80 100 120
50
40
30
20
Poids (ka)
10
0
0 20 30 40
Poids (kg)
40
50
30
20
10
0
IVI (%)
= 23x + 17,628
= 86,95%
N. b N. a N. c
Figure 19 : Droite de régression de la
variation du poids des ruches en fonction des IVI des principales
espèces mellifères G. : Garango ; N. : Nazinga ; a : toute
l'année ; b : miellée principale ; c : miellée
secondaire
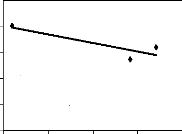
Abondance
y = -0,0133x + 42,868
R2 = 74,32%
200 450 700 950 1200
50
40
30
20
Poids (kg)
10
0
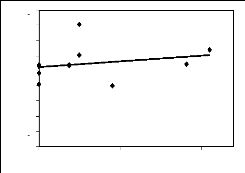
Poids (kg)
45
40
35
30
25
20
15
10
5
0
0 5 00 1000
y = 0,0036x + 26,279
R2
= 5, %
78
Abo danc
n e
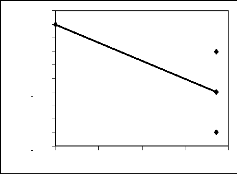
Poids (kg)
27,05
26
26
26
26
26
26,9
26,8
26,7
26,6
,95
,85
,75
,65
,55
27
0 50 1 00 150 200
y = -0,0013x + 27
R2 =
Ab dan on ce
51,02%
G. b' G. a' G. c'
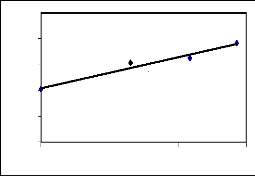
Poids (kg)
40
20
50
30
10
0
0 40
y 03 0,
= 7
bonda e
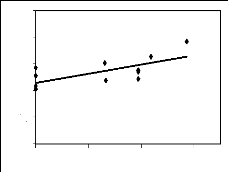
Poids (kg)
40
50
30
20
10
0
0 200 400 600
y = 0,0173x + 22,978
R2 = 50,46%
Abondance
2
2
3
3
1
1
1 200 3 400
,0053x + 3
R2 = 18,0
N. b' ' N. c'
N. a
Figure 20 : Droite de regression de la
variation du poids des ruches en fonction des IVI des princip e c
ales spè es mellifères G. : Garango ; N. : Nazinga
; a' : toute l'année ; b' : miellée princi ; m é c a
pale c' : iell e se ond ire
Résultats et discussion : Facteurs de variation du poids
des ruches
Dans la zone de Nazinga, les droites présentent des
pentes positives. Les coefficients de déterminations montrent que 64,21%
de la variation du poids des ruches sont dues à l'IVI des espèces
mellifères (Fig. 19, N. a) et 50,46% à leur abondance (Fig. 20, N
a'). Ces coefficients sont importants surtout pendant la miellée
principale (86,95% et 96,97%). Par contre en saison pluvieuse, où
seulement 11,84% des ligneux fleurissent et, dont deux sont abondantes
(Piliostigm a thonningii et Anogeissus leiocarpus), les
coefficients sont 3,35% et 18,04% respectivement pour l'IVI (Fig. 19, N. c) et
l'abondance (Fig. 20, N. c'). Ces faibles corrélations montrent
effectivement que la variation du poids des ruches est due à la
floraison des espèces ligneuses surtout représentées en
grand nombre.
4.3. Conclusion
La variation du poids des ruches présente des
corrélations divers es en fonction des différents facteurs. La
corrélation est faible en fonction du nombre d'espèces
mellifères en fleurs par mois. Elle est moyenne en fonction de l'IVI et
est plus marquée en fonction de l'abondance.
V. Etude des grains de pollen d'espèces
mellifères
L'analyse des pollens d'échantillons de miel des deux
zones permet de compléter les résultats des observations directes
de butinage. Cette analyse nécessite dans un premier temps une bonne
collection de lames de référence et aussi une description des
grains de pollen des espèces mellifères.
5.1. Lames de référence
L'acétolyse des grains de pollen des espèces en
fleurs prélevées autour des différents ruchers dans l'aire
de butin e des abeilles a permis de con
ag stitu er 46 lames de
référence des grains de po d'espèces
mellifères reparties 4
llen en 2 genres et 24
familles (Annexe 3). Ces lames sont déposées au
Laboratoire de Biologie et Ecologie Végétales de l'Unité
de Formation et de Recherche en Sciences de la Vie et de la Terre (UFR/SVT) de
l'Université de Ouagadougou.
écrits (Annexe 4 et
5.2. Description des grains de pollen
Vingt un (21) grains de pollen d'espèces mellifères
ont été d 5). Cette description montre :
t :
- Deux types de grains de pollen en fonction de leur
association. Ce n
so
* les monades constituées d'un seul grain de pollen. Ils
sont dominants au niveau des pollens décrits (19 espèces) ;
* les polyades constituées de plusieurs grains de pollen
qui se rencontrent essentiellement chez les Mimosaceae.
- Une variation de leur dimen . Les dimensions vont des
très petits pollens (D < 20
sion
um) qui comprend les pollens de Terminalia avicennioides,
Lonchocarpus laxiflorus,
Feretia apodanthera, Mitragyna inermis, Eucalyptus
camaldulensis, Psidium guajava, Anogeissus leiocarpus aux larges
pollens (50<D<100 um) chez Parkia biglobosa.
- Que le nombre ou la forme des apertures est également
varié. En effet On distingue :
* des apertures de forme arrondie ou subcirculaire : on parle de
pore ou « porus » et le pollen est dit poré;
* des apertures de forme allongée ; on parle de sillon
ou « colpus » et le pollen est colpé lorsque l'endoaperture
est absent, ou colporé lorsque l'endoaperture est présente.
En fonction du nombre de pores ou de sillons on note :
** des pollens monoporés qui se rencontrent chez
Pennisetum glaucum ; ** des pollens triporé s chez
Piliostigma thonningii ;
** des pollens polyporés chez Acacia polyacantha
et Parkia biglobosa ;
** des pollens tétracolporés chez Vitellaria
paradoxa et Khaya senegalensis ; ** des pollens tricolpés
chez Vitex doniana et Stereopermum kunthianum ;
** des pollens tricolporés et hexalo bés chez
Anogeissus leiocarpus, Combretum paniculatum et
Terminalia avicennioides ;
*d es pollens tricolporés et Trilobés dans les
autres familles.
- Enfin elle montre que l'ornementation de la surface des grains
de pollen est :
* réticulée chez Stereospermum kunthianum,
Mitragyna inermis et Psidium guajava ;
* perforée chez Piliostigma thonningii, Lonchocarpus
laxiflorus, Vitellaria paradoxa et Vitex doniana ;
* striée chez Terminalia avicennioides, Lannea
microcarpa, Sclerocarya birrea ; * lisse chez Eucalyptus camaldulensis
;
* striato-perforée chez Feretia apodanthera ;
* scabrée chez Pennisetum glaucum.
Nous pouvons constater donc que les pollens des espèces
visitées sont variés tant par leurs dimensions, leur
ornementation, que par leur système apertural. Ces caractères ne
semblent donc pas influencer le mécanisme de butinage de Apis
mellifera adansonii Lat (Nombré et al. 2002 c). La valeur
nutritive du grain de pollen, notamment sa teneur en azote, joue le rôle
attractif car les abeilles ne récoltent du pollen que lorsque sa teneur
en azote es t supérieure à 35% (Louveaux, 1984). De plus, le
rôle attractif des abeilles semble êt re exercé aussi par la
présence du pollencoat dans l'exine (Lobreau-Callen, 1985). En effet des
substances lipoïdes contenues dans le pollen-coat renferment des corps
volatiles, odorants, avec un très fort pouvoir attractif pour les
abeilles (Dobson, 1983 ; Lobreau-Callen, 1994).
Les pollens de taille inférieure à 30 um avec 16
espèces semblent être les plus visités au détriment
des pollens de tailles supérieures à 30 um. Cela corrobore les
résultats de Andrew cité par Lobreau-Callen (1987) qui montrent
que les abeilles recherchent prioritairement les pollens de petite taille en
laissant de côté les gros pollens.
VI. Matériel et techniques apicoles
traditionnels dans les zones de Garango et de Nazinga
Le matériel et les techniques apicoles traditionnels
observés dans les zones de Garango et Nazinga présentent une
grande similarité avec ceux décrits par Damblon (1986) et
Schweitzer (2002) au Maroc, Castagné (1983) au Congo-Brazzaville, Romet
(2000) au Cameroun, Hertz (1994) en Gambie, Kepaletswe (1997) au Botswana,
Ratia (1991) au Rwanda et Van Der Woerd (1997) au Mali. Cependant nous avons
relevé quelques particularités au niveau du matériel
utilisé et des techniques apicoles elles-mêmes.
6.1. Matériel apicole traditionnel
6.1.1. Ruches
Les ruches traditionnelles utilisées ont des formes
variées. Les matériaux u tilisés pour leur confection sont
aussi divers. Il y a :
- les ruches coniques en paille tressée de
graminées (Andropogon pseudapricus, Cymbopogon schoenanthus
subsp. proximus, Ctenium newtonii, Sporobolus
pyramidalis). L'ouverture est fermée par un disque fabriqué
à partir d'un mélange d'argile et d'herbe (planche I. 2). Sur ce
disque sont aménagées des perforations q ui constituent les trous
d'entrée. Ces ruches se rencontrent surtout dans la zone de Garango.
- Les ruches cylindriques en écorces ou en troncs
évidés de gros arbres (Isob erlinia doka, Afzelia
africana, Daniellia oliveri). Les extrémités sont
fermées par des pierres plates (planche I. 1). Ces ruches se rencontre
nt surtout dans la zone de Nazinga.
Planche I
Ruches traditionnelles en espèces
végétales.
Fig. 1 : Tronc d'arbre évidé ; la
troisième ouverture médiane fermée ici par une pierre
plate.
Fig. 2 : Ruche conique en tiges de Ctenium
newtonii tressées.
(a) : Plateau d'argile avec des trous servant d'entrée
;
(b) : Deuxième ouverture qui laisse échapper les
abeilles lors des opérations de récolte.
Fig. 3 : Trou naturel d'un arbre
transformé en ruche.
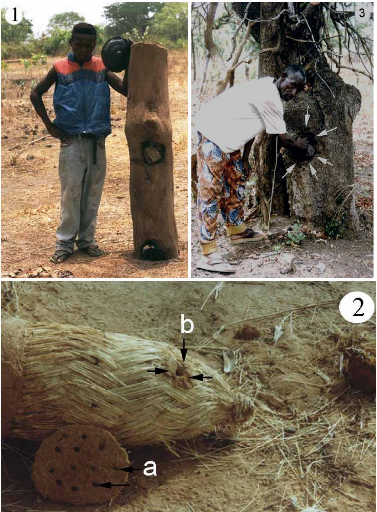
Planche I
- Les ruches en pots d'argile cuite (planche II.) de grand
volume (jarre) ou, de petit volume (canari). Les canaris peuvent être
installés seuls ou en double, renversés l'un sur l'autre.
Toutes ces ruches ont une ouverture à chaque
extrémité et parfois une troisième ouverture
médiane pour les ruches en troncs évidés ou en
écorces.
Outre ces ruches traditionnelles qui nécessitent un
travail de construction de la part des apiculteurs, certains apiculteurs
aménagent des trous naturels se trouvant dans des arbres (planche I. 3).
L'ouverture est réduite au maximum à l'aide d'un bouchon en
pierre.
Dans le cas d es ruches cylindriques à deux ouvertures,
la récolte se fait à partir des extrémités, ce qui
permet d'épargner le couvain généralement localisé
au centre de la ruche (Sawadogo, 1993).
Les ruches en paille, en tronc ou écorces d'arbres sont
vulnérables aux feux de brousse, à l'eau de pluies et aux actions
des termites. D'où la tendance des apiculteurs des deux zones à
utiliser d'avantage les ruches en pots d'argile.
6.2. Techniques utilisées en apiculture
traditionnelle
6.2.1. Préparation des ruches pour le
piégeage des essaims
6 .2.1.1. Techniques utilisées.
La préparation des ruches en vue de capturer les
essaims est exécutée avec le maximum de soins de manière
à attirer efficacement les essaims d'abeilles. Dans un premier temps,
l'intérieur des ruches est enduit d'un mélange d'eau, de bouse
fraîche de vache (pour les ruches en pot d'argile et en écorce) et
d'argile (pour les ruches en paille) ; l'ensemble est séché
pendant plusieurs jours.
Planche II
Ruches traditionnelles en argile cuite
Fig.1 : Canari
Fig. 2 : Deux canaris renversés l'un sur
l'autre ; on peut observer les pierres qui servent à obstruer les trous
d'entrée.
Fig. 3 : Jarre

Planche II
Résulats et et discussion
ésultats discussion : :
MatérielMatériel et e techniques
techniques apicoles apicoles traditonels
traditionnels
Ce crépissage permet de protéger les abeilles de
la lumière, des actions néfastes des variations de
température, des infiltrations des eaux de pluie. Il permet
également une meilleure rétention des essences lors de
l'enfumage.
Dans un second temps, la ruche est enfumée (planche
III. 1). Dans un trou creusé dans le sol, de diamètre égal
à celui de l'ouverture de la ruche, différents organes
végétaux (Tab. V) y sont déposés en association
avec de la bouse de vache. Le tout est al lumé et leur combustion
dégage un parfum qui attire les essaims d'abeilles.
6 .2.1.2. Produits végétaux
utilisés
Au total quinze (15) espèces végétales
appartenant à 10 familles botaniques sont utilisées seules ou en
association pour enfumer les ruches afin d'attirer les essaims d'abeilles (Tab.
V).
Tableau V : Plantes utilisées pour attirer les
essaims d'Apis mellifera
adansonii Lat. dans la zone de Garango ou de
Nazinga
|
Famille
|
Espèces
|
Organes utilisés
|
|
Caesalpiniaceae
|
Piliostigma reticulatum
|
- Fruits secs
|
|
Piliostigma thonningii
|
|
|
Combretaceae
|
Combretum glutinosum
|
- Tiges feuillées
|
|
Guiera senegalensis
|
|
|
Asteraceae
|
Dicoma tomentosa
|
- Tiges feuillées
|
|
Dioscoreaceae
|
Dioscorea dumetorum
|
- Tubercules
|
|
Ebenaceae
|
Diospyros mespiliformis
|
- Jeunes feuilles
|
|
|
- Fruits secs
|
|
Lamiaceae
|
Hyptis spicigera
|
- Tiges feuillées
|
|
Leucas martinicensis
|
|
|
Ocimum americanum
|
|
|
Mimosaceae
|
Acacia seyal
|
- Fruits secs
|
|
Parkia biglobosa
|
- Décocté des graines bouillies
|
|
Poaceae
|
Cymbopogon schoenanthus subsp.
|
- Inflorescences sèches
|
|
Proximus
|
|
|
Polygalaceae
|
Securidaca longepedunculata
|
- Racines
|
|
Sapotaceae
|
Vitellaria paradoxa
|
- Ecorces
|
Les plantes utilisées pour enfumer les ruches sont
généralement aromatiques à l'instar de Hyptis
spicigera, Leucas martinicensis, Ocimum americanum de la
famille des Lamiaceae ou de Cymbopogon schoenanthus (Poaceae)
dont les extrémités fleuries sont très parfumées
(Millogo/Rasolodimby et al., 1998). Les Caesalpiniaceae ont
été citées par Arbonnier (2000) comme intervenant dans
l'enfumage des ruches. Quant à Dicoma tomentosa de la famille
des Asteraceae, son nom vernaculaire en langue Bissa est « Zorka
» ou dard d'abeille. Cela présente une homonymie avec le nom de
l'abeille (« Zor »). Enfin l'eau des graines bouillies de Parkia
biglobosa est utilisée à cause de son parfum. Securidaca
longepedunculata est reconnue comme répulsif de serpents
(Arbonnier, 2000) et pourrait être utilisée ici pour
protéger les ruches contre ces reptiles.
6.2.2. Récolte du miel
La récolte se déroule toujours la nuit et
essentiellement pendant la saison sèche. Elle peut s'effectuer deux
à trois fois par an. Une importante phase de préparation
précède récolte proprem
l'opération de ent dite. Au cours de cette phase,
certains apiculteurs se frottent le corps avec les feuilles
d'Annona senegalensis, de Solanum aethiopicum ou de
Nicotiana tabacum ; tandis que d'autres s'enduisent simplement le bras
de miel.
Les ruches sont enfumées avec des torches de paille
allumées afin d'éloigner les abeilles (Planche III. 2). Pour les
ruches à une ouverture (canaris, ruches coniques) la récolte se
fait par le trou d'entrée, mais les abeilles peuvent toujours
s'échapper du côté opposé par un ou plusieurs trous
prévus à cet effet (Planche I. 2).
Planche III
Techniques apicoles traditionnelles
Fig. 1 : Ruche en tiges de Cymbopogon
schoenanthus en train d'être enfum ée ; on peut noter ici les
organes des espèces végétales utilisés pour e
nfumer les ruches.
Fig. 2 : Echelle et torch e de paille
utilisées par les apiculteu rs traditionnels pour grim per dans les
hauts arbres et pour enfumer les ruches lors des récoltes.
Fig. 3 : Technique destructive et
meurtrière : ici un gros arbre abattu pour récolter du miel.

Planche III
L'apiculteur propriétaire de ruches traditionnelles a
en général une bonne connaissance des périodes de
récolte du miel. L'une intervient en saison sèche pendant la
pleine floraison de Parkia biglobosa et l'autre pendant
l'épiaison du Pennisetum glaucum. Ensuite, peu d'abeilles ou de
couvain sont tuées ou détruits lors des opérations de
récolte chez les api culteurs de Nazinga et de Garango (Nombré
et al., 2002 b) contrairement à la plupart des
apiculteurs traditionnels d'ailleurs qui tuent les abeilles lors des
récoltes (Zahan, 1968 ; FAO,1986 ; Kokoye, 1993). Dans ces zones, les
apiculteurs utilisent uniquement la fumée de leur torche de paille
éteinte sur la quelle ils soufflent pour enfumer les ruches.
Le miel utilisé pour recouvrir les bras de l'apiculteur
limite considérableme nt la mobilité des abeilles. Les organes
des plantes que ces apiculteurs utilisent pour se frotter le corps avant
d'aller récolter du miel sont des anti-inflammatoires. En effet, ces
plantes possèden t des propriétés anti-inflammatoires,
anti histaminiques et piégeurs de radicaux libres (Nacoulma/O uedraogo,
1996 et Nacoulma/Ouedraogo et al., 1998). Cette pratique a
été signalée aussi par Hertz (1994) chez les apiculteurs
de la Gambie. Elle vise à donner aux apiculteurs du courage, à
leur apporter de la chance,
|
mais aussi à lutter contre l'agressivité
|
des abeilles et surtout réduire l'effet
|
in flammatoire de leurs piqûres (Villières, 1987
b). Toutes ces pratiques permettent dans l'ensemble de préserver les
populations d'abeilles (Ratia, 1991). La destruction des colonies voire des
ruches ou des arbres (planche III. 3) est le fait de cueilleurs ou chasseurs de
miel et autres cambrioleurs qui n'hésitent pas à brûler les
ruches avec toute la colonie, à briser la ruche et pire à
utiliser des insecticides.
6.2.3. Extraction du miel
Les brèches gorgées de miel sont
transportées à la maison. Un tri permet de
séparer les rayons de pollen, de couvain et de miel. Ce
tri permet d'éviter la prolifération des larves de la fausse
teigne (Galleria mellonella ou Achroia grisella). Les
professionnels trient uniquement les gâteaux de miel operculés
qu'ils conservent dans des pots fermés hermétiquement avec de
l'argile. Ce miel est utilisé à l'occasion de certaines
cérémonies ou rituels et pour le traitement de certaines
maladies. Les amateurs fondent les gâteaux de miel dans des
récipients secs. Ces récipients sont déposés
directement sur du feu ou au soleil. Certains utilisent le bain-marie ou
déposent le récipient contenant les gâteaux de miel sur un
autre contenant des braises ardentes. Enfin d'autres pressent directement les
rayons de miel à la main. Ce miel est ensuite filtré et
conservé dans des bouteilles.
Mais malgré les soins des apiculteurs, la
qualité du miel reste altérée par les récipients
utilisés lors de la récolte et de l'extraction, la cendre des
torches de pailles et les débris de cire, de larves et d'abeilles mortes
(Nombré et al., 2002 b). De plus, l'extraction par la technique
de la fonte détruit les propriétés organoleptiques et les
propriétés médicinales du miel (Carrol, 1997). Le miel
pressé ou fondu donne une mixture de miel, de pollen, de gelée
royale, de couvain et de cire (Nombré et al., 2002 a). Ce miel,
même après écumage des débris ne peut pas avoir une
bonne qualité (Damblon, 1986 et Schweitzer 2002) et surtout, fermente
facilement à cause de l'excès d'eau ou de sa contamination par
des levures lors du pressage. Par contre les gâteaux operculés
triés et déposés dans des canaris peuvent se conserver
pendant longtemps.
6.3. Utilisation des produits de la ruche
Dans les zones de Garango et Nazinga, le miel est le produit le
plus connu et le plus
utilisé. La propolis, le pollen et souvent le couvain
le sont accessoirement. Les autres produits (venin, gelée royale, cire)
dont la récolte et le conditionnement nécessitent une technologie
plus élaborée sont très peu utilisés.
Le miel récolté est destiné avant tout
à l'autoconsommation, aux présents ou à la vente. Il est
gardé comme un bien précieux aux vertus multiples et de haute
valeur alimentaire, prophylactique et thérapeutique. Il est
utilisé comme médicament, soit à l'état pur, soit
mélangé à d'autres remèdes, et son usage est aussi
bien externe qu'interne (Tab. VI).
Tablea u VI : Utilisations des produits de l'abeille
dans la thérapeutique locale
|
Indications
|
Produits
|
Traitement
|
|
Morsure de serpen
|
|
Bien malaxer la propolis pour la rendre molle
|
Propolis et en faire une boule. Tâter avec la boule le
point de morsure pour retirer les crochets du serpent
restés dans la peau.
Constipation Pollen Prendre du pollen en rayon,
ajouter de l'eau
chaude, filtrer et boire à volonté trois fois pa
r
|
Début de furoncle
|
Miel liquide
|
Masser la zone douloureuse
|
|
Démangeaisons
|
Miel liquide
|
Appliquer en cataplasme trois fois par jour jusqu'à
guérison.
|
jour pendant trois jours.
Fracture de Miel liquide
membres
Maux de ventre Miel liquide
Poudre de racines de Cassia sieberiana
Hernie Miel liquide
Poudre de racines de Nauclea latifolia, de Strychnos
innocua et d e Hymenocardia acida Eau
Rougeole Miel liquide
Peau d'éléphant
Eau
Les membres immobilisés après fracture perdent
leur mobilité. Un massage de ce membre matin et soir permet de
rétablir rapidement sa flexibilité.
Mélanger les deux et prendre une cuillerée
à café trois fois par jour pendant trois jours pour les hommes et
pendant quatre jours pour le s femmes.
En période de crise, prendre une pincée de la
poudre, ajouter le miel et l'eau ; boire trois fois par jour pendant trois
jours.
Laisser la peau d'éléph ant macérer dans
l'eau pendant une demi-heure, ajouter le miel et boir puis se laver la face
trois fois par jour pendant trois jours
|
Manger à volonté le miel en gâteau, ou
boire à volonté trois fois par jour pendant trois jou rs pour un
bébé garçon et pendant quatre jours pour un
bébé fille l'eau farineuse mélangée au miel. Manger
à volonté directement le rayon de couvain. Broyer puis filtrer le
couvain. Ajouter de la farine et boire à volonté ou en faire un e
bouillie et le prendre trois fois par jour pendant trois jours.
Réduire les racines et écorces en poudre fin e.
Prendre une cuillerée à soupe dans un demilitre d'eau, ajouter le
miel et boire à volonté trois fois par jour pendant trois
jours.
|
Miel en gâteau ou extrait
Farine de Pennisetum glaucum
Eau
Rayon de couvain Farine de pennisetum glaucum
Eau
Miel liquide Racine de Cassia sieberiana, de
Securidaca
longepedunculata, de Achyranthes argentea, de
Leptadenia hastata. Racines et écorces de Entada
africana
Eau
Maux de ventre après
accouchement
Montée du lait dans les seins
(galactogène)
Vers intestinaux
Dans les zones de l'étude, le miel est utilisé
aussi bien dans l'alimentation que dans le traitement de certains maux. En
effet, il possède des propriétés antibactériennes
dues à sa haute teneur en sucre et à la présence
d'inhibines et des propriétés antimicrobiennes à cause de
sa forte concentration en sucre et une pression osmotique élevée
(Hakim, 1989 ; Cortopassi-Laurino et Gelli, 1991 ; Donadieu, 1993 ; Bogdanov
et al, 1995 ; Fleché et al. 1997). Les
différentes indications thérapeutiques recensées au
tableau VI viennent complèter celles recensées par Guinko et
al. (1989 a) dans la zone Quest et par Nacoulma et Rasolodimby-Millogo
(1995) dans le plateau central.
6.4. Conclusion sur les techniques apicoles traditio
nnelles
L'activité apicole traditionnelle est en régression
dans les deux zones de l'étude à cause des perturbations
climatiques et de la pression démographique. En
effet, les changements climatiques se traduisent par une
dégradation des formations végétales, ce qui affecte
négativement la disponibilité en qualité et en
quantité des nutriments fournis aux abeilles. L'évolution
démographique, quant à elle, s'acco mpagne de mauvaises pratiques
agricoles qui entraînent la destruction des formations
végétales. Cette régression est aussi liée à
certaines mauvaises pratiques que sont le vol, la coupe des gros arbres dont
les troncs constituent souvent des abris pour les essaims d'abeilles, la
destruction des ruches, la destruction des colon ies par le feu ou par les
insecticides dont le plus rencontré est le Dichloro-Diphényl
Trichloroéthane (D.D.T.).
VII. Productivité de différents types de
ruches
Depuis l'exécution dans la zone Quest du projet
FAQ/PNUD/Gouvernement du Burkina Faso de « développement et de
vulgarisation de l'apiculture améliorée en milieu paysan »,
la pratique de l'apicultu re moderne s'est répandue sur tout le
territoire avec l'utilisation de plusieurs types de ruches dont les plus
connues sont la ruche kenyane, la ruche Dadant et la ruche rectangulaire
à cadres (Fig.10).
Il est vrai que la productivité d'une ruche est
fonction de la force de la colonie d'abeilles et de la flore mellifère
qui l'environne. Mais lorsque ces conditions sont réunies (des colonies
fortes installées dans un même rucher), la production
dépend d'autres facteurs que sont le type de ruche utilisée et
les facilités de manipulation de ces ruches. La comparaison de la
production de trois types de ruches (kenyane, rectangulaire à cadres,
Dadant) montre une faible production de miel du Dadant (3,900 kg) alors que
celle des deux autres est moyenne (respectivement 8,000 kg et 8,800 kg) (Tab.
VII). Les difficultés d'utilisation sont importantes au niveau du Dadant
(Tab. VII).
La technique d'extraction qui permet d'apprécier le
rendement de chaque technique donne un taux d'extraction de 62% pour la
technique d'égouttage, tandis que la centrifugation donne une valeur
(66%) (Tab. VII).
Tableau VII : Quantité de miel obtenu et les
difficultés d'utilisation par type de Ruches et le taux d'extraction
|
Type de ruche
|
Moyenne de production (kg)
|
Difficultés de
manipulation
|
Taux d'extraction
|
|
Egouttage
|
Centrifugation
|
|
Dadant
|
3,9
|
+++
|
62%
|
66%
|
|
Rectangulaire
|
8
|
++
|
|
Kenyane
|
8,8
|
+
|
a) La faible quantité de miel de la ruche Dadant (Tab.
VII) s'explique par l'absence de stock de miel dans les hausses au moment de la
récolte. Or le stock de miel dans le corps de ruche est destiné
à l'alimentation de la colonie et ne doit pas être
récolté. Avec un volume intérieur total équivalent
à celui de la ruche rectangulaire à cadres (Tab. II) qui,
pourtant, a une production en miel supérieure, on peut penser que la
ruche Dadant et, en général, les ruches à hausses, ne
semblent pas être adaptées à l'apiculture locale. De plus,
leur utilisation est difficile et demande une technologie appropriée
(chasse abeille, soufflet etc). Cette difficulté d'utilisation pourrait
avoir une influence sur la qualité de récolte et par
conséquent sur la production de miel. Lorsque le couvercle est
enlevé, tous les «bee-space» (77 mm d'espace au total) se
retrouvent libres et des abeilles y sortent massivement pour se ruer sur
l'apiculteur.
b) La ruche rectangulaire à cadres, à extension
horizontale, fournit une moyenne de production comparable à celle
trouvée par Villières (1987 b) au Bénin. De plus les
rayons de miel soutenus aux quatre côtés sont solides et
l'extraction du miel peut se faire par centrifugation. Ce qui permet d'avoir un
miel de bonne qualité et des cadres avec des rayons vides, intacts qui
peuvent être retournés à la ruche. Cette ruche peut donc
être recommandée pour un programme de production de miel à
large échelle. Mais elle présente tout de même quelques
difficultés lors de sa manipulation. Les cadres avec leurs angles
supérieurs prolongés par des pointes (Fig. 10, b) sont
très fragiles et une fois recouvertes de propolis, les pointes peuvent
s'arracher pendant la manipulation entraînant la
détérioration des cadres. De plus, les longueurs de ces pointes
devant réaliser les «bee-space» au niveau des parois des
ruches sont difficiles à respecter surtout par les fabricants locaux de
ruches.
Cela conduit les abeilles à construire leurs rayons de
travers, rendant difficile la récolte. Enfin lorsqu'une planc hette (13
cm), est enlevée, elle libère 4 cadres et 5 «bee-space»
par lesquels s'échappent des abeilles pour se ruer sur l'apiculteur.
c) La ruche kenyane est facile à manipuler car ses
barrettes sont jointives et lorsqu'une barrette est enlevée, l'espace
correspondant (3 cm) est facile à contrôler. Elle semble donc
pratique pour les abeilles tropicales trop agressives (Villières, 1987
a; Adjaré, 1990; Hertz, 1994). La seule difficulté est que
l'extraction du miel se fait par égouttage, ce qui entraîne
surtout la perte d'une quantité non négligeable de miel
resté dans les brèches et du temps (au moins 24 heures). Le
pourcentage de miel obtenu par centrifugation (66 %) est supérieur
à celui obtenu par égouttage (62%) . L'idéal serait donc
de transformer les barrettes de la ruche kenyane en cadres
trapézoïdaux adaptés à l'extraction par
centrifugation. Ces « ruches kenyanes améliorées » avec
des cadres trapézoïdaux sont en cours d'expérimentation dans
les ruchers du Laboratoire de Biologie et Ecologie Végétales de
l'Unité de Formation et de Recherches en Sciences de la Vie et de la
Terre (UFR/SVT) de l'Université de Ouagadougou.
En somme, les principales ruches utilisées
présentent un volume intérieur sensiblement identique. Elles
présentent des difficultés d'utilisations variables. La technique
d'extraction par centrifugation donne un bon rendement et un miel de
qualité. Elle permet une économie de temps aussi bien pour
l'apiculteur que pour les abeilles.
CONCLUSION GENERALE
ET PERSPECTIVES
Conclusion générale et perspectives
Au terme de cette étude sur les potentialités
mellifères de deux zones du Burkina Faso, nous pouvons retenir les
principales conclusions ci-après :
- les abeilles réalisent une sélection des
espèces végétales à butiner. Dans la zone de
Garango et de Nazinga, 96 et 97 espèces végétales sont
respectivement visitées. La présence d'espèces
mellifères dans un milieu donné est un critère essentiel
dans l'appréciation de son potentiel mellifère.
- Le suivi de la période de floraison a permis de
dresser un calendrier de floraison des espèces mellifères dans
chaque zone et donc de disponibilité de nutriments. Le nombre
d'espèces mellifères en fleurs par mois n'a pas d'influence
notable sur la variation du poids des ruches.
- La variation mensuelle du poids des ruches montre deux
périodes de miellées qui alternent avec des périodes de
disettes plus ou moins longues. Les miellées de la zone de Nazinga
précèdent d'un mois celles de la zone de Garango. Elles
comprennent :
* une miellée principale en saison sèche due
à la floraison des espèces ligneuses hautement mellifères
;
* une miellée secondaire en saison des pluies due à
la floraison de quelques ligneux et surtout de celle des herbacées
annuelles.
- L'évaluation quantitative de la végétation
ligneuse montre que la végétation
autour des ruchers forme des groupements plus ou moins
homogène. Certaines espèces telles que Vitellaria
paradoxa, Lannea microcarpa, Sclerocarya birrea,
Piliostigma thonningii peuvent constituer des espèces
d'appellation d'origine botanique des miels. Elle montre surtout que
l'abondance des espèces mellifères est un facteur important dans
l'appréciation du potentiel mellifère.
- Un outil indispensable pour les analyses polliniques des
produits de la ruche a été constitué par la constitution
de 46 lames de référence d'espèces mellifères et la
description de 21 grains de pollens.
- L'enquête « ethnoapicole » a permis de noter
une similarité des techniques apicoles dans les deux zones et dans
d'autres pays africains. Les apiculteurs propriétaires des ruches ont
une attention particulière dans la préparation des ruches avant
leur installation et au cours des opérations de récolte. Les
méthodes destructives sont surtout l'oeuvre de cambrioleurs. Le miel
récolté est utilisé aussi bien dans l'alimentation, le
commerce que dans le traitement de certaines maladies.
- L'étude de la productivité des trois types de
ruches montre que la kenyane présente deux atouts (productive et facile
à manipuler). Pour résoudre les difficultés d'extraction,
nous proposons la transformation des barrettes en cadre
trapézoîdal. Cette ruche appelée « kenyane
améliorée est actuellement en pleine vulgarisation.
En perspectives il faudra :
- Etendre cette étude aux différentes zones
agroécologiques du Burkina Faso en vue de parvenir à dresser
d'une part une liste de la flore mellifère nationale tel que
recommandé par Guinko et al. (1989 b) et d'autre part fournir
des données fiables aux partenaires intervenant dans le domaine du
développement apicole.
- Augmenter le nombre des lames de référence des
grains de pollen et enrichir l'atlas de pollen en acétolysant des
pollens d'autres espèces mellifères de manière à
couvrir un grand nombre d'espèces mellifères. Cela facilitera le
travail de détermination des origines botanique et géographique
des miels, de contrôle des appellations d'origine et de la
sériation des miels.
- Faire des analyses polliniques des produits de la ruche pour
affiner et compléter les résultats des observations directes de
butinage et, établir un spectre pollinique pour chaque zone.
- Réaliser des analyses physico-chimiques des miels afin
d'établir des normes nationales de qualités.
- Promouvoir l'apithérapie.
REFERENCES BIBLIOGRAPHIQUES
|
Références bibliographiques
Adam J. G., 1958. Flore et
végétation de la réserve botanique de Noflaye (environs de
Dakar, Sénégal). Bull. Inst. Fr. Afr. Noire, Série A, Sc.
Nat., 20, 3, 802-868. Adjaré S., 1990. Beekeeping in
Africa. FAO Agric. services bulletin, 68/6, 130 P. Anchling
F., 2000 a. Le Grand départ. L'Abeille de France et
l'Apiculteur, 859, 246-250.
Anchling F ., 2000 b. Morphologie des abeilles.
L'Abeille de France et l'apiculteur, 865, 517-518.
Anchling F., 2000 c. Quel type de ruches choisir
? L'Abeille de France et l'apiculture, 855, 15-16.
Anchling F., 2001. La vie dans la ruche.
L'Abeille de France et l'Apiculteur, 867, 65-70.
Anchling F., 2002. Le partage. L'Abeille de
France et l'Apiculteur, 881, 233-237. Arbonnier M., 2000.
Arbres, arbustes et lianes des zones sèches d'Afrique de l'Ouest.
CIRAD-MNHN-UICN, 541 P.
Arnold G ., 2000. Les systèmes de
communication chez l'abeille. L'Abeille de France et l'Apiculteur, 862,
397-399.
Azzouz H.,
Déchaume-Moncharmont F.-X., 2000. Les
modalités de la communication sociale chez l'abeille domestique Apis
mellifera L. Bull. Tech. Apic., 17, 1, 9-19.
Bakyono E., 1988. Contribution à
l'éco-éthologie des indicateurs de la savane herbeuse de Nazinga.
Mémoire ingénieur, Univ. de Bourgogne, France, 146 P.
Berhaut J.,1967. Flore du Sénégal. Clairafrique,
Dakar, 486 P.
Bogdanov S., Bieri K.,
Figar M., Figueredo V., Iff
D., Känzig A., Stöckli H.,
Zürcher K., 1995. Miel : définition et directives
pour l'analyse et l'appréciation. In : Livre Suisse
des denrées alimentaires, OCFIM, PP. 1-26.
Braun-Blanquet 1932. Plant sociology. Macgran,
Hill, New York and London, 330 P. Briane G., 1991.
Cartographie des ressources mellifères dans les Pyrénées
Centrales. Bull. Tech. Apic. 18, 76, 163-170.
Bruneau E., 1993. Contrôle du
phénomène d'essaimage. Abeille et Fleurs, 421,
5-7. BU.NA.SOL, 1989.
Etude morpho-pédologique de la province du Boulgou au
1 /100 000. Rapport tech., 66, 66 P.
Caroll Msc T., 1997. Beekeeping, a biginner's
guide. Association for Better Land Husbandry, 37 P.
Cartel B., 2001. Essaimera, n'essaimera pas ?
L'Abeille de France et l'apiculteur, 870, 226-230
Castagné J. B., 1983.
L'apiculture au Congo-Brazzaville. Bull. Tech. Apic. 10, 4, 197-208.
Chauvin R., 1968 a. Action physiologique et
thérapeutique des produits de la ruche : les pollens. In :Traité
de biologie de l'abeille, tome III, Ed. Masson & Cie PP. 126- 136.
Chauvin R., 1968 b. La mue, la cuticule et les
formations cuticulaires chez l'abeille. In :Traité de biologie de
l'abeille, tome I, Ed Masson & Cie, PP. 100-128. Cortopassi-Laurino
M., Gelli DS, 1991. Analyse pollinique, propriétés
physico- chimiques et action antibactérienne des miels d'abeilles
africanisées Apis mellifera et de Méliponinés du
Brésil. Apidologie, 22, 61-67.
Crane E.,1980. A book of honey. Oxford
University Press ; 175 P.
Crane E., 1990. Bees and Beekeeping, science
pratice and word ressources. Heinemann Newnes, 614 P.
Curtis J. J., Macintosh
R. P., 1951. An upland forest continium in the
prairie-forest border region of Wisconsin. Ecology, 32, 476-496.
Damblon F., 1986. Miels de Thym du Maroc. I :
Conditions générales de la production et de la conservation des
miels traditionnels et industriels dans le haut Atlas Occidental. Al Biruniya,
Rév. mar. Pharm., tome II, 1, 7-16.
Damblon F., 1987. Miels de Thym du Maroc. II :
Etude palynologique des sources mellifères. Al Biruniya, Rev. mar.
Pharm., tome III, 1, 51- 73.
Damblon F., 1988. Caractérisation
botanique, écologique et géographique des miels du Maroc. Inst.
Fr. Pondichéry, trav. Sec. sci. Tech., tome. XXV, 309-329. Actes du Xe
Symp. APLF, Bordeaux, 28 sept.-2 oct. 1987.
Darchen R.-J., 1993. La
supersédure chez Apis mellifera scutellata. Abeilles et Fleurs,
419, 2-4.
De Layens G., Bonnier G., 1997.
Cours complet d'apiculture et conduite d'un rucher isolé. Editions
Belin, 458 P.
Debbagh S., 1988. Relation entre spectres
polliniques de quelques miels et
groupements phytogéographiques du
Sud marocain. Inst. fr.Pondichéry, trav. sec.
sci. tech., tome. XXV,
331-343. Actes X symp. APLF, Bordeaux, 28 sept.-2 oct.
e
1987.
Dobson H. E. M. , 1983. Lipides polliniques
des fleurs visitées par les abeilles. 5e symp. Internat. sur la
pollinisation ; Internat. Commission for Bee Botany, INRA, Versailles,
résumés, 8-9.
Donadieu Y., Marchiset C., 1984. La cire :
Thérapeutique naturelle. Maloine S. A. Éditeur, 131 P.
Donadieu Y., 1993. Les pages
d'apithérapie : un médicament-aliment majeur : la gelée
royale. Abeilles et Fleurs, n° 421, 12-13.
Dunbar A., 1969. Palynology and electron
microscopy. In : Handbook of palynology. Scandinavian University Books, PP.
401-415.
Erdtman G., 1969. Pollen and spores preparations
: the acetolysis method. In : Handbook of palynology, Scandinavian University
Books, PP. 213-216.
Faegri K., Iversen J., Waterbolk H. T., 1964.
Texbook of pollen analysis. Munksgaard, 236 P.
FAO, 1986. Tropical and subtropical apiculture.
FAO Agric. services bulletin, 68, 283 P.
Fléché C., Clément
M.-C., Zeggane S., Faucon
J.-P., 1997. Contamination des produits de la ruche
et risques pour la santé humaine : situation en France. Rev. Sci. tech.
Off. int. Epiz., 16, 2, 609-619.
Fluri P., Pickhardt A.,
Cottier V., Charrière
J.-D., 2001 a. La pollinisation des plantes à
fleurs par les abeilles - Biologie, Ecologie, Economie 1ère
partie. L'Abeille de France et l'Apiculteur, 871, 287-296.
Fluri P., Pickhardt A.,
Cottier V., Charrière
J.-D., 2001 b. La pollinisation des plantes à
fleurs par les abeilles - Biologie, Ecologie, Economie 2e partie.
L'Abeille de France et l'Apiculteur, 872, 335-340.
Fohou F.-N.
T., Messi J., Pauly A.,
2002. L'activité de butinage des Apoïdés sauvages
(Hymenoptera Apoidae) sur les fleurs de maïs à
Yaoundé (Cameroun) et réflexions sur la pollinisation des
Graminées tropicales. Biotechnol. Agr.. S oc. Environ., 6, 2, 87-98.
Fournier A., 1991. Phénologie,
Croissance et production végétales dans quelques savanes
d'Afrique de l'Ouest. Variation selon un gradient climatique. Ed ORSTOM
(IRD), 312 P.
Gadbin C., 1979. L'intérêt de
l'acétolyse en mélissopalynologie. Apidologie, 10, 1, 23-28.
Gadbin C., 1980. Les plantes utilisées
par les abeilles au Tchad méridional. Apidologie, 10, 2, 217-254.
Guinko S. 1984. Végétation de la
Haute Volta (Burkina Faso) tome I. Thèse de Doct. d'Etat, Univ. Bordeaux
III, France, 318 P.
Guinko S., Guenda W.,
Millogo-Rasolodimby J., Tamini Z.,
Zoungrana I., 1987. Etude des plantes mellifères dans
l'Ouest du Burkina Faso (provinces du Houet, de la Comoé et du
Kénédougou). Rapport d'études, projet TCP/BKF/4510
«développement de l'apiculture» 97 P.
Guinko S., Zoungrana I.,
Guenda W., Tamini Z.,
Millogo-Rasolodimby J., 1989 a. Apithérapie : quelques
usages médicaux du miel dans l'Ouest du Burkina Faso. Bull. Méd.
Trad., 3, 2, 111-115.
Guinko S., Guenda W.,
Millogo-Rasolodimby J., Tamini Z.,
Zoungrana I., 1989 b. Etude des plantes mellifères dans
trois provinces du Burkina Faso
(Houet, Comoé, Kenedougou). Rapport d'études,
projet BKF/87/016 «intensification de l'apiculture en paysannat ». 34
P. et planches.
Guinko S., Guenda W.,
Tamini Z., Zoungrana I., 1992. Les plantes
mellifères de la zone Ouest du Burkina Faso. Etudes, flor. vég.
Burkina Faso, 1, 27-46.
Guinko S., Fontès J.,
1995. Carte et notice de la végétation et de l'occupation du sol
au Burkina Faso. UMR-ICIV, 9964 du CNRS/Univ. Paul Sabatier, Toulouse,
IDR/FAST, Ouagadougou avec la collaboration de IRBET/CNRST et MET, Ouagadougou,
78 P.
Hakim H., 1989. Le miel
aliment-médicament. Angéiologue, 35 P.
Hetz O., 1994. Beekeeping handbook for Gambia.
Pollination by bees and beekeeping with top bar hives. Ronnes, 53 P.
Hien M., 2001. Etude des déplacements des
éléphants, lien avec leur alimentation et la disponibilité
alimentaire dans le Ranch de Gibier de Nazinga, province du Nahouri, Burkina
Faso. Thèse de Doct. Unique, Univ. Ouagadougou, Burkina Faso, 135 P.
Hutchinson J., Dalziel M.
D., 1963. Flora of West Tropical Africa. Se cond edition, vol.
II. Published by the crown agents for oversea governements and administrations,
Millbank, London. 544 P.
I.N.S.D., 1996. Recensement
général de la population et de l'habitat. MEF/Direction de la
dé mographie, Ouagadougou, 315 P.
Jean-Prost P., 1987. L'Apiculture. 6e
édition, Lavoisier, 579 P.
Jung-Hoffmann I., 1968. Développement des
larves. In : Traité de biologie de l'abeille, tome I, Ed. Masson &
Cie, PP. 69-99.
Kepaletswe K.,1997. Beekeeping in Botswana,
4e édition, 76 P.
Kéré U., 1998.
Végétation et utilisation des plantes spontanées dans la
zone de Tenkodogo (Burkina Faso). Etudes flor. vég. Burkina Faso, 4,
3-55
Kokoye S. J., 1993.
L'apiculture dans le développement de l'Atacora : importance
socio-économique et cadre de développement. In : West African bee
research seminar, Bakou, Gambia, 25-28 novembre 1991, PP. 48-53.
Latham P., 2000. Beekeeping in Bas Congo,
Democratic Republic of Congo With particular reference to some important bee
plants. Bees for Development, 84 P. Lavie P. 1968. Technique
d'apiculture. L'étude expérimentale de la conduite des ruches. In
: Traité de biologie de l'abeille, tome IV, Ed Masson & Cie, PP.
54-137. Leconte Y., 2002. L'abeille dans la classification des
insectes. Abeilles & Fleurs, 628, 15-16
Leoncini I., Brillet C.,
Leconte Y., 2002. La régulation sociale chez l'abeille.
Abeilles & Fleurs, 631, 28-29.
Lieux M. H., 1980. Acetolysis applied to
microscopical honey analysis. Grana 19, 57-61.
Lobreau-Callen D., 1985. Structure exinique du
pollen collecté par les Anthophores du Sénégal. Sci.
Géol. Bull., 38, 1, 99-106.
Lobreau-Callen D., 1987. Rapports
plantes-insectes analyse comparative de l'éthologie de quelques abeilles
solitaires et sociales vis à vis de la végétation de
climat soudanien. Palynologie et milieux tropicaux. IX Symp. APLF, Montpellier,
1987, 41-49.
Lobreau-Callen D.,1994.
Introduction au symposium de melissopalynologie. Grana 33, 181-183.
Lobreau-Callen D., Darchen
R., Le Thomas A., 1986. Apport de la palynologie
à la connaissance des relations abeilles/p lantes en savanes
arborées du Togo et du Bénin. Apidologie, 17, 4, 279-306.
Lobreau-Callen D., Damblon
F., 1994. Spectre pollinique des miels de l'ab eille Apis
mellifera L. (Hymenoptera, Apidae) et zones de
végétation en Afrique occidentale tropicale et
méditerranéenne. Grana, 33, 245-253.
Louveaux J., 1984. L'abeille domestique dans ses
relations avec les plantes cultivées. In : Pollinisation et production
végétales, INRA, PP. 527-555
Louveaux J., 1990 a. L'abeille dans le monde des
insectes. Bull. Tech. Apic. 17, 1, 59-66.
Louveaux J., 1990 b. Les relations
abeilles-pollens. Bull. soc. Bot. Fr., 137 Actuali. Bot., 2, 121-131.
Louveaux J., Maurizio A.,
Vorwohl G., 1978. Methods of melissopalynolgy. International
Commission for Bee Botany of U.I.S.B. Bee World 59, 4, 139-157. Lynch
S., Webster G. L., 1975. A new technique of preparing
pollen for scanning elecetron miscrocopy. Grana, 15, 127-135.
Marceau J., Boily R.
et Perron J. M., 1990. The relationship
between hive productivity and honeybee flight activity. Journal of Apicultural
Research 29, 1 28-34. Maurizio A., 1968. Evolution et
longévité des adultes. In : Traité de biologie de
l'abeille tome I, Ed. Masson & Cie, PP. 129-144.
Mc Tellaria, 1993. Floraison et récolte
du pollen par les abeilles domestiques (Apis mellifera L. var.
ligustica) dans la Pampa Argentine. Apidologie, 24, 109-120.
Millogo-Rasolodimby J., Nacoulma O.,
Samaté A. D., 1998. Les utilisations
des poaceae aromatiques au Burkina Faso. Rev. Med. Pharm. Afr., 11,
12, 157-164. Molès E., 2000. L'apiculture au
Bénin. L'Abeille de France et l'Apiculteur, n° 856, 129-129.
Nacoulma-Ouedraogo O., 1996. Plantes
médicinales et pratiques médicales traditionnelles au Burkina
Faso: Cas du plateau central, tome II. Thèse de Doct. d'Etat, Univ.
Ouagadougou, 285 P.
Nacoulma O., Millogo-Rasolodimby
J., 1995. Les produits de la ruche et leurs utilisations au Burkina
Faso. Rev. Méd. Pharm. Afr., 9, 2, 63-7 0. Nacoulma-Ouedraogo
O., Millogo-Rasolodimby J., Guinko
S., 1998. Les plantes herbacées dans la thérapie des
piqûres d'insectes. Rev. Med. Pharm. Afr., 11 , 12, 165-176.
Nilson S., Muller J., 1978.
Recommended palynological terms and definitio ns. Grana, 17, 55-58.
Nombré I., 1998. Contribution à
l'utilisation de la palynologie pour la détermination des espèces
pollinifères butinées par Apis mellifica adansonii
Latreille à Ouagadougou. Mémoire de Diplôme d'Etudes
Approfondies, Univ. Ouagadougou, Burkina Faso, 80 P.
Nombré I., Sawadogo
M., Guinko S., 2001. Etudes des plantes
mellifères et de l'évolution du poids des ruches dans la zone de
Garango (Province du Boulgou) centre-est du Burkina Faso. Bull. Tech. Apic.,
28, 4, 176-180.
Nombré I., Sawadogo
M., Guinko S., 2002 a. Les pratiques apicoles
traditionnelles dans la zone de Nazinga (Province du Nahouri,) Sud du Burkina
Faso. Abeilles et Fleurs (sous presse).
Nombré I., Sawadogo M.,
Boussim I J., Guinko S., 2002 b. Beekeeping
in Burkina Faso. Bees for Development Journal, 65, 9.
Nombré I., Millogo/Rasolodimby
J., Sawadogo M., Guinko S., 2002 c.
Relation entre la morphologie externe des grains de pollen et le transport par
les abeilles domestiques Apis mellifera adansonii Latreille dans la
zone de Nazinga, Burkina Faso. Etudes flor. vég. Burkina Faso, 7,
41-44.
O'Toole C., Raw A., 1991. Bees
and flowers. In : Bees of the World. Blandford book, PP. 128-142.
Ouédraogo I. T.
V. P., 1985. Contribution à
l'étude de la végétation ligneuse du Ranch pilote de
gibier de Nazinga. Mémoire d'ingénieur, Univ. Ouagadougou,
Burkina Faso, 143 P.
Pechha cker H., 1997. Economic importance of the
distance between nectar source and location of bees colonies. Apiacta, 12,
13-18
Philippe J. M., 19 88. Le guide
de l'apiculteur. Edisud, France, 347 P.
Philippe J. M.,1991. La
pollinisation par les abeilles. Edisud France, 182 P.
Pion S., De Olivera D.,
Belanger A., Ritchot C., 1983. Traitement
insecticides et activité de l'abeille domestique sur maïs-grain au
Québec. 5e Symposium International sur la pollinisation,
Versailles, 27-30 septembre 1983. Ed. INRA Publ., 201-208.
Ratia G., 1991. Ruchers dans la brume. Abeilles
et Fleurs, 404, 161-163. Ricciardelli d'Albore G., 1997.
Texbook of melissopalynology. Apimondia publishing house, Bucharest, 307 P.
Romet A., 2000. L'abeille adansonii
dans les hauts-plateaux de l'Ouest Cameroun. L'Abeille de France et
l'Apiculteur, 859, 257-261.
Ruttner F., 1968 a.
Systématique : Les races d'abeilles. In : Traité de biolo gie de
l'abeille, tome I, Ed. Masson & Cie, PP. 2-26.
Rutner F., 1968 b. L'organe génital
mâle et l'accouplement. In : Traité de biologie de l'abeille, tome
I, Ed. Masson & Cie, PP. 145-185.
Samuelsson K. E., 1969. Photomicrography of
recent and fossil pollen grains and spores. In : Handbook for palynology.
Scandinavian University Books, PP. 217- 230. Sawadogo M.,1993.
Contribution à l'étude du cycle des miellées et du cycle
biologique annuel des colonies d'abeilles Apis mellifica adansonii
Lat. à l'Ouest du Burkina Faso. Thèse de Doct.
3ème cycle, Univ. Ouagadougou, Burkina Faso, 152 P.
Sawyer R., 1988. Honey identification. Cardiff Academic Press,
115 P.
Schweitzer P., 2001. L'analyse pollinique des
miels : la collection de référence. L'Abeille de France et
l'Apiculteur, 870, 231-232.
Schweitzer P., 2002. Apiculture au Maroc.
L'Abeille de France et l'Apiculteur, 878, 93-100.
Seeley T. D., 1985. Honey
ecology. A study of adaptation in social life. University Press, New Jersey,
80-106.
Seregen P., 1997. Beekeeping in the tropics.
Agrodok N°32, 5e edition, 89 P. Sheppard W.
S., 1997. Subspecies of Apis mellifera. In : Honey Bee Pests,
Predators and Diseases, third edition, edited by R. A. Morse and K. Flottum.
Published by the A. I. Root compagny, PP. 519-533.
Sosu F. M.,
1993. The prospects of modern beekeeping in West African countries. In
: West African Bee Research Seminar, Bakau, Gambia, 25-28 November 1991,
published by Bees for Development, PP. 16-19.
Spichiger R., Loizeau
P.-A., Latour C., Barriera
G., 1996. Trees species richnees of South-Western Amazonian forest
(Janero Herrera ; Peru, 73°40'W/4°54' S). Candollea, 51,2,
560-577.
Stutz De Ortega L. C., 1987.
Etudes floristiques de divers stades secondaires des formations
forestières du Haut-Parana (Paraguay Oriental). Structure, composition
floristique et régénération naturelle : comparaison entre
la forêt primaire et la forêt sélectivement
exploitée. Candollea, 42, 1, 205-262.
Valdeyron G., 1984. Production de semences.
La production de semences p our quelques plantes de grande culture :
céréales, graminées fourragères, betterave à
sucre. In : Pollinisation et production végétales, INRA/Paris,
PP. 143-162.
Van Der Woe rd M. 1997. L'apiculture sous les
tropiques. L'Abeille de France et l'Apiculteur, 827, 267-272.
Villières B., 1987 a. Le point sur
l'apiculture en Afrique tropicale. Dossier n°5, GRET, ACCT, AFVP, 220
P.
Villières B., 1987 b. L'apiculture
africaine en zones tropicales et équatoriales de l'Ouest. Bull. Tech.
Apic., 14, 61, 193-220.
Voget M., 1989. Bees and beeproducts as
biological indicators of environmental contamination : An economical
alternative way of monitoring pollutants. Toxicological
and Environmental Chemistry, 20 ; 21, 199-202.
Von Maydell H.-J., 1990. Arbres et arbustes du
Sahel. Leurs caractéristiques et leurs utilisations. GTZ Verlag josef
margraf scientific books, 530 P.
Weiss K., 1989. Pratique de l'élevage en
apiculture, questions et réponses. Ed. européenne apicole ; 216
P.
Zahan D., 1968. L'abeille et le miel en Afrique
et à Madagascar. In : Traité de biologie de l'abeille, tome V, Ed
Masson & Cie, PP 86-100.
Annexes
Annexe 1 : Fiche d'enquête
«ethnoapicole»
Fiche d'enquête «ethnoapicole» N°:
Date : Nom, prénoms et âge :
1) Avez-vous des ruches ?
2) Quels sont les matériaux que vous utilisez pour
confectionner les ruches ?
3) Comment préparez-vous les ruches avant de les
installer ?
4) A quels moments placez-vous les ruches pour capturer les
essaims ?
5) Une ruche installée peut-elle rester pendant combien
d'années ?
6) Comment procédez-vous pour récolter le miel ?
Présente-t-elle des avantages ?
7) Combien de récoltes faites-vous par an et, quelles
sont les périodes ?
8) Quelles quantités (seau) de miel récoltez-vous
par ruche et par an ?
9) Comment faites-vous pour extraire et conditionner le miel
récolté ?
10) Quelles sont les utilisations alimentaires du miel que vous
connaissez ?
11) Quels sont vos besoins pour une amélioration des
pratiques apicoles ? Fiche d'apithérapie N°:
Date : Nom, prénoms, âge :
Indications
Mode de préparation
Posologie
Annexe 2 : Fiche descriptive des grains de pollen
N° lame
Année :
Traitement :
Espèce, auteur :
Famille :
Ville, localité : Date de récolte :
N° Collection :
|
Dimensions
|
Forme
|
Symétrie
|
Ornementation
|
Apertures
|
Coupes
|
|
L
|
E
|
|
|
|
|
V pol
|
V mer
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Moy. L
|
|
Moy. E
|
|
L/E
|
|
Max.
|
|
Min.
|
|
Mode
|
Annexe 4 : Index des espèces
représentées dans l'atlas
Acacia polyacantha (Mimosaceae) Planche : VI
Anogeissus leiocarpus (Combretaceae) Planche : IV
Bombax costatum (Bombacaceae) Planche : IV
Cassia mimosoides (Caesalpiniaceae) Planche : IV
Cleome viscosa (Capparidaceae) Planche : IV
Cochlospermum planchoni ( Cochlospermaceae)
Planche : V
Combretum paniculatum (Combretaceae) Planche : IV
Eucalyptus camaldulensis (Myrtaceae) Planche : V
Feretia apodanthera (Rubiaceae) Planche : V
Khaya senegalensis (Meliaceae) Pla nche : V
Lannea microcarpa (Anacardiaceae) Planche : V
Lonchocarpus laxiflorus (Fabaceae) Planche : VI
Melanthera abyssinica (Asteraceae) Planch e : VI
Mitragyna inermis (Rubiaceae) Planch e : VII
Parkia biglobosa (Mimosaceae) Planche : VI
Pennisetum glaucum (Poaceae) Planche : VI
Piliostigma thonningii (Caesalpiniaceae) Planche : VI
Psidium guajava (Myrtaceae) Planche : VII
Sclerocarya birrea (Anacardiaceae) Planche : VII
Securinega virosa (Euphorbiaceae) Planche : VII
Stereospermum kunthianum (Bignoniaceae) Planche :
VIII
Terminalia avicennioides (Combretaceae) Planche :
VIII
Vitellaria paradoxa (Sapotaceae) Planche : VIII
Vitex doniana Verbenaceae) Planche : VIII
Annexe 5 : Atlas descriptif des grains de
pollens des espèces mellifères des deux
zones
Acacia polyacantha Willd. var. Campylacantha
Planche VI
Famille : Mimosaceae
Lame N° 09
R écolté Lergo, Burkina Faso
à
A ire de distribution : Sénégal, Cameroun, Soudan,
Afrique tropicale. Espèce c ommun , souvent grégaire.
e
Intérêt mellifère : Nectarifère
Symétrie et forme
Pollen hétéropolaire, polyporé,
subsphérique. Polyade calymmé constitué de 16 m onades.
Dimensions (um)
De larges grains de pollens
D = 35,18 Max. = 38,75 Min. = 35 Mode = 35
A pertur es
Un pore à l'angle de chaque monade, aperture simple.
Ornementation de l'exine Ectex ine
lisse.
Famille : Combretaceae
Lame N° 04
Récolté à Nazinga, Burkina Faso
Aire de distribution : Sénégal, Cameroun, Afrique
centrale et orientale. Asse z commune, localement abondante et
grégaire.
Intérêt mellifère : Nectarifère et
pollinifère.
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, hétérocolporé, longiaxe.
Il est circulaire et hexalobé en vue polaire, elliptique en vue
méridienne.
Dimensions (um)
Pollen de très petite taille
L = 12,08 Max. = 12,5 Min = 11,25 Mode = 11,25
E = 10,38 Max. = 11,25 Min = 8,75 Mode = 10
L/E = 1,16
Apertures
Trois colporus alternant avec trois pseudocolpus. L'ectoaperture
est un sillon à marges nettes. L'endoaperture est circulaire e t allo
é lat ralem nt.
ng é e
Ornementation
L'ectexine columellaire est finement
striato-réticulée. L'endexine est mince.
Bombax costatum Planche : IV
Famille : Bombacaceae
Lame N° 28
Récolté à Nazinga
Aire de distribution : Arbre des savanes et forêts
sèches, se repartit du Sénégal au Centre de l'Afrique, de
la Guinée au Sud du Tchad en passant par le Ghana et le Nigeria.
Espèce assez commune, localement abondante.
Intérêt mellifère : pollinifère.
Symétrie et forme
La symétri e est d'ordre trois.
Pollen isopolaire, ellipsoïdal, tricolporé, longiaxe,
subangulaire, trilobé et planaaperturé en vue polaire, elliptique
en vue méridienne.
Dimensions (um)
Pollens de taille moye nne.
L= 32,36 Max. = 40 Min. = 27,5 Mode = 31,25
E = 24,03 Max. = 30 Min. =18,75 Mode = 23,75
L/E = 1,35
Apertures
Trois colporus. L'ectoaperture est un court sillon.
L'endoaperture est circulaire avec un épaississement
périapertural.
Ornementation de l'exine
L'ectexine épaisse est réticulée et
homobrochée. La lumière du réseau est large et pourvue de
bacules. Le mur des réseaux est également simplibaculé.
Endexine large de 1 um.
|
Cassia mimosoides
Famille : Caesalpiniaceae
Lame N° 47
Récolté à Nazinga
Aire de distribution : Pays tropicaux du vieux monde.
Intérêt mellifère : pollinifère
|
Planche : IV
|
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, rhomboïdal, tricolporé, longiaxe,
circulaire et trilobé en vue polaire, elliptique en vue
méridienne.
Dimensions (um)
Pollens de taille moyenne.
L= 35,58 Max. = 38,75 Min. = 33,75 Mode = 35
E = 28,33 Max. = 30 Min. = 25 Mode = 27,5
L/E = 1,25
Apertures
Trois colporus présentant une syncolpie. L'ectoaperture
est un sillon large de 3 um à marge nette avec une constriction
médiane. L'endoaperture est quadrangulaire avec un épaississement
périapertural.
Ornementation de l'exine
L'ectexine est scabre. Endexine mince
Cleome viscosa Planche : IV
Famille : Capparidaceae
Lame N° : 35
Récolté à Lergo, Burkina Faso
Aire de distribution : Îles du Cap-Vert, Soudan et
Australie tropicale.
Intérêt mellifère : Pollinifère
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, ellipsoïdal, tricolporé, longiaxe,
circulaire et trilobé en vue polaire, elliptique en vue
méridienne.
Dimensions (um)
Très petits
pollens
L= 14,21 Max. = 15 Min. = 12,25 Mode = 15
E = 11,33 Max. = 12,5 Min. =10 Mode = 11,25
L/E = 1,25
Apertures
Trois colporus. L'ectoaperture est un sillon. L'endoaperture est
circulaire avec un annulus.
Ornementation de l'exine
L'ectexine striato-réticulée, porte des bacules.
L'endexine est mince.
Planche : V
Cochlospermum planchoni Famille : Cochlospermaceae
Lame N° 35
Récolté à Lergo, Bu rkina Faso
Aire de distribution : espèce p antropicale
Intérêt mellifère : Nectarifère
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, ellipsoïdal, tricolporé,
subéquiaxe, circulaire et trilobé en vue polaire, elliptique en
vue méridienne.
Dimensions (um) Très petits pollens L=
12,46 Max. = 15 Min. = 11,25 Mode = 12,5
L/E = 1,09
Apertures
Trois colporus présentant une syncolpie. L'ectoaperture
est un sillon avec une constriction médiane. L'endoaperture n'est pas
bien définie.
Ornementation de l'exine
L'exine est scabre et baculée. L'endexine est mince.
Combretum paniculatum Planche : IV
Famille : Combretaceae
Lame N° 59
Récolté à Nazinga, Burkina Faso
Aire de distribution : Savanes, lisières et galeries
forestières, Sénégal, Gambie et Burkina Faso. Se repartit
seulement au Sud du Sahel.
Très répandue et commune, localement abondante et
grégaire.
Intérêt mellifère : Nectarifère
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, hétérocolporé,
subéquiaxe, circulaire et hexalobé en vue polaire, elliptique en
vue méridienne.
Dimensions (um) Pollens de petite taille
L = 20,95 Max. = 23,75 Min = 20 Mode = 20
E = 19,4 Max. = 21,25 Min = 17,5 Mode = 18,75
L/E = 1,08
Apertures
Trois colporus alternant avec trois pseudocolpus. L'ectoaperture
est un sillon à marges nettes. L'endoaperture est subcirculaire.
Ornementation
L'ectexine est finement striée. L'endexine est mince.
Eucalyptus camaldulensis Planche : V
Famille : Myrtaceae
Lame N° 53
Récolté à Lergo, Bu rkina Faso
Aire de distribution : Originai re d'Australie et actuellement
plantée dans les zones subtropicales, méditerranéennes et
semi-arides. Espèce pantropicale.
Intérêt mellifère : Nectarifère.
Symétrie et forme
La symétrie est d'ordre trois
Pollen isopolaire, tricolporé, triangulaire et anguloape e
e polaire et al
rturé n vu longé
avec une constriction médiane en vue méridienne
Dimensions (um)
Pollen de très petite taille
L = 17,55 Max. = 18,75 Min. = 15 Mode = 17,5
E = 9,3 Max. = 10 Min. = 7,5 Mode 10
L/E = 1,89
Apertures
Trois colporus formant souvent une syncolpie et un vestibulum.
L'ectoaperture est un sillon et l'endoaperture circulaire.
Ornementation de l'exine
L'ectexine scabre. L'endexine est mince
Feretia apodanthera Planche : V
Famille : Rubiaceae
Lame N° 41
Récolté à Nazinga, Burkina Faso
Aire de distribution : Sud du Sahel, du Sénégal au
Soudan, Kenya. Espèce Commune.
Intérêt mellifère : Nectarifère
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, ellipsoïdal, tricolporé, longiaxe,
circulaire et trilobé en vue polaire, elliptique en vue
méridienne.
Dimensions (um) Très petit po llen
L= 19,88 Max. = 25 Min. = 16,25 Mode = 18,75
E = 15,88 Max. = 21,25 Min. =12,5 Mode = 15
L/E = 1,25
Apertures
Trois colporus présentant une parasyncolpie avec un
triangle médian (vestibulum) de 4um de côté. L'ectoaperture
est un sillon à marge nette. L'endoaperture est circulaire avec des
bords nets.
Ornementation de l'exine
L'ectexine est réticulée et baculée.
Endexine large de 1 um.
Khaya senegalensis Planche : V
Famille : Meliaceae
Lame N° 33
Récolté à Nazinga, Burkina Faso
Aire de distribution : Du Sénégal au Soudan et en
Ouganda. Au Sud jusqu'à la zone de la forêt humide. Espèce
commune et plantée.
Intérêt mellifère : N ectarifère.
Symétrie et forme
La symé trie est d'ordre quatre.
Le pollen e st isopolaire, ellipsoïdal, subbréviaxe
et tétracolporé. Il est circulaire et tétralobé en
vue polaire et subsphérique en vue méridienne.
Dimensions (um) Pollens de petite taille.
L = 24,63 Max. = 27,5 Min. = 22,5 Mode = 23,75
E = 25,17 Max. = 27,5 Min. = 22,5 Mode = 25
L/E = 0,98
Apertures
Quatre colporus. L'ectoaperture est un court sillon mesurant 15
um à marge nette. L'endoaperture large de 2 um de diamètre est
entouré d'un épaississement.
Ornementation de l'exine
L'ectexine est lisse. L'endexine est mince.
Lannea microcarpa Planche : V
Famille : Anacardiaceae
Lame N° 34
Récolté à Lergo, Burkina Faso
Aire de distribution : Savane soudanienne de l'Afrique
occidentale, Sud du Sahel, Cameroun et la république Centrafricaine.
Parfois conservé dans les cultures pour ses fruits comestibles et son
écorce fibreuse. Espèce peu commune.
Intérêt mellifère : Nectarifère.
Symétrie et forme
Symétrie d'ordre trois.
Pollen isopolaire, tricolporé, longiaxe, circulaire et
trilobé en vue polaire, elliptique en vue méridienne.
Dimensions
Pollens de petite taille
L = 22,63 Max. = 2 7,5 Min. = 21,25 Mode = 22,5
E = 20,55 Max. = 22,5 Min. = 15 Mode = 20
L/E = 1,10
Apertures
Trois colporus. L'ectoaperture est un sillon à marges
nettes avec une constriction médiane. L'endoaperture est indistinctement
délimité.
Ornementation de l'exine
L'ectexine est striée. Les stries d'épaisseur
uniforme sont allongées, enchevêtrées et
plus ou moins
anastomosée s. Les lirés sont larges et simpli à
duplibaculées.
|
L'endexine est mince
Lonchocarpus laxiflorus
Famille : Fabaceae
Lame N° 23
Récolté à Lergo, Burkina Faso
|
Planche : VI
|
Aire de distribution : Sénégal, Cameroun, Soudan et
Ouganda. Peu commune. Intérêt mellifère :
Nectarifère.
Symétrie et forme
La symétrie est d'ordre trois.
Le pollen est isopolaire, ellipsoïdal, tricolporé,
longiaxe. Il est subangulaire en vue polaire et el liptique en vue
méridienne.
Dimensions (um)
Pollen de très petite taille.
L = 18,38 Max. = 2 0 Min. = 16,25 Mode = 17,5
E = 16,75 Max. = 18,75 Min. = 13,75 Mode = 16,25
L/E = 1,10
Apertures
Trois colporus. L'ectoaperture est un sillon à marge nette
avec une constriction
médiane. L'endoaperture est très large (4 um) et
allongé transversalement.
Ornementati on de l'exine
L'ectexine tecté est perforé. L'endexine est
mince.
Melanthera abyssinica Planche :VI
Famille : Asteraceae
Lame N° 52
Récolté à Lergo, Burkina Faso
Aire de distribution : Soudan, Ethiopie, Afrique Occidentale.
Intérêt mellifère : Nectarifère et
pollinifère.
Symétrie et forme
La symétrie est d'ordre trois.
Pollen hétéropolaire, sphéroïdal,
tricolporé, circulaire et trilobé en vue polaire.
Dimensions (um)
Pollens de petites tailles.
D = 22,5 Max. = 23,75 Min. = 21,25 Mode = 22,5
Apertures
Trois colporus. L'ectoaperture est court sillon. L'endoaperture
est circulaire.
Ornementation de l'exine
L'ectexine échinulée est finement baculée.
L'endexine est mince.
Famille : Rubiaceae
Lame N° 42
Récolté à Nazinga, Bu rkina Faso
Aire de distribution : Du Sahel à la République
Démocratique du Congo, en Côte d'Ivoire, au Togo, Bénin et
même jusqu'au bord de la mer.
Intérêt mellifère : Ne ctarifère et
pollinifère.
Symétrie et forme
Pollen isopolaire, ellipsoïdal, tricolporé, breviaxe,
circulaire et trilobé en vue polaire, elliptique en vue
méridienne.
La symétrie est d'ordre trois.
Dimensions
Pollen de très petite taille.
L = 11,38 Max. = 13,75 Min. = 10 Mode = 11,25
E = 13,25 Max. = 15 Min. = 12,5 Mode = 13,75
L/E = 0,86
Apertures Trois colp u
or s. L 'ectoaperture u
est n sillon large de 3 um à marge nette. L'endoaperture
circulaire est entouré d'épaississement.
Ornementation de l'exine
L'ectexine tectée, réticulée est
distinctement simplibaculée. L'endexine est mince .
Parkia biglobosa Planche VI
Famille : Mimosaceae
Lame N° 40
Récolté à Lergo, Burkina Faso.
Aire de distribution : Sénégal, Cameroun, Soudan.
Amérique tropicale, Inde Occidentale. Espèce très commune,
localement abondante et grégaire.
Intérêt mellifère : Nectarifère et
pollinifère.
Symétrie et forme
Pollen hétéropolaire, polyporé,
subsphérique. Polyade calymmé constitué de 32 monades.
Dimensions (um)
De larges grains de pollens
D = 77,58 Max. = 86,25 Min. = 72,5 Mode = 78,75
Apertures
Un pore à l'angle de chaqu e monade, aperture simple.
Ornementation de l'exine Ectexine
scabrée.
Famille : Poaceae
Lame N° 37
Récolté à Lergo, Burkina Faso Aire de
distribution :
Intérêt mellifère : Pollinifère
Symétrie et forme
Pollen hétéropolaire , uniporé, circulaire
en vue polaire, elliptique en vue méridienne.
Dimensions (um)
Pollens de taille moyenne.
L= 47,67 Max. = 50 Min. = 40 Mode = 45
E = 35,75 Max. = 40 Min. =27,5 Mode = 37,5
L/E = 1,33
Apertures
Aperture sim ple, circulaire a 5 um de diamètre. Il est
entouré d'un annulus.
Ornementation de l'exine
L'ectexine est scabre. L'endexine est mince.
Piliostigma thonningii Planche : V
Famille : Caesalpiniaceae
Lame N° 45
Récolté au Burkina Faso
Aire de distribution : Toute l'Afrique, dans les savanes
arborées et les galeries forestières, aussi dans les forêts
secondaires. Très commune.
Intérêt mellifère : Nectarifère et
pollinifère.
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, sphérique, triporé et circulaire
en vue polaire, elliptique en vue méridienne. Pollen se
présentant fréquemment en vue polaire.
Dimensions (um)
Pollen de taille moyenne.
D = 32,42 Max. = 32,5 Min. = 27,5 Mode = 30
Apertures
Trois pores entourés chacun d'un épaississement
périapertural.
Ornementations d e l'exine
L'ectexine tectée porte des bacules. Elle est
perforée et spinulée. L'endexine est m ince.
Psidium guajava Planche : VII
Famille : Myrtaceae
Lame N° 01
Récolté à Lergo, Burkina Faso
Aire de distribution : Espèce pantropicale originaire du
Brésil, répandu du Sénégal au Cameroun.
Intérêt mellifère : Nectarifère.
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, tr icolporé, breviaxe, subtriangulaire
en vue polaire et elliptique en vue méridienne.
Dimension (
s um)
Ce sont des pollens de très petite taille.
L = 10,58 Max.= 11,25 Min = 10 Mode = 10
E = 14,8 Max. = 16,25 Min. = 13,75 Mode = 15
L/E =0,71
Apertures
Trois colporus. L'ectoaperture est un sillon à marges
nettes présentant une syncolpie. L'endoaperture est circulaire.
Ornementations de l'exine
L'ectexine est tectée et réticulée.
L'endexine est mince.
Sclerocarya birrea Planche : VII
Famille : Anacardiaceae
Lame N° 39
Récolté à Lergo, Burkina Faso
Aire de distribution : Au Nord du 9e parallèle
en Afrique de l'Ouest, au Sénégal, Cameroun, Ouganda et en
Ethiopie.
Intérêt mellifère : Nectarifère.
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, tricolporé, longiaxe, subangulaire aux
angles arrondis en vue polaire et elliptique en vue méridienne.
Dimensions (um) Pollens de petite taille
L = 26,43 Max. = 31,25 Min. = 22,5 Mode = 27,5
E = 21,88 Max. = 26,25 Min. = 18,75 Mode = 22,5
L/E = 1,21
Apertures
Trois colporus. L'ectoapertu re est un sillon à marges
nettes à bords parallèles formant un triangle équatorial
de dimensions 4 um souvent une syncolpie. L'endoa perture circulaire est
allongé longitudinalement.
Ornementations de l'exi ne
L'exine est striée. St ries de même taille à
mur large et simplibaculées sont dirigées vers les pôles et
apparaissant enchevêtrées. L'endexine est mince.
Securinega virosa Planche : VII
Famille : Euphorbiaceae
Lame N° 32
Récolté à Lergo, Bu rkina Faso
Aire de distribution : Sénéga l, Cameroun,
Afrique tropicale, et Australie. Elle est répandue au Sahel et dans la
zone soudano-sahélienne. Espèce commune et
disséminée mais distribuée
irrégulièrement.
In térêt mellifère : Nectarifère.
Symétrie et forme
La symétri es rdre trois.
e t d'o
Le pollen est isopolaire, ellipsoïdal, tric lporé
o , longiaxe. Il est circulaire en vue polaire
et elliptique en vue méridienne.
Dimensions (um)
Pollen de très petite taille.
L = 17,13 Max. = 20 Mi n. = 15 Mode = 17,5
E = 13,42 Max. = 15 Min. = 12,5 Mode = 13,75
L/E = 1,28
Apertures
Trois colporus. L'ectoaperture est un sillon à marge nette
avec un attrium saillant. L'endoapertu re circulaire est entouré d'un
épaississement périapertural.
Ornementation de l'exine
L'ectexine est réticulée et simplibaculéee.
L'endexine est mince.
Stereospermum kun thianum Planche : VIII
Famille : Bignoniaceae
Lame N° 15
Récolté à Lergo, Burkina Faso
Aire de distribution : Se rencontre dans les savanes africaines
(tropicale et orientale) du Sénégal au Cam eroun, jusqu'en
Ethiopie, de l'Ouganda au Malawi.
Intérêt mellifère : Necta rifère.
Symétrie et forme
La symétrie est d'ordre trois.
Pollen isopolaire, ellipsoïdal, tricolpé, longiaxe,
circulaire et subangulaire en vue polaire, ellip tique en vue
méridienne.
Dimensions (um) Pollens de petite taille.
L = 30,71 Max. = 36,25 Min. = 25 Mode = 27,5
E = 23,83 Max. = 27,5 Min. = 17,5 Mode = 26,25
L/E = 1,29
Apertures
Trois colpi. L'ectoaperture est un long sillon à marge
nette. Les ectoapertures se rejoignent à l'équateur formant un
triangle médian équilatéral de 12 um de
côté.
Ornementation de l'exin e
L'ectexine est tectée, baculée et
réticulée homobrochée. L'endexine est mince.
Terminalia avicennioides Planche : VIII
Famille : Combretaceae
Lame N° 48
Récolté à Nazinga, Burkina Faso
Aire de distribution : Sénégal, Tchad et Ethiopie.
Assez commune.
Intérêt mellifère : Nectarifère.
Symétrie et forme
La symétrie est d'ordre trois.
Le Pollen est isopolaire, ellipsoïdal, tricolporé,
hétérocolpé, longiaxe. Il est hexalobé en vue
polaire et elliptique en vue méridienne.
Dimension (
s um)
Très petit pollen.
L = 16,13 Max. = 18,75 Min. = 16,25 Mode = 15
L/E = 1,19
Apertures
Trois colporus alternent ave c trois pseudocolpus. L'ectoaperture
est un sillon étroit à
marges nettes. L'endoaperture est circulaire.
Ornementation de l'exine
L'ectexine est rugulée. Endexine est mince.
Planche : VIII
Vitellaria paradoxa
Lame N° 26
Famille : Sapotaceae
Récolté à Nazinga, Burkina Fa so
Symétrie et forme
La symétri es rdre trois.
e t d'o
Pollen isop
o ire, e
la llipsoïdal, trétr acolp ré, lo
o ngiaxe, subcirculaire et tétralobé en vue
Aire de distribution : Se distribue à l'extrême
Sud du Sahara, dans la savane voisine soudanienne et Gu inéenne.
Peuplements denses en Guinée, Mali, Burkina Faso, Niger, ainsi qu'au
Nord de la Côte d'Ivoire, du Ghana, du Togo, du Bénin, Du Nigeria
et du Cameroun. Plus à l'Est quelques petites étendues en Afrique
centrale et en Ouganda.
In térêt mellifère : Nectarifère et
pollinifère.
polaire, elliptique en vue méridienne.
Dimensions (um) Pollen de petite taille.
L = 27,71 Max. = 30 Min. = 25 Mode = 27,5
E = 19,71 Max. = 22,5 Min. = 17,5 Mode = 20
L/E = 1,41
Apertures
Quatre colporus. L'ectoaperture est un long sillon à marge
nette avec une constriction médiane. L'endoaperture circulaire est
entouré d'un épaississement.
Ornementati on de l'exine
L'ectexine tectée, fossulée à perfo
rée. Endexine est mince.
Vitex doniana Planche : VIII
Famille : Verbenace ae
Lame N° 18
Récolté à Lergo, Burkina Faso
Aire de distribution : Toute l'Afrique, savanes
côtières, forêts secondaires ou sèches. In
térêt mellifère : Nectarifère et
pollinifère.
Symétrie et forme
La symétri es rdre trois.
e t d'o
Pollen isop o la ire, tr icolpé subéqui axe, c
ircula ire et trilobé en v ue p olaire, elliptique en vue
méridienne.
Dimensions (um) Pollen de petite taille
L =20,7 Max. = 22,5 Min. = 18,75 Mode = 20
E =17,7 Max. = 20 Min. = 15 Mode = 17,5
L/E = 1,17
Apertures
Trois colpi. L'ectoaperture est un sillon à marges nettes,
à bords parallèles et formant en vue polaire un triangle
équato de e
rial dim nsion 4 um. L'en oape
s d rture circulaire
est entouré d 'un épaississement.
Ornementations de l'exine
L'ectexine est épaisse, tectée et perforée.
L'endexine est épais de 1 um.
Planche IV : 1-5 Anogeissus leiocarpus
; 6-9 Bombax costatum ; 10-15 Cassia mimosoides ;
16-20 Cleome viscosa ; 21 Combretum paniculatum.
(1) : coupe méridienne (x1000) ; (2) et (3) : coupe
polaire, pollen hexalobé (x1000) ; (4) : vue subpolaire ;(5) : aperture
vue de face avec un colpus diffus ; (6) et (7) : vue polaire (x1000), L. O.
Analyse ; (8) : vue polaire de surface ; (9) : ornementation de l'exine avec
des bacules présents dans les luminae.(10) (11) : LO Analyse montrant
l'amincissement de l'endexine (x1000) ; (12) : coupe subpolaire
présentant une syncolpie (x1000) ; (13) : intercolpium scabre ; (14) :
aperture vue de face avec ectoaperture à bords nets présentant
une constriction médiane ; (15) : ornementation scabre de l'exine ; (16)
et (17) : coupe méridienne (x1000) ; (18) : colpus granuleux ; (19) :
apocolpium ; (20) : ornementation striato perforée ; (21) : coupe
polaire.
Planche V : 1-5 Feretia apodanthera ;
6-10 Khaya senegalensis ; 11-15 Lannea microcarpa ; 16-17
Cochlospermum planchonii ; 18-21 Eucalyptus camaldulensis.
(1) : coupe méridienne (x1000) ; (2) : vue polaire
(x1000) ; (3) : apocolpium ; (4) : colporus avec une endoaperture à
marge nette ; (5) : ornementation microréticulée de l'exine ; (6)
; vue méridienne (x1000) ; (7) et (8) : vue subpolaire ; (9) : aperture
complexe avec une endoaperture circulaire et une ectoaperture (court colpus) ;
(10) : ornementation lisse ; (11) : vue méridienne (x1000) ; (12) et
(13) : vue polaire, LO Analyse (x1000) ; (14) intercolpium strié avec la
membrane du colpus granuleuse ; (15) : ornementation striée ; (16) :
coupe meridienne (x1000); (17) : vue polaire (x1000) ; (18), (19) : coupe
équatorial, LO Analyse (x1000) ; (21) : vue syncolpiale ; (20) :
ornementation scabre.
Planche VI : 1-3 Parkia biglobosa ; 4-5
Acacia polyacantha ; 6-8 Pennisetum glaucum ; 9-12
Piliostigma thonningii ; 13-16 Lonchocarpus laxiflorus ;
17-19 Melanthera abyssinica.
(1) et (3) : polyade constitué de 32 monades ; (2) :
surface microperforée de l'exine ; (5) et (6) polyade constitué
de 16 monades à ornementation lisse ; (7) et (8) : pollen
monoporé à aperture en forme circulaire entourée d'un
annulus ; (9) : surface scabre de l'exine ; (10 et (11) : LO Analyse de la vue
méridienne (x1000) ; (12) : vue aperturale avec un sillon court ; (13) :
ornementation microperforée et spinulée de l'exine ;(14) : coupe
méridienne (x1000) ; (15) et (16) : vue polaire (x1000) ; (17) :
ornementation perforée de l'exine ; (18) : LO Analyse (x1000) ; (19) :
coupe polaire (x1000) ; (20) : vue de surface, ornementation
échinulée ; (19) : vue polaire.
Planche VII : 1-4 Psidium guajava ;
5-10 Sclerocarya birrea ; 11-14 Securinega virosa ;
15-19 Mitragyna inermis.
(1) : coupe méridienne (x1000) ; (2) et (3) : vue
polaire, LO Analyse (x1000) ; (4) : exine scabre montrant une syncolpie ; (5) :
coupe méridienne (x1000) ; (6) et (7) : coupe polaire, LO Analyse
(x1000) ; (8) : ornementation striée ; (9) colporus avec le colpus
à marge diffuse ; (10) : syncolpie; (11) et (12) : coupe
méridienne ; LO Analyse (x1000) ; (13) : vue polaire avec un attrium
saillant ; ; (14) ornementation réticulée ; (15) : vue
méridie nne ave LO Analyse (x1000) ; (16) : vue polaire, LO Analyse
(x1000), ectexine baculée ; (17) :vue polaire; (18) : ornementation
supraréticulée ; (19) : intercolpium réticulé.
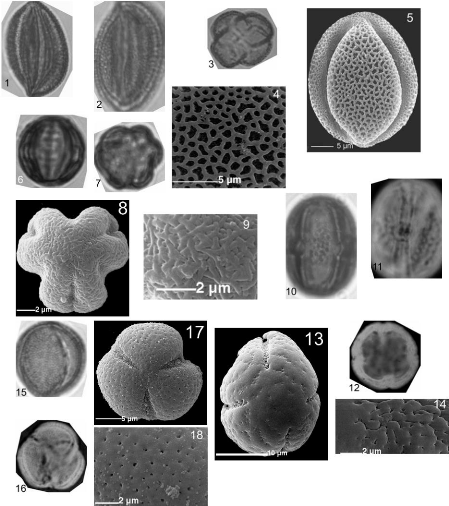
Planche VIII : 1-5 Stereospermum
kunthianum ; 6-9 Terminalia avicennioides ; 10-14 Vitellaria
paradoxa ; 15-18 Vitex doniana.
(1) et (2) : vue méridienne, LO Analyse (x1000) ; (3)
vue polaire ; (4) : ornementation supra-réticulée ; (5) :
intercolpium; (6) : coupe méridienne LO Analyse (x1000) ; (7): vue
subpolaire (x1000) ; (8) : vue subpolaire, hexalobé avec des
pseudosillons ; (9) : ornementation rugulée ; (10) et (11) : vue
méridienne LO Analyse (x1000) ; (12) : vue subpolaire (x1000) ; (13) :
vue subpolaire; (14) : ornementation scabre de l'exine ; (15) : vue
méridienne LO Analyse (x1000) ; (16) : vue polaire (x1000) ; (17) : vue
polaire avec un apocolpium ; (18) : ornementation perforée.
Annexe 6 : Analyse quantitative de la
végétation des deux zones
Analyse quantitative de la végétation
dans la zone de Garango
|
Espèces
|
N
|
D. R. (%)
|
F. R. (%)
|
d. R.
(m2/ha)
|
%IVI
|
|
Ziziphus mucronata*
|
13
|
0,5
|
0,01
|
0,05
|
0,56
|
|
Ziziphus mauritiana*
|
23
|
0,88
|
0,02
|
0,08
|
0,98
|
|
Ximenia americana*
|
40
|
1,53
|
0,03
|
0,45
|
2,005
|
|
Vitex doniana*
|
18
|
0,69
|
0,01
|
1,32
|
2,019
|
|
Vitellaria paradoxa*
|
134
|
5,13
|
0,04
|
7,67
|
12,83
|
|
Terminalia avicennioides*
|
32
|
1,22
|
0,01
|
0,33
|
1,57
|
|
Tamarindus indica*
|
26
|
0,99
|
0,01
|
1,88
|
2,886
|
|
Strychnos spinosa
|
14
|
0,54
|
0,01
|
0,05
|
0,6
|
|
Stereospermum kunthianum*
|
8
|
0,31
|
0,01
|
0,12
|
0,437
|
|
Securinega virosa*
|
73
|
2,79
|
0,06
|
0,01
|
2,863
|
|
Securidaca longepedunculata*
|
2
|
0,08
|
0
|
0,1
|
0,179
|
|
Sclerocarya birrea*
|
327
|
12,5
|
0,07
|
21,5
|
34,08
|
|
Pterocarpus erinaceus*
|
6
|
0,23
|
0
|
0,19
|
0,427
|
|
Psidium guajava*
|
1
|
0,04
|
0
|
0,02
|
0,062
|
|
Prosopis africana
|
65
|
2,49
|
0,02
|
3,07
|
5,573
|
|
Piliostigma thonningii*
|
70
|
2,61
|
0,06
|
0,32
|
2,983
|
|
Piliostigma reticulatum*
|
43
|
1,64
|
0,02
|
0,95
|
2,614
|
|
Parkia biglobosa*
|
92
|
3,52
|
0,04
|
13,1
|
16,65
|
|
Mitragyna inermis*
|
6
|
0,23
|
0
|
0,11
|
0,347
|
|
Maytenus senegalensis*
|
32
|
1,22
|
0,02
|
0,37
|
1,615
|
|
Mangifera indica*
|
7
|
0,27
|
0
|
1,27
|
1,538
|
|
Maerua angolensis
|
6
|
0,23
|
0
|
0,03
|
0,26
|
|
Lonchocarpus laxiflorus*
|
2
|
0,08
|
0
|
0,02
|
0,102
|
|
Lannea microcarpa*
|
251
|
9,6
|
0,06
|
17,3
|
26,98
|
|
Lannea acida*
|
40
|
1,53
|
0,02
|
1,62
|
3,178
|
|
Khaya senegalensis*
|
13
|
0,5
|
0,01
|
2,1
|
2,612
|
|
Guiera senegalensis*
|
29
|
1,11
|
0,02
|
0,01
|
1,148
|
|
Grewia bicolor*
|
28
|
1,07
|
0,02
|
0,14
|
1,232
|
|
Gardenia ternifolia*
|
19
|
0,73
|
0,01
|
0,02
|
0,757
|
|
Gardenia erubescens*
|
2
|
0,08
|
0
|
0,09
|
0,168
|
|
Ficus gnaphalocarpa
|
4
|
0,15
|
0
|
0,66
|
0,82
|
|
Feretia apodanthera*
|
70
|
2,68
|
0,04
|
0,25
|
2,968
|
|
Faidherbia albida*
|
13
|
0,5
|
0
|
0,63
|
1,132
|
|
Dichrostachys cinerea*
|
13
|
0,5
|
0,01
|
0,1
|
0,604
|
|
Diospyros mespiliformis
|
191
|
7,31
|
0,05
|
4,22
|
11,58
|
|
Combretum paniculatum*
|
9
|
0,34
|
0,01
|
0,01
|
0,358
|
|
Combretum molle*
|
16
|
0,61
|
0,01
|
0,15
|
0,777
|
|
Combretum glutinosum*
|
103
|
3,94
|
0,07
|
0,11
|
4,125
|
|
Celtis integrifolia
|
1
|
0,04
|
0
|
0,01
|
0,049
|
|
Cassia sieberiana
|
11
|
0,42
|
0,01
|
0,08
|
0,512
|
|
Capparis corymbosa
|
13
|
0,5
|
0,01
|
0,02
|
0,528
|
|
Bombax costatum*
|
9
|
0,34
|
0
|
0,57
|
0,914
|
|
Balanites aegyptiaca*
|
126
|
4,82
|
0,02
|
2,86
|
7,702
|
|
Azadirachta indica
|
9
|
0,34
|
0,01
|
0,12
|
0,474
|
|
Anogeissus leiocarpus*
|
186
|
7,12
|
0,04
|
9,16
|
16,31
|
|
Annona senegalensis*
|
77
|
2,95
|
0,06
|
0,07
|
3,084
|
|
Acacia sieberiana*
|
75
|
2,87
|
0,02
|
1,82
|
4,704
|
|
Acacia seyal*
|
38
|
1,45
|
0,02
|
0,85
|
2,321
|
|
Acacia polyacantha*
|
9
|
0,34
|
0,01
|
0,37
|
0,718
|
|
Acacia pennata*
|
1
|
0,04
|
0
|
0,01
|
0,046
|
|
Acacia gourmaensis*
|
38
|
1,45
|
0,02
|
0,63
|
2,105
|
|
Acacia dudgeoni*
|
247
|
9,45
|
0,04
|
2,96
|
12,45
|
Analyse quantitative de la végétation de
la zone de Nazinga
|
Espèces
|
N
|
D. R.(%)
|
F. R. (%)
|
d. R.(%) (m2/ha)
|
I.V.I.
|
|
Ziziphus mucronata*
|
6
|
0,23
|
0
|
0
|
0,23
|
|
Ximenia americana*
|
56
|
2,12
|
0,03
|
0
|
2,15
|
|
Xeroderris stuhlmannii*
|
39
|
1,48
|
0,01
|
0
|
1,49
|
|
Vitex simplicifolia*
|
1
|
0,04
|
0
|
0
|
0,04
|
|
Vitex doniana*
|
2
|
0,08
|
0
|
0
|
0,08
|
|
Vitellaria paradoxa*
|
436
|
16,5
|
0,07
|
0,5
|
17,1
|
|
Terminalia macroptera*
|
14
|
0,53
|
0,01
|
0
|
0,54
|
|
Terminalia laxiflora*
|
50
|
1,9
|
0,03
|
0
|
1,93
|
|
Terminalia avicennioides*
|
126
|
4,78
|
0,04
|
0,02
|
4,84
|
|
Tamarindus indica*
|
31
|
1,18
|
0,02
|
0
|
1,2
|
|
Strychnos spinosa
|
11
|
0,42
|
0,01
|
0
|
0,42
|
|
Strychnos innocua
|
15
|
0,57
|
0,01
|
0
|
0,58
|
|
Stereospermum kunthianum*
|
33
|
1,25
|
0,03
|
0
|
1,28
|
|
Sterculea setigera*
|
5
|
0,19
|
0,01
|
0
|
0,19
|
|
Securinega virosa*
|
12
|
0,46
|
0,01
|
0
|
0,46
|
|
Securidaca longepedunculata
|
4
|
0,15
|
0
|
0
|
0,15
|
|
Saba senegalensis*
|
18
|
0,68
|
0,01
|
0
|
0,69
|
|
Pterocarpus erinaceus*
|
65
|
2,46
|
0,03
|
0,11
|
2,61
|
|
Pteleopsis suberosa
|
9
|
0,34
|
0,01
|
0
|
0,35
|
|
Pseudocedrela kotschyi*
|
136
|
5,16
|
0,02
|
0,02
|
5,2
|
|
Prosopis africana
|
4
|
0,15
|
0
|
0
|
0,16
|
|
Piliostigma thonningii*
|
266
|
10,1
|
0,07
|
0,06
|
10,2
|
|
Parkia biglobosa*
|
37
|
1,4
|
0,02
|
0,02
|
1,45
|
|
Ozoroa insignis
|
1
|
0,04
|
0
|
0
|
0,04
|
|
Oncoba spinosa
|
24
|
0,91
|
0,01
|
0
|
0,92
|
|
Nauclea latifolia*
|
48
|
1,82
|
0,02
|
0
|
1,85
|
|
Mitragyna inermis*
|
23
|
0,87
|
0,01
|
0
|
0,88
|
|
Maytenus senegalensis*
|
15
|
0,57
|
0,01
|
0
|
0,58
|
|
Lonchocarpus laxiflorus*
|
49
|
1,86
|
0,01
|
0
|
1,87
|
|
Lannea velutina*
|
15
|
0,57
|
0,01
|
0
|
0,58
|
|
Lannea microcarpa*
|
25
|
0,95
|
0,02
|
0,01
|
0,97
|
|
Lannea kerstengii*
|
30
|
1,14
|
0,03
|
0 ,02
|
1,18
|
|
Lannea acida*
|
55
|
2,09
|
0,04
|
0,01
|
2,14
|
|
Khaya senegalensis*
|
14
|
0,53
|
0,01
|
0 ,01
|
0,55
|
|
Isoberlinia doka*
|
56
|
2,12
|
0,01
|
0,03
|
2,16
|
|
Hymenocardia acida*
|
4
|
0,15
|
0
|
0
|
0,16
|
|
Hexalobus monopetalus*
|
3
|
0,11
|
0
|
0
|
0, 12
|
|
Grewia cissoides*
|
5
|
0,19
|
0,01
|
0
|
0,19
|
|
Grewia bicolor*
|
24
|
0,91
|
0,02
|
0
|
0,93
|
|
Gmelina arborea*
|
11
|
0,42
|
0,01
|
0
|
0,42
|
|
Gardenia ternifolia*
|
2
|
0,08
|
0
|
0
|
0,08
|
|
Gardenia erubescens*
|
54
|
2,05
|
0,0 2
|
0
|
2,07
|
|
Gardenia aqualla*
|
5
|
0,19
|
0,01
|
0
|
0,19
|
|
Ficus platyphylla
|
2
|
0,08
|
0
|
0
|
0, 08
|
|
Ficus gnaphalocarpa
|
3
|
0,11
|
0
|
0
|
0,12
|
|
Ficus glumosa
|
1
|
0,04
|
0
|
0
|
0,04
|
|
Feretia apodanthera*
|
11
|
0,42
|
0,01
|
0
|
0,42
|
|
Eucalyptus camaldulensis*
|
2
|
0,08
|
0
|
0
|
0,08
|
|
Diospyros mespiliformis
|
137
|
5,19
|
0,04
|
0 ,06
|
5,3
|
|
Dichrostachys cinerea*
|
7
|
0,27
|
0
|
0
|
0,27
|
|
Detarium microcarpum*
|
49
|
1,86
|
0,03
|
0
|
1,89
|
|
Daniellia oliveri*
|
33
|
1,25
|
0,02
|
0
|
1,27
|
|
Crossopterix febrifuga*
|
21
|
0,8
|
0,01
|
0
|
0, 81
|
|
Combretum paniculatum*
|
6
|
0,23
|
0
|
0
|
0,23
|
|
Combretum nigricans*
|
14
|
0,53
|
0,01
|
0
|
0, 54
|
|
Combretum molle*
|
14
|
0,53
|
0,01
|
0
|
0,54
|
|
Combretum glutinosum*
|
86
|
3,26
|
0,04
|
0
|
3,31
|
|
Combretum fragrans*
|
59
|
2,24
|
0,03
|
0
|
2,27
|
|
Combretum collinum*
|
64
|
2,43
|
0,03
|
0
|
2,46
|
|
Cissus populnea*
|
1
|
0,04
|
0
|
0
|
0,04
|
|
Cassia siamea*
|
19
|
0,72
|
0
|
0
|
0,73
|
|
Cassia sieberiana*
|
10
|
0,38
|
0,01
|
0
|
0, 39
|
|
Burkea africana*
|
7
|
0,27
|
0,01
|
0
|
0,27
|
|
Bridelia scleroneura
|
4
|
0,15
|
0
|
0
|
0,15
|
|
Bridelia micrantha
|
1
|
0,04
|
0
|
0
|
0,04
|
|
Bombax costatum*
|
9
|
0,34
|
0,01
|
0
|
0,35
|
|
Azadirachta indica
|
1
|
0,04
|
0
|
0
|
0,04
|
|
Anogeissus leiocarpus*
|
12 3
|
4,66
|
0,04
|
0,08
|
4,78
|
|
Annona senegalensis*
|
9
|
0,34
|
0,01
|
0
|
0,35
|
|
Albizia chevalieri
|
15
|
0,57
|
0,01
|
0
|
0,58
|
|
Afzelia africana*
|
25
|
0,95
|
0,01
|
0 ,01
|
0,97
|
|
Adansonia digitata*
|
3
|
0,11
|
0
|
0
|
0,12
|
|
Acacia sieberiana*
|
5
|
0,19
|
0,01
|
0
|
0,19
|
|
Acacia seyal*
|
9
|
0,34
|
0,01
|
0
|
0,35
|
|
Acacia polyacantha*
|
1
|
0,04
|
0
|
0
|
0,04
|
|
Acacia erhenbergiana*
|
2
|
0,08
|
0
|
0
|
0,08
|
N : Abondance ; D. R. :
Densité Relative ; F. R. : Fréquence Relative ;
d. R. : dominance Relative ; IVI : Importance
Value Index
* : Espèce mellifère
Annexe 7 : Liste générale des
espèces végétales citées dans le texte
Abelmoschus esculentus (L) Moench 47, 51, 57, 58, Annexe
3 ( MALVACEAE) Acacia dudgeoni Craib ex Holl. 30, 48, 51, 57,
58, 67, 70,
Annexe 6 (MIMOSACEAE)
Acacia erhenbergian a Hayne Annexe 6 (MIM OSA
CEAE)
Acacia gourmaensis A.Chev. 48, 57, Annexe 6 (MIMOS
ACEAE)
Acacia macrostachya enth 48, 51 (MIMO EAE)
Reich. ex B . , 58 SAC
Acacia nilotica var. ada nsonii (Guill.&
Perr.) O. Ktze. 48, 57 ( MIMO SACEAE) Acacia pennata (Linn.)
Willd. 48, 57, An nexe 6 ( MI MOSACEAE)
Acacia polyacantha Willd. Subsp.
campylacantha.(Hochst. Ex A. Rich.) Brenan 48, 57, 78, Annexe 3, 4 ,
5, 6 (MIMOSACEAE)
Acacia sieberiana DC. , 58 0, Ann 6
(MIMOSACEAE
48, 51, 57 , 7 exe )
Acacia seyal Del. 4 8, 49, 57, 84, Ann ex e 6 (M IMO
SACEAE)
Achyranthes arge ntea Lam. 90 (A MARA NTHAC EA
E)
Adansonia digitata Linn. 29, Annexe 6 ( BOMB ACA
CEAE)
Afrormosia laxiflora (B enth. Ex Ba k.) Harms 51, 58 ,
Annexe 3 (F ABACEAE) Afzelia africana Sm. 30, 50, 58, 70, 80,
Annexe 6 ( CA ESALPINIACEAE) Albizia chevalieri Harms 6
(MI OSAC )
Annexe M EAE
Allium cepa Linn. 30, 47 57 (LILI ACE AE)
Anacardium occidentale Linn. 46 57
(ANACARDIACEAE)
Andropogon ascinodis C. B . Cl. 3 0
(POACEAE)
Andropogon gayanus K unth 30, 2,
48, 5 57, 58 (POACEAE)
Andropogon pseudapricus Stapf 80
30, (POA CEAE)
Annona senegalensis Pers. 46, 5 7, , An
0, 5 58, 85 nexe 6 (ANNONACEAE) Anogeissus
leiocarpus (DC.) Guill. & Perr. 29, 30, 46, 50, 57, 58, 67, 76, 78,
Annexe 3, 4, 5, 6 (
)
(Linn.) Del. , 57
46 , 67 (BALANITACEAE)
nn. 48, 52, 5 7, 58 (NYCTAGINACEAE)
48, 52, 57 , 5 8 (N YCTA GIN ACEAE)
Pell. & Vuill. 46, 49, 50, 53, 57, 58
(BOMBACACEAE)
COMBRETACEAE)
Arachis hypogaea L inn. 29, 47, 5 , 5
1 57 8 (FA EAE)
BAC
Aspilia bussei O. H offm. & Muschl. 51 (
RAC
ASTE EAE)
Azadirachta indica A . Juss. 29, A exe
nn 6 (ME LIAC E
EA Balanites aegyptiaca Boerhavia diffusa Li
Boerhavia erecta Linn. Bombax costatum
Borassus aethiopum Mart. 46, 57 ECACEAE)
(AR
Borreria filifolia (Schu m. & Thonn . Sc
.) K hum. 48, , 57, (RUBIACEAE
52 )
Borreria scabra (Schum. & Thonn . S
.) K chum. 52, 57 (R
48, , 58 UBIACE AE)
Borreria stachydea (DC.) Hutch. & Dalz. 48, 52, 57,
58 (RUBIACEAE)
|
Bridelia micrantha
|
(Hochst.) Baill. nne
A xe 6 (EUPHORBIACEAE)
|
Bridelia scleroneura Müll. Arg. Annexe 6
(EUPHORBIACEAE) Burkea africana Hook. Annexe 6
(CAESALPIANIACEAE) Capparis corymbosa Lam. Annexe 6
(CAPPARIDACEAE)
Cassia mimosoides Linn. 46, 50, 57, 58, Annexe 3, 4, 5
(CAESALPINIACEAE) Cassia occidentalis Linn. 46, 57
(CAESALPINIACEAE)
Cassia siamea Lam. Annexe 6 (CAESALPINIACEAE)
Cassia sieberiana DC. 89, 90 (CAESALPINIACEAE) Cassia
singueana Del. Annexe 6 (CAESALPINIACEAE) Cassia tora
Linn. 29 (CAESALPINIACEAE)
Ceiba pentandra (Linn.) Gaertn. 46, 57, Annexe 3
(BOMBACACEAE)
Celosia trigyna Linn. 46, 57 (AMARANTHACEAE)
Celtis integrifolia Lam. 29, Annexe 6 (ULMACEAE)
Cissus populnea Guill. & Perr. 52, 58, Annexe 6
(VITACEAE) Citrus aurantifolia Linn. 58, Annexe 3
(RUTACEAE)
Cleome gynandra Linn. 46, 50, 57, 58
(CAPPARIDACEAE)
Cleome viscosa Linn. 46, 50, 57, 58, Annexe 6
(CAPPARIDACEAE) Cochlospermum planchoni Hook. F. 46, 50, 57,
58,
Annexe 3, 4, 5 (COCHLOSPERMACEAE)
Cochlospermum tinctorium A. Rich. 46, 50, 57, 58
(COCHLOSPERMACEAE) Colocynthis citrullus (Linn.) O. Kze. 47
(CUCURBITACEAE)
Combretum aculeatum Vent. 46, 57, Annexe 6
(COMBRETACEAE)
Combretum collinum Fress. 50, 58, Annexe 6
(COMBRETACEAE)
Combretum fragrans Hoff. 50, Annexe 6
(COMBRETACEAE)
Combretum glutinosum Perr. ex DC. 30, 46, 50, 57, 58,
67, 84 (COMBRETACEAE) Combretum micranthum G. Don 47, 53 57,
Annexe 3 (COMBRETACEAE) Combretum molle R. Br. ex G. Don 47,
50, 57, 58, Annexe 3, 6 (COMBRETACEAE) Combretum nigricans
Lepr. ex Guill. & Perr. 50, 58, Annexe 6 (COMBRETACEAE)
Combretum paniculatum Vent. 47, 51, 53, 57, 58,
Annexe 3, 4, 5, 6 (COMBRETACEAE)
Commelina benghalensis Linn. 47, 51, 57, 58
(COMMELINACEAE)
Crossopteryx febrifuga (Afzel. ex D. Don) Benth. 52, 58,
Annexe 6 (RUBIACEAE) Crotalaria goreensis Guill. & Perr.
47, 57 (FABACEAE)
Crotalaria retusa Linn. 47, 51, 57
(FABACEAE)
Ctenium elegans Kunth 29 (POACEAE)
Ctenium newtonii Hack. 30, 80 (POACEAE)
Cyanotis lanata Benth. 47, 51, 57, 58
(COMMELINACEAE)
Cymbopogon schoenanthus subsp. proximus
(Hochst. ex A. Rich.) M. & W. 29, 80, 84, 85 (POACEAE)
Cyperus esculentus Linn. 47, 51, 57, 58
(CYPERACEAE)
Daniellia oliveri (Rolfe) Hutch. & Dalz. 50, 58, 70,
80,
Annexe 6 (CAESALPINIACEAE)
Datura innoxia Mill. 52 (SOLANACEAE)
Detarium microcarpum Guill. & Perr. 30, 50, 58,
Annexe 6 (CA ESALPINIACEAE) Dichrostachys cinerea (L.) W. et
Am. 48, 51, 57, 58, Annexe 6 (MIMOSACEAE) Dicoma tomentosa
Cass. 84, 85 (ASTERACEAE)
Dioscorea dumetorum (Kunth) Pax 84
(DIOSCOREACEAE)
Diospyros mespiliformis Hochst. ex A. DC. 84, Annexe 6
(EBENACEAE) Echinochloa colona (Linn.) Link 29 (POACEAE)
Entada africana Guill. & Perr. 50, 58, 90, Annexe 6
(MIMOSACEAE) Eucalyptus camaldulensis Dehnhard 29, 48, 51,
57, 58, 70, 78,
Annexe 3, 4, 5 (MYRTACEAE)
Faidherbia albida (Del.) A. Chev. 29, 48, 57, Annexe 6
(MIMOSACEAE) Feretia apodanthera Del. 48, 52, 57, 58, 78,
Annexe 3 , 4, 5, 6 (RUBIACEAE) Ficus glumosa Del. Annexe 6
(MORACEAE)
Ficus gnaphalocarpa (Miq.)Steud. ex A. Rich. Annexe 6
(MORACEAE) Ficus platyphylla Del. Annexe 6 (MORA
CEAE)
Gardenia aqualla Stapf & Hutch. Annexe 6
(RUBIACEAE)
Gardenia erubescens Stapf & Hutch. 30, 48, 52, 57,
58, Annexe 6 (RUBIACEAE) Gardenia sokotensis Hutch. 52, 58,
Annexe 6 (RUBIACEA E)
Gardenia ternifolia Schum. & Thonn. 48, 52, 57, 58,
Annexe 6 (RUBIACEAE) Gmelina arborea Roxb 49, 52, 57, 58, 70,
Annexe 3, 6 (VERBENACEAE) Gossypium barbadense Linn. 51, 58
(MALVACEAE)
Grewia bicolor Juss. 49, 52, 57, 58, Annexe 3, 6
(TILIACEAE)
Grewia cissoides Hutch. & Dalz. 52 Annexe 6
(TILIACEAE)
Guiera senegalensis J. F. Gmel. 47, 57, 84, Annexe 3, 6
(COMBRETACEAE) Hexalobus monopetalus (A. Rich.) Engl. &
Diels Annexe 6 (ANNONACEAE) Hibiscus cannabinus Linn. 47, 51
(MALVACEAE)
Hibiscus sabdariffa Linn. 47? 57 (MALVACEAE)
Hoslundia opposita Vahl 47 (LAMIACEAE)
Hymenocardia acida Tul. 51, 89
(HYMENOCARDIACEAE)
Hyparrhenia smithiana (Hook.) Stapf 30
(POACEAE)
Hyparrhenia subplumosa Stapf 30 (POACEAE)
Hyptis spicigera Lam. 84, 85 (LAMIACEAE)
Indigofera leprieurii Bak. 47, 51, 57, 58
(FABACEAE)
Ipomoea aquatica Fursk 47, 51, 57,
(CONVOLVULACEAE)
Ipomoea eriocarpa R. Br. 47, 51, 57, 58
(CONVOLVULACEAE)
Isoberlinia doka Craib & Stapf 50, 58, 70, 80 ,
Annexe 6 (CAESALPINAICEAE) Ludwigia senegalensis (DC.) Brenan
48 58 (ONAGRACEAE)
Khaya senegalensis (Desv.) A. Juss. 29, 48, 49, 51, 53,
57, 58, 78,
Annexe 3, 4, 5, 6 (MELIACEAE)
Lagenaria siceraria (Mol.) Standl. 20, 30
(CUCURBITACEAE)
Lannea acida A. Rich. 30, 46, 50, 57, 58, Annexe 6
(ANACARDIACEAE) Lannea kerstingii Engl. & K. Krause 50,
58, 70 Annexe 6 (ANACARDIACEAE) Lannea microcarpa Engl. &
K. Krause 29, 46, 50, 53, 57, 58, 67, 70, 78, 96, Annexe 3, 4, 5, 6
(ANACARDIACEAE)
Lannea velutina A. Rich. 50, Annexe 6
(ANACARDIACEAE)
Leptadenia hastata (Pers.) Decne. 46, 50, 57, 58, 90
(ASCLEPIADACEAE) Leucaena leucocephala (DC.) Benth. Annexe 3
(MIMOSACEAE)
Leucas martinicensis (Jacq.) Ait. 47, 84, 85
(LAMIACEAE)
Lonchocarpus laxiflorus Guill. & Perr. 47, 51, 57,
58, 77, 78,
Annexe 3, 4, 5, 6 (FABACEAE)
Loudetia togoensis (Pilger) C. E. Hubbard 30
(POACEAE)
Lycopersicum esculentus Mill. 30
(SOLANACEAE)
Maerua angolensis DC. Annexe 6
(CAPPARIDACEAE)
Mangifera indica Linn. 29, 46, 49, 57, Annexe 6
(ANACARDIACEAE)
Maytenus senegalensis (Lam.) Exell 46, 50, 57, 58,
Annexe 6 (CELASTRACEAE)
Melanthera abyssinica (Sch. Bip.) Oliv. & Hiern
47,57,
Annexe 3, 4, 5 (ASTERACEAE)
Melothria maderaspatana (Linn.) Cogn. 47, 57
(CUCURBITACEAE) Microchloa indica (Linn.) P. Beauv. Ess.
Agrost. 30 (POACEAE) Mitracarpus scaber Zucc. 48, 52, 57
(RUBIACEAE)
Mitragyna inermis (Willd.) O. Kze. 48, 52, 57, 58,
78,
Annexe 3, 4, 5, 6 (RUBIACEAE)
Nauclea latifolia Sm. 52, 58, 89 (RUBIACEAE)
Nicotiana tabacum L inn. 85 (SOLANACEAE)
Ocimum americanum Linn. 84, 85 (LAMIACEAE)
Oncoba spinosa Frorsk. Annexe 6 (FLACOURTIACEA
E) Oryza sativa Linn. 29 (POACEAE)
Parinari curatellifolia Planch. ex Benth. 52 , 58,
Annexe 3 (CHRYSOBALANACEAE) Parkia biglobosa (Jacq.) Benth.
29, 48, 51, 53, 57, 58, 67, 70, 78, 84, 85, 86, Annexe 3, 4, 5, 6
(MIMOSACEAE)
Pennisetum glaucum (Linn.) R. Br. 29, 48, 52, 57, 58,
73, 78, 86, 89, 90, Annexe 3, 4, 5 (POACEAE)
Pennisetum pedicellatum Trin. 52 (POACEAE)
Pennisetum polystachion (Linn.) Schult. 52
(POACEAE) Phyllanthus reticulatus Poir. 47, 57
(EUPHORBIACEAE)
Piliostigma reticulatum (DC.) Hochst. 46, 57, 84, Annexe
3, 6 (CAESALPINIACEAE) Piliostigma thonningii (Schum.)
Milne-Redhead 46, 50, 57, 58, 67, 76, 78, 84, 96, Annexe 3, 4, 5, 6
(CAESALPINIACEAE)
Prosopis africana (Guill. & Perr.) Taub. Annexe 6
(MIMOSACEAE)
Pseudocedrela kotschyi (Schweinf.) Harms 51 , 58, 67,
Annexe 3, 6 (MELIACEAE) Psidium guajava Linn. 48, 57, 78,
Annexe 3, 4, 5, 6 (MYRTACEAE)
Pteleopsis suberosa Engl. & Diels. 30, Annexe 6
(COMBRETACEAE) Pterocarpus erinaceus Poir. 51, 58, 67, 70,
Annexe 6 (FABACEAE) Saba sengalensis (A. DC.) Pichon 50, 58,
Annexe 6 (APOCYNACEAE)
Schizachyrium sanguineum (Retz.) Alston Suppl. Fl.
Ceylon 3 0 (POACEAE) Schoenefeldia gracilis Kunth 29
(POACEAE)
Sclerocarya birrea (A. Rich.) Hochst. 46, 57, 67, 70,
78, 96, Annexe 3, 4, 5, 6 (ANACARDIACEAE)
Securidaca longepedunculata Fres. 84, 85, 90, Annexe 6
(POLYGALACEAE)
Securinega virosa (Roxb. ex Willd.) Baill. 47, 51, 57,
58,
Annexe 3, 4, 5, 6 (EUPHORBIACEAE)
Sesbania pachycarpa DC. 47, 57 (FABACEAE)
Sida acuta Burm. 47, 51, 57, 58 (MALVACEAE)
Sida alba Linn. 47, 51, 57, 58 (MALVACEAE)
Sida cordifolia Linn. 29 (MALVACEAE)
Sida rhombifolia Linn. 51, 58 (MALVACEAE)
Solanum aethiopicum Linn. 85 (SOLANACEAE)
Solanum melongena Linn. 29 (SOLANACEAE)
Sorghum bicolor (Linn.) Moench. 29, 48, 52, 57, 58, 73
(POACEAE) Sporobolus pyramidalis P. Beauv. 80
(POACEAE)
Sterculia setigera Del. 52, Annexe 6
(STERCULIACEAE) Stereospermum kunthianum Cham. 46, 50, 57,
58, 78,
Annexe 3, 4, 5, 6 (BIGNONIACEAE)
Strychnos innocua Del. 89, Annexe 6
(LOGANIACEAE)
Strychnos spinosa Lam. Annexe 6
(LOGANIACEAE)
Tamarindus indica Linn. 29, 46, 50, 57, 58, Annexe 6
(CAESALPINIACEAE) Terminalia avicennioides Guill. & Perr.
30, 47, 51, 57, 58, 67, 77, 78, Annexe 3, 4, 5, 6 (COMBRETACEAE)
Terminalia laxiflora Engl. 51, 58, Annexe 6
(COMBRETACEAE)
Terminalia macroptera Guill. & Perr. 51, 58, Annexe
6 (COMBRETACEAE) Tridax procumbens Linn. 47, 51, 57, 58,
Annexe 3 5 (ASTERACEAE) Triumfetta lepidota K. Schum. 49, 52, 57, 58,
Annexe 3 (TILIACEAE) Vernonia pauciflora (Willd.) Less. 47,
51, 57, 58, Annexe 3 (ASTERACEAE) Vigna unguiculata (Linn.) Walp. 47,
51, 57 (FABACEAE)
Vitellaria paradoxa Gaertn. 29, 30, 48, 52, 57, 58, 67,
70, 78 , 84, 96, Annexe 3, 4, 5, 6 (SAPOTACEAE)
Vitex doniana Sweet 49, 52, 57, 58, 70, 78, Annexe 3, 4,
5, 6 (VERBENACEAE) Vitex simplicifolia Oliv. 52, Annexe 6
(VERBENACEAE)
Waltheria indica Linn. 49, 52, 57, 58, Annexe 3
(STERCULIACEAE) Wissadula amplissima (Linn.) R. E. Fries 47,
51 57 (MALVACEAE) Xeroderris stuhlmannii (Taub.) Men 51, 58,
70, Annexe 6 (FABACEAE) Ximenia americana Linn.48, 52, 57,
58, Annexe 3, 6 (OLACACEAE) Zea mays Linn. 29, 48, 52, 57,
58, 73 (POACEAE)
Ziziphus mauritiana Lam. 29, 48, 57, Annexe 3, 6
(RHAMNACEAE) Ziziphus mucronata Willd. 48, 52, 57, Annexe 3,
6 (RHAMNACEAE)
Annexe 8 : Planches photographiques
Ruches et ruchettes modernes installées sur
support ou dans un arbre.
Fig. 1 : Ruche kenyane.
Fig. 2 : Ruche rectangulaire.
Fig. 3 : Ruche Dadant (ici corps de ruche sans
sa hausse).
Fig. 4 : Ruchette utilisée pour capturer
les essaims.

Planche IX
Ruchers apicoles (ensemble de plusieurs
ruches)
Fig. 1 : Rucher couvert.
Fig. 2 : Rucher installé sous de gros
arbres.

Planche X
Activités de butinage de l'abeille domestique
Apis mellifera adansonii Lat.
Fig. 1 : Activité de récolte de
nutriments sur Guiera senegalensis et sur Cochlospermum
planchoni (en haut à gauche)
Fig. 2 : Activité de récolte de
l'eau

Planche XI
Rayons de miels operculés prêts à
être récoltés.
Fig. 1 : Cadre avec pointes d'une ruche
rectangulaire.
Fig. 2 : Cadre trapézoïdal d'une
ruche kenyane améliorée.
Fig. 3 : Barrette d'une ruche kenyane.
Fig. 4 : Cadre en section pour la production de
miel en section.

Planche XII
173
Opérations d'extraction et de conditionnement
du miel
Fig. 1 : Désoperculation de cadres de
miel operculés à l'aide d'une herse et d'un bac à
désoperculer.
Fig. 2 : Extraction de miel. Ici un extracteur
centrifuge (a) combiné à un bac à désoperculer (b)
et un maturateur (c).
Fig. 3 : Miel extrait à l'extracteur et
mis en pot ; observer la diffé rence de couleur due à leur
origine végétale différente.
Fig. 4 : Miel traditionnel ; (a) miel provenant
de vieux rayons, (b) miel provenant de nouveaux rayons. Observer les
impuretés.

Planche XIII
Matériels apicoles
Fig. 1 : Tenue apicole
(a) : Chapeau avec voile ;
(b ) : Combinaison apicole ;
(c) : Paire de gants ;
(d) : Enfumoir ;
(e) : Paire de bottes ;
(f) : Brosse à abeilles, lève cadres et
couteau.
Fig. 2 : Approvisionnement des abeilles en eau
; ici un canari posé sur un support.
Fig. 3 : autres matériels apicoles
(a) : Grille pour récolter la propolis ;
(b) : Cadre pour la production de miel en section ;
(c) : Grille à reine ;
(d) : Trappe pour la récolte du pollen.

Planche XIV
Quelques ennemis et leurs dégâts des
abeilles
Fig. 1 : Scarabée noir (Aethina
tumida Murray) ; se nourrit du pollen stocké dans les
alvéoles.
Fig. 2 : Fourmi noire ; empêche la
colonisation des ruches.
Fig. 3 : Dégâts de la fausse teigne
(Galleria mellonela) ; très nocif surtout pour les faibles
colonies.

Planche VI
Annexe 9 : Publicatio
ns
| 


