|

A ceux qui m'ont tout donné sans rien en
retour
A ceux qui m'ont encouragé et soutenu dans mes
moments les plus durs
Et ceux à qui je dois tant
A ma mère,
La réussite de tes enfants a toujours
été un souci permanant. Tu nous as
éduquées
Dans le sens de la dignité, de
l'honnêteté et du courage.
Ce travail est le tien
A mon père,
Tu n'as jamais reculé devant aucun sacrifice pour que
nous puissions bénéficier
D'une bonne éducation et d'une bonne
formation.
Puisse dieu te prêter longue vie afin que tu puisses
jouir enfin du fruit de tes
Sacrifices et de tes efforts inlassables.
A mes soeurs.
A mes oncles et tantes
A mes grands pères et mères.
A tout mes amies.
![]()
Mes sincères remerciements et ma
profonde reconnaissance sont adressés à tous ceux qui ont
contribués à la réalisation de ce travail,
notamment :
A monsieur kacem mourad qui a accepté
de diriger ce travail et qui nous a énormément aidées dans
la compréhension.
A l'équipe du département de
biotechnologie de l'université d'Oran.
J'adresse également mes remerciements,
à tous mes enseignants, qui m'ont donnée les bases de la
science.
Au personnel du laboratoire de l'hôpital
d'Oran (CHU) et plus spécialement à l'ingénieur madame
kacem.
Je tiens à remercier également messieurs
les membres du jury, d'avoir accepter d'évaluer ce travail.
Merci enfin pour tous et celles qui m'ont aidé a
ce travail et les efforts déployer de prés ou de loin, je les
remercie du fond du coeur.
sommaire
1 - Introduction 01
2 - Etude bibliographique
2.1 - Définition 02
2.2 - Historique 03
2.2.1 - Données générales 03
2.3 - Epidémiologie 04
2.3.1 - Incidence 04
2.3.2 - Age de survenue 04
2.3.3 - Mortalité 04
2.4 - Facteurs étiologiques 04
2.4.1 - Facteurs génétiques 04
2.4.2 - Facteurs environnementaux 05
2.4.2.1 - Agents chimiques 05
2.4.2.2 - Agents physiques 05
2.4.2.3 - Agents infectieux 05
2.4.3 - Autres facteurs étiologiques 05
2.5 - Physiopathologie 06
2.5.1 - Les facteurs de croissance du clone 06
2.5.1.1 - L'interleukine 6 06
2.5.1.2 - interleukine 3 ; interleukine 5 ; G-CSF 06
2.5.1.2 - TNF alpha et interleukine 3 06
2.6 - Les différents types de myélome 08
2.7 - Présentation clinique 09
2.8 - Critères de diagnostique 10
2.9 - Démarche de diagnostique 11
2.10 - Classification de myélome 12
2.11 - Pronostic de myélome 13
2.12 - Les stades du myélome 14
2.13- Traitement 15
3 - Matériel et
méthodes
3.1 - Les malades 17
3.2 - Prélevement du sang 17
3.3 - Centrifugation et obtention du serum 18
3.4 - Eléctrophorèse 18
3.5 - Lecture au densitomètre 20
3.6 - Etude statistique 20
4 - Résultats:
4.1 - Centrifigation du sang 21
4.2 - Eléctrophorèse 21
4.3 - Données relatives aux archives 21
5 - Discussion 27
6 - Conclusion 28
7 - Références
bibliographiques 29
Liste des figures
Figure 1: Aspect des cellules
myélomateuses.
Figure 2: Physiopathologie du myélome
multiple.
Figure 3: Structure des immunoglobuline
.
Figure 4: Les étapes du prélevements
sanguin
.
Figure 5: Centrifugation du sang et obtention du
sérum.
Figure6: les étapes de la technique
d'électrophorèse des proteines sériques .
Figure 7: Les différentes phases du sang
obtenues après centrifugation.
Figure 8: Apparition d'une bande dense après
migration.
Figure 9: Apparition du pic monoclonal au niveau des
gammaglobulines.
Figure 10: Fréquence de la pathologie selon le
sexe.
Figure 11: La répartition des sujets atteints
du myélome selon le sexe.
Figure 12: Fréquence de la pathologie chez les
femmes selon les tranches d'âges.
Figure 13 : Comparaison fréquence de la
pathologie chez les hommes selon les
tranches d'âges.
Figure14 : Le nombre de cas par année et leur
fréquence.
Liste des tableaux
Tableau 1: Critères de diagnostiques des
myélomes selon le « Southwest
Oncology Group».
Tableau 2: Nouveaux critères de
diagnostiques du myélome multiple.
Tableau 3: Bilan de diagnostique du
myélome multiple.
Tableau 4: Classification de Durie et Salmon
(1975) à trois niveaux.
Tableau 5: International Staging System
(ISS).
Tableau 6: Les différentes options
thérapeutiques classique.
Tableau 7: les médicaments les plus
fréquemment utilisés .
Tableau 9: Description de la population.
Tableau 10: Fréquence de la pathologie selon
le sexe.
Tableau 11: Fréquence de la pathologie chez
les hommes selon les tranches
D'âges.
Tableau 12 : Comparaison fréquence de la
pathologie chez les hommes selon les
tranches d'âges.
Tableau 13 :Le nombre de cas par année et leur
fréquence .
1 - Introduction
Le myélome multiple ou maladie de Kahler est une
hémopathie maligne caractérisée par une
prolifération monoclonale de plasmocytes. Elle s'accompagne de la
sécrétion d'une immunoglobuline monoclonale complète ou
incomplète, et de lésions osseuses qui apparaissent
d'emblée ou au cours de l'évolution de la maladie [1, 2].
C'est une Iymphopathie B relativement rare. Son incidence au
plan mondial est de l'ordre de 2,4/100000/an. Elle a connu une croissance ces
dernières années et l'implication de facteurs environnementaux,
notamment chimiques, a été fortement évoquée dans
sa genèse [2].
En Algérie, l'incidence du myélome a
été évaluée à 1,1/100 000 par an. La
majeure partie des patients est âgée de plus de 40 ans avec un pic
qui concerne la tranche d'âge de 65 à 70 ans. La
prédominance masculine de l'affection reste à démontrer
[3].
Sur le plan étiopathogénique, elle demeure une
affection mal connue, même si ces dernières années des
avancées significatives ont été faites grâce aux
progrès de la biologie moléculaire. Son diagnostic repose sur la
conjonction d'un ensemble d'arguments cliniques et para cliniques qui sont
aujourd'hui bien connus. Son pronostic est redoutable. Malgré les
progrès obtenus dans le domaine thérapeutique, le myélome
multiple demeure une affection incurable [3].
Le but de ce travail est de mettre en évidence chez un
groupe de patients de la région d'Oran et de ses environs le
myélome multiple par technique d'électrophorèse des
protéines sériques.
Une étude rétrospective portant sur des patients
ayant été enrégistrés dans le service d'immunologie
du CHU d'Oran.
2- Etude bibliographique
2.1 - Définition
Le myélome multiple ou myélome plasmocytaire
fait partie d'un groupe nosologique qui porte selon la classification la
dénomination de néoplasies plasmocytaires dans la classification
OMS des hémopathies malignes lymphoïdes [4].
Le myélome est une prolifération excessive de
cellules plasmocytaires anormales. Ces plasmocytes produisent des
immunoglobulines monoclonales, en quantités importantes. Elles sont
trouvées dans le sang et les urines. Les plasmocytes anormaux, encore
appelés cellules myélomateuses (Figure 1) peuvent entraîner
un fonctionnement anormal des autres cellules de la moelle osseuse
reflété par l'anémie et/ou une leucopénie et une
thrombopénie [5].
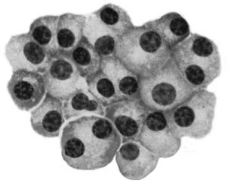
Figure 1: Aspect des cellules myélomateuses
L'accumulation des plasmocytes malins dans la moelle osseuse,
entraine également :
· la destruction et l'invasion de l'os environnant la
cavité de la moelle osseuse.
· une immunodépression, essentiellement
marquée par une baisse des immunoglobulines et une
susceptibilité accrue aux infections [6].
Les plasmocytomes sont des tumeurs composées de
plasmocytes, qui peuvent se développer à l'intérieur
(intra médullaire) ou à l'extérieur (extra
médullaire) de l'os ou des tissus mous. Lorsque les plasmocytomes sont
multiples, on parle alors de myélome multiple [6].
2.2 - Historique :
2.2.1 - Données générales :
- 1846, découverte du premier cas de
myélome multiple par Dalrymple. L'examen des urines effectué par
Bence Jones met en évidence la protéine myélomateuse
(protéine de Bence Jones) [7].
- 1889, Kahler décrit la maladie
[8].
- 1965, Rowe et Fahey découvrent le
premier cas de myélome à IgD [9].
- 1969, Alexanian propose l'association
melphalan - prednisone dans le traitement du myélome multiple[9].
- 1975, Durie et Salmon établissent
une classification pronostique de la maladie
[10].
- 1980, Découverte simultanée
du myélome asymptomatique par deux équipes
Américaines. Kyle décrit le- smoldering myeloma
(myélome rampant) et
Alexanian, l'indolent myeloma (myélome latent) [11].
- 1996
· Première
étude randomisée démontrant la supériorité
des traitements
Intensifs avec greffe de moelle par rapport au traitement
conventionnel [12].
- 2001
· Proposition d'un nouveau
système de classification du myélome et des maladies
apparentées.De nouvelles classifications pronostiques sont
proposées par :
ï Le SWOG (Southwest Oncology Group) propose un
système en 4 groupes basé sur les taux sériques de
ß2- microglobuline et d'albumine.
ï L'IFM (Intergroupe Français du Myélome)
propose un système en 3 groupes basé sur les taux sériques
de ß2- microglobuline et la présence ou non d'anomalies du
chromosome 13 [12].
· 2004
· Présentation
d'une nouvelle classification pronostique, l'I.S.S.
o (International Staging System). [6].
2.3 - Epidémiologie
2.3.1- Incidence
Au plan mondial, l'incidence du myélome multiple est
estimée à 2,8/100000/ an pour les hommes et 2,1/l00000/an pour
les femmes [13].
2.3.2 - Age de survenue
Le myélome est généralement une maladie
des personnes âgées. Le pic de fréquence va selon les pays
de 65 à 70 ans. Les cas observés avant 40 ans sont rares, environ
2%. Son incidence augmente significativement avec l'âge, soit plus de 50
nouveaux cas /1 00000 /an au delà de 80 ans [14, 15].
2.3 .3 - Mortalité
La mortalité en Europe varie entre 1,9 et 4,8/100000/an
chez les hommes et 1,4 et 3,2/100000/an chez les femmes [16].
2.4 - Facteurs étiologiques
L'étiologie du myélome multiple est pour
l'instant inconnue mais certains facteurs ont été
identifiés comme favorisant l'émergence d'un clone plasmocytaire
malin.
2.4.1 - Facteurs génétiques:
Beaucoup d'anomalies chromosomiques ont été
identifiées dans la pathogénie du myélome multiple:
translocations, délétions et anomalies de nombre.
Les translocations sont de loin les plus fréquentes, en
particulier celles impliquant la région chromosomique l4q32. Pour la
plupart des auteurs, elle est retrouvée chez 73% des patients atteints
de myélome multiple [17, 15, 18].
Les délétions concernent surtout les chromosomes
13 et 17. La délétion du bras long du chromosome 11
entraîne des mutations au niveau du gène p53. Ces mutations ont
longtemps été considérées comme importantes dans la
pathogénie du myélome multiple. En réalité, elles
sont rarement observées sauf au stade terminal de la maladie [19,
20].
Par contre, les délétions monoalléliques
du chromosome 13 atteignent souvent le gène du rétinoblastome (RB
1). Elles constitueraient un événement fréquent et
précoce dans la pathogénie du myélome multiple [11].
Les études effectuées sur les cas familiaux de
myélome multiple ne permettent pas d'affiner l'existence formelle d'un
facteur génétique dans la genèse de cette maladie. Si dans
certaines études comme celle de Brown et coll., le risque de
myélome est plus élevé chez les sujets ayant un
antécédent familial de myélome [17], d'autres par contre
ne trouvent pas de mécanisme génétique direct dans le
développement du myélome [21].
2.4.2 - Facteurs environnementaux
2.4.2.1 - Agents chimiques
Plusieurs études ont examiné la relation
existant entre l'exposition à certains agents chimiques et le
développement d'un myélome multiple.
Il existe ainsi diverses professions augmentant le risque de
survenue d'un myélome multiple. Les principales sont:
· L'industrie du caoutchouc, du pétrole, le
groupe des garagistes-pompistes,
Chauffeurs mécaniciens de garage qui sont des secteurs
d'activité impliquant notamment une exposition au benzène [22,
23].
Les coiffeurs et esthéticiennes: le
nombre de substances auxquelles ces sujets sont susceptibles d'être
exposés est important et aucun agent étiologique
spécifique n'a ce jour été fortement identifié.
Cependant l'utilisation de teintures capillaires est fortement
incriminée [24, 25].
· Les fermiers, forestiers, agriculteurs: de nombreux
agents étiologiques ont été suggérés:
insecticides, herbicides, champignons... [4, 16, 22].
2.4.2.2 - Agents physiques
Une étude effectuée chez des employés de
centrales nucléaires aux USA montrait une augmentation de l'incidence
avec 85 décès imputables au myélome pour 100.000
employés [12]. Le myélome multiple radio-induit apparaît
plusieurs années après l'exposition initiale.
Les rayonnements électromagnétiques l'exposition
aux champs électromagnétiques serait impliquée dans la
survenue de leucémies. Mais leur rôle dans la survenue du
myélome multiple n'est pas encore élucidé [12, 22].
2.4.2.3 - Agents infectieux
Certains virus sont considérés comme cofacteurs
ou inducteurs dans le Développement du myélome multiple. Ainsi
une étude a montré que les sujets VIH positif ont un risque de
développer l'affection 4, 5 fois plus élevé que les Sujets
VIH négatif [12].
Des études récentes lient le
développement du myélome multiple à une infection par
l'herpès virus humain 8 (HIN 8). Mais dans d'autres études, ce
lien n'est pas retrouvé [12, 26, 27].
2.4.2.4 - Autres facteurs étiologiques
Les stimulations antigéniques chroniques joueraient
aussi un rôle important car favorisent l'éclosion d'un clone
plasmocytaire insensible aux facteurs de régulation de l'immunité
[28].
Le myélome multiple est donc probablement une affection
multifactorielle qui résulterait de l'expansion d'un clone de
plasmocytes après que plusieurs mutations induites par des facteurs
environnementaux aient altéré son matériel
génétique [28].
2.5 - Physiopathologie
Les connaissances concernant la physiopathologie du
myélome multiple sont en pleine évolution. Même si beaucoup
d'interrogations subsistent encore, la plupart des auteurs s'accordent sur le
rôle de certaines cytokines dans la croissance du clone plasmocytaire et
la physiopathologie des principales manifestations clinico-biologiques (Figure
2).
2.5.1 - Les facteurs de croissance du clone
Ce sont principalement les cytokines qui contrôlent la
prolifération plasmocytaire tumorale [29,30]. L'interleukine 6 est la
plus importante car elle joue un rôle central aussi bien dans la
prolifération que dans la survie des cellules myélomateuses
[31,2].
2.5.1.1 - L'interleukine 6 (L'IL-6)
L'IL-6 est synthétisée par les cellules du
microenvironnement mais également par les cellules plasmocytaires
elles-mêmes [32]. L'IL-6 est un puissant stimulant des plasmocytes
tumoraux en culture. Aux stades avancés de la maladie, les taux d'IL-6
dans le sang sont augmentés [32].
Cependant, il existe d'autres cytokines qui agissent soit en
augmentant la sensibilité des cellules myélomateuses à
l'interleukine 6, soit en induisant une sécrétion autocrine
d'interleukine 6 dans ces cellules [33,34].
2.5.1.2 - Interleukine3 ; interleukines5 ; G-CSF
Les travaux ont permis de montrer que ces cytokines sont de
puissants stimulants de la prolifération plasmocytaire en stimulant la
réponse à l'interleukine 6 des cellules myélomateuses.
Cependant elles n'ont pas d'effet sur la production d'interleukine 6 par
l'environnement tumoral [32,33].
2.5.1.3 - TNF alpha et interleukine 3
Ils induisent une production d'interleukine 6 par les cellules
de l'environnement tumoral et celles myélomateuses, mais n'agissent pas
directement sur la prolifération plasmocytaire [35].
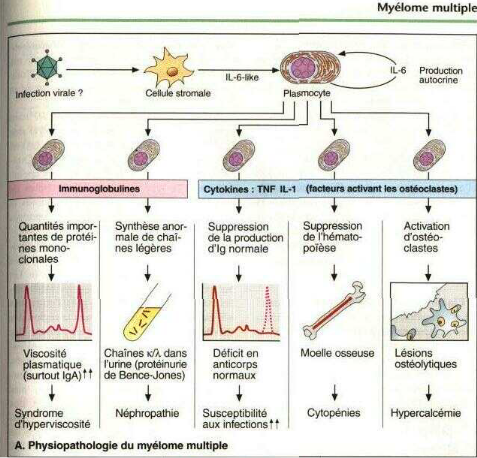
Figure 2 : Physiopathologie du myélome multiple [37].
2.6 - Les différents types de myélome
Le myélome est une maladie très variable selon
le patient : cela signifie à la fois que les malades font face à
des complications très diverses et qu'ils réagissent très
différemment aux traitements. Certaines de ces différences sont
dues aux types et aux sous-types de myélomes existants [36].
La structure particulière de chaque immunoglobuline est
basée sur deux composantes principales : les chaînes lourdes et
les chaînes légères. Ces composantes comportent deux
chaînes lourdes et deux chaînes légères (Figure 3)
[36].
Il existe cinq types possibles de composantes de chaînes
lourdes, caractérisés par les lettres G, A, D, E et M et deux
types possibles de composantes de chaînes légères
caractérisées par les lettres grecques kappa (k) et lambda ()
[37].
Chaque immunoglobuline (ou Ig) ne peut contenir que l'un des
cinq types de chaînes lourdes possibles et l'un des deux types possibles
de chaîne légère [37].
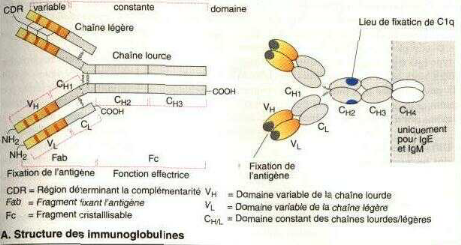
Figure 3: Structure des immunoglobuline [37].
.
La majorité des gens atteints de myélome
(environ. 65 %) souffre d'un myélome dit de type IgG. L'immunoglobine
sécrétée est alors une immunoglobuline de type G (l'une
des cinq chaînes lourdes possibles) alliée à une composante
de chaîne légère kappa ou lambda [36].
Le deuxième type le plus répandu est le
myélome de type IgA allié à des chaînes
légères kappa ou lambda. Les types IgM, IgD et IgE sont tous
assez rares [36].
2.7 - Présentation clinique
Les manifestations cliniques du myélome multiple
viennent principalement de l'atteinte médullaire par les cellules
tumorales et des effets produits par les protéines anormales [41].
Si les douleurs squelettiques constituent un symptôme
d'appel classique du myélome multiple, d'autres manifestations
cliniques, moins évidentes, méritent d'attirer l'attention du
clinicien [41]:
· Nausées, état de déshydratation en
relation avec une hypercalcémie.
· Infections récurrentes liées à un
déficit de production d'anticorps et/ou à une
neutropénie.
· Manifestations hémorragiques par troubles de
l'hémostase primaire (thrombopénie et/ou altérations des
fonctions plaquettaires);
· Symptômes et signes d'anémie.
· Fractures pathologiques.
· Signes d'insuffisance rénale
(néphropathies à chaînes légères, calcique,
urique, amyloïdose).
· Tassements vertébraux avec signes de compression
médullaire (paraplégie);
· Amyloïdose (cardiomyopathie, macroglossie,
syndrome du tunnel carpien);
· Syndrome d'hyperviscosité (troubles visuels,
neurologiques, signes de défaillance cardiovasculaire).
· Découverte fortuite d'une immunoglobuline
monoclonale chez un patient asymptomatique.
Les cytopénies (anémie, neutropénie,
thrombopénie) résultent d'une insuffisance de production
secondaire à l'infiltration plasmocytaire de la moelle
hématopoïétique. L'anémie est souvent en relation
avec le degré d'insuffisance rénale (défaut
d'érythropoïétine). Elle est rarement d'origine immune. En
revanche, on note fréquemment la présence d'une fausse
anémie par expansion du volume plasmatique dont l'intensité est
en rapport direct avec des taux élevés d'immunoglobulines
circulantes [41].
2.8 - Critères de diagnostiques
Des critères de diagnostiques ont été
publiés depuis 1980 dans le but de poser le diagnostic avec plus de
précision (Tableau 1). Une réactualisation de ces critères
a été réalisée en 1990 en y associant l'index de
marquage des plasmocytes et le taux de béta 2 microglobuline , Ceci
permet non seleument de poser le diagnostic avec certitude, mais aussi
d'apprécier le degré de malignité (Tableau 2) [42].
Tableau 1 : Critères de diagnostiques des
myélomes selon le « Southwest Oncology Group» [42 ].
|
Critères majeurs
· 1-Infiltration plasmocytaire de la moelle osseuse
>30%
· 2-Plasmocytome en biopsie
· 3-Présence d'une immunoglobuline monoclonale:
-Sérum: IgG >35 g/l
-IgA >20 g/l
· -Urines: protéines de Bence-Jones
(chaînes légères kappa ou >1 g / 24 h)
|
|
Critères mineurs
· 1-Infiltration plasmocytaire de la moelle osseuse comprise
entre 10 et 30%
· 2-Présence d'une immunoglobuline monoclonale
à un taux inférieur à A3
· 3-Lésions lytiques du squelette
· 4-Diminution des immunoglobulines (<50% des intervalles
de référence):
- IgG <6 g/l
- IgA <1 g/l
- IgM <0,5 g/l
|
Tableau 2 : Nouveaux critères de diagnostiques du
myélome
multiple [43]
|
Gammapathie monoclonale de signification
indéterminée:
· Structure osseuse normale
· Hémoglobine et calcium normaux
· Taux d'immunoglobulines polyclonales normal
· Plasmocytose médullaire inférieure
à 10% ."
· Index de marquage infèrieur à 1%
|
|
Myélome indolent :
· Peu de lésions ostéolytiques
· Pas de fracture osseuse
· Hémoglobine et calcium normaux
· Taux d'immunoglobl'lines polyclonales normal
· Plasmocytose médullaire inférieure
à 20%
· Index de marquage inférieur à 1%
|
2.9 - Démarche de diagnostique
Le myélome multiple est souvent détecté
de façon fortuite, au cours d'un
examen sanguin de
routine.
La principale conséquence du myélome est la
présence d'une très grande quantité d'immunoglobulines
dans le
sang. Ces
immunoglobulines
sont des
protéines, qui
se manifestent par [44]:
· L'élévation de la
vitesse de
sédimentation.
· Une
hyperprotidémie.
· L'électrophorèse des
protéines du
sérum montrant une
paraprotéine
(un pic généralement dans la zone des
gammaglobulines
à l'
électrophorèse
des
protéines du
sérum. En effet,
le myélome est un cancer "tous les
plasmocytes
dérivent d'une même cellule ce sont des
clones", et produisent donc la
même
immunoglobuline, ce
qui explique le pic). L'immunofixation permet de prouver le caractère
monoclonal du pic [44].
Il existe d'autres examens indiqués dans le (Tableau
3) [44].
Tableau 3: Bilan de diagnostique du myélome multiple.
|
· Myélogramme et biopsie de moelle osseuse: le
myélogramme étudie les cellules de la moelle osseuse, à la
recherche d'un excès de plasmocytes.
· Bilan radiologique du squelette (lorsque le patient est
asymptomatique,
au minimum un crâne, une colonne dorsolombaire de
profil, un bassin de face)
· Protéines totales
· Dosages des IgG, IgA et IgM
· Créatinine sérique
· Calcémie
· Recherche d'une protéinurie de Bence-Jones
(chaînes légères)
· Rapport k / urinaire
|
2.10 - Classification
En 1975, la classification de Durie & Salmon [39] a
été proposée (Tableau 4). Cette classification relie les
principaux paramètres cliniques à la masse tumorale (le nombre
total de cellules tumorales dans l'organisme) [38].
La classification de Durie et Salmon est la plus ancienne et
la plus largement utilisée. Elle envisage 3 stades, mais n'a que peu de
valeur pronostique. Une nouvelle classification internationale, ISS
(International Staging System), tient compte aujourd'hui d'un facteur
pronostique, la béta2-microglobuline et du taux d'albumine (Tableau
5).
Tableau 4: Classification à trois niveaux de Durie
& Salmon [39].
|
Stades
|
Critères
|
Nombre de cellules myelomateuses
|
|
Stade I :présence de tous les critères
|
- Immunoglobuline monoclonale
- IgG <50 g/l
- IgA <30 g/l
- Chaînes légères <4 g / 24 h
- 91 lésions osseuses lytiques
- Hémoglobine >100 g/l
- Calcium <3 mmol/l
|
Myélome de faible masse tumorale avec fonctions
rénales normale
<0,6 x 1012 cellules/m2
|
|
Stade II :(intermédiaire entre I et III
|
|
Myélome de masse tumorale intermédiaire
0,6-1,2 x 1012 cellules/m2
|
|
Stade III :présence d'un ou plusieurs critères
|
-Immunoglobuline monoclonale
- IgG >70 g/l
- IgA >50 g/l
- Chaînes légères >12 g / 24 h
- >3 lésions osseuses lytiques
- Hémoglobine <85 g/l
- Calcium >3 mmol/l
|
Myélome de forte masse tumorale avec dysfonctionnement
des
fonctions rénales
>1,2 x 1012 cellules/m2
|
Tableau 5: International Staging System (ISS) [40].
|
Stade
|
Critères
|
|
Stade I :
|
â2- microglobuline sérique < 3,5 mg/dL
et albumine sérique = 3,5 g/dL
|
|
Stade II :
|
Ni stade I ni stade III
Deux possibilités pour le stade II :
â2- microglobuline <3,5 mg/dL, mais albumine
sérique <3,5 g/dL ou
· â2- microglobuline 3,5-5,5 mg/dL sans tenir
compte de l'albumine sérique.
|
|
Stade III :
|
I
II â2-microglobuline sérique > 5,5 mg/dL
|
Tableau 6 : Le taux normal des immunoglobulines dans le
sang [37].

2.12 - Pronostic du myélome
Pour l'ensemble des patients atteints de myélome
multiple, tous stades confondus, la médiane de survie est de 3 ans. Le
pourcentage de patients encore en vie à 10 ans n'est que de 10%. Les
médianes de survie sont respectivement supérieures à 60
mois, de 41 mois et de 23 mois pour les stades I, II et III (Tableau. 4). Les
patients avec insuffisance rénale ont une médiane de survie de 8
mois, contre 37 mois chez les sujets avec une fonction rénale normale
[44].
2.13 - Les stades du myélome
Le myélome est une maladie évolutive et
l'évaluation du stade d'évolution détermine le traitement.
Les critères de diagnostic du myélome reconnus au niveau
international, reposent sur les examens biologiques, le myélogramme et
les radiographies [45].
Ils permettent de poser le diagnostic et d'établir le
stade de la maladie qui déterminera s'il faut traiter ou non.
- Gammapathie monoclonale de signification
indéterminée ou MGUS
Première situation, les examens conduisent au
diagnostic de MGUS :
· pic monoclonal < 30 g/l
·taux de plasmocytes dans la moelle osseuse < 10
%
·aucun signe clinique ou biologique de
myélome.
Dans ce cas, aucun traitement ne sera
proposé. Une simple surveillance en consultation une fois par an est
requise. C'est un état bénin, stable, qui comporte un risque
très faible d'évolution vers le myélome (1% par an). Cette
anomalie peut précéder de plusieurs dizaines d'années
l'apparition du myélome multiple et la majorité des
personnes à ce stade n'auront jamais de myélome [45].
- Myélome asymptomatique
Il correspond au stade I de la classification de Durie &
Salmon [39]. Ce stade, appelé aussi myélome
« indolent » ou « latent », ne
nécessite pas de traitement mais une surveillance des paramètres
qui ont permis le diagnostic : les examens cliniques, avec des consultations
à la recherche d'éléments nouveaux, des examens
biologiques sanguins et urinaires tous les 3-4 mois (hémogramme,
créatinine, calcémie, électrophorèse), et un bilan
radiologique osseux une fois par an. En effet, le risque d'évolution
vers un myélome multiple est plus important que lorsqu'il s'agit d'une
simple gammapathie monoclonale. Le délai vers un stade symptomatique est
de 2 ans en moyenne. Il n'existe aujourd'hui aucun argument pour traiter un
myélome asymptomatique [45].
- Myélome symptomatique
L'existence des symptômes, atteinte du tissu
osseux, anémie, hypercalcémie, ou insuffisance
rénale, impose un traitement spécifique. Les myélomes
symptomatiques correspondent aux stades II et III de la classification de Durie
& Salmon [39]. Ils sont évolutifs et doivent être
traités. De nombreux traitements sont aujourd'hui disponibles qui
tiennent compte de l'âge du malade et des facteurs de gravité de
sa maladie [45].
2.13 - Traitement du myélome multiple
Le but du traitement du myélome est de contrôler
son évolution, d'obtenir une rémission, d'améliorer la
qualité de vie et d'allonger l'espérance de vie [46].
Le traitement du myélome s'est appuyé pendant
plusieurs années sur la chimiothérapie classique.
Les principaux progrès observés ces 15
dernières années dans le traitement de myélome multiple
proviennent essentiellement des traitements intensifs (Tableau 8) et en
particulier de l'autogreffe de cellules souches
hématopoïétiques [46].
-La chimiothérapie
La mono chimiothérapie utilise l'association
séquentielle de melphalan à
Faible dose de 0,25 mg / kg et de prednisone 2 mg /kg par jour
pendant 4 jours, Elle entraîne des remissions chez 40% des malades. Ces
rémissions durent 2 à 3 ans (Tableau 6) [46, 47].
La chimiothérapie intensive utilise le Melphalan
à hautes doses en intraveineuse
En injection unique. Elle permet d'obtenir un taux
élevé de réponses complètes, mais cette
rémission est de courte durée [48].
Tableau 6: Les différentes options thérapeutiques
classiques [48] .
|
1. Chimiothérapie
2. Chimiothérapie intensive avec greffe
3. Irradiation
4. Traitement d'entretien (interféron alpha)
5. Traitement de soutien :
· Érythropoiétine
·
Antidouleur
· Bisphosphonates
· Facteurs de croissance
· Antibiotiques
·
· Antalgiques
· Traitement d'urgence (dialyse,
plasmaphérèse, chirurgie)
|
Tableau 7 : les médicaments les plus fréquemment
utilisés [49].
|
Nom
|
Autre Dénomination
|
Commentaires
|
|
Melphalan
(M)
|
Alkéran
(oral ou intraveineuse)
|
|
|
Cyclophosphamide
(C or CY)
|
Cytoxan
(oral ou intraveineuse))
|
Efficacité similaire au myélome, toxicité
gastro-intestinale supérieure, mais moindre
toxicité pour les cellules
souches médullaires
|
|
Thalidomide
(T)
|
Thalomid
(oral)
|
Elle entraîne une diminution du nombre de plasmocytes et
une augmentation du taux d'hémoglobine chez 78% des malades.
|
Tableau 8 : Traitements intensifs [49].
|
Types
|
Avantages
|
Inconvénients
|
|
Simple
autogreffe
|
· 50% d'excellente rémission
· Supérieure aux traitements
conventionnels en terme de
réponse et survie pour les
patients de moins de 60 ans.
|
Taux de rechute identiques à
ceux des traitements conventionnels.
· Toxicité et coût plus importants.
.
|
|
Double
autogreffe
|
Identiques à ceux de la
simple autogreffe
· des études montre un
avantage de survie pour les
patients ne présentant pas
une réponse complète après
une greffe.
|
· Bénéfice non confirmé pour
l'ensemble des patients.
· Plus toxique et plus chère
|
|
Greffe
allogénique
standard
|
· Pas de risque de contamination
du greffon par des cellules
malignes.
· Possible effet « greffon contre
myélome ».
|
· Risque important de complications,
voire de décès (25-30%)
· Limite d'âge (< 55 ans).
· Plus toxique et plus chère que
l'autogreffe.
|
3-Matériel et méthodes
3.1-Les malades
Notre étude a porté sur 16 malades qui ont
été hospitalisés dans différents services du CHU
d'Oran .
L'étude statistique à porté sur 291
patients (H/F : 127/164) d'un âge moyen de 55 ans atteints d'un
myélome durant la période de février 2006 à mars
2010 au niveau de différents services du CHU d'Oran.
3.2- Prélèvement du sang
Les prélèvements sanguins sont realisés
après 12 heures de jeûnes par ponction veineuse sur tube sec.
La ponction veineuse permettant un prélèvement
de sang est un acte quotidien indispensable pour rechercher une anomalie
sanguine. Nous avons réalisé les étapes suivantes
comme l'indique la Figure 4:
· Demander au patient de s'assoir le bras reposant sur
une surface dure jamais debout (car risque de malaise).
· Se laver les mains soigneusement et mettre des gants
par précaution.
· Chercher la veine du plie du coude la plus visible et
la plus palpable, une fois trouvée appliquer le garrot en le serrant
modérément environ 10 cm au dessus du point de ponction et ceci
pour faire gonfler la veine .
· Désinfecter l'endroit de la ponction veineuse
à l'aide d'un coton alcoolisé .
· Tenir l'aiguille avec un ongle de 30°, la faire
pénétrer dans la veine .
· Remplir la seringue d'environ 5 ml du sang.
· Desserrer le garrot, faire sortir l'aiguille du point
de ponction .
· Mettre le sang prélevé dans un tube a
heparine .
· Mettre du coton sec au niveau du point de ponction et
demander au patient de plier le bras pour que l'écoulement du sang
s'arrête, puis lui mettre du pansement.

Figure 4: Les étapes du prélevements sanguin
3.3 - Centrifugation du sang et obtention du
sérum
La centrifugation est une technique qui utilise le principe de
la force centrifuge pour séparer les composants du sang.
Le sang des malades est centrifugé à une vitesse
de 1200g pendant 15 minutes dans des tubes à centrifugation (Figure
5).
Après centrifugation le surnageant (le sérum)
est récupéré dans de nouveaux tubes.
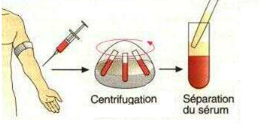
Figure 5: Centrifugation du sang et obtention du
sérum.
3.4 - Electrophorèse des protéines
sériques
L'électrophorèse des protéines
sériques permet la séparation des constituants d'un
mélange protéique sous l'action d'un champ électrique. Et
de diagnostiquer une production anormale de protéines et de
préciser quel type d'immunoglobuline est concerné.
Pour effectuer la technique
d'électrophorèse des proteines sériques nous avons
réalisé les étapes suivantes (Figure 6) :
· Mettre à tremper le gel d'acétate de
cellulose dans le
tampon
d'électrophorèse (tampon Tris-barbital pH 8,8) pendant 10
à 20 minutes.
· Eliminer l'excès de tampon en plaçant le
gel d'acétate de cellulose entre deux feuilles de papier absorbant .
· Remplir les deux compartiments de la cuve avec un
même volume de tampon d'électrophorèse.
· Couper deux bandelettes de forme rectangulaire du
papier buvard qui sérviront à fixer le gel d'acétate de
cellulose et aider la migration du tampon.
· Prélever les échantillons du sérum
à l'aide d'un applicateur qui porte huits cavaliers (chaque cavalier
correspond à un patient) et les déposer sur le gel.
· Placer le gel d'acétate de cellulose sur le
portoir d'appareil d'électrophorèse en veillant à disposer
la face absorbante vers le haut.
· Déposer les deux bandelettes
préalablement préparées aux extrémités de
chaque bande d'acétate de cellulose.
· Fermer la cuve et mettre sous tension (environ 30 mn
de migration à 190 V).
· Après migration, le gel est coloré au
rouge ponceau pendant 5mn [Le rouge ponceau reconnu pour sa fixation
linéaire sur les protéines en fonction de leur concentration.
Mais son affinité est différente vis à vis de l'albumine
et des globulines (plus faible)], puis lavé et décoloré
dans des bains successifs d'acide acétique à 5 % pendant 10
minutes.
· Le gel de cellulose est transparaisse dans une
solution: méthanol/acide acétique/diacétone alcool
(70/20/10, v/v/v), la transparisation est achevée par un séchage
à l'étuve à 80°C pendant 5 mn. Le gel est ensuite lu
au densitomètre.


Trempage
Essorage


Gel dans la cuve Migration


Coloration en rouge ponceau Décoloration
Figure 6: Les étapes de la technique
d'électrophorèse des proteines sériques.
3.5 - La lecture au densitomètre
Le densitomètre est un système de lecture
automatique qui mesure le résultat de la migration. Il donne un profil
sous forme de pics obtenus en fonction de l'intensité de la coloration
et de la longueur de la bande : ce profil est appelé
électrophorégramme.
3.6 - Etude statistique
Cette étude est réalisée à partir
du registre des archives. Nous avons fait une étude
rétrospective portant sur 291 dossiers de malades hospitalisés
dans le centre hospitalo-universitaire d'Oran pour la période allant de
février 2006 à mars 2010.
La répartition a été effectuée
selon l'âge et le sexe des malades atteints du myélome.
4- Résultats
4.1 -Centrifugation du sang
La Figure 7 montre un exemple de résultat obtenu
après centrifugation du sang. Nous pouvons observé 2 phases, un
surnageant jaunâtre (le plasma) et un culot d'hématies.

Figure7: Les différentes fractions du sang obtenues
après centrifugation.
4.2 -Electrophorèse
Les résultats sont a la fois qualitatifs (courbe
d'intégration ) et semi-quantitatifs (pourcentage que représente
chaque bande par rapport à l'ensemble des proteines de
l'échantillon ) .
Après migration et révélation de la
plaque d'acetate de cellulose nous avons obsérvé 6 bandes
nettement séparées. Ces bandes correspendes aux
différentes fractions : l'Albumine et les globulines 1, 2, 1, 2, et
globuline comme indique la Figure 8.
La présence d'une immunoglobuline monoclonale (cas de
myélome) se traduit par la présence d'une bande dense comme
montre la Figure 8.
La lecture densitométrique nous a permis d'observer le
résultat montré dans la Figure 9. Nous pouvons constaté la
présence d'un pic monoclonal au niveau des gammaglobulines indiquant un
éventuel myélome. Le type de myélome peut être
confirmer par immunofixation.
Bande dense


Figure 8:Apparition d'une bande dense après
migration.
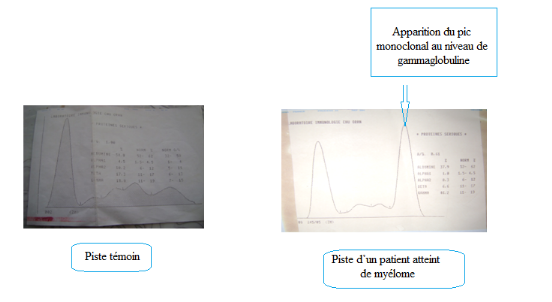
Figure 9: Apparition du pic monoclonal au niveau des
gammaglobulines.
4.3- Données relatives aux archives
Comme décrit dans la partie matérielle et
méthodes, cette étude à été
réalisée à partir du registre des archives des malades
atteints du myélome selon l'âge et le sexe.
Nous exposons les résultats selon les tranches
d'âges et le sexe sur un total de 291 malades:
Tableau 8:Description de la population
|
Nombre
|
Age min
|
Age max
|
Age Moyen
|
|
HOMME
|
127
|
22
|
83
|
53#177;
|
|
FEMME
|
164
|
19
|
85
|
58#177;
|
- Fréquence de la pathologie selon le sexe (Tableau
3) :
Sur la population totale étudiée (N=291), on
note une fréquence de cette pathologie plus élevées chez
les femmes (N=164) par rapport aux hommes (N=127)
Tableau 9:Fréquence de la pathologie selon le sexe
|
Sexe
|
Nombre
|
Fréquence (%)
|
|
HOMME
|
127
|
43%
|
|
FEMME
|
164
|
57%
|
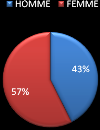
Figure 10: Fréquence de la pathologie selon le sexe
- Fréquence selon l'âge des hommes (Tableau
10) :
On note que la pathologie touche surtout la tranche
d'âge > 60 ans alors que le nombre de cas recensés chez les
plus jeunes est le plus faible (figure 11). De plus, on note que le nombre de
cas chez les hommes corrélé positivement avec l'âge.
Tableau 10:Fréquence de la pathologie chez les hommes
selon les tranches d'âges
|
Hommes
|
|
Tranches d'âges
|
Nombre
|
Fréquence (%)
|
|
< 40 ans
|
8
|
6%
|
|
40-49 ans
|
20
|
15%
|
|
50-59 ans
|
46
|
36%
|
|
= 60 ans
|
53
|
41%
|
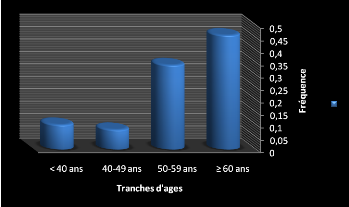
Figure 11: Fréquence de la pathologie chez les hommes
selon les tranches d'âges.
- Fréquence selon l'âge des Femmes (Tableau
11) :
On note que la pathologie touche surtout la tranche
d'âge > 60 ans alors que le nombre de cas recensés chez les
plus jeunes est le plus faible (figure 12). De plus, on note que le nombre de
cas chez les hommes corrélé positivement avec l'âge.
Tableau 11 : Fréquence de la pathologie chez les femmes
selon les tranches d'âges.
|
Femmes
|
|
Tranches d'âges
|
Nombre
|
Fréquence (%)
|
|
< 40 ans
|
18
|
1%
|
|
40-49 ans
|
14
|
8%
|
|
50-59 ans
|
56
|
34%
|
|
= 60 ans
|
76
|
46%
|
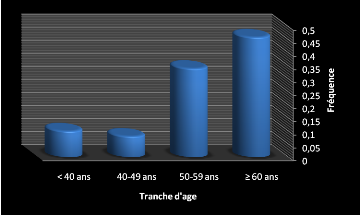
Figure 12: Fréquence de la pathologie chez les femmes
selon les tranches d'âge
- Comparaison fréquence de la pathologie chez les
hommes et les femmes selon les tranches d'âges (Tableau 12) :
Excepté la tranche d'âge 40-49 ans ce sont les
hommes qui sont plus touchées par cette pathologie comme le montre les
fréquences et sexe ratio est inferieur à 1 obtenu dans cette
étude.
Tableau 12 : Comparaison fréquence de la pathologie chez
les hommes et les femmes selon les tranches d'âges.
|
Fréquence (%)
|
|
|
Tranches d'âges
|
Hommes
|
Femmes
|
Sexe ratio
|
|
< 40 ans
|
(6%)
|
1%
|
0,44
|
|
40-49 ans
|
15%
|
8%
|
1,42
|
|
50-59 ans
|
36%
|
34%
|
0,82
|
|
= 60 ans
|
41%
|
46%
|
0,69
|
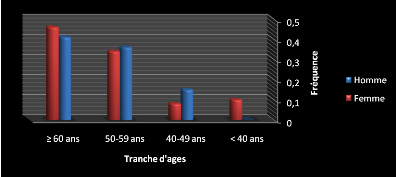
Figure 13 : Comparaison fréquence de la pathologie chez
les hommes et les femmes selon les tranches d'âges.
- Le nombre de cas par année et leur
fréquence :
Le nombre de nouveaux cas de maladie de Myélome
multiple est en nette progression depuit 2006 au 2OO9 Tableau 13.
Tableau 13 :Le nombre de cas par année et leur
fréquence .
|
Année
|
Le nombres des cas
|
Fréquence (%)
|
|
2006
|
31
|
18%
|
|
2007
|
37
|
45%
|
|
2008
|
91
|
68%
|
|
2009
|
102
|
21%
|
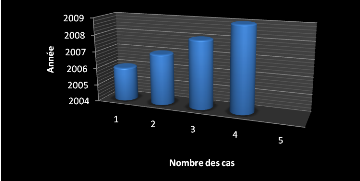
Figure14 :Le nombre de cas par année et leur
fréquence.
5- Discussion
Au plan mondial, l'incidence du myélome multiple est
estimée à 2,8/100000/ an pour les hommes et 2,1/ 100000/an pour
les femmes [12].
En Europe, l'incidence atteint 4,1/ 1 00000/an pour les hommes
et 2,7/100000/an pour les femmes [21]. Cependant une étude
effectuée en 1993 par l'I.A.R.C (International Agency Recherch of Cancer
) révèle que depuis 1984 il y a une légère
augmentation de l'incidence du myélome qui varie selon les pays entre
3,1 et 9,5/ 1 00000/an pour les hommes et entre 2,7 et 7 /100000/ an pour les
femmes [40].
Aux U.S.A, l'incidence atteint un taux de 2 à 4
/100000/ an dans la race blanche alors qu'elle est plus élevée 7
à 8 / 100000 an dans la race noire [21]. Il est retrouvé
également une augmentation de l'incidence entre 1960 et 1980. Cette
période correspond à l'introduction dans l'industrie de
substances chimiques reconnues comme facteurs de risque de myélome
multiple [15].
En Asie par contre, le myélome est moins
fréquent avec une incidence de l'ordre de 1,5/ l00000 / an au Japon, en
Chine et en Inde[12].
En Algérie, l'incidence du myélome a
été évaluée à 1,1/100 000 habitants par an
et lors d'une mise à jour récente(2007) l'incidence a
été de 1.6. L'âge médian de l'atteinte était
62 ans (25- 85 ans) contre70 ans en France [40] .
L'incidence national telle que rapporté (1/100 000
habitants par an ) [40] est inférieure à celle observé
dans le monde. Cette maladie touche une tranche de population plus jeune par
rapport a ce qui a été décrit dans les pays occidentaux
car la population algérienne est jeune. 9% des patients de cette
enquête avait moins de 40 ans contre seulement 3% en Europe et 16% au
Maroc.
Dans l'étude que nous avons éffectué, il
a été constaté que la population féminine est
nettement supérieure à la population masculine, ce qui est
contraire au constat réalisé dans les continents et pays
listés ci-dessus. Aussi, le nombre de sujets atteints dans la
région d'Oran est d'après les statistiques receuillis entre 2006
et 2009 est en augmentation progressive.
6-Conclusion
Nous présentons à travers notre travail, une
recherche et détection du myélome multiple dans l'ouest
algérien . Cette recherche a porté dans un premier temps sur une
étude d'un échantillon choisi de manière aléatoire
qui a montré que sur les 16 malades: deux patients uniquement
présentaient un pic monoclonal. Ces résultats pouraient cependant
être confirmés par la technique d'immunofixation.
Notre études à porté sur 164 femmes et
127 hommes d'âge moyen de 55ans . avec une nette prédominance
féminine . L'ensemble de ces malades tous originaires de la wilaya
d'Oran et de ses environs sont atteint de myélomes.
Le myélome est une maladie relativement rare, et les
études d'autant plus difficiles et longues, si bien qu'aujourd'hui on
est incapable de dire pourquoi telle personne va déclencher un
myélome. Même les études réalisées parmi les
nombreux patients qui présentent un pic monoclonal, facteur
prédisposant au myélome multiple, n'ont pu identifier de cause
à l'apparition d'une telle affection.
7- Référence bibliographique
[1] LUNDBERG 1., MlLATOU SMITH R. Mortality and cancer
incidence among Swedish paint industry workers with, long-term exposure to
organic solvents ' .Scandinavian journal of work, Environment and health
1998.
[2] ZULLIAN GB., BABARE R., ZAGONEL V., MONFARDINI S. Multiple
myeloma,Critical review in oncology/haematology.Guidelines for management of
cancer in the elderly 1998.
[3] AGU VU., CHRISTENSEN BL., BUFFLER PA. Geographie patterns
of multiple myeloma : racial and industrial correlates, State ofTexas,
1969-1971. J. Natl. Cancer 1980.
[4] AGU VU., CHRISTENSEN BL., BUFFLER PA. Geographie patterns
of multiple myeloma : racial and industrial correlates, State ofTexas,
1969-1971. J. Natl. Cancer 1980.
[4] GROGAN L. PLASMA CELL NEOPLASMS. In: Jaffe ES, Harris NL,
Stein H, Vardiman JW (eds.). Pathology & Genetics.. Lyon: IARC Press;
2001.
[5] GAHRTON G, DURIE BGM, SAMSON DM. Multiple Myeloma and
Related Disorders. Oxford University Press 2004.
[6] BERENSON JAMES R. Biology and Management of Multiple
Myeloma. Humana Press. 2004.
[7] SANKALE M., FRAMENT V., DIOUf S.La maladie de KAHLER dans
un service de médecine générale 1999 .
[8] OSSENT JC., WINKEL CN. Multiple myeloma in the
Afro-Caribbean population of Curacao Netherlands journal of medicine 1993 .
[9] Kyle RA. History of multiple myeloma. In: Neoplastic
Diseases of the Blood, 3rd edition.
[10] CARLEBACH M., AMIEL A. M. Multiple myeloma: monoallelic
deletions ofthe tumor suppressor genes TP 53 and RB1 in long-term follow-up.
Cancer genetics and cytogenetics 2000.
[11] BERENSON JAMES R. New Advances in the Biology and
Treatment of Myeloma Bone Disease Seminars in Hematology 2001 .
[12] CARTWRIGHT R. A., GILMAN E. A., NICHOLSON P., ALLON D.
Epidemiology of multiple myeloma in parts of England, 1984-1993 Haematological
Oncology 1999.
[13] HUREZ D. Epidémiologie des gammapathies
monoclonales .Revue du praticien 1993 .
[14] AVET-LOISEAU H., 14q32 translocations and monosomy 13
observed in monoclonal gammapathy of multiple myeloma. Intergroupe Francophone
du Myélome. Cancer Res. 1999 .
[15] HUREZ D. Epidémiologie des gammapathies
monoclonales . Revue du praticien 1993.
[16] BERGSAGEL P. L.Translocations 14q32 : trace d'un
événement oncogènique critique? : in va Workshop
international 'sur le myélome multiple Publications Med. Inter. 1995
.
[17] HAROUSEAU IL. Myélomes: physiopathologie,
diagnostic, principes du traitement Revue du praticien 1992 .
[18] BATAILLE R. 14q32 translocations and monosomy 13 Cancer
Res. 1999 .
[19] OWEN RG., DAVIS SAA .MORGAN GJ. p53 gene mutations in
multiple myeloma Molecular pathology 1997 .
[20] LOTH TS., PEROTA AL., Genetics aspects of familial
multiple myeloma Military medicine 1991.
[21] HOET P.LAUWERYS R.Cancers du système lymphatique et
hématopoïétique ( leucémies, lymphomes,
myélomes multiples) d'origine toxique professionnelle.Synthèse
des données épidémiologiques 1995 .
[22] LUNDBERG R.Mortality and cancer incidence among Swedish
paint industry workers withlong-term exposure to organic solvents 'Scandinavian
journal of work, environment and health 1998.
[23] BROWN LM., EVERETT GDHair dye use and multiple myeloma in
white men Americanjournal ofpublic health 1992 .
[24] CORREA A., JACKSON L., MOHAN Use ofhair dyes,
haematopoietic neoplasm, and lymphomas : a literature review. II. Lymphomas and
multiple myeloma Cancer investigations 2000.
[25] BOULANGER E. L'herpès virus humain 8 (HHV8).
Rôle pathogène et sensibilité aux antiviraux Annales de
biologie clinique 1999.
[26] HJAlGRIM H., FRISCH M., MELBYE M. Incidence rates of
Kaposi's sarcoma and multiple myeloma do not correlate British journal ofcancer
1998
.
[27] ZOURE D. Le myélome multiple à propos de 28
observations colligées à l'Hôpital Principal de Dakar
Thèse Médecine Dakar 1989 .
[28] DELMER A. Myélomes: physiopathoiogie, diagnostic,
traitement Impact internat 1996 .
[29] HAROUSEAU IL. Myélomes: physiopathologie,
diagnostic, principes du traitement Revue du praticien 1992 .
[30] BATAILLE R., KLEIN B. Role of interleukin-6 in multiple
myeloma
Ann. Med. Interne 1992 .
[31] Audrey Baur Chauberta, Françoise
Delacrétaza. Das Multiple Myelom , Schweiz Med Forum 2005.
[32] DURlE B. G. M.The Epidemiology, of Multiple myeloma
Seminars in Hematology 2001 .
[33] KLEIN B., BATAILLE R. Interleukine 6 et myélome
multiple chez l'homme Médecine - sciences 1991 .
[34] L PERLEMUTER , A CENAC .dictionnaire pratique de
médecine clinique .2ème Edition .MASSON.1982.
[35] NOELLE GENETET .Immunologie.4ème
edition .faure .1997.
[36] DURlE B. G. M.The Epidemiology, of Multiple myeloma
Seminars in Hematology 2001 .
[37] GREIPP PR, DURIE, BGM, ET. AL. International Staging
System for multiple myeloma. J Clin Oncol. 2005.
[38] GREIPP PR, DURIE, BGM, ET. AL. International Staging
System for multiple myeloma. J Clin Oncol. 2005.
[39] G, DURIE BGM, ET. al. Multiple Myeloma and Related
Disorders, The role of imaging in myeloma.Arnold 2004.
[40] AUDREY BAUR CHAUBERTA, FRANÇOISE DELACRETAZA. Das
Multiple Myelom , Schweiz Med Forum 2005.
[41] BATAILLE R.Plasmocytomes humains. étude clinique,
diagnostic et prognostic Encycl. Med. Chir. (Paris - France),
Hématologie, 1994.
[42] ZULIAN GB.Myélome multiple. quand et comment
faut-il traiter? Médecine et hygiène 1991.
[43] AUDREY BAUR CHAUBERTA, FRANÇOISE DELACRETAZA.Das
Multiple Myelom , Schweiz Med Forum 2005.
[44] KYLE RA, RAJKUMAR SV. Monoclonal gammopathies of
undetermined
significance. Rev Clin Exp Hematol 2002.
[45] DURlE B. G. M.The Epidemiology, of Multiple
myelomaSeminars in Hematology 2001 .
[46] FACONT.Traitement conventionnel du myélome
multiple .La revue de médecine interne 1999 .
[47] BATAlLLE R.Myélome multiple: traitements
symptomatiques et antitumoraux Encycl. Med. Chïr. (Elsevier, Paris),
Hématologie.
[48] GAHRTON G, ET AL. Allogeneic bone marrow
transplantation in multiple myeloma. Br J Haematol 1996.
[49] MALONEY DG, SAHEBI F, STOCKERL-GOLDSTEIN KE, ET AL.
Combining an allogeneic graft-vs.-myeloma effect withhigh-dose autologous
stem cell rescue in the treatment of multiple myeloma Blood 2001.
| 


