|
UNIVERSITE
TECHNOLOGIQUE BEL CAMPUS

FACULTE DE MEDECINE
ULCERE DE BURULI DANS LA PROVINCE DU MANIEMA.
Etude Exploratoire menée
De Mars en Avril 2010
Année Académique 2003 - 2004
?
Travail de fin d'études présenté
en vue l'obtention de grade de docteur en médecine chirurgie et
accouchement
Directeur : Professeur Anatole KIBADI KAPAY
(MD, PhD, Chirurgien Plasticien)
JEROME MUNYANGI WA
NKOLA
Gradué en sciences
Biomédicales
Année Académique
2011-2012
PLAN DU TRAVAIL
Epigraphe
Dédicace
Remerciements
Table des matières
Liste des abréviations
Introduction
Chapitre I : Généralités
Chapitre II : Matériels et Méthodes
Chapitre III : Résultats et Discussion
Conclusions et Recommandations
Bibliographie
EPIGRAPHE
La parole ne vient qu'avec la connaissance. Acquiers la
connaissance, et tu posséderas la parole.
Lumière sur le sentier.
DEDICACE
A Papa Godefroid MUSENGE NKOLA et Maman Christine BAHATI
MUNYANGI ceci est le résultat de vos efforts et sacrifices.
A nos parents Fabien BWETHA NKOLA et Sidonie SIFA WABENIA.
Au Dr TIENDREBEOGO Alexandre, Médecin LEP et MTN/OMS
c'est grâce à votre confiance en moi que l'OMS nous a
confié cette mission.
A toute la famille NKOLA.
A toutes les victimes de l'Ulcère de Buruli,
Nous dédions ce travail.
REMERCIEMENTS
Cette oeuvre est le fruit de l'apport des uns et des autres,
apport que nous tenons ici à saluer.
Nos remerciements s'adressent en premier lieu à la
Toute Puissante Présence de Dieu et l'Etre Incréé ainsi
que toute sa hiérarchie.
En second lieu nous remercions très sincèrement
les autorités de l'Université Technologique Bel
Campus(UTBC) ; particulièrement à Président Fondateur
et Président du Conseil d'Administration qui m'a donné des
grandes responsabilités des recherches pendant mon cursus
académiques.
Nos sincères remerciements à l'Initiative
Mondiale de lutte contre l'ulcère de Buruli (GBUI) à
Genève pour avoir disponibilisé les moyens financiers nous
permettant de réaliser cette étude
Nous tenons à remercier le sous bureau de l'OMS
à Kindu et les membres de l'équipe provinciale de la santé
qui nous fourni l'appui logistique et matériel pour la
réalisation de la mission dans les zones de santé
Nos remerciements s'adressent aussi :
· Aux membres des équipes des zones de
santé visitées pour leur collaboration et soutien
· Les agents de santé dans les centres de
santé qui nous ont accompagné et assurent la prise en charge des
cas détectés
· Aux Autorités politiques, administratives,
religieuses et traditionnelles qui nous ont accueillis, soutenus et
appuyés dans les différentes activités
· Aux directeurs des écoles et enseignants dans
les villages visités qui ont autorisés l'accès aux salles
de classes
· Aux techniciens des différents média qui
nous ont facilité la tâche de sensibilisation et de diffusion du
calendrier des visites dans les villages
· Aux communautés visitées qui ont
accepté notre intrusion dans leurs sociétés
· Aux cas suspects qui se sont présentés et
se sont soumis à notre examen
Nous remercions également le Professeur Docteur Anatole
KIBADI KAPAY, directeur de ce mémoire, votre façon de faire et
amour pour les patients touchés par cette maladie négligée
ont aiguisé mon esprit de recherche.
A toute l'équipe de l'IMT/Anvers
particulièrement à Suykerbuyk Patrick qui m'a initié dans
les recherches de terrain sur l'ulcère de Buruli ; au Dr Phanzu
Delphin qui a accepté de nous recevoir et apprendre.
Au Dr SINGA Jackie, Directrice du Programme National de Lutte
Contre l'Ulcère de Buruli pour votre confiance et le fait d'avoir
accepté mon intrusion au programme.
A tous nos compagnes et compagnons de lutte
et tous ceux qui de près ou de loin ont pu contribuer à notre
cursus académique en médecine nous vous remercions.
ABREVIATIONS UTILISEES DANS
CE MEMOIRE
Ø UB = Ulcère de Buruli
Ø OMS = Organisation Mondiale de la Santé
(Abreviation internationale : WHO, World Health
Organization)
Ø NTD = Neglicted Tropical Disease
Ø GBUI = Global Buruli Ulcer Initiative
Ø BAAR = Bacille Acido-Alcoolo-Résistant
Ø POD = Prevention Of Disabilities (Prévention
des Incapacités
Ø M.ulcerans= Mycobacerium ulcerans
TABLE DES MATIERES
PLAN DU TRAVAIL
I
EPIGRAPHE
II
DEDICACE
III
REMERCIEMENTS
IV
ABREVIATIONS UTILISEES DANS CE MEMOIRE
VI
TABLE DES MATIERES.
VII
I. INTRODUCTION
1
II. OBJECTIFS
2
II.1 GENERAL
2
II.2. SPECIFIQUES
2
CHAPITRE I : GENERALITES
3
I.1.HISTORIQUE
3
I.2.EPIDEMIOLOGIE
4
I.2.1. REPARTITION MONDIALE
4
I.2.2.FACTEURS ENVIRONNEMENTAUX
8
I.2.3.AGE ET SEXE DES PATIENTS
8
I.3.BACTERIOLOGIE
9
I.4.IMMUNOPATHOLOGIE
10
I.5.TRANSMISSION
11
I.6.PHYSIOPATHOLOGIE
12
I.6.1.PHASE PRE-ULCERATIVE
12
1.6.2. PHASE ULCERATIVE OU GUERISON
13
I.7. DIAGNOSTIC
15
I.7.1.CLINIQUE
15
I.7.2 .DIAGNOSTIC DIFFERENTIEL DE L'ULCERE DE
BURULI :
19
I.7.3. BACTERIOLOGIQUE
21
I.8. TRAITEMENT
23
I.8.1.ANTIBIOTHERAPIE
23
I.8.2. CHIRURGIE
25
I.8.3. PREVENTION DES INCAPACITES
25
CHAPITRE II : MATERIEL ET METHODES
26
II.1.MATERIEL
26
II.1.1. CADRE ET PERIODE D'ETUDE
26
II.1.2. POPULATIONS
26
II.2.METHODES
26
II.2.1. NATURE D'ETUDE
26
II.2.2. COLLECTE DES DONNEES.
26
CHAPITRE III. RESULTATS ET DISCUSSION
27
CONCLUSION ET RECOMMANDATIONS
31
CONCLUSION
31
RECOMMANDATIONS
31
BIBLIOGRAPHIE
32
I. INTRODUCTION
L'Ulcère de Buruli est une maladie infectieuse
chronique cutanée, dont l'agent pathogène est une
mycobactérie environnementale, Mycobacterium ulcerans.
Elle est endémique dans plus de 30 pays dans le monde.
L'Afrique est le continent le plus affecté avec 14 pays
endémiques confirmés (Bénin, Cameroun, Centrafrique,
Congo, Côte d'Ivoire, Gabon, Ghana, Guinée, Guinée
Equatoriale, Nigeria, Ouganda, RD Congo, Soudan et Togo) et 9 pays
endémiques suspects (Angola, Burkina Faso, Liberia, Malawi, Mali, Sierra
Leone, Tanzanie, Tchad et Zambie).
Rarement mortelle, la maladie est un véritable
fléau par ses conséquences délabrantes sur la peau et les
tissus mous, d'où un retentissement fonctionnel et social, à
l'origine d'un handicap majeur.
Son diagnostic mérite donc d'être mieux connu et
plus précoce afin d'instaurer au plus vite un traitement
médico-chirurgical et éviter la survenue de ces
morbidités.
L'Ulcère de Buruli est peu connu du milieu
médical, mais n'en est pas moins fréquent et connaît
même une recrudescence inquiétante depuis quelques années
avec une extension des zones d'endémie et une multiplication des cas.
Les recherches et les actions tant à but diagnostic que
thérapeutique sur le terrain restent au degré mondial très
marginales, handicapées par le manque de médiatisation de cette
infection qui touche pourtant dans certaines régions plus de sujets que
la tuberculose.
Ce mémoire vise, à évaluer l'ampleur du
problème dans cette province en vue de proposer des mesures de lutte si
nécessaires.
II. OBJECTIFS
II.1 GENERAL
Evaluer l'ampleur de l'UB dans la province du Maniema.
II.2. SPECIFIQUES
- Rechercher des cas suspects récents d'UB dans les
villages d'origine des cas rapportés par le MIP du Maniema
- Confirmer par examen clinique et examen de labo (ZN et PCR)
les cas suspects retrouvés dans les villages.
CHAPITRE I : GENERALITES
I.1.HISTORIQUE
L'Ulcère de Buruli (UB) est décrit pour la
première fois en 1897 par un médecin britannique, Sir Albert
Cook. Travaillant à l'hôpital Mengo à Kampala (Ouganda), il
décrit plusieurs cas d'ulcères cutanés compatibles avec ce
que l'on connaît actuellement de l'Ulcère de Buruli (1).
En 1940, le professeur australien Peter MacCallum et ses
collègues sont les premiers scientifiques à isoler l'agent
causal, Mycobacterium ulcerans, dans une biopsie
prélevée à partir d'un ulcère de la jambe chez un
enfant de Bairnsdale, près de Melbourne. Ils découvrent donc que
la maladie est de nature infectieuse et que l'agent pathogène est une
bactérie acido-alcoolo-résistante. Ils isolent l'UB pour la
première fois comme entité nosologique et décrivent en
détail la maladie chez six patients originaires de la région de
Bairnsdale (dans le sud de l'Australie, la maladie est toujours appelée
ulcère de Bairnsdale). (1).
Dans les années 60, de nombreux cas se produisent dans
le Comté de Buruli (aujourd'hui le district de Nakasongola) en Ouganda,
près du lac Kyoga. Le Groupe Ougandais de Buruli étudie de
manière approfondie les aspects clinicopathologiques et
épidémiologiques de la maladie - d'où le nom le plus
couramment utilisé pour la maladie.(2).
1998 : implication de l'OMS dans la lutte contre l'UB
grâce à la mise en place d'une stratégie de lutte
spécifique à la maladie : GBUI (Global Buruli Ulcer
Initiative), lors de la Conférence de Yamoussoukro (Côte
d'Ivoire, juillet 1998).(3).
En RDC, le premier cas publié est celui décrit
en 1950 par Van Oye et Baillon chez un enfant Américain de la
région de Kwilu. En 1959 un nouveau foyer est découvert à
Kasongo par Janssens et all.
Suite aux travaux de ces mêmes auteurs les nouveaux
foyers furent découverts ; le foyer de Kimpese et ses environs.(4)
En 2001 un programme de lutte contre l'UB a été mis en
place, et au cours de cette année, une enquête conduite en 2004 a
montré la présence de cas suspects d'UB dans cinq des 11
provinces du pays. Mais 3 provinces sont considérées comme
endémiques (Bas-Congo, Bandundu et Maniema) (5).L'Institut
Médical Evangélique de Kimpese, le Centre Mère Teresa de
Kinshasa et l'unité de Chirurgie Plastique Reconstructive et
Esthétique, Chirurgie de la Main et Brulologie Cliniques Universitaires
de Kinshasa servent de centres de référence pour la prise en
charge médico-chirurgicale des cas d'UB.(5).
Une intégration de la prise en charge des cas d'UB au
niveau périphérique est organisée dans les ZS de Kimpese
et de Songololo depuis 2007.(14.16,17.).
I.2.EPIDEMIOLOGIE
L'Ulcère de Buruli est classé par l'OMS comme
une des 13 maladies tropicales négligées. L'OMS les
définit comme des pathologies qui « persistent exclusivement dans
les communautés les plus pauvres et les plus marginalisées, ont
été largement éliminées partout ailleurs et sont
donc souvent oubliées. La plupart peut être prévenue et
éliminée. Elles prospèrent dans les lieux où on
trouve des eaux insalubres, de mauvaises conditions d'hygiène et un
accès limité aux soins médicaux de base. Elles causent des
douleurs sévères et des handicaps permanents, et sont souvent
moins visibles donc moins prioritaires [pour les structures sanitaires locales
et les instances internationales.] » (6).
I.2.1. REPARTITION MONDIALE
Il faut retenir que l'Ulcère de Buruli n'est pas une
maladie rare. Des cas d'UB ont été notifiés dans plus de
trente pays, situés principalement dans les régions tropicales ou
subtropicales (climat chaud et humide).
A cela il faut ajouter sa présence probable dans les
pays où il n'est pas reconnu ni recensé en tant que tel. Selon
l'OMS, « la méconnaissance de cette maladie, sa répartition
focale et le fait qu'il touche principalement les communautés rurales
démunies font que les cas sont peu notifiés » (seuls 14 pays
notifiaient à l'OMS leurs données concernant la maladie en 2009).
(6).
Les pays officiellement touchés en 2006 sont :
- AFRIQUE : Bénin, Côte d'Ivoire
et Ghana sont les plus touchés. Maladie également recensée
au Burkina-Faso, Angola, Cameroun, Congo, République démocratique
du Congo, Gabon, Guinée, Guinée équatoriale,
Libéria, Malawi, Nigeria, Ouganda, Sierra Leone, Soudan, Togo, et
récemment République Centrafricaine ;
- AMERIQUE LATINE : Guyane française
(le foyer endémique le plus important du continent américain),
Bolivie, Mexique, Pérou (forêt amazonienne), Suriname,
Brésil (récemment) ;
- ASIE : Inde, Indonésie, Malaisie,
Sri Lanka, Chine, Japon. (la situation en Asie du Sud-Est n'est actuellement
pas connue) ;
- OCEANIE : Australie et Papouasie
Nouvelle-Guinée surtout, Kiribati (Micronésie).
Ci-dessous une carte mondiale des pays officiellement
touchés par l'Ulcère de Buruli.
Figure 1 : Répartition géographique des
pays déclarant des cas d'Ulcère de Buruli.
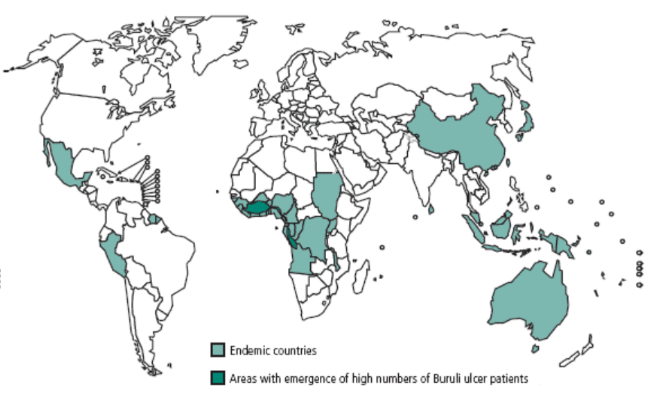
Source : OMS
En RDC 3 de ces provinces sont considérés
très endémiques: Bas Congo, Bandundu et Maniema, tandis que les 3
autres sont faiblement endémiques (Equateur, Katanga et P Orientale).
Figure 2 : Carte de la RDC avec les
provinces où des cas suspects ont été rapportés
en
2008.
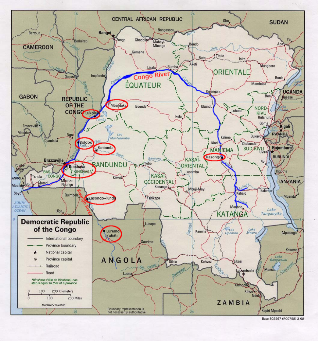
Source Prof KIBADI.
I.2.2.FACTEURS
ENVIRONNEMENTAUX
L'Ulcère de Buruli est une maladie qui survient par
foyers endémiques. Les zones atteintes sont pour la plupart
rurales. Les foyers d'endémie sont circonscrits
géographiquement, presque toujours autour d'un
écosystème aquatique (fleuves, lacs artificiels
ou naturels, rivières à débit lent, mares et zones
marécageuses, systèmes d'irrigation...), et les
communautés d'endémie peuvent être situées à
quelques kilomètres à peine de communautés
épargnées. Des cas se sont aussi produits à la suite
d'inondations. Les activités à proximité de l'eau, comme
l'agriculture, constituent un facteur de risque selon certaines études.
L'apparition de nouveaux foyers serait liée à
des perturbations écologiques importantes. En Ouganda, un grand nombre
de cas apparaît en 1965 dans le district de Busoga, au nord du Lac
Victoria, alors qu'aucun cas d'UB n'y avait été enregistré
jusqu'alors malgré son existence dans d'autres zones du pays. Ce
phénomène aurait été mis en rapport avec des
inondations sans précédent autour des lacs de l'Ouganda entre
1962 et 1964, suite à des précipitations particulièrement
abondantes.
Les facteurs environnementaux jouent certainement un
rôle essentiel dans la survie de la mycobactérie, étant
donné la localisation des cas dans les zones intertropicales humides.
Ce lien épidémiologique entre l'UB d'une part et
l'eau et les activités humaines d'autre part est un
élément essentiel sur lequel se basent un grand nombre de
recherches quant au mode de transmission de la mycobactérie.(8).
I.2.3. AGE ET SEXE DES
PATIENTS
L'Ulcère de Buruli frappe couramment des personnes
démunies vivant dans des zones rurales isolées avec un
accès limité aux soins primaires.
Il peut toucher à n'importe quel âge, mais la
grande majorité (70% environ) des personnes atteintes sont des enfants
de 2 à 14 ans (âge médian = 12 ans).
Le sex ratio paraît être égal à 1,
même si chez l'adulte, certaines études ont signalé des
taux d'incidence plus élevés chez les femmes que chez les hommes
(rôle des points d'eau ?).
I.3.BACTERIOLOGIE
L'agent pathogène de l'Ulcère de Buruli est une
mycobactérie environnementale (exmycobactérie atypique)
appelée Mycobacterium ulcerans. Elle possède un tropisme
essentiellement cutané. Il est utile de connaître ses
caractéristiques propres afin de mieux envisager
l'épidémiologie de la maladie, sa physiopathologie et les bases
du traitement.
M. ulcerans appartient à un groupe de
mycobactéries potentiellement pathogènes pour l'homme et l'animal
(parfois appelées « mycobactéries opportunistes »).
Selon de récentes informations, M. ulcerans ne se trouverait
pas dans l'environnement à l'état libre, mais elle occuperait une
niche spécifique dans certains milieux aquatiques (petits animaux
aquatiques ou biofilms), à partir desquels elle se transmettrait
à l'homme par un mécanisme encore imparfaitement connu.
Mycobacterium ulcerans est un bacille
acido-alcoolo-résistant (BAAR). Difficilement cultivable à partir
des échantillons cliniques, c'est une mycobactérie à
croissance lente : son temps de doublement est d'environ 20 heures. Le milieu
de culture idéal est le milieu de Löwenstein-Jensen (milieu de
culture classique pour les mycobactéries). La croissance de M.
ulcerans est favorisée par un milieu microaérophilique,
c'est à dire pauvre en oxygène (pression en oxygène p02
< 2,5 kPa). Le pH optimal pour sa croissance varie de 5,4 à 7,4. Les
cultures primaires peuvent prendre de 6 à 8 semaines, comme pour le
bacille tuberculeux, mais les sous-cultures deviennent en général
positives en deux semaines, suivant le nombre de mycobactéries dans
l'inoculum.(8).
I.4.IMMUNOPATHOLOGIE
M. ulcerans possède une particularité
qui la rend unique parmi les mycobactéries : sa virulence ne provient
pas du germe lui-même mais d'une toxine destructrice qu'elle produit, la
mycolactone, qui provoque des lésions tissulaires et
inhibe la réaction immunitaire.
C'est en fait une exotoxine lipidique nécrosante qui
possède des propriétés cytotoxiques pro-coagulantes et
immunosuppressives., Il est admis depuis peu que la mycolactone est
classée dans les polykétides (composés naturels
contenant des groupements carbones et méthylène alternés,
dérivés de la condensation itérative d'acétyl-CoA),
et également reconnue comme un membre de la famille des macrolides. La
virulence de M. ulcerans s'explique en grande partie par les effets
toxiques de cette mycolactone.
Les connaissances actuelles permettent d'élaborer le
scénario immunopathologique le plus probable : une fois qu'il est
parvenu dans le tissu sous-cutané, le bacille prolifère et
synthétise la toxine qui s'attaque aux adipocytes. La nécrose qui
en résulte crée un milieu qui stimule la prolifération de
la mycobactérie .Au cours de cette phase, à cause des
propriétés immunosuppressives de la mycolactone, la
réaction immunitaire à médiation cellulaire est
très faible.
En effet, l'activation de la toxine entraînerait la lyse
du macrophage hôte et paralyserait les fonctions cellulaires des
lymphocytes et des macrophages qui s'infiltrent. Cette
immunosuppression locale pourrait à son tour contribuer à
retarder la réponse immunitaire systémique précoce
à l'antigène bactérien. Cela pourrait expliquer le fait
que souvent les patients présentant des lésions évolutives
ne réagissent pas à un antigène dérivé de
M. ulcerans (buruline) et administré par voie intradermique.
On retrouve donc, au stade précoce, des nodules
cutanés précoces avec un grand nombre de BAAR
extracellulaires, une nécrose sous-cutanée étendue, dans
un contexte de réaction inflammatoire très faible.
Puis, sans que l'on sache en expliquer la raison, certaines
lésions guérissent spontanément (activation tardive des
défenses immunitaires de l'hôte, sous quelle influence ?) avec
fibrose cutanée d'origine inflammatoire (cette fibrose entraînant
des contractures majeures) ou bien au contraire, la lésion s'aggrandit,
avec apparition d'ulcérations qui évoluent de
façon péjorative (atteinte des tissus mous sous-jacents et
extension de l'ulcère). Ces ulcérations sont
caractérisées par un faible nombre de BAAR et l'apparition de
nouvelles structures histologiques : les granulomes. A noter qu'à ce
stade granulomateux autant qu'au stade de guérison avec fibrose,
l'intradermoréaction à la buruline se positive, indiquant qu'une
réponse immunitaire cellulaire est apparue et se développe.
L'hypothèse d'un système d'anticorps à
développement lent est donc actuellement avancée. (9).
I.5.TRANSMISSION
La transmission de M. ulcerans à l'homme est un
des thèmes de prédilection de la recherche actuelle sur l'UB, et
un de ceux qui a occasionné le plus de découvertes dans la
dernière décennie.
Mais s'il faut préciser qu'elle reste très
imparfaitement connue des infectiologues et chercheurs. On a vu que l'agent
pathogène est une mycobactérie environnementale, probablement
présente de façon ubiquitaire dans l'environnement
hydro-tellurique. On la retrouve notamment à la surface des
végétaux aquatiques (confirmé lors d'études par
PCR) des zones d'endémie, végétaux qui servent de support
au biofilm formé par M. ulcerans. Les études
réalisées sur l'écosystème de M. ulcerans sont donc
parties de l'observation de la présence quasi-systématique d'un
milieu aquatique à proximité des foyers endémiques.
Plusieurs hypothèses sont proposées, ne
s'excluant pas mutuellement :
1) L'agent pathogène pourrait être inoculé
à l'homme par contact direct avec de l'eau contaminée par M.
ulcerans, ceci à travers des (micro ou macro-) traumatismes
cutanés préexistants.
2) Certains insectes aquatiques ou vivants près des
points d'eaux, infectés par M. ulcerans, pourraient transmettre
la bactérie à l'homme par piqûre. Cette hypothèse
est issue de plusieurs études récentes (toutes datant de moins de
4 ans) d'intérêt majeur dans la compréhension de la
transmission de la mycobactérie à l'homme, et donc dans le
versant prophylactique possible du traitement. (10)
I.6.PHYSIOPATHOLOGIE
I.6.1.PHASE PRE-ULCERATIVE
Après avoir été
introduites dans l'épiderme, puis par contiguïté dans le
derme et le tissu sous-cutané, les mycobactéries passeraient par
une phase de latence, de durée variable.
Elles seraient alors intracellulaires pour la majorité.
Il est possible que la sécrétion de mycolactone débute
précocement mais pas en quantité suffisante pour atteindre des
concentrations toxiques. A la fin d'un intervalle libre (sous l'impulsion de
quels facteurs ?), les mycobactéries se multiplient et la
sécrétion de toxine augmente. Les dégâts tissulaires
commencent à survenir.
La toxine, qui paraît avoir une affinité
particulière pour les adipocytes (nombreux dans les tissus
sous-cutanés), génère une nécrose importante. Ce
terrain de cellules graisseuses nécrosées est un milieu de
culture idéal pour M. ulcerans, et favorise un cycle
d'auto-entretien pour les bacilles car elle favorise leur prolifération,
qui à son tour aboutit à une sécrétion accrue de
toxine.
A ce moment, une partie de la population bactérienne
devient extracellulaire dans des zones tissulaires nécrotiques et une
autre partie reste intracellulaire à la périphérie de la
zone de nécrose.
A ce stade, la réponse immunitaire de l'hôte est
très faible car inhibée par les propriétés
immunosuppressives de la toxine (l'intradermoréaction à la
buruline est alors classiquement négative). On retrouve donc
histologiquement, comme on l'a vu dans le chapitre immunopathologie, des
lésions riches en BAAR, riches en nécrose, avec une quasi-absence
de réaction inflammatoire. Ces lésions se traduisent en clinique
par les lésions pré-ulcératives.
1.6.2. PHASE ULCERATIVE OU
GUERISON
Par la suite, sous l'impulsion d'un facteur encore inconnu,
l'immunité de l'hôte se déclenche finalement (toxine
neutralisée ? Arrêt de prolifération des bacilles ?
Arrêt de sécrétion de la mycolactone ?) avec apparition de
phénomènes inflammatoires. L'intradermoréaction se
positive. La synthèse de TNF (Tumor Necrosis Factor) serait alors
inhibée et celle de MIP-2 (chimiokine pro-inflammatoire). Ces
phénomènes aboutissent à la formation de structures
histologiques caractéristiques : les granulomes.
Il apparaît que l'évolution naturelle finale de
toute lésion d'UB, après des mois ou des années
d'évolution, et même sans traitement, serait une guérison
avec constitution d'une cicatrice (le combat serait donc finalement
gagné par l'immunité de l'hôte).
Figure 3 : phases de cicatrisation d'une lésion
d'Ulcère de Buruli.
Source
(OMS).


I.7. DIAGNOSTIC
I.7.1.CLINIQUE
Le délai d'incubation de l'infection à M.
ulcerans est de 6 à 12 semaines. Les lésions d'UB se situent
sur les membres dans 85% des cas. 60% environ siègent sur les membres
inférieurs, 30% environ sur les membres supérieurs. Les autres
lésions peuvent se situer sur le tronc, les fesses ou la région
périnéale, le visage, le cuir chevelu.
En l'absence d'autre (sur)infection :
- lésion en général indolore
(y compris les ulcères, même étendus)
- pas d'altération de l'état
général, pas de fièvre,
symptômes généraux rares
- pas d'adénopathie clinique.
Selon la classification officielle reconnue par l'OMS, deux
formes cliniques se distinguent : forme inactive et forme évolutive.
Ø La forme inactive se
caractérise par un antécédent d'infection à M.
ulcerans avec une cicatrice affaissée en étoile, avec ou
sans séquelles.
Ø La forme évolutive
revêt trois aspects : non ulcérative,
ulcérative, et un stade de cicatrisation.
Retenir donc que malgré son nom, l'UB n'est pas
toujours une lésion ulcérée, d'où
l'intérêt de le diagnostiquer précocement, au stade - non
ulcéré justement - où un traitement pourra aboutir
à une guérison souvent sans séquelle
fonctionnelle.
Les FORMES NON ULCERATIVES (ou
PRE-ULCERATIVES) peuvent être :
PAPULE :
Lésion cutanée surélevée, de moins
d'un centimètre de diamètre. Indolore mais parfois
prurigineuse.
Un érythème est fréquemment
observé autour de la lésion. Forme la plus fréquente en
Australie.
NODULE
Lésion sous-cutanée ferme, palpable, de 1
à 2 cm de Diamètre, parfois plus grande. Froid, indolore, souvent
prurigineuse. Adhérente à la peau, mobile au plan profond.
Parfois entourée d'un halo oedémateux. La peau en regard est
souvent dépigmentée. Forme courante en Afrique.
PLAQUE
Lésion en placard, bien démarquée mais
à bords irréguliers, surélevée, ferme et
indurée, de plus de 2 cm de diamètre. Froide, indolore. La peau
en regard est souvent dépigmentée (ou rouge).
OEDEME
Tuméfaction diffuse, étendue, froide et ferme,
ne prenant pas le godet, à bords mal définis, parfois
douloureuse, avec ou sans modification de la pigmentation de la peau
affectée. Localisations possibles : membre (entier ou une partie),
tronc, visage, région périnéale.(10.)
Les FORMES ULCERATIVES :
Sans traitement, les formes pré-ulcératives
ci-dessus aboutissent en général à la formation d'un
ulcère. Celui-ci, symbole de la maladie, peut apparaître à
n'importe quelle partie de la lésion initiale. Il possède les
caractéristiques suivantes:
Ø Perte de substance dermo-épidermique
Ø Indolore (ou très peu
douloureux) et non malodorant, en l'absence de surinfection
Ø Fond nécrotique, jaunâtre
(peut être blanc cotonneux)
Ø Bords creusés,
décollés
Ø Induration périphérique,
classiquement noirâtre
Ø Fréquent oedème cutané en
périphérique
Ø Pas ou peu de signes
généraux
Complications de la forme ulcérée
:
- surinfection de la plaie (staphylocoque,
streptocoque, pyocyanique, Corynebacterium sp) avec évolution
possible vers phlegmon et sepsis
- atteinte osseuse : elle peut survenir sous
forme de
- ostéite réactionnelle
(contiguë) : elle survient lorsque la nécrose a
détruit les tissus sus-jacents à l'os. Elle attaque donc celui-ci
de la périphérie à la profondeur.
Il arrive que l'exposition de l'os atteigne le stade de la
dévascularisation, de la nécrose de l'os cortical, du
séquestre, parfois jusqu'à l'ostéomyélite.
- ostéomyélite véritable
à M. ulcerans : souvent par métastases septiques,
parfois par contiguïté. Cette nécrose infectieuse
débute donc cette fois à partir du centre de l'os
(médullaire), à partir d'un ou plusieurs foyers, parfois à
distance de la lésion cutanée ou après sa
guérison.
Au-dessus de l'os, la peau est souvent intacte, sans
lésion apparente. L'ostéomyélite à M. ulcerans
est indolore au départ avant de devenir franchement douloureuse
(douleur exquise).
Au niveau cutané, on retrouve alors en regard une zone
inflammatoire, chaude, oedematiée avec possible fistule et
extériorisation de tissu nécrosé. En cas d'incision, en
dessous d'un tissu gélatineux on observe un os totalement
rongé.
Les complications classiques de l'ostéomyélite
sont possibles, à savoir déformation osseuse, séquelles
fonctionnelles, surinfection, sepsis...
- atteinte loco-régionale profonde,
par extension contigüe de l'ulcère : destruction des tissus mous
(gaines de tendons, muscles, aponévroses / atteinte possible des tissus
périorbitaires avec perte de l'oeil, en cas de localisation au visage),
arthrite
- déformations de membres, rétractions
: elles résultent des cicatrices au niveau de muscles
(contractures), d'articulations. Ankylose parfois associée,
séquelles fonctionnelles majeures
- handicap social et/ou esthétique
- complications
Le STADE DE CICATRISATION
:
La cicatrisation spontanée des lésions
apparaît après plusieurs mois (voire années)
d'évolution. Elle fait suite à la détersion de
l'ulcère, puis à l'accolement des bords d'où part
l'épidémisation. Le tissu cicatriciel est fibreux,
scléreux et les invalidités définitives sont
fréquentes à type de rétraction (contractures des
muscles), d'ankylose, d'amputation de membre parfois de lymphoedème par
striction cicatricielle. Selon les études, ces séquelles
fonctionnelles seraient présentes chez 25% à 66% des patients
« guéris » de leur infection. Elles entraînent des
incapacités majeures qui font l'objet d'une prise en charge
spécifique.
NOUVELLE CLASSIFICATION:
Depuis 2004, la modification du traitement de l'UB
(introduction des antibiotiques dans les recommandations de stratégie
thérapeutique) a entraîné la création d'une nouvelle
classification validée par l'OMS.
Cette nouvelle classification est fondée sur la taille
des lésions. Son but est de de séparer les lésions
potentiellement guérissables par traitement antibiotique seul de celles
qui nécessiteront une chirurgie ; elle a donc un intérêt
évident pour les soignants qui diagnostiquent les cas sur le terrain.
Elle permettra également aux organisations sanitaires de mieux suivre
les progrès diagnostiques (plus de lésions réduites
diagnostiquées = reflet d'une politique de diagnostic précoce
efficace) dans chaque pays touché.
On classe les lésions en 3 catégories:
Ø Catégorie I : une
lésion unique < 5 cm de diamètre. La plupart de ces
lésions guérissent complètement avec le traitement
antibiotique seul (pas besoin de chirurgie).
Ø Catégorie II : une
lésion unique de 5 à 15 cm de diamètre. Certaines de ces
lésions peuvent guérir complètement avec le traitement
antibiotique seul.
Ø Catégorie III : une
lésion unique > 15 cm de diamètre ou
lésions multiples ou une ou plusieurs
lésions sur des localisations critiques (oeil, sein, organes
génitaux) ou ostéomyélite.
Pour la plupart de ces lésions, il faudra avoir recours
à la chirurgie (excision, greffe cutanée ou amputation dans les
cas graves).
I.7.2 .DIAGNOSTIC DIFFERENTIEL DE L'ULCERE de BURULI :
· Devant une papule cutanée en zone
d'endémie, penser à : piqûre
d'insecte, lésion herpétique, psoriasis, pityriasis, granulome
annulaire
· Devant un nodule cutané en zone
d'endémie, éliminer :
- nodules inflammatoires : piqûre d'insecte, furoncle,
adénite, anthrax, abcès, kyste sébacé
infecté, leishmaniose sous sa forme nodulaire, érythème
noueux, myase...
- nodules non ou peu inflammatoires : kyste, lipome, nodule
onchocerquien, granulome à corps étranger, gommes (hypodermites
subaiguës évoluant vers le ramolissement et l'ulcération),
sporotrichose, actinomycose, tuberculose cutanée, lèpre, syphilis
tertiaire...
· Devant un placard sous-cutané en
zone d'endémie, éliminer :
- pour un placard inflammatoire : érysipèle
(très inflammatoire et douloureux, signes généraux),
piqûre, phlegmon, lupus et autres maladies inflammatoires (rares),
sarcoïdose diffuse en placard (souvent symétrique, nez et joues)
- pour un placard non inflammatoire : hématome
(anamnèse), urticaire (prurit, lésion fugace), psoriasis
(squameux), mycose, eczéma (anamnèse), lèpre.
· Devant un oedème de membre ou du
tronc en zone endémique, il faut éliminer :
- oedèmes très inflammatoires : cellulite
infectieuse (inflammation marquée, adénopathie
satellite), traumatismes (anamnèse évidente),
ostéomyélite à pyogène (pas de lésion
cutanée d'UB, âge...), phlegmon
- oedèmes généralisés et
symétriques, prenant le godet (insuffisances rénale, cardiaque,
hépatique; hypoalbuminémie par dénutrition)
- oedèmes asymétriques : compression lymphatique
d'origine tumorale, filariose lymphatique actinomycose, onchocercome,
oedème kaposien.
· Devant un ulcère cutané en
zone d'endémie, il faut éliminer :
- ulcère phagédénique tropical («
bourrelet périphérique taillé à pic sur le versant
interne, en pente douce sur le versant externe, et parsemé de
clapiers purulents ») ;
- ulcère variqueux (signes d'insuffisance veineuse,
bord souple ou induré, fond propre et bourgeonnant, souvent près
de la malléole externe ;
- ulcère artériel (signes d'AOMI, ulcère
profond, circulaire, très douloureux) ;
- dermo-hypodermite nécrosante d'origine
streptococcique (placard inflammatoire qui s'étend très
rapidement de façon centrifuge) ;
- leishmaniose cutanée (ulcération unique au
visage ou aux membres, croûteuse - 2 formes : sèche avec bourrelet
indolore prurigineux, humide avec enduit purulent et lymphangite
régionale ; diagnostic : mise en évidence du parasite au
microscope) ;
- tuberculose cutanée ulcérée (chercher
d'autres signes de tuberculose maladie) ;
- mycose cutanée : histoplasmose africaine
(ulcération gommeuse à fond granulomateux), sporotrichose
(ulcération précédée de gomme, pus chocolat,
adénopathie satellite souvent multiple) ;
- pian (tréponématose non vénerienne
donnant une ulcération prurigineuse, avec souvent aspect de
papillomatose bourgeonnante, rechercher la coexistence de pianomes ou
pianides) ;
- carcinome cutané ou mélanome
ulcéré (bourgeonnants, saigne au contact) ;
- ulcère drépanocytaire
(antécédents drépanocytaires, ulcère très
douloureux, chercher d'autres signes de la maladie),
· Devant une cicatrice cutanée en zone
d'endémie, éliminer :
- cicatrice dystrophique de brûlure, de
traumatisme...
- ankylose secondaire à une tuberculose cutanée
ou osseuse.
I.7.3. BACTERIOLOGIQUE
· Quatre examens paracliniques sont proposés
par l'OMS actuellement : l'examen direct au microscope après
coloration, la culture, l'examen anatomo-pathologique et la PCR.
· Deux examens positifs suffisent à affirmer
le diagnostic positif d'infection à M. ulcerans.
Ø examen direct
- Le prélèvement (écouvillon ou biopsie)
doit être réalisé au niveau du tissu ulcéré
en zone périphérique nécrotique.
- Facile et rapide à réaliser dans les
établissements locaux de santé, peu coûteux.
- Positif en cas de présence de BAAR
après coloration de Ziehl-Nielsen.
- Méthode toutefois peu sensible (Se = 40% environ) car
les bacilles ne se répartissent pas uniformément dans les tissus
et leur nombre tend à diminuer avec le temps.
Ø Culture bactérienne
- Elle est pratiquée à partir
d'écouvillons ou de biopsies.
- Réalisée sur milieu de Lowenstein-Jensen ou de
Coletsos.
- Méthode très lente : culture difficile, et
mycobactérie à croissance lente. Nécessite 6 à
8 semaines (lorsqu'elle est positive, peut se révéler
néanmoins interprétable dès la3ème ou4ème
semaine). Sensibilité moyenne : entre 20% et 60%.
Ø examen anatomo-pathologique
(histologique)
Cet examen requiert une biopsie tissulaire. Celle-ci doit
être prélevée sur les bords de l'ulcère, mais elle
doit comprendre la base nécrosée et du tissu profond.
Pour ce faire, il est recommandé l'excision qui
s'étendra si possible un peu au-delà de la zone creusée.
Les biopsies pour examen anatomopathologique sont d'ailleurs traditionnellement
réalisées à l'occasion d'un traitement chirurgical
- L'OMS stipule que les échantillons venant de plaques
ou de lésions oedémateuses doivent provenir de l'endroit qu'on
estime être au centre de la lésion et comporter toutes les couches
du derme et du tissu sous-cutané, ceci pour augmenter la
lisibilité de la pièce et au final la sensibilité de
l'examen.
- Résultats obtenus rapidement.
- Positive lorsque l'examen de la
pièce biopsique montre une nécrose du collagène
dermique et du tissu cellulo-adipeux sous-cutané, avec une
réaction inflammatoire minime et typiquement
présence de BAAR en nombre variable.
- Méthode sensible : 90 % environ.
- Utilisée fréquemment pour établir un
diagnostic différentiel lorsque les 3 autres méthodes sont
négatives.
- A noter que 2 nouvelles méthodes (biopsie à
l'emporte-pièce et aspiration à l'aiguille) sont en cours de
validation, même s'il apparaît que l'emporte-pièce ne
permettrait pas toujours d'obtenir une qualité satisfaisante de
tissu.
Ø PCR (amplification
génique)
Réalisée à partir d'un écouvillon
ou d'une biopsie.
- Le principe est la recherche de l'ADN de Mycobacterium
ulcerans par PCR (Polymerase Chain Reaction)
- Résultats obtenus rapidement, avantage de ne pas
dépendre de la vitesse de multiplication de la mycobactérie
- Très difficile à réaliser en dehors de
centres de référence, méthode coûteuse. De plus,
peut donner des faux-positifs dans des laboratoires qui manquent
d'expérience.
- Très bonne sensibilité : évaluée
entre 90 et 98%. Spécificité 100%.(10).
I.8. TRAITEMENT
I.8.1.ANTIBIOTHERAPIE
En 2007, l'OMS a diffusé des recommandations proposant
d'utiliser l'antibiothérapie dans le traitement de l'UB.
Ces recommandations étaient principalement issues de
deux réunions du groupe consultatif spécial de l'OMS sur l'UB
(mars 2003 puis mars 2004, Genève). Elle rapportait des conclusions
encourageantes quant au traitement RIFAMPICINE + AMINOSIDE (streptomycine ou
amikacine) sur des lésions de petite taille. Cette association
était celle qui avait obtenu le plus d'efficacité parmi les
différentes étudiées.
Les recommandations sont les suivantes :
v Toute lésion d'UB confirmée doit être
traitée avec une association bi- antibiothérapique
composée de rifampicine + un aminoside (streptomycine
en général) pendant 8 semaines.
v Jamais de monothérapie ! Les deux
traitements doivent toujours être associés pour éviter la
sélection de mutants pharmacorésistants
v Les soins locaux (débridement,
pansements) seront poursuivis pendant le traitement antibiotique et
après celui-ci, pour une durée suffisante (jusqu'à
guérison complète)
v En cas de chirurgie nécessaire, la faire
précéder de 4 semaines de bi antibiothérapie
(avec les mêmes produits que mentionnés plus haut :
rifampicine + aminoside, aux mêmes doses). Celle-ci réduirait
l'étendue des lésions et donc de l'intervention. Elle
réduirait aussi le risque de récurrence (ramené à
<2% après l'introduction des antibiotiques). Ne pas réaliser
la chirurgie seule.
v En pré-opératoire immédiat (une heure
avant l'intervention), administrer une dose de la même
bi-antibiothérapie pour couvrir au maximum le geste
opératoire.
v Durant toute la durée du traitement antibiotique, le
patient doit être sous surveillance directe des soignants (effets
secondaires, efficacité).
EN PRATIQUE
RIFAMPICINE : 10 mg/kg par
voie orale tous les jours pendant 8 semaines. +
STREPTOMYCINE : 15 mg/kg en injection intramusculaire
tous les jours pendant 8 semaines. (11).
I.8.2. CHIRURGIE
On rappelle que les lésions pour lesquelles le recours
à la chirurgie sera probable sont schématiquement celles de
Catégorie III : une lésion unique > 15 cm de diamètre
ou lésions multiples ou une ou
plusieurs lésions sur des localisations critiques (oeil, sein, organes
génitaux) ou ostéomyélite. On y ajoute,
par extension, toute lésion osseuse ou articulaire.
Le principe du traitement chirurgical est d'être
à la fois « curatif » en ôtant les tissus
infectés, et en même temps réparateur de la perte de
substance et des
séquelles articulaires. Pour accélérer la
guérison, le tissu nécrosé doit être
éliminé en préservant le plus possible les tissus
adjacents.(11).
I.8.3. PREVENTION DES INCAPACITES
C'est un aspect essentiel de la prise en charge de
l'Ulcère de Buruli qui, longtemps sousestimé et peu
pratiqué, fait aujourd'hui partie intégrante du traitement en
association avec les antibiotiques et la chirurgie.
En effet, comme on l'a vu, la cicatrisation des lésions
(sous traitement ou spontanément) s'accompagne souvent d'une
rétraction des tissus entraînant un enraidissement global,
musculaire puis articulaire.
Et lorsque la chirurgie n'est pas invalidante, c'est la
maladie elle même qui le devient, occasionnant de sérieux
handicaps. Ceux-ci ont un impact réel et direct sur la vie quotidienne
(travail, alimentation, vie sociale) de tous les patients atteints de
lésions de taille importante.
La Prévention des Incapacités (POD en anglais)
consiste à prendre en charge l'aspect fonctionnel de l'atteinte
provoquée par l'UB, de façon à « diminuer les
répercussions des incapacités et à permettre à
l'individu de récupérer son autonomie, son intégration
sociale et une meilleure qualité de vie» (définition
OMS).
Elle est décrite en détails dans un manuel19
à destination des personnels soignants qui ont à prendre en
charge des patients souffrant d'infections à M. ulcerans, ce
manuel étant mis à leur disposition par l'OMS.(12).
CHAPITRE II : MATERIEL ET METHODES
II.1.MATERIEL
II.1.1. CADRE ET PERIODE D'ETUDE
Cette étude s'est déroulée dans six zones
de santé de la partie Sud de la Province du Maniema du 12 mars au 10
Avril 2010.
II.1.2. POPULATIONS
Populations des villages d'origine de cas suspects
notifiés dans la province du Maniema en 2008-2009.
II.2.METHODES
II.2.1. NATURE D'ETUDE
Enquête transversale descriptive des cas d'UB
dépistés lors de la visite des villages d'origine des cas
suspects notifiés dans la province du Maniema.
II.2.2. COLLECTE DES DONNEES.
Nous avions collecté les données dans les
villages, les centres de santé, dans les Bureaux Centraux de Zone de
Santé de la partie Sud de la Province du Maniema.
Les Supports papiers de collecte de l'information sur l'UB
(UB01, UB02, et UB 03) ont été utilisés pour la collecte
des données. En outre un registre électronique était mis
en place pour les cas UB confirmés par au moins un examen de laboratoire
(ZN et PCR).
Ces donnés ont été analysées par
le logiciel Epi-info et Excel.
.
CHAPITRE III. RESULTATS ET DISCUSSION
Au total 66 cas suspects d'ulcère de Buruli ont
été retrouvés dans les six zones de santé
visités (dans la partie Sud de la Province du Maniema. Les examens de
labo avec la coloration de Ziehl Nielsen réalisée sur place dans
les Zones de santé ont permis de confirmer 9 cas d'UB. Les examens par
PCR à l'INRB, après la mission d'appui de l'Institut de
Médecine tropicale d'Anvers en juillet 2010 ont permis de confirmer 8
cas dont 3 qui ne l'avaient pas été par le Ziehl Nielsen de
terrain. Ce qui fait un total de 12 cas confirmés par ZN et/ou PCR soit
un taux de confirmation par le laboratoire de 18%. (Voir le tableau des
résultats).
Tableau 1. Résultats synthétiques de
l'enquête
Parmi les 66 patients suspectés cliniquement 12 (18%) ont
été confirmés par la méthode ZN et PCR et 54
patients (82%) avaient un résultat négatif.
Tableau 2 Origine des Patients
|
District du Sud Maniema
|
Zone de Santé
|
Nombre
|
%
|
|
Kasongo
|
3
|
25
|
|
Samba
|
3
|
25
|
|
Kibombo
|
3
|
25
|
|
Lusangi
|
2
|
16.6
|
|
Salamabila
|
1
|
8.4
|
|
Total
|
|
12
|
100
|
Parmi ces 12 cas confirmés, tous viennent du Sud
Maniema, dont 3 cas dans la zone de santé de Kasongo, Samba et Kibombo,
2 cas dans la zone de santé de Lusangi et 1 cas dans la zone de
santé de Salamabila.
Presque tous ces patients dans ces Zones de Santé
proviennent des villages proches du fleuve Congo ou de ses affluents. Et
dans ces villages, les habitants se livrent à des différentes
activités notamment, la pêche, les rouissages de manioc, la
lessive, la vaisselle, baignade, natations, dans le fleuve ou au bord des
rivières.
Janssens et al en mars 1957 ont enregistrés les
premiers cas d'UB à Kasongo et ces malades vivaient dans un village
situé tout près de la rivière Mwasa(13). Et Suykerbuyk et
al en 2007 ont isolés le Mycobacterium ulcerans dans les
échantillons environnementaux à Kasongo(15).
Cette enquête s'est déroulée au mois de
Mars et Avril. Une période de saison de pluie. Cette observation
confirme d'autres études sur les facteurs environnementaux liés
à l'ulcère de Buruli dont la saison de pluie est toujours
incrimée(6).
Tableau 3. Distribution selon l'âge et le
sexe
|
Age
|
nombre
|
Masculin
|
Feminin
|
|
0-15
|
6
|
2
|
4
|
|
16-25
|
3
|
1
|
2
|
|
26-35
|
3
|
2
|
1
|
Ce tableau de distribution selon l'âge de ces patients
nous montre que 6 patients sont situés dans la tranche d'âge de
0-5 ans soit 50%, 3 patients se trouvent entre 16-25 ans soit 25% et 3
patients dans la tranche d'âge 26-35 ans soit 25%. Et l'âge
médian est 17 ans. Ceci rejoint les études et littératures
sur l'UB qui prouvent que la plupart des patients ont moins de 15 ans (6,7).
Une étude menée en 2002-2004 dans le Bas Congo a confirmé
cette hypothèse en montrant que l'âge médian était
de 17 ans (6 ,15).
Au cours de cette étude, nous avons diagnostiqué
8 cas de sexe féminin soit 66.7% contre 4 cas de sexe masculin 33.3%
Aucune différence quant à la distribution de sexe n'a
été vraiment confirmé mais certaines études
rapportent que le sexe féminin est beaucoup plus affecté que le
sexe masculin à cause des activités des femmes qui restent en
contact d'eau souillé (6). Nous avions observé quant à la
localisation des lésions que tous les malades avaient une lésion
au niveau des membres avec une prédominance des membres inferieurs. Ce
qui confirme les autres études montrant que les lésions sur les
membres inferieurs sont deux fois plus courantes que celles sur les membres
supérieurs (2, 11,).
CONCLUSION et RECOMMANDATIONS
CONCLUSION
La province du Maniema est une région endémique
d'UB et particulièrement le district du Sud-Maniema. Pour qu'une
prévalence et une incidence de cette maladie soient
déterminées dans la province, une enquête qui couvrira
toute la province est vraiment souhaitée. Les impacts
socio-économiques d'UB dans cette province sont visibles mais qui n'ont
jamais été évalués par une étude. Le but de
cette étude est d'arriver à installer un programme de lutte
contre UB dans cette province. Une approche multidisciplinaire est vraiment
nécessaire pour le contrôle de cette maladie et ceci va concerner
la détection active des cas, le traitement médical, traitement
chirurgical et la prévention des incapacités.
RECOMMANDATIONS
1. Aux autorités publiques, tant politiques que
sanitaires, et aux organisations oeuvrant dans le secteur de la
santé :
v De mobiliser les fonds nécessaires pour faire une
enquête couvrant toute la province du Maniema
v D'installer le programme de lutte contre l'ulcère de
Buruli dans la province.
2. Aux familles des malades : d'amener toute plaie
rapidement à l'hôpital pour une meilleure prise en charge
3. Au corps médical :
v D'examiner minutieusement toute forme d'UB.
v De sensibiliser suffisamment la population sur cette
maladie
v De prendre en charge rapidement et efficacement tout cas
d'UB
v De transférer à temps toute forme grave et
compliquée.
BIBLIOGRAPHIE
1. Portaels F. (1989), Epidemiologie de l'Ulcère de
Buruli, Ann.Soc.belge Méd Trop 69 ,91-103.
2. The uganda Buruli Group ,(1971),Epidemiology of
Mycobacterium Ulcerans Infection, at Kinyara, Uganda Royal society of
Tropical and Hygiene.Vol.65 N° 6,763-775.
3. Organisation Mondiale de la Santé (2000)
Ulcère de Buruli, Infection à Mycobacterium ulcerans -
WHO/CDS/GBUI/ 1 : Annexes 2, 3, 4 (pages 73 à 83)
4. Van Oye E.Ballion M.(1950) , Faudra -t-il tenir
compte d'une nouvelle affection à bacillus acido-alcoo-résistants
en Afrique? Ann.Soc.Belg Med Trop 30 : 619-621.
5. Kibadi,K. et al (2006): Résultats de
l'enquête nationale préliminaire sur l'ulcère de Buruli en
République Démocratique du Congo.Bull de l'ALLF
18 ,24-5.
6. Organisation Mondiale de la Santé, (2004):
Guidelines for controlling Buruli Ulcer in the African region,
Epidemiology,2-5.
7. Marsollier L., Aubry J., Milon G., Brodin P., (2007) :
Punaises aquatiques et transmission de Mycobacterium ulcerans. M/S n°
6-7, vol. 23.
8. Centre Pasteur du Cameroun, Cours de International
Microbiologie de Mycobacterium
ulcerans, agent responsable de l'ulcère de Buruli,
2006.
9. George KM,Chatterjee D, Gunawardana G,et al.,(1999)
Mycolactone : a polyketide toxin from Mycobacterium ulcerans
required for virulence. Science ; 283 : 854-7.
10. Organisation Mondiale de la Santé :Diagnostic
de l'infection à Mycobacterium ulcerans -
who/cds/cpe/gbui/2001.4
11. Organisation Mondiale de la Santé
Ulcère de Buruli : prise en charge de l'infection à
Mycobacterium ulcerans - who/cds/cpe/gbui/2001.3
12. Organisation Mondiale de la Santé
Ulcère de Buruli Ulcère de Buruli : prévention des
incapacités (POD), 2006.
13. Janssens PG et al. (1959), Necrotic Tropical Ulcers and
mycobacterial causative agents, Trop Med 11,293-312.
14. Phanzu and Others, (2006) : Mycobacterium
ulcerans Disease(Buruli Ulcer) in a Rural Hospital in Bas Congo
Democratic Republic of Congo, 2002-2004. Am J Med Hyg 75,311-4?
15. Suykerbuyk et al (2007): Persistence of
Mycobacterium ulcerans disease(Buruli ulcer) in the historical focus
of Kasongo Territory ,the Democratic Republic of Congo. Am J Med Hyg
81,888-94.
16. Kibadi,K; et al(2009): Prise en charge chirurgicale de
l'ulcere de Buruli à l'hopital de Nsona-Mpangu ,Province du
Bas-Congo,en République Démocratique du Congo.Compte rendu d'une
mission.Bull de ALLF 24 ,85-7.
17. Kibadi,K ; et al(2009) : Therapeutic itineraries
of patients with ulcerated forms of Mycobacterium Ulcerans(Buruli
ulcer) disease in a rural health zone in the Democratic Republic of Congo.
Trop Med Int Health 14(9), 1110-1116.

| 


