|
Année académique 2000 - 2001
UNIVERSITE LIBRE DE BRUXELLES ( ULB )
FACULTE DE MEDECINE
PRESENTATIONS INHABITUELLES DE LA SARCOÏDOSE
DIX CAS CLINIQUES
MEMOIRE DE FIN D'ETUDES PRESENTE PAR
Dr KATALAY LASONG FIELWA
En vue de l'obtention du Diplôme d'Etudes
Spéciales ( D.E.S. ) en Pneumologie
Tuteur : Professeur R. SERGYSELS
1
DEDICACE
- A mon feu père KATALAY Honoré qui a semé
sans récolter. - A ma mère MUMBA MBUR Caroline, mère des
orphelins
- A mes oncles NDATAM Delphin, NDEEM Romain et KITOKO Paulin pour
m'avoir montré le chemin de la vie.
- A ma tante ETIA TYNE-PE Marie-Eugénie et son feu mari
OKOLOBA Roger pour tout ce que vous avez fait pour ma mère, mes
frères, mes soeurs et moi.
- A mes grands parents AMVAAL Philomène et son feu mari
LASONG Fielwa
- A ma très chère épouse KAPASA MIKONDO
Jeanne et nos enfants KATALAY TYNE-PE, K. AMVAAL Philo, K. NDWE-MA Caro, K.
LASONG Trésor, K. NTO-NZI Fortune, K. Francine, pour tant de
privations.
- A ma tante Françoise
- A mon grand frère SALAPAMBA NGWELE Gilbert pour tout ce
que tu as fait. - A mes frères, soeurs, nièces, cousins,
cousines, oncles et tantes.
- A mon ami depuis l'enfance MWANKEN LABE NZONZI Rémy.
- A ma belle famille.
Je dédie ce travail
2
REMERCIEMMENTS
Ce travail, fruit de tant de sacrifices, de
persévérance et de ténacité marque le couronnement
de mes études de pneumologie à l'Université Libre de
Bruxelles. Que mon épouse KAPASA MIKONDO Jeanne qui n'a cessé de
m'encourager et de me soutenir, trouve ici l'expression de ma sincère
gratitude
Je dois m'acquitter d'un impérieux devoir de remercier
ceux qui m'ont aidé à atteindre mon objectif en commençant
par mes maîtres les Professeurs E. COGAN (Hôpital ERASME), R.
SERGYSELS ( Hôpital St PIERRE ), P. DEVUYST ( Hôpital ERASME ),N.
CLUMECK ( Hôpital St PIERRE ), A-B. TONNEL ( Hôpital A. CALMETTE,
Lille France ) et le Docteur JP. GRIGNET ( CH. DENAIN France ).
Mes pensées se dirigent vers Maître MUTOMBO
BAKAFWA NSENDA, Général MANZEMBE MA EBANGA, Mr NDANGYE Innocent ,
Mr IPALA NDUE-NKA, ; chacun de vous sait ce qu'il a fait pour moi.
Je ne saurai passer sous silence la contribution remarquable
à la réalisation de ce travail de l'ensemble du personnel du
service de Pneumologie du Centre Hospitalier de DENAIN en particulier les
Docteurs JP GRIGNET ( Chef de Service ), P. DEMAREST, M-L. CARLIER, l'infirmier
B. BRUYERE et le Kinésithérapeute P. FLAVIGNY.
Mes remerciements s'adressent également au Dr LUSADUSU
Daniel, Dr O. MICHEL ( Hôpital St PIERRE ), Dr MWANAMPU, Dr TSHIAMALA (
Chef de Service de Médecine Interne de la Clinique Ngaliema - Kinshasa
), Dr MAMAY, Dr MAWISSA, Mr S. PLOUVIER, mes oncles paternels BURU Henri et
EZINE Dieudonné, le Professeur PHOBA MVIKA ( Université de
Kinshasa ) et les amis MAPUKU Aimé, MASINI Bernard, MAYOYO Patrick,
EEMAN Henri.
Ceux qui de près ou de loin ont contribué
à ma vie, à ma formation et qui ne sont pas repris ici, par
manque de place, ne doivent pas se sentir oubliés. Je leur exprime
également mes sentiments de reconnaissance.
3
PLAN
INTRODUCTION
I 1ère PARTIE
1. Définition et
étiopathogénie
2. Manifestations cliniques et
radiologiques
3. Autres examens complémentaires
4. Approche diagnostique
5. Pronostic et évolution
6. Traitement
II 2ème PARTIE : Cas
cliniques
III CONCLUSION
IV BIBLIOGRAPHIE
4
INTRODUCTION :
Depuis la mise en évidence de cette
entité au XIXème siècle par les dermatologues BESNIER (
Paris 1889 ), BOECK ( Oslo 1899 ), SCHAUMANN ( Stockholm 1977 ), bien des
paramètres constituant cette maladie ont été remis en
question.
Historique :
L'histoire de la sarcoïdose est marquée par trois
grandes étapes :
a) En 1889, Ernest BESNIER de
Paris décrit une nouvelle variété de lésions
cutanées qu'il nomme LUPUS PERNIO.
Jonathan HUTCHINSON avait déjà en 1869 puis
1877 décrit des cas de lésions analogues qu'il avait
nommées Syndrome de MORTIMER.
En 1899, Caesar BOECK à Oslo publie une étude
clinique et histologique d'un type de lésions cutanées qu'il
rapproche des cas de HUTCHINSON ( et seulement en 1916, de ceux de BESNIER ) et
qu'il caractérise par la prolifération de cellules
épithéliales dont il attribue l'origine au tissu conjonctif
prenant parfois un aspect sarcomateux, qu'il baptise « sarcoïdose
cutanée bénigne multiple »
En 1909, DARIER et ROUSSY rapportent le cas de
sarcoïdose cutanée qu'ils affectent d'origine tuberculeuse.
b) En 1909,HEERFORDT à
Copenhague décrit l'uvéo-parotidite chronique à laquelle
il lègue son nom et qui sera ultérieurement rapportée
à la sarcoïdose.
En 1904, KREIBICH à Vienne rapportait l'observation des
lésions d'ostéite kystique des phalanges ( signe de Perthes
Jüngling )associées à un LUPUS PERNIO.
En 1914, et par des travaux s'échelonnant de 1917
à 1936,SCHAUMAN de Stockholm établit un lien entre les
lésions décrites par BESNIER et BOECK. D'autre part il
décrit la diffusion des lésions non seulement cutanées
mais aux ganglions lymphatiques, à la muqueuse nasale, aux amygdales,
aux doigts, aux poumons, rattachant l'ensemble de ces lésions à
un substratum anatomique commun : le granulome tuberculoïde.
En 1936, BRUINS-SLOT puis PAUTRIER décrivent les
lésions oculaires de la maladie.
c)Ce n'est qu'à partir de 1940
que se développe la notion d'atteinte thoracique prédominante
En 1946, LÖFGREN décrit l'association
érythème noueux et adénopathies hilaires
bilatérales d'origine sarcoïdosique.
But de l'étude et méthode de recherche
:
But de l'étude :
L'intérêt de ce travail est de démontrer
l'atteinte multisystémique de la sarcoïdose mais surtout de faire
voir les difficultés de parvenir au diagnostic dans les formes
inhabituelles et extrapulmonaires qu'il convient de rechercher
systématiquement.
Méthode et technique de recherche :
Ce travail est une revue rétrospective de dossiers parmi
lesquels 10 cas cliniques ont été sélectionnés vu
leur intérêt.
5
I 1ère PARTIE :
1 Définition et étiopathogénie:
1.1Définition :
La sarcoïdose est une maladie granulomateuse
multiviscérale d'étiologie inconnue affectant principalement les
poumons.
1.2 Etiopathogénie :
La sarcoïdose se déclare entre 20 et 40 ans ; elle
est identifiée avant l'age de 40 ans dans 70% des cas. Elle touche aussi
bien les hommes que les femmes avec une prépondérance
féminine ; ces dernières sont plus touchées après
la ménopause.
Toute les races sont concernées mais avec une incidence
plus élevée chez les noirs ( les afro-caraïbéens sont
les plus touchés avec les formes les plus sévères ).
C'est une des rares maladies respiratoires qui soient moins
fréquentes chez les fumeurs que chez les non fumeurs.
Des cas de sarcoïdoses familiales sont rapportés
pour une fréquence d'environ 3% des cas ( rôle de
l'hérédité ? ).
Aucun agent étiologique n'a jamais pu être
incriminé de façon formelle mais l'hypothèse
mycobactérienne a été suggérée avec
insistance à cause de la similitude histologique du granulome
sarcoïdosique et celle du granulome tuberculeux ; la forte
prévalence des atteintes respiratoires est compatible avec une cause
aéroportée.
Quelque soit l'organe atteint, la maladie se
caractérise par trois types de lésion à savoir :
1 infiltrat macrophagique et lymphocytaire T
2 la formation de lésions granulomateuses
3 l'altération de l'architecture des organes
atteints.
L'évolution fibrogène est possible sans que l'on
puisse identifier clairement les facteurs favorisant.
Sur le plan immunitaire, la sarcoïdose est
caractérisée, au niveau des organes cibles, par une
réponse à polarisation TH1.
Malgré l'anergie tuberculinique et la constatation
fréquente d'une lymphopénie parfois sévère, la
sarcoïdose ne prédispose pas aux affections opportunistes.
2 Manifestations cliniques et radiologiques :
2.1 La symptomatologie clinique dépend
beaucoup de l'intensité et de la localisation de l'atteinte tissulaire,
l'atteinte fonctionnelle pouvant résulter aussi bien de la granulomatose
active que de la fibrose secondaire.
Le mode découverte le plus fréquent était
fortuit lors de la réalisation d'un cliché thoracique, lorsque
les clichés de dépistage étaient largement
réalisés. Actuellement, c'est plutôt ( par ordre de
fréquence décroissante) les signes respiratoires ( toux,
dyspnée ), des manifestations extrarespiratoires ( polyarthralgies,
signes ophtalmologiques, cutanés, ganglions périphériques,
etc. ), des manifestations systémiques ( fatigue, altération de
l'état général, fièvre).
6
L'examen clinique est pauvre en cas d'atteinte respiratoire
simple, la toux est sèche, la dyspnée est tardive.
L'installation peut être brutale par une insuffisance
respiratoire subaigue associée à des multiples lésions
micro nodulaires parenchymateuses ( chez le sujet noir ), à des
lésions en verre dépoli ( chez le fumeur ) et à une
atteinte nodulaire bronchique floride.
Les signes d'atteinte extra respiratoires doivent être
recherchés systématiquement, le patient ne faisant pas
nécessairement le lien entre les manifestations très
variées et sa maladie respiratoire.
Les formes pulmonaires ont été reconnues pour la
première fois par KUZNITZKY et BITTORF en 1915, elles sont
isolées ou associées à d'autres localisations
viscérales mais, en général, elles sont présentes
dans 90% des cas.
2.2 Tableau radiologique:
La radiographie de thorax a une place de
première importance dans le diagnostic, le pronostic et la surveillance.
Des signes radiologiques sont observés chez 80 à 90 des patients
sous forme d'adénopathies intra thoraciques et / ou d'infiltrations
pulmonaires diffuses. La classification radiologique comprend 5 stades.
Stade0 :Radiographie normale.
Stade1 :Adénopathies intra thoraciques
isolées. Elles sont typiquement hilaires et / ou médiastinales,
bilatérales, symétriques et non compressives. Il s'y associe ou
non des adénopathies latéro trachéales et / ou sous
carènaires. Le stade 1 s'observe le plus souvent à un stade
précoce de la maladie. Il évolue le plus souvent vers la
guérison spontanée mais peut précéder un type 2, ou
persister inchangé pendant plusieurs années ( type1 chronique
).
Stade2 :Adénopathies intra thoraciques
bilatérales associées à une infiltration pulmonaire
diffuse donnant dans la plupart des cas une image micronodulaire ou
réticulomicronodulaire
L'infiltration est prédominante habituellement dans les
2/3 supérieurs des champs pulmonaires. Elle est parfois
asymétrique. Le lobe supérieur droit est le plus souvent
touché.
Le type 2 succède en général au type 1 en
quelques mois ; il peut régresser ou évoluer vers le type 3.
Stade 3 : Infiltrations pulmonaires sans
adénopathie décelable . Il succède au type 2. Une
régression spontanée est rare. Il peut persister inchangé
ou aboutir rapidement au stade 4.
Stade4 : Infiltration pulmonaire diffuse avec fibrose,
opacités linéaires denses associées à une
rétraction pulmonaire ou une distorsion trachéobronchique.
Le scanner thoracique est plus sensible pour
détecter les lésions minimes, il permet surtout une
appréciation beaucoup plus fine des lésions susceptibles d'une
réversibilité sous l'effet d'un traitement.
Signes radiologiques inhabituels :
- Atteinte unilatérale, ganglionnaire mais aussi
parenchymateuse. - Calcifications ganglionnaires.
- Excavation des opacités avec possibilité de
greffe aspergillaire.
7
- Atteinte pleurale : pleurésie, épaississement
pleural à un stade avancé de la maladie, pneumothorax.
- Atteintes bronchiques vues plus facilement en endoscopie.
Elles entraînent rarement des distorsions et des sténoses.
- Atteintes artérielles pulmonaires ( très rares
) par atteintes vasculaires directes ou compression par des
adénopathies.
3 Autres examens complémentaires :
3.1 Epreuves fonctionnelles respiratoires ( EFR ) :
Elles sont un élément essentiel pour
apprécier la gravité ou l'évolution de la maladie et
décider de l'indication ou de l'adaptation du traitement. Elles sont
souvent mais inconstament normales aux stade 0 et 1. On peut observer une
baisse de la DLCO.,un syndrome restrictif, un syndrome obstructif.
On note également des désordres atteignant les
gaz du sang :hypoxémie avec normo, hyper ou hypocapnie.
3.2 Endoscopie bronchique :
C'est un examen essentiel car elle permet :
- La visualisation d'éventuelles lésions
bronchiques( sarcoïdes assez rares ).
- La réalisation de biopsies ( bronchiques ou
transbronchiques ) à la recherche de granulomes.
- La réalisation de lavage bronchoaléolaire qui met
en évidence une alvéolite à nette prédominance
lymphocytaire avec augmentation du rapport CD4 / CD8 supérieur à
3.5 ; mais l'augmentation du rapport CD4 / CD8 est inconstante. Une
lymphocytose alvéolaire est mise en évidence dans 80% des cas,
une alvéolite à lymphocytes CD8 peut même être
observée (rarement) ; de même on peut observer une
polynucléose à neutrophiles au stade tardif de la maladie.
Le LBA a certainement une valeur d'orientation diagnostique.
De nombreuses maladies entraînent une lymphocytose alvéolaire, y
compris à lymphocyte CD4. La valeur du LBA en présence des
présentations atypiques ou limitées à des signes extra
thoraciques reste entièrement à démontrer. La
présence d'une lymphocytose alvéolaire se voit en cas de maladie
active. Son absence ne permet pas de déduire le contraire et en aucun
cas la lymphocytose alvéolaire n'est liée à la
gravité de la maladie ; elle n'a donc aucune valeur pronostique. Le LBA
n'a qu'une place réduite dans la décision
thérapeutique.
3.3 Scintigraphie au gallium 67 :
Elle peut aider au diagnostic ( association d'une fixation
oculaire, parotidienne et pulmonaire très évocatrice de
sarcoïdose ) et au suivi évolutif par la détection des
foyers évolutifs résiduels.
3.4 Bilan sanguin :
Seules les élévations de l'enzyme de conversion
de l'angiotensine(ECA), les perturbations du bilan phosphocalcique (
hypercalcémie ) ont une orientation diagnostique. Ces tests sont surtout
utiles lors de la surveillance des sujets
8
traités. Le parenchyme pulmonaire est avec le rein et
la circulation mésentérique un des sites les plus importants de
la sécrétion de l'enzyme de conversion de l'angiotensine I et
angiotensine II.
L'activité de l'ECA a été
découverte pour la première fois par SKEGGS en 1956.
En 1975, LIBERMAN en étudiant le taux de l'ECA au cours
de différentes maladies, a rapporté une élévation
significative dans la plupart des sarcoïdoses actives ( chez 15 des 17
patients présentant une sarcoïdose active ).L'ECA n'est
élevée que dans 60% des cas sarcoïdoses .
L'élévation du taux de l'ECA n'est pas spécifique de la
sarcoïdose. On peut le trouver élevé lors des affections
granulomateuses ou non, à expression intra ou extra thoracique : Maladie
de GAUCHER, tuberculose, pneumoconiose, pneumopathies d'hypersensibilité
ou médicamenteuses, lèpre, maladie de CROHN, cirrhose
hépatique ( en particulier cirrhose biliaire primitive ), lymphome de
LENNERT, diabète, maladie de BASEDOW, bérylliose.
STUDDY a estimé à 90% la valeur
prédictive positive d'une élévation du taux de l'ECA et
à 60% la valeur prédictive négative d'un dosage normal en
présence d'une situation clinique compatible.
Le taux de l'ECA n'a aucune valeur pronostique, il suit
fidèlement l'évolution spontanée ou sous traitement de la
maladie. Son dosage est particulièrement utile pour contrôler
l'efficacité du traitement d'attaque puis de décroissance pour
les corticoïdes.
Le bilan hépatocellulaire est anormal dans 20% des cas.
Il existe une hypergammaglobulinémie polyclonale dans 50% des cas ; une
hypogammaglobulinémie exclut ( sauf exception ) le diagnostic de
sarcoïdose.
4 Approche diagnostique :
le diagnostic repose sur trois critères :
- Tableau clinique et radiologique compatibles.
- Démonstration de granulomes non caséeux.
- Exclusion d'autres pathologies pouvant donner les mêmes
manifestations
cliniques et histologiques.
ATS / ERS Statement on sarcoïdosis. Am J Respir Crit Care
Med 1999 ; 160 :
736-755
Plusieurs diagnostics différentiels doivent être
recherchés :
a) La tuberculose et les infections à
mycobactéries atypiques.
- Les granulomes tuberculeux y sont nécrosés avec
caséum.
- L'IDR à la tuberculine est positive.
- Dans le tableau plus parlant , la recherche de BK est
positive.
b)Les lymphomes malins , en particulier devant un tableau
de poly-
adénopathies chez un adulte jeune mais ces
adénopathies ont une
distribution différente de celles de la sarcoïdose en
général.
c)Le bérylliose est lié le plus souvent
à une exposition professionnelle
chronique au béryllium, d'origine immunoallergique sans
relation avec
l'importance de l'exposition.
d) L'alvéolite allergique extrinsèque
survient dans un contexte
d'exposition massive à des aérocontaminants. On
retrouve au scanner
9
un aspect de verre dépoli ou milliaire floue. Le LBA
est très cellulaire à prédominance lymphocytaire CD8 avec
augmentation des mastocytes. Le test d'éviction est positif.
Pour les formes extrathoraciques, l'atteinte neurologique peut
faire évoquer une tumeur. Certaines formes cutanées sont
évocatrice d'une lèpre, d'un lupus tuberculeux, d'une
leishmaniose ou d'une syphilis tertiaire. Les lésions articulaires
peuvent faire évoquer une polyarthrite rhumatoïde, une
spondylodiscite tuberculeuse.
5 Pronostic et évolution :
La probabilité de guérison à court terme
est forte durant les deux premières années d'évolution et
s'amenuise ensuite.
Le risque de fibrose pulmonaire est quasiment nul dans les
deux premières années puis s'accroît pour devenir important
au delà de 5 ans.
Le pronostic est péjoratif lorsque la maladie
débute après 40 ans
Les probabilités de résolution radiographique
spontanée varient selon le type radiographique : Type 1 ( 80% ), Type 2
( 60% ) , Type 3 ( 20 à 30% ) , type 4 ( 0%). Le risque de complications
et de décès s'accroît en sens opposé. La survenue
d'un syndrome obstructif a une valeur péjorative.
Tous les cas de sarcoïdose doivent
bénéficier d'une surveillance périodique jusqu'à la
guérison. Cette surveillance comprend au minimum un examen clinique, une
radiographie de thorax et un dosage de l'ECA tous les 3, 6 ou 12 mois selon
l'ancienneté et l'évolutivité de la maladie. Les EFR, un
ECG, et un examen ophtalmologique seront réalisés tous les
ans.
La guérison spontanée survient le plus souvent
en moins de deux ans. L'évolution peut aussi se faire vers la
chronicité des lésions .Près de 5% des patients atteints
de sarcoïdose en meurent. Les causes de décès les plus
fréquentes sont l'insuffisance respiratoire , le coeur pulmonaire et les
hémoptysies de grande abondance.
D'autres causes de décès sont possibles :
localisations cardiaques, atteinte du système nerveux central,
hémorragie digestive ( par hypertension portale et / ou
thrombopénie ), insuffisance hépatique, etc.
6 Traitement :
Deux tiers des cas de sarcoïdose guérissent
spontanément sans séquelle. Lorsque le traitement est
indiqué, on donne une corticothérapie par voie orale à
raison de 0.5 à 1 mg / Kg / j pendant 3 mois suivie d'une longue
période de décroissance très progressive sur 12 à
18 mois parfois plus.
En cas de contre indication ou d'échec de la
corticothérapie, les antipaludéens de synthèse (
Chloroquine ) et des immuno suppresseurs peuvent être employés, en
particulier le Méthotréxate à faible posologie
hebdomadaire.
Les autres médications testées ne sont en
principe pas recommandées soit à cause des effets secondaires (
Chlorambucil, Azathioprine ) , soit à cause de leur
inéfficacité sur la sarcoïdose ( Ciclosporine ).Les
corticoïdes locaux sont
10
utilisés pour des atteintes ophtalmiques ou
cutanées à l'exception du Lupus Pernio. Les corticoïdes
inhalés n'ont pas fait preuve de leur intérêt même
dans les formes bronchiques, néanmoins ils ont un effet antitussif
appréciable.
Des traitements symptomatiques peuvent aider en fonction de
l'organe atteint et des conséquences attendues. Les troubles du
métabolisme phospho calcique doivent être traités et
prévenus.
11
II 2ème PARTIE : Cas cliniques
1er cas .Opacités pulmonaires excavées,
hémoptysie et sarcoïdose :
Patient de 39 ans d'origine marocaine, installé en
Belgique depuis 1993 et ne présentant pas d'antécédents
particuliers, ne fume pas, a travaillé dans le bâtiment.
Le 25 / 05 / 2000, il est admis aux urgences de
l'hôpital St Pierre pour toux peu productive, pyrexie, sudation nocturne
et amaigrissement de 4 KG en 6 mois. L'examen clinique retrouve essentiellement
un patient amaigri, présentant des sibilants et des ronchis à
l'auscultation pulmonaire ; le reste de l'examen clinique étant sans
particularité.Un bilan sanguin, réalisé aux urgences,
montre une CRP à 4.7 mg % ( normale inférieure à 0.5 ),
fonction rénale et hépatique normales, hémogramme normal.
La radiographie du thorax montre une importante infiltration réticulo
nodulaire diffuse avec présence de cavernes surtout aux deux lobes
supérieurs.(fig.1)
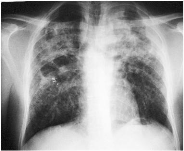
figure 1
En attendant la preuve bactériologique, un traitement
antituberculeux (quadrithérapie associant Nicotibine®,
Rifadine®, Myambutol® et Tébrazid®) est instauré.
Le patient est hospitalisé et mis en isolement respiratoire
Bilan complémentaire :
Le scanner thoracique confirme les lésions
décrites en radiographie de thorax avec des volumineuses
adénopathies en régions aorto-pulmonaires,
pré-trachéales et sous carénaires (fig. 2).
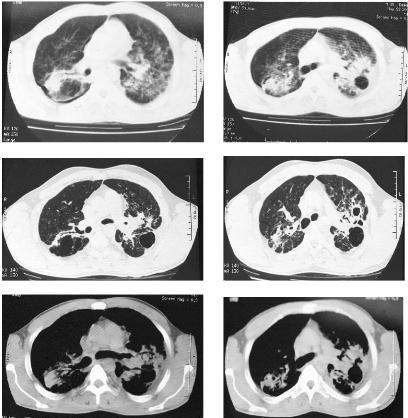
12
figure 2
Les expectorations sont négatives ,pas de BK à
l'examen direct et en culture ; La fibroscopie bronchique est normale.
L'examen bactériologique du LBA est négatif.
Les biopsies bronchiques montrent des granulomes sur corps
étranger probablement d'origine parasitaire.
Les sérologies parasitaires sont négatives pour
le ténia, l'ascaris, l'échinococcus, aspergillus, entomoeba
histolytica.
Les sérologies bactériennes et virales sont
négatives ainsi que les
coprocultures et l'intradermo-réaction
à la tuberculine.
Le bilan immunologique montre des IgE totales à 10, des
IgE spécifiques négatives.
La médiastinoscopie permet de prélever des
ganglions dont l'histo-pathologie montre une granulomatose non
nécrosante évoquant une sarcoïdose.
La scintigraphie au gallium montre plusieurs zones
hypercaptantes au niveau du parenchyme pulmonaire et en région
médiastinale.
13
L'ECA est à 48 UI / l, le typage lymphocytaire donne un
rapport T4 / T8 = 0.84 au niveau sanguin.
Le fond d'oeil et l'électrocardiogramme sont
normaux.
Les EFR montrent un trouble ventilatoire mixte avec un VEMS
à 35%, un CV à 42%, CPT à 44%, Tiffeneau à 84%,
DLCO à 53% et résistances élevées à 266%.
Le traitement antituberculeux est arrêté et on
commence une corticothérapie par voie orale à 32 mg / jour. La
scintigraphie au gallium de contrôle réalisée le 04/07/00
montre une nette régression des anomalies précédemment
décrites. Le patient est autorisé à rentrer au domicile le
06/07/00 avec un suivi ambulatoire.
Le 01 / 09 / 2000 le patient est hospitalisé de
nouveau pour hémoptysie.
La radiographie du thorax reste inchangée. Le bilan
sanguin est quasi normal hormis une CRP à 4.5 mg % et les LDH à
721. Les ANCA sont négatifs, la coagulation est normale, la fibroscopie
bronchique confirme le saignement venant du lobe supérieur gauche avec
aspect infiltré du tronc souche gauche et de la lingula. Les biopsies
montrent seulement un chorion inflammatoire sans granulome. La recherche de BK
dans le liquide d'aspiration trachéo-bronchique est négative. Un
nouveau scanner thoracique montre toujours des masses bi-apicales partiellement
excavées avec un contenu extrêmement remanié et
présence de bulles d'emphysème à l'apex gauche.
Le 07 / 09 / 2000 le patient présente une
récidive d'hémoptysie et bénéficie d'une
fibroscopie bronchique qui ne montre pas de saignement actif mais objective une
petite ulcération au niveau de la lingula et du segment apico-dorsal
dont les biopsies montrent une métaplasie
régénèrative sur fond inflammatoire non
spécifique.
Une artériographie bronchique est
réalisée le 12 / 09 / 2000 et met en évidence une vaste
zone hyperhémiée au niveau de l'artère bronchique gauche.
On réalise alors une embolisation.
Le 13 / 09 / 2000, suite à une 3ème
récidive d'hémoptysie massive avec instabilité
hémodynamique, le patient est transféré aux soins
intensifs et subira une thoracotomie le 15 / 09 / 2000 avec
exérèse de la cavité nécrotique.
L'anatomo-pathologie des pièces opératoire
montre des micro granulomes constitués de lymphocytes et de cellules
géantes compatibles avec la sarcoïdose. Pas d'agent infectieux mis
en évidence par les colorations spéciales ( ZIEHL, PAS ).
Dans les suites opératoires, le patient
développe une surinfection bronchique à Klebsiella pneumoniae
traitée par Bactrim® et Ciproxine®. IL a aussi reçu du
Sporanox® du fait de la présence d'aspergillus fumigatus dans les
sécrétions trachéo-bronchiques et au niveau du drain
pleural.
Le patient est sorti de l'hôpital le 11 / 10 / 2000 avec
comme traitement 32mg de Médrol® par jour, progressivement
réduit puis arrêté. Depuis le patient est
régulièrement suivi en consultation de pneumologie.
Discussion :
La sarcoïdose pulmonaire avec excavation est très
rare ( 1,15 ). Les cavités
( cavernes ) sarcoïdosiques se produisent chez les jeunes
patients. La caverne peut être présente dès le début
de la maladie ou peut se développer dans la
14
période de suivi. Les cavernes sont habituellement
rondes, solitaires ou multiples avec un diamètre de 3 à 5cm.
La caverne est causée par la nécrose de la masse
granulomateuse. Occasionnellement une destruction pulmonaire dans la
sarcoïdose peut résulter d'une sévère maladie
cavitaire avec surinfections fréquentes, bronchectasies et formation
d'abcès ( 1, 13, 14 ). Ces cavernes sont généralement le
siège d'une prolifération d'aspergillus ( 16 ).
Les autres causes comme les mycobactéries, mycoses,
parasites et les bactéries pyogènes doivent être exclues
avant de retenir le diagnostic de cavités sarcoïdosiques ( 11 ).
L'hémoptysie est exceptionnelle, elle est due à
une greffe aspergillaire ( 1, 16 ) ou à une localisation bronchique
spécifique.
15
2ème cas .Sarcoïdose hépatique
:
Patiente de 39 ans, d'origine marocaine, suivie en
gastro-entérologie en octobre 1999 pour cholestase hépatique (
phosphatase alcaline à 1413 ) et dont la biopsie hépatique par
voie transjugulaire montre des granulomes épithéloïdes
contenant des cellules géantes mutinucléées sans
nécrose centrale avec image histologique d'une hépatite
granulomateuse. Elle est confiée en pneumologie. Cette patiente est
diabétique type II traitée par Glucophage®, elle prend aussi
des aérosols de Ventoline® pour l'asthme bronchique. Elle ne prend
pas d'alcool et ne fume pas.
Autre bilan réalisé : sérologie
hépatique négative, sérologie parisitaire
( schistosome, leishmania ) négative, sérologie
bactérienne < à 100 (yersinia enterolitica ) et
négative pour la toxoplasmose. Le bilan sanguin était normal
hormis les phosphatases alcalines à 1413, ?GT à
239, une CRP à 4.6, bilan auto immun négatif,
l'échographie du foie, de la vésicule et du pancréas sans
particularité ; CWR normal.Radiographie de thorax normale. Le scanner
thoracique montre des ganglions centimétriques au niveau du creux
axillaire, du médiastin supérieur et des hiles pulmonaires et
aussi la présence de micronodules septaux interlobulaires et scissuraux.
Le lavage broncho alvéolaire montre 11% de lymphocytes avec CD4 / CD8 =
3.4, neutrophiles 25%, éosinophiles 1%. Les marqueurs immunologiques :
sans particularité. L'intradermo réaction est négative (
tuberculine, candidine, varidase ) L'ECA élevée à 300
UI./l. Recherche de BK négative dans les expectorations et le LBA.L'EFR
objective un trouble ventilatoire obstructif sévère
caractérisé par CV :1.65l soit 54%, VEMS : 1.05l soit 41% de la
valeur prédite, tiffeneau 63.6%, CPT à 3.85l soit 88%, DLCO 62%,
KCO 88%.La fibroscopie bronchique montre des sténoses concentriques
intéressant le segment ventral du LSD, le lobe moyen, LSG et du segment
apical du LIG. Deux biopsies transbronchiques montrent seulement une
discrète inflammation.
Un traitement ( corticothérapie ) a été
instauré et un bilan ultérieur montrait une baisse des
phosphatases alcalines ( 883 ) Malheureusement la patiente n'est plus revenu
pour assurer le suivi.
Discussion : L'atteinte
hépatique est très fréquente à l'échelle
microscopique ; elle occasionne des anomalies biologiques mineurs (
augmentation modérée des phosphatases alcalines et / ou des
transaminases ) dans 20% des cas ( 1, 23). Une hépatomégalie est
rare mais est indicatrice d'un pronostic vital réservé( 1, 22 ).
Les complications les plus graves ( mais heureusement peu fréquentes )
sont l'hypertension portale, une cholestase intra hépatique chronique
simulant une cirrhose biliaire primitive, et le syndrome de BUDD CHIARI ( 21,
24, 26 ).
Le diagnostic est révélé par la biopsie
hépatique qui montre des granulomes non caséeux ( 21, 24, 26 )
surtout quand il y a également atteinte pulmonaire. L'attitude
thérapeutique est identique à celle des formes pulmonaires, mais
il existe des approches thérapeutiques non médicales notamment la
splénectomie , le shunt porto cave en cas d'hypertension portale ( 26 )
et la transplantation hépatique si le stade de la maladie est
avancé notamment l'insuffisance hépatique sévère (
27 ).
Les autres causes de granulomatoses hépatiques sont :
la tuberculose, la brucellose, la beryllose, la syphilis, la lèpre,
l'histoplasmose, lymphome, la cirrhose biliaire primitive, la
mononucléose et le sida ( 11 ).
16
3ème cas . Atteinte des glandes salivaires ,
lacrymales et sarcoïdose :
Patiente de 40 ans d'origine marocaine, hospitalisée en
mars 1988 pour toux persistante depuis 2 mois, dyspnée d'effort,
courbatures, sécheresse oculaire et buccale et asthénie.
Pas d'antécédents majeurs hormis un abcès
latéro cervical ( dans l'enfance ) et du psoriasis. Elle ne fume pas et
ne boit pas d'alcool. Elle travaille comme femme de ménage.
A l'examen clinique, on objective seulement un oedème
palpébral bilatéral, les parotides augmentées de volume et
douloureux à la palpation. L'auscultation cardio pulmonaire est
normale.
Les principaux examens complémentaires montrent :
Radiographie du thorax : syndrome interstitiel
bilatéral avec adénopathies hilaires volumineuses à
droite. Ceci est confirmé par le scanner thoracique qui retrouve aussi
des micronodules bilatéraux avec adénopathies hilaires et
médiastinales bilatérales.
L'IDR à la tuberculine est négative.
Le bilan sanguin montrait un syndrome inflammatoire ( VS
à 44mm / h , fibrinogène à 479 mg /dl ), calcémie
et calciurie normales, sérologie syphilitique positive ( FTA 1/ 120,
TPHA 1/ 640 ) , ECA 478 UI/l.
La gazométrie en air ambiant : normale ( pH 7.48, PCO2
35 mmHg, PO2 90 mm /Hg, Saturation à95%, HCO3 24 mg /l
Le fond d'oeil montre une blépharo-conjonctivite
chronique.
Les EFR montrent un léger syndrome restrictif.
La scintigraphie au gallium est hypercaptante dans les deux
champs pulmonaires et les deux parotides.
Le test de SCHIRMER est positif, montrant une insuffisance des
secrétions soit 5mm à l'oeil droit et 0mm à l'oeil gauche
( normale : 10 à 15mm ). L'échographie cardiaque est normale
La fibroscopie bronchique est macroscopiquement normale.
L'analyse cytobactériologique des aspirations bronchiques est
négative y compris la recherche de BK.
Le LBA montre une lymphocytose ( 62 à 67% ), à
prédominance CD4 ( 68.8 ) et un taux de CD8 à 7.3 soit un rapport
CD4 / CD8 à 9.4.
En conclusion, cette patiente présente une
sarcoïdose stade II avec atteinte parotidienne bilatérale et un
syndrome de SJOGREEN. Elle a été traitée par
corticothérapie par voie orale et des larmes artificielles.
Du fait de la sérologie syphilitique positive un
traitement par pénicilline a été administré.
L'évolution a été favorable
marquée par la disparition des images radiologiques, de la
dyspnée et du syndrome inflammatoire, absence de captation du gallium au
niveau pulmonaire, amélioration des EFR et amélioration de la
blépharo-conjonctivite. Un traitement par Indocid® a
été instauré devant la persistance des douleurs
parotidiennes.
La corticothérapie est progressivement diminuée
jusqu'à l'arrêt complet en Mai 1988 à cause des effets
secondaires ( cushing, obésité, HTA ).
Janvier 1989 : Légère dyspnée.
17
La radiographie de thorax est normale, les EFR normales avec
une diffusion normale .
Depuis 1990 la patiente est en rémission mais il
persiste un petit gonflement bilatéral des parotides peu symptomatique.
Le scanner cervico-facial réalisé ne visualise pas d'anomalie
significative.
Discussion :
L'atteinte de la glande parotide se voit chez 6% des patients
atteints de sarcoïdose ( 32, 33 ). Elle est bilatérale dans 70% des
cas avec une incidence plus élevée chez les femmes, plus
fréquemment dans la tranche d'âge de 20 à 40 ans, avec
participation d'autres organes. Elle peut être isolée et peu
douloureuse.
Le plus souvent elle régresse spontanément en
quelques semaines voir quelques mois sans lien avec l'évolution des
autres localisations ( 1 ). Pour le reste, le traitement ( corticoïdes )
est nécessaire et la réponse est lente et incomplète comme
chez notre patient.
Les glandes sous maxillaires et sublinguales sont souvent moins
touchées. L'hypertrophie bilatérale des glandes salivaires et
lacrymales avec diminution ou suppression de leurs secrétions constitue
le syndrome de MIKULICZ dont la sarcoïdose est une des causes les plus
fréquentes.
Le syndrome de GOUGEROT SJOGREEN est parfois observé
dans la sarcoïdose ( 34 ), il comporte un tarissement de toutes les
secrétions, bronchiques incluses ; la biopsie salivaire montre un aspect
histologique particulier distinct de celui de la sarcoïdose.
Le syndrome de HEERFORD est développé plus loin
( cas 5, 6, 7 ).
18
4ème cas .Sarcoïdose cardiaque :
Patiente de 63 ans hospitalisée le 22/02/99 pour
précordialgies irradiant dans le bras gauche avec un paroxysme
nocturne.
Ses antécédents sont : une sarcoïdose
pulmonaire en 1993 , un fibrome utérin opéré en 1983, une
paralysie faciale en 1986, hypertension artérielle et
hypercholestérolémie.
Son traitement à domicile comprend
Bécotide®,Tildiem®, Lipanthyl®, Voltarène
retard®, Sibellium®, Loramet®.
Elle ne fume pas et ne boit pas d'alcool.
L'examen clinique est globalement peu contributif.
Le bilan sanguin est normal hormis une VS à 38mm
à la 1ère heure ; les enzymes cardiaques normaux , D
Dimère négatif, ECA 11UI / l ( N 8 à 52 ), calcémie
normale, le typage lymphocytaire CD4 absolu à 133 et le rapport CD4 /
CD8 à 0.83.
La gazométrie en air ambiant : pH 7.47, PCO2 40 mm Hg,
PO2 77 mm Hg, SaO2 à 92%.
L'ECG déroule un rythme sinusal régulier avec un
segment ST aplati de V1 à V6.
La radiographie de thorax montre seulement un infiltrat para
hilaire gauche. Au scanner thoracique on trouve un infiltrat pulmonaire du lobe
inférieur droit en partie atélectasique, présence
d'adénopathies médiastinales, de multiples micronodules
parenchymateux au niveau des deux champs pulmonaires, résultat
compatible avec une sarcoïdose pulmonaire et médiastinale.
Les EFR sont normales avec une diffusion normale.
L'examen ophtalmologique est normal.
La fibroscopie bronchique est macroscopiquement normale. Le
LBA montre une prédominance lymphocytaire CD4 avec un rapport CD4 / CD8
à 3.2, La recherche de BK est négative.
L'échographie cardiaque montre une hypertrophie
ventriculaire gauche septale compatible avec un infiltrat sarcoïdosique.
La fraction d'éjection ventriculaire gauche est conservée ( 60
à 70% ). A noter qu'une échographie réalisée en
1996 était normale.
L'hypothèse d'une sarcoïdose pulmonaire avec
atteinte cardiaque est retenue mais en attendant les résultats des
biopsies bronchiques et aussi du fait de la disparition complète des
douleurs précordiales au 2ème jour d'hospitalisation, la patiente
est autorisée à sortir de l'hôpital le 26/02/99.
Le résultat des biopsies bronchiques et
trans-bronchiques est obtenu le 02/03/99 et montre une fibrose associée
à la présence de multiples granulomes à cellules
géantes sans nécrose centrale, compatible avec une
sarcoïdose. Les colorations spéciales ( PAS et Ziehl ) sont
négatives.
La corticothérapie ( Médrol® 32mg/j ) est
instaurée le 08/03/99 et la patiente est suivie en ambulatoire.
L'évolution est favorable sur le plan pulmonaire et
cardiaque après 6 semaines de corticothérapie; celle-ci est alors
réduite à 16mg / j.
Une échographie cardiaque réalisée le
09/06/99 montre un épanchement péricardique apical de 10mm sans
trouble hémodynamique. Le traitement est majoré à 32 mg de
Médrol® et la patiente est réhospitalisée le 29/06/99
et subit un bilan complémentaire notamment une radiographie de thorax
qui montre seulement une bande atélectasique du lobe supérieur
gauche ; ceci est confirmé par le scanner thoracique qui retrouve aussi
quelques opacités en verre dépoli,
19
surtout au niveau du lobe supérieur droit. A
l'électrocardiogramme on voit seulement une altération non
spécifique de la repolarisation. La fibroscopie bronchique est normale.
Les biopsies bronchiques montrent un aspect discrètement inflammatoire.
La recherche de BK est négative. La scintigraphie au gallium est
normale. Les EFR objectivent un léger syndrome restrictif avec une
diffusion abaissée.
La patiente est donc sortie de l'hôpital le 09/07/99
avec Médrol® 32mg / J et son traitement habituel.
Le 07/12/99, elle est revue en consultation de
cardiologie. L'échographie cardiaque met en évidence une
hypertrophie ventriculaire gauche septale limitée à 11mm sans
évidence d'infiltrat sarcoïdosique, avec une FEVG conservée
et persistance de l'épanchement péricardique surtout apical de
10mm sans trouble hémodynamique.
En accord avec le pneumologue, le Médrol® est
diminué à 16mg / j et sera progressivement réduit puis
finalement stoppé en juillet 2000.
Novembre 2000, la patiente se plaint de dyspnée.
L'échographie cardiaque est stationnaire tandis que le scanner
thoracique montre des infiltrations pulmonaires bilatérales comparables
à celles de 1999 avant le traitement par corticoïdes. Il y a donc
récidive de l'atteinte pulmonaire après arrêt des
corticoïdes depuis 5 mois alors que sur le plan cardiaque la patiente est
stable. Les EFR sont normales avec VEMS à 83%, CV à 91%,
Tiffeneau à 94% et une diffusion normale à 82%. La patiente est
reprise en charge en pneumologie.
Discussion :
La fréquence des atteintes cardiaques est
estimée à moins de 5% des cas (1 ). Bien que pouvant toucher
n'importe quelle partie du coeur, les localisations cardiaques
spécifiques concernent surtout le ventricule gauche ( 1 , 35 , 36 ): on
peut donc avoir des troubles de la conduction auriculo-ventriculaire, des
troubles du rythme ventriculaire , des douleurs thoraciques parfois angineuses,
des troubles de la repolarisation , une insuffisance ventriculaire gauche
progressive, un aspect électrocardiographique d'infarctus du myocarde,
une péricardite ou une mort subite surtout chez les sujets jeunes.
Le diagnostic de sarcoïdose cardiaque n'est pas simple
mais doit être fortement évoqué chez tout patient souffrant
de sarcoïdose et qui présente un électrocardiogramme anomal,
des douleurs thoraciques, une lipothymie ou une syncope ( 42 ).
Bien qu'il soit rare d'avoir uniquement une atteinte cardiaque
isolée de la sarcoïdose sans participation des autres organes , il
est important de garder ce diagnostic à l'esprit dans
l'évaluation des maladies cardiaques sans autre cause évidente,
surtout chez les jeunes patients.
Outre l'échographie cardiaque, la tomoscintigraphie de
perfusion au thallium 201 ou au MIBI marqué au technétium 99m est
très utile au diagnostic ( 1, 37, 40, 43 ); elle met en évidence
des zones d'hypofixation à l'état basal résolutives
totalement ou partiellement lors d'une nouvelle exploration après
injection intraveineuse de dipyridamole ( 1, 38 ). Ce résultat est
opposé à celui observé en cas de maladie coronarienne
commune. Dans les cas difficiles et préoccupants, il peut être
justifié de recourir à une biopsie endomyocardique mais la
rentabilité de celle-ci est inconstante du fait qu'un résultat
négatif n'élimine pas une atteinte myocardique ( 39, 40, 43 ).
20
Chez ce patient, devant le développement d'un
épanchement péricardique alors que les lésions
sarcoïdosiques pulmonaires et cardiaques ont régressé sous
traitement, toute autre étiologie ( notamment infectieuse ) a
été recherchée et exclue.
21
Localisations ophtalmologiques dans la
sarcoïdose: 5ème cas
Patient de 29 ans adressé le 28/08/99 par la
consultation d'ophtalmologie pour bilan d'une uvéite antérieure
évoluant depuis 4 ans et traitée localement par collyre de
corticoïdes . Aucune gêne respiratoire.
Pas d'antécédents morbides majeurs. Tabagisme
arrêté depuis un an.
L'examen clinique est normal.
Un bilan complémentaire est réalisé et on
trouve des adénopathies médiastinales plus marquées
à gauche à la radiographie et au scanner thoracique.
Le bilan sanguin montre un ECA à 68 UI / l,
calcémie normale, pas de syndrome inflammatoire.
La fibroscopie bronchique est normale. Le LBA montre une
lymphocytose supérieure à 50% dont 81.5% de CD4 et 5.7% de CD8
avec un rapport CD4 / CD8=14.
La scintigraphie au gallium est hypercaptante au niveau des
glandes lacrymales, au niveau des parotides et surtout au niveau des ganglions
hilaires pulmonaires.
La spirométrie est normale avec une diffusion
légèrement abaissée à 72%.
La biopsie des glandes salivaires accessoires conclut à
une sialadenite granulomateuse.
Ces éléments permettent de retenir le diagnostic
de sarcoïdose avec comme manifestation première une uvéite
antérieure.
Pas de traitement instauré par voie orale et le patient
sera réévalué dans les mois à venir.
Février 2000 : pas de plainte.
Le bilan réalisé montre : ECA à 40 UI /l
( normal ). Persistance des adénopathies hilaires bilatérales
à la radiographie du thorax. Les EFR sont normales avec une diffusion
abaissée à 66%.
Septembre 2000 : Evolution très favorable de
l'uvéite antérieure. Les EFR sont normales avec une diffusion
normale ( 88% ).
Novembre 2000 : La radiographie de thorax montre une
nette régression des adénopathies par rapport à
Février 2000.
En conclusion : Sarcoïdose Stade I ayant comme
manifestation première l'uvéite. Rémission
spontanée des atteintes pulmonaires. Le patient sera
réévalué dans un an .
22
6ème cas :
Patiente de 79 ans suivie en ophtalmologie pour uvéite
bilatérale traitée par collyre ( Tropicole® et Pred
Forte®). Elle est adressée en pneumologie en août 2000, elle
se plaint d'une petite toux.
Ses antécédents sont : l'hypertension
artérielle ( traitée par Amlor® et Ténormin® ).
Elle a été opérée de la vessie et a subi une
mastectomie. Elle ne fume pas et était kinésithérapeute de
profession.
L'examen clinique est banal, l'auscultation pulmonaire
retrouve seulement quelques râles bronchiques aux bases pulmonaires.
Le bilan sanguin montre un ECA à 128 UI /l. Le reste
étant normal.
La radiographie du thorax est normale hormis une turgescence
du hile gauche. Le scanner thoracique retrouve des adénopathies
médiastinales et hilaires gauches.
La fibroscopie bronchique est globalement normale, le lavage
broncho-alvéolaire est à prédominance lymphocytaire (
supérieur à 50% )avec un rapport CD4 / CD8 = 54.7.
L'intradermoréaction est négative à la
tuberculine, candidine et varidase.
Les EFR sont normales sauf une discrète
élévation du volume résiduel à 130%, la diffusion
est normale.
Il s'agit encore d'un cas de sarcoïdose dont la
première expression clinique est l'atteinte oculaire.
La patiente n'a pas été traitée et une
réévaluation clinique, radiologique et spirométrique
était prévue dans 6 mois.
23
7ème cas :
Patient de 30 ans adressé en pneumologie en Novembre 93
pour bilan d'une uvéite bilatérale débutée en
Septembre 93.
Les antécédents de ce patient sont une tendinite
à la cheville gauche en Mai 93 et une amygdalectomie. Il ne fume pas, il
a travaille dans la photogravure. Son traitement comprend du Maxitrol®
collyre.
L'examen physique est banal.
On lui réalise un bilan complémentaire notamment
une radiographie du thorax et un scanner thoracique qui montrent un syndrome
interstitiel avec des adénopathies hilaires et médiastinales.
Les intradermoréactions ( à la tuberculine,
candidine et varidase ) sont négatives.La fonction respiratoire
présente une légère restriction, la diffusion est
normale.
La scintigraphie au gallium montre une captation pathologique
au niveau des glandes parotides, des glandes lacrymales.
Le lavage bronchoalvéolaire était
ininterprétable du fait de l'importante contamination par les cellules
respiratoires ( 72 à 85% ).
L'enzyme de conversion de l'angiotensine ( ECA ) est à 127
UI /l pour une normale variant de 8 à 52UI /l. Le reste du bilan sanguin
est quasi normal Les résultats de la fibroscopie avec biopsies
bronchiques sont compatibles avec une sarcoïdose ( granulomatose non
caséeuse ).
En conclusion : Le patient présentait une
sarcoïdose révélée par une uvéite Un
traitement par Médrol® 32mg /j est instauré le 02/12/93.
Le patient est revu en consultation le 23/12/93 et signale une
amélioration de l'acuité visuelle, la fonction respiratoire est
améliorée. La radiographie de thorax montre une disparition quasi
complète de l'infiltration interstitielle avec une nette
régression des ganglions hilaires.
Depuis lors le patient est régulièrement suivi
et évolue favorablement. La corticothérapie est progressivement
réduite.
Novembre 1994 : Poussée d'uvéite
après sevrage partiel de la corticothèrapie. Le bilan
réalisé est rassurant ( radiographie thoracique normale, EFR
stables ). Cette poussée est contrôlée par un traitement
local ( collyre ).
Février 1995 : nouvelle poussée
d'uvéite après arrêt complet de la corticothérapie.
Pas d'autres plaintes associées. EFR stables, diffusion normale. La
corticothérapie locale est poursuivie
Juin 1997 : Le patient consulte pour dyspnée
d'effort apparue depuis un mois. L'examen clinique est banal en dehors d'un
vitiligo au niveau du thorax, atteinte cutanée pouvant être
secondaire à la sarcoïdose. Un nouveau bilan est
réalisé et montre à la radiographie du thorax ainsi qu'au
scanner thoracique, une réapparition d'adénopathies
médiastinales et un syndrome interstitiel. L' ECA est à 167UI
/l.
Les EFR montrent un syndrome restrictif avec CPT à 69%,
la diffusion est normale.
Le LBA montre une alvéolite lymphocytaire intense ( 62
à 73% ) dont 72% de CD4 et 5% de CD8 avec un rapport CD4 / CD8 à
14.5.
Il s'agit donc d'une poussée de sarcoïdose stade
II.
24
Une corticothérapie ( Médrol® 32mg /j ) est
reprise apportant ainsi une amélioration significative de la fonction
respiratoire. Du fait de l'apparition d'une myopathie cortisonique, la
corticothérapie a été progressivement diminuée puis
stoppée en Octobre 1997.
Depuis lors , le patient bénéficie d'un suivi
régulier dont le dernier en date du 29/05/2000 montrait une
uvéite en rémission quasi complète, les EFR normales. A la
radiographie on retrouvait encore quelques opacités
réticulonodulaires. Une nouvelle consultation était prévue
en mai 2001.
Discussion :
Les localisations ophtalmologiques s'observent dans 20
à 50% des cas de sarcoïdose en fonction de leur recherche
systématique par un examen à la lampe à fente ( 49, 52 ).
Tous les tissus oculaires peuvent être atteints mais l'uvéite
antérieure représente les 2/3 des cas ( 49 ). Une névrite
optique est rare.
L'atteinte oculaire est soit une manifestation
révélatrice de la sarcoïdose soit une complication de
celle-ci ( 6, 52 ).
Le syndrome d'HEERFORD associe l'uvéite, parotidite et
fièvre et le plus souvent une atteinte d'un nerf facial et / ou d'un
autre nerf crânien ( 52, 53 ). Le syndrome de MIKULICK a
été développé précédemment ( voir cas
N°3 ). Les patients de race noire font plus facilement des uvéites
antérieures tandis que ceux de race blanche développent plus
facilement l'uvéite postérieure ( 11, 54 ).
25
8ème cas . Chylothorax et sarcoïdose
:
Avec l'accord de l'auteur ( DR Marie Luce CARLIER ), je
reprends ici en grandes lignes un cas intéressant publié dans la
Revue des Maladies Respiratoires, 1997, 14, 315-317 ( 69 ).
Il s'agit d'un homme de 64 ans d'origine algérienne qui
consultait en Octobre 1992 pour une toux.
La radiographie du thorax montrait un élargissement du
médiastin avec de
volumineuses adénopathies. Ceci est confirmé par
le scanner thoracique. L'ECA est à 147UI /ml ( normale inférieure
à 55UI / ml ).
L'histopathologie des biopsies ganglionnaires, obtenues par
médiastinoscopie, met en évidence des lésions
epithélio-giganto-cellulaires non caséifiées compatibles
avec la sarcoïdose.
En absence de toute perturbation fonctionnelle (voir tableau
I),aucun traitement n'a été instauré.
Avril 1994 :Le patient consulte pour dyspnée
d'effort. La radiographie du
thorax montrait un épanchement pleural droit de moyenne
abondance.
L'ECA était à 224UI /ml.
La ponction pleurale ramenait 600ml de liquide
séro-fibrineux exsudatif ( taux
de protéines à 61g /l, Rivalta positif ) contenant
60% de lymphocytes.
La recherche de BK est négative.
La biopsie pleurale montre un aspect inflammatoire non
spécifique.
Les EFR sont normales avec une diffusion normale du monoxyde de
carbone,
pas d'hypoxie à l'effort.
Le patient refusant d'autres investigations, a quitté le
service.
Mars 1995 :Une radiographie du thorax
réalisée de façon systématique montre un
épanchement pleural droit dont la ponction ramène 400ml de
liquide chyliforme. L'analyse de ce liquide confirme qu'il s'agit de chyle vrai
avec un taux de protéines à 60g /l, présence de
chylomicrons, les triglycérides sont à 13g /l et le taux de
cholestérol total à 1.33g /l.
L'analyse cytobactériologique de ce liquide
était négative ( pas de cellules suspectes de malignité,
pas de BK ni d'autres germes ).
La fibroscopie bronchique avec biopsies des éperons est
négative.
L'ECA est à 135UI /ml.
Le LBA montrait 200000 cellules /ml dont 31% de macrophages,
67% de lymphocytes et 2% de neutrophiles.
Les EFR montrent un syndrome restrictif ( voir tableau I )
Le scanner thoracique confirme l'épanchement pleural
droit avec rétraction de l'hémithorax droit, collapsus de la
bronche lobaire inférieure droite et multiples adénopathies
médiastinales, bilatérales, antérieures,
paratrachéales et sous carènaires (fig. 3).
L'analyse anatomo-pathologique d'un ganglion latéro
trachéal droit prélevé lors d'une deuxième
médiastinoscopie ( réalisée pour exclure une pathologie
néoplasique ) confirmait encore une fois le diagnostic de
sarcoïdose.
26
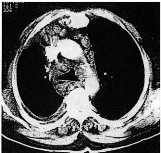
Un régime alimentaire avec triglycérides
à chaîne moyenne était instauré et une
corticothérapie ( 1mg /kg /j soit 60mg /j de Prednisolone® )
était débutée en Avril 1995.
Trois mois plus tard, on a observé une
régression modérée du volume des adénopathies
médiastinales et de l'épanchement pleural, associé
à une
normalisation de L'ECA. La corticothérapie fut alors
diminuée
progressivement jusqu'à 15mg /j.
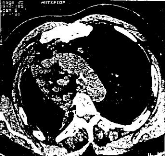
Mai 1996 : Un nouveau bilan est réalisé
et on trouve l'ECA élevé à 93UI /ml, persistance de
l'épanchement pleural droit ( à la radiographie de thorax ),
confirmé par le scanner thoracique qui met aussi en évidence des
adénopathies médiastinales de taille identique à celles
observées en Mars 1995 et une importante rétraction de
l'hémithorax droit (fig. 4).
figure 4
Les EFR objectivent un syndrome restrictif
sévère sans anomalie de la diffusion du monoxyde de carbone (
voir tableau I ).
La gazométrie en air ambiant est normale au repos. La
scintigraphie pulmonaire de ventilation et de perfusion montre une exclusion
fonctionnelle quasi totale du poumon droit.
L'épreuve d'effort, limitée par la
dyspnée, n'entraîne pas de désaturation ( voir tableau II
).
La fibroscopie bronchique est normale.
Le LBA ramène 64000 cellules/ ml dont 48% de
macrophages, 50% de lymphocytes et 2% de neutrophiles.
Vu l'importance du trouble ventilatoire, les anomalies et les
signes biologiques d'activité, la corticothérapie est
majorée.
27
Tableau I -Paramètres fonctionnels respiratoires (
les pourcentages des valeurs théoriques sont exprimés entre
parenthèses ).
Octobre Avril Mars Mai
1992 1994 1995 1996
CVF (ml) 3200 3000 2000 1650
(82%) (80%) (53%) 44%
VEMS (ml) 2600 2520 1560 1330
(89%) (87%) (54%) (47%)
VEMS / CVF (%) 81% 84% 78% 81%
CPT (ml) 5780 5610 non fait 2400
(88%) (86%) (36%)
DLCO (ml /min non fait 24.00 non fait 11.41
mmHg (95%) (45%)
DLCO / VA (ml / non fait 4.96 non fait 4.76
min / mmHg / L ) (98%) (125%)
CVF : capacité vitale forcée ; VEMS :volume
expiratoire maximale seconde ; CPT : capacité pulmonaire totale ; DLCO :
diffusion du monoxyde de carbone VA : volume alvéolaire
Tableau II - Epreuves d'effort
Avril 1994 Mai 1996
repos effort repos effort
Charge maximale 60 Watts 55Watts
PH 7.42 7.37 7.42 7.43
Pa O2 (mmHg) 89 90 76.7 78.5
PaCO2 (mmHg) 38 37.0 42.6 38.5
SaO2 (%) 97 96.7 93.4 93.8
VO2max (ml /min /Kg) non fait 10.2
P(A-a)O2 (mmHg) non fait non fait 21 32
28
Discussion :
Le chylothorax est l'accumulation du chyle dans l'espace
pleural. La ponction pleurale ramène du liquide laiteux, exsudadif,
renfermant des triglycérides à un taux supérieur à
110 mg /dl. S'il existe un doute diagnostique ou un taux de
triglycérides entre 50 et 110 mg / dl, la présence de
chylomicrons à l'électrophorèse des lipoprotéines
du liquide pleural établit le diagnostic de chylothorax. Il faut le
différencier d'un pseudo-chylothorax où le taux de
cholestérol est élevé, d'évolution chronique.
Dans certains cas, le liquide peut être
séro-fibrineux d'aspect et de quantité variables en fonction des
apports lipidiques.
Les quatre grands groupes d'étiologies de chylothorax
sont :les tumeurs dures dans 50% des cas ( secondaires à un lymphome
dans plus de 75% des cas ),les causes traumatiques dans 25% des cas,
idiopathiques dans 15% des cas et le quatrième groupe renfermant les
causes rares comme la sarcoïdose.
Le chylothorax est la conséquence d'une lésion
du canal thoracique, collecteur central des voies lymphatiques sous
diaphragmatique. Le canal thoracique prend son origine dans la région
lombaire supérieure à hauteur de L2. Il chemine à la face
antérieure des corps vertébraux. entre l'aorte et les veines
azygos. Il entretient durant son trajet des rapports étroits avec la
crosse aortique et l'oesophage. Entre les vertèbres dorsales D6 et D4,
il croise la ligne médiane de la droite vers la gauche, pour gagner
l'artère sous-clavière gauche qu'il accompagne jusqu'à la
région cervicale inférieure. Du fait de son trajet, une
lésion en amont de D6 sera responsable d'un chylothorax droit et une
lésion en aval de D4 entraîne un chylothorax gauche ou
bilatéral ( 70 ).
Deux mécanismes peuvent être à l'origine
d'une lésion du canal thoracique : un traumatisme direct du canal
thoracique ou d'une de ses principales collatérales ou une compression
extrinsèque avec augmentation de pression en amont de la sténose
et rupture de collatérales fragilisées. Cependant ,la ligature du
canal thoracique à différents points ne donne pas toujours de
chylothorax car il existe d'importantes variations anatomiques individuelles et
le nombre d'anastomoses lymphatico-lymphatiques ou lymphatico- veineuses est
variable.
L'évolution de la pathologie responsable sera donc
marquée par l'apparition d'un chylothorax en fonction de la richesse des
collatérales, de l'importance de la compression extrinsèque , de
son extension aux collatérales et de la vitesse d'installation ( 70, 71
).
Le chylothorax est une manifestation rare de la
sarcoïdose ( 62 ), il peut être inaugural ou compliquer
l'évolution d'une sarcoïdose connue ( 60, 61, 66, 67 ), le plus
souvent par compression extrinsèque des voies lymphatiques principales
par des adénopathies médiastinales ( comme chez ce patient ) et
dont la lymphographie confirme l'absence de fuite du produit de contraste ( 64,
66 ). L'apparition progressive de la rétraction hémi-thoracique
droite, de l'exclusion fonctionnelle pulmonaire droite et du trouble restrictif
sévère chez ce patient est compatible avec la présence
d'une fibrose pleurale comme cela a déjà été
rapporté dans la littérature ( 64 ).
Cependant, l'origine de la fibrose pleurale n'est pas
très claire. L'une des hypothèses est que la fibrose pleurale
soit secondaire à la sarcoïdose et dans ce cas, on devrait
retrouver des granulomes sur les biopsies pleurales réalisées (
65 ) mais cette hypothèse ne se rapporte pas au cas
présenté du fait de l'absence de granulomes sur les biopsies
pleurales réalisées et de l'unilatéralité de la
rétraction thoracique.
Une autre hypothèse, plus adaptée au cas
présenté, est celle d'une fibrose pleurale secondaire à la
pérennisation du chylothorax.
29
La mise en route du traitement ( corticothérapie )
permet normalement la régression puis la disparition des
adénopathies et de l'épanchement pleural ( 61, 65, 66 )
contrairement au cas présenté où le chylothorax se
pérennise nécessitant ainsi de prolonger le traitement à
des doses efficaces.
Il faut savoir que la sarcoïdose est une pathologie qui
se complique rarement de chylothorax. Il est donc indispensable
d'éliminer une pathologie néoplasique sous jacente ou
associée à la sarcoïdose ( 63 ).
L'apparition du chylothorax ( en 1994 ) chez ce patient dont
la sarcoïdose a été diagnostiquée en 1992 par
médiastinoscopie justifiait la réalisation d'une deuxième
médiastinoscopie ( 1995 ) afin d'écarter les autres
étiologies plus fréquentes.
30
9ème cas . Sarcoïdose cutanée, nasale
et pulmonaire :
Patiente de 26 ans, d'origine marocaine, hospitalisée
du 04/09/96 au 18/09/96 pour amaigrissement ( 8Kg en 6 semaines ) malgré
un appétit conservé, dyspnée d'effort, obstruction nasale
chronique, asthénie, légère dysphagie aux aliments solides
et toux peu productive.
Ses antécédents sont : Une thrombopénie
durant la grossesse, appendicectomie et cholécystectomie. Elle fume 2
à 3 cigarettes par jour et ne boit pas d'alcool.
A l'examen clinique on retrouve essentiellement une patiente
amaigrie, une lésion cutanée au niveau du front et un petit
ganglion cervical gauche.
Les examens complémentaires sont réalisés
:
Bilan sanguin : Leucopénie à 2300 /mm3,
thrombopénie à 118000 /mm3, VS 36mm à la première
heure, une hypertriglycéridémie à 211mg / dl, l'ECA
à 93UI / l. Le reste du bilan sanguin est négatif. Les ANCA et
les facteurs rhumatoïdes sont négatifs. Les expectorations sont
négatives ( examen direct, culture et recherche de BK).
La radiographie du thorax montre des micronodules
bilatéraux, des adénopathies hilaires et médiastinales.
Ceci est confirmé par le scanner thoracique.
A la fibroscopie bronchique on note un aspect inflammatoire de
la muqueuse surtout au niveau de lobe inférieur droit.
L'examen bactériologique du LBA est négatif (
examen direct, culture et recherche de BK ).
Les biopsies transbronchiques retrouvent des lésions
granulomateuses non caséeuses au niveau du lobe inférieur droit,
la coloration de Ziehl est négative.
Biopsie cutanée : présence de multiples
granulomes épithéloïdes, coloration de Ziehl
négative.
La scintigraphie au gallium montre une hypercaptation au
niveau des deux champs pulmonaires, du nez et de la région
cervico-latérale gauche.
L'examen ORL et la rhinoscopie objectivent de volumineux
cornets et de multiples granulomes au niveau du septum et des cornets.
Le scanner des sinus : comblement complet des sinus
maxillaires, des sinus éthmoïdes bilatéralement, du sinus
frontal gauche. Pas de remaniement ostéolytique.
Les EFR : déficit obstructif modéré avec une
diffusion abaissée.
L'examen ophtalmologique met en évidence une
sécheresse oculaire majeure sans signe d'uvéite.
L'IDR ( tuberculine, candidine, varidase ) est
négative.
L'ECG, l'échographie cardiaque et la fibroscopie digestive
sont sans particularité En conclusion : Il s'agit d'une
sarcoïdose avec atteinte multi-systémique ( pulmonaire,
cutanée et nasale). La patiente est traitée par
corticothérapie locale ( Bécotide® associée au
Béconase aqua® ).
Février 97 : Rémission de la
symptomatologie, la radiographie du thorax montre un discret syndrome
interstitiel bi-basal, pas d'adénopathies. L'ECA est normal (56UI /l).
La corticothérapie inhalée est stoppée parce que mal
supportée par la patiente.
Février 98 : La patiente est enceinte de 7 mois,
se plaint de dyspnée à la marche et signale des épisodes
d'épistaxis. Un nouveau bilan est programmé afin d'exclure une
récidive. Malheureusement la patiente ne s'est plus
présentée en consultation.
31
Discussion :
-Les manifestations cutanées de la sarcoïdose se
voient chez 20% à 35% des patients, deux fois plus souvent chez les
femmes que chez les hommes (1, 52, 74, 75 ). Les lésions granulomateuses
observées sont les sarcoïdes à petits ou gros nodules, les
plaques, les nodules sur cicatrice, le lupus pernio et les nodules sous
cutanés ( 1, 72 ). 10% des cas de sarcoïdose sont
révélés par un érythème noueux.
L'érythème noueux
( localisé le plus souvent à la face
antérieure des jambes ) n'est pas une lésion sarcoïdienne
spécifique cependant la sarcoïdose en est la cause identifiable la
plus fréquente ( 1, 78 ).
L'association érythème noueux,
adénopathies hilaires bilatérales et une intradermo
réaction négative à la tuberculine constitue le syndrome
de LÖFGREN dont la sarcoïdose en est la cause unique ( 1 ). Parfois
les adénopathies hilaires apparaissent plusieurs semaines après
l'apparition de l'érythème noueux. 90% des cas de LÖFGREN
régressent sans séquelle en moins de deux ans.
-La localisation nasale représente moins de 5% des cas.
L'atteinte de l'os nasal est plus fréquente chez la
femme durant les 3ème, 4ème et 5ème
décennies de la vie (11, 80 ) ; cliniquement, elle se manifeste par la
congestion nasale, une sensation de nez bouché et d'induration nasale.
La perforation nasale est rare ( 11, 81 ).
32
10ème cas . sarcoïdose pulmonaire
et transplantation pulmonaire :
Patient de 28 ans adressé en consultation de
pneumologie le 29/01/1982 pour toux sèche avec parfois des
expectorations muqueuses évoluant depuis 3 mois, amaigrissement et
dyspnée d'effort, pas de fièvre ni de sudation anormale,
l'appétit est conservé. Il a d'abord été
traité comme une trachéïte mais sans succès car la
toux s'aggrave, surtout à l'inspiration.
Ses antécédents sont : une notion de tuberculose
dans le bas âge, une fracture du tibia gauche suite à un accident.
Il fume en moyenne 15 cigarettes par jour. Il exerce la profession de
réparateur d'appareils électroniques.
L'examen clinique est banal hormis une toux sèche
declenchée à l'inspiration profonde et quelques petites
adénopathies inguinales.
Un bilan complémentaire réalisé en
ambulatoire montre une biologie sanguine normale, pas de syndrome
inflammatoire, les anticorps anti-nucléaires sont faiblement positif,
pas d'IgE spécifique. La radiographie pulmonaire montre de nombreuses
opacités réticulaires et micronodulaires bilatérales avec
un maximum au niveau des deux sommets sans image cavitaire évidente. Sur
les tomographies, on retrouve quelques images ganglionnaires
médiastinales droites. La fibroscopie bronchique ne montre pas
d'anomalie. Le lavage bronchoalvéolaire montre une lymphocytose
alvéolaire à 14%, 2% d'éosinophiles, pas de neutrophile.
L'examen cytobactériologique du LBA est négatif..
L'intradermoréaction est négative pour la tuberculine, la
candidine et la varidase. Les EFR montrent un trouble ventilatoire obstructif (
voir tableau III ). L'épreuve d'effort est bien tolérée,
pas de désaturation significative du sang artériel. Les biopsies
transbronchiques montrent du tissu conjonctif avec des petits granulomes
formés par les histiocytes, des cellules épithéliales et
des lymphocytes. La coloration de Ziehl est négative. La scintigraphie
au gallium montre une hypercaptation pulmonaire. L'ensemble de ce bilan permet
de retenir le diagnostic de sarcoïdose pulmonaire le 12/03/1982.
Compte tenu de l'état clinique stable du patient et
aussi de la possibilité de régression spontanée le patient
n'est pas traité mais sera réévalué dans 6 mois.
Février 1984 : Persistance de la toux surtout
à l'effort, la dyspnée est assez marquée, perte
pondérale de 3Kg en 2 ans. Le bilan sanguin est non contributif. La
radiographie pulmonaire reste inchangée.. Le LBA montre une très
nette augmentation des lymphocytes alvéolaires entre 25 et 42%. Les EFR
sont très perturbées par rapport à celles de 1982 ( voir
tableau III ). L'épreuve d'effort est mal tolérée et
montre une importante tachycardie et une hyper ventilation majeure pour une
charge de 120 watts. Malgré la stabilité des images
radiologiques, le traitement est instauré ( Prednisolone® 50mg
/jour ) mais le patient refuse ce traitement et se confie aux
homéopathes.
Décembre 1984 : Dégradation de
l'état général, aggravation de la dyspnée,
aggravation des images radiologiques décrites précédemment
avec apparition d'images bulleuses. Le patient consent à commencer le
traitement le 05/12/1984. Après un mois et demi , il signale une nette
régression de la dyspnée et a même repris 4Kg.
Radiologiquement ( cliché de Février 1985 ), on observe une
régression remarquable des micronodules.
33
Fin Mai 1985 : Le patient se sent beaucoup mieux. Les
EFR montrent un léger gain de la capacité vitale et du VEMS.
Malgré l'évolution radiologique péjorative qui montre un
aspect emphysèmateux et bulleux de l'ensemble des deux champs
pulmonaires, la corticothérapie est réduite à 30mg
/jour.
Par la suite, le patient est alors régulièrement
revu en consultation et subit à chaque fois un bilan radiologique et
fonctionnel. Malgré la relative stabilité de la dyspnée,
les EFR deviennent de plus en plus catastrophiques ( voir tableau III ). La
Prednisolone® est réduite progressivement ( à 15mg, 10mg,
5mg ) est sera arrêtée en Novembre 1991, le patient ne prenant
plus que Duovent® et Bécotide®.
Fin Octobre 1992 : La possibilité d'une greffe
pulmonaire est évoquée et le patient est hospitalisé
à ERASME du 18/01/93 au 22/01/93 pour bilan de pré-greffe.
L'équipe de transplantation ne retient pas l'indication d'une greffe
pulmonaire.
Alors qu'il réalisait encore un effort de 80 Watts en
novembre 1990, en 1995 il ne peut réaliser qu'un effort de 30 Watts. La
sarcoïdose a atteint le stade terminal dont la seule solution
thérapeutique reste la greffe. Le patient est alors inscrit sur une
liste d'attente le 15/08/95.
34
Tableau III : Epreuves Fonctionnelles Respiratoires
Pré- opératoires
Quelques valeurs
récapitulatives.
|
Février 82
|
Février 84
|
Janvier 85
|
Janvier 86
|
Mai 87
|
Janvier 93
|
Décembre 94
|
Avril 95
|
|
CV ( l )
|
4.3
|
3.9
|
3.8
|
4.4
|
3.38
|
-
|
2.14
|
2
|
|
CRF ( l )
|
3.9
|
3
|
4.3
|
3.7
|
6.8
|
-
|
-
|
-
|
|
CPT ( l )
|
5.8
|
5.36
|
5.9
|
-
|
-
|
-
|
-
|
-
|
|
VEMS ( l )
|
2.59
|
1.79
|
1.42
|
1.43
|
0.9
|
0.84
|
0.70
|
0.56
|
|
VEMS/CV ( % )
|
60.15
|
46
|
37
|
32
|
27
|
-
|
27
|
28
|
|
DLCO
(ml/ min/ mmHg)
|
23.5
|
18.19
|
20.84
|
16.86
|
15.3
|
-
|
57
|
33
|
|
KCO
(ml/ min/ mmHg/l)
|
3.52
|
4.72
|
4.63
|
4.02
|
3.83
|
-
|
-
|
-
|
35
Le 24/03/97 : Il bénéficie d'une
transplantation bi-pulmonaire. Dans les suites opératoires, le patient a
présenté un saignement relativement important au niveau des
drains thoraciques et qui s'est progressivement tari en 48 heures. Il a ensuite
présenté une ischémie de la muqueuse bronchique au
delà des anastomoses, spontanément résolutive. Il n'y a
pas eu de complication infectieuse et le patient est sorti de l'hôpital
au 24ème jour post opératoire tout en continuant
à prendre son traitement ( Néoral®, Imuran®,
Médrol®, Bactrim fort®, Calcium et D cure® ). Il a par la
suite bénéficié d'une revalidation qui a progressivement
améliorée son état général et sa fonction
respiratoire ( voir tableau IV ).
L'endoscopie , réalisée au début du mois
de Mai 97, montrait la disparition des lésions d'ischémie
bronchique visualisées antérieurement. Le lavage
bronchoalvéolaire était stérile et les biopsies
trans-bronchiques ne montraient pas de rejet.
Mars 98 : Le patient est hospitalisé pour bilan
à un an de la transplantation. Il est en très bonne forme, il
avait présenté quelques expectorations teintées de sang
mais sans gravité. Le bilan est globalement satisfaisant, les EFR sont
normales (voir tableau IV ). La scintigraphie pulmonaire de ventilation et de
perfusion est normale alors qu'avant la greffe la perfusion était de 52%
à gauche et 48% à droite. Au test de marche de 6 minutes, le
patient parcourt 658 mètres sans modification de la saturation
artérielle en oxygène ; Il réalise un test d'effort de 110
watts avec un VO2max à 26 ml / Kg / min. L'endoscopie bronchique est
normale, les anastomoses sont saines. Le lavage bonchoalvéolaire est
stérile et les biopsies trans-bronchiques ne montrent pas de signe de
rejet.. La densité osseuse est abaissée au niveau de la colonne
lombaire ( 81% ) et du col fémoral ( 80% ) , les IgG sont à 598
mg /l , la clearance à la créatinine est 79 ml /min. Le reste du
bilan est rassurant ( radio de thorax, scanner thoracique, fond d'oeil,
échographie cardiaque et abdominale, bilan sanguin , examen
microscopique des urines ).
Depuis Septembre 1998 le patient n'est plus revenu en
consultation et il a même réduit les doses d'immuno-suppresseurs
sans avis médical.
Du 19/04/1999 au 23/04/1999 : Il est
hospitalisé pour un nouveau bilan après deux ans. Dans l'ensemble
le bilan est rassurant hormis une insuffisance rénale chronique due
à la Ciclosporine ( Néoral® ), la clearance à la
créatinine est de 60 ml / min.
Du 27/11/2000 au 29/11/2000 : Nouvelle hospitalisation
pour une réévaluation après trois ans et demi de
transplantation. Le bilan est globalement satisfaisant : les valeurs de la
fonction respiratoire sont normales mais inférieures par rapport aux
meilleures valeurs obtenues ( voir tableau IV ). Le scanner thoracique met en
évidence un trappage expiratoire important. La scintigraphie pulmonaire
de ventilation et de perfusion est plus hétérogène avec
une perfusion de 45% à gauche et 55% à droite .LBA stérile
; biopsies transbronchiques sans particularité. Peut être qu'un
rejet chronique de l'allogreffe pulmonaire s'installe mais ceci devrait
être confirmé ou infirmé par les résultats d'autres
biopsies prévues en janvier 2001. L'ostéoporose est
corrigée ( Arédia®, Calcium, D cure® ). On note une
hypogammaglobulinémie avec IgG à 502 mg ( normale
supérieure à 650 ). La clearance à la créatinine
est de 54ml / minute.
36
Tableau IV : Quelques valeurs des EFR
post-opératoires.
|
Avril 1997
|
Juin 1997
|
Mars 1998
|
Avril 1999
|
Novembre2000
|
|
VEMS
|
65%
|
|
2.81 l
|
|
|
3.26 l
|
|
3.78 l
|
|
3.52 l
|
|
|
|
(
|
76%
|
)
|
(
|
89% )
|
(
|
104%
|
)
|
( 89%
|
)
|
|
CV
|
55%
|
|
3.12 l
|
|
|
3.99 l
|
|
4.36 l
|
|
4.08 l
|
|
|
|
(
|
67%
|
)
|
(
|
85%)
|
(
|
98%
|
)
|
( 89%
|
)
|
|
CPT
|
-
|
|
4.88 l
|
|
|
5.48 l
|
|
5.62 l
|
|
5.26 l
|
|
|
|
(
|
72%
|
)
|
(
|
81% )
|
(
|
83%
|
)
|
( 78%
|
)
|
|
IFFENEAU
|
-
|
(
|
90%
|
)
|
(
|
88% )
|
(
|
86%
|
)
|
( 86%
|
)
|
|
DLCO /VA
|
-
|
(
|
80%
|
)
|
(
|
69% )
|
(
|
84%
|
)
|
( 80%
|
)
|
Discussion :
Il s'agit d'un cas de sarcoïdose pulmonaire qui a
évolué vers le stade terminal avec une présentation
clinique et fonctionnelle de bronchopathie chronique obstructive qui est une
des complications tardives de la sarcoïdose ; à ce stade le
traitement médical est peu efficace, la meilleure solution
thérapeutique est la transplantation ( 84, 88, 89 ).
La transplantation bi-pulmonaire, plutôt qu'une
transplantation mono-pulmonaire est justifiée chez ce patient à
cause des importantes zones de destruction parenchymateuse dans les deux
poumons ; le patient étant jeune, une transplantation mono-pulmonaire
lui aurait fait courir un risque réel de récidive de la
sarcoïdose dans le poumon greffé ainsi qu'un risque infectieux non
négligeable ( aspergillus ) dans le poumon restant en place ( 1, 90
).
Il existe quatres complications respiratoires tardives
possibles de la sarcoïdose ( 1 ) : l'insuffisance respiratoire par fibrose
pulmonaire, l'aspergillome intra-cavitaire, la bronchopathie chronique
obstructive ( comme chez notre patient) et le coeur pulmonaire chronique ;
elles apparaissent en général après plus de deux ans
d'évolution et peuvent s'associer entre elles.
.
III Conclusion :
37
La sarcoïdose est une maladie granulomateuse
multiviscérale , elle affecte
principalement les poumons ( tableau V ); il existe cependant
des présentations tout à fait inhabituelles et extra pulmonaires
. C'est le mérite de ce travail qui a sélectionné dix cas
cliniques: dans un cas la sarcoïdose se présente par une
manifestation pulmonaire assez rare ( cas 1 ) ; elle est
révélée par les localisations extra-pulmonaires ( cas 2,
3, 5, 6 et 7 ) ; l'atteinte est d'emblée multi-systémique
touchant le poumon, la sphère ORL et la peau ( cas 9 ). Le
4ème cas est une sarcoïdose cardiaque survenue sept ans
plus tard chez une patiente qui avait présenté une
sarcoïdose pulmonaire ; les deux autres sont des complications de
sarcoïdose pulmonaire notamment le chylothorax ( cas 8 ) et
l'évolution vers un état broncho-emphysémateux avec
trouble ventilatoire obstructif très sévère
nécessitant une transplantation bipulmonaire (cas 10 ).
Recommandations :
1 Outre le bilan préconisé dans
les paragraphes 2.2 et 3 , les atteintes des autres viscères devront
recherchées très soigneusement par :
- l'examen clinique du patient : exploration de tout le
revêtement cutané, palpation de tous les territoires
ganglionnaires, palpation du foie et surtout de la rate.
- L'examen ORL systématique.
- L'examen ophtalmologique systématique avec une lampe
à fente
- L'électrocardiogramme systématique qui devrait
être complété en cas de symptôme même mineur
par l'échographie cardiaque, le holter et la scintigraphie myocardique.
- L'examen des glandes salivaires
- La recherche d'atteintes osseuses par des radiographies
appropriées en particulier celles du crâne, des mains et des
pieds.
- L'examen neurologique : les localisations neurologiques ( 5
à 10% des cas ) concernent le système nerveux
périphérique ( surtout les nerfs crâniens VII,VIII,V,II,
les oculomoteurs ) et / ou le système nerveux central (méningite,
les atteintes directes du cortex ou de la moelle, l'atteinte
cérébelleuse est très rare ).
- Tout organe devrait être exploré au moindre signe
d'appel.
2 Qui faut-il traiter ?
Connaissant la résolution spontanée des stades
I, de LÖFGREN, il parait souhaitable d'observer une abstention
thérapeutique (91) mais avec surveillance attentive à ce stade.
Les patients non symptomatiques mais avec atteinte parenchymateuse
débutante voir très discrète peuvent voir la mise en route
de leur corticothérapie différée éventuellement de
quelques mois afin de mieux juger d'un éventuel degré
d'évolutivité de la maladie ( 91 ).
Dans la majorité des cas il ne faut pas traiter mais
une surveillance médicale doit être maintenue jusqu'à la
guérison. Néanmoins il est nécessaire de traiter :
- Certaines sarcoïdoses fébriles et les formes
très actives et très rapidement évolutives. - Les
localisations viscérales posant un pronostic vital ( localisations
cardiaques, nerveuses, rénales ).
- Les formes qui entraînent des désordres
fonctionnels graves ou inconfortables
38
( localisations ophtalmologiques, formes
dyspnéïsantes ). - Les localisations cutanées
inesthétiques.
Toute affection symptomatique avec signes
généraux au stade II radiologique, avec atteinte extrathoracique
associée, doivent bénéficier d'un traitement par
corticothérapie par voie générale. Cela d'autant plus que
des manifestations fonctionnelles respiratoires ont été
dépistées aux EFR. Les signes biologiques d'activité sont
également à prendre en compte pour la mise en route du traitement
(91).
39
Tableau V MALADIE MULTISYSTEMIQUE
Siège : Fréquence(%)
:
Médiastino pulmonaire 90
Nez < 5
Larynx exceptionnel
Glandes salivaires 5 à 10
Ganglions périphériques 30
Rate 5 à 20
Foie 20
Gastro intestinales exceptionnel
OEil 20 à 50
Peau 15 à 35
Coeur < 5
Muscle < 0,5
Rein rare ( hypercalcémie 3 à 10)
Glandes endocrines 0,5
Os 3 à 5
Articulations 5 ( manifestations aigües )
exceptionnel ( formes chroniques )
Système nerveux 3 à 10
40
IV BIBLIOGRAPHIE :
1. VALEYRE D. Sarcoïdose. Dans :AUBIER M ,FOURNIER M ,
PARIENTE R. Ed. pneumologie Paris : médecine-sciences, Flammarion 1996
:883-893.
2. GRENIER P. Sarcoïdose. Dans : GRENIER P, Ed. Imagerie
thoracique de l'adulte. Paris : médecine-sciences, Flammarion 1996 ;
2ème éd :519-528.
3. FRASER R. Sarcoïdosis. In :FRASER R., PARE J. Eds
diseases of the chest. Philadelphia :WB Saunders Company, 1994 ;
2ème éd :829-844.
4. MÜLLER-QUERNHEIM J. Sarcoidosis : immunopathogenetic
concepts and their clinical application. Eur Respir J. 1998 ; 12 : 716-738.
5. P. DEMAREST, M. DEMAREST-LECOMTE. Critères
diagnostiques et pronostiques dans la sarcoïdose
médiastinopulmonaire. Thèse pour le doctorat en médecine,
Lille 1981.
6. MAMAY MASEKI. Les particularités de la
sarcoïdose des africains. 4ème doctorat ULB ;
1999-2000.
7. LIEBERMAN J. Evolution of serum angiotensin converting enzyme
level in sarcoïdosis. Am J méd 1975 ; 59 : 365-372.
8. SKEGGS LT, KALM J. R., SHUMWAY N.P. The preparation and
function of hypertensin-converting enzyme. J Exp Med 1956 ; 103 : 295-299.
9. STUDDY P-R, BIRD R, GERAINT JAMES D, SHERLOCK S. Serum
angiotensin converting enzyme in sarcoidosis and other granulomatous disorders.
Lancet 1978 ; 11 : 1331-1334.
10. HARRISSON. Maladies de l'appareil respiratoire. Principes de
médecine interne. 14ème édition 1998.
11. D. GERAINT JAMES. Sarcoidosis and other granulomatous
disorders. Volume 73, 1994.
12. SHARMA OP. Sarcoidosis ; unusual pulmonary
manifestations. Postgrad Med J 1977 ; 61 :67-73.
13. SCHIFFNER RQ, SHARMA OP. Acute pulmonary cavitation in
sarcoidosis. West J Med 1977 ; 127 :346-350.
14. BIEM J, HOFFSTEIN Y.Aggressive cavitary pulmonary
sarcoidosis. Am Rev Respir Dis 1991 ;143 :428-430.
15. TELLIS CJ, PUTNAM JS. Cavitation in large multinodular
pulmonary disease. A rare manifestation of sarcoidosis. Chest , 1977 ; 17
:792-793.
16.
41
WOLLSCHLAGER C, KHAN F. Aspergillomas complicating
sarcoidosis. A prospective study in 100 patients. Chest, 1977 ; 86 :585-588.
17. YAMAGUCHI M, OHTA K, TAKIZAWA H, et al . A case of
sarcoidosis with right pneumothorax and multiple cavities in both lung fields.
Nihon Kyobu Shikkan Gakkai Zasshi.1995 ;33 :533-537.
18. MIHAESCU TT, VERES L. Pneumothorax and pulmonary
cavitation in a man with systemic sarcoidosis. Sarcoïdosis 1990 ; 7
:129-132.
19. LIDA K, YOSHINAGA M, KAWAMOTO S. : A case of pulmonary
sarcoidosis with multiple cavitation and pneumothorax. Nihon Kokyuki Gakkai
Zasshi. 1998 ; 36 :197202.
20. YOSHIDA N, KUME H, MIZUNO Y, SAITO Y, SHIMIZU M, TORII K,
ITO Y, SUZUKI R, YAMAKI K. Sarcoidosis with primary acute cavitation
exacerbated by bronchial asthma. Nihon Kokyuki Gakkai Zasshi. 2000 Apr. ; 38(4)
:293-297.
21. RUDZKI C, ISHAK K, ZIMMERMAN HJ. Chronic intrahepatic
cholestasis of sarcoidosis. Am J Med 1975 ; 59 :373-387.
22. NEVILLE E ,WALKER AN , JAMES DG. Prognostic factors
predicting th outcome of sarcoïdosis : analysis of 818 cases. Q J Med,
1983, 208 :525-533
23. ISRAEL HL, MARGOLIS LM, ROSE LJ. Hepatic granulomatosis
and sarcoidosis, further obsevations. Dig Dis Sci 1984 ; 29 :353-356.
24. KEEFFE E. Sarcoidosis and primary biliary cirrhosis. Am J
Med 1987 ; 83 :977-980.
25. BAUGHMAN RP. Sarcoidosis : usual and unusual
manifestations. Chest 1988 ; 94 :165170.
26. BERGER I, KATZ M. Portal hypertension due to hepatic
sarcoidosis. Am J Gastroenterol 1973 ; 59 :147-151.
27. CASAVILLA FA,GORDON R, WRIGHT HI,GAVALER JS,STARZL TE,
VAN THIEL DH. Clinical course often liver transplantation in patients with
sarcoidosis. Ann Intern Med 1993 ;118 :865-866.
28. HUGHES P, Mc GAVIN CR. Sarcoidosis and primary biliary
cirrhosis with coexisting myositis. Thorax 1997 ; 52 :201-202.
29. FARREL LD. Hepatic granulomas : a morphologic approach to
diagnosis. Surg Pathol 1990 ; 3 :87-106.
30. SHERLOCK S. The liver in sarcoidosis. Semin Liver Dis
1992 ; 13 :450-454.
31.
42
SHERMAN S, NIELAND NS, VAN THIEL DH. Sarcoidosis and primary
biliary cirrhosis coexistence in a single patient. Dig Dis Sci 1988 ; 33
:368-374.
32. JAMES DG, SHARMA OP. Parotid gland sarcoidosis.
Sarcoidosis vasc Diffuse lung Dis 2000 Mar. ; 17(1) :27-32.
33. JAMES DG, JONES WILLIAM. Sarcoidosis and other
granulomatosis disorders. Philadelphia ; Saunders 1985 :148-151.
34. LOIS M, ROMAN J, HOLLAND W, AGUDELO C. Coexisting
Sjogren's syndrome and sarcoidosis in the lung. Semin Arthritis Rheum 1998 ; 28
:31-40.
35. ROBERTS WC, Mc ALLISTER HA, FERRANS VJ. Sarcoidosis of
the heart. Am J Med, 1977 ; 63 :85-108.
36. SILVERMAN KJ, HUTCHINS GM, BULKLEY BH. Cardiac sarcoid :
a clinicopathologic study of 84 unselected patients with systemic sarcoidosis.
Circulation, 1978 ; 58 :1204-1211.
37. LE GUDULEC D, MENAD F, FARAGGIM et al. Myocardial
tomoscintigraphy-99mMIBI and thalium-201.Chest, 1994 ; 106 :1675-1682.
38. TELLIER P, PAYCHA F, ANTONY I. et al. Reversibility by
dipyridamole of thallium 201 myocardial scan defects in patients with
sarcoidosis. Am J Med 1988 ; 85 :189-193.
39. RATNER SJ, FENOGLIO JJ, URSELL PC. Utility of
endomyocardial biopsy in the diagnosis of cardiac sarcoïdosis. Chest,
1986, 90 :528-529
40. SHARMA OMP, MAHESHWARI A, THAKER K. Myocardial
sarcoidosis. Chest 1993 ; 103 :253-258.
41. WAIT JL, MOVAHED A. Anginal chest pain in sarcoidosis.
Thorax 1989 ; 44 :391-395.
42. SHARMAS RL, MOVAHED A. Sarcoidosis of the heart. Clin
Cardiol 1993 ;16 :462-472.
43. OKAYAMA K, KURATA C, SATO A. Diagnostic and pronostic
value myocardial scintigraphy with thallium 201 and gallium 67 in cardiac
sarcoidosis. Chest 1995 ; 107 :330-334.
44. SEKIGUSHI M, YASAKI Y, ISABE M, HIROE M. Cardiac
sarcoidosis : Diagnostic, pronostic and therapeutic considerations. Cardiovasc
Drugs Ther 1996 ; 10 :495-510.
45. SCADDING JG, MITCHELL DN. The heart in sarcoidosis.
2nd Ed . London : Chapmann and Hall, 1985.
46. KITA T, IWATA M, IDA M. et al : a case of
sarcoïdosis associated with severe cardiac conduction disturbances and
unilateral pleural effusion. Nihpon Kyobu Shikkan Gakkai. Zasshi, 1994 ; 32
:913-917.
47.
43
SHABETAI R. Sarcoidosis and the heart. Curr Treat Options
Cardiovasc Med 2000 Oct. ; 2(5) :385-398.
48. EGUSHI M, TSUCHIHASHI K, NAKATA T, HASHIMOTO A, SHIMAMOTO
K. Right ventricular abnormalities assessed by myocardial single photon
emission computed tomography using technitium-99m sestamibi/ tetrofosmin in
right ventricle originated ventricular tachyarrythmias. J Am Call Cardiol 2000
Nov. 15 ; 36(6) :1767-1773.
49. BADELON I, CHAINE G.Les manifestations ophtalmologiques
de la sarcoïdose. Rev Prat, 1994 44 :2042-2045.
50. TAKAHASHI N, ENOMOTO T, HAGIWARA T. et al : A case of
sarcoidosis presenting with Heerfordt syndrome, associated with
hepatosplenomegaly, pleural diffusion and ascite. Nihon Kyobu Shikken Gakkai
Zasshi. 1992 ; 30 :684-688.
51. KARMA A, HUHTI E, POUKKULA A. Course and outcome of
ocular sarcoidosis. Am J Ophtalmol 1988 ; 106 :467-472.
52. CALLAN JP, MAHL. Oculocutaneous manifestations observed
in multisystem disorders. Dermatol Clin 1992 ; 10 :709-716.
53. MAYERS M.Ocular sarcoidosis. Int Ophtalmol Clin 1990 ;30
:257-263.
54. ROTHOVA, et al. Doc ophtalmol 1989 ; 72 :287-296
55. SILVER MR, MESSNER LV. Sarcoidosis and ocular
manifestations. J Am Optom Assoc 1994 ; 65 :321-327.
56. READ RW, RAO NA, SHARMA OP. Sarcoid chorioditis initially
diagnosed as birdshot choriodopathy. Sarcoidosis Vasc Diffuse Lung Dis. 2000,
Mar ; 17(1) :85-86.
57. OGAWA A, SATO Y, MIYASAKA S, FUJITA K, SHIMADA H,
KINUKAWA :
A case of proliferative sarcoid retinopathy with sarcoid
nodules in tissue obtained during vitrectomy. Nippon Ganka Gakkai Zasshi. 2000,
Mar ; 104(3) :174-178.
58. BULL Soc Belge Ophtalmol 2000 ; (277) :57-63.
59. FAJNKUCHEN F, BADELON I, BATTESTI JP, VALEYRE D, CHAINE
G. Presse Med 2000 Nov 4 ; 29(33) :1801-1806.
60. ABERG H, BAH M, WATERS AW : Sarcoidosis complicated by
chylothorax. Minn Med, 1966 ;57 :1065-1070.
61. HAEGELI A, KELLER R. Chylothorax bei sarkoidose. Schweiz
Med Wochenschr, 1981 ; 111 :125-128.
62.
44
ROCKOFF SD, ROHATGI PK. Unusual manifestations of thoracic
sarcoidosis. Am J Roentgenol, 1985 ;144 :513-528.
63. REGDOSZ R, MULLIEZ PH, CROXO C et al : Association of
sarcoidosis, Hodjkin's lymphoma and chylothorax. Presse Med. 1984 ; 13
:1158.
64. CAPPELL MS, FRIEDMAN D, MIKHAIL N : Chyloperiteum
associated with chronic severe sarcoidosis. Am J Gasrtroenterol 1993 ; 88
:99-101.
65. PARKER JM, TORRIGTON KG, PHILLIPS YY : Sarcoidosis
complicated by chylothorax. Southern Med Journal 1994 ; 87 :860-862.
66. JARMAN PR, WHYTE MKB, SABROE I, HUGHES JMB. Sarcoidosis
presenting with chylothorax. Thorax 1995 ; 50 :1324-1325.
67. LENGYEL RJ, SHANLEY DJ. : reccurent chylothorax
associated with sarcoidosis. Hawaï Med J 1995 ; 54 :817-818.
68. HAITSCH R, FRANK W, EVERS H, PAULI R : Chylothorax as a
complication of sarcoidosis. Pneumologie 1996 ; 50 :912-914.
69. CARLIER ML, ROUX JP, PEREZ T et al : Chylothorax and
sarcoidosis. Rev Mal Respir, 1997 ; 14 :315-317.
70. SASSON CS, LIGHT RW. : Chylothorax and pseudochylothorax.
Clin Chest Med, 1985 ; 6 :163-171.
71. WILSON AG. : Chylothorax. in : Armstrong P, Wilson AG.
Dee P. (eds). Imaging of diseases of the chest. Year book Medical
Publishers.Inc, 1990 :662-666.
72. MISERY, FAURE M. Manifestations cutanées de la
sarcoïdose. Rev Prat 1994 ; 44 :20382041.
73. IWANAGA T, FUJISE S, TAKAHASHI N, INUZUKA S, KISHIKAWA R,
IKEDA T, SHOJI S, NISHIMA S. Subcutaneous sarcoidosis of the extremities .
Nihon Kokyuki Gakkai Zasshi 2000, Apr. ;38(4) :317-320.
74. KERDEL FA, MOSCHELLA SL. Sarcoidosis : an updated review.
J Am Dermatol 1984; 11 :1-14.
75. ZAX RH, CALLEN JP. Sarcoidosis. Dermatol Clin, 1989 ; 7
:505-515.
76. SHARMA OMP. Cutaneous sarcoidosis :Clinical features and
management. Chest 1972 ; 61 :320-325.
77. BANSE-KUPIN L, PELACHYK JM. Ichthyosiform sarcoidosis. J
Am Acad Dermatol, 1987 ; 616-620.
78.
45
CANCRINI C, ANGELINI F, COLAVITA M, CORTIS E, CHINI L, MAMNONE
F et al Erythema nodosum : a presenting sign of early onset sarcoidosis. Clin
Exp Rhumatol 1998 ; 16 :337-339.
79. WILSON R, LUND V, SWEATMAN et al. Upper respiratory tract
involvement in sarcoidosis and its management. Eur Respir J, 1988, 1
:269-272
80. PATEY O, BONNIEUX P, ROUCAYROL AM, LAFAIX C. Sarcoidosis
of the nose : report of a case with nasal perforation. Sarcoidosis 1990 ; 7
:123-124.
81. HAMMOND BL, KATARIA YS. Nasal sarcoidosis with septal
perforation. J Otolaryngol., 1980 ; 9 :31-34.
82. NEVILLE E, MILLS RGS, JAMES DG. Sarcoidosis of the upper
respiratory tract and relation to lupus pernio. Ann NY Acad Sci, 1976 ; 278
:417-426.
83. PARIZEL P, KETS R, DE SCHEPPER GR. Sarcoïdosis of
the nasal bones. ROFO 1983 ; 139 :103-104.
84. WALKER S, MIKHAIL G, BANNER N, et al. Medium terms
results of lung trasplantation for end stage pulmonary sarcoidosis. Thorax 1998
; 53 :281-284.
85. BARBERS RG. Role of transplantation (lung, liver and
heart) in sarcoidosis. Clin Chest Med 1997 ;18 :865-874.
86. JUDSON MA. Lung transplantation for pulmonary
sarcoidosis. Eur Respir J 1988 ; 11 :738-744.
87. PADILLA ML, SCHILERO GJ, TEIRSTEIN AS. Sarcoidosis and
transplantation. Sarcoidosis Vasc Diffuse Lung Dis, 1997 ; 14 :16-22.
88. JUDSON MA, STRANGE C : Bullous sarcoïdosis : a
report of three cases. Chest 1988 ; 114 :1474-1478.
89. TERAMOTO S, MATSUSE T, OUCHI Y : Sarcoidosis is a
significant cause of bullous emphysema. Chest 1999 ; 115 :1758.
90. JOHNSON BA, DUNCAN SR, OHORI NP et al. Reccurence of
sarcoidosis in pulmonary allograft recipients. Am Rev Respir Dis, 1993 , 148
:1373-1377.
91. GRIGNET JP, CARLIER ML : Les problèmes posés
par la sarcoïdose. Pneumologie, Oct 1998, 105 : 7-8.
| 


