|
REPUBLIQUE TUNISIENNE
|
MINISTERE DE
L'AGRICULTURE ET
DES
RESSOURCES
HYDRAULIQUES
Institution de la Recherche et
de
l'Enseignement Supérieur
Agricole
|
|
MINISTERE DE
L'ENSEIGNEMENT SUPERIEUR
DE LA
RECHERCHE ET DE LA
TECHNOLOGIE
Université de Carthage
|
PROJET DE FIN D'ETUDES
Pour l'obtention du diplôme National
d'Ingénieur
Spécialité : Science de la Production
Végétale Option : Forêt
Par
Imen JDIDI
Etude phytochimique et activités biologiques des
extraits et des huiles essentielles de Foeniculum vulgare
Mill.
Soutenu publiquement le 25 juin 2015, devant le jury
composée de :
Mr. Lamjed TOUMI Président
Mr. Abdelhamid KHALDI Encadreur entreprise
Mr. Ali FERCHICHI Encadreur INAT
Mr. Hatem CHAAR Examinateur

Année Universitaire 2014/2015
Table des matières
Introduction 1
Chapitre 1. 2
Etude bibliographique 2
I. Les plantes aromatiques et médicinales 3
1. Historique 3
2. Réglementation 3
3. Domaines d'application des plantes aromatiques et
médicinales 4
II. Les huiles essentielles 5
1. Définitions 5
2. Localisation et lieu de synthèse 5
3. Facteurs de variabilité des huiles essentielles 5
4. Composition chimique des huiles essentielles 6
5. Propriétés physiques des huiles essentielles
7
6. Méthodes d'extraction des huiles essentielles 7
7. Activités biologiques des huiles essentielles 8
III. Les composés phénoliques 10
1. Généralités 10
2. Classification des composés phénoliques : 10
3. Rôle des polyphénols chez les
végétaux 16
IV. Les antioxydants 17
1. Les radicaux libres et la notion de stress oxydatif 17
2. Nature des antioxydants 17
3. Mode d'action des antioxydants 18
V. Foeniculum vulgare Mill. 19
1. Description morphologique 19
2.
1. Analyse de l'activité antiradicalaire de l'huile
essentielle des graines de F.vulgare
de Téboursouk 42
Classification botanique 19
3. Ecologique et localisation géographique 21
4. Propriétés et Usages 21
Matériels et méthodes 23
I. Matériel végétal 24
II. Préparation des extraits 25
1. Préparation des extraits aqueux 25
2. Extraction des huiles essentielles 25
III. Détermination de la composition chimique des huiles
essentielles 26
IV. Dosage des composés phénoliques 27
1. Dosage des polyphénols totaux 27
2. Dosage des flavonoïdes 28
3. Dosage des tanins condensés 29
V. Etude de l'activité antioxydante: Test DPPH 30
Résultats et discussion 32
I. Rendement et composition chimique 33
1. Rendements en huiles essentielles 33
2. Rendements en extraits aqueux 34
3. Analyse de la composition chimique des huiles essentielles
des graines de
Foeniculum vulgare Mill. 35
II. Teneurs en polyphénols totaux, flavonoïdes et
tanins 36
1. Polyphénols totaux 36
2. Les flavonoïdes 38
3. Les tanins condensés 39
III. Etude de l'activité antioxydante des huiles
essentielles et des extraits aqueux des
graines de Foeniculum vulgare Mill. 41
Liste des figures
Figure 1: Structures chimiques des terpénoides (Hellal,
2011) 6
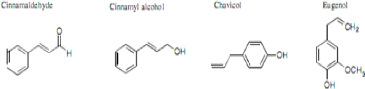
Figure 2 : Structures chimiques des composés aromatiques
(Hellal, 2011) 7
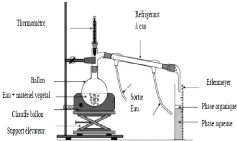
Figure 3: Montage d'hydrodistillation (Treiner, 2000) 8
Figure 4: Les acides hydoxybenzoiques (Macheix et al., 2005)
11
Figure 5: Les principaux acides phénoliques (Macheix et
al., 2005) 11
Figure 6: Les principales classes de flavonoïdes (Macheix et
al., 2005) 13
Figure 7: Les monolignols dérivés des acides
hydroxycinnamiques et leur intégration dans la
lignine (Macheix et al., 2005) 15
Figure 8: Foeniculum vulgare Mill. 19
Figure 9: Foeniculum vulgare subsp.piperitum 20
Figure 10: Foeniculum vulgare subsp. Vulgare 21
Figure 11: Les différents sites de collecte de
Foeniculum vulgare MILL. 24
Figure 12: Hydrodistillation par système clevenger 25
Figure 13: chromatographe en phase gazeuse avec détection
par ionisation de flamme (GC-
FID) 26
Figure 14: Couplage chromatographe en phase gazeuse!
Spectrométrie de masse (CG ! SM)
27
Figure 15: Spectrophotomètre 28
Figure 16: Mécanisme d'action d'un antioxydant (Akrout et
al., 2009) 30
Figure 17: Rendements moyens en huiles essentielles des graines
de F.vulgare Mill. de
différentes provenances. 33
Figure 18: Rendements
moyens en extraits des graines de F.vulgare Mill. de
différentes
provenances 34
Figure 19: Teneurs en polyphénols totaux
des extraits aqueux et des huiles essentielles des
graines de Foeniculum vulgare Mill. 37
Figure 20:
Teneurs en flavonoïdes des extraits aqueux des graines de Foeniculum
vulgare
Mill. 39
Figure 21: Teneurs en tanins condensés des
extraits aqueux des graines de Foeniculum
vulgare Mill. 40
Figure 22: Variation du pourcentage
d'inhibition du radical libre en fonction de la
concentration d'huile essentielle F. vulgare Mill.
43
Liste des tableaux
Table 1: Les principales classes des composées
phénoliques (Macheix et al., 2005) 10
Table 2: Composition chimiques des huiles essentielles des
graines de Foeniculum vulgare
Mill des différentes provenances 35
Table 3:
Activité antiradicalaire (CI50 en ìg.ml-1) des extraits et des
huiles essentielles des
graines de Foeniculum vulgare Mill. des
différentes provenances 41
Remerciement
Mes sincères remerciements s'adressent à mes
encadreurs Monsieur Ali FERCHICHI et Monsieur
Abdelhamid KHALDI. Je vous remercie pour l'aide que vous
m'avez accordée dans l'accomplissement de ce travail. Vous m'avez
patiemment guidée en faisant prévoir beaucoup de gentillesse. Que
vous trouvez dans ce travail l'expression de mon profond respect et ma haute
reconnaissance.
J'exprime ma profonde reconnaissance à Madame
Marwa KHAMMASSI pour son aide, sa directive, sa gentillesse et
ses encouragements pour la réalisation de ce projet. Ses conseils ont
permis à ce travail d'aboutir. Ses capacités scientifiques et ses
compétences étaient mon grand support.
Je tiens à exprimer ma gratitude et mes remerciements
aux membres de jury pour avoir porté un intérêt à
mon travail en acceptant de le juger.
J'exprime mes plus vifs remerciements envers tous les
professeurs qui m'ont apporté du soutien durant mes études.
Je remercie également tous le personnel de l'INRGREF et
à tous ceux qui ont contribué de près ou de loin à
la réalisation de ce projet.
Résumé
Foeniculum vulgare Mill. est une
espèce aromatique et médicinale dotée d'activités
biologiques intéressantes. Dans ce travail, une évaluation de la
capacité antioxydante de cette espèce collectée de huit
régions de la Tunisie, a été effectuée. Les
principaux résultats ont montré que les extraits aqueux et les
huiles essentielles de cette espèce possèdent des teneurs
relativement appréciables en composés phénoliques.
L'analyse de la composition chimique des huiles essentielles des
différentes populations a montré que le methylchavicol est le
composé majoritaire. L'évaluation de l'activité
antiradicalaire des huiles essentielles et des extraits des graines de F.
vulgarea été évaluée par la méthode de
DPPH. Les résultats ont montré que l'huile essentielle des
graines de Teborsek riche en polyphénols totaux est dotée
d'activité antiradicalaire importante (CI50 =6,12
ìg.ml-1).
Mots-clés : Foeniculum.vulgare Mill, huile
essentielle, extrait aqueux, composés phénoliques,
activité antioxydante.
Abstract
Foeniculum vulgare Mill. is an aromatic and medicinal
species with interesting biological activities. In this work, the evaluation of
the antioxidant capacity of this specie collected in eight regions of the
Tunisia was been made. The main results showed that aqueous extracts and
essential oils of this species have relatively significant levels of phenolic
compounds. The analysis of the chemical composition of the essential oils of
different populations showed that the methyl chavicol is the majority compound.
The evaluation of the scavenging activity of essential oils and extracts of the
seeds of F.vulgare was been evaluated by the DPPH. method. The results
showed that the essential oil from the seeds of Teborsek rich of total
polyphenol has important scavenging activity (IC50 = 6.12g.ml-1).
Keywords: Foeniculum vulgare Mill, essential oil,
extracted aqueous, phenolic compounds, antioxidant activity.
ÕÎáãáÇ
ÉÒíËðäÇ
ÊíÌ?ä?íÈäÇ
ÊØÔóáÇ òí
ÐíÐÚäÇ ÍõðÍ
íÎäÇ ÊíÈØäÇ ?
ÊíÒØÚäÇ
ËÇÍÇÈõäÇ òí
Ú?ó ?ú Foeniculum vulgare Mill.
. æÇðÎúáÇä
ËÒ?ÙÇ . Óó?Í òí
ÞØÇõí íóÇðË
òí øÚðÌ ìÍ
íÐäÇ Ú?õäÇ
ÇÐ?ä ÉÐÓßáÇÇ
ËÇÏÇÖí ÉÑÐÞä
ìííÞÍ
ÁÇÒÌÇ ìÍ
Ú?ÒÔðäÇ ÇÐú í
ËÇÈßÒðäÇ
òí ÇíÈÓó
ÊíäÇÚ
ËÇíðßÈ ÚÎðÎÍ
ÚÇ?óáÇÇ öÐ?ä
ÊíÓÇÓáÇÇ
Ë?íÒäÇ?
ÊíÆÇðäÇ
ËÇÕåÎÎÓðäÇ
ñÇ
ÊíÓíÆÒäÇÌÆÇÎõäÇ
ØÇÔó
ìííÞÎä
.ÈäÇÛäÇ
ÈßÒðäÇ ?ú
á?ßíÇÔÍ ñÇ
ÞØÇõðäÇ
åÎÎðä
ÊíÓÇÓáÇÇ
Ë?íÒåä
íÆÇíðíßäÇ
ÈíßÒÎäÇ
ãíåÍÍ
Ò?ÙÇ.Êíä?õíäÇ
áÇÚ
??ÎÓðÈÒíðÎí
á?õííä?ÈäÇÈ
ÊíõÛäÇ
ÞÓÒÈÍ Ñ?ÐÈä
íÓÇÓáÇÇ
ÌíÒäÇ ñÇ
ÌÆÇÎõäÇ
ÌõíÈ ËíÍ DPPH
ÊÞíÒØ
ÇõåðÚÎÓÇ
ÍÓßäÇ (CI50 = 6,12 ìg.ml-1)
ÍÓßäÇ ØÇÔó
òí
撌򂊂
Êíä?õíäÇ
ËÇÈßÒðäÇ
ÊíÆÇðäÇ
ËÇÕåÎÎÓðäÇ
íÓÇÓáÇÇ
ÌíÒäÇ Foeniculum vulgare
Mill.Ó
ÍíÊÇãáÇ
ÊÇãáßáÇ
ÉÐÓßáÇä
ÉÏÇÖðäÇ
1
Introduction
Les plantes aromatiques et médicinales connues par
leurs propriétés biologiques intéressantes sont
utilisées dans divers domaines à savoir en médecine, en
pharmacie, en cosmétologie et en agriculture.
Les activités biologiques des plantes aromatiques et
médicinales sont connues depuis l'antiquité. Toutefois, il aura
fallu attendre le début du 20ème siècle pour que les
scientifiques commencent à s'y intéresser. Ces
propriétés sont dues essentiellement à la fraction d'huile
essentielle et aux composés phénoliques contenues dans les
plantes.
Il existe aujourd'hui approximativement 3000 huiles, dont
environ 300 sont réellement commercialisées, destinées
principalement à l'industrie des arômes et des parfums.
Les huiles essentielles ont suscité beaucoup
d'intérêt scientifique dû au fait qu'elles présentent
une source d'antioxydants naturels et de molécules biologiquement
actives. L'activité antioxydante des extraits de plantes a
constitué la base de nombreuses applications incluant les
procédés de conservation des aliments et les thérapies
naturelles. En effet, plusieurs huiles essentielles extraites à partir
de Sauge et de Gingembre ont montré un bon pouvoir antioxydant et
d'excellentes capacités à inhiber les réactions
oxydatives.
Pour ces raisons, l'étude des activités
biologiques des substances issues des plantes en vue de leurs applications
à la santé humaine demeure une tâche intéressante et
utile.
Dans ce contexte, ce travail a pour objectif l'étude
des huiles essentielles et des extraits d'une plante aromatique et
médicinale collectées de différentes régions de la
Tunisie : Foeniculum vulgare Mill. et l'évaluation de leur
pouvoir antioxydant.
Notre travail sera donc répartit en trois chapitres,
initié par une recherche bibliographique sur les huiles essentielles,
les composés phénoliques, l'activité antioxydante et
l'espèce Foeniculum vulgare Mill.
Dans le deuxième chapitre, nous allons décrire
la méthode d'extraction et d'identification des huiles essentielles et
des extraits aqueux ainsi que les protocoles expérimentaux
préconisés pour évaluer leurs activités
antioxydantes.
Dans le troisième chapitre, nous annoncerons les
résultats obtenus ainsi que leurs discussions. Nous terminerons par une
conclusion résumant les résultats de l'étude
effectuée.
2
Chapitre 1.
Etude bibliographique
3
I. Les plantes aromatiques et médicinales
1. Historique
Depuis longtemps, les plantes aromatiques et
médicinales ont été utilisées pour la
préparation des remèdes thérapeutiques (Meftah, 2003).
D'après l'Organisation Mondiale de la Santé (2002), en Chine, 40%
environ de l'ensemble des soins de la santé relèvent de la
médecine traditionnelle utilisée pour traiter ou prévenir
les maladies chroniques.
Au 5ème siècle, Hippocrate, père de la
médecine occidentale, est connu par son utilisation de ces plantes pour
les traitements thérapeutiques et l'explicitation de leurs performances
multiples. Ses données ont été publiée en 280 avant
J.-C. dans le Corpus Hippocrate qui traite d'environ 250 "simples"(Meftah, 2003
; Fouche et al, 2000).
Au 8éme et 9éme siècle, les arabes avaient
aussi leurs spécialistes en médecine et en pharmacie. `Ibn Sina'
ou Avicenne fut l'un des grands médecins dans son époque qui a
produit la première huile essentielle pure, une huile essentielle de
roses. Avicenne écrit le `Canon de la médicine' et d'autres
ouvrages médicaux dans lesquels il fait une large place aux huiles
essentielles (Mohammedi, 2006).
Les plantes, au 18éme siècle, acquièrent
leurs identités telles qu'on les connaît aujourd'hui, à
savoir un double nom latin indiquant le genre et l'espèce. A
l'époque contemporaine (19 éme et 20éme siècle),
les plantes sont analysées chimiquement et leurs activités
biologiques sont démontrées (Mohammedi, 2006)
2. Réglementation
Les plantes médicinales sont soumises à une
réglementation et un enregistrement en tant que phytomédicament
qui englobe, les matières végétales, les plantes, les
préparations et les produits finis à base de plantes.
Parmi les exigences utilisées dans les systèmes
de réglementation internationaux, on peut citer la description dans une
monographie de pharmacopée avec la dénomination internationale,
l'état de prescription, la revendication d'un effet
thérapeutique, les ingrédients ou les substances prévues
ou réglementés et les périodes d'utilisation (Dutertre,
2011).
4
3. Domaines d'application des plantes aromatiques et
médicinales
? En alimentaire
Différentes espèces médicinales sont
utilisées comme épices pour aromatiser et augmenter la
durée de vie des aliments. En effet, ces espèces contiennent des
huiles essentielles dotées d'activités antimicrobiennes
intéressantes et peuvent servir d'agents de conservation alimentaires
(Mohammadi, 2006).
? En cosmétologie
Les plantes aromatiques sont utilisées dans la
formulation des produits de beauté. Les huiles essentielles de la
lavande (Lavandula officinalis) sont utilisées dans les
préparations pour bains calmants ou relaxants (Bruneton, 1993).
? En médecine
Certaines plantes sont utilisées pour le traitement des
troubles nerveux et des troubles liés au stress telles que
Angélica archangélica et Valérian aofficialis
(Messkgue, 1975 ; Iserin, 1997 ; Legrand, 1994).
D'autres, telles que l'Aunée officinale (Inula
helenium), Origan (OriganumVulgare) et l'Eucalyptus
(Eucalyptus globulus) ont prouvé leur efficacité dans le
traitement des problèmes respiratoires et les bronchites (Iserin, 1997 ;
Legrand, 1994).
Les plantes aromatiques et médicinales ont une valeur
thérapeutique importante et l'intérêt de ces plantes ne
cesse de grandir. Exemple : Foeniculum vulgare est utilisée
pour la remède des douleurs abdominales et les graines de cette
espèce sont utilisées pour la production d'un médicament
pour soigner les troubles digestifs (Messkgue, 1975 ; Iserin, 1997).
5
II. Les huiles essentielles
1. Définitions
Les huiles essentielles sont des substances organiques,
liquides et aromatiques. On les trouve naturellement dans diverses parties de
plantes. Selon la norme AFNOR (NF T 75-006,2000), les huiles essentielles sont
« des produits obtenus à partir de matières naturelles
végétales, soit par entraînement à la vapeur d'eau,
soit par des procédés mécaniques à partir de
l'épicarpe des citrus, soit par distillation sèche. L'huile
essentielle ainsi obtenue est séparée de la phase aqueuse par des
procédés physiques ». La Commission de la Pharmacopée
Européenne (2008) a définit l'huile essentielle comme
étant un «Produit odorant, généralement de
composition complexe, obtenu à partir d'une matière
première végétale botaniquement définie ».
2. Localisation et lieu de synthèse
Les huiles essentielles sont des métabolites
secondaires synthétisées et secrétées par les
plantes aromatiques. La synthèse de ces huiles se fait par
l'intermédiaire des structures histologiques spécialisées
situées généralement sur la surface de la plante (les
poils, les canaux et les poches sécrétrices) (Bruneton, 1993 ;
Benazedine, 2010).
3. Facteurs de variabilité des huiles
essentielles
Le rendement et la composition chimique des huiles
essentielles varient d'une espèce à une autre. Cette
variabilité peut être liée à des facteurs
extrinsèques et intrinsèques.
? Facteurs extrinsèques
Les conditions environnementales notamment la
température, la lumière, la pluviométrie et les conditions
édaphique agissent sur la composition chimique des plantes aromatiques
et médicinales (Bruneton, 1999; Mohammad et al., 2009; Olle et Bender,
2010; Aprotosoaie et al.,2010). Les conditions culturales telles que les
techniques de récolte, la date de semis, l'emploi d'engrais, les
traitements phytosanitaires influencent également la composition et le
rendement des huiles essentielles.(Barry, 2001; Lahlou, 2004; Stefanini et al.,
2006; Benini, 2007; Aprotosoaie et al., 2010).
6
? Facteurs intrinsèques
Le stade végétatif (Aprotosoaie et al., 2010)
,l'organe de la plante (Chowdhury et al., 2009), la mutation, l'hybridation, la
polyploïdie (Aprotosoaie et al., 2010) et les chimiotypes (Belyagoubi,
2006) sont parmi les facteurs intrinsèques qui interviennent dans la
variabilité de la composition et le rendement des huiles
essentielles.
4. Composition chimique des huiles
essentielles
Les huiles essentielles sont des mélanges complexes de
composés volatils qui appartiennent, de façon quasi exclusive,
à deux groupes (Duquenois, 1982) :
? Les terpénoïdes
Le groupe des terpènoïdes est
considéré comme étant le groupe le plus important. Il
comprend les monoterpènes, les sesquiterpènes et les
diterpènes. Les terpènes qui sont les plus volatiles (Piochon,
2008), sont des molécules organiques de formule [C5H8] n
(Figure 4) (Kaloustian et Hadji-Minaglou, 2012). Ces substances lipophiles sont
responsables de l'odeur des plantes (Hopkins, 2003).
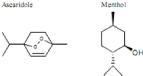
Figure 1: Structures chimiques des
terpénoides (Hellal, 2011)
? Les composés aromatiques
Le groupe des composés aromatiques renferme les
molécules de parfum comme la vanilline, l'eugénol,
l'anéthol et l'estragol (Figure 5). Ces composés sont abondantes
dans les huiles essentielles des Apiaceae (anis, fenouil, cannelle, basilic)
(Hellal, 2011).
7
Figure 2 : Structures chimiques des
composés aromatiques (Hellal, 2011)
5. Propriétés physiques des huiles
essentielles
Les huiles essentielles sont des substances odorantes, volatiles
et solubles dans les solvants organiques. Elles s'oxydent facilement à
la lumière. Elles doivent être donc conservées à
l'abri de la lumière pour éviter leur oxydation et leur
polymérisation (Padrini et lucheroni, 2006).
6. Méthodes d'extraction des huiles
essentielles
? L'enfleurage
Cette méthode est très ancienne. Elle consiste
à extraire les parfums à partir des fleurs par contact avec la
matière grasse. Les graisses seront encombrées en essence et
utilisées comme produit cosmétique sous forme de pommade
(Silvant, 2015).
? Extraction par solvant
Cette méthode est utilisée en parfumerie. Il
s'agit d'extraire l'huile essentielle par un solvant volatile (Silvant,
2015).La matière végétale et le solvant est placés
dans un récipient puis chauffés. Le mélange ainsi obtenu
est ensuite filtré et mélangé avec l'alcool qui
s'évapore après chauffage et il ne reste que l'huile
parfumée appelée absolue (Hellal, 2011).
? L'hydrodistillation
C'est la méthode la plus ancienne, la plus
utilisé et la plus rentable qui a été introduite en Europe
par les Arabe entre le VIIIème et le Xème siècle (willem,
2004). Il s'agit de mettre le matériel végétal à
l'intérieure d'un alambic remplie d'eau et qui est porté ensuite
à ébullition (Figure 6). L'huile essentielle se sépare par
différence de densité après la condensation des vapeurs
hétérogènes sur une surface froide (Bruneton, 2009).
8
Figure 3: Montage d'hydrodistillation
(Treiner, 2000)
? Extraction au CO2 supercritique
Cette méthode est récente .Elle est basée
sur l'utilisation d'un fluide supercritique qui possède les
propriétés des gaz et des liquides. Ce qui lui permet de
pénétrer dans les matrices d'échantillon solides. Le
principe de cette technique correspond à une distillation
répétée du solvant extrayant un soluté de
l'échantillon solide (Brisset, 2011).
7. Activités biologiques des huiles
essentielles
Plusieurs études ont montré que les huiles
essentielles sont dotées d'activités biologiques
intéressantes.
? Activité antimicrobienne
Les huiles essentielles possèdent des
propriétés antimicrobiennes intéressantes et luttent
contre les maladies infectieuses d'origine bactérienne et fongique (De
Billerbeck, 2007).L'activité antifongique des huiles essentielles peut
être due à la présence des terpènes qui causent la
rupture des membranes fongiques et inhibent le développement des
champignons.
Les huiles essentielles permettent également la
protection contre les champignons phytopathogènes et les microorganismes
envahissant les denrées alimentaires (Zambonelli et al., 2004 ; Mangena
et Muyima, 1999).
? Activité antioxydante
L'activité antioxydante des huiles essentielles est
attribuée à certains alcools, éthers, cétones et
aldéhydes monoterpéniques tels que le linalool, le
1,8-cinéoIe, le géranial,
9
le néral, le citronellal, l'isomenthone, la menthone et
quelques monoterpènes comme l'á-terpinène et le
ã-terpinène (Edris, 2003).
? Activité antiviral
Les huiles essentielles riches en phénols ont
montré une activité antivirale contre certains virus notamment
l'Herpes simplex (Girard, 2010).
? Activité neurale
Les huiles essentielles possèdent une action
sédative et agissent sur le système nerveux central en stimulant
ou en inhibant le système sympathique ou parasympathique. Elles
permettent ainsi la régulation de système nerveux
périphérique. (Girard, 2010).
Les huiles essentielles possèdent également
d'autres activités telles que l'activité désodorisante
dans la mesure où certaines huiles essentielles peuvent être
utilisées pour lutter contre les mauvaises odeurs. De très
nombreuses drogues à huile essentielle (Mentha X citrata,
Lippiacitriodora,...) sont réputées efficaces pour diminuer ou
supprimer les spasmes gastro-intestinaux (Bruneton, 1993).
10
III. Les composés phénoliques
1. Généralités
Les composés phénoliques forment le groupe des
composés phytochimiques le plus important des plantes. Ils
présentent près de 8000 molécules divisées en une
dizaine de classes chimiques (Stalikas, 2007). Chaque classe est
caractérisée par la présence d'un noyau benzoïque
auquel un ou plusieurs groupes hydroxyles sont directement liés (Macheix
et al., 2005).
2. Classification des composés phénoliques
:
Les composés phénoliques peuvent être
classés selon la complexité, le degré et les liaisons
possibles du squelette de base avec d'autres molécules (Tableau 1)
(Macheix et al., 2005).
Table 1: Les principales classes des
composées phénoliques (Macheix et al., 2005)
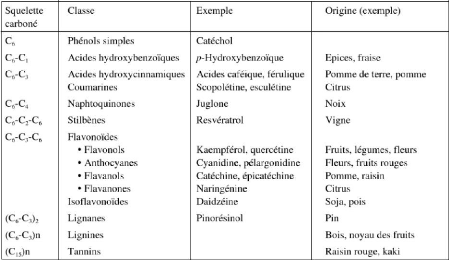
On distingue :
? Les formes simples qui présentent des structures
chimiques allant de C6 aux C15 : Acides hydroxybenzoiques, Acides
hydoxycinnamiques et les flavonoïdes.
? Les formes condensées qui résultent de la
condensation de certaines formes simples telles que les tanins et les lignines
(Macheix et al., 2005).
? Les acides hydroxybenzoiques
Ces acides sont dérivés de l'acide
benzoïques (Figure 7).Ils sont fréquents sous formes d'esters
méthyliques ou glycosylés chez les gymnospermes et les
angiospermes. Ils sont libérés après hydrolyse alcaline de
certain molécules en particulier la lignine et certains tanins. (Macheix
et al., 2005).
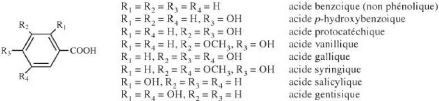
Figure 4: Les acides hydoxybenzoiques (Macheix et al.,
2005) ? Les acides hydoxycinnamiques (phénylpropanoides)
C'est une classe très importante qui dérive de
l'acide cinnamique (Figure 8). La réactivité de ces acides est
liée au degré d'hydroxylation du cycle benzénique et son
modification aléatoire par des réactions secondaires. On
distingue deux séries isomères grâce à la
présence de double liaison : cis (Z) et tans (E). (Macheix et al.,
2005)
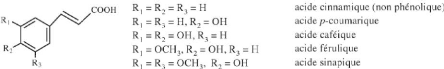
11
Figure 5: Les principaux acides
phénoliques (Macheix et al., 2005)
12
? Les flavonoïdes
Les flavonoïdes sont des pigments naturels (Causse, 2005)
responsables de la coloration des feuilles, des fleurs et les fruits. Ils sont
très répandus chez les végétaux. (Roux et Catier,
2007).Ces pigments sont répartis en plusieurs familles dont les plus
importantes sont les flavones et les isoflavones (Figure 9) (Causse, 2005).Ils
présentent plus que 9000 structures et ont comme structure de base deux
noyaux aromatiques reliés par 3 carbones. (Bruneton, 2009). Plusieurs
études ont montré que les flavonoïdes permettent la
réduction du taux du cholestérol (Causse, 2005).
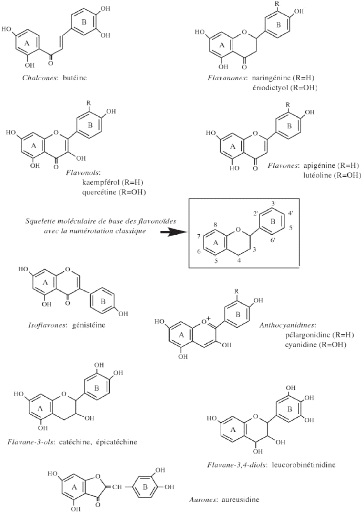
13
Figure 6: Les principales classes de
flavonoïdes (Macheix et al., 2005)
14
? Les tanins
Les tanins sont responsables de l'aspect astringent (Macheix
et al., 2005).Ils sont combinés aux alcaloïdes et aux
protéines dans les différentes organes de la plante. (Fraga et
al., 2010). Ces composées qui confèrent des réactions de
condensation avec les anthocyanes présentent un pouvoir antiseptique qui
gêne le développement de certains microorganismes. On distingue
chez les végétaux deux groupes de tanins :
? Les tanins hydrolysables qui sont des polyesters de glucides
et d'acides phénoliques (Grundhöfer et al., 2001)
? Les tanins condensés qui sont nommés
également tanins catéchiques ou proanthocyanidols. Ils ne sont
pas hydrolysables. Leurs structures qui ne présentent pas de sucre se
rapprochent de celle des flavonoïdes (Hurabielle et Paris, 1981).
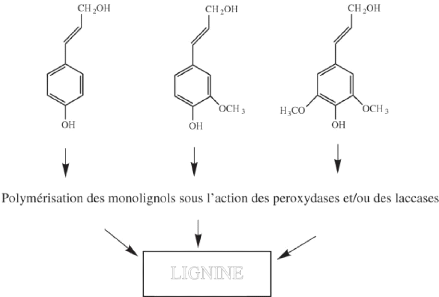
? Les lignines
Les lignines se déposent dans la paroi cellulaire
(Hamilton Raven et al., 2000). Ils proviennent de la polymérisation de
trois molécules phénoliques (Figure 10). Ces composées qui
présentent des activités biologiques intéressantes
(Macheix et al., 2005) assurent la résistance au compression et la
rigidité des parois cellulaires et augmentent ainsi leurs
imperméabilités à l'eau (Hamilton Raven et al., 2000).
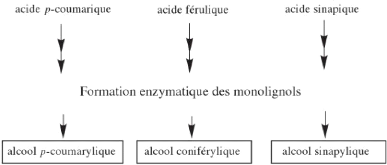
15
Figure 7: Les monolignols dérivés
des acides hydroxycinnamiques et leur intégration dans la lignine
(Macheix et al., 2005)
? Coumarine :
Ce sont des substances organiques aromatiques
caractérisées par une saveur amère et qui se
présentent chez les végétaux aux niveaux des
différents organes sous forme de cristaux blancs ou jaunâtre
(Bruneton, 2009).
16
3. Rôle des polyphénols chez les
végétaux
? Dans le domaine agroalimentaire
Plusieurs industries agroalimentaires utilisent les
composés phénoliques naturels comme additifs alimentaires. Les
anthocyanes sont utilisés comme colorants alimentaires dans la
vinification et les tocophérols sont utilisés dans le maintien de
la stabilité des huiles végétales et la prévention
des produits alimentaires contre le rancissement causé par les radicaux
libres (Macheix et al., 2005).
? Dans le domaine pharmaceutique et
médical
Des études ont montré que les polyphénols
protègent contre les accidents cardiovasculaires et les maladies
coronariennes. Ces composés naturels dotés d'activité
antioxydante intéressante ont une relation importante avec la
prévention des maladies inflammatoires et le traitement du cancer. Leurs
efficacités varient en fonction de leurs natures, leurs concentrations,
leurs vitesses d'absorption dans l'intestin grêle et de leurs
dégradations par la flore intestinale. (Macheix et al., 2005).
Les polyphénols sont des molécules contenants au
moins un cycle benzéniques et des groupes hydroxyles. C'est parce que ce
groupe hydroxyle se lie aux protéines salivaires que les
polyphénols sont astringents.
Les tannins sont responsables de l'astringence de divers fruits
(peau et pépins par exemple) et les anthocyanes sont responsables de la
couleur des fruits rouges.
17
IV. Les antioxydants
Les antioxydants sont des molécules capables
d'interagir sans danger avec les radicaux libres et de mettre fin à la
réaction en chaîne avant que les molécules vitales ne
soient endommagées.
1. Les radicaux libres et la notion de stress
oxydatif
? Définition
Un radical libre est un atome ou une molécule
possédant un ou plusieurs électrons non appariés sur
l'orbite électronique la plus externe, ce qui le rend très
instable. Une réaction en chaîne commence lorsqu'un radical libre
attaque la molécule stable la plus proche essayant de capturer
l'électron manquant pour se stabiliser, ce qui déstabilise la
molécule attaquée et la transforme en radical. Les radicaux
peuvent réagir avec des composants cellulaires (ADN,
protéines...) causant des dommages très graves
(Gardès-Albert, 2003).
Lorsque ces radicaux sont présents en grande
quantité dans l'organisme, il ya rupture de l'équilibre entre les
oxydants et les antioxydants en faveur des oxydants créant ainsi ce
qu'on appelle stress oxydatif.
Le stress oxydatif est donc un état de
déséquilibre entre la génération des espèces
réactives de l'oxygène (ERO) et la capacité du corps
à neutraliser et à réparer les dommages oxydatifs. Il
correspond à une perturbation du statut oxydatif intracellulaire
(Mohammedi, 2006).
? Origine des radicaux
Les radicaux libres sont produits lors du métabolisme
normal des cellules mais aussi suite à l'exposition aux agressions
environnementales (agents infectieux, pollution, rayonnements UV,
xénobiotiques, ...) (Mohammedi, 2006).
2. Nature des antioxydants
? Les antioxydants endogènes : Ils
constituent la première ligne de défense contre les radicaux
libres. Ces molécules sont, en effet, des protéines enzymatiques
et de substances antioxydantes telles que la superoxyde dismutase (SOD), la
catalase, la
18
glutathion peroxydase, les molécules «
piégeurs » (l'acide urique, les protéines à
groupement thiols, ubiquinone...) (Pincemail et al, 1998).
? Les antioxydants naturels : Ils sont
présents dans toutes les parties des plantes supérieures. On peut
citer la vitamine E, les caroténoïdes et les composés
phénoliques qui peuvent prévenir l'oxydation des
lipoprotéines de faible densité (LDL) (Meyer et al., 1997).
? Les antioxydants synthétiques : Le
butylhydroxytoluène (BHT) et le butylhydroxyanisole (BHA), sont des
antioxydants phénoliques de synthèse utilisés dans
l'industrie alimentaire pour la conservation des aliments. (Multon, 2002).
3. Mode d'action des antioxydants
Il existe des antioxydants préventifs dont le
rôle est d'inhiber la production des radicaux initiateurs des
réactions d'oxydation. Il s'agit de substances décomposant les
hydroperoxydes en alcools comme les thiols, de substances complexant les
doubles liaisons les rendant moins sensibles à l'oxydation, de
substances protectrices vis-à-vis des rayons ultraviolets comme les
carotènes ou de substances chélatant les métaux promoteurs
d'oxydation tel que le fer et le cuivre.... D'autres types d'antioxydants
agissent comme donneurs d'hydrogène vis-à-vis d'un radical
hydroperoxyle et interrompent les réactions en chaîne, ils sont
appelés «pièges radicalaires». A cette catégorie
appartiennent les tocophérols et les antioxydants phénoliques.
(Marfak, 2003).
19
V. Foeniculum vulgare Mill.
1. Description morphologique
Le fenouil, Foeniculum vulgare Mill., est une plante
médicinale et aromatique vivace ou bisannuelle appartenant à la
famille des Apiacées (Umbelliferaceae).
Les feuilles plumeuses de 40cm de longueur sont
divisées en segments filiformes (Vienna et al. 2005).Les fleurs
apparaissent en été (Août). Elles sont de couleur jaune et
sont constituées de pétales à lobe arrondi et
enroulés. Elles sont réunies en ombelles de 7 à 10 cm.
Leur parfum est très anisé. Les tiges sont droites,
feuilletées et unies de couleur jaune verdâtre et peuvent
atteindre 2m de longueur (Vienna et al., 2005; Kaur &Arora,2010).
Le fruit est formé de deux akènes de 4 à
10 mm de longueur (Diaaz-Maroto et al., 2006) ,de 1 mm de largeur et à
côtes saillantes (figure1 ) (Pottier-Alapetite, 1979; Arvy et Gallouin,
2003)

Figure 8: Foeniculum vulgare Mill.
2. Classification botanique
L'espèce Foeniculum vulgare Mill.se divise en
deux sous-espèces : subsp. piperitum et subsp.
Vulgare (Badoc et al., 1995; Vienna et al.,2005; EFSA, 2009).La sous
espèce vulgare est
20
présenté par 3 variétés
(var.vulgare :fenouil amer ;var. dulce : fenouil doux ;var.azoricum : fenouil
bulbeux )(Amimar et al., 2001; Vienna et al., 2005; Kothe, 2008).
? Foeniculum vulgare subsp.
Piperitum
C'est une plante vivace caractérisée par des
grains amers (Diaaz-Maroto et al., 2006) . Elle est hémicryptophyte et
peut atteindre 2 m de longueur. Cette plante, dont la floraison est entre
juillet et septembre, est pollinisée par des insectes et
disséminée par gravité.
Cette sous espèce a une odeur aromatique
caractéristique. Sa tige arrondie et assez grêle. Ses feuilles en
lanières divariquées sont courtes et un peu épaisse. Ses
petites ombelles sont brièvement pédonculées avec des
rayons inégaux et courts renfermant des fleurs jaunes (figure2). Ses
fruits sont étroits (Rameau et al. ,2008).

Figure 9: Foeniculum vulgare
subsp.piperitum
? Foeniculum vulgare
subsp.vulgare
Elle possède des graines dont leurs odeurs rassemblent
à celle de l'anis.Sesgrainessont lisses etutilisées comme
aromatisants dans les produits de boulangerie et dans les boissons
alcoolisées (Diaaz-Maroto et al., 2006). Cette sous espèce est
très répandue. Sa morphologie est spécifique avec des
feuilles divisées en segments allongées et des ombelles grandes
de couleur jaune vif (figure3) (Bernáth et al., 1996).

21
Figure 10: Foeniculum vulgare subsp.
Vulgare
3. Ecologique et localisation
géographique
Foeniculum vulgare est répandue dans la
région méditerranéenne et en Europe Centrale (Vienna et
al., 2005; Zahid et al.,2009; Aprotosoaie et al., 2010). En Tunisie, elle est
répandue à Aïn Draham, El Haounria, Sfax, Mahdia, Kerkenna,
Djerba,
Oasis, Moularès (Ser.) (Pottier-Alapetite,
1979).
Cette plante pousse sur les sols calcaires. On la rencontre
essentiellement au bord des Oueds (Rejeb et al., 2006).
4. Propriétés et Usages
Le fenouil, Foeniculum vulgare Mill., est une
espèce très aromatique d'usage culinaire et médicinale
(Diaaz-Maroto et al., 2006) . Elle est consommée comme aliment ou
épice. Les graines de fenouil sont utilisées traditionnellement
comme collyre pour les troubles visuel les. Elles sont également
utilisées pour la stimulation de la lactation et pour le traitement des
problèmes digestifs. En effet, elles améliorent la
sécrétion des enzymes digestives et stimule le tractus
gastro-intestinal du péristaltisme au niveau de l'appareil digestif.
22
Les graines de fenouil contiennent de 2 à 6% d'huile
essentielle. Elles contiennent aussi des acides organiques, des
flavonoïdes et des polysaccarides. (Khan et Ather, 2006).
23
Chapitre 2.
Matériels et méthodes
24
Matériel et méthodes
Dans ce chapitre, nous présenterons les protocoles
expérimentaux préconisés pour l'extraction et l'analyse de
la composition chimique des huiles essentielles et des extraits ainsi que les
techniques utilisées pour le dosage de l'activité
antioxydante.
I. Matériel végétal
Des prospections effectuées, en Tunisie, durant les
mois de Novembre 2014, nous ont permis de repérer huit populations de
Foeniculum vulgare Mill., représentatives de l'aire de
répartition de l'espèce qui s'étend de l'étage
bioclimatique humide (Mjeles),sub-humide (EL Alia,Oued zarga,
Téboursouk), au semi-aride (Kélibia, Zouarine, Zaghouan, Cebalet
ben ammar). Nous avons tenu compte dans notre échantillonnage de
l'éloignement géographique des populations et du bioclimat. La
localisation géographique des populations est rapportée dans la
figure 11.
Dix individus de chaque population ont été
collectés. Les plantes ont été séchées
à l'air libre et à l'ombre pendant une semaine et les graines ont
été isolées du reste de la plante pour servir à
l'extraction.
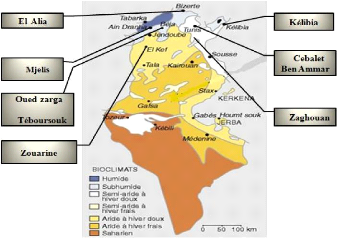
Figure 11: Les différents sites de
collecte de Foeniculum vulgare MILL.
II. Préparation des extraits
1. Préparation des extraits aqueux
L'extraction a été effectuée selon la
méthode de Mau et al. (2001).Elle est réalisée en
ajoutant 10 g de poudre végétale à 100 ml d'eau
distillée. Après une macération de 24 heures, le
mélange est filtré sur du papier filtre (papier watman
N°4).Les extraits ont été évaporés sous vide
grâce à un évaporateur rotatif. Le résidu sec est
pesé puis repris dans l'eau distillée, de façon à
obtenir une concentration de 1 mg/ml. Les extraits ainsi obtenus sont
conservés à 4°C et à l'abri de la lumière pour
être utilisés pour les différentes analyses.
2. Extraction des huiles essentielles
L'extraction des huiles essentielles a été
effectuée par hydrodistillation à l'aide d'un appareil de type
Clevenger (figure12).
100 g de graines séchées ont été
broyés. La poudre obtenue est soumise à une hydrodistillation
dans un dispositif de type clevenger pendant trois heures. Les vapeurs
chargées d'huiles en traversant un réfrigérant se
condensent. L'eau et l'huile se séparent par différence de
densité. Les huiles essentielles obtenues sont conservées
à -4°C.

25
Figure 12: Hydrodistillation par système
clevenger
26
Le rendement des huiles essentielles s'exprime par le rapport
entre la quantité d'huile extraite et la quantité de
matière végétale utilisée pour l'extraction. Il est
calculé de la manière suivante : R (%) =
(MHE/MMV)*100
Avec : MHE : masse de l'huile essentielle obtenue
MMV : masse de la matière végétale
utilisée
III. Détermination de la composition chimique des
huiles essentielles
L'analyse de la composition des huiles essentielles a
été effectuée par la technique de la chromatographie en
phase gazeuse (CPG) et par chromatographie en phase gazeuse couplée
à une spectrophotométrie de masse (SM).
Les huiles essentielles sont analysées par
chromatographie en phase gazeuse du type `SHIMADZU Séries GC-2014 system
(figure 13) équipé d'un injecteur diviseur (220°C) et d'un
détecteur à ionisation de flamme (280°C). La colonne
capillaire en silice fondue est à phase stationnaire apolaire .Elle est
de type DB5 (30 m x 0,25 mm).
La température du four est programmé de 50
jusqu'à 220°C à raison de 5°C/min. Le débit du
gaz vecteur (l'azote) est de 1ml/min. Avant l'analyse, les huiles essentielles
sont diluées 20 fois dans l'hexane. L'identification des
différents composés a été réalisée
sur la base des indices de rétention linéaires.

Figure 13: chromatographe en phase gazeuse
avec détection par ionisation de flamme
(GC-FID)
27
Le couplage CG / SM a permis également l'identification
des huiles essentielles. Le principe repose sur la fragmentation des
composés suite à leur bombardement par un flux d'électrons
et leur exposition à des champs électriques. Les ions
libérés seront classés selon leur rapport masse/charge. Le
chromatographe utilisé est de type Agilent 19091S-433(figure14). La
phase stationnaire est formée de 5% phényl méthyl siloxane
et 95% diméthylpolysiloxane. Le gaz vecteur est l'hélium, avec
une pression de 7,63 psi en tête de la colonne et un débit
constant de 1 ml par minute dans la colonne. L'injection de l'extrait se fait
en mode split (100 :1). 2ul de l'extrait sont injectés. La
température du four au moment de l'injection est constante (50°C)
puis elle suit un gradient linéaire jusqu'à 300°C à
raison de 2°C par minute pendant 15 minutes.

Figure 14: Couplage chromatographe en phase
gazeuse/ Spectrométrie de masse (CG / SM)
IV. Dosage des composés phénoliques 1. Dosage
des polyphénols totaux
? Principe
Selon Dewanto et al. (2002), Le dosage des
polyphénols totaux se fait par la méthode colorimétrique
de Folin- Ciocalteu qui est basé sur le principe de
l'oxydoréduction. Le réactif de Folin-Ciocalteu (RFC), un acide
de couleur jaune, présente des polyhétérocycles acides
contenant du molybdène et tungstène. En milieu alcalin, il est
28
réduit en présence de polyphénols, en oxyde
de tungstène et de molybdène en donnant une couleur bleue.
? Mode opératoire
Une prise de 125ul de l'extrait aqueux / 500 ul huile essentielle
dilué est mélangée avec 500ul d'eau distillée et
125ul de réactif de Folin-Ciocalteu. Après une agitation
vigoureuse du mélange suivie d'un repos de 3 minutes, une prise de
1250ul de Carbonate de sodium Na2CO3 à 7% est additionnée. Enfin
le mélange obtenu est ajusté par 3ml d'eau distillée.
Après un repos de 90 minutes à l'obscurité.
La lecture de l'absorbance est effectuée à une longueur d'onde de
760 nm par rapport à un blanc dont l'extrait est remplacé par le
solvant d'extraction (figure15).
Une gamme étalon d'acide gallique est
préparée dans les mêmes conditions que les
échantillons, pour des concentrations variables de 0 à 100
mg.l-1.Les teneurs des extraits en polyphénols totaux sont
exprimés en mg d'équivalent acide gallique par gramme de
matière sèche (mg EAG.g-1MS).

Figure 15: Spectrophotomètre
2. Dosage des flavonoïdes
? Principe
Selon Dewanto et al. (2002), le dosage des
flavonoïdes se fait par la méthode colorimétrique qui est
basée sur la formation d'un complexe jaune entre les flavonoïdes et
le chlorure d'aluminium.
29
? Mode opératoire
Une prise de 125ul de l'extrait aqueux convenablement
dilué est mélangée avec 35,5ul de NaNO2 (5 %).
Après un repos de 6 minutes, 75ul de AlCl36H2O (10 %) fraîchement
préparée est ajouté au mélange et 5 minutes plus
tard, 250ul de NaOH (1M) sont additionnés. Finalement, le mélange
est ajusté à 1250ul avec de l'eau distillée. La lecture de
l'absorbance se fait à 510 nm contre un blanc dans lequel l'extrait est
remplacé par le solvant d'extraction.
Une gamme étalon de catéchine est
préparée dans le méthanol, dans les mêmes conditions
que les échantillons, pour des concentrations allant de 0 à 100
mg.l-1. Les teneurs des extraits en flavonoïdes sont
exprimées en mg d'équivalent catéchine par gramme de
matière sèche (mgEC.g-1MS).
3. Dosage des tanins condensés
? Principe
Selon Price et al. (1978) le dosage des tanins
condensés se fait par la méthode colorimétrique
basée sur la dépolymérisation des tanins condensés
en présence d'acide sulfurique. Sous l'effet de la vanilline, ces tanins
se transforment en anthocyanidols de couleur rouge spécifique. (Sun et
al., 1998).
? Mode opératoire
Un aliquote de 0.05 ml de l'extrait aqueux est additionné
à 3 ml de vanilline (4 %) et 1,5 ml de HCl concentré.
Après 15 min d'incubation à une température ambiante,
l'absorbance est mesurée à 500 nm.
Une gamme étalon de catéchine est
préparée, dans les mêmes conditions que les
échantillons, pour des concentrations allant de 0 à 100
mg.l-1. Les teneurs des extraits en tanins condensés sont
exprimées en mg d'équivalent catéchine par gramme de
matière sèche (mgEC.g-1MS).
30
V. Etude de l'activité antioxydante: Test DPPH
Différentes techniques sont employées pour
mesurer l'activité antioxydante des extraits et des huiles essentielles
des plantes. Dans notre étude, on s'est basée, pour
l'évaluation de cette activité, sur la mesure de
l'activité antiradicalaire par la méthode du DPPH.
? Principe
Le test DPPH, le radical libre synthétique
2,2-diphenyl-1-picryle-hydrazyle, est le procédé le plus
utilisé dans l'évaluation de l'activité antioxydante. Le
DPPH est caractérisé par coloration violette en cas d'absence de
l'antioxydant. En contact d'antioxydants, la couche électronique de ce
radical est saturée d'où la disparition de sa coloration
violette.
Cette décoloration représente l'aptitude de
l'extrait de la plante à piéger ce radical (figure 16) (Akrout et
al., 2009).
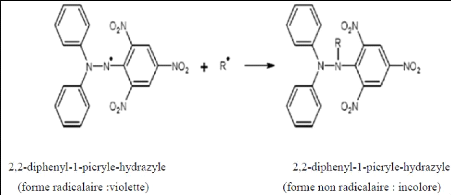
Figure 16: Mécanisme d'action d'un
antioxydant (Akrout et al., 2009)
? Mode opératoire
L'activité antiradicalaire est mesurée selon la
méthode de Hanato et al. (1988). La solution DPPH.
(0,2 mM) est obtenue en dissolvant 7.8mg de DPPH. dans 100 ml de
méthanol. 250 ul de cette solution sont additionnés à 1 ml
d'extrait/huile essentielle à différentes concentrations.
31
Après une agitation vigoureuse du mélange, il est
conservé au repos pendant 30 minutes à l'obscurité.
L'absorbance est mesurée à 517 nm l'aide d'un
spectrophotomètre UV visible en se référant à un
témoin sans extrait.
Selon Rashid et al. (2010) L'activité antiradicalaire est
estimée en pourcentage d'inhibition grâce à la formule
suivante :
PI = (DO témoin - DO échantillon / DO
témoin)* 100
? PI : pourcentage d'inhibition
? DO témoin : lecture de l'absorbance du témoin
? DO échantillon : lecture de l'absorbance de la solution
de l'échantillon
La courbe représentant la variation de l'absorbance en
fonction de la concentration permet de déterminer la valeur de
CI50 (concentration correspondant à 50 % d'inhibition,
exprimée en ug.ml-1).
La valeur de CI50 la plus faible correspond
à l'efficacité de l'extrait la plus élevée. Le
témoin positif est le BHT : 3, 5-
ditertiobutyl-4-hydroxytoluène.
L'étude quantitative et qualitative des huiles
essentielles extraites à partir des plantes aromatiques et
médicinales permet leur valorisation afin de les cibler selon leurs
rendements, leurs compositions et leurs activités pour de futures
applications.
? Analyse statistique
Dans le présent travail, Le traitement statistique des
données est réalisé à l'aide du logiciel SPSS 18
(par la méthode ANOVA).La comparaison des moyennes a été
effectuée par le test de comparaison multiple de Newman-Keuls au seuil
de 5% (la différence est significative pour une valeur de p<0,05).
32
Chapitre 3.
Résultats et discussion
33
I. Rendement et composition chimique 1. Rendements en
huiles essentielles
L'extraction des huiles essentielles à partir des
graines de Foeniculum vulgare Mill. de huit populations de la Tunisie
a permis d'obtenir différents rendements illustrés dans la figure
17.
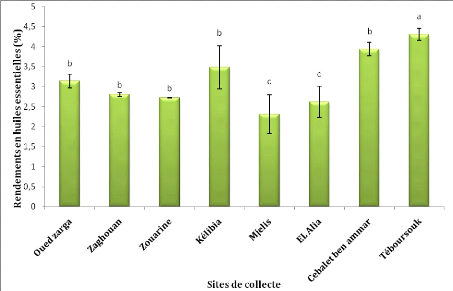
Figure 17: Rendements moyens en huiles
essentielles des graines de F.vulgare Mill. de
différentes
provenances.
L'analyse statistique a montré que le rendement moyen
en huile essentielle des graines de Foeniculum vulgare Mill.de la
région de Téboursouk appartenant à l'étage
bioclimatique subhumide se distingue significativement des autres
régions avec un rendement de 4,29%.
Les huiles essentielles de la population de Mjeles de
l'étage bioclimatique humide présente le rendement le plus faible
(2,31%). Ce rendement est significativement différent des rendements
enregistrés pour les sites appartenant à l'étage
bioclimatique semi-aride (Kélibia, Zouarine, Zaghouan, Cebalet ben
ammar).
34
Des études menées par Munoz-Bortomeu et al
(2006) ont montré que le rendement en huile essentielle varie en
fonction de l'étage bioclimatique. Les conditions d'un climat aride
favorisent la biosynthèse des huiles essentielles qu'un climat
humide.
Le rendement en huile essentielle des graines de
Foeniculum vulgare Mill.de la Turquie rapporté par
l'étude de Özcan et Chalchat (2004) est plus important (6,01%) que
celui que nous avons enregistré chez les populations collectées
dans les différentes régions de la Tunisie. Cependant, Roby et
al. (2013) ont montré que des huiles essentielles des graines de
Foeniculum vulgare Mill de l'Egypte se caractérisent par un
rendement faible (1,95%).
2. Rendements en extraits aqueux
L'examen des résultats illustrés dans la figure
18 montre que les rendements moyens des extraits des graines de F.vulgare
Mill. des populations de Mjelis (humide) et Cebelet ben Ammar (semi-aride)
sont significativement différent des autres régions avec des
pourcentage 20,98% et 20,15 % respectivement.
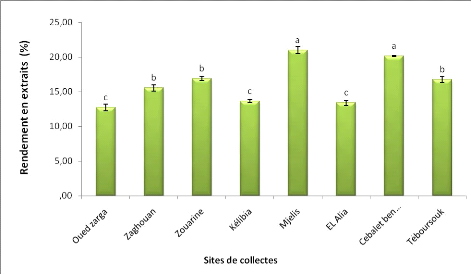
Figure 18: Rendements moyens en extraits des
graines de F.vulgare Mill. de différentes
provenances
35
Les extraits de la population d'Oued zarga de l'étage
bioclimatique semi-aride présente le rendement le plus faible
(12,7%).
Les rendements moyens des extraits aqueux des populations de
Zaghouan, Zouarine et Téboursouk sont proches du rendement de l'extrait
aqueux de F.vulgare de la Turquie (16,20%) (Oktay et al. 2003).
3. Analyse de la composition chimique des huiles
essentielles des graines de Foeniculum vulgare Mill.
L'analyse de la composition chimique des huiles essentielles des
graines de F.vulgare par CG -FID et GC/MS (Tableau 3), vise
essentiellement la détection de variations dans la teneur et la nature
des composés
Table 2: Composition chimiques des huiles
essentielles des graines de Foeniculum vulgare
Mill des
différentes provenances
Distribution en pourcentages des composés chimiques des
huiles essentielles des graines de F.vulgare (%)
|
Composés chimiques
|
RT
|
|
|
|
|
|
|
|
|
|
Zwerine
|
Mjeliss
|
Oued zarga
|
Sabelet ben ammar
|
Teboursek
|
Elalya
|
Zaghouen
|
Klibia
|
|
Tricyclene
|
7700
|
-
|
1,91
|
1,14
|
-
|
0,7
|
-
|
-
|
0,47
|
|
á-tujene
|
7808
|
2,14
|
14,16
|
12,24
|
8,28
|
4,82
|
17,8
|
3,03
|
11,1
|
|
á-Pinene
|
8075
|
-
|
1,99
|
2,19
|
-
|
1,92
|
4,24
|
0,88
|
1,65
|
|
Sabinene
|
9100
|
-
|
-
|
-
|
0,24
|
-
|
-
|
-
|
-
|
|
â-Pinene
|
9550
|
0,18
|
0,79
|
0,7
|
0,88
|
0,33
|
1,69
|
1,24
|
-
|
|
â-Myrcene
|
9633
|
0,68
|
1,81
|
2,15
|
13,16
|
1,99
|
1,31
|
1,31
|
1,88
|
|
á-Phellandrene
|
10200
|
1,24
|
-
|
1,93
|
-
|
3,7
|
-
|
-
|
-
|
|
A.3-Carene
|
10408
|
-
|
2,33
|
0,46
|
-
|
2,88
|
-
|
5,39
|
-
|
|
p-Cymene
|
10942
|
0,14
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Para cymene
|
10958
|
-
|
|
3,36
|
0,26
|
12,98
|
-
|
1,95
|
-
|
|
l-Limonene
|
11117
|
21,63
|
16,75
|
21,21
|
19,09
|
9,97
|
18,46
|
30,58
|
36,7
|
|
â-Phellandrene
|
11308
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
cis-Ocimene
|
11400
|
-
|
-
|
-
|
-
|
1,26
|
1,78
|
-
|
-
|
|
Fenchone
|
13558
|
3,76
|
1,59
|
1,9
|
5,99
|
5,07
|
3,96
|
5,26
|
-
|
|
á-Fenchone
|
13583
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Methylchavicol(estragole)
|
18358
|
49,55
|
51,87
|
35,93
|
42,61
|
47,33
|
46,19
|
45,46
|
43,8
|
|
Fenchylacetate exo
|
19925
|
-
|
0,8
|
-
|
-
|
-
|
0,13
|
-
|
-
|
|
Fenchylacetate
|
19333
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
á-Copaene
|
26217
|
0,29
|
-
|
-
|
0,46
|
|
0,78
|
-
|
-
|
|
E-anethol
|
34758
|
15,13
|
2,85
|
14,57
|
5,99
|
4,46
|
1,46
|
1,24
|
2,79
|
|
Total
|
|
94.738
|
96.85
|
97.787
|
96.95
|
97.4
|
97.783
|
96.32
|
96.72
|
36
La composition chimique des huiles a été
identifiée en se basant sur les valeurs de leurs indices de
rétention (RI) et par comparaison de leurs spectres de masse avec ceux
rapportés dans la littérature.
Les huiles essentielles ont été
identifiées de 94,73% à 97,78%. Elles ont pour composé
majoritaire le methylchavicol.
La population de Mjelis de l'étage bioclimatique humide
renferme le pourcentage le plus élevé en methylchavicol
(estragole) avec une teneur de 51,87% suivi du l-Limonene (16,75%).
Les huiles essentielles des graines de Zouarine, Zaghouan et
Kélibia appartenant à l'étage bioclimatique semi-aride se
caractérisent par des taux plus élevés en l-Limonene que
les autres sites.
Les variations, rencontrées dans la composition
chimique du point de vue qualitatif et quantitatif de nos populations peuvent
être dues à certains facteurs notamment la location
géographique, l'étage bioclimatique ou même à des
facteurs génétiques.
Napoli et al (2010) rapporte que l'huile essentielle extraite
des graines de F.vulgare Mill. de la région de « Val di
Noto » de l'Italie se caractérise par le même
chémotype que notre espèce. En effet, la composition de cette
huile essentielle est riche en estragole (71,1%). D'autres constituants avec
des teneurs plus faibles sont présents : Le fenchone (14,3%) et le
limonene (4,3%).
Cependant d'autres compositions de F. vulgare Mill.
ont été rapportées. En Inde, l'huile essentielle extraite
des graines de cette espèce se caractérise par le
chémotype trans-anéthol (70, 1%) (Singh et al., 2006).
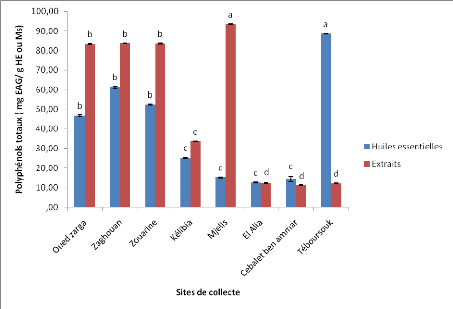
II. Teneurs en polyphénols totaux,
flavonoïdes et tanins 1. Polyphénols totaux
Les résultats de dosage des polyphénols totaux
par la méthode de Folin-Ciocalteu des extraits aqueux et des huiles
essentielles des graines de Foeniculum vulgare Mill. collectées
de huit régions de la Tunisie sont représentés dans la
figure 19.
37
Figure 19: Teneurs en polyphénols
totaux des extraits aqueux et des huiles essentielles des
graines de
Foeniculum vulgare Mill.
Les résultats obtenus ont montré que les teneurs
en polyphénols totaux des huiles essentielles et des extraits aqueux des
graines de Foeniculum vulgare Mill varient considérablement
d'une région à une autre.
Les huiles essentielles de la population de Téboursouk
de l'étage bioclimatique subhumide sont riches en polyphénols
totaux. Elles se distinguent significativement des autres populations avec une
teneur de 88,55 mg EAG/g HE. Cependant, les huiles essentielles des graines
collectées de la région d'El Alia a présenté la
teneur la plus faible (12,6mg EAG/g HE). Cette teneur est significativement
différente des teneurs enregistrées pour les sites appartenant
à l'étage bioclimatique semi-aride (Zouarine et Zaghouen).
La comparaison de nos résultats avec les travaux de
Moghaddama et al. (2015) sur une espèce médicinale de la
famille des apiaceaes «Cuminum cyminum L.» a montré
la supériorité des résultats enregistrés pour le
site de Téboursouk qui est deux fois plus riches en polyphénols
totaux. Cette étude a montré des teneurs similaires en ces
biomolécules (40 mgEAG/gHE) avec les teneurs enregistrées dans le
site d'Oued zarga.
38
Les teneurs des extraits aqueux de Foeniculum vulgare
Mill. en polyphénols totaux de la région de Mjelis se
distinguent significativement des autres régions avec une teneur de
93,42mg EAG/g MS.
Les extraits aqueux de la population de Cebalet ben ammar de
l'étage bioclimatique semi-aride présente la teneur la plus
faible (12,6mg EAG/g MS). Cette teneur est significativement différente
des teneurs enregistrées pour les sites de Zouarine et Zaghouen bien
qu'ils appartiennent au même étage bioclimatique.
Dua et al., (2013) ont rapporté que les teneurs en
polyphénols totaux des extraits aqueux de Foeniculum vulgare
Mill.de l'Inde renferme 16,506 mg EAG/g MS. Ces résultats sont en
accord avec les teneurs qu'on a trouvé pour les sites d'El Alia,
Téboursouk et Cebalet ben ammar.
L'analyse de la variabilité des teneurs des
polyphénols des huiles essentielles et des extraits aqueux entre les
populations montre des différences significatives surtout pour les
extraits. Cette variation peut être peut être due aux conditions
climatiques et à la localisation géographique (Falleh et al.,
2008).
On peut également attribuer cette variation au fait que
la méthode de Folin-Ciocalteu permet une évaluation brute des
composés phénoliques présents dans les extraits
végétaux pouvant donner des concentrations phénoliques
apparentes élevées. D'ailleurs, les divers composés
phénoliques répondent différemment dans cette analyse,
selon le nombre de groupes phénoliques qu'ils possèdent (Cook and
Samman, 1996).
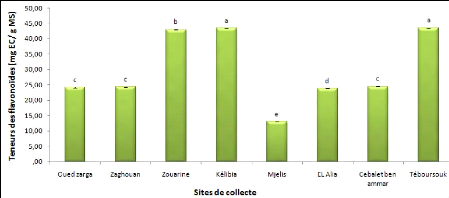
2. Les flavonoïdes
L'évaluation des teneurs en flavonoïdes est
effectuée par des dosages spectrophotométrique. Les
résultats sont exprimés en milligramme catéchine par
gramme de matière végétal sec.
39
Figure 20: Teneurs en flavonoïdes des
extraits aqueux des graines de Foeniculum vulgare
Mill.
Les résultats des teneurs en flavonoïdes
présentés dans la figure 20 montent que les extraits aqueux,
révèlent une variation entre les populations qui semblent
être corrélée à leur appartenance aux
différents étages bioclimatiques. En effet, les teneurs des
extraits de Foeniculum vulgare Mill. en flavonoïdes de la
région de Téboursouk (subhumide) et kélibia (semi-aride)
se distinguent significativement des autres régions avec des teneurs de
43,52 mgEC.g-1 MS et 43,45 mgEC.g-1 MS respectivement.
Les extraits de la population de Mjelis présente la
teneur la plus faible (13,07mgEC.g-1MS). Cette teneur est
significativement différente des teneurs enregistrées pour les
sites (Cebalet ben ammar, Zouarine et Zaghouan).
Les extraits aqueux des graines de Foeniculum vulgare
Mill. collectées de différentes provenances de la
Tunisie exhibe des teneurs plus élevées en flavonoïdes par
rapport à celles obtenues chez la même espèce de l'Inde
(9,325 #177; 1.25 mg EC/g MS) (Dua et al., 2013).
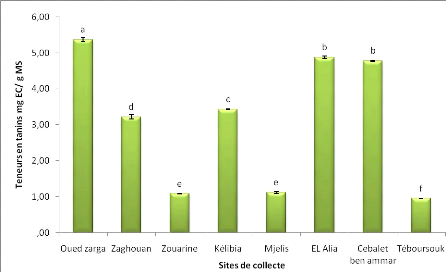
3. Les tanins condensés
L'analyse des résultats de quantification des tanins
condensés des extraits aqueux des graines de Foeniculum vulgare
Mill. (figure 21) montre que les teneurs enregistrées pour les
différentes populations sont beaucoup moins importants que celles en
flavonoïdes.
40
Figure 21: Teneurs en tanins condensés
des extraits aqueux des graines de Foeniculum
vulgare Mill.
Les teneurs en tanins des extraits aqueux d'Oued zarga
(subhumide) sont les plus importantes (5,37 mg EC/ g MS) et se distinguent
significativement des autres sites. Cependant, les résultats obtenus ont
montré que le site de Téboursouk du même étage
bioclimatique est la plus faible (0,955 mg EC/ g MS).
Les extraits aqueux des graines collectées d'El Alia et
Cebalet ben ammar présentent des teneurs similaires bien qu'ils
appartiennent à des étages bioclimatiques différents.
Les travaux menés par Lasonie et al, (2007)
sur Foeniculum vulgare Mill. de l'Algérie ont montré
également que les extraits aqueux contiennent des faibles teneurs en
tanins.
En général, la production des composés
phénoliques qui sont des métabolites secondaires peuvent
être influencée par les localisations géographiques et par
les changements climatiques.
Les teneurs en ces composés varient en fonction de
plusieurs conditions notamment la méthode d'extraction et la
durée d'extraction.
41
III. Etude de l'activité antioxydante des huiles
essentielles et des extraits aqueux des graines de Foeniculum vulgare
Mill.
L'activité antioxydante des huiles essentielles et des
extraits aqueux des graines de Foeniculum vulgare Mill. est
évaluée par la méthode de DPPH.
Les courbes des pourcentages d'inhibition du radical libre en
fonction des concentration des extraits ou des huiles nous ont permis de
déterminer les concentrations d'inhibition à 50 % (CI50) . Le
tableau 2 représente les valeurs des CI50 obtenues.
Table 3: Activité antiradicalaire
(CI50 en ìg.ml-1) des extraits et des huiles essentielles
des
graines de Foeniculum vulgare Mill. des différentes
provenances
|
CI50 (ìg.ml-1)
|
|
Sites
|
Extraits aqueux
|
Huile essentielles
|
|
Zwérine
|
111,46 #177; 0.03 g
|
43,825 #177; 0.025 e
|
|
Sabélit ben ammar
|
30,335 #177; 0.06 c
|
51,155 #177; 0.045 f
|
|
Mjelis
|
68,4 #177; 0.1 e
|
145,28 #177; 0.02 h
|
|
oued zarga
|
61,87 5 #177; 0.015 d
|
21,73 #177; 0.01 c
|
|
Klibiya
|
89,475 #177; 0.005 f
|
87,265 #177; 0.015 g
|
|
Alia
|
24,21 #177; 0.09 b
|
41,875 #177; 0.025 d
|
|
Zaghouen
|
165,36 #177; 0.07 h
|
8,675 #177; 0.025 b
|
|
Teborsok
|
21,87 #177; 0.02 a
|
6,12 #177; 0.01 a
|
Les résultats représentés sont les
moyennes de trois répétitions. Les valeurs suivies d'une
même lettre ne sont pas significativement différentes selon le
test de comparaison multiple de Newman-Keuls au seuil de 5%.
Les analyses statistiques ont montré que les valeurs
des CI50 des extraits et des huiles essentielles de Foeniculum
vulgare Mill. des différentes provenances sont significativement
différentes.
L'extrait aqueux de la population de Zaghouen de
l'étage bioclimatique semi-aride présente la plus importante
valeur de CI50 (165,36 ìg.ml-1) correspondant
à la capacité antiradicalaire la plus faible. Cependant, la
population de Téboursouk de l'étage bioclimatique subhumide
exhibe la capacité antiradicalaire la plus importante avec une valeur de
CI50 la plus faible
42
(21,87ìg.ml-1).
Les travaux menés par Parejo et al. (2004) sur les
extraits aqueux de F. vulgare Mill. de l'Espagne ont montré une
valeur de CI50 égale à 16,42 ìg.ml-1.Ces
extraits exhibent une activité antiradicalaire moins importante que
celle de Téboursouk.
Les travaux de Chatterjee et al. (2012) sur les extraits
aqueux de F.vulgare Mill. de Rajasthan sont proche de nos
résultats pour la population de Cebalet ben ammar avec une valeur de 30
ìg.ml-1.
Les résultats obtenus ont montré que la plus
faible capacité antiradicalaire des huiles essentielles F. vulgare
Mill est enregistrée pour la population de Mjeless qui
présente la plus grande valeur de CI50 (145,28
ìg.ml-1).
Les valeurs des CI50 des huiles essentielles de F.vulgare
Mill. montrent que la population de Téboursouk exhibe
l'activité antiradicalaire la plus importante (CI50 =
6,12ìg.ml-1) suivi de l'huile essentielle de Zaghouan (CI50 =
8,75ìg.ml-1).
Les travaux de Bouguerra (2012) sur les huiles essentielles de
F. vulgare Mill. de l'Algérie montrent une faible
activité antiradicalaire par rapport à nos résultats avec
une valeur de CI50 très grande
(752,65#177;32,5ìg.ml-1). Cependant, les travaux d'Anwar et
al. (2009) sur F. vulgare Mill. de Pakistan sont proche de nos
résultats pour la population de Sabelit ben ammar avec une valeur de
32,32 ìg.ml-1.
1. Analyse de l'activité antiradicalaire de l'huile
essentielle des graines de F.vulgare de Téboursouk
L'évaluation du pouvoir antioxydant par la
méthode DPPH de l'huile essentielle de Téboursouk a permis de
tracer la courbe représentée dans la figure 22.
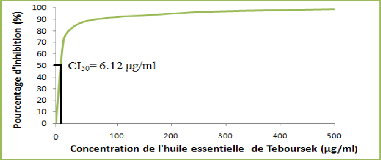
43
Figure 22: Variation du pourcentage
d'inhibition du radical libre en fonction de la
concentration d'huile
essentielle F. vulgare Mill.
Cette courbe montre que l'huile essentielle des graines de F.
vulgare est un bon capteur des radicaux libres.
A partir de cette courbe, on a pu déterminer graphiquement
la valeur de CI50, celle-ci exprime la concentration de
l'échantillon exigée pour réduire le DPPH. en
solution de 50 %. Pour mettre en évidence le pouvoir antiradicalaire de
cette huile, son CI50 (6,12 ug.ml-1) a été
comparée avec celle du standard de référence, le BHT (CI50
= 12,8 ug.ml-1).
La forte activité antiradicalaire de l'huile essentielle
de Téboursouk peut être liée à sa richesse en
composés phénoliques notamment en polyphénols totaux
(88,55 mg EAG/g HE). En effet, plusieurs études ont
démontré l'existence d'une relation étroite entre le
contenu en polyphénols du matériel végétal et sa
capacité antioxydante (Burda et Oleszek, 2001 ; Vinson et al.,
1995 ).
44
Conclusion
Les plantes aromatiques et médicinales riches en
principes actifs trouvent des applications dans de nombreux domaines notamment
dans le domaine alimentaire et médical.
La tendance actuelle à chercher des produits naturels,
a entraîné un regain d'intérêt des scientifiques pour
les substances issues des plantes médicinales.
Dans ce cadre, le présent travail a été
consacré à l'extraction et l'identification chimique des huiles
essentielles et des extraits aqueux d'une espèce spontanée de la
Tunisie, Foeniculum vulgare Mill. ainsi que l'étude de leurs
activités antioxydantes.
La détermination des rendements d'extraction en huiles
essentielles ont montré que l'huile essentielle des graines de
Foeniculum vulgare Mill.de la région de Teboursek appartenant
à l'étage bioclimatique subhumide se caractérise par un
rendement moyen (4,29%) plus élevé que les autres
régions.
L'analyse de la composition chimique des huiles essentielles
des graines de Foeniculum vulgare Mill. a montré que les huiles
collectées des huit régions sont principalement riches en
méthylchavicol (estragol). La composition à estragol
caractérise également le fenouil sauvage de l'Italie alors que
celle à E-anéthol caractérise Foeniculum vulgare
Mill.de l'Inde.
Les résultats de la quantification des composés
phénoliques indiquent queles huiles essentielles de la population de
Teboursek de l'étage bioclimatique sub-humide révèlent un
meilleur taux de polyphénols totaux (88,55 mg EAG/g HE) tandis que la
population de Mjeless située à l'humide, arbore des taux
élevés en polyphénols totaux (93,42 mg EAG/g MS) au niveau
des extrait aqueux.
L'évaluation de l'activité antioxydante des
extraits aqueux et des huiles essentielles par la méthode de DPPH a
montré que l'huile essentielle des graines de F. vulgare de la
population de Teboursek exhibe l'activité antiradicalaire la plus
importante (CI50 = 6,12 ìg.ml-1) .Cette activité est
plus forte que celle de BHT (CI50 = 12,8 ìg.ml-1)
Les résultats obtenus méritent donc d'être
compléter en vue d'une éventuelle utilisation des huiles
essentielles en médecine et en alimentaire.
Il serait intéressant de développer les axes de
recherche suivants :
45
? Evaluer l'activité antioxydante par d'autres
méthodes telles que le blanchissement de la ?-carotène, la mesure
du pouvoir réducteur.
? Identification par HPLC et caractérisation par RMN
des principales molécules antioxydantes de F. vulgare Mill.
? La recherche d'autres activités biologiques
particulièrement anti-inflammatoire et anti-tumorale.
46
Références bibliographiques
AFNOR, 2000. Huiles essentielles.
Echantillonnage et méthodes d'analyse (Tome 1), Monographies relatives
aux huiles essentielles (Tome 2. Volumes 1 et 2).Mars.
Akrout A., Hajlaoui H., Mighri H., Najjaa H. et Neffati
M., 2009. Antimicrobial and antioxydant activities of Artemisia
herba-alba essenial oil cultivated in Tunisian arid zone. Académie des
sciences.24, 1-7.
Amimar Z., Lamarti A., Badoc A., Reduron J.P., Ouahabi S.
and Muckensturm B., 2001. Clonage du fenouil doux par culture d'apex.
Bull. Soc. Pharm. Bordeaux, 140, pp.43-58.
Anwar F., Ali M., Ijaz Hussaina A. et Shahid M.,
2009. Antioxidant and antimicrobial activities of essential oil and
extracts of fennel (Foeniculum vulgare Mill.) seeds from Pakistan. Flavour
Fragrance Journal, 24 : 170-176.
Aprotosoaie A.C., Spac A.D., Hancianu M., Miron A.,
Tanasescu V.F., Dorneanu V. et Stanescu U., 2010.The chemical profile
of essential oils obtained from fennel fruits (Foeniculum vulgare Mill.).
FARMACIA, Vol. 58 (1) ; pp. 46-54.
Arvy M.P. et Gallouin F., 2003. Epices, aromates
et condiments : 412p. France Paris. Belin N°
003063. France.Paris : 412p.
Badoc A., Amimar Z., Lamarti A. et Deffieux G.,
1998. Action de la colchicine lors de la micropropagation du fenouil
(Foeniculum vulgare Mill.) sur l'huile essentielle des fruits. Bull. Soc.
Pharm. Bordeaux, 137, pp. 25-36.
Barry N., 2001. Art d'extraire les huiles
essentielles. De parfum à faire soi même, pp. 125128.
Benazedine S., 2010. Activité insecticide
de cinq huiles essentielles vis à vis de Sitophilusoryzae
(coleoptera ; Curculionidae) et Triboliumconfusum (Coleoptera ;
Tenebrionidae). Ecole nationale supérieure agronomique El Harrach
Algérie.
Benini C., 2007. Contribution à
l'étude de la diversification de la production d'huiles essentielles
aux Comores. Mémoire d'ingéniorat.
Université Gembloux, 109p.
Bouguerra A., 2012. Etude des activités
biologiques de l'huile essentielle extraite des graines
47
de Foeniculum vulgare Mill. en vue de son utilisation
comme conservateur alimentaire.
Mémoire de magister en biotechnologie alimentaire.
Institute de la nutrition de l'alimentation
et des technologies agro alimentaires. Constantine. 103p.
Brisset J.L., 2011. Chimie analytique en
solution : Principes et applications, Lavoisier, 2éme
édition.
Bruneton J.,1993. Pharmacognosie :
phytochimie, plantes médicinales. Lavoisier ed.,Paris :
Tec
et Doc. 915.
Bruneton J., 1993. Pharmacognosie,
Phytochimie, Plantes médicinales. Paris : éditions
médicales internationales. Editions Tec et Doc
Lavoisier.409-417.
Bruneton J., 1999. Pharmacognosie :
Phytochimie, plantes médicinales. Tec. et Doc.
Lavoisier. 3ème édition, Paris.
Bruneton J., 2009. Pharmacognosie -
Phytochimie, plantes médicinales, 4ème éd., revue et
augmentée, Tec et Doc. éditions médicales
internationales, Paris : 1288
Burda S. et Oleszek W., 2001. Antioxidant and
antiradical activities of flavonoids, Journal
of Agricultural and Food Chemistry, 49 : 2774-2779.
Causse C., 2005. Les secrets de santé
des antioxydants, Alpen Edition s.a.m. 95p.
Chatterjee S., Goswami N. et Bhatnagar P.,
2012. Estimation of phenolic components and
in vitro antioxidant activity of fennel (Foeniculum vulgare)
and ajwain (Trachyspermum
ammi) seeds. Advances in Bioresearch, 3[2] : 109-118.
Cook N. C. et Samman S., 1996. Flavonoids
Chemistry, metabolism, cardioprotective effects
and dietary sources. Nutritional biochemistry, 7 : 66-76.
Ozcan M.M. et Chalchat J.C, 2004. Aroma
profile of Thymus vulgaris L. growing wild in
turkey.
Bulg. J. Plant Physiol., 30 (3-4), pp.68-73.
De Billerbeck V.G., 2007. Huiles essentielles
et bactéries résistantes aux antibiotiques.
Phytothérapie. p. 249-253.
Dewanto V., Wu X., Adomk K.K. et Liu R.H.,
2002. Thermal processing enhances the
nutritional
value of tomatoes by increasing total antioxidant activity.
Journal of Agricultural and
Food Chemistry, 50 : 3010-3014.
Diaaz-Maroto M.C., Pearez-Coello M.S., Esteban J. et
Sanz J., 2006. Comparison of the
volatile composition of wild fennel samples (Foeniculum
vulgare Mill.) from Central Spain. J.
48
Agric. Food Chem. 54, 6814-6818.
Dua A., Garg G. et Mahajan R., 2013.
Polyphenols, flavonoids and antimicrobial properties of methanolic extract of
fennel (Foeniculum vulgare Miller). European Journal of Experimental Biology,
3(4) : 203-208.
Duquenois P., 1982. Les médicaments
aromatiques, leur caractère, leur contr'le. Phytothérapie.
1 : 10-17.
Dutertre J.M-J., 2011. Enquête prospective
au sein de la population consultant dans les cabinets de médecine
générale sur l'île de la Réunion : à propos
des plantes médicinales, utilisation, effets, innocuité et lien
avec le médecin généraliste, Thèse de doctorat
d'Etat : Médecine, France : Université Bordeaux 2- Victor
Segalen.
Edris A.E., Shalaby A. et Fadel H., 2003.
Evaluation of a chemotype of spearmint (Menthaspicatal) growing in Siwa Oasis,
Egypt. Eur. Food Technol. 218 : 74-78.
EFSA, 2009.EFSA Scientific cooperation (ESCO)
working group on botanicals and botanical preparations ; Advice on the EFSA
guidance document for the safety assessment of botanicals and botanical
preparations intended for use as food supplements, based on real case studies
on request of EFSA. EFSA Journal, 7 (9) : 280 ; 104p.
Falleh H., Ksouri R., Chaieb K., Karray-Bouraoui N.,
Trabelsi N., Boulaaba M. et Abdelly C., 2008. Phenolic composition of
Cynara cardunculus L. organs, and their biological activities C.R. Biologies.
331 : 372-379.
Fraga C. G., Galleano M., Verstraeten S.V. et et Oteiza
P. I., 2010. Basic biochemical mechanisms behind the health benefits
of polyphénols. Molecular Aspects of Medicine. Girard G.,
2010. Les propriétés des huiles essentielles dans les
soins bucco-dentaires d'hier aujourd'hui, France : Université Henri
Poincaré Nancy 1.
Grundhofer X., Donghong L., Jianchu C., Xingqian Y.,
Yaqin Met John S., 2001. Juice components and antioxidant capacity of
Citrus varieties cultivated in China. Food Chem, 106 : pp 545-551.
Hamilton Raven P., Franklin Evert R., et Eichhorn S. E.,
2000 Biologie Végétale, Paris, 944 p.
Hatano T., Kagawa H. et Yasuhara T. et Okuda T.,
1988. Two new flavonoids and other constituents in licorice root their
relative astringency and radical scavenging effect. Chem. Pharm. Bull, 36 :
2090-2097.
49
Hellal Z., 2011. Contribution à
l'étude des propriétés antibactériennes et
antioxydantes de certaines huiles essentielles extraites des citrus.
Application sur la sardine. Mastère, faculté des sciences
agronomiques, Algérie, 120p.
Hopkins W.G., 2003. Physiologie
végétale. Paris : 532p.
Huang et al., 1987. Perfumer and flavorist, Vol.
13, N° 2, 67p.
In Besombes C., 2008.Contribution
l'étude des phénomènes d'extraction
hydro-thermomécanique d'herbes aromatiques. Applications
généralisées. Thèse de doctorat. Université
de La Rochelle, 41p.
Hurabielle M. et Paris M., 1987. Monographies,
Généralités : plantes glucides (holosides,
hétérosides), à lipides, à huiles essentielles,
à protides et à alcaloïdes. Abrégé de
matière médicale, pharmacognosie. Tome I, 339p.
In Belaagoune S. et Himed L., 2007. Etude de
l'activité antioxydant d'une huile essentielle de Schinus molle.
Mémoire d'Ingéniorat. INATAA, Université Constantine.
57p.
Iserin P., 1997. Encyclopédies des
plantes médicinales : Identification, préparation, soins,
Larousse-Bordas, pp 1-130.
Kaloustian J. et Hadji-Minalou F., 2013. La
connaissance des huiles essentielles : qualitologie et aromathérapie.
Paris , 226p.
Kaur G.J. et Arora D.S., 2010. Bioactive
potential of Anethumgraveolens, Foeniculum vulgare and Trachyspermumammi
belonging to the family Umbelliferae - Current status. Journal of Medicinal
Plants Research Vol. 4(2), pp. 087-094.
Kothe H.W., 2008. 1000 plantes aromatiques et
médicinals. Terre editions. Toulouse, 328p. 2008.
Lahlou M., 2004. Methods to study phytochemistry
and bioactivity of essential oils. Phytotherapy Research 18 : pp. 435-448.
Lazouni H.A., Benmansour A., Taleb-Bendiab S.A. et
Chabane Sarid D., 2007. Composition des constituants des huiles
essentielles et valeurs nutritives du Foeniculum vulgare Mill.Sciences
& Technologie. 25 : 7-12.
Legrand G., 1994. Manuel du Préparateur
en pharmacie l'usage des élèves préparateurs et
étudiants stagiaires en pharmacie, Edition : Masson, pp 1-20.
Lis-Balchin M. et Deans S.G., 1997. Bioactivity
of selected plant essential oils against Listeria monocytogenes. J. Appl.
Microbiol., 82,p :759-62.
50
Macheix J. J, Fleuriet A et Jay Allemand C.,
2005. Les composés phénoliques des
végétaux, un exemple de métabolites secondaires
d'importance économique. Presses Polytechniques et Univesitaires
Romandes. Lausanne : 192 p.
Mau J.L., Chao G.R. et Wu K.T., 2001.
Antioxidant properties of methanolic extracts from several ear mushrooms.
Journal of Agricultural and Food Chemistry, 49 : 5461-5467. Meftah T et
A.N.N., 2003. Programme UICN - Cosmétologie au naturel :
cosmétologie au naturel; Alger.
Messkgue M., 1975.Mon herbier de sante, Edition
Robert Laffont S.A., Paris, pp 1-50. Moghaddama M., Khaleghi Miran
S.N., Pirbalouti A.G., Mehdizadeh L. et Ghaderie Y. ,2015 Variation in
essential oil composition and antioxidant activity of cumin (Cuminum cyminum
L.) fruits during stages of maturity. Industrial Crops and Products, 70 :
163-169. Mohammad S, Abu-Darwish and Abu-Dieyeh Z.H.M., 2009.
Essential oil content and heavy metals composition of Thymus vulgaris
cultivated in various climatic regions of Jordan. Int. J. Agric. Biol., Vol.
11, N° 1, pp.59-63.
Mohammedi Z., 2006. Etude du pouvoir
antimicrobien et antioxydant des huiles essentielles et flavoîdes de
quelques plantes de la région de Tlemcen. Thése de doctorat,
Faculté des sciences Tlemcen.
Munoz-Bertomeu J, Arrillaga I et Segura J.,
2006. Essential oil variation within and among naturel populations of
Lavandulalotifolia and its relation to their ecological areas, Biochemical
systematics and ecology, 1-10.
Napoli E.M., Curcuruto G., Ruberto G., 2010.
Screening the essential oil composition of wild Sicilian fennel. Biochemical
systematics and ecology 38 : 213-223.
OktayaM, Gulcin I_ et Kufrevioglu I_. Determination of in vitro
antioxidant activity of fennel (Foeniculum vulgare) seed extracts.
Lebensm.-Wiss. U.-Technol. 36 : 263-271. 2003. Olle M. et Bender I.,
2010. The content of oils in Umbelliferous crops and its formation.
AgronomyResearch 8 (3), pp.687-696.
Organisation mondiale de la santé, 2002.
Médecine traditionnelle (rapport du secrétariat). Conseil
exécutif, cent onzième session.
Padrini F. et Lucheroni M.T., 2006. Huiles
essentielles. Italie. 206p.
Parejo I., Viladomat F., Bastida J., Schmeda-Hirschmann
G., Burillo J. et Codina C., 2004. Bioguided isolation and
identification of the nonvolatile antioxidant compounds from fennel (Foeniculum
vulgare Mill.) waste. Journal of Agricultural and Food Chemistry, 52 :
1890-1897.
51
Pellecuer J, Jacob M, De Simeon B, Dusart G, Attisso M,
Barthez M, Gourgas L, Pascal B et Tomei B., 1980 Plant. Méd.
Phytothér.
Pharmacopée européenne. 2008.
Huiles essentielles - Aetherolea.
Piochon M., 2008. Étude des huiles
essentielles d'espèces végétales de la flore laurentienne
: composition chimique, activités pharmacologiques et
hémi-synthèse. Mémoire de maîtrise : Ressources
renouvelables. Canada : université de Québec.
Pottier-Alapetite G., 1979. Flore de la Tunisie
: Angiospermes - Dicotylédones. Apétales. Dialypétales.
Edit. Imprimerie officielle de la République Tunisienne. Tunis :
651p.
Price M.L., Scoyoc S.V. et Butle L.G., 1987. A
Critical Evaluation of the Vanillin Reaction as an Assay for Tannin in Sorghum
Grain. Journal of Agricultural and Food Chemistry, 26, No. 5. 1978.
Rameau J.C., Mansion D., Dumé G., Gauberville C.,
Bardat J., Bruno é. et Keller R., 2008. Flore forestière
fran§aise : Région méditerranéenne,Forêt
privée française, Paris, 2426p.
Rashid A, Qureshi M.Z, Raza S.A, William J et Arshad M.,
2010. Quantitative determination of antioxidant potential of Artemisia
persica. Analele Universita N' iidinBucuresti - Chimie(serienoua), vol. 19 N1,
pp. 23-30.
Rejeb M.N, Khouja M.L, Ghrabi Z, Chemli R, Albouchi A,
Khaldi A et Dahmen M., 2006. Guide des plantes médicinales et
aromatiques, Maghreb.
Roby M.H.H, Sarhan M.A, Selim K.A-H et Khalel K.I.,
2013. Antioxidant and antimicrobial activities of essential oil and
extracts of fennel (Foeniculum vulgare L.) and chamomile (Matricaria chamomilla
L.). Industrial Crops and Products, 44 : 437- 445. Roux D. et Catier
O.2007, Botanique, pharmacognosie, phytothérapie, France, 141p.
Silvant C. 2015, L'Aromathérapie : La nature au service
de l'humanité, Paris, 208p. 2015. Singh G., Maurya S., Lampasona
M.P., Catalan C., 2006. Chemical constituents, antifungal and
antioxidative potential of Foeniculum vulgare volatile oil and its acetone
extract. Food Control 17 : 745-752.
Stalikas, C. D., 2007.Extraction, separation,
and detection methods for phenolic acids and flavonoids Review. J. Sep. Sci.
30, 3268 - 3295.
Stefanini M.B, Ming L.C, Marques M.O.M, Meireles M.A.A,
Moura L.S and Marchese J.A., 2006.Seed productivity, yield and
composition of the essential oil of fennel Foeniculum vulgare var. dulcis in
the season of the year. Rev. Bras. Pl. Med., Botucatu,Vol.8, pp.86-90.
52
Sun B.S, Ricardo-da-Silva J.M et Spranger I,
1998. Critical factors of vanillin assay for catechins and
proanthocyanidins .Journal of Agricultural and Food Chemistry.
Treiner J., 2000. Glossaire de la classe de
Seconde. Bulletin Officiel, 6 : 25- 35.
Ultree A, Slump R.A, Steging G et Smid E.J.,
2002. Antimicrobial activity of carvacrol on rice. Journal of food
protection.63, p : 620-624.
Vienna C.F, Bauer R, Carle R, Tedesco D, Tubaro A and
Zitterl-Eglseer K., 2005 Assessment of plants/herbs, plant/herb
extracts and their naturally or synthetically produced components as
"additives" for use in animal production. FEEDAP ; 297p.
Vinson J.A., Dabbagh Y.A., Serry M.M. et Jang J.,
1995.Plant flavonoids, especially tea flavonols, are powerful
antioxidants using an in vitro oxidation model for heart disease. Journal of
Agricultural and Food Chemistry, 43 : 2800-2802.
Viollon C, Chaumont J.P et Leger D., 1993. Plant
MédPhytothér 26, 17. 1993.
Zahid N.Y, Abbasi N.A, Hafiz I.A et Ahmad Z.,
2009. Genetic diversity of indigenous fennel (Foeniculum vulgare
Mill.) Germplasm in pakistan assessed by RAPD markers. Pak. J. Bot., 41(4) :
pp.1759-1767.
Zambonelli A, D'Aurelio A.Z, Severi A, Benvenuti E, Maggi
L et Bianchi A., 2004.Chemical
composition and fungicidal activity of comercial oils of thymus
vulgaris L. J. Essent. Oil Res. 16(1) : p. 69 - 74.
| 


