|
REPUBLIQUE TUNISIENNE
Ministère de l'Enseignement Supérieur et
de la Recherche Scientifique
Université de Carthage
Institut Supérieur des Sciences et Technologies
de l'Environnement de Borj-Cédria
|
|
|
|
|
|
|
|
Projet de Fin d'Etudes
Licence Appliquée en
Physique, chimie de l'environnement
Réalisé à : Laboratoire de
Traitement des Eaux Usées Centre de Recherche et Des Technologies des
Eaux Bordj-Cédria
Présenté par :
BEN MOULA Mouna & ALI Afef
Thème
Etude des propriétés biochimiques et
adhésives des
souches de Candida spp. isolées de la
station
de traitement des lixiviats de Djebel Chakir
Soutenu devant le jury composé de :
Mr Taher El Kateb Président
(ISSTE-Tunis)
Mr Snoussi Mejdi Encadreur (CERTE,
Borj-Cédria)
Mme Noumi Emira Encadreur (ISBM, Monastir)
Année Universitaire: 2011 - 2012 N° d'ordre
:
.2050 ä?ã ÇÇãÍ 1003
È.Õ ÉíÑÏÓáÌ
ÇÑÈÈ
íÌæáæäßÊáÇ
ÈØÞáÇ
ÉíÑÏÓáÌ
ÇÑÈÈ ÉÆíÈáÊ
ÇÇíÌæáæäßÊ
æ ãæáÚá
íáÇÚáÇ ???
Dédicace
A mes parents Abed Razzak Ben Moula et Khadija
Salaani.
A mes frères et soeurs Mohamed, Majdi, Maha et
Malek.
Vous vous êtes dépensés pour moi sans
compter.
En reconnaissance de tous les sacrifices consentis par
tous.
Avec toute ma tendresse.
A mes oncles, tantes, cousins et cousines.
Vous avez de près ou de loin contribué à
ma formation.
Affectueuse reconnaissance
A tous mes ami(e)s et à leurs familles.
Dédicace
A mes parents Lotfi Ali et Saliha Ali.
A mes frères et soeurs Haithem, Saleh, Rachid et
Bouthaina.
Vous vous êtes dépensés pour moi sans
compter.
En reconnaissance de tous les sacrifices consentis par
tous.
Avec toute ma tendresse.
A mes oncles, tantes, cousins et cousines.
Vous avez de près ou de loin contribué à
ma formation.
Affectueuse reconnaissance
A tous mes ami(e)s et à leurs familles.
Merci ...
Remerciements
Ce travail a été effectué grâce
à la collaboration du laboratoire
de Traitement des Eaux Usées au Centre de Recherches
Et des
Technologies Des Eaux (Technopôle de
Bordj-Cédria).
Nous remercions ce partenaire pou l'intérêt
qu'il à porté à ce
sujet.
Nous avons l'honneur d'exprimer nos sentiments de gratitude
et
nos remerciements les plus chaleureux à toute
personne qui nous
a aidés dans l'accomplissement de ce travail et
particulièrement à
nos encadreurs Mr. Snoussi Mejdi, Maitre Assistant
en
Microbiologie (CERTE) et Mme Noumi Amira, Assistante
en
Microbiologie (ISBM, Monastir) qui ont accepté de
diriger notre
projet de fin d'études, pour leur important et
efficace aide pour
l'élaboration de ce travail.
Que ce travail soit le témoignage de notre vive
reconnaissance et
notre profond respect à Mr. Trabelsi Ismail pour
l'honneur qu'il
nous a accordé pour travailler pour la
première fois sur cette
matrice : les lixiviats et pour ces prestigieux
conseils.
De même, nous tenons à exprimer nos sentiments
de respect et
nos remerciements les plus profonds A Melle Dehmeni
Ameni,
étudiante en Master, Melle Ben Rhomdane Hajer
(Technicienne
du laboratoire) qui nous ont soutenus pour accomplir ce
rapport.
Nous exprimons aussi nos remerciements aux membres de
jurys
pour le grand honneur qu'ils nous ont accordé en
acceptant de
juger ce projet de fin d'études.
Sommaire
Introduction 1
Synthèse bibliographique
I. Définition des lixiviats 3
1. Mécanisme de formation des lixiviats
3
2. Composition des lixiviats 4
3. Types de lixiviats 4
II. Généralités sur les Candida
. 4
1. Taxinomie et classification 5
2. Morphologie et reproduction . 5
2. 1. Caractéristiques macroscopiques
5
2.2. Caractéristiques microscopiques 5
2.3. Caractéristiques biochimiques . 5
a. Structure cellulaire . 6
b. Structure générale de la paroi .
6
3. Distribution des espèces de
Candida........................................ 6
III. Facteurs de pathogénicité des
Candida spp 8
1. Variabilité morphologique .. 8
2. Le dimorphisme .. 9
3. Les enzymes 9
4. Adhérence de C.
albicans......................................................
9
IV. différents types de candidoses
10
1. Les candidoses cutanées . 10
2. Les candidoses vaginales 10
3. Les candidoses buccales et digestives 11
V. Résistance aux antifongiques . 11
1. Différent types de résistance
11
VI. Les biofilm fongiques 12
1. Structure d'un biofilm 12
2. Propriétés du biofilm ..
12
3-Développement du biofilm à
Candida....................................13
4-Facteurs favorisant le développement d'un biofilm
à Candida... 14
Méthodologie & Protocoles
I-Description du site d'étude 15
II-Identification biochimique des espèces de
Candida spp. isolées 16
II. 1. Echantillonnage. 16
II.2. Isolement et
caractérisation biochimique des espèces de
16
Candida
II.2.1. Isolement des espèces de Candida sur
milieu chromogénique 16
II.2.2. Purification des espèces de Candida sur
gélose Sabouraud- 17
chloramphénicol .
II.2.3. Observation microscopique 17
II.2.4. Test de floculation 17
II.2.5. Etude des caractères biochimiques sur galeries
Api Candida 18
III. Etude phénotypique de la résistance
des isolats de Candida 19
spp. aux agents antifongiques ..
III.1. Test de résistance à l'acide borique
19
III.2. Test de résistance à l'amphotéricine
B 19
III.2.1. Sur milieu solide . 19
III.2.2.Détermination de la Concentration
Minimale Inhibitrice et
20
(CMI) et de la Concentration Minimale Fongicide (CMF)
20
IV. Etude des activités enzymatiques
IV.1. Détermination de l'activité de la
phospholipase .. 20
IV.2. Détermination de l'activité de
l'aspartylprotéase secrétée ..... 21
IV.3. Détermination de l'activité de
l'estérase . 21
IV.4. Etude de pouvoir hémolytique . 22
IV.5. Identification des enzymes par les galeries Api ZYM ..
22
V. Etude qualitative et quantitative de
l'adhésion des souches de
Candida isolées .. 23
V.1. Etude qualitative de l'adhésion
24
V.1.1. Coloration à la safranine .
24
V.1.2. Production de « slime » sur gélose
préparée au rouge Congo. 24
V.2. Etude quantitative de l'adhésion
24
V.2.1. Test de hydrophobicité 24
V.2.2. Adhésion des Candida spp. sur les
plaques en polystyrène 25
Résultats
I. Caractérisation phénotypique des
espèces de Candida spp.
isolées 27
1. Etude morphologique . 27
1.1. Caractéristiques macroscopiques
27
1.2. Caractéristiques microscopiques
28
2. Différentes espèces de Candida spp.
Isolées à partir de la station
de traitement des lixiviats de Djebel Chakir
29
3. Test de floculation 30
4. Test de résistance à l'acide borique
31
II. Activité antifongique 31
1. Méthode de diffusion de disque
31
1.
31
Méthode de diffusion de disque
2. Détermination de la Concentration Minimale
Inhibitrice (CMI) et
de la Concentration Minimale Fongicide (CMF) .
33
III. Etude de la virulence des différentes
espèces de Candida spp. 33
isolées .
1. Détermination de l'activité de la
phospholipase . 33
2. Détermination de l'activité de
l'aspartylprotéase secrétée 33
3. Détermination de l'activité de
l'estérase 34
4. Etude de pouvoir hémolytique
34
5. Identification des enzymes par les galeries Api ZYM
36
IV. Etude qualitative et quantitative de
l'adhésion des souches
de Candida spp. Isolées .
37
1. Etude qualitative de la formation de biofilm .
37
1.1. Coloration à la safranine ..
37
1.2. Culture sur milieu au rouge Congo .
37
2. Etude quantitative de la formation de biofilm
38
2.1. Test de hydrophobicité 38
2.2. Sur les plaques en polystyrène .
38
Discussion 45
Conclusions générales 46
Références bibliographiques
Liste des Abréviations
A : Absorbance
AmB : Amphotéricine B
BSA : Sérum Bovine Albumine
C. albicans : Candida albicans
CDR: Candida Drug Resistance
CMI: Concentration minimale inhibitrice
CMF: Concertations minimale fongicide
CVV: Candidose vulvo-vaginale
DCO: Demande Chimique en Oxygène
SDD: Susceptibilité Dose Dépendante
DMSO: Diméthyl Sulfoxyde
DO: Densité Optique
ELISA: Enzyme-linked Immunosorbent Assay
Fe2+ : Fer
h : heure
MDR: Multi Drug Resistance
min: minute
Mg2 + : Magnesium
MgSO4:
Mm: Millimolaire
MTT: Bromure de
3-[4,5-diméthylthiazol-2-yl]-2,5-diphényltétrazolium
NaCl : Chlorure de soduim
Na2HPO4 : sodium déshydrogénophosphate
nm: Nanomètre
PBS : Phosphate Buffer Saline
PZ: Activité enzymatique
R: Résistante
rpm : rotation par minute
S : Sensible
XTT:2,3-bis (2-méthoxy-4-nitro-5-sulfophényl)-5
[(phénylamino) carbonyl]-2H-tétrazoli
YNB: Yeast Nitrogène Base
YNBG : Yeast Nitrogène Base Glycose
YPD: Milieu de culture Yeast extact /peptone /dextrose
Liste des figures
Figure 1. Différentes formes de
croissance des Candida 8
Figure 2. Schéma d'un biofilm
formé aux surfaces polymérique 13
Figure 3. Photo aérienne du centre
d'enfouissement technique de Djebel-Chakir 15
et les bassins de stockage des lixiviats
Figure 4. Unité de traitement des
lixiviats de la décharge de Djebel- 16
Chakir
Figure 5. Les principaux morphotypes obtenus
sur milieu CHROMagarTM 27
Candida
Figure 6. Observation microscopique des
colonies de Candida sur gélose 27
Sabouraud - chloramphénicol
Figure 7. Observation microscopique des
cellules de Candida colorées à la 29
fushine au microscope optique (G×100)
Figure 8. Détermination des
diamètres des zones d'inhibition de la croissance des
levures sur milieu Mueller-Hinton-Glucose-Bleu de
31
Figure 9. Aspect de l'activité de la
phospholipase sur gélose à base de jaune 33
d'oeuf
Figure 10. Différents exemples de
l'activité de la protéase obtenue sur gélose à
34
base de BSA .
Figure 11. Aspect des colonies ayant un
pouvoir hémolytique de type â sur gélose
34
à base de sang de mouton .
Figure 12. Formation de biofilm par la
méthode de coloration à la safranine 37
1%
Figure 13. Dégradation de la couleur
des souches de Candida cultivées sur des 37
boites contenant le rouge Congo
Figure 14. Distribution des valeurs de
l'absorbance de XTT (a) à 492 nm et du 41
cristal violet à 595 nm ..
Liste des tableaux
Tableau I. Caractères enzymatiques
étudiés sur les galeries Api Candida............
18
Tableau II. Caractères enzymatiques
étudiés sur les galeries Api Zym .. 23
Tableau III. Couleur des isolats obtenus sur
milieu CHROMagarTM Candida en
fonction de l'origine d'isolement . 28
Tableau IV.
Différentes espèces de levures isolées à
partir de la station de
29
...
traitement des lixiviats de Djebel Chakir
Tableau V. Origine, forme et caractères
biochimiques des levures isolées et
testées par les galeries Api
Candida...............................................................
30
Tableau VI. Résistance phénotypique
des différentes souches test l'amphotéricine
B 32
Tableau VII. Activités enzymatiques
(phospholipase, estérase et aspartylprotéase)
et pouvoir hémolytique des différentes souches
isolées 35
Tableau VIII. Caractères enzymatiques des
différents isolats de levures obtenus
sur la galerie Api Zym 36
Tableau IX. Etude qualitative de la production
d'exopolysaccharides par
coloration à la safranine 1% 39

INTRODUCTION
1
Introduction
Les lixiviats représentent des effluents d'eaux
fortement polluées issus des centres d'enfouissements
contrôlés. De nos jours une préoccupation des
autorités concernées par la gestion durable des déchets
est accordée.
En Tunisie, les centres d'enfouissements techniques compte 20
décharges contrôlées dont 9 sont en phase d'exploitation.
La forte humidité des déchets en Tunisie (moyenne de 65%) produit
un volume important des lixiviats qui doivent être traitées avant
leurs rejets dans un milieu récepteur. Le stockage des lixiviats
produites des centres d'enfouissement a été la solution la plus
adoptée comme pour le cas de la décharge contrôlée
de Djebel Chakir. La décharge de Djebel Shakir est d'une importance et
particularité nationale. En fait, 40% des déchets produits en
Tunisie sont enfouis dans cette décharge. Jusqu'au nous jours les
lixiviats de cette décharge sont collecté sans traitement dans 13
bassins.
Les souches de Candida isolées des lixiviats
qui sont des effluents toxiques issus des centres de stockage des
déchets de Djébel Chakir figurent parmi les dix micro-organismes
pathogènes les plus fréquemment isolés et sont
responsables de 7% de tous les épisodes fébriles d'origines
infectieuses. Les levures du genre Candida peuvent être à
l'origine de mycoses superficielles ou invasives. Ces dernières sont
responsables d'une lourde morbidité et mortalité chez les
patients immunodéprimés.
L'accroissement du nombre de sujets atteints de candidose,
l'émergence de nouveaux agents pathogènes et la volonté de
diminuer cette morbidité sont l'origine du développement de
nouvelles technologies appliquées au diagnostique, au suivi de maladies
fongiques ainsi qu'au développement de nouvelles molécules
antifongiques. En effet, les biofilm fongiques sont des structures très
résistantes et complexes. Il a été démontré
que l'expression de certaine gènes est induite en fonction de la
colonisation des souches de Candida sur les supports, La formation de biofilm
ainsi que la communication intercellulaire ce qui induit leur virulence, leur
pathogénicité et leur résistance à certains agents
antifongiques.
2
Introduction
Notre rapport comporte une première partie
bibliographique avec un rappel épidémiologique, et l'étude
de caractéristiques biochimiques des souches de Candida spp.
Cette première partie est suivie d'une partie pratique
dont les objectifs sont :
1- Identifier biochimiquement les différentes
espèces de Candida isolées de la station de traitement
des lixiviats (Djébel Chakir).
2- Etudier la virulence des espèces identifiées
(activités des enzymes hydrolytiques et hémolytiques) sur milieux
solides spécifiques et sur galeries Api Zym.
3- Etudier qualitativement et quantitativement la formation
de la biofilm par deux méthodes (XTT et Cristal Violet).
4- Etudier la résistance phénotypique aux
antifongiques (méthode de disque et méthode liquide pour la
détermination des CMIs et CMFs).

SYNTHÈSE
BIBLIOGRAPHIQUE
Synthèse Bibliographique
I. Définition des lixiviats
Les lixiviats, appelés aussi lessivats, percolât
ou « jus de décharge », on désigne« L'eau qui a
percolé à travers les déchets en se chargeant
bactériologiquement et surtout chimiquement de substances tant
minérales qu'organiques. Le lixiviat (ou Percolât) est le liquide
résiduel qui provient de la percolation de l'eau à travers un
matériau.
Ce terme désigne notamment tous les «jus»
issus de décharges, de déchets, de composts, ... etc. Il vient de
l'adjectif latin « lixivius », qui signifie: «de lessive, eau
qui sert à laver». Dans le cas de déchets, le lixiviat se
charge de polluants organiques, minéraux et métalliques, par
extraction des composés solubles (lixiviation facilitée par la
dégradation biologique des déchets) et risque ainsi de provoquer
la pollution de la nappe phréatique. Cette contrainte est
particulièrement importante pour la localisation des décharges.
C'est en fait le résultat du chemin de l'eau qui s'est infiltré,
qui a percolé et ruisselé à travers les déchets
jusqu'à ce qu'elle se retrouve au fond de l'alvéole de stockage.
Il s'agit en quelque sorte du « jus de poubelle ». L'estimation des
taux de génération des lixiviats dans la décharge de Djbel
Chakir a été réalisée à partir de plusieurs
modèles numériques. Elle se base essentiellement sur les
paramètres climatiques lors du calcul des quantités de lixiviats
et le modèle du bilan hydrique qui tient compte des principales
composantes affectant la génération des lixiviats. Ces
composantes font inclure les paramètres climatiques et l'humidité
initiale des déchets.
En Tunisie, la quantité de lixiviats stockée
à Djbel Chakir est estimée à 100000 m3/an soit
270 m3/j qui sont stockés dans 8 bassins ayant une capacité
totale égale à 130000 m3. C'est en grande partie la
nature du lixiviat qui détermine la capacité des mâchefers
d'incinération d'ordures ménagères. La source principale
en eaux d'une décharge vient des précipitations. Il faut
toutefois tenir compte de l'humidité des déchets ainsi que du
niveau de la nappe phréatique qui peut remonter jusqu'à la base
d'une décharge.
1. Mécanisme de formation des
lixiviats
La formation des lixiviats est principalement causée
par l'infiltration directe de l'eau météoritique dans les
déchets qui va se charger en substances polluantes tels que la
matière organique soluble résultant de l'activité
biologique de la décharge (Leclerc et Bonneau) des
constituants inorganiques comme les métaux lourds et des germes qui
peuvent être très
dangereux pour la santé et l'environnement.
Synthèse Bibliographique
2. Composition de lixiviat
Les compositions chimiques et biochimiques des lixiviats sont
non seulement très diverses mais aussi variables dans le temps et dans
l'espace relèvent classiquement quatre types de polluants: (i) la
matière organique dissoute ou en suspension, issue de la biomasse,
exprimée généralement en DCO (les AGV, les substances
humiques et fulviques...); (ii) les micropolluants organiques (hydrocarbures,
composés aromatiques...) ; (iii) les composés minéraux
majeurs sous forme ionique (Ca2+, Mg2+, Na+,
K+ ,NH4+ ,Fe2+) et (iiii) les cations de
métaux lourds à l'état de trace.
D'autre part, les lixiviats peuvent aussi contenir certains
micro-organismes pathogènes. Plus de 200 familles de composés
organiques ont pu être identifiées au cours des nombreuses
études menées sur la caractérisation des lixiviats des
décharges. La composition globale des lixiviats est le plus
fréquemment déterminée grâce à des analyses
physico-chimiques. La qualité physico-chimique dépend de nombreux
facteurs qui sont cités dans les paragraphes
précédents.
3. Type de lixiviat
Suivant le stade d'évolution biologique des
déchets, trois types de lixiviats ont été
distingués.
· Les lixiviats stabilisés (Age de la
décharge > 10 ans)
· Les lixiviats intermédiaires 5 à 10 ans
· Les lixiviats jeunes (Age de la décharge < 5
ans)
Ces lixiviats se caractérisent par une charge organique
élevée biodégradable (très chargé par la
biomasse bactérienne) par rapport à celle de lixiviat
stabilisé.
II. Généralités sur les
Candida
1. Taxinomie et classification
Les Candida sont des champignons microscopiques. Ce
sont des organismes nucléés eucaryotes appartenant au
règne des champignons unicellulaires ou Fungi au phylum des
Ascomycètes, au sous-phylum des Saccharomycotina, de la classe des
Saccharomycètes, de l'ordre des Saccharomycétales, du groupe des
Saccharomycétales mitosporiques et du genre Candida.
Synthèse Bibliographique
Ce sont des organismes hétérotrophes,
constituant un groupe autonome dans le monde vivant indépendant des
bactéries. Ce genre regroupe plus de 200 espèces dont les plus
rencontrées en pathologie humaine sont C.
tropicalis, C. galabrata, C. krusei,
C.
guilliermondii, C. parapsilosis, C. kefyr,
C. dubliniensis et C. albicans. Cette dernière
étant la plus importante et la plus fréquemment
étudiée pour sa pathogénicité (Pfaller,
2006).
2. Morphologie et reproduction 2. 1.
Caractéristiques macroscopiques
L'examen macroscopique des espèces de Candida
cultivées en aérobiose, sur un milieu sélectif dont
le pH varie de 2.5 à 7.5 et à une température de 37°C
montre qu'il s'agit de colonies ovalaires, crémeuses, non
pigmentées et ayant une odeur de levure (Mc Culloudh et al.,
1996).
2. 2. Caractéristiques microscopiques
L'aspect microscopique brut de toutes les espèces de
Candida est semble. Ce sont des levures non capsulées, à
bourgeonnement multilatéral et productrices ou non filaments. Toutes les
espèces de Candida ont la forme de blastopores qui peuvent changer de
l'aspect ovoïde à allongé et même
sphérique (Odds, 1988). Macroscopiquement, C.
albicans apparaît une espèce dimorphique
caractérisée par la transition de la forme levure (blastopore
ovoïdes) à la forme filamenteuse (hyphes parallèles). En ce
qui concerne la taille, on remarque bien une variation entre les
espèces. En effet, la taille de C. albicans est de 2,9 à
7,2 x 2.9 à 14.4 ìm et C. krusei 2.2 à 5.6 x 4.3
à 15,2 ìm. Les cellules de C. krusei apparaissent
allongées et ayant l'aspect de grain de riz. C. kefyr est une
autre espèce médicalement importante ayant un aspect
microscopique semblable à celui de C. krusei
(Samaranayake et Samaranayake, 1994).
2.3. Caractéristiques biochimiques
Le principal caractère biochimique des espèces
de candida est la composition de la membrane cellulaire. En effet , la membrane
cellulaire est formé de 80 à 90% de carbohydrates qui sont des
polymères de glucose (â-glucanes), de
N-acétyl-D-glucosamine (chitine) et des polymères de mannose
associés d'une façon covalente aux protéine
(mannoprotéines), 6 à 25% de protéines et 1 à 7% de
lipides (Chaffin et al .,1998).
Synthèse Bibliographique
Le terme d'enveloppe cellulaire de
peut être défini comme étant l'ensemble de
la membrane plasmique, l'espace péri plasmatique, la membrane cellulaire
et la couche fibreuse associée à la région externe de la
membrane. La membrane plasmique forme une barrière perméable
entre le cytosol de la cellule et l'environnement extérieur. L'espace
péri plasmatique constitue la région entourée par la
membrane cellulaire et la membrane plasmique y compris l'espace
créé par évagination de la membrane. La membrane
cellulaire est essentielle pour la biologie de la biologie de la levure et la
présentation de son contenu cellulaire et aussi pour ses interactions
avec les cellules humaines hôtes (Cannon et Chaffin,
1999).
a. Structure cellulaire
C. albicans est un eucaryote avec un noyau, une
double membrane nucléaire, des chromosomes, des mitochondries et des
inclusions lipidiques. IL existe également dans ces cellules des
activités enzymatiques de type phosphatase, oxydase et peroxydase .la
membrane plasmique est recouverte d'une paroi qui donne à la levure sa
forme et sa stabilité mécanique .Elle est aussi une zone de
contact entre la cellule et son environnement et sa structure varie selon
l'âge et le stade morphologique de la levure (Calderone, 2002).
La paroi est l'élément le plus étudié de
la cellule.
b. Structure générale de la
paroi
La paroi de la levure représente environ 15 à 25
% du poids sec de la cellule. C'est un arrangement ordonné de
différents constituants. Certains sont liés par des liaisons
covalentes alors que d'autre sont retenus dans la paroi par des liaisons
covalentes alors que d'autres sont retenus dans la paroi par des liaisons
hydrogènes, des interactions ioniques, ou encore par des interactions
hydrophiles ou hydrophobes. Différent constituants comme les
polysaccharides, la chitine (N-acétylglucosamine ) et les
protéine constituent cette paroi Une structure rigide de polymère
complexes de glucose (-1,3 et -1,6 glucanes) et de chitine enveloppe la cellule
comme une armure et protège le champignon des stress environnementaux
tels que la pression osmotique ( Ruiz-Herrera,2006).
4. Distribution des espèces de
Candida
Les espèces de Candida sont des organismes
ubiquitaires (Odds, 1988).Ce sont des levures
pathogènes naturellement présentes dans la microflores de
l'être humain et des animaux, commensales du tractus digestif, de la
sphère or pharyngée et de l'appareil vaginal.
Synthèse Bibliographique
Cependant, en présence d'un déséquilibre
de la flore microbienne ou d'un affaiblissement du système immunitaire,
cette levure peut entrainer des pathologies (candidoses) parfois très
sévères. Celles-ci vont de la simple infection superficielle
(buccale et vaginale) à la propagation systémique
(candidémies) pouvant aller jusqu'à la mort (Shepherd et
al., 1985). Les Candida de la flore buccale sont
présentes chez 40% de la population humaine (Mac Farlance et
Samaranayake, 1989). Candida albicans est l'espèce
fongique majoritairement isolée de la cavité orale dont la
principale localisation est la face dorsale de la langue, la muqueuse buccale
et la surface des dents (Arendorf et walker, 1980;
budtz-jorgensen, 2000). Les autres espèces
isolées sont C. glabrata, C. tropicalis, C.
kefyr, C. krusei et C. guilliermondii (Mac
Farlance et Samaranayake, 1989 ; Pfaller, 2006).
4. Epidémiologie
L'épidémiologie des candidoses s'est
considérablement modifiée ces dernières décennies
avec l'apparition de nouvelles espèces (C. dubliniensis). En
effet, le genre Candida représente 83% des levures
isolées chez l'homme dont C.albicans constitue l'espèce la plus
fréquente (52%) vu qu'elle est saprophyte des muqueuses digestives. Les
autres espèces ayant une importance médicale sont C.
tropicalis (11%), C. parapsilosis (8%) et C. krusei (5%)
(Banerjee et al., 1991; Beck-sague et Jarvis, 1993;
klepser et al., 1998). Cependant, de nouvelle données
épidémiologique révèlent que l'incidence des
infections par des espèces de Candida autres que C.albicans telles que
C. glabrata, C. tropicalis, C. parapsilosis et
C. krusei est en voix d'augmentation (Wingard, 1993;
Colombo, 2003).
Les dernières données
épidémiologique montrent que les Candida spp. occupent
la quatrième place des germes isolés des
bactériémies et que les candi demies représentent 9% des
bactériémies nosocomiales (PFaller, 2001) avec
un pourcentage de mortalité allant jusqu'à 40% des cas
(Colombo et Guimarães, 2003). Cette augmentation de
l'incidence des infections fongiques par les espèces de Candida a
souvent été reliée à la déficience du
système immunitaire des patients (Horn et al., 1985;
Wey et al., 1989; Beck-Sague et Jarvis,
1993). De plus, le taux de colonisation de cette levure au niveau de
la cavité orale
augmente avec la sévérité de la maladie et
la durée de l'hospitalisation.
(C) pseudohyphes (Odds, 1998).
Synthèse Bibliographique
III. Facteurs de pathogénicité des
Candida spp.
La virulence de Candida spp. est due
à un ensemble complexe de facteurs. En effet, le genre
Candida possède des caractéristiques
communes à tous les microorganismes pathogènes
tels que la capacité de coloniser et d'envahir
l'ensemble des tissus et des organes de l'organisme, la
capacité de croitre rapidement à 37°C et la
possession d'une paroi cellulaire résistante aux
enzymes de dégradation de l'hôte.
Cependant, le genre Candida possède des
caractéristiques propres comprenant la sécrétion
d'adhésive servant à la reconnaissance de
l'hôte et à l'attachement aux muqueuses, la production
d'enzymes hydrolytiques telles que les phospholipases et les
aspartylprotéases et la variation de la morphologie
assurée par la transition (dimorphisme) entre la forme
levure et la forme mycélienne (Calderone et
Fonzi, 2001).
1. Variabilité morphologique
La cellule fongique peut être
considérée comme polymorphique, C'est-à-dire
qu'elle pourra prendre plusieurs aspects, visibles en
microscopie photonique. Les principaux stades morphologiques
sont le blastopore, la forme pseudo-mycélienne, le tube
germinatif, la forme mycélienne varie et enfin la
chlamydospore (Figure 1). Ces
différents stades morphologiques peuvent être
obtenus pas simple modification des paramètres
environnementaux (Odds, 1988).
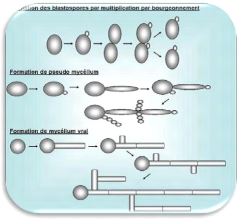
Figure 1. Différentes formes de
croissance des Candida: (A) levure, (B)
Hyphes et
Synthèse Bibliographique
2. Le dimorphisme
Le dimorphisme est la capacité du champignon à
changer de morphologie selon les conditions environnementales. Cette
capacité des souches de Candida à modifier leurs
phénotypes en fonction de l'environnement est un facteur de virulence.
Deux formes principales peuvent être observées, soit la forme
levure ou la forme mycélienne qui a été
considérée comme pathogène, celle-ci étant
observée dans les tissus infectés évitant ainsi les
mécanismes de défense du système immunitaire
(Odds, 1988).
3. Les enzymes
L'activité protéolytique de C. albicans
lui permet d'utiliser les protéines comme seule source d'azote. Les
protéases sont certainement les enzymes de C.albicans les mieux
étudiées. Leurs activité protéolytique est due
à la famille des gènes SAP qui codent pour des Secreted Aspartic
Protéinases (Wi hte et al., 1998). D'autre enzymes sont
sécrétées par C.albicans comme les phospholipases ( PL) et
les lipases .Le terme phospholipase décrit un groupe d'enzymes qui ont
la capacité d' hydrolyser une ou plusieurs liaisons ester des
glycéro-phospholipides. Chez C. albicans, les phospholipases
extracellulaires sont considérées comme des facteurs de
virulence. Différentes sous-classes ont été
détectée chez C. albicans: PLA, PLB, PLC et PLD
(Hube et al., 1998).
4. Adhérence de C. albicans
L'adhérence à des substrats de l'hôte est
essentielle à toute colonisation par un pathogène. La
réussite de la colonisation et de l'infection des tissus de l'hôte
par les espèces de Candida dépend de leur
capacité à adhérer aux muqueuses .Les adhésines de
Candida sont des protéines qui se retrouvent à la surface des
cellules (Chandra, 2001). Les espèces de Candida
sont capables de produire en grandes quantités des exo
polysaccharides ou «slime». Ces dernières sont
considérés un des facteurs de virulences des isolats de Candida
responsable de la dissémination de l'infection chez les organismes
hôtes ainsi que leurs persistance et colonisation au niveau des tissus
(Ramage et al., 2005). La possibilité de production
d'exo-polysaccharides par les souches de Candida spp. peut être
testée sur deux milieux différents : soit par leur croissance sur
gélose au rouge Congo soit par la méthode de coloration à
la
safranine (Davenport et al., 1986).
Synthèse Bibliographique
IV. différents types de candidoses
Les candidoses sont les infections à champignons
levuriformes les plus fréquentes et qui se développent en faveur
de la chaleur et de l'humidité. Elles se manifestent aux mêmes
endroits que les dermatophytoses, mais il existe aussi des formes buccales,
génitales et systémiques (Calderone et Fonzi,
2001). Il y a même eu rapport d'endocardites à C.
albicans (Maertens et al., 2001; Kaloterakis et
al., 2003).
1. Les candidoses cutanées
Les candidoses cutanées sont très
répandues chez l'homme (Hay, 1999). Elles sont
favorisées par l'humidité et la macération, ce qui
explique l'atteinte préférentielle des plis et leur
fréquence chez l'obèse. Elles peuvent résulter de
l'extension d'une candidose digestive ou génitale où l'on
retrouve des facteurs favorisants comme le très jeune âge, le
diabète, la prise d'antibiotique et des corticoïdes.
Il existe également une forme rare de candidoses
appelée la candidose mucocutanée chronique qui touche les
membranes muqueuses, mais qui peut s'étendre à la peau ou aux
ongles .Cette forme de candidoses est associée à des
problèmes de l'immunité cellulaire (Garber,
2001). Des données récentes tendraient aussi à
l'associer avec des déficient sélectives en anticorps
(Kalfa et al., 2003). Les groupes à fort risque de
développer une candidose systématique opportuniste sont donc
composés de patients ayant des atteintes hématologiques malignes
ayant reçu la greffe d'un organe solide et sous une médication
immunosuppressive, ceux ayant reçu une chimiothérapie
immunosuppressive en prévision d'une greffe de moelle et ceux ayant
été victimes de brûlures entraînant le perte de la
protection fournie par la peau (Garber, 2001).
2. Les candidoses vaginales
La candidose vulvo-vaginale (CVV) est l'une des plus
fréquentes infections gynécologique de la femme en période
d'activité génitale (Vasquez, 2002). Ces
dernières années, les CVV dues à des Candida non
albicans tels que C. glabrata, C. tropicalis et
C. krusei occupent une importance croissante. Le rôle des
facteurs hormonaux dans la survenue des CVV est illustré par plusieurs
faits: sa rareté avant la puberté, l'augmentation de sa
prévalence à la fin de la deuxième décennie avec un
pic persistant les deux décennies suivantes. Après la
ménopause, la prévalence de ce type de candidose
décroît. Chez l'homme,
les formes génitales sont les balanites et les
balano-posthites.
Synthèse Bibliographique
3. Les candidoses buccales et digestives
La candidose orale est une infection opportuniste de la
cavité buccale, ayant la plus forte prévalence chez l'humain et
causée par la croissance accélérée des champignons
unicellulaires du genre Candida (Abu-Elteen et Abu-Elteen,
1998). Plusieurs espèces de Candida sont responsables de cette
infection dont C. albicans, C. tropicalis, C.
glabrata, C. pseudotropicalis, C. guillieirimondii,
C. krusei, C. lusitaniae, C. parapsilosis et C.
stellatoidea avec une forte fréquence de C.
albicans (Odds, 1988). La population est en
général porteuse asymptomatique de C. albicans dans une
proportion de 20 à 75% (Farah et al ., 2000).
V. Résistance aux antifongiques
L'apparition de souches résistantes à certains
composés et la gravité des problèmes de toxicité
des antifongiques disponibles commercialement créent une situation
préoccupante dans les domaines de la santé publique. On assiste
au développement d'un secteur de recherche de plus en plus important et
qui semble maintenant s'orienter vers deux approches générales :
la recherche de cibles spécifique aux cellules fongique et
l'étude des mécanismes immunitaires impliqués lors de ce
type d'infection. Ceci pourrait permettre le développement de nouveaux
médicaments ayant moins d'effets secondaires
1. Différent types de
résistance
La résistance aux antifongiques peut être
classée deux catégories: une résistance clinique et une
résistance in vitro (expérimentales). La
résistance clinique signifie un manque de la réponse clinique
vis-à-vis de l'agent antifongique utilisé. Le plus souvent,
l'échec du traitement résultant des faibles concentrations de
l'agent antifongique dans le sérum et le tissus peut être du
à de nombreuses raisons, notamment au choix inadéquat du
médicament. De plus, une des raisons significatives de l'échec du
traitement est l'état immun déficient avancé du patient,
chez qui les fortes doses fongicides de l'agent utilisé sont incapables
d'éradiquer la prolifération et la colonisation de l'agent
pathogène.
Le deuxième type de résistance aux antifongiques
est la résistance in vitro qui peut être divisée en une
résistance primaire et une résistance secondaire.
(Sanglard et Odds, 2002). La résistance primaire,
connue aussi sous le nom de résistance intrinsèque ou
innée, est
Synthèse Bibliographique
produite lorsque l'organisme est naturellement
résistant à un antifongique donné (exemple C. krusei
qui est universellement connue par sa résistance au fluconazole,
Wingard et al., 1991).
La résistance secondaire ou acquise est décrite
lorsque l'isolat responsable de l'infection devient résistant à
l'agent antifongique suite à des mutations et une surexpression de
certains gènes (Sanglard et Odds, 2002). Cette forme de
résistance qui était rare durant les années
précédentes, est devenue de nos jours fréquemment
reportée chez les patients infectés par le SIDA et qui souffrent
d'une résistance accrue des candidoses oropharyngées et
oesophagiques au groupe des azoles (Johnson et al.,
1995; Kitchen et al., 1995). Actuellement, les seules
résistances connues avec une fréquence non négligeable
sont celles concernant la résistance à la 5-fluorocytosines et au
fluconazole. C. glabrata qui résistante pour 20% des isolats
(Pfaller, 2002; Pfaller, 2006) et C.
krusei qui est génétiquement résistante.
VI. Les biofilm fongiques
Les biofilm sont des structures tridimensionnelles de
micro-organismes qui se développent sur différents supports. En
ce qui concerne les levures du genre Candida, ces micro-organismes peuvent se
développer sur les cathéters ou encore sur des prothèses
(Donlan, 2001a; Donlan, 2001b;
Douglas, 2003). La formation du biofilm par les levures
pathogènes du genre Candida a été identifiée comme
un problème médical important du fait
que ces structures complexes sont de plus en plus
impliquée dans les pathologies
nosocomiales chez des population
à risque comme les patients immunodéprimés
(Khardori, 1995; Baillaie et Douglas,
1999a; Chandra et al., 2001a).
1. Structure d'un biofilm
L'organisation générale d'un biofilm de
Candida est similaire à celle du biofilm bactérien mais
le détail dans la composition d'un biofilm de Candida réside au
fait que sa structure est fortement dépendante des conditions de
formation du biofilm (Costerton, 1999). Cette
plasticité de structure suggère que l'architecture du biofilm
à Candida formé chez l'homme (hôte) peut aussi
varier selon la nature des implants sur lesquels il se développe et
leur localisation (Kumamoto, 2002) laissant
envisager des mécanismes de régulation
génétique
hautement spécifiques, dépendants de la réponse au contact
avec la surface
(Douglas, 2003).
Synthèse Bibliographique
2. Propriétés du biofilm
Les organismes qui croissent au sein d'un biofilm ont des
propriétés qui distingues des cellules planctoniques .Ces
caractéristiques incluent :
- La protection : lorsque la structure ou le phénotype
du biofilm protège les microorganismes des défenses de
l'hôte, des agents de traitement, de la dessiccation, des fluides
hydrodynamiques et des forces mécaniques.
- Les différences des expressions phénotypiques
et des caractéristiques de croissance. - La compétition et les
échanges des nutriments : augmentation des concentrations des
nutriments, hétérogénéité
microbienne et environnementale pour assurer le flux des
nutriments.
- Communication intercellulaire et inter espèces
(Kumamoto, 2002; Chen et al., 2004).
3. Développement du biofilm à
Candida
La formation du biofilm candidal répond aux mêmes
étapes que celle d'un biofilm bactérien, toutefois lors de la
phase de colonisation, une modification morphologique est observée
caractérisée par l'apparition de filaments appelés hyphes
(Figure 2). La formation de biofilm inclue l'adhésion
irréversible des cellules planctonique aux surfaces, la croissance et la
sécrétion de polymères extracellulaires (formation de
biofilm mature) et enfin le détachement des cellules (Smith et
al., 2003).
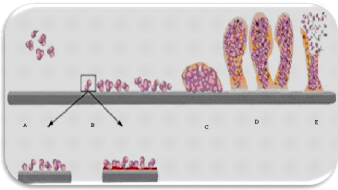
Figure 2. Schéma d'un biofilm
formé aux surfaces polymérique. (A): Cellule
planctonique,
(B): Attachement à la surface et formation de membrane cellulaire,
(C):
Prolifération cellulaire et production de polymères
extracellulaires, (D): maturation du
biofilm, (E): Détachement des
cellules.
Synthèse Bibliographique
4. Facteurs favorisant le développement d'un
biofilm à Candida
Il est à noter que la nature chimique de la surface
influence à la formation du biofilm. En effet, les surfaces comme le
latex favorisent cette formation, tandis qu'elle apparaît plus difficile
sue des surfaces de polyuréthane ou de silicone (Hawser et
Douglas, 1994). L'hydrophobicité de la surface semble
positivement corréler avec la formation du biofilm (Li et al.,
2003). Aussi, les conditions environnementales comme les turbulence
rencontrées dans les cathéters vasculaire ou urétraux
favorisent la croissance de la levure au sein d'un biofilm
(Hawser et al., 1998a; Kojic et
Darouiche, 2004).

MÉTHODOLOGIE
&
PROTOCOLES
Méthodologie & Protocoles
I-Description du site d'étude
C'est la première et la plus grande
décharge contrôlée en Tunisie
utilisée pour la récupération des déchets
des quatre gouvernorats du grand Tunis (Tunis, Ben Arous,
Ariana et Mannouba) qui a été crée en 1993 dans un
programme national de gestion des déchets
solides et mise en fonctionnement en 1999. La
décharge de Djbel-Chakir est située à 10
Km au Sud Ouest de la ville de Tunis d'une superficie
égale à environ 47 ha bâtie sur une
surface totale de 124 ha. Elle reçoit 2000 tonnes de
déchets/jour dont 68% des déchets organiques. La
production des lixiviats est de 270
m3.j-1. Ces lixiviats sont stockés dans 13
bassins avec une
|
capacité totale de 300 000 m3
|
(Figure 3).
|

Figure 3. Photo aérienne du
centre d'enfouissement technique de Djbel- Chakir et l
es bassins de stockage des lixiviats.
Après la réception des déchets, les camions
poubelles déversent leurs cargaisons dans les
alvéoles qui sont l'origine du lixivat jeune. Le traitement des
lixiviats (Figure 5) passe par plusieurs étapes.
L'échantillonnage a été fait au
départ à partir de deux bassins de stockage des
lixiviats: lixiviats jeunes (E8), lixiviats âgées (E6). A
l'arrivé des l ixiviats brutes (E1)
mélangées 2/3 jeunes et 1/3 âgées à la
station de traitement collective, elles passent par plusieurs
processus d'épuration. D'abord, les lixiviats brutes
subissent une filtration à sable qui est dans notre cas
non fonctionnelle, ensuite, traitées par l'acide
sulfurique à 98% suivi par un filtre à cartouche
(E2 ). Puis, les lixiviats passent par un système
d'ultrafiltration par osmose inverse de trois étages:
1er étage (E10), 2éme étage (E9) et
3éme étage (E3) qui s'effectue
à travers des membranes mi croporeuses retenant les
particules dont la taille est comprise entre 0,1 et 0,001 um
et qui ne laissent passer que les molécules d'eau.
Une fois le traitement
Méthodologie &
Protocoles
achevé, on obtient deux phases : le
concentrât (E4) qui va entrer de nouveau dans le cycle
de traitement, et le perméat épuré (E7)
qui est rejeté au niveau de l'embouchure de l'oued El
Attar (E5).

|
Figure 4. Unité de
traitement des lixiviats de la décharge de Djebel
|
-Chakir.
|
II-Identification biochimique des espèces de
Candida
spp. isolées
II. 1. Echantillonnage
Les échantillons analysés dans
cette étude ont été prélevés dura nt
trois campagnes d'échantillonnage à partir des
différentes phases de traitement des lixivi ats
de la station de Borj Chakir. La période de c
ollecte s'est étendue du mois de Novembr e
2011 au mois de Février 2012, date au cours de
laquelle la station est mise hors service. Les
échantillons de lixiviats sont prélevés
stérilem ent dans des bouteilles en verre (1 L)
préa l ablement stérilisées par la
chaleur sèche (volume fi nal 1 L) et conservées
dans des glacières contenant de la glace. Les
échantillons sont analysés d ès le retour
au laboratoire puis conservés à
-20°C.
Candida
II.2. Isolement et caractéris ation biochimique
des espèces de II.2.1. Isolement des es pèces de Candida
sur milieu chromogénique
L'isolement des espèces de Candida
à partir des différents
prélèvements a été
réalisé sur gélose CHROMagarTM
Candida (BioMérieux, France). Cette
gélose est un milieu
La floculation des isolats de Candida a
été testée en incubant les cellules (DO600nm=1) dans 10 ml
de bouillon YPD pendant 24h à 37°C. La lecture visuelle des
résultats est réalisée
Méthodologie &
Protocoles
chromogénique qui sert pour l'isolement sélectif
des levures et l'identification directe des espèces de Candida.
L'identification des isolats de C. albicans est
caractérisée par une coloration des colonies de cette
espèce en vert par l'hydrolyse spécifique d'un substrat
chromogène après une incubation de 24 à 48 h à
37°C. L'hydrolyse d'un deuxième substrat permet de
différencier les cultures mixtes et d'orienter l'identification vers
d'autres espèces à savoir C. tropicalis de couleur
«bleu métallique» et C. krusei
caractérisée par des colonies roses (Odds et
Bernaerts, 1994; Beighton et al., 1995;
Pfaller et al., 1996). Ce milieu permet de discriminer entre
ces trois espèces et de les isoler même si elles sont en culture
mixte et à faible quantité (UFC/ml).
Pour cela, dix millilitres de chaque prélèvement
sont enrichis dans 90 ml de bouillon YPD (10g extrait de levure; 10g peptone et
20g glucose) et sont incubés pendant 48h à 37°C
(Noumi et al., 2011a). Après incubation, l'isolement
sur le milieu chromogénique a été réalisé
selon la méthode d'isolement par cadrons.
II.2.2. Purification des espèces de Candida sur
gélose Sabouraud-chloramphénicol
La purification des espèces de Candida
poussant sur milieu CHROMagarTM Candida a
été réalisée sur des boites de gélose de
Sabouraud supplémentée par un antibiotique à large
spectre, le chloramphénicol (Bio-rad, France). En effet, la
gélose de Sabouraud constitue un milieu sélectif classique pour
la culture et l'isolement des levures et des moisissures en particulier les
espèces du genre Candida. Pour cela, 45,5 g de la gélose
de Sabouraud-chloramphénicol (pH=7) sont chauffés dans un litre
d'eau distillée puis autoclavés pendant 15 min à
120°C. Le milieu est coulé dans des boites de Pétri,
laissé refroidir puis mises dans l'étuve (37° C) pendant une
nuit (Chabasse et al. ,1999). Une fois ensemencées, les
boites sont incubées à 37°C pendant 24 à 48h.
II.2.3. Observation microscopique
Après isolement des souches de Candida sur
gélose Sabouraud-chloramphénicol, une colonie bien
individualisée a été étalée sur une lame
contenant une goutte d'eau physiologique stérile et puis fixée
par la flamme du bec Bunsen et colorée à la fuschine 1%. Les
observations ont été réalisées par un microscope
optique (hund H 500 WETZLAR, Germany) au fort grossissement (Gx100)
après ajout d'une goutte d'huile à immersion.
II.2.4. Test de floculation
Méthodologie &
Protocoles
après la sortie des tubes de l'étuve d'une à
deux heures. Le dépôt des cultures cellulaires au fond des tubes
en verre témoigne d'un test positif (Noumi et al.,
2012). II.2.5. Etude des caractères biochimiques sur
galeries Api Candida
Les caractères biochimiques des différents isolats
purifiés sur gélose Sabouraud-Chloramphénicol sont
déterminés en utilisant le système de galerie Api
Candida représenté par une galerie constituée de
10 microtubes contenant des substrats déshydratés pour
réaliser 12 tests d'identification. Les réactions produites
pendant la période d'incubation se traduisent par des virages
colorés spontanés. Après incubation, la lecture de ces
réactions se fait à l'aide du tableau de lecture et
l'identification est obtenue à l'aide du catalogue analytique ou d'un
logiciel d'identification (Tableau I).
Tableau I. Caractères enzymatiques
étudiés sur les galeries Api Candida
Tests Composants actifs
1) GLU D-glucose
2) GAL D-galactose
3) SAC D-saccharose
4) TRE D-tréhalose
5) RAF D-raffinose
6) BMAL 4-nitrophényl-BD-maltopyranose
7) áMAL
2-chloro-4-nitrophényl-áD-maltotrioside
8) BXYL 4-nitrophényl-BD-xylopyranoside
9) BGUR 4-nitrophényl-BD-glucuronide
10) URE Urée
11) BNAG (dans tube n°8)
5-bromo-4-chloro-3-indoxyl-N-acétyl-BDglucosminide
12) BGAL (dans tube n°9)
5-bromo-4-chloro-3-indolyl-BD-galactopyranoside
Pour cela, le fond et le couvercle d'une boîte Api sont
réunis et de l'eau distillée stérile est ajoutée
dans les alvéoles pour créer une atmosphère humide.
Ensuite, la galerie est déposée stérilement dans la
boîte d'incubation. Une suspension fongique très dense est alors
préparée à partir de colonies séparées pures
et jeunes sur gélose Sabouraud-Chloramphénicol dans une ampoule
d'NaCl 0,85% Medium qui sera répartie uniquement dans les tubes en
évitant de faire des bulles. Les 5 premiers tests et le dernier sont
recouverts d'huile de paraffine stérile. Les galeries sont par la suite
incubées pendant 24 h à 37°C.
La lecture de la galerie doit se faire en se
référant au tableau de lecture du guide d'utilisateurs. Les tests
sont regroupés en groupe de 3, et une valeur (1,2 ou 4) est
indiquée pour chacun. A l'intérieur de chaque groupe, les nombres
correspondants aux tests positifs sont additionnés. On obtient un nombre
de quatre chiffres qui sert de code d'identification. Le
Méthodologie &
Protocoles
code est par la suite entré dans la base de
données du logiciel Api Web (BioMérieux, France) et l'isolat est
ainsi identifié.
III. Etude phénotypique de la résistance
des isolats
de Candida spp. aux agents
antifongiques
La résistance des différents isolats a
été testée vis-à-vis de deux agents antifongiques
utilisés dans le traitement des candidoses buccales
(Amphotéricine B) et vaginales (Acide borique) selon deux
méthodes: sur milieu solide et milieu liquide.
III.1. Test de résistance à l'acide
borique
On prépare un milieu de culture de gélose
Sabouraud-Chloramphénicol et on lui ajoute 1,8 g d'acide borique/L par
filtration en utilisant un filtre seringue de diamètre 0,22 um (IWAKI,
Japan). Le milieu est par la suite coulé dans des boites de
Pétri, laissé refroidir à température ambiante.
Tous les isolats sont repiqués sur ce milieu (technique d'isolement par
cdrons) et les boites sont alors incubées de 24 à 48h à
37°C. Si la colonie pousse, elle est donc résistante à
l'acide borique sinon la souche est dite sensible à l'acide borique.
III.2. Test de résistance à
l'amphotéricine B
III.2.1. Sur milieu solide
La résistance des différents isolats à
l'amphotéricine B a été testée selon la
méthode CLSI (Wayne, 1997) sur milieu MHGBM
(Mueller-Hinton Glucose Bleu de méthylène de composition: MH 38
g, Glucose 2 % et 0,5 ug/ml Bleu de Méthylène). Des disques de
papier Wattman stériles de 6 mm de diamètre (Biolife, Milan,
Italie) ont été placés sur les tapis de levures (les
suspensions ont été ajustées à une
DO520nm=0,4 équivalent à une charge de 10
cellules/ml). L'amphotéricine B est diluée dans du DMSO
(diméthylsulfoxyde) 10% de façon à déposer 100
ug/disque (volume déposé: 10 ul). Les boites sont par la suite
incubées à 37°C pendant 24 à 48h. L'apparition d'un
halo autour de chaque disque traduit l'inhibition de la croissance des levures.
La mesure de cette activité consiste à mesurer le diamètre
d'inhibition avec une règle plate (L=20 Cm). Si le diamètre est
=9 mm la souche est dite résistante (R), si le diamètre est
compris entre 10 et 14 mm la souche est dite Sensible Dose Dépendante
(SDD) et si le diamètre et supérieur à 15 mm, la souche
est dite sensible à l'amphotéricine B.
Méthodologie &
Protocoles
III.2.2.Détermination de la Concentration
Minimale Inhibitrice et (CMI) et de la Concentration Minimale Fongicide
(CMF)
Les CMIs et CMFs ont été
déterminées selon le protocole décrit par Noumi
et ses collaborateurs (2009). Des inocula de chaque
souche ont été préparés dans l'eau physiologique
à partir d'une culture jeune sur gélose
Sabouraud-Chloramphénicol et la densité optique a
été ajustée DO520nm=0,4 équivalente
à 10 cellules/ml. Une solution mère d'amphotéricine B de
concentration (16ug/ml) a été préparée dans le
diméthylsulfoxyde à 10% (DMSO). Des dilutions en cascade sont
réalisées dans des tubes à hémolyse stériles
de 5 ml contenant le DMSO à 10%. Les plaques ELISA à 96 puits
(fond rond) ont été préparées de façon que
chaque puits contienne 95 ul de bouillon Sabouraud, 5 ul de la suspension
fongique et 100 ul de chaque dilution de l'amphotéricine B. Le puits
témoin positif contient 195 ul de bouillon Sabouraud stérile et 5
ul de la suspension fongique. Le volume final dans chaque puits est de 200 ul.
Après incubation à 37°C pendant 18 à 24 h, les
plaques sont lues à l'oeil nu pour la détermination des CMIs et
CMFs.
IV. Etude des activités enzymatiques
La production d'enzymes hydrolytiques telles que les
aspartylprotéases, les phospholipases, l'estérase et les
hémolysines par les espèces de Candida est un facteur de
virulence de cette levure (Ibrahim et al., 1995; Hube,
1998) pour cela, nous nous sommes intéressés à
l'étude de ces activités.
IV.1. Détermination de l'activité de la
phospholipase
Les souches isolées sont transférées dans
les tubes contenant 5 ml du bouillon YPD puis incubées à
37C° pendant 18 h. Après incubation, 1,5 ml de la culture fongique
sont transférés dans des tubes eppendorf et centrifugés
à 3000 rpm pendant 5 min. Le culot obtenu est lavé deux fois par
une solution de PBS stérile (PBS: Na2HPO4 7Mm,
NaH2PO4 3Mm et NaCl 130Mm, pH=7,2), puis
centrifugé à 3000rpm pendant 5 min. La gélose pour tester
l'activité phospholipase est préparée (10 g peptone, 30 g
glucose, 57,7 g NaCl, 0,55 CaCl2 et 20 g d'agar agar dans 1 litre
d'eau distillée). Après autoclavage et refroidissement du milieu,
100 ml de jaune d'oeuf sont stérilement récupérés
et additionné au milieu préparé. Après ajustement
de la densité à 0,5 McFarland, un volume de 1ul est mis en
triplicate à des points équidistants sur des boites des
Pétri qui sont par la suite incubées à 37°C pendant 4
jours. La présence de la phospholipase est déterminée par
la formation d'une zone opaque autour des
Méthodologie &
Protocoles
colonies. L'activité enzymatique (Pz) est
mesurée en calculant le rapport entre le diamètre de colonie et
le diamètre de la colonie avec la zone de précipitation. La
valeur de PZ est inversement proportionnelle à la nature de
l'activité. En effet, si le Pz est égale à 1, la souche
est dite phospholipase négative, si Pz est supérieur à
(0,63), la souche est dite phospholipase positive et enfin si Pz est
inférieur à (0,63), l'activité de phospholipase est
très élevée ou fortement positive (Price et al.,
1982).
IV.2. Détermination de l'activité de
l'aspartylprotéase secrétée
Les étapes de détermination de
l'activité de l'aspartylprotéase sont similaires à celles
de la phospholipase, la seule différence réside au fait
qu'après ajustement de la densité à 0,5 McFarland, un
volume de 1 ul est mis en triplicate à des point équidistants sur
des boites de gélose préalablement préparées (2g de
BSA: Sérum Bovine Albumine; 1,45 g sulfate d'ammonium, 20 g glucose, 20
g agar-agar dans 1 litre d'eau distillée). Les boites de Pétri
contenant l'inoculum des différentes souches sont incubées
à 37 C° pendant 7 jours (Aoki et al., 1990).
La sécrétion de l'aspartylprotéase par
les isolats testés est déterminée par la formation d'un
halo clair autour des colonies et l'activité enzymatique (Pz) est
mesurée de la même façon que celle pour la phospholipase
tout en divisant le diamètre de la colonie par le diamètre total
(le diamètre de la colonie avec la zone de précipitation). Nous
différencions quatre classes d'activité de cette enzyme: une
activité très faible (0,9<Pz<1), une activité faible
(0,8<Pz<0,89), une activité élevée
(0,7<Pz<0,79) et une activité très élevée
(Pz<0,69).
IV.3. Détermination de l'activité de
l'estérase
La détermination de cette activité a
été réalisée en adoptant la méthode
décrite par Ge et al. (2011). Les étapes de
détermination de l'activité de l'estérase sont similaires
à celles de la phospholipase. Après ajustement de la
densité à 0,5 McFarland, un volume de 1ul est mis en triplicate
à des points équidistants sur des boites de gélose
d'estérase préalablement préparée (10 g peptone, 5
g NaCl, 0,1 g CaCl2 et 15 g agar-agar dans 1 litre d'eau distillée; pH
6,8). Après autoclavage et refroidissement du milieu, 50 ml de Tween 80
sont stérilement additionnés au milieu préparé. Les
boites de Pétri contenant l'inoculum des différents isolats sont
incubées à 37°C pendant 10 jours. La présence de
l'estérase est déterminée par la formation d'une zone
opaque autour des colonies. L'activité enzymatique (PZ) est
mesurée en calculant le rapport entre le diamètre de la colonie
et le diamètre de la colonie avec la zone de précipitation
(Diamètre total). La valeur de PZ est inversement proportionnelle
à la nature
Méthodologie &
Protocoles
de l'activité. En effet, si la valeur du PZ est
égale à 1, la souche est dite estérase négative, si
PZ est supérieur à 0,63, la souche est dite estérase
positive, enfin si PZ est inférieur à 0.63, l'activité
estérase est très élevée ou fortement positive.
IV.4. Etude de pouvoir hémolytique
La production d'hémolysines par les espèces de
Candida isolées des différentes phases de traitement des
lixiviats à Borj-Chakir a été évaluée en
utilisant la technique décrite par Manns et ses
collaborateurs (1994). Les souches purifiée sur
gélose sabouraud-chloramphénicol sont
récupérées et lavées avec une solution saline
stérile (PBS, pH 7,2). Une suspension de 10 cellules /ml a
été préparée en ajustant sa densité optique
à 0,4 sous une longueur d'onde de 520nm (Samaranayake et Mac
Farlane, 1981). Un microlitre de cette suspension est inoculé
sur gélose au sang du mouton enrichie par du glucose (3%). La
gélose au sang du mouton enrichie par du glucose a été
préparée en ajoutant 7 ml de sang frais de mouton à 100 ml
de gélose de sabouraud-chloramphénicol supplémentée
avec 3% de glucose (m/v). Le pH final du milieu ainsi préparé est
de 5,6#177;0,2.
Les boites sont incubées à 37 °C sous
atmosphère à 5% de CO2 pendant 48 h. La
présence d'halo translucide autour de l'inoculum témoigne d'une
activité hémolytique positive. Le rapport des diamètres de
la zone de lyse et celui de la colonie est considéré comme un
indice hémolytique pour présenter l'intensité de la
production d'hémolysines par les différentes espèces de
Candida (Wu et al., 1996). L'analyse est
réalisée en triplicate et à deux occasions
séparées pour chaque isolat. Trois différents types
d'hémolyse peuvent être observés sous la lumière
autour de la colonie de Candida (Yigit et Aktas,
2009). Le premier type est caractérisé par un anneau
translucide relatif à une bêta hémolyse et le second est un
halo verdâtre à noirâtre correspondant à l'alpha
hémolyse et le dernier qualifié de gamma hémolyse (pas
d'activité). Le calcul de l'indice d'hémolyse a été
fait en adoptant la formule proposée par Yigit et Aktas (2009)
tout en divisant le diamètre de la colonie par le
diamètre total (diamètre de la colonie additionné du
diamètre de la zone d'hémolyse). Cet indice donne une idée
sur l'intensité de production des hémolysines par les souches de
Candida.
IV.5. Identification des enzymes par les galeries Api
ZYM
Le système Api ZYM est une micro méthode semi
quantitative pour la recherche des activités enzymatiques applicable
à des différents types d'échantillons (microorganismes,
suspensions cellulaires, tissus, liquides biologiques, etc.). Il permet
d'étudier rapidement et simultanément 19 activités
enzymatiques à partir de très faibles quantités
d'échantillons. La
Méthodologie &
Protocoles
galerie Api ZYM contient 20 cupules spécialement
adaptées à l'étude des réactions enzymatiques. Les
tests enzymatiques sont inoculés avec une suspension dense, qui
réhydrate les substrats. Les réactions produites pendant la
période d'incubation (4h) se traduisent par des virages colorés
révélés par l'addition des réactifs Zym A et Zym B
(Tableau II).
En effet, 100 ìl de la suspension de chaque isolat de
levure sont utilisés pour inoculer les différentes cupules des
galeries Api Zym. Après 4 h d'incubation à 37°C, les
réactifs Zym A et Zym B sont ajoutés dans les différentes
cupules et les galeries sont soumises après 5 min de réaction
à la lumière blanche pour la révélation des
différentes réactions enzymatiques (variation de couleurs). Les
couleurs obtenues sont comparées à celles décrites dans le
manuel d'utilisation fourni par le fabriquant.
Tableau II. Caractères enzymatiques
étudiés sur les galeries Api Zym (BioMérieux).
|
N°
|
Enzyme recherchée
|
Substrats
|
|
1
|
Témoin
|
|
|
2
|
Phosphatase alcaline
|
2-naphtol phosphate
|
|
3
|
Estérase (C4)
|
2-naphtol butyrate
|
|
4
|
Estérase Lipase (C8)
|
2-naphtol caprylate
|
|
5
|
Lipase (C14)
|
2-naphtolmyristate
|
|
6
|
Leucine arylamidase
|
L-leucyl-2-naphtylamide
|
|
7
|
Valine arylamidase
|
L-valyl-2- naphtylamide
|
|
8
|
Cystine arylamidase
|
L-cyctil-2- naphtylamide
|
|
9
|
Trypsine
|
N-benzoyl-DL-arginine-2- naphtylamide
|
|
10
|
á-chymotrypsine
|
N-glutaryl-fenylalanine-2- naphtylamide
|
|
11
|
Phosphatase acide
|
2-naphtyl phosphate
|
|
12
|
Naphtol-AS-BI -phosphohydrolase
|
Naphtol-AS-BI-phosphate
|
|
13
|
á-galactosidase
|
6-Br-2-naphtyl-áD-galactopyranoside
|
|
14
|
3-galactosidase
|
2-naphtyl-3D- galactopyranoside
|
|
15
|
3-glucuronidase
|
Naphtol-AS-BI-3D-glucuronide
|
|
16
|
á-glucosidase
|
2-naphtyl-áD-glucopyranoside
|
|
17
|
3-glucosidase
|
6-Br-2-naphtyl-3D-glucosaminide
|
|
18
|
N-acétyl-3-glucosaminidase
|
1-naphtyl-N-acétyl-3D-glucosaminide
|
|
19
|
á-mannosidase
|
6-Br-2-naphtyl-áD-monnopyranoside
|
|
20
|
á-fucisidase
|
2-naphtyl-áL-fucopyranoside
|
V. Etude qualitative et quantitative de l'adhésion
des
souches de Candida isolées
Pour expliquer la persistance des souches de Candida
dans les différentes phases de traitement des lixiviats, nous avons
testé la capacité de ces levures à s'adhérer et
à former un
Méthodologie &
Protocoles
biofilm sur une surface inerte qui est le polystyrène
ainsi que la production de « slime » ou exopolysaccharides sur
milieux liquide et solide.
V.1. Etude qualitative de l'adhésion V.1.1.
Coloration à la safranine
La production de « slime » ou exopolysaccharides a
été déterminée selon la technique décrite
par (Noumi et al., 2011). Brièvement, quelques colonies
de Candida cultivées sur gélose Sabouraud dextrose agar
ont été inoculées dans les tubes contenant 10 ml de
bouillon Sabouraud supplémenté avec du glucose à 8%. Les
tubes ont été incubés pendant 24 h à 35°C,
puis égouttés et colorés avec 5 ml de safranine 1% pour
vérifier la présence ou l'absence d'un culot. La production de
slime par chaque isolat est considérée faible (+), moyenne (++),
ou forte (+++) selon l'intensité du culot obtenu. Le résultat a
été lu par trois observateurs différents.
V.1.2. Production de « slime » sur
gélose préparée au rouge Congo
L'aptitude de souche de Candida à produire un
biofilm a été évaluée sur milieu rouge Congo en
utilisant la technique décrite par Dag et al. (2010).
Ce milieu est préparé en ajoutant 0,8 g de rouge Congo (Sigma,
France) et 80 g de glucose (Labosi, France) à un 1itre
de gélose coeur cervelle (Bio-rad, France). Le milieu a
été autoclavé à 115 C° pendant 10 min. Les
boites sont incubées pendant 24 h à 37°C en aérobie,
suivi d'une nuit à l'obscurité à température
ambiante. Les souches productrices de biofilm « slime Producer »
apparaissent sous forme de colonies noires, tandis que les souches biofilm
négatif sont non pigmentées (blanches, roses avec un point noir
au centre).
V.2. Etude quantitative de l'adhésion V.2.1. Test
de hydrophobicité
L'hydrophobicité des souches de levures est
mesurée selon le protocole décrit par Rosenberg
et ses collaborateurs (1983). Le test consiste
à mesurer l'adhésion de cette levure au cyclohexane
(hydrocarbure) et au xylène .Pour cela, les isolats de levures sont
incubés toute une nuit dans 5 ml de bouillon YPD à 28 C°.
Les cellules de Candida sont par la suite lavées avec du PBS et
leur densité optique (DOi) est ajustée à 1 (DO600 nm =1).
Pour le test d'adhésion, 3 ml de la suspension de levure sont
mélangés avec 150 ul de cyclohexane ou xylène et dans un
tube en verre lavé avec de l'acide sulfurique.
Méthodologie &
Protocoles
Le mélange est agité (vortex) durant 1 min puis
laissé à température ambiante de 20 min à 1 h.
L'absorbance (Af) de la phase aqueuse est mesurée à 600 nm puis
comparée avec l'absorbance initiale (A ). Le pourcentage des cellules
adhérentes formant une membrane fine à la surface des solvants
testés (le cyclohexane et le xylène) est déterminé
pour estimer le pourcentage l'hydrophobicité des souches de levure selon
l'équation suivante (I).
(I) % d'hydrophobicité= [(DOi-DOf)/DOi] x
100
V.2.2. Adhésion des Candida spp. sur les
plaques en polystyrène
Afin de quantifier la formation de biofilm formé par
les différentes espèces de Candida isolées, nous
avons recours à une première méthode basée sur un
dosage spectrophotométrique du Cristal violet 1% dans des plaques ELISA
96 puits à font rond et une deuxième technique
colorimétrique basée sur la réduction du 2,3- bis
(2-méthoxy-4-nitro-5-sulfophenyl)-5 [(phénylamino)
carbonyl]-2H-tétrazolium (XTT) en un composé coloré
hydrosoluble (le formazan) sous l'effet de la déshydrogénase
mitochondriale des Candida dans des plaques ELISA de 96 puits à
font plat (Hawser, 1998b).
Toutes les espèces de Candida spp. ont
été cultivées pendant 18h à 37°C sur milieu
Sabouraud- Chloramphénicol. Par la suite, les souches ont
été incubées dans un bouillon YNB (Yeast Nitrogen Base;
Sigma - Aldrich, St Louis, Mo, India) supplémenté par 100 Mm de
glucose (18g/l). Après une nuit de culture, les levures ont
été récupérées à la fin de la phase
exponentielle de croissance et lavées deux fois avec 5 ml d'une solution
saline tamponnée (PBS; pH 7,2). Une suspension de 10 cellules/ ml a
été préparée en ajustant la densité optique
à 0,4 mesurée à 520 nm.
Les biofilms ont été produits sur des plaques
ELISA en polystyrène à 96 puits et à fond plat pour le XTT
et à fond rond pour le Cristal violet 1% (Nunc, Roskilde, Danemark)
selon le protocole précédemment décrit par Noumi et ses
collaborateurs (2010). Cent microlitres de la suspension
cellulaire (10 cellules/ml) sont transférés dans les puits de
chaque type de plaques à l'aide d'une micropipette. Les plaques sont
incubées à 37°C durant 1 h 30 min dans un shaker à 75
rpm pour permettre à la levure d'adhérer aux surfaces des
puits (Kuhn al., 2002). Pour chaque plaque, trois puits ne
renfermant pas la suspension de Candida sont considérés
comme témoin négatif.
Après la phase d'adhésion, les suspensions de
cellules ont été aspirées et les plaques ont
été lavées deux fois avec 150 ul de PBS stérile
pour enlever les cellules non adhérentes. Cent microlitres du bouillon
YNB ont été alors transférés dans chaque puits et
les plaques ont
Méthodologie &
Protocoles
été incubées à 37° C dans un
shaker à 75 rpm. Les biofilms ont été
développés durant 66 h et la viabilité cellulaire a
été mesurée par analyse de la réduction du XTT
(cellule viables) et au Crystal violet (cellules fixées). Le milieu a
été renouvelé quotidiennement par aspiration du milieu
épuisé et addition d'un nouveau milieu chaque jour. Toutes les
analyses ont été effectuées en triplicate (Melo et
al ., 2006).
L'analyse de la réduction du XTT est
réalisée selon la technique décrite par
Kuhn et ses collaborateurs (2002). Brièvement,
la solution de XTT (1 mg/ml de PBS; Sigma-Aldrich, Inc.Germany) a
été préparée et stérilisée par
filtration à travers un filtre de 0,22 um de porosité (Millipore,
Satorius Minisart CE 0297, Germany) puis stockée à -70°C. La
solution de ménadione (0,4 mM dans l'acétone; Sigma-Aldrich, St
Louis, Mo., Switzerland) a été préparée et
stérilisée par filtration (filtre 0,22 um juste avant chaque
analyse). Avant chaque essai, la solution de XTT et décongelée et
mélangée avec la solution de ménadione (5 :1; v/v). Les
biofilms ont été lavés cinq fois avec 200 ul de PBS
stérile puis nous avons ajouté 200 ul de PBS additionnés
par 12 ul de la solution de XTT-ménadione. Les plaques ont
été incubées à l'obscurité pendant 2 h
à 37 °C.
Pour la méthode au Cristal violet 1%, les biofilms ont
été lavés cinq fois avec 200 ul de PBS stérile et
colorés avec 200 ul de Cristal violet 1% pendant 15 min. Les plaques
sont séchées en position inversée. Les puits sont
lavés de nouveau avec du PBS stérile et le Crystal violet a
été solubilisé dans 200ul d'une solution
éthanol-acétone (80:20 v/v).
Après incubation, 100 ul de la solution ont
été transférés dans de nouveaux puits et le
changement de couleur de la solution a été mesuré avec un
lecteur ELISA (BioRad, France) à 492 nm pour les plaques contenant le
XTT et à 595 nm pour le Cristal violet 1%. Les valeurs des absorbances
pour les puits témoin ont été alors soustraites des
valeurs des puits inoculés par les suspensions pour éliminer les
faux résultats dus à l'interférence de fond
(Ramage et
al., 2001).

RÉSULTATS
Résultats
I. Caractérisation phénotypique des
espèces de
Candida spp. isolées
1. Etude morphologique
1.1. Caractéristiques macroscopiques
Sur milieu chromogénique, plusieurs morphotypes sont
décrits pour les échantillons analysés (Tableau III):
colonies de couleur bleue, colonie de couleur blanche et colonies de couleur
rose ou blanche à centre rose, colonies de couleur mauve et colonies de
couleur beige (Figure 5).
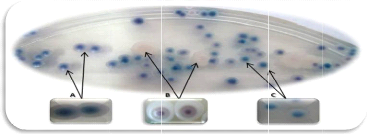
Figure 5. Les principaux morphotypes obtenus sur
milieu CHROMagarTM Candida (A): colonies de couleur bleue;
(B): colonies de couleur blanche à centre rose; (C): clonies de couleur
turquoise.
L'examen macroscopique des espèces de Candida
cultivées en aérobiose à 37°C sur gélose
Sabouraud-Chloramphénicol (pH 7,2) montre qu'il s'agit de colonies
crémeuses, lisses, rondes et bombées (Figure 6) ayant une odeur
de levure. La croissance de Candida sur ce milieu sélectif nous
a permis de remarquer que la couleur des colonies est variable selon
l'espèce. En effet, sur la gélose
Sabouraud-Chloramphénicol, C. albicans est
blanchâtre.
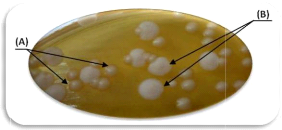
Figure 6. Observation microscopique des colonies
de Candida sur gélose Sabouraud-Chloramphénicol. (A):
colonies blanches ou crémeuses et lisses; (B): colonies grandes et
sèches.
Résultats
Tableau III. Couleur des isolats obtenue sur
milieu CHROMagarTM Candida en fonction de l'origine
d'isolement.
|
Code
|
Origine
|
Milieu
|
Couleur obtenue
|
|
M1
|
E5
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M2
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M5
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M7
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M8
|
E5
|
CHROMagarTM Candida
|
Colonie beige
|
|
M9
|
E8
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M10
|
E8
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M11
|
E8
|
CHROMagarTM Candida
|
Colonie rose
|
|
M13
|
E7
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M14
|
E7
|
CHROMagarTM Candida
|
Colonie blanche
|
|
M16
|
E5
|
CHROMagarTM Candida
|
Colonie beige
|
|
M17
|
E5
|
CHROMagarTM Candida
|
Colonie beige
|
|
M18
|
E5
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M19
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M20
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M21
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M22
|
E5
|
CHROMagarTM Candida
|
Colonie blanche
|
|
M23
|
E10
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M24
|
E2
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M25
|
E2
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M28
|
E10
|
CHROMagarTM Candida
|
Colonie mauve claire
|
|
M30
|
E1
|
CHROMagarTM Candida
|
Colonie mauve claire
|
|
M31
|
E1
|
CHROMagarTM Candida
|
Colonie grande blanche
|
|
M32
|
E4
|
CHROMagarTM Candida
|
Colonie blanche
|
|
M36
|
E2
|
CHROMagarTM Candida
|
Colonie beige
|
|
M39
|
E2
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M40
|
E2
|
CHROMagarTM Candida
|
Colonie blanche
|
|
M41
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M42
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M43
|
E5
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M44
|
E5
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M45
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M46
M47
|
E5
E5
|
CHROMagarTM
CandidaCHROMagarTM Candida
|
Colonie mauve Colonie bleue
|
|
M49
|
E5
|
CHROMagarTM Candida
|
Colonie grande blanche à centre
|
|
M50
|
E5
|
CHROMagarTM Candida
|
Colonie grande blanche à centre
|
|
M56
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M57
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
1.2. Caractéristiques microscopiques
L'aspect microscopique de toutes les espèces de
Candida est semblable. L'observation microscopique des cellules de
Candida au grossissement (*100) a montré qu'on a 62,16 % de
souches de forme ovalaire (Figure 7A) de 2 à 8 um de diamètre.
Les autres 37,83% de souches ont une forme allongée ou en forme de grain
de riz (Figure 7 B).
Résultats
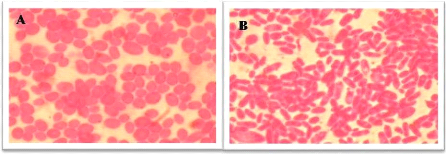
Figure 7. Observation microscopique des cellules
de Candida colorées à la fushine au microscope optique
(G*100). (A) : cellules de Candida de forme ovoïde, (B) :
cellules de Candida ayant la forme des grains de riz.
2. Différentes espèces de Candida
spp. Isolées à partir de la station de traitement des
lixiviats de Djebel Chakir
L'identification des souches a été
réalisée par les galeries Api Candida pour 37 isolats.
Par la suite, l'interprétation des résultats a été
effectuée par le logiciel Api Web (bioMérieux, France). Deux
genres sont identifiés : Candida et Saccharomyces
regroupent les espèces suivants isolées C.
albicans, C. krusei, C. famata, C. tropicalis,
C. guilliermondii et C. lusitaniae et l'espèce
Saccharomyces cerevisiae (Tableau IV).
Tableau IV. Différentes espèces
de levures isolées à partir de la station de traitement des
lixiviats de Djebel Chakir en se basant sur les caractères obtenus sur
les galeries Api Candida.
|
Espèces identifiées
|
Nombre
|
Codes obtenu sur Api Candida
|
|
C. albicans C. krusei
|
15
14
|
7512 ; 7712 ; 4512
1000 ; 1010 ; 1020 ; 1030
|
|
C. famata
|
3
|
2100 ;
|
3100
|
; 5100
|
|
C. tropicalis
|
2
|
|
7710
|
|
|
C. guilliermondii
|
1
|
|
7320
|
|
|
C. lusitaniae
|
1
|
|
7520
|
|
|
Saccharomyces cerevisiae
|
1
|
|
7300
|
|
Nous avons noté au cours de ce travail que les deux
espèces isolées est C. albicans (n =15) et C. krusei
(n=14) sont majoritairement isolées. Les profils biochimiques des
différentes espèces de Candida isolées sont
illustrés dans le tableau V ci-dessous.
Résultats
Tableau V. Origine, fo rme
et caractères biochimiques des levures isolées
et testées par les galeries Api Candida
(BioMérieux, France).
|
Isolats testés Origine
|
Date de prélèvement
|
Forme*
|
Identification biochimique par Api
Code Identification (%)
|
|
Candida albicans
|
|
|
|
|
|
|
M2 E5
|
25/11/2011
|
Ovale
|
4512
|
C. albicans
|
ND
|
|
M5 E5
|
25/11/2011
|
Ovale
|
7712
|
C. albicans
|
61,7
|
|
M7 E5
|
25/11/2011
|
Ovale
|
7712
|
C. albicans
|
61,7
|
|
M8 E5
|
25/11/2011
|
Ovale
|
7712
|
C. albicans
|
61,7
|
|
M16 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M20 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M21 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M24 E2
|
25/11/2011
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M25 E2
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M36 E2
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M42 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M45 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M47 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M56 E5
|
06/02/2012
|
Ovale
|
7712
|
C. albicans
|
61,7
|
|
M57 E5
|
06/02/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
Candida krusei
|
|
|
|
|
|
|
M13 E7
|
25/11/2011
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M22 E5
|
06/01/2012
|
Grains de riz
|
1030
|
C. krusei
|
ND
|
|
M30 E1
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M31 E1
|
06/01/2012
|
Grains de riz
|
1020
|
C. krusei
|
87,6
|
|
M32 E4
|
06/01/2012
|
Grains de riz
|
1010
|
C. krusei
|
99,5
|
|
M39 E2
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M40 E2
|
06/01/2012
|
Grains de riz
|
1020
|
C. krusei
|
87,6
|
|
M41 E5
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M43 E5
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M44 E5
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M49 E5
|
06/02/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M17 E5
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M18 E5
|
06/01/2012
|
Grains de riz
|
1020
|
C. krusei
|
87,6
|
|
M50 E5
|
06/02/2012
|
Grains de riz
|
1020
|
C. krusei
|
87,6
|
|
Candida famata
|
|
|
|
|
|
|
M9 E8
|
25/11/2011
|
Ovale
|
5100
|
C. famata
|
99,2
|
|
M10 E8
|
25/11/2011
|
Ovale
|
2100
|
C. famata
|
57,6
|
|
M11 E8
|
25/11/2011
|
Ovale
|
3100
|
C. famata
|
57,6
|
|
C. tropicalis
M28 E10
|
06/01/2012
|
Ovale
|
7710
|
C. tropicalis
|
95,7
|
|
M46 E5
|
06/01/2012
|
Ovale
|
7510
|
C. tropicalis
|
99,9
|
|
C. lusitaniae
M1 E5
|
25/11/2011
|
Ovale
|
7520
|
C. lusitaniae
|
99,3
|
|
C. guilliermondii
M14 E7
|
25/11/2011
|
Ovale
|
7320
|
C. guilliermondii
|
96,5
|
|
Saccharomyces cerevisiae
M23 E10
|
06/01/2012
|
Ovale
|
7300
|
S. cerevisiae
|
98,8
|
ND : Non Déterminé par le logiciel
API WEB;
3. Test de floculation
Après incubation de 24 h dans l'étuve 37
° C, nous avons pu remarquer que toutes les
souches testées floculent dans le bouillon
Sabouraud-Chloramphénicol avec dépôt des
cellules
au fond des tubes (culot blanc).
Résultats
4. Test de résistance à l 'a cide
borique
Le but de la réalisation de ce test
est de voir le taux de sensibilité ou de
résistance des souches de Candida sur un
milieu qui contient de l'acide borique (agent
antifongique). On a pu remarquer que 22 souches parmi 43
poussent après incubation de 24 h à 37 °C.
En effet, ces dernières sont résistantes
à l'acide borique. Les autres souches sont
alors considérés sensibles.
II. Activité anti fo
ngique
disque
1. Méthode de diffusion de
Sur milieu MHGBM, nous avons montré
que toutes les souches testées ne répondent pas
de la même façon à l'amphotéricine B (100
ug/disque). En effet, seize souches sont résistantes à
l'amphotéricine B puisque les diamètres d'inhibition de la
croissance sont inférieurs à 9 ; treize souches
sont sensibles à l'amphotéricine B pu i
sque les diamètres d'inhibition de la croissance sont
compris entre 10 et 14 mm, alors que q uatorze
souches ont une susceptibilité dose dépendante
avec des diamètres d'inhibition de la cr
oissance supérieurs à 15 mm (Figure 8).

Figure 8.
Détermination des diamètres des zones
d'inhibition de la croissance des levures sur milieu
Mueller-Hinton-Glucose-Bleu de Méthylène par
l'amphotéricine B (100 ug/disque). (A): Souche
résistante; (B): Souche à Sensibilité
Dose Dépendante; (C): Souche sensible.
(CMI) et de la
2. Détermination de la Concentration Minimale
Inhibitrice Concentration Minimale Fongicide (CMF)
La détermination des concentrations
minimales inhibitrices (CMIs) et des concentrations minimales
fongicides (CMFs) a été faite selon une lecture
visuelle. Les valeurs
Résultats
de CMIs sont comprises entre 0,015 et 0,0312 ug/ml alors que
les CMFs varient de >0,5 à >16 ug/ml.
Tous ces résultats sont résumés dans le tableau
VI ci-dessous.
Tableau VI. Résistance
phénotypique
l'amphotéricine B (sur milieu MHGBM et
sur
vis-à-vis de
milieu liquide) et à l'acide borique.
des différentes souches testées
Souche
|
Résistance à l'acide
borique (1,8 g/L)
|
Amph otéricine B
|
|
|
Sur milieu MHGBM* Milieu liquide
(100ug/disque) (ug/ml)
ZI#177;DS* Interprétation CMIs CMFs
|
|
Candida albicans
|
|
|
|
|
|
|
C. albicans ATCC 2091
|
Sensible
|
6#177;0
|
R
|
0.0312
|
>16
|
|
C. albicans ATCC 90028
|
Sensible
|
6#177;0
|
R
|
0.0312
|
>16
|
|
C. albicans SC5314
|
Sensible
|
6#177;0
|
R
|
0.015
|
>4
|
|
M2
|
Résistante
|
6#177;0
|
R
|
0.015
|
=8
|
|
M5
|
Résistante
|
17#177;1
|
S
|
0.015
|
>8
|
|
M7
|
Résistante
|
15#177;1
|
S
|
0.015
|
>8
|
|
M 8
|
Sensible
|
20#177;0
|
S
|
0.015
|
>16
|
|
M16
|
Résistante
|
19#177;1
|
S
|
0.0312
|
>4
|
|
M20
|
Résistante
|
13#177;1
|
SDD
|
0.015
|
>8
|
|
M2 1
|
Sensible
|
19#177;0
|
S
|
0.0312
|
>0.5
|
|
M24
|
Résistante
|
14,33#177;0,5
|
SDD
|
0.0312
|
>4
|
|
M25
|
Résistante
|
13,33#177;1,52
|
SDD
|
0.0312
|
>4
|
|
M36
|
Résistante
|
14,33#177;3,21
|
SDD
|
0.015
|
>4
|
|
M42
|
Sensible
|
16,33#177;0,57
|
S
|
0.015
|
>2
|
|
M45
|
Résistante
|
18#177;1
|
S
|
0.0312
|
>4
|
|
M47
|
Résistante
|
16,33#177;2,30
|
S
|
0.015
|
>4
|
|
M56
|
Résistante
|
17#177;1
|
S
|
0.015
|
>4
|
|
M57
|
Résistante
|
18#177;1,73
|
S
|
0.015
|
>4
|
|
Candida krusei
|
|
|
|
|
|
|
C. krusei ATCC 6258
|
Résistante
|
18#177;1
|
S
|
0.015
|
>16
|
|
C. krusei 05 (054)
|
*
|
*
|
*
|
0.015
|
>8
|
|
M1 3
|
Sensible
|
13#177;1
|
SDD
|
0.0312
|
>16
|
|
M22
|
Résistante
|
11,33#177;0,57
|
SDD
|
0.0312
|
>16
|
|
M30
|
Résistante
|
7,67#177;0,57
|
R
|
0.015
|
>16
|
|
M31
|
Résistante
|
9,67#177;1,15
|
SDD
|
0.015
|
>16
|
|
M32
|
Sensible
|
13,67#177;0,57
|
SDD
|
0.015
|
>16
|
|
M39
|
Sensible
|
14,67#177;1,15
|
SDD
|
0.015
|
>4
|
|
M4 0
|
Sensible
|
7,33#177;0,57
|
R
|
0.0312
|
>16
|
|
M4 1
|
Sensible
|
6,67#177;0,57
|
R
|
0.015
|
>16
|
|
M43
|
Sensible
|
11,67#177;0,57
|
SDD
|
0.015
|
>4
|
|
M44
|
Résistante
|
12#177;1
|
SDD
|
0.0312
|
>4
|
|
M49
|
Sensible
|
9#177;1
|
R
|
0.015
|
>4
|
|
M1 7
|
Sensible
|
9#177;1
|
R
|
0.0312
|
>16
|
|
M18
|
Résistante
|
12,67#177;0,57
|
SDD
|
0.015
|
>16
|
|
M5 0
|
Sensible
|
9#177;0
|
R
|
0.015
|
>2
|
|
Candida famata
|
|
|
|
|
|
|
C. famata V 2
|
Sensible
|
6#177;0
|
R
|
0.015
|
>1
|
|
M9
|
Résistante
|
6,33#177;057
|
R
|
0.015
|
>16
|
|
M1 0
|
Sensible
|
10,67#177;0,57
|
SDD
|
0.015
|
>16
|
|
M1 1
|
Sensible
|
18,33#177;1,52
|
S
|
0.0312
|
>16
|
|
Candida tropicalis
|
|
|
|
|
|
|
C. tropicalis 06(085 )
|
*
|
*
|
*
|
0.015
|
>16
|
|
M28
|
Résistante
|
15,67#177;0,57
|
S
|
0.015
|
>4
|
|
M46
|
Résistante
|
6#177;0
|
R
|
0.015
|
>2
|


Sensible 7,33#177;0,57 R
Sensible 6#177;0 R
Sensible 9,33#177;057 R
14#177;1 S DD
Candida lusitaniae
C. lusitaniae CECT 11458
M1
Candida guilliermondii
M1 4
Saccharomyces cerevisiae
M23 Résistante
0.015 >16
0.015 >1
0.015 >16
0.0312 >4
*MHGBM: gélose Mueller-Hinton Glucose
|
Bleu de Méthylène; ZI: Diamètre de la zone
d'inhibition; DS: Déviation
|
Standard; R: Résistante; S: Sensible; SDD:
Susceptibilité Dose Dépendante; *: Non
testé.
de l'aspartylprotéase présente une
variation intra et inter-espèces (Figure 1
0).
Résultats
|
III. Etude de la
|
virulence des différentes
|
espèces de
|
|
Candida spp. isolées
1. Détermination de l'activité
|
de la phospholipase
|
|
Parmi les 43 souches testées dont
celles isolées à partir de la station de
traitement des
lixiviats de Borj Chakir, 19
souches ont une activité phospholipase
positive (PZ >0,63)
révélée par la présence d'un halo
opaque autour des colonies sur gélose à
base de jaune d'oeuf, 14 souches ont une activité
phospholipase négative (PZ = 1) et 10 souches
ont une activité fortement positive (PZ<0,63).
Les valeurs de PZ qui sont inversement
proportionnelles à la nature de l'activité,
se sont étendues de 0,48 à 0,63 (Figure 9).
A travers notre étude, nous avons aussi
remarqué que la nature de l'activité de cette
enzyme varie d'une souche à une autre d'une même espèce. En
effet, au sein de l'espèce C. albicans, nous
avons décelé deux types d'activité
(négative et positive) .(figure9)
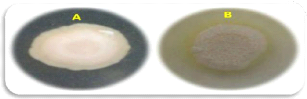
Figure 9. Aspect de l'activité
de la phospholipase sur gélose à base de jaune
d'oeuf. (A):
Souche phospholipase négative;
(B): Souche phospholipase positive.
2. Détermination de l'activité de
l'aspartylprotéase secrétée
L'incubation des colonies de levures pendant 8
jours à 37 °C sur la gélose à base de BSA a
montré que parmi les 43 souches testées, 32 ont
une activité protéase très
élevée (PZ < 0,69), deux ont une
activité élevée (PZ=0,7), trois isolats
ont une activité faible (0,8<PZ<0,89) et 6
présentent une activité très faible ou
pas d'activité (PZ =1). Pour l'espèce la plus
fréquente, C. albicans , les activités
varient de très faible à très élevée
alors que toutes les souches de C. krusei
possèdent une activité
aspartylprotéase secrétée très
élevée.
|
Pendant notre étude, nous
|
avons remarqué que la distribution des
valeurs
|
de l'activité
|
Résultats

Figure 10. Différents exemples
de l'activité de la protéase obtenue sur
gélose à base de BSA.
(A): Absence d'une
activité; (B): Activité faible; (C):
Activité élevée; (D): Activité
très
élevée.
3. Détermination de l'activité de
l'estérase
L'incubation des colonies de Candida
pendant 10 j à 37°C sur l a gélose de
base de Tween 80 à montré que parmi les 43
souches testées, 20 souches ont une activité
estérase négative (PZ) = (1), 12 souches ont une
activité estérase positive (PZ>0.6 3) et 11
souches ont une activité estérase fortement positive
(PZ<0,63).
4. Etude de pouvoir hémolytique
Les résultats ont montré
qu'après 48 h d'incubation sur gélose au sang du
mouton sous atmosphère à 5% CO2, la
plupart des espèces de Candida ont la
possibilité de dégrader l'hémoglobine par
lyse des érythrocytes. Trois différents types
d'hémolyse ont été observés sous
la lumière autour de la colonie ensemencée: le
premier type est caractérisé par un anneau
translucide relatif à une hémolyse de type alpha
et le second type est caractérisé par un halo
verdâtre à noirâtre correspondant à
une béta hémolyse (Figure 11 ). Le dernier type
caractérisent les souches non hémolytiques
(gamma-hémolytiques). En effet, 19 souches sont â
hémolytiques, 17 á hémolytiques et sept
souches sont de type gamma.
|
Figure 11. Aspect des
|
colonies ayant un pouvoir hémolytique de type â sur
gélose à base de sang de mouton.
|
Résultats
L'ensemble des résultats des
activités enzymatique est résumé dans le
Tableau VII ci -dessous.
Tableau VII. Activités enzymatiques
(phospholipase, estérase et aspartylprotéase) et
pouvoir hémolytique des différentes souches isolées.
Les différentes enzymes hydrolytiques
testées
|
Isolats testés
|
Phospholipase
|
|
Estérase Aspartyl
|
protéase Pouvoir
|
Pz#177;DS Interprétation
Pz#177;DS Interprétation Pz#177; DS
Interprétation (IH)* Type
C. albicans
C. albicans ATCC 2091 0,76#177;0,09
Positive
C.albicans ATCC 90028 0,73#177;0,06
Positive
C. albicans SC 5314 0,86#177;0,015
Positive
M2 0,78#177; 0,41
Positive
M5 1#177;0
Négative
M7 1#177;0
Négative
M8 0,75#177;0,09 Positive
M16 1#177;0
négative
M20 0,71#177;0 Positive
M21 1,18#177;0,01
Positive
M24 0,62#177;0,09 Fortement
positive
M25 0,58#177;0,065 Fortement
positive
M36 0,66#177;0,02
Positive
M42 0,62#177;0,04 Fortement
Positive
M45 1#177;0
Négative
M47 1#177;0
Négative
M56 0 ,58#177;0,01 Fortement
positive
M57 0,57#177;0,08 Fortement
positive
C. krusei
C. krusei ATCC 6258 1#177;0
Négative
C. krusei 05 (054) * *
M13 0,66#177;0,03
Positive
M22 0,83#177;0,12
Positive
M30 1,51#177;0,01
Positive
M31 0,77#177;0,09
Positive
M32 0,85#177;0,01
Positive
M39 1#177;0
négative
M40 0,55#177;0,02 Fortement
Positive
M43 0,52#177;0,02 Fortement
positive
M44 1,5#177;0 Positive
M49 0,61#177;0,03 Fortement
Positive
M41 1#177;0
négative
M17 1,45#177;0,09
Positive
M18 1#177;0
négative
M50 0,61#177;0,03 Fortement Positive
1#177;0 Négative 0,23#177;0 ,02
Très élevée 2,11 â
Très élevée 1,77 â
Très élevée 1 ã
Très élevée 1,93 â
Pas d'activité 1,81 â
Elevée 2,05 â
Elevée 2,36 á
Pas d'activité 2,26 â
Faible 2,84 á
Pas d'activité 2,12 â
Très élevée 1,38 â
Pas d'activité 2 â
Très élevée 1,71
á
Très élevée 2 â
Pas d'activité 1,76 â
Très élevée 1,48
á
Pas d'activité 1 ã
Très élevée 2,1 â
1#177;0 Négative 0,32#177;0,05
1#177;0 Négative 0,41#177;0,08
1#177;0 Négative 0,33#177;0,05
0,71#177;0,1 Positive 1#177;0
0,53#177;0,12 Fortement positive
0,77#177;0,28
1#177;0 Négative 0,72#177;0,04
0,7#177;0,28 Positive 1#177;0
0,51#177;0,01 Fortement positive 0,84#177;0
0,7#177;0,04 Positive 1#177;0
0,43#177;0,31 Fortement positive
0,37#177;0,04
1#177;0 Négative 1#177;0,04
1#177;0 Négative 0,23#177;0,02
0,9#177;0,14 Positive 0,68#177;0,04
0,51#177;0,03 Fortement positive 1#177;0
0,52#177;0,02 Fortement positive
0,59#177;0,06
0,72#177;0,17 Positive 1#177;0
1#177;0,09 Négative 0,6#177;0
Très élevée 1,58
á
* * *
Très élevée 1,44
á
Très élevée 1 ã
Très élevée 1 ã
Très élevée 1 á
Très élevée 1,47 â
Très élevée 1,97 â
Très élevée 1,41 â
Très élevée 1,75
á
Très élevée 1,91 â
Très élevée 1,54
á
Très élevée 1,71
á
Très élevée 1,42
á
Très élevée 1 ã
Très élevée 1,83
á
1#177;0 Négative 0,42#177;0,08
* * *
1#177;0 Négative 0,46#177;0,01
0,51#177;0 Fortement positive 0,69#177;0,08
1#177;0 Négative 0,56#177;0,06
1#177;0 Négative 0,53#177;0,005
1#177;0 Négative 0,53#177;0,04
1#177;0 Négative 0,53#177;0,05
0,58#177;0,08 Fortement positive
0,57#177;0,02
0,65#177;0,06 Positive 0,73#177;0,18
0,71#177;0,01 Positive 0,61#177;0,01
0,55#177;0 ,02 Fortement positive
0,22#177;0,03
0,56#177;0,09 Fortement positive
0,62#177;0,03
0,9#177;0,15 Positive 0,19#177;0,07
0,89#177;0,14 Positive 0,36#177;0,18
0,6#177;0 Positive 0,6#177;0,14
C. famata
1#177;0 Négative 0,25#177;0,02
0,55#177;0 Fortement positive 0,8#177;1,3
1#177;0 Négative 0,56#177;0,06
1#177;0 Négative 0,18#177;0,01
Très élevée 1,78
á
Faible 1 ,69 á
Très élevée 1,54
á
Très élevée 1,51 â
* * *
Très élevée 1 ã
Très élevée 2 â
C. famata V2 0,76#177;0,09 Positive
M9 1#177;0 Négative
M10 1#177;0 négative
M11 1#177;0 négative
C. tropicalis
* * *
C. tropicalis 06(085) * *
0,64#177;0,09 Positive 0,4#177;0,02
0,54#177;0,04 Fortement positive
0,61#177;0,01
M28 1,64#177;0,01 Positive
M46 0,71#177;0,08 Positive

C. lusitaniae
1#177;0 Négative 0,55#177;0,09
1#177;0 Négative 0,68#177;0,33
0 ,66#177;0,05 Positive 0,51#177;0,11
1#177;0 Négative 0,83#177;0,26
Très élevée 1 ã
Très élevée 2 á
Très élevée 1,44 â
faible 2,18 á
C. lusitaniae CECT 11458 1#177;0
Négative
M1 1#177;0 négative

C. guilliermondii
M14 0,6#177;0,4 Fortement Positive

Saccharomyces cerevisiae
M23 0,8#177;0,01 Positive
â : deux zones d'hémolyse ;á : une
seule zone d'hémolyse ; ã : pas de zone
d'hémolyse
Résultats
5. Identification des enzymes par les galeries Api
ZYM
Les produits des différentes souches
testés montrent la présence de 19
activités enzymatiques. En effet, toutes les souches
produisent: Estérase (C4), Valine arylamidase,
Cystine arylamidase et Naphtol-AS-BI -phosphohydrolase. Les
résultats sont résumés dans le tableau
VIII ci-dessous.
Tableau VIII. Caractères
enzymatiques des différents isolats de levures
obtenus sur la galerie Api Zym.
Souches
Caractères étudiés sur les
galeries API ZYM
5 6 7 8 9 10 11 12 13 1 4
15 16 17 18 19 20
1 2 3 4
%
- + + + - - 60 - + + + - - 60 + + + + + + 95 + + + + + +
95 + + + + + + 95 - + + + - - 65 + + + + + - 80 + + + + - - 65
+ + + + + + 95 - + + + - - 55 - + +
+ - - 60 + + + + + + 95 + + + + + +
85 + + + + + + 95 + + + + + -
90
60 100 100 100 60 46,6
+ + + + + + 95
- - - - - - 50
- - - - - - 55
+ + + + + + 95 + + + + + - 90 + + + + + + 95 - + - + + +
85 - + + + - - 50
- - - - - - 45
+ + + + + + 95
+ + + + + + 95
- - - - - - 45
+ + + + + + 95
+ + + + + + 95
57,1 71,4 64,2 71,4 64,2 57,1
% des tests positifs 0 86,6 100
100 93,3 100 100 100 66,6 53,3 100 100 60 60
Candida albicans
M2 - + + +
M5 - + + +
M7 - + + +
M8 - + + +
M16 - + + +
M20 - + + +
M21 - + + +
M24 - + + +
M25 - + + +
M36 - - + +
M42 - + + +
M45 - + + +
M47 - - + +
M56 - + + +
M57 - + + +
Candida krusei
M13 - + + +
M22 - + + +
M30 - + + +
M31 - + + +
M32 - + + +
M39 - + + +
M40 - + + +
M43 - - + -
M44 - + + +
M49 - + + +
M41 - + + +
M17 - + + +
M18 - + + +
M50 - + + +
% des tests positifs 0 92,8 100 100
Candida famata
M9 - - + +
M10 - + + +
M11 - + + +
% des tests positifs 0 66,6 100
100
C. tropicalis
+ + + + - - + + - - + + + + - - + + - - + + + + + + +
+ + + + + + + + + + + + + + + + + + + + + + + + + + + + - + + - - + + + + + - +
+ + + + + + + - - + + - - + + + + + + + + + + + + + +
- - + + - - + + + + - - + + - - + + + + + + + + + + - + + + +
+ + + + + + + + + + + + + + + + + + + + + +
+ + +
+ + + + + + + + + + + + + + + - - + + - + + + + + + +
+ - - + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + +
+ + + + + + + - - + + - - + + + + - - + + - - + + + + + + + + + + + +
+ + + + + + + + + + + + - - + + - - + + + + + + + + +
+ + + + + + + + + + +
100 100 100 100 78,5 71,4 92,8 100 71,4 64,2
- - - - - - 35
- - - - - - 45
+ + + + + + 95
- + + + - - + + - -
+ + + + - - + + - -
+ + + + + + + + + +

33,3 33,3 33,3 33,3 33,3 33,3

66,6 100 100 100 33,3 33,3 100 100 33,3 33,3
M28 - + + + + + + + - - + + - - - + - + - -
55

% total 0 89,1 100 97,2
91,8 97,2 100 100
13-á-galactosidase, 14-â-galactosidase,
-Phosphatase acide, 12-Naphtol-AS-BI phosphohydrolase,
% des tests positifs 0 100 100 100
Candida lusitaniae
M1 - + + + - - + + - - + + -
-
% des tests positifs 0 100 100 100
C. guilliermondii
M14 - + + +
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
64,8
|
59,4
|
97,2
|
100
|
59,4
|
56,7
|
56,7
|
83,7
|
81,1
|
81,1
|
59,4
|
48,6
|
1-Témoin, 2-Phosphatase alcaline, 3-Estérase (
C4),
arylamidase , 9-Trypsine ,10-á-chymotrypsine, 1
1
15-â-glucuronidase,
16-á-glucosidase,17-â-glucosidase,
4-Estérase Lipase (C8), 5-Lipase (C14), 6-Leucine
arylamidase,7-Valine arylamidase, 8-Cystine
18-N-acétyl-â-glycosaminidase,
19-á-mannosidase, 20-á-fucosidase.
100 100 100 100 0 50 100 100 0 0
0 100 50 100 50 0
+ + + +
100 100 100 100
% des tests positifs 0 100 100 100
Saccharomyces cerevisiae
M23 - + + +
% des tests positifs 0 100 100 100
- + + - - - 45
0 100 100 0 0 0
+ + + + + + 95
100 100 100 100 100 100
95
0 0 100 100 0 0 100 100 0 0
+ + + + + + + + + +
100 100 100 100 100 100 100 100 100 100
M46 - + + + + + + + - + + + - - - + + + + -
70
Résultats
|
IV. Etude qualitative et quantitative de
des souches de Candida spp.
isolées
1. Etude qualitative de l a formation de biofilm 1.1.
Coloration à la safranine
|
l'adhésion
|
L'étude qualitative de formation de biofilm
testée par la méthode de coloration à la safranine 1% a
montré que toutes souches de Candida
testées sont phénotypiquement formatrices de biofilm
à des degrés variables. En effet, 17,77 % de
souches sont faiblement formatrices de biofilm (noté
` +') et 57,77% sont moyennement formatrices
de biofilm (noté
`++') et 24,44% sont fortement formatrices de
biofilm (noté `+++').
Les souches de Candida fortement formatrices de biofilm
montrent un dépôt (culot) très dense

au fond du tube en verre après c
oloration à la safranine 1% (Figure12).
(+++)
(++) (+)
Figure 12. Formation de biofilm
par la méthode de coloration à la safranine
1%.souche faiblement formatrice de biofilm (+),
souche moyennement formatrice de biofi lm (++) et souche
fortement formatrice de biofilm (+++).
|
1.2. Culture sur milieu au rouge
|
Congo
|
Tous les isolats sont non producteurs de biofilm (slime
négatif) et donnent des colonies de couleur rouge
(n=41) et rose (n=4).

Figure 13. Dégradation
de la couleur des souches de Candida cultivées sur des
boites
contenant le rouge Congo.
Résultats
2. Etude quantitative de la formation de biofilm 2.1.
Test de hydrophobicité
Le test de hydrophobicité est basé sur la mesure
de l'adhérence des cellules de Candida au cyclohexane
(hydrocarbure) à montrer que l'hydrocarbure testé est capable de
s'adhérer aux différentes souches de Candida avec
différents degrés et ceci est en fonction de l'espèce .En
effet, l'adhérence optimale à été observée
pour le cyclohexane 85,83% par la souche C. albicans (M47). Aussi,
nous avons remarqué que la souche Saccharomyces cerevisiae
(M23) a un pourcentage d'hydrophobicité très
élevé 84,16%et 47,5% par le cyclohexane et le xylène
respectives .Les différentes souches C. albicans ont une
adhérence varient entre 10,11% pour la souche C. albicans (M 2)
et 85,83% pour la souche C. albicans
(M47). Dans un autre lieu, les pourcentages
d'hydrophobicité pour les souches de C.
Tropicalis varient
entre 1,81% pour la souche de référence C. Tropicalis
06(085) et fort 79,09% pour la souche M46.
Le pourcentage de souches qui ont une adhérence au
cyclohexane supérieur à 50% est 33,33%.
Aussi, la mesure de l'adhérence au xylène a
indique que le xylène est capable de s'adhérer comme le
cyclohexane aux différentes souches de Candida avec une
variation de pourcentage d'adhérence d'une souche à une autre. Le
pourcentage le plus élevé à été
trouvé chez la C. albicans (M7), (66,66%) et 59,37% pour C.
krusei(M30). L'adhérence au xylène pour les souches de
C. albicans varient entre 3,26% pour la souche M57 et 66,66% pour la
souche (M7). Pour seule souche S. cerevisiae (M23) a un
pourcentage élevé 47,5%.
Le pourcentage des souches qui ont une adhérence au
xylène supérieur à 50% est 12,69%.
2.2. Sur les plaques en polystyrène
L'adhésion et la formation de biofilm par les
espèces de Candida à la surface des puits des plaques en
polystyrène durant 66h ont été déterminées
par la réduction colorimétrique du XTT. La formation du biofilm a
montré la présence d'une corrélation entre les valeurs des
absorbances à 492 nm et l'intensité colorimétrique du XTT.
Notre étude a été réalisée sur 43 souches de
Candida. Nous avons essayé d'étudier tout d'abord la
variation intra-espèce de la réduction du XTT chez C.
albicans, C. krusei, C. tropicalis,
Résultats
|
C. guilliermondii, C. lusitania
|
e et C. famata. Par la suite,
étudié la variation
|
cette réduction reflétant la
capacité
inter-espèce de
de formation du biofilm par cette levure.
(Tableau IX).
Tableau IX. Etude qualitative
de la production d'exopolysaccharides par coloration à la
safranine 1% et sur gélose au rouge Congo et test
d'adhésion aux solvants organiques (xylène
et cyclohexane).
Production de slime
|
|
|
Hydrophobicité (%)
|
|
Souches testées
|
Coloration à la Safranine
1%
|
Rouge Congo
Morphotype Interprétation
|
|
Xylène Cyclohexane
|


Candida albicans
C. albicans ATCC 2091
C. albicans ATCC 90028
C. albicans SC 53 14
M2
M5
M7
M8
M1 6
M20
M2 1
M24
M25
M36
M42
M45
M47
M56
M57
Candida krusei
C. krusei ATCC 6258
C. krusei 05 (054)
M1 3
M22
M30
M3 1
M32
M39
M40
M4 1
M43
M44
M49
M1 7
M1 8
M50
Candida famata
C. famata V2
M9 M1 0 M1 1 Candida tropicalis
C. tropicalis 06(085)
M28
M46
Candida lusitaniae
C. lusitaniae CECT 11458
M1
Candida guilliermondii
M1 4
Saccharomyces cerevisiae
M23
++ Rouge Slime négatif
+++ Rose Slime négatif
+++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rose Slime négatif
+++ Rouge Slime négatif
++ Rouge Slime négatif
+++ Rouge Slime négatif
+ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
+++ Rouge Slime négatif
++ Rouge Slime négatif
+++ Rouge Slime négatif
+++ Rouge Slime négatif
+++ Rouge Slime négatif
++ Rouge Slime négatif
+++ Rouge Slime négatif
++ Rose Slime négatif
+ Rouge Slime négatif
+ Rouge Slime négatif
++ Rouge Slime négatif
+ Rouge Slime négatif
+ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rose Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
+ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
++ Rouge Slime négatif
+++ Rouge Slime négatif
++ Rouge Slime négatif
+ Rouge Slime négatif
+ Rouge Slime négatif
++ Rouge Slime négatif
+++ Rouge Slime négatif
33,92 33,03
10 19
15,78 10,52
16,85 10,11
17,27 29,09
66,66 57,77
1,66 15,83
56,66 17,5
16,66 52,22
16,49 46,39
17,79 57,62
14 78
46,66 66,66
48,18 82,72
55 80
62,5 85,83
50 76,66
3,26 29,34
3,50 12,28
22,22 1,11
11,81 41,81
3,27 40,98
59,37 70,62
55 56,66
37 27,55
10 34
24,54 61,81
2 48
11 52
16,66 42,5
7,20 54,05
5 4
2 30
32,20 44,91
10,71 25,89
24,60 41,26
0,8 6,62
14,51 16,93
6,36 1,81
24,19 4,83
56,36 79,09
21,66 24,16
11,25 10
21,84 24,36
47,5 84,16
(+) : souche faiblement formatrice de biofilm
; (++) : souche moyennement formatrice de biofilm; (+++) :
souch e fortement formatrice de biofilm.
Résultats
La figure 14 (a) montre que les moyennes des valeurs des
densités optiques relatives à l'activité de la
déshydrogénase mitochondriale différent entre les 43
souches de Candida testées. En effet, les valeurs des
densités optiques varient de 0.063 pour la souche C. albicans
SC 5314 à 0,375 pour la souche C. albicans (M21). Nous
avons pu remarquer que tous les isolats de C. albicans sont plus
formateurs de biofilm sur les polystyrènes que les souches de
référence SC 5314 (DO=0,063) et C. albicans ATCC 90028
(DO= 0,262). Pour les souches C. krusei, les valeurs des
densités optiques varient de 0,19 pour la souche de
référence C. krusei 05(054) à 0,33 pour la souche
de C. krusei (M43). Nos résultats ont montré que
l'espèce albicans est plus formatrice de biofilm sur le
polystyrène (DO= 0,375) que l'espèce de C. krusei
(DO=0.289). Aussi les espèces C. tropicalis
s'avèrent fortement formatrice de biofilm sur ce même
matériaux puisque pour la souche de référence C.
tropicalis 06(0,85) a une DO=0,306 et pour la souche C. tropicalis
M28 la DO est 0,243, et il en est en même pour la souche
C. famata V2 (DO= 0,243).
Pour le Cristal violet 1%, la figure 14 (b) montre que les
moyennes des valeurs des densités optiques différentes entre les
43 souches de Candida testées. En effet, les valeurs des
densités optiques varient de 0.107 pour la souche C. albicans
(M7) à 0,331 pour la souche C. albicans (M57). Pour les
souches de C. krusei, les valeurs des densités optiques varient
de 0,100 pour la souche de référence C. krusei 05(054)
à 0,234 pour la souche de C. krusei (M44).
41
Résultats
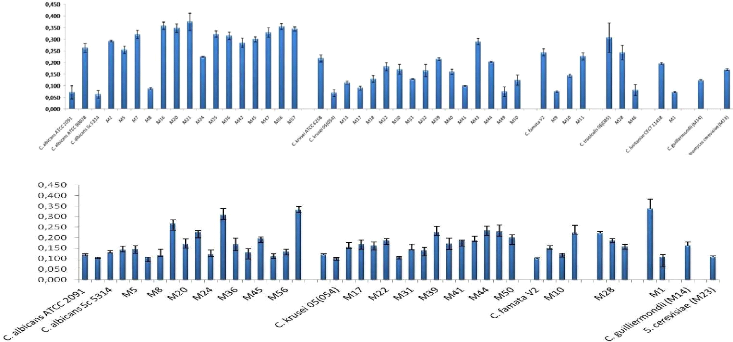
(a)
(c)
Figure 14. Distribution des valeurs de
l'absorbance de XTT (a) à 492 nm et du cristal violet à 595 nm en
fonction des différentes espèces de
Candida
isolées de la station de traitement des lixiviats de
Djebel-Chakir.

DISCUSSION
42
Discussion
Dans cette étude, 37 souches de levures ont
été isolées de la station de traitement des déchets
de Djebel Chakir, avec dominance des deux espèces C. albicans
(15/37) et C. krusei (14/37).
Six espèces de Candida spp. ont
été isolées qui sont C. albicans, C.
lusitaniae, C. famata, C. guilliermondii, C.
tropicalis, C. krusei ainsi que la souche Saccharomyces
cerevisiae.
L'étude morphologique des Candida spp. a
porté sur l'aspect et la forme des colonies sur milieu solide
sélectif. L'examen macroscopique des souches cultivées sur ce
milieu et à une température de 37°C a montré qu'il
s'agit de colonies crémeuses ayant une odeur de levures. La
capacité des espèces de Candida à se
développer à 37°C est une caractéristique importante
à considérer dans l'identification des espèces cliniques
sachant que la plupart, des espèces pathogènes se
développent aisément à 25°C et à 37°C
(McCullough et al., 1996).
L'observation microscopique des cellules de Candida
spp. a montré qu'elles sont semblables. Les blastopores peuvent
changer de l'aspect ovoïde à allongé et même
sphérique (Odds, 1988). Notre étude nous a permis de
vérifier que macroscopiquement, C. albicans apparait une
espèce caractérisée par la forme de levure (blastopores
ovoïdes) et les souches de C. krusei sont de forme
allongée ou en grain de riz.
Les activités hydrolytiques incluant la phospholipase,
la protéase et l'estérase jouent un rôle important dans la
pathogénie des champignons. La sécrétion de ces enzymes
à été discutée dans la littérature
(da Costa et al., 2009, Noumi et al., 2009).
Les enzymes hydraulitiques peuvent entrainer la destruction de la membrane
cellulaire et son aussi impliquée dans la pathogénicité
des levures de genre Candida.
La sécrétion des phospholipases extracellulaires
par les espèces de Candida a été reportée
pour la première fois par Costa et ses collaborateurs
(1968) suite à la croissance de cette levure sur milieu
solide à base de jaune d'oeuf. Nos résultats ont prouvé
que 31,11% des souches de Candida ont une activité
phospholipase négative et que 44,44% des souches C. albicans
sont phospholipase positive, contrairement à l'étude de
Farina et ses collaborateurs en 2009 qui ont montré que
99,4% des souches de C. albicans sont productrices de cette enzyme.
D'autre étude ont montré que d'autre espèces de
Candida telles que les C. tropicalis, C. famata, et C.
guilliermondii secrètent aussi de la phospholipase (Noumi
et al., 2011).
43
Discussion
En ce qui concerne l'activité protéolique,
Naglik et ses collaborateurs (2003) ont
prouvé que les Aspartyl protéases sécrétées
par les Candida jouent un rôle important dans la virulence de
cet organisme. Les rôles attribués à cette enzyme lors de
l'infection par C. albicans pourraient aller de la simple absorption
des substances nutritives jusqu'à la digestion des immunoglobulines de
l'hôte afin de résister au système immunitaire. Nous avons
aussi montré que 86,04% des souches de Candida testées
sont productrices de la protéase et que cette production est
répartie au niveau des six espèces de Candida
étudiés (C. albicans, C. lusitaniae, C. famata, C.
guilliermondii, C. tropicalis, C. krusei).
L'étude expérimentale a
révélé que 46,51% des isolats de Candida
testés ont une activité estérase négative. Les
souches de Candida qui ont une activité estérase
positive ont un pourcentage de 27,90% parmi elles: C. albicans
33,33% et C. krusei 35,71%. Mudaliar et ses
collaborateurs en 2005, la majorité des espèces
sont non productrice de l'estérase sur 149 souches de Candida
isolées de différents patients malades à
montré que 92.3% de C. albicans ne secrète pas
l'estérase, C. tropicalis (92.3%), C. parapsilosis
(25%), C. dubliniensis (16.6%), C. inconspicua (100 %),
et C. lipolytica (100%) non sécrétrices de
l'estérase.
Le pouvoir hémolytique des souches de C. albicans
à été rapporté pour la première fois
par Manns et ses collaborateurs (1994).
L'étude de Gang et ses collaborateurs
(2001) a démontré qualitativement et
quantitativement l'activité hémolytique chez différentes
espèces de Candida. Nos résultats ont montré que
la majorité des souches testées ont la possibilité de
dégrader l'hémoglobine (source de fer par production de deux
différents types d'hémolysines responsable de la lyse des
érythrocytes). En effet, les souches hémolytiques de Candida
ont montré les trois types d'hémolyse. Cependant,
l'activité beta hémolytique (hémolyse complète) a
été uniquement observée après 48 h d'incubation
précédée d'une activité alpha hémolytique
(hémolyse incomplète) durant les premières 24 h
d'incubation.
L'analyse quantitative des données a montré que
l'activité beta hémolytique de C. albicans est plus
importante que celle des autres espèces testées. Aussi cette
variation a été observée au sein d'une même
espèce. En effet, les deux types d'hémolyse (bêta et alpha)
ont été observés chez les souches de C. albicans
et C. krusei. Ces résultats ont été
prouvés en 1999 par Watanabe et ses
collaborateurs. Ces observations suggèrent que alpha et beta
hémolyse peuvent résulter de deux ou plusieurs différents
facteurs hémolytiques produits par
ce type de levures.
44
Discussion
L'adhésion des isolats de Candida à
différentes surfaces à été testée
qualitativement et quantitativement. La production de Biofilm testée par
méthode de coloration à la safranine 1% a montré que
toutes les souches de Candida testées sont
phénotypiquement formatrices de biofilm avec des degrés variables
en fonction de l'intensité du biofilm. En effet, 17,77 % de souches sont
faiblement formatrices de biofilm (noté `+') et 57,77% sont moyennement
formatrices de biofilm (noté `++') et 24,44 % sont fortement formatrices
de biofilm (noté `+++'). Cerickcioglu et ses
collaborateurs (2004) suggèrent l'utilisation de cette
technique puisqu'elle est simple et efficace pour la détermination des
propriétés adhésives de souches de Candida.
La production d'exo-polysaccharides sur milieu au rouge Congo
a montré que les souches testées donnent deux morphotypes (rouge
et rose) qui sont interprétés comme étant des souches
slime négatif. En 2010, Dag et ses
collaborateurs ont montré la présence de différents
morphotypes : rouge foncé (noté slime positif), rose à
centre noir (noté souche faiblement productrice de slime) et rose pale
et blanc (noté souche slime négatif). De plus, Gökce
et ses collaborateurs (2007) ont étudié
la production de biofilm chez 99 souches de C. albicans isolées
d'hémoculture en utilisant la méthode en tube et les
méthodes spectrophotométriques. Les résultats obtenus
montrent une corrélation positive entre les différentes
techniques testées.
Il est connu que le rouge Congo interagit avec plusieurs
polysaccharides avec une forte affinité pour la chitine et le glucane
(Roncero et Duran, 1985). Ceci étant, l'interaction
entre ces molécules et le rouge Congo limitent son utilisation pour
évaluer qualitativement la formation de biofilm par les souches de
Candida. Ainsi et compte tenu de ces remarques, nous ne recommandons
pas l'utilisation de ce test (CRA) pour le screening des souches de Candida
formatrices de biofilm sur ce milieu. Cette position est aussi prise par
Dag en 2010 et Noumi et ses collaborateurs (2011). En effet,
ces auteurs ont montré que le test sur rouge Congo a une faible
sensibilité avec un pourcentage élevé de faux positifs.
Au cours de notre travail, nous avons étudié
l'hydrophobicité des 43 souches de Candida au cyclohexane et au
xylène .Nous avons montré que les hydrocarbures testés
sont capable de s'adhérer aux différentes souches de Candida
avec différentes degrés .Pour le cyclohexane
l'adhérence optimale est pour la souche C. albicans
(M47) 85,83% et pour le xylène l'adhérence
optimale est pour la souche C. albicans M7 (66,66%) et 59,37% pour
C. krusei. En 2010, Raut et ses
collaborateurs ont étudié l'hydrophobicité de 50
souches
45
Discussion
cliniques de Candida en corrélation avec la
formation de biofilm sur le polystérene .Ils ont trouvé que
l'hydrophobicité de la surface des cellules de Candida varie de
2 à 41 %. Ils ont aussi noté qu'il n'y a pas de
corrélation entre l'hydrophobicité des cellules de cette levure
et leur adhésion au polystyrène.
Les isolats de Candida ont été
testés pour leur capacité à former un biofilm à la
surface des puits des plaques en polystyrène par mesure de la
viabilité cellulaire suite à la réduction du XTT par la
déshydrogénase mitochondriale des cellules de Candida
métaboliquement actives. Le changement colorimétrique durant
la phase de formation de biofilm reflète le nombre des cellules vivantes
et peut être quantifié par un lecteur ELISA (Kuhn et al.,
2002).
Notre étude nous a permis de remarquer que C.
albicans est l'espèce la plus productrice du biofilm suivi par
C. krusei. En effet, certaines études ont
démontré que le métabolisme du XTT par les cellules
adhérentes de Candida peut varier d'une espèce à
une autre et que ce métabolisme est plus élevé chez C.
albicans que chez les autres espèces vu qu'elle est l'espèce
la plus adhérente.
Dans la dernière partie nous avons étudié
l'activité antifongique de l'amphotéricine B contre des isolats
de Candida. Dans le même domaine, les études de
kunkel en 2011 sur 51 souches de C.
albicans qui ont été isolées des différents
services de l'hôpital à partir des cathéters et des sondes
après leur ablation a montré que les cellules de C. albicans
sont très résistantes ,cette résistance augmente au
cours phases de la formation des biofilms jusqu'à ce qu'elle atteigne
son seuil à la phase de maturation (après 48 h) par dosage
colorimétrique après coloration au cristal violet.
Il en sort de ce travail que toutes les espèces de
Candida isolées des différentes phases de traitement des
lixiviats de Djebel-Chakir sont dotées de plusieurs
propriétés virulentes: (i) sécrétion de plusieurs
enzymes hydrolytiques (phospholipases, estérase,
aspartylprotéases), (ii) dégradation des globules rouges, et
(iii) formation de biofilm. De telles levures déversées
directement dans le milieu récepteur (Oued El Attar) peuvent être
une source de danger
potentiel pour l'être humain.

CONCLUSION
GENERALE
Conclusion générale
Les Candida sont des levures ubiquitaires
fréquemment isolées de l'environnement (air, fruit, viande,
produit laitiers....). Chez l'homme, elles peuvent coloniser de nombreux sites,
vivre à l'état commensal à l'intérieur du tube
digestif, des voies génito-urinaires, des voies aériennes
supérieurs ou au niveau du revêtement cutané. Ce sont des
levures opportunistes qui peuvent à la faveur d'une altération
des barrières locales, d'un déséquilibre de la flore
endogène ou d'un déficit immunitaire, se comporter en
pathogènes et envahir un certains nombre de tissus.
Actuellement les données épidémiologiques
montrent que les souches de Candida spp. occupent la
quatrième place parmi les micro-organismes pathogènes les plus
fréquemment isolés. L'épidémiologie des Candida
s'est considérablement modifiée ces dernières
années avec l'apparition des nouvelles espèces (C.
dubliniensis). En effet, le genre Candida représente les
champignons les plus isolés chez l'homme, les espèces C.
albicans et C. glabrata constituent les espèces les plus
fréquentes.
La première partie concerne l'étude de la
caractéristique biochimique des espèces de Candida. Ces
levures ont une forme ovalaire qui est plus remarquable chez C.
albicans. Cette forme est allongée chez des autres espèces
comme C. krusei. Aussi, les souches des Candida ne sont pas
toutes résistantes à l'acide borique. L'utilisation des galeries
Api Candida comme système d'identification des espèces
de Candida a montré la présence de sept espèces
C. albicans, C. krusei, C. glabrata, C. lusitaniae, C. guilliermondii, C.
famata et C. tropicalis et l'identification de deux genres qui
sont Candida et Saccharomyces.
La deuxième partie de cette étude a
été focalisée sur l'étude des facteurs de
virulences ou pathogénicité des Candida spp.
La sécrétion d'enzymes est indispensable
à la dégradation des tissus parasités. Les phosolipases
favorisant la dissémination de l'infection, étaient
déterminées chez la plupart des souches ; la production de ces
enzymes est plus importante chez les souches isolées à partir de
certains échantillons. Les protéases sont certainement les
enzymes des Candida Spp les mieux étudiées. Les
résultats obtenus confirment la forte activité
protéolytique des souches testées. Les estérases sont des
enzymes secrétées par les souches de Candida. La
sécrétion de cette enzyme n'est pas observée chez toutes
les souches de Candida.
Conclusion générale
L'activité hémolytique est également
déterminée chez toutes les souches de Candida. Une
activité ß-hémolytique est développée
après une lyse totale des érythrocytes du sang du
mouton. Ainsi, il est intéressant de souligner
l'importance de l'élément fer dans le
métabolisme des
Candida. L'étude des caractères enzymatiques aux
galeries Api Zym a permis de détecter 19 enzymes chez les
différentes souches de Candida testées. La
présence des enzymes varie d'une souche à une autre .Les enzymes
les plus détectées sont l'Estérase (C4), la Valine
arylamidase, la Cystine arylamidase et le Naphtol-AS-BI phosphohydrolase chez
toutes les espèces testées.
La troisième partie concerne l'étude qualitative et
quantitative de la formation de
biofilm
L'étude qualitative de la formation de biofilm faite
par la coloration à la safranine montre que la majorité des
isolats sont moyennement formatrice de biofilm et pour la culture sur milieu au
rouge Congo la totalité des souches n'est pas productrice de biofilm.
L'étude quantitative de la formation de biofilm par le
test de hydrophobicité indique que le cyclohexane et l'xylène
peuvent s'adhérer aux différentes souches de Candida
avec des degrés différents. Aussi, concernant
l'adhésion et l'implication des isolats de Candida dans la
formation de biofilm sur les plaques ELISA, notre étude a bien
confirmé que ce facteur
(l'adhésion) est variable selon les espèces.

RÉFÉRENCES
BIBLIOGRAPHIQUES
Page 1
Références
Bibliographiques
1- Abu-Elteen, K.H.; Abu-Elteen, R.M. (1998). The prevalence
of Candida albicans population in the mouths of complete denture
wearer's. New Microbiol, 21:41-48.
2- Aoki, S.; Ito-Kuwa, S.; Nakamura, Y.; Masuhara, T. (1990).
Comparative pathogenicity of wild-type strain and respiratory mutants of
Candida albicans in mice. Zol.Bakt,
273:332-343.
3- Arendorf, T.M.; Walker, D.M. (1980).The prevelance and
intra-oral distribution of Candida albicans in man. Arch
.Oral Biol, 25:1-10.
4- Baillie, G.S.; Douglas, L.J. (1999a). Role of dimorphisim
in development of Candida albicans biofilm. J. Med
Microbiol, 48(7):671-679.
1- Banerjee, S.N.; Emori, T.G.; Culver, D.H.; Gaynes, R.P.;
Jarvis, W.R.; Horan, T. (1991). Secular trends in nosocomial primary blood
stream infections in the United States. Am .J. med,
91: 86-89.
2- Baillie, G.S.; Douglas, L.J. (1999a). Role of dimorphisim
in development of Candida albicans biofilm. J. Med
Microbiol, 48(7): 671-679.
3- Beck-Sague, C.M.; Jarvis, T.R. (1993) Secular trends in
the epidemiology of nosocomial fungal infection in the United States.
J. Infect . Dis, 167: 1247-1251.
4- Budtz-Jorgensen, E. (2000). Ecology of Candida-associated
denture stomatitis. Microb. Ecol. Health Dis,
12:170-185.
5- Cannon, R.D.; Chaffin, W.L (1999). Oral colonization
by Candida albicans. Critical review in Oral Biology and
Medicine, 10:359-383.
6- Chaffin, W.L.; López- Ribot, J.L.; Casanova, M.;
Gozalba, D .and Martinez, J.P. (1998). Cell wall and secreted proteins of
Candida albicans: identification, function and expression.
Microbiology and molecular Biology Review,
62:130-180.
7- Calderone, R.D.; Fonzi, W.A (2001). Virulence factors
of Candida albicans. Trends Microbiol, 9(7):
327-335.
8- Calderone, R.A. (2002). Taxonomy and biology of
Candida. In: Calderone, R.A. (Eds). Candida and Candidiasis,
ASM Press, Washington D .C, pp15-27.
9- Cerikçio lu, N.; Ilki, A .; Bilgen, H.; Ozek, E.;
Metin, F.; Kalaça, S. (2004). The relationship between candidemia and
candidal colonization and virulence factors of the colonizing strains in
preterm infants. Turk J Pediatr.46(3):245-50.
10- Chabasse, D.; Guiguen, C.P.; Contet-Audonneau, N.
(1999).Mycologie Médicale. Paris : Masson
Page 2
Références
Bibliographiques
11- Chandra, J.; Kuhn, D.M.; Mukhergee, P.K.; Hoyer, L.L.;
McCormick, T.; Ghannoum, M.A. (2001a) .Biofilm formation by the fungal
pathogen Candida albicans: development, architecture, and drug
resistance. J. Bacteriol., 183(18): 5385-5394.
12- Chandra, J.; Mukhergee, P.K.; Leidich, S.D.; Faddoul, F.F.;
Hoyer, L.L.; Douglas, L.J.; Ghannoum, M.A .(2001b). Antifungal resistance of
candidal biofilms formed on denture acrylic in vitro. J. Dent.
Res, 80:903-908.
13- Chen, H.; Fujita, M.; Feng, Q.; Clardy, J.; Fink, G.R.
(2004). Tyrosol is a quorum-sensing molecule in Candida albicans.
Proc .Nat .Acad .Sci, 101(14): 5048-52.
14- Colombo, A.L.; Guimaraes, T. (2003). Epidemiology of
hematogenous infections due to Candida spp. Rev .Soc .Bras
.Med .Trop, 36(5):599-607.
15- Costerton, J.W.; Stewart, P.S.; Greenberg, E.P (1999).
Bacterial biofilms: a common cause of persistent infections.
Science, 284:1318-1322
16- Costa, A.; Costa, C.; Misefari, A.; Amato, A. (1968). On the
enzymatic activity of certain fungi .VII.Phosphatidase activity on media
containing sheep's blood of pathogenic strains of Candida albicans.
Atti Soc .Sci .Fic .Mat .Nat, 14:93-101.
17- Da, CostaKRC.; Ferreira J.C.; Komesu, M.C.; Candida R.C.
(2009). Candida albicans and Candida tropicalis in oral
candidosis: quantitative analysis, exoenzyme activity, and antifungal drug
sensitivity. Mycopathologia; 167:73-9.
18- Dag, I.; Kiraz, N.Oz Y (2010). Evaluation of different
detection methods of biofilm formation in clinical Candida isolates.
African Journal of Microbiology Research, 4(24),
pp.
19- Devenport, D.S.; Massanari, R.M.; Pfaller, M.A.; Bale, M.J.;
Streed, S.A.;,Hierholzer W.J (1986). Usefulness of a test for slime production
as a marker for clinically significant infections with coagulase-negative
staphylococci. J. Infect. Dis.,153: 332339.
20- Donlan, R.M (2001a). Biofilm formation: a clinically
relevant microbiological process. Clin. Infect. Dis,
33:1387-1392.
21- Donlan, R.M (2001b). Biofilms and device -associated
infection. Emerg. Infect. Dis, 7:277-281.
22- Douglas, L.J. (2003). Candida biofilms and their
role in infection. Trends Microbiol, 11 (1):
30-36.
23- Farah, C.S.; Ashman, R.B.; Challacombe, S.J. (2000). Oral
Candidosis. Clinicsin Dermatology,18(5):553-562.
Page 3
Références
Bibliographiques
24- Farina, C.; Saleri, N.; Lombart JP, et al. (2009).
Epidemiological phenotypic characteristics of vaginal yeasts at the Comoros.
Mycoses, 52:458-461.
25- Gang, L.; Samaranayake, L.P.; Yau, J.Y. (2001).
Candida Species Exhibit Differential in Vitro Hemolytic Activities.
J .Clin Microb, 39(8):2971-2974.
26- Garber. (2001) .An overview of fungal infection
.Drugs, 61(1):1-12.
27- Gokce, G.; Cerikcioglu N.; Yagci, A. (2007). Acid
proteinase, phospholipase, and biofilm production of Candida species
isolated from blood cultures .Mycopathol Mycol Appl
164(6):265-9.
28- Hay, R.J. (1999). The management of superficial
candidaisis .J. Am .Acad.Dermatol., 40:535-542.
29- Hawser, S.P.; Douglas, L.J. (1994).Biofilm formation
by Candida species on the surface of catheter materials in vitro
.Infect .Immun, 62(3):915-921.
30- Hawser, S.P.; Baillie, G.S.; Douglas, L.J. (1998a).
Production of extracellular matrix by Candida albicans biofilms
.J.Med .Microbiol,
47(3):253-256.
31- Hawser, S.P.; Norris. H.; Jessup, C.J.; Ghannoum, M.A.
(1998b). Comparison of 2,3-bis(2-methoxy -4-nitro-5-sulfophenyl)-5-[(
phenylamino)carbonyl]-2H-tetrazolium hydroxide (XTT) colorimetric method with
the standardized National Committee for Clinical Laboratory Standards method of
testing clinical yeast isolates for susceptibility to antifungal
agents. J.Clin .Microbiol, 36:1450-1452.
32- Horn, R.; Wong, B.; Kiehn, T.E.; Armstrong, D. (1985).
Fungemia in a cancer hospital: changing frequency, earlier onset, and results
of therapy .Rev.Infect .Dis , 7:646-655.
33- Hube, B. (1998). Possible role of proteinases in
Candida infections .Rev. Iberoam.Micol,
15:68-71.
34- Ibrahim, A.S.; Mirbod, F.; Filler, S.G.; Banno, Y.; Cole,
G.T.; Kitajima, Y., Edwards, J.E.; Nozawa, y.; Ghannoum , M.A. (1995). Evidence
implicating phospholipase as a virulence factor of Candida albicans
.Infect .Immun, 63:1993-1998.
35- Johnson, E.M.; Warnock, D.W.; Luker, J., Porter, S.R.and
Scully, C. (1995). Emergence of azole drug resistance in Candida species from
HIV-infected patients receiving prolonged fluconazole therapy for oral
candidiasis .J.Antimicrob .Chemother, 35:103-104.
36- Kalfa, V.C.; Roberts, R.L.; Stiehm, E.R.(2003). The
sundrome of chronic mucocutaneous candidiasis with selective antibody
deficiency .Ann. Allergy Asthma
Immunol, 90(2):259-64.
Page 4
Références
Bibliographiques
37- Kaloterakis, A.; Rizos, I.; Goumas, G.; Filiotou , A.;
Barbetseas ,J.; Papathanasiou ,P.(2003). Isolated native tricuspid valve
Candida endocarditis in a non - drug-addicted patient: case report and
review of the literature .J. Heart V alve Dis., 12
(5): 652-8.
38- Khardori, N.; Yassien, M. (1995).Biofilm in
device-related infection .J. Ind .Microbiol,
15:141-147.
39- Kitchen, V.S.; Savage, M.; Harris, J.R. (1995).
Candida albicans resistance in AIDS. J. Infect.
Dis, 22:204-205.
40- Kunkel. D.; Sari- Belkaroubi.; Boucherit, K.; Seddiki,
S.M.L.; Boucherit-Atmani, Z(2011). Les biofilm de Candida albicans
formée dans les catheters et des sondes et leurs resistance à
l'amphotèricine B .
41- Klipser, M.E.; Lewis, R.E.; Pfaller, M.A (1998). Therapy
of Candida infection: susceptibility testing resistance and
therapeutic option .Ann. Pbarmacotber, 32:
1353-1361.
42- Kojic, E.M.; Darouiche, R.O. (2004). Candida
infections of medical devices .Clin .Microbiol. Rev.,
17(2): 255-267.
43- Kuhn, D.M.; George, T.; Chandra, J.; Mukherjee, P.K.;
Ghannoum, M.A. (2002). Antifungal susceptibility of Candida biofilm:
unique efficacy of amphotericin B lipide formulation and echinocandins.
Antimicrob. Agent Chemother, 4 6:1773-1780.
44- Kumamoto, C.A. (2002). Candida biofilms
Curr.Opin. Microbiol, 5: 608-611.
45- Leclerc et Bonneau (1982). La lixiviation : Source,
composition et atténuation eau du Québec, 15
(1),37-44.
46- Li, X., Yan, Z.and Xu, J. (2003). Quantitative variation
of biofilms among strains in natural population of Candida albicans.
Microbiology, 149(2):353-362.
47- Macfarlane, T.W.; Samaranayake, L.P (1989). Fungal
infection .In: clinical oral microbiology. London:
Wright: 122-139.
48- Emira Noumi.; Mejdi Snoussi.; Saghrouni F.; Ben Said M.;
Del Castillo L.; Valentin E.; Bakhrouf A (2009). Molecular typing of
clinical Candida strains using random amplified polymorphic DNA and
contour-clamped homogenous electric fields electrophoresis .Journal
of Applied Microbiology, 107:1991-2000.
49- Emira Noumi.; Mejdi Snoussi .; Hajer Hentati . ; Rafael
Sentandreu. ; Lucas del Castillo. ; Amina Bakhrouf. ; Eulogio Valentin
(20011a). Virulence properties and random amplification of polymorphic DNA
(RAPD) fingerprinting of Candida
Page 5
Références
Bibliographiques
albicans isolates obtained from Monastir dental
hospital, Tunisia. African Journal of Biothechnology,
10(6):905-912.
50- Emira Noumi.; Mejdi Snoussi.; Najla Trabelsi. ; Riadh
Ksouri . ; Amina Bakhrouf (2012). Antioxidant activities and RF-HPLC. ;
identification of polyphenols in the ethyl acetate extract of Tunisian Juglans
regia L treated barks .Journal of Medicinal plants Research , Vol
.6(xx),pp.xxx-xxx23February.; 2012.
51- Emira Noumi.; Mejdi Snoussi.; Kammoun Dorra.; Amina
Bakhrouf. ; Eulogio Valentin (2011). Comparison of the adhesion ability of
Candida albicans strains to biotic and abiotic surfaces.
African Journal of Biotechnology, 10(6): 977-985.
52- Manns, J.M.; Mosser, D.M.; Buckley, H.R (1994)
.Production of a hemolytic factor by Candida albicans
.Infect. Immun, 62: 5154-5156.
53- McCullough, M.J.; Ross, B.C.; Reade, P.C
(1996).Candida albicans: a review of its history, taxonomy,
epidemiology, virulence attributes, and methods of strain differentiation
.Int.J.Maxillofoc. Surg, 25:136-144.
54- Maertens, J.; Vrebos, M.; Boogaerts, M. (2001). Assessing
risk factors for systemic fungal infection .Eur.J. Cancer
Care, 10 (1):56-62.
55- Melo, A.S.A.; Padovan , A.C.B .; Serafim,R.C.; Puzer , L
.; Carmona , A.K.; Juliano Neto , L .; Brunstein 1 ,A.; Briones , M.R.S
(2006).The Candida albicans AAA ATPase homologue of Saccharomyces
cerevisiae Rix7p (YLL034c) is essential for proper morphology , biofilm
formation and activity of secreted aspartyl proteinases . Genet.
Mol. Res., 5 (4): 664 - 687.
56- Naglik, J.R.; Challacombe, S.J.; Hube, B. (2003)
Candida albicans secreted aspartyl proteinases in virulence and
pathogenesis .Microbiol .Mol .Biol .Rev, 67(3):
400-428.
57- Noumi, E.; Snoussi, M.; Hentati, H.; Mahdouani, K.; del
Castillo, L.; Valentin, E.; Sentandreu, R.; Bakhrouf, A. (2010). Adhesive
properties and Hydrolytic Enzymes of Oral Candida albicans strains.
Mycopathologia, 169: 269-278.
58- Tizaoui Ch.; Bouselmi L.; Mansouri L.; and Ghrabi A.
(2007). Landfill leachate treatment withozone and ozone/hydrogenperoxide
systems. Journal of Hazardous Materials, 140,
316-324.
59- Odds, F.C. (1988). Candida and Candidosis
.A review and bibliography .2nd and. London: Baillière
Tindall, 42-59. (Öman et Junestedt, 2008;
Öman et Hynning, 1993)
Page 6
Références
Bibliographiques
60- Odds. ; berneart (1994). Evaluation of CHROMagar
Candida for presumptive identification of clinically important
Candida species. Diagnostic Microbiologiy and infectious
Disease, 201-204.
61- Ozanne F. (1990). Les lixiviats de décharge. Le
point des connaissances en 1990. Techniques sciences.
L'eau, 6, 289-314.
62- Price, M. F.; Wilkinson, I.D.; Gentry, L.O. (1982). Plate
method for detection of phospholipase activity in Candida albicans.
Sabouraudia, 20: 7-14.
63- Pronost R. ; Matejka G., Les lixiviats de
décharges d'ordures ménagères. Production,
caractérisation, traitement, Environnement &
Technique. 196 (2000) 25-29.
64- Pfaller, M.A.; Diekema, D.J.; Jones, R.N. (2001).
International surveillance of bloodstream infection due to Candida
species: frequency of occurrence and in vitro susceptibilities to fluconazole,
ravuconazole and voriconazole and voriconazole of isolates collected from 1997
through 1999 in the SENTRY antimicrobial surveillance program .J.
Clin .Microbiol, 39:3254-3259.
65- Pfaller, M.A.; Diekema, D.J. (2002). Role of Sentinel
surveillance of Candidemia: trends in species distribution and
antifungal susceptibility .J. Clin
.Microbiol, 40: 3551-3557.
66- Pfaller, M.A.; Diekema, D.J.; Colombo, A.L.; Kibble, C.,
Ng, K.P.; Gibbs, D.L.; Newell, V.A. (2006).Candida rugosa, an emerging
fungal pathogen with resistance to azoles: geographic and temporal trends from
the ARTEMIS DISK antifungal surveillance program. J.Clin
.Microbiol, 44(10):3578-3582.
67- Ramage, G.; Walle, K.V.; López-Ribot, J.L. (2001).
Biofilm formation by Candida dubliniensis .Journal of
Clinical Microbiology, 39:3234-3240.
68- Ramage, S.S.; Walle, K.V.; Lopez-Ribot, J.L.
(2005).Candida biofilm: an update .Eukaryot.
Cell, 4: 633-638.
69- Roncero, C.; Duran, A. (1985) .Effect of calcofluor white
and Congo red on fungal wall morphogenesis: in vivo activation of chitin
polymerization .J,Bacteriol, 170:1950-1954.
70- Rosenberg M.; Judes H.; Weiss E (1983). Celle Surface
Hydrophobicity of Dental Plaques Microorganisms. Infect
Immun. 42(2): 831-834.
71- Rout J.; Rathod V.; Karuppayil (2010). Celle surface
hydrophobicity and adhesion: a study on fifty clinical isolates of Candida
albicans, Jpn J Med Mycol, 51:131-136.
72- Samaranayke, L.P.; Macfarlane, T.W. (1981).The Adhesion
of the yeast Candida albicans to epithelail cells of human origin in
vitro .Arch .Oral Biol ., 26:815-820
Page 7
Références
Bibliographiques
73- Shepherd, M.G.; Poulter, R.T.M.; Sullivan, P.A.
(1985). Candida albicans: biology, genetic and pathogen
city. Ann. Rev Microbiol, 39: 579-614.
74- Samaranayke, Y. H.; Samaranayake, L.P. (1994). Candida
krusei: biology, epidemiology, pathogenicity and clinical manifestations
of an emerging pathogen .J.Med Microbiol,
41:925-310.
75- Sanglard, D.; Odds, F.C. (2002). Resistance of
Candida species to antifungal agents: molecular mechanisms and clinical
consequences .Lancet Infect .Dis, 2: 73-85.
76- Smith, K., Bu, Y.; Suga, H. (2003). Induction and
inhibition of Pseudomonas aeruginasa quorum sensing by synthetic autoinducer
analogs .Chem. Biol, 10:81
77- Sillet. ; Royer S.; Coque Y. and Thomas O. (2001). Les
lixiviats de décharges d'ordures, ménagères :
genèse, composition et traitement. Déchets, Science
et Techniques, 22, 7-11.
78- Vasquez, J.A. ; sobel, J.D. (2002). Mucosal candidiasis
.Infect .Dis .Clin .North.Am., 16: 793-820.
79- Watanabe,T.; Takano, M.; Murakami, M.; Tanaka, H.;
Matsuhisa,A.; Nakao, N.; Mikami, T.;Suzuki,M. Matsumoto ., T.(1999).
Characterization of a haemolytic factor from Candida albicans
.Microbiology, 145:689-694.
80- Wingard, J.R .; Merz, W.G .; Rinaldi, M.G.; Miller , C.B .;
Karp , J.E.; Saral , R.(1993).Association of Torulopsis glabrata infection with
fluconazole prophylaxis in neutropenic bone marrow transplant patients
Antimicrob . Agent Chemother, 37: 1847-1849.
81- White, T.C.; Marr, K.A.; Bowden, R. (1998). Clinical,
cellular, and molecular factors that contribute to antifungal drug
resistance. Clin. Microbiol .Rev, 11:382-402.
82- Wingard, J.R.; Merz, W .G .; Rinaldi , M.G .; Johnson ,
T.R .; Karp, J.E .; Saral , R.(1991). Increase in Candida krusei
infection among patient with bone marrow transplantation and neutropenia
treated prophylactically with fluconazole. N. Engl. J. Med,
18:1274-1277.
83- Wu, T.; Samaranayake, L.P.; Cao, B.Y.; Wang, J. (1996).
In-vitro proteinase production by oral Candida albicans isolates from
individuals with and without HIV infection and its attenuation by antimycotic
agent. Med.Microbiol, 44:311-316.
84- Yi Ping Ge.; Gui Xia Lu.; Yong Nian Shen.; Wei Da Liu
(2011). In Vitro Evaluation of Phospholipase, Proteinase, and Esterase
Activities of Candida parapsilosis and
Candida metapsilosis. Mycopathologia,
172:429-438.
Références
Bibliographiques
Page 8
85- Yigit, N.; Aktas, E (2009). Comparison of the efficacy of
different blood medium in determining the hemolytic activity of
Candida species. Journal de Mycologie
Médicale, 19:
110-115.
. ÏÉÇÖã
ÇÏæã - ??????? -
ÊÇãíÒäÇ - ????? :
ÍíÊÇãáÇ
ÊÇãáßáÇ
Résumé
Dans la présente étude, nous nous sommes
intéressés à la caractérisation biochimique et
à l'étude des propriétés adhésives des
souches de Candida spp de la station de traitement des lixiviats de
djebel Chakir. La résistance aux agents antifongiques, la production des
enzymes et la production de biofilm (qualitativement et quantitativement) de 43
souches de Candida isolées sont étudiées. Les
isolats étudiés ont été identifiés sur
milieu chromogénique « CHROMagarTM Candida
» et par des galeries Api Candida. Les résultats
obtenus ont montré que ces isolats produisent plusieurs enzymes et la
majorité des souches est hémolytique. Les souches
étudiées sont capables de former un biofilm sur les plaques de
polystyrène.
Mots clé : CHROMagarTM
Candida, galeries Api Candida, enzymes, agents antifongiques,
biofilm.
Summary
In this work, we study the biochemical and adhesive properties
of Candida spp. strains isolated from leachate (Djebel Chakir). The
susceptibility to Amphotericin B and boric acid, the production of hydrolytic
enzymes and the production of biofilm by the 43 strains of
Candida were tested. All strains were recovered on «
CHROMagarTM Candida » and identified using Api
Candida strips. The results obtained showed that the majority of the
isolates produced several enzymes and are hemolytic. Most of the studied
strains are able to form a biofilm on polystyrene plates.
Keywords: CHROMagarTM
Candida, Api Candida strips, enzymes, biofilm, antifungal
agents.
?????
|
??? ÑíÂÇÔ ????
|
ÑíåØÊáÇ ????
|
???? ??
ÉáæÒÚãáÇ
ÊÇíÑØáÇ ????
ÉíÌæáæíÒíáÇ
ÕÆÇÕÎáÇ
ÉÓÏÑÇ áãÚáÇ
ÇÐå ??
|
ÇäáæÇÍ
|
|
??? ÇÏæã ÉÏÚ
|
??? ÞÇÕÊá?Ç
|
??? ÊÇíÑØáÇ ???
ÑÉÏÞ ÇÖí
ÇäÓÏÑ ÇãÂ
.CHROMagarTM Candida
íÐÛã
|
ØÓæ
|
.Polystyrène
|
ìáÅ ÉÇÖÅ ??????
?????????? ????? ??? íÆÇÞÊä?Ç
|
ØÓæáÇ ??
|
ÉáæÒÚãáÇ
ÊÇíÑØáÇ ???
|
?~?
ÉíÑÈÎãáÇ
Ñ~ÈÇÌÊáÇ
ÊÊÈË
|
|
Úæä ??
ÇÏæãáÇ ??? ??????? ????? æ
ÞÇÕÊá?Ç ??? æ
|
ÊÇíÑØáá
|
ÏÉÇÖãáÇ
ÇÏæãáá
ÇåÊãæÇÞã
|
æ ÊÇãíÒä?Ç ??
ÏíÏÚáÇ
ÇÇÒÑÅ
|
.Polystyrène



