Bujumbura, Mai 2013
UNIVERSITE DU BURUNDI

FACULTE DES SCIENCES
DEPARTEMENT DE BIOLOGIE


ETUDE DE LA SPECIFICITE DES CHAMPIGNONS ECTOMYCORHIZIENS
POUR LEURS HOTES : Cas
ICAC
de la forêt claire à Brachystegia
de Rumonge (BURUNDI)
Par :
neveu
Gilbert NIJIMBERE
A tous ceux qui nous s
Sous la direction de :
|
Dr Jérôme DEGREEF
Prof Marie Josée BIGENDAKO
|
Mémoire présenté et défendu
publiquement en vue de l'obtention du grade de Licencié en
Sciences Biologiques
|
i
DEDICACE
A nos parents ;
A nos frères et soeurs ;
A nos oncles et tantes ;
A nos cousins et cousines ;
A nos neveux et nièces ;
A tous ceux qui nous sont chers ;
Nous dédions ce mémoire.
ii
REMERCIEMENTS
Au terme de ce travail, nous voudrions exprimer nos vifs
sentiments de gratitude à toutes les personnes qui ont contribué
d'une manière ou d'une autre à sa réalisation.
Nos sincères remerciements s'adressent au Docteur
Jérôme DEGREEF, Directeur du mémoire, au Professeur Marie
Josée BIGENDAKO, codirecteur de ce mémoire, pour nous avoir
guidé et soutenu avec méthode et rigueur dans nos premiers pas de
recherche.
Nous tenons aussi à remercier nos parents pour nous
avoir mis sur le banc de l'école, nos enseignants depuis l'école
primaire jusqu'à l'Université spécialement ceux de la
Faculté des Sciences, Département de Biologie, pour la formation
tant humaine que scientifique qu'ils nous ont dispensée.
Nous exprimons aussi notre reconnaissance envers le personnel
du laboratoire de chimie à la Faculté des Sciences dont la
collaboration a facilité la réussite de nos travaux de
laboratoire.
A Jacques NKENGURUTSE, Maître assistant à
l'Université du Burundi, qui nous a donné sa documentation et ses
conseils encourageants au cours de la réalisation de ce travail, nous
disons merci.
Nous prenons cette occasion pour manifester nos sentiments de
gratitude à la famille NIYONIZIGIYE Anaclet pour l'hospitalité
qu'il nous a témoignée lors de nos missions de récolte des
champignons à Rumonge.
Nos remerciements s'adressent également à tous
nos camarades de classe avec qui nous avons partagé joies et peines et
à tous ceux qui de près ou de loin, ont contribué à
la réussite de ce travail.
Que toute personne qui a accordé son soutien d'une
façon ou d'une autre tout au long de nos études et au cours de la
réalisation de ce travail trouve ici le résultat de ses
efforts.
Gilbert NIJIMBERE.
iii
SIGLES, SYMBOLES ET ABREVIATIONS
B. : Brachystegia
C.C.T.A : Commission de Coopération
Technique en Afrique
I.N.E.C.N : Institut National pour
l'Environnement et la Conservation de la
Nature
IGEBU : Institut Géographique du
Burundi
pH : Potentiel d'Hydrogène
sp. : Espèce
iv
RESUME
Le présent travail intitulé « Etude
de la spécificité des champignons ectomycorhiziens pour leurs
hôtes : Cas de la forêt claire à Brachystegia de
Rumonge (BURUNDI) » a pour but d'approprier l'espèce de
champignon ectomycorhizien à ses espèces d'arbres hôtes.
D'abord, nous avons passé en revue les
généralités sur la symbiose ectomycorhizienne. En suite,
nous avons procédé à la présentation du milieu
d'étude, la description et l'identification des spécimens de
champignons récoltés.
Les résultats de l'identification ont abouti à
23 espèces de champignons appartenant aux familles des Boletaceae,
Cantharellaceae, Gyrodontaceae, Russulaceae, Strobilomycetaceae, Xerocomacae et
des Amanitaceae.
Les espèces d'arbres visés au cours du travail
sont : Brachystegia bussei, Uapaca nitida, Brachystegia
microphylla, Brachystegia utilis, Brachystegia spiciformis et
Isoberlinia angolensis.
Au terme de ce travail, nous avons conclu que la famille des
Russulaceae est la plus représentée, et Brachystegia bussei
est l'espèce d'arbre susceptible d'être la plus
ectomycorhizée.
v
LISTE DES FIGURES ET TABLEAUX Liste des
figures
Figure 1 : Zone d'étude (Carte confectionnée avec
le logiciel QGIS) 7
Figure 2 : Vue panoramique de la forêt claire de Rumonge
8
Figure 3: Diagramme ombrothermique de la zone d'étude pour
la période de 2005-2010 9
Figure 4 : Différentes parties du champignon visualisant
les caractères macroscopiques
mesurés 11
Figure5 (a & b) : Photos d'un Séchoir 13
Figure 6 : Nombre de spécimens récoltés
durant différentes missions de terrain 21
Liste des tableaux
Tableau 1 : Tableau récapitulatif des données
collectées 15
Tableau 2 : Abondance des espèces par famille 18
Tableau 3 : Abondance des espèces au sein de leurs genres.
19
Tableau 4 : Espèces d'arbres et champignons
ectomycorhiziens 20
Tableau 5 : Ecologie des champignons ectomycorhiziens en fonction
de la
granulométrie 22
vi
TABLE DES MATIERES
DEDICACE i
REMERCIEMENTS ii
SIGLES, SYMBOLES ET ABREVIATIONS iii
RESUME iv
LISTE DES FIGURES ET TABLEAUX v
I. INTRODUCTION 1
I.1. Problématique 1
I.2. But et intérêt du travail 1
I.3. Objectifs spécifiques 2
CHAPITRE I : GENERALITES SUR LA SYMBIOSE
ECTOMYCORHIZIENNE 3
I.1. Les différents partenaires de la symbiose
ectomycorhizienne 3
I.1.1 Les partenaires chlorophylliens 3
I.1.2. Les partenaires fongiques 4
I.2. Fonction des ectomycorhizes dans la nature 4
I.2.1. Meilleur approvisionnement en nutriments du sol 4
I.2.2. Protection contre les polluants 5
I.2.3. Réponse physiologique au stress 5
I.2.4. Liaison entre les racines de nombreuses plantes
hôtes 5
I.2.5. Meilleure résistance aux pathogènes 6
CHAPITRE II : METHODOLOGIE ET MATERIEL 7
II.1. Présentation de la zone d'étude 7
II.1.1. Position géographique 7
II.1.2. Végétation de la forêt claire de
Rumonge à Nyamirambo 8
II.1.3. Pédologie 8
II.1.4. Le climat 9
II.2. Activités sur terrain 10
II.2.1. Récolte des champignons et identifications des
espèces d'arbres hôtes 10
II.3. Activités après la récolte 10
II.3.1. L'étude macroscopique 10
II.3.2 Prise de photos techniques 12
II.3.3. Etude macrochimique 12
II.3.4. Réalisation d'une sporée 12
II.3.5. Identification 12
II.3.6. Le séchage 12
II.3.7. Mise en herbier 13
CHAPITRE III : PRESENTATION ET DISCUSSION DES
RESULTATS 14
III.1. Présentation des résultats 14
III.2. Discussion des résultats 17
III.2.1. Critique méthodologique 17
vii
III.2.2. Abondance des espèces et leurs familles 17
III.2.3. Genres et espèces rencontrés 18
III.2.4. La spécificité symbiotique 19
III.2.5. Les champignons et différentes périodes
de l'année d'étude 21
III.2.6. Spécificité granulométrique des
champignons ectomycorhiziens 22
CONCLUSION ET RECOMMANDATIONS 23
BIBLIOGRAPHIE 25
ANNEXES 28
1
I. INTRODUCTION
I.1. Problématique
Le mot « mycorhize » est d'origine grecque et il
traduit la collaboration entre un champignon (myco) et les racines (rhize)
d'une plante. Cette collaboration est une symbiose, car elle résulte
d'une certaine compatibilité entre les deux partenaires (Boullard,
1990).
Dans cette liaison, les champignons bénéficient
des sucres solubles provenant de la photosynthèse de leur partenaire
chlorophyllien (Buyck, 1994). Les champignons sont bénéfiques
pour les plantes en augmentant leur capacité d'absorption d'eau et
d'éléments minéraux essentiels (Raven et al.,
2000). Chez les arbres qui n'ont pas de poils absorbants mais également
chez de nombreuses plantes herbacées, l'absorption de l'eau se fait par
l'intermédiaire de mycorhizes (Lafon et al., 1990).
En plus d'être utile pour la plante et le champignon, la
mycorhize joue un rôle dans divers domaines. L'agriculture et
l'horticulture utilisent désormais les champignons mycorhiziens comme
fertilisant. L'ajout des champignons permet de diminuer les apports d'engrais
chimiques de 15% à 20% (Dechamplain et Gosselin, 2002).
La présence des mycorhizes garantit aux plantes une
meilleure nutrition dans les sols pauvres (Boullard, 1968). Les champignons
ectomycorhiziens sont souvent liés à des essences
forestières (Boullard, 1968). On ne trouve pas n'importe quel champignon
n'importe où. C'est un fait que l'on constate dès que l'on fait
quelques excursions mycologiques (Moreau, 1978).
Au Burundi, peu de données sont actuellement
disponibles sur les champignons ectomycorhiziens, alors qu'ils constituent une
source potentielle de revenus.
Le peu de connaissances en matière de mycorhization au
Burundi nous est connu entre autres aux travaux de Nzigidahera (1993), Buyck
(1994), Sindayihebura (1994), Ntiharirizwa (1996) Nkurunziza(2000), Kakunze
(2006) et Nkengurutse (2012).
Notre étude va se faire sur la forêt claire de
Rumonge, dominée par les arbres du genre Brachystegia, vivant
indiscutablement avec les champignons ectomychorhiziens.
I.2. But et intérêt du travail
C'est dans l'optique de mettre en évidence la
spécificité entre différentes espèces de
champignons et d'arbres que nous avons entrepris une étude
intitulée : « Etude de la spécificité des
champignons ectomycorhiziens pour leurs hôtes: Cas de la forêt
claire à Brachystegia de Rumonge au Burundi»
Il s'agit d'approprier telle espèce de champignons
à telle espèce d'arbre sur base des résultats
observés sur terrain, en notant l'espèce d'arbre dont la racine
est plus proche du champignon. L'intérêt du sujet est d'orienter
les chercheurs et les populations mycophages sur les lieux de récolte de
différentes espèces de champignons. Et partant, un moyen
d'apporter une contribution à la connaissance du phénomène
d'ectomycorhization.
2
I.3. Objectifs spécifiques
Les objectifs poursuivis dans le cadre de cette étude
sont notamment :
- Faire une étude macroscopique des champignons
récoltés.
- Dresser la liste des espèces de champignons
ectomycorhiziens ;
- Montrer l'espèce d'arbre la plus
ectomycorhizée ;
- Confectionner un herbier.
- Montrer l'importance de l'ectomycorhization dans les
écosystèmes forestiers du type
forêts claires.
3
CHAPITRE I : GENERALITES SUR LA SYMBIOSE
ECTOMYCORHIZIENNE
Ectomycorhize (du grecque ektos : au dehors,
mukês : champignon, rhiza : racine) est un complexe
né de l'asssociation symbiotique entre un champignon supérieur et
une racine (Boullard, 1997). L'ectomycorhize qualifie une mycorhize dont la
majeur partie du mycélium fongique (d'ascomycète ou de
basidiomycète) se situe à l'extérieur de la racine de
l'hôte, constituant là un manchon(ou gaine) se prolongeant entre
les cellules de l'ecocortex racinaire en un discret réseau de Hartig
(Boullard, 1997).
I.1. Les différents partenaires de la symbiose
ectomycorhizienne
I.1.1 Les partenaires chlorophylliens
La symbiose ectoycorhizienne ne concerne que 3% des
végétaux vasculaires (Smith et Read, 1997 in Carriconde, 2008).
Les essences ligneuses (Gymnospermes et Angiospermes) ont presque
l'exclusivité de l'élaboration d'ectomycorhizes (Boullard,
1997).
La plupart de ces arbres sont largement
représentés dans les régions tempérées et
boréales des deux hémisphères. Ce sont en particulier les
espèces de la famille des Pinaceae, des Fagaceae, des Betulaceae et des
Salicaceae (Carriconde, 2008). En Afrique tropicale, les espèces
d'arbres ectomycorhizées ont été estimées à
300 (Thoen, 1993). Ces espèces appartiennent aux familles des
Euphorbiaceae (avec le genre Uapaca, actuellement Phyllantaceae) (APG
III, 2009) ; Dipterocarpaceae, Proteaceae et Gnetaceae mais le groupe le plus
large est constitué des Légumineuses avec 12 genres appartenant
aux Caesalpinioidae (Buyck et Watling, 1996 in Nkengurutse, 2012).
Dans la forêt claire de Rumonge, les espèces de
Brachystegia microphylla, Brachystegia bussei,
Brachystegia utilis, Brachystegia spiciformis, Uapaca nitida et Isoberlinia
angolensis sont associées aux champignons ectomycorhiziens (Buyck,
1994).
4
I.1.2. Les partenaires fongiques
En termes de diversité taxonomique, environ 5000
espèces de champignons ont été définies comme
ectomycorhiziennes (Molina et al., 1992 in Carriconde, 2008).
Ces espèces fongiques appartiennent en grande
majorité aux phyla des Basidiomycota et des Ascomycota, et la plupart,
tout particulierement les Basidiomycota forme des fructifications visibles
(Carriconde, 2008).
En Afrique tropicale, les champignons ectomycorhiziens se
retrouvent essentiellement dans les familles des Russulaceae, Amanitaceae,
Cantharellaceae ainsi que chez les Boletales. Les genres Russula, Amanita,
Cantharellus ainsi que la plupart des Bolets sont ectomycorhiziens
(Dicousso et al., 2003).
I.2. Fonction des ectomycorhizes dans la nature
Aucun spécialiste ne met plus en doute
l'intérêt considérable des ectomycorhizes et leur valeur
d'authentiques symbioses harmonieuses, c'est - à -dire d'associations
à bénéfices réciproques (Boullard, 1990).
Contrairement aux champignons saprotrophes, les champignons
mycorhiziques ne peuvent en général extraire l'ensemble des
substances qui sont nécessaires à leur métabolisme,
à partir d'un substrat organique privé de vie plus ou moins en
voie de décomposition microbienne ou fongique (Delmas, 1989). Ils
doivent recevoir les molécules essentielles par le canal de la plante
hôte qui les synthétise grâce à sa fonction
chlorophyllienne (Delmas, 1989). De son union avec un champignon
ectomycorhizien, l'hôte retire de substantiels avantages à savoir
:
? Meilleur approvisionnement en nutriments du sol
? Protection contre les polluants
? Réponse physiologique au stress
? Liaison entre les racines de nombreuses espèces d'arbre
hôtes
? Meilleure résistance aux pathogènes
I.2.1. Meilleur approvisionnement en nutriments du sol
La plante hôte bénéficie des
éléments minéraux (phosphore, azote, calcium, eau,...)
absorbés par les champignons (Buyck, 1994). Le réseau d'hyphes
des mycorhizes s'étend à plusieurs centimètres des racines
colonisées et exploitent donc un volume important de sol avec
efficacité accrue (Raven et al., 2000). Il permet la
rétention de l'Azote et du Phosphore. La sécrétion de
l'acide oxalique augmente la capacité à dégrader le
feldspath pour accéder au Potassium (Grevy, 2011).
L'utilisation des champignons ectomycorhiziens dans
l'agriculture et l'horticulture comme fertilisant permet de diminuer les
apports d'engrais chimiques de 15 à 20%, ce qui fait baisser les couts
relatifs à l'entretien et à l'exploitation des sols et ce, pour
de meilleurs rendements (Dechamplain et Gosselin, 2002).
5
I.2.2. Protection contre les polluants
Les mycorhizes protègent l'arbre des effets toxiques
des polluants. Ces derniers contiennent entre autre des métaux lourds
qui se déposent aussi en forêts. Si certains de ces
éléments, tels le fer, le zinc ou le cuivre, sont indispensables
à la plante, d'autres sont toxiques, comme le plomb, le cadmium, le
nickel, le mercure ou le chrome (Grevy, 2011). Les métaux lourds
n'étant pas décomposables, ils s'accumulent dans la
biosphère et constituent ainsi un danger croissant pour les organismes
vivants. Mais une partie des champignons mycorhiziens y résistent
particulièrement bien, même lorsque leurs teneurs dans le sol sont
élevées. Chez les plantes mycorhizées, ils sont retenus
dans le manteau fongique déjà et ils ne parviennent à la
racine de la plante qu'en quantités réduites. Ici, la mycorhize
est comparable à un filtre (GREVY, 2011).
I.2.3. Réponse physiologique au stress
L'effet des mycorhizes sur la croissance
végétative des plantes est fortement lié aux conditions
d'arrosage et à la fertilité des substrats (IQDHO, 2008). Les
mycorhizes permettent la recolonisation de sites miniers et de grands
chantiers. Elles offrent la capacité à résister en milieu
sec et chaud (38oC) et favorisent l'installation en sol riches en
métaux (Cobalt, Nickel, etc.), pauvres en nutriments (Fer).
L'inoculation ectomycorhizienne corrige la carence en fer des
substrats toxiques (Grevy, 2011). L'inoculation de semis de pin gris fait
augmenter l'accumulation de la biomasse de l'hôte (Bois, 2005). Il a
été démontré sans ambigüité que les
jeunes pins symbiotiques étaient plus grands, plus pesants, plus riches
en azote, en phosphore, en potassium, que les sujets dépourvus
d'ectomycorhizes (Hatch, 1937 in Boullard, 1990).
Les sujets bien équipés de mycorhizes se
révèlent 4 ou5 fois plus grands que ceux dépourvus de
complexes (Boullard, 1968).
Ainsi, les champignons mycorhiziens sont utilisés pour
restaurer des sols perturbés, car ils protègent les racines
contre la sécheresse et fournissent des nutriments et de l'eau aux
plantes, même des sols pauvres comme les sables bitumeux exploités
pour le pétrole (Dechamplain et Gosselin, 2002).
I.2.4. Liaison entre les racines de nombreuses plantes
hôtes
Lorsqu'un même champignon colonise des systèmes
racinaires différents, il peut se produire des échanges de
carbone d'une plante hôte, y compris entre des espèces
différentes (Dechamplain et Gosselin, 2002). Les réseaux
mycéliens améliorent le transfert du carbone, nutriments et eau
(Grevy, 2011). C'est le cas notamment entre des semis de bouleau et de sapin
Douglas, lorsque exposés à des conditions de lumière
différente. Le bouleau fournit du carbone au sapin et ce rapport
représente environ 9,5% de la quantité totale de carbone que fixe
le sapin grâce à la photosynthèse (Dechamplain et Gosselin,
2002).
6
I.2.5. Meilleure résistance aux
pathogènes
Les mycorhizes offrent une protection à l' égard
des champignons pathogènes et des nématodes (Raven et
al., 2000). Elles rendent la plante moins sensible à ces
pathogènes en réduisant la teneur en sucres des racines (Oei,
1993). Cette protection peut se faire par la production de composés
allélopathiques (antibactériens ou antifongiques), c'est-
à dire des composés libérés dans le milieu et
agissant à distance sur des organismes cibles (Carriconde, 2008).
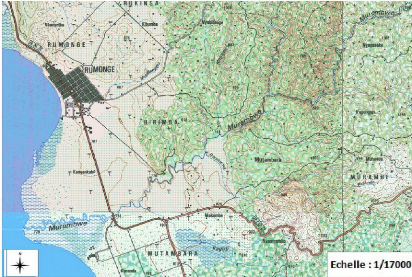
Figure 1 : Zone d'étude (Carte
confectionnée avec le logiciel QGIS)
7
CHAPITRE II : METHODOLOGIE ET MATERIEL
II.1. Présentation de la zone
d'étude
II.1.1. Position géographique
Le travail a été mené dans une forêt
claire à Brachystegia située à Rumonge au
Burundi.
Selon la définition botanique (formulée lors de
la réunion de la Commission de Coopération Technique en Afrique
au Sud du Sahara à Yangambi au Zaïre en 1956), la forêt
claire est une formation végétale constituée
essentiellement par des arbres dont la densité est suffisante pour
entraîner une composition floristique de la strate herbacée
distincte de celle des savanes. Théoriquement, on parlera de forêt
claire et non plus de savane arborée dès que le couvert de la
strate arborée dépasse 60% (Buyck, 1994).
La forêt claire de Rumonge est située au
Sud-Ouest du Burundi en Commune Rumonge de la Province Bururi (figure 2). Sa
superficie est de 600 ha. Elle appartient à l'ensemble des forêts
claires occupant les escarpements côtiers de la partie occidentale du
Sud, partant de Rumonge jusqu' à Nyanza-lac. Elles remontent
jusqu'à l'extrême Nord du Kumoso-Buyogoma contre la
frontière tanzanienne (Nzigidahera, 1993).
Par contre, la matière organique fait souvent
défaut même dans des sols noirs. Ces sols sont durs en saison
sèche et boueux en saison des pluies.
8
II.1.2. Végétation de la forêt claire
de Rumonge à Nyamirambo
D'après une étude réalisée par
Havyarimana (2008), la flore de la forêt claire de Rumonge est
constituée de 109 espèces réparties en 85 genres et 43
familles. C'est un bilan floristique faible comparativement aux autres
écosystèmes forestiers. Malgré la présence des
espèces typiques de la forêt, on remarque la présence des
espèces de savanes qui deviennent surtout abondantes quand le couvert
ligneux disparaît.
Deux espèces occupent une part importante de la surface
de cette forêt. Il s'agit de Brachystegia bussei Harms et
Brachystegia utilis Burtt Davy et Hutch qui ont respectivement des
surfaces terrières moyennes de 8,693 m2/ha et 4,935
m2 /ha. Ce sont les plus abondantes et les plus fréquentes.
Elles appartiennent à la famille des Caesalpiniaceae. Cette famille
s'est avérée la plus territorialiste. Elle présente en
effet une surface terrière égale à 15,453
m2/ha. La famille des Euphorbiaceae est la suivant avec 2,755
m2/ha, lorsque toutes les autres familles ont des surfaces
terrières comprises entre 0,013 et 0,760 m2/ha, soit une
moyenne de 0,3865 m2/ha (Havyarimana, 2008).

Figure 2 : Vue panoramique de la forêt claire de
Rumonge (Photo prise par Nijimbere, 2012)
II.1.3. Pédologie
Selon Lewalle (1972), l'Imbo, région naturelle dans
laquelle se trouve la forêt claire de Rumonge est
caractérisée par des sols alluvionnaires. Ces terres sont riches
en éléments minéraux (Ca, Mg, Na, K), par endroits se
forment même des efflorescences salines.
9
Le sol des forêts claires de Rumonge subit une
érosion superficielle intense laissant souvent un sol squelettique. Le
milieu est caractérisé par une acidité assez
marquée. Les valeurs de pH sont de 4,635 au sommet des collines, 4,98
à proximité des termitières et 5,29 vers la limite de la
forêt (Nzigidahera, 1993).
II.1.4. Le climat
La commune de Rumonge est localisée dans la
région naturelle de l'Imbo, la région la plus chaude du Burundi
avec des températures moyennes supérieures à
23oC (Lasserre ,1979 in Hakizimana, 2005).
Selon les données climatologiques disponibles à
l'Institut Géographique du Burundi de 2005 à 2010, la
température moyenne annuelle est de 27,3°C et la moyenne mensuelle
la plus élevée enregistrée est de 31,44°C. La
température minimale est de 24,3°C.
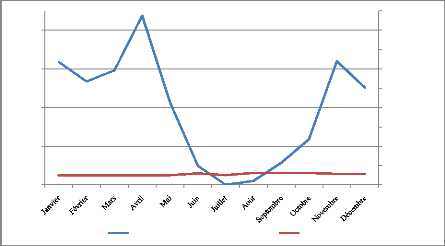
Les précipitations annuelles sont de l'ordre de 1170 mm
avec une saison sèche s'étalant de juin à septembre, et
une saison des pluies qui s'étend du mois d'octobre au mois de
mai(Fig.4).
Températures en °C
200
150
100
50
0
Précipitations en mm Températures en °C
450
400
250
200
350
300
50
0
150
100
Précipitations moyennes en mm
Figure 3: Diagramme ombrothermique de la zone d'étude pour
la période de 2005-
2010(Nijimbere, 2012)
10
II.2. Activités sur terrain
II.2.1. Récolte des champignons et identifications
des espèces d'arbres hôtes
La récolte a été faite le matin de bonne
heure sur quatre collines de la forêt claire de Rumonge. Quand on fait la
récolte des champignons, il y a des précautions à prendre,
par exemple il ne faut pas couper le pied des champignons pour ne ramasser que
le chapeau car on risque de laisser sur place un élément
extrêmement important pour la détermination qui est par exemple la
volve. Un champignon destiné à une étude ne doit jamais
être brisé ou coupé à la base du pied ; mais
récolté entier afin d'en conserver tous les caractères
morphologiques indispensables à son identification précise.
Leur fixation dans le sol, leur vie
éphémère et fragile nécessitent un certain nombre
de précaution. Ainsi, un couteau est utilisé pour déterrer
la partie souterraine afin d'en conserver tous les caractères.
Lors de la récolte il faut regarder sous quel arbre
vous êtes, il y a des affinités particulières entre
certains arbres et certaines espèces de champignons. Il est donc
souhaitable de pouvoir identifier les principales essences d'arbres
courants.
Dans le cas de notre travail, les dessins rappelant la
silhouette des feuilles de certaines espèces de la forêt ont servi
de moyen d'identification (Buyck ,1994). Avec un couteau robuste, il faut
creuser sous le champignon et noter l'espèce d'arbre dont la racine est
la plus proche du sporophore.
Dans un carnet de terrain, on indique le nom de
l'espèce d'arbre devant le numéro du spécimen de
champignon ainsi que le type de sol d'après les études
granulométriques faites
sur les sols de Nkayamba et l'écologie des
différentes espèces d'arbres
hôtes(Nzigidahera ,1993?.
Avant de déterrer le champignon, il faut d' abord prendre une photo de
celui-ci car elle vous fait l'idée lors de l'identification. Le
numéro de la photo est alors gardé dans un carnet. Aussitôt
déterré, il faut noter le goût et l'odeur particuliers
avant de le conserver dans le carton de récolte.
II. 3. Activités après la
récolte
II.3.1. L'étude macroscopique
Elle inclut les observations faites lors de la récolte
comme l'allure du chapeau, l'objectif étant de garder les
caractères ne pouvant plus s'observer après le séchage
ainsi que les mesures relatives à la taille. Ces caractères
concernent entre autres la chair, le chapeau, le stipe et
l'hyménophore.
11
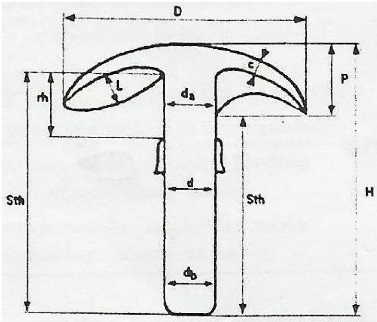
Figure 4 : Différentes parties du champignon
visualisant les caractères macroscopiques mesurés (Eyi Dong
et al., 2011)
Légende :
D : Diamètre du chapeau
H : Hauteur du sporophore
Sth : Hauteur du stipe
P : Hauteur du chapeau
Rh : Hauteur depuis l'anneau jusqu'aux lamelles
da : Diamètre du stipe au sommet
d : Diamètre du stipe au milieu
db : Diamètre du stipe à la base
12
II.3.2 Prise de photos techniques
Sur une plaque à fond neutre, prendre un ou quelques
spécimens en positions différentes, mettre à
côté un papier sur lequel nous inscrivons le numéro
correspondant, et ensuite, prendre soigneusement une photo.
II.3.3. Etude macrochimique
Certains produits chimiques font apparaître de nouvelles
colorations à quelques groupes de
champignons tandis que d'autres restent immuables (Eyi Ndong
et al., 2011).
Nous avons pris un morceau de la chair du champignon et avec une
pipette, nous avons mis
goutte à goutte le produit chimique. Ou la chair se colore
ou elle reste immuable.
Les produits chimiques utilisés sont :
? KOH (Potasse)
? NaOH (Soude caustique)
? Sulfate ferreux ; solution aqueuse à 10%
? NH4OH(Ammoniaque)
II.4.4. Réalisation d'une sporée
La couleur des spores constitue un des caractères les plus
importants pour l'identification des
Basidiomycètes. Sans sa connaissance, la
détermination de l'espèce peut devenir
problématique
pour certains taxons. La couleur des spores est généralement
déterminée en réalisant une sporée.
Néanmoins, si le sporophore collecté a atteint sa
maturité, les spores peuvent aussi être observées en masse
sur le haut du stipe (Eyi Ndong et al., 2011).
Pour chaque champignon, un morceau a été pris et
déposé sur un papier convenable comportant le numéro du
spécimen, les lamelles ou les tubes sont tournés sur le papier.
L'ensemble a été gardé dans un endroit où
l'humidité est favorable au dépôt de spores (une nuit peut
suffire). Le papier avec sporée a été conservé dans
une enveloppe portant le numéro du spécimen. Notons que le
largage des spores peut ne pas survenir surtout quand le champignon n'est pas
mûr.
II.3.5. Identification
Quant à la détermination scientifique, les
ouvrages suivants nous ont servi de références. Il s'agit de :
Russula I (Buyck, 1993), Russula II (Buyck, 1994),
Russula III (Buyck, 1997) de la « Flore illustrée des
champignons d'Afrique centrale. » Genre Lactarius (Heim, 1955),
Cantharellineae (Heinemann, 1959), Boletineae (Heinemann, 1954),
[Amanita, Volvaria] (Beeli, 1935) de la « Flore
iconographique des champignons du Congo ».
II.3.6. Le séchage
Le séchage consiste à placer un morceau de
l'échantillon dans un courant d'air chaud. Ce morceau est
enveloppé dans un sachet pour séchage afin d'éviter les
fumées. Sécher un champignon c'est provoquer l'évaporation
de l'eau qu'il renferme.
13
Le séchage est réalisé grâce
à l'étuve artisanale (Fig.5 (a&b)) et la chaleur est fournie
par une ampoule électrique de 100 watts. Il faut chaque fois faire une
rotation de ces sachets dans différentes étagères surtout
quand on a beaucoup de champignons à sécher.

a b
Figure 5 (a & b) : Photos d'un Séchoir
(Nijimbere, 2011)
II.3.7. Mise en herbier
Les spécimens séchés sont alors
emballés dans des sachets en plastique de type « mini grip »
et rangés avec une étiquette dans l'herbier de la Faculté
des Sciences, Département de Biologie.
L'étiquette porte les informations suivantes :
Nom du récolteur, date de récolte, localité,
végétation, nom de l'espèce.
14
CHAPITRE III : PRESENTATION ET DISCUSSION DES
RESULTATS
III.1. Présentation des résultats
La récolte des champignons ectomycorhiziens a abouti
à 23 espèces reparties dans 7 familles à savoir :
Amanitaceae, Boletaceae, Cantharellaceae, Gyrodontaceae, Russulaceae,
Strobilomycetaceae et Xerocomaceae. Ces espèces se répartissent
en 10 genres : Boletus, Tubosaeta, Tylopilus,
Amanita, Cantharellus, Rubinoboletus,
Lactarius, Russula, Afroboletus et Xerocomus.
La période de récolte couvre les mois de Mai, Novembre,
Décembre l'an 2011 et Janvier, Février, Mars et Avril 2012 soit 7
mois.
Les espèces d'arbres hôtes probables sont :
Brachystegia bussei, Uapaca nitida, Brachystegia microphylla,
Brachystegia utilis, Brachystegia spiciformis et Isoberlinia
angolensis. La description des espèces de champignons et les
silhouettes des différentes espèces d'arbres susceptibles
d'être hôtes se trouvent dans les annexes1&2. Les
données écologiques des différentes espèces
d'arbres hôtes (celles que nous avons pu avoir dans notre documentation)
nous ont aussi permis de déduire différents types de sols.
Toutes ces données sont rassemblées dans le tableau
récapitulatif ci-après (tableau 1).
15
Tableau 1 : Tableau récapitulatif des
données collectées
|
Familles
|
Espèces de champignons
ectomycorhiziens
|
Espèces d'arbres hôtes
|
Types de sol
|
Période de récolte
|
|
1. Boletaceae
|
1. Boletus spectabilissimus Watling
|
Brachystegia utilis Burtt Davy et Hutch
|
Argileux
|
Le 18 Novembre 2011
|
|
|
1. Brachystegia utilis Burtt Davy et Hutch
|
Argileux
|
Le 18 Novembre 2011
|
|
|
2.Brachystegia bussei Harms
|
Limono-argileux
|
|
3.Tylopilus sp. 1
|
Brachystegia bussei Harms
|
Limono-argileux
|
Le 28 Janvier 2012
|
|
4. Tylopilus sp. 2
|
Brachystegia bussei Harms
|
Limono-argileux
|
Le 13 Avril 2012
|
|
2. Amanitaceae
|
1. Amanita pudica Beeli
|
Brachystegia microphylla Harms
|
sablonneux
|
Le 07 Mai 2011
|
|
Brachystegia utilis Burtt Davy et Hutch
|
Argileux
|
Le 17 Novembre 2011
|
|
Uapaca nitida Muell. Arg.
|
-
|
Le 17 Novembre 2011
|
|
Brachystegia utilis Burtt Davy et Hutch
|
Argileux
|
Le 17 Novembre 2011
|
|
|
Brachystegia microphylla Harms
|
sablonneux
|
Le 28 Décembre 2011
|
|
|
3. Cantharellaceae
|
1. Cantharellus symoensii Heinemann
|
1.Brachystegia microphylla Harms
|
sablonneux
|
Le 07 Mai 2011
|
|
2. Uapaca nitida Muell. Arg.
|
-
|
|
|
3.Brachystegia bussei Harms
|
Limono-argileux
|
|
|
2. Cantharellus cyanescens Buyck
|
Brachystegia bussei Harms
|
Limono-argileux
|
Le 27 Décembre 2011
|
16
|
4. Gyrodontaceae
|
1. Rubinoboletus luteopurpureus (Beeli) Heinem. &
Rammeloo
|
1.Brachystegia bussei Harms
|
Limono-argileux
|
Le 07 Mai 2011
|
|
2.Brachystegia microphylla Harms
|
sablonneux
|
|
3. Uapaca nitida Muell. Arg.
|
-
|
|
4 Isoberlinia angolensis
|
-
|
|
2. Rubinoboletus sp.
|
Uapaca nitida Muell. Arg.
|
-
|
Le 12 Avril 2012
|
|
5. Russulaceae
|
1. Lactarius sp.
|
Brachystegia bussei Harms
|
Limono-argileux
|
Le 07 Mai 2011
|
|
Brachystegia utilis Burtt Davy et Hutch
|
Argileux
|
Le 18 Novembre 2011
|
|
Brachystegia bussei Harms
|
Limono-argileux
|
Le 15 Avril 2012
|
|
Uapaca nitida Muell. Arg.
|
-
|
Le 28 Janvier 2012
|
|
Uapaca nitida Muell. Arg.
|
-
|
Le 12 Avril 2012
|
|
Brachystegia spiciformis Benth
|
-
|
Le 07 Mai 2011
|
|
|
Brachystegia bussei Harms
|
Limono-argileux
|
Le 15 Avril 2012
|
|
|
6.Strobilomycetaceae
|
Afroboletus luteolus (Heinemann) Pegler& Young
|
Isoberlinia angolensis
|
-
|
Le 27 Décembre 2011
|
|
7. Xerocomaceae
|
1. Xerocomus subspinulosus Heinem
|
Brachystegia microphylla Harms
|
sablonneux
|
Le 17 Novembre 2011
|
|
|
Brachystegia spiciformis Benth
|
-
|
Le 28 Décembre2011
|
|
Les chiffres 1, 2, 3, ... à côté des
espèces d'arbres indiquent le numéro de l'espèce d'arbre
hôte probable.
17
III.2. Discussion des résultats
III.2.1. Critique méthodologique
Notre étude a été effectuée
uniquement sur 4 collines de la forêt bordant la route Rumonge-Bururi, et
la récolte des champignons se faisait trois jours le mois. Les mois de
Mai, Novembre, Décembre l'an 2011 et Janvier, Février, Mars et
Avril 2012 ont fait objet de la période de récolte.
Le nombre d'espèces et de spécimens pourrait
augmenter avec la surface forestière et la durée de
récolte. Aussi, les études moléculaires d'ADN des
espèces susceptibles d'être symbiotiques qui étaient
prévues n'ont pas abouti, et sans elles, l'attribution de telle
espèce de champignon à telle espèce d'arbre semble
être une problématique. En effet, le sporophore peut provenir du
mycélium de la racine de l'espèce d'arbre situé loin du
sporophore, et donc, l'espèce d'arbre dont la racine est sous le
champignon pourrait ne pas avoir de relation symbiotique avec le champignon. De
ce fait, les résultats ne sont pas retenus exacts mais plutôt
probables.
De plus, nous avons manqué certains ouvrages et
matériel qui nous auraient aidés dans la détermination.
Les études microscopiques n'ont pas été faites et nos
descriptions restent toujours incomplètes. Ainsi, des problèmes
de détermination ont toujours demeuré raison pour laquelle un
certains nombre de nos spécimens est qualifié de « sp.
» par manque de sûreté dans leur
détermination.
III.2.2. Abondance des espèces et leurs familles
Lors de nos récoltes, le nombre d'espèces
identifiées a varié d'une famille à l'autre comme
l'indique le tableau 2.
18
Tableau 2: Abondance des espèces par
famille
|
Familles
|
Nombre d'espèces identifiées
|
Pourcentage
|
|
Amanitaceae
|
5
|
21,7
|
|
Boletaceae
|
4
|
17,4
|
|
Cantharellaceae
|
2
|
8,7
|
|
Gyrodontaceae
|
2
|
8,7
|
|
Russulaceae
|
7
|
30,4
|
|
Strobilomycetaceae
|
1
|
4,3
|
|
Xerocomaceae
|
2
|
8,7
|
Ce tableau 2 montre que la famille des Russulaceae est la plus
abondante (30,4% des espèces) suivie des Amanitaceae (21,7%), des
Boletaceae (17,4%), des Xerocomaceae, Cantharellaceae et Gyrodontaceae (8,7%
chacune), et enfin Strobilomycetaceae (4,3%).
Pour une étude faite par Nzigidahera(1993) à
Nkayamba, les Russules sont représentées à 52,3%, les
Amanites 19%, les Boletales 22,2% et les Cantharelles 4,7%. Dans la
Réserve Forestière de Bururi, les espèces d'Amanites sont
représentées à 10,41% (Nkurunziza, 2000). Dans les
plantations d'essences exotiques du Burundi, 30,4% des espèces
inventoriées dans les plantations d'Eucalyptus sont des Bolets,
les Russules sont à 30,7%, les Amanites à 23%, et les
cantharelles à 7,7% (Nkengurutse, 2012).
III.2.3. Genres et espèces rencontrés
Les espèces récoltées sont
regroupées dans 10 genres à savoir : Boletus,
Tubosaeta, Tylopilus, Amanita, Cantharellus,
Rubinoboletus, Lactarius, Russula, Afroboletus
et Xerocomus. Le tableau 3 suivant nous montre l'abondance des
espèces au sein des genres.
19
Tableau 3: Abondance des espèces au sein de leurs
genres.
|
Genres
|
Nombre d'espèces
|
Pourcentage d'espèces
|
|
Afroboletus
|
1
|
4,3
|
|
Amanita
|
5
|
21,7
|
|
Boletus
|
1
|
4,3
|
|
Cantharellus
|
2
|
8,7
|
|
Lactarius
|
3
|
13,0
|
|
Rubinoboletus
|
2
|
8,7
|
|
Russula
|
4
|
17,4
|
|
Tubosaeta
|
1
|
4,3
|
|
Tylopilus
|
2
|
8,7
|
|
Xerocomus
|
2
|
8,7
|
|
Total
|
23
|
100
|
Le tableau 3 montre le genre Amanita est le plus
représenté (21,7% des espèces) suivi des genres
Russula (avec 17,4% des espèces), Lactarius (avec
13,0% des espèces), Tyopilus, Rubinoboletus et
Xerocomus (avec 8,7% des espèces chacun), et en fin,
Boletus, Tubosaeta et Afroboletus (avec 4,3% des
espèces chacun).
Comparativement aux résultats trouvés ailleurs,
dans les forêts d'Afrique de l'Ouest, les genres Russula,
Lactarius, Amanita, Cantharellus, Inocybe
et Boletus sont parmi les plus représentés
(Ducousso et al., 2003). Dans la partie méridionale du Burkina,
27 espèces ont été mentionnées. (Sanon et
al., 1997 in Ducousso et al., 2003).
III.2.4. La spécificité symbiotique
Du tableau 1, nous déduisons le tableau 4 où
nous indiquons le nombre d'espèces de champignons ectomycorhiziens et le
pourcentage par espèce d'arbre hôte probable.
20
Tableau 4 : Espèces d'arbres et champignons
ectomycorhiziens
|
Espèces d'arbres hôtes
|
Nombre d'espèces de champignons
ectomycorhiziens /23 espèces
identifiées
|
Pourcentage
|
|
Brachystegia bussei
|
9
|
39,1
|
|
Brachystegia microphylla
|
6
|
26,1
|
|
Brachystegia spiciformis
|
2
|
8,7
|
|
Brachystegia utilis
|
5
|
21,7
|
|
Isoberlinia angolensis
|
2
|
8,7
|
|
Uapaca nitida
|
6
|
26,1
|
Les résultats du tableau 4 ci-dessus montrent que
Brachystegia bussei est l'espèce susceptible d'être la
plus ectomycorhizée (à 39,1%), suivie de Uapaca nitida
et Brachystegia microphylla (à 26,1%), Brachystegia
utilis (à 21,7%), Brachystegia spiciformis et
Isoberlinia angolensis (à 8,7% chacun).
Dans les plantations d'essences exotiques du Burundi, 81,2%
des espèces sont trouvées sous Eucalyptus et 18,7% sous
le Pinus (Nkengurutse, 2012).
Le tableau 2 montre des espèces de champignons
appartenant à une seule espèce d'arbres susceptible d'être
hôte et d'autres à plusieurs. Aussi bien les champignons, en
majorité des Basidiomycètes que les arbres peuvent avoir
plusieurs partenaires (Miesch et Sell, 1997). A ce point, nous sommes en accord
avec Tosco(1977) lorsqu' il dit que les champignons qui forment des
associations ectomycorhiziques vivent exclusivement dans le boisement, et
quelques-uns s'unissent à une seule espèce d'arbre, d'autres
à plusieurs.
Les recherches menées en Ecosse ont montré qu'un
seul pin peut développer de 15 à 19 espèces
ectomycorhiziennes (Saari et al., 2005 in Nkengurutse, 2012).
Du tableau 4, il ressort que le genre Brachystegia de
la famille des Caesalpiniaceae est le plus préféré des
champignons ectomycorhiziens. Brachystegia bussei qui est une
espèce abondante de la forêt claire (Havyarimana, 2008) semble
aussi être l'espèce la plus mycorhizée de la forêt
(à 39,1%).
Figure 6: Nombre de spécimens
récoltés durant différentes missions de
terrain
21
La liste des hôtes probables des récoltes
appartenant aux Agaricales, Boletales et Aphyllophorales montre que
Brachystegia microphylla est l'espèce d'arbre la plus
mycorhizée de Nkayamba (Nzigidahera, 1993).Cette espèce vient en
2ème position dans notre travail (tableau 4) et elle est la
plus abondante de la forêt claire de Nkayamba.
Dans les forêts d'Afrique de l'Ouest, les arbres
ectomycorhiziens sont localement diversifiés et/ou abondants. Ils
appartiennent aux familles botaniques des Caesalpiniaceae, Dipterocarpacae et
Uapacaceae (Ducousso et al., 2003).
III.2.5. Les champignons et différentes
périodes de l'année d'étude
L'étude phénologique nous renseigne sur la
période d'apparition, d'abondance et même de disparition des
espèces de champignons étudiés. On précisera ici
que les différentes espèces apparaissent avec la saison des
pluies et disparaissent avec la fin de cette dernière. La disparition
dont il est question ici concerne les sporophores car les mycélia se
conservent dans le sol pour donner de nouveaux sporophores au retour de la
pluie.
La figure 7 ci- après montre la quantité de
spécimens récoltés à certaines périodes de
l'année, lors de nos missions de terrain.
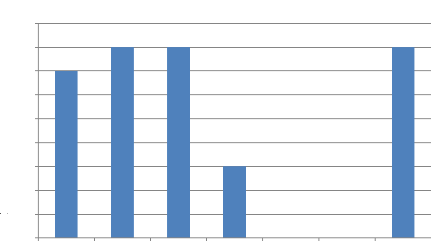
Nombre de spécimens de champignons
récoltés et
décrits
4
2
9
7
6
5
3
0
8
1
|
Du 7 au 10 Mai 2011
|
Du 17 au 20 Novembre
2011
|
Du 27 au 30 décembre
2011
|
Du 28 au 29 janvier 2012
|
Du27 au 28 Février 2012
|
Du 24 au 25 Mars 2012
|
Du 12 au 15 Avril 2012
|
Périodes de récolte
22
La figure 7 montre que les mois de Novembre, Décembre
et Avril sont les mois où nous observons un nombre élevé
de sporophores suivis de Mai, et puis Janvier. Les mois de février et
mars semblent ne pas être favorables à la fructification des
champignons ectomycorhiziens, ce qui serait la conséquence de
l'irrégularité des pluies.
Il n'y a pas eu de récoltes pendant les mois de Juin,
Juillet, Août, Septembre et Octobre parce que les pluies disparaissent
avec Juin et réapparaissent avec Septembre, octobre (Fig. 4) et il faut
un moment pour la croissance du mycélium.
Comparativement aux résultats d' ailleurs, les
meilleurs périodes de récoltes sont successivement le mois de
Décembre, Avril, Mars, Janvier, Février (Nzigidahera, 1993)
Cela pourrait être la conséquence des changements
saisonniers. Pour Sindayihebura, 1994, ces périodes de récolte
sont successivement le mois de Décembre, Mai, Janvier, Avril, Mars,
Février et Novembre.
III.2.6. Spécificité granulométrique
des champignons ectomycorhiziens
Les études granulométriques faites sur les sols
de Nkayamba ont montré que Brachystegia microphylla
s'établit sur des sols sablonneux, Brachystegia bussei sur
des sols limono-argileux, Brachystegia utilis sur des sols argileux
selon Nzigidahera(1993).
Des résultats du tableau 1, nous déduisons
l'écologie des champignons (tableau 5).
Tableau 5 : Ecologie des champignons ectomycorhiziens
en fonction de la granulométrie
|
Types de sols
|
Nombre d'espèces de
champignons
ectomycorhiziens
|
Pourcentage
|
|
Sols limono-argileux
|
9
|
47,4
|
|
Sols argileux
|
5
|
26,3
|
|
Sols sablonneux
|
5
|
26,3
|
|
Total
|
19
|
100
|
Ces résultats montrent que 47,4% de champignons
ectomycorhiziens préfèrent un sol limono-argileux, 26,3% un sol
argileux et 26,3% restants un sol sablonneux.
En tenant compte de la granulométrie du sol et
l'écologie des différentes espèces d'arbres, le tableau 5
montre que beaucoup d'espèces fongiques préfèrent un sol
limono-argileux alors que l'étude effectuée par Nzigidahera, 1993
révèle une préférence marqué pour des sols
sablonneux.
23
CONCLUSION ET RECOMMANDATIONS Conclusion
La forêt claire de Rumonge est riche en espèces
fongiques. Les 23 espèces inventoriées se repartissent en 10
genres (Boletus, Tubosaeta, Tylopilus, Amanita,
Cantharellus, Rubinoboletus, Lactarius,
Russula, Afroboletus et Xerocomus), en 7 familles
à savoir : Amanitaceae, Boletaceae, Cantharellaceae, Gyrodontaceae,
Russulaceae, Strobilomycetaceae et Xerocomaceae.
Les espèces de la famille des Russulaceae sont les plus
abondantes avec 30,4% des espèces, celles des Amanitaceae suivent avec
21,7%, celles des Boletaceae sont à 17,4%, celles des Xerocomaceae,
Cantharellaceae et Gyrodontaceae représentent chacune 8,7%, et celles
des Strobilomycetaceae 4,3%.
Le présent travail a permis d'approprier les
différentes espèces de champignons à leurs espèces
d'arbres hôtes probables. Les résultats montrent que 39,1% des
espèces de champignons sont en symbiose avec Brachystegia
bussei, 26,1% avec Uapaca nitida, 26,1% avec Brachystegia
microphylla, 21,7% avec Brachystegia utilis, 8,7% avec
Brachystegia spiciformis, et 8,7% avec Isoberlinia
angolensis. Donc, Brachystegia bussei est l'espèce
susceptible d'être la plus ectomycorhizée de la forêt claire
de Rumonge.
La documentation utilisée n'a pas permis la
détermination de tous les spécimens récoltés.
Ainsi, un certain nombre de ces derniers est qualifié de « sp.
» par manque de sûreté dans leur détermination.
Les mois de Novembre, Décembre et Avril sont les plus
favorables à la fructification des champignons.
Comme la période de fructification n'est pas la
même pour toutes les espèces fongiques, une seule saison ne suffit
pas pour une telle étude, il faut donc beaucoup d'observations à
différentes périodes de l'année.
24
Recommandations
De ce travail, nous retenons que les champignons
ectomycorhiziens ont une importance capitale dans le développement des
écosystèmes forestiers. Cela nous amène à
suggérer un certain nombre d'actions qui doivent être
menées par tous les intervenants et qui contribueront positivement au
maintien des écosystèmes forestiers, comme ces forêts
claires.
Ainsi, nous recommandons :
? A l'Etat :
· d'augmenter le budget destiné au
ministère de l'Eau, Environnement, Aménagement du territoire et
Urbanisme afin de valoriser les écosystèmes forestiers jusqu'ici
non bien entretenus.
? A l'INECN :
· de protéger les espèces symbiotiques des
écosystèmes forestiers.
? Aux chercheurs :
· de mener d'autres études en matière de
la spécificité symbiotique, afin de nous compléter, par
des études moléculaires d'ADN des espèces symbiotiques en
vue d'enrichir la connaissance mycologique.
· Etant donné que nos échantillons sont
maintenant conservés en herbier du Département de Biologie, nous
recommandons que les études microscopiques approfondies soient
menées afin de pouvoir nous compléter et identifier les
espèces restées indéterminées.
? A la population environnante des forêts
claires, en particulier la forêt claire de Rumonge :
· de respecter les forêts claires, en veillant
à ne pas les exploiter d'une façon irrationnelle.
· de former des associations bien reconnues pour la
récolte et la vente des champignons.
25
BIBLIOGRAPHIE
1. APG III, 2009 : Classification phylogénétique
par Angiosperms Phylogeny Group.
2. Beeli, M., 1935: [Amanita, Volvaria], Flore
Iconographique des champignons du Congo 1 : 12 -25.
3. Boullard, B., 1968: Les mycorhizes. Collection de
Monographie de Botanique et de Biologie végétale. Masson, Paris,
135p.
4. Boullard, B., 1990 : Dictionnaire de Botanique,
Université de Rouen/Haute-Normandie, 398 p.
5. Boullard, B., 1990 : Guerre et paix dans le Règne
Végétal, Rue Bargue 75015, paris, 336p.
6. Buyck, B., 1993: Russula I (Russulaceae):
239-408. Fig. 210-257; Pl. 55-68.
7. Buyck, B., 1994: Russula II (Russulaceae):
411-539. Fig. 258-351; Pl. 69-87.
8. Buyck, B., 1994: « Ubwoba », Les champignons
comestibles de l'Ouest du Burundi. Publication Agricole, Bruxelles, 124 p.
9. Buyck, B., 1997: Russula III (Russulaceae):
545-.598. Fig. 352-364; Pl. 88-93.
10. Carriconde, F., 2008 : Dispersion et colonisation chez le
champignon ectomycorhizien, Thèse pour obtenir le grade de docteur de
l'Université de Toulouse III-Paul Sabatier. U.F.R. Sciences de la vie et
de la terre, 130 p.
11. Dechamplain, N. et Gosselin, L., 2002 : Les champignons
mycorhiziens, Université de Laval, 12p.
12. Delmas, J., 1989 : Les champignons et leur culture :
Flammaraison, La Maison Rustique, Paris, 970 p.
13. Ducousso, M., Bã, A.M. et Thoen, D., 2003 : Les
champignons ectomycorhiziens des forêts naturelles et des plantations
d'Afrique de l'Ouest, une source de champignons comestibles, Laboratoire des
symbioses tropicales et méditerranéennes, TA 10/J34398
Montpellier Cedex France, 63p.
14. Eyi Ndong, H., Degreef, J. & De Kessel, A., 2011:
Champignons comestibles des forêts denses d'Afrique Centrale, 253p
15. Gregory, B., 2005 : Ecophysiologie de semis de
conifères ectomycorhizés en milieu salin et sodique, Thèse
présentée à la faculté des études
supérieurs de l'Université de Laval de le cadre du programma de
doctorat en sciences forestière pour l'obtention du grade de
Philosophiae Doctor (Ph.D.) Département des Sciences en Bois et de la
forêt, Faculté de foresterie et Géomatique,
Université Laval, Quebec, 186p.
26
16. Grevy, M.F., 2011 : Entre sol et forêt : Les
champignons, Séminaire final-Projet européen Mycosylva,
Valladolid, Espagne, 21 p.
17. Hakizimana, D., 2005 : Détermination de la valeur
nutritive des champignons comestible sauvage à Rumonge. Mémoire
présenté et défendu publiquement en vue de l'obtention du
grade de Licence en Sciences Biologiques, Université du Burundi, 67
p.
18. Havyarimana, F., 2008 : Etude floristique et structurale
de la forêt claire de Rumonge. Mémoire présenté et
défendu publiquement en vue de l'obtention du Diplôme d'Etudes
spécialisés en Gestion de l'environnement. Université du
Burundi, 54 p.
19. Heim, R., 1955 : Genre Lactarius :
4ème fascicule, 81-98, Pl. 13-15
20. Heinamann, P., 1954 : Boletineae : 49-80. Pl. 9-12.
21. Heinamann, P., 1959 : Cantharellineae 153-166, Pl. 26-28
: Flore iconographique des champignons du Congo.
22. IGEBU, 2012 : Données climatologiques. Institut
Géographique du Burundi.
23. IQDHO, 2008 : Evaluation des effets de la présence
des mycorhizes dans le terreau pendant et après le cycle de la
production d'annuelles en paniers suspendus, Rapport final du projet
réalisé dans le cadre du Programme de Soutien à
l'Innovation Horticole du ministère de l'Agriculture, des Pêches
et de l'Alimentation du Québec, 67p.
24. Kakunze, A., 2003 : Contribution à l'Etude
systématique des champignons ectomycorhiziques de la forêt claire
de KIGWENA. Mémoire présenté pour l'obtention de Licence
en Sciences Biologiques. Université du Burundi, 61p.
25. Lafon, P., Tharaud-Prayer, C. et Levy, G., 1990 :
Biologie des plantes cultivées, 11, rue Lavoisier- F 75384 Paris CEDEX
08, 238 p.
26. Lewalle, J., 1972 : Les étages de la
végétation du Burundi occidentale, Travaux de l'Université
Officielle de Bujumbura, 173 p.
27. Miesch, R. et Sell, Y., 1997 : Botanique
générale, Facultés des Sciences de la vie,
Université Louis Pasteur, Strasbourg, 602 p.
28. Moreau, C., 1978 : Larousse des champignons. 17, Rue de
Mont Parnasse, Paris, 327p.
29. Nkengurutse, J., 2012 : Contribution à
l'étude de la mycoflore ectomycorhizienne associée aux
plantations d'essences exotiques du Burundi. Mémoire
présenté et défendu pour l'obtention du grade de Master en
Sciences, Université Libre de Bruxelles, 67p.
30. Nkurunziza, D., 2000 : Contribution à
l'étude systématique et écologique des champignons
homobasidiomycètes de la réserve naturelle forestière de
Bururi.
27
Mémoire présenté en vue de l'obtention du
grade d'Ingénieur Industriel. Gitega, Université du Burundi,
Institut Supérieur d'Agriculture, 93 p.
31. Ntiharirizwa, E., 1996 : Contribution à
l'étude systématique des champignons ectomycorhiziques dans les
écosystèmes naturels forestiers de GISAGARA (CANKUZO Est),
Mémoire présenté et soutenu publiquement en vue de
l'obtention du grade d'Ingénieur Industriel, Option : Génie
Rural, Eaux et Forêts(GREF), Gitega-Université du Burundi,
Institut Supérieur d'Agriculture, 122 p.
32. Nzigidahera, B., 1993: Contribution à
l'étude systématique et écologique des champignons
ectomycorhiziques de la forêt claire de NKAYAMBA (Rumonge, Burundi).
Mémoire présenté pour l'obtention de Licence en sciences
Biologiques. Université du Burundi, 146 p.
33. Oei, P., 1993: La culture des champignons. Paris et Tool,
Amsterdam, 318 p.
34. Raven, P.H., Evert, R.F. et Eichhorn, S.E., 2000 :
Biologie végétale, Rue des Minimes, 39-B-1000 Bruxelles, 944
p.
35. Sindayihebura, N., 1996 : Contribution à
l'étude des Bolétales au Burundi, Mémoire
présenté pour l'obtention de Licence en sciences Biologiques.
Université du Burundi, 83 p.
36. Tosco, U., 1977 : Les champignons, Editions Atlas, s.a.r.l,
Paris, 90 p.
ANNEXES
29
Annexe 1 : descriptions des espèces
récoltées I. Famille des Amanitaceae
1. Amanita pudica Beeli (NG001)

Figure 1: Amanita pudica Beeli (NG001):
Photo: Nijimbere,2011
Ecologie : espèce trouvée sous Brachystegia
microphylla Harms.
Date de récolte : le 07/05/2011
Solitaire, stipité, amanitoïde.
SPOREE : blanche, hauteur du pied 67 mm.
CHAPEAU : diamètre 50 mm convexe, surface uniforme, marge
ondulée. PILEIPELLIS à la marge juste, non séparable,
épais, humide, glabre mat.
CHAIR DU CHAPEAU : charnu, de couleur uniforme, goût :
doux, odeur : fongique.
PIED : diamètre au sommet 7 mm, diamètre au centre
5 mm, diamètre à la base
6 mm central, séparable, surface uniforme.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût doux, odeur
fongique.
VOILE PARTIEL : absent.
VOILE UNIVERSEL :
présent.
HYMENOPHORE : lamellé.
LAMELLES : très espacées. REACTIONS : nulles.
Ce champignon non comestible.
30
2. Amanita sp. 1 (NG008)

Figure 2 : Amanita sp. 1 (NG008) :
Photo: Nijimbere,2011
Ecologie : espèce trouvée sous Brachystegia
utilis Burtt Davy et Hutch, sol un peu humide et riche en humus.
Date de récolte : le 17/11/2011
Solitaire, stipité, amanitoïde.
SPOREE : blanche, hauteur 90 mm.
CHAPEAU : diamètre 87 mm concave, surface uniforme.
PILEIPELLIS à la marge trop court, séparable,
épais, humide.
CHAIR DU CHAPEAU : membraneux, goût : fongique, odeur :
fongique.
PIED : diamètre au sommet 10 mm, diamètre au centre
15 mm, diamètre à la
base 19 mm central.
STIPITIPELLIS humide, glabre luisant, couleur uniforme. CHAIR DU
PIED : plein, charnu, goût doux, odeur fongique. VOILE PARTIEL :
absent VOILE UNIVERSEL : présent.
HYMENOPHORE : lamellé.
LAMELLES : blanches.
REACTIONS : pied avec NaOH : jaune.
Ce champignon n'est pas comestible.
31
3. Amanita sp. 2 (NG010)

Figure 3: Amanita sp. 2 (NG010) :
Photo: Nijimbere,2011
Ecologie : espèce trouvée sous Uapaca
nitida, sol un peu humide et riche en
humus.
Date de récolte : le 17/11/2011
Solitaire, stipité.
SPOREE : jaune pale, hauteur 87 mm.
CHAPEAU : diamètre 90 mm convexe.
PILEIPELLIS à la marge juste, séparable, humide.
CHAIR DU CHAPEAU : membraneux, goût : fongique, odeur :
fongique.
PIED : diamètre au sommet 15 mm, diamètre au centre
17 mm, diamètre à la
base 19 mm central, séparable.
STIPITIPELLIS collant.
CHAIR DU PIED : caverneux, charnu, goût doux, odeur
fongique.
VOILE PARTIEL : présent.
HYMENOPHORE : lamellé.
LAMELLES: blanches.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
32
4. Amanita sp. 3
(NG011)

Figure 8: Amanita sp. 3 (NG011) :
Photo: Nijimbere,2011
Ecologie : espèce trouvée sous Brachystegia
utilis Burtt Davy, riche en humus.
Date de récolte : le 17/11/2011
Solitaire, stipité, amanitoïde.
SPOREE : blanche, hauteur 95 mm.
CHAPEAU : diamètre 63 mm plat.
PILEIPELLIS à la marge juste, séparable,
mucilagineux.
CHAIR DU CHAPEAU : spongieux, goût : fongique, odeur :
fongique.
PIED : diamètre au sommet 10 mm, diamètre au
centre 10 mm, diamètre à la
base 10 mm central, séparable.
STIPITIPELLIS humide, glabre luisant.
CHAIR DU PIED : plein, charnu, goût fongique, odeur
fongique.
VOILE PARTIEL :
présent,
VOILE UNIVERSEL : présent.
HYMENOPHORE : lamellé.
LAMELLES: blanches.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
33
5. Amanita loosii Beeli
(NG021)

Figure 5: Amanita loosii Beeli (NG021)
: Photo: Nijimbere,2011
Ecologie : espèce trouvée sous Brachystegia
microphylla Harms, sol un peu
humide, riche en humus, végétation de
fougères.
Date de récolte : le 28/12/2011
Grégaire, stipité, amanitoïde.
SPOREE : jaune pale, hauteur 110 mm.
CHAPEAU : diamètre 130 mm plan, surface uniforme.
PILEIPELLIS à la marge juste, séparable
jusqu'à mi rayon, épais, humide.
CHAIR DU CHAPEAU : charnu, goût : doux, odeur :
fongique.
PIED : diamètre au sommet 20 mm, diamètre au centre
20 mm, diamètre à la
base 30 mm central, non séparable.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût doux, odeur
fongique.
VOILE PARTIEL : absent,
VOILE UNIVERSEL : absent.
HYMENOPHORE : lamellé.
LAMELLES : blanches.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
34
II. Famille des Boletaceae Chevalier
6. Boletus spectabilissimus Watling
(NG014)

Figure 6: Boletus spectabilissimus Watling
(NG014) : Photo: Nijimbere,2011
Ecologie : espèce trouvée sous Brachystegia
utilis Burtt Davy et Hutch, sol un
peu humide et riche en humus.
Date de récolte : le 18/11/2011
Solitaire, stipité, boletoïde.
SPOREE : non obtenue, hauteur 95 mm.
CHAPEAU : diamètre 25 mm convexe, surface uniforme.
PILEIPELLIS à la marge excédent, non
séparable, humide, glabre mat.
CHAIR DU CHAPEAU : charnu, goût : amer, odeur :
fongique.
PIED : diamètre au sommet 25 mm, diamètre au centre
40 mm, diamètre à la
base 35 mm central, non séparable.
STIPITIPELLIS humide, taches éparses.
CHAIR DU PIED : plein, charnu, goût amer, odeur
fongique.
HYMENOPHORE : tubulé.
TUBES: jaunes.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
35
7. Tubosaeta brunneosetosa (Singer) E.
Horak (NG015; NG020, NG032)

Figure 7: Tubosaeta brunneosetosa
(Singer) E. Horak (NG015) : Photo: Nijimbere,2011
Ecologie : espèce trouvée sous Brachystegia
utilis Burtt Davy et Hutch Brachystegia bussei Harms, sol un peu
humide, riche en humus.
Date de récolte : le 18/11/2011
Grégaire ou solitaire, stipité, boletoïde.
SPOREE : orange, hauteur 35-50 mm.
CHAPEAU : diamètre 45-50 mm convexe, surface uniforme.
PILEIPELLIS à la marge juste, non séparable,
épais, humide, taches éparses. CHAIR DU CHAPEAU : charnu,
goût : amer, odeur : fongique.
PIED : diamètre au sommet 10-15 mm, diamètre au
centre 6-12 mm, diamètre à la base 5-16 mm central, non
séparable, surface rugueuse.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût amer, odeur fongique,
couleur uniforme. HYMENOPHORE : tubulé.
TUBES : jaunes ou mauves.
REACTIONS : Chapeau ; chapeau (contexte) ; pied et pied
(contexte) avec NaOH, NH4OH : orange ou rose.
Ce champignon n'est pas comestible.
36
8. Tylopilus sp.1 (NG025)

Figure 8: Tylopilus sp.1 (NG025):
Photo: Nijimbere, 2012
Ecologie : espèce trouvée sous Brachystegia
bussei Harms, sol un peu humide, riche en humus.
Date de récolte : le 28/01/2012
Solitaire, stipité, boletoïde.
SPOREE : orange, hauteur 59 mm.
CHAPEAU : diamètre 69 mm convexe, surface
striée.
PILEIPELLIS à la marge un peu excédent,
séparable, humide, glabre mat.
CHAIR DU CHAPEAU : charnu, goût : doux, odeur :
fongique.
PIED : diamètre au sommet 14 mm, diamètre au centre
15 mm, diamètre à la
base 14 mm central, séparable.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût amer, odeur
fongique.
HYMENOPHORE : tubulé.
TUBES : brunes foncées.
REACTIONS : chapeau ; chapeau (contexte) ; pied (contexte) ;
hyménophore avec NaOH : vert.
Ce champignon n'est pas comestible.
37
9. Tylopilus sp. 2 (NG031)

Figure 9: Tylopilus sp. 2 (NG031):
Photo: Nijimbere, 2012
Ecologie : espèce trouvée sous Brachystegia
bussei Harms, sol un peu humide, riche en humus.
Date de récolte : le 13/04/2012
Solitaire, stipité, boletoïde.
SPOREE : non obtenue, hauteur 40 mm.
CHAPEAU : diamètre 60 mm concave, surface uniforme.
PILEIPELLIS à la marge juste, non séparable,
humide, glabre mat. CHAIR DU CHAPEAU : charnu, goût : acre, odeur :
humique.
PIED : diamètre au sommet 10 mm, diamètre au centre
5 mm, diamètre à la base 6 mm central, séparable.
STIPITIPELLIS sec, glabre mat.
CHAIR DU PIED : plein, charnu, goût acre, odeur humique.
HYMENOPHORE : tubulé.
REACTIONS : chapeau, chapeau (contexte), pied, pied (contexte),
hyménophore avec NaOH : brune, NH4OH : brune.
Ce champignon n'est pas comestible.
38
III. Famille des Canthalleraceae Schroet
10. Cantharellus symoensii Heinemann
(NG007; NG018; NG028)

Figure 10: Cantharellus symoensii Heinemann
(NG028) : Photo: NIJIMBERE, 2011
Ecologie : espèce trouvée sous Brachystegia
microphylla Harms, Brachystegia bussei Harms, Uapaca nitida
Muel. Arg., sol un peu humide et riche en humus.
Date de récolte : le 07/05/2011
Solitaire ou grégaire, stipité,
cantharelloïde.
SPOREE : orange, hauteur 35-82 mm.
CHAPEAU : diamètre 35-55 mm concave.
PILEIPELLIS à la marge juste, séparable,
épais, humide.
CHAIR DU CHAPEAU : charnu, de couleur blanche, goût : doux,
odeur : fongique.
PIED : diamètre au sommet 15mm, diamètre au centre
8-15 mm, diamètre au centre 8-15 mm, diamètre à la base
7-8 mm central, séparable.
STIPITIPELLIS humide ou gluant, glabre mat.
CHAIR DU PIED : creux, goût doux, odeur fongique.
HYMENOPHORE : lamellé. LAMELLES : oranges.
REACTIONS : nulles.
Ce champignon est comestible.
39
11. Cantharellus cyanescens Buyck
(NG019)

Figure 11: Cantharellus cyanescens Buyck
(NG019) : Photo: Nijimbere, 2011
Ecologie : espèce trouvée sous Brachystegia
bussei Harms, sol un peu humide,
riche en humus.
Date de récolte : le 27/12/2011
Grégaire, stipité, cantharelloïde.
SPOREE : non obtenue, hauteur 36 mm.
CHAPEAU : diamètre 45 mm infundibuliforme, surface
pliciforme.
PILEIPELLIS à la marge juste, non séparable,
charnu, humide.
CHAIR DU CHAPEAU : charnu, goût : doux, odeur :
fongique.
PIED : diamètre au sommet 10 mm, diamètre au centre
5 mm, diamètre à la base
8 mm central, non séparable.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : creux, charnu, goût doux, odeur
fongique.
HYMENOPHORE : lamellé.
LAMELLES : jaunes foncées.
REACTIONS : nulles.
Ce champignon est comestible.
40
IV. Famille des Gyrodontaceae (Sing.) Heinem.
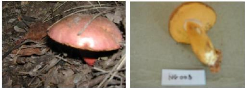
12. Rubinoboletus luteopurpureus
(Beeli) Heinem. & Rammeloo (NG002 ; NG003, NG004,
NG016, NG024, NG030)
Figure 12: Rubinoboletus luteopurpureus (Beeli)
Heinem. & Rammeloo (NG0024) : Photo: NIJIMBERE, 2011
Ecologie : espèce trouvée sous Isoberlinia
angolensis (BENTH) HOYLE & BRENAM, Brachystegia bussei
Harms, Brachystegia microphylla
Harms, Uapaca nitida Muel. Arg., sol caillouteux et
riche en
humus.
Date de récolte : le 07/05/2011
Grégaire, stipité, boletoïde.
SPOREE : blanche, hauteur du pied 35-65 mm,
CHAPEAU : diamètre 35-150 mm convexe, surface uniforme.
PILEIPELLIS à la marge juste, séparable,
épais, humide, glabre mat.
CHAIR DU CHAPEAU : charnu, de couleur uniforme, goût :
amer, odeur : fongique.
PIED : diamètre au sommet 13-31mm, diamètre au
centre 12-29 mm, diamètre à la base 10-18 mm central, non
séparable, surface uniforme.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût doux, odeur fongique,
couleur uniforme.
HYMENOPHORE : tubulé.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
41
13. Rubinoboletus sp. (NG029)

Figure 13: Rubinoboletus sp. (NG029):
Photo: Nijimbere, 2012
Ecologie : espèce trouvée sous Uapaca nitida
Muell. Arg., sol un peu humide,
riche en humus.
Date de récolte : le 12/04/2012
Solitaire, stipité.
SPOREE : non obtenue, hauteur 35 mm.
CHAPEAU : diamètre 110 mm plan, surface
fissurée.
PILEIPELLIS à la marge juste, non séparable,
humide, écailleux.
CHAIR DU CHAPEAU : charnu, goût : doux, odeur :
fongique.
PIED : diamètre au sommet 39 mm, diamètre au centre
37 mm, diamètre à la
base 26 mm central, non séparable.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût doux, odeur
fongique.
HYMENOPHORE : tubulé.
TUBES : blanches.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
42
V. Famille des Russulaceae Lotsy 14. Lactarius
sp. (NG005)

Figure 14: Lactarius sp. (NG005) :
Photo: Nijimbere, 2011 Ecologie : espèce trouvée sous
Brachystegia bussei Harms.
Date de récolte : le 07/05/2011
Solitaire, stipité.
SPOREE : pas obtenue, hauteur du pied 55 mm,
CHAPEAU : diamètre 48mm plan concave, surface uniforme.
PILEIPELLIS à la marge juste, non séparable, sec,
glabre mat.
CHAIR DU CHAPEAU : charnu, de couleur uniforme, goût :
doux, odeur : fongique.
PIED : diamètre au sommet 10 mm, diamètre au centre
10 mm, diamètre à la base 16 mm central, non séparable,
surface uniforme.
STIPITIPELLIS sec, glabre mat.
CHAIR DU PIED : plein, charnu, goût doux, odeur
fongique.
LATEX : présent.
HYMENOPHORE : lamellé.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
43
15. Lactarius pelliculatus
(Beeli) Buyck (NG012;
NG013)

Figure 15: Lactarius pelliculatus (Beeli) Buyck
(NG012): Photo: Nijimbere, 2011
Ecologie : espèce trouvée sous Brachystegia
utilis Burtt Davy et Hutch, sol
riche en humus.
Date de récolte : le 18/11/2011
Solitaire, stipité.
SPOREE : blanche, hauteur 70-100 mm.
CHAPEAU : diamètre 75 mm concave.
PILEIPELLIS à la marge juste, non séparable,
sec.
CHAIR DU CHAPEAU : charnu, goût : amer, odeur :
fongique.
PIED : diamètre au sommet 10-20 mm, diamètre au
centre 15-20 mm, diamètre
à la base 12-15 mm central, non séparable.
STIPITIPELLIS humide, taches éparses.
CHAIR DU PIED : plein, fragile, goût amer, odeur
fongique.
HYMENOPHORE : lamellé.
LAMELLES : blanches.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
44
16. Russula flavobrunnea Buyck
(NG026)

Figure 16: Russula flavobrunnea Buyck
(NG026): Photo: Nijimbere, 2012
Ecologie : espèce trouvée sous Uapaca
nitida, sol un peu humide, riche en
humus.
Date de récolte : le 28/01/2012
Solitaire, stipité.
SPOREE : non obtenue, hauteur 25 mm.
CHAPEAU : diamètre 40 mm convexe, surface uniforme.
PILEIPELLIS à la marge un peu excédent,
séparable, glabre mat.
CHAIR DU CHAPEAU : charnu, goût : fongique, odeur :
fongique.
PIED : diamètre au sommet 12 mm, diamètre au centre
11mm, diamètre à la
base 6 mm central, non séparable.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût doux, odeur
fongique.
HYMENOPHORE : lamellé.
LAMELLES : jaunes pales.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
45
17. Russula cellulata Buyck
(NG027)

Figure 17: Russula cellulata Buyck (NG027)
: Photo: Nijimbere,2012
Ecologie : espèce trouvée sous Uapaca nitida
Muell. Arg., sol un peu humide, riche en humus.
Date de récolte : le 12/04/2012
Solitaire, stipité.
SPOREE : non obtenue, hauteur 80 mm.
CHAPEAU : diamètre 90 mm plan, surface fissurée.
PILEIPELLIS à la marge juste, séparable, sec, glabre mat. CHAIR
DU CHAPEAU : charnu, goût : doux, odeur : nul.
PIED : diamètre au sommet 18 mm, diamètre au centre
17 mm, diamètre à la base 12 mm central.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût doux, odeur nul.
HYMENOPHORE : lamellé.
LAMELLES : blanches.
REACTIONS : chapeau, chapeau (contexte), pied, pied (contexte),
hyménophore avec NaOH : jaune.
(Contexte) avec, NH4OH: vert.
Ce champignon est comestible.
46
18. Russulas sp. 1 (NG006)

Figure 18: Russula sp. 1 (NG006) :
Photo: Nijimbere,2011
Ecologie : espèce trouvée sous Brachystegia
spiciformis Benth.
Date de récolte : le 07/05/2011
Solitaire, cespiteux.
SPOREE : blanche, hauteur du pied 130 mm.
CHAPEAU : diamètre 110 mm convexe.
PILEIPELLIS à la marge juste, non séparable,
épais, humide.
CHAIR DU CHAPEAU : charnu, de couleur uniforme, goût :
doux, odeur :
fongique.
PIED : diamètre au sommet 50 mm, diamètre au centre
40 mm, diamètre à la
base 40 mm central, non séparable.
STIPITIPELLIS humide, squamuleux.
CHAIR DU PIED : plein, charnu, goût doux, odeur
fongique.
HYMENOPHORE : lamellé.
LAMELLES : blanches.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
47
19. Russsula sp. 2 (NG034)

Figure 19: Russula sp. 2 (NG034) :
Photo: Nijimbere,2012
Ecologie : espèce trouvée sous Brachystegia
bussei Harms, sol un peu humide,
riche en humus.
Date de récolte : le 15/04/2012
Grégaire, stipité, pleurotoïde.
SPOREE : non obtenue, hauteur 35 mm.
CHAPEAU : diamètre 70 mm plan, surface uniforme.
PILEIPELLIS à la marge juste, non séparable,
humide, glabre mat.
CHAIR DU CHAPEAU : charnu, goût : fongique, odeur :
fongique.
PIED : diamètre au sommet 20 mm, diamètre au centre
19 mm, diamètre à la
base 15 mm central, séparable.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût fongique, odeur
fongique.
HYMENOPHORE : lamellé.
LAMELLES : jaunes pales.
REACTIONS: nulles.
Ce champignon n'est pas comestible.
48
20. Lactarius inversus Gooss. &
Heim (NG035)

Figure 20: Lactarius inversus Gooss. & Heim
(NG035): Photo: Nijimbere, 2011
Ecologie : espèce trouvée sous
Brachystegia bussei Harms, sol un peu humide,
riche en humus.
Date de récolte : le 15/04/2012
Solitaire, stipité.
SPOREE : blanche, hauteur 45 mm.
CHAPEAU : diamètre 50 mm concave, surface uniforme.
PILEIPELLIS à la marge trop court, non séparable,
humide, glabre mat.
CHAIR DU CHAPEAU : charnu, goût : acre, odeur : humique.
PIED : diamètre au sommet 11 mm, diamètre au centre
5 mm, diamètre à la base
8 mm central, non séparable.
STIPITIPELLIS humide, glabre mat.
CHAIR DU PIED : plein, charnu, goût acre, odeur humique.
HYMENOPHORE : lamellé.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
49
VI. Famille des Strobilomycetaceae
21. Afroboletus luteolus (Heinemann) Pegler&
Young (NG017 ; NG023)

Figure 21: Afroboletus luteolus (Heinemann)
Pegler& Young (NG017): Photo: Nijimbere, 2011
Ecologie : espèce trouvée sous Isoberlnia
angolensis(BENTH) HOYLE& BRENAM, sol un peu humide, riche en humus.
Date de récolte : le 27/12/2011
Solitaire, stipité, boletoïde.
SPOREE : jaune pale, hauteur 129- 133 mm.
CHAPEAU : diamètre 83 mm mamelonné, surface
rugueuse.
PILEIPELLIS à la marge un peu excédent,
séparable seulement à la marge, fibreux, sec.
CHAIR DU CHAPEAU : charnu, goût : fongique, odeur :
fongique.
PIED : diamètre au sommet 32-33 mm, diamètre au
centre 30-31 mm, diamètre à la base 33 mm central.
STIPITIPELLIS sec, squamuleux.
CHAIR DU PIED : plein, charnu, goût nul, odeur fongique.
HYMENOPHORE : tubulé.
TUBES : blanches.
REACTIONS : chapeau, chapeau (contexte), pied, pied (contexte)
hyménophore avec NaOH : rouge.
Ce champignon n'est pas comestible.
50
VII. Famille des Xerocomaceae
22. Xerocomus spinulosus Heinem. &
Gooss.-Fontana (NG009)

Figure 22: Xerocomus spinulosus Heinem. &
Gooss.-Fontana (NG009): Photo: Nijimbere, 2011
Ecologie : espèce trouvée sous Brachystegia
spiciformis Benth, sol un peu humide et riche en humus.
Date de récolte : le 17/11/2011
Grégaire, stipité, boletoïde.
SPOREE : orange, hauteur 60 mm.
CHAPEAU : diamètre 70 mm convexe, surface uniforme.
PILEIPELLIS à la marge un peu excédent, non
séparable, épais. CHAIR DU CHAPEAU : charnu, goût :
fongique, odeur : fongique.
PIED : diamètre au sommet 12 mm, diamètre au centre
14 mm, diamètre à la base 16 mm central, non séparable.
STIPITIPELLIS sec, glabre mat.
CHAIR DU PIED : plein, charnu, goût doux, odeur nul.
HYMENOPHORE : tubulé.
TUBES : jaunes.
REACTIONS : chapeau (contexte) et pied (contexte) avec FeSO4 :
bleu, pied (contexte) avec NaOH : brune.
Ce champignon n'est pas comestible.
51
23. Xerocomus subspinulosus Heinem.
(NG022)

Figure 23: Xerocomus subspinulosus Heinem
(NG022) : Photo: Nijimbere, 2011
Ecologie : espèce trouvée sous Brachystegia
microphylla Harms, dans un sol
caillouteux, un peu humide.
Date de récolte : le 28/12/2011
Solitaire, stipité, boletoïde.
SPOREE : non obtenue, hauteur 80 mm.
CHAPEAU : diamètre 95 mm convexe, surface rugueuse.
PILEIPELLIS à la marge trop court, non séparable,
humide, écailleux.
CHAIR DU CHAPEAU : charnu, goût : doux, odeur :
fongique.
PIED : diamètre au sommet 20 mm, diamètre au centre
17 mm, diamètre à la
base 20 mm central, non séparable.
STIPITIPELLIS humide, glabre luisant.
CHAIR DU PIED : plein, charnu, goût doux, odeur
fongique.
HYMENOPHORE : tubulé.
TUBES : jaunes.
REACTIONS : nulles.
Ce champignon n'est pas comestible.
52

Annexe 2 : Silhouettes de feuilles des principaux arbres
ectomycorhiziques associés aux divers champignons comestibles dans
l'Ouest du pays (Byuck ,1994): grandeur naturelle
1a: Brachystegia spiciformis 1b : Brachystegia
microphylla
53
1c : B. utilis 1d : Uapaca nitida
1e : B. bussei 1f : Isoberlinia angolensis
(partie d'une feuille)
54
Annexe 3 : Précipitations mensuelles et annuelles
en mm de la station de Nyanza- Lac (2005-2010)
|
Année Mois
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
Moyenne mensuelle
|
|
Janvier
|
147,4
|
126,2
|
172,5
|
201,9
|
113,9
|
192,6
|
159,0
|
|
Février
|
88,6
|
184,5
|
108,2
|
163,5
|
132
|
126,3
|
133,8
|
|
Mars
|
144,7
|
105,3
|
120,1
|
157,8
|
160,3
|
200,3
|
148,0
|
|
Avril
|
195,4
|
204,3
|
426,6
|
115,8
|
224,2
|
146,7
|
218,8
|
|
Mai
|
104,9
|
256,8
|
30,2
|
6,8
|
133,5
|
106,7
|
106,4
|
|
Juin
|
13,8
|
4,7
|
22,8
|
48,5
|
30,8
|
26,6
|
24,5
|
|
Juillet
|
|
0,9
|
|
|
|
|
0,1
|
|
Août
|
11,1
|
18,4
|
1,5
|
|
|
|
5,1
|
|
Septembre
|
18,1
|
40,6
|
4,5
|
21,4
|
71
|
16,3
|
28,6
|
|
Octobre
|
81,6
|
50,6
|
69,1
|
72,4
|
55,6
|
26,3
|
59,2
|
|
Novembre
|
112,1
|
208,2
|
175,4
|
172,4
|
166,8
|
125,2
|
160,0
|
|
Décembre
|
140,5
|
167,4
|
78,4
|
97,8
|
179,9
|
91,3
|
125,8
|
|
Total annuel
|
1058,2
|
1367,9
|
1209,3
|
1058,3
|
1268
|
1058,3
|
1170
|
Source : IGEBU, 2012
55
Annexe 4 : Température en degrés Celsius :
les relevés de la station de Nyanza-Lac (2005-2010)
|
Année
Mois
|
2005
|
2006
|
2007
|
2008
|
2009
|
2010
|
Moyenne mensuelle
|
|
Janvier
|
|
29,11
|
29,25
|
28,75
|
28,88
|
29,1
|
24,1
|
|
Février
|
|
29,44
|
29,63
|
28,25
|
28,81
|
29,6
|
24,2
|
|
Mars
|
|
29,33
|
30,34
|
28,45
|
29,05
|
28,9
|
24,3
|
|
Avril
|
|
28,83
|
29,53
|
29,32
|
28,52
|
29,7
|
24,3
|
|
Mai
|
|
29,61
|
31,69
|
30,66
|
28,91
|
30,0
|
25,1
|
|
Juin
|
29,23
|
30,17
|
29,83
|
29,39
|
29,78
|
30,03
|
29,7
|
|
Juillet
|
29,84
|
30,87
|
30,45
|
29,98
|
30,03
|
|
25,1
|
|
Août
|
30,9
|
30,35
|
31,25
|
31,12
|
31,46
|
31,3
|
31,0
|
|
Septembre
|
31,19
|
31,91
|
31,51
|
31,14
|
31,6
|
31,3
|
31,4
|
|
Octobre
|
30,77
|
32,2
|
31,1
|
29,55
|
31
|
30,8
|
30,9
|
|
Novembre
|
28,94
|
27,73
|
28,86
|
28,55
|
28,51
|
28,9
|
28,5
|
|
Décembre
|
28,11
|
28,8
|
28,38
|
28,63
|
28,43
|
28,7
|
28,5
|
|
Moyenne
annuelle
|
17,4
|
29,8
|
30,1
|
29,4
|
29,5
|
27,3
|
27,3
|
IGEBU, 2012



