|

République Algérienne Démocratique
et Populaire
Ministère de L'Enseignement Supérieur Et de la
Recherche Scientifique
Université des Sciences et de la Technologie
Houari Boumediene
Faculté de Génie Mécanique et de
Génie des Procédés
Département de Génie de
l'Environnement
Option : Développement Durable et
Environnement
Mémoire de MASTER
Thème
Traitement Chimique de la Boue de l'Industrie de
Textile
Proposé et dirigé par :
Présenté par :
Melle A.BENHADJI BELMILOUD Hiba
SAIDI Kahina
Soutenu devant le jury:
Pr. M. TALEB AHMED Professeur (USTHB) Président
Dr. A.BENHADJI Maître de conférences -B- (USTHB)
Promotrice
Dr. H. MEKATEL Maître Assistant -A- (USTHB) Examinateur
Année Universitaire 2014 /
2015
Remerciements
On remercie DIEU qui nous a offert la force et la patience
pour accomplir le présent travail.
Ce travail a été effectué au sein de
l'université des Sciences et de la Technologie Houari Boumediene,
Faculté de génie de procédés et génie
mécanique au niveau du laboratoire génie de
réaction.
Nous exprimons notre profonde gratitude et nos vifs
remerciements à MlleA. BENHADJI d'avoir accepté de
nous encadrer durant notre projet defin d'études, ainsi que de nous
avoir dirigé, aidé à avancer et soutenu pour la
réalisation de ce travail.
Nous remercions respectueusement Mr TALEB et
Mlle. ZERROUKI D. ainsi que toute l'équipe du laboratoire génie
de réaction; tant pour leurs qualités humaines que
leurscompétences scientifiques et pédagogiques
avérées qui nous ont permis d'enbénéficier
largement.
Nous remercions les membres de jury d'avoir accepté
d'examiner ce mémoire.
Jamais assez de merci pour ceux qui ont contribué
de près ou de loin à l'élaboration de notre
mémoire, et à qui ce travail a pu se réaliser dans
d'excellentes conditions.
Nous remercions également les membres de nos
familles, qui nous ont toujours apporté leur soutien et leur appui afin
d'arriver au terme de ce travail.
Liste des abréviations
CT : carbone total.
COT : Carbone Organique Total
DBK : Draa Ben Khedda.
MES : matières en suspension.
MI : matières inhibitrices
MO : matières
organiques.
UV : ultraviolet-visible
Liste des tableaux :
|
Tableau 1: Taux de fixation sur textile pour les
différentes classes de colorants
|
.5
|
|
Tableau 2: Analyse de la boue par fluorescence X
28
|
|
|
Tableau 3:Analyse de la boue par
spectrométrie d'absorption atomique (Métaux lourds)
|
29
|
Tableau 4: Teneurs maximales de la
matière sèche en mg/kg
(milligramme/kilogramme).....29
Tableau 5: absorbance et longueur d'onde
d'absorption des lixiviats . 30
Tableau 6: Concentration en COT dans les
lixiviats 47
Introduction générale
La protection de l'environnement contre la pollution
engendrée par les déchets industriels est devenue un sujet de
préoccupation croissante, et une attention grandissante est
accordée afin d'empêcher l'altération du milieu naturel.
Les rejets industriels de l'industrie textile sont parmi les
rejets qui induisent d'importantes nuisances sur l'environnement ; à
cause de la grande consommation d'eau et utilisation des produits toxiques dans
les processus. Par conséquent, ils produisent et libèrent de
grandes quantités d'effluents, et après leur traitement ils
génèrent une grande quantité de boue. L'élimination
définitive de ces boues reste un défi, à cause de ces
effets écotoxicologiques. Il y a donc la nécessité
d'opérer un traitement approprié aux boues avant leur
élimination ou de réutilisation
Parmi les traitements de la boue, on peut citer la lixiviation
chimique qui repose sur la mise en contact d'une matrice solide avec un
lixiviant, permettant d'extraire certains constituants du matériau.
Le travail présenté dans ce mémoire a
pour objectif l'étude de l'applicabilité du procédé
de lixiviation chimique pour l'élimination de la matière
organique contenue dans un la boue issu du traitement physico-chimique des eaux
usées de l'industrie de textile.
Ce manuscrit est subdivisé en trois principaux
chapitres.
Le premier chapitre présente une synthèse
bibliographique dont la première partie porte sur des
généralités sur l'industrie de textile. La seconde partie
est relative à la boue de textile son origine, classification, et son
toxicité. La quatrième partie est consacrée à la
présentation du procédé de lixiviation, les lois
régissant cette technique et les paramètres influençant
cette dernière.
Le deuxième chapitre est consacré à la
description du matériel et des méthodes expérimentales
ayant permis la réalisation pratique de cette étude. Le mode
opératoire, les appareils de mesures et d'analyse y sont
présentés
Dans le troisième et dernier chapitre, sont
présentés les résultats expérimentaux et leurs
discussions.
Nous terminons notre étude par une conclusion
générale.
I. Chapitre 1 : L'industrie de textile
I.1 Présentation :
L'industrie textile rassemble de très nombreux
métiers tout au long d'une chaîne de transformation partant de
matières fibreuses jusqu'à des produits semi-ouvragés ou
entièrement manufacturés. Elle présente l'avantage de
représenter une filière complète qui va de la
matière brute au produit fini livrable au consommateur (Bletty,
1976).
Les fibres textiles sont des substances susceptibles
d'être transformées en fil, puis en tissu, bonneterie, dentelle,
corde et ficelle. Elles peuvent provenir du règne animal,
végétal, minéral ou chimique (Brossard, 1997).
I.2 Zone d'étude
La cotonnière de Tizi-Ouzou, l'ex-complexe de textile
de DBK est situé sur la sortie Est de Draa Ben Khedda, et de 11km de la
ville de Tizi-Ouzou, elle s'étend sur une superficie de 28 hectares dont
14,5 ha sont couverts et 13,5ha d'espaces verts.
I.3. Matières premières
Les matières premières utilisées à la
filature sont :
a) le coton (fibres végétales)
b) polyesters (fibres chimique) c)fibranne (fibres chimique).
I.4. Description des étapes de production
La cotonnière de Tizi-Ouzou se compose de trois
départements de production, répondant an schéma suivant
(Figure 1) :
Filature tissage finissage
I.4.1. Filature : c'est ensemble des
opérations destinées à transformer la matière
première brute (coton) en fils de déférents
diamètres, en fonction des besoins.
I.4 .2.Tissage :c'est l'assemblage des fils
obtenus à la filature en vue de confectionner un tissu.
I.4.3. Finissage : le finissage ou
l'achèvement des textiles, étape importante dans la chaine de
fabrication, qui consiste à obtenir des tissus blanchis, teints ou
imprimés.
1)blanchiment : c'est l'ensemble des
opérations ayant pour finalité d'éliminer les
impuretés naturelles et celles acquises au cours des traitements
antérieurs.
2) teinture et impression : la teinture a pour
objectif de donner une couleur différente de celle naturelle,
l'impression est une teinture limitée à certaines portions de
tissu, elle est exécutée suivant des dessins choisis.
3)apprêtage : l'apprêtage est une
opération appliquée sur des tissues hautes gammes, en vue de
parfaire leur raideur, densité, ainsi qu'un aspect plus
agréable.
I.5. L'industrie de textile et l'environnement :
L'industrie de textile génère une pollution
importante en eaux résiduaires. Ces effluents sont très
chargés en colorants synthétiques Au cours des différentes
étapes de teinture, des quantités plus ou moins importantes de
colorants sont perdues par manque d'affinité avec les surfaces à
teindre ou à colorer (Tableau 1). Ces rejets organiques sont toxiques et
nécessitent une technique de dépollution adaptée
(Zollinger, 1987 ; DEPA, 2000).
Tableau 1: Taux de fixation sur textile pour
les différentes classes de colorants(Hawkins,
1989).
Classe de colorant Fixation (%) Fibres
utilisés
acide
azoïque
basique
De cuve
direct
dispersé 80-93
90-95
97-98
80-85
70-95
80-92
Laine, nylon
Cellulose
Acrylique
Cellulose
cellulose
synthétique
réactif
soufre
50-80
60-70
cellulose
cellulose
I.5.1. Polluants présents dans l'eau :
On distingue plusieurs catégories de polluants tels que
(Lowe ,1995 ; Koller, 2004):
1. Les sels minéraux : Ils nuisent
à la potabilité des eaux superficielles et même aux usages
industriels si leur concentration est importante.
2. Les acides et les alcalins : Le
fonctionnement d'une station d'épuration est perturbé par la
présence de ces polluants.
3. Les matières en suspension (MES):
Elles désignent toutes les matières minérales ou
organiques qui ne se solubilisent pas dans l'eau.
4. Les matières organiques (M. O.):
Ce sont tous les déchets carbonés tels que la cellulose.
Lorsque le milieu se retrouve totalement vidé de son oxygène, les
MO vont le chercher dans les
sulfates dissous, qu'elles réduisent en sulfure, qui se
dégage sous forme de sulfure d'hydrogène en engendrant une odeur
d'oeufs pourris.
5. Les matières inhibitrices (MI) :
Elles s'avèrent toxiques pour les daphnies (zooplancton). On y
trouve des métaux ou métalloïdes (mercure, plomb), des
pesticides, notamment les organochlorés (lindane), certaines huiles
minérales et certains hydrocarbures.
6. Les déchets solides divers: Ce
sont des objets divers d'origines variées, qui posent des
problèmes d'esthétique (rejet sur les rives et les plages) et de
gêne (avarie à des engins de pêche) et peuvent, en se
déposant sur les fonds, causer préjudice à la faune et
à la flore aquatique.
7. Les détergents synthétiques:
Ils comprennent un groupe de produits qui sont à la fois
émulsionnants et moussants.
8. Les matières colorantes: Leur
déversement dans le milieu aquatique même à de très
faibles concentrations, a un grand impact.
I.5.2. Les dangers potentiels :
1. Eutrophisation:
Sous l'action des microorganismes, les colorants
libèrent des nitrates et des phosphates dans le milieu naturel. Ces ions
minéraux introduits en quantité trop importante peuvent devenir
toxiques pour la vie piscicole et altérer la production d'eau potable.
Leur consommation par les plantes aquatiques accélère leur
prolifération anarchique et conduit à l'appauvrissement en
oxygène par inhibition de la photosynthèse dans les strates les
plus profondes des cours d'eau et des eaux stagnantes (Hawkins, 1989).
2. Sous-oxygénation :
Lorsque des charges importantes de matière organique
sont apportées au milieu via des rejets ponctuels, les processus
naturels de régulation ne peuvent plus compenser la consommation
bactérienne d'oxygène. Manahan (Manahan, 1994) estime que la
dégradation de 7 à 8 mg de matière organique par des
micro-organismes suffit pour consommer l'oxygène contenu dans un litre
d'eau.
3. Couleur, turbidité, odeur:
L'accumulation des matières organiques dans les cours
d'eau induit l'apparition de mauvais goûts, prolifération
bactérienne, odeurs pestilentielles et colorations anormales (Willmott
et al.,1998). Willmott et al., ont
évalué qu'une coloration pouvait être perçue par
l'oeil humain à partir de 5×10-6 g/L. En dehors de
l'aspect inesthétique, les agents colorants ont la capacité
d'interférer avec la transmission de la lumière dans l'eau,
bloquant ainsi la photosynthèse des plantes aquatiques.
I.5.3. Les dangers à long terme :
1. La persistance:
Les colorants organiques synthétiques sont des
composés impossibles à épurer par dégradations
biologiques naturelles (Colour Index,1975).Cette persistance est en
étroite relation avec leur réactivité chimique:
? La persistance des aromatiques augmente avec le nombre de
substituant.
? Les substituants halogènes augmentent plus la
persistance des colorants que les groupements alkyles.
2. Bio-accumulation:
Si un organisme ne dispose pas de mécanismes
spécifiques, soit pour empêcher la résorption d'une
substance, soit pour l'éliminer une fois qu'elle est absorbée,
cette substance s'accumule. Les espèces qui se trouvent à
l'extrémité supérieure de la chaîne alimentaire, y
compris l'homme, se retrouvent exposées à des teneurs en
substances toxiques pouvant être jusqu'à mille fois plus
élevées que les concentrations initiales dans l'eau.
3. Maladie :
Si la plupart des colorants ne sont pas toxiques directement,
une portion significative de leurs métabolites l'est
(Ganesh,1992). Leurs effets mutagènes,
tératogène ou cancérigène apparaissent après
dégradation de la molécule initiale en sous-produits d'oxydation
: amine cancérigène pour les azoïques (Brown, 1993).
I.5.4. L'état actuel en Algérie :
En Algérie selon un rapport publié en 2000 par
la Fédération des industries de textile, la consommation en
pigment et colorants de ce secteur dépasse les 4012 tonnes annuellement
alors que la consommation de produits chimiques auxiliaire atteint 16356
tonnes/an. L'alimentation en eau des unités de textile ayant des
activités de teintures et d'impression. Se fait à partir des
réseaux de distribution publics, avec un total de 4808 700
m3/an et à partir de puits ou de forages privés avec
un total de 763 000 m3/an. Les eaux résiduaires de
l'industrie de textile.
La lutte contre la pollution de ces rejets devient une
nécessité pour réduire au moins les effets néfastes
des rejets toxiques sur notre environnement par des techniques simples à
mettre en oeuvre et dont l'exploitation est facilitée.
I.6. Traitement des eaux du complexe :
Le traitement des rejets textiles, compte tenu de leur
hétérogénéité de composition, conduira
toujours à la conception d'une chaîne de traitement assurant
l'élimination des différents polluants par étapes
successives. La première étape consiste à éliminer
la pollution insoluble par l'intermédiaire de prétraitements
(dégrillage, dessablage, déshuilage.) et/ou de traitements
physiques ou physico-chimiques assurant une séparation
solide/liquide.
I.6.1 Nature et origine des eaux usées de cotitex
:
Les eaux usées du complexe sont divisées en deux
catégories d'origine différentes :
1. Origine 1 : eau fortement polluée
: ce type d'effluent provient exclusivement de finissage, englobant les
sections suivantes : Teintures pièce, Cuisine colorants, Teinture fils,
Impression, Laboratoire chimique. Le débit moyen est de 150
m3/h.
2. Origine 2 : eau faiblement polluée
: cet effluent regroupe les rejets des différents blocs administratifs
auxquels s'ajoutent les effluents de blanchiment, de purge de chaudière,
de collage, Eau de régénération des adoucisseurs. Le
débit moyen est de 200 m3/h.
I.6.2. fonctionnement de la station d'épuration
:
Le complexe de textile de DBK possède une importante
station d'épuration qui permet de rejeter dans la nature une eau
faiblement polluée et cela dans le but de la préservation de
cette dernière. Pour cela, elle subit les traitements suivants :
1. dégrillage :
Au niveau de deux stations de relevages sont
installées deux dérailleurs qui par l'ouverture d'une paroi et la
fermeture de l'autre, permettent le détournement de l'eau sur la grille
manuelle ou automatique.
2. station de relevage :
Il existe deux stations de relevages, une pour l'eau
faiblement polluée, et l'autre pour l'eau fortement polluée.
Après le dégrillage, les eaux sont déversées
chacune dans sa station de relevage ou se trouvent des pompes immergées
qui refoulent vers le floculateur, les fortement polluée, et vers le
sédimentateur les eaux faiblement polluée.
3. Floculateur :
A ce niveau, seulement les eaux fortement polluées
reçoivent les doses de sulfates de fer de poly-électrolyte
nécessaire à la floculation-coagulation correcte. Les eaux et les
flocs fortement une suspension dans le sedimentateur primaire.
4. Sedimentateur primaire :
Au ce niveau de sedimentateur primaire, il y'a le
mélange des eaux faiblement polluée qui proviennent directement
de la station de relevage et les eaux fortement polluée qui sont
passées par floculateur. Il y aura une sédimentation au fond du
décanteur primaire c'est-à-dire la formation d'une boue qui sera
extraite à l'aide des vannes pneumatiques programmables, puis
gravité jusqu'à à la station de relevage des boues
primaire.
5. Homogénéisation :
Les eaux clarifiées dans le bassin de
sédimentation sont acheminées vers le basin
d'homogénéisation qui est indispensable pour l'alimentation de la
section biologique (de pollution de niveau). Dans ce bassin se fait une
pré-neutralisation grâce à l'apport de CO2 provenant de la
cheminée des chaudières.
6. Neutralisation :
Les eaux homogène sont pompés à
débit constants dans le bassin de neutralisation où ce fait une
correction finale de pH par dosage automatique à l'acide chlorhydrique
dont la pompe doseuse est reliée à une sorte de pH
-mètre.
7. Préparation :
Dans le but de préparer l'eau qui sort du bac de
neutralisation à la phase du traitement biologique on lui injecte les
doses de :
-Urée et acide phosphorique : pour établir les
conditions de vie optimales de la boue biologique.
-Sulfate de fer : qui crée dans l'eau des flocs
d'appuis à la microflore bactrienne en améliorant notamment
l'habitat.
Le dosage de ces substances est effectué dans une
première section du bac (section de contact) ou le mélange se
réalise en agitation avec l'air comprimé introduit dans ce
sac.
8.Bassin d'aération biologique :
Il est évident que l'équipement biologique
à la boue activée soit du type à l'oxydation
étendue avec recyclage continu de boue dans le sac d'aération.
L'apport d'oxygène est assuré par deux aérateurs flottants
à basse vitesse assurant ainsi un parfaite homogénéisation
du mélange eau-boue.
9. Sédimentateur final :
Le mélange eau-boue du bac d'aération est
dirigé vers le bassin de sédimentation finale où
s'accumule la boue du fond. Cette boue extraite par un pont racleur est
refoulé par des pompes à vannes pneumatiques programmables.
L'eau épurée, javellisée sort par un trop
plein, acheminée par un canal et rejetée dans la nature.
I.6.3. Typologie des boues issue de la STEP du COTITEX
:
1. Boues primaire :
Elles sont produites par une simple décantation des
matières en suspension (MES) contenues dans les eaux usées. 70 %
des MES peuvent ainsi être retenues. Avec l'évolution de la
conception des stations, ce type de boues est en train de diminuer.
2. Boues physico-chimiques :
Variante du type précédent, les matières
organiques particulaires ou colloïdales contenues dans les eaux
usées sont agglomérées par addition d'un réactif
coagulant (sels de fer ou d'aluminium). 90 % des MES peuvent ainsi être
captées. Séparées par décantation, les boues
obtenues renferment une partie importante de sels minéraux issus des
eaux brutes et de l'agent coagulant.
3. Boues biologique :
Ces boues sont essentiellement formées par les
résidus de bactéries «cultivées» dans les
ouvrages d'épuration. Ces bactéries se sont nourries des
matières organiques contenues dans les eaux usées et les ont
digérées. Pour maintenir l'activité biologique de la
station à un bon niveau, une partie de la masse des bactéries ou
«biomasse en excès» doit être prélevée
soutirée régulièrement, entretenant ainsi la dynamique de
reproduction bactérienne.
4. Boues mixtes :
C'est un mélange de boues primaires et de boues
biologiques. Elles proviennent de la totalité de la station.
Conclusion :
Les effluents industriels présentent un
caractère toxique beaucoup plus prononcé que les effluents
urbains. Ils ont impact négatif sur l'environnement d'où la
nécessité de leur traitement avant déversement. Cependant,
les procédés de traitement des eaux usées
génèrent des boues dangereuses issues de transfert de pollution
à partir du milieu liquide vers le milieu solide. Dans notre
étude on s'intéresse à la boue native du sedimentateur
primaire après la coagulation.
II. CHAPITRE II : Généralités sur
les boues de l'industrie de textiles
II.1. Les boues de l'industrie de textile
L'urbanisation croissante et l'industrialisation ont
entraîné une augmentation spectaculaire du volume des eaux
usées produites dans le monde entier. Les industries textiles sont les
grands consommateurs industriels d'eaux. Les normes environnementales ont fait
que beaucoup de ces eaux usées doivent être traitées avant
d'être rejetées en toute sécurité. L'étape de
traitement des eaux usées concentre les divers polluants dans les eaux
usées dans la boue, contenant normalement entre 1 et 2% en poids de
solides secs(Priestly, 1991).
II.2. Origine :
Les boues sont un sous-produit du traitement des eaux
usées en station d'épuration. Elles sont principalement
générées par le procédé classique de
coagulation-floculation générant des masses considérables
et non négligeables de boues au fond du bassin. Ce qui pose un
problème de gestion de déchets.
II.3. Composition :
La composition des boues varie en fonction de l'origine des
eaux usées, de la période de l'année et du type de
traitement et de conditionnement pratiqué dans la station
d'épuration (Werther et Ogada, 1999 ; Jarde et al., 2003 ;
Singh et al., 2004).
Les boues de textiles contiennent des quantités
élevées de matière organique, N, P, K et
oligoéléments et, par conséquent, ils pourraient
être utilisés en tant qu'engrais dans les sols à faible
productivité agricole (Rosa et al., 2007a). Cependant ces boues
peuvent également contenir des substances toxiques telles que
métaux lourds, des colorants, d'autres composés organiques
récalcitrants, ainsi que des produits de transformation abiotiques et
biotiques qui peuvent avoir un impact négatif sur le sol (Hewitt et
Marvin 2005; Sharma et al ., 2007; Rosa et al . , 2007b )
.
II.3.1 Matière organique :
La concentration en matière organique peut varier de 30
à 80 %. La matière organique des boues est constituée de
matières particulaires éliminées par gravité dans
les boues primaires, des lipides (6 à 19 % de la matière
organique), des polysaccharides, des protéines et des acides
aminés (jusqu'à 33 % de la matière
organique), de la lignine, ainsi que des produits de métabolisation et
des corps microbiens résultant des traitements biologiques (digestion,
stabilisation) (Kakii et al., 1986 ; Inoue et al., 1996 ;
ADEME, 2001 ; Jarde et al., 2003).
II.3.2 Eléments fertilisants et amendements :
Selon la dose appliquée, les boues peuvent couvrir, en
partie ou en totalité, les besoins des cultures en azote, en phosphore,
en magnésie, calcium et en soufre ou peuvent aussi corriger des carences
à l'exception de celle en potassium (Zebarth et al., 2000 ; Su
et al., 2004 ; Warman et al., 2005). Les
éléments en traces tels que le cuivre, le zinc, le chrome et le
nickel présents dans les boues sont aussi indispensables au
développement des végétaux et des animaux.
II.3.3 Contaminants chimiques inorganiques et organiques
:
Ces mêmes éléments traces
métalliques (cuivre, le zinc, le chrome et le nickel) indispensables au
développement des végétaux et des animaux peuvent se
révéler toxiques à trop fortes doses (Chang et
al., 1992 ; Cripps et al., 1992). D'autres, tels que le
cadmium et plomb sont des toxiques potentiels (Alloway, 1995; McBride, 2003).
Ainsi, un polluant peut être défini comme un élément
ou un composé chimique ordinaire dont la nocivité
n'apparaît qu'à partir d'une certaine concentration. Aussi, dans
les boues, une multitude de polluants organiques (HAP, Phthalates, PCB, etc.)
peut se trouver en concentrations en général de l'ordre de mg/kg
MS (Lega et al., 1997; Pérez et al., 2001).
La nature et la concentration des eaux usées en
polluants organiques et inorganiques sont très dépendantes des
activités raccordées au réseau. L'essentiel des
contaminations chimiques vient des rejets industriels et dans une moindre
mesure des rejets domestiques (utilisation de solvants, déchets de
bricolage...). Du fait de la décantation lors du traitement, ces
contaminants chimiques se retrouvent dans les boues à de très
grandes concentrations par rapport aux eaux usées (Klöpffer,
1996).
II.3.4 Les micro-organismes pathogènes :
Les boues contiennent des milliards de microorganismes vivants
qui jouent un rôle essentiel dans les processus d'épuration. Seul
une infime partie est pathogène (virus, bactéries, protozoaires,
champignons, helminthes, etc.) et provient en majorité des
excréments humains ou animaux (Sahlström et al., 2004).
Les boues produites par les stations d'épuration sont
essentiellement des particules solides non retenues par les
prétraitements et les procédés de traitement de l'eau
(dégradation et séparation des polluants de l'eau).Ces boues se
composent de matières organiques non dégradées, de
matières minérales, de micro-organismes et d'eau (environ
99%).
II.4. Classification :
Les boues de textiles sont des boues industrielles peuvent
être classé en fonction de la nature de la matière solide,
de leur apparence physique, de la liaison eau / matrice solide ou du traitement
mis en oeuvre.
II.4.1. Classification en fonction de la nature de la
matrice solide :
Selon la nature des matières solides (organiques ou
minérales) qui composent les boues et selon les affinités de ces
matières solides avec l'eau qu'elles contiennent (hydrophiles ou
hydrophobes) et les boues de textiles sont de boues organiques hydrophiles.
La difficulté à déshydrater ces boues
provient de la présence de colloïdes, comme des hydroxydes et des
hydrocarbures, très hydrophiles.
II.4.2. Classification en fonction de l'état
physique de la boue :
L'origine de l'effluent et le traitement suivi par celui-ci,
qu'il soit biologique ou physicochimique, ne sont pas suffisants pour
caractériser une boue. Les propriétés mécaniques ou
plus précisément leur consistance comptent aussi
énormément pour sa manutention ultérieure [BOE99]. Un
certain nombre de notions sont utilisables a priori pour décrire
l'état physique de la boue et il existe des tests de
caractérisation spécifiques permettant de classer une boue parmi
les trois états conventionnels suivants :
? État liquide : la boue s'écoule simplement par
gravité ;
? État plastique : la boue est alors collante ;
? État solide avec retrait : les boues peuvent être
mises en tas sans s'affaisser.
L'état physique d`une boue dépend principalement
de sa siccité, qui représente la teneur en matières
sèches. Devant la diversité des boues produites, il est difficile
de connaître avec exactitude les valeurs limites de siccité pour
chaque état physique.
II.4.3. Classification en fonction de la nature de la
liaison eau/ matrice solide :
Nous venons de voir que la siccité de la boue a une
influence sur sa consistance. La proportion d'eau dans la boue et, plus
exactement, la manière dont cette eau est liée avec le
système complexe, formé de matières organiques et/ou
minérales, joue un rôle par rapport à la séparation
liquide-solide.
II.5.Les dangers des boues de textiles :
En raison de la diversité des produits chimiques qui
peuvent éventuellement être présents dans ces
déchets, il est difficile de déterminer sa la toxicité
basée uniquement sur l'analyse chimique (Araújo et al.,
2001 ; Kapanen et Itävaara , 2001; Celebi et Kendir, 2002; Wilke et
al., 2008). Les tests de toxicité peuvent fournir informations
supplémentaire sur le risque de ces mélanges complexes (Kapanen
et Itävaara 2001; Girotti et al., 2008; Wilke et al.,
2008).
Dans les derniers temps, des efforts ont été
orientés vers le traitement des eaux usées domestiques et
industrielles tandis que les boues qui leur sont associés sont
simplement rejetées sans traitement dans l'environnement. Bon nombre des
mesures prises pour traiter les eaux usées des résultats de la
concentration de polluants dans les boues (Priestly, 1991). Les boues devient
donc instable, et putrescible pathogène.
II.6. Les différentes voies de traitement et
valorisation de la boue de textile :
En raison de la forte augmentation du volume des eaux
usées traitées, un grand volume de boue doit être
éliminé d'une manière respectueuse de l'environnement. Il
y a donc la nécessité d'opérer un bon traitement des boues
avant leur élimination ou de réutilisation.
Les boues résultant du textile a
généralement été disposées dans une
décharge ou incinérés avec les coûts associés
élevés. Les pratiques de gestion des déchets modernes
suggèrent recyclage lorsque cela est possible (Rosa et a .,
2007b).
II.6.1L'enfouissement :
L'enfouissement et l'incinération sont les deux
méthodes principales d'élimination des boues de teinture de
textile en Chine. Du point de vue réglementaire et environnemental,
l'incinération est la méthode efficace pour réduction de
la teinture et la stabilisation des boues de textiles, Mais il conduit
inévitablement à l'émission de gaz nocifs dans
l'atmosphère.
(Werther, 1999).
II.6.2 Incinération :
Elle réalise la destruction de la matière
organique des déchets par combustion à haute température
(+ de 500 °C) produisant des fumées et des matières
minérales résiduelles nommées cendres. Dans l'objectif
d'une valorisation énergétique des déchets, la chaleur
produite est récupérée sous forme de vapeur ou
d'électricité pour le fonctionnement du four lui même, pour
le chauffage urbain ou industriel (Prevot, 2000). Les résidus de
l'incinération (mâchefer) sont utilisables pour les travaux
publics (Werther et Ogada, 1999).
Cependant, malgré l'intérêt de ce
procédé pour une réduction importante des volumes de
déchets, il présente des contraintes principalement liées
à un investissement très coûteux. Les boues seules ne sont
pas auto-combustibles, elles nécessitent des fours spéciaux et un
mélange avec d'autres déchets tels les déchets
ménagers. L'élimination des cendres et des mâchefers
exigent une décharge contrôlée de classe 1 ou une
unité d'inertage.
Cette technique reste aussi néfaste de point de vue
écologique et environnemental puisqu'elle contribue en plus du
gaspillage de matières organiques utiles pour le sol à la
diffusion de gaz très toxiques (NO, NO2, CO, SO, dioxine, etc.) (Mininni
et al., 2004 ; Nammari et al., 2004) qui ont fait l'objet de
réglementations spécifiques. En 1995, l'incinération des
déchets était à l'origine de 45 % de la dioxine produite
et rejetée dans l'air en France. La directive européenne du 4
décembre 2000 est plus sévère et fixe des concentrations
maximales admissibles pour certains produits toxiques dans la fumée (CE,
2000). Depuis, les incinérateurs sont modernisés ou
fermés, entraînant un coût supplémentaire d'une
dizaine d'euros par tonne de déchets incinérés.
II.6.3 Traitement biologique :
Le but de tous les systèmes de traitement biologique
des eaux usées est d'éliminer les solides de décantation
et des effluents en utilisant les populations microbiennes. Les traitements
biologiques font généralement partie de systèmes de
traitement secondaire. Les microorganismes utilisés sont responsables de
la dégradation de la matière organique et la stabilisation de
déchets organiques. Parmi les différents traitements biologiques
pratiques méthodes, la digestion anaérobie est souvent l'option
la plus intéressante pour le traitement des boues pour produire de
l'énergie sous forme de biogaz et du bio-engrais.
II.6.4 Recyclage :
L'argile utilisée pour la fabrication de briques doit
contenir une certaine quantité de substances organiques. L'oxydation de
ces substances au cours du processus de cuisson améliore la
qualité de la brique en sortie. Certaines argiles étant pauvres
en substances organiques, il convient donc d'en ajouter. Les boues
générées par le l'industrie du textiles sont excellentes
pour cet usage (Interlaine, 1999).
II.6.5 Epandage des boues
L'épandage de boues liquides, issues de l'industrie du
textile, est largement utilisé en France. 42% du gisement total de boues
concerne l'épandage direct. Cette technique se traduit par l'utilisation
des boues comme matière fertilisante pour mettre à profit les
capacités biologiques naturelles des sols, pour digérer les boues
et réintroduire les éléments dans les cycles naturels, et
valoriser les propriétés fertilisantes pour les cultures
agricoles.
Les boues de textiles contiennent des quantités
élevées de matière organique, N , P , K et
oligoéléments et , par conséquent, ils pourraient
être utilisés en tant que engrais dans les sols à faible
productivité agricole ( Rosa et al ., 2007a ).
III. Chapitre III : La lixiviation
III.1 Définitions associées
La lixiviation au sens littéral concerne l'extraction
d'un ou plusieurs éléments sous l'action d'un solvant. Par
extension on appelle lixiviation toute opération consistant à
soumettre une matrice (solide, pâteuse, pulvérulente, etc.)
à l'action d'un solvant, en général de l'eau. On appelle
lixiviat l'effluent aqueux rejeté dans le milieu naturel par une
décharge. La solution obtenue après lixiviation d'un
déchet ou d'un matériau est appelée un « éluat
» (insa-lyon 2005)
III.2 L'essai de la lixiviation :
L'essai de lixiviation est l'essai au cours duquel un
matériau est mis en contact avec un lixiviant et certains constituants
du matériau sont extraits.
III.3 Lixiviat :
Le lixiviat est le liquide chargé
bactériologiquement et chimiquement par la dégradation des
déchets lors de la circulation des eaux dans les déchets, contenu
dans une décharge et ou extrait.
III.4 Comportement à la lixiviation :
Le comportement à la lixiviation désigne le
relargage et l'évolution du relargage à partir d'un
déchet, par contact avec un agent lixiviant en fonction des conditions
spécifiées dans le scénario en particulier pendant la
période de temps spécifiée (Norme EN 12 920). Plus
simplement, le comportement à la lixiviation d'un déchet dans un
ouvrage correspond à la manière dont ce déchet va
relarguer ou non ses constituants sous l'influence des conditions d'exposition
de ce déchet dans l'ouvrage.
III.5La disponibilité ou potentiel lixiviable
:
La disponibilité ou potentiel lixiviable d'un
constituant est définie comme la fraction potentiellement mobilisable du
contenu total en constituants dans des conditions définies. Un test
paramétrique ou essai de paramètres spécifiques est un
essai destiné à mesurer une propriété
intrinsèque d'un déchet ou les effets (corrélés) de
paramètres spécifiques sur le relargage à partir d'un
déchet, dans le scénario envisagé.
III.6 Facteurs agissants sur la lixiviation:
Le but de la lixiviation est la mise en solution des
éléments métalliques. Pour y parvenir, plusieurs facteurs
doivent être considérés. Les principaux paramètres
qui ont une influence sur la solubilisation des métaux sont :
· Concentration de l'agent lixiviant.
· Granulométrie.
· Nature de lixiviant
· Rapport solide/liquide
· Température du milieu.
· Temps de contact entre les particules constituant la
charge et le solvant.
· Vitesse d'agitation.
Les paramètres qui peuvent influencer le relargage de
polluants sont :
III.6.1Concentration de l'agent lixiviant :
La concentration doit être suffisante pour permettre au
réactif lixiviant de participer à toutes les réactions de
lixiviation. Selon la loi Henry Le Chatelier, le déplacement de la
réaction dans le sens des réactifs vers les produits est
favorisé par l'augmentation de la concentration de l'un des
réactifs. Tout paramètre pouvant assurer l'efficacité des
réactifs et la boue contenant le matière organique à
lixivier est un appoint favorable à la cinétique car il assure un
contact intime entre les réactifs de lixiviation et la boue à
solubiliser.
III.6.2La granulométrie du déchet :
La granulométrie du déchet, elle va
déterminer la surface d'échange dont va dépendre les flux
de matière à l'interface liquide/solide.
III.6.3 La nature du solvant de lixiviation :
L'eau (déminéralisée, ultra-pure) est la
solution la plus utilisée, elle permet d'extraire la fraction
hydrosoluble des polluants. L'utilisation de solutions acides tamponnées
permet d'extraire certaines fractions de polluants solubilisables en milieu
acide comme les métaux. Des solutions organiques permettent de
solubiliser des polluants hydrophobes, en général pour
évaluer la toxicité de ces polluants.
III.6.4Le rapport liquide/solide :
Ce rapport permet d'extraire le maximum de polluants
relargables dans le long terme. De plus, des lixiviations successives avec des
solutions chaque fois renouvelées donnent la capacité maximale de
relargage (Wagner et Vasel, 1998). A l'inverse, des rapports faibles 1/1
fournissent un majorant de la concentration maximale relarguée, ce
rapport est également favorable à la détection de la
toxicité.
III.6.5 La durée de lixiviation :
Elle est variable, de 2 minutes à 48 heures. Toutefois,
des durées de 2 heures semblent nécessaires pour estimer le
relargage. En moyenne, la durée d'extraction est fixée à
24 heures (Ademe, 1999-c).
III.6.6 Le type d'agitation :
Il est réalisé avec un agitateur à
vitesse fixe (entre 30 à 250tours/minutes). Plus l'agitation est forte,
plus l'homogénéisation est importante.
III.6.7 La température :
Elle est de l'ordre de 20°C, plus la température
augmente, plus les échanges sont facilités. Toutefois, ce type de
paramètre est rarement pris en compte dans les protocoles.
III.7Cinétique de lixiviation :
La lixiviation est un des types de réaction
solide-liquide qui a fait l'objet de plusieurs travaux. Cependant, la
multiplicité des systèmes réactionnels et les très
abondants cas particuliers rendent difficile l'établissement d'une
règle générale.
La réaction globale solide-liquide peut être
décomposée en cinq étapes principales, lors qu'il n'y a
pas intervention de gaz :
? Le transport des réactants de la masse de la solution
à la surface du solide.
? L'adsorption du réactant à la surface du
solide.
? Réaction chimique proprement dite à
l'interface.
? La désorption du ou des produit de la
réaction.
? Transport du ou des produit vers la masse de la solution.
L'une ou l'autre de ces étapes, peut contrôler la
vitesse globale de la réaction, et la distinction est faite en se basant
sur la valeur des énergies d'activation.
Conclusion :
La lixiviation est une méthode d'extraction solide/
liquide permet de récupérer la matière polluante contenue
dans la boue de textile afin d'être éco-compatible et moins
toxique.
Matériel et méthodes
Ce chapitre décrit le montage expérimental mis
en oeuvre au cours de cette étude et les préparations de
différentes lixiviants élaborées, ainsi qu'un descriptif
des techniques physico-chimiques utilisées pour caractériser la
boue et les spécificités de chaque technique ainsi que les
conditions utilisées.
I.1 Origine de la boue
Les boues sont issues du précédé du
traitement des eaux usées de l'industrie de textile Cotex. Elles sont
générées par le procédé de
coagulation-floculation.
I.2 Caractérisation de la boue de textile
I.2.1 Préparation des échantillons
Dès le retour au laboratoire, les boues
prélevées sont transvasées dans des récipients en
polyéthylène, et séchées dans une étuve
à 85°C pendant 48 heures, afin d'assurer leur séchage
complet. Après refroidissement, ils sont broyés dans un mortier
en porcelaine ou en agate, puis tamisés selon leur destination :
? Les échantillons destinés aux analyses
physico-chimiques (pH, CE) sont tamisés à 2
mm.
? Les échantillons destinés au dosage des
métaux lourds sont tamisés 63ìm.
I.2.2. Paramètres physico-chimiques
Les paramètres physico-chimiques sont
déterminés par : la mesure du potentiel hydrogène (pH), la
conductivité électrique (CE).
1. Potentiel hydrogène (pH)
Dans un bécher, 50 ml d'eau distillée sont
ajoutés à 20 g de boue sèche tamisée à 2 mm
(rapport 1/2.5). Après agitation pendant 2 minutes suivie d'une
décantation pendant 30 minutes, le pH de l'échantillon est
mesuré au niveau du surnageant (Rodier et al., 2005) à
l'aide d'un pH mètre modèle (HANNA pH 210)
2. Conductivité électrique
(CE)
La conductivité électrique est un
paramètre qui traduit par une estimation, la concentration des sels
solubles dans un échantillon. Dans un bécher, 50 ml d'eau
distillée sont ajoutés à 10 g de boue sédiments
secs broyés et tamisés à 2 mm (rapport 1/5). Après
agitation pendant 1 heure à l'aide d'un agitateur réglé
à la vitesse 6, et après un temps de repos d'environ 30 minutes,
l'échantillon est centrifugé par la suite pendant 2 minutes
à 2000 tours / minute. La mesure de la conductivité
électrique s'effectue sur le surnageant obtenu après
centrifugation à l'aide d'un conductimètre modèle (HI 2314
conductivity meter HANNA instruments). Les lectures sont
exprimées en uS/cm.
3. Analyses des métaux lourds
La détermination de la concentration en métaux
lourds à été effectuée après une
étape de digestion de la boue. Il s'agit d'une
méthode qui consiste en une digestion humide à l'eau
régale (aqua regia), mélange d'HNO3 et d'HCl dont les proportions
sont 1 :3 respectivement. L'eau régale est ajoutée à 1 g
de boue séchée. La digestion est effectuée à chaud
en utilisons une plaque chauffante.
Après refroidissement, le liquide recueilli est
transféré, dans une fiole de 50 ml où le volume est
complété à 50 ml avec de l'eau distillée
La solution obtenue a été analysée par
spectrométrie d'absorption atomique (Solaar 969 en mode flamme :
acétylène/Air et acétylène/N2O pour A l et Cr) pour
le dosage du cadmium, du chrome, du cuivre, du plomb et du zinc.
4. Analyse minéralogique
Afin d'identifier les principaux minéraux
présents dans la boue, l'échantillon a été soumis
aux investigations prévues pour l'analyse minéralogique à
savoir :
? Analyse chimique élémentaire
(Fluorescence X)
La spectrométrie de fluorescence X est une
méthode d'analyse chimique utilisant une propriété
physique de la matière, la fluorescence de rayons X.
Lorsque l'on bombarde de la matière avec des rayons X,
la matière réémet de l'énergie sous la forme, entre
autres, de rayons X ; c'est la fluorescence X, ou émission secondaire de
rayons X.
Le spectre des rayons X émis par la matière est
caractéristique de la composition de l'échantillon, en analysant
ce spectre, on peut en déduire la composition élémentaire,
c'est-à-dire les concentrations massiques en éléments.
5. Détermination de la teneur en carbone total
(CT):
Sous l'action conjuguée d'une élévation de
température (au-delàs de800°C) et d'un courant
d'oxygène, le carbone inorganique (essentiellement carbonates) est
décompose et le carbone organique est oxyde, ce qui conduit globalement
ä la production de CO2.
La marque de l'analyseur est de carbone et soufre (ECO CS 400
HS)
I.3. les essais de lixiviation
L'objectif général des essais de lixiviation est
de quantifier la mobilité des espèces chimiques (polluantes ou
non) présentes dans des matrices solides (déchets ou
matériaux à base de déchets par exemple) dans un lixiviant
donné. Dans notre cas en utilise la lixiviation afin de
récupérer la matière organique contenue dans la boue
générée par l'industrie de textile et
spécifiquement la boue physico-chimique après l'étape de
coagulation.
I.3.1. Mode opératoire :
L'essai de lixiviation consiste à mettre en contact,
sous agitation mécanique permanente pendant 1 heure,
l'échantillon à tester avec 100 ml de lixiviant. La solution a
été séparée de la fraction solide résiduelle
par filtration en utilisant un filtre de porosité de 100 um
Les lixiviats obtenus serviront ensuite pour les analyses
chimiques.
I.3.2. Etude paramétriques
Etude paramétrique a pour le but d'optimisation des
processus qui consiste à améliorer les conditions de faire de
chacun des processus de traitement. Cette optimisation peut se faire par
étalonnage concurrentiel i.e. une analyse comparative des processus
entre les traitements ou par une analyse diagnostique de la performance des
processus du traitement.
Ces méthodes d'optimisation des processus peuvent se
réaliser en variant les paramètres qui
agissent sur la lixiviation qui sont :
? La nature de lixiviant
? La concentration de lixiviant
? La durée de l'agitation
? Le pH
+ Rapport solide /liquide + La vitesse d'agitation
I.3.3. Effet de la nature de lixiviants :
Plusieurs types de lixiviants ont été testés
pour déterminer lesquels vont solubiliser la matière organique
Les lixiviants sont : NaNO3, kNO3, HNO3, Na2S2O3, Na2S2O4
Na2S2O5, KH2PO4, NaOH. Le lixiviant de volume de 100 ml et de concentration 0,1
mol/l est mis en contact avec 5 g de la boue pâteuse (rapport 1/20)
soumise à une agitation mécanique continue pendant 1 heure
à une vitesse de100 tr/ min.
I.3.4. Effet de la concentration de lixiviant :
A partir des résultats obtenus après l'étape
précédente on a décidé d'utiliser le NaOH,
NaNO3,
KNO3, Na2S2O3, Na2SO4, Na2S2O5, HNO3, KH2PO4 pour la suite des
expériences à des
concentrations de 0,25-0,5-0,75 mol/l.
Nous avons fixé les conditions suivantes :
> temps d'agitation d'une heure.
> Vitesse d'agitation 100tr/min
> Rapport solide-liquide 1/20 g/l
> T° ambiante
> pH 6,5
I.3.5. Effet du temps d'agitation
Les tests de lixiviation ont été menés avec
un rapport solide/liquide de 1/20 durant 1 heure. Nous avons utilisé le
NaNO3, KNO3, Na2S2O3, HNO3, KH2PO4 à une concentration de lixiviant de
0,75 mol/là pH= 6,5.
I.3.6 Effet du pH
A partir des résultats obtenus, on a fixé les
conditions suivantes :
> Le temps d'agitation 1h.
> Concentration de lixiviant de 0,75 mol/l.
> Vitesse d'agitation de 100tr/min.
> Rapport solide-liquide de 1/20.
? Température ambiante.
Et nous avons fait varier le pH : 2-4-6-8.
I.3.7. Effet de Rapport solide /liquide
L'étude de l'effet du rapport solide/liquide a
été menée en utilisant trois lixiviants : NaOH,
NaNO3et le KH2PO4. Les rapports utilisés sont 1/10, 1/20
et 1/50 g/l.
I.3.8. Effet de la vitesse d'agitation
En se basant sur les résultats obtenus, nous avons
choisi d'utiliser le NaOH, NaNO3et le KH2PO4 comme lixiviant de la boue avec un
rapport S/L= 1/10.
I.4. Analyse des lixiviats
I.4. 1. Spectroscopie de masse UV-visible
Le spectrophotomètre est un appareil permettant de
mesurer l'absorbance d'une solution, pour différentes longueurs d'
ondes. il fait passer un rayon d'une
longueur d'onde choisie à travers une cuve contenant la solution
à étudier. Les molécules de la solution absorbent plus ou
moins le rayon lumineux, et on définit alors l'absorbance pour cette
longueur d'onde.
Le spectrophotomètre UV-visible utilisé dans
notre étude est de type Shimadzu (UV-1800), il permet de réaliser
un balayage radial allant de l'UV jusqu'au visible (200 à 900 nm). C'est
un appareil à double faisceau, il comporte deux compartiments, le
premier (à droite) contenant la cuve du blanc (référence)
et le deuxième (à gauche) renfermant la cuve qui contiendra
l'échantillon à analyser. La cuve est un petit récipient
de forme parallélépipédique d'épaisseur l = 1 cm
(trajet optique).
I.4. 3. COT
Cette méthode s'applique à la
détermination du carbone organique dans les échantillons aqueux.
Le domaine d'étalonnage se situe entre 0,1 mg/l et 100 000 mg/l C.
L'échantillon est mélangé avec du persulfate de sodium et
de l'oxygène pur (gaz vecteur), et est dirigé vers une chambre
à réaction où il est irradié aux ultraviolets afin
de dégrader la matière organique en bioxyde de carbone. Le gaz
carbonique (CO2) produit est acheminé vers le détecteur à
infrarouge. Le détecteur est ajusté à la longueur
d'absorption du CO2 dans l'infrarouge. Un système informatisé
calcule et affiche la concentration du carbone organique total présent
dans l'échantillon.
Le dosage a été effectué selon la
méthode ISO 8245, année 1999 ; via un analyseur COT de la marque
TOC tracer, Skalar.
Résultats et discussions
I. Caractéristique physico-chimique de la boue
:
pH et conductivité électrique :
? pH de la boue
Le pH est un paramètre qui mesure le degré
d'acidité ou d'alcalinité des boues. Le pH de la boue est
faiblement alcalin (7,45) à cause de la chaux qui a été
ajouté lors du traitement de l'eau usée de textile par
coagulation chimique.
? La conductivité de la boue
La mesure de la conductivité électrique permet
d'évaluer rapidement mais très approximativement la teneur en
sels soluble dans la boue. Elle dépend de la quantité des sels
ionisables. La valeur de la conductivité de la boue est de 544 uS/cm.
Détermination de la teneur en carbone total :
La valeur de CT est de 44,63 % ce qui montre que la boue
contienne une haute teneur des composés organique et inorganique.
I.1. Analyse minéralogique de la boue
:
La composition minéralogique de la boue a
été déterminée par fluorescence X. les
résultats sont représentés dans le tableau 2
|
Tableau 2: Analyse de la boue par fluorescence
X.
|
|
Elément Pourcentage
|
|
Silice (SiO2)
|
4,28%
|
|
Alumine (Al2O3)
|
1,12%
|
|
Fer
|
0.66%
|
|
Calcium
|
47,41%
|
|
Mg
|
2,22%
|
|
S
|
0,79%
|
|
Potassium
|
0,13%
|
|
Sodium
|
0,22%
|
Phosphore 0,11%
Titane
Pert au feu (composé volatils) 0,07%
43%
Nous remarquons que la boue, objet de l'étude, est riche
en calcium et en aluminium issus de l'opération de coagulation chimique.
Les matières volatiles représentent 43 % de la masse total de la
boue.
I.4. Détermination de la concentration en
métaux lourds :
La détermination de la concentration des métaux
lourds (Cd, Zn, Fe, Cu et plomb) présents dans la boue a
été réalisée par spectrométrie d'absorption
atomique. Les résultats montrent une forte teneur en fer et en zinc
(tableau 3).
Tableau 3:Analyse de la boue par spectrométrie
d'absorption atomique (Métaux lourds)
|
Teneur en mg/kg
|
|
Cadmium
|
4
|
|
Zinc
|
178
|
|
Fer
|
2260
|
|
Cuivre
|
20
|
|
Plomb
|
10
|
Tableau 4 : Valeurs limites
|
Teneur en mg/kg
|
|
Cadmium
|
800
|
|
Zinc
|
150
|
|
Fer
|
---
|
|
Cuivre
|
40
|
|
Plomb
|
20
|
Source : Charte N&P (nature et progrès)
Normes maximales de métaux lourds autorisées dans
les sols Naturels.
La comparaison entre les teneurs de la boue de textile et les
teneurs maximales de métaux lourds autorisées dans les sols
naturels, montre que la boue présente une faible teneur en métaux
lourds. Cependant, la boue contient une teneur élevée en fer.
II. Lixiviation de la boue :
II.1 effet de la nature du lixiviant :
Le premier paramètre à étudier
c'était le choix des lixiviants pour voir lesquels est le lixiviant qui
solubilise la quantité maximale de la matière organique.
La nature de lixiviant est très importante pour pouvoir
extraire les molécules d'intérêt et, si possible de
façon sélective. Le lixiviant doit avoir une affinité
importante pour les molécules ciblés et posséder une
grande capacité de dissolution une faible viscosité facilitera la
pénétration du lixiviant dans la matrice solide ainsi le
transfert de la matière au sein de la phase liquide.
Les lixiviants utilisés sont :NaNO3, KNO3, HNO3, H2SO4,
Na2S2O3, Na2S2O4, Na2S2O5, KH2PO4, NaOH
Le tableau 4 ci-dessous présente les valeurs de
l'absorbance obtenus lors de l'utilisation des différents lixiviants.
Tableau 5 :absorbance et longueur d'onde d'absorption
des lixiviats.
|
Le lixiviant (0,1 mol/l) ë (nm) ABS
|
|
NaOH
|
204
|
3,5
|
|
KHPO4
|
224
|
0,85
|
|
H2SO4
|
274
|
0,085
|
|
NaNO3
|
300
|
0,93
|
|
KNO3
|
300
|
0,73
|
|
HNO3
|
300
|
0,85
|
|
Na2S2O3
|
710
|
0,41
|
|
Na2S2O4
|
710
|
0,041
|
|
Na2S2O5
|
190
|
0,933
|
? Nous remarquons que tous ces lixiviants solubilisent la
matière organique contenu dans la boue.
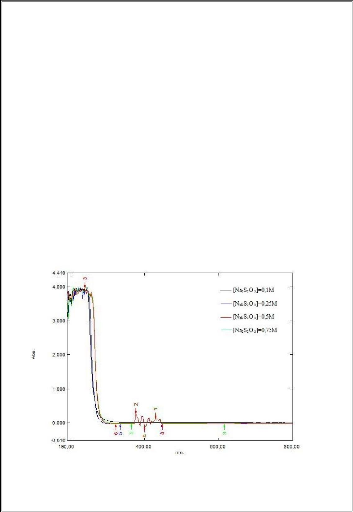
? Nous remarquons aussi que la longueur d'onde d'absorbance
des NaNO3, KNO3, HNO3 est de
300 nm ce qui signifié que ces trois lixiviants
absorbent une ou des composés identiques.
? Pour les autres lixiviants les longueurs d'onde d'absorption
varient entre 200 nm et 710 nm.
Le NaOH est le lixiviant qui possède la plus importante
absorbance =3,5.
II.2. L'effet de la concentration du lixiviant
:
L'étude de la concentration nous permet de
déterminer la concentration qui nous permet d'obtenir le meilleur
rendement de solubilisation de la matière organique.
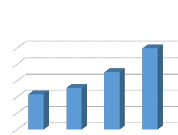
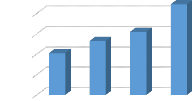
Les figures 1, 2, 3, 4, 5, 6 et 7 présentent
respectivement les résultats de lixiviations en fonction de l'absorbance
des lixiviants suivants NaNO3, KNO3, HNO3, Na2S2O3, Na2S2O5, KHPO4, NaOH
L'influence de la concentration est nécessaire pour
déterminer les conditions optimales de solubilisation de la
matière organique.
Nous remarquons que les valeurs de l'absorbance augmentent
proportionnellement avec l'augmentation de la concentration de lixiviant quel
que soit sa
nature.la concentration de 0,75 mol/l a
été choisi pour la suite des expériences afin d'optimiser
le procédé.
Figure 2 : absorbance en fonction de la
concentration du Na2S2O3
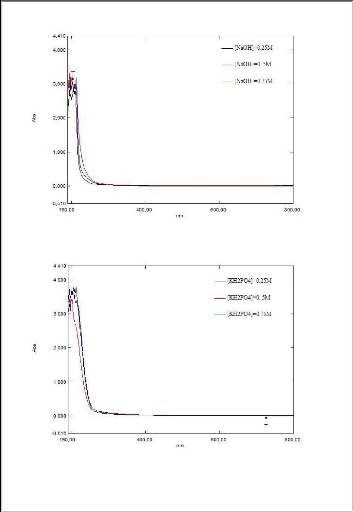
Figure 3: absorbance en fonction de la
concentration de NaOH
Figure 4: absorbance en fonction de la
concentration du KH2PO4
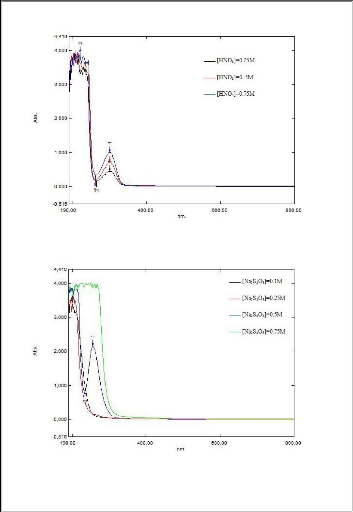
Figure 5: absorbance en fonction de la
concentration du HNO3
Figure 6: absorbance en fonction de la
concentration du Na2S2O5
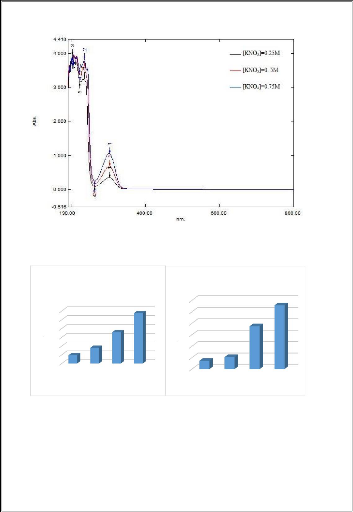
Figure 7: absorbance en fonction de la
concentration du KNO3
l'absorbance du NaNO3 en
fonction de la
concentration
a A=300 nm
l'absorbance du kNO3
en fonction de la
concentration a
A=300 nm
6
5,57
5,75
6
5
5
3,75
4
ABS
3,57
4
3
3
1,79
ABS
2
2
0,93
1
1,05
0,732
1
0
0,1 0,25 0,5 0,75
0
0.1 0.25 0.5 0.75
Concentration (mol/l)
Concentrtion (mol/l)
A.8 B.8
ABS
5
4
l'absorbance du HNO3 en
fonction de la
concentration a
A=300 nm
2,175
2
1
0
3
4,975
2,553
3,53
0.1 0.25 0.5 0.75
La concentration (mol/l)
l'absorbance du Na2S2O3 en
foncton de la concentration
a
A=710 nm
ABS
0,8
0,6
0,4
0,2
0
0,41
0,53
0,89
0,62
0.1 0.25 0.5 0.75
La concentration (mol/l)
C.8 D.8
l'absorbance du Na2S2O5 en
fonction de la
concentration a
A=190 nm
0.1 0.25 0.5 0.75
ABS
3,5
0,5
2,5
1,5
4
3
0
2
1
3,1
3,7
,15
0,915
concentration (mol/l)
l'absorbance du KH2PO4 en foction de la
concentration a A=224 nm
0.1 0.25 0.5 0.75
ABS
3,5
0,5
2,5
1,5
4
3
0
2
1
0,85
1,075
,83
3,9
concentration (mol/l)
l'absorbance du NaOHen
fonction de la concentration
a
A=204 nm
|
15
|
|
|
|
|
10
|
|
|
|
|
|
|
|
|
|
12,33
|
|
|
|
|
5
|
|
|
9
|
|
|
|
|
|
6,74
|
|
|
|
|
|
3,5
|
|
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
|
|
0.1 0.25 0.5 0.75
|
Concentartion (mol/l)
ABS
E.8 F.8
G.8
Figure 8 : histogrammes des différents
lixiviants en fonction de la concentration II.3.L'effet du temps
d'agitation
Les résultats sont présentés dans la figure
9, 10, 11, 12 ,13
Les résultats obtenus montrent que les valeurs de
l'absorbance pour les différents lixiviants ne varient pas avec
l'augmentation de la durée d'agitation. L'extraction de la
matière organique a atteint son maximum durant les première 60
minutes. Nous avons donc prie cette durée pour la suite des
expérimentations.
Figure 9: absorbance en fonction du temps
d'agitation utilisant hNO3 comme lixiviant du
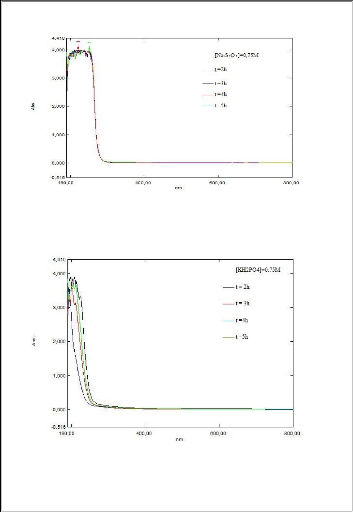
Figure 10: absorbance en fonction du temps
d'agitation utilisant
Na2S2O3comme lixiviant
Figure 11: absorbance en fonction du temps
d'agitation utilisant KH2PO4 comme lixiviant
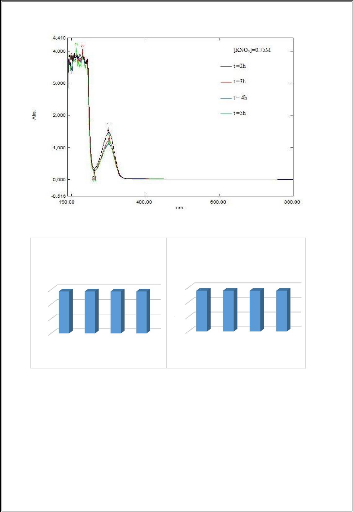
Figure 12: absorbance en fonction du temps
d'agitation utilisant KNO3 comme lixiviant
l'absorabance du NaNO3 en
fonction du temps
d'agitation a
A=300 nm
l'absorabance du kNO3 en
fonction du temps d'agitation
a
A=300 nm
5,75 5,75 5,75 5,75
5,57 5,57 5,57 5,57
6
6
4
4
ABS
ABS
2
2
0
0
2 3 4 5
2 3 4 5
le temps d'agitation (h)
Le temps d'agitation (h)
A.13 B.13
l'absorabance de kNO3 en
fonction du temps
a A=300 nm
6 4,97 4,97 4,97 4,97
2 3 4 5
ABS
4
0
2
temps d'agitation (h)
l'absorbance de Na2S2O3 en
fonction du temps
a
A=710 nm
2 3 4 5

ABS
0,5
0
1
0,89 0,89 0,89 0,89
temps d'agitation (h)
C.13 D.13
l'absorbance de NaOH a A=204
nm
15 12,33 12,33 12,33 12,3

2 3 4 5
Temps d'agitation (h)
l'absorbance de KHPO4 a A=224
nm
4
2
ABS
0
3,9 3,9 3,9 3,9
2 3 4 5
Temps d'agitation (h)
E.13 F.13
Figure 13: histogrammes de l'absorbances des
lixiviants en fonction du temps d'agitation II.4.L'effet du
pH
La polarité de beaucoup composés varie avec le pH
du lixiviant, par conséquent leur solubilité dépend
l'acidité/basicité de lixiviant.
L'observation faite sur les histogrammes nous
révèle qu'à un pH de 6 nous obtenons les meilleurs
absorbances pour le NaNO3 et KNO3 et le Na2S2O3et donc des meilleures
solubilisations de la matière organique. Pour la suite de notre
étude, nous avons travaillé à pH des solutions lixiviantes
(pH 6,5).
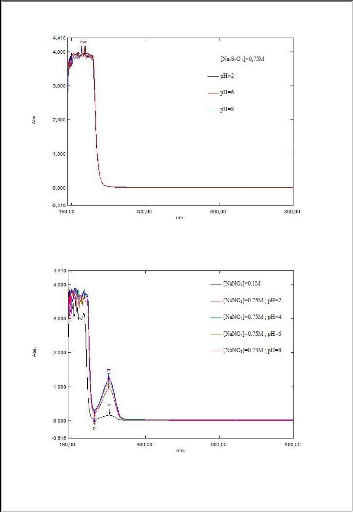
Figure 14: absorbance en fonction du pH
utilisant Na2S2O3 comme lixiviant
Figure 15: absorbance en fonction du pH
utilisant NaNO3 comme lixiviant
Figure 16: absorbance en fonction du pH
utilisant KNO3comme lixiviant
l'absorbance du NaNO3 en fonction
pH
a ?=300 nm
8
6,005
5,505 5,53
ABS
6
4,665
4
2
0
S...
2 4 6 8
pH
l'absorbance du kNO3 en fonction du
pH
a A=300 nm
2 4 6 8
ABS
5,8
5,6
5,4
5,2
5
5,26
5,71
5,66
5,5
pH
A.17 B.17
l'absorbance de Na2S2O3
en
fonction du pH a A=710
1
0,54 0,66
0
2 4 6 8
ABS
0,5
pH
C.17
Figure 17 : les histogrammes de l'absorbances
de lixiviants en fonction du Ph
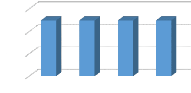
II.5.L'effet du rapport solide- liquide :
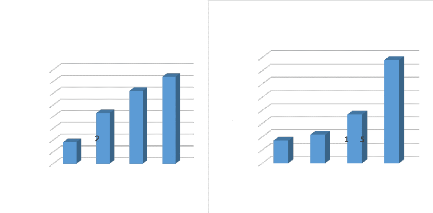
L'effet de rapport solide- liquide a été
étudié avec les trois lixiviants NaNO3, KNO3, KH2PO4qui ont les
meilleures valeurs d'absorbance.
Les ratios choisis sont 1/10 et 1/20 et 1/50 et les
résultats sont présentés dans les figures 18, 19,20
,21.
Les résultats montrent que l'absorbance augmente lorsqu'il
y'a plus de matière première (boue) par rapport un volume du
solvant donné. le rapport 1/10 est le rapport qui donne la meilleur
absorbance.
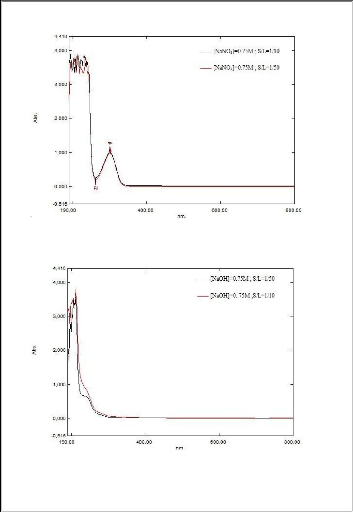
Figure 18 : absorbance en fonction du rapport
solide-liquide utilisant NaNO3comme lixiviant
Figure 19 : absorbance en fonction du rapport
solide-liquide utilisant NaOH comme lixiviant
Figure 20 : absorbance en fonction du rapport
solide-liquide utilisant KH2PO4comme lixiviant
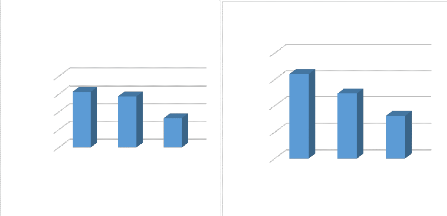
20
l'absorbance du NaNO3 en foction du rapport S/L
à A=300 nm
*1/10* *1/20* *1/50*
rapport solide/liquide
ABS
4,00
8,00
6,00
0,00
2,00
6,25 5,75
3,31
l'absorbance du NaOH en fonction du rapport S/L à
A=204nm
*1/10* *1/20* *1/50*
ABS
15
10
5
0
12,33
8,07
16
rapport solide/liquide
A.21 B.21
l'absorbance de
KH2PO4 en
fonction du rapport S/L
à A=224
nm
*1/10* *1/20* *1/50*
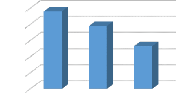
ABS
4
5
3
0
2
1
2,65
4,8
3,9
rapport solide/liquide
C.21
Figure 21 : les histogrammes de l'absorbance des
lixiviants en fonction du rapport solide/liquide II.6.L'effet de la vitesse
d'agitation :
L'agitation mécanique des particules dans le solvant
permet leur maintien en suspension et on homogénéisation du
milieu. Elle a un effet toujours favorable sur l'opération car elle
permet de réduire la résistance au transfert de matière
organique au niveau de l'interface solide liquide et d'augmenter le coefficient
de transfert.
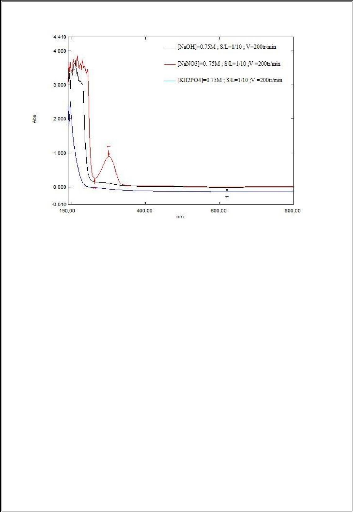
Figure 22: absorbance en fonction du rapport
solide-liquide utilisant NaNO3 et NaOH et KH2PO4comme lixiviant.
Les figures montrent qu'une vitesse d'agitation
mécanique de 200 trs/min donne une meilleurs absorbance par rapport
à la vitesse de 100 trs/min.
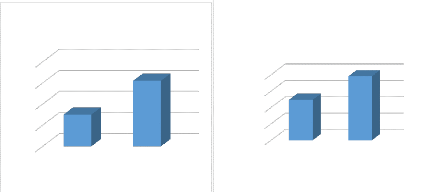
l'absorbance du NaNO3 en
fonction de la vitesse
d'agitation
a A=300 nm
100 200
ABS
6,5
5,5
7
6
5
6,55
5,75
La vitesse d'agitation (tr/min)
l'absorbance du HNO3 en
fonction de la vitesse
d'agitation
a A=204 nm
100 200
ABS
20
15
10
5
0
19,5
12,33
Vitesse d'agitation (tr/min)
A.23 B.23
l'absorbance de
KH2PO4 en
fonction de la vitesse
d'agitation a
A=224 nm
A B
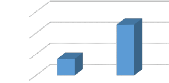
ABS
15
10
5
0
3,9
12
La vitesse d'agitation (tr/min)
C.23
Figure 23 : les histogrammes de l'absorbance des
lixiviants en fonction de la vitesse d'agitation. II.7. Le COT
Les résultats obtenus montre le les lixiviats HNO3,
NaNO3, KH2PO4, NaOH,Na2S2O3peuvent être utilisé pour solubiliser
la matière organique présente dans la boue. La
détermination de la concentration du carbone organique total dans le
lixiviat a été effectuée. Les résultats montrent
que la soude et le sel de phosphate permettent d'obtenir les meilleurs
rendements (tableau 6).
Tableau6: Concentration en COT dans les lixiviats
(concentration de
lixiviant=0,1M ;t=1h ;v=100 trs/min)
|
Lixiviants HNO3 NaNO3 KH2PO4 NaOH Na2S2O3
|
|
COT
(mg/l)
|
4,3
|
2,7
|
9,8
|
10,9
|
4,5
|
Ces résultats confirment la présence de
matière organique dans le solvant. En effet, La matière organique
peut également s'estimer par mesure de l'absorbance à
différentes longueurs d'onde (254, 280, 465 et 665 nm). Cependant, les
absorbances aux longueurs d'onde de 254nm et 280nm sont usuellement choisies
pour le dosage de la MO, parce qu'elles représentent les longueurs
d'onde d'absorption des systèmes conjugués (noyaux
aromatiques)
(Chin et al., 1994)
Mais du point du vue environnementale le NaOH fait augmenter
le pH des cours d'eau, représentant ainsi une menace potentielle pour la
faune et la flore aquatiques. La soude caustique s'infiltre dans la terre et
peut nuire à l'agriculture comme à l'environnement des
végétaux, des minéraux et des animaux proches ou lointains
(rivière, fleuve, nappe phréatique).
Par contre les sels NaNO3 et KNO3 sont des nutriments des
plantes indispensables à leur croissance et se forment naturellement
dans les sols par action de bactéries ou de microorganismes sur l'azote
et l'oxygène atmosphériques. L'excès de nitrates et de
phosphates qui arrive dans les rivières et dans la mer peut conduire au
phénomène d'eutrophisation (l'excès de nutriments se
traduit par une croissance excessive des algues et une diminution de
l'oxygène dissous dans l'eau).
Conclusion générale
Ce travail avait pour l'objectif, l'étude de la
lixiviation chimique afin de récupérer la matière
organique contenue dans la boue générée par l'industrie de
textile et spécifiquement la boue physico-chimique après
l'étape de coagulation. Ce procédé consiste à
mettre en contact, sous agitation mécanique, l'échantillon
à tester avec plusieurs lixiviants.
Nous sommes intéressés à l'optimisation
de cette méthode de traitement par la variation de plusieurs
paramètres (nature et la concentration de lixiviant, le temps et la
vitesse d'agitation et le pH du milieu, le rapport solide- liquide)
Les résultats expérimentaux ont prouvé
que tous les lixiviants choisis ont dissout la matière organique. Les
taux de l'absorbance augmentent avec l'augmentation sur la concentration de
lixiviant quel que soit sa nature ci pour cela on a adopté une
concentration de 0,75 mol/l pour la suite des essais.
Le temps de contact n'a pas d'effet sur l'absorbance car
l'absorption de la matière organique a atteint son maximum à une
heure de contact à pH du milieu. Le rapport solide/liquide de 1/10 est
considéré comme le meilleur ratio de lixiviation. Les meilleurs
lixiviants d'après toutes ces expériences qui ont une meilleurs
absorbances sont le NaOH, le NaNO3 et le KH2PO4.
Références bibliographiques
· Lowe. Guide des solutions d'assainissement. Programme
d'Assainissement du Littoral de l'Atlantique (PALA), Saint- John, Canada.
(1995)
· Allaway B. et Ayres D. C., 1997. Chemical principals
of environmental pollution. Chapman et Hall Eds., 395 p.
· Brown M. A. and DeVito S. C. (1993). Predicting azo
dye toxicity. Critical Reviews in Environmental Science and Technology, 23(3),
pp. 249-324.
· Brossard, «Technologie des textiles».
4ème Editions DUNOD, Paris, 1970, 254.
· Chang A.C GRANATO TC-page A.L 1992 a methodology for
establishing phytotoxicity criteria for sewage munipcipal sluges. Environ
21-521-536
· Chen, W., Mahlke, S., Warter, N., Anik, S., and Hwu,
W. (1994). Profile assisted instruction scheduling. Int. J. of Parallel
Programming, 22(2):151-181.
· Colour Index, The Society of Dyers and Colourists.
Revised third edition, UK, 1975.
· Culp, F. A. Beland, R. H. Heflich, Mutation research
(506/507) (2002) 55-63.
· DEPA (Danish Environmental Protection Agency), Survey
of azo-colorants in Denmark,Toxicity and fate of azo dyes, 2000.
· EPA, Integrated Risk Information System, Azobenzene
CASRN 103-33-3, may 1998
· Flandrin-M Bletty, Technologie et Chimie des Textiles.
Edition Cépaduès (1976)
· Ganesh-R, Fate of azo dye in sludges. ThChim.:
Virginia polytechnic institute and state university, (1992) p.193.
·
HEWITT, L. M. & MARVIN, C. H., 2005, Analytical methods in
environmental effects-directed investigation of effluents. Mutat. Res.,
589:208-232.
· Hawkins J.A., M.C. Healey, M.H. Johnson-Delivorias, J.R.
Heitz, Vet. Parasitol. 16 (1984) 35-41.
· Hawkins J.A., R.R. Evans, T.J. Newby, M.H.
Johnson-Delivorias T.D.L. Tyler, Vet.
· Koller E.., Traitement des pollutions industrielles.
Edition Dunod, Paris. (2004)
· Manahan-S. E., Environmental chemistry, Ed (6), Lewis
publisher, U.S.A. 1994.
· Mills, R. J. Bull, K. P. Cantor, rapport d'un groupe
d'experts. Maladie chronique au canada, 19 (1998) p 3.
· Rodier J., Bazin C., Broutin J. P., Champsaur H. et Rodi
L., 2005. L'analyse de l'eau. Eaux
· naturelles. Eaux résiduaires. Eau de mer.
8ème Ed. DUNOD. Paris, 1383 pp.
· ROSA, E. V. C., MATERA, L., SOUZA-SIERRA, M. M.,
RÖRIG, L. R., VIEIRA, L. M. & RADETSKI, C. M., 2007b, Textile sludge
application to non-productive soil: Physico-chemical and phytotoxicity aspects.
Ecotoxicol. Environ. Saf., 68:91-97. doi:10.1016/j.eco env.2006.06.006
· SHARMA, K. P., SHARMA, S., SHARMA, S., SINGH, P. K.,
KUMAR, S., GROVE, R. & SHARMA, P. K., 2007, A comparative study on
characterization of textile waste waters (untreated and treated) toxicity by
chemical and biological tests. Chemosphere, 69:48-54.
doi:10.1016/j.chemosphere.2007.04.086
· Santé Canada, Chloration de l'eau, votre
santé et vous, mars (1999).
· Santé Canada, Sous-produits de désinfection
(SPCD), Groupe de travail sur les SPCD,Novembre (1999).
· Sahlström, L., Aspan, A., Bagge, E.,
Danielsson-Tham, M-L., Albihn, A. (2004) Bacterial pathogen incidences in
sludge from Swedish sewage treatment plants. Water Research vol 38, (8),
pp1989-1994
· Tsuda.S, Matsusaka N, Madarame H, Mutation Research 465
(2000) 11-26.
· Werther, J., Ogada, T., 1999. Sewage sludge combustion.
Prog. Energy Combust. 25, 55-116.
· (Sahlström et al., 2004).
· Willmott-N. J., J. T. Guthrie, G. Nelson, JSDC, 114
(1998) 38-41.
· Zebarth B.J MCDAUGALL 2000 `availability of nitrogen from
municipal sewage sludge for dryland forage grass ` can J.plant sci
80-575-582
· Zollinger.H, Color chemistry, Syntheses, properties and
applications of organic dyes and pigments. VCH, 1987
·
http://tice.insa-lyon.fr/lixiviation/index.php?active=2
Résumé :
Cette étude concerne la lutte contre la pollution d'une
boue industrielle de textile par un traitement chimique, la lixiviation
chimique.
Plusieurs paramètres ont été choisis pour
contrôler le traitement de la boue. On peut citer la variation de la
nature et de la concentration de lixiviant, pH, le temps de contact, la vitesse
d'agitation et le rapport solide-liquide.
Les résultats obtenus montrent que le meilleur rendement
est obtenu par lixiviation avec des sels : Na NO3, KH2PO4, NaOH à des
fortes concentrations (0,75 mol/l) et un pH neutre avec un rapport de 1/10
pendant 1h d'agitation à une vitesse de 200 tr/min.
Abstract
This study concerns the fight against pollution of textile
industrial waste after chemical treatment using chemical leaching.
Several parameters were selected to monitor the purification of
textile sludge. These include changes in the nature and concentration of
leachate, pH, time contact, stirring speed and the solid-liquid ratio.
the results shown that the best performance is given by the
leaching of salts such as Na NO3, KHPO4, NaOH at high concentrations (0.75 mol
/ l) and a near neutral pH with a ratio of 1/10 for 1 hour stirring at a speed
of 200 rpm.
|
|
|
ÕÎáã
|
|
ÊÇíÇäáÇ
ÍíÔÑÊ
ãÇÏÎÊÓÇÈ
ÉíÆÇíãíßáÇ
ÉÌáÇÚãáÇ
ÏÚÈ
ÉíÚÇäÕáÇ
|
ÊÇíÇäáÇ
|
äÚ
|
ãÌÇäáÇ
辇懂
ÉÍÇßãÈ
ÉÓÇÑÏáÇ åÐå
ÞáÚÊÊ
|
|
|
|
.ÉíæÖÚáÇ
ÏÇæãáÇÈ
íäÛáÇ
äíØáÇß
ÉíÚÇäÕáÇ
|
|
ÉÌÑÏæ
ÉÑÇÕÚáÇ
ÒíßÑÊæ
ÉÚíÈØ í
ÊÇÑííÛÊáÇ
åÐå áãÔÊæ
|
.äíØáÇ
|
ÉíÞäÊ
|
äíÓÍÊá
ÑííÇÚãáÇ äã
ÏíÏÚáÇ
ÑÇíÊÎÇ ãÊ
ÏÞæ
|
.ÉáÆÇÓáÇ/ÉÈáÕáÇ
ÏÇæãáÇ
ÉÈÓäæ
ßíÑÍÊáÇ
ÉÚÑÓæ ÉÏãæ
ÉÖæãÍáÇ
KHPO4 HN O3
ÍáÇãáÇÈ
ÍíÔÑÊáÇ
ááÇÎ äã åíáÚ
áÕÍä ÁÇÏ áÖ ä
ÌÊäÊÓä ä äßãí
ÌÆÇÊäáÇ
ÑíÓÊ ÏÚÈ
|
ÉáÆÇÓáÇ/ÉÈáÕáÇ
ÏÇæãáÇ
|
ÉÈÓä
|
Úã
|
ÏíÇÍãáÇ
äã
|
ÈíÑÞ
íäíÌæÑÏíåáÇ
ãÞÑáÇæ )ÑÊá /
áæã 0.75( ÉíáÇÚ
ÊÇÒíßÑÊÈNaOH
|
.ÉÞíÞÏ / Éá
200 ÉÚÑÓÈ ÉÚÇÓ 1
ÉÏãá
ßíÑÍÊáÇæ
ÑÊá / ãÇÑÛ1/10
| 


