|
REPUBLIQUE DEMOCRATIQUE DU CONGO
UNIVERSITE DE LUBUMBASHI
FACULTE POLYTECHNIQUE


ANNEE ACADEMQUE : 2014- 2015

Elimination du cuivre des solutions de sulfate de
zinc par précipitation chimique
Travail présenté et défendu par le groupe
6
SABIN MULUMBU Sabin (METALLURGIE)
MULUNDA KADJELE Bruce (METALLURGIE) SADIKI RAMAZANI
Ben (CHIMIE INDUSTRIELLE) ZALI MUNUNGA Franck (ELECTROMECANIQUE) ZUZE MUHUNGA
Arcel (ELECTROMECANIQUE)
Promotion : Deuxième Bachelier
Dirigé par : CT Georges KONGOLO BULOF
Page | I
EPIGRAPHE
« Si tu as une pomme, que j'ai une pomme, et que l'on
échange nos pommes, nous aurons chacun une pomme. Mais si tu as une
idée, que j'ai une idée et que l'on échange nos
idées, nous aurons chacun deux idées. »
Georges Bernard Shaw
Projet Multidisciplinaire_Groupe 6
Projet Multidisciplinaire_Groupe 6
Page | II
REMERCIEMENTS
Nous tenons à remercier du fond du coeur le chef des
travaux Georges KONGOLO BULOF pour avoir dirigé ce travail dans un
climat convivial et fructueux. Son encadrement scientifique efficace et son
sens élevé de responsabilité ne nous laisserons jamais
indifférents.
Nous remercions également la Faculté
Polytechnique pour avoir, à travers l'adoption du système LMD,
initié les travaux en équipe nous permettant de nous familiariser
et de partager nos connaissances. Par-là, nous tenons à remercier
les Professeurs Bilez NGOY BIYUKALEZA, Doyen de la Faculté ; Christian
KATWIKA NDOLWA, Richard NGENDA BANKA ainsi que le CT Daniel KALUFYA
MUKALAYI.
Pour leur assistance tant scientifique que matérielle,
nous remercions aussi Messieurs Guy NKULU WA NGOIE, Gilbert MUKADI
KANTABILENGA, Polydor ILUNGA MWANZA, Christian KIYEBWA MUKOKO et MALOBA
SUMAHILI.
Nous tenons à adresser nos remerciements à vous,
nos très chers parents, pour vos encouragements sans faille et votre
soutien moral, matériel et spirituel auxquels nous sommes assujettis
depuis notre enfance jusqu'au jour d'aujourd'hui.
Merci également à toutes les personnes qui ont
contribué de près ou de loin à la réalisation de ce
travail, sans oublier nos compagnons d'études.
Page | III
RESUME
Le présent travail porte sur l'élimination du
cuivre d'une solution de sulfate de zinc par sulfuration en utilisant le
sulfure de sodium comme agent sulfurant.
Les essais ont été réalisés sur
une solution de sulfate de zinc issue de la lixiviation à l'acide
sulfurique de l'oxyde de zinc produit par la Société pour le
Traitement du Terril de Lubumbashi, STL en sigle, lors de la fusion
réductrice de la scorie des usines de Lubumbashi. Cette solution a
été dopée avec du sulfate de cuivre dans le but de se
rapprocher de la concentration en cuivre (1 g/l) des solutions ex-UZK.
Ces essais nous ont permis de déterminer les conditions
opératoires pour lesquelles nous avons obtenu les meilleurs rendements
d'élimination de cuivre de la solution (pH : 1 ; Température :
ambiante (28°C) ; agitation : 400 tr/min ; quantité de Na2S.2H2O :
4 g/l). Les rendements obtenus ont été d'environ 99 % pour
l'élimination de cuivre, 3 % pour le zinc et 90 % pour le fer.
Un essai a permis de mettre en évidence l'influence de
la température sur les rendements d'élimination. Pour les
mêmes conditions que ci-haut mais à pH 4, nous avons obtenu les
rendements suivants : 97 % pour l'élimination de cuivre, 26 % pour le
zinc et 100 % pour le fer alors que lorsque nous avions élevé la
température dans le réacteur à 45°C, nous avions
obtenu des rendements autour de 99,99 % pour l'élimination de cuivre,
17,59 % pour le zinc et 100 % pour le fer.
Projet Multidisciplinaire_Groupe 6
Mots clés : purification,
élimination, zinc, cuivre, sulfuration, lixiviation, pH, sulfate,
sulfure
Page | IV
TABLE DES MATIERES
EPIGRAPHE I
REMERCIEMENTS II
RESUME III
TABLE DES MATIERES IV
INTRODUCTION 5
CHAPITRE I:OBTENTION DE L'OXYDE DE ZINC A LA STL ET LES
USAGES DU ZINC 3
I.1 Obtention de l'oxyde de zinc à la STL
3
I.1.1 Historique de la STL 3
I.1.2 Obtention de l'oxyde de zinc 3
I.2 Usages du zinc 4
CHAPITRE II:METHODES DE PURIFICATION DES SOLUTIONS
5
II.1 Introduction 5
II.2 Méthodes d'éliminations des ions
métalliques en solution 5
II.2.1 La précipitation par réduction
gazeuse 5
II.2.2 La précipitation par cémentation
6
II.2.3 L'élimination des ions par extraction par
solvant 6
II.2.4 La précipitation par
électrodéposition 7
II.2.5 L'élimination des ions par résines
échangeuses d'ions 8
II.2.7 Précipitation d'un composé insoluble
ou précipitation chimique 8
CHAPITRE III:DIAGRAMMES DE POURBAIX DES SYSTEMES Cu-H2O,
Zn-H2O, Fe-H2O
et S-H2O 17
III.1 Introduction 17
III.2 Diagramme de Pourbaix du système cuivre-eau
17
III.3 Diagramme de Pourbaix du système zinc-eau
18
III.4 Diagramme de Pourbaix du système soufre-eau
19
III.5 Diagramme de Pourbaix du système fer-eau
20
CHAPITRE IV:ESSAIS DE PRECIPITATION DU CUIVRE PAR
SULFURATION 23
IV.1 METHODES EXPERIMENTALES 23
IV.1.1 Materiels 23
IV.1.2 Préparation de la solution de sulfate de
zinc 25
IV.1.3 Mode opératoire 26
IV.2 ESSAIS PROPREMENT DITS 27
IV.2.1 Influence de la quantité de sulfure de
sodium (Na2S.2H2O) 27
IV.2.2 Influence du pH 29
IV.2.3 Influence de la température dans le
réacteur 31
CONCLUSION 34
REFERENCES BIBLIOGRAPHIQUES 35
Projet Multidisciplinaire_Groupe 6
Projet Multidisciplinaire_Groupe 6
Page | V
INTRODUCTION
Dans le traitement hydrométallurgique des minerais, on
procède par plusieurs opérations pour obtenir des solutions
contenant le métal à valoriser. Ce dernier se retrouve
accompagné d'autres métaux qui, lors de la lixiviation, sont
passés en solution car cette opération n'est pas
sélective.
Dans la métallurgie du zinc, les minerais
traités sont principalement les sulfures et les oxydes. Ils contiennent,
outre le zinc, des métaux tels que le cuivre, le fer, le cadmium,...
L'opération finale, dans le traitement
hydrométallurgique étant l'électrolyse, la solution de
lixiviation, après la séparation solide-liquide, doit passer par
l'étape de purification pour la débarrasser des
éléments plus électropositifs que le zinc.
L'objectif de ce travail est donc de purifier la solution de
sulfate de zinc obtenue par lixiviation de la poudre de zinc produite par
l'entreprise STL.
Pour atteindre cet objectif, nous avons subdivisé notre
travail, outre l'introduction et la conclusion, en deux parties dont la
première, bibliographique, comprend :
? L'obtention de l'oxyde de zinc à la STL et les usages du
zinc ;
? Les méthodes de purification des solutions ;
? Les diagrammes de Pourbaix des systèmes cuivre-eau,
fer-eau, zinc-eau et soufre-eau ;
et la seconde, expérimentale, comprend :
? L'élimination du fer par précipitation des
hydroxydes ; ? Les essais de précipitation du cuivre par sulfuration.

PARTIE BIBLIOGRAPHIQUE
Projet Multidisciplinaire_Groupe 6
Page | 2
Page | 3
CHAPITRE I: OBTENTION DE L'OXYDE DE ZINC A LA STL ET
LES
USAGES DU ZINC
I.1 Obtention de l'oxyde de zinc à la STL I.1.1
Historique de la STL
La Générale des carrières et des mines,
Gécamines en sigle, entreposait la scorie produite aux usines de
Lubumbashi dans un parc et au fil des années, cette scorie s'est accrue
en donnant une immense montagne dite Terril de Lubumbashi. Cette montagne de
scorie provenait de la fusion pour matte au four Water Jacket et renfermait des
métaux valorisables tels que le cobalt, le cuivre et le zinc pour ne
citer que ceux-là [15].
Voyant l'importance de ce Terril, la Société
pour le Traitement du Terril de Lubumbashi, STL en sigle, envisagea son
exploitation en vue de l'extraction du cobalt et du cuivre sous forme d'un
alliage blanc.
Cette société fût créée
à la suite de la concrétisation d'un projet de valorisation de
cette scorie. Ce fût le 08 Septembre 1999, sous l'initiative des
personnalités morales ci-après que la STL a vu le jour. Il s'agit
de :
? La société de droit de Jersey,
Groupement pour le traitement du Terril de Lubumbashi (GTL) ;
? La Générale des
Carrières et des Mines (GCM) ;
? La société de droit finlandais
OUTOKUMPU Mining Group (OMG), qui forme une société anonyme de
droit luxembourgeois ;
? Le Groupe Georges Forrest International
d'Afrique (GFIA).
I.1.2 Obtention de l'oxyde de zinc
La STL est donc spécialisée dans la production
de l'alliage blanc en traitant les scories du Terril par voie thermique en
utilisant un four électrique; elle utilise le coke pour la fusion
réductrice qui se fait généralement à une
température de 1450°C. Les produits de ces opérations sont
donc l'alliage blanc, la scorie et les gaz constitués principalement du
monoxyde de carbone, dioxyde de carbone et zinc.
En vue d'une protection environnementale, ces gaz sont
aspirés dans une conduite jackettée non raccordée
directement sur la voûte. En présence d'air ambiant, le monoxyde
de carbone est transformé en dioxyde de carbone alors que le zinc et le
plomb sont
Projet Multidisciplinaire_Groupe 6
Projet Multidisciplinaire_Groupe 6
Page | 4
transformés en leurs oxydes respectifs. Après la
conduite, nous avons le spray chamber dans lequel on injecte de l'eau à
partir des sprays pour refroidir les gaz sous forme de poussière d'oxyde
de zinc qui est recueillie par un petit transporteur à chaîne pour
la pelletisation et est récupérée dans le big bag [15].
I.2 Usages du zinc
Le zinc métal est principalement utilisé pour
les revêtements, la production des alliages tels que le laiton, les
alliages moulés sous pression et le zinc plaqué ou forgé.
Il est également utilisé pour produire des composés du
zinc, des pigments et d'autres produits chimiques [7].
D'après la Conférence des Nations Unies sur le
Commerce et le Développement (CNUCED), de manière
générale, à l'échelle internationale, en 2003, le
zinc métal est utilisé à 45 % dans la construction, 25 %
dans les transports, 23 % dans les produits domestiques et biens
électriques et 7 % dans les machines [12].
En 2012, à l'échelle mondiale, les principaux
secteurs d'utilisation du zinc sont la galvanisation : 50 %, le laiton : 17 %,
les autres alliages : 17 %, les demi-produits : 6 %, les usages chimiques : 6 %
et les autres produits : 4 % [7].
Page | 5
CHAPITRE II: METHODES DE PURIFICATION DES SOLUTIONS
II.1 Introduction
Pour pouvoir obtenir de bons résultats et de bons
produits partant des solutions, on doit au préalable les purifier,
c'est-à-dire les débarrasser si possible d'un maximum
d'impuretés en vue d'obtenir des solutions suffisamment pures. Les
méthodes ou techniques de purification sont nombreuses et fort
variées, nous pouvons citer : l'extraction par solvant, la
précipitation chimique, la cémentation, les résines
échangeurs d'ions et l'électrolyse. En ce qui concerne la
purification par précipitation chimique, on peut procéder
à la précipitation des composés sous forme d'hydroxydes,
des phosphates, arséniates, carbonates, sulfates, sulfures, fluorures,
bromures, chlorures, sulfites, silicates et des chromates [3].
II.2 Méthodes d'éliminations des ions
métalliques en solution Parmi les méthodes de
purification, nous pouvons citer :
II.2.1 La précipitation par réduction
gazeuse
La réduction gazeuse, et généralement par
hydrogène sous pression, est une méthode de précipitation
des ions métalliques en solution sous forme de poudre métallique
[17]. La réaction de précipitation peut s'écrire :
MeSO4 + H2 ? Me + H2SO4 (II.1)
Sous forme ionique, nous pouvons écrire :
Me2+ +H2 ? Me +2 H+ (II.2)
La
constante d'équilibre de la réaction peut s'écrire :
log K = 2log [H+] - log [Me2+] - log
PH2 (II.3)
A la température et pression constantes, les termes log
K et log pH2 sont des constantes et la relation peut s'écrire :
log [Me2+] = - 2 pH - Cste (II.4)
La relation (II.4) montre que la réduction par
l'hydrogène est favorable à pH
élevé.
Projet Multidisciplinaire_Groupe 6
Projet Multidisciplinaire_Groupe 6
Page | 6
En fait, si nous voulons que la réaction progresse de
gauche à droite, il faut neutraliser l'acide qui se forme en ajoutant
une base.
L'examen de la réaction (II.3) montre également
que lorsque la pression ????2 augmente, l'équilibre se
déplace vers la droite et donc [Me2+] diminue en solution.
II.2.2 La précipitation par cémentation
L'élimination d'un métal à partir d'une
solution acide d'un de ses sels est appelé cémentation [2].
Le métal le moins électropositif ou moins noble
va passer en solution et y déplacera un métal plus
électropositif ou plus noble que lui. C'est donc un processus
électrochimique [2].
Autrement dit, un métal donné, placé dans
une solution d'un autre métal de potentiel redox normal plus
élevé que le sien passera en solution provoquant par
conséquent la précipitation du métal qui se trouvait en
solution.
mNN+ + nM = nMM+ + mN (II.5)
avec N le métal noble et M l'agent
précipitant.
Fe = Fe2+ + 2e- E0= +0,440V
(II.6)
Cu2+ + 2e- = Cu E0= +0,337V
(II.7)
Cu2+ + Fe = Fe2+ + Cu AE0 =
+0,777 V (II.8)
II.2.3 L'élimination des ions par extraction par
solvant
L'extraction par solvant ou extraction liquide-liquide est un
procédé de transfert de matière utilisé dans
l'industrie minérale pour la purification de solutions de lixiviation
[17]. Il consiste à déplacer sélectivement les ions du
métal recherché de la solution aqueuse de lixiviation vers une
autre phase non miscible, typiquement une phase organique, avec la
première ; cette étape est appelée extraction.
Une fois que le transfert des ions a été
complété, les deux phases sont séparées en
profitant de leur différence de masse volumique.
Projet Multidisciplinaire_Groupe 6
Page | 7
La phase organique riche en ions métalliques, est alors
mise en contact avec une phase aqueuse pauvre pour y ramener les ions
métalliques recherchés. Cette étape, appelée
élution (stripping), est nécessaire car les
procédés de récupération du métal à
partir de la solution sont normalement accomplis en phase aqueuse
(électro-récupération, précipitation,
réduction, cristallisation).
En résumé, cette procédure permet la
récupération sélective des ions métalliques
recherchés, laissant de côté les ions indésirables.
Les deux étapes de l'extraction par solvant peuvent être
résumées par la réaction ci-dessous :
Extraction
2RH + Me2+ + SO4 2- ? R2 M + 2H+ + SO4 2-
(II.9)
Stripage
Org aq Org aq
Il en résulte que :
? L'extraction et le stripage se font suivant une
réaction d'équilibre qui est réversible en fonction de la
concentration relative des réactifs et des produits.
? La diminution de la concentration des ions H+
pousse la réaction vers la droite tandis que l'augmentation de cette
concentration la pousse vers la gauche.
II.2.4 La précipitation par
électrodéposition
La cémentation n'étant en somme qu'une
précipitation, il semble plus avantageux d'effectuer la
précipitation en utilisant directement une énergie
électrique. Comme il faut éviter toute addition métallique
au bain, on se sert d'anodes inattaquables en plomb durci par l'antimoine, en
graphite, etc... [17]
La précipitation par électrolyse entraîne
toujours la réalisation d'un cycle fermé de la solution entre
divers départements de l'usine. La bonne récupération du
métal requiert celle des métaux résiduels qui sont alors
renvoyés en amont du circuit.
L'électrolyse demande une solution suffisamment
concentrée et convenablement purifiée. D'autre part, elle ne
permet qu'un épuisement partiel de la solution sous peine d'obtenir une
mauvaise qualité de dépôt.
Projet Multidisciplinaire_Groupe 6
Page | 8
II.2.5 L'élimination des ions par résines
échangeuses d'ions
L'extraction solide-liquide se fait par des résines
synthétiques et celle liquide-liquide par des solvants organiques.
L'échange d'ions est la même que celle de l'extraction par
solvant, mais dans l'échange d'ions, les résines organiques sont
basées sur une matrice en polystyrènes et opère en fixant
le lit des solides dans une série des réacteurs [11]. Le
débit d'échange d'ions est strictement limité par le temps
de séjour. Ce mode de précipitation est la meilleure pour
purifier la solution de cobalt.
II.2.6 Précipitation par cristallisation
Cette méthode d'extraction est basée sur la
différence de solubilité des sels en fonction de la
température [17].
Par un refroidissement de la solution, la cristallisation de
certains métaux sous forme de sels s'effectue.
Une cristallisation partielle est effectuée par
évaporation ; on obtient ainsi des cristaux riches en sels insolubles et
une solution composée principalement de corps solubles. Cette
opération doit être répétée jusqu'à
l'obtention de composés purs.
La cristallisation nécessite donc une succession
d'opérations qui rend son coût prohibitif et a été
remplacée par l'extraction par solvant ou l'échange d'ions
[17].
II.2.7 Précipitation d'un composé insoluble
ou précipitation chimique
La précipitation est une opération analytique
consistant à faire passer un ion sous forme d'un composé peu
soluble appelé précipité [4].
Dans cette méthode, les composés insolubles du
métal désiré peuvent être formés par addition
d'agent précipitant, par élévation de pH de la solution
grâce à l'ajout d'une base.
Par cette méthode, nous pouvons précipiter des
hydroxydes, sulfures, carbonates, phosphates, arséniates, etc... [8]
La précipitation joue un rôle très
important dans les processus
hydrométallurgiques. Elle est utilisée comme un
moyen de séparation pour récupérer les métaux de
leur solution. Durant le processus de lixiviation, hormis le métal
valorisable, certains
Projet Multidisciplinaire_Groupe 6
Page | 9
autres métaux peuvent entrer en solution. Il est
essentiel que ces métaux précipitent et soient
éliminés de la solution pour qu'enfin soit
récupéré le métal valorisable [4].
a. Principe de formation d'un
précipité
La formation d'un précipité est régie par
la loi suivante : le produit des concentrations des ions dans la solution doit
être au moins égal au produit de solubilité de la substance
pour cette température [4].
Autrement dit, le produit de solubilité
théorique doit être inférieur ou égal au produit de
solubilité pratique ou quotient de solubilité.
KS = QS (II.10)
avec KS: produit de solubilité théorique ;
QS: produit de solubilité pratique ou quotient de
solubilité.
La solubilité est la concentration d'une solution
saturée à une température donnée. Elle correspond
à la quantité maximum de soluté que l'on peut dissoudre
dans une quantité déterminée de solvant. La
solubilité s'exprime en g/L ou en mol/L.
Le produit de solubilité est le produit des
concentrations des ions dans une solution saturée d'un
électrolyte peu soluble, lesquelles concentrations sont affectées
chacune d'un exposant égal à l'indice de l'ion dans la
molécule.
Le produit de solubilité est constant à une
température déterminée.
Trois cas distincts sont à envisager pour un
électrolyte de type AxBy dont la réaction peut s'écrire
:
AxBy ? xA"- + yBm+ (II.11)
Ks < [A"-] x[Bm+]y : La
solution est dite insaturée ; Ks = [A"-]x[
Bm+]y : La solution est dite saturée ; Ks >
[A"-]x[ Bm+]y : La solution est dite
sursaturée.
C'est lorsque la solution est saturée qu'il y a formation
d'un précipité du
composé.
Page | 10
b. Quelques phénomènes rencontrés
lors d'une réaction de précipitation
b.1 la coprécipitation
La coprécipitation est le dépôt de la
substance principale avec des substances étrangères qui ne
précipitent pas avec le réactif employé dans des
conditions expérimentales déterminées [13]. A titre
d'exemple, l'addition d'acide sulfurique à une solution chlorhydrique
d'ions Ba2+ et Fe3+ précipite le sulfate de baryum
mais également le sulfate de Fer (III) généralement
soluble dans l'eau. Ainsi donc, la coprécipitation est une source
d'erreur très importante en gravimétrie.
b.2 L'adsorption
L'adsorption est la fixation d'ions ou des molécules
à la surface d'un précipité. Par exemple, le
précipité de chlorure d'argent formé lors de l'addition
d'une solution de nitrate d'argent à une solution de NaCl adsorbe les
ions Ag+ en excès. Les ions ou les molécules
adsorbés sont éliminés par lavage du précité
[13].
b.3 L'occlusion
C'est l'emprisonnement des particules
coprécipitées à l'intérieur des particules du
précipité principal. Pour éliminer les particules
occluses, il faut dissoudre le précipité dans un solvant
approprié [13].
c. Précipitation des hydroxydes, des phosphates,
des arséniates et des sulfures c.1 Précipitation des
hydroxydes
La précipitation sélective des hydroxydes des
métaux par variation de pH est peut être la méthode la plus
utilisée pour l'élimination de certains métaux des
solutions de lixiviation impures [5].
La précipitation dépend grandement du produit de
solubilité de l'hydroxyde.
Les valeurs de pH auxquelles les différents hydroxydes
commencent à précipiter des solutions peuvent être
déterminées de la manière suivante :
Projet Multidisciplinaire_Groupe 6
Pour un hydroxyde du type Me(OH)n, la
réaction peut s'écrire :
Projet Multidisciplinaire_Groupe 6
Page | 11
Me(OH)n ? Men+
+ n OH- (II.12)
Ks= [Men+][ OH-]n (II.13)
log Ks = log[Men+] + n log[OH-]
(II.14)
Nous trouvons finalement :
Ks
pH = 14- 1 log
(II.15)
n [Me??+]
où Ks est le produit de solubilité, fonction de la
température et [Mn+] est la concentration en ions
métalliques.
Le diagramme de précipitation des hydroxydes des
métaux est donné à la figure II.1 [5]; il permet d'estimer
les solubilités théoriques des hydroxydes des métaux pour
une valeur donné de pH.
Sur ce diagramme, nous pouvons lire l'ordre de
précipitation des hydroxydes des certains métaux en fonction du
pH croissant.
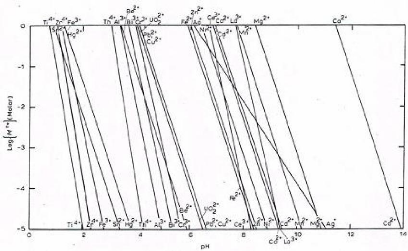
Figure II.1. Diagramme de solubilité des hydroxydes
des métaux en fonction de la concentration molaire et du pH
Projet Multidisciplinaire_Groupe 6
Page | 12
Les réactifs utilisés dans ce procédé
de purification sont la chaux, le calcaire, la soude caustique... Dans la
métallurgie du cuivre, la chaux reste l'agent le plus utilisé
[8].
Les valeurs de pH de début de précipitation des
certains hydroxydes sont données dans le tableau II.1. Nous pouvons
remarquer que la séparation des certains métaux est difficile ;
c'est pour le cas par exemple du cuivre et du zinc.
Tableau II.1-Valeurs de pH de précipitation de
certains hydroxydes [5].
pH Ion métallique
3 Sn++, Fe+++, Zr++++
4 Th++++
5 Al+++
6 Zn++, Cu++,
Cr+++
7 Fe++
8 Co++, Ni++,
Cd++
9 Ag+, Mn++,
Hg++
11 Mg++
c.2 Précipitation des sulfures
La précipitation des sulfures des métaux se
produit à des pH caractéristiques des sulfures à obtenir.
L'ordre suivant lequel les sulfures précipitent avec l'augmentation du
pH est de sulfures de : arsenic, mercure, argent, cuivre, bismuth, cadmium,
plomb, étain, zinc, cobalt, nickel, fer, manganèse [5].
Les sulfures de Hg(III), As(III), Sb(III), Sn(IV), Pb(II),
Bi(III), Cd(III) et Cu(II) précipitent dans les solutions acides ; par
contre les sulfures de Fe(II), Zn(II), Ni(II), Co(II) précipitent dans
les solutions faiblement acides ou neutres. Le premier groupe des métaux
est précipité sous forme des sulfures à pH entre 1.0 et
2.5 alors que le second donne ses précipités a pH
supérieur à 4 mais inférieur à 4.3 de
préférence [8].
Pour un sulfure du type MeS, nous aurons en solution aqueuse
MeS ? Me2+ + S2- (II.16)
Projet Multidisciplinaire_Groupe 6
Page | 13
Le produit de solubilité peut s'écrire :
Ks = [Me2+][S2-] (II.17)
log Ks = log [Me2+] + log [S2-] (II.18)
Pour le système de sulfure, on assume que les solutions
soient en équilibre avec du H2S gazeux, et l'équilibre
impliqué est [5] :
H2S(g) ? 2H+ + S2-
(II.19)
Kp est la constante d'équilibre de cette
réaction
Ainsi, la relation entre pH et l'activité ionique de
sulfure est donnée par la
relation:
log [S2-] = 2pH +
log????2??+ log Kp (II.20)
Nous pouvons ainsi relier le pH de précipitation des
sulfures avec la concentration en ions métalliques en combinant les
relations (II.18) et (II.20), nous obtenons alors
pH = 1 ????
2 (?????? ([????2+]*????2??*????))
(II.21)
Le diagramme de précipitation des sulfures des
métaux est donné à la figure II.2 ; il permet d'estimer
les solubilités théoriques des sulfures des métaux pour
une valeur de pH donné et d'activité en ions S2-.
Projet Multidisciplinaire_Groupe 6
Page | 14
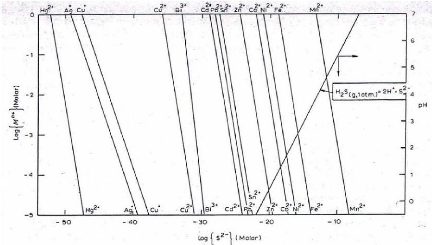
Figure II.2. Diagramme de précipitation des sulfures
des métaux en fonction de la concentration molaire en sulfure, en ion
métallique ainsi que du pH [5]
Dans ce procédé, on peut utiliser plusieurs
agents sulfurants dont le sulfure de calcium (CaS), le sulfure de sodium
(Na2S), le sulfure d'hydrogène (H2S), l'hydrogénosulfate de
sodium (NaHS) [8].
c.3 Précipitation des phosphates et
arséniates
Comme pour les hydroxydes et les sulfures, la
précipitation des phosphates et arséniates est gouvernée
par le produit de solubilité du composé et le pH [10].
Pour le système d'arséniate, la dissociation de
l'acide arsénique est considérée comme la source d'ions
arséniates. Les équilibres impliqués sont :
K13
H+ + H2As04 # H3AsO4 (II.22)
K12
H+ + HAs04- # H2As04 (II.23)
K1
H+ + As04- # HAs04- (II.24)
L'équilibre généralisé sera alors
:
/31n
nH+ + As04- # HnAs043-n)- (/31n
= K1.K12...K1n) (II.25)
Projet Multidisciplinaire_Groupe 6
Page | 15
La relation qui lie le pH à l'activité de l'ion
arséniate dans le cas des arséniates des métaux est
donnée par :
log [As??43-] = log [HnAs??4
(3-??)-] + npH- logâ1n (II.26)
|
D'où pH= 1 (?????? [??????4
3-]*??1??
?? [??????????4 (3-??)-]
|
) (II.27)
|
Le même raisonnement peut être appliqué aux
phosphates des métaux !
Les figures II.3 et II.4 reprennent les diagrammes de
précipitation des arséniates et des phosphates des métaux
pris à 25°C [5]. Ils permettent d'estimer les solubilités
théoriques des arséniates et phosphates des métaux pour
une valeur de pH donné et d'activité en ions
As??43- ???? ????43-.
Projet Multidisciplinaire_Groupe 6
Page | 16
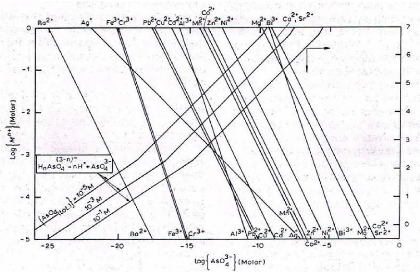
Figure II.3. Diagramme de précipitation des
arséniates en fonction de la concentration molaire des ions
métalliques, des arséniates et du pH.
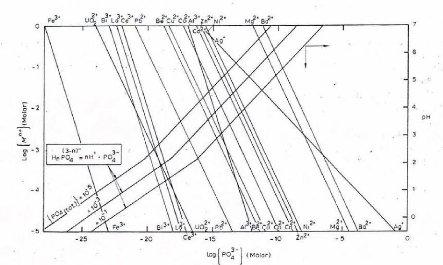
Figure II.4. Diagramme de précipitation des phosphates
en fonction de la concentration molaire des ions métalliques, des
phosphates et du pH.
Projet Multidisciplinaire_Groupe 6
Page | 17
CHAPITRE III: DIAGRAMMES DE POURBAIX DES SYSTEMES
Cu-H2O, Zn-H2O, Fe-H2O et S-H2O
III.1 Introduction
Dans une solution, il peut s'établir une succession
d'équilibres entre différentes espèces et le calcul de
leurs concentrations peut être relativement complexe. Pour
résoudre ce problème, les chimistes ont établi de nombreux
diagrammes d'équilibres thermodynamiques. Leur utilisation permet de
prévoir les réactions thermodynamiquement possibles lorsque l'on
met en présence différents réactifs ou solutions et de
connaître les espèces prédominantes une fois les
équilibres établis [1].
Les diagrammes potentiel-pH présentent
l'évolution du potentiel standard des couples redox en fonction du pH
pour différentes valeurs du logarithme décimal des concentrations
des espèces dissoutes. Ces diagrammes sont tracés à la
température de 25°C.
III.2 Diagramme de Pourbaix du système
cuivre-eau
Dans le diagramme du système cuivre-eau à
25°C [6], nous remarquons que le cuivre sous forme Cu2+ est
stable à des pH acides et en milieu oxydant. D'une façon
générale, il faudrait des conditions acides et oxydantes pour
rompre l'équilibre afin d'obtenir les ions cuivriques, les conditions
acides sont suffisantes pour se retrouver dans le domaine de stabilité
de Cu2+.
Pour obtenir l'hydroxyde de cuivre, il nous faudrait des
conditions peu acides ou basiques et oxydantes.
La précipitation des ions Cu2+ sous forme
d'hydroxyde se fait suivant la réaction ci-dessous :
Cu2+ + 2H2O = Cu(OH)2 + 2H+ (III.1)
log [Cu2+] = 9,21 -2pH (III.2)
Projet Multidisciplinaire_Groupe 6
Page | 18
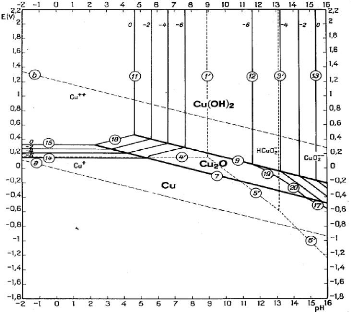
Figure III.1. Diagramme E-pH du système Cu-H2O
tracé à 25°C. Les droites (a) et (b) délimitent le
domaine de stabilité de l'eau.
III.3 Diagramme de Pourbaix du système
zinc-eau
Dans le diagramme du système zinc-eau, nous retrouvons
les ions zinciques (Zn2+) dans le domaine des pH acides et des
potentiels légèrement réducteurs et oxydants.
La réaction entre l'oxyde de zinc et les ions
H+ conduit à la solubilisation du zinc et l'obtention des
ions zinciques selon l'équilibre suivant [6] :
ZnO + H+ = Zn2+ + H2O (III.3)
log [Zn2+] = 10,96 - 2pH (III.4)
La précipitation des ions zinciques sous forme
d'hydroxyde s'obtient par la réaction suivante :
Zn2+ + 2H2O = Zn(OH)2 + 2H+ (III.5)
log [Zn2+] = 12,26 -2pH (III.6)
Projet Multidisciplinaire_Groupe 6
Page | 19
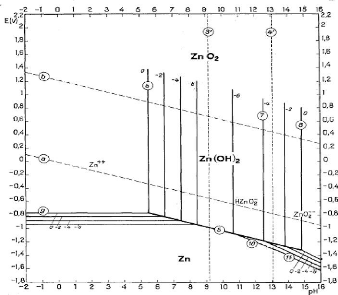
Figure III.2. Diagramme E-pH du système Zn-H2O
tracé à 25°C. Les droites (a) et (b) délimitent le
domaine de stabilité de l'eau.
III.4 Diagramme de Pourbaix du système
soufre-eau
Tous les corps de nombre d'oxydation intermédiaire
entre les extrêmes -2 (sulfures) et +6 (sulfates), hormis le nombre
d'oxydation 0 présenté par le soufre solide, sont
thermodynamiquement instables et tendent à se dismuter. Ainsi, les
thiosulfates, les hydrosulfites, les sulfites et les polythionates sont en faux
équilibre en présence de solutions aqueuses; d'autre part, les
persulfates sont thermodynamiquement instables en présence d'eau. Si les
équilibres étaient réalisés, on ne devrait trouver
en solution que H2S, HS-, S2-, S,
HSO4-et SO42-
[6].
Projet Multidisciplinaire_Groupe 6
Page | 20
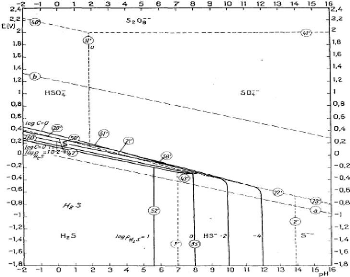
Figure III.3. Diagramme E-pH du système S-H2O
tracé à 25°C. Les droites (a) et (b) délimitent le
domaine de stabilité de l'eau.
III.5 Diagramme de Pourbaix du système
fer-eau
Le fer est un élément nocif lors de
l'électrolyse pour la récupération des métaux
valorisables dans une solution. Il est donc important de l'éliminer de
la solution avant de l'acheminer à la salle d'électrolyse.
On élimine le fer en fixant le pH entre 2 et 6,5 afin
d'éviter la précipitation du zinc. On prend la précaution
d'oxyder au préalable le fer (II) en fer (III) par injection d'air ou
par ajout, par exemple, de dioxyde de manganèse [7].
L'oxydation du fer (II) en fer (III) se fait selon
l'équilibre :
Fe2+? Fe3+ + ??-
(III.7)
Page | 21
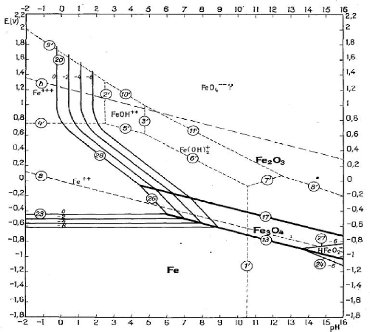
Figure III.4. Diagramme E-pH du système Fe-H2O
tracé à 25°C. Les droites (a) et (b) délimitent le
domaine de stabilité de l'eau.
Projet Multidisciplinaire_Groupe 6

PARTIE EXPERIMENTALE
Projet Multidisciplinaire_Groupe 6
Page | 22
Projet Multidisciplinaire_Groupe 6
Page | 23
CHAPITRE IV: ESSAIS DE PRECIPITATION DU CUIVRE PAR
SULFURATION
IV.1 METHODES EXPERIMENTALES
IV.1.1 Materiels
Pour nos essais, nous avons utilisé les materiels suivants
:
a. Verrerie
· Les ballons jaugés de 500, 1000 et 2000 ml ;
· Les béchers de 600,1000 et 5000 ml ;
· Les éprouvettes de 25 et 500 ml ;
· Un verre de montre ;
· Les pipettes de 5 et 10 ml ;
· Une burette de 50 ml ;
· Une fiole pour filtration.
b. Appareillage
· Une balance électronique ;
· Un agitateur magnétique chauffant;
· Une pompe à vide ;
· Un chronomètre ;
· Un pH- mètre muni d'une sonde de
température.
c. Accessoires
· Une pissette ;
· Un barreau magnétique ;
· Un mortier ainsi que le pilon ;
· Un entonnoir ;
· Une pro-pipette ;
· Un Büchner ;
· Des papiers filtres ;
· Des flacons de 60 ml ;
Projet Multidisciplinaire_Groupe 6
Page | 24
· Une spatule.
d. Réactifs
Les réactifs ayant été utilisés au
cours de nos essais sont :
· Le sulfate de cuivre hydraté ;
· L'acide sulfurique concentré ;
· La soude caustique ;
· Le dioxyde de manganèse ;
· Le permanganate de potassium ;
· Le sulfure de sodium ;
· Le sulfate d'ammonium ;
· La solution de sulfate de zinc issue de la lixiviation
de l'oxyde zinc produit à la STL (Société pour le
Traitement du Terril de Lubumbashi) dont la composition est reprise dans le
tableau IV.1.
e. Dispositif expérimental
Le dispositif expérimental utilisé pour nos
différents essais est donné à la figure IV.1 ci-dessous
:

Figure IV.1. Dispositif expérimental lors des essais
de sulfuration du cuivre
Projet Multidisciplinaire_Groupe 6
Page | 25
Ce dispositif est constitué de :
· Un agitateur magnétique chauffant ;
· Un bécher (réacteur) de 600 ml ;
· Un statif avec une burette de 50 ml ;
· Un pH-mètre muni d'une sonde de température
;
· Un potentiomètre ;
· Un porte-électrode.
IV.1.2 Préparation de la solution de sulfate de
zinc
a. Matière première
Nous avons utilisé la poudre d'oxyde de zinc produit
au four de fusion de la scorie de STL pour préparer la solution à
soumettre au décuivrage. La composition chimique de cet oxyde est
donnée dans le tableau IV.1 ci-dessous :
Tableau IV.1-Composition chimique de l'oxyde de zinc
Elément Zn Co Cu Cd Fe Pb C S Hum
Teneur (%) 63.47 0.05 0.18 0.12 0.34 0.33 0.01
0.3 8
b. Lixiviation de la poudre de ZnO
Les conditions opératoires utilisées pour
effectuer cette lixiviation sont :
· Quantité de poudre de ZnO : 150 g ;
· Volume de la pulpe : 1000 ml ;
· Quantité d'acide sulfurique : 100 g ;
· Température : 75°C ;
· Agitation : 700 tr/min ;
· Temps : 1 heure.
La solution obtenue après lixiviation et filtration a
été dopée avec du sulfate de cuivre afin d'atteindre une
concentration en cuivre de 1 g/l car ne disposant pas d'une solution
industrielle. La composition chimique de la solution obtenue après
dopage est donnée dans le tableau IV.2 suivant :
Projet Multidisciplinaire_Groupe 6
Page | 26
Tableau IV.2-Composition de la solution de sulfate de
zinc
Element Zn Cu Fe
Concentration en g/l 95.250 0.941 0.471
c. Elimination du fer par précipitation de la
jarosite
Après avoir obtenu la solution de sulfate de zinc,
nous avons procédé à l'élimination du fer qui est
aussi une impureté en hydrométallurgie du zinc. Afin d'atteindre
cet objectif nous avons procédé ainsi :
· Prélever la solution de sulfate de zinc dans un
bécher;
· Démarrer l'agitateur magnétique à
400 tr/min ;
· Plonger l'électrode de mesure de potentiel redox
de la solution ;
· Ajouter progressivement du KMnO4 jusqu'à
atteindre un potentiel supérieur à 800 mV ;
· Ajuster le pH à 3 ;
· Ajouter la quantité de sulfate d'ammonium
nécessaire ;
· Filtrer la solution et récupérer le
filtrat.
C'est après cette opération que nous sommes
passés aux essais proprement dit de sulfuration de cuivre.
IV.1.3 Mode opératoire
1. Prélever 500 ml de la solution et verser dans un
bécher de 600 ml ;
2. Démarrer l'agitateur magnétique à 400
tr/min ;
3. Plonger les électrodes du pH-mètre et de la
sonde de température déjà calibrées ;
4. Ajouter une solution d'acide sulfurique ou celle de soude
caustique afin de régler le pH de travail ;
5. Ajouter le sulfure de sodium (Na2S.2H2O) ;
6. Démarrer le chronomètre juste au moment
d'ajout de sulfure de sodium ;
7. Maintenir constant le pH en ajoutant une solution d'acide
sulfurique ou celle de soude caustique;
8. Arrêter l'essai à 25 minutes;
9. Filtrer la solution ;
Projet Multidisciplinaire_Groupe 6
Page | 27
10. Mesurer le volume du filtrat à l'aide d'un ballon
jaugé ou d'une éprouvette graduée ;
11. Prélever un échantillon du filtrat à
envoyer aux analyses.
IV.2 ESSAIS PROPREMENT DITS
IV.2.1 Influence de la quantité de sulfure de
sodium (Na2S.2H2O) a. But
Le but de ces essais est de déterminer la
quantité de sulfure de sodium à utiliser pour éliminer
plus de cuivre présent dans la solution et de minimiser la
coprecipitation du zinc.
b. Conditions opératoires
Les conditions opératoires retenues pour
étudier l'effet de la quantité de sulfure de sodium sur le
rendement de décuivrage sont :
? Agitation : 400 tr/min ;
? Température : ambiante (28°C); ? Temps : 25
minutes ;
? pH : 2 ;
? Quantité de Na2S.2H2O variable: 0,84 g ; 1,00 g ; 2,00
g et 4,20 g.
c. Résultats
Les résultats des analyses fes filtrats ainsi que les
rendement de sulfuration et de déferrage sont repris dans les tableaux
IV.3 et IV.4 :
Tableau IV.3-Résultats des analyses chimiques de
filtrats de différents essais
|
Essais
|
|
|
Concentration en g/l
|
|
|
Qté Na2S.2H2O
|
Zinc
|
Cuivre
|
Fer
|
|
1
|
0.84 g
|
73,00
|
0,1345
|
0,0158
|
|
2
|
1.00 g
|
81,00
|
0,0844
|
0,0312
|
|
3
|
2.00g
|
78,75
|
0,00023
|
0,0139
|
|
4
|
4.2 g
|
77,75
|
0,0004
|
0,0344
|
Projet Multidisciplinaire_Groupe 6
Page | 28
Tableau IV.4-Rendements d'élimination de zinc, cuivre
et fer en fonction de la quantité de sulfure de sodium.
|
Essais
|
Rendements d'élimination de zinc, cuivre et fer
(%)
|
|
Zinc
|
Cuivre
|
Fer
|
|
1
|
23,36
|
85,71
|
96,65
|
|
2
|
14,96
|
91,03
|
93,38
|
|
3
|
17,32
|
99,98
|
97,05
|
|
4
|
18,37
|
99,96
|
92,70
|
La figure IV.2 nous donne une représentation graphique
du rendement d'élimination du zinc, cuivre et fer en fonction de la
quantité de sulfure de sodium.
120
100
Zinc Cuivre Fer
Rendement (%)
80
60
40
0.84 1 2 4.2
Quantité de Na2S.2H2O en g
20
0
Figure IV.2. Influence de la quantité de Na2S.2H2O sur
le rendement d'élimination de zinc, cuivre et fer.
d. Constatation :
L'analyse de la figure IV.2 montre que :
? Le rendement de sulfuration du cuivre croît avec la
quantité de sulfure de sodium ajouté à la solution ;
Projet Multidisciplinaire_Groupe 6
Page | 29
? La sulfuration du zinc diminue anormalement d'abord puis
elle croît avec la quantité de sulfure ajouté ;
? Le rendement d'élimination du fer n'a pas un
comportement régulier.
e. Interprétation :
? Les rendements d'élimination de fer
élevés s'expliquent par le fait que lors de l'oxydation des ions
Fe2+ en Fe3+, nous avons porté le potentiel redox
de la solution à des valeurs très élevées
(supérieures à 900 mV). Cela a fait qu'il était possible
de précipiter la majeure partie de fer sous forme de Fe(OH)3 à
l'étape de déferrage. S'il existe du fer éliminé
sous forme de sulfure lors de l'ajout de Na2S.2H2O, cela devrait être en
faible quantité ;
? L'augmentation des rendements de sulfuration de cuivre et
zinc avec la quantité de Na2S.2H2O est due au fait qu'il y a plus d'ions
HS- disponibles en solution qui réagissent d'abord avec les
ions Cu2+puis avec les ions Zn2+ (voir figure IV.2)
Nous retenons la quantité de sulfure de sodium
Na2S.2H2O de 2 g pour la suite
de nos essais.
IV.2.2Influence du pH
a. But
Le but de ces essais est de déterminer le pH optimal
pour lequel nous aurons un bon rendement de sulfuration du cuivre et une faible
précipitation du zinc sous forme de sulfure ZnS.
b. Conditions opératoires
Pour étudier l'influence de ce paramètre, nous
avons retenu les conditions opératoires suivantes :
? Agitation : 400 tr/min ;
? Température : ambiante (28°C) ; ? Temps : 25
minutes ;
? Quantité de Na2S.2H2O : 2,00 g. ? pH variable : 1 ; 3 et
4.
Projet Multidisciplinaire_Groupe 6
Page | 30
c. Résultats
Les tableaux IV.5 et IV.6 reprennent les résultats
d'analyse ainsi que des rendements de sulfuration et de déferrage.
Tableau IV.5-Résultats des analyses chimiques des
filtrats
|
Essais
|
pH
|
|
Concentration en g/l
|
|
|
Zinc
|
Cuivre
|
Fer
|
|
5
|
1
|
91,77
|
0,00019
|
0,0444
|
|
3
|
2
|
78,75
|
0,00023
|
0,0139
|
|
6
|
3
|
74.01
|
0,00330
|
0,0009
|
|
7
|
4
|
70,10
|
0,0265
|
0,0000
|
Tableau IV.6-Rendements d'élimination de zinc, cuivre
et fer en fonction du pH de la solution
Rendements d'élimination de zinc, cuivre et fer en
fonction du
|
Essais
|
|
pH
|
|
|
Zinc
|
Cuivre
|
Fer
|
|
5
|
3,65
|
99,980
|
90,573
|
|
3
|
17,32
|
99,976
|
97,049
|
|
6
|
22,30
|
99,649
|
98,089
|
|
7
|
26,40
|
97,184
|
100
|
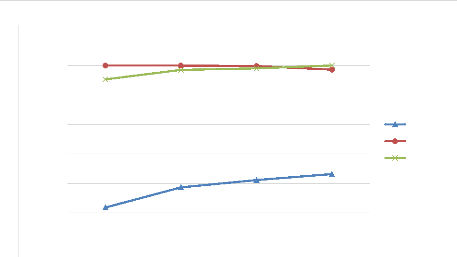
La figure IV.3 nous donne une représentation graphique des
rendements d'élimination de zinc, cuivre et fer en fonction du pH.
Projet Multidisciplinaire_Groupe 6
Page | 31
20
0
1 2 3 4
pH
120
100
rendement de (%)
80
60
40
Zinc Cuivre Fer
Figure IV.3. Influence du pH sur le rendement
d'élimination de zinc, cuivre et fer
d. Constatation :
L'analyse de la figure IV.3 montre que :
? Le rendement de sulfuration du cuivre décroît
avec le pH alors que celui de zinc croît ;
? Le rendement d'élimination du fer croît avec
le pH et à pH 4, il est de 100% ;
e. Interprétation :
? L'accroissement et la forte diminution de rendement de
sulfuration respectivement du zinc et du cuivre seraient dus à
l'augmentation de la teneur en HS- avec le pH de la solution ;
? L'élimination du fer augmente avec le pH car lorsque
ce paramètre augmente, les ions Fe3+ sous forme
d'hydroxydes.
Nous retenons le pH 1 comme valeur optimale d'élimination
de cuivre.
IV.2.3 Influence de la température dans le
réacteur a. But
Le but de cet essai est d'étudier l'influence de la
température sur le rendement d'élimination de zinc, cuivre et
fer.
Projet Multidisciplinaire_Groupe 6
Page | 32
b. Conditions opératoires
Les conditions opératoires retenues sont :
? Agitation : 400 tr/min ;
? Temps : 25 minutes ;
? Quantité de Na2S.2H2O : 2,00 g.
? pH : 4 ;
? Température : 45°C.
c. Résultats
Les résultats des analyses du filtrat et des rendements
d'élimination de zinc cuivre et fer sont donnés respectivement
dans les tableaux IV.7 et IV.8 suivants.
Tableau IV.7-Résultats des analyses chimiques du
filtrat
Concentration en g/l
Essai pH Température Zinc Cuivre Fer
|
7
|
4
|
28°C
|
70,10
|
0,0265
|
0,000
|
|
8
|
4
|
45°C
|
78,5
|
0,00005
|
0,000
|
Tableau IV.8-Rendements d'élimination de zinc, cuivre
et fer en fonction de la température dans le réacteur
Concentration en g/l
Essai Température Zinc Cuivre Fer
|
7
|
28°C
|
26,40
|
97,184
|
100
|
|
8
|
45°C
|
17,59
|
99,994
|
100
|
Projet Multidisciplinaire_Groupe 6
Page | 33
|
|
|
|
|
|
|
|
|
|
|
|
120 100 80 60 40
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rendement (%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zinc Cuivre Fer
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 45
|
|
|
|
|
|
Température dans le réacteur
|
|
|
|
|
Figure IV.4. Rendement d'élimination de zinc, cuivre
et fer en fonction de la température dans le réacteur
Sur la figure IV.4, nous pouvons constater que le rendement
d'élimination de zinc décroît avec la température
dans le réacteur alors que celui de cuivre croît. Quant au
rendement d'élimination du fer, il reste maximum à cette
température.
Cette observation s'expliquerait par le fait que la
température pourrait agir sur le produit de solubilité. Lorsque
la température augmente, le produit de solubilité augmente aussi
légèrement. Ainsi la solubilité de ZnS qui croit avec la
température, il se dissocie facilement qu'à température
ambiante, ainsi les ions Zn2+ restent en solution. Pour le cuivre,
l'accroissement du rendement d'élimination pourrait s'expliquer par le
fait la solubilité de CuS est faible que celui de ZnS, il
précipite avant le zinc dans la solution.
Projet Multidisciplinaire_Groupe 6
Page | 34
CONCLUSION
Dans ce travail, nous avons mené une étude
portant sur la purification des solutions. Dans la première partie, nous
avons fait une étude bibliographique portant sur les différentes
méthodes de purification des solutions ; nous avons retenu la
purification par précipitation chimique par sulfuration des
métaux présents dans la solution.
Cette étude a porté sur l'élimination du
cuivre de la solution de sulfate de zinc dont la composition est reprise dans
le tableau IV.1 ; nous avons donc retenu les conditions suivantes qui donnent
des bons résultats de purification :
? Agitation : 400 tr/min ;
? Température : ambiante (28°C) ; ? Temps : 25
minutes ;
? Quantité de Na2S.2H2O : 2,00 g ; ? pH: 1.
Au vu de ces résultats, nous pouvons retenir ces
conditions pour l'élimination du cuivre d'une solution de sulfate de
zinc par sulfuration.
Projet Multidisciplinaire_Groupe 6
Page | 35
REFERENCES BIBLIOGRAPHIQUES
[1]. GORREC B. (Janvier 2005)-Thermodynamique et
cinétique électrochimique expérimentale.
[2]. ILUNGA MUTOMBO G. (2014-2015)-Notes de cours de
Métallurgie Extractive, Bac 2 Métallurgie et Chimie
industrielle, Faculté Polytechnique, UNILU. (Inédit).
[3]. MASHINDA TSHONA. (2009)-Elimination des ions cuivre
dans une solution de sulfate de zinc-Influence de l'acidité,
Travail de fin de cycle, faculté polytechnique, UNILU.
(Inédit)
[4]. MESPLEDE J. (Août 2003)-Chimie MPSI,
Collection Les Nouveaux Précis Bréal, ISBN 978-274950-232-8, pp.
87-95.
[5]. MONHEMIUS A. J. (Déc 1977)-Precipitation
diagrams for metal hydroxides, sulphides, arsenates and phosphates, Trans
IMM C, vol. 86, ISSN 0371-9553, pp. 02-06.
[6]. POURBAIX M. et al. (Déc 1977)-Atlas
d'équilibres électrochimiques, Gauthier-Villars &
Cie.
[7]. VIGNES J-L, JEHANNE Y. (Octobre
2003)-L'Hydrométallurgie, Bull. Un. Phys., vol. 97, N°
857, pp. 1281-1299.
[8]. Rolf K. Gadd et al, Methods of purifying
waste aqueous solutions from heavy metals,
United States patent, Avril 1984. Disponible via le lien
http://www.google.com/googlebooks/uspto.html(consulté
le 20 Septembre 2015).
[9]. KANDA J-M. (2014-2015)-Notes de cours de Chimie
analytique, Bac 2 Métallurgie et Chimie industrielle et Mines,
Faculté Polytechnique, UNILU. (Inédit).
[10]. Yeonuk C. et al. (Mars 1985)-Selective
precipitation of metal sulfides, United States patent.
[11]. Techniques de l'ingénieur.
(2014-2015)-Métallurgie extractive et recyclage des
Métaux de transition, Réf. Internet 42369. (Disponible sur
le site
http://www.techniques-ingenieur.fr).
[12]. INERIS. (2014)-Données
technico-économiques sur les substances chimiques en France: Zinc et
principaux composés, DRC-14-136881-02237A, 74p.
(http://rsde.ineris.fr/ ou
http://www.ineris.fr/substances/fr/).
[13]. PIRSON P. et al. (2011)-Chimie
6è, Collection chimie, ISBN 978-2-8041-6360-0, 208p.
[14]. CNUCED :
http://www.unctad.org/infocomm/francais/zinc/utilisat.htm
(consulté le 01 Novembre 2015).
Projet Multidisciplinaire_Groupe 6
Page | 36
[15]. LWEMBWE YAV R. (2013)-Rapport de stage effectué
à la société pour le traitement de Lubumbashi (STL) du 18
Mars au 13 Avril 2013. (Inédit)
[16]. KASONGO NZAZI R. (2013)-Contribution à
l'étude d'élimination du cobalt contenu dans une solution de
sulfate de zinc issue de la lixiviation des poussières ex-STL par
cémentation sur colonne, Travail de fin d'études,
Faculté Polytechnique, UNILU. (Inédit)
[17]. RIZET L., CHARPENTIER P-E. (2008)-Métallurgie
extractive_Hydrométallurgie, Techniques de l'ingénieur
Page | 0
Projet Multidisciplinaire_Groupe 6
| 


