|
UNIVERSITE CHEIKH ANTA DIOP DE DAKAR

FACULTE DES SCIENCES ET
TECHNIQUES
Département de biologie animale
Année : 2018 Numéro : 411
Données sur la biodiversité ichtyologique
marine : cas de la
baie de Hann et de la Zone Economique Exclusive
(ZEE)
du Sénégal
MEMOIRE DE FIN D'ETUDES
Présenté pour l'obtention du
Diplôme de Master II en Biologie
Animale
Spécialité
Ecologie et Gestion des Ecosystèmes
Présenté et soutenu publiquement le 05 mars
2018
Au Département de Biologie Animale
Par
M. Naby Souleymane FAYE
JURY
Président : M. Cheikh Tidiane BA,
Professeur titulaire (FST-UCAD)
Membres : Mme Constance AGBOGBA,
Maîtres de Conférences (FST-UCAD) M. Patrice BREHMER, Chercheur,
HDR (IRD-LEMAR)
M. Massal FALL, Chercheur, Chargé de Recherche
(ISRA-CRODT)
M. Papa Ibnou NDIAYE, Maîtres de Conférences
(FST-UCAD)

ii
UNIVERSITE CHEIKH ANTA DIOP DE DAKAR

FACULTE DES SCIENCES ET
TECHNIQUES
Département de biologie animale
Année : 2018 Numéro : 411
Données sur la biodiversité ichtyologique
marine :
cas de la baie de Hann et de la Zone
Economique
Exclusive (ZEE) du Sénégal
MEMOIRE DE FIN D'ETUDES
Présenté pour l'obtention du
Diplôme de Master II en Biologie
Animale
Spécialité
Ecologie et Gestion des Ecosystèmes
Présenté et soutenu publiquement le 05 mars
2018
Au Département de Biologie Animale
Par
M. Naby Souleymane FAYE
JURY.
Président : M. Cheikh Tidiane BA,
Professeur titulaire (FST-UCAD)
Membres : Mme Constance AGBOGBA,
Maîtres de Conférences (FST-UCAD) M. Patrice BREHMER, Chercheur,
HDR (IRD-LEMAR)
M. Massal FALL, Chercheur, Chargé de Recherche
(ISRA-CRODT) M. Papa Ibnou NDIAYE, Maîtres de Conférences
(FST-UCAD)
DEDICACES

iii
Je dédie ce travail
A Allah le Tout Puissant, le Clément, le
Miséricordieux.
A son envoyé le Prophète Mouhamad,
Bénédiction et Paix sur Lui.
A mon très cher père Waly et à ma
très chère mère Seynabou KANTE, pour tous les sacrifices
que vous avez consentis à mon éducation. Votre soutien moral et
vos encouragements m'ont beaucoup aidé à réussir mes
études. Qu'Allah vous aide davantage et vous accorde santé et
longue vie.
A tous mes frères et soeur : Idrissa Wagane, Fatoumata
Bintou, Seydina Alioune, Mouhamadou Lamine et Ibrahima.
A mes neveux Seynabou, Naby Souleymane (mon homonyme) et
Ousmane.
A mon encadreur et directeur de l'ISRA/CRODT, le Docteur
Massal FALL. C'est grace à lui que ce travail a pu être
réalisé. Merci pour tout ce que vous m'avait appris et dans tout
ce que vous avez eu à m'impliquer.
A tous mes amis sans exception.
A Mme Ndour, ex-assistante du Doyen de la FST/UCAD. Je lui dois
mon parcours à l'UCAD.
REMERCIEMENTS

iv
La recherche en océanographie n'est jamais un travail
solitaire. Enrichie de nombreuses rencontres, cette expérience
scientifique fut également une belle aventure humaine. Cette
année et demie de stage n'aurait pu être finalisés sans de
nombreux soutiens tant professionnels que personnels. Ces quelques lignes me
permettent de remercier sincèrement et chaleureusement ceux et celles
qui ont permis la réalisation de ce travail.
Je tiens, d'abord, à exprimer ma profonde
reconnaissance à mon directeur de stage qui m'a accordé sa
confiance, soutenu et guidé dans ce travail : Dr. Massal
FALL, mon mentor. Vous m'avez beaucoup appris. Merci à vous,
initiateur de ce sujet de mémoire, encadrant au quotidien, travailleur
infatigable, d'avoir partagé vos connaissances en biodiversité
marine et pour vos conseils et la rigueur que vous avez apporté à
ce travail.
Au Dr Constance AGBOGBA, mon cher professeur,
mon mentor, qui m'a fait aimer la discipline de l'écologie. Elle est
comme une mère pour moi et pour nous tous, ses étudiants. Au
début, elle s'est déplacée jusqu'à l'ISRA pour
s'entretenir des conditions de mon stage avec mon encadreur. Vous avez fait
pour moi des choses que vous ne faites pas pour tout le monde. Vous êtes
ma plus grande source d'inspiration. Mille mercis à vous.
Au Pr Mbacké SEMBENE d'avoir bien voulu
m'accepter dans son master. Merci. Respect !
Au Dr Papa Ibnou Ndiaye qui a joué un
rôle important dans mon orientation dans les sciences de la mer grace
à ses cours et aux sorties pédagogiques que l'on faisait. Vous
m'avez inspiré. J'ai beaucoup d'admiration pour votre personne. Merci
pour votre disponibilité, votre sens de l'écoute et pour tout ce
que vous avez fait pour nous.
Au Pr Cheikh Tidiane Bâ. Vous
êtes doté d'une grande sagesse. Vous et le Dr. Ndiaye, avaient
joué un rôle important dans la quête d'une solution pour la
finalisation de ce travail. Vos conseils et directives m'ont été
d'une grande utilité. Puisse vos qualités humaines et
professionnelles et votre inlassable dévouement, nous inspirer dans la
vie. Mes hommages !
A l'ensemble du corps professoral du master
de biologie animale ainsi qu'à ou les professeurs qui
ont eu à m'enseigner depuis la maternelle. Merci à vous tous.
A tout le personnel du CRODT. Merci aux
Docteurs Ndiaga THIAM, Ismaïla NDOUR et
Oumar SADIO pour vos conseils précieux et votre
disponibilité à mon égard. Merci à tous mes
amis stagiaires (ingénieurs et doctorants) : Amidou, Yoba,
Fallou, Modou, Ousmane, Mamadou Niang, Kamarel, M. Ndepp Sène, Oulimata
Oumar Faye. Merci à Mme Racky SY qui a eu l'idée
de me présenter au directeur quand je cherchais un stage. Merci aux
techniciens M. Alassane DIENG, Mlle Djilane NDOYE, M. Oumar
NDIAYE et aux aides de plage Pape Samba et Iba.
A Mme Caty AIDARA FALL du CRODT, à
Mme DEME SAKHO de l'AUF et à M. DIOUF
de la Bibliothèque Universitaire de l'UCAD pour leur aide dans
ma recherche de documents scientifiques.
A M. Madické SECK dans la traduction
en anglais du résumé, à M. Mamadou NDIAYE
pour les tests statistiques et à M. Ibrahima DIACK
pour la confection de la carte de la zone d'étude.
SOMMAIRE

v
DEDICACE iii
REMERCIEMENTS iv
SOMMAIRE v
TABLEAUX vii
FIGURES vii
ACRONYMES & ABREVIATIONS viii
INTRODUCTION 1
CHAPITRE I. SYNTHESE BIBLIOGRAPHIQUE 3
I.1. Notions de biodiversité 3
I.1.1. Définition 3
I.1.2. Biodiversité marine 3
I.2. Notions halieutiques 3
I.2.1. Poissons 3
I.3. Notion de zone littorale et de zone côtière
5
I.4. Notion de pêche artisanale et de pêche
scientifique 6
I.4.1. Pêche artisanale 6
I.4.2. Notion de campagne scientifique de pêche 6
CHAPITRE II. MATERIEL & METHODES 8
II.1. Zone d'étude de la pêche artisanale : le
quai de pêche de Hann (baie de Hann) 8
II.2. Zone d'étude de la pêche scientifique : la
Zone Economique Exclusive (ZEE) 9
II.2.1. Zone nord 9
II.2.2. Zone centre 9
II.2.3. Zone sud incluant la ZMC 9
II.3. Matériel de la pêche artisanale 10
II.4. Matériel de la pêche scientifique 11
II.5. Méthodologie de la pêche artisanale 11
II.5.1. Méthodes d'échantillonnage sur le
terrain 11
II.5.2. Traitement des données de la pêche
artisanale 11
II.5.2.1. Indices de biodiversité 11
II.6. Méthodologie de la pêche scientifique
13
II.6.1. Méthodes d'échantillonnages à
bord du navire Itaf DEME 13
II.6.2. Traitement des données de la pêche
scientifique 13
II.6.2.1. Statistiques élémentaires 13
II.6.2.1.1. Paramètres de tendances centrales 13
II.6.2.1.2. Paramètres de dispersions 14
II.6.2.2. Analyse de variance à un facteur (ANOVA-1)
14
CHAPITRE III. RESULTATS & DISCUSSION 16
III.1. Résultats 16
III.1.1. Résultats de la pêche artisanale 16
III.1.1.1. Biodiversité 16
III.1.1.2. Occurrence 20
III.1.1.3. Indice de Jaccard 22
III.1.1.4. Indice de similitude de Sørensen 22
III.1.1.5. Indice de Whittaker 22
III.1.1.6. Indice de Liste Rouge (ILR) de l'UICN 22
III.1.2. Résultats de la pêche scientifique 24
III.1.2.1. Biodiversité 24
III.1.2.2. Richesse spécifique 26
III.1.2.3. Occurrence 26

vi
III.1.2.4. Indice de Jaccard
|
27
|
|
III.1.2.5. Indice de similitude de Sørensen
|
27
|
|
III.1.2.6. Indice de Whittaker
|
27
|
|
III.1.2.7. Indice de Liste Rouge (ILR) de l'UICN
|
27
|
|
III.1.2.8. Analyse de variance à un facteur : ANOVA-1
|
28
|
|
III.2. Discussion
|
28
|
|
CONCLUSIONS, RECOMMANDATIONS & PERSPECTIVES
|
35
|
|
BIBLIOGRAPHIES
|
36
|
|
RAPPORTS
|
42
|
|
WEBOGRAPHIES
|
42
|
|
ANNEXES
|
..44
|
TABLEAUX

vii
Tableau I : liste des espèces débarquées
(ordre alphabétique) au quai de pêche de Hann 17
Tableau II : liste des familles débarquées au
quai de pêche de Hann 18
Tableau III : liste des espèces les plus occurrentes
débarquées au niveau du site de Hann 21
Tableau IV : nombre d'espèces de poissons marins dans
chaque catégorie de l'UICN (2017)
pour la Liste Rouge 23
Tableau V : statistiques élémentaires de la
richesse spécifique globale 26
Tableau VI : niveau de significativité des variables
déterminant la diversité des espèces 28
FIGURES
Figure 1 : quai de débarquement de Hann (Ba, 2005) 8
Figure 2 : limites maritimes et côte
sénégalaise - ZMC = zone maritime commune entre le
Sénégal et la Guinée-Bissau 10
Figure 3 : groupes zoologiques 16
Figure 4: nombre de taxons par zone 18
Figure 5 : nombre de taxons/tranches bathymétriques
19
Figure 6: nombre de taxons/strate bathymétrique 19
Figure 7: nombre de taxons par engins-pêche 20
Figure 9 : groupes zoologiques 24
Figure 10 : nombre de taxons par zone 24
Figure 11 : nombre de taxons par saison 25
Figure 12 : nombre taxons/tranche horaire 25
Figure 13 : nombre taxons/tranche bathymétrique 26
ACRONYMES & ABREVIATIONS

viii
ACCT : Agence de coopération
culturelle et technique
ADUPES : Projet d'Aménagement Durable
des Pêcheries Du Sénégal
AFD : Agence Française pour le
Développement
AGC : Agence de Gestion et de
Coopération
AMP : Aire Marine Protégée
COFREPECHE : Bureau d'études
international en pêche, aquaculture et environnement marin
COPACE : Comité des Pêches de
l'Atlantique Centre-Est
CR : En danger critique
CRODT : Centre de Recherches
Océanographiques de Dakar-Thiaroye
CSRP : Commission Sous-Régionale des
Pêches
DD : Données Insuffisantes
DPM : Direction des Pêches Maritimes
EAS : Echantillonnage Aléatoire
Stratifié
EN : En Danger
FAO : Food and Agriculture Organization
FED : Fonds Européen de
Développement
ID : Itaf Dème
IFREMER : Institut Français de
Recherche pour l'Exploitation de la Mer
IRD : Institut de Recherche pour le
Développement
ISRA : Institut Sénégalaise de
Recherche Agricole
JICA : Japan International Cooperation
Agency
LC : Préoccupation mineure
MAAP : Ministère de l'Alimentation, de
l'Agriculture et de la Pêche (France)
MEA : Millennium Ecosystem Assessment
MAER : Ministère de l'Agriculture et
de l'Equipement Rural
MNHN : Muséum National d'Histoire
Naturelle (France)
MRAG : Marine Resources Assessment Group
NE : Non évaluée
NFDS : Nordenfjeldske Development Services
N/O : Navire océanographique
NT : quasi menacée
OAFIC : Overseas Agro-Fisheries Consultants
Co
ONU : Organisation des Nations Unies
POSEIDON: Aquatic Resource Management Ltd
UE : Union Européenne
UEMOA : Union Economique Monétaire
Ouest-Africaine
UICN : Union Internationale pour la
Conservation de la Nature
VU : Vulnérable
WWF : World Wide Fund (Fonds mondial pour la
nature)
ZEE : Zone Economique Exclusive
ZMC : Zone Maritime Commune
INTRODUCTION

1
Les ressources halieutiques exploitées au
Sénégal comprennent des pélagiques côtiers et
hauturiers, des démersaux côtiers et profonds outre celles dites
continentales, certes moins représentées (Fall & Farokh,
2014). Les espèces démersales côtières regroupent
divers poissons (exemple : rouget et dorade), crustacés (exemple :
crevette, langouste et crabe) et mollusques (exemple : cymbium, poulpe et
seiche) pêchés entre 0 et 200 m de profondeur à l'aide
d'engins de fonds industriels et artisanaux (Fall, 2009).
Au Sénégal, les espèces démersales
côtières sont surexploitées ! Ces ressources sont
économiquement importantes tant pour la pêche industrielle
qu'artisanale. Elles représentent 65 % du volume des exportations de
produits halieutiques (Barry et al., 2005) et 15% des captures totales
réalisées dans la Zone Economique Sénégalaise (ZEE)
avec, en moyenne, 45000 tonnes pêchées par an sur la
période 1981-2013. Cependant, dans les trois dernières
décennies, la pêche s'est intensément
développée en Afrique de l'Ouest. L'effort de pêche, au
Sénégal, a été multiplié par 2.5 au cours de
la période 1981-2013, entraînant en même temps, une forte
diminution de la biomasse de beaucoup d'espèces, notamment
démersales côtières (Barry et al., 2004 ; Gascuel
et al., 2004; Thiaw et al., 2009 ; Thiaw, 2010 ; Thiaw et
al., 2011 ; Thiao et al., 2012 ; Thiaw et al., 2015).
Au Sénégal, comme dans tous les autres pays de
l'Afrique de l'Ouest, l'ichtyofaune démersale est très riche et
diverse. Un grand nombre de ces espèces n'a qu'une valeur
économique et halieutique limitée, mais leur importance
écologique est toute autre (Anonyme, 2014).
Depuis 1961, le CRODT-ISRA (Centres de Recherches
Océanographiques de Dakar-Thiaroye - Institut Sénégalais
de Recherches Agricoles) évalue ces ressources grace à la
réalisation de campagnes de navires océanographiques, par
chalutage pour les ressources démersales et par
écho-intégration pour les pélagiques côtiers. Ces
campagnes sont financées par le budget national et/ou des partenaires
(JICA et AGC, par exemple). Au cours de ces campagnes, sont aussi recueillies
les données visant à approfondir les connaissances sur la
biologie et le comportement des espèces présentes (Barry et
al., 2005). Les campagnes scientifiques démersales
côtières, grace au Navire Océanographique Itaf Dème,
ont permis de faire, sur une longue période, une évaluation de la
biodiversité des poissons au large de la côte
sénégalaise et au niveau de la Zone Maritime Commune (ZMC) entre
le Sénégal et la Guinée Bissau.
Pour information, le Sénégal est souvent
cité comme étant une nation à forte tradition de
pêche. Plusieurs facteurs d'ordre écologique et
socioéconomique ont été particulièrement favorables
au développement de la pêche artisanale (Thiao, 2009).
Le domaine d'activités des pêcheurs artisans se
situe entre 0 et 24 milles ou plus. Cette zone côtière, peu
profonde et où s'effectue l'essentiel des upwellings, est
caractérisée par la présence d'espèces
majoritairement immatures et par sa richesse nourricière. Les
espèces halieutiques se trouvant dans cette zone sont capturées
par divers engins de pêche actifs et/ou passifs.
En 2005, la pêche artisanale a fourni 406248 tonnes de
produits frais d'une valeur estimée à 77 milliards de FCFA avec
un parc piroguier de 13903 unités, 59428 pêcheurs, plus de 6670
transformatrices, plus de 2000 mareyeurs et autant dans les autres
activités connexes (Diouf, 2006).

2
La baie de Hann est située dans le village de Hann, qui
est un des centres classés villages traditionnels au même titre
que d'autres villages majoritairement de l'ethnie « lébou »,
reconnus comme de grands pêcheurs. La pêche artisanale
s'avère très dynamique sur ce site. L'économie de Hann est
en grande partie basée sur cette activité. Cette dernière
exploite les stocks pélagiques et les stocks démersaux
côtiers. Elle occupe une place prépondérante dans la
sécurité alimentaire des sénégalais : environ 75 %
des protéines animales consommées par les
sénégalais proviennent du poisson (Dia, 2014).
L'objectif de notre travail est l'évaluation de la
biodiversité ichtyologique des eaux maritimes sénégalaise.
Nous avons choisi 2 objectifs spécifiques :
? étude des débarquements sur le quai de
pêche artisanale de Hann (baie de Hann)
? analyse au laboratoire de données de pêche
scientifique agrégées sur une série annuelle assez vaste
allant de 2001 à 2015.
Le mémoire a été structuré, outre
l'introduction, la conclusion, les recommandations, les perspectives et les
références bibliographiques, en 3 chapitres. Le chapitre I
traitera de la synthèse bibliographique ; le chapitre II sera
consacré au matériel et méthodes utilisés ; le
chapitre III égale aux résultats et discussion portera sur
l'analyse des enquêtes sur les débarquements de pêche
à Hann et sur celle des données de pêche scientifique dans
la ZEE sénégalaise
CHAPITRE I. SYNTHESE BIBLIOGRAPHIQUE

3
I.1. Notions de biodiversité
I.1.1. Définition
Le mot « biodiversité » (biodiversity, en
anglais) résulte de la fusion des termes « bio » (vie) et
« diversité », soit littéralement la diversité
de la vie. Chacun de ces deux termes revêt une importance cruciale sur
notre planète aux yeux de Tilman (2005) qui estime que « la
caractéristique la plus frappante de la Terre, c'est la vie
et la caractéristique la plus frappante de la vie, c'est
sa diversité »
Il existe aujourd'hui de nombreuses définitions de la
biodiversité (Gaston & Spicer, 2002). La plus simple que l'on peut
donner en première approximation est donc que la biodiversité est
le nombre total d'espèces (richesse spécifique) peuplant un type
d'habitat biogéographique ou encore de la biosphère tout
entière. En ce sens, le terme de biodiversité est assimilable
à la richesse spécifique totale d'une communauté vivante
donnée, quelle que soit l'étendue des habitats qu'elle peuple
(Ramade, 2009).
I.1.2. Biodiversité marine
Qui dit biodiversité marine pense spontanément
dauphins, tortues, coraux. Bref, espèces et habitats. Or, la
biodiversité marine, c'est aussi la génétique au sein des
espèces et la diversité des écosystèmes. Les
équilibres des écosystèmes océaniques sont
complexes et dépendent des uns et des autres. Ils sont en
perpétuelle évolution pour des raisons naturelles ou humaines.
Alors, protéger la biodiversité marine exige de comprendre le
fonctionnement des océans, connaître l'impact des usages sur le
milieu, préciser ses capacités de résistance. On ne
connaît qu'environ 280 000 espèces marines, alors qu'on estime
qu'il en existe plusieurs millions sans doute. Les océans sont, par
certains aspects, moins connus que la Lune (Sergent, 2014).
? Diversité en poissons du milieu
marin, qui est remarquable avec plus de 25 000
espèces décrites au niveau mondial (
www.fishbase.org). À eux
seuls, les poissons représentent plus de la moitié de toutes les
espèces de vertébrés vivants (48 000 espèces). En
termes de répartition, 58 % des espèces de poissons sont marins,
41 % sont des poissons d'eaux douces et 1 % partagent les deux milieux. Des 14
500 espèces de poissons marins, la vaste majorité (69 %) vivent
dans des zones de faibles profondeurs comme les zones coralliennes. Seulement 2
% des espèces vivent près de la surface dans le vaste milieu
pélagique hauturier (pélagiques principalement). La
biodiversité marine est ainsi inégalement répartie dans
les océans : elle s'exprime plus près des côtes qu'au
large, bien qu'il y ait de notables exceptions avec les faunes associées
aux monts sous-marins et les récifs coralliens (Cury & Morand,
2004).
I.2. Notions halieutiques
I.2.1. Poissons
Le poisson est un vertébré aquatique, pourvu de
nageoires, dont le corps est généralement recouvert
d'écailles. Seuls les poissons possèdent une vessie natatoire, ce
qui leur permet de

4
flotter, même si tous n'en sont pas pourvus comme les
requins (déplacement constant). La plupart possèdent une ligne
latérale sensitive. Ils ont généralement une forme
hydrodynamique et représentent une grande variété
d'aspects et de couleurs. Le poisson vit dans l'eau, respire par des branchies
et est généralement ovipare. (Thurre & Kurth, 2005)
? Classification actuelle des poissons
Les poissons constituent plus de la moitié du nombre
total des vertébrés actuels. Les zoologistes du
XIXème siècle considéraient qu'il y avait une
classe de poissons, aujourd'hui ils subdivisent les poissons en deux classes :
les poissons sans mâchoires ou agnathes ou cyclostomes, qui ne sont plus
représentés à l'heure actuelle que par les lamproies et
les myxines et les poissons à mâchoires ou gnathostomes,
répartis en poissons cartilagineux appelés chondrichtyens
(requins,
raies et chimères), et poissons osseux appelés
ostéichtyens (tous les autres poissons) (Idder-Ighili, 2014).
Les espèces démersales vivent,
d'après le « Vocabulaire de l'Océanologie » (ACCT,
1976), sur le fond ou dans son voisinage. Les démersaux côtiers
regroupent divers taxons de poissons pêchés entre 10 et 200 m de
profondeur à l'aide de chaluts. Ce sont les ressources les plus
ciblées de toutes, comme en atteste leur valeur marchande moyenne
à très forte. Globalement surexploitées (Thiam, 2000),
elles ont toujours joué un rôle stratégique dans le cadre
des accords de pêche liant le Sénégal à des
communautés ou états et tiers, Union Européenne (UE)
notamment et ce, depuis 1979. Selon Diop (2006), la valeur marchande des
espèces démersales côtières représentait 33 %
de la compensation financière des accords Sénégal/UE de
2002 - 2006. Les derniers en date sont ceux de 2014-2019 (merlus et thons
exclusivement) et là, pour la 1ère fois, les
démersaux côtiers sont exclus !
En fonction du gradient thermique lié à la
profondeur, Domain (1980) distingue 3 peuplements de poissons démersaux
côtiers : peuplements littoral, intermédiaire et du rebord du
plateau continental.
Le peuplement littoral est, strictement,
côtier et est inféodé aux sédiments meubles
baignés par des eaux chaudes et susceptibles de subir des dessalures en
zones d'estuaire. En fonction des saisons hydro-climatiques, l'aire de
distribution de ce peuplement s'étale plus ou moins vers le large. Les
espèces du peuplement littoral sont représentés par des
jeunes plutôt planctophages et les adultes plutôt benthophages.
Parmi les principales espèces de poisson, on peut citer la sole
(Cynoglossus spp.), le machoiron (Arius spp.) et le «
sompatt » (Pomadasys jubelini).
Le peuplement intermédiaire est
composé de 39 espèces majoritairement à affinités
d'eaux froides. Il est localisé entre 20 et 70-80 m en saison froide,
son biotope remonte à 40 m en saison chaude. On distingue un peuplement
de fonds meubles et vaseux caractérisé par le pageot
(Pagellus bellottii), un peuplement de fonds meubles et sableux avec 3
espèces importantes, le rouget (Pseudupeneus prayensis), le
pagre à points bleus (Sparus caeruleosticus) et le mérou
de Gorée (Epinephelus goreensis) et enfin un peuplement de
fonds durs surtout développé de Dakar à la Casamance entre
40 et 60 m avec le gros dentex rose (Dentex filosus) et le
mérou royal (Mycteroperca rubra).

5
Le peuplement du rebord du plateau continental
est constitué d'espèces qui vivent dans des eaux dont
les caractéristiques varient peu au cours de l'année. Le biotope
de ce peuplement correspond à une bande vaseuse et sablo-vaseuse entre
80 et 200 m de fond répartie de chaque côté de la rupture
de pente du plateau observée vers 100-120 m. Trente-trois (33)
espèces, dont 13 présentent un intérêt commercial,
constituent ce peuplement. On peut citer la brotule (Brotula barbata),
l'apogon (Synagrops microlepis), la dorade rose (Dentex
angolensis, Dentex macrophtalmus) et le saint-pierre (Zeux
faber).
Un poisson est appelé pélagique
lorsqu'il vit dans les eaux proches de la surface ou entre la surface
et le fond (par exemple hareng, sardine, anchois, maquereau et le thon). Ils
ont le dos bleu-vert. Cette coloration les protégerait des oiseaux et
prédateurs marins. Leur forme oblongue leur permet de se déplacer
très facilement. La plupart des poissons pélagiques sont
grégaires, ce qui signifie qu'ils vivent en groupe et nagent en bancs.
Un banc est constitué de poissons de même taille. Il peut
être formé de plusieurs espèces différentes, chaque
individu ayant quasiment la même longueur (Ifremer, 2017). Ainsi, les
risques d'attaque par des prédateurs sont réduits. D'une part,
ils sont tenus à distance par le déplacement de cette masse
ondulante synchronisée, et, d'autre part, la multiplicité des
paires d'yeux offre aux poissons une bien meilleure protection que s'ils
étaient isolés (Taquet, 2007).
Certains poissons pélagiques vivent isolés. En
fait, dans leurs premières années les poissons pélagiques
se déplacent souvent en groupe ; ils deviennent solitaires plus tard.
Le plancton qui se meut au gré des vagues est
pélagique. Les larves de poissons font partie du zooplancton. Certaines
espèces sont pélagiques au stade larvaire et deviennent
benthiques, c'est-à-dire vivant sur le fond, au stade adulte. C'est le
cas de nombreux poissons plats, comme la sole (Ifremer, op. cit). Les poissons
pélagiques s'alimentent principalement dans les couches de surface ou un
peu en dessous. On les pêche le long des côtes et en haute mer,
surtout au moyen de chaluts semi-pélagiques, de seines coulissantes, de
filets maillants, d'étalières et de fascines (Ministère de
Pêches et des Océans, 1984).
I.3. Notion de zone littorale et de zone
côtière
? La zone littorale est une espace de
rencontre entre la terre et la mer. Elle se compose à la fois de
territoires marins et terrestres qui partagent les mêmes enjeux, mais
sont uniques de par leurs richesses et leurs spécificités
(Corlay, 1993). Plus qu'un simple trait, c'est un espace à
géométrie variable dont les limites se définissent en
fonction de l'enjeu ou du problème posé et des réponses
à apporter (Corlay, op.cit).
? La zone côtière
Interface où la terre rencontre la mer, renfermant les
environnements côtiers comme les eaux côtières adjacentes.
Ses composantes peuvent inclure les deltas, les plaines côtières,
les marais, les plages et dunes, les récifs, les forêts de
mangrove, les lagons, les fjords et autres caractéristiques
côtières (VETOFISH, 2018).
Il faut noter qu'il n'y a pas de consensus sur la
différence entre côte et littoral (
www.aquaportail.com/definition-1140-littoral.html).
I.4. Notion de pêche artisanale et de pêche
scientifique

6
I.4.1. Pêche artisanale
Un groupe de travail sur les pêches artisanales
organisé par la FAO à Bangkok, Thaïlande, en 2003 a conclus
qu'il n'est ni possible ni utile d'essayer de formuler une définition
universelle des pêches artisanales vu leur diversité et dynamisme.
La description suivante du sous-secteur a été acceptée
:
« les pêches artisanales peuvent être
caractérisées d'une façon générale comme un
secteur dynamique en développement qui, pour exploiter, transformer et
distribuer le produit des captures en eaux marines et continentales, emploie
des technologies à forte intensité de main d'oeuvre. Les
activités de ce sous-secteur, pratiquées à plein temps ou
à temps partiel, ou seulement de façon saisonnière,
souvent ne sont destinées qu'à fournir du poisson et des produits
de la pêche aux marchés locaux et domestiques, et à
satisfaire les besoins de subsistance. Cependant, la production orientée
vers l'exportation s'est intensifiée dans beaucoup de pêcheries
artisanales au cours des deux dernières décennies à cause
de la plus grande intégration des marchés et de la globalisation.
Bien que, de manière générale, les hommes pratiquent la
pêche proprement dite et les femmes s'occupent du traitement et de la
commercialisation du poisson, il arrive que ces dernières prennent aussi
part aux activités de capture dans les zones proches du rivage et les
hommes aux activités de commercialisation et de distribution du poisson.
D'autres activités secondaires telles que la fabrication de filets, la
construction de bateaux, la réparation et l'entretien des moteurs, etc.
peuvent également fournir des emplois supplémentaires liés
à la pêche et des opportunités de revenu pour les
communautés de pêche marines et continentales.
Les pêches artisanales opèrent à des
niveaux organisationnels très différents allant des
opérateurs individuels indépendants aux microentreprises non
officielles et aux petites exploitations commerciales reconnues par le secteur.
Ce sous-secteur, par conséquent, n'est pas homogène dans et
à travers pays et régions et une attention particulière
doit être accordée à ce fait lors de la formulation des
stratégies et des politiques pour rehausser sa contribution à la
sécurité alimentaire et à la réduction de la
pauvreté » (FAO, 2004).
I.4.2. Notion de campagne scientifique de pêche
Une campagne de pêche scientifique est conduite, en
principe, par des scientifiques ou des commerciaux sous la direction de ces
derniers. Elle permet d'observer les ressources halieutiques en suivant
toujours les mêmes méthodes d'échantillonnage
(aléatoire stratifié/EAS - systématique) et opérant
dans la même zone, à la même saison, avec des engins de
pêche standardisés, afin que les données soient comparables
d'année en année. Elle sert à décrire les
espèces commerciales ou non d'une zone et à observer les
changements éventuels. Les ressources halieutiques (poissons, mollusques
et crustacés par exemple) sont dénombrées,
mesurées, pesées et évaluées en termes de biomasses
et/ou de densités. Certaines d'entre elles font l'objet de
prélèvements biologiques (exemple écailles et otolithes).
Chaque campagne fournit ainsi une photographie quantitative de l'ensemble des
espèces de la zone à une période donnée (Ifremer,
2009).
I.5. Les saisons marines

7
Les saisons marines du Sénégal ont
été répertoriées par plusieurs travaux d'auteurs :
Rossignol et al. (1965), Rébert (1979) et Fall (2009).
La saison froide va de décembre
à mai. Elle est caractérisée par la manifestation des
alizés à dominante nord-nord-ouest. C'est la période
d'upwelling, par excellence, et celle des eaux canariennes.
La saison de réchauffement va de mai
à juin. C'est la période de transition entre la saison froide et
la saison chaude. Elle correspond au début d'apparition des eaux
tropicales chaudes. La saison chaude va de juin à
novembre. Pendant cette période, il y a une atténuation des
alizés et de l'upwelling. C'est la période de la mousson avec
l'apparition des pluies et l'apport des eaux tropicales guinéennes.
La saison de refroidissement va de novembre
à décembre. C'est la de transition entre la saison chaude et la
saison froide. Il y a le retrait des eaux tropicales chaudes vers le sud et le
début de l'apparition des eaux canariennes froides.
CHAPITRE II. MATERIEL & METHODES

8
II.1. Zone d'étude de la pêche artisanale
: le quai de pêche de Hann (baie de Hann)
La plage de Hann est située dans le village
traditionnel du même nom, à 6 km du centre de la ville de Dakar,
dans la baie de Hann. Il s'étend sur une superficie de 1,4
Km2 (Ba, 2005). Située sur la façade maritime
orientale de la presqu'île du Cap-Vert, la baie de Hann s'étend de
la pointe de Bail-Air au village de Mbao (Dia, 2014). Ses coordonnées
géographiques sont de 14°43'21"N et 17°23'12"W (Figure 1). Sur
le plan physique, la baie de Hann a un fond sablo-vaseux en bordure et
sablo-coquiller un peu plus au large.
Les courants marins comme le courant des Canaries (novembre -
mai / sud-sud-ouest) et le contre-courant équatorial (mai - octobre /
ouest-est) déterminent les saisons de pêches.
Concernant la diversité taxonomique marine, on distingue
les démersaux dont la grande saison est la saison froide avec des
espèces nobles (par exemple le thiof) et les pélagiques en grande
colonie durant la saison chaude (cycle de croissance à la baie de
Gorée) avec la sardinelle. Marqué par une grande
irrégularité interannuelle, le climat de la baie de Hann est
tropical. Il est soumis à plusieurs facteurs : les vents, les
températures et les pluies (Dia, 2014).

Figure 1 : quai de débarquement de Hann (Ba,
2005)
II.2. Zone d'étude de la pêche
scientifique : la Zone Economique Exclusive (ZEE)

9
Le Sénégal est un pays sahélien
doté d'une superficie terrestre de 200 000 km2 environ et
d'une espace maritime de 198 000 km2 (Figure 2). Il occupe la partie
méridionale du bassin sédimentaire
sénégalo-mauritanien. Globalement compris entre le rivage et
l'isobathe 200 m, son plateau continental d'environ 23 600 km2 est
peu accidenté (Domain, 1978). La côte sénégalaise
mesure environ 718 km (Figure 2) ; elle est incluse dans la zone ou
région du Comité des Pêches de l'Atlantique Centre-Est
(COPACE). Elle s'étend (Figure 2) entre les positions 16°04'N
(Saint-Louis) et 12°20'N (Cap-Roxo) enserrant les eaux gambiennes
(13°05'N - 13°36'N). Elle présente 3 zones : nord, centre et
sud (Domain, 1976 ; Fall, 2009).
II.2.1. Zone nord
La zone nord ou grande côte, s'étend de
Saint-Louis (16°04N) à la pointe des Almadies (14°36N)
à Dakar. C'est une suite de dunes et de cordons littoraux dont le plus
important est la langue de Barbarie orientant, dans une direction SS0, le cours
du fleuve Sénégal sur une longueur de 20 km environ au niveau de
son embouchure. Son plateau continental est traversé sur toute sa
largeur par un canyon sous-marin, la fosse de Kayar, située par
15°00 N en face du village du même nom. Les fonds meubles y dominent
les fonds rocheux qui sont situés à l'intérieur des 6
milles (Fall, 2009).
II.2.2. Zone centre
La zone centre va de Dakar (14°36 N) à la
frontière maritime nord de la Gambie (13°36). Elle englobe la
« Petite côte » et le Sine et le Saloum qui sont drainés
par les cours d'eaux des mêmes noms. Les principaux centres de
pêche sont Mbour et Joal. Elle présente 2 falaises sous-marines.
La première située à -70 m, est limitée au
sud-ouest de Dakar. La seconde, se trouve
Ba (2005)
entre -35 m et -45 m. On y trouve aussi des bancs et hauts
fonds rocheux de faible importance, situés près du littoral, de
Dakar à Joal. A ce biotope non ou difficilement chalutable, il faut
ajouter d'autres fonds sableux présents de la zone côtière
jusqu'à 40 m, ainsi que de la flèche de Sangomar au fleuve
Casamance. Différentes frayères, zones de grossissement ou de
reproduction y sont signalées (Fall, op.cit).
II.2.3. Zone sud incluant la ZMC
Comprise entre les limites 13°04 N et 12°20 N, elle
correspond à la Casamance. Le plateau continental y atteint sa largeur
maximale, soit près de 54 miles. Les fonds rocheux sont situés au
large, essentiellement sur le rebord du plateau. Cette zone héberge la
plus importante vasière du pays s'étendant du sud de l'embouchure
du fleuve Casamance aux îles Bissagos (11°35 N), entre 25 et 50 m de
profondeur. Elle regorge de crevettes dont les juvéniles sont
apportés par le fleuve Casamance (local) et le Rio Cacheu
(Guinée - Bissau) (Fall, 2009).


10
Figure 2 : limites maritimes et côte
sénégalaise - ZMC = zone maritime commune entre le
Sénégal et la Guinée-Bissau
II.3. Matériel de la pêche artisanale ?
Moyens matériel
1' 1 fiche pour l'effort de pêche journalier
1' 1 fiche pour le prix des poissons frais
1' 1 fiche pour les captures et tailles des espèces
(Annexe, 2)
1' 1 fiche de pour les positions et lieux de pêche par
rapport au port de Hann (Annexe 3)
1' 1 décamètre de 1.5 m et 1 planche graduée
d'un mètre de long pour la mensuration des taxons
1' Clés d'identification : FAO (2016), Blache, Cadenas
& Stauch (1970), le catalogue des poissons du navire océanographique
Dr. Fridtjof NANSEN et Fishbase.
II.4. Matériel de la pêche
scientifique

11
? Moyens matériel
y' Navire océanographique Itaf Dème : chalutier de
pêche arrière de 37.4 m de long et 8.1
m de large.
y' 1 Chalut à poissons bentho-démersale de 31.82 m
et 45 mm de maille étirée
y' 1 poche avec des mailles étirées 25 mm de maille
pour capturer davantage de juvéniles
y' 1 balance de pesée
y' 1 ichtyomètre
y' 1 pied à coulisses
y' Des pelles
y' Des paniers et des seaux en plastique
y' 1 table de triage
y' Clés de détermination : Blache, Cadenat &
Stauch (1970) et Bellemans, Sagna & Scilabba
(1988)
II.5. Méthodologie de la pêche
artisanale
II.5.1. Méthodes d'échantillonnage sur le
terrain
L'étude a été réalisée dans
le site de Hann du 02 au 29 mai 2017. Onze (11) jours d'enquêtes ont
été effectués (Annexe 1). La collecte de données
débute à 06h30 du matin et se termine à 19 h. Il existe 3
types de recueil de données : le relevé de l'effort de
pêche, les enquêtes socio-économiques et l'enquête sur
les captures des espèces et sur leurs tailles.
Les enquêtes consistent à interviewer le
capitaine de pirogue après sa descente de sa pirogue. Les questions
portent sur : le centre d'origine de la pirogue, l'équipage, la
puissance du moteur, les engins de pêche utilisés, l'heure de
départ, le lieu de pêche, la profondeur et le type de pêche.
Les données recueillies portent sur toutes les espèces
débarquées, le poids ou le nombre d'individus.
La mesure de la taille des espèces se fait après
les transactions lorsque les poissons sont vendus aux mareyeurs.
II.5.2. Traitement des données de la pêche
artisanale
Les données ont été traitées avec
le tableur EXCEL® 2013 (tableaux croisés dynamiques et indices de
biodiversité). Le travail a, aussi, nécessité
l'utilisation de la page web de l'UICN version 2017-3 (statut menacé des
taxons), de FishBase version 06/2017 et du Catalogue of life.
II.5.2.1. Indices de biodiversité
? Richesse spécifique totale ou moyenne (S ou
Sm)
Elles correspondent, respectivement, au nombre total
d'espèces que comporte le peuplement considéré dans un
écosystème donné (S) et au nombre moyen d'espèces
présentes dans un échantillon du biotope.
? Indice de Jaccard (Sj)
Cet indice permet de mesurer la différence de
diversité entre 2 sites (MAAP & MNHN, 2009).
j
Sj = (a + b + j)
a = richesse spécifique du 1er site, b =
richesse spécifique du 2ème site, j = nombre
d'espèces communes aux sites. Variant entre 0 et 1 (Jaussaud, 2011), il
prend la valeur 0 lorsque les 2 sites n'ont aucune espèce en commun et 1
lorsque toutes les espèces sont en commun. Ici, on comparera 2
à 2 les zones (sites) nord, centre et sud, soit les combinaisons nord -
centre, centre - sud et nord - sud.
? Indice de similitude de Sørensen
(13)
Il mesure la similitude en espèce entre 2 sites et vient
en complément de l'indice de Jaccard.
13 =
2c
S1 + S2 (Sørensen, 1948)
Avec c = nombre d'espèces communes entre deux
sites, S1 = nombre d'espèces pour le site 1, S2 = nombre
d'espèces pour le site 2. Il varie de 0 (aucune espèce commune
entre les 2 sites) à 1 (toutes les espèces rencontrées
dans le site 1 existent aussi dans le site 2) (Landeau, 2008). Les
mêmes niveaux de comparaison que ci-dessus sont reconduits ici.
? Mesure de Whittaker
L'indice de Whittaker est défini comme suit :
S
13w = á? (Whittaker, 1960).
Avec S le nombre total d'espèces dans le temps ou
l'espace et ?? la moyenne du nombre d'espèces. Elle est comprise entre 1
et le nombre total d'échantillons, elle peut être ramenée
à l'intervalle [0 ; 1]. Il donne une très bonne mesure de la
??-diversité (Belin & Soudant, 2011).
? Occurrence d'un taxon (F0)
Il correspond au pourcentage de relevés pour lesquels
l'espèce i est rencontrée. Une espèce pourra être
qualifiée de permanente (100-75)%, fréquente (75-50)%,
occasionnelle (50-25)% ou rare (25-0)% en fonction de sa fréquence
d'occurrence (Tessier et al., 2005 ; Rousseau, 2010).
Ei : le nombre de stations ou l'espèce est présente
et Et : le nombre de stations total ? Indicateur de Liste Rouge (ILR)
de l'UICN

12
C'est un indicateur composite fondé sur les listes
rouges de l'UICN, calculé à partir de la moyenne des statuts de
conservation des espèces. Il peut être calculé pour
n'importe quel groupe d'espèces sur lequel il existe au moins deux
données temporelles. Il est construit à partir

13
du nombre d'espèces au sein de chaque catégorie
de l'UICN et à partir du nombre d'espèces ayant changé de
catégorie, ce qui traduit une amélioration ou une
détérioration de l'état de la biodiversité (Levrel,
2006).
II.6. Méthodologie de la pêche
scientifique
II.6.1. Méthodes d'échantillonnages à
bord du navire Itaf DEME
Les stations ont été chalutées du lever
au coucher du soleil. Une particularité majeure, la prise en compte de
stations côtières de remplacement pour diverses raisons par
exemple de sonde instable, de proximité de la côte, de
récifs artificiels et d'engins explosifs. Les données recueillies
sont relatives :
? aux opérations de chalutage :
latitudes, longitudes et heures de début et de fin de trait,
zone, numéro du trait, saison, vitesse de chalutage entre autres,
? à la biologie : identification des
taxons, poids en kg, effectifs et fréquences de tailles. Les captures
ont été traitées selon la méthodologie de travail
classique du CRODT : tri total ou tri partiel puis échantillonnage si la
capture est trop importante. Au cas où des individus d'une espèce
particulière seraient présents dans une grande capture, tous ces
individus peuvent être sélectionnés et enregistrés
comme capture totale de cette espèce.
? à l'environnement :
températures (°C) et salinités (g/l) de surface et
de fonds, profondeurs (m) de début et de fin de trait et pression
atmosphérique (bars).
II.6.2. Traitement des données de la pêche
scientifique
Les méthodes de traitement de données sont les
mêmes que celles utilisées dans la pêche artisanale sauf
qu'ici, nous avons également utilisé Matlab version 2013-a avec
la base de données Etopo-2 (pour la réalisation de la carte de la
zone d'étude) et le logiciel R version 3.4.1 (tests statistiques
d'analyse de variance à 1 facteur - ANOVA-1 -). Le tableur Excel, aussi,
a été utilisé pour la détermination des
statistiques élémentaires.
II.6.2.1. Statistiques élémentaires
Les analyses statistiques nécessitent au
préalable une analyse systématique des variables à partir
des statistiques élémentaires comme les paramètres de
tendances centrales et de dispersions.
II.6.2.1.1. Paramètres de tendances
centrales
Ils permettent de décrire la position des n individus
sur l'échelle de la variable. Ce sont des paramètres
calculés, spécifiquement, dans le cadre de la richesse
spécifique.
? Moyenne, mode et médiane
? La moyenne (x) représente
la mesure la plus courante de tendance centrale des observations. Elle se
calcule en additionnant les valeurs observées (x) de chaque individu
divisées par le nombre de sujets observés (n) :
? ??
??
=
n
? Le mode d'une série
d'observations est donc la valeur la plus fréquente d'un ensemble de
données. On l'appelle aussi valeur dominante. On le note Mo.
? La médiane d'une
série statistique est la valeur de la variable qui a autant
d'observations qui lui sont supérieures et inférieures. Si le
nombre des observations est pair, la médiane est le plus souvent leur
valeur moyenne. La médiane est insensible aux valeurs
extrêmes, contrairement à la moyenne, voire le mode.
II.6.2.1.2. Paramètres de dispersions
C'est la mesure de l'étalement des valeurs d'une
variable statistique, de part et d'autre d'une position centrale (moyenne ou
très rarement médiane). Cet étalement caractérise
un échantillon ou une population et permet des comparaisons.
· Minimum, maximum, écart-type et
coefficient de variation
? Le maximum d'une série
statistique est la valeur maximale que peut prendre le caractère (la
plus grande valeur).
? Le minimum d'une série
statistique : est la valeur minimale que peut prendre le caractère (la
plus petite valeur).
? L'écart-type est la racine
carrée de la variance (moyenne du carré des écarts
à la moyenne). La variance est une mesure globale de la variation d'un
caractère.
2
??
???? = v1 ?? ?(???? - î)
??-1
? Le coefficient de variation (CV)
détermine l'homogénéité de la série :
s
CV = * 100%
??
Si CV < 15 % ? les données sont homogènes et si
CV > 15 % ? les données sont hétérogènes.
II.6.2.2. Analyse de variance à un facteur
(ANOVA-1)
L'ANOVA-1 a été faite en croisant
individuellement la zone, la saison, l'année, l'heure et la
bathymétrie avec la richesse spécifique moyenne (nombre
d'espèces/trait de chalut) :
· la zone comporte 3 modalités : nord, centre et Sud
;
· la saison, 2 modalités : saison froide et saison
chaude ;
· l'année, 7 modalités : 2001, 2004, 2005,
2009, 2010, 2014 et 2015 ;
· la strate horaire, 4 tranches : 6 - 10 h (1), 10 - 13 h
(2), 13 h - 16 h (3) et 16 h -20 h (4)
· 
14
la bathymétrie, 4 couches: 10 - 50 m(A), 50 -100m (B), 100
- 150m(C) et 150 -200m(D)

15
L'ANOVA-1 est une technique de comparaison simultanée
des moyennes de plusieurs populations, facteurs, groupes ou
échantillons. Elle se fonde sur les mesures de variances mais, n'a pas
vocation à étudier leurs différences. Elle permet de se
poser la question suivante :
dans l'Anova-1, chaque facteur, pris isolément
influe-t-il sur la richesse spécifique ?
|
|
L'Anova évalue la significativité des facteurs sur
la biodiversité se basant sur 2 hypothèses : 1- H0 : les moyennes
sont toutes égales / 2- H1 : une moyenne au moins est différente
des autres
Sur la base de la probabilité p de se tromper en
affirmant que l'hypothèse H0 est vraie alors qu'il n'en est rien, nous
retenons ce qui suit entre les moyennes testées :
? différence non significative si p > 5 %, donc
acceptation de H0, ? différence significative si p < 5 %,
? différence hautement significative si p < 1 %,
? différence très hautement significative si p
< 1 %o.
CHAPITRE III. RESULTATS & DISCUSSION

16
III.1. Résultats
Ils portent d'une part sur les données de
débarquements obtenus pour la pêche artisanale et d'autre part sur
les données de la pêche scientifique.
III.1.1. Résultats de la pêche artisanale
III.1.1.1. Biodiversité
Sur 615 pirogues échantillonnées, le nombre
total de taxons rencontré à la baie de Hann (zone de
débarquement de pêche) est de 113 selon divers facteurs :
? Groupe zoologique : 109 espèces de
poissons osseux ou Ostéichtyens (96 %) et 4 espèces de poissons
cartilagineux ou Chondrichtyens (4 %) ont été
répertoriés (Figure 3, Tableau I).
? Famille : les 113 taxons sont
répartis en 51 familles (04 de poissons cartilagineux avec Rajidae -
Lamnidae - Dasyatidae - Carcharhinidae et 47 de poissons osseux
(Tableau
II). Les Sparidae et Carangidae comptent le plus de
représentants (10 au moins).
Cartilagineux Osseux
96%
4%
Figure 3 : groupes zoologiques

17
Tableau I : liste des espèces
débarquées (ordre alphabétique) au quai de pêche de
Hann
Genres - Espèces
|
Genres - Espèces
|
Genres - Espèces
|
Acanthurus monroviae
|
Epinephellus caninus
|
Priacanthus arenatus
|
Albula vulpes
|
Epinephellus goreensis
|
Pseudotolithus senegalensis
|
Argyrosomus regius
|
Epinephellus guaza (marginatus)
(gigas)
|
Pseudotolithus typus
|
Arius (Carlarius) heudelotii
|
Euthynnus alleteratus
|
Pseudupeneus prayensis
|
Arius gambiensis (Carlarius
latiscutatus)
|
Exocoetidae
|
Raja miraletus
|
Arius spp.
|
Fistularia petimba
|
Sarda sarda
|
Auxis thazard
|
Fistularia tabacaria
|
Sardinella aurita
|
Balistes carolinensis
|
Galeoides decadactylus
|
Sardinella maderensis
|
Bodianus speciosus
|
Gerres octatis (nigri)
|
Sarotherodon melanotheron
|
Boops boops
|
Istiophorus platypterus
|
Sarpa salpa
|
Brachydeuterus auritus
|
Isurus paucus
|
Scomber japonicus
|
Brama brama
|
Katsuwonus pelamis
|
Scomberomorus tritor
|
Branchiostegus semifasciatus
|
Lagocephalus laevigatus
|
Scorpaena spp.
|
Brotula barbata
|
Lethrinus atlanticus
|
Scyris (Alectis) alexandrinus
|
Caranx crysos
|
Lithognathus mormyrus
|
Selene dorsalis
|
Carcharhinus spp.
|
Lutjanus agennes
|
Sepia officinalis
|
Cephalacanthus (Dactylopterus)
Volitans
|
Lutjanus fulgens
|
Seriola spp.
|
Chaetodon hastatus
|
Lutjanus goreensis
|
Serranus cabrilla
|
Chaetodon hoefleri
|
Makaira nigricans
|
Serranus scriba
|
Chaetodon sp.
|
Merluccius senegalensis
|
Smaris (Spicara) melanurus
|
Chloroscombrus chrysurus
|
Mobula mobular
|
Sparisoma sp.
|
Chromis chromis
|
Mugil cephalus
|
Sparus (pagrus) pagrus
|
Coryphaena hippurus
|
Mugil sp.
|
Sphyraena barracuda
|
Cynoglossus sp.
|
Muraenidae
|
Sphyraena guachancho
|
Dactylopterus volitans
|
Mycteroperca rubra
|
Sphyraena sphyraena
|
Decapterus (Caranx) rhoncus
|
Oreochromis niloticus
|
Sphyraena spp.
|
Dentex canariensis
|
Pagellus bellottii
|
Spondyliosoma (cantharus)
cantharus
|
Dentex macrophthalmus
|
Pagrus (Sparus) caeruleostictus
|
Synaptura spp.
|
Diplodus bellottii
|
Pagrus auriga
|
Taeniura grabata
|
Diplodus cervinus
|
Parakuhlia macrophthalmus
|
Thunnus obesus
|
Diplodus sargus
|
Parapristipoma octolineatum
|
Tilapia guineensis
|
Diplodus vulgaris
|
Plectorhinchus mediterraneus
|
Trachinotus ovatus
|
Drepane africana
|
Polydactylus quadrifilis
|
Trachurus trecae
|
Elagatis bipinnulata
|
Pomadasys incisus
|
Trichiurus lepturus
|
Elops senegalensis
|
Pomadasys jubelini
|
Umbrina canariensis
|
Engraulis guineensis
(encrasicolus)
|
Pomadasys perotaei
|
Uranoscopus spp.
|
Ephippion guttifer
|
Pomadasys rogerii
|
Zeus faber
|
Epinephellus aeneus
|
Pontinus kuhlii
|
Nombre total d'espèces : 113
|
|
Tableau II : liste des familles débarquées
au quai de pêche de Hann

18
Familles
Nombre
d'espèces
|
Familles
|
Nombre
d'espèces
|
Familles
|
Nombre
d'espèces
|
Sparidae
|
14
|
Scorpaenidae
|
2
|
Engraulidae
|
1
|
Carangidae
|
10
|
Serranidae
|
2
|
Exocoetidae
|
1
|
Haemulidae
|
8
|
Tetraodontidae
|
2
|
Gerreidae
|
1
|
Scombridae
|
7
|
Merlucciidae
|
1
|
Labridae
|
1
|
Epinephelidae
|
5
|
Coryphaenidae
|
1
|
Lamnidae
|
1
|
Sciaenidae
|
4
|
Cynoglossidae
|
1
|
Mobulidae
|
1
|
Sphyraenidae
|
4
|
Dasyatidae
|
1
|
Mullidae
|
1
|
Ariidae
|
3
|
Lethrinidae
|
1
|
Muraenidae
|
1
|
Chaetodontidae
|
3
|
Malacanthidae
|
1
|
Ophidiidae
|
1
|
Cichlidae
|
3
|
Acanthuridae
|
1
|
Pomacentridae
|
1
|
Lutjanidae
|
3
|
Albulidae
|
1
|
Priacanthidae
|
1
|
Clupeidae
|
2
|
Balistidae
|
1
|
Rajidae
|
1
|
Dactylopteridae
|
2
|
Bramidae
|
1
|
Scaridae
|
1
|
Fistulariidae
|
2
|
Carcharhinidae
|
1
|
Soleidae
|
1
|
Istiophoridae
|
2
|
Centracanthidae
|
1
|
Trichiuridae
|
1
|
Mugilidae
|
2
|
Drepaneidae
|
1
|
Uranoscopidae
|
1
|
Polynemidae
|
2
|
Elopidae
|
1
|
Zeidae
|
1
|
|
? Zone : le nombre total d'espèces
est plus élevé à la position nord (101) par rapport
à la position sud (63) qui regorge plus d'espèces que la position
centre (40) (Figure 4).
? Strate horaire : le nombre total
d'espèces décroît suivant la période de la
journée. Il est, ainsi, plus important durant la matinée (93
entre 6h30-10h à 67 entre 10-13h) que la soirée (54 entre 13-16h
à 04 entre 16-19h) (Figure 5)
Nombre d'espèces
|
|
|
101
|
|
|
|
|
|
63
|
|
40
|
|
|
|
|
|
|
|
|
Centre Nord Sud
Zones
Figure 4: nombre de taxons par zone
100
|
90
|
|
|
|
93
|
|
80
|
|
|
70
|
|
|
|
|
60
|
|
|
67
|
|
50
|
|
|
|
|
54
|
|
40
|
|
|
|
|
|
|
30
|
|
|
|
|
|
|
20
|
|
|
|
|
|
|
10
|
|
|
|
|
|
4
|
0
|
|
|
|
|
|
|
|
|
|
|
|
Strates horaires
Nombre d'espèces

19
Figure 5 : nombre de taxons/tranches
bathymétriques
? Strate bathymétrique : le nombre de
taxons baisse de la côte au large quand on passe de la tranche des 03-50
m (97 taxons) à celle des 200-600 m (32 taxons) (Figure 6).
? Engins de pêche : le nombre
d'espèces est plus élevé dans les filets dormants de fond
(FDF) et les Trémails (58 taxons chacun, Figure 7). Ils sont suivis des
filets maillants dérivants de surface (FMDS) (47) et puis des filets
dormants de surface (FDS) (33). Elle est pratiquement faible dans les
éperviers (EP), les lignes casiers lignes casiers seiches (LCS) et les
lignes ou palangre glacière (LPG) (01 à 02 espèces
seulement)
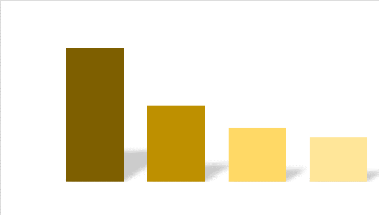
Nombre de taxons
120
100
40
20
60
80
0
03-50 m 50-100 m 100-200 m 200-600 m
States bathymétriques
97
55
39
32
Figure 6: nombre de taxons/strate
bathymétrique

Nombre d'espèces
1
58
33
47
21
Engins de pêches
2
20
26
2
17
6
26
58
EP
FDF FDS FMDS FME LCS LPG LSM LTR Palangre SP
ST
TM

20
Figure 7: nombre de taxons par engins-pêche
Légende des engins : EP
= épervier, FDF = filet dormant de fond, FDS
= filet dormant de surface, FMDS = filet maillant
dérivant de surface, FME = filet maillant encerclant,
LCS = ligne casier seiche, LPG = ligne
palangre glacière, LSM = ligne simple motorisée,
LTR = ligne traine, SP = senne de plage,
ST = senne tournante, TM = trémail
III.1.1.2. Occurrence
Les résultats d'occurrences de taxons
révèlent que parmi les 113 espèces de poissons
rencontrées, à part la sardinelle ronde (Sardinella
aurita) qui apparait comme une espèce occasionnelle (25 à
50% d'occurrence), tous les autres taxons sont considérés comme
rares (moins de 25 % d'occurrence). C'est le cas, par exemple, de Sarda
sarda (bonite à dos rayé) et de Sardinella maderensis
(sardinelle plate) qui sont les plus `occurrentes' de cette
catégorie (occurrence > 20 % tous sont des poissons osseux).
Le Tableau III, ci-dessous, illustre les taxons les plus
occurrents rencontrés au niveau du quai de pêche artisanale de
Hann.

21
Tableau III : liste des espèces les plus
occurrentes débarquées au niveau du site de Hann
Genres - Espèces Occurrences Genres -
Espèces Occurrences Genres - Espèces Occurrences
Sardinella aurita
|
26,02
|
Mugil cephalus
|
1,63
|
Bodianus speciosus
|
0,49
|
Sarda sarda
|
24,23
|
Chromis chromis
|
1,46
|
Polydactylus
quadrifilis
|
0,49
|
Sardinella maderensis
|
20,00
|
Cynoglossus sp.
|
1,46
|
Taeniura grabata
|
0,49
|
Decapterus rhoncus
|
17,89
|
Epinephellus aeneus
|
1,46
|
Thunnus obesus
|
0,49
|
Plectorhinchus
mediterraneus
|
16,75
|
Parapristipoma
octolineatum
|
1,46
|
Uranoscopus spp.
|
0,49
|
Auxis thazard
|
14,80
|
Sparisoma sp.
|
1,46
|
Boops boops
|
0,33
|
Trachurus trecae
|
13,01
|
Arius heudelotii
|
1,30
|
Chaetodon sp.
|
0,33
|
Sphyraena sphyraena
|
11,38
|
Arius gambiensis
|
1,30
|
Drepane africana
|
0,33
|
Pagrus caeruleostictus
|
10,73
|
Merluccius senegalensis
|
1,30
|
Gerres octatis
|
0,33
|
Scomber japonicus
|
8,78
|
Pontinus kuhlii
|
1,30
|
Lithognathus
mormyrus
|
0,33
|
Pomadasys jubelini
|
8,29
|
Pseudotolithus
senegalensis
|
1,30
|
Pomadasys rogerii
|
0,33
|
Brama brama
|
7,15
|
Scorpaena spp.
|
1,30
|
Raja miraletus
|
0,33
|
Katsuwonus pelamis
|
6,02
|
Selene dorsalis
|
1,30
|
Sarotherodon
melanotheron
|
0,33
|
Trichiurus lepturus
|
5,53
|
Sepia officinalis
|
1,30
|
Scomberomorus tritor
|
0,33
|
Acanthurus monroviae
|
5,20
|
Synaptura spp.
|
1,30
|
Sphyraena barracuda
|
0,33
|
Brachydeuterus auritus
|
5,20
|
Fistularia petimba
|
1,14
|
Balistes carolinensis
|
0,16
|
Euthynnus alleteratus
|
4,39
|
Mycteroperca rubra
|
1,14
|
Chaetodon hastatus
|
0,16
|
Galeoides decadactylus
|
4,23
|
Oreochromis niloticus
|
1,14
|
Chloroscombrus
chrysurus
|
0,16
|
Diplodus cervinus
|
3,58
|
Sarpa salpa
|
1,14
|
Coryphaena hippurus
|
0,16
|
Smaris melanurus
|
3,41
|
Carcharhinus spp.
|
0,98
|
Elagatis bipinnulata
|
0,16
|
Trachinotus ovatus
|
3,09
|
Pagrus auriga
|
0,98
|
Elops senegalensis
|
0,16
|
Caranx crysos
|
2,76
|
Sphyraena guachancho
|
0,98
|
Engraulis guineensis
|
0,16
|
Brotula barbata
|
2,60
|
Spondyliosoma cantharus
|
0,98
|
Ephippion guttifer
|
0,16
|
Zeus faber
|
2,60
|
Albula vulpes
|
0,81
|
Epinephellus caninus
|
0,16
|
Dentex canariensis
|
2,44
|
Branchiostegus
semifasciatus
|
0,81
|
Exocoetidae
|
0,16
|
Diplodus bellottii
|
2,44
|
Istiophorus platypterus
|
0,81
|
Isurus paucus
|
0,16
|
Fistularia tabacaria
|
2,44
|
Lagocephalus laevigatus
|
0,81
|
Lutjanus goreensis
|
0,16
|
Pagellus bellottii
|
2,44
|
Lethrinus atlanticus
|
0,81
|
Muraenidae
|
0,16
|
Arius spp.
|
2,28
|
Lutjanus agennes
|
0,81
|
Parakuhlia
macrophthalmus
|
0,16
|
Dentex macrophthalmus
|
2,28
|
Lutjanus fulgens
|
0,81
|
Pomadasys perotaei
|
0,16
|
Pseudupeneus prayensis
|
2,28
|
Serranus cabrilla
|
0,81
|
Priacanthus arenatus
|
0,16
|
Umbrina canariensis
|
2,28
|
Argyrosomus regius
|
0,65
|
Pseudotolithus typus
|
0,16
|
Mobula mobular
|
2,11
|
Cephalacanthus Volitans
|
0,65
|
Scyris alexandrinus
|
0,16
|
Mugil sp.
|
2,11
|
Chaetodon hoefleri
|
0,65
|
Seriola spp.
|
0,16
|
Diplodus vulgaris
|
1,95
|
Dactylopterus volitans
|
0,65
|
Serranus scriba
|
0,16
|
Makaira nigricans
|
1,95
|
Epinephellus goreensis
|
0,65
|
Sparus pagrus
|
0,16
|
Tilapia guineensis
|
1,79
|
Epinephellus guaza
|
0,65
|
Sphyraena spp.
|
0,16
|
Diplodus sargus
|
1,63
|
Pomadasys incisus
|
0,65
|
|
|
III.1.1.3. Indice de Jaccard

22
Les indices de Jaccard, comparables entre les 3 zones de Dakar
prises 2 à 2, affichent 22.53 % entre le centre et le nord, 26.13 %
entre le nord et le sud, 20.77 % entre le centre et le sud. Cela signifie qu'il
existe beaucoup plus d'espèces communes entre le nord et le sud par
comparaison entre le centre et le sud où l'on rencontre beaucoup plus
d'espèces communes par rapport entre le nord et le centre. L'indice
excède les 25% de similitude, seulement, entre le nord et le sud.
III.1.1.4. Indice de similitude de Sørensen
Le but est de connaître la similitude en espèces
en croisant les 3 zones de pêche de Dakar, 2 à 2. L'indice de
Sørensen est un complément de l'indice de Jaccard. Les
résultats sont :
· entre le centre et le nord : 0.58
· entre le nord et le sud : 0.71
· entre le centre et le sud : 0.52
III.1.1.5. Indice de Whittaker
La comparaison en nombre d'espèces uniques ou
spécifiques à chacune des 3 positions (nord, sud et centre) de
Dakar affiche les résultats suivants (Figure 8) :
· position nord : 37 taxons
spécifiques
· position centre : 2 taxons
spécifiques
· position sud : 10 taxons
spécifiques
Ceci montre que la diversité taxonomique
spécifique est beaucoup plus forte au sud de la presqu'île du
Cap-Vert par comparaison au sud et au centre de Dakar. L'indice de Whittaker
permet de mesurer la diversité (ou dissimilitude) entre les 3 zones en
termes d'espèces.
Les résultats du calcul de cet indice montrent la
valeur «1.66 » (compris entre 1 et le nombre total de sites).
L'indice est égal à 0.66 si on le ramène à
l'intervalle [0 ; 1]. La valeur de â trouvée est assez faible donc
le nombre d'espèces similaires entre sites est élevé.
III.1.1.6. Indice de Liste Rouge (ILR) de l'UICN
Les résultats montrent que sur 113 espèces, on
a : 04 espèces en danger (EN) et 06 espèces vulnérables
(VU). Les espèces classées dans ces 2 catégories sont
désignées toutes comme « menacées » et
représentent 8.85 % des espèces. Cet indice révèle,
ensuite, que 04 espèces sont quasiment menacées. Les taxons
menacés et quasi menacés représentent environ 12.39 % des
113 taxons recensés. On note, aussi, que 71 espèces ont un statut
de préoccupation mineure, 12 sont classées comme
données insuffisantes et 16 espèces sont
considérées comme étant non
évaluées par l'UICN.
Selon l'indice, les espèces dont leur statut
appartient aux catégories EN, VU, NT et LC sont plus ou moins
menacées de risque d'extinction (Tableau IV).

23
Tableau IV : nombre d'espèces de poissons marins
dans chaque catégorie de l'UICN (2017)
pour la Liste Rouge
EN DANGER (EN)
|
Diplodus vulgaris
|
Sparus (pagrus) pagrus
|
Epinephellus guaza (mérou brun)
|
Drepane africana
|
Sphyraena barracuda
|
Merluccius senegalensis (Merlu)
|
Elagatis bipinnulata
|
Sphyraena guachancho
|
Mobula mobular (mante)
|
Engraulis guineensis
|
Sphyraena sphyraena
|
Pseudotolithus senegalensis (Otolithe)
|
Ephippion guttifer
|
Spondyliosoma cantharus
|
VULNERABLE (VU)
|
Euthynnus alleteratus
|
Tilapia guineensis
|
Balistes carolinensis (baliste)
|
Fistularia petimba
|
Trachinotus ovatus
|
Isurus paucus (petit taupe)
|
Fistularia tabacaria
|
Trachurus trecae
|
Makaira nigricans (empereur)
|
Gerres octatis (nigri)
|
Trichiurus lepturus
|
Pseudupeneus prayensis (rouget)
|
Istiophorus platypterus
|
Umbrina canariensis
|
Sardinella maderensis (sardinelle plate)
|
Katsuwonus pelamis
|
DONNES INSUFFISANTES
(DD)
|
Thunnus obesus (Thon obèse)
|
Lagocephalus laevigatus
|
Arius gambiensis
|
QUASI-MENACEES (NT)
|
Lethrinus atlanticus
|
Bodianus speciosus
|
Albula vulpes (albule)
|
Lithognathus mormyrus
|
Elops senegalensis
|
Brachydeuterus auritus (pristipome doré)
|
Lutjanus fulgens
|
Epinephellus caninus
|
Epinephellus aeneus (`thiof'- mérou)
|
Mugil cephalus
|
Epinephellus goreensis
|
Galeoides decadactylus (petit capitaine)
|
Mycteroperca rubra
|
Lutjanus agennes
|
PREOCCUPATION MINEURE (LC)
|
Pagellus bellottii
|
Lutjanus goreensis
|
Acanthurus monroviae
|
Pagrus caeruleostictus
|
Parakuhlia macrophthalmus
|
Argyrosomus regius
|
Pagrus auriga
|
Plectorhinchus mediterraneus
|
Arius (Carlarius) heudelotii
|
Parapristipoma
octolineatum
|
Pontinus kuhlii
|
Auxis thazard
|
Polydactylus quadrifilis
|
Taeniura grabata
|
Boops boops
|
Pomadasys incisus
|
Zeus faber
|
Brama brama
|
Pomadasys jubelini
|
Serranus scriba
|
Branchiostegus semifasciatus
|
Pomadasys perotaei
|
NON EVALUEES (NE)
|
Brotula barbata
|
Pomadasys rogerii
|
Arius spp.
|
Caranx crysos
|
Priacanthus arenatus
|
Carcharhinus spp.
|
Cephalacanthus Volitans
|
Pseudotolithus typus
|
Chaetodon hastatus
|
Chaetodon hoefleri
|
Raja miraletus
|
Chaetodon sp.
|
Chloroscombrus chrysurus
|
Sarda sarda
|
Cynoglossus sp.
|
Chromis chromis
|
Sardinella aurita
|
Exocoetidae
|
Coryphaena hippurus
|
Sarpa salpa
|
Mugil sp.
|
Dactylopterus volitans
|
Scomber japonicus
|
Muraenidae
|
Decapterus (Caranx) rhoncus
|
Scomberomorus tritor
|
Oreochromis niloticus
|
Dentex canariensis
|
Scyris alexandrinus
|
Sarotherodon melanotheron
|
Dentex macrophthalmus
|
Selene dorsalis
|
Scorpaena spp.
|
Diplodus bellottii
|
Sepia officinalis
|
Seriola spp.
|
Diplodus cervinus
|
Serranus cabrilla
|
|
Diplodus sargus
|
Smaris (Spicara) melanurus
|
|

24
III.1.2. Résultats de la pêche
scientifique
III.1.2.1. Biodiversité
Le nombre total de taxons au large des côtes
sénégalaises est de 405 selon divers facteurs :
? Groupe zoologique : 353 poissons osseux ou
Ostéichtyens (87 %) et 52 poissons
cartilagineux ou Chondrichtyens (13 %) ont été
répertoriés (Figure 9, Annexe 4).
? Famille : les 405 taxons sont
répartis en 109 familles (Annexe 5). Les Soleidae, Serranidae,
Carangidae, Sparidae, Scorpaenidae et Haemullidae comptent le
plus de représentants (10 au moins).

Poissons osseux
87%
Poissons cartilagineux Poissons osseux
Poissons
cartilagineux
13%
Figure 8 : groupes zoologiques
? Zone : le nombre total d'espèces
par zone augmente du nord (267) au sud (316) en passant par le centre (296)
(Figure 10).
? Saison : le nombre total d'espèces
est plus important en saison chaude (340) qu'en saison froide (316) (Figure
11).
296
316
Nord Centre Sud
Zones d'échantillonnages
Figure 9 : nombre de taxons par zone

25
|
|
|
|
|
|
|
|
|
Saisons marines
|
Froide
|
|
323
|
|
|
|
|
|
|
Chaude
|
|
|
340
|
|
|
|
|
|
|
|
|
Taxons
|
|
|
Figure 10 : nombre de taxons par saison
? Strate horaire : le nombre total
d'espèces décroît suivant la période de la
journée. Il est ainsi plus important durant la matinée (328 entre
6-10h à 325 entre 10-13h) que la soirée (310 entre 13h-16h
à 233 entre 16h-20h) (Figure 12).
? Strate bathymétrique : le nombre total
de taxons baisse de la côte au large avec un facteur multiplicatif de 2.5
quand on passe de la tranche des 10-50 (345 taxons) à celle des 150-200
m (138 taxons) (Figure 13).
328 325 310
Nombre d'espèces
233
6-10 h 10-13 h 13-16 h 16-20h
Strates horaires
Figure 11 : nombre taxons/tranche horaire
273
345
Taxons
138
10-50m 50-100m 100-150m 150-200m
Strates bathymétriques
204

26
Figure 12 : nombre taxons/tranche
bathymétrique
III.1.2.2. Richesse spécifique III.1.2.2.1.
Situation globale
Les statistiques élémentaires relatives
à la richesse spécifique (nombre d'espèces/trait de
chalut) sont résumées ci-dessous (Tableau V) et en Annexe 6.
Tableau V : statistiques élémentaires de la
richesse spécifique globale
Paramètre
Global
|
Minimum
|
Maximum
|
Mode
|
Médiane
|
Moyenne
|
Ecart-type
|
Coefficient de
variation
|
|
47
|
19
|
19
|
20
|
6,72
|
0,34
|
|
La distribution globale des données de richesse
spécifique autour de leur moyenne est hétérogène
dans la mesure où le Coefficient Variation (CV) dépasse 15 %.
Cette distribution est proche de la Loi normale car la moyenne
mode médiane 19 - 20.
III.1.2.3. Occurrence
Les résultats d'occurrence de taxons
révèlent que parmi les 405 espèces de poissons
rencontrées, seule Trigla gabonensis (Grondin du Gabon) est
assimilable à un taxon fréquent (53 % d'occurrence). A part cette
espèce, 15 autres sont des taxons occasionnels (25 à 50 %
d'occurrence) dont : Pagellus bellottii (Pageot à tache rouge),
Trachurus trecae (chinchard noir), Zeus faber mauritanicus
(saint-pierre), Pseudupeneus prayensis (rouget du
Sénégal), Raja miraletus (raie miroire),
Brachydeuterus auritus (pelon) et trichiurus lepturus
(poisson-sabre). Les 389 taxons restants sont plutôt rares
(occurrence < 25%) comme, par exemple, le Sphyraena guanchancho
(barracuda Guachanche), la Sardinella aurita (sardinelle
ronde), le Sarda sarda (bonite à dos rayé) et le
Epinephelus caninus (Mérou de chien).

27
Sur les 10 espèces les plus occurrentes, une seule est
un poisson cartilagineux (Raja miraletus).
III.1.2.4. Indice de Jaccard
Les indices de Jaccard, comparables entre les 3 zones prises
2 à 2, affichent 27.35 % entre le centre et le nord, 27.43 % entre le
nord et le sud, 27.95 % entre le centre et le sud. Cela signifie qu'il existe
beaucoup plus d'espèces communes entre le centre et le sud par
comparaison entre le nord et le sud où l'on rencontre beaucoup plus
d'espèces communes par rapport entre le nord et le centre. On note,
également, que l'indice excède les 25% de similitude, dans tous
les cas.
III.1.2.5. Indice de similitude de Sørensen
Le but était de connaître la similitude en
espèce en croisant les 3 zones 2 à 2. L'indice de Sørensen
est un complément de l'indice de Jaccard. On retient les
résultats suivants :
· entre le centre et le nord : 0.753
· entre le nord et le sud : 0.756
· entre le centre et le sud : 0.775
Les résultats des indices de Sørensen confirment
les conclusions ceux des indices de Jaccard.
III.1.2.6. Indice de Whittaker
La comparaison du nombre de taxons qui sont unique (ou
spécifique) à chacune des 3 zones (nord, sud et centre) de la
côte sénégalaise affiche les résultats suivants
(Figure 14) :
· nord : 34 espèces
spécifiques
· centre : 42 espèces
spécifiques
· sud : 53 espèces
spécifiques
Ceci montre que la diversité taxonomique
spécifique est plus forte du sud vers le nord en passant par le centre.
L'indice de Whittaker permet de mesurer la diversité (ou dissimilitude)
entre les 3 zones en termes d'espèces.
Les résultats du calcul de cet indice montrent la
valeur « 1.38 » (compris entre 1 et le nombre total de sites).
L'indice est égal à 0.38 si on le ramène à
l'intervalle [0 ; 1]. La valeur de â trouvée est assez faible donc
le nombre d'espèces similaires entre sites est élevé.
III.1.2.7. Indice de Liste Rouge (ILR) de l'UICN
La Liste Rouge évalue le risque d'extinction des
espèces sur la base d'un ensemble de critères objectifs et
mesurables (Tableau V). Ainsi, on a :
· 2 En danger critique d'extinction (CR) avec
Squatina aculeata ou Ange de mer épineux et S. oculata
ou Ange de mer de Bonaparte
· 7 En danger (EN) comme le Pseudotolithus
senegalensis ou Otolithe Sénégalais
· 13 Vulnérables (VU) par exemple Galeoides
decadactylus ou petit capitaine Les espèces classées dans
ces 3 catégories sont désignées toutes comme «
menacées ». Cet indice révèle, ensuite, que :
? 14 espèces sont Quasiment menacées (NT) avec
Albula vulpes ou banane de mer, par exemple
Les taxons menacés et quasi menacés
représentent environ 8 % des 405 taxons recensés.
? 228 espèces ont un statut de Préoccupation
mineure (LC) par exemple, le Dentex macrophthalmus
? 43 sont classées dans les Données
insuffisantes (DD) avec Lutjanus goreensis (vivaneau de
Gorée) comme exemple.
? 98 espèces sont Non évaluées (NE) comme
le Gobius senegalensis ou Gobie
Selon l'indice, les espèces dont leur statut
appartient aux catégories CR, EN, VU, NT et LC sont plus ou moins
menacées de risque d'extinction.
III.1.2.8. Analyse de variance à un facteur :
ANOVA-1
Les résultats de l'analyse de variance nous montrent
que la saison (chaude et froide), la zone (centre, sud et nord), la profondeur
(10-50 m, 50-100 m, 100-150 m et 150-200 m) et l'heure (610 h, 10-13 h, 13-16 h
et 16-20 h) d'échantillonnage ont un impact sur la biodiversité
et de manière très hautement significative (Tableau VI).
Tableau VI : niveau de significativité des
variables déterminant la diversité des espèces
Facteurs
|
Pr (> Chi) (P-value)
p < 1 %o.
|
Niveau de
Significativité
|
Saison
|
0.0006502
|
***
|
Zone
|
2.946 e-11
|
***
|
Profondeur
|
1.786 e-5
|
***
|
Heure
|
0.0001730
|
***
|
|
III.2. Discussion
P our la pêche artisanale, au niveau
du quai de pêche de Hann, 113 espèces de poissons ont
été débarquées. Plusieurs auteurs ont
travaillés dans ce domaine : Lenfant et al. (2011) avec 106
espèces de Leucate à Port-Vendres en France ; Najih et al.
(2015) avec 34 taxons dans la lagune de Nador, au Maroc et Hounsounou
et al. (2013) avec 257 espèces au Bénin.
Concernant les 51 familles, Sparidae et Carangidae comptent
10 représentants au moins. La grande diversité de ces familles a
été rapportée par des auteurs comme Ayissi et al.
(2015) dans le Golfe de Guinée, au Cameroun (11 familles), Najih
et al. (2015) au Maroc et Hounsounou et al. (2013) au
Bénin. La biodiversité est grande et les raisons seraient dues
à la transition des saisons marines froide et chaude du mois mai
caractérisée par l'apparition des eaux tropicales chaudes
(Rossignol et al., 1965). Selon Stéquert et al.
(1979), ces eaux refoulent vers le nord les eaux d'upwellings ainsi que
les espèces qui leur sont liées. Elles amèneront avec
elles les espèces à affinité guinéenne comme par
exemple la grande carangue (Caranx hippos) et le barracuda
(Sphyraena spp.).
28
L a position nord de Dakar regorge plus
d'espèces que la position sud, d'une part, et la position centre,
d'autre part. Ceci pourrait s'expliquer par la structuration sous-marine de la
zone nord qui lui conférerait de nombreux habitats faunistiques. Il
existe, dans cette zone, des bancs rocheux et des falaises sous-marines
bordées soit par un éboulis chaotique sous-marin, soit par une
plateforme d'abrasion marine telle la chaussée des Almadies (Domain,
1976).
On y note, aussi, de récifs artificiels de l'île
de la Madeleine. La pêche est interdite sur un rayon de 500 m des
récifs artificiels. On considère que le récif va restaurer
les habitats dégradés par l'homme et augmenter la
biodiversité et la diversification des ressources (Sène &
Sané, 2008).
L e nombre total d'espèces diminue de
l'aube au soir ((93 entre 6h30-10h à 04 entre 16-19h). Ce
phénomène pourrait s'expliquer par le phototropisme positif ou le
phototropisme négatif.
D'après le Catalogue et Index des Sites
Médicaux de langue Française (CISMEF), le phototropisme est une
réaction d'orientation d'un animal fixé, s'effectuant soit dans
la direction de la lumière solaire (héliotropisme positif), soit
dans la direction opposée (héliotropisme négatif). Les
espèces présentant un héliotropisme positif sont actives
la journée mais vers 17-18 h, elles s'installent sur la vase. Au fur et
à mesure que l'on chalute, le nombre d'espèces diminue
pratiquement. Vers 19h, on ne pêche que de petits pélagiques et
ceux-ci sont pris lors de la remontée du chalut (Communication
Personnelle Dr Ndiaga Thiam, le 22 février 2017).
Les travaux au Congo de Fontana (1981) sur l'activité
de la crevette rose du large (La) ou Parapenaeus longirostris
confirment nos résultats. Ceux de Pham (2011) en
Nouvelle-Calédonie sur la crevette bleue (Litopenaeus stylirostris
au stade nauplius) et ceux de Kurc & Blancheteau (1966) en France sur
la pêche à la lumière s'en rapprochent, aussi.
L e nombre d'espèces de poissons
diminue de la côte vers le large. Ceci pourrait s'expliquer par une
grande disponibilité de la nourriture et de l'oxygène dissout
à la surface.
Premièrement, selon Nzayisenga (2007),
l'oxygène dissous diminue progressivement avec la profondeur.
D'après Legendre (2012), au niveau des premiers mètres de la
colonne d'eau, la teneur en O2 est généralement abondante par
suite de la dissolution dans l'eau de mer des gaz de l'atmosphère qui
contient 20 % d'O2. De plus, à certaines saisons, la
photosynthèse du phytoplancton marin produit beaucoup d'oxygène
dans les eaux de surface. Les organismes qui vivent dans la colonne d'eau
consomment de la matière organique pour vivre, croître et se
reproduire ; ce faisant, ils utilisent de l'oxygène.
Deuxièmement, la période d'upwelling en saison
froide (Fall, 2009) joue, aussi, un rôle dans la grande diversité
ichtyologique observée au large des côtes. Lorsqu'il se produit,
un vent fort souffle à la surface de l'océan, poussant les eaux
chaudes de surface vers le large. Pour combler le vide, les eaux froides du
fond (Anonyme, 2012) de la mer remontent chargées d'oxygène et de
nutriments.
L es résultats ont montrés
qu'il y a plus et autant d'espèces (58) dans les trémails et FDF
que dans les autres engins de pêche artisanale. Cette
égalité de taxons entre ces 2 engins n'est peut-être pas
étonnante. En effet, d'après Thiao (2009), « le
trémail est une variante du filet dormant et est posé de la
même manière ce celui-ci ».
Les filets dormants à «poissons» sont les
plus répandus sur le fleuve Sénégal. En Casamance, leur
fonction varie selon le type et l'éventail d'espèce
recherchée (Bousso, 2000).
Concernant le trémail, il réputé pour
son efficacité et est très répandu dans le monde. Au
Sénégal, dans certains villages, il est devenu l'engin dominant
parmi les pêcheurs utilisant des filets
29
maillants ou des casiers. Les seiches ou les soles seraient
capturées avec une efficacité particulière, et que, le
trémail assurerait par ailleurs des prises régulières et
diversifiées de différentes espèces (Charles-Dominique
& Diallo, 1997).
Les engins de pêche ont été cités
par : Saint-Felix (1979) sur la bordure caraïbe de la Martinique, Le
Douguet (2009) dans les AMP d'Afrique de l'ouest, Bousso (1994), Bakhayokho
et al. (1997), Charles-Dominique & Diallo (1997), Bousso (2000) et
Thiao (2009) au Sénégal.
L `espèce la plus occurrente est la
Sardinella aurita assimilée à un taxon «
Occasionnelle ». Les autres taxons sont des espèces «
Rares » avec Sardinella maderensis et Sarda sarda qui
sont les plus occurrentes de ce lot. Ceci valide le constat de Dème
et al. (2012) selon lequel les espèces pélagiques
côtières représentent en moyenne 70% des captures (les 2
sardinelles principalement) de la pêche artisanale
sénégalaise.
Au Sénégal, les pêcheries ciblent la
sardinelle avec une préférence pour la sardinelle ronde. Elle a
été intensivement pêchée, surtout en 2011-2012, et
les efforts sont en nette augmentation. En outre, les juvéniles sont
également capturés (Munroe et al., 2015). Thiam &
Sarré (2015) considère S. aurita comme un taxon
d'occurrence « rare ».
En ce qui concerne Sarda sarda ou thon blanc, les
premières captures importantes se situent en général au
mois de mai lorsque commence le rassemblement des reproducteurs près de
la côte. C'est un poisson d'alimentation important, abondant dans de
très nombreuses localités et est ciblé par un certain
nombre de pêcheries dans toute son aire de répartition. Elle a,
donc, un fort intérêt commercial. (Dardignac, 1962 ; Maigret &
Ly, 1986 ; Collette et al., 2011).
L es indices de Jaccard et de Sorensen
montrent que le duo des positions nord et sud renferme beaucoup plus
d'espèces communes que les croisements positions centre et nord ainsi
que les positions centre et sud. Les indices excèdent les 25 % de
similitude, uniquement, entre le croisement des positions nord et sud. On
suppose que les conditions environnementales sont beaucoup plus identiques
entre ces 2 positons alors qu'elles le sont un peu moins au niveau des autres
positions croisées.
Le croisement des positions sud et centre présentent
moins de taxons en communs que les positions croisées. En effet, le
centre est représenté, principalement, par la baie de Hann.
Connaissant l'état actuel très pollué cette baie
(Kandé, 2017 ; Sonko, 2017), on suppose que la diversité
taxonomique y est faible. Par conséquent, tout croisement de site avec
la position centre présentera moins d'espèces de poissons que si
on croisait les positions nord et sud.
On comprend pourquoi l'indice de Whittaker est de 0.66 et que
la diversité taxonomique spécifique est plus grande au nord (37
taxons) et au sud (10 taxons).
La valeur de â supérieure à la moyenne,
le nombre d'espèces similaires entre sites est assez grand et la
dissimilitude de taxons entre les sites est peu grande.
L 'indice de liste rouge a
révélé 04 espèces en danger (EN,
exemple Merluccius senegalensis), 06 vulnérables
(VU, exemple Sardinella maderensis) et 04
quasi-menacés (NT, exemple. Epinephelus
aeneus). Ces espèces précitées sont celles qui ont la
plus grande valeur commerciale dans chaque catégorie selon UICN
(2017).
Pour Merluccius senegalensis (Merlu
sénégalais), les menaces sont, principalement, leur exploitation
commerciale par les Espagnols, les chaluts de fond, les petits palangriers,
les
30
pêcheurs aux filets maillants et la pêche
accessoire des pêcheries céphalopodières et
crevettières, (Iwamoto, 2015).
Concernant Sardinella maderensis
(Sardinelle plate), elle est menacée par les
pêcheurs de canot : filets annulaires, filets maillants, sennes de plage
; les senneurs locaux ; les chalutiers industriels (Tous et al.,
2015).
Enfin, pour Epinephelus aeneus
(`Thiof' ou Mérou), la principale menace est la
surpêche. Elle a une importance économique considérable,
important sur le marché du poisson au Sénégal par la
pêche artisanale ; c'est un produit frais à l'échelle
industrielle et pour l'exportation (Thierry et al., 2008).
Ensuite, 12 et 16 taxons relèvent de la
catégorie Données insuffisantes (DD) et
Non Evalués (NE), respectivement. Ces catégories
ne signifient pas que l'espèce n'est pas menacée mais que les
données sont insuffisantes ou n'ont pas pu être quantifiées
pour mesurer l'impact des menaces potentielles ou réelles
(Sidibé, 2010 ; Abdul Malak et al., 2011).
Sur une note plus positive, plus de la moitié (71
espèces) des poissons sont catalogués
préoccupation mineure, ce qui signifie qu'ils ne sont
pas confrontés à un risque d'extinction imminent (exemple
Dentex macrophthalmus et Pagellus bellottii).
Nos travaux sont confrontés à ceux de
Sidibé (2010), en Afrique de l'Ouest, qui a étudié le
statut UICN de 12 espèces de poissons (1 VU, 2 NT, 4 LC et 5 DD).
P our la pêche scientifique, les
nombreuses campagnes scientifiques démersales côtières
menées au large des côtes du Sénégal montrent des
résultats cohérents entre elles : la diversité est
très grande. Au total, 405 espèces ou groupes d'espèces de
poissons, répartis en 109 familles, ont été
rencontrées. Des études locales y ont bien été
menées, aussi, par des auteurs comme Domalain et al. (2002) qui
ont trouvé 291 espèces. Dans d'autres pays, Domalain et al.
(2002) ont rencontré 300 espèces en Guinée, Amorim
et al. (2002) 316 espèces en Guinée Bissau, Gascuel
et al. (2012) 211 en Mauritanie, Taï et al. (2013) 243
espèces au Maroc et Tamdrari (2007) 117 espèces dans le nord du
Golfe du Saint-Laurent à Québec au Canada.
Au Sénégal, les 405 espèces sont
réparties en 353 poissons osseux (87 %) et 52 poissons cartilagineux (13
%). Ce taux est assez proche de celui de Thiam & Sarré (2015) ayant
identifié 92 % d'espèces de poissons sur 158 espèces
rencontrées. Il dépasse même celui de Taï et al.
(2013) au Maroc qui ont trouvé 204 Ostéichtyens (63%) et 39
Chondrichtyens (13%). De tels pourcentages s'expliquent aisément par le
fait que l'engin de pêche utilisé est un chalut standard à
poisson.
Les 109 familles notées au Sénégal sont
à dominante de Soleidae, Serranidae, Carangidae, Sparidae, Scorpaenidae
et Haemullidae comptant chacune 10 représentants au moins. Au Maroc,
Taï et al. (2013) ont rencontrés 96 familles dont les plus
représentées sont les Soleidae, les Sparidae et les Rajidae
(raies). La grande diversité de ces familles, au Sénégal,
a été rapportée par plusieurs auteurs comme Ndiaye et
al. (1982), Fall & Niass (2014), Thiam & Sarré (2015) et
UEMOA (2015). Plusieurs facteurs peuvent expliquer cette diversité
ichthyologique locale.
D 'après l'ANOVA-1 mise en oeuvre
ici, le nombre d'espèces de poissons augmenterait de manière
très hautement significative du sud vers le nord en passant par le
centre. Les raisons qui pourraient expliquer que la zone influe sur la
biodiversité sont plurielles.
Premièrement, le traitement de données montre
que la pression d'échantillonnage est beaucoup plus forte au sud (507
stations) qu'au centre (364 stations) et au nord (382 stations). De plus, la
31
ZMC entre le Sénégal et la Guinée Bissau
confère au sud une côte d'une grande superficie, à
même de renfermer d'avantage de taxons.
Deuxièmement, au sud, le plateau continental atteint
sa largeur maximale (Fall, 2009). Domain (1977) confirme ce fait : la largeur
de celui-ci ne fait qu'augmenter jusqu'en Guinée Bissau contrairement au
Nord ou le plateau est plus ou moins étroit. Dans le sud, on note aussi
une pente faible jusqu'à 100 m (Diop, 1990).
Troisièmement, le sud présente un ensemble
d'estuaires comme le Saloum, la Gambie, la Casamance, l'extrême
nord-ouest de la Guinée-Bissau et les archipels Bissagos. Ces
systèmes estuariens génèrent les mangroves des «
Rivières du Sud » zones qui occupent une place
particulièrement importante pour les communautés ichtyologiques
(Barusseau et al., 1999), sont, également, des lieux de
nourriceries pour leurs stades juvéniles (Johannes, 1978 ; Beckley, 1984
; Day et al., 1989 in Guiral et al., 1999 ; Fall, 2009).
Notons que la zone des Rivières du Sud est le siège d'une forte
activité minéralisatrice incluant des bactéries libres et
fixées (Ducklow et al., 1982) et des
micro-hétérotrophes (Day et al., 1989), toutes choses
qui concourent à enrichir les eaux en nutriments. Ainsi, les post-larves
et les juvéniles de poissons y trouvent des conditions trophiques
favorables (phytoplanctons et zooplanctons) (Miller & Dunn, 1980 ; Mann,
1982 ; Legett, 1986) in (Guiral et al., 1999).
Enfin, la variété morpho-édaphique et
hydrologique des estuaires des Rivières du Sud a pour conséquence
une grande diversité des conditions environnementales, et donc des
habitats disponibles pour les communautés ichtyologiques (Barusseau
et al., 1999).
A u Sénégal, la
diversité des poissons est plus importante en saison chaude (340
espèces) qu'en saison froide (323 espèces). Ceci pourrait
s'expliquer de différentes manières :
D'abord, le nombre d'espèce observé,
spécifiquement/uniquement, durant la saison chaude est plus
élevé que durant la saison froide. Donc, on suppose que les
côtes sénégalaises possèdent beaucoup plus
d'espèces de saison chaude (par exemple Ophisurus serpens ou
l'anguille de sable) que d'espèces de saison froide (par exemple
Scomber japonicus ou maquereau espagnol).
Ensuite, durant la saison chaude (Fall, 2009), on note une
manifestation de la mousson et une apparition des pluies entrainant des
périodes de hautes eaux annuelles des 4 systèmes pluviaux du pays
(Lopez, 1979 in Fall, 2009 ; Domain, 2000). D'après Domain (2000),
celles-ci transportent, à la mer, des apports terrigènes qui
favorisent une forte productivité primaire et donc une importante source
d'enrichissement (e.g. sels minéraux - matières organiques,
Anonyme, 2014) des milieux littoraux (Diop, Fabres & Pravettoni, 2012) et
du plateau continentale de la Sénégambie (Fall, 2009) et,
également, le recrutement de certaines espèces
(Sciaenidés, par exemple) des grands fleuves (Domain, 2000).
Enfin, durant la saison chaude, on note un contre-courant
équatorial qui est dévié de la Guinée à la
Mauritanie en passant par le Sénégal. Ce courant véhicule
2 types de masses d'eaux chaudes sur le plateau continental : eau tropicale
chaude et salée, fin mai à août, eaux guinéennes
chaudes, dessalées, turbides, riche en nourriture, août à
décembre (Domain, 2000 ; Fall, 2009).
Les résultats de cette étude confirment ceux de
Domain (2000) sur la communauté des Sciénidés entre 1985
et 1986. En termes d'abondance, les valeurs obtenues en fin de saison humide
étaient en effet largement supérieures aux valeurs de saison
sèche.
L e grondin du Gabon ou Trigla
gabonensis présente 53 % d'occurrence : ce qui en fait une
espèce fréquente. En effet, elle fréquente le littorale
des côtes occidentales d'Afrique (Séret,
32
2011) de même que le plateau continental (Schneider,
1992). Elle est pêchée à la ligne ou au chalut comme prise
accessoire, et consommée à des niveaux artisanaux (Russell et
al., 2015). Le statut fréquent du grondin du Gabon a
été évoqué par Thiam & Sarré (2015) au
Sénégal qui confirment nos résultats. Quartey & Ekuban
(2015) du Ghana ont trouvés que cette espèce est rare ; ce qui
s'expliquerait par la diversité des biotopes marins entre le
Sénégal et le Ghana. Dans cette étude, 15 espèces
sont considérées comme occasionnelles : Pagellus bellottii,
Trachurus trecae, Zeus faber mauritanicus, Pseudupeneus prayensis, Raja
miraletus, Brachydeuterus auritus, Trichiurus lepturus, Arnoglossus imperialis,
Dentex angolensis, Boops boops, Syacium micrurum, Decapterus rhonchus,
Sphoeroides pachygaster, Priacanthus arenatus et Sphoeroides
spengleri.
Nos résultats confrontés à ceux de
Jouffre et al. (2002) en Guinée, au Sénégal et en
Mauritanie, montrent que Pagellus bellottii, Trachurus trecae et
Raja miraletus sont des espèces fréquentes. Zeus
faber mauritanicus (absent au Sénégal), Pseudupeneus
prayensis (fréquente au Sénégal et rare en
Guinée), Syacium micrurum et Decapterus rhonchus sont
des espèces occasionnelles tandis que Brachydeuterus auritus,
Trichiurus lepturus, Boops boops et Sphoeroides spengleri sont
des espèces rares.
Les études de Thiam & Sarré (2015) au
Sénégal montrent que Pagellus bellottii, Trachurus trecae
et Pseudupeneus prayensis sont des espèces permanentes.
Raja miraletus et Brachydeuterus auritus sont des taxons
fréquents. Zeus faber mauritanicus, Trichiurus lepturus,
Boops boops, Syacium micrurum, Decapterus rhonchus et Sphoeroides
spengleri sont des espèces occasionnelles. Arnoglossus
imperialis, Dentex angolensis, Sphoeroides pachygaster et Priacanthus
arenatus sont des taxons rares.
Les 389 taxons restant sont rares. Les causes sont
variées : forte exploitation commerciale par la pêcherie,
pêche accessoire, destruction de l'habitat, profondeurs reculées
avec par exemple Sphyraena guanchancho (barracuda), Sardinella
aurita (sardinelle ronde), Sarda sarda (bonite à dos
rayé) et Epinephelus caninus (Mérou de chien).
D'après Froese & Pauly (2016), ces espèces
précitées appartiennent à la pêcherie hautement
commerciale et voire même sportive pour le Sarda sarda.
Les travaux de Jouffre et al. (2002) et ceux de
Thiam & Sarré (2015) confirment le statut rare de Sardinella
aurita et de Sphyraena guachancho ; ce qui est normal, ces
espèces étant strictement pélagiques, tandis que le chalut
utilisé est de type bentho-démersal.
L es indices de Jaccard et de Sorensen
montrent que le centre et le sud renferment plus de taxons communs entre eux,
qu'entre le sud et le nord d'une part, le centre et le nord d'autre part.
D'abord, les indices excèdent 25 % de similitude et on
suppose que les conditions environnementales sont assez identiques entre les
sites croisés.
Le sud et le centre présentent plus de taxons en
communs que les autres sites croisés en raison de la présence en
ces lieux des « Rivières du Sud » et d'un plateau continental
large avec plusieurs habitats.
On comprend alors pourquoi l'indice de Whittaker est de 0.38
et que la diversité taxonomique spécifique est plus grande au sud
(53 espèces) et au centre (42 espèces). La valeur de â
étant faible, le nombre d'espèces similaires entre sites est
élevé et la dissimilitude de taxons entre les sites est
faible.
33
Ensuite, le sud et le nord sont les 2èmes sites
croisés ayant le plus d'espèces communes, sachant qu'au nord
aussi on note la présence du fleuve Sénégal (Domain, 1977
; Fall, 2009) et, donc, implicitement des hydro systèmes, apports
terrigènes et donc une grande biodiversité.
Le nord est caractérisé, aussi, par la
présence d'un canyon sous-marin : la fosse océanique de Kayar. De
nombreuses espèces démersales et pélagiques y sont
présents en saison froide (Diarra, 2006).
D eux grandes espèces de requin-ange
trapue (Squatina aculeata et S. oculata) sont en
danger critique d'extinction. Des évaluations en 2007, 2011 et
2015 montrent que leur catégorie n'a pas changé (Morey et
al., 2007). Leur effondrement est dû aux pressions intenses de la
pêche démersale. Le faible pourcentage d'échange entre les
populations isolées indique qu'elles sont prédisposées
à décroître localement, et au moins une espèce,
l'Ange de mer épineux, Squatina aculeata, a été
exterminée de la Méditerranée et est
considérée comme éteinte du point de vue commercial
(Cavanagh & Gibson, 2007).
Concernant les taxons en danger (exemple
Pseudotolithus senegalensis), vulnérables
(exemple Galeoides decadactylus) et
quasi-menacés (exemple Albula vulpes) qui
sont, respectivement, au nombre de 7, 13 et 14, les menaces sont diverses :
pêche industrielle, artisanale et étrangère dans la
sous-région (Sidibé, 2003 ; Sidibé, 2010), pollution
marine ; exploitations pétrolières (Nunoo & Nascimento,
2015), pollution hydrocarbures; destruction des mangroves (Carpenter et
al., 2015), pêche accessoire, filets non autorisés,
influences climatiques, anthropiques (Adams et al., 2012). Nos travaux
sont confrontés à ceux de Abdul Malak et al., (2011), sur la mer
Méditerranée, qui ont montrés que sur 519 taxons de
poissons marins, plus de la moitié des espèces sont
menacées par la pêche ciblée ou par les prises
accessoires.
34
CONCLUSIONS, RECOMMANDATIONS & PERSPECTIVES
Les données sur la biodiversité ichtyologique
marine de la baie de Hann et de la Zone Economique Exclusive (ZEE) du
Sénégal montre que la diversité taxonomique est grande
avec 113 espèces au port de Hann et 405 observée en pêche
expérimentale. Cette biodiversité est plus grande durant la
saison chaude marine que durant la saison froide. Elle décroît de
la côte vers le large et de l'aube vers le soir. Elle est, aussi, plus
important au niveau de la position nord du site de Hann et dans la zone sud de
la ZEE que par rapport aux autres positions et zones. Le nombre
d'espèces de poissons est plus grand dans les trémails et FDF (58
taxons chacun), les FMDS et les FDS. Il est relativement faible dans les EP,
les LCS et les LTR (1 à 2 taxons). Les indices de Jaccard montrent que
les croisements des positions nord et sud par rapport au port de Hann de
même que les croisements zones sud et centre de la ZEE présentent
beaucoup plus d'espèces communes par rapports aux autres sites
croisés. L'indice de Whittaker a montré que la position nord du
quai de pêche artisanale de Hann de même que la zone sud de la ZEE
sénégalaise possèdent beaucoup plus d'espèces
spécifiques à ces zones là que par rapport aux autres
sites. L'étude a montré (grâce aux tests statistiques de
l'ANOVA-1) que les niveaux de richesse spécifique inter strates, zones
et saisons sont significatives. Elle révèle, également,
par rapport au statut ILR établi par l'UICN, que près de 9 % des
espèces débarquées au quai de pêche artisanale de
Hann et près de 5 % des taxons rencontrés en pêche
scientifique au Sénégal sont menacées (VU- EN-CR)
d'extinction.
Pour une meilleure gestion des ressources halieutique, nous
recommandons :
· le respect des dispositions pertinentes du Code de la
pêche maritime,
· la promotion de techniques de pêche «
écologiques » et/ou d'espaces marins protégés,
· la lutte contre la pêche illicite, non
déclarée et non réglementée (INN),
· la remise en liberté immédiate et sans
conditions des 2 espèces d'anges de mer, à savoir Squatina
aculeata et S.oculata (en danger critique d'extinction) suite
à leur capture,
· l'identification de moyens plus efficaces et surtout
pérennes pour faire l'évaluation régulière des
stocks via la conduite de campagnes de chalutages scientifiques sachant que
l'on connaît assez bien le rôle destructeur des chaluts de
pêche commerciaux, industriels notamment (exemple : capture
d'espèces non ciblées et destruction des habitats)
· la sensibilisation accrue des pêcheurs artisans
pour l'adoption de techniques de pêche plus responsables et plus
durables
Dans le futur, il serait intéressant :
· de suivre régulièrement un pêcheur
artisan avec un engin de pêche bien déterminé afin
d'évaluer les débarquements de cet engin sur une période
bien définie, surtout plus longue
· d'évaluer l'abondance, la biomasse, les
fréquences de tailles et l'aspect socio-économique des
débarquements du quai de pêche de Hann et des autres centres.
· d'étendre cette étude au-delà de
200 et jusqu'à 800 m de profondeur c'est-à-dire prendre en compte
les ressources démersales profondes (exemple merlus, rascasses et
baudroie)
· de faire ce travail au niveau des eaux continentales
du Sénégal comme les estuaires (Saloum et Casamance), le fleuve
Sénégal et les lacs (exemple Guiers, Retba et Tanma)
· d'élargir cette étude au niveau de toute
la zone côtière marine de l'Afrique de l'Ouest.
35
BIBLIOGRAPHIES
Abdul Malak D., Livingstone S. R., Pollard D.,
Polidoro B. A., Cuttelod A., Bariche M., Bilecenoglu M., Carpenter K. E.,
Collette B. B., Francour P., Goren M., Kara M. H., Enric M., Papaconstantinou
C. & Tunesi L., (2011). Aperçu du statut de conservation
des poissons marins présents en mer Méditerranée. Gland,
Suisse et Málaga, Espagne : UICN, p. 61, ISBN : 9782831714332.
Amorim P. A., Mané S. S. & Stobberup K. A.,
(2002). Structure des peuplements de poissons démersaux
fondée sur les campagnes scientifiques de chalutage menées sur la
plateforme continentale et le talus supérieur au large de la
Guinée-Bissau. In : Chavance P., Ba M., Gascuel D., Vakily J. M. &
Paul D. (dirs.). Pêcheries Maritimes, Ecosystèmes et
Sociétés en Afrique de l'Ouest : un siècle de changement.
Bruxelles, collection des rapports de recherche halieutique ACP-UE,
vol. 1, n°15, p. 37-44.
Ayissi I., Aksissou M., TiwariM., & Fretey J.,
(2015). Étude descriptive des pêcheries artisanales et de
leur incidence sur les tortues marines au sein du futur parc national marin de
Manyange na Elombo Campo (Cameroun, golfe de Guinée). Bulletin de la
Société Herpétologique de France, n°156, p.
15-30.
Ba H., (2005). Le groupement
économique féminin, GÉF, des micro-mareyeuses au site de
Hann à Dakar. Centre de Recherche sur les Innovations Sociales (CRISES).
Collection Études de cas d'entreprises d'économie
sociale, n°ES0502, p. 70, ISBN : 2896051805.
Bakhayokho M., Dieng A., Dème M., Diallo M.,
Diadhiou H. D., Diop M. Y., Sagna A., Diop A., Diouf A., Diouf P. S.,
Guèye A., & Sall A., (1997). Inventaire des
technologies des petits exploitants des ressources halieutiques. Archives
Scientifiques du Centre de Recherches Océanographiques de Dakar-Thiaroye
(CRODT), n°201, p. 78.
Barry M. D., Bousso T., Dème M., Diouf T.,
Fontana A., SAMB B. & Thiam D., (2005). Les ressources
halieutiques. Bilan de la recherche agricole et agroalimentaire au
Sénégal. ISRA, ITA, CIRAD, p. 23.
Barry M. D., Laurans M., Thiao D. & Gascuel D.,
(2004). Diagnostic de l'état d'exploitation de cinq
espèces démersales côtières
sénégalaises. In : Chavance P., Ba M., Gascuel D., Vakily J. M.,
Paul D. (dirs.). Pêcheries maritimes, écosystèmes et
sociétés en Afrique de l'Ouest : un demi-siècle de
changement. Bruxelles, collection des rapports de recherche halieutique
ACP-UE, vol. 1, n°15, p. 183-194.
Barusseau J.-P., Bâ M. & Diop S., (1999).
L'environnement physique. In : Cormier M.-C. C. (dir.).
Rivières du Sud. Sociétés et mangroves ouest-africaines.
Marseille, IRD Editions, « hors collection », p. 416, p.
33-61, ISBN : 9782709914260, ISBN électronique : 9782709917780, DOI :
10.4000/books.irdeditions.4974.
Beckley L. E., (1984). The ichthyofauna of
the Sundays estuary, South Africa, with particular reference to the juvenile
marine component. Estuaries, vol. 7, p. 248-258, DOI :
10.2307/1352145.
Bélin C. & Soudant D., (2011).
Note sur l'approche statistique de la diversité en
écologie : application à l'indice composition pour le
phytoplancton. Rapport de Recherche DYNECO/VIGIES/11-02/DS. Nantes, Ifremer, p.
21.
Bellemans M., Sagna A., Fischer W. & Scilabba N.,
(1988). Guide des ressources halieutiques du Sénégal et
de la Gambie (espèces marines et d'eaux saumâtres). Fiches FAO
d'identification des espèces pour les besoins de la pêche. Rome,
FAO, p. 277.
Bertrand J., (1994). Campagne internationale
de chalutage démersale en Méditerranée (MEDITS). Rapport
final. Commission Européenne/IEO/IFREMER/Collectivité
territoriale Corse pour la France ministère des ressources
forestières, agricoles et alimentaires/NCMR. IFREMER/ARCHIMER, p. 34.
36
Blache J., Cadenas J. & Stauch A., (1970).
Clé de détermination des poissons de mer signalés
dans l'Atlantique Oriental entre le 20ème parallèle Nord et le
15ème parallèle Sud. Editions de l'ORSTOM, p. 479.
Bousso T., (1994). Typologie des engins et
techniques de pêche artisanale utilisée au Sine-Saloum
(Sénégal). Centre de Recherches Océanographiques de
Dakar-Thiaroye (CRODT), n°141, p. 111.
Bousso T., (2000). Biodiversité et
stratégies de pêche, exemple des pêcheries estuariennes du
Sénégal. Centre de Recherches Océanographiques de
Dakar-Thiaroye (CRODT), p. 27.
Cavanagh R. D. & Gibson C., (2007).
Overview of the Conservation Status of Cartilaginous Fishes (Chondrichthyans)
in the Mediterranean Sea. IUCN, Gland, Switzerland and Malaga, Spain. Vol. 1,
p. 42.
Charles-Dominique E., & Diallo M., (1997).
Le trémail, une innovation dans la pêche artisanale
sénégalaise: processus de diffusion et fonctionnement. Centre de
recherches océanographiques de Dakar-Thiaroye, ISRA, n°145, p. 23,
ISSN : 08501602.
Corlay J-P., (1993). La pêche au
Danemark. Essai de géographie halieutique. Thèse de doctorat
d'État en géographie, Université de Bretagne Occidentale,
Brest, France, p. 131.
Cury P. & Morand S., (2004).
Biodiversité marine et changements globaux : une dynamique
d'interactions où l'humain est partie prenante. Biodiversité et
changements globaux. Enjeux de société et défis pour la
recherche. Paris, éditions ADPF, chapitre 3, p. 30.
Day J. W., Hall C. A., Kemp W. M., &
Yáñez-Arancibia A. (dirs), (1989).
Estuarine ecology. Vol, p. 558, ISBN : 9780471062639.
De Bello F., Lep J., & Sebastià M. T.,
(2007). Grazing effects on the species-area relationship: Variation
along a climatic gradient in NE Spain. Journal of Vegetation Science,
vol. 18, n°1, p. 25-34.
Dème M., Thiao D., Ngom Sow Fambaye, Sarre A.
& Diadhiou H. D., (2012). Dynamique des Populations de Sardinelles
en Afrique du Nord-Ouest : Contraintes Environnementales, Biologiques et
Socio-économiques. USAID/COMFISH project, Senegal, University of Rhode
Island, Narragansett, RI, p. 125.
Dia D., (2014). La pêche artisanale
à partir de la baie de Hann. Mémoire de fin d'études pour
l'obtention du diplôme de master 2 en Espace, Société
option Aménagement et Gestion Urbaine en Afrique (AGUA).
Université Cheikh Anta Diop de Dakar, Sénégal, p. 75.
Diarra B., (2006). Quelles stratégies
de Suivi, Contrôle et Surveillance des Ressources Halieutiques en
Cogestion locale ? Etude de cas : la surveillance participative au niveau des
sites pilotes du programme GIRMaC. Mémoire de master en Sciences
Halieutiques et Aquacoles. Institut Universitaire de Pêche et
d'Aquaculture (IUPA), Université Cheikh Anta Diop de Dakar (UCAD),
Dakar, Sénégal, p. 62.
Diop N. T., (2006). Rapport sur les
négociations, accord et protocole en matière de pêche entre
le Sénégal et la Communauté Européenne.
Ministère de l'Economie Maritime et des Transports Maritimes
Internationaux, Direction des Pêches Maritimes, p. 34.
Diop S., (1990). La Côte
Ouest-Africaine. Du Saloum (Sénégal) à la Mellaco
(République de Guinée). Paris, ORSTOM, Etudes et
Thèses, p. 300.
Diouf S., (2006). Aménagement des
pêcheries maritimes artisanales au Sénégal : bilan et
perspectives. Mémoire de fin d'études pour l'obtention du
diplôme de master en sciences halieutiques et aquacoles. Institut
Universitaire de Pêche et d'Aquaculture (IUPA), Université Cheikh
Anta Diop de Dakar (UCAD), Dakar, Sénégal, 68 p.
Domain F., (1977). Carte
sédimentologiques du plateau continental sénégambien.
Extension à une partie du plateau continental de la Mauritanie et de la
Guinée Bissau. Paris : ORSTOM, n°68, p. 18, ISBN 2709904381.
Domain F., (1978). Potentialités
comparées des différentes zones de pêche d'espèces
démersales du golfe de Guinée (19° N à 6° S). In
Domain F. (dir.) : Le courant des Canaries : upwelling et ressources vivantes.
Document Scientifique CRODT, Dakar, Sénégal, n°67 p. 10.
37
Domain F., (1980). Contribution à la
connaissance de l'écologie des espèces démersales du
plateau continental sénégalo-mauritanien : les ressources
démersales dans le contexte du golfe de Guinée. Thèse de
doctorat, Université de Paris VI, Paris, France, p. 342.
Domain F., (2000). Influence de la
pêche et de l'hydroclimat sur l'évolution dans le temps du stock
côtier (1985-1995). In : Domain F., Chavance P., Diallo A., (dirs.). La
pêche côtière en Guinée ressources et exploitation.
CNSHB IRD, Boussoura (Guinée), Paris (France), Chapitre 2-4, p.
117-133.
Domalain G., Jouffre D., Thiam D., Traoré S.
& Wang C.-L., (2002). Évolution de la diversité
spécifique et des dominances dans les campagnes de chalutage
démersal du Sénégal et de la Guinée. In Chavance
P., Ba M., Gascuel D., Vakily J. M., Paul D. (dirs.). Pêcheries
Maritimes, Ecosystèmes et Sociétés en Afrique de l'Ouest :
un siècle de changement. Bruxelles, collection des rapports de recherche
halieutique ACP-UE, vol. 1, n°15, p. 3744.
Ducklow H. W., Kirchman D. L. & Rowe G. T.,
(1982). Production and vertical flux of attached bacteria in the
Hudson River Plume of the New-York bight as studied with floating sediment
traps, Applied and Environmental Microbiology, vol. 43, n°4, p.
769-776.
Fall M. & Niass F., (2014). Analyse de
données de campagnes scientifiques relatives à la brotule
Brotula barbata et aux saint-pierre Zeus faber mauritanicus
et Zenopsis conchifer des côtes sénégalaises.
Journal of Applied Biosciences, vol. 83, p. 7506-7519, ISSN :
19975902.
Fall M., (2009). Pêcherie
démersale côtière au Sénégal. Essai de
modélisation de la dynamique de l'exploitation des stocks. Thèse
de doctorat en Ecologie fonctionnelle, Université Montpellier 2,
Montpellier, France, p. 233.
Fontana A., (2000). Les pêches
maritimes guinéennes : réalités et enjeux. In : Domain F.,
Chavance P. & Diallo A. (dirs.). La pêche côtière en
Guinée. Ressources et Exploitation. Editions IRD/CNSHB, Paris, p.
37-49.
Fontana A. (dir), (1981). Milieu marin et
ressources halieutiques de la République Populaire Du Congo. Edition
de l'Office de la Recherche Scientifique et Technique Outre-Mer,
Paris. Travaux et documents de l'ORSTOM, num°138, p. 339,
ISBN : 270990619.
Fossat J., Pelletier D., & Levrel H.,
(2009). Projet Système d'Information sur la Nature et les
Paysages, volet mer. Synthèse des indicateurs institutionnels de
biodiversité marine et
côtière. Rapport IFREMER pour le SINPmer, working
paper, version 0.2, p. 109.
Gascuel D., (2004). Cinquante ans
d'évolution des captures et biomasses dans l'Atlantique Centre-Est :
analyse par les spectres trophiques de captures et de biomasses. In : Chavance
P., Ba M., Gascuel D., Vakily M., Pauly D. (dirs). Pêcheries Maritimes,
Ecosystèmes et Sociétés en Afrique de l'Ouest : un
siècle de changement. Bruxelles, collection des rapports de recherche
halieutique ACP-UE, vol. 1, n°15, p. 6.
Gascuel D., Monteiro C., Yahya S., Brahim Kh., Ould
Bouzouma M. M. & Ould Vally Y., (2006). Estimation des captures
par espèce, pour les différentes flottilles opérant en
Mauritanie de 1991 à 2005. Groupe de travail de l'IMROP, Nouadhibou,
Mauritanie. IMROP éditions, n°5, p. 15.
Gaston K. J. & Spicer J. I., (2002).
Biodiversity An Introduction. Blackwell Science.
Guiral D., Albaret J.-J., Baran É., Bertrand
F., Debenay J.-P., Diouf P. S., Guillou J.-J., Le Loeuff P., Montoroi J.-P.
& Sow M., (1999). Les écosystèmes à mangrove.
In : Cormier M.-C. C. (dir.). Rivières du Sud. Sociétés et
mangroves ouest-africaines. Marseille, IRD Editions, « hors collection
», p. 63-130, p. 416, ISBN : 9782709914260, ISBN électronique
: 9782709917780, DOI : 10.4000/books.irdeditions.4974.
Hounsounou L. C., Sohou Z. & Akouehou G. S.,
(2013). Pêche à la senne de plage au Benin et
durabilité des ressources halieutiques. Journal de la Recherche
Scientifique de l'Université de Lomé, Togo, vol. 15, n°3, p.
1-13.
Huston M. A., (1994). Biological diversity.
The coexistence of species on changing landscapes. Cambridge University
Press, Cambridge.
38
Idder-Ighili H., (2014). Polycopié de
zoologie, 2ème année, les vertébrés.
Université Kasdi Merbah-Ouargla, faculté des sciences de la
nature et de la vie, département des sciences de la nature et de la vie
et département des sciences agronomiques. Année universitaire
2013-2014, p. 21.
Jaussaud E., (2011). Mise en place d'un suivi
amphibien à Vohibola, l'une des dernières forêts humides de
la côte Est de Madagascar. Thèse de mémoire en
Biodiversité, Écologie et Environnement. Université Joseph
Fourier, Grenoble, France, p. 46.
Johannes R. E., (1978). Reproductive
strategies of coastal marine fishes in the tropics, Environmental Biology
of Fishes, vol. 3, p. 65-84.
Jouffre D., Domalain G., Thiam D., Traore S.,
Caveriviere A., Domain F. & Inejih C. A., (2002).
Communautés démersales d'Afrique de l'Ouest 1987-1999 :
Changements de répartition et de composition spécifique,
observés par chalutages scientifiques. In : Chavance P., Ba M., Gascuel
D., Vakily J. M., Paul D. (dirs.). Pêcheries Maritimes,
Ecosystèmes et Sociétés en Afrique de l'Ouest : un
siècle de changement. Bruxelles, collection des rapports de recherche
halieutique ACP-UE, vol. 1, n°15, p. 303-322.
Kandé Y., (2017). Etude de la
variabilité spatiale de la pollution marine autour de la
presqu'île du Cap-Vert. Mémoire de fin d'études pour
l'obtention du diplôme de master 2 en Statistique et Informatique
Décisionnelle. Université Alioune Diop de Bambey, UFR SATIC,
département de mathématiques, p. 64.
Kurc G. & Blancheteau M., (1966). Etude
théorique et pratique de la pêche à la lumière.
Revue des Travaux de l'Institut des Pêches Maritimes, vol. 30,
n°4, p. 289-312.
Landeau R., (2008). Comparaison de la
diversité spécifique intra et inter-habitat et observation de la
distribution des taxons le long des gradients environnements significatifs :
Application des environs du Col de Lautaret (05). Licence STS, parcours
Initiation Milieux de Montagne L3, Université de Chambery, Chambery,
p.21.
Le Douguet L., (2009). Guide de
reconnaissance des engins et filets de pêche artisanale utilisés
dans les Aires Marines Protégées d'Afrique de l'ouest. Conception
: Olivier Plisson - 308 Production, Edition : 4ème trimestre 2009, p.
36, ISBN : 9782918445012.
Legendre L., (2012). La
désoxygénation de l'océan : situation actuelle et
prévisions. Institut océanographique, Fondation Albert Ier,
Prince de Monaco, p. 2.
Lenfant P., Neveu R., Miller A., Defranoux H., Bay G.,
Gabaud S., Auger T. & Jarraya M., (2011). Les débarquements
de la pêche artisanale : de Leucate à PortVendres (20082010).
Rapport CEFREM pour Agence des Aires Marines Protégées (1/3), p.
48.
Levrel H., (2006). Biodiversité et
développement durable : quels indicateurs ? Thèse de doctorat en
Recherches Comparatives sur le Développement spécialité
Economies et finances. Ecole des Hautes Etudes en Sciences Sociales (EHESS),
France, HAL ID : tel-00128430, p. 397.
Lopez J., (1979). Ecologie, biologie et
dynamique de Galeoides decadactylus du plateau continental
sénégambien. Thèse de doctorat, Université de
Bretagne Occidentale, Brest, France, p. 165.
Maigret J. & Ly B., (1986). Les poissons
de mer de Mauritanie. Science Nat., Compiègne, France, p.
213.
Mann, K. H. (1982). Ecology of coastal
waters: a systems approach. University of California Press, Vol. 8,
ISBN : 9780520047341, p. 312.
Miller J. M. & Dunn M. L., (1980).
Feeding strategies and patterns of movement in juvenile estuarine fishes. In :
Kennedy V. S. (dir), (1980). Estuarine perspectives, New-York, Academic
press, p. 437-448, p. 537.
Najih M., Berday N., Lamrini A., Nachite D., &
Zahri,, Y. (2015). Situation de la pêche aux petits
métiers après l'ouverture du nouveau chenal dans la lagune de
Nador. Revue Marocaine des Sciences Agronomiques et
Vétérinaires, vol. 3, n°1, p. 19-30.
39
Ndiaye B., Diouf O., Seck M., Sagna A. &
Sène T., (1982). Répertoire synonymique des principales
espèces de poissons débarquées par la pêche
artisanale sénégalaise. Document CRODT, n°108.
Nzayisenga T., (2007). Contribution à
l'étude du zooplancton du lac Kivu : cas du bassin Est au large de
Kibuye. Mémoire de master de science en biologie, Université
Nationale du Rwanda.
Pham D., (2011). Les capacités
osmorégulatrices chez la crevette bleue Litopenaeus
stylirostris, au cours de l'ontogenèse. Thèse de doctorat en
physiologie des crustacés. IRD Nouméa, Université de la
Polynésie Française, p. 131.
Quartey R. & Ekuban E., (2015). Projet
régional d'évaluation des stocks halieutiques. Rapport
scientifique de la campagne démersale dans la ZEE du Ghana (5 au 14
avril 2015). Fisheries Scientific Survey Division-Ghana/Union Économique
et Monétaire Ouest-Africaine (UEMOA), p. 24.
Ramade F., (2009). Éléments
d'Ecologie. Ecologie fondamentale. Masters-Ecoles d'ingénieurs : 4e
édition, Science Sup, Dunod, Paris, ISBN : 9782100530083.
Rossignol M., Aboussouan M.T., Crémoux J.-L.
(collab.), Meyrueis A.M. (collab.), (1965). Hydrologie marine
côtière de la presqu'île du Cap Vert : contribution à
l'étude de la productivité des eaux. Dakar,
Sénégal, ORSTOM, CRODT, p. 167.
Rousseau Y., (2010). Structure des
peuplements ichtyologiques des récifs coralliens de la Martinique en
relation avec la qualité de l'habitat. Prise en compte dans la
délimitation des zones de cantonnement, p. 24.
Saint-Felix C., (1979). Les fonds de
pêche sur la bordure caraïbe de la Martinique. Exploitation
actuelle, première prospection. Science et Pêche, p. 289,
1-12.
Schneider W., (1992). Fiches FAO
d'identification des espèces pour les besoins de la pêche. Guide
de terrain des ressources marines commerciales du golfe de Guinée.
Préparé et publié avec la collaboration du Bureau
régional de la FAO pour l'Afrique. Rome, FAO, p. 268.
Séne C., & Sané K., (2008).
Programme d'immersion des récifs artificiels pour une gestion
durable de la pêche au Sénégal. p. 40.
Seret B., (2011). Poissons de mer de l'Ouest
africain tropical. IRD Editions, Marseille, France, p. 452, ISBN :
9782709917025.
Sergent G., (2014). La biodiversité
marine, cette belle inconnue. Agence française pour la
biodiversité. 1 p.
Sidibé A., (2003). Les ressources
halieutiques démersales côtières de la Guinée :
exploitation, biologie et dynamique des principales espèces de la
communauté à Sciaenidés. Thèse de Doctorat
Halieutique, Ensa-Rennes, p. 320.
Sidibé A., (2010). Liste Rouge et
Gestion Ecosystémique des Pêches en Afrique de l'Ouest.
Utilisation de la Liste Rouge de l'UICN pour le suivi des risques de perte de
biodiversité : application aux poissons démersaux
exploités d'Afrique du Nord-Ouest. UICN, Programme marin et côtier
pour l'Afrique Centrale et Occidentale, p. 58.
Sonko A., (2017). Etude de la toxicité
globale des sédiments marins de la presquîle du Cap-Vert
(Sénégal). Mémoire de fin d'étude en
bio-toxicologie appliquée à l'environnement, à l'industrie
et à la santé. Laboratoire de toxicologie et hydrologie,
faculté de medecine, de pharmacie et d'odontologie. Université
Cheikh Anta Diop de Dakar, Sénégal, n°235, p. 42.
Sørensen T. A., (1948). A method of
establishing groups of equal amplitude in plant sociology based on similarity
of species content, and its application to analyses of the vegetation on Danish
commons. Kongelige Danske Videnskabernes Selskabs Biologiske Skrifter, vol. 5,
p. 1-34.
Spain. Vol. 1, p. 42.
Stéquert B., Brugge W. J., & Begerard P.
Freon P., Samba A., (1979). La Pêche artisanale maritime au
Sénégal. Etude des résultats de la pêche en 1976 et
1977: aspects biologiques et économiques. Centre de recherches
océanographiques de Dakar-Thiaroye, Institut Sénégalais de
Recherches Agricoles, n°73, p. 49.
40
Taï I., Masski H., Benchoucha S., Yahyaoui A.,
Chaghif A. & Bazairi H., (2013). Biodiversité.
Diversité et répartition des espèces démersales et
benthiques des fonds chalutables de la côte nord atlantique marocaine :
Cap Spartel (35°47'N) - Baie d'Agadir (30°26'N). In : Bulletin de la
Société Zoologique de France, vol. 138, n°1-4, p.
305-322.
Tamdrari H., (2007). Analyse de la
diversité biologique des poissons démersaux du nord du Golfe du
Saint-Laurent. Mémoire de maitrise en Océanographie.
Université du Québec à Rimouski, Québec, Canada, p.
72.
Tessier E., Chabanet P., Pothin K., Soria M. &
Lasserre G., (2005). Visual censuses of tropical fish aggregations on
artificial reefs: slate versus video recording techniques. Journal of
Marine Biologie Ecology, vol. 315, p. 17-30.
Thiam D., (2000). Trajectoire des indices
d'abondance des principales espèces démersales d'export du
Sénégal. In : Impacts socio-économique et environnemental
de la libéralisation du commerce : Etude nationale sur le secteur des
pêches sénégalaises. Document ENDA Tiers Monde, p. 24.
Thiam M., (1978). Ecologie et dynamique des
cynoglosses du plateau continental sénégambien. Thèse de
doctorat, Université de Bretagne Occidentale, Brest, p. 181.
Thiam Nd. & Sarré A., (2015).
Projet Régional d'Evaluation des Stocks Halieutiques. Rapport
scientifique de la campagne démersale dans la ZEE du
Sénégal. CRODT/ISRA/UEMOA, 58 p.
Thiao D., Chaboud C., Samba A., Laloë F. &
Cury P. M. (2012). Economic dimension of the collapse of the `false
cod' Epinephelus aeneus in a context of ineffective management of the
small-scale fisheries in Senegal, African Journal of Marine Science,
vol. 34, n°3, p. 305-311.
Thiao D., (2009). Un système
d'indicateurs de durabilité des pêcheries côtières
comme outil de gestion intégrée des ressources halieutiques
sénégalaises. Thèse de doctorat en Sciences Economiques
Spécialité Développement Soutenable Intégré.
Université de Versailles-St Quentin en Yvelines, Ecole doctorale SOFT,
Sète, France, p. 275.
Thiaw M. (2010). Dynamique des ressources
halieutiques à durée de vie courte : cas des stocks de poulpe et
de crevettes exploités au Sénégal. Thèse de
doctorat mention Halieutique, Agrocampus Ouest, Rennes, France, p. 228.
Thiaw M., Gascuel D., Jouffre D. & Thiaw O.T.,
(2009). A surplus production model including the effect of environment
: application to the white shrimps stocks in Senegal Progress in Oceanography,
vol. 83, p. 351-360.
Thiaw M., Gascuel D., Thiao D., Thiaw O.T. &
Jouffre D., (2011). Analysing environmental and fishing effects on a
short-lived species stock: the dynamics of the octopus Octopus vulgaris
population in Senegalese waters. African Journal of Marine Science
2011, vol. 33, n°2, p. 209-222.
Thurre D. & Kurth C., (2005-2006).
Poissons et Trésors Aquatiques. Dossier Pédagogique pour
les Enseignants (APED). Muséum Histoire Naturelle : département
des affaires culturelles.
Whittaker, R.H., 1960, Vegetation of the Siskiyou Mts., Oregon
and California, Ecological Monographs, 30: 279-338.
41
RAPPORTS
ACCT (dir.), (1976a). Vocabulaire de
l'Océanologie, Paris, Hachette, p. 431.
COFREPECHE, NFDS, POSEIDON & MRAG, (2013).
Évaluation prospective de l'opportunité d'un accord de
partenariat dans le secteur de la pêche entre l'Union Européenne
et la République du Sénégal. Contrat cadre MARE/2011/01 -
Lot 3, contrat spécifique 5, Bruxelles, Belgique, p. 115.
CRODT, (2005). Etude de base de la
pêche pour une gestion intégrée des ressources marines et
côtières : diagnostic du secteur de la pêche
sénégalaise. Rapport d'étude pour le Programme de Gestion
Intégrée des Ressources Marines et Côtières
(GIRMaC), p. 177.
FAO, (2004). Advisory Committee on Fisheries
Research. Report of the second session of the Working Party on Small-scale
Fisheries. Bangkok, Thailand, 18 - 21 November 2003. FAO Fisheries Report,
Rome, FAO, n°735, p. 21.
MAAP & MNHN, (2009). Indicateurs de
biodiversité en milieu agricole. Document de travail. Elaboration d'un
jeu d'indicateurs permettant de mieux suivre la biodiversité en lien
avec l'évolution de l'agriculture, p. 66.
MEPN, (2010). Quatrième Rapport
National sur la Mise en OEuvre de la Convention sur la Diversité
Biologique, p. 116.
Ministère des Pêches et des
Océans, (1984). Le monde sous-marin. Les poissons
pélagiques et diadromes de l'Atlantique. Direction
Générale des Communications, Ottawa, Ontario, KIA 0E6, p. 8, ISBN
: 0662926838.
WEBOGRAPHIES
Adams A., Guindon K., Horodysky A., MacDonald T.,
McBride R., Shenker J. & Ward R., (2012). Albula vulpes.
La Liste Rouge de l'UICN des espèces menacées en 2012.
Disponible sur <
http://dx.doi.org/10.2305/IUCN.UK.2012.RLTS.T194303A2310733.en
> (Consulté le 13 Mars 2017).
Anonyme, (2012). Annexe manuel
plancton-upwelling. Le mécanisme de l'upwelling. Disponible sur <
http://docs.eclm.fr/pdf_annexe/ManuelPlancton-Upwelling.pdf
> (Consulté le 23 février 2018).
Anonyme, (2014). Chapitre 2-1. Les
communautés démersales en Afrique de l'ouest. Institut national
supérieur des sciences agronomiques, agroalimentaires, horticoles et du
paysage (AGROCAMPUS Ouest), Rennes, France. Disponible sur <
http://halieutique.agrocampus-ouest.fr/publi/644/Chapitre2-1.pdf
> (Consulté le 23 février 2018)
Carpenter K. E., Camara, K., Djiman, R., Lindeman, K.,
Montiero, V., Nunoo, F., Quartey, R., Sagna, A., Sidibe, A., de Morais, L.
& Williams, A. B., (2015). Galeoides decadactylus. La
Liste Rouge de l'UICN des espèces menacées en 2015. Disponible
sur
<
http://dx.doi.org/10.2305/IUCN.UK.2015-4.RLTS.T21132319A42691739.en
>
(Consulté le 13 Mars 2017).
Collette B., Amorim A., Boustany A., Carpenter K.,
Dooley J., Fox W., Fredou F., Fritzsche R., Graves J., Hazin F., Herdson D.,
Juan Jorda MJ, Leite N., Lessa R., Matsuura K., Minte-Vera C., Nelson J.,
Nelson R., Oxenford H. & Travassos P., (2011). Sarda
sarda. Liste rouge de l'UICN des espèces menacées 2011.
Disponible sur <
http://dx.doi.org/10.2305/IUCN.UK.20112.RLTS.T155096A4703085.en
> (Consulté le 20 décembre 2017).
Diop S., Fabres J. & Pravettoni R.,
(2012). Gestion durable des services d'origines écosystémiques et
des ressources marines de la ZEE et du plateau continental en Afrique
42
de l'ouest : cas du Sénégal. Disponible sur <
http://www.esalifdiop.org/documents/Shelfsn.pdf
> (Consulté le 23 février 2018), p. 21. Froese R.
& Pauly D. (dir.), (2016). FishBase. World Wide Web electronic
publication.
www.fishbase.org, version
10/2016.
Ifremer, (2009). Grands
invertébrés et poissons observés par les campagnes
scientifiques. Bilan
2007. Ifremer, Nantes, EMH : 09-002, p. 103 <
http://www.ifremer.fr/docelec/doc/2009/rapport-6160.pdf
> (Consulté le 25 Mars 2017). Iwamoto T., (2015).
Merluccius senegalensis. Liste rouge des espèces
menacées de l'UICN
2015. Disponible sur <
http://dx.doi.org/10.2305/IUCN.UK.2015-
4.RLTS.T15522229A15603615.en
> (Consulté le 21 décembre 2017).
Munroe T., Brown J., Aiken K.A. & Grijalba Bendeck
L., (2015). Sardinella aurita. (Version errata publiée
en 2017) Liste rouge des espèces menacées de l'UICN 2015.
Disponible sur <
http://dx.doi.org/10.2305/IUCN.UK.20154.RLTS.T198581A15542908.en
> (Consulté le 19 décembre 2017).
Morey G., Serena F., Mancusi C., Coelho R., Seisay M.,
Litvinov F. & Dulvy N., (2007). Atelier UICN
Méditerranéen SSG, Saint - Marin, 2003. Squatina
oculata. La Liste Rouge de l'UICN des espèces menacées en
2007. Disponible sur <
http://dx.doi.org/10.2305/IUCN.UK.2007.RLTS.T61418A12477553.en
> (Consulté le 12 Mars 2017).
Morey G., Serena F., Mancusi C., Coelho R., Seisay M.,
Litvinov F. & Dulvy N., (2007). Squatina aculeata. La
Liste Rouge de l'UICN des espèces menacées en 2007. Disponible
sur <
http://dx.doi.org/10.2305/IUCN.UK.2007.RLTS.T61417A12477164.en
> (Consulté le 12 Mars 2017).
Nunoo F. & Nascimento J., (2015).
Pseudotolithus senegalensis. La Liste rouge de l'UICN des
espèces menacées 2015. Disponible sur <
http://dx.doi.org/10.2305/IUCN.UK.2015-4.RLTS.T49217798A49222499.en
> (Consulté le 13 Mars 2017).
Taquet M., (2007). 2.2. Les poissons
pélagiques et la pêche. Tour de la Bretagne en planche à
voile 2007. Fiche réalisée avec le soutien de la Lyonaise des
Eaux, SUEZ, Ifremer, Océanopolis, LPO, Aide et Action. Behem
Edition, p. 3. <
https://www.fichier-pdf.fr/2014/07/21/poissons-pelagique-et-la-peche/poissons-pelagique-et-la-peche.pdf
> (Consulté le 24 décembre 2017).
Thierry C., Sadovy Y., Fennessy S., Choat J. H.,
Ferreira B., Bertoncini A. A., Craig M. T. & Rocha L., (2008).
Epinephelus aeneus. Liste rouge de l'UICN des espèces
menacées
2008. Disponible sur <
http://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T132722A3432379.en
> (Consulté le 21 décembre 2017).
Tous P., Sidibé A., Mbye E., de Morais L.,
Camara K., Munroe T., Adeofe, T.A., Camara Y.H., Djiman R., Sagna A. &
Sylla M., (2015). Sardinella maderensis. Liste rouge des
espèces menacées de l'UICN 2015. Disponible sur
<
http://dx.doi.org/10.2305/IUCN.UK.20154.RLTS.T198582A15543624.en.
> (Consulté le19 décembre 2017).
UEMOA, (2015). Atlas UEMOA des campagnes
d'Evaluation- (c) 2015. Disponible sur <
http://atlas.statpeche-uemoa.org/atlas_presh/
> (Consulté le 22 février 2018).
UICN, (2016). Liste Rouge de l'UICN des
espèces menacées. Version 2016-3. Disponible sur <
Http://www.iucnredlist.org >
(Consulté le 13 Mars 2017).
UICN, (2017). Liste rouge de l'UICN des
espèces menacées. Version 2017-2. <
http://www.iucnredlist.org>
(Consulté le 14 septembre 2017)
UICN, (2017). Liste rouge de l'UICN des
espèces menacées. Version 2017-3. Disponible sur <
http://www.iucnredlist.org >
(Consulté le 22 décembre 2017).
VETOFISH, (2018). Zone côtière.
Définition. Disponible sur <
https://www.vetofish.com/definition/zone-cotiere
> (Consulté le 23 février 2013)
43
ANNEXES
Annexe 1 : programme d'enquête du
site de Hann

44
Annexe 2 : fiche d'enquête de la
pêche artisanale

45
Annexe 3 : positions nord, centre et sud
relatives au port de Hann dans la presqu'île du Cap-Vert

46
Annexe 4 : liste des espèces de
poissons dénombrés dans les campagnes scientifiques de
pêche
|
Acanthurus monroviae
|
Caranx rhonchus
|
Dasyatis centroura
|
|
Albula vulpes
|
Caranx senegallus
|
Dasyatis margarita
|
|
Alectis (Scyris) alexandrinus
|
Caranx spà
|
Dasyatis pastinaca
|
|
Aluterus blankerti
|
Carapus acus
|
Decapterus punctatus
|
|
Aluterus punctata
|
Carcharhinus brevipinna
|
Decapterus rhonchus
|
|
Aluterus schoepfii
|
Carcharinus signatus
|
Dentex angolensis
|
|
Aluterus sp
|
Carlarius (Arius) parkii (heudelotii/mercatorius)
|
Dentex canariensis
|
|
Antennarius delaisi
|
Centrophorus granulosus
|
Dentex congoensis
|
|
Antennarius occidentalis
|
Centrophorus uyato
|
Dentex gibbosus
|
|
Antennarius pardalis
|
Cephalopholis nigri
|
Dentex macrophthalmus
|
|
Antennarius senegalensis
|
Cephalopholis taeniops
|
Dentex sp
|
|
Antennarius sp
|
Cepola macrophthalma
|
Diastodon sp.
|
|
Anthias accraensis
|
Cepola pauciradiata
|
Dicentrarchus punctatus
|
|
Anthias anthias
|
Chaetodipterus goreensis
|
Dicologoglossa (Solea) hexophthalma
|
|
Anthias sp
|
Chaetodipterus lippei
|
Dicologoglossa cuneata
|
|
Antigonia capros
|
Chaetodon hoefleri
|
Dicologoglossa sp
|
|
Apogon imberbis
|
Chaetodon robustus
|
Diodon holocanthus
|
|
Apsilus fuscus
|
Chascanopsetta lugubris
|
Diodon hystrix
|
|
Argyrosomus regius
|
Chelidonichthys (Trigla) gabonensis
|
Diodon maculatus
|
|
Ariomma bondi
|
Chelidonichthys (Trigla) lastoviza
|
Diodon sp
|
|
Ariosoma balearicum
|
Chelidonichthys (Trigla) lucerna
|
Diodon speciosus
|
|
Arius latiscutatus (gigas)
|
Chelidoperca sp
|
Diplodus bellottii (senegalensis)
|
|
Arius sp
|
Chilomycterus reticulatus
|
Diplodus cervinus (cervinus)
|
|
Arnoglossus imperialis
|
Chilomycterus sp
|
Diplodus sargus
|
|
Aulopus cadenati
|
Chilomycterus spinosus mauretanicus (antennatus)
|
Diplodus vulgaris
|
|
Aulopus filamentosus
|
Chlorophthalmus (Parasudis) fraserbrunneri
|
Drepane africana
|
|
Balistes capriscus (carolinensis)
|
Chlorophthalmus atlanticus
|
Echelus myrus
|
|
Balistes punctatus (forcipatus)
|
Chloroscombrus chrysurus
|
Echeneis naucrates
|
|
Batracoides liberiensis
|
Chromis chromis
|
Eleotris senegalensis
|
|
Bauchotia (Chaetodon) marcellae
|
Chromis limbata
|
Elops lacerta
|
|
Bembrops heterurus
|
Chromis lineatus (cadenati)
|
Engraulis encrasicolus
|
|
Blennius normani
|
Citharichthys stampflii
|
Ephippion guttifer
|
|
Blennius oscellaris
|
Citharus linguatula
|
Epigonus denticulatus
|
|
Blennius sp
|
Citharus macrolepidotus
|
Epigonus sp
|
|
Bodianus (Diastodon) speciosus
|
Citharus sp
|
Epigonus telescopus
|
|
Bodianus iagonensis
|
Coelorhynchus coelorhychus
|
Epinephelus aeneus
|
|
Boops boops
|
Conger conger
|
Epinephelus alexandrinus
|
|
Bothus podas africana
|
Congridae
|
Epinephelus caninus
|
|
Brachydeuterus auritus
|
Coris julis
|
Epinephelus costae
|
|
Branchiostegus semifasciatus
|
Cynoglossus canariensis
|
Epinephelus fasciatus
|
|
Bregmaceros mcclellandi
|
Cynoglossus monodi
|
Epinephelus gigas
|
|
Brotula barbata
|
Cynoglossus senegalensis (goreensis)
|
Epinephelus goreensis
|
|
Capros aper
|
Cynoglossus sp
|
Epinephelus guaza
|
|
Caranx crysos
|
Cynoponticus ferox
|
Erythrocles monodi
|
|
Caranx hippos (carangus)
|
Dactylopterus (Cephalacanthus) volitans
|
Ethmalosa fimbriata
|
|
Eucinostomus (Gerres) melanopterus
|
Lophius sp
|
Ophichthus sp
|
|
Euthynnus alleteratus
|
Luciobrotula corethromycter
|
Ophidiidae
|
|
Fistularia petimba (villosa)
|
Lutjanus agennes
|
Ophidion barbatum
|
|
Fistularia tabacaria
|
Lutjanus dentatus
|
Ophisurus serpens
|
|
Gadella (ex Uraleptus) maraldi
|
Lutjanus fulgens
|
Oxynotus centrina
|
|
Gadella imberbis
|
Lutjanus goreensis
|
Oxynotus paradoxus
|
|
Gaidropsarus mediterraneus
|
Malacocephalus laevis
|
Oxynotus sp
|
|
Galeoides decadactylus
|
Malacocephalus occidentalis
|
Pagellus bellottii
|
|
Galeorhinus galeus
|
Malacocephalus sp
|
Paraconger notialis
|
|
Galeus polli
|
Manta birostris
|
Paragaleus pectoralis
|
|
Galeus sp
|
Merluccius sp (M. polli & M. senegalensis)
|
Parapristipoma octolineatum
|
|
Gephyroberyx darwinii
|
Microchirus variegatus
|
Pegusa (Solea) lascaris
|
|
Gobiidae indéterminés
|
Microchirus boscanion
|
Pegusa (Solea) triophthalma (triophthalmus)
|
|
Gobioides africanus
|
Microchirus frechkopi
|
Pegusa cadenati
|
|
Gobius angolensis
|
Microchirus hispidus
|
Pentanemus quinquarius
|
|
Gobius senegalensis
|
Microchirus ocellatus
|
Pentheroscion mbizi
|
|
Grammoplites gruvelli
|
Microchirus sp
|
Peristedion cataphractum
|
|
Gymnura altavela
|
Microchirus theophila
|
Perulibatrachus eliminensis
|
|
Gymnura poecilura
|
Microchirus variegatus
|
Perulibatrachus rossignoli
|
|
Halobatrachus didactylus
|
Microchirus wittei
|
Phycis phycis
|
|
Helicolenus dactylopterus
|
Miracorvina angolensis
|
Phyllogramma regani
|
|
Hemicaranx bicolor
|
Mobula rochbrunei
|
Physiculus huloti
|
|
Hippocampus sp (hippocampes)
|
Mobulidae
|
Pisodonophis semicinctus
|
|
Histrio histrio
|
Mola mola
|
Platycephalus gruveli
|
|
Holacanthus africanus
|
Monochirus hispidus
|
Plectorhynchus macrolepis
|
|
Hoplostethus cadenati
|
Monolene microstoma
|
Plectorhynchus mediterraneus
|
|
Hoplostethus mediterraneus
|
Monomitopus metriostoma
|
Polydactylus quadrifilis
|
47
|
Hyperoglyphe moselii
|
Monomotipus sp
|
Pomacanthus paru
|
|
Hypoclydonia bella
|
Mugil bananensis
|
Pomadasys incisus
|
|
Ilisha africana
|
Mugil cephalus
|
Pomadasys jubelini
|
|
Lagocephalus laevigatus
|
Mugil curema
|
Pomadasys peroteti
|
|
Lagocephalus lagocephalus
|
Mugil sp/Mugilidae
|
Pomadasys peroteti =(Pomadasys perotaei )
|
|
Lagocephalus sp
|
Muraena helena
|
Pomadasys rogeri
|
|
Lepidotrigla carolae
|
Muraena sp
|
Pomadasys sp
|
|
Lepidotrigla sp
|
Mustelus mustelus
|
Pomatomus saltatrix
|
|
Lethrinus atlanticus
|
Mycteroperca rubra
|
Pontinus accraensis
|
|
Lithognathus mormyrus
|
Myliobatidae
|
Pontinus kuhlii
|
|
Liza falcipinnis
|
Myliobatis aquila
|
Priacanthus arenatus
|
|
Liza grandisquamis
|
Mystriophis rostellatus
|
Psettodes belcheri
|
|
Liza ramada
|
Mystriophis spp
|
Psettodes bennetti
|
|
Liza sp
|
Naucrates ductor
|
Pseudotolithus (fonticulus) elongatus
|
|
Lobotes surinamensis
|
Nicholsina usta
|
Pseudotolithus brachygnathus
|
|
Lophiodes (*Lophius) kempi
|
Oblada melanura
|
Pseudotolithus senegalensis
|
|
Lophius (piscatorius) budegassa (vomerinus)
|
Ophichthidae
|
Pseudotolithus typus
|
|
Pteroscion peli
|
Ophichthus ophis
|
Pseudupeneus prayensis
|
|
Pterothrissus belloci
|
Seriola carpenteri
|
Synbranchus afer
|
|
Rachycentron canadum
|
Seriola sp
|
Synchiropus (Callionymus) phaeton
|
|
Raja doutrei
|
Serranus (Chelidoperca) africanus
|
Synchiropus phaeton
|
|
Raja miraletus
|
Serranus accraensis
|
Syngnathus (Enneacampus) kaupi
|
|
Raja montagui
|
Serranus cabrilla
|
Syngnathus acus(vipère de mer)
|
|
Raja sp.
|
Serranus scriba
|
Syngnathus pelagicus
|
|
Raja straeleni
|
Serranus sp
|
Syngnathus sp
|
|
Rajella (Raja) barnardi
|
Setarches guentheri
|
Synodus saurus
|
|
Remora remora
|
Smaris macrophthalmus (Spicara alta)
|
Synodus synodus
|
|
Requins divers indéterminés
|
Smaris macrophthalmus (Spicara melanurus)
|
Tetraodontidae
|
|
Rhinobatos atlanticus
|
Solea hexophthalma
|
Thalassoma pavo
|
|
Rhinobatos cemiculus
|
Solea senegalensis
|
Torpedo bauchotae
|
|
Rhinobatos rhinobatos
|
Solea sp
|
Torpedo fuscomaculata (marmorata)
|
|
Rhinobatos schoenlinii
|
Solea triophthalma
|
Torpedo nobiliana
|
|
Rhinoptera bonasus
|
Solea vulgaris
|
Torpedo torpedo
|
|
Rhinoptera marginata
|
Sparisoma novacula
|
Trachinocephalus myops
|
|
Rhizoprionodon acutus
|
Sparisoma radians
|
Trachinotus maxillosus
|
|
Rostroraja (Raja) alba
|
Sparisoma rubripinne
|
Trachinotus ovatus
|
|
Rypticus saponaceus
|
Sparisoma sp
|
Trachinotus teraia
|
|
Sarda sarda
|
Sparus (Pagrus) caeruleostictus
|
Trachinus arenatus
|
|
Sardina pilchardus
|
Sparus aurata
|
Trachinus armatus
|
|
Sardinella aurita
|
Sparus auriga/Pagrus auriga
|
Trachinus draco
|
|
Sardinella maderensis
|
Sparus pagrus/Pagrus pagrus/PPA
|
Trachinus maxillosus ou trachinotus?
|
|
Sargocentron (holocentrus) hastatum (us)
|
Sphoeroides pachygaster (cutaneus)
|
Trachinus pellegrini
|
|
Saurida brasiliensis
|
Sphoeroides spengleri
|
Trachinus radiatus
|
|
Saurida parri
|
Sphyarena guachancho (dubia)
|
Trachinus sp
|
|
Schedophilus pemarco
|
Sphyraena (piscatorium) afra
|
Trachurus trachurus
|
|
Scomber colias (japonicus)
|
Sphyraena barracuda
|
Trachurus trecae
|
|
Scomber japonicus
|
Sphyraena sp
|
Trachyrhinchus scabrus
|
|
Scomberomorus tritor
|
Sphyraena sphyraena
|
Trachyrinchus sp
|
|
Scorpaena angolensis
|
Sphyrna couardi
|
Triakidae
|
|
Scorpaena elongata
|
Sphyrna lewini
|
Trichiurus lepturus
|
|
Scorpaena laevis
|
Spondyliosoma cantharus
|
Trigla (Lepidotrigla) carolae
|
|
Scorpaena loppei
|
Squatina aculeata
|
Trigla sp
|
|
Scorpaena normani
|
Squatina oculata
|
Umbrina canariensis
|
|
Scorpaena scrofa
|
Squatina sp
|
Uranoscopus cadenati
|
|
Scorpaena sp
|
Stephanolepis hispidus
|
Uranoscopus polli
|
|
Scorpaena stephanica
|
Stromateus fiatola
|
Uranoscopus sp
|
|
Scyliorhinus canicula
|
Syacium micrurum
|
Uraspis secunda
|
|
Scyliorhinus sp
|
Symphurus nigrescens
|
Vanstraelenia chirophthalmus
|
|
Sebastes capensis
|
Synagrops microlepis
|
Xyrichtys novacula
|
|
Selar crumenophthalmus
|
Synagrops sp
|
Zanobatus schoenleinii
(atlanticus/atlantica/zanobatus)
|
|
Selene dorsalis
|
Synaptura (Dagetichthys) cadenati
|
Zanobatus sp
|
|
Synaptura lusitanica
|
Zenopsis conchifer
|
|
|
Synaptura sp
|
Zeus faber mauritanicus
|
48
Annexe 5 : liste des familles
rencontrées au Sénégal lors des campagnes scientifiques de
pêche
|
Familles
|
Nombre
d'espèces
|
Familles
|
Nombre
d'espèces
|
Familles
|
Nombre
d'espèces
|
|
Soleidae
|
25
|
Uranoscopidae
|
4
|
Rhinopteridae
|
2
|
|
Serranidae
|
21
|
Acropomatidae
|
3
|
Sphyrnidae
|
2
|
|
Carangidae
|
20
|
Ariidae
|
3
|
Zeidae
|
2
|
|
Sparidae
|
19
|
Blenniidae
|
3
|
Acanthuridae
|
1
|
|
Scorpaenidae
|
11
|
Carcharhinidae
|
3
|
Apogonidae
|
1
|
|
Haemulidae
|
10
|
Chaetodontidae
|
3
|
Ariommatidae
|
1
|
|
Sciaenidae
|
9
|
Dasyatidae
|
3
|
Branchiostegidae
|
1
|
|
Diodontidae
|
8
|
Epigonidae
|
3
|
Bregmacerotidae
|
1
|
|
Mugilidae
|
8
|
Lophiidae
|
3
|
Carapidae
|
1
|
|
Ophichthidae
|
8
|
Mobulidae
|
3
|
Dactylopteridae
|
1
|
|
Rajidae
|
7
|
Oxynotidae
|
3
|
Drepanidae
|
1
|
|
Rhinobatidae
|
7
|
Platycephalidae
|
3
|
Eleotridae
|
1
|
|
Tetraodontidae
|
7
|
Polynemidae
|
3
|
Elopidae
|
1
|
|
Trachinidae
|
7
|
Pomacentridae
|
3
|
Emmelichthyidae
|
1
|
|
Triglidae
|
7
|
Squatinidae
|
3
|
Engraulidae
|
1
|
|
Antennariidae
|
6
|
Trachichthyidae
|
3
|
Gerreidae
|
1
|
|
Labridae
|
6
|
Triakidae
|
3
|
Hemigaleidae
|
1
|
|
Macrouridae
|
6
|
Albulidae
|
2
|
Holocentridae
|
1
|
|
Ophidiidae
|
6
|
Aulopidae
|
2
|
Lethrinidae
|
1
|
|
Clupeidae
|
5
|
Balistidae
|
2
|
Lobotidae
|
1
|
|
Cynoglossidae
|
5
|
Caesionidae
|
2
|
Merlucciudae
|
1
|
|
Lutjanidae
|
5
|
Callionymidae
|
2
|
Molidae
|
1
|
|
Monacanthidae
|
5
|
Caproidae
|
2
|
Moronidae
|
1
|
|
Scaridae
|
5
|
Centrolophidae
|
2
|
Mullidae
|
1
|
|
Scombridae
|
5
|
Centrophoridae
|
2
|
Paralichthyidae
|
1
|
|
Sphyraenidae
|
5
|
Cepolidae
|
2
|
Percophidae
|
1
|
|
Syngnathidae
|
5
|
Chlorophthalmidae
|
2
|
Peristediidae
|
1
|
|
Synodontidae
|
5
|
Echeneidae
|
2
|
Phycidae
|
1
|
|
Batrachoididae
|
4
|
Ephippidae
|
2
|
Pomatomidae
|
1
|
|
Bothidae
|
4
|
Fistulariidae
|
2
|
Priacanthidae
|
1
|
|
Citharidae
|
4
|
Gymnuridae
|
2
|
Rachycentridae
|
1
|
|
Congridae
|
4
|
Muraenesocidae
|
2
|
Requins
|
1
|
|
Gobiidae
|
4
|
Muraenidae
|
2
|
Sebastidae
|
1
|
|
Moridae
|
4
|
Myliobatidae
|
2
|
Setarchidae
|
1
|
|
Scyliorhinidae
|
4
|
Pomacanthidae
|
2
|
Stromateidae
|
1
|
|
Torpedinidae
|
4
|
Psettodidae
|
2
|
Synbranchidae
|
1
|
|
Nombre total de taxons = 405
|
Trichiuridae
|
1
|
49
Annexe 6 : variations entre modalités
saisonnières et zonales
Les données sont hétérogènes (CV
> 15 %) avec, toutefois, une situation comparable entre la saison chaude (34
%) et la saison froide (33 %), une accentuation plus marquée au sud (37
%) et au centre (33 %), comparativement au nord (28 %). Les maximums (47
taxons) et les plus fortes moyennes sont notés en saison froide (20
taxons) et au centre (22 taxons).
Statistiques élémentaires de la richesse
spécifique selon la saison et la zone
|
Paramètres statistiques
|
Saison chaude
|
Saison froide
|
Centre
|
Nord
|
Sud
|
|
Minimum
|
2
|
1
|
1
|
1
|
2
|
|
Maximum
|
42
|
47
|
47
|
36
|
42
|
|
Médiane
|
19
|
20
|
22
|
19
|
18
|
|
Mode
|
19
|
22
|
17
|
19
|
15
|
|
Moyenne
|
19
|
20
|
22
|
20
|
19
|
|
Ecart-type
|
6,54
|
6,84
|
7,27
|
5,52
|
6,86
|
|
Coefficient de variation (CV)
|
34 %
|
33 %
|
33 %
|
28
|
37
|
Variations entre modalités des strates horaires et
bathymétriques
Sur la base du CV qui gravite autour de 32 - 35 %,
l'hétérogénéité est observée entre
toutes les strates horaires et bathymétriques sauf pour celle des 150 -
200 m dont le coefficient de variation est de 26 %. Les valeurs maximales et la
plus forte moyenne sont, respectivement, logées à la strate 6-10
h (47 taxons) et celle des 10-50 m (21 taxons)
Statistiques de la richesse spécifique/strates
horaires & bathymétriques
|
Paramètres statistiques
|
Strates horaires (4)
|
Strates bathymétriques (4)
|
|
6-10 h
|
10-13 h
|
13-16 h
|
16-20h
|
10-50 m
|
50-100 m
|
100-150 m
|
150-200 m
|
|
Minimum
|
6
|
2
|
2
|
1
|
2
|
2
|
1
|
6
|
|
Maximum
|
47
|
42
|
37
|
38
|
47
|
42
|
34
|
33
|
|
Médiane
|
21
|
19
|
18
|
18
|
20
|
19
|
19
|
20
|
|
Mode
|
19
|
19
|
17
|
15
|
15
|
15
|
19
|
17
|
|
Moyenne
|
21
|
20
|
19
|
19
|
21
|
19
|
19
|
19
|
|
Ecart-type
|
6,77
|
6,81
|
6,44
|
6,34
|
7,12
|
6,82
|
5,98
|
5,05
|
|
CV
|
32 %
|
35 %
|
34 %
|
34 %
|
34 %
|
35 %
|
32 %
|
26 %
|
50
Données sur la biodiversité ichtyologique
marine : cas de la baie de Hann et de la Zone Economique Exclusive
(ZEE) du Sénégal
JURY : Président : M. Cheikh Tidiane
BA, Professeur titulaire (FST-UCAD)
Membres : Mme Constance AGBOGBA, Maîtres de
Conférences (FST-UCAD) M. Patrice BREHMER, Chercheur, HDR (IRD-LEMAR)
M. Massal FALL, Chercheur, Chargé de Recherche
(ISRA-CRODT) M. Papa Ibnou NDIAYE, Maîtres de Conférences
(FST-UCAD)
Résumé
Pour la pêche artisanale,
la diversité en poissons débarqués au quai de pêche
Hann est évaluée à partir de données de 11 jours
d'enquêtes durant le mois de mai 2017. Au bilan, 113 taxons de poissons
répartis en 51 familles. Cette biodiversité est plus
élevée à la position nord (101) par rapport au sud (63) et
au centre (40). Elle diminue du matin au soir et de la côte au large
quand on passe de la tranche des 03-50 m (97 taxons) à celle des 200-600
m (32 taxons). Le nombre d'espèces est plus élevé dans les
FDF et les Trémails (58 taxons chacun). Elle est faible dans les EP, les
LCS et les LPG (01 à 02 espèces). Hormis Sardinella aurita
qui est une espèce occasionnelle et les 50 taxons restants sont
plutôt rares. Les indices de Jaccard affichent 22,53 % entre le centre et
le nord, 26,13 % entre le nord et le sud, 20,77 % entre le centre et le sud. Il
en est de même pour celui de Sorensen : 0.58, 0.71 et 0.52,
respectivement. L'indice de Whittaker est égal à 0.66 et
révèle qu'il y a 10 espèces spécifiques au sud, 02
au centre et 37 au nord. Pour l'ILR, 04 espèces sont en danger, 06
vulnérables et 04 quasi-menacées.
Pour la pêche
scientifique, la diversité en poissons des
côtes sénégalaises est évaluée à
partir de données de 22 campagnes de saison froide et chaude de 2001
à 2015 en zones nord, centre et sud, à bord du N/O Itaf
Dème, ciblant les démersaux côtiers. Au bilan, 405 taxons
de poissons répartis en 109 familles. Cette biodiversité augmente
du nord (267 taxons) au sud (316) en passant par le centre (296). Plus
importante en saison chaude (340) qu'en saison froide (316), elle diminue,
aussi, du matin au soir et de la côte au large avec un facteur
multiplicatif de 2.5 quand on passe de la tranche des 10-50 m (345 taxons)
à celle des 150-200 m (138 taxons). La richesse spécifique varie
de 1 à 47 taxons avec un CV de 34 %, un mode, une moyenne et une
médiane 19-20. Hormis Chelidonichthys gabonensis qui est un
taxon fréquent et 15 taxons occasionnels (e.g. pageot), les 389 taxons
restants sont plutôt rares. Les indices de Jaccard affichent 27.35 %
entre le centre et le nord, 27.43 % entre le nord et le sud, 27.95 % entre le
centre et le sud. Il en est de même pour celui de Sorensen : 0.753, 0.756
et 0.775, respectivement. L'indice de Whittaker est égal à 0.85
et révèle qu'il y a 53 espèces spécifiques au sud,
42 au centre et 34 au nord. Pour l'ILR, 2 taxons sont en danger critique
d'extinction, 7 en danger, 13 vulnérables et 14 quasi-menacés.
Mots-clés :
biodiversité, UICN, indicateurs, démersaux, campagnes,
pêche artisanale, Hann, engins de pêche
Data on marine ichthyological biodiversity: the case of
Hann Bay and the Exclusive Economic Zone (EEZ) of
Senegal
Abstract
For artisanal fisheries, the
diversity of fish brought at Hann fishing pier has been estimated from data
after 11 days of surveys, during the month of May 2017. In the end, 113 fish
taxa divided into 51 families. This biodiversity is higher in the north (101)
compared to the south (63) and the center (40). It decreases from morning to
evening and depends on the offshore coast when we pass from the range of 03-50
m (97 taxa) to 200-600 m (32 taxa). The number of species is higher in FDF and
Trammel (58 taxa each). It is low in EP, LCS and LPG (01 to 02 species). Apart
from the Sardinella aurita which are occasional species and the
remaining 50 taxa are rather rare. The Jaccard indexes show 22.53% between the
center and the north, 26.13% between the north and the south, 20.77% between
the center and the south. The Sorensen's results are: 0.58, 0.71 and 0.52,
respectively. The Whittaker index is 0.66 and reveals that there are 10 species
in the south, 02 in the center and 37 in the north. For the ILR, 04 species are
in danger, 06 vulnerable and 04 near-threatened.
For scientific fisheries, the fish
diversity of the Senegalese coasts has been evaluated using data from 22 cold
and hot season campaigns, from 2001 to 2015, in the northern, central and
southern parts, on board of the oceanograohic ship Itaf Dème, targeting
coastal demersal. In the end, 405 fish taxa divided into 109 families. This
biodiversity increases from the north (267 taxa) to the south (316) through the
center (296). More important in the hot season (340) than in the cold season
(316), it also decreases from morning to evening and depends also on the
offshore coast with a multiplicative factor of 2.5 when we go from the 10-50 m
section (345 taxa) to that of 150-200 m (138 taxa). Species richness got a
range going from 1 to 47 taxa with a CV of 34%, mode, mean and median 19-20.
Apart from Chelidonichthys gabonensis which is a frequent taxon and 15
occasional taxa (e.g. pandora), the remaining 389 taxa are rather rare. The
Jaccard indices show 27.35% between the center and the north, 27.43% between
the north and the south, 27.95% between the center and the south. It is the
same according to the Sorensen ones: 0.753, 0.756 and 0.775, respectively. The
Whittaker index is 0.85 and reveals that there are 53 species in the south, 42
in the center and 34 in the north. For the ILR, 2 taxa are critically in
danger, 7 in danger, 13 vulnerable and 14 near-threatened.
Keywords: biodiversity, IUCN,
indicators, demersal, surveys, artisanal fisheries, Hann, fishing gear
51
52
| 


