|
Je dédie ce travail à mon feu père
MOYOU Siméon et ma maman KENMOE Lucienne, puissiez trouver ici le fruit
des multiples efforts consentis à mon éducation.
Remerciements
Je remercie en premier lieu le Seigneur Tout Puissant qui nous
accorde sa grâce et nous donne le souffle d'avancer jour après
jour. Je tiens également à exprimer mes sincères
remerciements à toutes les personnes qui ont contribuées à
la réalisation de ce travail. Je pense ainsi :
- au Dr. DOSSOU-YOVO Pierre, mon superviseur qui,
malgré ses multiples occupations n'a ménagé aucun effort
pour l'avancée et la réussite de ce travail ;
- à Monsieur BOKO Adrien (Directeur de l'INRAB) qui a
bien voulu nous permettre d'effectuer nos travaux dans son laboratoire. Je
remercie également le personnel de l'INRAB pour la
collaboration ;
- à M. COMMETE Augustin et ses collègues de la
direction de la pêche pour la coopération ;
- aux Pr. TOUKOUROU Fatiou, Dr. BOKOSSA YAOU Innocent, au
corps professoral de l'UAC en général et de la Maîtrise
Professionnelle de Biotechnologie dans les Industries Agroalimentaires (IAA) en
particulier pour l'encadrement reçu durant la formation ;
- à Seydou Ra-Sablga OUEDRAOGO pour ses conseils
judicieux, son appui, sa sollicitude et sa patience à mon
égard ;
- aux familles FEUZEU, KEMEGNE, TCHOUANBOU et TCHOUANKEM pour
leur soutien et les sacrifices faits ;
- à M. DOSSOU-AHOUE Joël pour les conseils, le
soutien et l'accueil au Bénin ;
- à mes soeurs et frères : Carine L.
Wouleheu, Hélène S. Fepesie, Collins J. Meutcheyeu, J.R
Tchimtchoua ;
- aux amis Théodor Enoné, Bienvenu Fogang,
Jackson Muganura, Dénis Houngnimon, Hermine Nguimfack, Alix Gnonlonfoun,
Moufidath El Hadj Razak et Mme Lokossou Céline pour leur
disponibilité et leur bienveillance.
Enfin à tous ceux dont le nom n'a pas été
cité et dont le soutien physique ou moral m'a été d'un
grand secours.
Table des
matières
Remerciements
ii
Table des matières
iii
Liste des tableaux et figures
vi
Liste des sigles et abréviations
vii
RESUME
viii
ABSTRACT
ix
INTRODUCTION
1
PREMIÈRE PARTIE
REVUE DE LA LITTÉRATURE
4
1. TECHNIQUES DE CONSERVATION
4
1.1. STABILISATION BIOLOGIQUE
5
1.1.1. Destruction des agents biologiques
5
1.1.2. Inhibition des agents biologiques
7
1.1.2.1- Inhibition par diminution de l'activité de
l'eau
7
1.1.2.2- Inhibition chimique
8
1.1.3. Séparations
9
1.2. STABILISATION PHYSICO-CHIMIQUE
9
2. GÉNÉRALITÉS SUR LE POISSON
10
2.1. BIOCHIMIE DU MUSCLE DU POISSON
10
2.1.1. Composition du muscle
10
2.1.2. Evolution post mortum du muscle
12
2.2. MICROBIOLOGIE DU MUSCLE
15
3. LE SALAGE DU POISSON
15
3.1. LE SEL
15
3.1.1. Origine du sel
16
3.1.2. Composition du sel
17
3.1.3. Fonction du sel dans les IAA
18
3.1.4. Propriété physico-chimique du sel
19
3.3.4.1- La solubilité du Chlorure de sodium
19
3.3.4.2- La conductibilité électrique
20
3.2. TECHNOLOGIE DE SALAGE
21
3.3. PARAMÈTRES INFLUENÇANT LE SALAGE
21
3.3.1. Influence de l'état de fraîcheur du poisson
21
3.3.2. Influence de la grosseur et du taux en matière
grasse du poisson
24
3.3.3. Influence de la préparation préliminaire
24
3.3.4. Influence de la grosseur du sel
24
3.3.5. Influence de la température
25
3.3.6. Influence de la méthode de salage
25
DEUXIEME PARTIE
MATERIELS ET METHODES
26
1. MATÉRIELS
26
1.1. LE POISSON
26
1.2 LE SEL
27
2. MÉTHODES
27
2.1. PRÉPARATION DES FILETS SALÉS
27
2.2. MESURE DE LA CONDUCTIVITÉ
29
2.3. MESURE DU PH
30
2.4. DÉTERMINATION DE LA TENEUR EN EAU
31
2.5. DÉTERMINATION DES CENDRES TOTALES
32
2.6. DETERMINATION DU TAUX DE PROTÉINE TOTALE
33
TROISIEME PARTIE
RESULTATS ET DISCUSSION
35
1. EVOLUTION DE LA CONDUCTIVITÉ ET DU PH
35
1.1. LA CONDUCTIVITÉ
35
1.2. LE PH
38
2. ETUDE COMPARATIVE DE L'ÉVOLUTION DE LA
CONDUCTIVITÉ DANS DEUX DIFFÉRENTS LOTS DE POISSON
40
3. LA TENEUR EN EAU
42
4. LES CENDRES TOTALES
44
5. LE TAUX DE PROTÉINES
45
CONCLUSION ET PERSPECTIVES
49
PROBLEMES RENCONTRES ET SUGGESTIONS
51
REFERENCES BIBLIOGRAPHIQUES
52
ANNEXES
55
Liste des tableaux et
figures
Liste des tableaux
Tableau 1 : Importance du pH pour la
conservation des aliments
8
Tableau 2 : Composition comparée de la
chair du poisson et du muscle squelettique de mammifère
12
Tableau 3 : Grille d'évaluation
organoleptique de l'état de fraîcheur des poissons entiers
23
Tableau 4 : Teneur en eau dans les filets
frais et salés de Pseudotolithus senegalensis près 20
heures de salage
43
Tableau 5 : Cendres totales dans les filets
frais et salés de Pseudotolithus senegalensis
44
Tableau 6 : Conductivités
spécifiques des solutions de KCl
55
Liste des figures
Figure 1 : Stratégies de stabilisation
biologique des aliments.
5
Figure 2 : Structure matricielle des
aliments
9
Figure 3 : Evolution du muscle poisson
après la mort.
14
Figure 4 : La structure d'un cristal de
chlorure de sodium.
19
Figure 5 : Comportement du sel dans l'eau
20
Figure 6 : Pseudotolithus
senegalensis
26
Figure 7 : Photo du sel utilisé
27
Figure 8 : Etapes de filetage manuel de
Pseudotolithus senegalensis
28
Figure 9 : Evolution de la conductivité
dans les solutions de hachis de Pseudotolithus senegalensis
salé à différents pourcentages et à
20#177;2°C (1er lot)
35
Figure 10 : Evolution du pH dans les solutions
de hachis de Pseudotolithus senegalensis salé à
différents pourcentages et à 20#177;2°C (1er
lot)
38
Figure 11 : Evolution comparative de la
conductivité de 2 lots à 10% à 20#177;2°C
40
Figure 12 : Evolution comparative de la
conductivité de 2 lots à 15% à 20#177;2°C
41
Figure 13 : Evolution comparative de la
conductivité de 2 lots à 20% à 20#177;2°C
41
Figure 14 : taux de
protéines dans le Pseudotolithus senegalensis frais et
salé à pourcentages différents
46
Liste des sigles et abréviations
ADN : Acide Désoxyribonucléique
aw : Water Activity
Cm : Centimètre
CRE : Capacité de Rétention d'Eau
CT : Cendres Totales
CuSO4 : Sulfate de cuivre
DDE : Direction Départementale de l'Equipement
DLUO : Date Limite d'Utilisation Optimale
FSA : Faculté des sciences Agronomiques
GHB : Good Hygiene Practice
H2SO4 : Acide sulfurique
IAA : Industries Agroalimentaires
INRA : Institut National de la Recherche Agronomique
INRAB : Institut National des Recherches Agricoles du
Bénin
MAT : Matière Azotée Totale
KCl : Chlorure de potassium
mL : millilitre
min : minute
mS : milli Siemens
NaCl : Chlorure de Sodium
NaOH : Hydroxyde de Sodium (soude)
(NH4)2SO4 : Sulfate
d'ammonium
pH : Potentiel Hydrogène
UAC : Université d'Abomey-Calavi
UHT : Ultra Haute Température
TE : Teneur en Eau
RESUME
L'objet de cette étude est d'apporter une approche
explicative du pouvoir de conservation du sel sur le Pseudotolithus
senegalensis frais et salé puis entreposé sous climatisation
à 20#177;2°C par des paramètres physico-chimiques. L'effet
du sel à 10, 15 et 20% dans les filets du poisson a été
étudié pour une série de lot par le suivi de la
conductivité et du pH pendant une période de conservation de 4
jours. Ont également été déterminées
d'autres grandeurs dont la teneur en eau (20 heures après l'application
du sel) et certains constituants chimiques (cendres totales et protéines
totales). Des résultats obtenus, il ressort qu'il peut être
établi un lien étroit entre l'évolution de la
conductivité et la forme (ionique ou métallique) du sel dans le
milieu et/ou les phénomènes d'interaction qui se produisent entre
le sel et certains constituants intrinsèques des filets. Il en ressort
que le sel, en plus de sa facilité à utiliser l'eau disponible
dans la chair du poisson pour s'ioniser en Na+ et Cl-, a
la capacité de créer une force ionique qui provoque la
déshydratation des protéines. Ceci permet de limiter les
altérations dues aux modifications biochimiques. Cela se traduit d'une
part, par la diminution de la teneur en eau dans les filets de 9,37 ; 11,40 et 16,43%, et
d'autre part, par la concentration élevée des matières
azotées dans filets salés par rapport à la matière
sèche première de 53,21 ; 52,06 et 46,13% pour des
concentrations respectives en sel de 10, 15 et 20%.
Mots clés :
conservation ; Pseudotolithus senegalensis ;
conductivité ; interaction ; altération
ABSTRACT
The main purpose of this study is to bring out an explanatory
approach of physico-chemical preservation by salt on fresh salted
Pseudotolithus senegalensis stored in an air-conditioned room at
20#177;2°C. Effect of salt at 10, 15 and 20 degrees in flesh was studied
for a series of package by following up the conductivity and pH during 4 days
of conservation. Other measures whose moisture content (20 hours after salting)
and others chemical constituents of flesh (total ashes and proteins) were also
determined. From results obtained, it comes out that a straight relationship
can be established between conductivity's evolution and salt form (ionic or
crystal) in a specific context and/or the phenomena of interaction which occurs
between salt and some intrinsic constituents of flesh. This reveals that salt,
in addition to have the facility to use available water in the fish to ionise
into Na+ and Cl-, it has also the capacity to create an
ionic power which causes the proteins dehydration. These results permit to
reduce spoilages due to biochemical modifications. That is expressing in on one
hand, by the decrease of the moisture content in flesh of 9.37, 11.40 and 16.43
%, and on the other hand, by the concentration of salted fish in nitrogenous
substances compare to the dried raw materials of 53.21, 52.06 and 46.13 % for
salt concentrations respectively of 10, 15 and 20 %.
Keywords : preservation ;
Pseudotolithus senegalensis ; conductivity ; interaction ;
spoilage
INTRODUCTION
Les problèmes de conservation ont été et
demeurent une question d'actualité de part le monde. L'Homme s'est
toujours trouvé confronté au problème de conservation des
denrées pendant les saisons de grandes productions pour assurer sa
survie en périodes de pénurie. C'est ainsi qu'il a
élaboré des méthodes pour augmenter la durée de
conservation des aliments. Les premières furent le séchage au
soleil, le salage et le fumage.
Bien plus tard, à ce savoir-faire ancestral, se sont
ajoutées des techniques plus modernes s'appuyant presque toujours sur
les mêmes principes fondamentaux : destruction des microorganismes,
arrêt ou ralentissement de la prolifération bactérienne,
des activités enzymatiques, des réactions d'oxydation et de
radicalisation. Ceci étant fait soit en agissant directement sur ces
agents soit en modifiant les paramètres limitant leur croissance.
Cependant, malgré l'essor remarquable dont ont
été marquées les sciences alimentaires en matière
de conservation au début du 19ème siècle, dans
plusieurs pays africains, les méthodes rudimentaires de conservation
persistent. Le salage, le séchage et le fumage constituent encore les
moyens les plus répandus de conservation dans les villages mais aussi
dans certaines villes. On explique cela par la cherté des technologies
nouvelles, surtout celles qui utilisent le froid, et par la non maîtrise
de ces technologies par les populations impliquées dans la
transformation.
Le poisson, principale source de protéines d'origine
animale pour les populations africaines, se trouvent souvent soumis à
ces technologies de traitement avant sa consommation. Les techniques de
conservation ont été revues et améliorées plusieurs
fois pendant l'histoire de l'humanité et sont encore largement
utilisées (FAO, 1999). Depuis des temps très anciens, le
séchage, le salage et le fumage étaient utilisés pour
conserver le poisson dans différentes cultures. Pour certains auteurs
comme Sainclivier (1985) et Linden et Lorient (1994), le produit (poisson)
salé est tantôt un produit fini, tantôt une matière
première destinée à un traitement
complémentaire : séchage, fumage, semi-conserve. En effet,
dans certains pays ouest africains à l'instar du Bénin ou du
Sénégal, certains traitements artisanaux ont pris une place
importante dans l'industrie du poisson et par là dans l'économie
du pays. Il s'agit notamment du lanhouin1(*), du métora2(*), du ketiakh3(*), du tambadiang4(*) et du sali5(*). A ce même titre, en
Afrique centrale, le makayabu6(*) au Congo constitue le produit dominant de poisson
transformé sur le marché national.
En examinant toutes ces technologies de près, on note
un apport de sel à une étape de toutes les préparations.
Ce qui mérite d'accorder à cet aliment (sel) un accent
particulier. Plusieurs auteurs se sont d'ailleurs appesantis sur l'action du
sel sur le poisson. Les travaux de Dossou-Yovo (2002) révèlent un
apport plus important de sel par les productrices de lanhouin lorsque
la matière première est déjà entrée en phase
initiale d'autolyse dans l'intention de la stopper très rapidement soit
à tort de la corriger. D'autres chercheurs (Grau, 1961 ; Cutting,
1962 ; Voskresensky, 1965 ; Del Valle et Nickerson, 1967) ont
étudié l'aspect physico-chimique du sel sur le poisson.
D'après Mackie et al. (1971), le processus peut être
décrit d'une manière sommaire comme comportant une série
de mécanismes consécutifs et parfois simultanés. La
question qui se pose immédiatement, est celle de savoir ce qui est
à la base réelle de ces mécanismes et comment on peut les
expliquer ? C'est dans cette optique que nous nous avons choisi
l'étude de l'Approche physico-chimique du pouvoir conservateur
du sel : cas du salage de Pseudotolithus senegalensis.
Cette étude se propose d'être une nouvelle approche aux diverses
interprétations qui ont déjà été
émises à ce sujet. Il s'agira d'expliquer le mécanisme de
conservation du poisson par le sel sur la base du suivi de l'évolution
de certains paramètres physico-chimiques particulièrement la
conductivité électrique et le pH.
L'objectif général que nous fixons dans la
démarche à suivre est de montrer que c'est la dissociation du
NaCl en Na+ et Cl- et la mobilité de ces ions qui
sont à la base du pouvoir conservateur du sel.
Les objectifs spécifiques qui en découlent sont
de montrer que :
- Le sel (NaCl) utilise l'eau disponible du poisson pour
s'ioniser et que les ions ainsi formés sont à la base de la
conservation ;
- La mobilité des ions et la force ionique qui se
crée provoquent l'élimination d'une partie de l'eau liée
aux constituants de la chair du poisson;
- L'effet est plus prononcé selon la concentration en
sel utilisée.
REVUE DE LA
LITTÉRATURE
1. TECHNIQUES DE
CONSERVATION
Pour maintenir son équilibre psychique, physique et
pour assurer le bon fonctionnement de ses organes, l'homme doit s'alimenter
convenablement (repas sain et équilibré). La nature offre une
grande diversité de produits d'origines animale et
végétale qui se détériorent très vite
lorsqu'ils cessent d'appartenir aux organismes vivants. D'après Jeantet
et al. (2006), la complexité et
l'hétérogénéité du système
formé par l'aliment seraient la base de sa grande instabilité aux
plans thermodynamique, biologique et chimique. Aussi pour assurer sa survie en
période de disette, l'homme a tout le temps recherché des
méthodes de conservation des denrées alimentaires. Nout et
al. (2003) affirment précisément que le début du
développement de la science alimentaire fut stimulé par la
nécessité de conserver les aliments. L'altération de la
qualité organoleptique, hygiénique et nutritionnelle de ceux-ci
(provoquée par les réactions chimiques, les réactions de
lipolyse, de protéolyse et d'oxydation, la production de
métabolite et le développement des enzymes et microorganismes au
sein du produit) peut être freinée ou stoppée par certaines
méthodes dites de conservation. Il a été observé
dans un premier temps que certaines évolutions naturelles conduisaient
à l'obtention de produits plus stables et d'intérêt
gustatif (Jeantet et al., 2006). Depuis lors, d'autres technologies de
conservation se sont développées et sont aujourd'hui
appliquées dans les Industries Agroalimentaires (IAA) pour la
conservation des denrées alimentaires. D'une manière globale, on
parle de traitement de stabilisation scindé en deux groupes
distincts : stabilisation biologique et stabilisation physico chimique.
1.1. Stabilisation
biologique
Les stratégies mises en oeuvre pour garantir la
stabilité biologique des aliments sont présentées dans la
figure ci-après :
STABILISATION BIOLOGIQUE
INHIBITION
SEPARATION
DESTRUCTION
Conditions physicochimiques
Diminution de l'aw
Elimination de l'eau
Fixation de l'eau
Acidification et fermentation
Molécules à action
bactériostatique
Réfrigération
Filtration
Déshydratation
Evaporation
Molécules hydrophiles
Cristallisation (congélation)
Hautes pressions
Ionisation
Traitement thermique
Microfiltration
Décantation centrifuge

Figure 1 :
Stratégies de stabilisation biologique des aliments.
Source : (Jeantet et al., 2006)
1.1.1. Destruction des agents
biologiques
On regroupe dans cette stratégie de stabilisation
biologique, les traitements thermiques (pasteurisation, stérilisation),
l'ionisation et les hautes pressions.
La destruction des agents biologiques par les traitements
thermiques qui apportent l'énergie nécessaire à la
dénaturation des macromolécules (protéines, ADN) a
été initiée par Appert7(*) et Pasteur8(*) (Jeantet et al., 2006). Le traitement
thermique est aujourd'hui considéré comme la plus importante
technique de conservation de longue durée. Par l'action de la chaleur,
les enzymes sont inactivées et les microorganismes sont totalement ou
partiellement détruits. Cependant, si la qualité sanitaire est
assurée par un traitement thermique intense, la qualité
nutritionnelle et organoleptique est réduite. L'application des
températures extrêmes peut causer la rupture des liaisons
hydrogènes et donc la perte de la structure secondaire des
protéines (Hennen, 1998) ou provoquer la dénaturation des
macromolécules impliquées dans la texture de l'aliment et les
constituants d'intérêts biologiques (vitamines) (Jeantet et
al., 2006). De nos jours, les traitements couplés
(procédés physiques de conservation ou de transformation plus
traitement thermique modéré) sont de plus en plus employés
pour préserver la qualité sensorielle et nutritionnelle, tout en
assurant la qualité hygiénique. Nous avons par exemple le cas du
lait stabilisé par ultrafiltration tangentielle, seule ou couplée
au traitement thermique.
Outre les traitements thermiques, d'autres traitements peuvent
être également envisagés pour la conservation de longue
durée par destruction des agents biologiques. Il s'agit de l'ionisation,
des hautes pressions et des champs électriques pulsés.
L'ionisation a pour objectif de détruire les micro-organismes
pathogènes ou responsables de l'altération des aliments sans
compromettre la sécurité ni les qualités nutritionnelles
et organoleptiques des produits. Cette amélioration de la qualité
microbiologique constitue donc une réponse supplémentaire aux
exigences sanitaires, et s'inscrit dans le concept de l'assurance
qualité. Mais malgré qu'ils se soient développés
depuis plus d'une trentaine d'années ces traitements athermiques sont
limités dans leur application pour plusieurs raisons.
1.1.2. Inhibition des agents
biologiques
La stabilisation par inhibition se divise en inhibition
chimique et inhibition par abaissement de la teneur en eau, soit par diminution
de l'activité de l'eau.
1.1.2.1- Inhibition par
diminution de l'activité de l'eau
L'eau représente le constituant le plus abondant de la
plupart des aliments à l'état naturel exceptées les
graines (Jeantet et al., 2006). Dans l'aliment, on la retrouve sous
forme d'eau libre ou d'eau liée et, selon son état de liaison,
elle présente des propriétés physico-chimiques
différentes. D'après Jeantet et al. (2006), diverses
observations auraient montré que l'eau dite
« liée » peut elle-même être liée
plus ou moins fortement et que l'état de l'eau a d'autant d'importance
pour la stabilité d'un aliment que la teneur totale en eau. L'eau
disponible ou eau libre (symbolisée en science alimentaire par
l'activité de l'eau) joue un rôle déterminant dans la
conservation des aliments. Elle a un double rôle : celui de solvant
et de réactif. En effet, en abaissant cette eau, on améliore la
stabilisation du produit et les réactions d'hydrolyse.
L'activité de l'eau (notée
aw) peut être abaissée en éliminant l'eau libre
par évaporation et séchage, par cristallisation de l'eau solvante
(congélation) ou par apport de solutés très hydrophiles
qui fixent les molécules d'eau par interactions hydrogènes ou
dipolaires (salage, sucrage) (Jeantet et al., 2006). La
déshydratation des produits alimentaires permet d'en assurer une bonne
stabilité par abaissement de l'activité de l'eau et permet de
réduire les coûts de transport et stockage (Bimbenet et Loncin,
1995). En se dissolvant dans l'eau contenue dans les aliments, le sel diminue
l'eau disponible et stoppe ainsi la croissance des microorganismes.
Par rapport aux traitements thermiques, la conservation par
inhibition en abaissant l'eau disponible a l'avantage de moins altérer
la qualité nutritionnelle et organoleptique. De plus l'inhibition
générée par abaissement d'aw peut être
levée par réhydratation, décongélation et
dilution.
1.1.2.2- Inhibition
chimique
Le pH (potentiel hydrogène) de l'aliment est
également une des grandeurs qui influence le comportement des
microorganismes. A des pH en dessous de 4.5, l'activité et la survie
d'une grande flore microbienne sont très réduites. Entre 4.5 et
6.0, seuls les acidotolérants résistent. Au pH neutre, la plupart
des microorganismes se trouvent dans les conditions optimales de survie. Il est
donc possible de ralentir les phénomènes d'altérations
microbiennes en s'écartant des conditions optimales (Jeantet et
al., 2006) ; c'est à dire de la neutralité (pH=7).
Ce qui peut se réaliser par acidification du milieu, soit par ajout
d'acide, soit par fermentation. Le tableau ci après présente le
comportement des microorganismes en fonction du pH du milieu.
Tableau 1 :
Importance du pH pour la conservation des aliments
|
pH
|
Valeurs importantes pour l'industrie
alimentaire
|
|
6.0-7.5
|
Tous les microorganismes survivent, c'est le pH de la plupart des
aliments
|
|
4.5-6.0
|
Seulement les microorganismes acidotolérants survivent,
c'est le pH de beaucoup de fruits
|
|
3.2-4.5
|
Activité et survie des microorganismes sont très
limitées : concentré de fruits (citrons)
|
Source : (Nout et al., 2003)
1.1.3. Séparations
Contrairement aux deux stratégies de stabilisation
biologique précédem-ment décrites, cette technique n'est
ni basée sur la destruction des microorganismes ni sur l'inhibition des
facteurs favorisant leur croissance ; mais sur la séparation non
destructive des microorganismes présents dans les produits liquides en
jouant sur la différence de masse volumique ou sur les
caractéristiques de la taille. On inclut dans ces opérations la
décantation centrifuge et la microfiltration. Il va donc de soi que la
qualité organoleptique du produit n'est en aucun cas compromise. Les
microorganismes sont simplement ôtés du produit sans destruction
physique mais par séparation sélective.
1.2. Stabilisation
physico-chimique
La constitution hétérogène de l'aliment
concoure énormément à son instabilité et donc
à son altération.
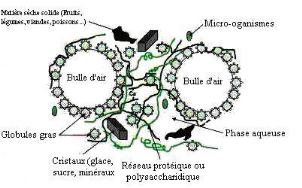
Figure 2 :
Structure matricielle des aliments
Source : Jeantet et al, 2006.
On voit dans cette structure une forte dispersion des
constituants de l'aliment. La présence simultanée dans l'aliment
de ces constituants dispersés et thermodynamiquement incompatible
génère des tensions qui contribuent à déstabiliser
le produit. Selon Jeantet et al. (2006), pour stabiliser les
éléments dispersés, on agit sur le diamètre des
particules et sur la viscosité de la phase dispersante, ou on
crée un réseau macromoléculaire limitant le
déplacement des particules en les incluant dans ses mailles. Lorsque
l'on a affaire à deux phases non miscibles, l'une des techniques les
plus répandues consiste à émulsifier une phase dans
l'autre c'est-à-dire disperser les gouttelettes de l'une des phases dans
l'autre. D'autre part, pour empêcher la séparation des phases
(phase grasse de la phase aqueuse), les industries emploient soit des
macromolécules de nature glucidique ou protéique, soit
d'émulsifiants de faible poids moléculaire qui créent,
modifient et stabilisent la structure physico-chimique de produits
alimentaires. En effet, grâce à leurs propriétés
épaississantes et gélifiantes, les macromolécules
protéique et glucidique arrivent à augmenter la viscosité,
et parfois même, à former des gels sous l'influence de certains
facteurs et servent ainsi à stabiliser les émulsions. Comme
exemples d'émulsifiants, nous pouvons citer l'utilisation des pectines
dans les produits laitiers, les boissons fruités, les confiseries ;
des aginates dans les produits laitiers, les produits en poudre, les produits
restructurés (viandes, fruits, légumes, poissons).
2.
GÉNÉRALITÉS SUR LE POISSON
La chair du poisson une denrée extrêmement
périssable, d'excellente valeur nutritionnelle et de grande
digestibilité.
2.1. Biochimie du muscle du
poisson
2.1.1. Composition du
muscle
Le muscle du poisson est ce qui reste lorsqu'on enlève
au poisson entier les nageoires, la tête, les viscères et les
arêtes. C'est un assemblage de tissu musculaire et de tissu conjonctif.
Selon Linden et Lorient (1994), c'est la partie la plus intéressante du
poisson en tant qu'aliment. La composition biochimique de la chair de poisson
se rapproche de celle du muscle de viande des animaux terrestres, en
particulier, en ce qui concerne les teneurs en protéines, en sucres et
minéraux. Il est cependant important de mentionner que ce rapprochement
entre les protéines des animaux terrestres et aquatiques ne se
vérifie qu'en terme de quantité non pas de qualité. Les
protéines du poisson se distinguent de celles des animaux terrestres par
une plus forte teneur relative en protéines solubles. Comme le souligne
Kaushik (1997), la chair de poissons est nettement plus pauvre en
protéines insolubles (3 à 10%) par rapport à la viande
bovine (16 à 28%) et plus riche en protéines myofibrillaires (70
à 90%).
En revanche, les teneurs en lipides et en eau sont un peu
différentes. La teneur en matière grasse des poissons fluctue
considérablement et permet de ce fait de les classer en deux
catégories : Les poissons dits "gras" et les poissons dits
"maigres". Chez les poissons gras, la teneur de graisse fluctue
considérablement d'une saison à l'autre, en fonction du cycle
sexuel ; par exemple de 1 à 20% chez la sardine, mais se maintient
à des valeurs moyennes pendant la meilleure saison de pêche ;
chez les poissons maigres la teneur en lipides est inférieure à
5% (Cheftel et Cheftel, 1977).
De plus, les lipides du poisson se caractérisent par
une forte proportion d'acides gras insaturés ; dans les huiles de
poisson gras, ce taux peut atteindre 75% (Gret, 1993). D'après Jeantet
et al. (2007), cette richesse en acides gras polyinsaturés lui
conférerait les propriétés nutritionnelles
particulières pour prévenir les maladies cardiovasculaires. Ces
acides gras insaturés sont plus digestes et donc plus facilement
assimilables. D'autre part, Toliara (1997) souligne que la chair du poisson
possède une excellente valeur nutritionnelle ; elle est riche en
protéines de haute valeur biologique à un taux relativement
élevé (15 à 24%) ; en vitamines (A et D surtout); en
oligo-éléments (iode surtout).
De façon un peu plus détaillée, le
tableau suivant illustre la composition du muscle du poisson.
Tableau 2 :
Composition comparée de la chair du poisson et du muscle
squelettique de mammifère
|
Constituants
|
Poisson (filet)
|
Muscle squelettique
De mammifère
|
|
Minimum
|
Intervalle normal
|
Maximum
|
|
Protéines
|
6
|
16-21
|
28
|
15-23
|
|
Lipides
|
0,1
|
0,2-25
|
67
|
4-15
|
|
Hydrates de carbone
|
|
<0,5
|
|
0,5-1,0
|
|
Cendres
|
0,4
|
1,2-1,5
|
1,5
|
1,0-1,3
|
|
Eau
|
28
|
66-81
|
96
|
65-72
|
Source : Stansby, 1962, Love, 1970 , Linden et
Lorient, 1994.
2.1.2. Evolution post mortum du
muscle
Après la mort du poisson, plusieurs réactions
entrent en jeu dans son système protéique musculaire. Les
phénomènes d'apparition et de résolution de la
rigidité cadavérique sont rapides et interviennent en moyenne
respectivement 5 à 22 heures après la mort lors de l'entreposage
immédiat à 0°C (Linden et Lorient, 1994). La chute du pH
reste modérée pendant l'apparition du rigor mortis.
D'après Cheftel et Cheftel (1977), ceci s'expliquerait par les
résistances qu'opposerait le poisson au moment de la capture. Car les
réserves en glycogène diminueraient de façon
proportionnelle à la résistance qu'oppose le poisson à la
capture (plus il est résistant plus élevée est la perte en
glycogène). Cet abaissement de pH est généralement de 7.0
à 6.5-6.0 dans le cas des poissons maigres et de 6.0 à 5.6 dans
le muscle brun des poissons gras (Linden et Lorient, 1994). A ces pH, le
poisson n'est pas à l'abri de la prolifération microbienne et des
activités enzymatiques (protéases, lipases). Pour cela, le
poisson doit être immédiatement réfrigéré
après sa mort et conservé.
Plus schématiquement, la figure ci après
explique ce qui se passe dans le muscle du poisson après la mort.
PHASE DE PRE-RIGOR
Phase d'excitabilité musculaire et de contractions
fibrillaires
- les sarcomères relaxés sont encore
extensibles
- l'actine et la myosine sont libres
- le pH est voisin de 7
- beaucoup de protéines sont extractibles
- fermeté, cohésion, dureté, hydratation
après cuisson
dépendent du degré de raccourcissement du
muscle
PHASE DE RIGIDITE CADAVERIQUE
PHASE DE RESOLUTION DE RIGIDITE CADAVERIQUE
PHASE D'AUTOLYSE
- pH supérieur à 7
- protéines de plus en plus hydrolysées
- la fraction NPN augmente
- la chair molle et gluante, se liquéfiant
Post Rigor
- les sarcomères se désintègrent
légèrement par
hydrolyse progressive des troponines, des stries Z et
M
- les protéines sarcoplasmiques sont
partiellement
hydrolysées
- rupture de la structure du collagène
- le pH remonte vers 7
- à nouveau beaucoup de protéines
extractibles
- chair hydratée, juteuse, plastique tendre
après
cuisson
Rigor Mortis de 1 à 7 heures après la mort
- les sarcomères sont partiellement
contractées
- formation irréversible d'actinomyosine
- rupture partielle des myocommes
- le pH descend vers 6
- peu de protéines extractibles
- baisse de la capacité de rétention
d'eau
- chair dure après cuisson surtout si la Rigor
Mortis intervient à une température de
l'ordre
de +18°C
ATP (à partir du Réticulum sarcoplasmique)
ADP Relargage du Ca++
Glycolyse anaérobie
Cathepsines
Ca++ protéinases collagénases
Enzymes endogènes
Enzymes bactériennes
â-glucuronidase et autres enzymes lysosomales
Acide lactique

Figure 3 :
Evolution du muscle poisson après la mort.
Source : Linden et Lorient, 1994.
2.2. Microbiologie du
muscle
Dans son milieu naturel, le poisson
porte sur lui et en lui des micro-organismes avec lesquels il vit en
symbiose9(*) ou en
parasites10(*).
Normalement, la chair du poisson est stérile. Les régions
contaminées sont les branchies, le mucus qui recouvre la peau et le tube
digestif. La flore intestinale est constituée des bactéries
appartenant aux genres Pseudomonas, Vibrio, Achrobacter, Aeromonas
flavobacterium, Serrattia, Sarcina, Proteus. On en rencontre sur toutes
les surfaces externes (peau et branchies) et dans les intestins. Toliara (1997)
estime les chiffres à :
- sur les branchies 103 à 109
germes/g
- dans les viscères 103 à
109 germes/g
- sur la peau 102 à 107
germes/g
Cependant, Les muscles du poisson vivant ou fraîchement
capturé sont indemines de micro-organismes, et les germes
endogènes ne les détériorent pas. Mais le muscle du
poisson reste un milieu propice au développement de microorganismes car
il est très riche en éléments nutritifs.
3. LE SALAGE DU POISSON
3.1. Le sel
Au sens chimique du terme, le sel désigne le
résultat de l'action d'un acide sur une base, l'ion hydrogène de
l'acide étant remplacé par un ion métal. Le sel auquel
nous faisons référence ici (combinaison chimique du Sodium et du
Chlore) se définit comme étant une substance friable, soluble,
d'un goût piquant, dont on se sert pour assaisonner les aliments (sel de
cuisine ou sel de table). Comme mentionné dans « le livre
blanc du chlore », c'est un élément aussi indispensable
au corps humain que sont l'eau et l'air. Il peut provenir de plusieurs sources
et en dehors de sa propriété révélatrice de
goût ou assaisonnement, il a des vertus conservatrices. Jeantet et
Al. (2006) affirment d'ailleurs que le chlorure de sodium (NaCl), bien
que considéré plutôt comme un ingrédient alimentaire
que comme additif, est sans doute l'un des premiers conservateurs chimiques qui
ait été utilisé en alimentation. C'est une matière
première quasiment inépuisable, ayant des
propriétés inhibitrices de la plupart des bactéries
anaérobies et Pseudomonas à 5%.
3.1.1. Origine du sel
Le sel a quatre origines possibles:
(1) La mer (40%) : la récolte de
sel marin se fait par évaporation dans les bassins, les marais
salants. C'est le cas en France et au Portugal. L'eau de mer est
introduite dans ces bassins à marée haute. Le sable
sédimente et la chaleur du soleil fait évaporer l'eau. Le sel se
dépose sur le fond du bassin et on peut alors le racler avant de le
purifier. Dans les régions plus froides, on utilise la
méthode de congélation : de l'eau de mer salé,
seule l'eau gèle. Le reste de la solution devient de plus en plus
concentrée et le sel précipite (livre blanc du chlore, 2006).
(2) Les mines de sel (10%) : les mines
de sel souterraines ont été formées par
l'assèchement des mers intérieures. Les couches de sel ont
été préservées suite à leur recouvrement par
de couches d'argile imperméables. Comme le souligne le Livre blanc du
chlore, c'est lorsque la couche de sel est suffisamment épaisse, qu'elle
peut être extraite comme un minerai ou de la houille dans les mines
souterraines. C'est le cas en Allemagne, en Angleterre et en Espagne. On parle
de sel gemme s'il s'agit d'un mélange naturel composé
principalement de NaCl et d'environ 1.5% d'impuretés. L'extraction du
sel gemme dans des mines à ciel ouvert ou en galeries exploitant des
gisements marins fossiles, résultant, lors des mouvements et plissements
tectoniques, du recul des océans et des bouleversements d'origine
volcanique de la croûte terrestre (Labouret, 2002). Lorsque la couche de
sel n'est pas épaisse, on peut l'extraire par lixiviation. A l'aide
d'une tour à forage, on perce la couche de sel, qui peut atteindre une
profondeur de plusieurs centaines de mètres, et on injecte l'eau. Le sel
se dissout, on en pompe la saumure ou on l'expulse, ensuite elle est
traitée dans un électrolyseur.
(3) Les sources d'eau salée
(30%) : l'extraction du sel est faite par la chaleur.
(4) Exploitation de la potasse : quatre
millions de tonnes sont produites annuellement. 10% seulement est
destinée à une utilisation ménagère, et 90% est
destinée à l'industrie et la Direction Départementale de
l'Equipement (DDE), pour le déneigement (Labouret, 2002).
3.1.2. Composition du sel
On retrouve dans le sel certains contaminants naturels tels
que des sulfates, carbonates et bromures de calcium, de potassium, de
magnésium etc. présents en quantités variables selon
l'origine et la méthode de production. Mais, d'après la norme du
Codex Alimentarius de 198511(*), le sel pour être utilisé en
alimentation ne doit pas avoir une teneur en chlorure de sodium (NaCl)
inférieure à 97% de l'extrait sec, non compris les additifs. Pour
Labouret (2002), le "sel de table" correspond au chlorure de sodium, NaCl, qui,
bien sûr, représente en poids, la majorité par rapport aux
autres sels. Rapportée au poids des deux éléments (Na et
Cl), la proportion est de 40% de sodium, l'élément mis en cause
dans les méfaits du sel, et de 60% de chlore).
Le sel marin est de couleur grise. A cause de la
présence de certains minéraux à l'état de trace, on
le considère comme un aliment de qualité remarquable. Il
présente trois aspects particuliers : gros sel gris naturel, sel fin
gris naturel et fleur de sel.
3.1.3. Fonction du sel dans les
IAA
Le livre blanc du chlore nous informe que : sans le sel,
nous serons condamnés à mourir de déshydratation un
organisme qui fonctionne bien à besoin de plusieurs grammes de sel par
jour. Dans les industries agroalimentaires, le sel a plusieurs fonctions. Il
peut être:
u Exhausteurs de goût : C'est sa
fonction la plus connue et la plus fréquente. Il renforce la saveur et
fait ressortir le goût naturel des aliments. Le sel enlève la
fadeur du pain, l'amertume et l'aigreur des fromages et yaourts et il donne aux
charcuteries leur goût particulier (Labouret, 2002).
u Révélateur de couleur : Cette
fonction est surtout ressentie dans les industries de charcuterie où
l'usage d'énormes quantités de sel (sels nitrités) donne
aux produits de charcuterie (pâté, jambon, saucisson...) leur
couleur rose et stable très appréciée des consommateurs
(Labouret, 2002).
u Régulateur de fermentation : Au
cours de la fabrication de certains produits, le sel règle la vitesse de
fermentation. Cette vitesse varie graduellement avec le taux de concentration
en sel dans le Lanhouin par exemple (Dossou-Yovo, 2002). Le sel permet
aussi d'assurer la constance de la qualité de ces produits
fermentés.
u Conservateur : L'utilisation du sel pour la
conservation des aliments remonte à des siècles. Afin de ralentir
la prolifération des microorganismes d'altération, nos grands
parents l'utilisaient déjà pour la conservation des viandes et
poissons. Le sel n'est pas à proprement parler un antiseptique car il ne
détruit pas, ou détruit très peu les bactéries ; il
freine ou stoppe la croissance de la plupart d'entre elles à des
concentrations suffisantes (Clinquart, 2005). D'après Mescle (2002), il
permettrait de diminuer l'intensité des traitements physiques et de
limiter les modifications organoleptique et nutritionnelle. Ce qui signifie
qu'il améliore les qualités nutritionnelle et organoleptique des
produits conservés.
3.1.4. Propriété
physico-chimique du sel
Le chlorure de sodium (NaCl), composé ionique, se
présente sous forme d'un réseau cristallin d'ions chlore
(Cl-) et sodium (Na+) régulièrement
disposés dans l'espace les uns par rapport aux autres. Testaniere
(2001), dans son cours de Chimie - Classe de première - Série
S le schématise comme un cube à face centrée tel
qu'indiqué sur la figure 4 ci-dessous.
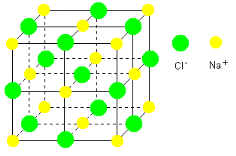
Figure 4 : La
structure d'un cristal de chlorure de sodium.
3.3.4.1- La
solubilité du Chlorure de sodium
Lorsqu'on met du sel (chlorure de sodium) dans l'eau, celui-ci
se dissout. La dissolution est une conséquence du caractère
dipolaire de l'eau (Encyclopædia Universalis, 2007). Les molécules
d'eau polaires s'orientent sous l'action de forces électriques. Leur
pôle négatif (atome oxygène ·O·) est
attiré par un ion Na+, leur pôle positif (situé
au milieu des atomes hydrogène ·H·) est attiré par
un ion Cl- (Testanière, 2001). L'eau entoure et sépare
ainsi progressivement chacun des ions (voir figure 5).
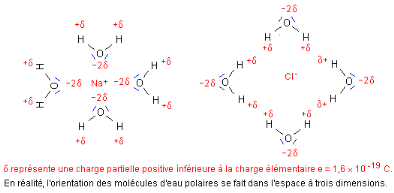
Figure 5 :
Comportement du sel dans l'eau
L'équation de la réaction qui se produit
lorsqu'on dissout le chlorure de sodium solide dans l'eau s'écrit :
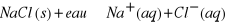 . Retenons que dans cette écriture, (s) est mis pour
solide et (aq) pour aqueux. . Retenons que dans cette écriture, (s) est mis pour
solide et (aq) pour aqueux.
3.3.4.2- La
conductibilité électrique
La conductibilité électrique d'une solution
résulte de la présence et de la mobilité des ions à
l'intérieur de la solution. Elle dépend de la nature et de la
concentration des ions, ainsi que de la température. Karapétiantz
(1978) soutient que, la conductivité décroît avec la
dilution de la solution. Il l'explique selon au fait que, la dilution diminue
la proportion d'électrolytes dans la solution. La mesure de la
conductivité électrique d'une solution (conductimétrie)
permet donc d'estimer sa teneur globale en ions, et se révèle
être aussi un bon outil d'étude du comportement des solutés
dans les solutions.
La solution aqueuse de NaCl conduit le courant
électrique car le NaCl se dissout bien dans l'eau en cations
Na+ et anions Cl- : Soumillion et Ghins (2002)
parlent de dissociation électrolytique en solution (les ions se
séparent). Chemical education material study (1965) nous enseigne que la
dissolution du sel favorise peut-être la production de particules
chargées électriquement et que, le déplacement de ces
particules chargées dans la solution permet la circulation du
courant.
3.2. Technologie de
salage
Le salage du poisson commence au moment du contact entre le
poisson et le sel, il se termine lorsque la salinité du poisson est
suffisante pour devenir impropre à la prolifération
bactérienne contaminante et lorsqu'il a acquis le goût, l'odeur et
consistance spécifiques et caractéristiques des produits
salés prêts à la consommation (Linden et Lorient,
1994). C'est l'une des méthodes de conservation les plus efficaces et
elle donne d'excellents résultats à condition que le poisson et
le sel soient de bonne qualité et que ce dernier soit utilisé en
quantité suffisante (Gret, 1993). D'après plusieurs auteurs comme
Clinquart (2005) et Jeantet et Al. (2006), le pouvoir conservateur du
sel reposerait essentiellement sur son effet bactériostatique
plutôt que bactéricide. Il freine ou stoppe la croissance des
microorganismes par une diminution de l'eau disponible et n'agit que faiblement
à proprement parler comme antiseptique. Le salage du poisson peut
être pratiqué de deux manières : salage à sec
(le sel est directement mis sur le poisson) et le salage en saumure (le poisson
trempe dans une solution saline).
3.3. Paramètres
influençant le salage
Le salage peut être influencé par plusieurs
paramètres liés aux caractéristiques intrinsèques
du poisson, à la qualité du sel comme à la
température de déroulement de l'opération.
3.3.1. Influence de
l'état de fraîcheur du poisson
La conservation par sel n'est qu'une course de vitesse entre
les phénomènes d'altération, provoqués par autolyse
des tissus ou par des agents bactériens et la pénétration
du sel qui arrête ou empêche ce phénomène. Il est de
ce fait impossible de prétendre une conservation par le sel pour des
poissons déjà entrés en phase d'autolyse. On peut noter de
la figure 3 que, la phase de rigidité cadavérique commence entre
1 à 7 heures après la mort, selon le type de poisson et la
résiste à la capture. Un intervalle fixe ne saurait donc
être défini pour préconiser le démarrage du salage.
Il vient donc que, les meilleures délais sont d'appliquer la technologie
à la limite une heure après la mort quelque soit le type de
poisson. Les poissons salés en respectant cet intervalle limite de temps
sont susceptibles de fournir de meilleurs résultats.
Certaines techniques peuvent être utilisées pour
évaluer l'état de fraîcheur du poisson. Il existe des
techniques d'évaluation sensorielle et les méthodes de dosage
chimique. Selon Mapaq (2002), Bien que l'analyse sensorielle demeure le test le
plus utilisé pour évaluer l'état de fraîcheur du
poisson en industrie, les dosages chimiques sont très présents en
recherche pour appuyer et expliquer les résultats de l'évaluation
sensorielle. Parmi les techniques sensorielles, nous pouvons
énumérer la grille l'évaluation organoleptique que propose
le tableau 3 ci-après :
Tableau 3 : Grille
d'évaluation organoleptique de l'état de fraîcheur des
poissons entiers
|
Cote
|
Odeur des branchies et de la cavité
abdominale
|
Mucus
|
Apparence de la peau
|
Yeux
|
Branchies
|
Qualité générale
|
|
9
|
Odeurs d'algues fraîches
|
Transparent ou blanc
|
Brillante et sans décoloration
|
Pupille noire convexe, cornée translucide
|
Couleur rouge vif, sans dépôt de mucus
|
Excellent
|
|
8
|
Odeurs de poisson frais
|
Légèrement opalescent
|
Éclat quelque peu réduit
|
Pupille noire et convexe, cornée translucide
|
Couleur rouge vif, un peu de mucus translucide
|
Très bon
|
|
7
|
Odeurs neutres
|
Opaque et quelque peu laiteux
|
Perte de brillance et décoloration
|
Yeux légèrement enfoncés, cornée
légèrement opaque
|
Légère décoloration et présence de
mucus
|
Bon
|
|
6
|
Odeur plus intense, mais pas d'odeurs aigres ou acides ni
d'odeurs de vieux
|
Opaque, traces de décoloration
|
Perte totale de la brillance et sans couleur
|
Yeux enfoncés, pupille grise, cornée opaque
|
Brunâtre et mucus opaque
|
Satisfaisant
|
|
5
|
Odeur de poisson, odeurs aigres ou acides, acide lactique
|
Épais et décoloration
|
Perte de l'aspect naturel et terne
|
Yeux concaves et cornée opaque
|
Gris brunâtre, mucus épais
|
Peu satisfaisant
|
|
4
|
Odeurs acides fortes
|
Épais et jaunâtre
|
Perte de l'aspect naturel et décoloration
|
Yeux complètement enfoncés (concaves), pupille
blanc laiteux
|
Gris, mucus épais et jaunâtre
|
Pauvre
|
|
3
|
Odeurs fortes et répulsives de soufre et autres odeurs
sulfureuses
|
Continuellement épais et jaunâtre
|
Décoloration marquée
|
Yeux concaves, pupille blanc laiteux
|
Les branchies se détachent
|
Gâté
|
Source : Johansen et al., 1996.
3.3.2. Influence de la grosseur
et du taux en matière grasse du poisson
Selon une fiche de presse de l'Institut National de la
Recherche Agronomique, l'état d'engraissement du poisson ainsi que sa
grosseur semblent avoir une conséquence directe sur la
pénétration du sel lors du salage (INRA, 2006). D'après
les chercheurs de cette institut, pour des durées de salage identiques,
la teneur en sel diminue à mesure que le taux de lipides augmente et ce
jusqu'à environ 11% de lipides. Au-delà de cette valeur, la
teneur en sel ne diminue plus et reste constante. Ce qui signifie que la
teneur en graisse influence la pénétration du sel jusqu'à
une limite de 11%. En dessous de cette valeur le sel continue sa migration dans
la chair mais à faible vitesse ; au delà de 11% de lipide la
migration est limitée voire suspendue. D'autre part, la grosseur du
poisson freine également le processus de pénétration du
sel : en effet plus épais est le poisson moins grande est la
vitesse diffusion du sel. Il et donc très difficile de réussir
le salage des poissons gras et/ou épais.
3.3.3. Influence de la
préparation préliminaire
Les préparations préliminaires sur le poisson
peuvent avoir un impact sur la bonne réussite de l'opération de
salage. Selon que le salage est réalisé sur le poisson
éviscéré ou non, lavé ou non, sur les filets de
poisson ou sur le poisson entier, on aura une plus grande ou faible
pénétration du sel, et une bonne ou mauvaise conservation
respectivement.
3.3.4. Influence de la grosseur
du sel
La grosseur des cristaux de sel est un paramètre
très important dans le salage. Si le sel fin a l'avantage d'être
uniformément et très rapidement reparti sur toute la surface du
poisson, il présente l'inconvénient d'altérer la
qualité organoleptique du poisson. Les gros cristaux quand à eux
agissent plus lentement donc de manière moins brutale et permettent
ainsi d'obtenir un poisson de meilleure qualité.
3.3.5. Influence de la
température
S'il est vrai que la perméabilité des tissus et
les possibilités d'échanges augmentent avec la
température, il est aussi prouvé qu'à des fortes
températures les phénomènes d'autolyses qui provoquent
l'altération du poisson sont plus activés. Le but du salage est
d'empêcher l'autolyse et de ce fait l'altération. Même si
l'élévation de la température améliore la
perméabilité des tissus et par là une meilleure
pénétration du sel, si vitesse de diffusion du sel demeure
inférieure à la propagation de l'autolyse, il n'y a pas
conservation. Ce que veut dire que les paramètres vitesse de diffusion
du sel et vitesse de propagation de l'autolyse doivent être pris en
compte pour définir la température de salage. Il a
été par ailleurs observé que la perméabilité
des membranes cellulaires augmentait lorsque les tissus sont refroidis à
environ 0°C.
3.3.6. Influence de la
méthode de salage
Le salage à sec permet une pénétration
plus rapide mais aussi plus abondante du sel dans le poisson que lors du salage
en saumure. Pendant le salage en saumure, le sel contenu dans la saumure
provoque une migration de l'eau du poisson vers la saumure. L'effet
immédiat est que la saumure devient de moins en moins concentrée
ce qui ralentit la diffusion du sel car, l'équilibre à tendance
à s'établir entre la concentration en NaCl dans la chair et celle
dans la saumure. Il a été constaté que dans les couches
superficielles du poisson salé à sec, il pénètre,
pendant la même unité de temps, 10% de plus de sel que dans les
poisons salés en saumure et il en pénètre environ 20% de
plus dans les couches profondes. Cependant pour des préparations
délicates, le salage en saumure est préféré au
salage à sec.
MATERIELS ET METHODES
1. MATÉRIELS
Le matériel utilisé pour réaliser cette
étude est constitué de poisson, de sel, des appareils pour mesure
de conductivité et de pH, une étuve et un four pour le
séchage et la calcination, une balance de précision, de la
verrerie et d'autres petits ustensiles (glacière, bassines, bols en
polyéthylène, couteaux, fourchettes, ...)
1.1. Le poisson
L'espèce utilisée est le Pseudotolithus
senegalensis ou Cassava croaker et communément
appelé « Bar » (voir figure 6). C'est un poisson de
la famille des Sciaenidae, de la classe des
Actinoptérygiens (poissons à nageoires rayonnées)
(Valencienne, 1833). Frai de novembre à mars dans les eaux de 22
à 25°C du golfe de la Guinée. Pseudotolithus
senegalensis est le poisson démersal le plus économiquement
important des eaux d'Afrique Occidentale. D'après Piclet (1987)
cité par Jeantet et al., (2007), il a une teneur en graisse
comprise entre 0.8 et 2.5% donc appartient à la catégorie des
poissons dits maigres.

Figure 6 :
Pseudotolithus senegalensis
Nous nous procurons du poisson au Port Autonome de Cotonou.
Ces poissons sont ramenés de mer par des petits chalutiers de
pêche tous les mardi et vendredi entre deux heures et cinq heures du
matin. Les poissons récupérés très tôt le
matin (aux alentours de 6 heures) sont alors acheminés jusqu'au
laboratoire dans une glacière. Une fois au laboratoire, nous jugeons de
la qualité et transformons immédiatement en filet ceux de bonne
qualité avant d'y effectuer un salage au poids.
1.2 Le sel
Le sel utilisé dans le cadre de ces travaux est du sel
blanc, de grains moyens acheté dans un super marché de la place.
Il est de marque CEDO et importé de la Communauté
Européenne, donc respectant un grand nombre de règles
d'hygiène. Comme ingrédient, il est signalé qu'il contient
un antiagglomérant12(*) E535 ou E536 conformément au code
européen assigné aux additifs alimentaires.

Figure 7 :
Photo du sel utilisé
2. MÉTHODES
2.1. Préparation des
filets salés
Après acquisition des poissons, une fois au
laboratoire, on évalue d'abord son état de fraîcheur
suivant la grille d'évaluation organoleptique de Johansen et
al., 1996 (cf. page 23).
Les poissons que nous retenons sont ceux ayant obtenu une cote
comprise entre 7-9 c'est à dire de qualité générale
excellent, très bon ou bon. Ils sont alors filetés comme
illustrés par les photos de la figure 8 suivante avant d'être
salés :
|
|
|
Etape 1 :
|
Enlèvement des écailles du poisson
|
Etape 2 :
|
Coupure l'abdomen du poisson au milieu à partir de
l'anus jusqu'à la tête et enlèvement des viscères
|
|
|
|
Etape 3 :
|
Rinçage du poisson à grande eau. Elimination de
la flore contaminante des viscères, de la peau ainsi que des
écailles restantes.
|
Etape 4 :
|
Faire un mouvement de va et vient à partir de la
tête afin de dégager la partie antérieure du filet.
|
|
|
|
Etape 5 :
|
Incision à l'arrière de la nageoire pectorale et
dégagement du premier filet
|
Etape 6 :
|
Retournement du poisson et répétition
l'étape 4.
|
|
|
|
Etape 7 :
|
Dégagement du second filet.
|
Etape 8 :
|
Séparation des filets, des arêtes et du reste du
corps.
|
Figure 8 :
Etapes de filetage manuel de Pseudotolithus senegalensis
Après l'apprêt des filets, nous les salons au
poids à trois pourcentages distincts 10, 15 et 20 % par rapport à
la masse de chaque filet.
Après salage, les échantillons
sont portés au Laboratoire d'agropédologie de l'INRAB (Institut
National des Recherches Agricoles du Bénin) pour la mesure des
paramètres de conductivité et de pH. Les premières mesures
sont réalisées 1h30min à 2h directement après
salage et se répètent à des intervalles assez
régulières pendant 4 jours.
2.2. Mesure de la
conductivité
Principe
Le principe est basé sur la vitesse de
déplacement des ions en présence dans une unité de
volume.
Pour la mesure, on applique, à l'aide d'un
conductimètre, le voltage alternatif de haute fréquence à
une électrode baignant dans une solution aqueuse de
l'échantillon. L'électrode est scellée dans un tube de
verre que l'on peut plonger dans la solution colloïdale (la solution de
hachis préparée).
Appareillage
- bécher de 50mL ou 100mL ;
- conductimètre CG854 ;
- électrode en verre ;
- pissette en matière plastique ;
Réactifs
Solution de KCl 0.050N dissoudre 3.728g de KCl sec à un
litre d'eau distillée
Solution de KCl 0.01N (diluer 50mL de la solution 0.05N
à 250mL)
Solution de KCl 0.005N (diluer 25mL de la solution 0.05N
à 250mL)
Solution de KCl 0.002N (diluer 50mL de la solution 0.01N
à 250mL)
Mode opératoire
On transfère une quantité de
l'échantillon dans un petit Becher. Pour obtenir cette quantité
de solution, on pile un peu d'échantillon dans un mortier en porcelaine,
puis on pèse 2g du filet pilé qu'on homogénéise
dans 50mL d'eau distillée. Ensuite on filtre le mélange obtenu
sur du papier filtre supporté par un verre fuité. Pour prendre la
mesure, on introduit directement l'électrode préalablement
rincée avec de l'eau distillée et séchée dans le
filtrat, de manière que les électrodes soient entièrement
baignées. On fait la lecture sur l'échelle choisie du
conductimètre.
Méthode de calcul
Pour déterminer la conductivité de notre
échantillon, on multiplie le résultat lu sur l'écran de
l'appareil par l'échelle de mesure et le facteur de correction.
NB : Le facteur de correction est déterminé par
l'utilisateur en réalisant des essais sur des solutions de KCl de
conductivité spécifiques connues (Annexe 1). En faisant une
étude statistique sur les résultats obtenus et les standards, on
détermine ainsi le facteur de correction.
2.3. Mesure du pH
Principe
Le principe est basé la détermination de la
quantité des ions hydronium (H+) dans une solution.
Le pH est mesuré électroniquement au moyen d'un
pHmètre à lecture directe, en utilisant une électrode de
verre et de référence au chlorure de potassium-calomel à
saturation.
Appareillage
- becher ;
- pHmètre : pH 730 :
- électrode au KCl-calomel à
saturation ;
- pissette en matière plastique.
Réactifs
Solution de phtalate acide de potassium 0.05Mol/L ;
Solution de phosphate monopotassique + phosphate disodique,
0.025Mol/L pour chaque composant ;
Solution de borate de Sodium 0.01Mol/L.
Mode opératoire
On étalonne le pHmètre sur des solutions tampon
de phtalate et de phosphate selon les instructions fournies par le fabricant et
on rince longuement les électrodes. On sèche l'électrode
et on la plonge dans l'échantillon préparé comme
décrit plus haut et introduit dans un bécher, de manière
qu'elle baigne bien dan la solution. On branche l'appareil sur l'échelle
de lecture et on note le pH à 0.001 unité près.
2.4. Détermination
de la teneur en eau (AOAC, 1984)
Le principe repose sur la perte d'eau libre de
l'échantillon à l'étuvage. On pèse
premièrement les creusets vides et on note les valeurs
« xi » lues. On ajoute dans les creusets 3-5g de
produit à sécher et on relève la nouvelle masse
« yi » de l'ensemble. Les creusets sont d'abord
portés à l'étuve à 65°C pendant 72 heures
ensuite, on les place à l'étuve à 105°C pour le
séchage. Au bout de 3 heures à 105°C, on les sort de
l'étuve, on les passe au dessiccateur pour les refroidir et on les
pèse. Après cela, on remet les creusets à l'étuve
à 105°C. Après 30 minutes, on les sort à nouveau, les
refroidit et les pèse. L'opération est
répétée jusqu'à ce que les masses entre deux
pesées consécutives du même creuset soient
différentes d'au plus 0.01g. On note alors les valeurs
« zi » des différents creusets.
La détermination de la teneur en eau (TE) du produit
sera obtenue en faisant le calcul ci après :
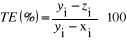
Nous avons utilisé les étuves Memmert
du département de la production animale de la Faculté de Sciences
Agronomiques (FSA) de l'université d'Abomey-Calavi.
2.5. Détermination
des cendres totales
Les cendres ont été déterminés
sur la matière sèche analytique c'est à dire sur 5g
d'échantillon étuvé à 105°C jusqu'à
stabilisation du poids de la matière sèche. Après
l'obtention de la matière sèche analytique, les creusets et leur
contenu sont portés dans un four à moufle à 550°C
pendant environ 08 heures. Ces creusets sont ensuite pesés après
avoir été refroidis dans un dessiccateur.
Le calcul du taux de cendres ce fait alors comme
suit :
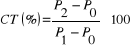
Avec : - P0 = poids du creuset vide
- P1 = poids du creuset + échantillon
séché à l'étuve 105°C
- P2 = poids du creuset + résidu
calciné
Pour la calcination, nous nous sommes servis du Four à
moufle du laboratoire de chimie organique.
2.6. Détermination
du taux de protéine totale
Principe
Premièrement relevons le fait que la
détermination de l'azote d'un milieu protidique permet de
connaître la proportion de protéines de ce milieu. La
méthode utilisée est celle décrite par Kjeldahl en 1883
(voir annexe 2). Conventionnellement, on admet que toutes les protéines
renferment 16% d'azote et on utilise le coefficient 6.25 pour passer de l'azote
total aux protéines. Cette méthode a deux limites :
- D'une part la teneur en azote des protéines varie de
14 à 18% ;
- D'autre part, l'azote peut avoir une origine, par exemple
origine ammoniacal, origine amidé, etc.
Malgré cela, cette convention est pratique est
très utilisée. Le dosage s'effectue en deux temps :
- La matière organique est attaquée par l'acide
sulfurique concentré, et en présence de catalyseur l'azote passe
à l'état d'ion ammonium (c'est la minéralisation);
- L'ammoniaque est déplacée par la soude, base
plus forte. Par chauffage, elle distille avec l'eau. L'ammoniaque est
recueillie dans la solution d'acide borique et dosée par une solution
d'acide sulfurique diluée et de titre bien connu.
On procède aux calculs des résultats comme
suit:
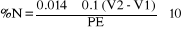
Avec PE : masse de prise d'essai en gramme
V2 : volume d'HCl à partir du quel
l'indicateur vire du vert au rose
V1 : volume d'HCl utilisé pour le
dosage blanc
0.1 = Titre de la solution d'acide chlorhydrique
0.014 = poids molaire de l'azote  10-3 10-3
En faisant l'hypothèse que la matière
azotée totale (MAT) provient exclusivement de protéines contenant
16%N, on obtient :
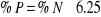
Avec : 6.25 = Facteur de Conversion
%N = Pourcentage d'azote
%P = pourcentage de Protéine totale
RESULTATS ET DISCUSSION
1. EVOLUTION DE LA
CONDUCTIVITÉ ET DU PH
1.1. La
conductivité
La figure suivante présente l'évolution de la
conductivité dans les solutions de hachis des filets du poisson
utilisé pour l'étude salé à 10, 15 et 20%.

Figure 9 :
Evolution de la conductivité dans les solutions de hachis de
Pseudotolithus senegalensis salé à différents
pourcentages et à 20#177;2°C (1er lot)
En observant cette figure 9 représentant
l'évolution de la conductivité dans des solutions de hachis de
filets de ce poisson salé et exposé sous climatisation à
20#177;2°C, on peut constater qu'elle présente trois phases
distinctes :
- une phase de croissance exponentielle ;
- une phase de décroissante ;
- une phase relativement constante ou faiblement croissance
selon le cas.
Pendant les premières heures qui suivent le salage, la
conductivité augmente de façon remarquable dans les filets. Ce
qui voudrait dire que le degré d'ionisation est significatif dans le
filet. Autrement dit, il se forme suffisamment d'ions (cations et anions) qui
s'accumulent dans la chair et seraient à la base de la montée de
la conductivité. En effet, lorsque le sel est en contact avec la chair,
il se produit une diffusion qui se traduit par la migration d'eau et du sel
dans le produit. Le phénomène est d'autant plus marqué que
la concentration en sel et la durée du salage sont importantes. Kechaou
(2007) démontre dans ses travaux que plus le temps se salage se
prolonge, plus l'enrichissement de la chair en sel et sa déshydratation
sont prononcés. Notons par ailleurs que nos échantillons
renferment suffisamment d'eau environ 80%. Une fois dans cette eau, le sel ce
dissocie fortement mais progressivement en Na+ et Cl- car
ils appartiennent au groupe d'électrolytes forts (Dossou-Yovo, 2002).
Nous pouvons imaginer que c'est la concentration de la chair en Na+
et Cl- qui est responsable de l'augmentation de la
conductivité. Car, en utilisant l'eau disponible dans la chair du
poisson pour se dissocier, et par là, accroître la
conductivité, le NaCl réduit la teneur en eau des filets. Notons
cependant que cette première phase dure plus longtemps pour la courbe de
salage à 10%. Ce qui porte à croire que la dissolution du NaCl
n'est pas la seule responsable de l'augmentation de la conductivité dans
ces filets.
En fait, les protéines sont des colloïdes
hydrophiles et, dans les solutions aqueuses, autour de chaque molécule
protéique, il se forme des enveloppes aqueuses composées de
molécules d'eau ayant une orientation particulière dans l'espace.
L'eau d'une telle enveloppe est appelée «eau liée» ou
«eau saturée». Cette eau ne gèle pas à basse
température ; ce qui augmente la stabilité des
protéines dans une solution. Mais à fortes concentrations de sel,
cette eau est affectée par le Na+ et le Cl- et la
molécule protéique peut précipiter, parce que leurs
groupes carboxyliques et aminés sont ionisés.
Ainsi donc cette forme ionique augmente avec l'apport
grandissant en sel, ce qui engendre la conductivité (électrique)
du milieu. Mais, à la longue, il s'ensuit la précipitation.
Pendant la 2nde phase, on observe une
décroissance de la conductivité. On peut expliquer cet
abaissement par la réduction du degré d'ionisation dans la chair.
Les ions Na+,
Cl- et les protéines du muscle entrent en compétition
pour la faible quantité d'eau restant dans les filets car tous ont une
affinité pour l'eau. Mais les ions Na+ et Cl- qui
sont en forte concentration et ont une plus grande affinité que les
protéines déshydratent celles-ci qui précipitent. Ce qui
est en accord avec l'affirmation de plusieurs auteurs comme Linden et Lorient
(1994) et Jeantet et al. (2006) qui pensent qu'aux valeurs
élevées de force ionique, les charges de surface de la
protéine sont écrantées et l'hydratation diminue pendant
que les protéines précipitent.
Au cours de la troisième phase, on note une
légère différence dans le comportement des trois courbes.
§ La courbe représentant le salage à 20%
semble se stabiliser, signe que le système est en équilibre c'est
à dire qu'il n y'a plus de mouvement d'ions : agrégation ou
régénération.
§ Celle à 15% aussi s'est stabilisée,
seulement après une faible élévation. La
légère remontée de la conductivité pourrait
s'expliquer par une nouvelle régénération d'ions dans les
filets. Or de part la littérature, le maximum de solubilité des
protéines se situerait entre les concentrations en sel de 3 à 12%
(selon la température et le type de poisson). Donc normalement au
delà de 12%, les protéines précipitent. Puisque le salage
est fait à 15% sur les filets de poissons, nous pensons que :
- soit cette brève élévation de la
conductivité représente la solubilisation des protéines
restantes après le temps de salting-out. Dans ce cas, il y
aurait une insuffisance d'électrolytes entraînée
certainement avec le liquide exsudatif.
- Soit que l'élévation est due à une
autre forme d'ionisation que la protéolyse. Peut être qu'il s'agit
aussi d'une lipolyse avec libération des radicaux d'acides gras
libres.
§ Par contre la courbe illustrant le salage à 10%
est en croissance. Ce qui veut dire que les réactions d'hydrolyses ne
sont pas stoppées et donc qu'il continue de se former des ions dans les
filets d'où l'augmentation de la conductivité. Autrement dit, les
filets salés à 10% sont soumis à deux types
d'altérations : l'oxydation de la faible quantité des
lipides qu'ils contiennent et la modification de la texture et de la
structure.
1.2. LE PH
La figure suivante présente les résultats des
valeurs de pH durant la conservation obtenues pour les solutions de hachis du
poisson utilisé pour cette étude salé à
différents pourcentages.

Figure 10 :
Evolution du
pH dans les solutions de hachis de Pseudotolithus
senegalensis salé à différents pourcentages et
à 20#177;2°C (1er lot)
En observant cette figure, on constate à
première vue que les trois courbes ont une allure pratiquement
semblable. Les courbes de la figure 10 montrent toutes des phases successives
de croissance et de décroissance du pH. Les pH initiaux oscillent autour
de 6.85#177;0.04 et ils tendent à la fin de la durée de
conservation dans cette étude vers 6.83#177;0.05, mais passent par des
valeurs limites (des maxima de 7.11, 7.02 et 6.90 et des minima de 6.88, 6.83
et 6.72 respectivement pour les salages à 10, 15 et 20%). Ce qui est un
signe du fait que le système n'est pas stable, soit qu'il s'y produit
des réactions suscitant les variations du pH. Mais on peut aussi voir
que ces courbes tendent à se stabiliser au-delà de 3310 minutes
soit environ 2 jours et 8 heures après le salage.
Cependant, pour la courbe représentant le salage
à 10%, on remarque qu'après 1 jour 9 heures 20 minutes environ,
elle passe au dessus du pH neutre. De plus, le pH reste dans cette plage
pendant, en moyenne (480 minutes). Ce pH étant favorable à la
croissance de la plupart des germes, il est possible qu'ils déclenchent
dans les filets une autolyse surtout que la durée offerte à la
prolifération n'est pas négligeable.
D'autre part, on peut voir d'après les résultats
de conductivité que la courbe représentant celle des filets
salés à 10% a une première phase de croissance plus longue
que celle des deux autres (son pic est s'observe à 1940 minutes alors
que celui des autres est observé à 1545 min). Or, vue l'apport
moindre de sel comparé aux autres salages et la même
quantité d'eau disponible pour la dissolution du sel, ce prolongement
dans l'évolution de conductivité ne peut-être
expliqué que par l'ionisation du NaCl.
Il semble assez évident qu'un lien étroit existe
entre l'évolution conductivité, le pH du poisson salé et
la conservation de la qualité biochimique. Mais est-ce que ce seul
résultat pourrait être globalement accepté ? Nous ne
saurons répondre à cette interrogation qu'en
répétant l'expérience sur plusieurs lots
différents. Ceci étant, nous avons jugé nécessaire
de faire une comparaison entre les phénomènes observés au
niveau de l'évolution de la conductivité pour deux lots
distincts.
2. ETUDE COMPARATIVE DE
L'ÉVOLUTION DE LA CONDUCTIVITÉ DANS DEUX DIFFÉRENTS LOTS
DE POISSON
En ce qui concerne ce paramètre qui est à la
base même de ce travail, l'étude a porté aussi sur d'autres
lots. Mais nous n'avons retenu que ces deux lots pour analyses. Le choix des
lots est simplement dû au fait que, l'évolution y a
été suivie de manière ininterrompue et que chaque phase a
ainsi pu être captée. Notons que ces lots sont tous de bonne
qualité générale et que les valeurs de la
conductivité et du pH du produit frais sont respectivement de
14.88mS/cm, 18.23mS/cm et 6.78, 6.82 pour le 1er et le
2nd lot.

Figure 11 :
Evolution comparative de la conductivité de 2 lots à 10%
à 20#177;2°C

Figure 12 :
Evolution comparative de la conductivité de 2 lots à 15%
à 20#177;2°C

Figure 13 :
Evolution comparative de la conductivité de 2 lots à 20%
à 20#177;2°C
Au regard de ces courbes, on remarque en premier lieu qu'elles
ont toutes une particularité, celle d'évoluer à chaque
fois de la même façon. Cependant on peut également noter
à chaque instant et à salage identique une tendance de la courbe
représentant la conductivité du second lot à vouloir
surpasser celle du premier lot. Ce qui voudrait dire qu'il y a plus d'ions qui
se forment dans le 2nd lot que dans le 1er et
parallèlement qu'il y a moins de liens qui se créent dans la
chair du 2nd lot par rapport à celle du 1er lot.
Ainsi, il y aurait plus de réactions d'hydrolyses dans le lot 2 que dans
le lot 1 malgré l'application du même taux de sel.
Or ces deux lots ont eu une même cote correspondant au
qualificatif "bonne qualité" après évaluation
organoleptique de l'état de fraîcheur. Cependant, les mesures du
pH et de la conductivité du poisson frais montre de
légères différences. Ce qui justifierait le fait que les
chercheurs font des dosages chimiques pour appuyer et expliquer les
résultats de l'évaluation sensorielle. Dans notre cas, nous
constatons par exemple que le 2nd lot a des valeurs un peu
supérieures au 1er, signe que certaines modifications s'y
sont développées avant l'application du sel.
Nous avons pourtant déjà remarqué que les
salages à 10 et 15% ne stabilisaient pas vraiment la
3ème phase de la courbe de conductivité. Il se
pourrait donc que, cette tendance des courbes, des figures 11 et 12
représentant le salage à 10 et 15% du 2nd lot,
à surpasser celle du 1er lot soit simplement due à
l'insuffisance de la quantité de sel présente à rattraper
le niveau d'hydrolyse du muscle frais, d'autant plus que les courbes de la
figure 13 représentant le salage à 20% des deux lots tendent
à se confondre.
3. LA TENEUR EN EAU
Après vingt heures d'exposition, l'évaluation
de la teneur en eau dans les différents produits salés a fourni
les résultats inventoriés dans le tableau
ci-après :
Tableau 4 :
Teneur en eau dans les filets frais et salés de
Pseudotolithus senegalensis près 20 heures de salage
|
TE (%)
Echantillons
|
1er essai
|
2nd essai
|
Valeur moyenne
|
|
Témoin (frais & sans sel)
|
79.19%
|
79.96%
|
79.57#177;0.38
|
|
Salage à 10%
|
70.31%
|
70.08%
|
70.20#177;0.12
|
|
Salage à 15%
|
68.40%
|
67.94%
|
68.17#177;0.23
|
|
Salage à 20%
|
62.94%
|
63.34%
|
63.14#177;0.20
|
On remarque dans tous les filets salés, que la teneur
en eau a été diminuée. Ce qui traduit simplement le fait
qu'il y a eu réduction d'eau dans les filets après ajout de sel.
Ces résultats concordent avec la littérature ainsi que les
travaux réalisés par certains chercheurs dont (Del Valle et
Nickerson, 1962 cités par Mackie et al., 1971 ; Kechaou,
2007) : lors du salage du poisson, au contact du sel, il se crée un
gradient de concentration qui conduit à la diffusion du sel dans la
chair et de l'eau vers l'extérieur. Kechaou (2007) assure que plus le
temps de salage et la quantité de sel sont importants, plus
l'enrichissement de la chair en sel et la déshydratation sont
prononcés. En effet, nous constatons que plus les quantités de
sel apportées pour le salage sont grandes, plus considérable est
la variation de la teneur eau.
La teneur en eau du poisson frais a été
réduite de 16.43, 11.40 et 9.37% respectivement pour les filets de
poissons salés à 20, 15 et 10% vingt heures après
l'opération de salage. On voit bien la chute de la teneur en eau est
assez significative à 20%
4. LES CENDRES TOTALES
Le tableau suivant présente les résultats du
taux de cendre totale obtenu dans les échantillons de poisson
Pseudotolithus senegalensis frais et salé utilisé pour
l'étude par rapport à la matière sèche
analytique.
Tableau 5 :
Cendres totales dans les filets frais et salés de
Pseudotolithus senegalensis
|
CT (%)
Echantillons
|
1er essai
|
2nd essai
|
Valeur moyenne
|
|
Témoin (frais & sans sel)
|
6.81
|
6.67
|
6.74#177;0.07
|
|
Salage à 10%
|
37.91
|
35.79
|
36.85#177;1.06
|
|
Salage à 15%
|
42.75
|
42.28
|
42.52#177;0.24
|
|
Salage à 20%
|
54.48
|
52.89
|
53.69#177;0.79
|
On peut remarquer à la lecture de ce tableau que les
valeurs du taux de cendre augmentent en fonction du pourcentage de sel
ajouté.
Ce résultat est tout à fait concevable, d'autant
plus que les cendres totales dans un aliment permettent d'estimer le taux de
minéraux qu'il contient. Donc le pourcentage important des cendres dans
les filets salés par rapport au muscle frais s'explique par l'ajout de
NaCl qui a été réalisé. Il est néanmoins
nécessaire de préciser que si la différence se fait aussi
grande par rapport à l'échantillon témoin, c'est
simplement parce que ces valeurs ont été définies en
fonction de la matière sèche analytique (produit dépourvu
de toute son eau).
Si l'écart entre le taux de cendre des
échantillons salés à 10 et 15% semble se rapprocher, la
différence avec le salage à 20% est beaucoup plus significative.
La même remarque faite avec la variation de la teneur en eau dans les
échantillons salés à 20% par rapport aux autres
pourcentages de salage pourrait bien expliquer ce grand décalage des
mesures.
Le rapprochement des valeurs de CT(%) et TE(%), laisse
comprendre que le sel se serait plus nettement fixé aux constituants de
la chair dans les filets salés à 20%. Ce qui voudrait dire qu'il
y aurait moins de perte de sel dans le liquide exsudatif. De la même
manière à 10 et 15%, les pertes dans le liquide exsudatif
auraient été plus importantes. Si la fixation du sel a
été grande, cela signifie que la consolidation des constituants
de la chair avec le sel est plus importante. Le constituant majeur de la
matière sèche du poisson étant les protéines, nous
dirons plus simplement que les risques d'hydrolyse de ces derniers ont
été réduits au profit de leur combinaison au sel avec
libération des molécules d'eau.
5. LE TAUX DE
PROTÉINES
Trois (03) jours après salage et exposition, le taux de
protéines a été déterminé dans les filets de
poisson salés. Les résultats obtenus nous ont permis de tracer
l'histogramme ci après :
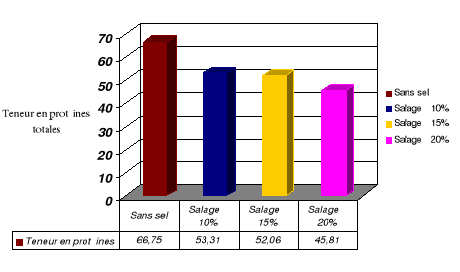 Figure 14 :
taux de protéines dans le Pseudotolithus senegalensis
frais et salé à pourcentages différents Figure 14 :
taux de protéines dans le Pseudotolithus senegalensis
frais et salé à pourcentages différents
Au regard de l'histogramme ci-dessus, Nous constatons une
décroissance du pourcentage de protéine totale (53.32%, 52.06% et
45.81%) selon que la proportion en sel augmente (10%, 15% et 20%) lors du
salage des filets du Pseudotolithus senegalensis. Ce
phénomène et bien évident ; car dans le poisson, il y
a diverses formes d'azote constituant la totalité de l'azote qui se
prête au dosage.
L'azote total est converti en protéine totale de
façon conventionnelle, du fait que dans la chair du poisson frais, au
moins 10% d'azote se trouve sous forme de substances non protéiques
(Kosstylev et Ryabochapko, 1982). De plus, il a été
démontré qu'à mesure que la concentration de sel augmente,
les protéines myofibrillaires commencent à se dissoudre
jusqu'à ce qu'elles atteignent une solubilité maximum qui se
situe entre 3 et 12 pour cent, selon la température et l'espèce
(Mackie et al., 1971). En fait au point isoélectrique, la
protéine se trouve dan un état moins stable et avec de
légères variations du pH du milieu, elle précipite
facilement. Une modification artificielle (à l'aide de facteurs
physiques et chimiques) de la charge de la molécule protéique et
la rupture de l'enveloppe aqueuse qui l'entoure, entraînent sa
précipitation.
Ainsi, dans une solution saturée de sel, la plus grande
partie des protéines précipitent dans le muscle (Crean, 1961
cité par Mackie et al., 1971). Dyer et al., (1950)
cités par Mackie et al., (1971) ont de même
précisé que le taux d'extraction maximum des protéines
s'obtient à pH compris entre 7 et 9 et qu'il diminue très
rapidement de pH 6 à pH 5, valeur voisine du pH isoélectrique de
la plupart des protéines.
C'est pourquoi, les processus de fermentation
réalisés avec une concentration de sel inférieure à
20 pour cent, une certaine proportion de protéines se dissout selon le
pH et la température ; mais à des concentrations plus
élevées, la quasi-totalité des protéines
précipitent (Del Valle et Nickerson, 1967 cités par Mackie et
al., 1971).
Sur la figure 10, nous signalions déjà, vu
l'oscillation des valeurs de pH du système (ces valeurs se situant entre
6.72 et 7.11), l'instabilité de ce dernier. Les résultats de taux
de protéines obtenus confirment les différentes
démonstrations des chercheurs, quant à la solubilisation des
protéines sous l'action du chlorure de sodium (53,31%, et 52,06%) mais
à 20% de NaCl, nous avons 45.81% de protéine totale ; ce qui
représente une chute de taux par rapport aux deux premiers
résultats obtenus respectivement à 10% et 15% de salage.
C'est-à-dire que les protéines, à un salage de 20% de
NaCl, ont précipité ; ce qui confirme les résultats
de Del Valle et Nickerson (1967) cités par Mackie et al., 1971,
et à ce taux de salage, nous pouvons extraire plus facilement les
protéines natives.
En rapportant par simulation les taux de protéine
totale obtenus sur la matière sèche première à
l'échantillon, on évalue mieux cette précipitation. Il
ressort que la concentration des protéines dans les filets de poissons
augmente de manière progressive par rapport aux filets frais sans sel,
et aussi avec le taux de sel appliqué. Cette concentration grandissante
pourrait s'expliquer par l'élimination d'eau du filet après ajout
et pénétration de sel dans le muscle. L'élimination d'eau
libre entraîne, la réduction du poids total et donc un meilleur
pourcentage des autres constituants comparé au pourcentage dans le filet
frais. De plus, la sortie de l'eau liée aux molécules
protéiques achève la diminution du poids total tout en provoquant
l'agglomération des protéines dans les filets.
CONCLUSION et
PERSPECTIVES
Au terme de cette étude sur l'approche physico-chimique
du pouvoir conservatoire du sel dans le cas du salage de Pseudotolithus
senegalensis, il se révèle que c'est la forme ionique du
NaCl qui est à la base de la conservation. Ce qui voudrait dire que le
suivi de l'évolution de la conductivité serait un moyen
acceptable pour expliquer le pouvoir physico-chimique de la conservation par le
sel. La production et dispersion des ions sodium et chlorure dans la chair a eu
pour effet de réduire la disponibilité de l'eau et
d'empêcher la solubilisation des protéines.
Nous observons plusieurs modifications dans la chair du
poisson avant la stabilisation. Ces modifications se résument
en :
- l'augmentation de la conductivité et la
réduction simultanée de la teneur en eau dans les filets pendant
les 20 premières heures qui ont suivies le salage ;
- la diminution de la conductivité qui dure 1430min,
1100min et 705min respectivement dans les filets salés à 20, 15
et 10% ; s'accompagnant de l'élimination en partie de l'eau
liée et l'agglomération des protéines de la
chair ;
- une phase de stabilisation réactionnelle autant en
termes de production que de consolidation d'ions.
L'application à plusieurs lots atteste qu'aussi bien la
qualité initiale du poisson que les concentrations en sel
appliquées ont une incidence sur la profondeur des observations. Plus le
poisson sera de bonne qualité initiale plus appréciables seront
les résultats. Il ressort aussi que les concentrations en sel de 15 et
20% donnent de meilleurs résultats mais il est important de noter que
les résultats de salage concluants exigent une matière
première de très bonne qualité. Quelque soit le taux de
sel appliqué nous retiendrons que la qualité la matière
première ne peut être améliorée car le sel n'a pas
d'effet correcteur mais prévient simplement l'altération
biochimique en stabilisant les constituants du poisson.
Par ailleurs, les aliments conservés étant
destinés à l'alimentation humaine, il est indispensable qu'ils
répondent à un certain nombre de règles
hygiéniques. De ce fait, il s'avère nécessaire de coupler
à cette étude phyico-chimique du pouvoir conservateur du sel
d'autres travaux qui contribueront à approfondir ce premier travail.
Nous suggérons donc qu'il soit ouvert des recherches sur :
- L'évaluation microbiologique de la qualité des
filets salés : effet du chlorure de sodium sur les
microorganismes ;
- La régulation des proportions de sel dans les
produits de salage afin d'éviter aux consommateurs les maladies
liés au excès de sel ;
- L'application des règles de Good Hygiene Practice
(GHP) par les manipulatrices afin d'assurer la qualité sanitaire des
produits de salaison.
PROBLEMES RENCONTRES ET
SUGGESTIONS
Au cours la réalisation de ce travail, nous nous
confrontés à plusieurs sortes de difficultés, dont
certaines méritent d'être mentionnées ici. Le
problème majeur est celui du financement, mais à
côté de celui-ci, nous pouvons aussi citer :
- le manque de laboratoires ou de matériel de
laboratoire ;
- l'absence de documentation adéquate ;
- la non initiation à la recherche et la
rédaction des documents scientifiques.
Nous suggérons aux responsables de la formation ainsi
qu'au corps administratif de l'Université Abomey-Calavi pour lever cet
handicap de :
- créer des laboratoires de recherche, de les
équiper et de suivre de près l'entretien et la maintenance de ces
équipements ;
- mettre sur pied une bibliothèque fournie dans tous
les domaines d'éducation ;
- introduire dans son programme des cours d'initiation
à la recherche et rédaction des documents scientifiques.
REFERENCES BIBLIOGRAPHIQUES
(vancouver)
Livres
1. BIMBENET JJ, et LONCIN M, 1995, Base du génie
des procédés alimentaires, Masson, Paris,
304pp.
2. CHEFTEL J.C. et CHEFTEL H., 1976, (septième tirage
1992), Introduction à la biochimie et à la technologie des
aliments, Tome I, Tech & Doc Lavoisier, Paris, 381pp.
3. DAUDIN J. D., 1988,
congélation, in Technologie de la
viande et des produits carnés, chapitre 1, Girard
J.P., Tech & Doc, Paris, ancienne
édition.
4. HENNEN G., 1998, Biochimie 1er cycle; cours
et questions de révisions, Dunod, 271pp.
5. JEANTET R., CROGUENNEC T., SCHUCH P. et BRULÉ G.,
2006, Science des aliments :
Biochimie-Microbiologie-Procédés-Produits, Vol 1 :
Stabilisation biologique et physico-chimique, Tech & Doc, Paris, 383
pp.
6. JEANTET R., CROGUENNEC T., SCHUCH P. et BRULÉ G.,
2007, Science des aliments : Biochimie - Microbiologie -
Procédés - Produits, Vol 2 : Technologie des produits
alimentaires, Tech & Doc, Paris, 456 pp.
7. KARAPETIANTZ M. 1978, Initiation à la
théorie de phénomènes chimiques, Mir, Moscou,
335pp.
8. KOSSTYLEV E. F. et RYABOCHAPKO A. P., 1982, La
biochimie de matières premières halieutiques, Industrie
légère et alimentaire, Moscou, 144pp
9. LINDEN G., LORIENT D., 1994, Biochimie
agro-industrielle : Valorisation alimentaire de la production
agricole, Masson SA, Paris, 367pp.
10. MESCLE J-F., 2002, Additifs conservateurs
(antibactériens, antifongiques), in Additifs
et auxiliaires de fabrication dans les industries agroalimentaires,
191-205, Multon J-L , Tec & Doc Lavoisier, Paris, dernière
édition.
11. NOUT R., HOUNHOUIGAN J. D. et BOEKEL T. V., 2003, Les
aliments Transformation, Conservation et Qualité, Backhuys publishers,
Germany, 257pp.
12. PICLET G. 1987, cité par Jeantet et al.,
2007.
13. SAINCLIVIER M., 1985, L'industrie alimentaire
halieutique, Vol 2 : des techniques ancestrales à leurs
réalisations contemporaines, Ecole nationale supérieure
agronomique de Rennes.
Ouvrages
1. AOAC, (Association of official Analytical Chemists), 1984,
Official methods of analysis, 14th edition, Washington DS.
2. Chemical Education Material Study, 1965, la chimie,
Montréal, Canada, 468pp.
3. CLINQUART A., 2005, Les techniques de conservation des
aliments, Université de Liège,
Faculté de Médecine vétérinaire (secteur
Technologie), 25 pp.
4. Codex Alimentarius, 1985, CODEX STAN 150-1985.
5. GRET, 1993, Conserver et transformer le poisson.
Collection le « Point Sur » Guide technique et
méthodologique. La Fayette, Paris, 286pp.
6. JOHANSEN S., MAGNUSSEN O. M. et NORDTVEDT T. S., 1996,
cités par MAPAQ, 2002 Guide de l'élevage des
salmonidés. Fascicule 12 : transformation. 132pages.
7. LANGE N. A., 1967, Handbook of chemistry, tenth edition, Mc
Graw-Hill Book Compagny, New york.
8. MACKIE I. M., HARDY R. et HOBBS G., 1971, Poisson
fermenté et produits dérivés, Rapport de la FAO sur
les pêches, N° 100, Rome.
9. MAPAQ, 2002 Guide de l'élevage
des salmonidés. Fascicule 12 : Transformation. 132pages
10. SOUMILLION J. Ph. et GHINS M., 2002, Les
électrolytes et les non-électrolytes dans les solutions
aqueuses,
Thèse
1. DOSSOU-YOVO P., 2002, Justification biochimique de
l'amélioration de procédés traditionnels de production du
Lanhouin au Bénin. Thèse de Doctorat ès Science
technique, soutenue à Astrakkan, Russie
Articles et journaux scientifiques
1. CREAN, 1961, cité par Mackie et al.,
1971.
2. DYER, 1942, cité par Mackie et al.,
1971.
3. KAUSHIK S.J., 1997, Nutrition - Alimentation et composition
corporelle chez le poisson, Cahiers de Nutrition et de
Diététique, Vol. 32 (2), p. 100-106
4. KECHAOU N., 2007, Etude de paramètres de
qualité et de migration de l'eau et du NaCl au cours du séchage
et du salage de poisson salé et/ou non salé.
5. LABOURET P., 2002, Le sel : Bienfaits et
méfaits.
Internet
1. BAYARD Damien, 2007, Conservation
alimentaire
http://www.da-b.info/conservation-alimentaire/chaud.php.
2. Encyclopædia Universalis, 2007,
www.paraschool.com
dissolution_du_chlorure_de_sodium.htm France SA
3. FAO (Food Agriculture Organisation) documents techniques
sur la pêche - T351, 1999, par Zugarramurdi A., Parin M.A. et Lupin H
.M., Ingénierie économique appliquée aux industries de la
pêche, Rome, 268pp. Disponible sur
www.fao.org/DOCREP/003/V8490F/v8490f04.htm
4. INRA (Institution National de la Recherche Agronomique)
2006. Teneur en sel dans les saumons fumés, (fiche de presse
info),
www.inra.fr/layout/set/print/presse/teneur_sel_du_saumon_fume
5.
http://www.belgochlor.be/fr/PDF_FR/WITBOEKF.PDF, livre blanc du
chlore, 2004, Bruxelles. (Consulté le 6 septembre 2007)
6. STANSBY, 1962 ; LOVE, 1970, cités par FAO (Food
Agriculture Organisation), La qualité et son évolution dans
le poisson frais.
www.fao.org/DOCREP/003/V7180F/V7180F05.HTM
7. TESTANIERE A., 2001, Chimie - Classe de première
- Série S (Leçon 3). Disponible sur :
http://www.perso.orange.fr/physique.chimie/15Chimie.htm
(consulté le 29 Août 2007).
8. TOLIARA M., 1997, Guide pour le Traitement et la
Valorisation du Poisson - Torolalana Momba ny Fikarakarana ny Fia, projet
intégré de la pêche traditionnelle sur la cote sud.
Disponible sur :
www.fao.org/docrep/field/379683.htlm
(consulté le 16 septembre 2007)
9. VALENCIENNES A., 1833, Pseudotolithus senegalensis
(Otolithe sénégalais).Disponible sur :
http://filaman.ifm-geomar.de/Summary/SpeciesSummary.php?id=432&lang=frensh.
ANNEXES
Annexe 1 :
Conductivités spécifiques des solutions de
KCl
Tableau 6 :
Conductivités spécifiques des solutions de KCl
|
è(°C)
|
0,002N
|
0,005N
|
0,01N
|
0,05N
|
|
15 239
|
585
|
1147
|
5404
|
|
16 244
|
598
|
1173
|
5527
|
|
17 249
|
611
|
1199
|
5651
|
|
18 255
|
625
|
1225
|
5775
|
|
19 260
|
638
|
1251
|
5889
|
|
20 266
|
651
|
1278
|
6024
|
|
21 271
|
665
|
1305
|
6149
|
|
22 276
|
678
|
133
|
6275
|
|
23 8
|
692
|
1359
|
6402
|
|
24 87
|
706
|
1386
|
6529
|
|
25 293
|
720
|
1413
|
6656
|
|
26 299
|
734
|
1440
|
6784
|
|
27 304
|
748
|
1468
|
6912
|
|
28 310
|
763
|
1496
|
7041
|
|
29 316
|
777
|
1524
|
7170
|
|
30 321
|
792
|
1552
|
7300
|
|
31 327
|
807
|
1580
|
7430
|
|
32 333
|
821
|
1609
|
7561
|
|
33 339
|
837
|
1637
|
7692
|
|
34 345
|
852
|
1666
|
7824
|
|
35 351
|
867
|
1695
|
7956
|
Source : Lange, 1967.
Annexes 2 : Dosage de l'azote d'une
matière protidique par la méthode de Kjeldahl
Commencer la manipulation par la mise en route de la
minéralisation de la substance organique. Pendant la
minéralisation, doser la solution de H2SO4
diluée par une solution de (NH4)2SO4 de
titre connu.
1. Minéralisation de
l'échantillon
Peser avec précision 1.0g la matière organique
et placer chaque prise d'essai dans un matras. Ajouter une pincée de
catalyseur (mélange de KCl de CuSO4 et de
sélénium) et 2mL d'H2SO4 concentrée.
Dans un autre matras qui servira de témoin, mettre 2mL
d'H2SO4 concentrée et le catalyseur.
Porter le matras à ébullition et maintenir
celles-ci jusqu'à coloration identique à celle du témoin
(solution limpide). Placer le matras dans un panier métallique et
laisser refroidir.
2. Dosage de la solution de
H2SO4 diluée au moyen de la technique du
micro-Kejldhal
2.1. Description sommaire de
l'appareil ;
Il comprend :
- un générateur de vapeur
- une ampoule à vidange
- un matras à réaction
- un réfrigérant
2.2. Dosage de la solution de
H2SO4
Dès le début de la manipulation, refaire l'eau
dans le générateur de vapeur en le remplissant au maximum au
¾. Porter à ébullition modérée. Quand la
vapeur ne sera pas utilisée pour le dosage, la laisser s'échapper
dans l'atmosphère. Avant chaque dosage, il est nécessaire de
rincer 3 fois à l'eau distillée le matras à
réaction.
Mettre dans un bécher parfaitement sec et propre
environ 20mL de solution d'acide borique à 2% et deux gouttes de
réactif de Tashiro (solution d'alcool saturée de Rouge de
méthyl, contenant quelques gouttes de bleu méthylène
à 1%).
Introduire par l'entennoir de remplissage 2mL de solution de
(NH4)2SO4 de référence. Rincer
l'entennoir avec un peu d'eau distillée afin d'entraîner tout le
(NH4)2SO4 dans le matras. Ajouter au moyen
d'une éprouvette environ 15mL de NaOH 10N puis rincer rapidement
l'entennoir avec de l'eau distillée.
Boucher la sortie de vapeur vers l'atmosphère. La
vapeur d'eau entraîne m'ammoniac qui va se condenser dans le
réfrigérant et dès que la première goutte atteint
la solution d'acide borique, la coloration de l'indicateur vire au vert. A
partir de ce moment laisser la distillation se poursuivre pendant 10min au
moins de façon à entraîner toute l'ammoniaque.
* 1 Lanhouin :
poisson fermenté, salé et séché au Bénin
* 2
Métora : poisson salé, fumé et
séché au Sénégal
* 3 Ketiakh :
poisson braisé, salé, séché et fumé au
Sénégal.
* 4 Tambadiang :
poisson salé, séché au Sénégal.
* 5 Sali : poisson
salé, séché au Sénégal.
* 6 Makayabu :
poissons salé et séché au Congo
* 7 Nicolas Appert (1749-1841)
Industriel français, créateur de l'industrie des conserves
alimentaires.
* 8 Louis Pasteur (1822-1895)
Chimiste et biologiste français
* 9 Symbiose : fusion plus
ou moins intime de deux êtres vivants d'espèces
différentes
* 10 Parasite : organisme
vivant qui se nourrit, s'abrite ou se reproduit aux dépens d'un autre
* 11 Voir la norme Codex pour
le sel de qualité alimentaire en annexe.
* 12
Antiagglomérant : catégorie d'additifs agissant sur la
texture de l'aliment.
| 


