II-3 Quelques tests électrochimiques sur les
échantillons préparés par les deux
méthodes :
La stabilité chimique de l'oxyde
La3-xCaxMn2O7 a été
étudiée d'abord en suivant le potentiel en fonction du temps,
ensuite la variation de l'intensité du courant en fonction du potentiel
en mode anodique
Préparation des électrodes :
En premier lieu, on prépare des pastilles de 14 mm
de diamètre sous une pression de 10 bars, en suite on prépare les
électrodes. Le Contact électrique avec les électrodes est
assuré par un fil de cuivre. Ce dernier est soudé à l'aide
de la laque d'argent. On augmente la résistance mécanique de ce
contact ainsi que l'isolation électrique avec l'araldite qui couvre une
face entière de la pastille.
Mode opératoire :
Les tests sont réalisés dans une cellule
électrochimique composée d'une électrode de
référence en KCl, d'un contre électrode qui est une grille
de platine dont le rôle est de diminuer les chutes ohmiques et d'une
électrode de travail préparée précedemment,
l'ensemble est introduit dans une solution de KOH (1N).
La cellule est liée à un potentiostat
contrôlé par ordinateur, le logiciel VOLTAMASTER4
permet d'effectuer les expériences voulues.
Dans notre cas, nous avons d'abord étudier la
stabilité de l'électrode en suivant son potentiel à
l'abondant E en fonction du temps t pendant 12 heures.
Ensuite on a réalisé les courbes de
l'intensité du courant en fonction du potentiel en fixant comme point
de départ le potentiel de stabilité de l'électrode
à partir des courbes E=f (t). Dans un intervalle de potentiel
[E0-E0+500] mV.
Résultat et discussion :
Les courbes obtenues sont tracées à l'aide de
logiciel origine. Ils sont représentés sur les
figures suivantes :
Chapitre II
Résultats et discussion
-
Fig (II-10) : courbes E=f (t) des trois
électrodes préparer par la méthode Péchini en
milieu KOH (1 N).
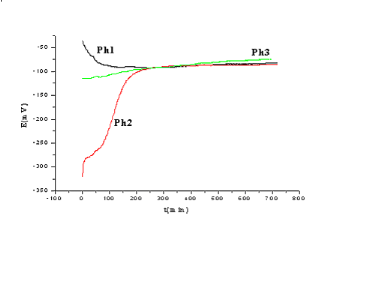
Fig (II-11) : courbes i=f (E) des trois
électrodes préparer par la méthode Péchini en
milieu
KOH (1N).
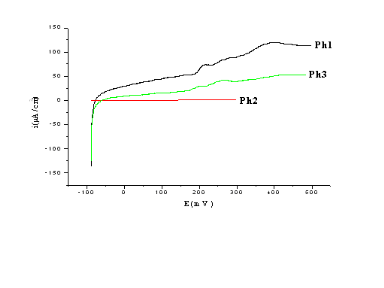
Fig (II-11) : courbes i=f (E) des trois
électrodes préparer par la méthode Péchini en
milieu KOH (1N).
Chapitre II
Résultats et discussion
Fig (II-12) : courbes E=f (t) des trois
électrodes préparées par la méthode Citrate en
milieu KOH (1 N).
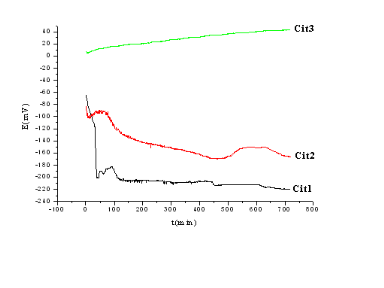
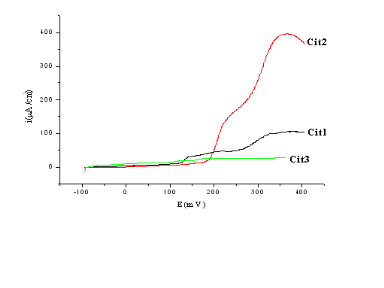
Fig (II-13) : courbes i=f (E) des trois
électrodes préparer par la méthode Citrate en milieu
KOH (1N).
Chapitre II
Résultats et discussion
Nous remarquons que pour les électrodes de Ph1,
Ph2, Ph3, le potentiel varie rapidement les premières heures, puis il se
stabilise ce qui peut montrer une variation au niveau de l'interface du solide
(stoechiométrie par exemple), on remarque que Ph1, Ph2, Ph3 tendent
vers une même valeur du potentiel (E -80mV) à partir d'un
même temps (t=240mn).
On peut dire d'après ces courbes que l'interface
de Ph1 et Ph2 tend vers celle de Ph3.
Au cours de ces tests, une grande quantité d'un
gaz se dégage en surface des électrodes et aucune
dégradation de l'oxyde n'est observée. Cela indique que les
électrodes sont stables au moins pendant 24 heures.
Pour les courbes intensité potentiel on remarque
une oxydation au sens de Lewis, le courant commence à augmenter
rapidement dés qu'on change le potentiel ensuite cette augmentation
commence à freiner ce qui montre un phénomène de
passivation qui peut être du à une hydroxylation de notre
échantillon.
Pour les échantillons préparées
par la méthode citrate, la variation du potentiel à l'abandon en
fonction du temps a diminué pour se stabiliser à partir d'un
même temps pour les échantillons cit1 et cit2 avec un potentiel
différent ce qui laisse dire que l'interface aussi reste
différent.
En ce qui concerne les courbes
intensité-potentiel, le comportement de ces échantillons est
complètement différent des précédents,
l'intensité du courant reste inchangée pendant une période
de 150mV, eÿÿuite l'oxydation prend place et l'intensité
commence à augmenter, et elle est plus rapide et plus importante dans
l'échantillon cit2 que l'échantillon cit1.
Pour les échantillons cit3 et ph2 nous
soupçonnons un mauvais contact au niveau des électrodes
préparées puisque le courant reste inchangé et
égale à 0.
| 


