Master Recherche Ingénierie des Systèmes
de Santé
Spécialité : Méthodes d'Analyse
des Systèmes de santé
Promotion 2008-2009
Impact de la mise sous traitements
antirétroviraux sur les
comportements sexuels des personnes vivant
avec le VIH/Sida
au Cameroun (Cohorte Stratall-ANRS 1 2110)
Mémoire réalisé du 9
février au 30 juin 2009
A l'observatoire régional de la santé,
INSERM U912
(Sciences Economiques et Sociales, Systèmes de
santé, Sociétés)
23, rue Stanislas
Torrents, 13006 Marseille
Sous la direction de:
Maria Patrizia
CARRIERI
(Ingénieur de Recherches,
INSERM)
Soutenu publiquement le 9 juillet 2009
Par Gilbert
NDZIESSI
Jury de soutenance
Pr. Roland SAMBUC
Pr. Pascal AUQUIER
Pr. Nicolas Tanti HARDOUIN Mme Maria Patrizia CARRIERI
Dédicaces
Ce mémoire est dédié à mon
regretté frère ainé Dominique NDZIESSI
Tu as quitté ce monde prématurément au
moment ou toute la famille NDZIESSI avait encore besoin de toi. Ce
mémoire représente un des aboutissements de nos projets familiaux
mais surtout des encouragements que tu m'as prodigués tout au long de la
vie. Merci « Yaya MIMI ». Regrets eternels!
Remerciements
Aux membres du Jury
Vous me faites l'honneur d'accepter de juger ce travail.
Veuillez trouvez ici l'expression de mon profond respect, de ma
reconnaissance et de mon admiration pour vos qualités professionnelles
et humaines.
Je tiens particulière à remercier madame Maria
Patrizia CARRIERI de l'Unité 912 de l'INSERM pour m'avoir honoré
en acceptant de diriger ce travail,
Je remercie tous ceux sans qui ce mémoire ne serait pas
ce qu'elle est, aussi bien par les discussions que j'ai eues la chance d'avoir
avec eux, leurs suggestions ou contributions. Je pense ici en particulier
à Fabienne MARCELLIN et Sylvie BOYER,
Merci également à Jérôme, Julien et
Camélia pour leur disponibilité et l'aide précieuse quant
à l'utilisation des logiciels statistiques,
Merci à monsieur le professeur Jean Paul MOATTI Directeur
de l'unité 192 de l'INSERM pour l'intérêt qu'il a
manifesté pour notre travail et nos perspectives académiques,
A mes collègues de la promotion
Je vous dis que notre train est arrivé en gare et courage
pour la suite de la marche,
J'adresse mes sincères remerciements au personnel
enseignant et non enseignant du master 2 Recherche « Méthodes
d'Analyse des Systèmes de Santé » pour leur encadrement et
soutien tout au long de notre de notre formation à la faculté de
médecine de Marseille.
A mon Epouse Adurée Gisèle NDZIESSI
Trouves ici un des fruits de nos ambitions. Avec amour,
A mes enfants, Ulrich ESSA NDZIESSI et Geoffry Stevens Eman
NDZIESSI Que ce travail puisse vous servir d'exemple. Je vous aime tous les
deux,
A ma mère Angélique ESSA
Pour sa ténacité et sa fièvre de croire
toujours que tout est encore possible,...encore possible,
A ma famille, pour son soutien multiforme,
Enfin, je désire saluer avec respect et gratitude
l'équipe de l'essai Stratall pour leur travail auprès des
patients vivant avec le VIH au Cameroun,
Je ne saurai terminer sans exprimer ma gratitude aux personnes
vivant avec le VIH/sida participant à l'essai ANRS au Cameroun.
Liste des abréviations et acronymes
ARV Antirétroviraux
ANRS Agence Nationale française de Recherche sur le Sida
et les hépatites virales
CENAME Centrale Nationale d'Approvisionnement en
Médicaments et consommables
Médicaux Essentiels
CTA Centre de Traitement Agrée (des PVVS au Cameroun)
ESTHER Ensemble pour une Solidarité Thérapeutique
Hospitalière en Réseau
GEE Generalized Estimating Equations
HRSH Homme ayant des rapports sexuels avec les hommes
INSERM Institut Nationale français de la Santé et
de la Recherche Médicale
IST Infection Sexuellement Transmissible
OMS Organisation Mondiale de la Santé
ONUSIDA Programme Commun des Nations Unies sur le VIH/Sida
ORS Observatoire Régionale de la Santé
PVVS Personne Vivant avec le VIH/Sida
Sida Syndrome d'Immunodéficience Acquise
UPEC Unité de Prise en Charge (des PVVS au Cameroun)
VIH Virus de l'Immunodéficience Humaine
WHOQOF-HIV Echelle de mesure de la qualité de vie des PVVS
élaboré par l'OMS
Listes des figures et tableaux
Contexte général
Figure 1. Prévalence du VIH observée chez les
adultes en Afrique en 2007
Tableau 1. Nombre de régimes ARV de première ligne
selon la région du monde en 2007
Description de l'échantillon
Tableau 2. Caractéristiques sociodémographiques de
l'échantillon des 437 PVVS inclus dans
l'essai Stratall au Cameroun (3 juin 2006 au 26 février
2008)
Tableau 3. Caractéristiques de la vie de couple,
activité sexuelle et données médicales des
PVVS à l'inclusion dans l'essai Stratall au Cameroun.
Tableau 4. Connaissances et croyances vis-à-vis du
VIH/Sida et des antirétroviraux parmi les
patients VIH positif à l'inclusion dans l'essai Stratall
au Cameroun, 2006-2008
Tableau 5: Caractéristiques sociodémographiques,
comportementales et médicales des 242
PVVS ayant eu au moins une fois des rapports sexuels au cours
du suivi, essai Stratall, Cameroun. Données à l'inclusion
(période du 3 juin 2006 au 26 février 2008)
Consommation d'alcool et qualité de
vie
Tableau 6: Consommation d'alcool chez les PVVS 12 mois
après initiation du traitement ARV,
essai Stratall.
Tableau 7: Résultats de la comparaison des scores moyens
du WHOQOL-HIV bref OMS
(échelle à 6 domaines) entre l'inclusion et le
12e mois du traitement par ARV chez des PVVS au Cameroun, essai
Stratall (n=437).
Régression logistique
Tableau 8: Déterminants des comportements sexuels à
risque (rapports sexuels non protégés
avec un partenaire stable sérodiscordant, de statut
inconnu ou avec partenaire occasionnel) chez les PVVS avant initiation de la
thérapie par ARV, analyse par régression logistique (N=129)
Generalized Estimating Equations (GEE)
Tableau 9. Déterminants des comportements sexuels à
risque dans les 3 mois précédant les
visites chez des patients camerounais infectés par le
VIH et ayant repris l'activité sexuelle sous ARV au cours de 12 mois de
suivi : Analyse univariée basées sur un modèle GEE
logistique (cohorte STRATALL, 113 patients, 267 visites)
Tableau 10. Facteurs associés aux comportements sexuels
à risques dans les 3 mois précédant les
visites chez des patients camerounais infectés par le
VIH et ayant repris l'activité sexuelle sous ARV au cours de 12 mois de
suivi: Analyse multivariée basée sur un modèle GEE
logistique (cohorte STRATALL, 113 patients, 267 visites)
Tableau 11. Déterminants des comportements sexuel à
risques dans les 3 mois précédant les
visites chez des patients camerounais infectés par le VIH:
Analyse univariée basée sur un modèle GEE logistique
(cohorte Stratall, 242 patients, 396 visites)
Tableau 12. Facteurs associés aux comportements sexuels
à risque dans les 3 mois précédant les
visites chez des patients camerounais infectés par le VIH:
Analyse multivariée basée sur un modèle GEE logistique
(cohorte STRATALL, 242 patients, 396 visites)
SOMMAIRE
Introduction 1
Première partie: Contexte general 2
1.1-Epidémiologie du VIH/Sida 2
1.2-L'accès aux antirétroviraux en Afrique 2
1.3- ARV et comportements sexuels à risque parmi les PVVS:
Etat des lieux 4
1.3.1-Dans les pays développés 5
1.3.2-En Afrique subsaharienne 7
1.4-Organisation de l'accès aux ARV au Cameroun 9
1.5-Présentation de l'essai STRATALL 10
1.5.1-Contexte général et objectifs 10
1.5.2-Recueil des données 10
1.5.3-Descriptif général des données 11
Deuxième partie: Etude de l'impact des ARV sur les
comportements
sexuels it risque 12
I-Problématique 12
II-Hypothèses de recherche 12
III-Objectifs de l'étude 13
3.1-Objectif général 13
3.2-Objectifs spécifiques 13
IV. Méthodologie 13
4.1-Description des données 13
4.2-Régression logistique 13
4.3-Analyse de l'évolution des comportements sexuels et de
la qualité de vie 14
4.4-Analyse sur données répétées:
Generalized Estimating Equations (GEE) 15
4.5-Informatisation des données 15
V-Résultats 16
A-Description de l'échantillon 16
1-Taille de l'échantillon 16
2-Caractéristiques sociodémographiques 16
3-Caractéristiques de la vie de couple, activité
sexuelle et données médicales 17
4-Connaissances et croyances vis-à-vis du VIH/Sida et des
ARV 17
5-Description de l'échantillon des 242 PVVS sexuellement
actifs 18
B-Evolution des comportements sexuels, de la consommation
d'alcool et de la qualité de vie 20
1-Comportements sexuels 20
2-Consommation d'alcool 20
3-Qualité de vie 20
C-Régression logistique 21
1-Déterminants des comportements sexuels à risques
chez les PVVS sans HAART (n=129) 21
D-Analyse sur données
répétées: Generalized Estimating Equations (GEE)
23
1-Déterminants des comportements sexuels à risque
sous ARV (n=113) 23
2-Lien entre ARV et comportements sexuels à risque (N=242)
25
VI-Discussion 28
6-1. Activités sexuelles chez les PVVS 28
6.2. Evolution des comportements sexuels, sociaux et
qualité de vie 28
6.3. Facteurs associés aux comportements sexuels à
risques avant ARV 28
6.4. Facteurs associés aux comportements sexuels à
risque sous ARV 29
6.5. Lien ARV et comportements sexuels à risque 29
Conclusions 32
Validité interne des résultats 32
Conclusions en termes de santé publique 32
Perspectives de recherche 32
Bibliographie 34
Annexes 36
Annexe 1 : Questionnaire de l'essai Stratall (inclusion) 37
Annexe 2 : Document OMS sur le calcul de la qualité de vie
des PVVS 55
Annexe 3 : Carte du Cameroun 64
Introduction
Le VIH/Sida figure parmi les principales causes de
décès dans le monde. L'ONUSIDA a estimé à 33
millions le nombre de personnes vivant avec le VIH/Sida (PVVS) en 2007 dans le
monde, et à 2 millions le nombre de décès liés
à cette infection. Le nombre de nouvelles infections au cours de cette
année était de 2,7 millions, dont 1,9 millions en Afrique
subsaharienne. L'accès aux traitements antirétroviraux (ARV) des
PVVS dans ce continent reste très faible en raison d'obstacles majeurs
que sont le nombre limité de médecins (par exemple un
médecin pour 10083 habitants au Cameroun) et leur répartition
géographique et institutionnelle déséquilibrée en
faveur des grandes villes et des hôpitaux centraux. Par ailleurs,
l'impossibilité des gouvernements à augmenter significativement
le nombre de médecins ne permet pas de rendre davantage disponible les
services de prise en charge médicale des PVVS, surtout en milieu rural.
Devant ces difficultés, l'Organisation Mondiale de la Santé (OMS)
a proposé une approche de prise en charge
«allégée» pour favoriser l'accès aux ARV
à grande échelle dans les pays à ressources
limitées.
Les rapports sexuels non protégés parmi les PVVS
recevant des ARV sont un sujet de préoccupation majeure en santé
publique en raison du risque de transmission du VIH et surtout des souches de
virus devenues résistantes aux traitements. Nonobstant des études
contradictoires, une méta-analyse réalisée en 2004 dans
les pays du Nord conclut que la fréquence des comportements sexuels
à risque n'est pas plus élevée chez les PVVS recevant des
ARV, et ce même lorsque la charge virale plasmatique est
indétectable. En revanche, l'impact de la thérapie
antirétrovirale sur les comportements sexuels à risque chez les
PVVS en Afrique est à ce jour peu documentée. Le nombre
élevé de nouvelles infections à VIH en Afrique
subsaharienne montre la persistance de la chaîne de transmission de ce
virus. Dans ce contexte, nous nous proposons à travers cette
étude de déterminer si le traitement ARV, en améliorant la
qualité de vie des PVVS, favoriserait un relâchement dans
l'adoption de comportements sexuels à risque dans le contexte d'un
accès au traitement ARV à grande échelle en Afrique
subsaharienne.
Ce document décrit les résultats d'une
étude épidémiologique réalisée dans le cadre
du mémoire de fin de cycle de Master 2 Recherche en
«Ingénierie des Systèmes de Santé» à
l'Observatoire Régional de la Santé (ORS)
Provence-Alpes-Côte d'Azur, au sein de l'Unité 912 de l'INSERM. Il
comporte deux parties principales: la première décrit le contexte
général de l'étude, et la seconde l'étude de
l'impact des traitements ARV sur les comportements sexuels à risque chez
les personnes infectées par le VIH au Cameroun. Cette deuxième
partie comporte les points suivants : exposé de la problématique,
hypothèse de recherche, objectifs de l'étude, méthodologie
de recherche, résultats obtenus et discussion des résultats. Ce
document se termine par une conclusion en trois phases (validité interne
des résultats, conclusions en termes de santé publique et
perspectives de recherche) suivi de la bibliographie et des annexes.
Premiere partie: Contexte general
1.1-Epidémiologie du VIH/Sida
Le VIH/Sida figure parmi les principales causes de
décès dans le monde. Selon l'ONUSIDA [1], en 2007, 33 millions
[30,3 - 36,1 millions] de personnes vivaient avec le VIH/Sida (PVVS). Le nombre
de personnes infectées au cours de cette année était de
2,7 millions [2,2-3,2 millions], et 2 millions [1,8 - 2,3 millions] de
décès dus au Sida ont été enregistrés.
L'Afrique subsaharienne reste la région la plus sévèrement
touchée. Selon les estimations de la source sus citée, il y a eu
1,9 millions [1,6-2,1 millions] de nouvelles infections dans cette
région en 2007, ce qui porte à 22 millions [20,5-23,6 millions]
le nombre de personnes vivant avec le VIH/Sida, soit près des deux tiers
(67%) du total mondial. Trois quarts (75%) des décès dus au sida
s'y sont produits en 2007. Enfin, plus de 60% des PVVS sont des femmes et 90%
des enfants infectés de moins de 15 ans et décédés
d'une maladie liée au sida vivent en Afrique subsaharienne.
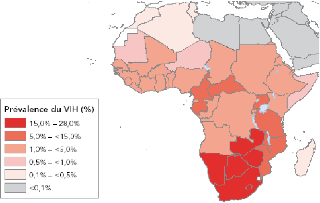
Figure 1. Prévalence du VIH
observée chez les adultes en Afrique en 2007 (Source: ONUSIDA, 2008)
1.2-L'accès aux antirétroviraux en
Afrique
Les premiers programmes africains structurés
d'accès aux antirétroviraux (ARV) n'ont vu le jour qu'en 1998
dans de rares pays comme le Sénégal, la Côte d'Ivoire et
l'Ouganda. Ces programmes ont montré l'efficacité du traitement
ARV en Afrique, avec des résultats comparables à ceux obtenus
dans les pays du Nord en termes de survie, d'efficacité virologique,
immunologique et clinique, d'observance, d'émergence des
résistances et de toxicité [2, 3]. Les résultats de ces
projets pilotes ont répondu aux objections d'ordre biomédical
quant à l'utilisation des ARV en Afrique (efficacité sur les
souches non B du VIH-1, effets indésirables et leur gestion,
observance). Cependant, de très nombreux autres obstacles s'opposaient
à la large diffusion de ces traitements tels que le coût des
médicaments bien sûr mais aussi celui du suivi biologique, ou le
manque d'infrastructures médicales et de personnel médical
formé.
Progressivement, en dépit de ces contraintes,
l'accès au traitement s'est étendu à bien d'autres pays
africains dans le cadre soit de programmes gouvernementaux soit d'initiatives
privées (dont celles des ONG). Toutefois, la plupart du temps, cet
accès est resté limité aux capitales ou aux grandes
villes. La prise en charge recommandée y est le plus souvent très
proche de celle des pays du Nord, reposant sur un suivi effectué par des
médecins avec des bilans biologiques complets pour évaluer
l'efficacité et la tolérance du traitement.
L'accès au traitement reste néanmoins encore
très limité en 2004: seulement 8 % du total des patients
africains ayant une indication immédiate de traitement recevaient des
ARV (310.000 sur 4 millions) cette année. L'OMS et l'ONUSIDA plaident
pour une extension rapide de cet accès et visaient un objectif de 3
millions de personnes traitées à la fin de l'année 2005
[4]. Si les résultats obtenus étaient encourageants ( la
couverture par la thérapie antirétrovirale était
passée de 7% en 2003 à 20% en 2005), le nombre de 3 millions de
personnes sous ARV n'avait pas été atteint à cette date
[5]. A la fin de l'année 2006, l'OMS estimait en Afrique subsaharienne
à 4,8 millions et 1,3 millions respectivement le nombre de PVVS ayant
besoin des ARV et le nombre de PVVS recevant la thérapie ARV soit un
taux de couverture de 28% [6].
Si certains obstacles initiaux à l'accès aux ARV
en Afrique ont progressivement été levés, d'autres
persistent surtout dans la perspective de l'extension de l'accès au
traitement. En particulier, le nombre limité de médecins (par
exemple, un médecin pour 10.083 habitants au Cameroun), leur
répartition géographique et institutionnelle
déséquilibrée en faveur des grandes villes et
hôpitaux centraux, et l'impossibilité des gouvernements à
augmenter significativement le nombre de médecins ne permet pas de
rendre davantage disponible des services de prise en charge médicale des
personnes infectées par le VIH, surtout en milieu rural. Sans parler de
la mesure de la charge virale limitée, au mieux, aux grands centres
urbains et les possibilités de tests de résistances aux ARV
quasi-inexistantes, la disponibilité d'examens plus simples tels que la
mesure des lymphocytes T CD4 ou même d'examens de biochimie demeure
problématique. Même lorsqu'ils sont disponibles, le coût de
ces bilans dissuade le plus souvent les patients de les effectuer.
Paradoxalement, la disponibilité des régimes
thérapeutiques en Afrique demeure la plus faible au monde alors que
cette région du monde concentre plus de 90% des besoins en ARV. A titre
d'illustration, en 2007, l'Europe occidentale disposait de 47 régimes
thérapeutiques de première ligne pour 760.000 patients contre 3
régimes en Afrique subsaharienne pour 22,5 millions patients comme le
montre le tableau suivant.
|
Tableau
|
1. Nombre de régimes ARV de
première ligne selon la région du monde en 2007
|
|
|
Région
|
Nombres d'enfants et adultes VIH+
2001
|
Nombres d'enfants
et adultes VIH+
2007
|
Nombre de régimes
de 1ere lignes pour
traiter 90%
de
patients
|
|
Afrique subsaharienne
|
20.900.000
|
22.500.000
|
3
|
|
Moyen-Orient et Afrique du Nord
|
300.000
|
380.000
|
|
|
Asie du sud et du Sud-est
|
3.500.000
|
4.000.000
|
3
|
|
Asie de l'Est
|
420.000
|
800.000
|
3
|
|
Océanie
|
26.000
|
75.000
|
|
|
Amérique latine
|
1.300.000
|
1.600.000
|
11
|
|
Europe occidentale et centrale
|
620.000
|
760.000
|
47
|
Source: synthèse faite à partir
des rapports et données ONUSIDA
Compte tenu de l'ampleur des besoins, des contraintes, des
disparités criardes en matière d'accès aux ARV dans les
pays à ressources limitées et en particulier en Afrique
subsaharienne, une «approche allégée» de prise en
charge médicale des personnes infectées par le VIH a
été proposée par l'OMS [7] afin de faciliter
l'accès aux ARV d'un plus grand nombre de PVVS dans ce continent. La
stratégie d'allègement du suivi des patients permet de ne pas
avoir à mettre en place des infrastructures coûteuses. Le suivi
thérapeutique n'est en effet pas réalisé sur la base
d'analyses de marqueurs biologiques ou immunologiques, mais à partir de
constatations cliniques. En outre, l'implication de personnel
paramédical dans le suivi clinique des patients, en alternance avec le
médecin, permet de mettre en place une prise en charge moins intensive
en personnel médical.
En pratique, l'approche «allégée» qui
représente un enjeu majeur pour le «passage à
l'échelle» est encore peu répandue en Afrique
subsaharienne.
1.3- ARV et comportements sexuels à risque parmi
les PVVS: Etat des lieux
Le concept de comportement sexuel à risque chez les
PVVS, par rapport à la transmission sexuelle du VIH, est utilisé
dans ce travail pour décrire notamment des situations où une
personne qui a habituellement un comportement sexuel à moindre risque
commence à se livrer à des activités sexuelles à
haut risque, soit parce qu'elle pense qu'elle n'est plus à risque de
transmettre le virus ou que, même si elle s'infecte, les
conséquences néfastes seront minimes.
Les comportements sexuels à risque, parmi les personnes
recevant les traitements antirétroviraux (ARV) sont
un sujet de
préoccupation majeure en raison du risque de transmission du VIH. La
littérature publiée sur
l'impact des ARV sur les comportements
sexuels est abondante et concerne souvent les pays développés
et
surtout les pratiques sexuelles des hommes ayant des rapports
sexuels avec les hommes (HRSH). De façon générale, les
données disponibles dans la littérature ne fournissent pas de
réponse absolue à la question de l'association entre ARV et
comportements sexuels à risque chez les PVVS. D'une part, il y a en
effet des études qui ont trouvé une association entre les ARV et
les comportements sexuels à risque, et d'autre part des études
qui n'ont pas démontré cette association.
Généralement, le lien entre les ARV et les
comportements sexuels à risque était identifié soit par
l'observation d'une augmentation de nouveaux cas d'infections sexuellement
transmissibles (IST) chez les patients prenant des ARV (augmentation
supposée être due à des pratiques sexuelles à
risque), soit par une fréquence élevée des pratiques
sexuelles à risque chez les patients prenant des ARV.
Nous allons présenter, dans un premier temps, les
études réalisées dans les pays développés et
dans un second temps les études réalisées en Afrique
subsaharienne.
1.3.1-Dans les pays développés
Dans les pays développés, une
méta-analyse qui a étudié en 2004 si le fait d'être
sous thérapie ARV était associé à un risque accru
de se livrer à des rapports sexuels non protégés chez les
PVVS a conclu que dans les pays du nord les ARV favorisent des comportements
sexuels à moindres risques [8].
Malgré les résultats de cette
méta-analyse, il existe des études qui ont mis en évidence
un lien entre le traitement par ARV et les comportements sexuels à
risques chez les PVVS. Par exemple, dans une étude transversale
réalisée en 1998 [9] portant sur un échantillon de 379
HRSH aux États-Unis, 18% des hommes déclaraient avoir des
rapports sexuels sans risque moins souvent depuis que des traitements ARV
efficaces étaient devenus disponibles. Par ailleurs, en Australie, une
étude transversale réalisée à Sydney et à
Melbourne en 1998 [10] sur un échantillon de 4.090 gays a montré
une relation significative entre la pratique des relations anales non
protégées avec des partenaires occasionnels et le fait
d'être d'accord que «une personne séropositive qui est sous
une combinaison de thérapie a peu de chances de transmettre le
VIH».
A Chicago, dans une étude réalisée sur un
échantillon de 548 HRSH (219 VIH négatif et 329 VIH positif), la
pratique des rapports sexuels anaux non protégés était
associée à la diminution de l'inquiétude au sujet de la
transmission du VIH sous ARV. En effet, parmi les sujets VIH négatif,
les rapports anaux non protégés étaient significativement
plus souvent rapportés par les hommes déclarant que les ARV
avaient amoindri leurs inquiétudes quant à contracter le VIH et,
chez les hommes VIH positif, les rapports anaux non protégés
étaient significativement plus souvent rapportés par les hommes
déclarant que les ARV avaient réduit leurs inquiétudes
quant à la transmission du VIH à leurs partenaires [11]. Une
autre étude américaine réalisée à San
Francisco [12], sur un échantillon représentatif de HRSH, avait
constaté qu'avec l'augmentation de l'usage des ARV parmi les HRSH vivant
avec le Sida (4% en 1995 versus 45% en 1999), le pourcentage de HRSH ayant des
rapports sexuels anaux sans protection ainsi que le multipartenariat sexuel
avaient considérablement augmenté (24% en 1996 versus 45% en
1999).
Une étude de cohorte réalisée à
Amsterdam aux Pays-Bas sur un échantillon 1500 HRSH avait observé
qu'après 1996, année où les ARV étaient devenus
disponibles, le nombre des PVVS qui avaient des rapports sexuels non
protégés avait augmenté comparativement à la
période allant de 1992 à1996. Cela a été
illustré par une importante augmentation du nombre de cas de gonococcie
ano-génitale [13].
Une étude réalisée en Alabama aux
Etats-Unis d'Amérique (USA) sur un échantillon de HRSH avait
trouvé une association significative entre l'utilisation des ARV
inhibiteurs de la protéase et la pratique des rapports sexuels non
protégés [14]. Une étude réalisée à
Philadelphie aux USA sur une cohorte de 220 PVVS des deux sexes avait quant
à elle mise en évidence une forte association entre l'optimisme
quant à l'efficacité du traitement et les pratiques sexuelles
à haut risque, et ce indépendamment du sexe [15.]
Une étude réalisée à San Francisco
qui avait utilisé les données du programme de surveillance des
IST avait conclu que depuis que les ARV étaient devenus disponibles,
l'incidence des IST dans la population des PVVS sous ARV était
passée de 0,66% en 1995à 1,32% en 1998 [16].
Nous avons relevé dans la littérature une autre
série d'études qui ne montrent aucune association entre les ARV
et les pratiques sexuelles à risque chez les PVVS. Il s'agit par exemple
d'une étude transversale réalisée à Londres sur un
échantillon de 420 HRSH sexuellement actifs. Vingt deux pour cent des
hommes avaient eu des relations anales non protégées avec au
moins un partenaire occasionnel au cours du mois précédant
l'étude. Le nombre moyen de partenaires sexuels et la fréquence
des IST étaient moins élevés chez les personnes qui
étaient sous ARV par rapport aux personnes qui ne l'étaient pas
[17]. Une étude transversale auprès de 248 HRSH
réalisée à San Francisco (USA) a montré que les ARV
n'étaient pas associés aux pratiques sexuelles à risque
[18].
Dans une étude réalisée sur un
échantillon de 316 patients infectés par le VIH (hommes et
femmes), tous noirs américains, dont 133 étaient sous ARV, aucune
association entre le traitement et les pratiques sexuelles à risque n'a
été trouvée [19].
En France, dans une étude longitudinale portant sur un
échantillon de 188 PVVS sexuellement actifs injecteurs de drogues (dont
34 sous ARV), la proportion de PVVS rapportant au moins une fois des rapports
sexuels non protégés dans les six derniers mois était
significativement moins élevée chez les patients sous ARV que
chez les patients non traités (respectivement: 47,1% versus 23,5%,
P=0,008. La prise de risque sexuel était significativement plus faible
dans le groupe sous ARV comparé au groupe sans ARV (OR 0,4 ; IC95%
0,17-0,95). Les facteurs associés aux comportements sexuels à
risque étaient les suivants: être de sexe féminin,
déclarer des pratiques d'injection à moindres risques, consommer
de l'alcool, et enfin, avoir des relations sexuelles avec un partenaire stable
[20]. En 2004, en France, une étude chez les PVVS injecteurs de drogues
portant sur un échantillon de 192 patients traités par ARV qui
avaient rapporté des partenaires sexuels occasionnels au moins une fois
pendant la période de suivi avait obtenu que 134 patients (70%) avaient
déclaré au moins une fois des rapports sexuels à risque
avec des partenaires occasionnels [21].
1.3.2-En Afrique subsaharienne
Si de façon générale, les ARV
«protègent» de la prise de risque sexuel dans les pays du
Nord, quelle est la situation dans les pays du Sud?
Les ARV sont disponibles dans les pays
développés depuis 1996, alors qu'ils ne sont disponibles en
Afrique récemment. On supposait qu'en Afrique, les ARV pouvaient avoir
un effet de type «risque moral» chez les bénéficiaires
( c'est-à-dire pratiquer des rapports sexuels non protégés
sachant que la transmission du VIH est faible sous ARV) et favoriser ainsi la
propagation du VIH et surtout des souches virales parfois devenues
résistantes aux ARV [22].
Malgré ces inquiétudes, peu d'études ont
été réalisées en Afrique subsaharienne. Certes, la
littérature sur la thématique est abondante dans les pays
développés mais les résultats obtenus ont une pertinence
limitée en Afrique où la transmission du VIH a lieu
principalement lors de rapports hétérosexuels.
La quasi-totalité des études
réalisées montre une fréquence élevée des
comportements sexuels à risque parmi les PVVS. La fréquence de
ces comportements apparaît toutefois moins élevée
après l'initiation des ARV et ces derniers ne sont pas souvent
associés à la pratique des rapports sexuels à risque. Par
exemple, en Côte d'Ivoire, dans une étude transversale
réalisée en 2003 sur un échantillon de 711 personnes (164
PVVS sous ARV et 547 PVVS sans ARV), la moitié des sujets (n=334)
étaient sexuellement actifs pendant les 6 mois précédant
l'étude dont 43,7% avaient déclaré avoir eu au moins un
rapport sexuel non protégé. Selon les conclusions de cette
étude, les facteurs associés aux pratiques sexuelles à
risque étaient: le fait de ne pas recevoir de traitement
antirétroviral, un diagnostic de séropositivité
récent (< 9 mois), le fait de ne pas connaître le statut
sérologique du partenaire sexuel principal, une consommation
élevée d'alcool et l'absence de participation aux dépenses
du ménage [23].En Afrique du Sud, une étude portant sur un
échantillon de 149 PVVS (44 hommes et 105 femmes) âgées de
18 à 55 ans avait obtenu que, sur un total de 101 sujets (68%)
sexuellement actifs au cours des 6 derniers mois, un peu plus de la
moitié n'avait pas utilisé le préservatif lors du dernier
rapport sexuel. Les facteurs associés à la pratique des rapports
sexuels non protégés étaient les suivants: un
dépistage récent de l'infection à VIH, le fait de ne pas
connaître le statut VIH du partenaire et la consommation de l'alcool
avant les rapports sexuels [24].
En Ouganda, dans une étude transversale portant sur un
échantillon de 723 PVVS, 48% des sujets étaient sexuellement
actifs dans les 6 mois précédant l'étude. La pratique de
rapports sexuels protégés avec le partenaire stable était
plus fréquente dans le groupe ARV que dans le groupe sans ARV (OR 2, IC
95 % 1,07-2,30) [25]. Une étude prospective de cohorte,
réalisée dans les régions rurales de l'Ouganda entre mai
2003 et décembre 2004, publiée en 2006, sur un échantillon
de 926 adultes infectés par le VIH, a conclu que six mois après
l'initiation du traitement ARV, la fréquence des comportements sexuels
à risque était réduite de 70% (rapport de risque
ajusté 0,3; IC95% 0.2-0.7, p = 0,002) et la mise sous ARV était
associée à cette réduction [26]. Les résultats
d'une étude transversale, réalisée au KwaZulu-Natal, en
Afrique du Sud, qui étudiait les facteurs prédictifs de rapports
sexuels non protégés chez 152 patients VIH positif a
montré que 50% des sujets étaient sexuellement actifs dont 30%
avaient signalé des rapports sexuels non protégés. La
consommation d'alcool, l'expérience des rapports
sexuels forcés, les rapports sexuels avec partenaire séropositif
ou avec partenaire occasionnel étaient associés à la
pratique des rapports sexuels non protégés [27]. Dans une autre
étude sud africaine réalisée au Cap sur un
échantillon de 924 personnes séropositives (520 sous ARV et 404
en attente de traitement ARV), la moitié des PVVS (43,2%)
déclarait ne pas utiliser de préservatifs lors de leur dernier
rapport sexuel. La perception ambivalente de la relation entre les ARV et la
transmission du VIH, la non divulgation du statut VIH positif au partenaire
étaient des facteurs associés aux rapports sexuels non
protégés [28].
Deux études réalisées à Mombassa
au Kenya ont signalé des taux plus élevés de prise de
risque sexuel chez les PVVS avant la mise sous ARV qu'après. Dans une
étude portant sur un échantillon de 234 adultes (83 hommes et 149
femmes) dont l'âge moyen était de 37 ans, 47,5% des PVVS
étaient sexuellement actifs dans les 12 mois précédant
l'étude. Après 12 mois de traitement ARV, la proportion des
sujets signalant des rapports sexuels non protégés était
passée de 53,3% à 28,0%. Les facteurs associés à la
pratique de rapports sexuels non protégés chez les patients sous
ARV étaient les suivants: la non-divulgation du statut VIH aux
partenaires, ne pas être marié ou vivant en concubinage, le
vécu de la stigmatisation, la dépression et un indice de masse
corporelle <18.5 [29]. Une autre étude comparait les comportements
sexuels à risque de 179 personnes vivant avec le VIH/Sida et recevant un
traitement ARV avec ceux de 143 PVVS sans ARV et recevant une thérapie
préventive avec le cotrimoxazole/isoniazide. Dans cette étude,
45% des participants se sont déclarés sexuellement actifs au
cours des six derniers mois. Les participants recevant la thérapie
préventive étaient significativement plus susceptibles de
signaler un nombre de partenaires supérieur ou égal à 2
(13% vs 1%, P = 0,006) ainsi que des symptômes d'IST [30].
En Afrique subsaharienne, dans la littérature
disponible, seule une étude longitudinale réalisée sur une
courte période de 6 mois en 2005 sur un échantillon de 600 PVVS
(300 sous ARV et 300 sans ARV) dans une unité de soins ambulatoires et
de conseils en Côte d'Ivoire montrait que le traitement ARV était
associé à la pratique des rapports sexuels non
protégés chez les PVVS [31]. En effet, dans les 6 mois
précédant l'étude, la proportion des PVVS déclarant
avoir eu au moins un rapport sexuel non protégé était
significativement plus élevée dans le groupe de PVVS sans ARV que
dans le groupe avec ARV (27% versus 20,4%.). Après six mois de suivi, il
a été observé une augmentation significative de la
fréquence de rapports sexuels non protégés chez les PVVS
sous ARV (20,4% versus 30,1%) alors qu'aucune différence significative
n'a été observée dans le groupe de PVVS sans ARV (27,0%
versus 28,8%) mais aussi entre les deux groupes (P=0,48). Dans cette
étude, l'âge (<40 ans) et la consommation d'alcool
étaient des facteurs associés à des pratiques sexuelles
à risque.
1.4-Organisation de l'accès aux ARV au
Cameroun
Au Cameroun, entre 1997 et 2000, l'introduction des ARV s'est
faite de manière progressive, en fonction des moyens financiers des
patients. A partir de 2000, de profonds changements sont intervenus allant vers
une organisation au niveau national de la distribution des ARV, une
rationalisation des prescriptions et une diminution du coût des
traitements. En avril 2001, des négociations menées par le
gouvernement camerounais avec l'industrie pharmaceutique (programme ACCESS) ont
permis à la Centrale Nationale d'Approvisionnement en Médicaments
et Consommables Médicaux Essentiels (CENAME) d'obtenir des
trithérapies pour un montant allant de 76 à 114 Euros par mois,
selon les schémas thérapeutiques. Enfin, en août 2001, le
Ministère de la Santé Publique recommande l'utilisation des
génériques, avec entre autres la Triomune® comprenant d4T
(stavudine), 3TC (lamivudine) et névirapine (4,5 euros par mois à
partir du 1er octobre 2004). Le Comité National de Lutte contre le Sida
a par ailleurs organisé depuis juin 2000 plusieurs ateliers nationaux de
consensus sur le suivi biologique des PVVS, les critères de mise sous
ARV et les modalités de fonctionnement des centres de dispensation des
ARV. De nombreuses formations nationales impliquant des médecins
prescripteurs, aussi bien que des paramédicaux et volontaires
d'association ont été organisées.
Le Cameroun bénéficie du soutien de la Banque
Mondiale, du Fonds Mondial pour le Sida, la Tuberculose et le Paludisme, ainsi
que de partenariats hospitaliers dans le cadre du programme «Ensemble pour
une Solidarité Thérapeutique Hospitalière en
Réseau» (ESTHER) initié par le Ministère de la
Santé français.
Dans la période de 2004 à 2005, 21 Centres de
Traitement Agréés (CTA) ont été ouverts par le
Ministère de la Santé Publique pour la dispensation des ARV
répartis dans les chefs-lieux des 10 provinces du pays. Le bilan
biologique de mise sous traitement et de suivi est très proche de celui
des pays riches incluant notamment la mesure de la charge virale VIH et des
lymphocytes T CD4 tous les 6 mois (approche de référence). Outre
le coût de ces examens (58 euros pour la charge virale et 19 euros pour
les lymphocytes T CD4), leur accessibilité reste problématique
surtout pour la charge virale qui ne peut en effet être
réalisée qu'à Yaoundé, la capitale du pays (tous
les CTA viennent d'être équipés pour le comptage des
lymphocytes T CD4). Au total, 9000 personnes bénéficiaient d'un
traitement ARV de 2004 représentant 11 % seulement des personnes
éligibles. Face à cette situation, le Ministère de la
Santé Publique a opté pour une décentralisation de la
prise en charge vers les hôpitaux de district en utilisant les
critères simplifiés de l'OMS pour la mise sous traitement et le
suivi des patients. Depuis, plus d'une centaine d'unités de prise en
charge (UPEC) assurent la prise en charge des PVVS au sein des hôpitaux
de district. Dans ce contexte, le Ministère de la Santé Publique
camerounais a demandé, en 2004, à l'Agence Nationale
française de Recherche sur le VIH/Sida et les hépatites (ANRS)
d'accompagner son programme d'accès à grande échelle aux
ARV. L'ANRS a répondu par la mise en place d'un programme de recherche
opérationnel et d'un essai clinique dénommé STRATALL.
1.5-Présentation de l'essai STRATALL
1.5.1-Contexte général et
objectifs
L'essai STRATALL de l'ANRS (ANRS12110), mené en
partenariat avec le programme ESTHER, a pour but d'évaluer
l'efficacité une approche de prise en charge des PVVS
«allégée», recommandée par l'OMS, par rapport
à l'approche de référence, utilisée dans les pays
du Nord. Il s'agit d'un essai comparatif d'intervention, randomisé, sans
insu sur l'intervention, de non infériorité, mené dans 9
hôpitaux de district de la province du Centre au Cameroun (Mbalmayo,
Mfou, Nanga-Eboko, Obala, Sa'a, Monatélé, Bafia,
Ndikiniméki, Ayos). L'approche «allégée» ne
devant pas apporter de meilleurs résultats que l'approche de
référence, un essai de non infériorité permettra de
déterminer si cette approche est équivalente à l'approche
de «référence» (et donc si elle peut être
recommandée en l'état) ou si elle lui est inférieure (et
donc si elle doit être modifiée).
L'objectif principal de cet essai ANRS est de comparer le gain
en lymphocytes T CD4 chez des patients recevant un traitement ARV selon
l'approche «allégée» et chez ceux traités avec
l'approche de référence.
La sélection des patients a été faite par
randomisation et les patients reçoivent les ARV recommandés et
disponibles dans le programme national. Seuls les patients répondant aux
critères d'inclusion fixés par l'ANRS participent à
l'étude. L'inclusion des patients a eu lieu entre juin 2006 et avril
2008. L'étude prendra fin en avril 2010. Les patients sont suivis
pendant 24 mois. La fréquence des consultations systématiques est
bimensuelle pendant le premier mois (J15 et M1) puis trimestrielle (M3, M6, M9,
M12, M15, M18, M21 et M24). Au cours de ces visites de suivi, des
prélèvements sont effectués pour la mesure de la charge
virale et du taux de lymphocytes T CD4.
Cet essai s'intègre à un programme de recherche
associant également des évaluations de l'impact social,
comportemental et économique de la mise en place du programme national
d'accès au traitement.
1.5.2-Recueil des données
Les données de l'essai Stratall ont été
recueillies auprès des patients sur la base d'un questionnaire
administré en face à face à l'inclusion (J0), au
3e mois (M3), au 6e mois (M6), au 12e mois
(M12) et au 24e mois (M24). L'essai est en cours au Cameroun depuis
2006 et se terminera en avril 2010. Le questionnaire utilisé par
Stratall a été adapté de celui utilisé par l'INSERM
dans le cadre d'une étude portant sur l'accès au traitement
antirétroviral et les comportements sexuels chez les patients
infectés par le VIH en Côte d'Ivoire [23]. Ce questionnaire
comportait 6 modules qui permettaient d'obtenir les informations sur les
caractéristiques socio-démographiques et économiques, la
consommation de soins, la consommation de substances, les comportements
sexuels, la santé perçue-qualité de vie et l'observance
thérapeutique. Pour les besoins de notre étude, seules les
données sur les caractéristiques socio-démographiques,
cliniques liées au VIH, comportementales, et psychosociales ont
été exploitées.
1.5.3-Descriptif général des
données
L'essai Stratall inclut des camerounais vivant avec le VIH et
mis sous ARV dans 9 hôpitaux du district sanitaire du centre du pays,
inclus dans l'étude par randomisation. Deux bras ont été
ainsi constitués: le bras «approche allégée» et
le bras «approche de référence». La base des
données individuelle crée dans le cadre de l'essai Stratall,
présente des informations relatives à 447 PVVS inclus entre juin
2006 et avril 2008.
Les critères d'inclusion des patients pour cette
étude sont les suivants:
- Etre Homme ou femme, âgé(e) d'au moins 18 ans
- Habiter dans le district sanitaire de l'hôpital de
suivi
- Etre infecté par le VIH-1 (groupe M)
- Répondre aux critères de mise sous ARV dans les
hôpitaux de district tels que définis par le protocole camerounais
et recommandés par l'OMS ( annexe 3)
o Stade III ou IV (classification OMS) quel que soit le taux de
lymphocytes totaux o Stade II (OMS) et taux de lymphocytes totaux =
1200/mm3
- Patient acceptant d'être suivi mensuellement et
traité pendant au moins 24 mois, selon les modalités du
protocole
- Consentement éclairé signé
Les critères de non inclusion sont les suivants:
- Infection à VIH-1 groupe O ou N, ou VIH-2
- Primo-infection à VIH-1
- Tuberculose pulmonaire en cours de traitement et taux de
lymphocytes totaux >1200/mm3
- Cancer évolutif ou lymphome malin (à l'exception
du sarcome de Kaposi cutanéo-muqueux) - Maladie psychiatrique
évolutive
- Insuffisance hépato-cellulaire
- Antécédent de traitement antirétroviral
- Traitement par corticostéroïde de longue
durée, traitement immuno-modulateur, ou autre thérapeutique
expérimentale
- Grossesse
- Non respect prévisible du protocole
Deuxieme partie: Etude de l'impact des ARV sur les
comportements sexuels a risque
I-Problématique
Les ARV entraînent une baisse de la mortalité et
de la morbidité chez les PVVS [1]. Mais, l'une des conséquences
inattendues des ARV est qu'ils peuvent accroître les comportements
sexuels à risque. Les études portant sur l'impact des
comportements sexuels chez les PVVS sous thérapie ARV sont
contradictoires. D'une part, des études ont mise en évidence que
les ARV étaient liés aux comportements sexuels à risque
parmi les PVVS [8, 9, 10, 11, 12, 13, 14,15] et d'autre part le contraire [16,
17, 18,19]. Ces études ont toutes concerné les pays riches
où les rapports hétérosexuels représentent le mode
dominant de transmission du VIH.
De façon générale, l'impact des ARV sur
les comportements sexuels dans les pays du Sud est peu documenté. Peu
d'études ont concerné le continent Africain nonobstant le passage
en cours à grande échelle de l'accès aux ARV. Les quelques
données disponibles sur ce contient sont contradictoires. D'une part,
les ARV ne sont pas associés aux comportements sexuels à risque
comme démontré dans la quasi-totalité des études
disponibles, toutes transversales, réalisées en Côte
d'Ivoire [23 ], en Afrique du sud [24], en Ouganda [25], en Afrique du sud [27,
28 ], au Kenya [29,30]. Dans une étude longitudinale
réalisée en Ouganda, les patients VIH positif recevant les ARV ne
présentaient pas de risque accru des rapports sexuels non
protégés [26]. Une autre étude longitudinale
réalisée en Côte d'Ivoire avait conclu que la mise sous ARV
était liée à la prise de risques sexuels chez les
bénéficiaires [31].
A notre connaissance, les études portant sur l'impact
des ARV sur les comportements sexuels à risque menées
jusqu'à ce jour sur le continent africain concernent soit des
comparaisons entre PVVS sous ARV et PVVS sans ARV (études
transversales), soit des comparaisons de PVVS sous ARV avant et après
initiation du traitement. Aucune étude longitudinale n'a
été à ce jour menée pour étudier l'impact
des ARV sur les comportements sexuels à risque dans le contexte de
l'accès aux ARV à grande échelle en Afrique
subsaharienne.
Sur la base des données collectées dans le cadre
de l'essai Stratall, nous nous proposons de déterminer si la mise sous
ARV favorise ou non les comportements sexuels à risque chez les PVVS
dans le contexte du programme national d'accès aux ARV au Cameroun.
II-Hypothèses de recherche
Le traitement ARV, en améliorant la qualité de
vie des PVVS, favoriserait un relâchement des comportements de
prévention du risque de transmission du VIH dans le contexte
d'accès à grande échelle aux ARV en Afrique
subsaharienne.
III-Objectifs de l'étude
3.1-Objectif général
Déterminer l'impact de la mise sous traitement ARV sur les
comportements sexuels à risque parmi les patients de l'essai STRATALL au
Cameroun.
3.2-Objectifs spécifiques
- Identifier les facteurs associés aux comportements
sexuels à risque chez les PVVS dans les 3 mois précédant
l'initiation de la thérapie ARV;
- Evaluer l'évolution des comportements sexuels à
risque chez les PVVS mis sous thérapie ARV et suivis pendant 12 mois;
- Identifier les facteurs associés aux comportements
sexuels à risque chez les PVVS ayant repris une activité sexuelle
sous thérapie ARV durant la première année de suivi;
- Mesurer le lien entre la mise sous ARV et les comportements
sexuels à risque chez les PVVS durant la première année de
suivi.
IV. Méthodologie
4.1-Description des données
Parmi les 437 PVVS ayant des données disponibles dans
la base, notre analyse a porté sur le sous échantillon des 242
PVVS sexuellement actifs au moins une fois au cours du suivi. D'abord, nous
avons comparé la distribution des caractéristiques de
l'échantillon selon le sexe. Pour comparer les variables qualitatives,
nous avons utilisé le test du chi-deux ou le test de Fischer en cas de
données non appariées, et le test de McNemar en cas de
données appariées. Pour comparer les variables quantitatives,
nous avons utilisé le test de Student (apparié ou non
apparié) ou, en cas de non normalité de la distribution, le test
de U de Mann Whitney - Wilcoxon.
La description des données a concerné
l'échantillon à l'inclusion (Baseline). Les
résultats descriptifs sont présentés soit sous forme de
tableaux commentés, soit simplement sous forme de commentaires.
4.2-Régression logistique
Afin d'identifier les facteurs associés aux
comportements sexuels à risque chez les PVVS au cours des 3 mois avant
l'initiation de la thérapie ARV, nous avons utilisé des
modèles de régression logistique sur les données
recueillies à l'inclusion L'analyse a porté sur le sous
échantillon des 129 sujets se déclarant sexuellement actifs au
cours des 3 derniers mois avant l'inclusion. Les patients n'ayant pas
notifié de rapport sexuel pendant les 3 derniers mois ont
été considérés comme sexuellement abstinents et
n'ont pas été pris en compte dans l'analyse.
Nous avons défini la variable réponse
«comportement sexuel à risque» (variable dichotomique: oui =1;
non=0) comme le fait de déclarer avoir eu au moins un rapport sexuel non
protégé avec un(e) partenaire principal(e) sérodiscordant,
de statut VIH inconnu ou avec un(e) partenaire occasionnel(le) au cours des 3
derniers mois. Les patients sexuellement actifs déclarant des rapports
sexuels non protégés avec un partenaire principal stable
séropositif au cours de 3 derniers mois ont été
considérés comme à moindre risque de transmettre le VIH.
La variable d'intérêt a été choisie en tenant compte
des études antérieures sur la thématique [23, 26, 31].
Nous avons dans un premier temps procédé
à des analyses univariées. Chaque variable explicative à
été croisée avec la variable réponse et des odds
ratios (OR) avec leurs intervalles de confiance à 95% ont
été calculés afin d'estimer la force d'association de
chacune des variables explicatives avec la variable réponse. Sur la base
des données de la littérature, nous avons testé les
variables explicatives suivantes: âge, sexe, lieu de résidence,
niveau d'éducation, religion, consommation d'alcool, connaissance du
mode de transmission principal du VIH (rapports sexuels non
protégés), connaissance de l'origine virale du VIH/sida, statut
matrimonial, délai depuis le diagnostic VIH positif, statut du
partenaire principal, divulgation du statut VIH positif au partenaire stable,
fait d'avoir des partenaires occasionnels, fait d'avoir déjà eu
des relations sexuelles forcées, fréquence moyenne des rapports
sexuels par mois, fait d'avoir au moins un enfant, désir d'avoir
d'autres enfants, score moyen de qualité de vie (WHOQOL HIV bref).
Nous avons également testé les variables
cliniques suivantes: le stade clinique de l'infection VIH (OMS) et le taux de
CD4 (données uniquement disponibles à l'inclusion). Les
données sur la charge virale n'étaient pas disponibles au moment
de l'analyse (les mesures de charge virale seront effectuées en
rétrospectif à la fin de l'essai).
Seules les variables qui avaient une P-valeur
inférieure ou égale à 0,20 lors de l'analyse
univariée ont été incluses dans l'analyse
multivariée. Nous avons ensuite utilisé une méthode
descendante pas à pas, basée sur le rapport du maximum de
vraisemblance (Hosmer: Applied logistic regression), pour sélectionner
les variables significatives dans le modèle final avec un risque alpha
de première espèce de 5%.
4.3-Analyse de l'évolution des comportements
sexuels et de la qualité de vie
Nous avons étudié l'évolution des
comportements sexuels, de la consommation d'alcool, et de la qualité de
vie durant la première année de traitement ARV. Ces deux
dernières variables ont été retenues du fait de leur
association avec la pratique des rapports sexuels sans préservatifs chez
les PVVS [23,24].
De façon plus précise, nous nous sommes
intéressés aux variables suivantes:
Comportements sexuels à risque
- Nombre de rapports sexuels à risque au cours des 3
derniers mois
Consommation d'alcool
- Consommation d'alcool
- binge drinking (consommation excessive d'alcool en une seule
occasion)
Evolution de la qualité de vie
Six domaines de la qualité de vie ont été
explorés (échelle WHOQOL-HIV bref de l'OMS):
- qualité
de vie physique (douleur et gêne, énergie et fatigue, sommeil et
repos)
- qualité de vie psychologique (sentiments positifs et
négatifs, estime de soi, image du corps, perception des capacités
cognitives)
- niveau d'indépendance (mobilité,
dépendance vis-à-vis du traitement, capacité à
effectuer les tâches quotidiennes)
- relations sociales (relations interpersonnelles, soutien moral,
activité sexuelle)
- environnement (satisfaction par rapport à : la
sécurité physique, le logement, la pollution, le bruit, la
possibilité d'obtenir les informations utiles dans la vie quotidienne,
l'accessibilité et la qualité des soins, les activités de
loisir, les transports)
- spiritualité/religion
L'évolution du score moyen pour chaque domaine a
été mesurée. Le document de l'OMS décrivant
l'échelle WHOQOL-HIV Bref se trouve en annexe. Pour établir les
comparaisons entre J0 et M12, trois tests ont été utilisés
: le test de Mc Nemar pour les variables dichotomiques, le test
d'homogénéité marginale pour les variables
catégorielles à plus de deux modalités et le test de
Wilcoxon pour les variables continues.
4.4-Analyse sur données
répétées: Generalized Estimating Equations
(GEE)
Afin d'analyser l'impact de la mise sous ARV sur les
comportements sexuels à risque après ajustement sur les variables
de confusion potentielles, nous avons réalisé une analyse de type
régression logistique basée sur la méthode des
équations d'estimation généralisée (GEE,
generalized estimating equations), qui permet de tenir compte de la
corrélation entre des données issues de mesures
répétées au cours du temps. Cette analyse a
concerné le sous échantillon des sujets déclarant
être sexuellement actifs à au moins une visite durant le suivi.
Les visites avec prise de risque ont été comparées avec
les visites sans prise de risque. La méthode utilisée pour la
sélection des variables dans le modèle multivarié est la
même que précédemment (cf. point 4.2).
4.5-Informatisation des données
La base de données Stratall a été
produite par les statisticiens du projet à l'INSERM U912 à
Marseille sur le logiciel SPSS 15.0 version Windows (SPSS Inc, Chicago,
Illinois, USA). Nous avons utilisé le logiciel SPSS 15.0 et le logiciel
STATA 10.0 (StataCorp LP, College Station, Texas, USA) pour l'analyse des
données.
V-Résultats
A-Description de l'échantillon
1-Taille de l'échantillon
La base de données individuelle créée
dans le cadre de l'essai Stratall au Cameroun, disponible pendant pour la
période de notre stage, présente des informations relatives
à 447 personnes vivant avec le VIH. Pour la description
générale de l'échantillon, 10 observations dont la
variable «sexe» n'était pas mentionnée ont
été exclues. Notre travail a porté sur un
échantillon de 437 sujets.
2-Caractéristiques
sociodémographiques
Notre échantillon de 437 PVVS comporte 307 femmes
(70,3%) et 130 hommes (29,7%). L'âge médian est de 37 ans. Le plus
haut niveau d'étude atteint est le primaire pour 45,8% des individus
(36,9% chez les hommes et 49,4% chez les femmes). Les niveaux secondaires et
supérieurs concernent quant à eux 13,3% de l'échantillon
et les femmes sont moins représentées à ces deux niveaux
que les hommes (9,0% versus 24,0%). Cette différence de niveau
d'éducation entre les femmes et les hommes est significative
(P<0,001).
Les religions les plus représentées sont la
religion catholique (69,9%) et la religion protestante (15,6%).
La consommation d'alcool en grande quantité en une
occasion au moins une fois par mois (binge drinking) concerne 13,3%
sur l'échantillon total (20,8% des hommes versus 9,4% des
femmes; P=0,003).
Tableau 2. Caractéristiques
sociodémographiques de l'échantillon des 437 PVVS inclus dans
l'essai Stratall au Cameroun (3 juin 2006 au 26 février 2008)
Total Hommes Femmes P

N % N % N %
Age moyenne (écart- type)
|
37 (+/-10)
|
|
40(+/-8)
|
|
36
|
(+/-11)
|
<0,0001
|
|
Niveau d'éducation
|
|
|
|
|
|
|
|
|
Jamais allé(e) à l'école
|
10
|
2,3
|
0
|
0
|
10
|
3,3
|
<0,001
|
|
Primaire
|
200
|
45,8
|
48
|
36,9
|
152
|
49,5
|
|
|
Secondaire 1e cycle
|
153
|
35,0
|
44
|
33,8
|
109
|
35,5
|
|
|
Secondaire 2e cycle
|
51
|
11,7
|
24
|
18,5
|
27
|
8,8
|
|
|
Supérieur
|
8
|
1,8
|
6
|
4,6
|
2
|
0,7
|
|
|
Autres formations
|
15
|
3,4
|
8
|
6,2
|
7
|
2,3
|
|
|
Religion (n=435) Catholique
Protestante
Autre religion Binge drinking
|
304
68
63
|
69,9
15,6
14,5
|
90 15 2 5
|
69,2
11,5
19,2
|
214 53 38
|
70,2
17,4
12,5
|
0,087
|
|
Oui
|
56
|
12,8
|
27
|
20,8
|
29
|
9,4
|
0,001
|
|
Non
|
381
|
87,2
|
103
|
79,2
|
278
|
90,6
|
|
3-Caractéristiques de la vie de couple,
activité sexuelle et données médicales
Sur l'ensemble de l'échantillon, 279 PVVS (63,1%) se
déclarent célibataires, avec une proportion de
célibataires significativement plus élevée chez les femmes
que chez les hommes (P< 0,001). Le taux moyen des CD4 était de 239
cellules/mm3 et 75,1% des PVVIH étaient aux
stades 2 ou 3 de la maladie selon la classification de l'OMS. Au total, 55% des
PVVS ne connaissent pas le statut VIH de leur partenaire stable et 13,9% ont un
partenaire stable de statut VIH discordant. Cent quarante trois personnes se
déclarent sexuellement actifs au cours des 3 mois
précédant la visite d'inclusion. La proportion des personnes
sexuellement actives est significativement plus élevée chez les
hommes que chez les femmes (P=0,02).
Tableau 3. Caractéristiques de la vie de
couple, activité sexuelle et données médicales des PVVS
à l'inclusion dans l'essai Stratall au Cameroun.
|
Total
|
|
Hommes
|
|
Femmes
|
P
|
|
N
|
%
|
N
|
%
|
N %
|
|
Statut matrimonial (n=440)
|
|
|
|
|
|
|
|
Célibataire
|
279
|
63,1
|
62
|
48,1
|
213 69,4
|
<0,001
|
|
Marié
|
89
|
20,4
|
49
|
38,0
|
40 13,0
|
|
|
Veuf/Divorcé
|
72
|
16,5
|
18
|
14,0
|
43 17,6
|
|
|
Statut du partenaire sexuel stable (n=165)
|
|
|
|
|
|
|
|
HIV+
|
31
|
18,8
|
14
|
25,0
|
17 15,6
|
0,389
|
|
HIV -
|
23
|
13,9
|
9
|
16,1
|
14 12,8
|
|
|
Inconnu
|
92
|
55,8
|
28
|
50,0
|
64 58,7
|
|
|
Pas de partenaire stable
|
19
|
11,5
|
5
|
8,9
|
14 12,8
|
|
|
Relations sexuelles forcées (n=428)
|
|
|
|
|
|
|
|
Oui
|
56
|
13,1
|
8
|
6,3
|
48 16,0
|
0,006
|
|
Non
|
372
|
86,9
|
120
|
93,8
|
252 84,0
|
|
|
Sexuellement actifs au cours des 3
|
|
|
|
|
|
|
|
derniers mois (n=399)
|
|
|
|
|
|
|
|
Oui
|
143
|
35,8
|
52
|
44,4
|
91 32,3
|
0,021
|
|
Non
|
256
|
64,2
|
65
|
55,6
|
191 67,7
|
|
|
Désir d'avoir un (autre) enfant
(n=423)
|
|
|
|
|
|
|
|
Oui
|
37
|
8,7
|
12
|
9,4
|
25 8,4
|
0,362
|
|
Non
|
141
|
33,3
|
48
|
37,8
|
93 31,4
|
|
|
NSP
|
245
|
57,9
|
65
|
52,8
|
178 60,1
|
|
|
Stade VIH (OMS) (n=437)
|
|
|
|
|
|
|
|
Stade 2 ou 3
|
328
|
75,1
|
94
|
72,3
|
234 76,2
|
0,39
|
|
Stade 4
|
109
|
24,9
|
36
|
27,7
|
73 23,8
|
|
|
Taux moyen de CD4cellules/mm3
|
239 (+/-201)*
|
238 (+/-202)*
|
214 (+/-202)*
|
0,90
|
|
*Ecart type
|
|
|
|
|
|
|
4-Connaissances et croyances vis-à-vis du VIH/Sida
et des ARV
Nous avons évalué les connaissances et croyances
des PVVS vis-à-vis du VIH et des ARV au moment de l'initiation du
traitement. La quasi-totalité (94,4%) des PVVS est informée du
fait que l'on puisse se contaminer avec le VIH en ayant des rapports sexuels
non protégés. Une forte proportion de PVVS (88,6%) est
informée de l'origine virale de la maladie.
Tableau 4. Connaissances et croyances
vis-à-vis du VIH/Sida et des antirétroviraux parmi les patients
VIH positif à l'inclusion dans l'essai Stratall au Cameroun,
2006-2008
|
|
Total
|
Hommes
|
Femmes
|
P*
|
|
N
|
%
|
N
|
%
|
N
|
%
|
|
|
Le VIH peut être guéri par les ARV (le virus
disparaît) (n=427)
|
|
|
|
|
|
|
|
|
D'accord
|
178
|
41,7
|
58
|
46,0
|
120
|
41,7
|
0,417
|
|
Pas d'accord
|
92
|
21,5
|
23
|
18,3
|
69
|
22,9
|
|
|
Ne sait pas (NSP)
|
157
|
36 ,8
|
45
|
35,7
|
112
|
37,2
|
|
|
Sous ARV on ne transmet pas la maladie
(n=424)
|
|
|
|
|
|
|
|
|
D'accord
|
86
|
20,3
|
30
|
24 ,0
|
56
|
18,7
|
0,356
|
|
Pas d'accord
|
199
|
46,9
|
59
|
47,2
|
140
|
46,8
|
|
|
Ne sait pas
|
139
|
32,8
|
39
|
28,8
|
103
|
34,4
|
|
|
Une personne peut attraper le VIH en ayant des rapports
sexuels non protégés (n=430)
|
|
|
|
|
|
|
|
|
D'accord
|
406
|
94,4
|
122
|
96,0
|
284
|
93,7
|
0, 336
|
|
Pas d'accord /NSP
|
24
|
5,6
|
5
|
4,0
|
19
|
7,3
|
|
|
Par transfusion sanguine (n=429)
|
|
|
|
|
|
|
|
|
D'accord
|
380
|
88,6
|
115
|
90,6
|
265
|
87,7
|
0,608
|
|
Pas d'accord
|
17
|
4,0
|
5
|
3,9
|
12
|
4,0
|
|
|
Ne sait pas
|
32
|
7,5
|
7
|
5,5
|
25
|
8,3
|
|
|
Le VIH/Sida est causée un virus ou microbe
(n=429)
|
|
|
|
|
|
|
|
|
D'accord
|
380
|
88,6
|
112
|
89,6
|
268
|
88,2
|
0,691
|
|
Pas d'accord
|
8
|
1,9
|
3
|
2,4
|
5
|
1,6
|
|
|
Ne sait pas
|
41
|
9,6
|
10
|
8,0
|
31
|
10,2
|
|
*degré de significativité de la p-valeur du test
5-Description de l'échantillon des 242 PVVS
sexuellement actifs
Parmi les 437 sujets sélectionnés, 242 sujets ont
déclaré être sexuellement actifs au moins une fois dans les
3
mois précédant les visites dont 129 (53,3%) à
l'initiation de la thérapie ARV (J0), 67 (27,7%) à M6 et 46
(19,0%) à M12.
Tableau 5: Caractéristiques
sociodémographiques, comportementales et médicales des 242 PVVS
ayant eu au moins une fois des rapports sexuels au cours du suivi, essai
Stratall, Cameroun. Données à l'inclusion (période du 3
juin
2006 au 26 février 2008)
Caractéristiques Modalités Effectif
(%)
ou médiane (IIQ)
Caractéristiques
sociodémographiques
Sexe Masculin 76(31,4)
Féminin 166(68,6)
Age 37[31-40]
Niveau scolaire (n=240) secondaire/supérieur 135(56,6)
primaire/sans niveau 105(43,4)
|
A au moins un enfant (n=238) Oui 195(81,9)
Non 43(18,1)
|
Désir d'avoir des enfants (n=235) Oui 31(13,2)
Ne peut plus concevoir 19(8,1)
Non 185(78,7)
|
Statut matrimonial Marié 68(28,1)
Non marié 174(71,9)
|
CARACTERISTIQUES CLINIQUES LIEES AU VIH
Délai depuis le premier test VIH positif (n=240) < 9
mois 175(72,9)
>= 9 mois 65(27,1)
|
Stade clinique VIH (OMS) 2 ou 3 178(73,6)
4 64(26,4)
|
Taux de CD4 (cellules/mm3) 205[87-383]
FACTEURS COMPORTEMENTAUX
Binge drinkinga Non 207(85,5)
Oui 35(14,5)
|
Importance de la religion Très importante 124(51,2)
Assez, peu ou pas importante 118(48,8)
|
Partenaire occasionnel (n= 135)** Non 73(54,1)
Oui 62(45,9)
Fréquence mensuelle moyenne des rapports sexuels <= une
fois 56(45,5)
(n= 123)** >une fois 67(54,5)
FACTEURS PSYCHOSOCIAUX
|
Statut du partenaire stable (n= 238) Connu 104(43,7)
Non connu 73(30,7)
Non concerné 61(25,6)
|
A déjà informé son partenaire de son statut
VIH+ Oui 104(58,8)
(n=177 patients)** Non 73(41,2)
WHOQOL-physique b 12[9-15]
WHOQOL-psychologique b 12[9-13]
WHOQOL-indépendance b 11[7-14]
WHOQOL-relations sociales b 12[9-14]
WHOQOL-environnement b 10[9-12]
WHOQOL-spiritualité b 14[12-17]
a Consommation de trois grandes bouteilles et/ou de 6
verres d'alcool ou plus en une seule fois.
b Scores de la WHO QOL sur 20 (échelle à
6 domaines)
** effectif trop faible du fait des données manquantes
à l'inclusion
B-Evolution des comportements sexuels, de la
consommation d'alcool et de la qualité de vie
1-Comportements sexuels
Nous avons étudié l'évolution de la prise
de risque sexuel chez les 129 PVVS qui étaient sexuellement actifs dans
les 3 mois avant initiation de la thérapie ARV. Au total, 40 patients
sur 129 (31,0%) étaient toujours sexuellement actives 12 mois
après l'initiation du traitement. Parmi ces 40 patients, la proportion
de patients déclarant avoir eu au moins un rapport sexuel non
protégé avec un partenaire stable (VIH négatif ou de
statut inconnu) ou avec un partenaire occasionnel pendant les 3 derniers mois
précédant l'inclusion était plus élevée (non
significativement) à l'initiation du traitement ARV qu'au 12e
mois du traitement ARV (54,2% versus 43,8%, P=0,263).
2-Consommation d'alcool
A propos de l'évolution de la consommation d'alcool
entre J0 et M12 chez les PVVS sous ARV, nous avons apprécié la
quantité de bière consommée par mois et le
phénomène de binge drinking. Comme illustré dans
le tableau, on observe une baisse non significative de la consommation d'alcool
et du phénomène de binge drinking chez les PVVS dans les
3 mois précédant le 12e mois de suivi par rapport aux
3 mois précédant le début du traitement par ARV
(inclusion).
Tableau 6: Consommation d'alcool chez les PVVS
12 mois après initiation du traitement ARV, essai Stratall.
N J0 M12 Chi-2 P*
Consommation d'alcool* 268 36 (13,4) 31 (11,6)
0,239 0,65
Binge drinking** 268 24 (9,0) 17 (6,3) 0,878
0,349
*degré de significativité de la p-valeur du test
3-Qualité de vie
Comme le montre le tableau 7, l'analyse des scores pour chaque
domaine du WHOQOL-HIV bref entre l'initiation du traitement ARV et 12 mois
après suggère que les participants estiment avoir à M12
une meilleure qualité de vie physique, un meilleur niveau
d'indépendance et un meilleur environnement. Aucune différence
significative n'est notée en ce qui concerne l'évolution de la
qualité de vie psychologique, des relations sociales et de la
spiritualité chez les PVVS entre le moment de l'inclusion et le
12e mois sous ARV.
Tableau 7: Résultats de la comparaison
des scores moyens du WHOQOL-HIV bref OMS (échelle à 6 domaines)
entre l'inclusion et le 12e mois du traitement par ARV chez des PVVS
au Cameroun, essai Stratall (n=437).
|
Z
|
P
|
|
WHOQOL-physique
|
-2,59
|
0,01
|
|
WHOQOL-psychologique
|
-0,47
|
0,60
|
|
WHOQOL-indépendance
|
-2,19
|
0,02
|
|
WHOQOL-relations sociales
|
-1,27
|
0,20
|
|
WHOQOL-environnement
|
-2,20
|
0,03
|
|
WHOQOL-spiritualité
|
-1,19
|
0,23
|
C-Régression logistique
1-Déterminants des comportements sexuels à
risques chez les PVVS sans HAART (n=129)
Sur 129 PVVS sexuellement actifs, 75 (58,1%) ont
déclaré avoir eu des rapports sexuels non protégés
au cours des 3 derniers mois avant l'initiation du traitement par AVR contre 54
(41,9%) qui ont déclaré avoir eu des rapports sexuels
protégés. Il n'y avait pas de différence significative
entre les hommes et les femmes en ce qui concerne la pratique des rapports
sexuels non protégés (53,5% versus 60,5%, P=0,45).
Comme le montre les résultats de l'analyse
univariée dans le tableau 8, deux facteurs sont significativement
associés à la pratique des rapports sexuels non
protégés avec un(e) partenaire stable sérodiscordant(e),
de statut VIH inconnu ou avec un(e) partenaire occasionnel(le) parmi les PVVS
dans les 3 mois avant initiation de la thérapie ARV:
- Le statut VIH du partenaire influence la pratique des
rapports sexuels protégés : la proportion des PVVS qui ont
déclaré des rapports sexuels non protégés est
significativement plus élevée quand le (la) partenaire stable a
un statut VIH inconnu (76,3%) que quand il connu (25,5%), P<0,001.
- La pratique des rapports sexuels non protégés
chez les PVVS est liée à la divulgation du statut VIH au
partenaire principal: La proportion des PVVS qui ont des rapports sexuels non
protégés est significativement plus élevée chez les
PVVS qui n'ont jamais divulgué leur statut à leur partenaire
stable que chez ceux l'ayant divulgué (P=0,012).
Après ajustement, «ne pas connaître le
statut VIH du partenaire principal» est le seul facteur associé
à la pratique des rapports sexuels non protégés avec
partenaire sexuel stable sérodiscordant ou avec partenaire occasionnel
chez les PVVS inclus dans l'essai Stratall au Cameroun (OR 10,1; IC95%
4,08-24,98; P<0,001).
Tableau 8: Déterminants des
comportements sexuels à risque (rapports sexuels non
protégés avec un partenaire stable sérodiscordant, de
statut inconnu ou avec partenaire occasionnel) chez les PVVS avant initiation
de la thérapie par ARV, analyse par régression logistique
(N=129)
|
Modalités
|
Total
|
n(%)
|
OR* (IC 95%)
|
p-valeur*
|
|
FACTEURS SOCIO-DEMOGRAPHIQUES
|
|
|
|
|
|
Sexe
|
Masculin Féminin
|
43
86
|
23(53,7)
52(60,5)
|
1,00
1,33(0,63-2,78)
|
0,44
|
|
Age
|
|
|
|
0,99(0,96-1,20)
|
0,68
|
|
Niveau scolaire
|
secondaire/supérieur
|
58
|
33(56,9)
|
1,00
|
|
|
primaire/sans niveau
|
71
|
42(59,2)
|
1,09(0,54-2,21)
|
0,79
|
|
A au moins un enfant
|
Oui
|
104
|
60(57,7)
|
1,00
|
|
|
Non
|
22
|
13(59,1)
|
1,05(0,41-2,69)
|
0,90
|
|
Désir d'avoir des enfants
|
Oui
|
21
|
11(52,4)
|
0,83(0,32-2,15)
|
0,7
|
|
Ne peut plus concevoir
|
8
|
6(75,0)
|
2,27(0,43-11,87)
|
0,32
|
|
Non
|
15
|
54(56,8)
|
1,00
|
|
|
Statut matrimonial
|
Marié
|
47
|
22(46,8)
|
1,00
|
|
|
Non marié
|
72
|
45(62,5)
|
1,894(0,89-3,99)
|
0,09
|
|
FACTEURS CLINIQUES LIES AU VIH
|
|
|
|
|
|
|
Nombre de mois depuis le
|
< 9 mois
|
91
|
56(61,5)
|
1,00
|
|
|
premier test VIH positif
|
>= 9 mois
|
38
|
19(50,0)
|
1,60(0,74-3,43)
|
0,22
|
|
Stade clinique VIH (OMS)
|
2ou3
|
98
|
54(55,1)
|
1,00
|
|
|
4
|
31
|
21(67,7)
|
0,58(0,25-1,37)
|
0,22
|
|
Taux de CD4 (cellules/mm3)
|
|
|
|
0,99(0,99-1,00)
|
0,07
|
|
CONNAISSANCE sur le VIH
|
|
|
|
|
|
|
On attrape le VIH par rapport
|
Oui
|
122
|
73(59,8)
|
1,00
|
|
|
sex.non protégés
|
Non/NSP
|
7
|
2(28,6)
|
0,26(0,05-1,44)
|
0,12
|
|
La maladie du VIH/sida est causée par un virus ou un
microbe
|
Oui
|
109
|
63(57,8)
|
1,00
|
|
|
Non /NSP
|
19
|
12(63,2)
|
1,25(0,45-3,42)
|
0,66
|
|
FACTEURS COMPORTEMENTAUX
|
|
|
|
|
|
|
Binge drinkinga
|
Non
|
104
|
59(56,7)
|
1,00
|
|
|
Oui
|
25
|
16(64,0)
|
1,35(0,54-3,34)
|
0,509
|
|
Importance de la religion
|
Très important
|
61
|
35(57,4)
|
0,94(0,46-1,89)
|
0,868
|
|
Assez, peu ou pas du tout important
|
68
|
40(58,8)
|
1,00
|
|
|
Partenaire occasionnel
|
Non
|
66
|
33(50,0)
|
1,00
|
|
|
Oui
|
61
|
41(67,2)
|
0,48(0,23-1,94)
|
0,05
|
|
Fréquence mensuelle moyenne de rapports sexuels
|
<= une fois
|
52
|
32(61,5)
|
1,00
|
|
|
>Une fois
|
64
|
32(50,0)
|
0,62(0,29-1,31)
|
0,21
|
|
FACTEURS PSYCHOSOCIAUX
|
|
|
|
|
|
|
Statut du partenaire stable
|
Connu
|
47
|
12(25,5)
|
1,00
|
|
|
Non connu
|
80
|
61(76,3)
|
9,34(4,06-21,55)
|
<0,001*
|
|
A déjà informé son partenaire de son statut
VIH+
|
Oui
|
74
|
35(47,3)
|
1,00
|
|
|
Non
|
45
|
32(71,1)
|
2,74(1,24-6,01)
|
0,012*
|
|
WHOQOL-physique b
|
|
|
|
0,94(0,85-1,03)
|
0,228
|
|
WHOQOL-psychologique b
|
|
|
|
0,94(0,83-1,06)
|
0,317
|
|
WHOQOL-indépendance b
|
|
|
|
0,92(0,86-1,04)
|
0,312
|
|
WHOQOL-relations sociales b
|
|
|
|
0,92(0,83-1,02)
|
0,123
|
|
WHOQOL-environnement b
|
|
|
|
0,98(0,86-1,11)
|
0,750
|
|
WHOQOL-spiritualité b
|
|
|
|
0,92(0,82-1,04)
|
0,195
|
a Consommation de trois grandes bouteilles et/ou de 6
verres d'alcool ou plus en une seule fois.
b Scores de la WHOQOL sur 20 (échelle à
6 domaines), * Odd ratio non ajusté, ** degré de
significativité en analyse univariée
D-Analyse sur données
répétées: Generalized Estimating Equations (GEE)
Parmi 437 PVVS retenus pour notre analyse, nous avons
sélectionné au total 242 patients qui avaient
déclaré avoir eu des rapports sexuels avec un partenaire stable
sérodiscordant, de statut VIH inconnu ou avec partenaire occasionnel au
cours des 3 mois précédant les visites au moins 1 fois dont 129
lors de la visite d'inclusion et 113 lors des visites de suivi (M6 et M12).
Pour ces patients sexuellement actifs, il y avait au total 396 visites pour
lesquelles ils ont déclaré des rapports sexuels avec partenaire
stable (VIH négatif ou VIH inconnu) ou avec partenaire occasionnel parmi
lesquelles 171 visites avec prise de risque (rapports sexuels non
protégés) et 225 visites pendant lesquelles les patients ont
déclaré avoir utilisé un préservatif au cours des
rapports sexuels.
1-Déterminants des comportements sexuels à
risque sous ARV (n=113)
Sur 113 patients initialement sexuellement inactifs à
l'inclusion et qui avaient déclaré avoir repris une
activité sexuelle en cours de suivi, il y avait au total 267 visites
pour lesquelles ils ont déclaré avoir des rapports sexuels avec
partenaire stable sérodiscordant, de statut inconnu ou avec partenaire
occasionnel au cours des 3 mois précédant les visites (M6 et M12)
au moins 1 fois. Sur les 267 visites, 96 visites (36%) ont été
avec déclaration de prise de risques (rapports sexuels non
protégés) et 171 visites (64%) pendant lesquelles les patients
ont déclaré avoir eu des rapports sexuels
protégés.
En analyse GEE univariée, nous avons mis en exergue
deux facteurs associés aux rapports sexuels à risque dans les 3
derniers mois avant la visite parmi les PVVS qui avaient repris avec
l'activité sexuelle pendant le suivi:
- «Ne pas connaitre le statut VIH du partenaire»:
les PVVS qui ne connaissant pas le statut de leur partenaire stable
s'engageaient significativement plus dans des rapports sexuels non
protégés (OR 4,02; IC95% 2,22- 7,29; P<0,001);
- «Ne pas informer le partenaire de son statut VIH
positif»: les PVVS qui n'avaient pas informé le partenaire stable
de son statut VIH+ s'engageaient plus dans des rapports sexuels non
protégés (OR 2,11; IC95% 1,22- 3,64; P=0,007).
La meilleure qualité de vie physique, psychologique, de
bonnes relations sociales et un meilleur environnement déterminaient le
comportement sexuel mais dans le sens de la moindre prise de risque.
Tableau 9. Déterminants des
comportements sexuels à risque dans les 3 mois précédant
les visites chez des patients camerounais infectés par le VIH et ayant
repris l'activité sexuelle sous ARV au cours de 12 mois de suivi :
Analyse univariée basées sur un modèle GEE logistique
(cohorte STRATALL, 113 patients, 267 visites)
|
Modalités
|
Nombre de visites (%)
ou médiane
[IQR]
|
OR* (IC 95%)
|
P**
|
|
FACTEURS SOCIODEMOGRAPHIQUES
|
|
|
|
|
|
Sexe
|
Masculin Féminin
|
85 (31,84)
182 (68,16)
|
1
1,64 (0,91-2,95)
|
0,09
|
|
Age
|
|
36[31-43]
|
1,01(0,98-1,04)
|
0,66
|
|
Niveau scolaire
|
Secondaire/supérieur Primaire/sans niveau
|
155(58,05)
112 (41,95)
|
1
1,19(0,70-2,03)
|
0,51
|
|
A au moins un enfant
|
Oui Non
|
|
|
|
|
Désir d'avoir des enfants
|
Oui
Ne peut plus Non
|
57(22,44)
9(3,54)
188(74,02)
|
1
0,84(0,20-3,48)
0,59 (0,32-1,08)
|
0,81
0,08
|
|
Statut matrimonial
|
Marié
Non marié
|
|
|
|
|
FACTEURS CLINIQUES LIES AU VIH
|
|
|
|
|
|
Nombre de mois depuis le premier test VIH positif
|
< 9 mois >= 9 mois
|
1955(73,86)
69(26,14)
|
1
1,39 (0,72-2,37)
|
0,36
|
|
Stade clinique VIH (OMS)
|
2ou3 4
|
207(77,53)
60(22,47)
|
1
1,39 (0,75-2,56)
|
0,28
|
|
FACTEURS COMPORTEMENTAUX
|
|
|
|
|
|
Binge drinkinga
|
Non Oui
|
229(85,77)
38(14,23)
|
1
1,81(0,89-3,68)
|
0,10
|
|
Importance de la religion
|
Très important
Assez, peu/pas du tout
|
130(48,69)
137(51,31)
|
1
1,43(0,84-2,43)
|
0,18
|
|
Partenaire occasionnel
|
Non Oui
|
172(66,67)
86(33,33)
|
1
1,38(0,81-2,34)
|
0,22
|
|
Fréquence mensuelle moyenne de rapports sexuels
Statut du partenaire stable
|
<= une fois >Une fois Connu
Non connu
|
76(30,28) 175(69,72) 116(44,96) 142(55,04)
|
1
1,41(0,79-2,51) 1
4,02(2,22-7,29)
|
0,24
<0,001
|
|
A déjà informé son partenaire de son statut
VIH+
|
Oui Non
|
156(62,35)
96(37,65)
|
1
2,11(1,22-3,64)
|
0,007
|
|
WHOQOL-physique b
|
|
15[11-16]
|
0,88 (0,82-0,96)
|
0,003
|
|
WHOQOL-psychologique b
|
|
14[11-16]
|
0,95(0,88-1,04)
|
0,31
|
|
WHOQOL-indépendance b
|
|
14[12-16]
|
0,92(0,85-1,01)
|
0,07
|
|
WHOQOL-relations sociales b
|
|
13[10-15]
|
0,97(0,90-1,05)
|
0,53
|
|
WHOQOL-environnement b
|
|
11[9-13]
|
0,88(0,79-0,97)
|
0,01
|
|
WHOQOL-spiritualité b
|
|
15[13-17]
|
0,92 (0,84-1,01)
|
0,11
|
a Consommation de trois grandes bouteilles et/ou de 6 verres
d'alcool ou plus en une seule fois.
b Scores de la WHOQOL sur 20 (échelle à
6 domaines), * Odd-ratio non ajusté, ** degré de
significativité en analyse univariée
Après analyse multivariée, donc après
ajustement, deux facteurs apparaissent associés à la pratique
de
rapport sexuel à risque chez les PVVS sous thérapie ARV
suivi pendant 12 mois: le binge drinking et le fait
de ne pas connaitre le
statut VIH du partenaire stable. Ce dernier facteur est fortement
associé (P<0,001).
Par ailleurs, cette analyse confirme le fait que la meilleure
qualité de vie physique est associée à la moindre prise de
risque sexuel parmi les PVVS sous traitement ARV.
Tableau 10. Facteurs associés aux
comportements sexuels à risques dans les 3 mois précédant
les visites chez des patients camerounais infectés par le VIH et ayant
repris l'activité sexuelle sous ARV au cours de 12 mois de suivi:
Analyse multivariée basée sur un modèle GEE logistique
(cohorte STRATALL, 113 patients, 267 visites)
|
Variables
|
Modalités
|
Nombre de visites
|
OR* (IC 95%)
|
P**
|
|
|
(%)
|
|
|
|
Binge drinkinga
|
Non
|
229(85,77)
|
1
|
|
|
Oui
|
38(14,23)
|
1,81(0,89-3,68)
|
0,02
|
|
Statut du partenaire stable
|
Connu
|
116(44,96)
|
1
|
|
|
Non connu
|
142(55,04
|
4,57(2,47-8,46)
|
<0,001
|
|
WHO-QOF-physique b
|
|
|
0,89(0,81-0,97)
|
0,01
|
a Consommation de trois grandes bouteilles et/ou de 6 verres
d'alcool ou plus en une seule fois.
b premier domaine du score du WHOQOL * Odd-ratio
ajusté, ** degré de significativité en analyse
multivariée
2-Lien entre ARV et comportements sexuels à risque
(N=242)
En analyse univariée, comment le montre le tableau 11,
3 facteurs déterminent la pratique des rapports sexuels non
protégés avec partenaire stable sérodiscordant, de statut
inconnu ou avec partenaire occasionnel parmi les PVVS:
1) «Ne pas connaitre le statut VIH du partenaire»:
les PVVS qui ne connaissaient pas le statut de leur partenaire stable
s'engageaient plus fréquemment dans des rapports sexuels non
protégés (OR 4,78; IC95% 2,98-7,67; P<0,001);
2) «Ne pas informer le partenaire de son statut»:
les PVVS qui n'avaient pas informé leur partenaire de leur statut VIH+
s'engageaient plus fréquemment dans des rapports sexuels non
protégés (OR 2,18; IC95% 1,40-3,39; P=0,001).
3) Avoir de partenaire sexuel occasionnel : les patients ayant
déclaré avoir eu de partenaire sexuel occasionnel ont
significativement plus de chance de d'avoir des rapports sexuels non
protégés (OR 1,74; IC95% 1,58-1,32; P = 0,008)
Etre sous thérapie ARV et avoir un meilleur score de
santé physique, un meilleur score de santé psychologique, un
meilleur score d'état spirituel, sont des déterminants de
comportement sexuels mais dans le sens de la réduction de la prise de
risque sexuel parmi les PVVS.
Tableau 11. Déterminants des
comportements sexuel à risques dans les 3 mois précédant
les visites chez des patients camerounais infectés par le VIH: Analyse
univariée basée sur un modèle GEE logistique (cohorte
Stratall, 242 patients, 396 visites)
|
Modalités
|
Nombre de visites
(%) médiane
[IQR]
|
OR* (IC 95%)
|
P**
|
|
FACTEURS SOCIODEMOGRAPHIQUES
|
|
|
|
|
|
Sexe
|
Masculin
|
128 (32,32)
|
1,00
|
|
|
Féminin
|
268 (67,68)
|
1,24 (0,93-1,65)
|
0,14
|
|
Age
|
|
37 [30-42]
|
0,97 (0,79-1,19)
|
0,76
|
|
Niveau scolaire
|
secondaire/supérieur
|
226 (57,07)
|
1,00
|
|
|
primaire/sans niveau
|
170 (42,93)
|
1,10 (0,70-1,73)
|
0,68
|
|
A au moins un enfant
|
Oui
|
211 (81,47)
|
1,00
|
0,70
|
|
Non
|
84 (18,53)
|
0,94 (0,68-1,31)
|
|
|
Désir d'avoir des enfants
|
Oui
|
78 (20,63)
|
1,00
|
|
|
Ne peut plus concevoir
|
17 (4,50)
|
1,11 (0,69-1,78)
|
0,65
|
|
Non
|
283 (74,87)
|
0,87 (0,67-1,13)
|
0,31
|
|
Statut matrimonial
|
Marié
|
81 (31,27)
|
1,00
|
|
|
Non marié
|
178 (68,73)
|
1,05(0,61-1,84)
|
0,85
|
|
FACTEURS CLINIQUES LIES AU VIH
|
|
|
|
|
|
Traité par ARV
|
Non
|
129 (32.6)
|
1,00
|
|
|
Oui
|
267 (67,42)
|
0,47 (0,32-0,68)
|
<0,001
|
|
Nombre de mois depuis le premier test VIH positif
|
< 9 mois
|
286 (72,77)
|
1,00
|
|
|
>= 9 mois
|
107 (27,23)
|
0,99 (0,60-1,65)
|
0,99
|
|
Stade clinique VIH (OMS)
|
2 ou 3
|
305 (77,02)
|
1,00
|
|
|
4
|
91 (22,98)
|
1,47 (0,90-2,39)
|
0,18
|
|
FACTEURS COMPORTEMENTAUX
|
|
|
|
|
|
Binge drinking a
|
Non
|
333 (84,09)
|
1,00
|
|
|
Oui
|
63 (15,91)
|
1,60 (0,93-2,77)
|
0,09
|
|
Importance de la religion
|
Très important
|
198 (50,00)
|
1,00
|
|
|
Assez/peu/ pas du tout important
|
198 (50,00)
|
1,77 (0,75-1,84)
|
0,49
|
|
Partenaire occasionnel
|
Non
|
238 (61,82)
|
1,00
|
|
|
Oui
|
147 (38,18)
|
1,74 (1,15-2,61)
|
0,008
|
|
Fréquence mensuelle moyenne de rapports sexuels
|
<= une fois
|
128 (34,88)
|
1,00
|
|
|
>Une fois
|
239 (65,12)
|
0,87 (0,58-1,32)
|
0,52
|
|
FACTEURS PSYCHOSOCIAUX
|
|
|
|
|
|
Statut du partenaire stable
|
Connu
|
163 (42,32)
|
1,0
|
|
|
Non connu
|
222 (57,66)
|
4,78 (2,98-7,67)
|
<0,001
|
|
A déjà informé son partenaire de son statut
VIH+
|
Oui
|
233 (62,30)
|
1,00
|
|
|
Non
|
141 (37,70)
|
2,18 (1,40-3,39)
|
0,001
|
|
WHOQOL-physique b
|
|
14 [11-17]
|
0,89 (0,84-0,94)
|
<0,001
|
|
WHOQOL-psychologique b
|
|
13 [10-15]
|
0,92 (0,86-0,97)
|
0,01
|
|
WHOQOL-indépendance b
|
|
14 [10-15]
|
0,91 (0,86-0,96)
|
0,001
|
|
WHOQOL-relations sociales b
|
|
12 [9-13]
|
0,94 (0,89-1,00)
|
0,06
|
|
WHOQOL-environnement b
|
|
11 [9-13]
|
0,91 (0,85-0,99)
|
0,02
|
|
WHOQOL-spiritualité b
|
|
14 [12-17]
|
0,91 (0,85-0,98)
|
0,01
|
a Consommation de trois grandes bouteilles et/ou de 6
verres d'alcool ou plus en une seule fois.
b Scores de la WHOQOL sur 20 (échelle à
6 domaines), * Odd-ratio non ajusté,** degré de
significativité en analyse univariée
Après ajustement sur d'éventuels facteurs de
confusion et l'étude des interactions entre la variable ARV et les
différentes variables, les facteurs suivant sont significativement
associés à la prise de risques de transmission du VIH chez les
PVVS:
1) La consommation d'alcool `le binge drinking'. Les
patients qui ont déclaré pratiquer el binge drinking avaient 2
fois plus de chance de déclarer des rapports sexuels non
protégés (OR 1,86; IC 95% 1,01-3,43; P= 0,04).
2) Ne pas connaitre le stable du partenaire sexuel. Les
patients qui ont déclaré ne pas connaitre le statut VIH de leur
partenaire stable avaient 5 fois plus de chance de déclarer des rapports
sexuels non protégés (OR 4,89; IC 95% 3,01-7,93; P<0,001).
L'analyse multivariée confirme que le fait d'être
sous traitement ARV était associée à la réduction
des rapports sexuels non protégés avec partenaire principal
sérodiscordant, de statut VIH inconnu ou occasionnel (OR 0,49; IC 95%
0,32-0,75; P= 0,001)
Tableau 12. Facteurs associés aux
comportements sexuels à risque dans les 3 mois précédant
les visites chez des patients camerounais infectés par le VIH: Analyse
multivariée basée sur un modèle GEE logistique (cohorte
STRATALL, 242 patients, 396 visites)
|
Variables
|
Modalités
|
Nombre de visites
(%)
|
OR* (IC 95%)
|
P**
|
|
Traité par ARV
|
Non
|
129(32,6)
|
1,00
|
0,001
|
|
Oui
|
267(67,42)
|
0,49 (0,32-0,75)
|
|
|
Binge drinkinga
|
Non
|
333(84,09)
|
1,00
|
|
|
Oui
|
63(15,91)
|
1,86 (1,01-3,43)
|
0,04
|
|
Statut du partenaire stable
|
Connu
|
163(42,32)
|
1,00
|
|
|
Non connu
|
222(57,66)
|
4,89 (3,01-7,93)
|
<0,001
|
a Consommation de trois grandes bouteilles et/ou de 6 verres
d'alcool ou plus en une seule fois. * Odd-ratio ajusté, ** degré
de significativité en analyse multivariée
VI-Discussion
Les résultats de notre étude montrent que dans
les trois mois avant la mise sous ARV, une proportion importante des PVVS est
sexuellement active et révèle que la mise sous ARV favorise la
reprise des activités sexuelles chez un grand nombre des PVVS
sexuellement inactifs avant traitement. Nous avons mis en évidence une
relation de causalité entre la mise sous ARV et la moindre prise de
risque sexuel chez les PVVS. La consommation d'alcool et le fait de ne pas
connaitre le statut VIH du partenaire sexuel stable jouent un rôle
important dans la prise de risque chez les PVVS.
6-1. Activités sexuelles chez les PVVS
Les personnes vivant avec le VIH restent sexuellement actives.
Cela a été déjà mis en évidence par des
études antérieures [23, 24, 25, 26,31]. Dans notre étude
qui portait sur un échantillon de 437 PVVS dont 70,3% étaient des
femmes, suivi sur une période de 12 mois, plus de la moitié a
déclaré avoir eu au moins une fois des rapports sexuels accours
des 3 mois derniers précédant les visites de suivi (T0, M6, M12).
Comme déjà le cas dans les études antérieures [23,
26,31] une forte proportion des PVVS sexuellement actifs ne connaissaient pas
le statut VIH de leurs partenaires sexuels. Le recours fréquent aux
partenaires occasionnels chez les PVVS déjà mis en
évidence dans certaines études [23,26] a été
retrouvé dans notre étude.
6.2. Evolution des comportements sexuels, sociaux et
qualité de vie
Chez les sujets PVVS sexuellement actifs, il n'y avait aucune
différence dans la pratique des rapports sexuels non
protégés entre 3 mois avant le début de ARV et 3 mois
précédent le 12e mois de suivi de ARV. Fortement
corrélée à la pratiqué des rapports sexuels non
protégés [33,34], il n'y avait pas de différence dans
l'évolution de la consommation entre ces deux périodes. De
façon générale, les PVVS ont déclaré avoir
une meilleure qualité sous ARV. Ces résultats confirment donc
l'amélioration de la qualité de vie de PVVS s'ils
bénéficient de traitement antirétroviral mais aussi la
persistance des rapports sexuels non protégés chez les PVVS sous
ARV déjà révélés par des études
antérieures [26,31]. La persistance des comportements à risque
peut être étayé par le fait que la près de la
moitié des PVVS pensent que le VIH peut être guérit par les
ARV (le virus disparait) mais aussi du fait d'une proportion non
négligeable de PVVS qui pensent que sous ARV, on ne transmet pas la
maladie.
Il est primordial de renforcer les activités de
prévention ciblant le changement des comportements sexuels à
risque chez les PVVS sous ARV.
6.3. Facteurs associés aux comportements sexuels
à risques avant ARV
La pratique des rapports sexuels protégés reste
le seul moyen efficace pour la prévention de la transmission du VIH par
voir sexuelle. Notre analyse montre bien qu'un nombre non négligeable
des PVVS, avant initiation des ARV, reste sexuellement. Parmi ces sujets
sexuellement actifs, plus de moitié ont eu au moins
une fois des rapports sexuellement non protégés.
Il y avait aucune différence dans cette prise de risque entre les sujets
qui ont dit être d'accord avec l'affirmation selon laquelle le VIH peut
être transmis par des rapports sexuels non protégés et ceux
qui ne savaient pas ou bien n'étaient pas d'accord avec cette
affirmation. Nos résultats sur la fréquence élevée
des rapports sexuels non protégés chez les PVVS corroborent les
résultats déjà obtenus dans des études
transversales réalisées en Afrique subsaharienne [23, 24, 29,30].
La faiblesse dans la pratique des rapports sexuels protégés est
d'autant plus importante que le sujet de ne connait pas le statut VIH de son
partenaire sexuel stable.
Il est donc primordial de renforcer la sensibilisation
sur l'utilisation du préservatif avec partenaire sexuel de statut VIH
inconnu ou avec des partenaires sexuels occasionnels aussi bien en population
générale que chez les PVVS.
6.4. Facteurs associés aux comportements sexuels
à risque sous ARV
Car fortement déterminée par la qualité
de vie, nombre de PVVS initialement sexuellement inactives avant ARV reprenne
leurs activités sexuelles sous ARV. Cependant, chez ces sujets, la
proportion des visites sans prise de risques était quasiment le double
de la proportion des visites avec déclaration de prise de risques. On
note donc qu'il y a reprise d'activités sexuelles sous ARV et
généralement, les sujets concernés pratiquent plus des
rapports sexuels protégés si l'on compare à la situation
chez les sujets PVVS dans les 3 mois avant initiation du traitement par ARV.
Après analyse multivariée, donc après
ajustement, deux facteurs apparaissent associés à la pratique de
rapport sexuel à risque chez les PVVS sous thérapie ARV suivi
pendant 12 mois: le binge drinking et le fait de ne pas connaitre le
statut VIH du partenaire stable. Cette analyse confirme que même sous
ARV, ne pas connaitre le statut du partenaire stable reste fortement
associé à la pratique de rapports sexuels non
protégés avec partenaire sérodiscordant, de statut VIH
inconnu ou avec partenaire occasionnel comme déjà obtenu
précédemment chez les PVVS qui n'étaient sous ARV, donc
avant initiation du traitement par ARV.
6.5. Lien ARV et comportements sexuels à
risque
Nous avons étudié la relation entre la prise de
risque sexuel et le traitement par ARV ajusté sur les facteurs
comportementaux (binge drinking, partenaire occasionnel), facteurs
psychosociaux (connaissance du statut du partenaire stable, avoir
informé de son statut don partenaire) et la qualité de vie, les
facteurs associés à la prise de risque parmi les PVVS demeuraient
le binge drinking et ne pas connaitre le statut du partenaire
stable.
Notre étude montre l'impact positif des ARV sur une
moindre prise de risques sexuels chez les PVVS au Cameroun confirmant ainsi les
résultats déjà trouvés par une méta-analyse
dans les pays du Nord [21].
Nos résultats ne sont pas compatibles avec les
précédents résultats montrant une association positive
entre les ARV et la pratique des rapports sexuels non protégés
dans certains pays développés [8, 9, 10, 11, 12, 13, 14,15].
Toutes ces études concernent des populations dont les principaux modes
de contamination sont des
rapports sexuels homosexuels ou l'injection des drogues,
tandis qu'en Afrique subsaharienne, le principal mode de transmission est
hétérosexuel. Dans ce cas, il est plausible qu'il ait une
différence dans la prise de risque sexuel entre les populations
africaines et les populations européennes.
La quasi-totalité des études transversales
réalisées en Afrique montrent que les comportements
Sexuels à risque parmi les PVVS n'étaient pas
associés aux ARV [23, 24, 25, 26, 27, 26, 28,30]. A notre connaissance,
seulement deux études prospectives quantitatives sur le sujet ont
été menées en Afrique subsaharienne dont une en Côte
d'Ivoire [26] et l'autre en Ouganda [31]. Nos résultats à propos
du lien entre la mise sous ARV et les comportements sexuels à risque
chez les PVVS ne sont pas compatibles à ceux obtenus en Cote d'Ivoire.
Cette contradiction peut s'expliquer par le fait que l'étude en
Côte d'Ivoire n'était pas menée en parallèle
à une intervention d'accès aux ARV et il s'agissait d'une
étude monocentrique, recrutant les patients à partir d'une seule
clinique, donc avec un risque de biais de sélection. La durée de
suivi des sujets peut aussi justifier l'issue des études car les
comportements peuvent variés selon la durée d'exposition à
un stimulus. En Côte d'Ivoire, les patients ont été suivis
sur une période courte de 6 mois tandis que cette durée
était de 12 mois dans notre étude. Par contre, nos
résultats corroborent ceux obtenus dans une étude longitudinale
réalisée en Ouganda dans le cadre d'un essai thérapeutique
qui n'avait pas trouvé une augmentation de la prise de risque sexuel
après initiation de traitement ARV. Cependant, en projetant qu'avec
l'approche de santé publique prônée par l'OMS [7 ],
plusieurs milliers de PVVS auront bénéficié des ARV et
avec la persistance des rapports sexuellement non protégés chez
ces derniers, bien que les résultats de notre étude ne
soutiennent pas un rapport de causalité entre la mise sous traitement
ARV et une augmentation de la prise de risque sexuel, le poids du nombre des
PVVS à la longue pourra en puissance modifier la tendance que nous avons
observé sur un échantillon de 242 patients sexuellement actifs.
L'impact à long terme, en Afrique, du large accès aux ARV
sur les comportements sexuels à risque nécessite d'être
élucider.
En population générale, les recherches
menées en Tanzanie [33] et au Kenya [34] ont signalé des taux
plus élevés de risque sexuel chez les personnes qui consomment de
l'alcool, comparativement à ceux qui n'en consomment pas. Comme
déjà démontré par les deux
précédentes études longitudinales réalisées
en Ouganda [26] et en cote d'ivoire [31], la consommation de l'alcool est un
facteur associé à la pratique des relations sexuelles non
protégés chez les personnes vivant avec le VIH au Cameroun. Il
est une certitude que l'alcool agit physiologiquement sur le système
nerveux et peut induire un effet euphorique si une certaine dose est
dépassée. Dans ce cas, la consommation de l'alcool peut entrainer
la déshinibition de comportements de prévention que la personne
peut avoir dans les conditions normales [33]. Notons que dans notre
étude, le binge drinking n'était associé à
la prise de risque chez les PVVS sans ARV (129 observations). Par contre, chez
les PVVS sous ARV (267 observations) ou bien quand on considérait
à la fois des PVVS sous ARV et des PVVS sans ARV (396 observations), le
binge drinking était associé à la prise de risque
sexuel. Cela parait logique vu que dans les deux derniers cas la puissance
statistique est plus grande.
Le fait de ne pas connaitre le statut VIH du partenaire est un
facteur fortement associé à la prise de risque sexuel chez les
PVVS au Cameroun comme c'est le cas dans d'autres pays Africains [23, 24]. Dans
notre étude, le fait que les femmes ont été les plus
concernées semble soulever un problème de communication dans le
couple et de négociation du préservatif lors des rapports
sexuels. Il sied de noter que, de façon générale, les
coutumes et les pratiques traditionnelles diverses basées sur le genre
en Afrique font obstacles à la communication en matière de
sexualité et surtout limitent les droits en santé sexuelle et
reproductive de la femme africaine. Il est évident que si les femmes ne
jouissent pas de leurs droits en santé sexuelle et reproductive, il est
peut probable que ces femmes aient la liberté de demander le statut VIH
de leurs conjoints par peur des représailles. Il serait
très important de renforcer la promotion des droits sexuels et
reproductifs des femmes dans le contexte du VIH/sida en Afrique
subsaharienne.
Le niveau d'éducation a été trouvé
comme facteur associé à la prise de risque en Afrique
subsaharienne [26,31]. Notre étude ne l'a pas confirmé. L'une des
raisons pourrait être la distribution du niveau d'éducation dans
l'échantillon. Dans le présent échantillon, la
majorité des répondants avaient au minimum le niveau
d'éducation secondaire. Une autre explication peut être
liée à la sélection des patients. L'association peut
être importante dans une zone rurale où la proportion des femmes
ayant le niveau d'enseignement supérieur est faible comme ce fut le cas
pour l'étude réalisée en Ouganda [26].
Dans les études antérieures, le diagnostic
récent de la séropositivité (< 9 mois) [23,24],
l'expérience des rapports sexuels forcés [27] et ne pas divulguer
son statut VIH positif au partenaire sexuel [28] étaient des facteurs
associés à la prise de risque sexuel chez les PVVS. Notre
étude n'a pas mis en évidence ces facteurs. Cela peut s'expliquer
par la définition de la variable réponse qui est
différente souvent d'une étude à l'autre qui
elle-même influence le choix des variables explicatives à utiliser
dans les différents modèles de régression.
Conclusions
Validité interne des résultats
Nous avons utilisé des données issues d'une
étude de cohorte basée sur un essai clinique randomisé,
donc robuste. L'étude elle-même a utilisé un questionnaire
validé et la méthode que nous avons choisie pour analyser les
données (GEE) correspond bien à l'étude des données
corrélées. Tels sont les points forts de notre étude
démontrant ainsi la fiabilité de nos résultats. Notre
étude montre l'impact positif des ARV sur une moindre prise de risque
sexuel chez les PVVS. Comme pour toutes les études utilisant les
données déclaratives, notre étude peut comporter un biais
d'information. Il faut pour cela tenir compte de deux situations possibles
quant à l'utilisation de nos résultats: si un nombre
élevé des patients qui déclarent ne pas prendre de risque
sexuel ne le sont pas vraiment, dans ce cas, il y a une sous estimation de la
proportion des patients ayant pris de risque sexuel. Au contraire, si un nombre
élevé des patients qui déclarent avoir pris de risque de
sexuel se trompent, dans ce cas, il y a une surestimation de la proportion des
sujets ayant pris de risque sexuel. Dans chacune des deux situations, le lien
entre les ARV et les comportements sexuels peut être modifié.
Nous pouvons dire sans se tromper qu'avec la randomisation,
les biais de sélection ont été minimisés. De
même, l'analyse multivariée en ajustant sur des facteurs de
confusion potentiels permet de limiter les biais de confusion, mais pour les
variables prises en compte uniquement. D'autres variables d'ajustement ont pu
certainement être omises dans cette analyse notamment les données
cliniques au cours du suivi qui elles n'étaient pas disponibles pendant
la durée de notre stage.
Conclusions en termes de santé publique
A notre connaissance, notre étude sur l'impact de la
mise sous ARV sur les comportements sexuels des bénéficiaires,
dans un contexte de «passage à l'échelle» à
l'accès aux ARV, est la première menée en Afrique
subsaharienne. Les résultats de notre étude ne soutiennent pas un
rapport de causalité entre la mise sous traitement ARV et une
augmentation de la prise de risque sexuel chez les patients infectés par
le VIH au Cameroun. Nous mettons en évidence la pratique
fréquente des rapports sexuels non protégés chez les PVVS
et le rôle de la consommation d'alcool, de la non divulgation du statut
VIH au partenaire sexuel, dans cette prise de risque. La mise en exergue de ces
facteurs par notre étude constitue un point de départ pour la
planification des projets en santé publique visant la prévention
secondaire de la transmission sexuelle du VIH au Cameroun dans un contexte
d'accès élargi aux ARV.
Perspectives de recherche
Notre étude soulève des interrogations pour
lesquelles des études seraient nécessaires : Comment
contrôler les facteurs associés aux comportements sexuels à
risque chez les PVVS? Il serait important de se servir de nos résultats
pour mettre en place des interventions qui permettront d'identifier des
stratégies adaptées pour contrôler les facteurs
associés aux comportements à moindres risques chez les PVVS.
Quelle sera l'impact
des ARV à long terme quand leur accès sera
réellement élargi en Afrique subsaharienne? Compte tenu de
l'échelle actuelle des traitements antirétroviraux en Afrique
sub-saharienne, plus de recherche est nécessaire afin d'examiner cette
question plus en profondeur.
Bibliographie
1. ONUSIDA. Rapport sur l'épidémie mondiale de
Sida, 2008. ONUSIDA/08.25F / JC1510F (version française,
août[enligne]
http://www.unaids.org/fr/KnowledgeCentre/HIVData/GlobalReport/2008/2008_Global_report
.asp, lu le 17 février 2009.
2. Laurent C, Diakhaté N, Ngom Gueye NF, Touré MA,
Sow PS, Faye MA, et al. The Senegalese government's highly active
antiretroviral therapy initiative: an 18-month follow-up study. AIDS
2002;16(10):1363-1370.
3. Seyler C, Anglaret X, Dakoury-Dogbo N, Messou E,
Touré S, Danel C, et al. Medium-term survival, morbidity and
immunovirological evolution in HIV-infected adults receiving antiretroviral
therapy, Abidjan, Côte d'Ivoire. Antivir Ther 2003; 8(5):385-393.
4. WHO-UNAIDS report. Treating 3 million by 2005: Making it
happen.[en ligne]:
http://www.who.int/3by5/publications/documents/en/3by5StrategyMakingItHappen.pdf;
lu le 17 février 2009.
5. OMS/ONUSIDA. Progress on global access to HIV antiretroviral
therapy: a report on «3 by 5» and beyond, 2006
6. WHO. Towards universal access, Scaling up priority HIV/AIDS
interventions in the health sector, Progress Report, April 2007
7. Gilks C F, Crowley S, Ekpini R, Gove S, Perriens J,
Souteyrand Y, et al. WHO public-health approach to antiretroviral treatment
against HIV in resource-limited settings. The Lancet 2006; 368: 505-10
8. Crepaz N, Hart TA, Marks G. La thérapie
antirétrovirale hautement active et un comportement sexuel à
risque: une méta-analyse review. JAMA. 2004 Nov 17;292(19):2335
9. Kelly, J.A., et al., Protease inhibitor combination therapies
and perceptions of gay men regarding AIDS severity and the need to maintain
safer sex. AIDS, 1998 12(10): p. F91-5
10. Van de Ven P, Kippax S., Knox S, Prestage G, Crawford J. HIV
treatments optimism and sexual behaviour among gay men in Sydney and Melbourne.
AIDS1999; 13:2289-2294
11. Ostrow DG, Fox K, Chmiel JS, Silvertre A, Visscher BR,
Vanable P et al. Atitudes towards Highly Active Therapy Sexuel Risk-Taking
among HIV-infected and uninfected gay men in the Multicentrique AID Cohort
Study (MACS). Int Conf AIDS 2000, 13: 9-14
12. 12Katz MH, Schwarcz SK, Kellog TA, Klausner JD, Dilley
JW, Gibson S, et al. Impact of highly active antiretroviral treatment on HIV
seroincidence among men who have sex with men: San Francisco. Am J Public
Health 2002; 92:388-394.
13. 13Dukers N.H., et al., Sexual risk behaviour relates to the
virological and immunological improvements during highly active antiretroviral
therapy in HIV-1 infection. AIDS, 2001. 15(3): p. 369-78.
14. DiClemente, R.J., et al., Protease inhibitor combination
therapy and decreased condom use among gay men. South Med J, 2002. 95(4): p.
421-5
15. Holmes, W.C. and J.L. Pace, HIV-seropositive individuals'
optimistic beliefs about prognosis and relation to medication and safe sex
adherence. J Gen Intern Med, 2002. 17(9): p. 677-83
16. Scheer, S., et al., Effect of highly active antiretroviral
therapy on diagnoses of sexually transmitted diseases in people with AIDS.
Lancet, 2001. 357(9254): p.432-5.
17. Stephenson, J.M., et al., Is use of antiretroviral therapy
among homosexual men associated with increased risk of transmission of HIV
infection? Sex Transm Infect 2003. 79(1):p. 7-10.
18. Dilley J.W, W.Jea. Availability of combination therapy for
HIV: effects on sexual risk taking in a sample of
high -risk gay and
bisexual men. AIDS CARE, 2003. 15(1): p. 27-37
19. Vlahov D, Safain M, Lai S, Strathdee SA, Johnson L, Sterling
T, et al. Sexual and drug risk-related behaviours after initiating highly
active antiretroviral therapy among injection drug users. AIDS, 2001. 15(17):
p. 2311-6.)
20. 20Bouhnik A-D, Moatti JP, Vlahov D, et al. Highly active
antiretroviral treatment does not increase sexual risk behavior among French
HIV infected injecting drug users. Journal of Epidemiology and Community Health
2002; 56: 349--353
21. 21Vincent E, Bouhnik AD, Carrieri MP, Rey D, Dujardin P,
Granier F, et al. MANIF-2000 Study Group. Impact of HAART-related side effects
on unsafe sexual behaviours in HIV-infected injecting drug users: 7-year follow
up. AIDS. 2004 Jun 18;18(9):1321-5
22. Sendagire H, Easterbrook PJ, Nankya I, Arts E, Thomas D,
Reynolds SJ. The Challenge of HIV-1 Antiretroviral Resistance in Africa in the
Era of HAART. AIDS Rev. 2009 Apr-Jun;11(2):59-70.
23. Moatti JP, Prudhomme J, Traore DC, Juillet-Amari A,
Akribi HA, Msellati P. Access to antiretroviral treatment and sexual behaviours
of HIV-infected patients aware of their serostatus in Cote d'Ivoire. Aids
2003,17 Suppl 3:S69-77
24. Olley BO, Seedat S, Gxamza F, Reuter H, Stein DJ.
Determinants of unprotected sex among HIV-positive patients in South Africa.
AIDS Care 2005; 17:1-9.
25. Bateganya M, Colfax G, Shafer LA, Kityo C, Mugyenyi P,
Serwadda D, et al. Antiretroviral therapy and sexual behavior: a comparative
study between antiretroviral- naive and -experienced patients at an urban
HIV/AIDS care and research center in Kampala, Uganda. AIDS Patient Care STDS.
2005 Nov;19(11):760-8
26. Bunnell R, Ekwaru JP, Solberg P, Wamai N, Bikaako-Kajura
W, Were W, et al; Changes in sexual behavior and risk of HIV transmission after
antiretroviral therapy and prevention interventions in rural Uganda. AIDS 2006;
20:85-92
27. Kiene SM, Christie S, Cornman DH, Fisher WA, Shuper PA,
Pillay S, et al. Sexual risk behaviour among HIV-positive individuals in
clinical care in urban KwaZulu-Natal, South Africa. Aids 2006, 20:1781-1784.
28. Eisele TP, Mathews C, Chopra M, Brown L, Silvestre E,
Daries V, et al. High Levels of Risk Behaviours Among People Living with HIV
Initiating and Waiting to Start Antiretroviral Therapy in Cape Town South
Africa. AIDS Behav 2008.
29. Luchters S, Sarna A, Geibel S, Chersich MF, Munyao P,
Kaai S, et al. Safer sexual behaviors after 12 months of antiretroviral
treatment in Mombasa, Kenya: a prospective cohort. AIDS Patient Care and STDs.
July 1, 2008, 22(7): 587-594.
30. Sarna A, Luchters SM, Geibel S, Kaai S, Munyao P, Shikely
KS, et al. Sexual risk behaviour and HAART: a comparative study of HIV-infected
persons on HAART and on preventive therapy in Kenya. Int J STD AIDS. 2008 Feb;
19 (2):85-9.
31. Diabaté S, Alary M, Koffi CK. Short-term increase in
unsafe sexual behavior after initiation of HAART in Côte d'Ivoire. AIDS.
Jan 2, 2008, 22(1) :154-6.
32. World Health organization. The world health report 2004.
Changing history Geneva : WHO ; 2004
33. Urassa W, Moshiro C, Chalamilla G, Mhalu F, Sandstrom
E.Risky sexual practices among youth attending a sexually transmitted infection
clinic in Dar es Salaam, Tanzania. BMC Infect Dis. 2008 Nov 19; 8:159.
34. Khasakhala AA, Mturi AJ. Factors associated with risky
sexual behaviour among out-of-school youth in Kenya. J Biosoc
Sci. 2008 Sep;40(5):641-53.
Annexes

Annexe 1 : Questionnaire de l'essai Stratall
(inclusion)



38


40


42


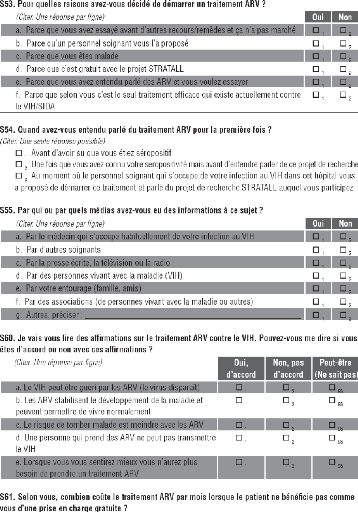
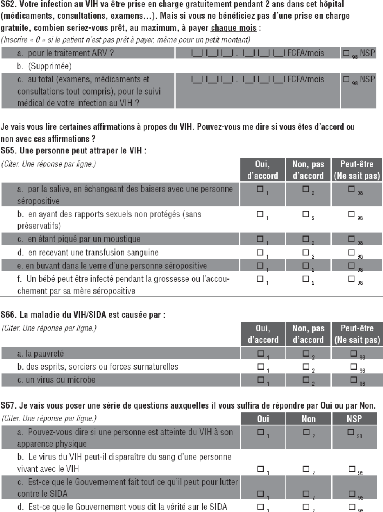

46

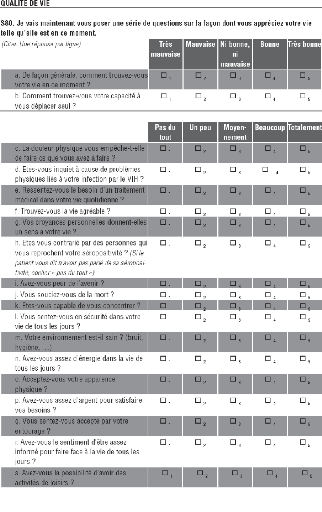
48
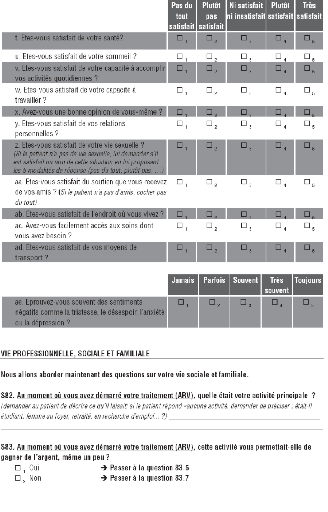





Annexe 2 : Document OMS sur le calcul de la
qualité de vie des PVVS






58




61


Annexe 3 : Carte provinciale du Cameroun