
 |
Optimisation d'une machine frigorifique à absorption-diffusion nh3-h2o-h2( Télécharger le fichier original )par Souad Himoun Université Djillali Liabès Algérie - Magister en génie mécanique 2009 |
Le principe de fonctionnement de ces machines repose sur la théorie et les propriétés des mélanges (ou couples) binaires. Les mélanges utilisés dans ces machines comprennent un « solvant » et un fluide frigorigène qui, en un certain point du cycle est « absorbé » par le solvant (d'où le nom donné à ce type de machines) et en un autre point, est libéré du solvant. Afin d'obtenir ce résultat, il est nécessaire que le solvant présente à froid une très grande affinité pour le fluide frigorigène ; lorsque la température du mélange s'élève, cette affinité diminue et il y a dégagement du fluide frigorigène du solvant. Les deux principaux couples binaires utilisés industriellement sont les couples suivants :
Figure I.2 : table des principaux couples binaires en industrie. I.2.2. Machine à absorption avec NH3-H2O : Cette machine utilise la propriété que présente l'eau à basse température d'absorber l'ammoniac (1000 fois son volume à 0°C) et de libérer par chauffage la presque totalité du gaz absorbé (à 100°C) [13]. Ces vapeurs d'ammoniac une fois condensées pourront donc nous assurer la production de froid désirée dans un évaporateur. I.2.2.1. Description :Une telle machine comprend (figure I.3) : - Un bouilleur (1) dans lequel sera chauffée la solution ammoniacale. - Un rectificateur-séparateur d'eau (2) libérant l'ammoniac des gouttelettes d'eau entraînées. > Un condenseur (3). > Un détendeur (4). > Un évaporateur (5). > Un absorbeur (6). > Une pompe de circulation de solution (7). > Un échangeur thermique (8). > Un robinet régleur de débit de solution (9). I.2.2.2. Fonctionnement :La solution ammoniac-eau est chauffée dans le bouilleur (1) par le serpentin de vapeur. La solubilité de l'ammoniac dans l'eau diminue, l'ammoniac gazeux se dégage sous une pression très voisine de sa tension de vapeur saturante à la température de la solution en ébullition. La solution restante dans le bouilleur s'appauvrit en ammoniac d'où le nom de solution pauvre qui lui est donné. entraînées mécaniqueme nt par le fluide dans dans le condenseur (3) . L'ammoniac gazeux se sépare des goutte lettes d'eau le rectificat eur-séparateur (2) et va se condenser
é par le robinet de réglage (9). une température très voisine de l a température ambiante la dissolution de l'ammoniac dans la solution du système, la chaleur provenant de la disso lution de par une pauvre, L'ammoniac liquide est admis à travers le détendeur vaporise sous la pressi on P5 correspondant à sa température cette vaporisation sont acheminées vers l'abso rbeur (6) où du bouilleur et dont le débit est régl L'abs orbeur est maintenu à circulation d 'eau, afin de favoriser au maximum d'une part ; et d'autre p art éliminer à l'extérie ur l'ammoniac dans l'eau. (4) à l'év aporateur ( 5) où, déten du, il s'y d'évaporation T5. Les vapeurs pro venant de elles renc ontrent la solution pauvre venant La solution ammoniacale pauvre, ainsi enrichie par absorption d'ammoniac ; d'où l'appellation de solution riche ; est prise en charge par une pompe (7) permettant de compenser la différence de pression existant entre l'absorbeur et le bouilleur. Nous avons donc une circulation de deux fluides : - L'ammoniac pratiquement pur qui, entre la sortie du bouilleur et l'entrée de l'absorbeur, subit les transformations habituelles d'un fluide frigorigène. - La solution ammoniacale, alternativement pauvre et riche, qui circule entre le bouilleur et l'absorbeur. L'échangeur thermique (8) a pour but d'améliorer le rendement de la machine en refroidissant la solution pauvre avant son admission dans l'absorbeur, et en réchauffant la solution riche avant son retour au bouilleur, les deux solutions circulent à contre-courant dans l'échangeur de chaleur. Les détendeurs (4) et (9), ainsi que la pompe (7), assurent la délimitation des circuits haute et basse pressions, rôle que jouait le détendeur à lui seul dans les machines à compression mécanique. Donc le schéma nous montre que le seul organe mécanique de l'installation est la pompe à solution (7). I.2.3. Avantages et inconvénients :I.2.3.1. Avantages :& Elles consomment essentiellement de l'énergie calorifique ; & Leurs utilisations sont intéressantes si on dispose d'une source de chaleur (chaleur gratuite perdue) ; & Intérêt d'avoir de l'eau comme fluide frigorigène (pas de toxicité) ; & Machines silencieuses et sans vibrations. I.2.3.2. Inconvénients : ' COP faible face aux machines à compression ; ' Puissances thermiques importantes à évacuer ; ' Fonctionnement en très basse pression ; ' Problème de construction ; étanchéité importante ; ' Cristallisation de l'eau (panne). 1.3. Réfrigération à absorption à pressions partielles :Au lieu d'utiliser une pompe pour amener le mélange de l'absorbeur au générateur et les vannes de lamination pour abaisser la pression de la valeur de condensation à celle d'évaporation, les suédois VAN-PLATTEN et Munsters eurent l'idée d'utiliser la loi de DALTON sur les pressions en ajoutant au mélange NH3-H2O un gaz inerte : hydrogène. La pression totale est la même le long de tout le circuit, alors que la pression de l'ammoniac varie du générateur au condenseur à l'évaporateur et à l'absorbeur. La circulation se fait par l'intermédiaire de la poussée hydrodynamique (crée suite à la différence de densité produite par la température à l'entrée et à la sortie du générateur) due à la différence de température entre liquide riche et liquide pauvre en ammoniac, il y a en outre une liaison entre l'absorbeur et l'évaporateur pour le passage de H2. 1.4.Diagrammes thermodynamiques utilisés : I.4.1. Diagramme de Merkel [14] :Le diagramme de Merkel permet une étude complète de la machine à absorption, car il fournit les bilans thermiques des différents appareils du circuit par lecture directe des différences d'enthalpie. L'axe des abscisses est gradué en concentrations de la phase liquide et l'axe des ordonnées en enthalpies (figure I.4). Il comporte, à la partie inférieure, des réseaux d'isothermes et d'isobares, de même que des courbes d'égale concentration de la phase vapeur en équilibre avec la phase liquide ; A la partie supérieure, des courbes de référence permettent, en partant d'un point d'équilibre déterminé dans la partie inférieure, de définir les caractéristiques de la phase vapeur. I.4.2. Diagramme d'Oldham [15] :C'est le diagramme le plus utilisé et le plus pratique pour une étude d'une machine à absorption, (figure I.5). L'axe des abscisses est gradué en (1/T) et l'axe des ordonnées en (Log P). Dans ce système de coordonnées, les courbes traduisant l'équilibre du système binaire dans la phase vapeur aussi bien que dans la phase liquide sont, à très peu de chose prés, des droites. La droite de teneur (100 %) correspond à l'équilibre liquide-vapeur de l'ammoniac pur. La droite de teneur (0 %) correspond à l'équilibre liquide-vapeur de l'eau pure.
Enthalpie de H2O a 20 Bar Enthalpie de NH3 a 20 Bar Concentration î Figure I.4. Diagramme de Merkel relatif au couple NH3-H20.
Figure I.5 Diagramme d'Oldham relatif au couple I.5. Mélanges pour une machine à absorption :Bien que, théoriquement, il n'y ait aucune impossibilité d'utiliser des mélanges d'ordre supérieur, on se limite pratiquement aux mélanges binaires qui sont donc une combinaison d'un fluide frigorigène et d'un agent d'absorption. Le choix du fluide interne d'une machine à absorption est d'abord dicté par le cycle choisi et l'application à laquelle la machine est destinée. Il faut ensuite tenir compte des réglementations concernant les fluides frigorigènes qui sont de plus en plus contraignantes. A l'heure actuelle, les couples ammoniac-eau et eau-bromure de lithium sont les seuls utilisés dans les machines commercialisées. I.5.1. Caractéristiques d'un couple binaire :Les deux substances fluide frigorigène- agent absorbant qui forment le couple binaire, ou la solution dans les cycles frigorifiques à absorption, doivent avoir les caractéristiques suivantes :
Les couples ammoniac-eau et eau-bromure de lithium sont les couples qui remplissent le plus de critères. I.5.2. Propriétés de l'agent d'absorption :L'agent d'absorption doit répondre aux caractéristiques suivantes :
Conclusion :Les travaux évoqués au cours de ce chapitre bibliographique mettent l'accent sur la complexité des procédés utilisés dans le domaine du froid. L'étude thermodynamique complète, des installations frigorifiques à absorption requiert la connaissance des propriétés thermodynamiques du couple utilisé. Dans ce chapitre, on a pu présenter une idée générale sur le thème de notre étude, cette partie fera l'objet du chapitre suivant. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
NH3 |
H2O |
H2 |
||
|
Masse molaire |
M [kg.kmole-1] |
17.03026 |
18.015268 |
2,02 10-3 |
|
Point critique |
Température Tc [K] |
405.4 |
647.14 |
33,2 |
|
Pression Pc [bar] |
113.336 |
220.64 |
12,8 |
|
|
Masse volumique ñc [kg.m-3] |
225 |
322 |
0,0312 |
|
|
Point |
Température Teb [K] |
239.74 |
373.15 |
20,28 |
|
Pression Peb [bar] |
1.013325 |
1.013325 |
1,013 |
|
|
Point triple |
Température Tt [K] |
195.41 |
273.16 |
13,8033 |
|
Pression Pt [bar] |
0.06077 |
6.112 10-3 |
6,951 10-3 |
|
Tableau II.1. Les paramètres fondamentaux des substances pures.
Considérons l'expression de la différentielle du de l'énergie interne obtenue par application simultanée des deux principes à un système fermé, et si n1, n2, , ni représentent les nombres de moles respectifs des différents composants présents dans la phase, on peut écrire que :
? u ? u
(II.1)
i
? n 1 ? ni
où plus simplement :
du TdS PdV
= - + dn + dn
1 +
du = TdS - PdV + ?? ui dni (II.2)
?ni
avec:
? ? ? ? ? =
u ì (II.3)
i j,
? ? ?
n i s v n , , j
Les quantités telles que ,
? ? ? ? ? =
u ì sont les potentiels chimiques des composants dans le système.
i j
? ? ?
n i s v n
, , j
Le potentiel chimique interne, défini par « Gibbs », est une mesure de l'influence de l'énergie interne de la phase considérée sur l'influence du nombre de moles du constituant (i).
Si l'on envisage maintenant l'enthalpie, l'énergie libre et l'enthalpie libre de la phase considérée, définies respectivement par :
H = u + PV (II.4)
F = u - TS ( Helmotz) (II.5)
G = H - TS (Gibbs) (II.6)
en calculant leurs différentielles et en substituant, les nouvelles expressions :
dH = TdS + VdP +? ìi dni (II.7)
i
dF = - SdT - PdV +? ìi dni (II.8)
i
dG = - SdT + VdP + ? ìi dni (II.9)
i
on aboutit à :
|
ì i |
? u ? H ? F ?G (II. 1 0) (? n i )s v n (? nijs,p,nj (? n i ?n )T v n () T , p ,nj
|
L'enthalpie libre peut être calculée sur la base des potentiels chimiques ìi des deux composantes (NH3 et H2O) :
G = (1 - x )ìH 2 O + xìNH3 (II.1 1 )
II.2.1. Condition d'équilibre :
A l'équilibre de la phase, à coté de l'égalité de la pression et de la température, il existe en plus l'égalité entre les potentiels chimiques de toutes les composantes des phases existantes.
ì( T , P , x g ) = ( T , P , xL ) i = NH H O (II.12)
3 , 2
i
Parmi les modèles cités précédemment on a choisi celui de MICHEL FEIDT [27] qui combine la méthode de l'énergie libre de Gibbs pour les propriétés thermiques et des équations qui calculent le point de bulle et le point de rosée du mélange. Cette méthode combine les avantages des deux et évite le besoin d'effectuer des itérations afin d'avoir les conditions d'équilibre de phases. Les corrélations proposées couvrent des conditions d'équilibre de phases à des pressions et des températures élevées.
Le domaine de validité pour les relations qui suit est :
· Pour les températures (K) : 230<T<600 ;
· Pour les pressions (bar) : 0.2<P<110.
Ce domaine se trouve sous les points critiques de toutes les composantes, de sorte que la détermination de l'équation d'état pour le mélange, ne prenne pas en considération les particularités référents au domaine d'état critique. L'équation d'état ne décrit pas l'état dans lequel la solution se trouve sous forme d'agrégation solide [27].
L'équation fondamentale de l'enthalpie libre de Gibbs est donnée sous une forme intégrale (Ziegler et Trepp [20], Ibrahim et Klein [21], Xu et Yogi Goswami [22]) :
Cp
G = H 0 - TS 0 + ? Cp dT + ? V dP -T ? dT
T
T P T
T P T
0 0 0
(II.13)
Cette équation est valable pour la phase gazeuse, ainsi que liquide.
Le comportement de l'état liquide du point de vue thermique est décrit par les corrélations suivantes (Ziegler et Trepp [20]), oil le volume liquide est fonction de la pression et de la température et CpL molaire du liquide de la température :
V L = a 1 + a 2 P + a 3 T + a 4T2 (II.14)
Cp L = b 1 + b 2 T + b 3T2 (II.15)
donc :
L L T Cp dTL
T P
G L = H 0 -TS 0 + ? Cp L dT + ? V I' dP - T ?
T
T 0 P 0 T0
(II.16)
Le développement de l'équation (II.16) avec l'aide des équations (II.14) et (II.15) aboutit à la forme réduite :
B B ? T
G r L = H r L - T S T + B
0
r r
0 1 ( T r - T0 ) +
r ,2 ( T
2
- T 0 r r ) + 3 (T 3 - T 3) -B1 Tlnr
,r
,
2 3 ? ?
? ?
Tr ,0
|
|
||
Les grandeurs adimensionnelles d'état sont :
|
|
||
G
= ;
RT B
· L'enthalpie libre molaire réduite : Gr
|
P = ; P B |
·
H
;
RT
B
L'enthalpie molaire réduite : Hr
S
· L'entropie molaire réduite : Sr = R ;
.
VP
· Le volume molaire réduit : B
RTB
V =
rLes indices utilisés sont :
· r : pour la grandeur réduite ;
· B : pour la grandeur de référence ;
· L : la phase liquide ;
· g : la phase gazeuse ;
· 0 : l'état de référence.
Les grandeurs de références [27] sont:
TB = 100 k ; PB = 10 bar et R = 8.3143 kj / kmole .k .
Dans la phase vapeur (Ziegler et Trepp [20]) prennent en considération les corrélations suivantes :
c c c P 2
g RT 2 3 4
V = + + + +

c (II.18)
1 3 11 11
P T T T
P ? ? ?
2 V
Cp d d T d T T
g 2
= + + - ? ?
? (II.19)
dP
1 2 3 T 2
0 ? ? ?
et :
T PT Cp g
g g
= -
g + ? + ? - ?
Cp dT V dP T
g g
G H TS dT
0 0
T
T 0 P 0 T0

(II.20)
Après le développement on trouve :
G g = H g0 - T r r S g 0 + D 1 ( T r - Tr 0 r r ) + (T 2 - T2 ) + D 3 ( T r r 3 - T 30 ) - DT1r ln ( Tr
r
2 3 /7,0
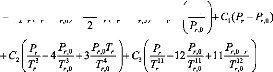
D T
T
-
T
-
3 T T 2
-
T 2
+
Tln
H
2
r
(
r r ,0 )
2 r ( r r ,0
)
r r-rn ,0
(P r --4 P a P 0 T r +C j (P P 0 +11 P ,0
Tr
C 4(P3 P3 r'° P 3'0
+ Tr
(II.21)
r 12 +11 r
3 T11 T11
Tr1,20
r
L'enthalpie, l'entropie et le volume molaires sont liés à l'enthalpie libre de Gibbs [27] :
H = - RT T2 ? ? ( G r TrYI
r [ ? (II.22)
? T
r P
S = - R[?Gr ???
(II.23)
? Tr
RT [?G ?
V = P B ? P (II.24)
r
Après développement, les équations deviennent : II.3.2.1. Pour la phase liquide :
B B
H r L ,0 + B1
( T
r -
T
)
+ 2
( T
r 2 -7;
)
+ 3
( T
3
- 7;
3
0+
( P
P
)( A
A
T
2)
A 2 ( P2 - Pt2.0)
2
H L = RTB
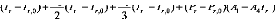
|
+ C 1 ( P r - Pr,0) + C 2 r ,' +3 . r , 3 r - 12 r, r T33 r T 3 r 0 T r % T11ll r T r1 0 1 T12 r0 r ,0 r r r ,0 1 4 r (II.25) |
S L = R [S r L 0 + Aln ( T r j+ B 2 ( T r - Tr + B 3 (T r 2 Tr ,0 2) - ( A 3 + 2 A 4 T r )(P r - Pr 0)?
(II.26)

T
,0 2
RT 2
V L B
= ? ? +
A A P A T A T
+ + ? ? (II.27)
1 2 r 3 r 4 r
PB
g 2 2 2
3 3 3
( T T
- ) + ( T T
- ) + ( T T
- ) (
+ C P P
- )
r r ,0 r r ,0 r r ,0 1 r r ,0
2 3
D D
H + D
r ,0 1
?
? ?
(II.28)
Hg R T B 3 3
= ? ? ? P P ? ? P P ? ? P P ? ?
,0 ,0 ,0
? + - +
r r r r r r
4 C 1 2 C - + -
4 C
2 ? 3 3 ? 3 ? 1 1 1 1 ? 4 1 1 1 1
T T
r r ,0 ? T T ? ? ?
r r ,0 ? ? T
? T
? ? r r ,0 ? ?
? ?
?
?
?
?
?
S g = R
|
2 RT C C C P T ? g 2 3 4 V = ? + + + B r r C + 1 3 11 11 P P B ? T T T r r r r |
? |
(II.30) |
|||||
|
Ammoniac |
Eau |
||||||
|
A1 |
3.971423.10-2 |
2.748796.10-2 |
|||||
|
A2 |
-1.790557.10-5 |
-1.016665.10-5 |
|||||
|
A3 |
-1.308905.10-2 |
-4.452025.10-3 |
|||||
|
A4 |
3.752836.10-3 |
8.389246.10-4 |
|||||
|
B1 |
1.634519.101 |
1.214557.101 |
|||||
|
B2 |
-6.508119 |
-1.898065 |
|||||
|
B3 |
1.448937 |
2.911966.10-1 |
|||||
|
C1 |
-1.049377.10-2 |
2.136131.10-2 |
|||||
|
C2 |
-8.288224 |
-3.169291.101 |
|||||
|
C3 |
-6.647257.102 |
-4.634611.104 |
|||||
|
C4 |
-3.045352.103 |
0 |
|||||
|
D1 |
3.673647 |
4.019170 |
|||||
|
D2 |
9.989629.10-2 |
-5.175550.10-2 |
|||||
|
D3 |
3.617622.10-2 |
1.951939.10-2 |
|||||
|
Hr,0 |
4.878573 |
21.821141 |
|||||
|
g Hr ,0 |
26.468879 |
60.965058 |
|||||
|
Mélange |
|||||||
|
E1 |
-41.733398 |
||||||
|
E2 |
0.02414 |
||||||
|
E3 |
6.702285 |
||||||
|
E4 |
-0.011475 |
||||||
|
E5 |
63.608967 |
||||||
|
E6 |
-62.490768 |
||||||
|
E7 |
1.761064 |
||||||
|
E8 |
0.008626 |
||||||
|
E9 |
0.387983 |
||||||
|
E10 |
0.004772 |
||||||
|
E11 |
-4.648107 |
||||||
|
E12 |
0.836376 |
||||||
|
E13 |
-3.553627 |
||||||
|
E14 |
0.000904 |
||||||
|
E15 |
24.361723 |
||||||
|
E16 |
-20.736547 |
||||||
? ?
T D ? P P ? ?
g r 3 2 2 r r , 0
S + D ln + D T T
( - ) + ( T - T ) 3
+ C - + ? (II.29)
r , 0 1 ? ? 2 r r , 0 r r , 0 2 ? 4 4
2 T T ?
? ?
T r , 0 ? r r , 0 ? ?
?
? 3 3
P P ? 1 1 ? P P ? ? ?
P
r , 0 , 0 ?
1 1 -
r r r r
C + C - - ln
3 ? 1 2 1 2 4 1 2 1 2
T T ? 3 ? T T ? ? P ? ?
? ? ? ? ? ? ?
r r , 0 r r , 0 r , 0
|
SrL0 |
1.644773 |
5.733498 |
|
|
Srg 0 |
8.339026 |
||
|
Tr,0 |
3.2252 |
5.0705 |
|
|
Pr,0 |
2 |
3 |
Tableau II.2. Les coefficients pour les équations (II.13.17.21.22.23.24.25.26) et (II.32.33.34) [27].
Selon l'analyse donnée par Ziegler et Trepp [20], la fonction de Gibbs d'un mélange liquide de l'ammoniac-eau est donnée par la relation idéale de mélange de solution plus l'énergie d'excès de Gibbs GE. Cette énergie, dont la relation est proposée par Xu et Yogi Goswami [22], est limitée à trois facteurs qui tiennne compte de la déviation du comportement idéal de solution (la solution liquide ne se comporte pas comme une solution idéale).
Grx x ? F F x
E = -
( ) ( ) ( )2
1 2 2 1 3 2 1
F x ? (II.31)
1 + - + - ?
?
E E
5 6
Avec : F E E P E E P T
= + r (
+ + r ) r + + (II.32)
1 1 2 3 4
Tr Tr
F 2 = E 7 + E 8 P r + (E 9 + E 10P r )T + E 11 + E 2 (II.33)
r T r Tr
6
F 3 = E 13 + E 14 P + E 15 E12 (II.34)
T T
r r
Les coefficients Ei (i=1....16), pour les équations (II.32.33.34) sont indiqués dans le tableau (II.2). L'enthalpie, l'entropie et le volume d'excès sont données par [27] :
|
H E = - RT B 7,,2 |
??( G E Tryl ? Tr L |
Pr x , |
(II.35) |
(II.36)
E
S = - R ? ? Gr
?
??
Tr P
r,x
RTG
? ? ? E V E = ? ?
B
r (II.37)
P B ? Pr ?T
r
,x
Après le développement on trouve :
2 E E
3 ? 2 E 3 E
5 6 11 12
E E P + x E E P
1 + + + -
(2 1)
2 r ? +
2 7 8 r + + 2
H E = RT Bx (1 - x)
T r Tr ?T r Tr
2 E 3 E ?
2 ? 15 16
+ - ? +
(2 1)
x E E P + ?
13 14 r + 2
T T
? r r ?
?
?
? ?
? ?(II.38)
?
?
? ?
|
S E = Rx (1 - x |
?E E 2 ? E 2 E ? ? 5 6 11 12 ? - - E E P + + + - - - (2 1) x E E P + + 3 4 ? ? ? r 2 3 9 10 r 2 3 T T r r ? T T r r ? ? ) ?(II.39) ? ? 2 ? ? 2 ? E E + - ? + ? 15 16 (2 1) x ? 2 3 ? ? ? T T r r ? ?? |
|
|
RT 2 V E B = x x E E T x E E T (1 ) - ? 2 + + - (2 1)( ) (2 1) 14 4 r 8 + + - ? x E ? 10 r ? P B |
(II.40) |
|
Donc, l'enthalpie, l'entropie et le volume molaire du mélange liquide NH3-H2O deviennent :
Hm L = xHNH L 3 + (1 - x )HH L 2O+ HE (II.41)
S m = xS NH + - x S H O + S + S (II.42)
L L L E ml
(1 )
3 2
V m = xV NH + - x V H O + V (II.43)
L L L E
(1 )
3 2
Avec : [ ln( ) (1 )ln(1 ) ]
S = - R x x + - x - x (II.44)
ml
La concentration massique est le rapport entre la masse de l'ammoniac et celle de la solution :
|
î= |
mNH3 |
(II.45) |
|
m NH 3 + mH2O |
où mNH3 : est la masse d'ammoniac de la solution ;
mH2 O : est la masse d'eau.
Entre la concentration massique î et celle molaire x existe la relation approchée :
î
=
x
î
+
MH2O
MNH3
(II.46)
La masse molaire à une solution de concentration molaire x est :
M = - x M H O + xM NH (II.47)
L (1 )
2 3
Il en résulte donc les expressions pour l'enthalpie, l'entropie et le volume massique de la solution liquide :
|
(II.48) (II.49) (II.50) |
La solution dans la phase vapeur à été considérée comme étant une solution idéale. Cette hypothèse est basée sur l'absence de l'énergie d'excès de Gibbs GE. L'enthalpie, l'entropie et le volume molaires du mélange vapeur de NH3-H2O sont calculés par :
H m = yH NH + - y H H O (II.51)
g g g
(1 )
3 2
S m = yS NH + - y S H O + S (II.52)
g g g mg
(1 )
3 2
V m = yV NH + - y V H O (II.53)
g g g
(1 )
3 2
avec : [ ln( ) (1 )ln(1 ) ]
S = - R y y + - y - y (II.54)
mg
Ces trois fonctions ont pour expressions :
Hg
h g = m (II.55)
mMg
Sg
s g =
(II.56)
m
Mg
V g
v g m
= (II.57)
m M g
Mg étant la masse molaire de la solution dans la phase vapeur.
M gg= =(1 - --y )MMH HO 0+ +yMM2 233(II.58)
Le point de bulle est calculéàa partir de lacorrélationn proposée par El-Sayed et Tribus [28] :
7? ? 10 ? ? ? ? ? ?
i
? P ?
,
= - ? +
? ? ( ) ln
i c m
T T (II.59)
eb c m
, ? C x
C i ij ? ? ? ? ? ?
i = 1 ? ? P
j = 1 ? ? ? ? ?
? ? ? j
|
4 avec H 2 O -? ( a x i T T = c m , c i i |
)(II.60)) |
i=11
|
? 8 ? i ( ) ? i ? b x ? H O 2 i = 1 P c m P c = e ? ? 1, oùuTc,m, : est latempératuree critique
du mélangeNH3-H2O0 ; |
(II.61) |
Le point de rosée est calculéàa partir de lacorrélationn proposée par EL-Sayed et Tribus [28] :
i
6 ? ? ? 4 ? ? ?
? ? ?
j P ?
c m
,
T T
= - ? +
? ? [ ln(1.0001 ) ln
] ? ? (II.62)
d c m
, ? d A - x
i ij ? ? ?
? P
i = 1 ? ? j = 1 ? ? ? ?
? P? ? ?
J
Leséquationss(II.59.60.61.62)) la pression en [psi] et latempératuree en[degrée F].
Les coefficients pour leséquationss(II.59.60.61.62)) sontindiquéss dans le tableau(II.3)) [27].
|
i |
ai |
bi |
Ci |
di |
|||||||||||||||||||
|
1 |
205.0009 |
0.368105523897 |
153.634521459 |
153.17055346 |
|||||||||||||||||||
|
2 |
280.930556 |
- 3.6679548875 |
- 13.0305543892 |
- 11.7705687461 |
|||||||||||||||||||
|
3 |
-317.0130009 |
46.6000470809 |
- 1.14845282991 |
- 1.78126355957 |
|||||||||||||||||||
|
4 |
263.194444 |
-262.921061996 |
0.550358094447 |
0.647385455059 |
|||||||||||||||||||
|
5 |
732.99536936 |
- 0.0753450148427 |
-0.0719950751898 |
||||||||||||||||||||
|
6 |
- 1076.0613489 |
0.0048111668267 |
0.00285423950706 |
||||||||||||||||||||
|
Aij |
j |
1 |
2 |
3 |
4 |
||||||||||||||||||
|
i |
|||||||||||||||||||||||
|
1 |
194.793913463 |
74.236124188 |
9.84103819552 |
0.436843852745 |
|||||||||||||||||||
|
2 |
- 74.3508283362 |
-33.2941879809 |
-4.78866918581 |
-0.225416733476 |
|||||||||||||||||||
|
3 |
13.0175447367 |
6.1586564117 |
0.789740337141 |
0.0321510834958 |
|||||||||||||||||||
|
4 |
-0.90857587517 |
-0.356752691147 |
0.0238067275502 |
0.00495593933952 |
|||||||||||||||||||
|
5 |
-0.00071863574153 |
-0.0251026383533 |
-0.0191664613304 |
-0.0017014253867 |
|||||||||||||||||||
|
6 |
0.00195441702983 |
0.00280533349937 |
0.0013899436563 |
0.000116422611616 |
|||||||||||||||||||
|
C ij |
i |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|||||||||||||||
|
j |
|||||||||||||||||||||||
|
1 |
-462.460321366 |
421.443122208 |
-248.783804168 |
126.965580728 |
-33.5343446156 |
3.97454953787 |
-0.170806170177 |
||||||||||||||||
|
2 |
23739.9986309 |
- 14560.354925 |
4807.07241098 |
- 2090.45270574 |
601.878586689 |
- 77.026846469 |
3.48182859299 |
||||||||||||||||
|
3 |
- 194504.35292 |
53051.4495633 |
13565.1003309 |
1993.17101166 |
-3064.82070658 |
541.19105807 |
- 27.7957587743 |
||||||||||||||||
|
4 |
639383.528867 |
382763.793582 |
- 466407.780832 |
100706.510396 |
71.7954752052 |
- 1696.60270972 |
113.762064546 |
||||||||||||||||
|
5 |
- 523748.057636 |
- 3.58358986875E+6 |
2.82708344764E+6 |
- 687388.808612 |
51780.666659 |
1713.45942707 |
- 258.750496922 |
||||||||||||||||
|
6 |
-2.32827147551E+6 |
1.22432653815E+7 |
-8.46971515799E+6 |
2.13241246959E+6 |
-209714.899856 |
4019.01019872 |
311.002585218 |
||||||||||||||||
|
7 |
7.5624I853499E+6 |
-2.23079700156E+7 |
1.4459588896E+7 |
-3.69919965914E+6 |
405011. 985355 |
- 14844.7928004 |
- 123.917993454 |
||||||||||||||||
|
8 |
- 9.66829589504E+6 |
2.28966568499E+7 |
-1.42810875331E+7 |
3.68836522546E+6 |
-428310.461566 |
19481.0094551 |
- 123.480627492 |
||||||||||||||||
|
9 |
5.92208187086E+6 |
- 1.24833248091E+7 |
7.59640359678E+6 |
- 1.97512239296E+6 |
238153.698326 |
-12107.0794501 |
154.375042114 |
||||||||||||||||
|
10 |
- 1.43240552125E+6 |
2.81331171633E+6 |
- 1.68400264482E+6 |
440201.446068 |
- 54497.0973336 |
2966.92804386 |
-48.5083828701 |
||||||||||||||||
|
7 |
797.948078048 |
-0.000120433757177 |
|||||||||||||||||||||
|
8 |
- 235.903904222 |
||||||||||||||||||||||
Tableau II.3. Les coefficients pour les équations (II.59.60.61.62) [27]. II.6. Propriétés de transport de la solution NH3-H2O [29] :
Une relation semi-empirique du calcul de la densité de la solution liquide à la saturation est la suivante :
|
3 2 3 3 2 2 ñ = - ( 0.00695 1.304 57.675 ) (0.00547 1.0625 48.75 50) T + T - î T + T - T + T + î 3 2 5 3 2 - (0.00128 0.264 14.1 305) 8.3310 - T - T + T + î + T - 0.0206 0.817 990 T + T + |
(II.63) |
Cette relation fournit les valeurs de la densité exprimées en (Kg.m-3), le domaine de précision satisfait pour les calculs techniques est :
· Pour les températures : 0 < T < 100 [ ° C] ;
· Pour les concentrations : 3
0.1 < î < 0.5 ? ? kg / m ? ? .
On peut calculer la concentration massique de la solution NH3-H2O sur la base de la connaissance des densités et des températures :
î = -
vT
2 - 4 2
5.5965 8.1301 2.5260 0.029266 1.099910
+ v - v + T - T - 0.047472
(II.64)
2 4 2 - 5 2 2 3
+ 0.017601 1.698410 -
v T + vT - 60501310 v T v m kg et T C
? ?
/ [ ]
°
? ?
Dans le domaine de validité de l'équation (II.63), l'erreur moyenne dans le calcul de la concentration est de 0.0012, mais celle maximale est de 0.004.
Dans la figure (II.4) on représente le diagramme des variations de la densité de la solution NH3-H2O en fonction de la concentration et la température.
|
|||
|
|||
II.6.2. La viscosité dynamique de la solution liquide :
|
|
||
|
|
|
||
La viscosité dynamique de l'ammoniac liquide est :
2214 5 2 ?
6
ì L 10 exp 0.3180
- ?
= - + 5.983910 T (II.67)
NH ? ?
3 ? T ?
Dans les relations (II.66) et (II.67), T et p sont respectivement en [K] et [Pas.s].
La figure (II.5) présente la variation de la viscosité dynamique en fonction de la concentration massique. Le domaine de validité de l'équation (II.65) est :
· Pour les concentrations : 0.3 < î < 0.9 ;
· Pour les températures : 10<T<60 °C.
Concentration î [ Kg / Kg ]
VicrncitiS rivnaminue u r 1(16 Pacc 1
Dans ce domaine, l'erreur moyenne fournie par l'équation (II.65) est de 6%, alors que celle maximale est de 12%.
Figure II.5. La viscosité dynamique de la solution NH3H2O
La solution gazeuse est considérée comme étant une solution idéale, donc la viscosité de la solution gazeuse est :
ì = - î ì H O + îì NH (II.68)
g g g
(1 )
2 3
|
|
||
|
|
|
||
La relations (II.69), pour la vapeur d'eau est valable pour l'intervalle de température : 0 °C <T<1000 °C, et la relation (II.70) est valable pour l'intervalle : -200 °C <T<1200 °C, ainsi que les valeurs calculées résulte en micropoises. La température est exprimée en k.
Pour la solution gazeuse composée de la vapeur d'eau et de l'ammoniac en phase gazeuse, on peut adopter l'hypothèse d'une solution idéale composée d'un gaz parfait. Dans ces conditions, la conductivité thermique de la solution gazeuse a pour expression :
ë = - î ë H O + îë NH (II.71)
g g g
(1 )
2 3
où ë H O et ë NH représentent la conductivité thermique de l'eau en état vapeur et la conductivité
g g
2 2
thermique d'ammoniac gazeuse, respectivement.
ëH O
g 2 4 2 8 3
= 17.53 2.4210
- - T + 4.310 - T - 21.7310 - T (II.72)
2
Cette relation est valable pour l'intervalle : 0 °C<T<800 °C.
g 2 4 2 8 3
= +
091 12.8710 - T + - T
ë NH 2.9310 - 8.6810 - T (II.73)
3
Cette relation est valable pour l'intervalle de : 0 °C<T<1400 °C. Les valeurs calculées pour les deux équations (II.72.73) sont exprimées en (microcal/s.cm.K), et la température en K.
Pour la solution liquide, on peut accepter l'hypothèse d'une solution idéale. Dans ces conditions la conductivité thermique de la solution liquide a pour expression :
ë = - î ë H O + îë NH (II.74)
L L L
(1 )
2 3
avec :
ë H O
L 3 6 2
= - + - T
0.4743 5.79310 - 7.22210 - T (II.75)
2
La relation (II.75) est valable pour l'intervalle : 273 K<T<373 K.
L 3 - 6 2
ë = 1.06094741 1.576510 -
- T - 1.228510 T (II.76)
NH 3
La relation (II.76) est valable pour l'intervalle : -77 °C<T<100 °C. ë en (w/m.k).
La figure (II.6), représente la variation de la conductivité thermique de la solution NH3-H2O liquide en fonction de la concentration et de la température.
r m
· 1 / 1_ erg 1Figure II.6. La conductivité thermique de la solution NH3-H2O liquide. II.6.6. La chaleur spécifique isobare pour la solution gazeuse :
En adoptant l'hypothèse de la solution idéale dans la phase gazeuse, composée à son tour d'un gaz parfait, en peut supposer les relations suivantes pour le calcul de la chaleur spécifique isobare de la solution gazeuse :
Cp = - î Cp H O + î Cp NH (II.77)
g g g
(1 )
2 3
La chaleur spécifique isobare pour la vapeur d'eau est donnée par :
g 3 - 6 2 10 3
1.79 0.1110 -
Cp H O + T + 0.5910 T - 2.0010 -
= T (II.78)
2
Cette relation est valable pour l'intervalle : 10 °C<T<115 °C.
La chaleur spécifique isobare pour l'ammoniac vapeur est donnée par :
g 3 - 6 2 10 3
1.604 1.410 -
CpNH + T + 10 T - 6.9610 -
= T (II.79)
3
Cette relation est valable pour l'intervalle de : -50 °C<T<50 °C. Les valeurs calculées sont en (kj/kg.K), et la température est exprimée en K.
La chaleur spécifique isobare de la solution liquide est donnée par la relation :
L = ? + î
4.186 1 (0.118 0.00208 )
2
Cp + T ? ? (II.80)
?
où bien on peut la calculer à partir de la relation :
Cp = - î Cp H O + î Cp NH (II.81)
L L L
(1 )
2 3
Les relations de calcul pour les chaleurs spécifiques isobares de l'ammoniac et l'eau liquide sont :
- 6 2 9 3
CpNH
L 8.049678 0.1301846 464.227410
+ T - T + 575.9936 10 -
= - T (II.82)
3
La relation (II.82) valable pour le domaine : -77.4 °C<T<100 °C. et
L 3 - 6 2 9 3
2.8217826 11.8254510 -
Cp H O + T - 35.04100610 T + 36.00378610 -
= T (II.83)
2
Relation valable pour l'intervalle : 0 °C<T<350 °C. Les chaleurs spécifiques sont exprimées en (kj/kg.k), la température est exprimée en k.
La figure (II.7), présente la variation de la solution NH3-H2O liquide en fonction de la concentration et la température.
Figure II.7. La chaleur spécifique isobare de la solution NH3-H2O liquide.
g 3 - 6 2 9 3
14.4 0.9510 -
CpH - T + 1.9810 T - 0.4310 ( / ) ( )
-
= T KJ KgK T K (II.84)
2
Figure II.8. La chaleur spécifique isobare de l'hydrogène
II.6.9. La conductivité thermique pour l'hydrogène gazeux et liquide : ë H (1.702 0.05573 T )10 ( cal / cm .sec. K )
- 4
= + (II.85)
2
Figure II.9. La conductivité thermique de l'hydrogène [30]
3
T 2 T +650.39
- 7
ç = 85.55810 - - ( )
poises
T + 19.55 T+ 1175.9
(II 86)
Figure II.10. La viscosité dynamique de l'hydrogène
Figure II.11. L'enthalpie massique de l'hydrogène [30]
Le couple binaire ammoniac-eau, a été la solution principale dans le fonctionnement des machines frigorifiques à absorption et cela pour plusieurs années. Plusieurs études ont été effectuées sur l'équilibre vapeur-liquide et sur les propriétés thermodynamiques et de transport de ce mélange.
Ce chapitre a rassemblé les équations de résolution du problème d'équilibre liquide-vapeur et qui sont : l'équation d'état pour la phase vapeur, et l'équation décrivant la non idéalité de la phase liquide. Cependant les écarts à l'idéalité sont généralement beaucoup plus marqués en phase liquide, en raison de sa densité, qu'en phase vapeur, et par conséquent il est d'usage d'adopter l'hypothèse d'un équilibre entre une phase vapeur assimilée à un mélange de gaz parfait et une phase liquide non idéale, ce qui permet de simplifier aussi les calculs mathématiques.

Avant de pouvoir réaliser la simulation nous devons passer par un calcul de chaque partie du cycle frigorifique et cela en déterminant les différents débits du mélange, aussi, les conditions opératoires telles que la pression, la température, et, la concentration ; chose qui nous permettra par la suite d'effectuer un calcul des enthalpies pour les différents débits entrants et sortants dans chaque compartiment de l'installation.
A l'aide de ces calculs ont pourra connaître l'efficacité de la machine et son coefficient de performance.
Le calcul du processus cyclique de l'agent de travail dans une machine frigorifique à absorption-diffusion se fait à l'aide d'une simulation numérique sur la base de l'équation fondamentale de la solution ammoniac-eau présentée ultérieurement (chapitre IV), ainsi que les équations pour le calcul des grandeurs d'états thermodynamiques déterminées en fonction de l'équation fondamentale.
Ces machines utilisant le couple eau-ammoniac sont utilisées pour des applications ménagères. Cherchant, d'une part à miniaturiser ces machines, d'autre part à éliminer le seul organe mécanique (la pompe) afin d'équiper des armoires de très faible capacité (35 a 120dm3), les ingénieurs suédois Platen et Munters ont pensé, dès 1926, à introduire dans le circuit un gaz inerte qui, en égalisant les pressions cotes haute et basse pression, permettait néanmoins à l'ammoniac de se vaporiser à basse pression (loi de Dalton pour le mélange des gaz).
La puissance frigorifique d'une telle machine dépend de la vitesse de diffusion de l'ammoniac dans le gaz neutre : l'hydrogène (en l'occurrence). Ce sont donc des machines a absorption-diffusion que des machines a absorption pure.
D'une façon plus détaillée le principe de fonctionnement d'une machine a absorption-diffusion est base sur la faculté du liquide utilise, absorbeur (réaction exothermique) et de désorbeur (réaction endothermique), cette machine utilise également le fait que la solubilité de la vapeur dans le liquide dépend de la température et de la pression. Ainsi, ces machines utilisent comme fluide de travail un mélange binaire, dont l'un des composants est beaucoup plus volatil que l'autre.
Figure III.1. Description schématique du cycle à absorption-diffusion NH3-H2O-H2 . III.1. Détermination des points de fonctionnement du cycle NH3-H2O-H2 :
Les machines frigorifiques à absorption mono-étagées sont soumises à certaines conditions limites de fonctionnement et qui, une fois dépassées, ne peuvent atteindre la température d'évaporation désirée voir même l'arrêt de fonctionnement.
La possibilité d'obtention de la température d'évaporation nécessaire ou non, est dictée par des températures limites qui se résument en :
· :. La température moyenne du chauffage (Tch), qui est dans les conditions idéales
de transfert de chaleur dans le bouilleur, égale à la température finale de la solution pauvre à la sortie du bouilleur ;· :. La température d'entrée du fluide de refroidissement (l'eau), (Te) dans les
conditions de travail idéales, égale à la température à la fin d'absorption (T1) ;· :. La température du fluide froid réalisée (T0) dans le cas d'une surface infinie de
transfert de chaleur dans l'évaporateur égale à la température finale de vaporisation (T7).
+ Facteur de circulation :
Il est défini comme étant le rapport des débits massiques de la solution riche m sr , et de vapeur d'ammoniac m a [14] :
|
fc |
m ~ î î sr g - sp = = (III.1) m ~ î î a sr - sp |
où îg : la concentration de vapeur d'ammoniac générée à la sortie de la colonne de rectification est supposée de l'ordre de 99.9 % ;
îsp : la concentration de la solution pauvre à la sortie du bouilleur ; îsr : la concentration de la solution riche à la sortie de l'absorbeur ; Äî = îsr - îsp : taux de dégazage (intervalle de neutralisation).
D'après les recommandations, si le facteur de circulation fc est supérieure à 20, ceci correspond à un taux de dégazage Äî = (2÷3) %, le cycle n'est plus possible, car une petite variation de l'une des trois températures du système pourrait conduire à un taux de dégazage nul, ce qui rendrait le cycle physiquement impossible et une machine réelle cesserait de fonctionner avant cela. Il est donc recommandé de prendre des valeurs pour le taux de dégazage supérieures à 5 %, néanmoins des valeurs plus importantes ne sont pas conseillées [31].
Pour le calcul du cycle thermodynamique (à partir de la figure (III.1)), les trois températures (TC, Te, T0), sont souvent des données du projet. Les pressions de condensation (PC) et de vaporisation (P0), doivent être choisies en fonction de ces trois températures.
+ Les données du calcul :
) L'agent de refroidissement des appareils (l'eau) :
9 La température à l'entrée Te1
;
9 La température à la sortie Te2.
) L'agent de chauffage (l'eau chaude) : 9 La température à l'entrée Tch1 ; 9 La température à la sortie Tch2.
) L'agent intermédiaire à refroidir (l'eau) :
V' La température à l'entrée dans l'évaporateur T11 ;
V' La température à la sortie de l'évaporateur T12.
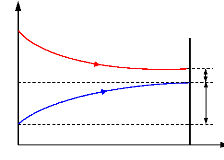
A cause de la présence d'une quantité d'eau dans l'agent frigorifique, la vaporisation qui a eu lieu dans l'évaporateur ne se produit pas à une température constante mais elle varie entre la température au début et à la fin de vaporisation. Cet intervalle de température de vaporisation dépend de la pureté de l'ammoniac liquide, c'est-à-dire, du degré de la rectification de celle-ci.
+ La température à la fin de la vaporisation, est déterminée en fonction de la
température de la solution à refroidir à la sortie de l'évaporateur.
T7 = T1 2 ? Ä T1 , Ä T1 = (2 ÷ 4) ° C (III.2)
+ La pression de vaporisation P0 (basse pression) en fonction de (T7) et
(î7=99.9%), est calculée a partir de la formule (III.58).
A
Aevap
T
Tf1
Tf2
ÄTf
T7
ÄT0
T12
Figure III.2. La variation de la température dans l'évaporateur.
v La température de condensation sera en fonction de la température de l'eau de refroidissement à la sortie du condenseur :
T12 = TC = Te 2 + Ä TC , Ä TC = (2 ÷ 5) ° C (III.3)
T
TC
ÄTC
Te2
Te1
Acd A
Figure III.3. La variation de la température dans le condenseur.
v La pression de condensation PC (haute pression) en fonction de (TC) et (îg=99.9%), est calculée a partir de la formule (III.58).
v La pression dans l'absorbeur est déterminée en fonction de la pression dans l'évaporateur et des pertes de pression sur le trajet entre les deux appareils :
Pab = P0 ? ÄP0 , ÄP0 = (0.2 ÷ 0.49) bar (III.4)
v La température de la solution riche à la sortie de l'absorbeur, est déterminée en fonction de la température de l'agent de refroidissement à l'entrée de l'absorbeur :
T1 = Te 1 + Ä Te 1 , Ä Te1 = (4 ÷ 12) ° C (III.5)
v La température de la solution pauvre à la sortie du bouilleur, est déterminée en fonction de la température d'eau chaude à la sortie du bouilleur :
T 3 = T ch 1 ? Ä T ch 1 , Ä T ch 1 = (4 ÷ 12) ° C (III.6)
Ab
A
T
Tch1
ÄTch1
Tch2
T3
ATch2
T2
Figure III.4. La variation de la température dans le bouilleur.
La température de la solution riche à l'entrée du bouilleur, est déterminée a partir
de l'équation (III.61).
T2 = f ( PC , îsr) (III.7)
v La concentration de la solution riche à la sortie de l'absorbeur est déterminée à l'aide de la formule (III.66).
îsr = f (Pab , T1) (III.8)
v La concentration de la solution pauvre à la sortie du bouilleur : îsp = f ( Pb , T3) calculée à partir de l'équation (III.66) (III.9)
v La vérification de l'intervalle de la neutralisation des gaz :
Äî = îsr - îsp = 5 % (III.10)
v Le facteur de circulation fc :
|
|
||
v La température de sortie dans l'échangeur liquide-liquide S2 :
|
|
||
v La température à l'entrée et à la sortie de l'échangeur gaz-gaz S1 :
T6 = T5 ? Ä TH 2 , Ä TH2 = (5 ÷ 15) ° C (III.13)
1 CpH 2 (T6 )
T T
SV H
ç Cp ( T )
S 1 Va 7
T8 = T7 + Ä TV (III.14)
Ä = Ä (III.15)
2
AS1
A
T
T5
ÄTV
T8
H2 vapeur
NH3 vapeur
T6
LTH2
T7
Figure III.5. La variation de la températme dans l'échangeur gaz-gaz S1.
+ La température à la sortie du bouilleur :
T9 = T2 + Ä T9 , Ä T9= (4 ÷ 10)° C (III.16)
+ La température à la sortie de la colonne de rectification :
T10 = T9 + Ä TR , Ä T R= (4 ÷ 10) ° C (III.17)
AR
A
T
T9
ÄTH2O
T11
NH3+H2O vapeur
ÄTR
T10
H2O liquide
Figure III.6. La variation de la température dans la colonne de rectification. + La température de l'eau refoulée à l'entrée du bouilleur :
T11 = T9 - Ä TH 2 O , Ä T H 2O= (4 ÷ 10) ° C (III.18)
+ L'enthalpie de la solution riche à la sortie de l'absorbeur :
h 1 = f (îsr , T1, P ab ) (III.19)
+ L'enthalpie de la solution riche à la sortie de l'échangeur liquide-liquide S2 :
h 2 = f (îsr , T2, PC) (III.20)
+ L'enthalpie de la solution pauvre à la sortie du bouilleur :h 3 = f ( î sp , T 3 , P C ) (III.21)
+ L'enthalpie de la solution pauvre à la sortie de l'échangeur liquide-liquide S2 :
h 4 = f ( î sp , T4, P ab ) (III.22)
+ L'enthalpie à l'entrée de l'échangeur gaz-gaz S1 :
h 7 = f ( î 7 , T7 , P0) (III.23)
L'enthalpie à l'entrée de l'absorbeur :
h 8 = h 7 + CpVa (T7 )Ä TV (III.24)
v L'enthalpie de la solution vapeur à la sortie du bouilleur :
h 9 = f (î9 , T9, PC) (III.25)
î9 = f (PC , T9) calculée à partir de l'équation (III.66)
v L'enthalpie de l'ammoniac liquide saturé à la sortie du condenseur :
h 12 = f (TC , PC) (III.26)
v L'enthalpie de l'eau refoulée à l'entrée du bouilleur:
h 11 = f (T1 1, PC) (III.27)
v L'enthalpie de la vapeur d'ammoniac à la sortie de la colonne de rectification :
h 10 = f (T1 0 , PC) (III.28)
La modélisation est basée sur les lois de conservation de chaleur et masse au niveau de chaque élément
de l'installation auxquelles on ajoute les équations d'équilibre de mélange ammoniac-eau et l'hydrogène.
m& 9 + m& 3 = m& 11 + m& 2 (III.29)
î9 m& 9 + î3 m& 3 = î 11 m& 11 + î2 m& 2 (III.30)
?b = m& 3 h 3 + m& 9 h 9 - ( m& 11 h 11 + m& 2 h2) (III.31)
m& 3 = m& 10(fC -1) (III.32)
m& 9 = m& 10 + m& 11 (III.33)
î9 m& 9 = î 10 m& 10 + î 11 m& 11 (III.34)
?R = m & 10 h 10 + m & 11 h 11 - m & 9 h 9 (III.35)
|
r =m11 & |
(débit reflut ( Kg / Kg)) |
(III.36)
m10
m 10 = m2 (III.37)
(1 +fC )
m& 10 = m& 12 (III.38)
î10 = î 12 (III.39)
? = ni1010 -- ni12 12
C h h (III.40)
m& 7 = m& 6 +m& 12 (III.41)
î7 m& 7 = î6 m & 6 + î 12 m & 12 (III.42)
?0 = m& 6 h 6 + m& 12 h 12 -m& 7 h7 (III.43)
(?0représente la quantité de froid produite par l'installation).
m& 7 = m& 8 , î7 =î8 (III.44)
m& 5 =m& 6 , î5 = î6 (III.45)
?S 1 = m& 7 h 7 - m & 8 h 8 (III.46)
m& 1 + m& 5 = m& 4 +m& 8 (III.47)
î 1 m & 1 +î5 m& 5 = î4 m& 4 +î 8 m & 8 (III.48)
?ab = m& 4 h 4 + m& 8 h 8 - ( m& 1 h 1 +m& 5 h5) (III.49)
m& 1 = m& 10 fC (III.50)
m & 2 = m & 1, î 2 = î 1 (III.51)
m & 3 = m & 4 , î 3 = î 4 (III.52)
? S 2 = m& 1 h 1 - m& 2 h2 (III.53)
Pour vérifier le bilan thermique de l'installation on calcule l'erreur, celle ci doit être inférieure à (5 %) :
|
erreur = |
( ? ? ? ? ? + - + + ) ( ab C b R 0 ) 5 % < ( ? ? + ) ab C |
(III.54) |
|
COP |
Effet frigorifique produit |
La chaleur totale fournie
Pour la machine frigorifique à absorption-diffusion NH3-H2O-H2
(III.55)
COP ?0
=
?b
Habituellement, l'étude de la machine frigorifique à absorption est faite à l'aide de deux diagrammes thermodynamiques se rapportant au mélange binaire utilisé. Le premier est le diagramme d'Oldham en (logP,1/T) qui permet d'évaluer les deux pressions extrêmes du fonctionnement de la machine, les concentrations du mélange et le cycle suivi par celui-ci. Le second diagramme est celui de Merkel en (h,î) qui détermine le comportement énergétique de la machine et par conséquent permet de dimensionner celle-ci.
La connaissance approfondie de la machine, en variant les différentes valeurs de paramètres tel que les températures, concentration ..., ne peut être manuelle, c'est un travail long et fastidieux sans parler des imprécisions dans la lecture des résultats.
Nous proposons dans ce qui suit, une automatisation de calcul des caractéristiques de ces machines, en se basant sur la numérisation des diagrammes de Merkel et d'Oldham. Pour la numérisation du diagramme de Merkel, nous utiliserons le mode de Gibbs [27], quant au diagramme d'Oldham nous proposons un modèle mathématique basé sur l'équation de Clapeyron [33].
La simulation du cycle nécessite non seulement la connaissance des propriétés physico-chimiques des systèmes, mais aussi l'établissement des corrélations en fonction de la température, la pression et la concentration, ....
III.3.1.1 Corrélations thermodynamiques de l'agent d'absorption (eau) : + Pression de saturation [34] :
i = 1
5a i
log ( )
P = ?
10 T -
i 1
(III.56)
Où a
: 7.13727210 ,
= a = 1820.059457 , a = 53309.1578 , a = - 45431991.41 ,
1 2 3 4
|
a = 4602051824, P 5 |
[ ] [ ] KPas et T K |
. |
+ Température de saturation :
La température de saturation de l'eau T [K] en fonction de la pression P[KPas], est obtenue par la résolution de l'équation (III.56) en utilisant l'algorithme de NEWTON-RAPHSON. Annexe (01).
III.3.1.2. Corrélations thermodynamiques du fluide frigorigène (ammoniac) : + Pression de saturation [33] :
a a
1 2
log ( )
P a
= + + (III.57)
10 0 (1.8. 491.7) (1.8. 491.7) 2
T + T +
|
Où |
: a = 6.59924 , a = - 1721.24882 , 2 112599.5598 , a = - P KPas et T C [ ] [ ] ° . 0 1 |
et : 0 = = °
T 325 .
C
+ Température de saturation :
La température de saturation de l'ammoniac est obtenue par la résolution de l'équation du 2ème degré (III.57).
III.3.1.3. Corrélations thermodynamiques du
mélange NH3-H2O :
+ Pression de saturation du
mélange NH3-H2O [33] :
log ( ) ( ) B ( î )
P A
= î - (III.58)
10 T
avec : A ( î ) = 7.44 - 1767 î + 09823 î + 0.3627 î (III.59)
2 3
B ( î ) = 2013.8 - 2155 î + 1540.9 î - 194.7 î (III.60)
2 3
P[KPas] et T[K], avec î : concentration massique de NH3 dans le mélange liquide. Le domaine de validité de cette équation est :
> 0.01 = P = 60 bar ;
> -75 = T = 240 °C.
+ La température de saturation du mélange liquide NH3-H2O :
De l'équation (III.58), et si P et î sont connus, on a l'expression de la température de saturation :
|
T= |
B ( î ) |
P[KPas] et T[K] (III.61) |
|
( A ( ) log ( ) î - 1 0 ) P |
·:. Température de saturation du
mélange vapeur [25] :
n i
P
4 0
= 0 (1 ) ln
î ? ? ? ?
m
- ? ? ? ?
i
T T a
? (III.62)
i P
i ? ? ? ?
oü les coefficients ai, mi et ni sont consignés dans le tableau (III.7). Le domaine de validité de cette équation est :
> 0.01 = P = 100 bar ;
> 0 = î = 1.
|
i |
mi |
ni |
ai |
||||
|
1 |
0 |
0 |
+0.324 004 x 101 |
||||
|
2 |
0 |
1 |
-0.395 920 x 100 |
||||
|
3 |
0 |
2 |
+0.435 624 x 10-1 |
||||
|
4 |
0 |
3 |
-0.218 943 x 10-2 |
||||
|
5 |
1 |
0 |
-0.143 526 x 101 |
||||
|
6 |
1 |
1 |
+0.105 256 x 101 |
||||
|
7 |
1 |
2 |
-0.719 281 x 10-1 |
||||
|
8 |
2 |
0 |
+0.122 362 x 102 |
||||
|
9 |
2 |
1 |
-0.224 368 x 101 |
||||
|
10 |
3 |
0 |
-0.201 780 x 102 |
||||
|
11 |
3 |
1 |
+0.110 834 x 101 |
||||
|
12 |
4 |
0 |
+0.145 399 x 102 |
||||
|
13 |
4 |
2 |
+0.644 312 x 100 |
||||
|
14 |
5 |
0 |
-0.221 246 x 101 |
||||
|
15 |
5 |
2 |
-0.756 266 x 100 |
||||
|
16 |
6 |
0 |
-0.135 529 x 101 |
||||
|
17 |
7 |
2 |
+0.183 541 x 100 |
||||
|
T0 = 100 K |
P0 = 2 MPa |
||||||
Tableau III.7. Les coefficients de l'équation (III.62)
+ La concentration massique du mélange NH3-H2O : La concentration massique est donnée par l'expression :
mNH 3
î = (III.63)
mmélange
avec : NH
m = n M
NH NH
3 3 3
|
m = n M H O H O H O 2 2 2 m = m + m mélange NH H O 3 2 n NH 3 d'où : î = M H O 2 n + n NH H O 3 2 MNH 3 |
(III.64) |
|||
|
M |
H O 2 NH3 |
1.05 |
, |
|
On remarque que la concentration molaire de NH3 est presque identique à sa concentration massique et on peut donc écrire que :
|
î |
n NH3 ~ n + n NH H O 3 2 |
(III.65) |
L'équation qui donne î en fonction de P et T est :
|
? |
194.7 ? ? 1540.9 ? ? 2155 ? 3 2 0.3627 + î ? + ? 0.9823 - ? - ? - î 1.767 ? î T ? ? T ? ? T ? |
+ |
(III.66) |
|||||||
|
2013.8 7.44 - - log ( ) 0, P = 10 T |
P KPas et T K [ ] [ ] |
|||||||||
|
i |
mi |
ni |
ai |
|||||||
|
1 |
0 |
0 |
+1.980 |
220 |
17 x 101 |
|||||
|
2 |
0 |
1 |
-1.180 |
926 |
69 x 101 |
|||||
|
3 |
0 |
6 |
+2.774 |
799 |
80 x 101 |
|||||
|
4 |
0 |
7 |
-2.886 |
342 |
77 x 101 |
|||||
|
5 |
1 |
0 |
-5.916 |
166 |
08 x 101 |
|||||
|
6 |
2 |
1 |
+5.780 |
913 |
05 x 102 |
|||||
|
7 |
2 |
2 |
-6.217 |
367 |
43 x 100 |
|||||
|
8 |
3 |
2 |
-3.421 |
984 |
02 x 103 |
|||||
|
9 |
4 |
3 |
+1.194 |
031 |
27 x 104 |
|||||
|
10 |
5 |
4 |
-2.454 |
137 |
77 x 104 |
|||||
|
11 |
6 |
5 |
+2.915 |
918 |
65 x 104 |
|||||
|
12 |
7 |
6 |
-1.847 |
822 |
90 x 104 |
|||||
|
13 |
7 |
7 |
+2.348 |
194 |
34 x 101 |
|||||
|
14 |
8 |
7 |
+4.803 |
106 |
17 x 103 |
|||||
|
P0 = 2 MPa |
||||||||||
Tableau III.8. Les coefficients de l'équation (III.67)
La résolution de cette équation est faite à l'aide de la méthode de NEWTON-RAPHSON, Annexe (01).
·:. La concentration de l'ammoniac dans le
mélange vapeur qui est en équilibre
avec la phase liquide [25] :
m i
? ? ? ?
P n 3
i
y = - ? -
1 exp ln(1 î ) ? a (III.67)
i ? ? ?
î
P
i 0
? ? ? ? ? ?
oü les coefficients ai, mi et ni sont consignés dans le tableau (III.8). Le domaine de validité de cette équation est :
> 0.01 = P = 100 bar ;
> 0 = î = 1.
A partir de l'équation (III.58), qui donne la pression du mélange NH3-H2O en fonction de la température et de la concentration [33], deux paramètres (P,T), (P,î) ou (T, î) sont suffisantes pour déterminer l'état thermodynamique d'un point donné, en effet :
+ Si (P, T) sont données, î est calculée à partir de l'équation (III.66) ;
+ Si (P, î) sont données, T est calculée à partir de l'équation (III.61) ;
+ Si (T, î) sont données, P est calculée à partir de l'équation (III.58).
Ci-dessous est représenté organigramme de calcul de la température, la pression étant de 0.016 jusqu'à 20 bars, et la concentration varie de 0 à 1. D'où on peut tracer le diagramme d'Oldham automatisé figures [(IV.3) et (IV.4)], (chapitre IV).
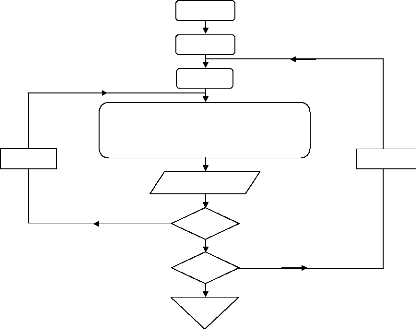
î = î +0.05
P = 0.016
Oui
Non
Oui
Ecrire P, T, î
P =20
î = 1
Non
Fin
P =P+0.5
A=f1(î) équation (III.59)
B=f2(î) équation (III.60)
î = 0
Début
Organigramme III.9. Démarche de calcul pour le diagramme d'Oldham.
Grâce aux deux équations (II.48) et (II.55), (chapitre II) pour les deux phases liquide et vapeur, on peut déterminer les enthalpies massiques du mélange NH3-H2O et ceci pour les deux phases de ce dernier. Le diagramme de Merkel est composé de deux parties :
·:. Partie inférieure (liquide) comporte
:
9 Des réseaux d'isothermes ;
9 Des réseaux d'isobares (courbes d'ébullition).
+ Partie supérieure comporte :
9 Des courbes d'égale concentration de phase vapeur en équilibre avec la phase liquide ;
9 Des courbes de condensation (rosé).
Dans ce qui suit nous représentons les organigrammes pour le tracé de chaque partie.
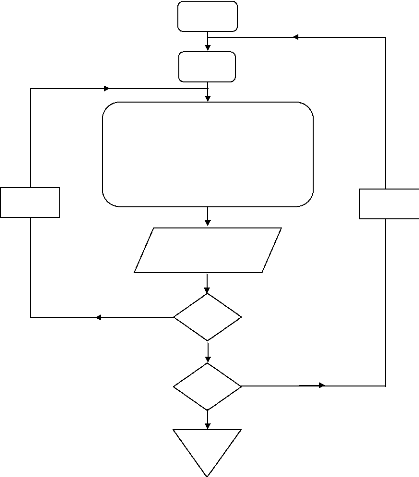
Début
a- Les réseaux d'isobares :

î = î +0.01
A=f1(î) équation (III.59)
B=f2(î) équation (III.60)
T=B(î)/(A(î)-log(P)) équation (III.61)
hm L = f3(T,P, î) équation (II.48)
P =P+Pas
P = 0.1
î = 0
Ecrire P, T, î , hm L
Oui
î =1
Non
Oui
P = 50
Non
Fin
Organigramme III.10. Démarche de calcul pour les réseaux d'isobares.
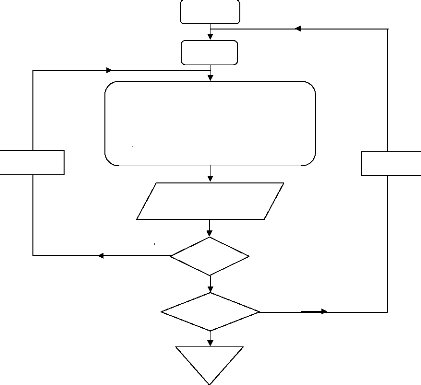
Début
b- Les réseaux d'isothermes :
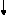
î = î +0.005
T =T+20
T=213.15
î s1
Ecrire P, T, î, hm L
Oui
î = î s2
Non
Oui
T = 515.15
Non
Fin
A=f1(î) équation (III.59)
B=f2(î) équation (III.60)
P=f3(T, î) équation (III.58)
Organigramme III.11. Démarche de calcul pour les réseaux d'isothermes.
NB:
î,s1 : représente la concentration correspondante à la température donnée, et à la pression de 0.1 bar.
î,s2 : représente la concentration correspondante à la température donnée, et à la pression de 50 bar.
Début
c- Les lignes de condensation :
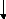
P =P+Pas
P = 0.1
î = 0
T=f1(P, î) équation (III.62)
hm g= f2(T,P, î) équation (II.55)
Ecrire P, T, î , hm g
Oui
î =1
Non
Oui
P = 50
Non
Fin
î = î +0.01
Organigramme III.12. Démarche de calcul pour les lignes de condensation.
Début
d- Les courbes d'équilibre de la phase vapeur avec la phase liquide :

î = î +0.01
P =P+Pas
A=f1(î) équation (III.59)
B=f2(î) équation (III.60)
T=f1(P, î) équation (III.62)
y=f4(P, î) équation (III.67)
h g = f5 (T,P,y) équation (II.55)
P = 0.1
î = 0
Ecrire P, T, x, y, hm L
Non
Oui
î =1
Non
Oui
P = 50
Non
Fin
Organigramme III.13. Démarche de calcul pour les courbes liquide-vapeur.
Conclusion :
L'établissement du bilan thermique d'une installation à pour objet de déterminer la puissance frigorifique nécessaire pour assurer un bon fonctionnement de l'installation en conformité avec le programme établi, les autres éléments constitutifs de l'installation sont ensuite calculés en fonction de la puissance frigorifique et des conditions de fonctionnement de l'installation.
Le but du bilan thermique est de calculer la quantité de chaleur totale à évacuer pour maintenir le niveau de température désiré.
Cette partie indispensable nous a permis de connaître les bilans thermiques ainsi que tous les paramètres qui rentrent dans notre programme de calcul, afin d'entamer notre simulation à l'aide du SARM 2.

Nous expliquerons dans ce qui suit comment procéder en pratique pour réaliser un programme de simulation adéquat. Afin d'être facilement compréhensible, les modèles présentés ici sont relativement plus simples sur le plan thermodynamique, calculables sans difficulté avec les hypothèses retenues.
Dans ce chapitre, on présentera nos résultats obtenus a partir de notre logiciel de simulation SARM 2 (Simulation of Absorption Réfrigération Machine 2), aussi on fera une étude comparative avec les résultats que P. Bourseau et Bugarel ont obtenus a partir de leurs études.
On doit mettre en évidence trois critères d'optimisation: la puissance frigorifique maximale, le coefficient de performance maximal et le rendement énergétique maximal, et ceci pour un aspect d'optimisation seulement. Dans la pratique, on doit trouver un optimum économique. Ceci dépend de plusieurs paramètres externes, par exemple : le coût des capteurs solaires pour le chauffage d'eau et les coûts d'investissement pour l'ensemble de l'installation.
En continuité, on présente seulement l'optimisation du point de vue thermodynamique en prenant le critère du coefficient de performance.
Dans le cadre de la simulation numérique du fonctionnement du système, nous nous sommes fixés deux objectifs :
1- Automatisation des diagrammes d'Oldham et de Merkel ;
2- Détermination des limites de fonctionnement pour une installation à absorption hydro-ammoniacale, (une température de vaporisation minimale, la température de l'agent de chauffage minimale, coefficient de performance maximal et une température de l'agent de refroidissement maximale).
Le programme de calcul "SARM 2", figure (IV.1) est composé de trois parties :
+ L'introduction des données ;
+ Le calcul ;
+ L'affichage des résultats dans une base de données Access.
Première partie : l'introduction des données, nécessite des informations concernant la :
1- Capacité frigorifique demandée ?0 ;
2- Température demandée par le consommateur à la sortie de l'évaporateur, du fluide secondaire à refroidir ;
3- Température de l'eau chaude disponible à l'entrée du générateur ;
4- Température de l'eau de refroidissement à l'entrée du condenseur et l'absorbeur. Deuxième partie : le calcul, il comporte les étapes suivantes :
1- Programmation des fonctions qui permettent la résolution des équations d'équilibre liquidevapeur c'est-à-dire :
+ L'enthalpie, l'entropie et le volume des composantes pures NH3 et H2O pour les deux phases, liquide et vapeur saturés ;
+ L'enthalpie, l'entropie et le volume pour le mélange NH3-H2O liquide et vapeur; + Propriétés de transport de la solution NH3-H2O ;
+ L'enthalpie, l'entropie et le volume pour la vapeur surchauffée ;
+ L'enthalpie, l'entropie et le volume pour le liquide sous-refroidi.
2- La conception des tables thermodynamiques ;
3- La conception des tables pour les propriétés de transport ;
4- La numérisation des deux diagrammes (Oldham et Merkel) ;
5- Le calcul thermique de l'installation frigorifique à absorption-diffusion (figure IV.2)
6- Pour une série de paramètres d'entrée : ?0 ,T0, TC, Tch, Tf et Te le programme exécute automatiquement les calculs pour toutes les variantes où Tb et Tab varient avec un pas ÄT=2.5 °C, les limites de Tb = (70÷150 °C), Tab= (20÷40 °C) en choisissant une série de résultats qui vérifient les conditions imposées suivantes :
9 Ä î = î ab - î sp = 5 % ;
9 Le bilan thermique pour l'ensemble de l'installation.
Troisième partie : l'affichage des résultats dans une base de données Access.
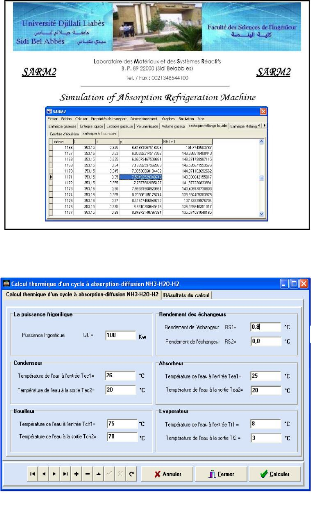
Figure IV.1. Le programme SARM 2 tel qu'il s'affiche à l'écran.
Figure IV.2. Exemple de calcul thermique d'un cycle à absorption-diffusion.
Dans notre programme, le remplissage, l'affichage et le vidage de chaque table de la base de données, ainsi que tous les paramètres des points d'états du cycle et les flux de chaleur échangés dans
chaque appareil et le coefficient de performance de l'installation, se font suivant des procédures bien déterminées.
Pour la simulation numérique du fonctionnement en régime stationnaire de l'installation frigorifique à absorption-diffusion, nous avons réalisé un programme de calcul avec le langage DELPHI. Ce programme fonctionne dans les limites suivantes :
> La température de vaporisation : +15 ..... -15 °C ;
> La température de l'agent de chauffage dans le bouilleur : 70 .... 250 °C ; > La température du fluide de refroidissement au condenseur et l'absorbeur : 20 ..... 60 °C;
> La température de condensation : 20 ..... 50 °C ;
> La capacité frigorifique ?0 : 50 ..... 2000 Kw.
Le programme inclut des codes spécifiques pour automatiser les deux diagrammes thermodynamiques d'Oldham et de Merkel.
Pour le calcul des paramètres du processus de la machine, nous avons adopté l'organigramme suivant :
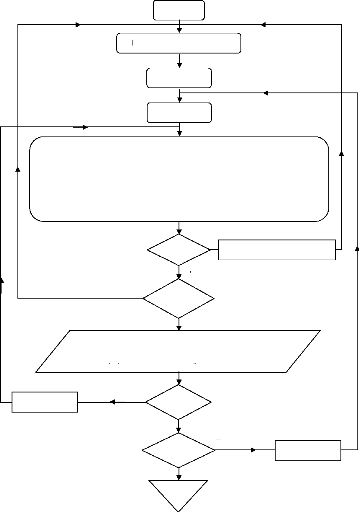
Tb = Tb+2.5
- Calcul des P, T, h, î des points d'états du cycle;
- Calcul des débits de masse circulant dans l'installation;
- Ecrire P, T, î ,h ,?, m pour tous les pointsd'états ;
Non verifier
Non
' '
Introduction des données
Calcul du cycle:
Tb = 7
Oui
Oui
Tab =
Tab = 20
Tb = 150
Début
Ä%
Bilan
Fin
Verifier
Oui
Non
Non
Le cycle physiquement ii
Tab = Tab+2.5
Organigramme IV.3. Organigramme de simulation d'une machine à absorption-diffusion.
Les résultats obtenus sont conformes à ceux de Merkel et Oldham. IV.5.1.1. Diagramme de Merkel (h, î) :
En se basant sur les relations (III.57), (III.58), (III.59) et (III.60) cités dans le chapitre III, et en utilisant les équations (II.48) et (II.55) du (chapitre II) pour les deux phases liquide et vapeur, le logiciel "SARM2" trace le diagramme de Merkel avec un simple click, figure (IV.4).
|
Enthalpie (Kj/Kg) |
2800 2600 2400 2200 2000 1800 1600 1400 1200 1000 800 600 400 200 0 -200 -400 -600 |
||||||||||
|
50 bar |
|||||||||||
|
30 20 |
10 5 2 0.5 0.2 0.1 bar |
||||||||||
|
50 bar 30 20 10 5 2 0.5 |
|||||||||||
|
0.2 0.1 bar |
|||||||||||
|
513.15 °K |
|||||||||||
|
493.15 |
|||||||||||
|
453.15 433.15 |
|||||||||||
|
413.15 |
393.15 |
||||||||||
|
373.15 353.15 |
50 bar 30 |
||||||||||
|
333.15 |
20 |
||||||||||
|
10 |
|||||||||||
|
313.15 293.15 |
5 |
||||||||||
|
273.15 |
253.15 233.15 21 |
2 0.5 0.2 3.15 °K 0.1 bar |
|||||||||
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
Concentration massique de l'ammoniac
Figure IV.4. Diagramme de Merkel automatisé.
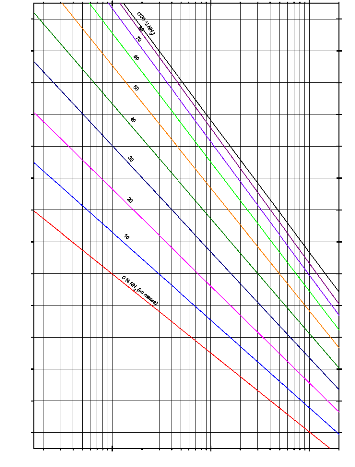
Selon l'organigramme (III.9), et en utilisant des équations (III.59), (III.60) et (III.61), (chapitre III). Le programme de simulation "SARM2", permet de tracer aisément le diagramme d'Oldham (figure IV.5).
Pression ( bar)

7
9
2
3
8
6
4
5
20
10
0,02
0,6
0,2
0,08
0,06
0,03
0,9
0,8
0,7
0,5
0,4
0,3
0,07
0,05
0,04
7
9
2
3
8
6
4
5
20
10
0,02
0,6
0,2
0,9
0,8
0,7
0,5
0,4
0,3
0,04
0,08
0,06
0,03
0,07
0,05
0,0048
0,0048
0,0046
0,0046
0,0044
0,0044
0,0042
0,0042
0,0040
0,0040
0,0038
0,0038
0,0036
0,0036
0,0034
0,0034
Temperature ( 1/ T(K))
0,0032
0,0032
0,0030
0,0030
0,0028
0,0028
0,0026
0,0026
0,0024
0,0024
0,0022
0,0022
Figure IV.5. Diagramme d'Oldham automatisé, (LogP,-1/T).
Début
Le logiciel "SARM2" remplit automatiquement les tables thermodynamiques de l'ammoniac pur (Annexe 02), et de l'eau pure (Annexe 03) suivant l'organigramme (IV.2)

T = -75 °C pour (NH3) T=0 °C pour (H2O)

Equation (III.56) pour (H2O)
Equation (III.57) pour (NH3)
hL équation (II.25)
hg équation (II.26)
sL équation (II.27)
sg équation (II.28)
vL équation (II.29)
T =T+1
Ecrire P, T, hL , hg , sL , sg ,vL , vg , LV , As
T134 (NH3)
T (H O)
Non
Fin
Oui

Organigramme IV.6. Démarche de remplissage des tables thermodynamiques de l'ammoniac et de l'eau.
Suivant l'organigramme (III.1), cité au chapitre III, le logiciel "SARM 2" remplit automatiquement la table de propriétés P-T-. (Annexe 4)
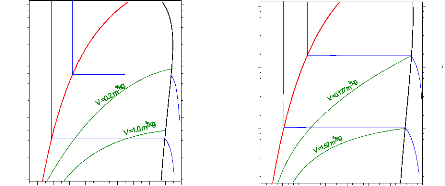
IV.5.2.3. Diagrammes de Molier (Log P,h) pour l'ammoniac et de l'eau :
400 800 1200 1600 2000 2400 2800
H (Kj/Kg°K)
H (Kj/Kg)
Figure IV.7. Diagramme de Mollier (log P, h) pour l'ammoniac. Figure IV.8. Diagramme de Mollier (log P, h) pour l'eau.
Pression (bar)
40,00
20,00
4,00
2,00
100,00
80,00
60,00
10,00
8,00
6,00
1,00
0,80
0,60
0,40
0,20
0,10
0,08
Pression (bar)
100,00
83,33
66,67
50,00
33,33
16,67
10,00
8,33
6,67
3,33
1,00
0,83
0,67
0,50
5,00
0,33
0,17
1,67
T = 200 °C
T = 100 °C
100,00 83,33 66,67
50,00
33,33
10,00 8,33 6,67
5,00
3,33
1,00
0,83
0,67
0,50
0,33
0,17
16,67
1,67
10,00
8,00
T = 10 °C
T = -50 °C
100,00
80,00
60,00
40,00
20,00
6,00
4,00
2,00
1,00
0,80
0,60
0,40
0,20
0,10
0,08
-500
0
400
800
500
200
100
900
700
600
300
-200
-100
-400
-300
1000
1400
1100
1300
1200
Enthalpie du liquide saturé hL
Enthalpie
du vapeur saturé h
g

Entropie du liquide saturé hL
Entropie du
vapeur saturé h
g

A partir de la connaissance de la pression où de la température, le logiciel "SARM 2" calcule tous les paramètres thermodynamiques et de transport pour l'ammoniac et l'eau.
Exemple :
Pour une température T=28 °C, on obtient les résultats affichés suivants :
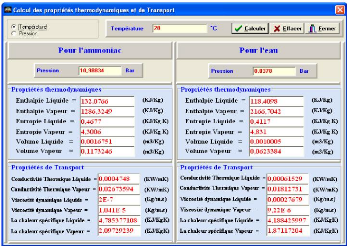
Figure IV.9. Exemple de calcul des paramètres thermodynamiques et de transport pour NH3 et H2O.
Les calculs ont été effectués pour une capacité de réfrigération de 100 KW au niveau de l'évaporateur.
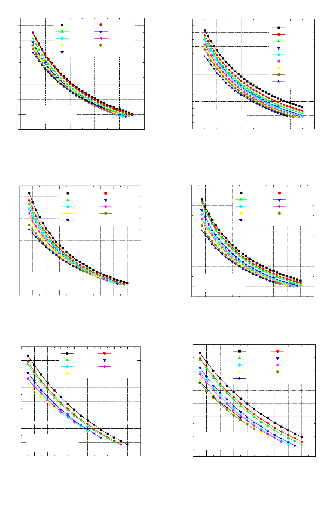
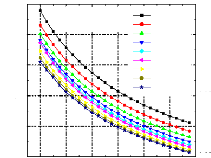
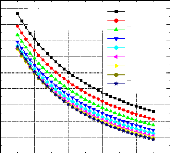
Pour voir l'influence de certains paramètres sur la performance de notre système, on a tracé des courbes traduisant les variations suivantes :
1 Variation du COP en fonction de la température du bouilleur, avec les températures de l'évaporateur et du condenseur constantes et la température de l'absorbeur variable ;
1 Variation du COP en fonction de la température du bouilleur, avec les températures de l'évaporateur et de l'absorbeur constantes et la température du condenseur variable ;
1 Variation du COP en fonction de la température du condenseur, avec les températures de l'évaporateur et du bouilleur constantes et la température de l'absorbeur variable ;
60 80 100 120 140 160
1- COP=f (Tb, Tab) avec TC et T0 constantes :
60 80 100 120 140 160
0,28
0,26
0,24
0,22
0,20
0,18
0,16
0,14 0,14
60 80 100 120 140 160
COP
T0(évaporateur=-5°C TC(condenseur)=20°C
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C
Tab=30 °C Tab=32.5 °C
Tab=35 °C Tab=37.5 °C
Tab=40 °C
Tb (Bouilleur)
Figure IV.10. Variation du COP= f (Tb,Ta) avec T0=-5 °C , TC=20 °C .
70 80 90 100 110 120 130 140 150 160
0,40
0,35
0,30
0,25
0,20
70 80 90 100 110 120 130 140 150 160
Tb (Bouilleur)
Figure IV.12. Variation du COP= f (Tb,Tab)
avec T0=-5 °C , TC=30 °C .
110 115 120 125 130 135 140 145 150 155
0,42
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,26 0,26
110 115 120 125 130 135 140 145 150 155
Tb (Bouilleur)
Figure IV.11. Variation du COP= f (Tb,Tab) avec T0=0 °C , TC=20°C
70 80 90 100 110 120 130 140 150 160
Tab=40 °C
0,35
0,35
0,30
0,30
0,25
0,25
T0(évaporateur=0°C
0,20
0,20
TC(condenseur)=30°C
Tb=22.5 °C
Tb=20 °C
Tab=25 °C Tab=27.5 °C
Tb=32.5 °C
Tb=30 °C
Tab=37.5 °C
Tab=35 °C
0,45
0,40
0,45
0,40
70 80 90 100 110 120 130 140 150 160
Tb(Bouilleur)
Figure IV.13. Variation du COP= f (Tb,Tab)
avec T0=0 °C , TC=30 °C .
110 115 120 125 130 135 140 145 150 155
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C
Tab=30 °C Tab=32.5 °C
Tab=35 °C Tab=37.5 °C
Tab=40 °C
0,36
0,34
T0(évaporateur=0°C TC(condenseur)=40°C
0,26 0,26
110 115 120 125 130 135 140 145 150 155
COP COP
T0(évaporateur) =
-5°C
TC(condenseur) = 40°C
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C
Tab=30 °C Tab=32.5 °C
Tab=35 °C
COP
COP
COP
80
0,26
0,24
0,14
60 80 100 120 140 160
T0(évaporateur=0°C TC(condenseur)=20°C
Tab=20 °C Tab=22.5 °C Tab=25 °C Tab=27.5 °C Tab=30 °C Tab=32.5 °C Tab=35 °C Tab=37.5 °C Tab=40 °C
0,26
0,24
0,14
0,30
0,28
0,22
0,20
0,18
0,16
0,30
0,28
0,22
0,20
0,18
0,16
T0(évaporateur)=-5°C
TC(condenseur)=30°C
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C
Tab=30 °C Tab=32.5 °C
Tab=35 °C Tab=37.5 °C
Tab=40 °C
0,28
0,26
0,24
0,22
0,20
0,18
0,16
0,40
0,35
0,30
0,25
0,20
0,42
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,42
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,42
0,40
0,38
0,32
0,30
0,28
80 90 100 110 120 130 140
80 90 100 110 120 130 140
COP
0,45
0,40
0,35
0,30
0,25
0,20
T0(évaporateur=5°C TC(condenseur)=30°C
Tab=20 °C Tab=22.5 °C Tab=25 °C Tab=27.5 °C Tab=30 °C Tab=32.5 °C Tab=35 °C Tab=37.5 °C Tab=40 °C
0,45
0,40
0,35
0,30
0,25
0,20
60 80 100 120 140 160
0,32 0,30 0,28 0,26
0,24
0,22 0,20 0,18 0,16
T0(évaporateur=5°C TC(condenseur)=20°C
Tab
=20 °C
0,32
Tab=22.5 °C
0,30
Tab
=25 °C
Tab=27.5 °C Tab=30 °C Tab=32.5 °C Tab=35 °C Tab=37.5 °C
0,28
0,26
0,24
Tab
=40 °C
0,22
0,20
0,18
0,16
0,14 0,14
60 80 100 120 140 160
Tb (Bouilleur)
Figure IV.16. Variation du COP= f (Tb,Tab)
avec T0=5 C , TC=20 C .
Tb(bouilleur)
Figure IV.17. Variation du COP= f (Tb,Tab)
avec T0=5 C , TC=30 C .
120 125 130 135 140 145 150
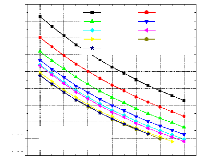
COP
0,44
0,42
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,26
T0(évaporateur=5°C TC(condenseur)=40°C
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C
Tab=30 °C Tab=32.5 °C
Tab=35 °C Tab=37.5 °C
Tab=40 °C
0,44
0,42
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,26
120 125 130 135 140 145 150
COP
Tb(Bouilleur)
Figure IV.18. Variation du COP= f (Tb,Tab) avec T0=5 C , TC=40 C .
Les figures (IV.10), (IV.12), (IV.14), représentent la variation du coefficient de performance en fonction des températures du bouilleur, du condenseur et de l'absorbeur en maintenant la température de l'évaporateur à -5 °C.
Les figures (IV.11.). (IV.13), (IV.15), montrent aussi la variation du coefficient de performance en fonction des températures du bouilleur, du condenseur et de l'absorbeur, mais avec une température de l'évaporateur maintenue a 0 °C.
Pour une température d'évaporation égale a 5 °C, on obtient les figures (IV.16), (IV.17), (IV.18).
On constate, donc, que l'augmentation des températures du condenseur et de l'absorbeur de (20÷40 °C) provoque une augmentation du COP de:
> (0.312÷0.25) pour la température du condenseur 20 °C, figure (IV.16) ;
> (0.441÷0.356) pour la température du
condenseur 30 °C, figure (IV.17) ;
> (0.425÷0.354)
pour la température du condenseur 40 °C, figure (IV.18) ;
Ces augmentations de température engendrent dans certains cas des intervalles oü la machine ne peut plus fonctionner.
2- COP=f (TC, Tab) avec Tb et T0 constantes :
TC (Condenseur) TC (Condenseur)
Figure IV.19. Variation du COP= f (TC ,Tab) Figure IV.20. Variation du COP= f (TC ,Tab)
avec T0 =5 C , Tb = 75 C . avec T0 =5 C , Tb =100 C .
20 25 30 35 40
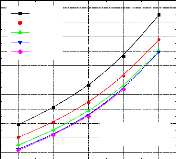
Tab=20 °C Tab=25 °C Tab=30 °C Tab=35 °C Tab=40 °C
Tb (Bouilleur)=140 °C T0 (Evaporateur)=5 °C
20 25 30 35 40
|
COP |
0,36 0,34 0,32 0,30 0,28 0,26 0,24 0,22 0,20 0,18 0,16 |
0,36
0,34
0,32 0,30 0,28 0,26
0,24
0,22 0,20 0,18 0,16
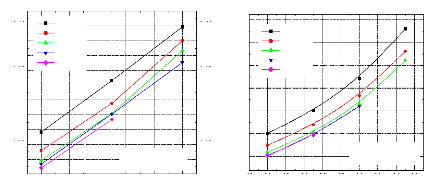
18 20 22 24 26 28 30 32 34 36
20 22 24 26 28 30
20 22 24 26 28 30
18 20 22 24 26 28 30 32 34 36
0,44
COP
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,26
0,24
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,26
0,24
COP
Tab=20 °C Tab=25 °C Tab=30 °C Tab=35 °C Tab=40 °C
Tb (Bouilleur)=75 °C T0 (Evaporateur)=5 °C
Tab=20 °C Tab=25 °C Tab=30 °C Tab=35 °C Tab=40 °C
Tb (Bouilleur)=100 °C T0 (Evaporateur)=5 °C
0,44
0,40
0,36
0,32
0,28
0,24
0,20
0,40
0,36
0,32
0,28
0,24
0,20
TC (Condenseur)
Figure IV.21. Variation du COP= f (TC ,Tab) avec T0 =5 C , Tb =140 C .
On remarque que pour les figures [(IV.19),... (V.21)], pour des températures du bouilleur et de l'évaporateur constantes, le coefficient de performance diminue avec l'augmentation de la température du bouilleur, et diminue aussi avec l'augmentation de la température du condenseur comme on le voie si bien dans ces figures, car il baisse de (0.44+0.316) pour T0=5 °C et Tb=75 °C avec une température de l'absorbeur Tab= (20+40).
3- COP=f (Tb, TC) avec Tab et T0 constantes :
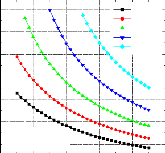
|
0,50 0,45 0,40 0,35 0,30 0,25 0,20 |
COP |
0,45 0,40 0,35 0,30 0,25 0,20 0,15 |
||||
|
COP |
0,40 0,36 0,32 0,28 0,24 0,20 0,16 |
|||||
|
COP |
0,50 0,45 0,40 0,35 0,30 0,25 0,20 |
|||||
T0 (Evaporateur)=5°C
Tab
(Absorbeur)=20°C
TC=20 °C
TC=25 °C TC=30 °C TC=35 °C TC=40 °C
0,45
0,40
0,35
0,30
0,25
0,20
0,15
60 80 100 120 140 160
60 80 100 120 140 160
Tb (Bouilleur)
Figure IV.22. Variation du COP= f (Tb ,TC)
avec Tab = 20 °C et T0 = 5 °C .
60 80 100 120 140 160
|
COP |
0,45 0,40 0,35 0,30 0,25 0,20 |
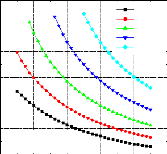
TC=20 °C TC=25 °C TC=30 °C TC=35 °C TC=40 °C
0,45
0,40
0,35
0,30
0,25
0,20
T0 (Evaporateur)=5°C
Tab
(Absorbeur)=30°C
0,15 0,15
60 80 100 120 140 160
Tb (Bouilleur)
Figure IV.24. Variation du COP= f (Tb ,TC)
avec Tab = 30 °C et T0 = 5 °C .
60 80 100 120 140 160
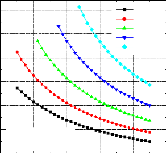
T0 (Evaporateur)=5°C
Tab
(Absorbeur)=25°C
TC=20 °C
TC=25 °C TC=30 °C TC=35 °C TC=40 °C
60 80 100 120 140 160
Tb (Bouilleur)
Figure IV.23. Variation du COP= f (Tb ,TC)
avec Tab= 25 °C et T0 = 5 °C .
0,40 0,36 0,32 0,28 0,24 0,20 0,16
60 80 100 120 140 160
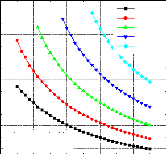
T0 (Evaporateur)=5°C
Tab
(Absorbeur)=35°C
TC=20 °C TC=25 °C TC=30 °C TC=35 °C TC=40 °C
60 80 100 120 140 160
Tb (Bouilleur)
Figure IV.25. Variation du COP= f (Tb ,TC)
avec Tab= 35 °C et T0 = 5 °C .
Les figures [(IV.22),.....(IV.25)] montre que la variation du coefficient de performance est une fonction décroissante avec l'augmentation de la température du condenseur pour chaque température de l'absorbeur, et croissante avec la diminution de la température de l'absorbeur et l'augmentation de la température du bouilleur.
60 80 100 120 140 160
60 80 100 120 140 160
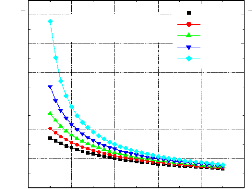
fc
4
2
7
6
5
3
1
Tab (Absorbeur)=20 °C
T0 (Evaporateur)=5
°C
TC=20 °C TC=25 °C TC=30 °C TC=35 °C TC=40 °C
4
2
7
6
5
3
1
Tb (Bouilleur)
Figure IV.26.
Variation du facteur de circulation fC = f(Tb,TC)
avec Tab=20 C et T0=5 C
La figure (IV.26) montre la variation du facteur de circulation en fonction des températures du bouilleur et du condenseur, ce qui nous laisse dire que l'augmentation de la température au niveau du condenseur engendre une augmentation du fC .
La validation d'un modèle, c'est la confrontation directe de nos résultats à ceux obtenus soit par l'expérimentation soit par d'autres modèles.
Pour une pression (ou une température) donnée, Lv (chaleur latente de vaporisation) est égale à l'écart entre les deux courbes (phase liquide et phase vapeur) de la figure (IV.27). Cette figure montre que l'écart (Lv) diminue lorsque la pression augmente, ce qui explique les résultats de la figure (IV.27).
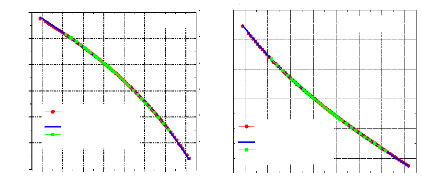
200 220 240 260 280 300 320 340
Résultats de
KUZMAN RAZNJEVIC [36]. Nos résultats.
Résultats de L. Haar et
J.S Gallagher [37]
?S=Sg-SL
4
8
7
6
5
3
200 220 240 260 280 300 320 340
1,(Nii<g)
200 220 240 260 280 300 320 340
8
1500
1500
LV=hg-hL
1400
1400
7
1300
1300
6
1200
5
Résultats de
KUZMAN RAZNJEVIC [36]. Nos résultats.
Résultats de L. Haar et
J.S Gallagher [37]
1200
DS (Kj/Kg.K)
1100
1100
4
1000
1000
3
900
900
200 220 240 260 280 300 320 340
Température (K) Température (K)
Figure IV.27. Variation de la chaleur latente de vaporisation de Figure IV.28. Variation de ÄS de l'NH3=f(T).
l'NH3=f(T).
La figure (IV.28), montre que l'augmentation de la température fournie une diminution du ÄS (l'écart entre l'entropie de la phase vapeur et la phase liquide). Même constations pour le volume de la vapeur saturé figure (IV.30). La figure (IV.7), représente le diagramme de Mollier (log P,h), fait une mise au point de clarté ce que nous constatons dans la figure (IV.27).
200 220 240 260 280 300 320 340
200 220 240 260 280 300 320 340
200 220 240 260 280 300 320 340 360
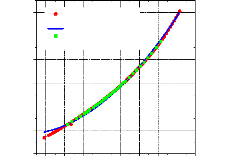
Volume du liquide saturd (m3/Kg)
0,0019
0,0018
0,0017
0,0016
0,0015
0,0014
0,0013
Résultats de
KUZMAN RAZNJEVIC [36]. Nos résultats.
Résultats de L. Haar et
J.S Gallagher [37]
0,0019
0,0018
0,0017
0,0016
0,0015
0,0014
0,0013
Volume de vapour sature (ms/Kg)
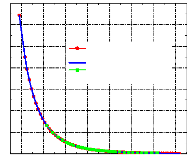
14
12
10
4
2
8
6
0
Résultats de
KUZMAN RAZNJEVIC [36]. Nos résultats.
Résultats de L. Haar et J.S Gallagher [37]
6
4
2
8
0
14
12
10
200 220 240 260 280 300 320 340 360
Température (K) Température (K)
Figure IV.29. Variation du volume liquide NH3=f(T). Figure IV.30. Variation du volume gazeux NH3=f(T).
On remarque dans la figure (IV.29), que l'augmentation de la température provoque une augmentation du volume liquide saturé.
IV.7.1.2. Pour l'eau :
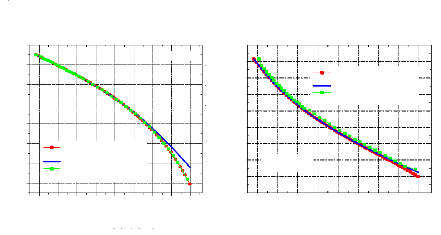
Température (K)
Figure IV.31. Variation de la chaleur latente
280 320 360 400 440 480 520 560 600
280 320 360 400 440 480 520 560 600
2600
LV=hg-hL
2400
2200
1,,(N/K.g)
2000
1800
1600
1400
1200
Résultats de
KUZMAN RAZNJEVIC [36]. Nos résultats.
Résultats de M.J MORAN et H.N SHAPIRO [37]
2600
2400
2200
2000
1800
1600
1400
1200
Température (K)
Figure IV.32. Variation de ÄS de l' H2O=f(T).
280 320 360 400 440 480 520 560 600
280 320 360 400 440 480 520 560 600
?S=Sg-SL
Résultats de
KUZMAN RAZNJEVIC [36]. Nos résultats.
Résultats de M.J MORAN et H.N SHAPIRO [37]
10
9
8
7
6
5
DS (Kj/Kg.°K)
4
3
2
1
10
9
8
7
6
5
4
3
2
1
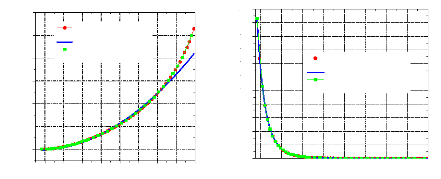
280 320 360 400 440 480 520 560 600
280 320 360 400 440 480 520 560 600
0,0016
0,0016
0,0015
0,0015
0,0014
0,0014
0,0013
0,0013
0,0012
0,0012
0,0011
0,0011
0,0010
0,0010
Résultats de
KUZMAN RAZNJEVIC [36]. Nos résultats.
Résultats de M.J MORAN et H.N SHAPIRO [37]
Température (K)
Température (K)
Volume de vapour sature (ms/Kg)
280 320 360 400 440 480 520 560 600
280 320 360 400 440 480 520 560 600
220
200
180
180
160
160
140
140
120
120
100
100
80
80
60
60
40
40
20
20
0
0
Résultats de
KUZMAN RAZNJEVIC [36]. Nos résultats.
Résultats de M.J MORAN et H.N SHAPIRO [37]
220
200
Volume du liquide sature (0/Kg)
Figure IV.33. Variation du volume liquide H2O =f(T). Figure IV.34. Variation du volume gazeux H2O =f(T).
D'une manière générale on peut considérer que les commentaires et les remarques concernant les résultats relatifs a l'eau sont les mêmes que ceux de l'ammoniac
Nous choisissons pour la validation des modèles d'enthalpie, d'entropie et de volume pour les deux corps NH3 et H2O, le test du coefficient de corrélation [35]. Ils s'appliquent donc concrètement lorsqu'on dispose de données présentées sous forme de deux distributions numériques, l'une correspondant par exemple au modèle de référence [36], [37] et [38], l'autre correspondant à nos résultats.
|
Ammoniac |
Eau |
Remarque |
|||
|
Coeff. |
de Corrélation r |
Coeff. |
de Corrélation r |
||
|
Enthalpie |
0.9999 |
0.9977 |
Valide |
||
|
Entropie |
0.9999 |
0.9997 |
Valide |
||
|
Volume liquide |
0.9987 |
0.9926 |
Valide |
||
|
Volume gazeux |
0.9999 |
0.9999 |
Valide |
Tableau IV.35. Résultats obtenus par le test de validation.
On est donc amené à conclure que les modèles mathématiques de Michel FEIDT [27], s'appliquent pour les propriétés thermodynamiques de la solution binaire NH3-H2O, ils représentent une bonne concordance avec les tables thermodynamiques du NH3 et H2O de KUMAN RAéNJEVIC [36], et de L. HAAR et J.S. GALLAGHER [37], et de MICHAEL.J et HOWARD.N [38].
Pour pouvoir valider les résultats de notre simulation, nous avons choisi les performances données par Bourseau [39], pour la comparaison du COP.
Les conditions de fonctionnement choisies pour cette première validation sont : > La température du condenseur TC = 30 °C ;
> La température de l'absorbeur Tab =30 °C ;
> La température de l'évaporateur T0 =5°C ;
> Le rendement des échangeurs ç =0.8.
Le tableau (IV.36), présente une comparaison entre nos résultats et les performances données par le chercheur Bourseau [39] pour le COP.
|
Tb |
COP (Bourseau) |
COP (Nos résultats) |
|
90 |
0,47484 |
0,46062 |
|
95 |
0,4717 |
0,43217 |
|
100 |
0,46541 |
0,40831 |
|
105 |
0,44969 |
0,38787 |
|
110 |
0,43711 |
0,37011 |
|
115 |
0,41824 |
0,35533 |
|
120 |
0,39308 |
0,34206 |
|
125 |
0,36478 |
0,33073 |
|
130 |
0,33962 |
0,32034 |
Figure IV.36. Comparaison avec les résultats obtenues par Bourseau a Tb = 30ûC
Afin de bien montrer cette concordance entre nos résultats et ceux de Bourseau nous avons représenté les valeurs du tableau précédent sous forme de graphe (figure IV.37).
90 100 110 120 130
90 100 110 120 130
COP
0,48
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32
0,30
T0 (Evaporateur)=5 °C TC (Condenseur)=30 °C Tab (Absorbeur)=30 °C
Résultats de Bourseau et Bugarel [39]
Nos Résutats
0,48
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32
0,30
Tb (Bouilleur)
Figure IV.37.
Comparaison des résultats du COP obtenus par
Bourseau et nous avec T0=5 °C, Tc=30°C.
Après avoir calculé l'erreur pour chaque COP pour des températures du bouilleur de Tb = (90÷130 °C), on a obtenu une erreur moyenne inférieur à 4.5 %, ce qui permet de considérer nos résultats comme étant crédibles.
Pour une deuxième comparaison et toujours avec les résultats de Bourseau [39] les conditions de fonctionnement choisies sont :
> La température du condenseur TC = 40 °C ; > La température de l'absorbeur Tab =40 °C ;
> La température de l'évaporateur T0 =5°C ; > Le rendement des échangeurs ç =0.8.
Le tableau (IV.38), permet de comparer directement les valeurs des différents coefficients de performance.
|
Tb |
COP Bourseau |
COP nos résultats |
|
120 |
0,353488 |
0,39145203 |
|
125 |
0,347287 |
0,36619827 |
|
130 |
0,336434 |
0,34421612 |
|
135 |
0,31938 |
0,32494725 |
|
140 |
0,299225 |
0,3094172 |
|
145 |
0,272868 |
0,29662084 |
Figure IV.38. Comparaison avec les résultats obtenus par Bourseau a Tb = 40ûC
120 125 130 135 140 145
120 125 130 135 140 145
COP
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,26
T0 (Evaporateur)=5 °C TC (Condenseur)=40 °C Tab (Absorbeur)=40 °C
Résultats de Bourseau et Bugarel [39]
Nos Résutats
0,40
0,38
0,36
0,34
0,32
0,30
0,28
0,26
Tb (Bouilleur)
Figure IV.39. Comparaison des résultats du COP obtenus par Bourseau et nous avec T0=5 °C, Tc=40°C.
La figure (IV.39) présente une comparaison graphique entre le COP de notre étude et celui de Bourseau.
Pour ce deuxième cas d'étude nous avons obtenu une erreur moyenne du coefficient de performance inférieur à 1.8 %.
Une description du modèle développé, une équation d'état pour la phase vapeur et une équation décrivant la non idéalité de la phase liquide sont présentés. Ces équations permettent la résolution du problème de l'équilibre liquide-vapeur, quasiment nécessaire pour le calcul du cycle.
Cependant, les écarts de l'idéalité sont généralement beaucoup plus marqués en phase liquide, en raison de sa densité, qu'en phase vapeur, et par conséquent il est d'usage d'adopter l'hypothèse d'un équilibre entre une phase vapeur assimilée à un mélange de gaz parfait et une phase liquide non idéale, ce qui permet de simplifier aussi les calculs mathématiques.
Le coefficient de performance n'est pas un critère suffisant à lui seul pour le choix optimal de la machine, mais il ya d'autres paramètres essentiels qui influent énormément sur la performance de la machine tels que :
> La température du bouilleur Tb ;
> La température du condenseur TC ;
> La température de l'absorbeur Tab ;
> La température de l'évaporateur
Nous constatons d'après les résultats de simulation d'une machine frigorifique à absorption illustrés par les graphes précédents que, pour obtenir un coefficient de performance maximal avec un minimum d'énergie fournie au bouilleur, nous devons garder la température de condensation et d'absorption les plus basses possibles (20÷30 °C). Donc, plus la température de l'évaporateur est basse, plus le coefficient de performance de la machine diminue.
Cette étude, a montré que l'analyse fonctionnelle de la machine frigorifique à absorption NH3- H2O nécessite le choix d'un nombre important de paramètres ayant une influence direct sur le fonctionnement de celle-ci.
Nous avons simulé le comportement d'une machine à absorption-diffusion avec un mélange ammoniac-eau-hydrogène grâce a un programme de simulation, base en premier lieu sur l'établissement du coefficient de rendement réel des différents éléments qui composent ces machines, grâce auquel nous pouvons obtenir les conditions thermodynamiques réelles du fluide frigorifique à la sortie de chaque élément en fonction de sa transformation.
A partir des résultats obtenus dans la simulation, il nous a été possible de représenter pour ce type de machine les diagrammes énergétiques pour n'importe quel type de conditions de fonctionnement préfixées.
Au cours de ce mémoire nous avons :
a- Etabli des fonctions pour calculer les propriétés thermodynamiques de la solution NH3- H2O ;
b- Conçu une base de données pour stocker tous les résultats de simulation ;
c- Conçu des tables des propriétés thermodynamiques et de transport pour NH3 et H2O ;
d- Fait la conception assisté par ordinateur des deux diagrammes d'Oldham et de Merkel, qui permettent la détermination de tous les paramètres thermodynamiques d'un point connaissant seulement deux paramètres soit : (pression, température), (pression, concentration) et (température, concentration). La nouveauté de cette conception assistée est l'élargissement de la plage d'utilisation pour le diagramme de Merkel et cela pour :
> Une pression de : 0.1 jusqu'à 50 bars ;
> Une température de : 213.15 jusqu'à 513.15 K.
e- Crée des procédures qui sont incorporées dans le logiciel "SARM" et qui permettent d'introduire les données, le remplissage, le vidage de la base de données et l'affichage des résultats ;
Suivant le mode d'abordement du sujet traité, ce mémoire nous a apporté une série de contributions intéressante :
+ On a pu faire une étude bibliographique très riche en documentation.
+ On a fait connaissance d'un autre domaine de programmation DELPHI, aussi nous avons pu élargie et améliorer notre savoir.
+ Nous avons réalisé une modélisation numérique des propriétés thermodynamique et de transport de la solution binaire NH3-H2O.
De l'étude antérieure nous pouvons tirer les suivantes conclusions :
La température optimale de fonctionnement du bouilleur, celle qui rende maximum le COP, doit être supérieure à la température minime de fonctionnement.
La température de condensation et d'absorption doivent être les plus faibles possible, parce que le coefficient de performance augmente si les températures Tc et Tab diminuent.
Si les deux éléments sont réfrigérés en série, la meilleure solution s'obtiendra en disposant l'absorbeur et le condensateur de manière que la température du premier soit inferieure à celle du deuxième.
A partir de l'analyse comparative des résultats de la simulation par "SARM", et les résultats données par BOURSEAU [39], et après avoir calculé l'erreur pour chaque COP pour des températures du bouilleur respectivement de Tb = (90÷130 °C), et de Tb = (120÷140) on a obtenue une erreur moyenne inférieure à 4.5 %, et une erreur inferieure à 1,8 % ce qui donne crédibilité à nos résultats. On peut observer une concordance relativement bonne pour les deux cas étudiés. Ce qui nous mène à dire que le logiciel de simulation "SARM", développé au cours de cette réalisation dans ce mémoire suit un bon fonctionnement et donne de bons résultats.
Perspectives et études futures :
Les machines frigorifiques constituent un sujet de recherche d'actualité. Elles présentent une alternative intéressante en raison de la pureté de la solution et elles éliminent le problème de pollution par les composés chlorofluorés. En Europe, les écoles allemandes ont développé des centres de recherche qui ont abordé ce sujet ; ainsi qu'en France.
Par la suite, il serait intéressant de poursuivre ce travail sur les quatre axes suivant :
1- Le fonctionnement des machines à absorption-diffusion en régime transitoire ;
2- Etudier d'autre critères d'optimisation du cycle comme (le rendement exérgétique maximal REX, la puissance frigorifique maximale et le coefficient d'effet frigorifique CEF) ;
3- Le développement du logiciel "SARM" par :
a- L'élargissement de la base de données des propriétés thermodynamiques et de transport pour de nouveaux couples binaires : LiBr-H2O, NH3-H2O-NaOH, NH3-LiNO3, NH3-NaSCN et les mélanges d'alcanes (n-C4H10/C5H12, i-C4H10/C5H12, ......) ;
b- L'introduction d'autres modèles thermodynamiques qui déterminent les propriétés des solutions binaires ;
c- Une meilleure flexibilité ;
4- La mise en place d'un prototype en site réel pour confirmation définitive de la validité des résultats avec obtention d'information telles que :
a- Longévité de fonctionnement ;
b- Action de l'environnement sur le système.
Nous ne pouvons parler de perspectives et études future sans aborder le sujet de l'hélium qui représente l'énergie alternative la plus convoitée et la plus favorable.
[1] MAIURI La renaissance de la machine frigorifique à absorption pour la production industrielle du froid, 1935.
[2] Von Platen and C.G. Munters Refrigerator, US Paten 1, 685, 764,1928.
[3] PIERRE RAPIN Formulaire du froid.
10ème Edition, DUNOD.
[4] B. Reistad
Thermal condition in heat driven refrigerating units for domestic use, Sairtryckur Kylteknisk Tidskrift, N°3, 1968.
[5] J. Chen, K.J. Kim and K.E. Herold
Performance Enhancement of a Diffusion Absorption Refrigerator, International Journal of
Refrigeration, Vol. 19, N°3,PP. 208-218, 1996.
[6] S.A Akam, N Said, Z. Ouchicha et B.Bellal
Expérimentation d'une boucle à absorption NH3-H2O, Revues des énergies renouvelables, JNVER, Valorisation, 1996.
[7] P. Srikhirin and S. Aphornratana
Investigation of a Diffusion Absorption Refrigerator. Applied Thermal Engineering, Vol. 22, N°11, 2002.
[8] M.P. Maiya
Studies on Gas Circuit of Diffusion Absorption Refrigerator, in: 21st IIR International Congress of
Refrigeration, Washington DC, USA, 2003.
[9] A. Zohar et all
Numerical investigation of a diffusion absorption refrigeration cycle, international journal of
refrigeration, vol. 28, 2005.
[10] Makhlouf et all
Simulation des Cycles de Machines Frigorifiques a Absorption NH3-H2O, Journées d'études Nationales de Mécanique, Université Hadj Lakhdar, Batna, 19-20 Novembre, 2007.
[11] ZIEGLER, B., TREPP, C
Equation of state for ammonia-water mixtures,
Int. J. Refrig., vol. 7, no. 2 March: p. 101-106, -1984.
[12] A.Zohar et all
The influence of diffusion absorption refrigeration cycle configuration on the performance,applied thermal engineering, vol.27, 2007.
[13] PIERRE RAPIN, PATRICK JACQUARD Technologie des installations frigorifiques
8ème édition DUNDO -2004.
[14] GEORGES VRINAT
Technique de l'Ingénieur,
Production du froid - Machine frigorifique à absorption, B 551 p1-7 -2001.
[15] PIERRE NEVEU
Absorption liquide machine,
Site web: http://www.neveu.pierre.free.fr (site consulté en novembre 2006).
[17] ENICK, R.M., DONAHEY, G.P., HOLSINGER
Modeling the high-pressure ammonia-water system with WAT AM and the Peng-Robinson Equation of state for Kalina cycle studies,
Ind. Eng. Chem. Res., vol. 37, p. 1644-1650 -1998.
[18] WEBER, L.A
Estimating the virial coefficients of the ammonia + water mixture, Fluid Phase Equilibria, vol. 162, no. 1-2: p. 31-49 -1999.
[19] RUKES, B., DOOLEY, R.B
Guideline on the IAPWS formulation 2001 for the thermodynamic properties of ammonia- water mixtures, IAPWS (The International Association for the Properties of Water and Steam) 2001, Maryland-USA.
[20] ZIEGLER, B., TREPP, C
Equation of state for ammonia-water mixtures,
Int. J. Refrig., vol. 7, no. 2 March: p. 101-106, -1984.
[21] IBRAHIM, O.M., KLEIN, S.A
Thermodynamic properties of ammonia-water mixtures, ASHRAE Trans. Symposia, vol. 21, no. 2: p. 1495-1502, -1993.
[22] XU, F., YOGI GOSWAMI, D
Thermodynamic properties of ammonia-water mixtures for power-cycle applications, Energy, vol. 24, no. 6:p. 525-536, -1999.
[23] JORDAN, D.P
Aqua-ammonia properties,
Department of Mechanical Engineering,
Texas Tech University, Lubbock-Texas, 19 p, -1997.
[24] NAG, P.K., GUPTA
Exergy analysis of the Kalina cycle,
Applied Thermal Engineering, vol. 18, no. 6: p. 427-439, -1997.
[25] M. CONDE
Thermophysical properties of NH3-H2O solutions for the industrial design of absorption refrigeration equipments,
M. Conde Engineering -2004.
[26] PAUL ROUX, JEAN-ROBERT SEIGNE
Thermodynamique, physique et chimique
Ellipses, édition Marketing SA, -1998.
[27] MICHEL FEIDT, AMER HAJ TALEB, OLIVIER LOTTIN
Thermodynamic properties of ammonia-water mixtures.
Internationnal Congress of Refrigeration 2003, Washington, ICR 0113.
[28] EL-SAYED, Y.M., TRIBUS
Thermodynamic properties of water-ammonia mixtures theoretical implementation for use in power cycles analysis.
ASME Paper AES, American Society of Mechanical Engineers, vol. 1: p. 89-95, 1985.
[29] BENAOUDIA MOHAMED
Les contributions à l'optimisation en régime stationnaire des installations frigorifiques à absorption avec la solution Hidro-Ammoniacale.
Université Technique de Construction BUCAREST, Thèse de Doctorat -2001.
[30] Harold W. Woolley, Russell B. Scott, and F. G. Brickwedde
Compilation of Thermal Properties of Hydrogen in Its Various Isotopic and
Ortho-Para Modifications,
Part of the Journal of Research of the National Bureau of Standards Research Paper RP1932 Volume 41, November 1948;
[31] KEITH.E.HEROLD, STANDFORD Absorption chillers and heat pumps. Congress press 1996.
[32] ÏæãÍã ÏãÍ äÇÖãÑ : ÑæÊßÏáÇ
ÏíÑÈÊáÇ ÉãÙä
ÉíÑÏäßÓ~Ç ÉÚãÇÌ ÉÓÏäáÇ Éíáß
- 1999 ÉíÑÏäßÓ~ÇÈ ÑÇÚãáÇ ÉÇÔäã ÑÇÏ
[33] DAE.WEN. SUN
Comparison of the performance of NH3-H2O, NH3-LiNO3 and NH3-SCN absorption refrigeration systems,
Energy Conversion, vol 39, N° 5/6, p357-368 -1998.
[34] D.S. KIM AND C.A. INFANTE FERREIRA Solar absorption cooling,
Delft University of Technology
Laboratory for Refrigeration and Indoor Climate Technology 1ère progresses report - October 2003.
[35] J.N BALÉO, B.BOURGES, PH. COURCOUX, C.FAUR-BRASQUET Méthodes et outils pour les expérimentations scientifiques,
Edition TEC&DOC -2003.
[36] KUZMAN. RAéNJEVIC
Tables et diagrammes thermodynamiques, Editions EYROLES -1970.
[37] L. HEAR, J.S. GALLAGHER Thermodynamic properties of ammoniac, J. Phys.Chem, Reference Data, Vol 7, -1996.
[38] MICHAEL J. MORAN, HOWARD N. SHAPIRO Fundamentals of Engineering Thermodynamics,
Third Edition, John Wiley & Sons, Inc -1996.
[39] P. Bourseau et R. Bugarel
Réfrigération par cycle a absorption-diffusion'comparaison des performances des systèmes NH3-H2O et NH3-NaSCN.
Figure I.1.a. Refroidisseur de liquide à absorption à simple étage, Série ABS-PRC005-EN 465KW
17 17 19 19
23
24
39
40 42 44 44
Figure I.1.b. Refroidisseur de liquide à absorption à doubles étages, Série ABSC 390 a 6000 KW
Figure I.2. Les principaux couples binaires les plus utilisés en industrie
Figure I.3.a. Schéma de principe d'une machine à absorption NH3-H2O .
Figure I.3.b Schéma technologique d'une machine à absorption NH3-H2O.
Figure I.4. Diagramme de Merkel relatif au couple NH3-H20.
Figure I.5 Diagramme d'Oldham relatif au couple NH3-H20.
Chapitre II : Étude des propriétés thermodynamiques de la solution NH3-H2O
Figure II.1. Les paramètres fondamentaux des substances pures
Figure II.2. Les coefficients pour les équations (II.13.17.21.22.23.24.25.26)et (II.32.33.34)
Figure II.3. Les coefficients pour les équations (II.59.60.61.62)
Figure II.4. La densité de la solution NH3-H2O liquide.
...
45
45
46
48
50
51
51
Figure II.5. La viscosité dynamique de la solution NH3-H2O liquide
Figure II.6. La conductivité thermique de la solution NH3-H2O liquide.
Figure II.7. La chaleur spécifique isobare de la solution NH3-H2O liquide
Figure II.8. La chaleur spécifique isobare de l'hydrogène
Figure II.9. La conductivité thermique de l'hydrogène
Figure II.10. La viscosité dynamique de l'hydrogène
Figure II.11. L'enthalpie massique de l'hydrogène
Chapitre III : Étude thermodynamique et thermique de la machine frigorifique à absorption diffusion
Figure III.1. Description schématique du cycle à absorption-diffusion NH3-H2O-H2 .
52
Figure III.2. La variation de la température dans l'évaporateur.
53
Figure III.3. La variation de la température dans le condenseur.
69
Figure III.4. La variation de la température dans le bouilleur.
69
Figure III.5. La variation de la température dans l'échangeur gaz-gaz S1
72
Figure III.6. La variation de la température dans la colonne de rectification
73
Figure III.7. Les coefficients pour l'équation (III.62) .
74
Figure III.8. Les coefficients pour l'équation (III.67)
74
Figure III.9. Démarche de calcul pour le diagramme d'Oldham
75
Figure III.10.Démarche de calcul pour les réseaux d'isobares
75
Figure III.11.Démarche de calcul pour les réseaux d'isothermes .. 76
Figure III.12.Démarche de calcul pour les lignes de condensation 77
Figure III.13.Démarche de calcul pour les courbes liquide-vapeur 77
Chapitre IV : Simulation numérique et validation des résultats
Figure IV.1. Le programme SARM 2 tel qu'il s'affiche à l'écran 69
Figure IV.2. Exemple de calcul thermique d'un cycle à absorption-diffusion 69
Figure IV.4. Diagramme de Merkel automatisé 72
Figure IV.5. Diagramme d'Oldham automatisé, (LogP,T) 73
Figure IV.7. Diagramme de Mollier (log P, h) pour l'ammoniac 75
Figure IV.8. Diagramme de Mollier (logP,h) pourl'eau 75
Figure IV.9. Exemple de calcul des paramètres thermodynamiques et de transport pour NH3 et H2O 76
Figure IV.10. Variation du COP= f (Tb,Tab) avec TC=20 °C 77
Figure IV.11. Variation du COP= f (Tb,Tab) avec TC=25 °C 77
Figure IV.12. Variation du COP= f (Tb,Tab) avec TC=30 °C ,T0=-5 °C 77
Figure IV.13. Variation du COP= f (Tb,Tab) avec TC=30 °C ,T0=0 °C 77
Figure IV.14. Variation du COP= f (Tb,Tab) avec TC=40 °C ,T0=-5 °C 77
Figure IV.15. Variation du COP= f (Tb,Tab) avec TC=40 °C ,T0=0 °C 77
Figure IV.16. Variation du COP= f (Tb,Tab) avec TC=20 °C ,T0=-5 °C 78
Figure IV.17. Variation du COP= f (Tb,Tab) avec TC=30 °C ,T0=5 °C 78
Figure IV.18. Variation du COP= f (Tc,Tab) avec Tb=75 °C ,T0=5 °C 78
Figure IV.19. Variation du COP= f (TC,Tab) avec Tb=100 °C ,T0=5 °C 79
Figure IV.20. Variation du COP= f (Tc,Tab) avec Tb=140 °C , T0=5 °C 79
79
Figure IV.21. Variation du COP= f (T11,T3) avec Tab=20 °C et T0=5 °C
80
Figure IV.22. Variation du COP= f (T11,T3) avec Tab=25 °C et T0=5 °C.
80
Figure IV.23. Variation du COP= f (T11,T3) avec Tab=30 °C et T0=5 °C 80
Figure IV.24. Variation du COP= f (T11,T3) avec Tab=35 °C et T0=5 °C 80
Figure IV.25. Variation du facteur de circulation f (Tb,Tc ) avec Tab=20 C et T0=5 C. 81
Figure IV.26. Variation de la chaleur latente de vaporisation de l'NH3= f (T)
82
Figure IV.27. Variation de ÄS de l'NH3=f(T)
Figure IV.28. Variation du volume liquide NH3=f(T)
82
Figure IV.29. Variation du volume gazeux NH3=f(T)
Figure IV.30. Variation de la chaleur latente de vaporisation de l'H2O=f(T) 82
Figure IV.31. Variation de ÄS de l' H2O=f(T)
Figure IV.32. Variation du volume liquide H2O =f(T) 82
Figure IV.33. Variation du volume gazeux H2O =f(T)
82
Figure IV.34. Résultats obtenus par le test de validation
86
Figure IV.37. Comparaison de nos résultats sur l'erreur moyenne et ceux de Bourseau à Tc=30 °C et T0=5°C
Figure IV.39. Comparaison des résultats du COP obtenus par Bourseau et nous avec) avec T0=5 °C,
Tc=40°C......................................................................................................................... 86
Tableau I.1. Les principaux couples binaires en industrie 18
Tableau II.1. Les paramètres fondamentaux des substances pures 28
Tableau II.2. Les coefficients pour les équations (II.13.17.21.22.23.24.25.26) (II.32.33.34) 33
Tableau II.3. Les coefficients pour les équations (II.59.60.61.62) 38
Tableau III.1. Les coefficients de l'équation (III.63) 58
Tableau III.2. Les coefficients de l'équation (III.67) 60
Tableau IV.1. Résultats obtenus par le test de validation 84
Tableau IV.2. Comparaison de nos
résultats avec ceux de Bourseau à Tab=30 C et T0=5
C......85
Tableau IV.3. Comparaison de nos résultats
avec ceux de Bourseau à Tab=40 C et T0=5 C......86
Organigramme III.1. Démarche de calcul pour le diagramme d'Oldham 61
Organigramme III.2. Démarche de calcul pour les réseaux d'isobares 62
Organigramme III.3. Démarche de calcul pour les réseaux d'isothermes 63
Organigramme III.4. Démarche de calcul pour les lignes de condensation 64
Organigramme III.5. Démarche de calcul pour les courbes liquide-vapeur 65
Organigramme IV.6. Organigramme de simulation d'une machine à absorption-diffusion........ 71
Organigramme V.1. Démarche de remplissage des tables thermodynamiques de l'ammoniac et de l'eau 74
Méthode de NEWTON-RAPHSON 1- Principe :
Si f(X) est continue dérivable dans le voisinage de X*, alors le développement en série de Taylor autour d'un estimé X (n) s'écrit :
( - X ( n)) )f ''( X ( n)) + ...
F ( X * ) = f ( X ( n ) ) + f ' ( X ( n ))(X * - X ( n ) ) + ( X * 2 (A9-1)
!
Si X (n) est un estimé proche de la solution X* de f(X)=0, alors l'écart de l'erreur å(n) (oil å(n)=( X*- X (n))) et les termes de degré supérieur sont négligeables, sachant que f(X*)=0, on obtient la relation approximative :
F ( X ( n ) ) + f ' ( X ( n ) )(X * - X ( n)) = 0 (A9-2)
et une approximation de l'erreur est donc :
C(n) =
f
( X ( n))
( X ( n))
(A9-3)
f '
On peut donc considérer qu'un meilleur estimé de X* sera :
X (n+1)= X (n)+ c(n) (A9-4)
Des équations (A9-3) et (A9-4), on obtient l'algorithme de NEWTON-RAPHSON.
X( 1)
n + =
(A9-5)
X ( n) f -
f '
( X ( n)) ( X ( n))
2- Convergence de la méthode :
D'une manière générale, la dérivée seconde joue un rôle important dans la convergence de la méthode. On pourrait montrer sans trop de difficulté le théorème suivant :
Soit (a,b) un intervalle tel que : f(a).f(b) < 0
? X ? [ a , b ] f ' (X ) ? 0 et f '(X) ? 0
Alors f(X) = 0 possède une seule racine dans [a,b] et [ ]
? X (0) ? a , b la suite (A9-5) converge
quadratiquement.
Le choix du point de départ est crucial. Pour assurer la convergence on choisira un X (0) tel que la condition de Fourier soit vérifiée à savoir :
f ' (X ). f ( X ) > 0 .
(0) (0)
Propriétés d'ammoniac saturé (NH3) (à différentes températures).
|
T |
P (bar ) |
T (°C) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS |
Volume spécifique |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
VL |
VG |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
198,15 |
0,077408 |
-75 |
-335,5584 |
1146,5788 |
1482,1372 |
-1,4213 |
6,0422 |
7,4635 |
0,001392 |
12,4271214 |
||||||||||||||||||||||||||||||||||||||||||||||
|
199,15 |
0,083537 |
-74 |
-331,0835 |
1148,4028 |
1479,4863 |
-1,3988 |
6,0144 |
7,4131 |
0,0013929 |
11,5703907 |
||||||||||||||||||||||||||||||||||||||||||||||
|
200,15 |
0,090073 |
-73 |
-326,6122 |
1150,2232 |
1476,8354 |
-1,3764 |
5,9869 |
7,3633 |
0,0013938 |
10,781638 |
||||||||||||||||||||||||||||||||||||||||||||||
|
201,15 |
0,097039 |
-72 |
-322,1442 |
1152,04 |
1474,1842 |
-1,3541 |
5,9598 |
7,314 |
0,0013948 |
10,0548239 |
||||||||||||||||||||||||||||||||||||||||||||||
|
202,15 |
0,104456 |
-71 |
-317,6794 |
1153,853 |
1471,5324 |
-1,332 |
5,9331 |
7,2651 |
0,0013958 |
9,3844986 |
||||||||||||||||||||||||||||||||||||||||||||||
|
203,15 |
0,112348 |
-70 |
-313,2177 |
1155,6621 |
1468,8798 |
-1,31 |
5,9067 |
7,2167 |
0,0013968 |
8,76574 |
||||||||||||||||||||||||||||||||||||||||||||||
|
204,15 |
0,120739 |
-69 |
-308,7588 |
1157,4671 |
1466,2259 |
-1,2881 |
5,8807 |
7,1688 |
0,0013979 |
8,1940979 |
||||||||||||||||||||||||||||||||||||||||||||||
|
205,15 |
0,129653 |
-68 |
-304,3028 |
1159,2678 |
1463,5706 |
-1,2663 |
5,8549 |
7,1213 |
0,001399 |
7,665545 |
||||||||||||||||||||||||||||||||||||||||||||||
|
206,15 |
0,139117 |
-67 |
-299,8494 |
1161,0642 |
1460,9136 |
-1,2447 |
5,8296 |
7,0742 |
0,0014002 |
7,1764331 |
||||||||||||||||||||||||||||||||||||||||||||||
|
207,15 |
0,149157 |
-66 |
-295,3984 |
1162,8561 |
1458,2545 |
-1,2231 |
5,8045 |
7,0276 |
0,0014013 |
6,7234546 |
||||||||||||||||||||||||||||||||||||||||||||||
|
208,15 |
0,1598 |
-65 |
-290,9498 |
1164,6433 |
1455,5931 |
-1,2017 |
5,7797 |
6,9815 |
0,0014026 |
6,3036074 |
||||||||||||||||||||||||||||||||||||||||||||||
|
209,15 |
0,171076 |
-64 |
-286,5034 |
1166,4257 |
1452,9291 |
-1,1804 |
5,7553 |
6,9357 |
0,0014038 |
5,9141648 |
||||||||||||||||||||||||||||||||||||||||||||||
|
210,15 |
0,183014 |
-63 |
-282,059 |
1168,2031 |
1450,2622 |
-1,1592 |
5,7311 |
6,8904 |
0,0014051 |
5,5526476 |
||||||||||||||||||||||||||||||||||||||||||||||
|
211,15 |
0,195643 |
-62 |
-277,6166 |
1169,9754 |
1447,592 |
-1,1382 |
5,7073 |
6,8454 |
0,0014064 |
5,2168 |
||||||||||||||||||||||||||||||||||||||||||||||
|
212,15 |
0,208996 |
-61 |
-273,1759 |
1171,7424 |
1444,9183 |
-1,1172 |
5,6837 |
6,8009 |
0,0014078 |
4,9045672 |
||||||||||||||||||||||||||||||||||||||||||||||
|
213,15 |
0,223104 |
-60 |
-268,7368 |
1173,5039 |
1442,2408 |
-1,0963 |
5,6605 |
6,7568 |
0,0014092 |
4,6140764 |
||||||||||||||||||||||||||||||||||||||||||||||
|
214,15 |
0,238001 |
-59 |
-264,2993 |
1175,2598 |
1439,5591 |
-1,0756 |
5,6375 |
6,713 |
0,0014106 |
4,3436189 |
||||||||||||||||||||||||||||||||||||||||||||||
|
215,15 |
0,253721 |
-58 |
-259,863 |
1177,01 |
1436,873 |
-1,0549 |
5,6148 |
6,6697 |
0,0014121 |
4,0916344 |
||||||||||||||||||||||||||||||||||||||||||||||
|
216,15 |
0,270299 |
-57 |
-255,428 |
1178,7542 |
1434,1821 |
-1,0343 |
5,5923 |
6,6267 |
0,0014136 |
3,8566974 |
||||||||||||||||||||||||||||||||||||||||||||||
|
217,15 |
0,287772 |
-56 |
-250,994 |
1180,4923 |
1431,4862 |
-1,0139 |
5,5701 |
6,584 |
0,0014152 |
3,6375038 |
||||||||||||||||||||||||||||||||||||||||||||||
|
218,15 |
0,306176 |
-55 |
-246,5609 |
1182,2241 |
1428,7849 |
-0,9935 |
5,5482 |
6,5417 |
0,0014168 |
3,4328604 |
||||||||||||||||||||||||||||||||||||||||||||||
|
219,15 |
0,32555 |
-54 |
-242,1285 |
1183,9494 |
1426,078 |
-0,9733 |
5,5265 |
6,4998 |
0,0014184 |
3,2416737 |
||||||||||||||||||||||||||||||||||||||||||||||
|
220,15 |
0,345934 |
-53 |
-237,6968 |
1185,6682 |
1423,365 |
-0,9531 |
5,5051 |
6,4582 |
0,00142 |
3,0629418 |
||||||||||||||||||||||||||||||||||||||||||||||
|
221,15 |
0,367367 |
-52 |
-233,2656 |
1187,3801 |
1420,6457 |
-0,933 |
5,484 |
6,417 |
0,0014217 |
2,8957452 |
||||||||||||||||||||||||||||||||||||||||||||||
|
222,15 |
0,38989 |
-51 |
-228,8347 |
1189,0851 |
1417,9198 |
-0,9131 |
5,463 |
6,3761 |
0,0014235 |
2,7392398 |
||||||||||||||||||||||||||||||||||||||||||||||
|
223,15 |
0,413548 |
-50 |
-224,404 |
1190,783 |
1415,187 |
-0,8932 |
5,4424 |
6,3355 |
0,0014252 |
2,5926501 |
||||||||||||||||||||||||||||||||||||||||||||||
|
224,15 |
0,438382 |
-49 |
-219,9734 |
1192,4735 |
1412,4469 |
-0,8734 |
5,4219 |
6,2953 |
0,001427 |
2,455263 |
||||||||||||||||||||||||||||||||||||||||||||||
|
225,15 |
0,464437 |
-48 |
-215,5426 |
1194,1566 |
1409,6992 |
-0,8537 |
5,4017 |
6,2554 |
0,0014289 |
2,3264224 |
||||||||||||||||||||||||||||||||||||||||||||||
|
226,15 |
0,491759 |
-47 |
-211,1117 |
1195,832 |
1406,9437 |
-0,8341 |
5,3817 |
6,2157 |
0,0014307 |
2,2055242 |
||||||||||||||||||||||||||||||||||||||||||||||
|
T |
P ar (b ) |
T |
Enthalpie |
Chaleur
de |
Entropie |
ÄS |
Volume spécifique |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
VL |
VG |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
227,15 |
0,520395 |
-46 |
-206,6803 |
1197,4996 |
1404,1799 |
-0,8145 |
5,3619 |
6,1764 |
0,0014326 |
2,0920118 |
||||||||||||||||||||||||||||||||||||||||||||||
|
228,15 |
0,550392 |
-45 |
-202,2484 |
1199,1591 |
1401,4076 |
-0,7951 |
5,3423 |
6,1374 |
0,0014346 |
1,9853718 |
||||||||||||||||||||||||||||||||||||||||||||||
|
229,15 |
0,5818 |
-44 |
-197,8159 |
1200,8105 |
1398,6264 |
-0,7757 |
5,323 |
6,0987 |
0,0014366 |
1,8851307 |
||||||||||||||||||||||||||||||||||||||||||||||
|
230,15 |
0,614667 |
-43 |
-193,3826 |
1202,4536 |
1395,8361 |
-0,7564 |
5,3039 |
6,0603 |
0,0014386 |
1,7908513 |
||||||||||||||||||||||||||||||||||||||||||||||
|
231,15 |
0,649047 |
-42 |
-188,9483 |
1204,088 |
1393,0363 |
-0,7372 |
5,2849 |
6,0221 |
0,0014407 |
1,7021296 |
||||||||||||||||||||||||||||||||||||||||||||||
|
232,15 |
0,684989 |
-41 |
-184,5129 |
1205,7138 |
1390,2267 |
-0,7181 |
5,2662 |
5,9843 |
0,0014428 |
1,6185921 |
||||||||||||||||||||||||||||||||||||||||||||||
|
233,15 |
0,722548 |
-40 |
-180,0763 |
1207,3307 |
1387,407 |
-0,6991 |
5,2477 |
5,9467 |
0,0014449 |
1,5398933 |
||||||||||||||||||||||||||||||||||||||||||||||
|
234,15 |
0,761778 |
-39 |
-175,6383 |
1208,9385 |
1384,5768 |
-0,6801 |
5,2293 |
5,9094 |
0,0014471 |
1,4657134 |
||||||||||||||||||||||||||||||||||||||||||||||
|
235,15 |
0,802735 |
-38 |
-171,1988 |
1210,5371 |
1381,7358 |
-0,6612 |
5,2112 |
5,8724 |
0,0014493 |
1,3957561 |
||||||||||||||||||||||||||||||||||||||||||||||
|
236,15 |
0,845474 |
-37 |
-166,7576 |
1212,1262 |
1378,8838 |
-0,6424 |
5,1932 |
5,8356 |
0,0014515 |
1,3297469 |
||||||||||||||||||||||||||||||||||||||||||||||
|
237,15 |
0,890054 |
-36 |
-162,3146 |
1213,7057 |
1376,0204 |
-0,6236 |
5,1754 |
5,799 |
0,0014538 |
1,2674311 |
||||||||||||||||||||||||||||||||||||||||||||||
|
238,15 |
0,936533 |
-35 |
-157,8697 |
1215,2755 |
1373,1452 |
-0,6049 |
5,1578 |
5,7628 |
0,0014561 |
1,2085724 |
||||||||||||||||||||||||||||||||||||||||||||||
|
239,15 |
0,98497 |
-34 |
-153,4227 |
1216,8353 |
1370,258 |
-0,5863 |
5,1404 |
5,7268 |
0,0014584 |
1,1529513 |
||||||||||||||||||||||||||||||||||||||||||||||
|
240,15 |
1,035428 |
-33 |
-148,9735 |
1218,3849 |
1367,3584 |
-0,5678 |
5,1232 |
5,691 |
0,0014608 |
1,1003641 |
||||||||||||||||||||||||||||||||||||||||||||||
|
241,15 |
1,087968 |
-32 |
-144,5219 |
1219,9243 |
1364,4462 |
-0,5493 |
5,1061 |
5,6554 |
0,0014633 |
1,0506211 |
||||||||||||||||||||||||||||||||||||||||||||||
|
242,15 |
1,142652 |
-31 |
-140,0679 |
1221,4531 |
1361,5209 |
-0,5309 |
5,0892 |
5,6201 |
0,0014657 |
1,0035462 |
||||||||||||||||||||||||||||||||||||||||||||||
|
243,15 |
1,199546 |
-30 |
-135,6111 |
1222,9712 |
1358,5824 |
-0,5126 |
5,0724 |
5,585 |
0,0014682 |
0,9589752 |
||||||||||||||||||||||||||||||||||||||||||||||
|
244,15 |
1,258714 |
-29 |
-131,1516 |
1224,4785 |
1355,6301 |
-0,4943 |
5,0559 |
5,5502 |
0,0014707 |
0,9167555 |
||||||||||||||||||||||||||||||||||||||||||||||
|
245,15 |
1,320222 |
-28 |
-126,6892 |
1225,9748 |
1352,664 |
-0,4761 |
5,0394 |
5,5156 |
0,0014733 |
0,8767446 |
||||||||||||||||||||||||||||||||||||||||||||||
|
246,15 |
1,384139 |
-27 |
-122,2236 |
1227,4599 |
1349,6835 |
-0,458 |
5,0232 |
5,4812 |
0,0014759 |
0,83881 |
||||||||||||||||||||||||||||||||||||||||||||||
|
247,15 |
1,450532 |
-26 |
-117,7549 |
1228,9335 |
1346,6885 |
-0,4399 |
5,0071 |
5,447 |
0,0014786 |
0,8028279 |
||||||||||||||||||||||||||||||||||||||||||||||
|
248,15 |
1,51947 |
-25 |
-113,2829 |
1230,3956 |
1343,6785 |
-0,4219 |
4,9911 |
5,413 |
0,0014812 |
0,7686827 |
||||||||||||||||||||||||||||||||||||||||||||||
|
249,15 |
1,591026 |
-24 |
-108,8073 |
1231,846 |
1340,6533 |
-0,404 |
4,9753 |
5,3792 |
0,001484 |
0,7362667 |
||||||||||||||||||||||||||||||||||||||||||||||
|
250,15 |
1,665269 |
-23 |
-104,3281 |
1233,2844 |
1337,6125 |
-0,3861 |
4,9596 |
5,3457 |
0,0014867 |
0,7054791 |
||||||||||||||||||||||||||||||||||||||||||||||
|
251,15 |
1,742273 |
-22 |
-99,8452 |
1234,7107 |
1334,5559 |
-0,3682 |
4,9441 |
5,3123 |
0,0014895 |
0,6762258 |
||||||||||||||||||||||||||||||||||||||||||||||
|
252,15 |
1,822111 |
-21 |
-95,3583 |
1236,1247 |
1331,4831 |
-0,3504 |
4,9287 |
5,2791 |
0,0014923 |
0,6484188 |
||||||||||||||||||||||||||||||||||||||||||||||
|
253,15 |
1,904858 |
-20 |
-90,8675 |
1237,5263 |
1328,3938 |
-0,3327 |
4,9134 |
5,2461 |
0,0014952 |
0,6219756 |
||||||||||||||||||||||||||||||||||||||||||||||
|
254,15 |
1,99059 |
-19 |
-86,3724 |
1238,9152 |
1325,2876 |
-0,315 |
4,8983 |
5,2134 |
0,0014981 |
0,5968193 |
||||||||||||||||||||||||||||||||||||||||||||||
|
255,15 |
2,079384 |
-18 |
-81,873 |
1240,2913 |
1322,1643 |
-0,2974 |
4,8833 |
5,1808 |
0,001501 |
0,5728775 |
||||||||||||||||||||||||||||||||||||||||||||||
|
256,15 |
2,171317 |
-17 |
-77,3692 |
1241,6543 |
1319,0235 |
-0,2799 |
4,8685 |
5,1483 |
0,001504 |
0,5500827 |
||||||||||||||||||||||||||||||||||||||||||||||
|
T |
P (bar) |
T |
Enthalpie |
Chaleur
de |
Entropie |
ÄS |
Volumeécifique |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
VL |
VG |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
257,15 |
2,266467 |
-16 |
-72,8607 |
1243,0042 |
1315,8649 |
-0,2623 |
4,8538 |
5,1161 |
0,001507 |
0,5283715 |
||||||||||||||||||||||||||||||||||||||||||||||
|
258,15 |
2,364915 |
-15 |
-68,3476 |
1244,3407 |
1312,6882 |
-0,2449 |
4,8392 |
5,084 |
0,00151 |
0,5076843 |
||||||||||||||||||||||||||||||||||||||||||||||
|
259,15 |
2,466741 |
-14 |
-63,8295 |
1245,6636 |
1309,4931 |
-0,2275 |
4,8247 |
5,0522 |
0,0015131 |
0,4879653 |
||||||||||||||||||||||||||||||||||||||||||||||
|
260,15 |
2,572027 |
-13 |
-59,3065 |
1246,9727 |
1306,2792 |
-0,2101 |
4,8103 |
5,0204 |
0,0015162 |
0,4691623 |
||||||||||||||||||||||||||||||||||||||||||||||
|
261,15 |
2,680856 |
-12 |
-54,7783 |
1248,268 |
1303,0463 |
-0,1928 |
4,7961 |
4,9889 |
0,0015194 |
0,4512259 |
||||||||||||||||||||||||||||||||||||||||||||||
|
262,15 |
2,79331 |
-11 |
-50,2449 |
1249,5491 |
1299,794 |
-0,1755 |
4,782 |
4,9575 |
0,0015226 |
0,4341101 |
||||||||||||||||||||||||||||||||||||||||||||||
|
263,15 |
2,909474 |
-10 |
-45,706 |
1250,8159 |
1296,5219 |
-0,1583 |
4,7679 |
4,9263 |
0,0015258 |
0,4177713 |
||||||||||||||||||||||||||||||||||||||||||||||
|
264,15 |
3,029434 |
-9 |
-41,1616 |
1252,0682 |
1293,2298 |
-0,1412 |
4,754 |
4,8952 |
0,001529 |
0,4021687 |
||||||||||||||||||||||||||||||||||||||||||||||
|
265,15 |
3,153275 |
-8 |
-36,6115 |
1253,3058 |
1289,9173 |
-0,124 |
4,7403 |
4,8643 |
0,0015323 |
0,3872638 |
||||||||||||||||||||||||||||||||||||||||||||||
|
266,15 |
3,281085 |
-7 |
-32,0556 |
1254,5285 |
1286,5842 |
-0,107 |
4,7266 |
4,8335 |
0,0015357 |
0,3730206 |
||||||||||||||||||||||||||||||||||||||||||||||
|
267,15 |
3,412952 |
-6 |
-27,4938 |
1255,7362 |
1283,23 |
-0,0899 |
4,713 |
4,8029 |
0,001539 |
0,3594049 |
||||||||||||||||||||||||||||||||||||||||||||||
|
268,15 |
3,548964 |
-5 |
-22,9259 |
1256,9285 |
1279,8544 |
-0,0729 |
4,6995 |
4,7725 |
0,0015424 |
0,3463847 |
||||||||||||||||||||||||||||||||||||||||||||||
|
269,15 |
3,689212 |
-4 |
-18,3517 |
1258,1055 |
1276,4572 |
-0,056 |
4,6862 |
4,7422 |
0,0015459 |
0,3339298 |
||||||||||||||||||||||||||||||||||||||||||||||
|
270,15 |
3,833785 |
-3 |
-13,7712 |
1259,2667 |
1273,038 |
-0,0391 |
4,6729 |
4,712 |
0,0015494 |
0,3220116 |
||||||||||||||||||||||||||||||||||||||||||||||
|
271,15 |
3,982775 |
-2 |
-9,1843 |
1260,4121 |
1269,5964 |
-0,0222 |
4,6597 |
4,6819 |
0,0015529 |
0,3106034 |
||||||||||||||||||||||||||||||||||||||||||||||
|
272,15 |
4,136275 |
-1 |
-4,5907 |
1261,5415 |
1266,1321 |
-0,0054 |
4,6466 |
4,652 |
0,0015564 |
0,2996796 |
||||||||||||||||||||||||||||||||||||||||||||||
|
273,15 |
4,294376 |
0 |
0,0096 |
1262,6545 |
1262,6449 |
0,0114 |
4,6336 |
4,6223 |
0,00156 |
0,2892165 |
||||||||||||||||||||||||||||||||||||||||||||||
|
274,15 |
4,457173 |
1 |
4,6168 |
1263,7511 |
1259,1343 |
0,0281 |
4,6207 |
4,5926 |
0,0015636 |
0,2791913 |
||||||||||||||||||||||||||||||||||||||||||||||
|
275,15 |
4,62476 |
2 |
9,2311 |
1264,8311 |
1255,6 |
0,0448 |
4,6079 |
4,5631 |
0,0015673 |
0,2695829 |
||||||||||||||||||||||||||||||||||||||||||||||
|
276,15 |
4,797232 |
3 |
13,8524 |
1265,8941 |
1252,0417 |
0,0615 |
4,5952 |
4,5337 |
0,001571 |
0,2603709 |
||||||||||||||||||||||||||||||||||||||||||||||
|
277,15 |
4,974685 |
4 |
18,481 |
1266,9401 |
1248,459 |
0,0781 |
4,5826 |
4,5045 |
0,0015747 |
0,2515364 |
||||||||||||||||||||||||||||||||||||||||||||||
|
278,15 |
5,157216 |
5 |
23,117 |
1267,9687 |
1244,8517 |
0,0947 |
4,57 |
4,4753 |
0,0015785 |
0,2430613 |
||||||||||||||||||||||||||||||||||||||||||||||
|
279,15 |
5,344922 |
6 |
27,7606 |
1268,9798 |
1241,2192 |
0,1113 |
4,5576 |
4,4463 |
0,0015823 |
0,2349286 |
||||||||||||||||||||||||||||||||||||||||||||||
|
280,15 |
5,537901 |
7 |
32,4118 |
1269,9732 |
1237,5614 |
0,1278 |
4,5452 |
4,4174 |
0,0015861 |
0,2271221 |
||||||||||||||||||||||||||||||||||||||||||||||
|
281,15 |
5,736252 |
8 |
37,0707 |
1270,9486 |
1233,8779 |
0,1443 |
4,5329 |
4,3886 |
0,00159 |
0,2196266 |
||||||||||||||||||||||||||||||||||||||||||||||
|
282,15 |
5,940073 |
9 |
41,7376 |
1271,9059 |
1230,1683 |
0,1607 |
4,5206 |
4,3599 |
0,0015939 |
0,2124275 |
||||||||||||||||||||||||||||||||||||||||||||||
|
283,15 |
6,149466 |
10 |
46,4125 |
1272,8447 |
1226,4322 |
0,1772 |
4,5085 |
4,3313 |
0,0015979 |
0,2055112 |
||||||||||||||||||||||||||||||||||||||||||||||
|
284,15 |
6,364529 |
11 |
51,0956 |
1273,7649 |
1222,6693 |
0,1935 |
4,4964 |
4,3029 |
0,0016019 |
0,1988648 |
||||||||||||||||||||||||||||||||||||||||||||||
|
285,15 |
6,585365 |
12 |
55,787 |
1274,6662 |
1218,8793 |
0,2099 |
4,4844 |
4,2745 |
0,0016059 |
0,1924758 |
||||||||||||||||||||||||||||||||||||||||||||||
|
286,15 |
6,812075 |
13 |
60,4867 |
1275,5485 |
1215,0617 |
0,2262 |
4,4724 |
4,2462 |
0,0016099 |
0,1863327 |
||||||||||||||||||||||||||||||||||||||||||||||
|
T |
P (bar) |
T |
Enthalpie |
Chaleur
de |
Entropie |
ÄS |
Volume spécifique (m3/K g) |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
VL |
VG |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
287,15 |
7,044761 |
14 |
65,1951 |
1276,4114 |
1211,2163 |
0,2425 |
4,4606 |
4,2181 |
0,001614 |
0,1804243 |
||||||||||||||||||||||||||||||||||||||||||||||
|
288,15 |
7,283527 |
15 |
69,912 |
1277,2547 |
1207,3427 |
0,2588 |
4,4488 |
4,19 |
0,0016182 |
0,1747401 |
||||||||||||||||||||||||||||||||||||||||||||||
|
289,15 |
7,528475 |
16 |
74,6378 |
1278,0783 |
1203,4405 |
0,275 |
4,437 |
4,162 |
0,0016223 |
0,1692702 |
||||||||||||||||||||||||||||||||||||||||||||||
|
290,15 |
7,779709 |
17 |
79,3725 |
1278,8817 |
1199,5093 |
0,2912 |
4,4253 |
4,1341 |
0,0016265 |
0,1640052 |
||||||||||||||||||||||||||||||||||||||||||||||
|
291,15 |
8,037334 |
18 |
84,1162 |
1279,6649 |
1195,5488 |
0,3074 |
4,4137 |
4,1063 |
0,0016308 |
0,1589359 |
||||||||||||||||||||||||||||||||||||||||||||||
|
296,15 |
9,425002 |
23 |
107,9745 |
1283,2677 |
1175,2933 |
0,3879 |
4,3565 |
3,9687 |
0,0016525 |
0,1362418 |
||||||||||||||||||||||||||||||||||||||||||||||
|
297,15 |
9,723187 |
24 |
112,7749 |
1283,9239 |
1171,149 |
0,4039 |
4,3452 |
3,9414 |
0,001657 |
0,1321819 |
||||||||||||||||||||||||||||||||||||||||||||||
|
298,15 |
10,028505 |
25 |
117,5852 |
1284,5579 |
1166,9727 |
0,4199 |
4,334 |
3,9141 |
0,0016614 |
0,1282661 |
||||||||||||||||||||||||||||||||||||||||||||||
|
299,15 |
10,341065 |
26 |
122,4055 |
1285,1696 |
1162,7641 |
0,4358 |
4,3228 |
3,887 |
0,001666 |
0,1244884 |
||||||||||||||||||||||||||||||||||||||||||||||
|
300,15 |
10,660973 |
27 |
127,236 |
1285,7587 |
1158,5227 |
0,4518 |
4,3117 |
3,8599 |
0,0016705 |
0,1208431 |
||||||||||||||||||||||||||||||||||||||||||||||
|
301,15 |
10,988338 |
28 |
132,0766 |
1286,3249 |
1154,2483 |
0,4677 |
4,3006 |
3,8329 |
0,0016751 |
0,1173246 |
||||||||||||||||||||||||||||||||||||||||||||||
|
302,15 |
11,323269 |
29 |
136,9276 |
1286,8679 |
1149,9403 |
0,4836 |
4,2896 |
3,806 |
0,0016798 |
0,1139278 |
||||||||||||||||||||||||||||||||||||||||||||||
|
303,15 |
11,665875 |
30 |
141,789 |
1287,3875 |
1145,5985 |
0,4995 |
4,2786 |
3,7791 |
0,0016844 |
0,1106478 |
||||||||||||||||||||||||||||||||||||||||||||||
|
304,15 |
12,016264 |
31 |
146,6611 |
1287,8834 |
1141,2223 |
0,5153 |
4,2677 |
3,7523 |
0,0016891 |
0,1074796 |
||||||||||||||||||||||||||||||||||||||||||||||
|
305,15 |
12,374547 |
32 |
151,5438 |
1288,3553 |
1136,8115 |
0,5311 |
4,2567 |
3,7256 |
0,0016939 |
0,104419 |
||||||||||||||||||||||||||||||||||||||||||||||
|
306,15 |
12,740832 |
33 |
156,4373 |
1288,8029 |
1132,3656 |
0,547 |
4,2459 |
3,6989 |
0,0016987 |
0,1014615 |
||||||||||||||||||||||||||||||||||||||||||||||
|
307,15 |
13,11523 |
34 |
161,3417 |
1289,226 |
1127,8843 |
0,5627 |
4,235 |
3,6723 |
0,0017035 |
0,098603 |
||||||||||||||||||||||||||||||||||||||||||||||
|
308,15 |
13,497851 |
35 |
166,2572 |
1289,6242 |
1123,367 |
0,5785 |
4,2242 |
3,6457 |
0,0017083 |
0,0958396 |
||||||||||||||||||||||||||||||||||||||||||||||
|
309,15 |
13,888805 |
36 |
171,1837 |
1289,9973 |
1118,8135 |
0,5943 |
4,2135 |
3,6192 |
0,0017132 |
0,0931676 |
||||||||||||||||||||||||||||||||||||||||||||||
|
310,15 |
14,288202 |
37 |
176,1216 |
1290,345 |
1114,2234 |
0,61 |
4,2028 |
3,5928 |
0,0017181 |
0,0905834 |
||||||||||||||||||||||||||||||||||||||||||||||
|
311,15 |
14,696152 |
38 |
181,0708 |
1290,667 |
1109,5962 |
0,6257 |
4,1921 |
3,5664 |
0,0017231 |
0,0880835 |
||||||||||||||||||||||||||||||||||||||||||||||
|
312,15 |
15,112767 |
39 |
186,0314 |
1290,963 |
1104,9315 |
0,6414 |
4,1814 |
3,54 |
0,0017281 |
0,0856648 |
||||||||||||||||||||||||||||||||||||||||||||||
|
313,15 |
15,538157 |
40 |
191,0037 |
1291,2327 |
1100,229 |
0,657 |
4,1708 |
3,5137 |
0,0017331 |
0,083324 |
||||||||||||||||||||||||||||||||||||||||||||||
|
314,15 |
15,972434 |
41 |
195,9876 |
1291,4758 |
1095,4882 |
0,6727 |
4,1602 |
3,4875 |
0,0017382 |
0,0810583 |
||||||||||||||||||||||||||||||||||||||||||||||
|
315,15 |
16,415707 |
42 |
200,9833 |
1291,692 |
1090,7087 |
0,6883 |
4,1496 |
3,4613 |
0,0017433 |
0,0788647 |
||||||||||||||||||||||||||||||||||||||||||||||
|
316,15 |
16,868088 |
43 |
205,9909 |
1291,8811 |
1085,8902 |
0,7039 |
4,139 |
3,4351 |
0,0017484 |
0,0767405 |
||||||||||||||||||||||||||||||||||||||||||||||
|
317,15 |
17,329687 |
44 |
211,0105 |
1292,0427 |
1081,0322 |
0,7195 |
4,1285 |
3,409 |
0,0017536 |
0,0746831 |
||||||||||||||||||||||||||||||||||||||||||||||
|
318,15 |
17,800617 |
45 |
216,0422 |
1292,1766 |
1076,1344 |
0,7351 |
4,118 |
3,3829 |
0,0017588 |
0,07269 |
||||||||||||||||||||||||||||||||||||||||||||||
|
319,15 |
18,280988 |
46 |
221,0861 |
1292,2824 |
1071,1963 |
0,7507 |
4,1075 |
3,3569 |
0,001764 |
0,0707588 |
||||||||||||||||||||||||||||||||||||||||||||||
|
320,15 |
18,770911 |
47 |
226,1424 |
1292,3599 |
1066,2175 |
0,7662 |
4,0971 |
3,3309 |
0,0017693 |
0,0688873 |
||||||||||||||||||||||||||||||||||||||||||||||
|
T |
P (bar) |
T |
Enthalpie |
Chaleur
de |
Entropie |
ÄS |
Volume spécifique |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
VL |
VG |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
321,15 |
19,270497 |
48 |
231,2111 |
1292,4087 |
1061,1976 |
0,7818 |
4,0866 |
3,3049 |
0,0017746 |
0,0670732 |
||||||||||||||||||||||||||||||||||||||||||||||
|
322,15 |
19,779857 |
49 |
236,2922 |
1292,4286 |
1056,1363 |
0,7973 |
4,0762 |
3,279 |
0,00178 |
0,0653144 |
||||||||||||||||||||||||||||||||||||||||||||||
|
323,15 |
20,299102 |
50 |
241,3861 |
1292,4192 |
1051,0332 |
0,8128 |
4,0658 |
3,2531 |
0,0017854 |
0,063609 |
||||||||||||||||||||||||||||||||||||||||||||||
|
324,15 |
20,828344 |
51 |
246,4926 |
1292,3803 |
1045,8877 |
0,8283 |
4,0554 |
3,2272 |
0,0017908 |
0,061955 |
||||||||||||||||||||||||||||||||||||||||||||||
|
325,15 |
21,367692 |
52 |
251,612 |
1292,3116 |
1040,6997 |
0,8437 |
4,0451 |
3,2013 |
0,0017963 |
0,0603505 |
||||||||||||||||||||||||||||||||||||||||||||||
|
326,15 |
21,917257 |
53 |
256,7442 |
1292,2128 |
1035,4685 |
0,8592 |
4,0347 |
3,1755 |
0,0018017 |
0,0587938 |
||||||||||||||||||||||||||||||||||||||||||||||
|
327,15 |
22,47715 |
54 |
261,8895 |
1292,0835 |
1030,194 |
0,8746 |
4,0244 |
3,1497 |
0,0018073 |
0,0572831 |
||||||||||||||||||||||||||||||||||||||||||||||
|
328,15 |
23,047482 |
55 |
267,048 |
1291,9236 |
1024,8756 |
0,8901 |
4,014 |
3,124 |
0,0018128 |
0,055817 |
||||||||||||||||||||||||||||||||||||||||||||||
|
329,15 |
23,628363 |
56 |
272,2196 |
1291,7327 |
1019,5131 |
0,9055 |
4,0037 |
3,0982 |
0,0018184 |
0,0543937 |
||||||||||||||||||||||||||||||||||||||||||||||
|
330,15 |
24,219903 |
57 |
277,4045 |
1291,5105 |
1014,1059 |
0,9209 |
3,9934 |
3,0725 |
0,0018241 |
0,0530118 |
||||||||||||||||||||||||||||||||||||||||||||||
|
331,15 |
24,822211 |
58 |
282,6029 |
1291,2567 |
1008,6538 |
0,9363 |
3,9831 |
3,0468 |
0,0018298 |
0,0516699 |
||||||||||||||||||||||||||||||||||||||||||||||
|
332,15 |
25,435398 |
59 |
287,8148 |
1290,9711 |
1003,1564 |
0,9516 |
3,9728 |
3,0212 |
0,0018355 |
0,0503665 |
||||||||||||||||||||||||||||||||||||||||||||||
|
333,15 |
26,059574 |
60 |
293,0402 |
1290,6534 |
997,6132 |
0,967 |
3,9625 |
2,9955 |
0,0018412 |
0,0491004 |
||||||||||||||||||||||||||||||||||||||||||||||
|
334,15 |
26,694847 |
61 |
298,2794 |
1290,3033 |
992,0239 |
0,9824 |
3,9522 |
2,9699 |
0,001847 |
0,0478703 |
||||||||||||||||||||||||||||||||||||||||||||||
|
335,15 |
27,341327 |
62 |
303,5323 |
1289,9205 |
986,3882 |
0,9977 |
3,942 |
2,9443 |
0,0018528 |
0,0466749 |
||||||||||||||||||||||||||||||||||||||||||||||
|
336,15 |
27,999122 |
63 |
308,7991 |
1289,5047 |
980,7057 |
1,013 |
3,9317 |
2,9187 |
0,0018587 |
0,0455131 |
||||||||||||||||||||||||||||||||||||||||||||||
|
337,15 |
28,668342 |
64 |
314,0798 |
1289,0558 |
974,9759 |
1,0283 |
3,9214 |
2,8931 |
0,0018645 |
0,0443837 |
||||||||||||||||||||||||||||||||||||||||||||||
|
338,15 |
29,349095 |
65 |
319,3747 |
1288,5733 |
969,1987 |
1,0436 |
3,9112 |
2,8675 |
0,0018705 |
0,0432857 |
||||||||||||||||||||||||||||||||||||||||||||||
|
339,15 |
30,041488 |
66 |
324,6836 |
1288,0571 |
963,3735 |
1,0589 |
3,9009 |
2,842 |
0,0018764 |
0,0422181 |
||||||||||||||||||||||||||||||||||||||||||||||
|
340,15 |
30,745629 |
67 |
330,0068 |
1287,507 |
957,5002 |
1,0742 |
3,8906 |
2,8164 |
0,0018824 |
0,0411797 |
||||||||||||||||||||||||||||||||||||||||||||||
|
341,15 |
31,461627 |
68 |
335,3443 |
1286,9225 |
951,5782 |
1,0895 |
3,8804 |
2,7909 |
0,0018885 |
0,0401697 |
||||||||||||||||||||||||||||||||||||||||||||||
|
342,15 |
32,189588 |
69 |
340,6962 |
1286,3036 |
945,6074 |
1,1047 |
3,8701 |
2,7654 |
0,0018945 |
0,0391871 |
||||||||||||||||||||||||||||||||||||||||||||||
|
343,15 |
32,929618 |
70 |
346,0626 |
1285,6499 |
939,5873 |
1,12 |
3,8598 |
2,7398 |
0,0019006 |
0,0382311 |
||||||||||||||||||||||||||||||||||||||||||||||
|
344,15 |
33,681825 |
71 |
351,4436 |
1284,9612 |
933,5176 |
1,1352 |
3,8496 |
2,7143 |
0,0019068 |
0,0373007 |
||||||||||||||||||||||||||||||||||||||||||||||
|
345,15 |
34,446315 |
72 |
356,8392 |
1284,2373 |
927,3981 |
1,1505 |
3,8393 |
2,6888 |
0,0019129 |
0,0363952 |
||||||||||||||||||||||||||||||||||||||||||||||
|
346,15 |
35,223193 |
73 |
362,2496 |
1283,4779 |
921,2283 |
1,1657 |
3,829 |
2,6633 |
0,0019191 |
0,0355138 |
||||||||||||||||||||||||||||||||||||||||||||||
|
347,15 |
36,012564 |
74 |
367,6748 |
1282,6829 |
915,0081 |
1,1809 |
3,8187 |
2,6378 |
0,0019254 |
0,0346556 |
||||||||||||||||||||||||||||||||||||||||||||||
|
348,15 |
36,814533 |
75 |
373,115 |
1281,852 |
908,737 |
1,1961 |
3,8085 |
2,6123 |
0,0019317 |
0,03382 |
||||||||||||||||||||||||||||||||||||||||||||||
|
349,15 |
37,629206 |
76 |
378,5701 |
1280,9849 |
902,4149 |
1,2113 |
3,7982 |
2,5869 |
0,001938 |
0,0330062 |
||||||||||||||||||||||||||||||||||||||||||||||
|
350,15 |
38,456686 |
77 |
384,0402 |
1280,0816 |
896,0413 |
1,2265 |
3,7879 |
2,5614 |
0,0019443 |
0,0322136 |
||||||||||||||||||||||||||||||||||||||||||||||
|
T |
P (bar ) |
T |
Enthalpie |
Chaleur
de |
Entropie |
spécifi que AS (KJ/Kg.°K) |
Volume
spécifique |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
VL |
VG |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
351,15 |
39,297077 |
78 |
389,5256 |
1279,1417 |
889,6161 |
1,2417 |
3,7776 |
2,5359 |
0,0019507 |
0,0314415 |
||||||||||||||||||||||||||||||||||||||||||||||
|
352,15 |
40,150481 |
79 |
395,0261 |
1278,1651 |
883,1389 |
1,2568 |
3,7672 |
2,5104 |
0,0019571 |
0,0306892 |
||||||||||||||||||||||||||||||||||||||||||||||
|
353,15 |
41,017003 |
80 |
400,542 |
1277,1516 |
876,6096 |
1,272 |
3,7569 |
2,4849 |
0,0019636 |
0,0299563 |
||||||||||||||||||||||||||||||||||||||||||||||
|
354,15 |
41,896743 |
81 |
406,0732 |
1276,101 |
870,0277 |
1,2871 |
3,7466 |
2,4594 |
0,0019701 |
0,0292419 |
||||||||||||||||||||||||||||||||||||||||||||||
|
355,15 |
42,789805 |
82 |
411,62 |
1275,0131 |
863,3932 |
1,3023 |
3,7362 |
2,4339 |
0,0019766 |
0,0285457 |
||||||||||||||||||||||||||||||||||||||||||||||
|
356,15 |
43,696289 |
83 |
417,1822 |
1273,8879 |
856,7057 |
1,3174 |
3,7259 |
2,4085 |
0,0019832 |
0,027867 |
||||||||||||||||||||||||||||||||||||||||||||||
|
357,15 |
44,616296 |
84 |
422,7601 |
1272,725 |
849,9649 |
1,3326 |
3,7155 |
2,383 |
0,0019898 |
0,0272054 |
||||||||||||||||||||||||||||||||||||||||||||||
|
358,15 |
45,549927 |
85 |
428,3536 |
1271,5244 |
843,1708 |
1,3477 |
3,7051 |
2,3575 |
0,0019964 |
0,0265602 |
||||||||||||||||||||||||||||||||||||||||||||||
|
359,15 |
46,497282 |
86 |
433,9629 |
1270,2859 |
836,323 |
1,3628 |
3,6948 |
2,332 |
0,0020031 |
0,0259311 |
||||||||||||||||||||||||||||||||||||||||||||||
|
360,15 |
47,458459 |
87 |
439,588 |
1269,0093 |
829,4213 |
1,3779 |
3,6844 |
2,3065 |
0,0020098 |
0,0253175 |
||||||||||||||||||||||||||||||||||||||||||||||
|
361,15 |
48,433558 |
88 |
445,229 |
1267,6947 |
822,4656 |
1,393 |
3,674 |
2,281 |
0,0020165 |
0,024719 |
||||||||||||||||||||||||||||||||||||||||||||||
|
362,15 |
49,422677 |
89 |
450,886 |
1266,3417 |
815,4557 |
1,4081 |
3,6635 |
2,2555 |
0,0020233 |
0,0241351 |
||||||||||||||||||||||||||||||||||||||||||||||
|
363,15 |
50,425914 |
90 |
456,5591 |
1264,9504 |
808,3913 |
1,4232 |
3,6531 |
2,2299 |
0,0020301 |
0,0235655 |
||||||||||||||||||||||||||||||||||||||||||||||
|
364,15 |
51,443365 |
91 |
462,2482 |
1263,5205 |
801,2723 |
1,4382 |
3,6427 |
2,2044 |
0,0020369 |
0,0230096 |
||||||||||||||||||||||||||||||||||||||||||||||
|
365,15 |
52,475128 |
92 |
467,9535 |
1262,0521 |
794,0985 |
1,4533 |
3,6322 |
2,1789 |
0,0020438 |
0,0224672 |
||||||||||||||||||||||||||||||||||||||||||||||
|
366,15 |
53,521298 |
93 |
473,6751 |
1260,5449 |
786,8698 |
1,4684 |
3,6217 |
2,1534 |
0,0020507 |
0,0219378 |
||||||||||||||||||||||||||||||||||||||||||||||
|
367,15 |
54,581972 |
94 |
479,413 |
1258,9991 |
779,5861 |
1,4834 |
3,6112 |
2,1278 |
0,0020577 |
0,021421 |
||||||||||||||||||||||||||||||||||||||||||||||
|
368,15 |
55,657243 |
95 |
485,1672 |
1257,4143 |
772,2471 |
1,4985 |
3,6007 |
2,1023 |
0,0020647 |
0,0209165 |
||||||||||||||||||||||||||||||||||||||||||||||
|
369,15 |
56,747206 |
96 |
490,9379 |
1255,7907 |
764,8528 |
1,5135 |
3,5902 |
2,0767 |
0,0020717 |
0,020424 |
||||||||||||||||||||||||||||||||||||||||||||||
|
370,15 |
57,851954 |
97 |
496,7251 |
1254,1282 |
757,403 |
1,5285 |
3,5797 |
2,0511 |
0,0020788 |
0,0199431 |
||||||||||||||||||||||||||||||||||||||||||||||
|
371,15 |
58,971582 |
98 |
502,5289 |
1252,4266 |
749,8977 |
1,5436 |
3,5691 |
2,0256 |
0,0020859 |
0,0194735 |
||||||||||||||||||||||||||||||||||||||||||||||
|
372,15 |
60,10618 |
99 |
508,3493 |
1250,6861 |
742,3367 |
1,5586 |
3,5586 |
2 |
0,002093 |
0,0190148 |
||||||||||||||||||||||||||||||||||||||||||||||
|
373,15 |
61,255842 |
100 |
514,1864 |
1248,9065 |
734,72 |
1,5736 |
3,548 |
1,9744 |
0,0021002 |
0,0185668 |
||||||||||||||||||||||||||||||||||||||||||||||
|
374,15 |
62,420657 |
101 |
520,0403 |
1247,0878 |
727,0475 |
1,5886 |
3,5374 |
1,9488 |
0,0021074 |
0,0181292 |
||||||||||||||||||||||||||||||||||||||||||||||
|
375,15 |
63,600717 |
102 |
525,911 |
1245,2301 |
719,3191 |
1,6036 |
3,5268 |
1,9232 |
0,0021146 |
0,0177017 |
||||||||||||||||||||||||||||||||||||||||||||||
|
376,15 |
64,796111 |
103 |
531,7985 |
1243,3333 |
711,5348 |
1,6186 |
3,5162 |
1,8976 |
0,0021219 |
0,017284 |
||||||||||||||||||||||||||||||||||||||||||||||
|
377,15 |
66,006929 |
104 |
537,703 |
1241,3975 |
703,6944 |
1,6336 |
3,5056 |
1,872 |
0,0021292 |
0,0168758 |
||||||||||||||||||||||||||||||||||||||||||||||
|
378,15 |
67,23326 |
105 |
543,6245 |
1239,4226 |
695,7981 |
1,6486 |
3,4949 |
1,8463 |
0,0021365 |
0,016477 |
||||||||||||||||||||||||||||||||||||||||||||||
|
379,15 |
68,47519 |
106 |
549,563 |
1237,4088 |
687,8457 |
1,6636 |
3,4843 |
1,8207 |
0,0021439 |
0,0160872 |
||||||||||||||||||||||||||||||||||||||||||||||
|
380,15 |
69,732808 |
107 |
555,5186 |
1235,356 |
679,8373 |
1,6786 |
3,4736 |
1,795 |
0,0021513 |
0,0157062 |
||||||||||||||||||||||||||||||||||||||||||||||
|
T (°K) |
P (bar) |
T (°C) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS |
Volume
spécifique |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
VL |
VG |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
381,15 |
71,006199 |
108 |
561,4914 |
1233,2643 |
671,7729 |
1,6935 |
3,4629 |
1,7694 |
0,0021587 |
0,0153337 |
||||||||||||||||||||||||||||||||||||||||||||||
|
382,15 |
72,29545 |
109 |
567,4814 |
1231,1338 |
663,6524 |
1,7085 |
3,4522 |
1,7437 |
0,0021662 |
0,0149697 |
||||||||||||||||||||||||||||||||||||||||||||||
|
383,15 |
73,600646 |
110 |
573,4887 |
1228,9646 |
655,4759 |
1,7235 |
3,4415 |
1,718 |
0,0021737 |
0,0146137 |
||||||||||||||||||||||||||||||||||||||||||||||
|
384,15 |
74,921871 |
111 |
579,5133 |
1226,7567 |
647,2434 |
1,7384 |
3,4308 |
1,6924 |
0,0021813 |
0,0142657 |
||||||||||||||||||||||||||||||||||||||||||||||
|
385,15 |
76,25921 |
112 |
585,5552 |
1224,5102 |
638,9549 |
1,7534 |
3,42 |
1,6667 |
0,0021889 |
0,0139254 |
||||||||||||||||||||||||||||||||||||||||||||||
|
386,15 |
77,612745 |
113 |
591,6146 |
1222,2252 |
630,6106 |
1,7683 |
3,4093 |
1,641 |
0,0021965 |
0,0135926 |
||||||||||||||||||||||||||||||||||||||||||||||
|
387,15 |
78,982558 |
114 |
597,6915 |
1219,902 |
622,2105 |
1,7832 |
3,3985 |
1,6153 |
0,0022042 |
0,0132671 |
||||||||||||||||||||||||||||||||||||||||||||||
|
388,15 |
80,368731 |
115 |
603,7859 |
1217,5405 |
613,7546 |
1,7982 |
3,3877 |
1,5896 |
0,0022119 |
0,0129488 |
||||||||||||||||||||||||||||||||||||||||||||||
|
389,15 |
81,771346 |
116 |
609,8978 |
1215,1409 |
605,243 |
1,8131 |
3,3769 |
1,5638 |
0,0022196 |
0,0126374 |
||||||||||||||||||||||||||||||||||||||||||||||
|
390,15 |
83,190481 |
117 |
616,0274 |
1212,7033 |
596,6759 |
1,828 |
3,3661 |
1,5381 |
0,0022273 |
0,0123328 |
||||||||||||||||||||||||||||||||||||||||||||||
|
391,15 |
84,626218 |
118 |
622,1747 |
1210,228 |
588,0533 |
1,8429 |
3,3553 |
1,5124 |
0,0022351 |
0,0120348 |
||||||||||||||||||||||||||||||||||||||||||||||
|
392,15 |
86,078634 |
119 |
628,3396 |
1207,7151 |
579,3755 |
1,8578 |
3,3445 |
1,4867 |
0,002243 |
0,0117433 |
||||||||||||||||||||||||||||||||||||||||||||||
|
393,15 |
87,547808 |
120 |
634,5224 |
1205,1647 |
570,6424 |
1,8728 |
3,3337 |
1,4609 |
0,0022508 |
0,0114581 |
||||||||||||||||||||||||||||||||||||||||||||||
|
394,15 |
89,033817 |
121 |
640,7229 |
1202,5771 |
561,8542 |
1,8877 |
3,3228 |
1,4352 |
0,0022588 |
0,0111789 |
||||||||||||||||||||||||||||||||||||||||||||||
|
395,15 |
90,536738 |
122 |
646,9413 |
1199,9524 |
553,0111 |
1,9025 |
3,312 |
1,4094 |
0,0022667 |
0,0109058 |
||||||||||||||||||||||||||||||||||||||||||||||
|
396,15 |
92,056645 |
123 |
653,1776 |
1197,2909 |
544,1133 |
1,9174 |
3,3011 |
1,3837 |
0,0022747 |
0,0106385 |
||||||||||||||||||||||||||||||||||||||||||||||
|
397,15 |
93,593615 |
124 |
659,4318 |
1194,5928 |
535,161 |
1,9323 |
3,2902 |
1,3579 |
0,0022827 |
0,0103769 |
||||||||||||||||||||||||||||||||||||||||||||||
|
398,15 |
95,147722 |
125 |
665,704 |
1191,8582 |
526,1542 |
1,9472 |
3,2793 |
1,3321 |
0,0022907 |
0,0101209 |
||||||||||||||||||||||||||||||||||||||||||||||
|
399,15 |
96,719039 |
126 |
671,9943 |
1189,0875 |
517,0933 |
1,9621 |
3,2685 |
1,3064 |
0,0022988 |
0,0098702 |
||||||||||||||||||||||||||||||||||||||||||||||
|
400,15 |
98,307639 |
127 |
678,3026 |
1186,2809 |
507,9784 |
1,9769 |
3,2576 |
1,2806 |
0,0023069 |
0,0096249 |
||||||||||||||||||||||||||||||||||||||||||||||
|
401,15 |
99,913595 |
128 |
684,629 |
1183,4386 |
498,8097 |
1,9918 |
3,2467 |
1,2548 |
0,0023151 |
0,0093847 |
||||||||||||||||||||||||||||||||||||||||||||||
|
402,15 |
101,536976 |
129 |
690,9735 |
1180,561 |
489,5875 |
2,0067 |
3,2357 |
1,2291 |
0,0023233 |
0,0091496 |
||||||||||||||||||||||||||||||||||||||||||||||
|
403,15 |
103,177855 |
130 |
697,3362 |
1177,6482 |
480,312 |
2,0215 |
3,2248 |
1,2033 |
0,0023315 |
0,0089194 |
||||||||||||||||||||||||||||||||||||||||||||||
|
404,15 |
104,836301 |
131 |
703,7172 |
1174,7006 |
470,9834 |
2,0364 |
3,2139 |
1,1775 |
0,0023397 |
0,008694 |
||||||||||||||||||||||||||||||||||||||||||||||
|
405,15 |
106,512382 |
132 |
710,1164 |
1171,7185 |
461,6021 |
2,0512 |
3,203 |
1,1518 |
0,002348 |
0,0084734 |
||||||||||||||||||||||||||||||||||||||||||||||
|
406,15 |
108,206167 |
133 |
716,5339 |
1168,7021 |
452,1682 |
2,0661 |
3,1921 |
1,126 |
0,0023563 |
0,0082573 |
||||||||||||||||||||||||||||||||||||||||||||||
|
407,15 |
109,917724 |
134 |
722,9697 |
1165,6518 |
442,6821 |
2,0809 |
3,1811 |
1,1002 |
0,0023647 |
0,0080456 |
||||||||||||||||||||||||||||||||||||||||||||||
Propriétés de la vapeur d'eau (H2O) saturée (à différentes températures).
|
T (°C) |
T (°K) |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
VL |
VG |
|||||||||||||||||||||||||||||||
|
0 |
273,15 |
0,006109 |
-0,3553 |
2501,1419 |
2501,4973 |
0,0015 |
9,1579 |
9,1564 |
0,0009962 |
206,2390778 |
|||||||||||||||||||||||||||
|
1 |
274,15 |
0,006568 |
3,8657 |
2502,9798 |
2499,1141 |
0,017 |
9,1313 |
9,1143 |
0,0009963 |
192,546476 |
|||||||||||||||||||||||||||
|
2 |
275,15 |
0,007056 |
8,0853 |
2504,8171 |
2496,7318 |
0,0323 |
9,1049 |
9,0726 |
0,0009964 |
179,8660705 |
|||||||||||||||||||||||||||
|
3 |
276,15 |
0,007576 |
12,3036 |
2506,654 |
2494,3504 |
0,0476 |
9,0787 |
9,0311 |
0,0009965 |
168,1160721 |
|||||||||||||||||||||||||||
|
4 |
277,15 |
0,008131 |
16,5206 |
2508,4903 |
2491,9697 |
0,0629 |
9,0528 |
8,9899 |
0,0009966 |
157,2218233 |
|||||||||||||||||||||||||||
|
5 |
278,15 |
0,00872 |
20,7363 |
2510,3261 |
2489,5898 |
0,0781 |
9,0271 |
8,9491 |
0,0009966 |
147,1151336 |
|||||||||||||||||||||||||||
|
6 |
279,15 |
0,009347 |
24,9507 |
2512,1613 |
2487,2105 |
0,0932 |
9,0017 |
8,9085 |
0,0009968 |
137,7336809 |
|||||||||||||||||||||||||||
|
7 |
280,15 |
0,010014 |
29,164 |
2513,9959 |
2484,8319 |
0,1083 |
8,9765 |
8,8682 |
0,0009969 |
129,0204709 |
|||||||||||||||||||||||||||
|
8 |
281,15 |
0,010722 |
33,376 |
2515,8298 |
2482,4538 |
0,1233 |
8,9515 |
8,8282 |
0,000997 |
120,9233502 |
|||||||||||||||||||||||||||
|
9 |
282,15 |
0,011475 |
37,5868 |
2517,6631 |
2480,0763 |
0,1382 |
8,9267 |
8,7885 |
0,0009971 |
113,3945658 |
|||||||||||||||||||||||||||
|
10 |
283,15 |
0,012273 |
41,7965 |
2519,4958 |
2477,6993 |
0,1531 |
8,9022 |
8,7491 |
0,0009972 |
106,3903683 |
|||||||||||||||||||||||||||
|
11 |
284,15 |
0,01312 |
46,0051 |
2521,3277 |
2475,3226 |
0,1679 |
8,8779 |
8,71 |
0,0009974 |
99,8706517 |
|||||||||||||||||||||||||||
|
12 |
285,15 |
0,014018 |
50,2126 |
2523,1589 |
2472,9463 |
0,1827 |
8,8538 |
8,6711 |
0,0009975 |
93,7986291 |
|||||||||||||||||||||||||||
|
13 |
286,15 |
0,014969 |
54,419 |
2524,9893 |
2470,5704 |
0,1974 |
8,8299 |
8,6325 |
0,0009977 |
88,1405376 |
|||||||||||||||||||||||||||
|
14 |
287,15 |
0,015977 |
58,6243 |
2526,819 |
2468,1946 |
0,2121 |
8,8063 |
8,5941 |
0,0009979 |
82,8653728 |
|||||||||||||||||||||||||||
|
15 |
288,15 |
0,017044 |
62,8287 |
2528,6478 |
2465,8191 |
0,2267 |
8,7828 |
8,5561 |
0,000998 |
77,9446462 |
|||||||||||||||||||||||||||
|
16 |
289,15 |
0,018173 |
67,032 |
2530,4757 |
2463,4437 |
0,2413 |
8,7596 |
8,5183 |
0,0009982 |
73,3521668 |
|||||||||||||||||||||||||||
|
17 |
290,15 |
0,019368 |
71,2345 |
2532,3028 |
2461,0683 |
0,2558 |
8,7365 |
8,4807 |
0,0009984 |
69,0638424 |
|||||||||||||||||||||||||||
|
18 |
291,15 |
0,02063 |
75,4359 |
2534,129 |
2458,693 |
0,2703 |
8,7137 |
8,4435 |
0,0009986 |
65,0574986 |
|||||||||||||||||||||||||||
|
19 |
292,15 |
0,021964 |
79,6365 |
2535,9542 |
2456,3177 |
0,2847 |
8,6911 |
8,4064 |
0,0009988 |
61,3127155 |
|||||||||||||||||||||||||||
|
20 |
293,15 |
0,023373 |
83,8362 |
2537,7784 |
2453,9422 |
0,299 |
8,6687 |
8,3696 |
0,000999 |
57,8106783 |
|||||||||||||||||||||||||||
|
21 |
294,15 |
0,024861 |
88,035 |
2539,6016 |
2451,5665 |
0,3133 |
8,6464 |
8,3331 |
0,0009992 |
54,5340418 |
|||||||||||||||||||||||||||
|
22 |
295,15 |
0,026431 |
92,2331 |
2541,4237 |
2449,1907 |
0,3276 |
8,6244 |
8,2968 |
0,0009995 |
51,4668073 |
|||||||||||||||||||||||||||
|
23 |
296,15 |
0,028086 |
96,4303 |
2543,2448 |
2446,8145 |
0,3418 |
8,6026 |
8,2608 |
0,0009997 |
48,5942098 |
|||||||||||||||||||||||||||
|
24 |
297,15 |
0,029832 |
100,6267 |
2545,0647 |
2444,438 |
0,3559 |
8,5809 |
8,225 |
0,0009999 |
45,9026163 |
|||||||||||||||||||||||||||
|
25 |
298,15 |
0,031671 |
104,8224 |
2546,8834 |
2442,061 |
0,37 |
8,5594 |
8,1894 |
0,0010002 |
43,3794321 |
|||||||||||||||||||||||||||
|
26 |
299,15 |
0,033609 |
109,0174 |
2548,701 |
2439,6836 |
0,384 |
8,5382 |
8,1541 |
0,0010004 |
41,0130159 |
|||||||||||||||||||||||||||
|
27 |
300,15 |
0,035649 |
113,2118 |
2550,5173 |
2437,3055 |
0,398 |
8,5171 |
8,119 |
0,0010007 |
38,7926019 |
|||||||||||||||||||||||||||
|
28 |
301,15 |
0,037796 |
117,4054 |
2552,3323 |
2434,9269 |
0,412 |
8,4962 |
8,0842 |
0,001001 |
36,7082294 |
|||||||||||||||||||||||||||
|
T (°C) |
T (°K) |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
AS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
29 |
302,15 |
0,040055 |
121,5984 |
2554,146 |
2432,5476 |
0,4259 |
8,4754 |
8,0496 |
0,0010013 |
34,7506774 |
|||||||||||||||||||||||||||
|
30 |
303,15 |
0,04243 |
125,7908 |
2555,9583 |
2430,1675 |
0,4397 |
8,4549 |
8,0151 |
0,0010015 |
32,911406 |
|||||||||||||||||||||||||||
|
31 |
304,15 |
0,044927 |
129,9827 |
2557,7693 |
2427,7866 |
0,4535 |
8,4345 |
7,981 |
0,0010018 |
31,1825018 |
|||||||||||||||||||||||||||
|
32 |
305,15 |
0,047551 |
134,1739 |
2559,5787 |
2425,4048 |
0,4673 |
8,4143 |
7,947 |
0,0010021 |
29,5566285 |
|||||||||||||||||||||||||||
|
33 |
306,15 |
0,050306 |
138,3647 |
2561,3867 |
2423,022 |
0,481 |
8,3943 |
7,9133 |
0,0010025 |
28,0269819 |
|||||||||||||||||||||||||||
|
34 |
307,15 |
0,053199 |
142,555 |
2563,1931 |
2420,6382 |
0,4947 |
8,3744 |
7,8798 |
0,0010028 |
26,5872475 |
|||||||||||||||||||||||||||
|
35 |
308,15 |
0,056235 |
146,7448 |
2564,9979 |
2418,2532 |
0,5083 |
8,3547 |
7,8464 |
0,0010031 |
25,2315632 |
|||||||||||||||||||||||||||
|
36 |
309,15 |
0,05942 |
150,9341 |
2566,8012 |
2415,8671 |
0,5219 |
8,3352 |
7,8133 |
0,0010034 |
23,9544842 |
|||||||||||||||||||||||||||
|
37 |
310,15 |
0,06276 |
155,123 |
2568,6027 |
2413,4796 |
0,5354 |
8,3158 |
7,7805 |
0,0010038 |
22,7509506 |
|||||||||||||||||||||||||||
|
38 |
311,15 |
0,066261 |
159,3116 |
2570,4025 |
2411,0909 |
0,5489 |
8,2967 |
7,7478 |
0,0010041 |
21,6162585 |
|||||||||||||||||||||||||||
|
39 |
312,15 |
0,06993 |
163,4998 |
2572,2005 |
2408,7007 |
0,5623 |
8,2776 |
7,7153 |
0,0010045 |
20,5460326 |
|||||||||||||||||||||||||||
|
40 |
313,15 |
0,073773 |
167,6876 |
2573,9967 |
2406,3091 |
0,5757 |
8,2587 |
7,683 |
0,0010049 |
19,5362016 |
|||||||||||||||||||||||||||
|
41 |
314,15 |
0,077796 |
171,8752 |
2575,791 |
2403,9158 |
0,589 |
8,24 |
7,651 |
0,0010052 |
18,5829753 |
|||||||||||||||||||||||||||
|
42 |
315,15 |
0,082008 |
176,0624 |
2577,5834 |
2401,5209 |
0,6024 |
8,2215 |
7,6191 |
0,0010056 |
17,6828237 |
|||||||||||||||||||||||||||
|
43 |
316,15 |
0,086415 |
180,2495 |
2579,3738 |
2399,1243 |
0,6156 |
8,203 |
7,5874 |
0,001006 |
16,8324577 |
|||||||||||||||||||||||||||
|
44 |
317,15 |
0,091024 |
184,4362 |
2581,1622 |
2396,7259 |
0,6288 |
8,1848 |
7,5559 |
0,0010064 |
16,0288112 |
|||||||||||||||||||||||||||
|
45 |
318,15 |
0,095844 |
188,6228 |
2582,9485 |
2394,3256 |
0,642 |
8,1667 |
7,5247 |
0,0010068 |
15,2690248 |
|||||||||||||||||||||||||||
|
46 |
319,15 |
0,100881 |
192,8093 |
2584,7326 |
2391,9233 |
0,6552 |
8,1487 |
7,4936 |
0,0010072 |
14,5504311 |
|||||||||||||||||||||||||||
|
47 |
320,15 |
0,106145 |
196,9956 |
2586,5146 |
2389,519 |
0,6683 |
8,1309 |
7,4626 |
0,0010076 |
13,8705399 |
|||||||||||||||||||||||||||
|
48 |
321,15 |
0,111642 |
201,1817 |
2588,2943 |
2387,1125 |
0,6813 |
8,1132 |
7,4319 |
0,0010081 |
13,2270264 |
|||||||||||||||||||||||||||
|
49 |
322,15 |
0,117383 |
205,3678 |
2590,0717 |
2384,7039 |
0,6943 |
8,0957 |
7,4014 |
0,0010085 |
12,6177188 |
|||||||||||||||||||||||||||
|
50 |
323,15 |
0,123374 |
209,5539 |
2591,8467 |
2382,2929 |
0,7073 |
8,0783 |
7,371 |
0,0010089 |
12,0405873 |
|||||||||||||||||||||||||||
|
51 |
324,15 |
0,129626 |
213,7399 |
2593,6194 |
2379,8795 |
0,7202 |
8,0611 |
7,3408 |
0,0010094 |
11,4937343 |
|||||||||||||||||||||||||||
|
52 |
325,15 |
0,136148 |
217,9259 |
2595,3895 |
2377,4637 |
0,7331 |
8,044 |
7,3108 |
0,0010099 |
10,9753853 |
|||||||||||||||||||||||||||
|
53 |
326,15 |
0,142948 |
222,1119 |
2597,1571 |
2375,0453 |
0,746 |
8,027 |
7,281 |
0,0010103 |
10,4838795 |
|||||||||||||||||||||||||||
|
54 |
327,15 |
0,150037 |
226,2979 |
2598,9222 |
2372,6242 |
0,7588 |
8,0102 |
7,2514 |
0,0010108 |
10,0176628 |
|||||||||||||||||||||||||||
|
55 |
328,15 |
0,157425 |
230,4841 |
2600,6846 |
2370,2005 |
0,7716 |
7,9935 |
7,2219 |
0,0010113 |
9,5752794 |
|||||||||||||||||||||||||||
|
56 |
329,15 |
0,165121 |
234,6703 |
2602,4442 |
2367,7739 |
0,7843 |
7,9769 |
7,1926 |
0,0010118 |
9,1553661 |
|||||||||||||||||||||||||||
|
57 |
330,15 |
0,173136 |
238,8567 |
2604,2011 |
2365,3444 |
0,797 |
7,9604 |
7,1635 |
0,0010123 |
8,7566452 |
|||||||||||||||||||||||||||
|
58 |
331,15 |
0,181481 |
243,0433 |
2605,9552 |
2362,9119 |
0,8096 |
7,9441 |
7,1345 |
0,0010128 |
8,3779187 |
|||||||||||||||||||||||||||
|
T (°C) |
T |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
59 |
332,15 |
0,190166 |
247,23 |
2607,7063 |
2360,4763 |
0,8223 |
7,928 |
7,1057 |
0,0010133 |
8,0180633 |
|||||||||||||||||||||||||||
|
60 |
333,15 |
0,199204 |
251,417 |
2609,4545 |
2358,0376 |
0,8348 |
7,9119 |
7,077 |
0,0010138 |
7,676025 |
|||||||||||||||||||||||||||
|
61 |
334,15 |
0,208604 |
255,6041 |
2611,1997 |
2355,5955 |
0,8474 |
7,896 |
7,0486 |
0,0010143 |
7,3508147 |
|||||||||||||||||||||||||||
|
62 |
335,15 |
0,218379 |
259,7916 |
2612,9418 |
2353,1502 |
0,8599 |
7,8802 |
7,0203 |
0,0010149 |
7,0415037 |
|||||||||||||||||||||||||||
|
63 |
336,15 |
0,228541 |
263,9794 |
2614,6807 |
2350,7013 |
0,8724 |
7,8645 |
6,9921 |
0,0010154 |
6,7472196 |
|||||||||||||||||||||||||||
|
64 |
337,15 |
0,239102 |
268,1675 |
2616,4164 |
2348,249 |
0,8848 |
7,8489 |
6,9641 |
0,001016 |
6,4671429 |
|||||||||||||||||||||||||||
|
65 |
338,15 |
0,250074 |
272,3559 |
2618,1489 |
2345,7929 |
0,8972 |
7,8335 |
6,9362 |
0,0010165 |
6,2005033 |
|||||||||||||||||||||||||||
|
66 |
339,15 |
0,261471 |
276,5447 |
2619,8779 |
2343,3332 |
0,9096 |
7,8181 |
6,9086 |
0,0010171 |
5,9465765 |
|||||||||||||||||||||||||||
|
67 |
340,15 |
0,273306 |
280,734 |
2621,6036 |
2340,8696 |
0,9219 |
7,8029 |
6,881 |
0,0010177 |
5,7046812 |
|||||||||||||||||||||||||||
|
68 |
341,15 |
0,285591 |
284,9236 |
2623,3258 |
2338,4022 |
0,9342 |
7,7878 |
6,8536 |
0,0010183 |
5,4741764 |
|||||||||||||||||||||||||||
|
69 |
342,15 |
0,298341 |
289,1138 |
2625,0444 |
2335,9307 |
0,9465 |
7,7728 |
6,8264 |
0,0010188 |
5,2544588 |
|||||||||||||||||||||||||||
|
70 |
343,15 |
0,31157 |
293,3044 |
2626,7595 |
2333,4551 |
0,9587 |
7,758 |
6,7993 |
0,0010194 |
5,0449604 |
|||||||||||||||||||||||||||
|
71 |
344,15 |
0,325291 |
297,4955 |
2628,4708 |
2330,9753 |
0,9709 |
7,7432 |
6,7723 |
0,00102 |
4,8451461 |
|||||||||||||||||||||||||||
|
72 |
345,15 |
0,339519 |
301,6872 |
2630,1784 |
2328,4912 |
0,983 |
7,7286 |
6,7455 |
0,0010207 |
4,6545119 |
|||||||||||||||||||||||||||
|
73 |
346,15 |
0,35427 |
305,8795 |
2631,8822 |
2326,0027 |
0,9952 |
7,714 |
6,7189 |
0,0010213 |
4,4725825 |
|||||||||||||||||||||||||||
|
74 |
347,15 |
0,369557 |
310,0724 |
2633,5821 |
2323,5097 |
1,0073 |
7,6996 |
6,6923 |
0,0010219 |
4,29891 |
|||||||||||||||||||||||||||
|
75 |
348,15 |
0,385398 |
314,2659 |
2635,278 |
2321,0121 |
1,0193 |
7,6853 |
6,6659 |
0,0010225 |
4,1330719 |
|||||||||||||||||||||||||||
|
76 |
349,15 |
0,401807 |
318,46 |
2636,9699 |
2318,5099 |
1,0313 |
7,671 |
6,6397 |
0,0010232 |
3,9746697 |
|||||||||||||||||||||||||||
|
77 |
350,15 |
0,418801 |
322,6549 |
2638,6577 |
2316,0028 |
1,0433 |
7,6569 |
6,6136 |
0,0010238 |
3,8233272 |
|||||||||||||||||||||||||||
|
78 |
351,15 |
0,436395 |
326,8504 |
2640,3413 |
2313,4909 |
1,0553 |
7,6429 |
6,5876 |
0,0010245 |
3,6786892 |
|||||||||||||||||||||||||||
|
79 |
352,15 |
0,454608 |
331,0467 |
2642,0207 |
2310,974 |
1,0672 |
7,629 |
6,5618 |
0,0010252 |
3,5404204 |
|||||||||||||||||||||||||||
|
80 |
353,15 |
0,473455 |
335,2438 |
2643,6958 |
2308,452 |
1,0791 |
7,6152 |
6,5361 |
0,0010258 |
3,408204 |
|||||||||||||||||||||||||||
|
81 |
354,15 |
0,492954 |
339,4416 |
2645,3665 |
2305,9249 |
1,091 |
7,6015 |
6,5105 |
0,0010265 |
3,2817406 |
|||||||||||||||||||||||||||
|
82 |
355,15 |
0,513122 |
343,6403 |
2647,0328 |
2303,3924 |
1,1028 |
7,5879 |
6,485 |
0,0010272 |
3,1607474 |
|||||||||||||||||||||||||||
|
83 |
356,15 |
0,533979 |
347,8399 |
2648,6945 |
2300,8546 |
1,1146 |
7,5743 |
6,4597 |
0,0010279 |
3,0449567 |
|||||||||||||||||||||||||||
|
84 |
357,15 |
0,555542 |
352,0403 |
2650,3516 |
2298,3114 |
1,1264 |
7,5609 |
6,4345 |
0,0010286 |
2,9341155 |
|||||||||||||||||||||||||||
|
85 |
358,15 |
0,577829 |
356,2416 |
2652,0041 |
2295,7625 |
1,1381 |
7,5476 |
6,4094 |
0,0010293 |
2,8279844 |
|||||||||||||||||||||||||||
|
86 |
359,15 |
0,60086 |
360,4438 |
2653,6518 |
2293,208 |
1,1498 |
7,5343 |
6,3845 |
0,0010301 |
2,7263369 |
|||||||||||||||||||||||||||
|
87 |
360,15 |
0,624654 |
364,6471 |
2655,2948 |
2290,6477 |
1,1615 |
7,5212 |
6,3597 |
0,0010308 |
2,6289584 |
|||||||||||||||||||||||||||
|
88 |
361,15 |
0,649231 |
368,8513 2656,9328 |
2288,0816 |
1,1732 7,5081 |
6,335 |
0,0010315 2,5356459 |
||||||||||||||||||||||||||||||
|
T (°C) |
T |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
89 |
362,15 |
0,67461 |
373,0565 |
2658,5659 |
2285,5095 |
1,1848 |
7,4952 |
6,3104 |
0,0010323 |
2,446207 |
|||||||||||||||||||||||||||
|
90 |
363,15 |
0,700813 |
377,2627 |
2660,194 |
2282,9313 |
1,1964 |
7,4823 |
6,2859 |
0,001033 |
2,3604594 |
|||||||||||||||||||||||||||
|
91 |
364,15 |
0,727859 |
381,4701 |
2661,817 |
2280,3469 |
1,2079 |
7,4695 |
6,2616 |
0,0010338 |
2,2782303 |
|||||||||||||||||||||||||||
|
92 |
365,15 |
0,75577 |
385,6785 |
2663,4348 |
2277,7563 |
1,2195 |
7,4568 |
6,2374 |
0,0010345 |
2,199356 |
|||||||||||||||||||||||||||
|
93 |
366,15 |
0,784568 |
389,8881 |
2665,0474 |
2275,1593 |
1,231 |
7,4442 |
6,2132 |
0,0010353 |
2,1236812 |
|||||||||||||||||||||||||||
|
94 |
367,15 |
0,814273 |
394,0988 |
2666,6547 |
2272,5558 |
1,2425 |
7,4317 |
6,1892 |
0,0010361 |
2,0510585 |
|||||||||||||||||||||||||||
|
95 |
368,15 |
0,844908 |
398,3107 |
2668,2565 |
2269,9458 |
1,2539 |
7,4193 |
6,1654 |
0,0010369 |
1,9813481 |
|||||||||||||||||||||||||||
|
96 |
369,15 |
0,876495 |
402,5238 |
2669,853 |
2267,3291 |
1,2653 |
7,4069 |
6,1416 |
0,0010377 |
1,9144175 |
|||||||||||||||||||||||||||
|
97 |
370,15 |
0,909058 |
406,7382 |
2671,4439 |
2264,7057 |
1,2767 |
7,3946 |
6,1179 |
0,0010385 |
1,8501405 |
|||||||||||||||||||||||||||
|
98 |
371,15 |
0,942618 |
410,9538 |
2673,0292 |
2262,0754 |
1,2881 |
7,3824 |
6,0944 |
0,0010393 |
1,7883978 |
|||||||||||||||||||||||||||
|
99 |
372,15 |
0,977201 |
415,1707 |
2674,6089 |
2259,4381 |
1,2994 |
7,3703 |
6,0709 |
0,0010401 |
1,7290755 |
|||||||||||||||||||||||||||
|
100 |
373,15 |
1,012829 |
419,389 |
2676,1828 |
2256,7938 |
1,3107 |
7,3583 |
6,0476 |
0,001041 |
1,6720658 |
|||||||||||||||||||||||||||
|
101 |
374,15 |
1,049527 |
423,6086 |
2677,7509 |
2254,1423 |
1,322 |
7,3463 |
6,0243 |
0,0010418 |
1,6172662 |
|||||||||||||||||||||||||||
|
102 |
375,15 |
1,087319 |
427,8295 |
2679,3131 |
2251,4835 |
1,3333 |
7,3345 |
6,0012 |
0,0010426 |
1,5645791 |
|||||||||||||||||||||||||||
|
103 |
376,15 |
1,126231 |
432,0519 |
2680,8693 |
2248,8174 |
1,3445 |
7,3227 |
5,9782 |
0,0010435 |
1,5139117 |
|||||||||||||||||||||||||||
|
104 |
377,15 |
1,166287 |
436,2757 |
2682,4196 |
2246,1439 |
1,3557 |
7,3109 |
5,9552 |
0,0010444 |
1,465176 |
|||||||||||||||||||||||||||
|
105 |
378,15 |
1,207513 |
440,501 |
2683,9638 |
2243,4628 |
1,3669 |
7,2993 |
5,9324 |
0,0010452 |
1,418288 |
|||||||||||||||||||||||||||
|
106 |
379,15 |
1,249936 |
444,7277 |
2685,5018 |
2240,774 |
1,378 |
7,2877 |
5,9097 |
0,0010461 |
1,3731678 |
|||||||||||||||||||||||||||
|
107 |
380,15 |
1,293581 |
448,956 |
2687,0335 |
2238,0775 |
1,3892 |
7,2762 |
5,8871 |
0,001047 |
1,3297395 |
|||||||||||||||||||||||||||
|
108 |
381,15 |
1,338475 |
453,1858 |
2688,559 |
2235,3732 |
1,4003 |
7,2648 |
5,8646 |
0,0010479 |
1,2879307 |
|||||||||||||||||||||||||||
|
109 |
382,15 |
1,384646 |
457,4172 |
2690,0781 |
2232,6609 |
1,4113 |
7,2534 |
5,8421 |
0,0010488 |
1,2476726 |
|||||||||||||||||||||||||||
|
110 |
383,15 |
1,432121 |
461,6501 |
2691,5908 |
2229,9406 |
1,4224 |
7,2422 |
5,8198 |
0,0010497 |
1,2088994 |
|||||||||||||||||||||||||||
|
111 |
384,15 |
1,480927 |
465,8847 |
2693,0969 |
2227,2122 |
1,4334 |
7,231 |
5,7976 |
0,0010506 |
1,1715487 |
|||||||||||||||||||||||||||
|
112 |
385,15 |
1,531093 |
470,121 |
2694,5965 |
2224,4755 |
1,4444 |
7,2198 |
5,7754 |
0,0010515 |
1,135561 |
|||||||||||||||||||||||||||
|
113 |
386,15 |
1,582648 |
474,3589 |
2696,0895 |
2221,7305 |
1,4554 |
7,2087 |
5,7534 |
0,0010524 |
1,1008793 |
|||||||||||||||||||||||||||
|
114 |
387,15 |
1,63562 |
478,5986 |
2697,5757 |
2218,9771 |
1,4663 |
7,1977 |
5,7314 |
0,0010534 |
1,0674495 |
|||||||||||||||||||||||||||
|
115 |
388,15 |
1,690039 |
482,8399 |
2699,0552 |
2216,2152 |
1,4773 |
7,1868 |
5,7095 |
0,0010543 |
1,03522 |
|||||||||||||||||||||||||||
|
116 |
389,15 |
1,745934 |
487,0831 |
2700,5278 |
2213,4447 |
1,4882 |
7,1759 |
5,6878 |
0,0010553 |
1,0041415 |
|||||||||||||||||||||||||||
|
117 |
390,15 |
1,803336 |
491,328 |
2701,9936 |
2210,6655 |
1,499 |
7,1651 |
5,6661 |
0,0010562 |
0,9741671 |
|||||||||||||||||||||||||||
|
118 |
391,15 |
1,862274 |
495,5748 |
2703,4523 |
2207,8776 |
1,5099 |
7,1544 |
5,6445 |
0,0010572 |
0,9452518 |
|||||||||||||||||||||||||||
|
T (°C) |
T |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
119 |
392,15 |
1,92278 |
499,8234 |
2704,9041 |
2205,0807 |
1,5207 |
7,1437 |
5,623 |
0,0010582 |
0,9173527 |
|||||||||||||||||||||||||||
|
120 |
393,15 |
1,984885 |
504,0738 |
2706,3487 |
2202,2749 |
1,5315 |
7,1331 |
5,6015 |
0,0010592 |
0,8904292 |
|||||||||||||||||||||||||||
|
121 |
394,15 |
2,04862 |
508,3262 |
2707,7862 |
2199,46 |
1,5423 |
7,1225 |
5,5802 |
0,0010602 |
0,864442 |
|||||||||||||||||||||||||||
|
122 |
395,15 |
2,114018 |
512,5805 |
2709,2164 |
2196,6359 |
1,5531 |
7,112 |
5,559 |
0,0010612 |
0,8393539 |
|||||||||||||||||||||||||||
|
123 |
396,15 |
2,181109 |
516,8367 |
2710,6394 |
2193,8027 |
1,5638 |
7,1016 |
5,5378 |
0,0010622 |
0,8151292 |
|||||||||||||||||||||||||||
|
124 |
397,15 |
2,249928 |
521,095 |
2712,055 |
2190,96 |
1,5745 |
7,0912 |
5,5167 |
0,0010632 |
0,791734 |
|||||||||||||||||||||||||||
|
125 |
398,15 |
2,320507 |
525,3552 |
2713,4632 |
2188,108 |
1,5852 |
7,0809 |
5,4957 |
0,0010642 |
0,7691356 |
|||||||||||||||||||||||||||
|
126 |
399,15 |
2,392879 |
529,6175 |
2714,864 |
2185,2465 |
1,5959 |
7,0707 |
5,4748 |
0,0010652 |
0,7473029 |
|||||||||||||||||||||||||||
|
127 |
400,15 |
2,467079 |
533,8818 |
2716,2572 |
2182,3754 |
1,6065 |
7,0605 |
5,4539 |
0,0010663 |
0,7262063 |
|||||||||||||||||||||||||||
|
128 |
401,15 |
2,543139 |
538,1483 |
2717,6428 |
2179,4945 |
1,6172 |
7,0503 |
5,4332 |
0,0010673 |
0,7058171 |
|||||||||||||||||||||||||||
|
129 |
402,15 |
2,621096 |
542,4168 |
2719,0208 |
2176,604 |
1,6278 |
7,0403 |
5,4125 |
0,0010684 |
0,6861082 |
|||||||||||||||||||||||||||
|
131 |
404,15 |
2,782835 |
550,9604 |
2721,7535 |
2170,7932 |
1,6489 |
7,0203 |
5,3714 |
0,0010705 |
0,6486282 |
|||||||||||||||||||||||||||
|
132 |
405,15 |
2,866689 |
555,2354 |
2723,1082 |
2167,8728 |
1,6595 |
7,0104 |
5,3509 |
0,0010716 |
0,6308082 |
|||||||||||||||||||||||||||
|
133 |
406,15 |
2,95258 |
559,5127 |
2724,455 |
2164,9423 |
1,67 |
7,0005 |
5,3305 |
0,0010726 |
0,6135709 |
|||||||||||||||||||||||||||
|
134 |
407,15 |
3,040545 |
563,7923 |
2725,7939 |
2162,0017 |
1,6805 |
6,9907 |
5,3102 |
0,0010737 |
0,5968942 |
|||||||||||||||||||||||||||
|
135 |
408,15 |
3,13062 |
568,0741 |
2727,1248 |
2159,0507 |
1,691 |
6,981 |
5,29 |
0,0010748 |
0,5807573 |
|||||||||||||||||||||||||||
|
136 |
409,15 |
3,222842 |
572,3582 |
2728,4477 |
2156,0894 |
1,7014 |
6,9713 |
5,2699 |
0,0010759 |
0,56514 |
|||||||||||||||||||||||||||
|
137 |
410,15 |
3,317249 |
576,6447 |
2729,7624 |
2153,1177 |
1,7119 |
6,9617 |
5,2498 |
0,001077 |
0,5500231 |
|||||||||||||||||||||||||||
|
138 |
411,15 |
3,413877 |
580,9335 |
2731,069 |
2150,1355 |
1,7223 |
6,9521 |
5,2298 |
0,0010782 |
0,5353882 |
|||||||||||||||||||||||||||
|
139 |
412,15 |
3,512767 |
585,2247 |
2732,3675 |
2147,1427 |
1,7327 |
6,9425 |
5,2098 |
0,0010793 |
0,5212175 |
|||||||||||||||||||||||||||
|
140 |
413,15 |
3,613955 |
589,5184 |
2733,6576 |
2144,1393 |
1,7431 |
6,9331 |
5,19 |
0,0010804 |
0,5074942 |
|||||||||||||||||||||||||||
|
141 |
414,15 |
3,71748 |
593,8144 |
2734,9395 |
2141,1251 |
1,7534 |
6,9236 |
5,1702 |
0,0010816 |
0,494202 |
|||||||||||||||||||||||||||
|
142 |
415,15 |
3,823383 |
598,113 |
2736,213 |
2138,1 |
1,7638 |
6,9142 |
5,1505 |
0,0010827 |
0,4813252 |
|||||||||||||||||||||||||||
|
143 |
416,15 |
3,931702 |
602,414 |
2737,4782 |
2135,0641 |
1,7741 |
6,9049 |
5,1308 |
0,0010839 |
0,468849 |
|||||||||||||||||||||||||||
|
144 |
417,15 |
4,042477 |
606,7176 |
2738,7349 |
2132,0173 |
1,7844 |
6,8956 |
5,1112 |
0,0010851 |
0,4567589 |
|||||||||||||||||||||||||||
|
145 |
418,15 |
4,155748 |
611,0237 |
2739,9831 |
2128,9594 |
1,7947 |
6,8864 |
5,0917 |
0,0010862 |
0,4450413 |
|||||||||||||||||||||||||||
|
146 |
419,15 |
4,271556 |
615,3324 |
2741,2227 |
2125,8903 |
1,8049 |
6,8772 |
5,0722 |
0,0010874 |
0,4336828 |
|||||||||||||||||||||||||||
|
147 |
420,15 |
4,389943 |
619,6437 |
2742,4538 |
2122,8101 |
1,8152 |
6,868 |
5,0529 |
0,0010886 |
0,4226708 |
|||||||||||||||||||||||||||
|
148 |
421,15 |
4,510948 |
623,9576 |
2743,6763 |
2119,7187 |
1,8254 |
6,8589 |
5,0335 |
0,0010898 |
0,4119931 |
|||||||||||||||||||||||||||
|
149 |
422,15 |
4,634614 |
628,2742 |
2744,8901 |
2116,6159 |
1,8356 |
6,8499 |
5,0143 |
0,001091 |
0,401638 |
|||||||||||||||||||||||||||
|
T (°C) |
T |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
150 |
423,15 |
4,760983 |
632,5934 |
2746,0951 |
2113,5017 |
1,8458 |
6,8409 |
4,9951 |
0,0010922 |
0,3915943 |
|||||||||||||||||||||||||||
|
151 |
424,15 |
4,890096 |
636,9154 |
2747,2915 |
2110,3761 |
1,856 |
6,8319 |
4,976 |
0,0010934 |
0,3818511 |
|||||||||||||||||||||||||||
|
152 |
425,15 |
5,021998 |
641,2401 |
2748,479 |
2107,239 |
1,8661 |
6,823 |
4,9569 |
0,0010947 |
0,372398 |
|||||||||||||||||||||||||||
|
153 |
426,15 |
5,156729 |
645,5675 |
2749,6577 |
2104,0902 |
1,8762 |
6,8141 |
4,9379 |
0,0010959 |
0,3632252 |
|||||||||||||||||||||||||||
|
154 |
427,15 |
5,294335 |
649,8977 |
2750,8275 |
2100,9298 |
1,8864 |
6,8053 |
4,9189 |
0,0010971 |
0,354323 |
|||||||||||||||||||||||||||
|
155 |
428,15 |
5,434858 |
654,2308 |
2751,9885 |
2097,7577 |
1,8965 |
6,7965 |
4,9001 |
0,0010984 |
0,3456821 |
|||||||||||||||||||||||||||
|
156 |
429,15 |
5,578343 |
658,5667 |
2753,1404 |
2094,5737 |
1,9065 |
6,7878 |
4,8812 |
0,0010996 |
0,3372938 |
|||||||||||||||||||||||||||
|
157 |
430,15 |
5,724833 |
662,9054 |
2754,2834 |
2091,378 |
1,9166 |
6,7791 |
4,8625 |
0,0011009 |
0,3291494 |
|||||||||||||||||||||||||||
|
158 |
431,15 |
5,874374 |
667,2471 |
2755,4174 |
2088,1703 |
1,9266 |
6,7704 |
4,8438 |
0,0011022 |
0,3212409 |
|||||||||||||||||||||||||||
|
159 |
432,15 |
6,02701 |
671,5916 |
2756,5423 |
2084,9507 |
1,9367 |
6,7618 |
4,8251 |
0,0011035 |
0,3135602 |
|||||||||||||||||||||||||||
|
160 |
433,15 |
6,182787 |
675,9391 |
2757,6581 |
2081,719 |
1,9467 |
6,7532 |
4,8066 |
0,0011048 |
0,3060999 |
|||||||||||||||||||||||||||
|
161 |
434,15 |
6,34175 |
680,2896 |
2758,7648 |
2078,4752 |
1,9567 |
6,7447 |
4,788 |
0,001106 |
0,2988525 |
|||||||||||||||||||||||||||
|
162 |
435,15 |
6,503945 |
684,6431 |
2759,8624 |
2075,2193 |
1,9666 |
6,7362 |
4,7696 |
0,0011074 |
0,2918112 |
|||||||||||||||||||||||||||
|
164 |
437,15 |
6,838217 |
693,3591 |
2762,0299 |
2068,6708 |
1,9865 |
6,7193 |
4,7328 |
0,00111 |
0,2783194 |
|||||||||||||||||||||||||||
|
165 |
438,15 |
7,010387 |
697,7217 |
2763,0998 |
2065,3781 |
1,9965 |
6,711 |
4,7145 |
0,0011113 |
0,2718563 |
|||||||||||||||||||||||||||
|
166 |
439,15 |
7,185976 |
702,0874 |
2764,1605 |
2062,0731 |
2,0064 |
6,7026 |
4,6962 |
0,0011126 |
0,2655735 |
|||||||||||||||||||||||||||
|
167 |
440,15 |
7,365032 |
706,4562 |
2765,2118 |
2058,7556 |
2,0163 |
6,6943 |
4,6781 |
0,001114 |
0,2594653 |
|||||||||||||||||||||||||||
|
168 |
441,15 |
7,547601 |
710,8281 |
2766,2538 |
2055,4257 |
2,0261 |
6,6861 |
4,6599 |
0,0011153 |
0,2535259 |
|||||||||||||||||||||||||||
|
169 |
442,15 |
7,733733 |
715,2033 |
2767,2865 |
2052,0832 |
2,036 |
6,6778 |
4,6418 |
0,0011167 |
0,24775 |
|||||||||||||||||||||||||||
|
170 |
443,15 |
7,923476 |
719,5816 |
2768,3098 |
2048,7282 |
2,0458 |
6,6696 |
4,6238 |
0,0011181 |
0,2421324 |
|||||||||||||||||||||||||||
|
171 |
444,15 |
8,116878 |
723,9631 |
2769,3237 |
2045,3606 |
2,0557 |
6,6615 |
4,6058 |
0,0011194 |
0,2366681 |
|||||||||||||||||||||||||||
|
172 |
445,15 |
8,313988 |
728,3479 |
2770,3282 |
2041,9803 |
2,0655 |
6,6534 |
4,5879 |
0,0011208 |
0,2313522 |
|||||||||||||||||||||||||||
|
173 |
446,15 |
8,514856 |
732,736 |
2771,3233 |
2038,5873 |
2,0753 |
6,6453 |
4,57 |
0,0011222 |
0,22618 |
|||||||||||||||||||||||||||
|
174 |
447,15 |
8,719531 |
737,1274 |
2772,3089 |
2035,1815 |
2,0851 |
6,6373 |
4,5522 |
0,0011236 |
0,221147 |
|||||||||||||||||||||||||||
|
175 |
448,15 |
8,928063 |
741,5221 |
2773,285 |
2031,7629 |
2,0948 |
6,6293 |
4,5344 |
0,001125 |
0,2162489 |
|||||||||||||||||||||||||||
|
176 |
449,15 |
9,140502 |
745,9201 |
2774,2516 |
2028,3315 |
2,1046 |
6,6213 |
4,5167 |
0,0011264 |
0,2114816 |
|||||||||||||||||||||||||||
|
177 |
450,15 |
9,356899 |
750,3215 |
2775,2088 |
2024,8872 |
2,1143 |
6,6133 |
4,499 |
0,0011278 |
0,2068408 |
|||||||||||||||||||||||||||
|
178 |
451,15 |
9,577304 |
754,7264 |
2776,1563 |
2021,43 |
2,124 |
6,6054 |
4,4814 |
0,0011292 |
0,2023229 |
|||||||||||||||||||||||||||
|
179 |
452,15 |
9,801768 |
759,1346 |
2777,0944 |
2017,9598 |
2,1337 |
6,5976 |
4,4638 |
0,0011307 |
0,1979238 |
|||||||||||||||||||||||||||
|
180 |
453,15 |
10,030342 |
763,5463 2778,0229 |
2014,4766 |
2,1434 6,5897 |
4,4463 |
0,0011321 0,1936402 |
||||||||||||||||||||||||||||||
|
T (°C) |
T |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
181 |
454,15 |
10,263079 |
767,9614 |
2778,9418 |
2010,9804 |
2,1531 |
6,5819 |
4,4289 |
0,0011336 |
0,1894683 |
|||||||||||||||||||||||||||
|
182 |
455,15 |
10,500029 |
772,38 |
2779,8511 |
2007,471 |
2,1627 |
6,5742 |
4,4114 |
0,001135 |
0,1854049 |
|||||||||||||||||||||||||||
|
183 |
456,15 |
10,741246 |
776,8022 |
2780,7508 |
2003,9486 |
2,1724 |
6,5664 |
4,394 |
0,0011365 |
0,1814467 |
|||||||||||||||||||||||||||
|
184 |
457,15 |
10,98678 |
781,2279 |
2781,6409 |
2000,413 |
2,182 |
6,5587 |
4,3767 |
0,0011379 |
0,1775905 |
|||||||||||||||||||||||||||
|
185 |
458,15 |
11,236685 |
785,6572 |
2782,5214 |
1996,8642 |
2,1916 |
6,5511 |
4,3594 |
0,0011394 |
0,1738332 |
|||||||||||||||||||||||||||
|
186 |
459,15 |
11,491013 |
790,09 |
2783,3923 |
1993,3022 |
2,2012 |
6,5434 |
4,3422 |
0,0011409 |
0,170172 |
|||||||||||||||||||||||||||
|
187 |
460,15 |
11,749818 |
794,5265 |
2784,2535 |
1989,727 |
2,2108 |
6,5358 |
4,325 |
0,0011424 |
0,1666038 |
|||||||||||||||||||||||||||
|
188 |
461,15 |
12,013153 |
798,9666 |
2785,1051 |
1986,1385 |
2,2204 |
6,5282 |
4,3078 |
0,0011439 |
0,1631261 |
|||||||||||||||||||||||||||
|
189 |
462,15 |
12,281072 |
803,4104 |
2785,9471 |
1982,5366 |
2,23 |
6,5207 |
4,2907 |
0,0011454 |
0,1597362 |
|||||||||||||||||||||||||||
|
190 |
463,15 |
12,553628 |
807,8579 |
2786,7794 |
1978,9215 |
2,2395 |
6,5132 |
4,2737 |
0,0011469 |
0,1564314 |
|||||||||||||||||||||||||||
|
191 |
464,15 |
12,830875 |
812,3091 |
2787,602 |
1975,293 |
2,249 |
6,5057 |
4,2567 |
0,0011484 |
0,1532092 |
|||||||||||||||||||||||||||
|
192 |
465,15 |
13,112868 |
816,764 |
2788,415 |
1971,651 |
2,2586 |
6,4983 |
4,2397 |
0,00115 |
0,1500674 |
|||||||||||||||||||||||||||
|
193 |
466,15 |
13,399661 |
821,2226 |
2789,2183 |
1967,9957 |
2,2681 |
6,4908 |
4,2228 |
0,0011515 |
0,1470035 |
|||||||||||||||||||||||||||
|
194 |
467,15 |
13,691309 |
825,6851 |
2790,012 |
1964,3269 |
2,2776 |
6,4834 |
4,2059 |
0,0011531 |
0,1440152 |
|||||||||||||||||||||||||||
|
195 |
468,15 |
13,987867 |
830,1513 |
2790,796 |
1960,6447 |
2,287 |
6,4761 |
4,189 |
0,0011546 |
0,1411006 |
|||||||||||||||||||||||||||
|
196 |
469,15 |
14,28939 |
834,6214 |
2791,5703 |
1956,9489 |
2,2965 |
6,4687 |
4,1722 |
0,0011562 |
0,1382573 |
|||||||||||||||||||||||||||
|
197 |
470,15 |
14,595934 |
839,0953 |
2792,335 |
1953,2397 |
2,3059 |
6,4614 |
4,1555 |
0,0011577 |
0,1354834 |
|||||||||||||||||||||||||||
|
198 |
471,15 |
14,907555 |
843,5731 |
2793,0901 |
1949,5169 |
2,3154 |
6,4542 |
4,1388 |
0,0011593 |
0,1327769 |
|||||||||||||||||||||||||||
|
199 |
472,15 |
15,224307 |
848,0548 |
2793,8354 |
1945,7806 |
2,3248 |
6,4469 |
4,1221 |
0,0011609 |
0,1301359 |
|||||||||||||||||||||||||||
|
200 |
473,15 |
15,546248 |
852,5404 |
2794,5712 |
1942,0307 |
2,3342 |
6,4397 |
4,1055 |
0,0011625 |
0,1275586 |
|||||||||||||||||||||||||||
|
201 |
474,15 |
15,873433 |
857,03 |
2795,2973 |
1938,2673 |
2,3436 |
6,4325 |
4,0889 |
0,0011641 |
0,1250432 |
|||||||||||||||||||||||||||
|
202 |
475,15 |
16,205919 |
861,5235 |
2796,0137 |
1934,4902 |
2,353 |
6,4253 |
4,0723 |
0,0011657 |
0,1225879 |
|||||||||||||||||||||||||||
|
203 |
476,15 |
16,543763 |
866,021 |
2796,7205 |
1930,6995 |
2,3624 |
6,4182 |
4,0558 |
0,0011673 |
0,1201911 |
|||||||||||||||||||||||||||
|
204 |
477,15 |
16,887022 |
870,5225 |
2797,4177 |
1926,8952 |
2,3717 |
6,4111 |
4,0394 |
0,0011689 |
0,1178511 |
|||||||||||||||||||||||||||
|
205 |
478,15 |
17,235753 |
875,0281 |
2798,1053 |
1923,0773 |
2,3811 |
6,404 |
4,0229 |
0,0011705 |
0,1155664 |
|||||||||||||||||||||||||||
|
206 |
479,15 |
17,590013 |
879,5377 |
2798,7833 |
1919,2457 |
2,3904 |
6,397 |
4,0065 |
0,0011722 |
0,1133354 |
|||||||||||||||||||||||||||
|
207 |
480,15 |
17,949859 |
884,0513 |
2799,4517 |
1915,4004 |
2,3997 |
6,3899 |
3,9902 |
0,0011738 |
0,1111568 |
|||||||||||||||||||||||||||
|
208 |
481,15 |
18,315349 |
888,5691 |
2800,1106 |
1911,5415 |
2,409 |
6,3829 |
3,9739 |
0,0011755 |
0,109029 |
|||||||||||||||||||||||||||
|
209 |
482,15 |
18,686542 |
893,091 |
2800,7598 |
1907,6688 |
2,4183 |
6,376 |
3,9576 |
0,0011771 |
0,1069506 |
|||||||||||||||||||||||||||
|
210 |
483,15 |
19,063495 |
897,617 |
2801,3995 |
1903,7825 |
2,4276 |
6,369 |
3,9414 |
0,0011788 |
0,1049204 |
|||||||||||||||||||||||||||
|
T (°C) |
T |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
211 |
484,15 |
19,446266 |
902,1472 |
2802,0297 |
1899,8825 |
2,4369 |
6,3621 |
3,9252 |
0,0011805 |
0,1029371 |
|||||||||||||||||||||||||||
|
212 |
485,15 |
19,834914 |
906,6816 |
2802,6504 |
1895,9688 |
2,4462 |
6,3552 |
3,909 |
0,0011822 |
0,1009993 |
|||||||||||||||||||||||||||
|
213 |
486,15 |
20,229498 |
911,2201 |
2803,2615 |
1892,0414 |
2,4554 |
6,3483 |
3,8929 |
0,0011838 |
0,0991058 |
|||||||||||||||||||||||||||
|
214 |
487,15 |
20,630075 |
915,7629 |
2803,8632 |
1888,1002 |
2,4647 |
6,3415 |
3,8768 |
0,0011855 |
0,0972555 |
|||||||||||||||||||||||||||
|
215 |
488,15 |
21,036706 |
920,31 |
2804,4553 |
1884,1454 |
2,4739 |
6,3347 |
3,8608 |
0,0011872 |
0,0954473 |
|||||||||||||||||||||||||||
|
216 |
489,15 |
21,449448 |
924,8613 |
2805,0381 |
1880,1768 |
2,4831 |
6,3279 |
3,8448 |
0,0011889 |
0,0936799 |
|||||||||||||||||||||||||||
|
217 |
490,15 |
21,868362 |
929,4169 |
2805,6114 |
1876,1945 |
2,4923 |
6,3211 |
3,8288 |
0,0011907 |
0,0919524 |
|||||||||||||||||||||||||||
|
218 |
491,15 |
22,293506 |
933,9768 |
2806,1753 |
1872,1984 |
2,5015 |
6,3143 |
3,8129 |
0,0011924 |
0,0902637 |
|||||||||||||||||||||||||||
|
219 |
492,15 |
22,72494 |
938,5411 |
2806,7298 |
1868,1887 |
2,5107 |
6,3076 |
3,797 |
0,0011941 |
0,0886127 |
|||||||||||||||||||||||||||
|
220 |
493,15 |
23,162725 |
943,1096 |
2807,2749 |
1864,1652 |
2,5198 |
6,3009 |
3,7811 |
0,0011959 |
0,0869985 |
|||||||||||||||||||||||||||
|
221 |
494,15 |
23,606918 |
947,6826 |
2807,8107 |
1860,1281 |
2,529 |
6,2943 |
3,7653 |
0,0011976 |
0,0854202 |
|||||||||||||||||||||||||||
|
222 |
495,15 |
24,057581 |
952,26 |
2808,3371 |
1856,0772 |
2,5381 |
6,2876 |
3,7495 |
0,0011994 |
0,0838767 |
|||||||||||||||||||||||||||
|
223 |
496,15 |
24,514774 |
956,8417 |
2808,8543 |
1852,0125 |
2,5473 |
6,281 |
3,7337 |
0,0012011 |
0,0823673 |
|||||||||||||||||||||||||||
|
224 |
497,15 |
24,978556 |
961,4279 |
2809,3622 |
1847,9342 |
2,5564 |
6,2744 |
3,718 |
0,0012029 |
0,0808909 |
|||||||||||||||||||||||||||
|
225 |
498,15 |
25,448989 |
966,0186 |
2809,8608 |
1843,8422 |
2,5655 |
6,2678 |
3,7023 |
0,0012047 |
0,0794468 |
|||||||||||||||||||||||||||
|
226 |
499,15 |
25,926132 |
970,6137 |
2810,3502 |
1839,7365 |
2,5746 |
6,2613 |
3,6867 |
0,0012065 |
0,0780342 |
|||||||||||||||||||||||||||
|
227 |
500,15 |
26,410046 |
975,2133 |
2810,8305 |
1835,6171 |
2,5837 |
6,2547 |
3,671 |
0,0012082 |
0,0766523 |
|||||||||||||||||||||||||||
|
228 |
501,15 |
26,900792 |
979,8175 |
2811,3015 |
1831,4841 |
2,5928 |
6,2482 |
3,6555 |
0,00121 |
0,0753002 |
|||||||||||||||||||||||||||
|
229 |
502,15 |
27,398431 |
984,4261 |
2811,7635 |
1827,3373 |
2,6018 |
6,2417 |
3,6399 |
0,0012118 |
0,0739772 |
|||||||||||||||||||||||||||
|
230 |
503,15 |
27,903024 |
989,0394 |
2812,2163 |
1823,1769 |
2,6109 |
6,2353 |
3,6244 |
0,0012137 |
0,0726827 |
|||||||||||||||||||||||||||
|
231 |
504,15 |
28,414631 |
993,6571 |
2812,6601 |
1819,0029 |
2,6199 |
6,2288 |
3,6089 |
0,0012155 |
0,0714158 |
|||||||||||||||||||||||||||
|
232 |
505,15 |
28,933314 |
998,2795 |
2813,0948 |
1814,8153 |
2,629 |
6,2224 |
3,5935 |
0,0012173 |
0,0701759 |
|||||||||||||||||||||||||||
|
233 |
506,15 |
29,459134 |
1002,9065 |
2813,5205 |
1810,614 |
2,638 |
6,216 |
3,5781 |
0,0012192 |
0,0689623 |
|||||||||||||||||||||||||||
|
234 |
507,15 |
29,992153 |
1007,5381 |
2813,9372 |
1806,3991 |
2,647 |
6,2097 |
3,5627 |
0,001221 |
0,0677743 |
|||||||||||||||||||||||||||
|
235 |
508,15 |
30,532431 |
1012,1744 |
2814,345 |
1802,1706 |
2,656 |
6,2033 |
3,5473 |
0,0012228 |
0,0666114 |
|||||||||||||||||||||||||||
|
236 |
509,15 |
31,080031 |
1016,8153 |
2814,7439 |
1797,9286 |
2,665 |
6,197 |
3,532 |
0,0012247 |
0,065473 |
|||||||||||||||||||||||||||
|
237 |
510,15 |
31,635014 |
1021,4609 |
2815,1338 |
1793,673 |
2,674 |
6,1907 |
3,5167 |
0,0012266 |
0,0643583 |
|||||||||||||||||||||||||||
|
238 |
511,15 |
32,197442 |
1026,1112 |
2815,515 |
1789,4038 |
2,683 |
6,1844 |
3,5015 |
0,0012284 |
0,0632669 |
|||||||||||||||||||||||||||
|
239 |
512,15 |
32,767377 |
1030,7662 |
2815,8874 |
1785,1212 |
2,6919 |
6,1782 |
3,4862 |
0,0012303 |
0,0621981 |
|||||||||||||||||||||||||||
|
240 |
513,15 |
33,34488 |
1035,4259 |
2816,251 |
1780,825 |
2,7009 |
6,1719 |
3,4711 |
0,0012322 |
0,0611515 |
|||||||||||||||||||||||||||
|
T (°C) |
T |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
241 |
514,15 |
33,930013 |
1040,0905 |
2816,6058 |
1776,5153 |
2,7098 |
6,1657 |
3,4559 |
0,0012341 |
0,0601264 |
|||||||||||||||||||||||||||
|
242 |
515,15 |
34,522839 |
1044,7597 |
2816,952 |
1772,1922 |
2,7187 |
6,1595 |
3,4408 |
0,001236 |
0,0591224 |
|||||||||||||||||||||||||||
|
243 |
516,15 |
35,12342 |
1049,4338 |
2817,2895 |
1767,8557 |
2,7277 |
6,1533 |
3,4257 |
0,0012379 |
0,058139 |
|||||||||||||||||||||||||||
|
244 |
517,15 |
35,731818 |
1054,1127 |
2817,6184 |
1763,5057 |
2,7366 |
6,1472 |
3,4106 |
0,0012398 |
0,0571756 |
|||||||||||||||||||||||||||
|
245 |
518,15 |
36,348094 |
1058,7964 |
2817,9388 |
1759,1423 |
2,7455 |
6,141 |
3,3956 |
0,0012418 |
0,0562318 |
|||||||||||||||||||||||||||
|
246 |
519,15 |
36,972312 |
1063,485 |
2818,2506 |
1754,7656 |
2,7544 |
6,1349 |
3,3806 |
0,0012437 |
0,0553071 |
|||||||||||||||||||||||||||
|
247 |
520,15 |
37,604534 |
1068,1784 |
2818,5539 |
1750,3755 |
2,7632 |
6,1288 |
3,3656 |
0,0012456 |
0,0544011 |
|||||||||||||||||||||||||||
|
248 |
521,15 |
38,244822 |
1072,8767 |
2818,8488 |
1745,9721 |
2,7721 |
6,1228 |
3,3507 |
0,0012476 |
0,0535134 |
|||||||||||||||||||||||||||
|
249 |
522,15 |
38,893238 |
1077,5799 |
2819,1352 |
1741,5554 |
2,781 |
6,1167 |
3,3358 |
0,0012495 |
0,0526434 |
|||||||||||||||||||||||||||
|
250 |
523,15 |
39,549846 |
1082,288 |
2819,4134 |
1737,1254 |
2,7898 |
6,1107 |
3,3209 |
0,0012515 |
0,0517908 |
|||||||||||||||||||||||||||
|
251 |
524,15 |
40,214707 |
1087,001 |
2819,6831 |
1732,6821 |
2,7987 |
6,1047 |
3,306 |
0,0012535 |
0,0509552 |
|||||||||||||||||||||||||||
|
252 |
525,15 |
40,887884 |
1091,719 |
2819,9447 |
1728,2257 |
2,8075 |
6,0987 |
3,2912 |
0,0012554 |
0,0501362 |
|||||||||||||||||||||||||||
|
253 |
526,15 |
41,56944 |
1096,4419 |
2820,198 |
1723,7561 |
2,8163 |
6,0927 |
3,2764 |
0,0012574 |
0,0493334 |
|||||||||||||||||||||||||||
|
254 |
527,15 |
42,259438 |
1101,1698 |
2820,4431 |
1719,2733 |
2,8251 |
6,0868 |
3,2617 |
0,0012594 |
0,0485463 |
|||||||||||||||||||||||||||
|
255 |
528,15 |
42,95794 |
1105,9027 |
2820,6801 |
1714,7774 |
2,8339 |
6,0809 |
3,2469 |
0,0012614 |
0,0477748 |
|||||||||||||||||||||||||||
|
256 |
529,15 |
43,665008 |
1110,6406 |
2820,909 |
1710,2684 |
2,8427 |
6,075 |
3,2322 |
0,0012634 |
0,0470184 |
|||||||||||||||||||||||||||
|
257 |
530,15 |
44,380707 |
1115,3836 |
2821,1299 |
1705,7463 |
2,8515 |
6,0691 |
3,2176 |
0,0012654 |
0,0462767 |
|||||||||||||||||||||||||||
|
258 |
531,15 |
45,105098 |
1120,1315 |
2821,3427 |
1701,2112 |
2,8603 |
6,0632 |
3,2029 |
0,0012675 |
0,0455494 |
|||||||||||||||||||||||||||
|
259 |
532,15 |
45,838244 |
1124,8846 |
2821,5477 |
1696,6631 |
2,869 |
6,0574 |
3,1883 |
0,0012695 |
0,0448362 |
|||||||||||||||||||||||||||
|
260 |
533,15 |
46,580208 |
1129,6427 |
2821,7447 |
1692,102 |
2,8778 |
6,0515 |
3,1737 |
0,0012715 |
0,0441368 |
|||||||||||||||||||||||||||
|
261 |
534,15 |
47,331054 |
1134,4058 |
2821,9339 |
1687,528 |
2,8865 |
6,0457 |
3,1592 |
0,0012736 |
0,0434509 |
|||||||||||||||||||||||||||
|
262 |
535,15 |
48,090843 |
1139,1741 |
2822,1153 |
1682,9411 |
2,8953 |
6,0399 |
3,1447 |
0,0012756 |
0,0427781 |
|||||||||||||||||||||||||||
|
263 |
536,15 |
48,859638 |
1143,9475 |
2822,2889 |
1678,3414 |
2,904 |
6,0342 |
3,1302 |
0,0012777 |
0,0421182 |
|||||||||||||||||||||||||||
|
264 |
537,15 |
49,637503 |
1148,7261 |
2822,4549 |
1673,7288 |
2,9127 |
6,0284 |
3,1157 |
0,0012797 |
0,0414709 |
|||||||||||||||||||||||||||
|
265 |
538,15 |
50,4245 |
1153,5097 |
2822,6132 |
1669,1035 |
2,9214 |
6,0227 |
3,1013 |
0,0012818 |
0,0408359 |
|||||||||||||||||||||||||||
|
266 |
539,15 |
51,220692 |
1158,2986 |
2822,7639 |
1664,4654 |
2,9301 |
6,017 |
3,0868 |
0,0012839 |
0,0402129 |
|||||||||||||||||||||||||||
|
267 |
540,15 |
52,026143 |
1163,0926 |
2822,9071 |
1659,8145 |
2,9388 |
6,0113 |
3,0725 |
0,001286 |
0,0396016 |
|||||||||||||||||||||||||||
|
268 |
541,15 |
52,840914 |
1167,8918 |
2823,0428 |
1655,1511 |
2,9475 |
6,0056 |
3,0581 |
0,0012881 |
0,0390019 |
|||||||||||||||||||||||||||
|
269 |
542,15 |
53,665068 |
1172,6962 |
2823,1711 |
1650,4749 |
2,9562 |
6 |
3,0438 |
0,0012902 |
0,0384134 |
|||||||||||||||||||||||||||
|
270 |
543,15 |
54,498669 |
1177,5058 2823,292 |
1645,7862 |
2,9649 5,9943 |
3,0295 |
0,0012923 0,0378358 |
||||||||||||||||||||||||||||||
|
T (°C) |
T |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
271 |
544,15 |
55,341779 |
1182,3206 |
2823,4056 |
1641,085 |
2,9735 |
5,9887 |
3,0152 |
0,0012944 |
0,0372691 |
|||||||||||||||||||||||||||
|
272 |
545,15 |
56,194461 |
1187,1407 |
2823,5119 |
1636,3712 |
2,9822 |
5,9831 |
3,001 |
0,0012965 |
0,0367129 |
|||||||||||||||||||||||||||
|
273 |
546,15 |
57,056778 |
1191,9661 |
2823,611 |
1631,6449 |
2,9908 |
5,9776 |
2,9868 |
0,0012986 |
0,0361669 |
|||||||||||||||||||||||||||
|
274 |
547,15 |
57,928792 |
1196,7967 |
2823,703 |
1626,9063 |
2,9994 |
5,972 |
2,9726 |
0,0013008 |
0,0356311 |
|||||||||||||||||||||||||||
|
275 |
548,15 |
58,810566 |
1201,6326 |
2823,7878 |
1622,1552 |
3,008 |
5,9665 |
2,9584 |
0,0013029 |
0,0351051 |
|||||||||||||||||||||||||||
|
276 |
549,15 |
59,702163 |
1206,4738 |
2823,8656 |
1617,3918 |
3,0167 |
5,9609 |
2,9443 |
0,0013051 |
0,0345887 |
|||||||||||||||||||||||||||
|
277 |
550,15 |
60,603646 |
1211,3203 |
2823,9364 |
1612,6161 |
3,0253 |
5,9554 |
2,9302 |
0,0013072 |
0,0340818 |
|||||||||||||||||||||||||||
|
278 |
551,15 |
61,515076 |
1216,1721 |
2824,0003 |
1607,8282 |
3,0339 |
5,9499 |
2,9161 |
0,0013094 |
0,0335841 |
|||||||||||||||||||||||||||
|
279 |
552,15 |
62,436517 |
1221,0293 |
2824,0573 |
1603,028 |
3,0424 |
5,9445 |
2,902 |
0,0013116 |
0,0330955 |
|||||||||||||||||||||||||||
|
280 |
553,15 |
63,368031 |
1225,8918 |
2824,1075 |
1598,2157 |
3,051 |
5,939 |
2,888 |
0,0013138 |
0,0326157 |
|||||||||||||||||||||||||||
|
281 |
554,15 |
64,30968 |
1230,7596 |
2824,1509 |
1593,3913 |
3,0596 |
5,9336 |
2,874 |
0,0013159 |
0,0321445 |
|||||||||||||||||||||||||||
|
282 |
555,15 |
65,261527 |
1235,6328 |
2824,1877 |
1588,5548 |
3,0681 |
5,9282 |
2,86 |
0,0013181 |
0,0316819 |
|||||||||||||||||||||||||||
|
283 |
556,15 |
66,223635 |
1240,5114 |
2824,2178 |
1583,7063 |
3,0767 |
5,9228 |
2,8461 |
0,0013203 |
0,0312275 |
|||||||||||||||||||||||||||
|
284 |
557,15 |
67,196065 |
1245,3955 |
2824,2413 |
1578,8458 |
3,0852 |
5,9174 |
2,8322 |
0,0013225 |
0,0307813 |
|||||||||||||||||||||||||||
|
285 |
558,15 |
68,17888 |
1250,2849 |
2824,2583 |
1573,9734 |
3,0938 |
5,9121 |
2,8183 |
0,0013248 |
0,030343 |
|||||||||||||||||||||||||||
|
286 |
559,15 |
69,172142 |
1255,1797 |
2824,2688 |
1569,0891 |
3,1023 |
5,9067 |
2,8044 |
0,001327 |
0,0299125 |
|||||||||||||||||||||||||||
|
287 |
560,15 |
70,175914 |
1260,0799 |
2824,273 |
1564,193 |
3,1108 |
5,9014 |
2,7906 |
0,0013292 |
0,0294896 |
|||||||||||||||||||||||||||
|
288 |
561,15 |
71,190256 |
1264,9856 |
2824,2708 |
1559,2851 |
3,1193 |
5,8961 |
2,7768 |
0,0013315 |
0,0290742 |
|||||||||||||||||||||||||||
|
289 |
562,15 |
72,215232 |
1269,8968 |
2824,2623 |
1554,3655 |
3,1278 |
5,8908 |
2,763 |
0,0013337 |
0,0286661 |
|||||||||||||||||||||||||||
|
290 |
563,15 |
73,250903 |
1274,8133 |
2824,2476 |
1549,4342 |
3,1363 |
5,8856 |
2,7492 |
0,001336 |
0,0282652 |
|||||||||||||||||||||||||||
|
291 |
564,15 |
74,297331 |
1279,7354 |
2824,2267 |
1544,4913 |
3,1448 |
5,8803 |
2,7355 |
0,0013382 |
0,0278713 |
|||||||||||||||||||||||||||
|
292 |
565,15 |
75,354578 |
1284,663 |
2824,1998 |
1539,5368 |
3,1533 |
5,8751 |
2,7218 |
0,0013405 |
0,0274843 |
|||||||||||||||||||||||||||
|
293 |
566,15 |
76,422706 |
1289,596 |
2824,1668 |
1534,5708 |
3,1618 |
5,8699 |
2,7081 |
0,0013428 |
0,027104 |
|||||||||||||||||||||||||||
|
294 |
567,15 |
77,501775 |
1294,5345 |
2824,1279 |
1529,5933 |
3,1702 |
5,8647 |
2,6945 |
0,001345 |
0,0267303 |
|||||||||||||||||||||||||||
|
295 |
568,15 |
78,591849 |
1299,4786 |
2824,083 |
1524,6044 |
3,1787 |
5,8595 |
2,6808 |
0,0013473 |
0,026363 |
|||||||||||||||||||||||||||
|
296 |
569,15 |
79,692988 |
1304,4282 |
2824,0323 |
1519,6041 |
3,1871 |
5,8543 |
2,6672 |
0,0013496 |
0,0260021 |
|||||||||||||||||||||||||||
|
297 |
570,15 |
80,805253 |
1309,3833 |
2823,9758 |
1514,5926 |
3,1955 |
5,8492 |
2,6537 |
0,0013519 |
0,0256474 |
|||||||||||||||||||||||||||
|
298 |
571,15 |
81,928707 |
1314,3439 |
2823,9136 |
1509,5697 |
3,204 |
5,8441 |
2,6401 |
0,0013543 |
0,0252988 |
|||||||||||||||||||||||||||
|
299 |
572,15 |
83,063409 |
1319,3101 |
2823,8458 |
1504,5357 |
3,2124 |
5,839 |
2,6266 |
0,0013566 |
0,0249561 |
|||||||||||||||||||||||||||
|
T (°C) |
T (°K) |
P (bar) |
Enthalpie |
Chaleur
de |
Entropie |
ÄS hL |
Volume
spécifique |
||||||||||||||||||||||||||||||
|
hL |
hG |
LV |
SL |
SG |
hG |
LV |
|||||||||||||||||||||||||||||||
|
300 |
573,15 |
84,209422 |
1324,2818 |
2823,7723 |
1499,4905 |
3,2208 |
5,8339 |
2,6131 |
0,0013589 |
0,0246193 |
|||||||||||||||||||||||||||
|
301 |
574,15 |
85,366807 |
1329,2591 |
2823,6933 |
1494,4342 |
3,2292 |
5,8288 |
2,5996 |
0,0013612 |
0,0242882 |
|||||||||||||||||||||||||||
|
302 |
575,15 |
86,535623 |
1334,242 |
2823,6089 |
1489,3669 |
3,2376 |
5,8238 |
2,5862 |
0,0013636 |
0,0239627 |
|||||||||||||||||||||||||||
|
303 |
576,15 |
87,715932 |
1339,2305 |
2823,5191 |
1484,2886 |
3,246 |
5,8187 |
2,5727 |
0,0013659 |
0,0236427 |
|||||||||||||||||||||||||||
|
304 |
577,15 |
88,907796 |
1344,2246 |
2823,4239 |
1479,1993 |
3,2544 |
5,8137 |
2,5593 |
0,0013683 |
0,0233281 |
|||||||||||||||||||||||||||
|
305 |
578,15 |
90,111273 |
1349,2242 |
2823,3235 |
1474,0992 |
3,2627 |
5,8087 |
2,546 |
0,0013706 |
0,0230188 |
|||||||||||||||||||||||||||
|
306 |
579,15 |
91,326426 |
1354,2295 |
2823,2178 |
1468,9883 |
3,2711 |
5,8037 |
2,5326 |
0,001373 |
0,0227146 |
|||||||||||||||||||||||||||
|
307 |
580,15 |
92,553314 |
1359,2404 |
2823,107 |
1463,8666 |
3,2794 |
5,7988 |
2,5193 |
0,0013754 |
0,0224155 |
|||||||||||||||||||||||||||
|
308 |
581,15 |
93,791997 |
1364,2569 |
2822,9912 |
1458,7343 |
3,2878 |
5,7938 |
2,506 |
0,0013778 |
0,0221215 |
|||||||||||||||||||||||||||
|
309 |
582,15 |
95,042536 |
1369,2791 |
2822,8703 |
1453,5913 |
3,2961 |
5,7889 |
2,4927 |
0,0013802 |
0,0218323 |
|||||||||||||||||||||||||||
|
310 |
583,15 |
96,304991 |
1374,3069 |
2822,7445 |
1448,4377 |
3,3045 |
5,784 |
2,4795 |
0,0013826 |
0,0215478 |
|||||||||||||||||||||||||||
|
311 |
584,15 |
97,579421 |
1379,3403 |
2822,6139 |
1443,2736 |
3,3128 |
5,7791 |
2,4663 |
0,001385 |
0,0212681 |
|||||||||||||||||||||||||||
|
312 |
585,15 |
98,865888 |
1384,3794 |
2822,4784 |
1438,099 |
3,3211 |
5,7742 |
2,4531 |
0,0013874 |
0,020993 |
|||||||||||||||||||||||||||
|
313 |
586,15 |
100,164449 |
1389,4241 |
2822,3381 |
1432,914 |
3,3294 |
5,7693 |
2,4399 |
0,0013898 |
0,0207224 |
|||||||||||||||||||||||||||
|
314 |
587,15 |
101,475165 |
1394,4745 |
2822,1932 |
1427,7187 |
3,3377 |
5,7645 |
2,4268 |
0,0013922 |
0,0204562 |
|||||||||||||||||||||||||||
|
315 |
588,15 |
102,798096 |
1399,5306 |
2822,0437 |
1422,5131 |
3,346 |
5,7596 |
2,4136 |
0,0013946 |
0,0201944 |
|||||||||||||||||||||||||||
|
316 |
589,15 |
104,1333 |
1404,5924 |
2821,8896 |
1417,2972 |
3,3543 |
5,7548 |
2,4006 |
0,0013971 |
0,0199368 |
|||||||||||||||||||||||||||
|
317 |
590,15 |
105,480836 |
1409,6599 |
2821,7311 |
1412,0712 |
3,3625 |
5,75 |
2,3875 |
0,0013995 |
0,0196834 |
|||||||||||||||||||||||||||
|
318 |
591,15 |
106,840765 |
1414,733 |
2821,5681 |
1406,8351 |
3,3708 |
5,7452 |
2,3744 |
0,001402 |
0,0194342 |
|||||||||||||||||||||||||||
|
319 |
592,15 |
108,213144 |
1419,8119 |
2821,4008 |
1401,5889 |
3,3791 |
5,7405 |
2,3614 |
0,0014045 |
0,0191889 |
|||||||||||||||||||||||||||
|
320 |
593,15 |
109,598033 |
1424,8964 |
2821,2292 |
1396,3328 |
3,3873 |
5,7357 |
2,3484 |
0,0014069 |
0,0189476 |
|||||||||||||||||||||||||||
|
321 |
594,15 |
110,99549 |
1429,9867 |
2821,0534 |
1391,0667 |
3,3956 |
5,731 |
2,3354 |
0,0014094 |
0,0187101 |
|||||||||||||||||||||||||||
|
322 |
595,15 |
112,405574 |
1435,0827 |
2820,8735 |
1385,7908 |
3,4038 |
5,7263 |
2,3225 |
0,0014119 |
0,0184765 |
|||||||||||||||||||||||||||
|
323 |
596,15 |
113,828342 |
1440,1844 |
2820,6895 |
1380,5051 |
3,412 |
5,7216 |
2,3096 |
0,0014144 |
0,0182466 |
|||||||||||||||||||||||||||
|
324 |
597,15 |
115,263854 |
1445,2918 |
2820,5015 |
1375,2097 |
3,4202 |
5,7169 |
2,2967 |
0,0014169 |
0,0180204 |
|||||||||||||||||||||||||||
|
325 |
598,15 |
116,712167 |
1450,405 |
2820,3095 |
1369,9045 |
3,4285 |
5,7123 |
2,2838 |
0,0014194 |
0,0177977 |
|||||||||||||||||||||||||||
|
326 |
599,15 |
118,17334 |
1455,5239 |
2820,1136 |
1364,5898 |
3,4367 |
5,7076 |
2,271 |
0,0014219 |
0,0175786 |
|||||||||||||||||||||||||||
Propriétés P-T-î
|
P (bar) |
T (°K) |
(1/T) (°K-1) |
î (Kg/Kg
de |
P (bar) |
T (°K) |
(1/T) (°K-1) |
î (Kg/Kg
de |
|
|
0,016 |
278,3075 |
0,003593148 |
0 |
12,516 |
363,1641 |
0,002753576 |
0,4 |
|
|
2,516 |
399,6198 |
0,002502379 |
0 |
15,016 |
370,8499 |
0,002696509 |
0,4 |
|
|
5,016 |
424,8844 |
0,002353581 |
0 |
17,516 |
377,6079 |
0,00264825 |
0,4 |
|
|
7,516 |
441,2345 |
0,002266369 |
0 |
20,016 |
383,6649 |
0,002606441 |
0,4 |
|
|
10,016 |
453,6295 |
0,002204442 |
0 |
0,016 |
195,2631 |
0,005121295 |
0,5 |
|
|
12,516 |
463,7384 |
0,002156388 |
0 |
2,516 |
291,7198 |
0,003427947 |
0,5 |
|
|
15,016 |
472,3409 |
0,002117115 |
0 |
5,016 |
312,7982 |
0,003196949 |
0,5 |
|
|
17,516 |
479,8686 |
0,002083904 |
0 |
7,516 |
326,6312 |
0,003061557 |
0,5 |
|
|
20,016 |
486,587 |
0,002055131 |
0 |
10,016 |
337,2204 |
0,00296542 |
0,5 |
|
|
0,016 |
256,5309 |
0,003898166 |
0,1 |
12,516 |
345,9227 |
0,002890819 |
0,5 |
|
|
2,516 |
372,1717 |
0,002686932 |
0,1 |
15,016 |
353,3757 |
0,002829849 |
0,5 |
|
|
5,016 |
396,5576 |
0,002521702 |
0,1 |
17,516 |
359,9334 |
0,002778292 |
0,5 |
|
|
7,516 |
412,3954 |
0,002424857 |
0,1 |
20,016 |
365,8148 |
0,002733624 |
0,5 |
|
|
10,016 |
424,4317 |
0,002356092 |
0,1 |
0,016 |
186,672 |
0,00535699 |
0,6 |
|
|
12,516 |
434,2671 |
0,00230273 |
0,1 |
2,516 |
279,6291 |
0,003576166 |
0,6 |
|
|
15,016 |
442,6503 |
0,00225912 |
0,1 |
5,016 |
300,0088 |
0,003333236 |
0,6 |
|
|
17,516 |
449,9963 |
0,00222224 |
0,1 |
7,516 |
313,3962 |
0,003190849 |
0,6 |
|
|
20,016 |
456,5605 |
0,00219029 |
0,1 |
10,016 |
323,6512 |
0,003089746 |
0,6 |
|
|
0,016 |
237,2497 |
0,004214968 |
0,2 |
12,516 |
332,0834 |
0,003011292 |
0,6 |
|
|
2,516 |
347,4719 |
0,002877931 |
0,2 |
15,016 |
339,3082 |
0,002947173 |
0,6 |
|
|
5,016 |
370,9833 |
0,002695539 |
0,2 |
17,516 |
345,6678 |
0,002892951 |
0,6 |
|
|
7,516 |
386,3039 |
0,002588636 |
0,2 |
20,016 |
351,3733 |
0,002845976 |
0,6 |
|
|
10,016 |
397,9739 |
0,002512728 |
0,2 |
0,016 |
180,7141 |
0,005533603 |
0,7 |
|
|
12,516 |
407,5272 |
0,002453824 |
0,2 |
2,516 |
270,7656 |
0,003693231 |
0,7 |
|
|
15,016 |
415,6822 |
0,002405684 |
0,2 |
5,016 |
290,5137 |
0,003442178 |
0,7 |
|
|
17,516 |
422,8376 |
0,002364974 |
0,2 |
7,516 |
303,4873 |
0,003295031 |
0,7 |
|
|
20,016 |
429,2388 |
0,002329706 |
0,2 |
10,016 |
313,4259 |
0,003190547 |
0,7 |
|
|
0,016 |
220,5656 |
0,004533799 |
0,3 |
12,516 |
321,5983 |
0,003109469 |
0,7 |
|
|
2,516 |
325,7211 |
0,003070111 |
0,3 |
15,016 |
328,6008 |
0,003043206 |
0,7 |
|
|
5,016 |
348,3783 |
0,002870443 |
0,3 |
17,516 |
334,7648 |
0,002987172 |
0,7 |
|
|
7,516 |
363,1856 |
0,002753413 |
0,3 |
20,016 |
340,2951 |
0,002938626 |
0,7 |
|
|
10,016 |
374,4877 |
0,002670315 |
0,3 |
0,016 |
177,2407 |
0,005642045 |
0,8 |
|
|
12,516 |
383,7546 |
0,002605832 |
0,3 |
2,516 |
264,9248 |
0,003774656 |
0,8 |
|
|
15,016 |
391,6759 |
0,002553131 |
0,3 |
5,016 |
284,0976 |
0,003519917 |
0,8 |
|
|
17,516 |
398,6342 |
0,002508565 |
0,3 |
7,516 |
296,6822 |
0,00337061 |
0,8 |
|
|
20,016 |
404,8655 |
0,002469956 |
0,3 |
10,016 |
306,317 |
0,003264592 |
0,8 |
|
|
0,016 |
206,556 |
0,004841302 |
0,4 |
12,516 |
314,2358 |
0,003182324 |
0,8 |
|
|
2,516 |
307,0944 |
0,003256328 |
0,4 |
15,016 |
321,0182 |
0,003115088 |
0,8 |
|
|
5,016 |
328,9351 |
0,003040113 |
0,4 |
17,516 |
326,9864 |
0,003058231 |
0,8 |
|
|
7,516 |
343,2432 |
0,002913386 |
0,4 |
20,016 |
332,3394 |
0,003008972 |
0,8 |
|
|
10,016 |
354,1826 |
0,002823402 |
0,4 |
0,016 |
176,0437 |
0,005680408 |
0,9 |
|
|
P (bar) |
T (°K) |
(1/T) (°K-1) |
î (Kg/Kg
de |
|||||
|
2,516 |
261,8029 |
0,003819667 |
0,9 |
|||||
|
5,016 |
280,4392 |
0,003565835 |
0,9 |
|||||
|
7,516 |
292,6493 |
0,003417059 |
0,9 |
|||||
|
10,016 |
301,9854 |
0,003311418 |
0,9 |
|||||
|
12,516 |
309,6509 |
0,003229443 |
0,9 |
|||||
|
15,016 |
316,2108 |
0,003162447 |
0,9 |
|||||
|
17,516 |
321,979 |
0,003105793 |
0,9 |
|||||
|
20,016 |
327,1492 |
0,003056709 |
0,9 |
|||||
|
0,016 |
176,8449 |
0,005654673 |
1 |
|||||
|
2,516 |
260,9756 |
0,003831776 |
1 |
|||||
|
5,016 |
279,0875 |
0,003583106 |
1 |
|||||
|
7,516 |
290,9213 |
0,003437356 |
1 |
|||||
|
10,016 |
299,9523 |
0,003333863 |
1 |
|||||
|
12,516 |
307,3561 |
0,003253555 |
1 |
|||||
|
15,016 |
313,684 |
0,003187922 |
1 |
|||||
|
17,516 |
319,2421 |
0,003132419 |
1 |
|||||
|
20,016 |
324,2191 |
0,003084334 |
1 |
|||||

