II.2. Notion de potentiel chimique [26] :
Considérons l'expression de la différentielle
du de l'énergie interne obtenue par application
simultanée des deux principes à un système fermé,
et si n1, n2, , ni représentent les nombres de moles
respectifs des différents composants présents dans la phase, on
peut écrire que :
? u ? u
(II.1)
i
? n 1 ? ni
où plus simplement :
du TdS PdV
= - + dn + dn
1 +
du = TdS - PdV + ?? ui
dni (II.2)
?ni
avec:
? ? ? ? ? =
u ì (II.3)
i j,
? ? ?
n i s v n , , j
Les quantités telles que ,
? ? ? ? ? =
u ì sont les potentiels chimiques des composants
dans le système.
i j
? ? ?
n i s v n
, , j
Le potentiel chimique interne, défini par « Gibbs
», est une mesure de l'influence de l'énergie interne de la phase
considérée sur l'influence du nombre de moles du constituant
(i).
Si l'on envisage maintenant l'enthalpie, l'énergie libre
et l'enthalpie libre de la phase considérée, définies
respectivement par :
H = u + PV (II.4)
F = u - TS ( Helmotz)
(II.5)
G = H - TS (Gibbs) (II.6)
en calculant leurs différentielles et en substituant, les
nouvelles expressions :
dH = TdS + VdP +?
ìi dni (II.7)
i
dF = - SdT - PdV +?
ìi dni (II.8)
i
dG = - SdT + VdP + ?
ìi dni (II.9)
i
on aboutit à :
|
ì i
|
? u ? H ? F ?G
(II. 1 0)
(? n i )s v n (?
nijs,p,nj (? n i ?n
)T v n ()
T , p ,nj
|
L'enthalpie libre peut être calculée sur la base des
potentiels chimiques ìi des deux composantes
(NH3 et H2O) :
G = (1 - x )ìH 2 O +
xìNH3 (II.1 1 )
II.2.1. Condition d'équilibre :
A l'équilibre de la phase, à coté de
l'égalité de la pression et de la température, il existe
en plus l'égalité entre les potentiels chimiques de toutes les
composantes des phases existantes.
ì( T , P , x
g ) = ( T , P , xL )
i = NH H O (II.12)
3 , 2
i
II.3. L'équation d'état fondamentale
choisie pour NH3-H2O :
Parmi les modèles cités
précédemment on a choisi celui de MICHEL FEIDT
[27] qui combine la méthode de l'énergie libre
de Gibbs pour les propriétés thermiques et des équations
qui calculent le point de bulle et le point de rosée du mélange.
Cette méthode combine les avantages des deux et évite le besoin
d'effectuer des itérations afin d'avoir les conditions
d'équilibre de phases. Les corrélations proposées couvrent
des conditions d'équilibre de phases à des pressions et des
températures élevées.
Le domaine de validité pour les relations qui suit est
:
· Pour les températures (K) :
230<T<600 ;
· Pour les pressions (bar) :
0.2<P<110.
Ce domaine se trouve sous les points critiques de toutes les
composantes, de sorte que la détermination de l'équation
d'état pour le mélange, ne prenne pas en considération les
particularités référents au domaine d'état
critique. L'équation d'état ne décrit pas l'état
dans lequel la solution se trouve sous forme d'agrégation solide
[27].
II.3.1. L'enthalpie libre :
L'équation fondamentale de l'enthalpie libre de Gibbs est
donnée sous une forme intégrale (Ziegler et Trepp
[20], Ibrahim et Klein [21], Xu et Yogi
Goswami [22]) :
Cp
G = H 0 - TS 0 + ? Cp
dT + ? V dP -T ? dT
T
T P T
T P T
0 0 0
(II.13)
Cette équation est valable pour la phase gazeuse, ainsi
que liquide.
II.3.1.1. Phase liquide :
Le comportement de l'état liquide du point de vue
thermique est décrit par les corrélations suivantes (Ziegler et
Trepp [20]), oil le volume liquide est fonction de la pression
et de la température et CpL molaire du liquide de la
température :
V L = a 1 + a
2 P + a 3 T + a
4T2 (II.14)
Cp L = b 1 + b
2 T + b 3T2
(II.15)
donc :
L L T Cp dTL
T P
G L = H 0 -TS 0
+ ? Cp L dT + ? V I' dP - T
?
T
T 0 P 0 T0
(II.16)
Le développement de l'équation (II.16) avec l'aide
des équations (II.14) et (II.15) aboutit à la forme
réduite :
B B ? T
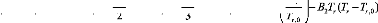
G r L = H r L - T S T + B
0
r r
0 1 ( T r - T0 ) +
r ,2 ( T
2
- T 0 r r ) + 3 (T 3 - T 3) -B1 Tlnr
,r
,
2 3 ? ?
? ?
Tr ,0
B A
- 2 3 T r ( T r 2 - Tr 2
,0 ) + ( A 1 + A3 T
r + A 4 T r 2 )(
Pr - Pr ,0 ) + 22 ( P r r2 -
P2, 0 )
|
- B 2 r r r T ( T - T 0 )
(II.17)
|
|
Les grandeurs adimensionnelles d'état sont :
· La température réduite :
Tr
|
T
= ;
TB
|
|
G
= ;
RT B
· L'enthalpie libre molaire réduite :
Gr
· La pression réduite : Pr
|
P
= ;
P
B
|
·
H
;
RT
B
L'enthalpie molaire réduite : Hr
S
· L'entropie molaire réduite :
Sr = R ;
.
VP
· Le volume molaire réduit : B
RTB
V =
r
Les indices utilisés sont :
· r : pour la grandeur réduite ;
· B : pour la grandeur de référence ;
· L : la phase liquide ;
· g : la phase gazeuse ;
· 0 : l'état de référence.
Les grandeurs de références [27]
sont:
TB = 100 k ; PB
= 10 bar et R = 8.3143 kj / kmole .k .
| 


