|
UNIVERSITÉ DES ANTILLES ET DE LA
GUYANE
FACULTÉ DES SCIENCES EXACTES ET NATURELLES

MASTER RECHERCHE EN SCIENCES ET TECHNOLOGIES
BIODIVERSITÉ
TROPICALE
Spécialité: Écosystèmes Naturels et
Exploités
Analyse de la diversité des champignons
ectomycorhiziens et des
ectomycorhizes du Raisinier bord de mer
(Coccoloba uvifera L.) le
long d'un gradient de salinité en
forêt littorale
Raymond Avril

Directeur de stage : Amadou B%o
Laboratoire de Biologie et Physiologie
Végétales (LSTM-UMR113), UFR Sciences Exactes et
Naturelles,
Université des Antilles et de la Guyane, BP. 592, 97159,
Pointe-à-Pitre,
Guadeloupe
Soutenu le : 25 juin 2009
REMERCIEMENTS
Ce stage s'est déroulé au Laboratoire de
Biologie et de Physiologie Végétales (LSTM-UMR113) de
l'Université des Antilles et de la Guyane. Ce travail de recherche a pu
se réaliser gr%oce au soutien de personnes que je tiens à
remercier en particulier :
Monsieur Amadou B%o , professeur à l'UAG, d'avoir
encadré ce travail avec enthousiasme et de m'avoir fait découvert
le monde fascinant des symbioses ectomycorhiziennes.
Mademoiselle Isabelle Boulogne, technicienne au laboratoire, pour
son soutien moral mais aussi pour son amabilité et son aide.
Mademoiselle Sandrine Bessard, doctorante au laboratoire,
surnommée grande sÏur, pour son aide.
Madame Clémence Chaintreuil, ingénieure de
recherche à l'IRD de Montpellier, d'avoir bien voulu nous apporter son
aide pour le séquençage de l'ADN.
Mademoiselle Fadul Ra
·ma, stagiaire en M1 au
laboratoire, pour ses encouragements, sa gentillesse et son amitié.
Mes camarades de promotion, Lisa Vidil, Pierre-Antoine Faddoul et
Anaël Ssosse, pour leur accueil, leur amitié et leur
encouragement.
Monsieur Harry-Ozier Lafontaine, directeur de recherche à
l'INRA, d'avoir bien voulu faire un rapport sur mon mémoire de stage.
Toute l'équipe du laboratoire de Biologie Marine pour
son accueil, en particulier Madame Soazig Lemoine, maître de
conférences à l'UAG, qui a aimablement mis à ma
disposition l'équipement de biologie moléculaire.
L'AUF Cara
·be pour son soutien financier à
travers la bourse de mobilité sans laquelle ce travail n'aurait pas vu
le jour. Que les responsables trouvent, ici, l'expression de ma reconnaissance,
particulièrement Mme Katty Saint-Louis, pour son attention et son
dévouement.
LISTE DES TABLEAUX ET FIGURES
Tableau 1. Les différents types de
mycorhizes 4
Figure 1. Principaux types d'associations
symbiotiques entre des champignons 5
(en bleu) du sol et des racines de végétaux
Figure 2. Représentation
schématique de l'ITS (ITS1, ITS2 et 5.8S) de l'unité 9
répétée de l'ADN ribosomique chez les
champignons
Tableau 2. Classification botanique de
Coccoloba uvifera 12
Figure 3. Fruits verts immatures, Fruits rouge
violacé matures 12
Figure 4. Fleurs m%oles, Graines sans la pulpe
13
Figure 5. Coccoloba uvifera en bordure
de mer sur la plage de Bois Jolan 15
Tableau 3. Champignons ectomycorhiziens
associés à C. uvifera aux Antilles 16
Figure 6. Plantules de Coccoloba uvifera
et sporophores de Russula cremeolilacina 16
sous le houppier d'un arbre-mère
Figure 7. Représentation
schématique (vue de profil) des six arbres -mères de
Coccoloba 17
uvifera échantillonnés le long d'un
gradient de salinité sur la plage de Bois Jolan
Figure 8. Représentation
schématique (vue de face) de la position des six 18
arbres-mères de Coccoloba uvifera
échantillonnés le long d'un gradient de
salinité sur la plage de Bois Jolan
Figure 9. Fructifications de Scleroderma
bermudense matures ouvertes en étoile .23
libérant la sporée et immatures fermées
Figure 10. Nombre de sporophores
récoltés sous Coccoloba uvifera pendant 24
8 mois en milieu peu salé
Tableau 4. Description des neuf morphotypes
ectomycorhiziens sur quelques .25
caractères macroscopiques et microscopiques
Figure 11. Morphotypes des arbres-mères
et de leurs plantules en milieu peu salé 25
Figure 12. Fréquence des morphotypes des
arbres-mères et leurs plantules en milieu peu saléÉ 26
Figure 13. Fréquence des morphotypes des
arbres-mères en milieu salé 26
Figure 14. Produits de l'amplification par PCR
de la région ITS de l'ADNr des morphotypesÉ 27
Figure 15. Produits de digestion par
HinfI de la région ITS de l'ADNr des morphotypes 28
Tableau 5. Polymorphisme de longueur des
fragments de restriction de la région ITS .29
(digestion par HinfI) des sporophores et des morphotypes
ectomycorhiziens
d'arbres-mères et de plantules de Coccoloba
uvifera
Figure 16. Fréquence des six ribotypes
(F, E, A, B, D et C) des arbres-mères et de leurs 30
plantules en milieu peu salé.
Figure 17. Fréquence de trois ribotypes
(A, B et F) des arbres en milieu salé 31
Figure 18. Arbre phylogénétique
basé sur le séquençage de l'ITS des huit taxons 32
fongiques (I à VIII en rouge) de C. uvifera,
comparé à des séquences de référence
dans GenBank (en noir)
SOMMAIRE
INTRODUCTION 1
SYNTHESE BIBLIOGRAPHIQUE 3
1. Symbiose mycorhizienne 3
2. Symbiose ectomycorhizienne 6
2.1. Diversité des champignons ectomycorhiziens 6
2.2. Diversité des ECM 7
2.3. Caractérisation moléculaire de la
diversité fongique 8
2.4. Les ECM en milieu salé 10
2.5. Importance des réseaux ectomycorhiziens 10
3. Coccoloba uvifera L 11
3.1. Classification et description botanique 11
3.2. Origine et aire de distribution 13
3.3. Quelques usages de C. uvifera 13
3.4. C. uvifera et ses symbiotes 14
MATERIELS ET METHODES 16
1. Description du site 16
2. Plan d'échantillonnage 18
3. Morphotypage, fréquence et conservation des ECM 19
4. Extraction de l'ADN 19
5. Amplification de l'ITS par la réaction de
polymérase en cha»ne 20
6. Polymorphisme de longueur des fragments de restriction de
l'ITS 21
7. Séquençage de l'ITS 22
8. Analyse statistique 22
RÉSULTATS ET DISCUSSION 23
1. Diversité des sporophores 23
2. Diversité des morphotypes 24
3. Caractérisation moléculaire des MT et des
sporophores 27
CONCLUSIONS ET PERSPECTIVES 33
BIBLIOGRAPHIE 34
ANNEXES 41
INTRODUCTION
La symbiose ectomycorhizienne, une association mutualiste
entre les racines fines des arbres et des champignons du sol, se traduit par la
formation d'un organe mixte dénommé ectomycorhize (ECM), et par
l'apparition d'organes sporofères appelés sporophores ou
carpophores visibles à proximité de la plante hôte (Smith
& Read, 2008). L'ECM assure une bonne alimentation en eau,
macroéléments (p.ex. P, N, K) et oligo -éléments
(p.ex. Zn, Cu) de la plante hôte (Diédhiou et al., 2004;
Bandou et al., 2006; Quoreshi & Khasa, 2008). Elle
développe, pour ce faire, un réseau mycélien qui explore
un grand volume de sol, au-delà de la zone d'épuisement, et
mobilise ainsi les nutriments essentiels. En retour, la plante autotrophe
fournit au champignon hétérotrophe des photosynthétats
nécessaires à son métabolisme.
La symbiose ectomycorhizienne est surtout localisée
sous les latitudes tempérées et boréales, et concerne
environ 90% des espèces d'arbres de ces régions (Smith &
Read, 2008). Beaucoup d'arbres appartenant à la famille des
Pinaceae, Fagaceae, Betulaceae, Tiliaceae
et Salicaceae sont associés à une
diversité d'environ 15000 espèces de champignons ectomycorhiziens
appartenant à des Basidiomycota et Ascomycota. En
revanche, beaucoup moins d'arbres sont associés à des ECM dans
les régions tropicales et subtropicales (B%o et al., 2008; B%o
et al., 2009). Il s'agit de familles d'arbres originaires d'Australie
(p. ex. Myrtaceae, Casuarinaceae, Acaciaea), d'Afrique (p.ex.
Caesalpinioideae, Phyllanthaceae), d'Asie (p. ex.
Dipterocarpaceae, Caesalpinioideae) et d'Amérique du Sud (p.ex.
Caesalpinioideae, Nyctaginaceae, Polygonaceae).
Dans les écosystèmes forestiers, des champignons
sont capables de coloniser à la fois les racines des plantules et des
arbres-mères de la même espèce ou d'espèces
différentes, et d'établir ainsi des réseaux
ectomycorhiziens communs (Read & Smith, 2008). Par le biais des
réseaux ectomycorhiziens, les arbres établis peuvent aider les
plantules de deux façons : (1) les champignons déjà
nourris par les adultes représentent un inoculum peu couteux en
photosynthétats pour les plantules dont ils assurent la
régénération et la survie (Onguene & Kuyper, 2002;
McGuire, 2007), (2) des transferts d'eau, de substrats carbonés et
azotés sont possibles entre arbres matures et plantules en
régénération (Tedersoo et al., 2007 ; Warren
et al., 2008) ; de tels échanges sont bien établis chez
certaines plantes de sous-bois non chlorophylliennes dites
mycohétérotrophes ou des plantes mixotrophes qui, en plus de leur
photosynthèse, s'alimentent en C et N issus de plantes
photosynthétiques (Julou et al., 2005 ; Selosse et
al., 2006 ; Tedersoo et al., 2007).
Parmi les arbres des forêts néotropicales,
Coccoloba uvifera (L) est l'une des rares espèces à ECM
qui fait l'objet de plantations ornementales (p.ex. haies -vives) en bordure de
route et de plage sur les côtes atlantiques, caribéennes et
pacifiques de l'Amérique tropicale et subtropicale (Parrota, 1994;
Bandou, 2005). Cet arbre appartient à la famille des
Polygonaceae et doit son nom de Raisinier bord de mer (en anglais
Ç seagrape È) à son fruit comestible ressemblant à
des grappes de raisins. Il pousse souvent sur des sols salés et pauvres
en éléments minéraux. Il est associé à
plusieurs espèces de champignons ectomycorhiziens (Pegler, 1983 ; Miller
et al., 2000 ; Guzman et al., 2003; Bandou, 2005 ; Bessard
et al., 2008) avec lesquels ses racines forment des ECM, une
association symbiotique vitale pour la nutrition des plantes (Bandou et
al., 2006). En effet, les ECM jouent un rôle majeur sur la
croissance et l'adaptation des plantules de C. uvifera aux stress
salin et hydrique (Bandou et al., 2006). Un inventaire des sporophores
fructifiant sous le houppier de C. uvifera a été
réalisé en Guadeloupe (Bandou, 2005). Cet inventaire mycologique
devait être complété par un inventaire des ECM pour avoir
une bonne image de la diversité des communautés de champignons
ectomycorhiziens de C. uvifera. De plus, sous le houppier des
arbres-mères de cette espèce prolifèrent des plantules
issues de semis qui pourraient se lier aux réseaux ectomycorhiziens
préexistants. L'existence de réseaux ectomycorhiziens communs aux
arbres - mères et plantules pourrait contribuer à la
régénération naturelle par semis.
Notre étude avait pour but (i) d'évaluer
l'impact de la salinité sur les communautés de champignons
ectomycorhiziens des arbres-mères et des plantules de C.
uvifera, (ii) de déterminer à quel point les
arbres-mères et leurs plantules partagent un cortège
ectomycorhizien commun.
SYNTHESE BIBLIOGRAPHIQUE
1. Symbiose mycorhiñenne
Le terme de mycorhize vient de l'association de deux mots
grecs, Ç mykes È qui signifie champignon et
ÇrhizaÈ qui signifie racine (Gagné, 2005). Il fut
créé par Franck en 1885 pour définir l'organe mixte
plante-champignon. Les mycorhizes se définissent comme des associations
durables impliquant des échanges à bénéfices
réciproques, au sein de structures spécifiquement mises en place
par les partenaires de la symbiose au niveau des racines des
végétaux (Smith & Read, 2008). Elles favorisent l'absorption
par les racines des éléments minéraux de la
mycorhizosphère et améliorent ainsi la nutrition de la plupart
des espèces végétales. En retour, le végétal
fournit le carbone nécessaire sous forme de sucres issus de la
photosynthèse, à son partenaire fongique
hétérotrophe (Gagné, 2005). Dans la nature, l'état
de mycorhization est la règle et celui de la nonmycorhization est
l'exception (Strullu, 1991).
Les mycorhizes à arbuscules (MA) et les ECM sont les
principaux types de mycorhizes des écosystèmes forestiers et
cultivés (B%o, 2008). Elles se distinguent par leur structure et leur
morphologie (Tableau 1; Figure 1). Les MA ne sont pas visibles à l'oeil
nu. Elles sont éclaircies et colorées pour révéler
deux structures typiques observées en microscopie photonique : les
vésicules et les arbuscules. Les vésicules sont un lieu de
stockage des lipides nécessaires au métabolisme du champignon
alors que les arbuscules sont le lieu d'échanges entre les deux
partenaires de la symbiose. Les vésicules peuvent être
intraracinaires et extraracinaires. Les arbuscules sont intraracinaires
logées dans l'espace périplasmique de la cellule. Les ECM sont,
en revanche, visibles à l'oeil nu gr%oce à la couleur du manteau
fongique qui recouvre la racine (Figure 1). Les hyphes pénétrent
entre les cellules corticales pour former le réseau de Hartig, lieu
d'échanges bidirectionnels entre les deux partenaires.
Les MA, apparues en même temps que les
végétaux terrestres, concernent plus de 80% des taxons
végétaux. Les champignons sont des symbiotes obligatoires,
ubiquistes et rattachés au phylum des Glomeromycota. Les ECM,
d'apparition plus récente, sont associées à environ 5% des
plantes vasculaires. Les champignons sont des Basidiomycota et des
Ascomycota apparus plusieurs fois indépendamment à
partir des phylums de saprophytes (Hibbett et al., 2000). En
général, les forêts boréales sont dominées
par les arbres à ECM, les forêts tempérées par les
arbres à MA et
ECM, et les forêts tropicales humides par les arbres
à MA. Cependant, on trouve des peuplements d'arbres à ECM
dominants dans les forêts tropicales humides d'Asie du Sud-Est, d'Afrique
et d'Amérique du Sud (Torti et al., 2001 ; McGuire, 2007 ;
Rivière et al., 2007). Ces arbres sont des légumineuses
(Caesalpinioideae) associées également aux MA. Les ECM,
à cause de leur origine saprophyte, participeraient à la
décomposition de la matière organique et seraient donc plus
efficaces que les MA pour mobiliser les nutriments des sols pauvres (Smith
& Read, 2008).
Tableau 1. Les différents types de
mycorhizes
|
MA
|
ECM Ectendo-
mycorhizes
|
Mycorhizes arbuto
·des
|
Mycorhizes monotropo
·des
|
Mycorhizes érico
·des
|
Mycorhizes
orchido
·des
|
|
Champignons Hyphes
|
|
|
|
|
|
|
|
cloisons
|
-
|
+ +
|
+
|
+
|
+
|
+
|
|
Arbuscules
|
+
|
- -
|
-
|
-
|
-
|
-
|
|
Vésicules
|
+ ou -
|
- -
|
-
|
-
|
-
|
-
|
|
Pelotons
|
-
|
- +
|
+
|
+
|
+
|
+
|
|
Manteau
|
-
|
+ + ou -
|
+ ou -
|
+
|
-
|
-
|
|
Réseau de Hartig
|
-
|
+ +
|
+
|
+
|
-
|
-
|
|
Taxonomie
|
Glom.
|
Basidio. Basidio.
|
Basidio.
|
Basidio.
|
Asco.
|
Basidio.
|
|
|
Asco. Asco.
|
|
|
|
Asco.
|
|
|
Zygo.
|
|
|
|
|
|
Plantes hôtes
|
Bryo.
|
Gymno. Gymno.
|
Erica.
|
Monotropa.
|
Erica.
|
Orchida.
|
|
Pterido.
|
Angio. Angio.
|
|
|
Bryo.
|
|
|
Gymno.
|
|
|
|
|
|
|
Angio.
|
|
|
|
|
|
Photosynthèse + + + + ou - - + + ou -
MA= Mycorhizes à arbuscules; ECM= Ectomycorhizes; - =
absent; + = présent; + ou - = présent ou absent; Glom.=
Glomeromycota; Basidio.= Basidiomycota; Asco.= Ascomycota; Zygo. = Zygomycota;
Bryo. = Bryophyte; Pterido. = Pteridophyte; Gymno. = Gymnosperme; Angio. =
Angiosperme; Erica. = Ericaceae; Monotropa. = Monotropaceae; Orchida. =
Orchidaceae. (Smith & Read, 2008).
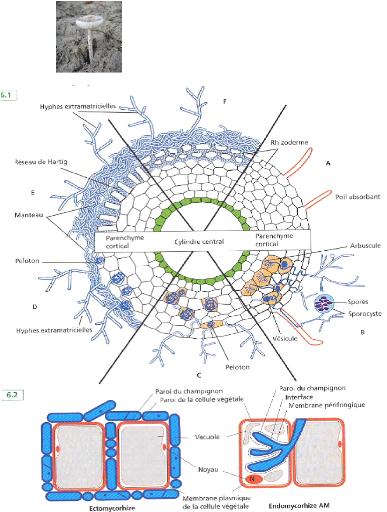
Sporophore
Figure 1. Principaux types d'associations
symbiotiques entre des champignons (en bleu) du sol et des racines de
végétaux; (A) racine sans mycorhize, (B) endomycorhizes à
vésicules et à arbuscules, (C) endomycorhizes à pelotons,
(D) ectendomycorhizes, (E) ectomycorhizes chez les Angiospermes, (F)
ectomycorhizes chez les Gymnospermes (Duhoux & Nicole, 2004).
2. Symbiose ectomycorhizienne
2.1. Diversité des champignons
ectomycorhiziens
Les champignons ectomycorhiziens sont présents dans le
sol sous forme de propagules de conservation et de dissémination (p.ex.
spores, vieilles mycorhizes, cordons mycéliens) (Bâ et
al., 1991). C'est sous ces différentes formes que les champignons
se maintiennent dans le sol à l'état de vie ralentie en
période sèche notamment. Quand les conditions sont favorables en
période humide, les propagules produisent des hyphes qui poussent et se
ramifient pour donner un mycélium capable de coloniser le système
racinaire pour former des ECM. La germination des propagules marque le
début du cycle de développement des Basidiomycota
auxquels appartient la plupart des champignons ectomycorhiziens. Ce cycle
se résume en deux phases principales: une phase végétative
comprenant la formation et le développement du mycélium ou thalle
à partir de la germination des spores, et une phase fructifère
marquée par l'apparition de sporophores épigés ou
hypogés, et la production de spores.
Chez les champignons supérieurs, le sporophore est la
partie visible de l'organisme que l'on appelle couramment Ç champignon
È. Il est constitué de filaments ou d'hyphes groupées en
amas ou mycélium. La présence de sporophores est associée
automatiquement à la présence de mycélium à la base
du pied, mais l'absence de sporophores ne signifie pas nécessairement
l'absence de mycélium dans le sol. Le sporophore, constitué d'un
chapeau et d'un pied, est un organe éphémère oü se
déroule la reproduction sexuée.
Les champignons ectomycorhiziens sont des symbiotes
obligatoires qui bouclent leur cycle de développement en fructifiant
notamment grâce aux ECM qu'ils contractent avec la plante hôte. La
formation de sporophores requiert donc la présence d'ECM alors
qu'à l'inverse on peut observer des ECM sans sporophores correspondants.
En effet, des champignons comme Thelephora et Cenoccocum
forment des ECM avec peu ou pas de fructifications et sont souvent
dominants sur les racines de leurs plantes hôtes (Henkel et al.,
2002 ; Diédhiou et al., 2004). La fructification des
champignons est un processus complexe et coüteux en énergie pour la
plante, qui dépend de l'espèce de champignon, de facteurs
climatiques, de l'âge des peuplements et de traitements sylvicoles (p.ex.
fertilisation, éclaircies). La formation de sporophores, difficile
à obtenir en conditions contrôlées, dépend du
champignon impliqué, de la qualité du substrat, des conditions de
culture (p.ex. humidité, lumière, température) et de la
production de métabolites par la plante hôte.
Hebeloma cylindrosporum en symbiose avec Pinus
pinaster, fructifie in vitro sur un milieu de culture
approprié et dans des conditions de lumière et de
température bien définies (Débaud & Gay, 1987).
Dans la nature, les sporophores épigés sont la
manifestation visible de la présence d'une espèce donnée
en symbiose avec une ou plusieurs plantes hôtes. Dans la plupart des cas,
les sporophores sont d'apparition fugace de quelques heures à quelques
jours, rarement davantage. Leur apparition fluctue d'une année à
une autre selon l'état hydrique du sol et l a périodicité
des cycles biologiques des champignons souvent méconnus. L'inventaire
des sporophores hypogés pose davantage de problèmes que les
épigés dans la mesure oü ils sont souterrains et non
visibles. Ils sont en général sous -évalués dans
les inventaires mycologiques. Pour avoir un inventaire exhaustif de la fonge
d'un biotope donné, il faut compter plusieurs récoltes
étalées sur 7 à 10 ans au moins (Guinberteau &
Courtecuisse, 1997).
Dans les régions boréales et
tempérées, de nombreuses communautés de champignons
ectomycorhiziens ont été décrites sur la base
d'inventaires de sporophores (Ferris et al., 2000). L'avantage de
cette approche réside dans la simplicité d'échantillonnage
avec peu de perturbation du milieu et dans l'identification de l'espèce
fongique à partir de la description du sporophore. Elle a cependant
l'inconvénient de nécessiter plusieurs récoltes dans
l'année, et d'une année à une autre pour prendre en compte
les champignons résupinés peu visibles dans les
écosystèmes forestiers (Erland & Taylor, 1999). Malgré
tout, on estime que la diversité des sporophores de champignons
ectomycorhiziens est comprise entre 10000 et 15000 espèces (Smith &
Read, 2008). Ce chiffre est loin d'être exhaustif car il ne prend pas en
compte la diversité encore peu connue des champignons des régions
tropicales. Les champignons sont le plus souvent des Basidiomycota
(p.ex. Russules, Lactaires, Amanites, Bolets, Girolles) et plus rarement
des Ascomycota (p.ex. Truffes, Cenoccocum). Certains
champignons sont comestibles et à forte valeur ajoutée (p.ex.
Truffes, Matsutake).
2.2. Diversité des ECM
L'inventaire des ECM est une approche qui permet aussi
d'accéder à la composition des communautés fongiques
(Agerer, 1991). Basée uniquement sur des caractères
morphologiques, anatomiques et histologiques, l'identification des ECM reste
très aléatoire. En effet, la couleur du manteau peut changer en
fonction de l'âge de la plante hôte ou de l'environnement (Thoen
& Bâ, 1989; Wurzburger et al., 2001 ; Diédhiou et
al., 2004). Les clés d'identification des ECM
proposées jusqu'ici se sont avérées dans
l'ensemble insuffisantes pour identifier un champignon à partir d'une
ECM à l'exception des ECM typiques du genre Cenococcum (Agerer,
1991).
Les caractères macroscopiques et microscopiques des ECM
s'avèrent peu concluants pour remonter aux sporophores. De plus, un
champignon peut former des ECM dont la morphologie change selon l'hôte ou
quelquefois en fonction de l'âge de l'hôte. Des champignons
différents peuvent former des ECM morphologiquement similaires. Tout
compte fait, l'abondance des sporophores renseigne peu sur la fréquence
des ECM. Des champignons comme Suillus fructifient abondamment et
forment peu d'ECM. Ë l'inverse, Thelephora forment jusqu'à
40 % des ECM en fructifiant peu ou pas (Diédhiou et al.,
2009).
Il est rarement possible d'observer des connexions entre le
mycélium à la base du pied des sporophores et celui des ECM
(Thoen & Bâ, 1989; Rivière et al., 2007). On suppose,
souvent à juste raison, que les sporophores, fructifiant au voisinage
des arbres, sont potentiellement ectomycorhiziens. Encore faut-il
établir un lien formel entre sporophores et ECM car on peut aussi
trouver des champignons parasites ou saprophytes à proximité des
arbres à ECM. C'est le cas de quelques russules saprophytes facultatives
ou parasites (p.ex. Russula parasitica) en Afrique tropicale (Buyck
et al., 1996). Pourtant, le genre Russula est souvent
ectomycorhizien. L'obstacle principal est l'identification de la composante
fongique des ECM, qui peut être surmonté par des méthodes
d'écologie moléculaire (p.ex. amplification et
séquençage de l'ADNr).
2.3. Caractérisation moléculaire de la
diversité fongique
Différentes techniques de biologie moléculaire
(p.ex. PCR-RFLP, séquençage), basées sur l'analyse de
l'ADNr, ont été développées ces dernières
années pour étudier la diversité génétique
des sporophores, identifier la composante fongique des ectomycorhizes et suivre
la persistance des souches fongiques introduites en pépinière et
en plantation (Gardes et al., 1991; Martin et al., 1991 ;
Selosse et al., 1999; Diédhiou et al., 2004;
Rivière et al., 2007; Sanon et al., 2009). La
technique PCR est utilisée pour amplifier différentes parties du
génome en ayant pour cibles l'ADN total, l'ADNr nucléaire ou
l'ADNr mitochondrial. L'ADN total est analysé par des techniques comme
l'AFLP (Ç Amplified Fragment Length Polymorphism È), l'ISSR
(Ç Inter Simple Sequence Repeat È), la RAPD (Ç Random
Amplified Polymorphism DNA È) ou les microsatellites pour accéder
au polymorphisme de larges portions d'ADN (Jacobson et al., 1993 ;
Redecker et al., 2001 ; Zhou et al., 2001). L'ADNr
mitochondrial possède des entités qui sont en plusieurs copies
indépendantes du génome nucléaire et utilisées pour
des études sur la structuration des
communautés de champignons. Le gène de la grande
sous-unité de l'ARNr mitochondrial (<< mtLSU rRNA È) en
particulier le fragment d'environ 450 pb amplifié par les amorces
ML5/ML6, est souvent utilisé en phylogénie des champignons
ectomycorhiziens (Bruns et al., 1998 ; Stendell et
al., 1999 ; Rivière et al., 2007). Bien que cette
région soit peu évolutive au niveau de l'espèce, elle
permet néanmoins de différencier sans ambigu
·té
les familles voire les genres (p.ex. Russula, Amanita, Cantharellus,
Thelephora, Tricholoma). De plus, il existe sur cette région une
base de données de plus d'une centaine de séquences
référencées dans NCBI (
http://www.ncbi.nlm.nih.gov/blast/Blast.cgi).
L'ADNr nucléaire existe en plusieurs copies (50 à 100 copies par
cellule) et se trouve donc déjà préamplifié dans
les extraits d'ADN. Il comprend des régions codantes pour les ARNr (18S,
5.8S, 25S et 5S) très conservées au niveau spécifique et
des espaceurs intergéniques, soit transcrit (ITS, <<Internal
Transcribed Spacer È), soit non transcrit (IGS, <<Intergenic
Spacer È), moins conservés évolutivement. L'espaceur
transcrit ITS (ITS1 et ITS2) conjointement amplifié avec le gène
5.8S, est un bon marqueur spécifique, mais très rarement au sein
de l'espèce. L'espaceur ITS, d'environ 600 à 1000 pb, est
amplifié par des amorces universelles (ITS1/ITS4), spécifiques
aux champignons (p.ex. ITS1f/ITS4) ou spécifiques au Basidiomycota
(p.ex. ITS1f/ITS4b) (White et al., 1990; Gardes et al.,
1991). L'amplification de l'ITS est souvent couplée à
l'étude du polymorphisme de longueurs des fragments de restriction
(RFLP) et son utilisation en identification repose sur le
séquençage nucléotidique. Il existe une importante base de
données sur les séquences des ITS des champignons dans NCBI et
UNITE (
http://unite.ut.ee/). Actuellement,
la plupart des études d'écologie et de taxonomie
moléculaires sur les champignons ectomycorhiziens sont basées sur
l'analyse des régions ITS (Tedersoo et al., 2007 ; Sanon et
al., 2009).
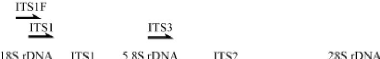

Figure 2. Représentation
schématique de l'ITS (ITS1, ITS2 et 5.8S) de l'unité
répétée de l'ADN ribosomique chez les champignons. Les
flèches représentent les sites de fixation des amorces les plus
utilisées en écologie moléculaire des champignons
(Tedersoo et al., 2007).
2.4. Les ECM en milieu salé
La salinité affecte environ 7% des terres dans le monde
(Munns & Tester, 2008). Elle peut avoir une origine naturelle (p.ex.
degradation de la roche mere, intrusion de lÕeau de mer) ou anthropique
(p.ex. fertilisation, irrigation avec de lÕeau saum%otre). Elle provoque
un double stress hydrique et ionique sur les plantes. Pour faire face à
ce double stress, les plantes, en particulier les halophytes,
développent trois mécanismes dÕadaptation : (i) un
mécanisme lie au stress osmotique qui consiste à ajuster la
pression osmotique des cellules pour assurer leur alimentation en eau
(épictese), (ii) un mécanisme lie au stress ionique qui consiste
à exclure les ions toxiques, (iii) un mécanisme lie au stress
ionique qui consiste à compartimenter les ions toxiques (Munns &
Tester, 2008). Comme les mycorhizes font partie intégrante des plantes,
les champignons font face aux memes contraintes dans les sols sales. Le manteau
fongique des ECM limite le passage des ions toxiques de la solution du sol aux
racines (Tian et al., 2004). Les hyphes résistantes sont en
effet capables de compartimenter les sels dans les vacuoles, préservant
ainsi les voies métaboliques. Elles peuvent aussi abaisser suffisamment
leur potentiel osmotique pour créer un flux dÕeau du sol vers les
racines et ainsi améliorer lÕalimentation en eau des plantes
(Bogeat-Triboulot et al., 2004 ; Bandou et al., 2006 ;
Yamato et al., 2008).
2.5. Importance des réseaux ectomycorhiziens
En general, les champignons ectomycorhiziens sont peu
spécifiques vis-à-vis des plantes hTMtes (Smith & Read,
2008). Autrement dit, ils ont un large spectre dÕhTMtes et peuvent
coloniser plusieurs especes dÕarbres. Par exemple, dans une hetraie, on
peut trouver jusquÕà 150 especes de champignons ectomycorhiziens.
Les champignons établissent un réseau mycélien liant les
racines (réseau ectomycorhizien) de la meme espece ou dÕespeces
différentes (He et al., 2004). Des transferts de
minéraux du sol et de photosynthétats sont alors possibles entre
arbres et plantules via les réseaux ectomycorhiziens
(Simard et al., 1997 ; He et al., 2004). En situation de
stress hydrique, les arbres-meres redistribuent lÕeau aux plantules par
le biais des réseaux ectomycorhiziens (Warren et al., 2008).
Des plantules, liées aux arbres-meres de la meme espece ou
dÕespeces différentes par des réseaux ectomycorhiziens,
peuvent améliorer leur croissance et leur survie (Newbery et
al., 2000 ; Onguene & Kuyper, 2002 ; McGuire, 2007).
Les réseaux ectomycorhiziens constituent aussi une
source dÕinoculum pour la régénération naturelle
par semis ou rejets de souches (Onguene & Kuyper, 2002 ;
Diédhiou et al., 2009). Connell & Lowman (1989) ont
suggéré que la predominance des Dipterocarpaceae dans
les forets humides dÕAsie du Sud-Est serait liée à la
capacité de leurs semis à former des ECM via les
réseaux
ectomycorhiziens préétablis des arbres-meres. La
presence ou lÕabsence dÕECM sur les plantules depend de la
distance à lÕarbre-mere. Ainsi, des plantules qui poussent en
dehors de la rhizosphere des arbres-meres ont des taux de mycorhization et de
survie tres faibles, alors que des plantules sous le houppier ont des taux de
mycorhization et de survie élevés. Ë LÕevidence, les
réseaux ectomycorhiziens influencent fortement la
régénération naturelle et la survie des plantules dans les
écosystèmes forestiers (Booth, 2004 ; McGuire, 2007).
3. Coccoloba uvifera L
3.1. Classification et description botanique
C. uvifera est un arbre de la famille des
Polygonaceae (Tableau 2). Il est couramment appelé Raisinier bord
de mer ou Ç rezinie bod lanmè È en creole et «
Seagrape » en anglais. C'est un arbre pouvant atteindre une dizaine de
metres de hauteur, mais présente généralement des
dimensions plus modestes dans les zones exposées au vent en bordure de
mer. CÕest une plante avec des branches étalées ou
tentaculaire et à racines ligneuses. Ses tiges sont dressées ou
étalées, glabres ou pubescentes distalement. Les feuilles du
C. uvifera sont persistantes, caulinaires, alternées,
pétiolées, ocrées souvent caduques, membraneuses à
coriaces et pouvant mesurer jusqu'à une vingtaine de centimetres de
largeur (Portecop & Petit Le Brun, 2003). Les feuilles présentent
une base cordiforme et sont rondes à transversalement elliptiques, de
longueur equivalente ou inférieure à la largeur (Figure 3).
C. uvifera possède des fleurs unisexuées; certaines plantes
ont uniquement des fleurs m%oles, et dÕautres seulement des fleurs
femelles (Figure 4). Le périanthe est blanc ou blanc verd%otre,
campanulé, glabre. La floraison est étalée de janvier
à mai et les fruits arrivent en maturité en juillet-aofit. Les
fruits de 1 à 2 cm de diamètre sont sphériques à
ovo
·des et disposes en grappe (Figure 3). Ë maturité, ils
prennent une couleur rouge violacé et sont comestibles.
Tableau 2. Classification botanique de
Coccoloba uvifera (Bush et al., 1969)
Classification botanique
Règne Plantae
Sous-règne Tracheobionta
Division Magnoliophyta
Classe Magnoliopsida
Sous-classe Caryophyllidae
Ordre Polygonales
Famille Polygonaceae
Genre Coccoloba
Nom binominal
Coccoloba uvifera
(L.) L., 1759

Figure 3. Fruits verts immatures (A), Fruits
rouge violacé matures (B)

3.2. Origine et aire de distribution
Dans la famille des Polygonaceae, largement
distribuée à lÕéchelle de la planète, le
genre Coccoloba reste exclusivement néo-tropical et regroupe
plus de 400 espèces (De Mélo, 2000). Les plus hauts niveaux de
diversité spécifique à lÕintérieur du
genre Coccoloba ont été décrits en Amazonie avec
44 espèces (De Mélo, 2004). Coccoloba est un genre,
compose dÕespèces tropicales et arboricoles qui
prédominent en Amérique
du Sud, le plus grand nombre étant au Brésil.
Dans la Cara
·be, dix espèces de Coccoloba ont
été répertoriées, dont C. uvifera,
lÕespèce la plus connue. C. uvifera est originaire des
Antilles, de la cTMte est de l'Amérique Centrale et de la cTMte nord-est
de l'Amérique du Sud . Cependant, il a été introdu it dans
le monde entier (p.ex. Asie du Sud-Est, Afrique, Océanie) en plantation
ornementale. C. uvifera occupe naturellement les cordons sableux des
forets littorales du bassin caribéen (Portecop & Petit Le brun,
2003). LÕarbre est réputé resistant aux embruns marins et
à la sécheresse (Figure 5).

Figure 5. Coccoloba uvifera en bordure
de mer sur la plage de Bois Jolan. Limite de la zone de balancement des marees
(fleche)
3.3. Quelques usages de C. uvifera
Les fruits de C. uvifera sont comestibles crues ou
sont utilisés pour fabriquer des produits de gelée, du vin ou du
rhum (EL Little Jr. et al. 1969). La sève rouge obtenue en
découpant l'écorce a été utilisée dans le
commerce pour le tannage et la teinture. Le bois est utilisé comme bois
de feu ou pour la fabrication du charbon de bois. Le bois rouge veiné
est aussi apprécié en ébénisterie (Parrotta, 1994).
En pharmacopée traditionnelle, un extrait aux propriétés
astreignantes est obtenu
par décoction de feuille et d'écorce et
commercialisé sous le nom de « Caribbean kino » ou «
Jamaican kino ». La décoction de feuille et d'écorce est
indiquée pour traiter la dysenterie (Portecop & Petit Le Brun,
2003).
C. uvifera est utilisé comme plante d'ornement
dans les jardins publics en ville, en bordure des route, dans
l'aménagement du littoral notamment comme brise-vent pour fixer les
dunes mobiles ou pour protéger la ponte des tortues marines dans le
Golfe du Mexique, aux Antilles, en Afrique et en Océanie
(Moreno-Casasola & Espejel, 1986 ; Tuxbury & Salmon, 2005).
3.4. C. uvifera et ses symbiotes
C. uvifera est associé à quinze especes
de sporophores ectomycorhiziens récoltés à
l'échelle des Antilles (Tableau 3). Six especes sont présentes en
Guadeloupe. En revanche, on ne dispose pas de données publiées
sur la diversité des ECM de C. uvifera. Or, comme on l'a
mentionné dans la partie introductive, il est indispensable d'explorer
la diversité des ECM pour avoir une bonne image du cortège
ectomycorhizien associé aux arbres.
Scleroderma bermudense , un champignon tres
répandu en forêt littorale, a un effet bénéfique sur
la croissance et l'adaptation des plantules de C. uvifera en situation
de stress salin et hydrique (Bandou et al., 2006).
Tableau 3. Champignons ectomycorhiziens
associés à C. uvifera aux Antilles
|
Familles
|
Espèces
|
Pays
|
Auteurs
|
|
Amanitaceae
|
Amanita cystidiosa
|
Anguilla, Guana (Iles
vierges), Porto Rico
|
(Miller et al., 2000)
|
|
Amantita antillana
|
Martinique, Trinidad
|
(Pegler, 1983)
|
|
Amanita arenicola
|
Porto Rico, Guadeloupe
|
(Miller et al., 2000;
Bandou, 2005)
|
|
Amanita microspora
|
Porto Rico
|
(Miller et al., 2000)
|
|
Cantharellaceae
|
Cantharellus
cinnabarinus
|
Martinique, Guadeloupe
|
(Pegler, 1983 ; Bandou, 2005)
|
|
Cortinariaceae
|
Inocybe littoralis
|
Martinique, Guadeloupe
|
(Pegler, 1983 ; Bandou, 2005)
|
|
Inocybe xerophitica
|
Guadeloupe
|
(Pegler, 1983 ; Bandou, 2005)
|
|
Russulaceae
|
Lactarius coccolobae
|
Anguilla, Guana (Iles
vierges), Porto Rico
|
(Miller et al., 2000)
|
|
Lactarius ferrugineus
|
Martinique, Porto Rico
|
(Pegler, 1983)
|
|
Lactarius nebulosus
|
Martinique, Iles Vierges, Porto-Rico
|
(Pegler, 1983)
|
|
Russula cremeolilacina
|
Iles Vierges, Porto Rico, Guadeloupe
|
(Pegler,1983; Bandou, 2005)
|
|
Sclerodermataceae
|
Scleroderma bermudense
|
Proto-Rico, Guadeloupe
|
(Guzman et al., 2004; Bandou et al., 2006)
|
|
Xerocomoideae
|
Xerocomus
coccolobae
|
Martinique
|
(Pegler, 1983)
|
|
Xerocomus cuneipes
|
Martinique
|
(Pegler, 1983)
|
|
Xerocomus guadelupae
|
Martinique, Dominique, Guadeloupe
|
(Pegler, 1983)
|
MATERIELS ET METHODES
1. Description du site
La plage de Bois Jolan (16°14' Nord 61°23' Ouest ;
altitude <1 m) est localisée environ 3 km du Chef-lieu de la commune
de Saint Anne, au milieu de la côte Sud de Grande-Terre en Guadeloupe.
Cette plage, située sur le littoral sableux, présente une strate
herbacée et une végétation haute. On y trouve une flore
diversifiée constituée d'arbres (p.ex. Thespesia populnea, C.
uvifera, Hippomane mancinella, Cocos nucifera), d'arbustes (p.ex.
Acacia tortuosa, Suriana maritima), d'herbacées (p.ex.
Stachytarpheta jama
·censis, Stylosanthes hamata, Ricinus
communis) et de plantes rampantes (p.ex. Ipomoea pes-capreae, Vigna
luteola, Stenotaphrum secundatum). C. uvifera et T.
populnea dominent la strate arborescente du littoral sableux. C.
uvifera est la seule espèce qui possède des ECM. Sous le
houppier de cet arbre, prolifère une importante
régénération naturelle par semis qui pousse sur sol
sableux, calcaire et pauvre en matière organique (Figure 6). Les
précipitations annuelles sont comprises entre 1000 et 1250 mm. Le site
est l'objet d'une forte pression anthropique. Le balayage quotidien de la plage
par les employés communaux et le piétinement des plantules par
les baigneurs empêchent la végétation de
régénérer.

Le choix du site était justifié par l'importance
des peuplements à C. uvifera (247 arbres) relativement bien
préservés par endroits. Le coté Est du site est beaucoup
plus préservé que le coté Ouest très
anthropisé. Dans la partie préservée du site, la zone
d'échantillonnage des sporophores et des ECM était située
le long d'un transect nord-sud (30 m de long et 15 m de large). Les figures 7
(vue de profil) et 8 (vue de face) sont des représentations
schématiques de l'allure et de la position des Coccoloba
échantillonnés sur le transect dont la composition du sol
est relativement homogène (sable blanc, calcaire, pauvre en
matière organique). Le gradient de salinité était compris
entre 15% et 2%. Chaque point est la moyenne de 5 mesures effectuées
avec un salinomètre (Portable refractometer) sous le houppier de chaque
arbre dans les vingt premiers cm du sol lors de l'échantillonnage des
racines en période pluvieuse. Les individus (numérotés 1,
4 et 6), situés à 1-3 m au-delà de la zone de balancement
des marées, sont de petites tailles (1 à 2 m de haut), rabougris
et multicaules. On n'a quasiment pas observé de plantules en
régénération sous le houppier de ces arbres exposés
au sel (15%), aux embruns marins et au vent. En revanche, quelques
mètres en aval de la zone salée, les individus
(numérotés 3, 5 et 2) sont de grands arbres (6 à 10 m de
haut), multicaules avec un houppier bien développé sous lequel
poussent des plantules
de tous %oges sur du
sable peu salé (2%).
3
2
5
1 4 6 Altitude
Mer
< 1m
Salinit é (ä)
15 2

30 m
Figure 7. Représentation
schématique (vue de profil) des six arbres-mères de Coccoloba
uvifera échantillonnés le long d'un gradient de
salinité sur la plage de Bois Jolan.
15 m

15
Salinité (ä)
_
2
5
6
1 4
5m
4m 6m
8m
3
8m
8m
2
30 m
Mer
Figure 8. Représentation
schématique (vue de face) de la position des six arbres-mères de
Coccoloba uvifera échantillonnés le long d'un gradient
de salinité sur la plage de Bois Jolan.
2. Plan d'échantillonnage
Nous avons échantillonné six arbres-mères
et leurs plantules le long du gradi ent de salinité en période
pluvieuse (janvier et février 2009). Les arbres-mères ont
été inventoriés et cartographiés sur le transect
(Figure 7 ). Dix plantules, à peu près du même %oge avec
deux cotylédons plus une feuille (Figure 6), ont été
échantillonnées sous le houppier de chaque arbre-mère,
à une distance de 1 m autour du tronc. Dix carottages de sol (15 cm de
diamètre et 20 cm de profondeur) ont été également
réalisés autour du tronc pour échantillonner des racines
de chaque arbre-mère. Les échantillons ont été
ensachés séparément, transportés et
conservés au réfrigérateur à 4°C en
laboratoire.
Parallèlement, des récoltes de sporophores ont
été réalisées sous le houppier des arbres- adultes
une fois par semaine pendant 7 mois (aoüt 2008 à février
2009) le long du transect. Les sporophores ont été
décrits, photographiés, séchés, identifiés,
dénombrés au laboratoire et mis en herbier à
l'Université de Lille (Laboratoire du Pr. Régis Courtecuisse).
3. Morphotypage, fréquence et conservation des
ECM
En laboratoire, le système racinaire de chaque
plantule a été soigneusement débarrassé de sa motte
de terre à l'eau courante. Les racines latérales ont
été séparées du pivot et observées dans de
l'eau courante sous la loupe binoculaire et au microscope optique. Les ECM ou
morphotypes (MT) ectomycorhiziens ont été
différenciées par des caractères macroscopiques et
microscopiques: texture et couleur du manteau fongique, présence d'anses
d'anastomoses, de cordons mycéliens et de sclérotes. Les nombres
d'apex mycorhizés et non mycorhizés ont été
comptés sur les racines. On a déduit un pourcentage de
mycorhization (nombre de racines mycorhizées/nombre total de racines
observées x 100) pour chaque morphotype.
Les racines des arbres -mères ont été
soigneusement séparées du sol à l'eau courante, et
observées dans les mêmes conditions que pour les plantules.
Les MT et des morceaux de sporophores ont été
conservés dans du CTAB (bromure
d'hexadécyltriméthylammonium) (cf. annexe) pour les études
moléculaires. Les morphotypes ectomycorhiziens ont été
étiquetés P pour Plantule et AM pour Arbre-Mère. Les
morceaux de sporophores ont été étiquetés C pour
Carpophore.
4. Extraction de l'ADN
L'ADN total a été extrait des ECM ou d'un
sporophore à l'aide du kit de purification d'ADN Dneasy de QIAGEN dans
les conditions décrites par le fournisseur. L'extraction a
été réalisée à partir d'une ECM ou d'un
morceau de sporophore. L'extraction comprend plusieurs étapes:
- Prérégler une étuve à 65°C, y
mettre les 2 flacons de solution d'élution AE;
- Broyer les échantillons à sec avec une
pincée de sable de Fontainebleau à l'aide d'un piston en
plastique dans un tube à microcentrifuger (2 ml);
- Ajouter 400ul de tampon de lyse (AP1) et 4 ul de RNase (100
mg/ml), broyer et vortexer vigoureusement (pour éliminer
éventuellement la masse de tissu et avoir une suspension liquide) ;
- Incuber 10 min à 65°C puis faire 2 à 3
inversions des tubes. C'est l'étape de la lyse des cellules;
- Ajouter 130 ul de tampon de déprotéinisation
(AP2), vortexer et incuber 5min dans la glace. C'est l'étape de la
précipitation des solvants, des protéines et des
polysaccharides;
- Centrifuger 5 min à 14000 rpm;
- Transférer le surnageant dans une colonne de filtration
QIAshredder et centrifuger 2 min à 1400 0 rpm;
- Transférer soigneusement le filtrat dans un nouveau tube
eppendorf de 1,5 ml sans le culot. Noter le volume de filtrat;
- Ajouter 0,5 volume de tampon AP3 et 1 volume d'éthanol
absolu. Mélanger en pipettant ; - Déposer 650 ul de
mélange dans une colonne Dneasy ;
- Centrifuger 1min à 8000 rpm. Jeter le filtrat et
répéter avec ce qui reste de mélange; - Placer la colonne
Dneasy dans un nouveau tube;
- Ajouter 500 ul de tampon de lavage (AW), centrifuger 1min
à 8000 rpm et jeter le filtrat;
- Ajouter à nouveau 500 ul de tampon de lavage (AW),
centrifuger 2 min à 14000 rpm et jeter le filtrat;
- Centrifuger 30 sec à 14000 rpm la colonne à
vide disposé dans un nouveau tube pour bien sécher la membrane et
jeter le filtrat+tube. La colonne doit être bien sèche avant de
procéder à l'élution de l'ADN;
- Transférer la colonne Dneasy dans un tube eppendorf de
1,5 ml;
- Ajouter 50 ul de Tampon AE préchauffé à
65°C dans la colonne. Déposer le tampon au milieu de la colonne;
- Laisser incuber le tampon AE pendant 5 min à
température ambiante;
- Centrifuger 1min à 8000 rpm;
- Répéter une fois les étapes 17, 18 et 19
dans un nouveau eppendorf (Ne pas faire pour les ECM); - Mélanger ou non
les 2 filtrats;
- Conserver l'ADN à -20°C.
5. Amplification de l'ITS par la réaction de
polymérase en cha»ne
Le protocole utilisé pour l'amplification de l'ITS est
celui du kit PCR Master Mix PROMEGA recommandé par le fournisseur. Pour
chacun des échantillons, le volume réactionnel final est de 25 ul
et comprend 9,5 ul de Nuclease-Free water, 12,5 ul de PCR master Mix (cf.
annexe), 1 ul de chaque amorce ITS1 (5'-TCC-GTA-GGT-GAA-CCT-GCG-G-3') et ITS4
(5'- TCC-TCC-GCT-TAT-TGA-TAT-GC-3'), et 1 ul d'extrait d'ADN.
La réaction PCR a été effectuée
dans une mini thermocycleur Applied Biosystems (GeneAmp PCR system 2700,
version 2.07) dans les conditions suivantes: 95°C pendant 5 min
(étape de dénaturation), 35 cycles de dénaturation
à 94°C pendant 30s, 55°C pendant 30s (étape de
l'hybridation), 72°C pendant 1min 30s (étape de
polymérisation), et 72°C pendant 7 min (polymérisation
finale). Chaque série d'amplification comprend un témoin
négatif sans ADN fongique afin de détecter d'éventuels
contaminants dans les tampons et réactifs.
Ë la fin de la réaction, 5 ul d'amplifiat addi
tionnés à 6 ul d'un tampon de charge ont été
déposés sur un gel horizontal d'agarose à 2% contenant 2
gouttes de bromure d'éthidium (BET) (0,625 mg/ml). Cinq ul de marqueur
de taille moléculaire 1Kb ÇSmart LadderÈ ont
été déposés dans un puit. La migration s'effectue
dans une cuve d'électrophorèse Max Fill (Modèle HU10, Made
in UK) contenant du tampon TAE 1x (cf. annexe) sous une tension de 90 volts
pendant 1h 30 min.
Le bromure d'éthydium en s'intercalant entre les bases
de l'ADN permet de visualiser l'ADN sous une lampe à UV d'une station
d'imagerie (ChemiDoc BIO-RAD Laboratories, Segrate, Milan). Des photos
numériques ont été prises au moyen de la caméra
optique reliée à un ordinateur muni du logiciel Quantity One de
BIO-RAD.
6. Polymorphisme de longueur des fragments de restriction
de l'ITS
L'analyse du polymorphisme de longueur des fragments de
restriction (RFLP) s'effectue à partir des produits purifiés
obtenus après amplification par PCR. Elle consiste en une digestion des
amplifiats par des enzymes de restriction pour obtenir des profils
électrophorétiques.
Pour un volume réactionnel de 20 ul, 15 ul d'amplifiat
sont additionnés à 0,5 ul d'enzyme (HinfI), 2 ul d'un
tampon 10 X et 2,5 ul d'eau ultrapure dans des tubes eppendorf de 1,5 ml. Le
mélange réactionnel a été mis à incuber
à 37° C pendant 2 h.
La totalité de la digestion, additionnée
à 3 ul de bleu de charge, est déposée dans un puit d'un
gel horizontal d'agarose de 3% contenant 2 gouttes de bromure
d'éthidium. Un mélange d'un ul de marqueur de taille (100 pb DNA
ladder PROMEGA, Madison, USA) et d'un ul de bleu PROMEGA a été
déposé dans un puit. La migration des fragments de restriction
dans le gel s'effectue sous une intensité de 35 mA et sous une tension
de 90 volts pendant 1 heure dans une
cuve d'électrophorèse contenant du tampon TAE 1X.
Après migration, les gels sont visualisés et photographiés
dans les mêmes conditions que précédemment.
On a déterminé la fréquence des profils de
restriction ou ribotypes (nombre de ribotypes/nombre total de ribotypes
observés x 100).
7. Séquençage de l'ITS
Le séquençage de l'ITS d'un représentant de
chaque ribotype a été réalisé au LSTM- UMR 1 1 3
à Montpellier.
Les séquences brutes que nous avons reçues de
Montpellier ont été traitées avec le logiciel Sequence
Navigator. Les électrophorégrammes des séquences
<<reverse>> et des séquences << front>> ont
été corrigés. Les séquences (front et reverse) ont
été ensuite alignées avec le logiciel Autoassembler pour
obtenir des séquences consensus. Un Blast a été
effectué sur le web pour comparer les séquences obtenues avec des
séquences de référence présentes sur NCBI (
http://www.ncbi.nlm.nih.gov/blast/Blast.cgi).
On a pu ainsi identifier la composante fongique des ECM au niveau de la famille
voire du genre.
Des séquences de champignons connus provenant de la
base de données de GenBank sont choisies comme séquences de
référence pour la construction des relations
phylogénétiques. Ces séquences de référence
associées aux séquences obtenues sont alignées en
utilisant le logiciel ClustalX ver.2.0.10 (Thompson et al. 1997), puis
l'alignement est optimisé manuellement avec le logiciel GeneDoc
(Nicholas et al. 1997). L'arbre est construit par la méthode du
Neighor-Joining en utilisant le logiciel de ClustalX ver.2.0.10, et l'analyse
de confiance des <<bootstrap>> est réalisée avec 100
réplications (Felsenstein, 1985). Deux séquences (Sebacina
incrustans et Sebacina epigaea) sont utilisées comme
<< outgroup >> pour enraciner l'arbre.
8. Analyse statistique
Les données ont été transformées
avec la fonction Arcsin vx et traitées par la procédure de
l'analyse de variance à un facteur. Les moyennes ont été
comparées à l'aide du test de Fisher-LSD (p<0,05) (Gagnon
et al., 1989).
RÉSULTATS ET DISCUSSION
1. Diversite des sporophores
Au cours de la période de récolte (7 mois), nous
avons identifié six espèces de champignons ectomycorhiziens :
Inocybe littoralis, Inocybe xerophytica, Russula
cremeolilacina, S. bermudense, Cantharellus cinnabarinus
et Amanita arenicola. Les six champignons avaient déjà
été répertoriés sous C. uvifera sur
différentes plages en Guadeloupe (Bandou, 2005). Nous avons
collecté 194 sporophores des six espèces fructifiant
sous le houppier des 3 arbres sur sol peu salé (2%0) et 30 sporophores
d'une espèce (S. bermudense) sous le houppier des 3 arbres en
milieu salé (15%0) sur le transect. Parmi les 194 sporophores
récoltés, on a trouvé 27 I. littoralis, 28 I.
xerophytica, 32 R. cremeolilacina, 19 S. bermudense,
51 C. cinnabarinus et 37 A. arenicola. C.
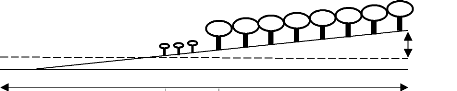
cinnabarinus appara»t le plus abondant et S. bermudense le
moins représenté en milieu non salé (Figures 9A, 9B et
10). Par contre, on a trouvé que des sporophores de S.
bermudense sous le houppier des 3 arbres poussant en milieu
salé.

A B
+
+
*
*
*
Figure 9. (A) Sporophores de Scleroderma
bermudense matures ouvertes en &toile liberant la sporee (*) et
immatures fermees (+). (B) Sporophores de Cantharellus
cinnabarinus.
Les sporophores étaient inégalement
distribués le long du gradient de salinité. S. bermudense
serait plus tolérant au sel que les cinq autres espèces.
L'aptitude de ce champignon à résister au sel a été
démontrée en particulier lorsqu'il est en symbiose avec C.
uvifera (Bandou et al., 2006). La faible diversité des
sporophores sous C. uvifera pourrait s'expliquer en partie par les
conditions stressantes du milieu. En effet, le spectre des champignons
colonisant C. uvifera est plus étroit que celui de C.
pubescens et C. swartzi, deux espèces de
Coccoloba distribuées à l'intérieur des terres en
Martinique (Bessard et al., 2008).
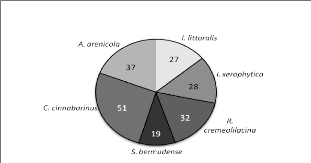
Figure 10. Nombre de sporophores
récoltés sous Coccoloba uvifera pendant 7 mois en milieu
peu salé.
2. Diversité des morphotypes
Afin de déterminer la diversité des ECM, nous
avons inventorié les MT ectomycorhiziens sur les racines des six
arbres-mères et de leurs plantules le long du gradient de
salinité. L'inventaire avait porté sur 3537 et 5366 apex
racinaires examinés respectivement sur des arbres-mères et des
plantules et en milieu peu salé. En milieu salé, l'inventaire
avait porté sur 2668 apex racinaires examinés sur trois arbres vu
qu'il n'y avait pas de plantules.
Sur 3537 apex racinaires d'arbres-mères en milieu peu
salé, 57% ont été mycorhizés alors que chez les
plantules, le taux de mycorhization était à peu près le
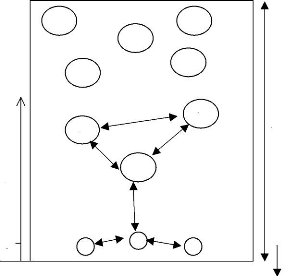
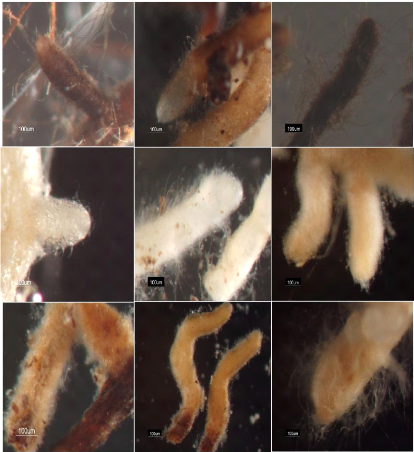
même pour 5366 apex comptés. Au total, 9 MT ( mcgs, bcc, bff, bcf,
jpf, bp, bfp, jpp et bbl), répertoriés sur la base de quelques
caractères macroscopiques et microscopiques, étaient
différents par la texture et la couleur du manteau, la présence
d'anses d'anastomose, de cordons mycéliens et de sclérotes
(Tableau 4; Figure 11). Sur les 9 MT répertoriés, 3 (bcc, bfp et
jpp) ont été présents sur les plantules et les 6 autres
(mcgs, bff, bcf, jpf, bp et bbl) ont été communs aux
arbres-mères et plantules (Figure 12). Globalement, la fréquence
des MT communs a été à peu près la même sur
les arbres -mères et leurs plantules (Figure 12). Elle a
été supérieure à celle des 3 MT présents
uniquement sur les plantules. Les arbres-mères et leurs plantules
partagent un cortège ectomycorhizien commun. Ces résultats
suggèrent l'existence de réseaux ectomycorhiziens potentiels
entre arbres-mères et plantules.
Tableau 4. Description des neuf morphotypes
ectomycorhiziens sur quelques caractères macroscopiques et
microscopiques.
Morphotype Couleur, texture Anse d'anastomose Cordon
mycélien Sclérote
mcgs Marron clair, garni de soies - + -
bcc Blanc crème, cireux + + -
bff Brun foncé, feutré + + -
bcf Brun clair, feutré + + -
jpf Jaune p%ole, feutré - - -
bp Blanc, poilu + - -
bfp Brun foncé, poilu + + -
jpp Jaune p%ole, poilu + - -
bbl Blanc brillant, lisse + + +
(+), présence ; (-), absence
a) b) c)
d)
g)
h)
e)
f
i)
Figure 11. Morphotypes des
arbres-mères et de leurs plantules en milieu peu salé. (a), bff ;
(b), bcf ; (c), bfp; (d), bbl; (e), bp; (f), bcc; (g), mcgs; (h), jp ; (i) jpp
(voir tableau 4 pour les abréviations).
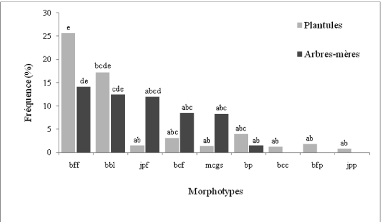
Figure 12. Fréquence des morphotypes des
arbres -mères et leurs plantules en milieu peu salé. Les valeurs
assorties d'une même lettre ne sont pas significativement
différentes au seuil de 5%.
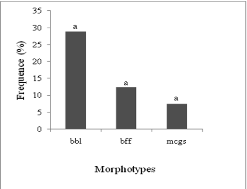
En milieu salé, on n'a pas observé de plantules
au pied des arbres. Ceci suggère que les plantules seraient sensibles au
sel. Seuls trois MT (bff, bbl et mgcs) ont été présents le
long du gradient de salinité, ce qui laisse penser que les champignons
impliqués seraient tolérants au sel (Figures 12 et 13). Comme
pour les sporophores, la diversité des MT est affectée par le
sel.
Le nombre de sporophores et de MT n'étaient pas le
même. On a trouvé moins de sporophores que de MT le long du
transect. De plus, il n'a pas été possible d'identifier les MT et
de les relier au mycélium de la base des sporophores. Compte tenu des
limites du morphotypage des ECM, l'utilisation d'outils moléculaires
nous a paru nécessaire pour caractériser les sporophores et les
MT (Diédhiou et al., 2004 ; Diédhiou et al.,
2009).
3. Caractérisation moléculaire des MT et
des sporophores
L'utilisation d'outils moléculaires (PCR -RFLP et
séquencage) s'était avérée indispensable pour
relier, d'une part les MT aux sporophores, et, d'autre part, identifier les
sporophores aux MT.
Ë partir de 170 échantillons d'ECM
collectées au niveau des arbres-mères et de leurs plantules le
long du transect, l'amplification de l'ITS n'a été possible que
pour 145 d'entre eux. Les tailles des régions ITS amplifiées sont
comprises entre 600 et 1183 pb et s'avèrent peu variables pour
discriminer les champignons (Figure 14).
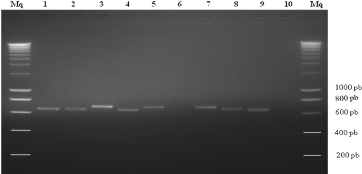
Figure 14. Produits de l'amplification par
PCR de la région ITS de l'ADNr de morphotypes. Puits: 1, 4 et 9= bcf ; 2
et 8= bff; 3= bbl ; 5= bcc; 6= pas d'amplifiat ; 7= bp; 10= témoin
négatif; Mq, marqueur de poids moléculaire (1kb).
Parmi les enzymes de restriction préalablement
testées (TaqI, HaeIII et HinfI), l'enzyme
Hinf I a été retenue parce qu'elle a
généré plus de bandes de restriction (résultats non
montrés). La digestion des amplifiats des différents MT par
HinfI a généré entre un et trois fragments de
restriction de tailles différentes (Figure 15). On a ainsi
caractérisé 6 ribotypes (A, B, C, D, E et F) pour 9 MT
décrits (Tableau 5). La diversité des MT ne correspond donc pas
à celle des ribotypes.
Parmi les 6 ribotypes, 4 (A, B, C et D) ont
présenté des profils RFLP identiques aux 4 espèces de
sporophores récoltées. Les ribotypes A, B, C et D correspondent
respectivement à S. bermudense, R. cremeolilacina,
C. cinnabarinus et I. xerophytica. L'identification
moléculaire, basée sur la comparaison des profils RFLP, a
été confirmée par le séquençage de l'ITS des
mêmes échantillons. Par contre, les ribotypes E et F n'ont pas
été reliés aux sporophores. Ces deux ribotypes ont
été, cependant, identifiés à deux espèces
de Tomentella par séquençage de l'ITS. Ce
résultat n'est pas surprenant car on sait par ailleurs que les
Tomentella fructifient rarement (Diédhiou et al., 2004).
On n'a pas trouvé de MT correspondant aux champignons I.
littoralis et A. arenicola dont les sporophores ont
été pourtant récoltés le long du gradient. Il est
possible que ces deux champignons aient formé très peu d'ECM. Il
existe en effet des champignons comme Suillus qui fructifient
abondamment mais forment très peu d'ECM (Smith & Read, 2008).
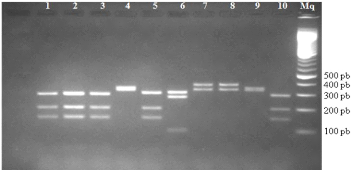
Figure 15. Produits de digestion par
HinfI de la région ITS de l'ADNr des morphotypes. Puits : 1, 2,
3, 5 et 10= ribotype E ; 4 et 9= ribotype F ; 6= ribotype A ; 7 et 8= ribotype
D ; Mq, marqueur de poids moléculaire (100 pb).
Il appara»t que les MT bcc, bp et bcf correspondent
à un mélange de ribotypes. Par exemple, le MT bp est un
mélange de 4 ribotypes. Ë l'inverse, un même ribotype peut
correspondre à des MT différents. C'est le cas notamment du
ribotype B trouvé chez 4 MT (bcc, mgcs, jpf et bp). En revanche, les MT
bbl et jpp ont été, dans tous les cas, rattachés
respectivement au ribotype A de S. bermudense et au ribotype C de
C. cinnabarinus. Cette étude montre les limites du morphotypage
pour identifier sans ambigu
·té la composante fongique des ECM
et pour évaluer la fréquence des champignons observés sur
les racines. Il est en effet bien connu que la couleur du manteau fongique peut
changer en fonction de l'âge des MT, de la plante hTMte et de
l'environnement (Diédhiou et al., 2004 ; Pestana Nieto &
Santolamazza Carbone, 2009 ; Diédhiou et al., 2009). Le cas
des
Tomentella est bien documenté à ce
propos. Ces champ ignons ont la particularité de former des MT brun
clair qui deviennent brun foncé au cours du vieillissement des racines
de la plante hôte (B%o et al., 1991 ; Diédhiou
et al., 2004).
Tableau 5. Polymorphisme de longueur des
fragments de restriction de la région ITS (digestion par HinfI)
des sporophores et des morphotypes ectomycorhiziens d'arbres-mères et de
plantules de Coccoloba uvifera. (*) E= Tomentella sp2 ; F=
Tomentella sp1.
|
Morphotype/ Sporophore
|
Taille
de l'I TS (pb)
|
Taille des fragments de restriction de l'ITS
(pb)
|
Ribotype
|
|
bbl
|
689
|
100, 270, 311
|
A
|
|
bcc
|
689
|
100, 270, 311
|
A
|
|
bcc
|
718
|
313, 392
|
B
|
|
bcc
|
738
|
346, 392
|
D
|
|
mcgs
|
718
|
315, 392
|
B
|
|
jpf
|
718
|
315, 392
|
B
|
|
jpp
|
1183
|
217, 433, 533
|
C
|
|
bp
|
689
|
100, 270, 311
|
A
|
|
bp
|
718
|
315, 392
|
B
|
|
bp
|
738
|
346, 392
|
D
|
|
bp
|
633
|
346
|
E*
|
|
bcf
|
633
|
346
|
E
|
|
bcf
|
655
|
165, 211, 308
|
F*
|
|
bfp
|
633
|
346
|
E
|
|
bff
|
655
|
165, 211, 308
|
F
|
|
S. bermudense
|
689
|
100, 270, 311
|
A
|
|
R. cremeolilacina
|
718
|
313, 392
|
B
|
|
C. cinnabarinus
|
1183
|
217, 433, 533
|
C
|
|
I. xerophytica
|
738
|
346, 392
|
D
|
|
I. littoralis
|
700
|
300, 400
|
G
|
|
A. arenicola
|
600
|
300
|
H
|
Le calcul de la fréquence des MT (Figures 12 et 13)
reste approximatif pour certains MT (bcc, bp et bcf) constitués
dÕun mélange de ribotypes. CÕest pourquoi il nous a paru
intéressant dÕévaluer la fréquence de 6 ribotypes
(Figure 16 et 17) pour avoir une estimation plus précise des
différents champignons sur les racines. Les fréquences des
ribotypes A, E et F sont globalement supérieures à celles des
ribotypes B, C et D quel que soit le stade de développement de
Coccoloba (Figure 16). Ces résultats sont en accord avec les
fréquences des MT (Figure 13). S. bermudense,
Tomentella sp1 et Tomentella sp2 sont majoritairement
presents sur les racines des arbres-mères et leurs plantules en milieu
peu salé. Ces trois champignons pourraient constituer des réseaux
ectomycorhiziens potentiels reliant les arbres-mères et leurs
plantules.
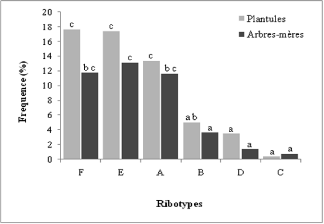
Figure 16. Frequence des six ribotypes (F, E, A,
B, D et C) des arbres-meres et de leurs plantules en milieu peu sale.
En milieu sale, il y a moins de ribotypes quÕen milieu
peu sale. Le ribotype A, rattaché à S. bermudense, a
été plus frequent que les ribotypes F et B rattachés
respectivement à Tomentella sp1 et R. cremeolilacina
(Figure 17). On a vu aussi que parmi les 3 ribotypes, seul S.
bermudense avait fructifié en milieu sale. Le cycle de reproduction
sexuée de ce champignon serait adapté à la
salinité.
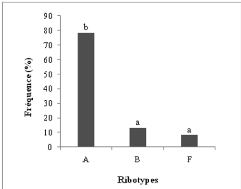
Figure 17. Fréquence de trois ribotypes
(A, B et F) des arbres en milieu salé.
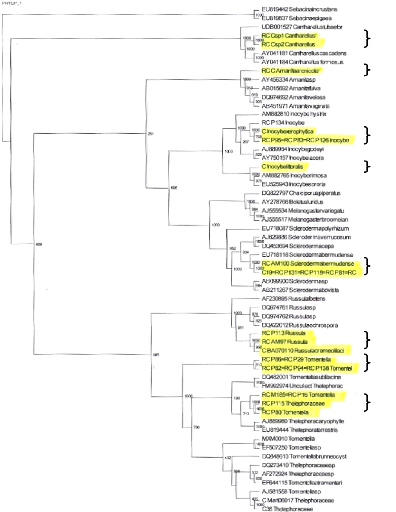
Nous avons confirmé, au moins au niveau du genre,
l'identification morphologique des sporophores et identifié la
composante fongique des MT par le séquençage des régions
ITS de l'ADNr nucléaire (Figure 18). L'analyse des séquences de
l'ITS nous a permis aussi de confirmer l'analyse RFLP et de relier des MT aux
sporophores. Sur l'arbre phylogénétique, on a distingué 8
groupes fongiques: C. cinnab arinus, A. arenicola, I. xerophytica, I.
littoralis, S. bermudense, R. cremeolilacina, Tomentella sp1 et
Tomentella sp2. Parmi les huit groupes, deux (A. arenicola et
I. littoralis) ne présentent pas de MT, quatre (C.
cinnabarinus, I. xerophytica, S. bermudense et R. cremeolilacina)
sont reliés à des MT, et deux (Tomentella sp1 et
Tomentella sp2) ne présentent pas de sporophores. Il y a une
forte homologie entre les séquences de chaque groupe
phylogénétique. Par exemple, les séquences des MT (AM100,
P131, P118 et P81) montrent une forte homologie (100%) avec la séquence
du sporophore (C19) de S. bermudense (Figure 18). Tout compte fait, la
diversité des sporophores ne reflète pas la diversité des
MT comme c'est le cas dans la plupart des régions tropicales
(Rivière et al., 2007 ; Sanon et al., 2009 ;
Diédhiou et al., 2009). La composition physico-chimique du sol
étant relativement homogène le long du gradient, il est fort
probable que la salinité participe en partie à la structuration
des communautés de champignons ectomycorhiziens de C. uvifera.
En effet, sur 8 groupes de champignons inventoriés, seules 3
espèces (S. bermudense, Tomentella sp1 et R.
cremelilacina) ont été présentes à
proximité du bord de mer et pourraient contribuer à l'adaptation
de Coccoloba à la salinité. Yamato et al.
(2008) ont montré à cet égard le rTMle important des
MA dans la structuration des herbacées et des plantes rampantes en
bordure de mer.
I
II
V
VI
VII
VIII
III
IV
Figure 18. Arbre phylogénétique
basé sur le séquencage de l'ITS des huit taxons fongiques (I
à VIII surlignés en jaune) de C. uvifera, comparé
à des séquences de référence dans GenBank (en
noir). Les valeurs de Ç bootstrap È sont indiquées au
niveau des branches.
CONCLUSIONS ET PERSPECTIVES
Ce travail a permis de révéler un gradient de
salinité sur la plage de Bois Jolan, qui semble avoir un impact
négatif sur la croissance de C. uvifera. Ë
proximité de l'eau de mer, les arbres sont de petites tailles et
rabougris alors que les arbres éloignés sont de plus grandes
tailles avec un houppier bien développé sous lequel prolifere une
importante régénération à partir de semis.
On a également noté une diversité de
champignons ectomycorhiziens inféodés à C.
uvifera le long du gradient de salinité. Cette diversité de
champignons semble structurée par la salinité. En effet, 6
especes de sporophores (A. arenicola, I. littoralis, C.
cinnabarinus, I. xerophytica, S. bermudense et R. cremeolilacina)
ont été identifiés en milieu peu salé et seulement
une espece (S. bermudense) en milieu salé. De même, neuf
MT ont été répertoriés en milieu peu salé
dont trois en milieu salé. L'étude de la diversité
génétique des champignons à l'aide d'outils
moléculaires (PCR- RFLP et séquençage de l'ITS) a permis
de relier des sporophores aux MT et de montrer que des arbres-meres et leurs
plantules partagent un meme cortège ectomycorhizien commun. Quatre
sporophores (C. cinnabarinus, I. xerophytica, S. bermudense et R.
cremeolilacina) ont été reliés à des MT, 2
sporophores (A. arenicola et I. littoralis) sont absents des
racines de C. uvifera et 2 MT identifiés (Tomentella
sp1 et Tomentella sp2) ne génerent pas de sporophores. La
diversité des sporophores ne reflete donc pas celle des MT. Notre
étude montre qu'il convient d'inventorier systématiquement les
sporophores et les ECM pour avoir une bonne image de la diversité des
champignons ectomycorhiziens de C. uvifera.
Les arbres-meres et leurs plantules ont en commun trois
champignons ectomycorhiziens (S. bermudense, Tomentella sp1 et
Tomentella sp2) majoritairement présents sur les racines
échantillonnées le long du gradient de salinité. Ces trois
champignons constituent des réseaux ectomycorhiziens potentiels reliant
les arbres-meres et leurs plantules en milieu peu salé. Une hypothese
que nous devrons démontrer est que certains champignons ectomycorhiziens
permettraient aux arbres-meres « d'élever » leurs plantules en
leur fournissant de l'eau et des nutriments (C en particulier) par le biais des
réseaux ectomycorhiziens communs. De plus, ces réseaux
fourniraient de l'inoculum nécessaire à l'établissement et
à la survie des plantules. On pourrait considérer la forêt
littorale à C. uvifera comme une « nursery » oti les
plantules profiteraient des arbres-meres via les réseaux
ectomycorhiziens commus.
BIBLIOGRAPHIE
Agerer R. (1991). Characterization of
ectomycorrhiza. In Norris JR, Read DJ, Varma AK (eds): Techniques for the study
of mycorrhiza. Methods Microbiology 23: 25-73
B%o A .M., Garbaye J & Dexheimer J. (1991).
Influence of fungal propagules during the early stade of the time
sequence of the ectomycorrhizal colonization of Afzelia Africana Sm.
seedlings. Canadian Journal of Botany 66 : 2442-2447.
B%o A.M., Diédhiou A.G., Prin Y., Galiana A.
& Duponnois R. (2009). Management of ectomycorrhizal symbionts
associated to useful exotic tree species to improve reforestation programmes in
tropical Africa. Annals of Forest Science (submitted).
B%o A.M. (2008). Occurrence and importance of
arbuscular mycorrhizas in the wetland tree Pterocarpus officinalis
Jacq. Invited speaker at the Workshop «Mycorrhizas in tropical
forests», September 22-25, Universidad Téchnica Particular
de Loja, Ecuador.
B%o A.M., Diédhiou A.G., Diabaté M.,
Duponnois R., Bena G & Dreyfus B. (2008). Diversity and role of
ectomycorrhizal symbiosis in African tropical forests. Invited speaker at the
Satellite Workshop on Mycorrhiza, 13th Congress of the African
Association for Biological Nitrogen Fixation, December 15-18, Hammamet,
Tunisia.
Bandou E. (2005). Diversité et
fonctionnement des symbioses ectomycorhiziennes de Coccoloba uvifera
(L) L. en situation de stress salin et hydrique. DEA, Environnement
tropical et valorisation de la biodiversité, Université des
Antilles et de la Guyane, 36 p.
Bandou E., Lebailly F., Muller F., Dulormne M.,
Toribio A., Chabrol J., Courtecuisse R., Plenchette C., Prin Y, Duponnois R.,
Thiao M., Sylla S., Dreyfus B. & B%o A.M. (2006). The
ectomycorrhizal fungus Scleroderma bermudense alleviates salt stress
in seagrape (Coccoloba uvifera L.) seedlings. Mycorrhiza 16 :
559-565.
Bessard S., Boulogne I., Chabrol J., Fiard J.P.,
Lecuru C., Courtecuisse R., & B%o A.M. (2008). Diversity of
ectomycorrhizal fungi and ectomycorrhizas of three Coccoloba species
in Martinique. Poster presented at the Workshop «Mycorrhizas in tropical
forests», September 22-25, Universidad Tecnica Particular de Loja,
Ecuador.
Bogeat-Triboulot M.I., Bartoli F., Garbaye J.,
Marmeisse R. & Tagu (2004). Fungal ectomycorrhizal communityand
droughtaffect root hydraulic propertie and soil adherence to roots of Pinus
pinaster seedlings. Plant and Soil 267: 213-223.
Booth M.G. (2004). Mycorrhizal networks mediate
overstorey-understorey competition in a temperate forest. Ecology Letters 7:
538-546.
Bruns T.D., Szaro T.M., Gardes M., Cullings K.W., Pan
J.J., Taylor D.L., Horton T.R., Kretzer A., Garbelotto M. & Li Y. (1998).
A sequence database for the identification of ectomycorrhizal
basidiomycetes by phylogenetic analysis. Molecular Ecology 7: 257-272.
Bush C. S. & Morton J. F. (1969).
Native Trees and Plants for Florida Landscaping. Bulletin No.
193, Department of Agriculture - State of Florida.
Buyck B., Thoen D. & Watling R. (1996).
Ectomycorrhizal fungi of the Guineo-Congo Region. Proceedings of the
Royal Society of Edinburgh 104B : 313-333.
Connell J.H. & Lowman M. (1989). Low
diversity tropical rainforests: some possible mechanisms for their existence.
American Naturalist 134 : 88-119.
De Mélo E. (2000). Polygonaceae Da Cadeia
Do Espinhaço, Bresil. Acta Botanica Brasil 14(3): 273-300.
De Mélo E. (2004). As espécies de
Coccoloba P. Browne (Polygonaceae) da Amazônia brasileira. Acta Amazonica
34(4) : 525-551.
Débaud J.C. & Gay G. (1987). In
vitro fruiting under controlled conditions of the ectomycorrhizal fungus
Hebeloma cylindrosporum associated with Pinus pinaster. New
Phytologist 105: 429-435.
Diédhiou A.G., B%o A.M., Sylla S. Nd., Dreyfus
B., Neyra M. & Ndoye I. (2004). The early-stage ectomycorrhizal
Thelephoroid fungal sp. is competitive and effective on Afzelia africana
Sm. in nursery conditions in Senegal. Mycorrhiza 14: 313-322.
Diédhiou A. G., Selosse M.A., Diabaté
M., Dreyfus B., B%o A. M., de Faria S. M., Galiana A., & Béna G.
(2009). Multi-host ectomycorrhizal fungi are predominant in a Guinean
tropical rainforest and shared between canopy trees and seedlings.
Environmental Microbiology (submitted).
Erland S. & Taylor A.F.S. (1999).
Resupinate ectomycorrhizal fungal genera. In: Ectomycorrhizal
fungi - Key genera in profile (eds: J.W.G. Cairney & S.M. Chambers).
Springer- Verlag: Germany, pp347-363.
Felsenstein J. (1985). Confidence limits on
phylogenies: an approach using the bootstrap. Evolution 39:424-429.
Ferris R., Peace A.J. & Newton A.C. (2000).
Macrofungal communities of lowland Scots pine (Pinus sylvestris
L.) and norway spruce (Picea abies (L.) Kartsen.) plantations in
England: relationships with the site factors and stand structure. Forest
Ecology and Management 131: 255- 267 .
Gagnon J., Haycock K.A., Roth J.M., Feldman D.S. &
Finzer W.F. (1989). SuperANOVA didacticiel. In Abacus Concepts Inc.
(ed) Les modèles linéaires généralisés.
Berkeley, CA, USA, pp. 1-47.
Gagné A. (2005). Etude
moléculaire du cortège ectomycorhizien de plantations de
conifères sur des sites forestiers après coupes à blanc.
Mémoire de ma»trise en sciences forestières, Faculté
des études supérieures, Université Laval, 90 p.
Gardes M., White T.J., Fortin J.A., Bruns T.D. &
Taylor T.W. (1991). Identification of indigenous and introduced
symbiotic in ectomycorrhizae by amplification of the nuclear and mitochondrial
ribosomal DNA. Canadian Journal of Botany 69: 180-190.
Guinberteau J. & Courtecuisse R. (1997).
Diversité des champignons (surtout mycorhiziens) dans les
ecosystems forestiers actuels. Revue Forestière de Française
XLIX: 25-39.
Guzman G., Ramirez-Guillen F., Miller O.K., Jr., Lodge
D.J. & Baroni T.J. (2004). Scleroderma stellatum versus
Scleroderma bermudense: the status of Scleroderma echinatum
and the first record of Veligaster nitidum from the Virgins
Islands. Mycologia 96(6): 1370-1379.
He X. H., Critcheley C., Ng H. & Bledsoe (2004).
Reciprocal N (NH4+) -N15 or (NO3-)-N15) transfer between non N2-fixing
Eucalyptus maculata and N2 fixing Casuarina cunninghamiana
linked by the mycorrhizal fungus Pisolithus sp. New Phytologist
163(3): 629-640.
Hibbett D.S., Gilbert L.B. & Donoghue M.J.
(2000). Evolutionary instability of ectomycorrhizal symbioses in
basidiomycetes. Nature (London) 407: 506-508.
Jacobson K.M. Miller O.K. Jr. & Turner B.J.
(1993). Randomly amplified polymorphic DNA makers are superior to
somatic imcompatibility tests for discriminating genotypes and natural
populations of ectomycorrhizal fungus Suillus granulates. The Proceedings of
the National Academy of Science (US) 90: 9159-9163.
Julou T., Burghardt B., Gebauer G., Bervillier D.
& Selosse M.A. (2005). Mixotrophy in orchids : insights from a
comparative study of green individuals and non-photosynthetic mutants of
Cephalanthera damasonium. New Phytologist 166: 639-653.
McGuire K.L. (2007). Common ectomycorrhizal
networks may maintain monodominance in a tropical rain forest. Ecology 88 :
567-574.
Miller O.K., Jr., Lodge D.J. & Baroni (2000).
New and interesting ectomycorrhizal fungi from Porto-Rico, Mona, and
Guana islands. Mycologia 92 : 558-572.
Moreno-Casasola P. & Espejel I. (1986).
Classification and ordination of coastal sand dune vegetation along
the Gulf and Caribbean Sea of Mexico. Vegetatio 66:147-182.
Munns R. & Tester M. (2008). Mechanisms of
salinity tolerance. Annual Review of Plant Biology 59 : 651-681.
Newbery D.M., Alexander I.J. & Rother J.A. (2000).
Does proximity to conspecificadults influence the establishment of
ectomycorrhizal tree species in an African rain forest? New Phytologist 147:
401-409.
Nicholas K.B., Nicholas H.B., & Deerfield D.W.
(1997). GeneDoc: analysis and visualization of genetic variation.
Embnet News 4:1-4.
Onguene N.A. & Kuyper T.W. (2002).
Importance of the ectomycorrhizal network for seedling survival and
ectomycorrhiza formation in rain forests of South Cameroon. Mycorrhiza 12:
13-17.
Pegler D.N. (1983). Agaric Flora of the Lesser
Antilles. London, Royal Botanic Garden, 668 p.
Perrotta J.A. (1994). Coccoloba uvifera
(L.) L. Sea grape. Uva de playa. Resaech Note SOITF- SM-74 . U.S.
Department of Agriculture, Forest Service, Southern Forest Experiment station.
New Orleans, LA, 5 p.
Pesta-a Nieto M. & Santolamazza Carbone S. (2009).
Characterization of juvenile maritime pine (Pinus pinaster
Ait) ectomycorrhizal fungal community using morphotyping, direct
sequencing and fruitbodies sampling. Mycorrhiza 19 : 91-98.
Portecop J. & Le Brun P. (2003). Arbres
indigènes des Antilles, Tome I, p 14-15
Quoreshi A.M. & Khasa D.P. (2008).
Effectiveness of mycorrhizal inoculation in the nursery on root
colonization, growth, and nutrient uptake of aspen and balsam poplar. Biomass
and Bioenergy 32(5): 381-391.
Redecker D., Szaro T.M., Bowman R.J. & Bruns T.D.
(2001). Small genets of Lactarius xanthangalactus,
Russula cremoricolor and Amanita francheti in late-stage
ectomycorrhizal successions. Molecular Ecology 10: 1025-1034.
Rivière T., Diédhiou A.G.,
Diabaté M., Senthilarasu K., Natarajan K., Ducousso M., Verbeken A.,
Buyck B., Dreyfus B., Béna G. & B%o A.M. (2007). Genetic
diversity of ectomycorrhizal Basidiomycetes in West African and Indian tropical
rain forests. Mycorrhiza 17: 415-428.
Sanon B.K., B%o A.M., Delaruelle C., Duponnois R.
& Martin F. (2009). Morphological and molecular analyses in
Scleroderma species associated with some Caesalpiniaceae, Dipterocarpaceae and
Phyllanthaceae trees in southern Burkina Faso. Mycorrhiza (in press).
Selosse M.A., Richard F, He X & Simard S (2006).
Mycorrhizal networks: les liaisons dangereuses. Trends in Ecology and
Evolution 11: 621-628.
Simard S.W., Perry D.A., Jones D.M., Myrold D.D., Durall
D.M. & Molina R. (1997). Net transfer of carbon between
ectomycorrizal tree species in the field. Nature 363: 579-582.
Smith S. & Read J. (2008). Mycorrhizal
symbiosis, 3nd edition (Hardcover). 800 p.
Stendell E.R., Horton T.R & Bruns T.D (1999).
Early effects of prescribed fire on the structure of the
ectomycorrhizal fungus community in a Sierra Nevada ponderosa pine forest.
Mycologia Research 103: 1353-1359.
Strullu D.G. (1991). Les relations entre les
plantes et les champignons. In : "Les mycorhizes des arbres et des
plantes cultivées", (éd. Lavoisier), p. 9-49.
Tedersoo L., Pellet P., Koljalg U. & Selosse M.A.
(2007). Parallel evolutionary paths to mycoheterotrophy in understorey
Ericaceae and Orchidaceae: ecological evidence for mixotrophy
in Pyroleae. Oecologia 151: 206-217.
Thoen D. & B%o A.M. (1989).
Ectomycorrhizae and putative ectomycorrhizal fungi of Afzelia africana
and Uapaca guineensis in Southern Senegal. New Phytologist 113 :
549-559.
Thompson J.D., Gibson T.J., Plewniak F., Jeanmougin
F., Higgins D.G. (1997). The Clustal-X windows interface: flexible
strategies for multiple sequence alignment aided by quality analysis tools.
Nucleic Acids Research 25:4876-4882.
Tian C.Y., Feng G., Li X.L. & Zhang F.S. (2004).
Different effects of arbuscular mycorrhizal fungal isolates from
saline or non-salinesoil on salinity tolerance of plants. Applied soil Ecology
26(2): 143-148.
Torti S.D., Coley P.D. & Kursar T.A.
(2001). Causes and consequences of monodominance in
tropical lowland forests. American Naturalist 157: 141-153.
Tuxbury S.M. & Salmon M. (2005). Competitive
interactions between artificial lighting and natural cues during seafinding by
hatchling marine turtles. Biological Conservation 121 : 311-316.
Warren J.M., Renée Brooks J., Meinzre F.C.
& Eberhart J.L. (2008). Hydraulitic redistribution of water from
Pinus ponderosa trees to seedlings: evidence for an ectomycorrhizal
pathway. New Phytologist 178 : 382-394.
White T.J., Bruns T.D., Lee S.B. & Taylor J.W.
(1990). Amplification and direct sequencing of fungal ribosomal RNA
genes for phylogenetics. In: PCR Protocols: a Guide to Methods and applications
(eds Innis MA, Gelfand DH, Sninsky JJ, White TJ); pp. 315-322. Academic Press,
London
Wurzburger N., Bidartondo M.I. & Bledsoe C.S.
(2001). Characterization of Pinus ectomycorrhizas from mixed
conifer and pygmy forests using morphotyping and molecular methods. Canadian
Journal of Botany 79: 1211-1216.
Yamato M., Ikeda S. & Iwase K. (2008).
Community of arbuscular mycorrhizal fungi in a coastal vegetation on
Okinawa island and effect of the isolated fungi on growth of sorghum under
salt-treated conditions. Mycorrhiza 18: 241-249.
Zhou Z., Miwa M., Matsuda Y. & Hogetsu T. (2001).
Spacial distribution of subterranean mycelia and ectomycorrhizae of
Suillus grevillei genets. Journal of Plant Research 114: 179-185.
ANNEXES
CTAB 2x
Composition: 100 mM Tris HCl (pH 7,5 à 8); 1,4 M NaCl ; 20
mM Na2EDTA ; 2 % CTAB. Pour 100 ml :
- Dissoudre 2 g de CTAB dans 50 ml d'eau ultrapure en
mélangeant et en chauffant légèrement (45 à
50°C) si besoin pour faciliter la dissolution)
- Ajouter ensuite en mélangeant :
10 ml de Tris HCl 1 M pH 7,5 à 8,0
28,6 ml de NaCl 5 M.
4 ml Na2EDTA 0,5 M pH 8,0.
- Ajuster le volume à 100 ml avec de l'eau ultrapure (7,4
ml environ).
- Preparation des diverses solutions:
Tris HCl 1 M :
Mélanger :
121,14 g de Tris Base. 800 ml de H
2 O ultrapure.
Ajuster le pH entre 7,5 et 8,0 avec HCl 37 % (environ 50 ml).
Ajuster le volume à 1 l avec H O ultrapure et stériliser à
l'autoclave.
2
Na2EDTA 0,5 M pH 8 :
Pour 250 ml :
46,53 g de Na2EDTA.
200 ml de H
2 O ultrapure.
Ajouter des pastilles de NaOH (environ 15) jusqu'à ce que
la solution devienne transparente. Ajuster le pH à 8,0 avec NaOH 10
N.
Ajuster le volume à 250 ml avec H O et autoclaver.
2
Chlorure de sodium (NaCl) 5 M :
Pour 1 l, mélanger :
292 g de NaCl.
q.s.p. 1 l de H2O ultrapure.
Bien homogénéiser et stériliser à
l'autoclave.
GELS D'AGAROSE
Gel d'agarose à 2% (Verification
PCR)
Agar 2 g
TAE(1X) 100 ml
Faire chauffer l'agarose dans le tampon TAE 1X à la
micro-onde pour le dissoudre, puis ajouter 1 ou 2 gouttes de BET de 0,624mg/ml
(préparation solution BET: 312 jsl de solution-mere de BET à
10mg/ml sont ajoutés à 4688 jsl d'eau
déminéralisée).
Gel d'agarose à 3% (Verification
RFLP)
Agar 3 g
TAE(1X) 100 ml
Faire chauffer l'agarose dans le tampon TAE 1X à la
micro-onde pour le dissoudre, puis ajouter 1 ou 2 gouttes de BET de 0,624mg/ml
(préparation solution BET: 312jsl de solution-mere de BET à
10mg/ml sont ajoutés à 4688 jsl d'eau
déminéralisée).
COMPOSITION DES TAMPONS
EDTA 0,5M, pH 8 (Solution mere):
EDTA 93,075 g
Eau déminéralisée 300 ml
Ajuster avec de l'eau jusqu'à 500ml. Le pH est
ajusté à 8 avec des cristaux de soude NaOH, puis la solution est
filtrée (0.2jsm) et stérilisée 20 min à
120°C.
TAE 50X (solution mere):
Tris Base 242 g
Acide Acétique glacial 57,1 ml
EDTA (0,5M, pH 8) 100 ml
Ajuster avec de l'eau déminéralisée en
chauffant pour le dissoudre
TE (Tampon Tris base 10mM, EDTA 1mM):
Tris Base 242g
EDTA (0,5M, pH 8) 57,1ml
Eau déminéralisée 100ml
Ajuster le pH
à 8 avec HCL.
Tris HCl pH 8:
Tris Base 121,1g
Eau déminéralisée 800ml
Ajuster le pH à 8 avec HCL.
Preparation des dNTP
Solution mere dNTP 10mM.
Pour avoir une solution de 2,5 mM de dNTP pour la rection de PCR,
il faut: 50ul de solution mere de dNTP dans 150ul d'eau ultrapure
stérile
A conserver a -20°C
Preparation des amorces ITS1 et ITS4
Solution mere ITS1/ ITS4 300 moles/ul.
Pour avoir une solution de 20 pmoles/ul de ITS1 ou ITS4 pour la
réaction PCR, il faut: 10ul de ITS1 ou ITS4 de solution mere dans 140ul
d'eau ultrapure stérile.
A conserver à -20°C.
Mettre une étiquette oü figure le nom de l'amorce, sa
concentration et la date.
Kit PCR Master Mix PROMEGA
Préparation du MIX pour échantillons + 1
témoins + 1 erreur = É. tubes
|
Produits
|
Volume/ tube
|
Volume pour É.. tubes
|
|
Nuclease Free-water
|
9,5ul
|
|
|
PCR master mix
|
12,5 ul
|
|
|
ITS1
|
1 ul
|
|
|
ITS4
|
1 ul
|
|
|
ADN total (extrait)
|
1 ul
|
|
|
Volume final
|
25 JAl
|
|
Kit RFLP PROMEGA
Préparation du MIX pour échantillons + 1
erreur = É tubes
|
Produits
|
Volume/ tube
|
Volume pour É.. tubes
|
|
Enzyme (Hinf I)
|
0,5ul (10 unités/ul)
|
|
|
Tampon B
|
2 ul
|
|
|
Eau ultra-pure
|
2,3 ul
|
|
|
BSA
|
0,2 ul
|
|
|
Amplifiat d'ADN
|
15 ul
|
|
|
Volume final
|
20 JAl
|
|
UNIVERSITÉ DES ANTILLES ET DE LA
GUYANE
FACULTÉ DES SCIENCES EXACTES ET NATURELLES
Résumé
La diversite morphologique et genetique des champignons
ectomycorhiziens et des ectomycorhizes de Coccoloba uvifera a ete
etudiee le long dÕun gradient de salinite (15ä -2ä) sur la
plage de Bois Jolan en Guadeloupe. Ë proximite de lÕeau de mer, les
arbres sont de petites tailles et rabougris alors que les arbres eloignes sont
de plus grandes tailles avec un houppier bien developpe sous lequel proliferent
des plantules issues de graines. Six especes de sporophores (Amanita
arenicola, Inocybe littoralis, Inocybe xerophytica Cantharellus
cinnabarinus, Scleroderma bermudense et Russula cremeolilacina)
ont ete repertoriees en milieu peu sale et seulement une espece (S.
bermudense) en milieu sale. De meme, neuf morphotypes ectomycorhiziens
(MT), correspondant à six ribotypes, ont ete repertories en milieu peu
salé dont trois en milieu sale. Le polymorphisme de longueur des
fragments de restriction et le sequencage de la region ITS de lÕADNr
nucléaire ont permis de relier des sporophores aux MT et de montrer que
des arbres -meres et leurs plantules ont partage un cortège
ectomycorhizien commun. Quatre sporophores (C. cinnabarinus, I.
xerophytica, S. bermudense et R. cremeolilacina ) ont ete relies
à des MT, deux sporophores (A. arenicola et I.
littoralis) etaient absents des racines de C. uvifera et deux MT
identifiés (Tomentella sp1 et Tomentella sp2)
nÕont pas genére de sporophores. Les arbres -meres et leurs
plantules ont eu en commun trois champignons (S. bermudense,
Tomentella sp1 et Tomentella sp2) presents en majorite sur leurs
racines. Les résultats de cette etude ont montre que (i) la salinite a
affecte la diversite des champignons ectomycorhiziens (ii) les sporophores ont
ete de mauvais indicateurs de diversite (iii) des reseaux ectomycorhiziens
potentiels pourraient relier les arbres -meres et leurs plantules.
Mots clés : Arbres-meres, Plantules,
PCR-RFLP, Sequencage, ITS, Reseaux mycorhiziens communs
Abstract :
The morphological and molecular diversity of ectomycorrhizal
fungi and ectomycorrhizae on Coccoloba uvifera were studied along a
salinity gradient ranged from 15%o to 2ä at Bois JolanÕs Beach in
Guadeloupe. Only mature trees with an abundant seedling recruitement were well
developed within areas far from the sea. Six sporocarps (Amanita arenicola,
Inocybe littoralis, Inocybe xerophytica, Cantharellus
cinnabarinus, Scleroderma bermudense and Russula cremeolilacina)
were collected within the low salinity levels, whereas one (S.
bermudense) was collected where the salinity levels were high. Similarly,
nine morphotypes (MT) of fungi, corresponding to six ribotypes, were sorted in
low salinity levels and only three of them in high salinity levels. The
restriction fragment length polymorphism and sequencing of the nuclear rDNA ITS
region allowed identification of mycobionts in MT by corresponding sporocarp
RFLP patterns and sequences. We determined four matched sporocarps (C.
cinnabarinus, I. xerophytica, S. bermudense and R.
cremeolilacina) with MT, two unmatched sporocarps (A. arenicola
and I. littoralis) and two identified MT (Tomentella sp1
et Tomentella sp2) without corresponding sporocarp. Mature trees and
seedlings of C. uvifera shared common mycorrhizal networks (CMN) with
three fungi (S. bermudense, Tomentella sp1 and Tomentella
sp2). The results of this study showed that (i) the salinity decreased the
fungal diversity, (ii) the sporocar ps were a bad indicator for fungal
diversity, (iii) there was a potential for the formation of CMN between mature
trees and seedlings.
Key words : Mature trees, Seedlings, PCR-RFLP,
Sequencing, ITS, Common mycorrhizal networks
| 


