|
|
UNIVERSITE MARIEN NGOUABI
.......................................

251629568FACULTE DES SCIENCES DE LA SANTE
...................................
|
REPUBLIQUE DU CONGO
Unité-Travail-Progrès
|
ANNEE ACADEMIQUE 2007-2008
N°D'ORDRE: 783
THESE
POUR L'OBTENTION DU DOCTORAT EN MEDECINE
(DIPLÔME D'ETAT)
HEPATITE VIRALE B:
INTERET DE L'UTILISATION DES ECHANTILLONS DE SANG SECHE DANS
L'EXTRACTION DE L'ADN VIRAL
THEME :
Présentée et soutenue publiquement le 23 OCTOBRE
2008 par
Séraphin TWAGIRIMANA NYENYELI
Né le 12 Octobre 1981 à
Karago (RWANDA)
Jury :
Président : Assori ITOUA-NGAPORO,
Professeur
Membres : Didier HOBER, Professeur
OBENGUI, Professeur
Agrégé
Directeur de thèse :
Jean-Rosaire IBARA, Professeur, FSS, Congo
Codirecteurs : Didier HOBER,
Professeur, Lille 2, France
Donatien MOUKASSA, Assistant, FSS,
Congo
|
UNIVERSITE MARIEN NGOAUBI
........................
FACULTE DES SCIENCES DE LA SANTE
........................
SECRETARIAT PRINCIPAL
........................
|
Unité-Progrès-Humanité
...............
|
ANNEE ACADEMIQUE 2007-2008
I. DECANAT
|
Professeur Ange Antoine ABENA
Professeur Jean-Rosaire IBARA
Madame Julienne NTSINOYIRANDAKA
Madame Augustine MOUANGANGA
|
Doyen
Secrétaire académique
Secrétaire Principale
Gestionnaire
|
II. ANCIENS DOYENS
|
Professeur Christophe BOURAMOUE
Professeur Assori ITOUA-NGAPORO
Professeur Grégoire KAYA- GANZIAMI
Professeur Georges Marius MOYEN
Professeur Hervé Fortuné MAYANDA
|
Cardiologie
Hépato-Gastro-Entérologie
Ophtalmologie
Pédiatrie
Pédiatrie
|
III. ADMINISTRATION DE LA FACULTE DES SCIENCES DE LA
SANTE
|
Doyen
Secrétaire académique
Secrétaire principale
Gestionnaire
Département de Médecine
Département de Chirurgie et de Maternité
Département des sciences Physiologiques
Département des sciences infirmières
Département d'Histologie-Embryologie et Anatomie
Pathologique
Département de santé publique
Département de Microbiologie et Hématologie
Bibliothèque
Service de Scolarité et des Examens
Attachés de Direction
|
Professeur Ange Antoine ABENA
Professeur Jean-Rosaire IBARA
Madame Julienne NTSINOYIRANDAKA
Madame Augustine MOUANGANGA
Professeur Agrégé H.G. MONABEKA
Professeur Agrégé Emile BOTAKA
Docteur Etienne MOKONDJIMOBE
Professeur Agrégé R.R. BILECKOT
Docteur J. François SILOU-MASSAMBA
Docteur Pascal TALANI
Professeur Agrégé OBENGUI
Monsieur Fidèle NGOMA
Monsieur Maurice BOUYA
Mesdames :
Ø Pauline NKOUNKOU
Ø Pauline KEMBI
Ø Marie BOUTABAKOU
|
IV. DIRECTEURS DES C.E.S.
|
1. Assori ITOUA-NGAPORO
2. Charles GOMBE-MBALAWA
3. Georges MOYEN
4. Jean Louis NKOUA
5. Jean Roger EKOUNDZOLA
6. Armand MOYIKOUA
|
Hépato-Gastro-Entérologie
Cancérologie
Pédiatrie
Cardiologie
Gynécologie-Obstétrique
Chirurgie Générale
|
V. CORPS ENSEIGNANT
1. PROFESSEURS DES UNIVERSITES, PRATICIENS
HOSPITALIERS
|
1. Assori ITOUA-NGAPORO
2. Charles GOMBE-MBALAWA
3. Grégoire KAYA-GANZIAMI
4. Georges MOYEN
5. Jean Louis NKOUA
6. Ange Antoine ABENA
7. Martin DIATEWA
8. Jean Roger EKOUNZOLA
9. Léon Hervé ILOKI
10. Armand MOYIKOUA
11. Arthur NGOLET
12. Jean Rosaire IBARA
|
Hépato-Gastro-Entérologie
Cancérologie
Ophtalmologie
Pédiatrie
Cardiologie
Pharmacologie
Biochimie
Gynéco-Obstétrique
Gynéco-Obstétrique
Orthopédie-Traumatologie
Anatomie Pathologique
Hépato-Gastro-Entérologie
|
2. MAITRES DE CONFERENCES AGREGES, MAITRES DE
CONFERENCES, PRATICIENS HOSPITALIERS
|
1. Emile BOTAKA
2. Gisèle KIMBALY-KAKY
3. OBENGUI
4. Alexis ELIRA DOCKEKIAS
5. Richard Roger BILECKOT
6. Henri Germain MONABEKA
7. Jean Bernard NKOUA-MBON
8. Honoré NTSIBA
9. Gontran ONDZOTTO
3. MAITRES ASSISTANTS DE FACULTE, CHEFS DE CLINIQUE DES
HOPITAUX
|
Ophtalmologie
Cardiologie
Infectiologie
Hématologie
Rhumatologie
Endocrinologie
Cancérologie
Rhumatologie
O.R.L.
|
|
1. Julien EKOBA
2. Joseph KOKOLO
3. Bernard MBATCHI
4. NDINGA-ASSITOU
5. Jean François SILOU-MASSAMBA
6. DEBY-GASSAYE
7. Pascal TALANI
8. Edouard MAKOSSO
9. Aurore MBIKA CARDORELLE
10. Alphonse GATSHE
11. Godefroy OKEMY
12. Damase BODZONGO
13. Albert NGATSE-OKO
14. Thiery Raoul A. NGOMBET
15. Narcisse ELE
16. Jean Félix PEKO
17. Abraham MOUKO
18. Alain Prosper BOUYA
19. Simon F. BOUAMBO-BAMANGA
20. Etienne MOKONDJIMOBE
21. Gérard Boniface NGOUONI
22. Judith NSONDE-MONDZIE née MALANDA MFINGA
|
Cardiologie
Anatomie Pathologique
Pharmacologie
Physiologie
Histologie-Embryologie
Hépato-Gastro-Entérologie
Santé Publique
Radiologie
Pédiatrie
Dermatologie
Anatomie
Chirurgie
Chirurgie
Cardiologie
Chirurgie
Anatomie Pathologique
Pédiatrie
Urologie
Gynéco-Obstétrique
Biochimie
Stomatologie
Cancérologie
|
4. ASSISTANTS DE FACULTE, ASSISTANTS DES
HOPITAUX
|
1. Jean Louis Olivier PAMBOU NOMBO
2. Alain ASSOUNGA
3. Yvonne Valérie VOUMBO-MATOUMONA
4. Paul Jean Claude BOUMANDOKI
5. Bébène DAMBA-BANDZOUZI
6. Adolphe OBA
7. Alain Maxime MOUANGA
8. Odile LEBVOUA EKOUBOU
5. MONITEURS DE FACULTE
|
Gynéco-Obstétrique
Néphrologie
Santé Publique
Infectiologie
Neurologie
Pédiatrie
Psychiatrie
Soins Infirmiers
|
|
Raymond NGAPELA
|
Soins Infirmiers
|
6. PROFESSEURS DE FACULTES ASSOCIES
7. MAITRES ASSISTANTS DE FACULTES ASSOCIES
|
1. Emmanuel DAHO
2. Joselyne DHELLOT
3. Joseph Marie MOUTOU
4. Blaise TCHIKAYAT
5. Dieudonné NTSOKINI
6. NGWUILU-MPEMBA
7. Raymond ELENGA
8. Félix KOUBOUANA
|
Sociologie médicale
Nutrition-Diététique
Chimie
Technique d'expression
Psychologie médicale
Droit médical
Physique
Pharmacopée traditionnelle
|
8. ASSISTANT DE FACULTES ASSOCIES
|
Vivien MAMBOULI
|
Physiologie
|
VI. ENSEIGNANTS VACATAIRES
1. CHARGES DE COURS
|
1. Jean AKIANA
2. Claire ASSAMBO-KIELI
3. Henri ATANDA
4. Benjamin ATIPO
5. Irénée Blaise ATIPO-IBARA
6. Marc BATOUMISSA
7. Michel BITEMO
8. Léon BOUKASSA
9. Antoine EKOUTOU
10. Bertrand ELENGA MBOLLA
11. Tanguy FOUEMINA
12. P. GONDOLA BOMPEMBE
13. Stéphane IKAMA MEO
14. Clotaire ITOUA
15. Fréitas Nathalie KANGNI
16. Roland NKOUKOU
17. Innocent KOCKO
18. Lydie KOMBO BAYONNE
19. Jean Jacques KOUENDZE
20. Ida LENGA LOUMINGOU
21. Pierre Claver MABIKA
22. Marie Claire MAKAMBILA KOUBEMBA
23. Chantal MAKITA BAGAMBOULA
24. Félix MALANDA
25. Ghislain MALANDA MA MAYEMBO
26. Antonin Ray MANKELE
27. Didace MASSAMBA MIABAOU
28. Raoul MASSENGO
29. Grégoire MBERE
30. Jean Jacques MABOUSSE
31. Ursule Honorée MOKONO née SENGA
32. Jean Bertin MOUANKIE
33. François MOUBARI
34. Donatien MOUKASSA
35. Richard MOUKENGUE LOUMINGOU
36. Jérémie MOUYOKANI
37. Grégoire NDZANGA
38. Marie Y. NDOUNDOU NKODIA
39. Lydie NGOLET
40. NGOMA-NKADOULOU MAMBOUANA
41. Roger NGOTENE
42. Philippe NSONDI
43. Wenceslas Sévère ODZEBE ANANI
44. Noel Gaétan OMBETTA BOUKA
45. Martin OKOUO
46. Henri Joseph PARRA
47. Henriette POATY
48. Gaston SAMBA
49. Paulin KIBEKE
2. CHARGES D'ENCADREMENT TECHNIQUE ET
PROFESSIONNEL
|
Entomologie
Néphrologie
Pédiatrie
Parasitologie-Microbiologie
Hépato-Gastro-Entérologie
Anglais
Statistiques
Neurochirurgie
Pneumologie
Cardiologie
O.R.L.
Pneumologie
Cardiologie
Gynécologie-Obstétrique
Anesthésie et Réanimation
Informatique
Hématologie
Dermatologie
Santé Publique
Dermatologie
Psychologie/Anthropologie
Toxicologie
Ophtalmologie
Hématologie
Neurologie
Immunologie (Biologie)
Anatomie
Chirurgie digestive
Pneumologie, Déontologie
Santé Publique
Neurologie
Pharmacologie-Toxicologie
Santé Publique
Anatomie Pathologique
Néphrologie
Santé Publique
Bactériologie-Virologie
Bactériologie-Virologie
Hématologie
Hépato-Gastro-Entérologie
Stomatologie
Anesthésie et Réanimation
Urologie
Radiologie
Hépato-Gastro-Entérologie
Biochimie
Génétique
Santé Publique
Maladies métaboliques et endocriniennes
|
|
1. Barnabé BOKEMBA KATSALA
2. Rufin Bertrand BOLANGA
3. Marie Julienne BOUHOYI
4. Jean Serge IBARA
5. Yvon Séverin KOMBO
6. Maurice LOMBOBO
7. Maryse Nathalie MANGUILA
8. Michel NDINGA ESSANGO
9. NGANDALOKI
10. Eugène NZABA
11. Louis Gervais OKOUERE
12. M.V. TCHIKAYA TCHITCHIETO
|
Soins Infirmiers
Bactériologie-Virologie
Soins Infirmiers
Parasitologie-Mycologie
Bactériologie-Virologie
Soins Infirmiers
Parasitologie-Mycologie
Soins Infirmiers
Soins infirmiers
Hygiène du milieu
Soins Infirmiers
Soins Infirmiers
|
SERMENT D'HIPPOCRATE
En présence des Maîtres de cette école,
de mes chers Condisciples, devant l'effigie d'Hippocrate, je promets et je
jure, au nom de l'Être Suprême, d'être fidèle aux lois
de l'honneur et de la probité dans l'exercice de la
Médecine.
Je donnerai mes soins gratuits à l'indigent et
n'exigerai jamais un salaire au-dessus de mon travail. Je ne participerai
à aucun partage clandestin d'honoraires.
Je dirigerai le régime des malades à leur
avantage selon mes forces et mon jugement, et m'abstiendrai de tout mal comme
de toute injustice.
Admis à l'intérieur des maisons, pour
l'utilité des malades, mes yeux ne verront pas ce qui s'y passe, ma
langue taira les secrets qui me seront confiés, regardant la
discrétion comme un devoir en pareil cas, et mon état ne servira
pas à corrompre les moeurs ni à favoriser le crime.
Je passerai ma vie et exercerai mon art dans l'innocence et
la pureté. Je ne permettrai pas que les considérations de
religion, de race, de parti ou de classe sociale viennent s'interposer entre
mon devoir et mon patient.
Je garderai le secret absolu de la vie humaine dès la
conception.
Même sous la menace, je n'admettrai pas de faire usage
de mes connaissances médicales contre les lois de
l'humanité.
Respectueux et reconnaissant envers mes Maîtres, je
rendrai à leurs enfants l'instruction que j'ai reçue de leurs
pères.
Si je remplis ce serment sans l'enfreindre, qu'il me soit
donné de jouir heureusement de la vie et de ma profession, honoré
à jamais parmi les hommes.
Que je sois couvert d'opprobre et méprisé de
mes confrères si j'y manque !
DEDICACES
Je dédie ce
travail :
A ma très chère mère Marie
MURORUNKWERE :
Trouves ici le fruit de tes sacrifices consentis pour mon
éducation, l'expression de mon amour et de ma gratitude pour
l'affection avec laquelle tu m'as toujours entouré ;
***
A mon défunt père Cyprien
TWAGIRIMANA :
Tu as cultivé et transmis en moi les meilleures
valeurs qui soient. En tout tu es un exemple.
La souffrance de ta disparition précoce m'a ouvert
les yeux et je crois que si tu étais là, tu devrais être
fier de ton petit garçon. Tu me manques papa !
***
A mes frères et soeurs, Dominique,
Bonaventure, Pacifique, Jean
Paul, Fulbert, Corneille,
Fabien et Paulette, pour les fous rires et
les pleurs de cette enfance heureuse à la maison comme à
l'école. Que Dieu vous donne une longue vie et une bonne
santé.
***
A tous mes grands parents disparus,
Vous représenterez toujours ces racines dont je suis
fier.
***
REMERCIEMENTS
A mon grand frère, Dominique
TWAGIRIMANA,
Pour toutes ces années ensemble en exil ; ta
confiance et ton appui inestimable m'ont toujours accompagné.
***
A la famille BABONA Evariste et
Séraphine
Pour m'avoir accueilli dans votre famille.
Soucieux de ma réussite, vous n'avez jamais
manqué une occasion de me manifester votre amour, votre soutien et votre
confiance en moi. Tout cela a servi à me forger comme je peux et voici
le résultat.
***
A Pacifique, Olivier, Céline, Marie
Aimée, Juvénal et Emmanuel
Séraphin ;
Que l'exemple donné par l'aboutissement de ces 7 ans
d'études supérieures soit pour vous une source d'encouragement.
Je sais que vous ferez mieux.
***
A mes amis de l'association des étudiants rwandais
au Congo, notamment : Augustin, André, Jean Louis, Jean
Pierre, Pierre Claver et Jean d'Amour;
Je crois qu'il existe des liens aussi forts que la
famille
***
A toute la communauté rwandaise de Brazzaville,
notamment les familles :
François HIGIRO, Emmanuel BAGARAGAZA, Egide
RWAMATWARA, Diego P. HATEGEKIMANA, Casimir NTEZIRYIMANA, Augustin RWAMUCYO,
J.D. Mandela, Jean de Dieu NTEZIMANA et Cyprien HABYARIMANA;
Pour votre soutien moral et financier. Que nos liens
d'amitié, de solidarité et de fraternité soient toujours
la priorité dans nos relations.
***
A tous les collègues de la 25 emè
promotion, notamment :
Eliot, Jisca, Prince, Judy, Akim, Raïssa,
Leticia, Céleste, Jean Paul, Axel, Cyrille, Patricia, Arnaud,
Mita ;
En souvenir de la bonne humeur et des encouragements
réciproques qui ont marqués ces moments inoubliables.
***
A tous les ainés dans la profession,
notamment :
Jean Marc BUTOYI, Armel IBAMBA, Armel MAPOUKOU,
Gaston EKOUYA, Bernice SITOU, Darius MBOU ESSIE, Engoba MOYEN, Vincent
NSABIMANA, Sixbert ILYIVUZE, Tey NKANGA et Nelly
MPANZOU ;
Vos remarques et votre contribution à ma formation
se passent de tout commentaire.
***
Aux Docteurs Hughes EKOUELE et
Venceslas AMBOULOU IBARRA,
Pour votre participation à ce travail et vos
précieux conseils.
***
A mes amis de la faculté, notamment :
Ataboho EBATETOU, Freddy POUKI, Jysses KOKOLO,
Boris OTOUANA, Lysette NGOUA, Alain NGABOGO, Estina AKOKO, Autis GOMO KOMBO,
Ange BIMANGOU, Karen OBONDZO, Pamela BODZONGO, Yvette GAJOU, Erica AKOBANDE,
Ngala ITOUA-NGAPORO, Eric NDAYISHIMIYE et
Béranger NDZON.
***
A tous les enseignants de la FSS, notamment :
Docteurs Bébène DAMBA
BANDZOUZI et Clotaire ITOUA,
Professeurs Jean louis NKOUA et
Charles GOMBE MBALAWA,
Nous avons eu le privilège de
bénéficier de vos enseignements et nous avons
particulièrement apprécié vos qualités
pédagogiques et humaines.
***
A tous les chefs des services cliniques de l'Hôpital
Général de LOANDJILI, en particulier les Docteurs Omer
NKODIA, Firmin BOSSALI, Godefroy KOUBEMBA,
Bona KIMBEMBE, Jean Bertin NTSIBA et
Alain BIKINDOU ;
La très bonne humeur et l'ambiance du groupe m'ont
permis de mener mon travail de façon agréable. Les discussions,
les remarques et les commentaires ont été sources d'idées
et ont contribué au développement et l'amélioration de ce
travail.
***
A toute l'équipe du laboratoire et à tous les
médecins de l'HGL, notamment ; les Docteurs Mireille
YAWENDA, Anicet MAVOUNGOU, Serge KATENDE, Joseph KESENGUE, Stéphane
GNIUNDOU, Guy MALANDA, Junior WOLPH et Monsieur Anicet
MAPAKOU ;
Vous avez disposé de votre temps et de votre
expérience pour construire en moi cette passion pour l'exercice de notre
métier.
***
A toute l'équipe de recherche du service de
virologie/UPRES EA 3610 Faculté de médecine, Université
Lille II, CHRU Lille, Centre de Biologie Pathologie et Parc EURASANTE,
notamment Famara SANE, Stéphanie
FRONVAL, Pierre SAUTER, Anne
GOFFARD et Delphine CALOONE ;
Pour m'avoir accueilli chaleureusement parmi vous.
J'espère avoir été à la hauteur de votre confiance
dans la réalisation de ce travail qui n'aurait pu être effectif
sans votre précieuse contribution.
***
Au Docteur Donatien MOUKASSA, Directeur
des affaires médicales de l'HGL, chef de service de laboratoire de l'HGL
et co-directeur,
Pour m'avoir accueilli au sein de votre équipe, pour
avoir initié et codirigé ce travail, pour les nombreuses
discussions que nous avons eues, pour votre sensibilité, votre
égard, le respect et la sympathie dont je fus témoin et pour
m'avoir intéressé au travail de laboratoire. Veuillez trouver,
cher maitre, l'expression de ma profonde gratitude.
***
A Monsieur Bernard SAMBA-Levy, Directeur
Général de l'HGL ;
Pour votre aide logistique dans l'aboutissement de ce
travail. Votre sens d'ouverture et votre logique de travail resteront pour moi
un exemple à suivre.
***
Au Professeur Didier HOBER, Chef de
service de Virologie au Centre de Biologie Pathologie au CHRU de Lille et
co-directeur,
Pour avoir accepté de travailler avec nous, pour la
confiance que vous m'avez accordée et votre encadrement durant mon
séjour à Lille, en me faisant partager votre enthousiasme pour la
recherche et votre grande expérience.
***
Au Professeur Jean-Rosaire IBARA,
Directeur de thèse,
Nous vous sommes reconnaissant d'avoir accepté de
diriger ce travail. La richesse de vos enseignements et votre rigueur dans le
travail ont constitué une source d'instructions et d'admiration.
***
Au Professeur Ange Antoine ABENA, Doyen de
la faculté des sciences de la santé,
Etre votre élève est un grand
privilège. Nous avons découvert un homme de grande droiture et
plein d'humanisme. Votre calme et votre simplicité font de vous un homme
au delà du maitre auquel nous aimerions ressembler. Veuillez
agréer, cher maitre, l'expression de notre profond attachement.
***
Au Professeur Georges MOYEN, Recteur de
l'Université Marien NGOUABI,
Veuillez agréer, cher maitre, l'expression de notre
profonde gratitude et notre respect, pour la bienveillance que vous avez
toujours manifesté à notre égard.
***
Au professeur Assori ITOUA-NGAPORO,
Président du jury de thèse,
Vous nous faites un grand honneur en acceptant de
présider le jugement de ce travail. Qu'il nous soit permis de vous
remercier très respectueusement.
***
Au Professeur Agrégé
OBENGUI;
Nous sommes très honorés de vous compter
parmi les juges de ce travail. Vos remarques et contributions permettront, sans
doute, d'améliorer ce travail.
Veuillez croire, cher maitre, à nos hommages
respectueux.
***
Je rends hommage :
A mon pays natal, le RWANDA, tu as
dirigé mes premiers pas. Mon souhait est que tu sois toujours un havre
de paix.
A mon pays d'accueil, le CONGO, tu es et
tu resteras ma deuxième patrie. J'ai été
émerveillé par ton hospitalité. Que Dieu bénisse le
CONGO.
***
LISTE DES ABREVIATIONS
ADN : Acide
Désoxyribonucléique
ALAT : Alanine Amino-Transferase
ARN : Acide Ribonucléique
ASAT : Aspartate amino Transferase
BCP : Basal Core Promoteur
CHC : Carcinome Hépatocellulaire
CHRU : Centre Hospitalier Régional
et Universitaire
CIDTS: Centre Interdépartemental de
Transfusion Sanguine
CMH : Complexe Majeur
d'Histocompatibilité
EA 3610 : Equipe d'Accueil 3610
EDTA: Ethylen-diamin-tetracetic Acid
ELISA: Enzyme-linked Immunosorbed Assay
HGL : Hôpital Général
de Loandjili
HLA: Human Leucocyte Antigen
INF PEG: Interféron
Pégylé
LiPA: Line Probe Assay
PCR: Polymerase Chain Reaction
SDS : Sodium Dodecyl Sulfate
TECK : Tris- EDTA-Chlorure de
Sodium-Protéinase K
TP : Taux de Prothrombine
TTV : Transfusion Transmited Virus
UFCM: Unité Fonctionnelle Commune de
Moyen
UPRES: Unité Propre de Recherche
d'Enseignement Supérieur
VHA : Virus de l'Hépatite A
VHB : virus de l'Hépatite B
VHC : Virus de l'Hépatite C
VHD : virus de l'Hépatite D
VIH : Virus de l'Immunodéficience
Humaine
LISTE DES TABLEAUX
Tableau I : Le score de METAVIR
Tableau II : Différentes situations
sérologiques rencontrées au cours de l'infection
chronique
Tableau III: Tableau récapitulatif
des caractéristiques épidémiologiques de la
population de l'étude
Tableau IV: Répartition des sujets
selon l'âge en années
Tableau V: Tableau récapitulatif des
paramètres biologiques
Tableau VI: Tableau récapitulatif
des résultats de l'ADN total extrait
Tableau VII : Répartition de la
quantité d'ADN total en fonction du statut VHC
Tableau VIII: Tableau récapitulatif
des résultats de la PCR du VHB
Tableau IX: Répartition des
résultats de la PCR du VHB des sujets du groupe I
Tableau X: Répartition des
résultats de la PCR du VHB des sujets du groupe II
Tableau XI : Répartition des
résultats de la PCR du VHB du sang total
Tableau XII : Répartition des
résultats de la PCR du VHB du plasma
LISTE DES FIGURES
Figure 1. Ultra structure du virus de
l'hépatite B en représentation schématique
Figure 2. Organisation génomique du VHB
Figure 3. Répartition de la
Prévalence de l'infection à VHB dans le monde
Figure 4. Cinétique de marqueurs
sériques de l'Hépatite virale B aiguë
Figure 5. Cinétique des marqueurs
sériques au cours d'une hépatite virale B chronique
Figure 6. Répartition géographique
des principaux génotypes du VHB
Figure 7. Carte de Guthrie
Figure 8.Comparaison des rendements d'ADN total
obtenu apres extraction par le
Qiagen et la méthode au Phenol
Chlorophorme
Figure 9: Courbe standard de la
quantité d'ADN extrait pour le témoin non connu
VHB positif
Figure 10. Courbe standard de la quantité
d'ADN total extrait pour l'ensemble de la
population
Figure 11. Répartition de la
quantité d'ADN en fonction de l'âge
SOMMAIRE
INTRODUCTION..........................................................................1
I.
GENERALITES..........................................................................4
1. Généralités sur l'infection à
VHB.................................................. 5
2. Génotypes du
VHB....................................................................32
II. MATERIELS ET
METHODES.......................................................40
1. Cadre de
l'étude.......................................................................41
2. Types et Période de
l'étude...........................................................43
3.
Méthodes...............................................................................43
III.
RESULTATS.............................................................................50
1.
Fréquences..............................................................................51
2. Paramètres
épidémiologiques........................................................51
3. Paramètres
biologiques...............................................................53
4. PCR du
VHB...........................................................................58
IV.
DISCUSSION............................................................................62
1. Analyse de la
Méthodologie..........................................................63
2.
Fréquences..............................................................................64
3. Structure de la
population..............................................................65
4. PCR DU
VHB..............................................................................66
C0NCLUSION ET
PERSPECTIVES........................................................70
RESUME.......................................................................................72
ABSTRACT...................................................................................74
REFERENCES................................................................................76
ANNEXES............................................................................................................................81
INTRODUCTION
Les hépatites virales sont des infections
systémiques atteignant préférentiellement le foie et
entrainant des altérations hépatocytaires, des lésions
inflammatoires et une élévation des transaminases
sériques. Outre l'Epstein Barr Virus, le cytomégalovirus et
certains arbovirus qui n'atteignent que secondairement ou occasionnellement le
foie, six virus répondent à cette définition : le
Virus de l'Hépatite A (VHA), Virus de l'Hépatite B (VHB), Virus
de l'Hépatite C (VHC), Virus de l'Hépatite Delta (VHD), Virus de
l'Hépatite E (VHE) et le TTV (Transfusion Transmitted Virus)
[1].
Parmi ces virus hépatotropes, seuls le VHB, le VHC et
le VHD associé au VHB peuvent entrainer une hépatite virale
chronique, pouvant se compliquer de cirrhose et de Carcinome
Hépatocellulaire (CHC).
Dans le monde, 2 milliards de personnes sont
infectées par le VHB [2] et environ 360 millions de personnes sont
porteuses chroniques. Selon un rapport de l'Organisation Mondiale de la
Santé (OMS) paru en 2000 environ 520 000 décès chaque
année seraient dus à une hépatite à VHB [2]. Il
s'agit d'un problème mondial de santé publique. Au Congo, la
prévalence de l'hépatite B est différente selon les
études. Elle varie entre 6,5 et 15% [3, 4, 5].
Dans les pays en voie de développement, notamment le
Congo où les structures de biologie moléculaire sont rares, seule
la sérologie est utilisée, notamment la recherche de l'Ag HBs qui
permet de détecter le virus mais sans préjuger de sa
réplication. La détection de l'ADN viral par la réaction
de polymérisation en chaine (PCR) représente un important
progrès technique, permettant de mettre en évidence la
présence de l'acide nucléique viral dans le sérum des
sujets infectés par le virus de l'hépatite B, même lorsque
celui- ci est en très faible quantité.
Certains auteurs ont signalé que l'aptitude à
détecter l'ADN du VHB dans le sérum a une valeur pronostique en
ce qui concerne l'évolution des infections aiguës et chroniques
dues au VHB [6, 7]. La méthodologie peut permettre la détection
de l'ADN du VHB après clairance de l'AgHBs [8] ou la détection du
VHB en l'absence de marqueur sérologique [9]. Cependant, on n'a pas
encore établi de relation entre les marqueurs sérologiques et les
taux d'ADN du VHB.
L'efficacité du traitement antiviral utilisé
pour les patients porteurs du VHB peut aussi être évaluée
grâce aux marqueurs sérologiques ou par une mesure de la fonction
enzymatique du foie. Néanmoins, le dosage quantitatif de l'ADN viral du
VHB dans le sérum ou le plasma est considéré comme la
mesure la plus directe et la plus fiable de la réplication virale [10].
On a montré qu'une chute rapide et persistante des taux d'ADN du VHB
chez des patients recevant un traitement à base d'interféron
alpha, de lamivudine ou de Ganciclovir® est un facteur
prédictif d'évolution favorable sous traitement [11].
La surveillance des taux d'ADN du VHB permet de prédire
le développement d'une résistance à la lamivudine. Par
conséquent, un test quantitatif offrant un dosage de l'ADN du VHB est un
outil utile que l'on peut utiliser en association avec d'autres marqueurs
sérologiques lors de la prise en charge d'une infection par le VHB.
Le cout élevé de l'acheminement des
échantillons vers les pays qui disposent des structures de biologie
moléculaire, est l'un des facteurs qui limitent le diagnostic
virologique et par conséquent le suivi des malades ayant une
hépatite chronique B au Congo.
Le but de cette présente étude est
d'évaluer l'utilisation des échantillons de sang
séché sur les papiers buvards en vue d'une élution de
l'ADN viral, afin de réaliser l'amplification des acides
nucléiques du Virus de l'Hépatite B.
Ainsi, les objectifs ont été de:
Ø Evaluer les avantages de l'utilisation des
échantillons de plasma et de sang total séchés sur papier
buvard ;
Ø Mettre au point l'acheminement de
prélèvements biologiques de patients pour rechercher l'ADN viral
par PCR.
GENERALITES
1. GENERALITES SUR L'INFECTION à VHB
1.1. HISTORIQUE
En 1964, Baruch Samuel BLUMBERG, médecin et biochimiste
américain, travaillant pour le National Institute of Health,
s'intéresse à la variabilité antigénique entre les
individus et au sein des différentes populations. Il émet
l'hypothèse selon laquelle des patients ayant reçu un grand
nombre de transfusions sanguines doivent avoir développé des
anticorps contre les antigènes qu'ils ne possèdent pas. Il met en
présence des échantillons de sang de patients
polytransfusés avec des sérums de personnes indemnes de toute
transfusion. Il observe alors, en immuno-diffusion, une ligne de
précipitation pour chaque système antigène-anticorps
révélé.
Ensuite, il remarque qu'un échantillon sanguin d'un
patient hémophile polytransfusé présente la
caractéristique de former une ligne de précipitation originale
avec un seul sérum, celui d'un Aborigène australien. Ce
sérum contient donc un antigène qui n'existe pas dans les autres
lots ; BLUMBERG le baptise : « Antigène
Australia ». Ses travaux consistent alors à établir la
répartition de cet antigène dans diverses populations : un
sérum sur 1000 est positif en Amérique du Nord contre 15
sérums sur 100 dans certaines îles du Pacifique ; il existe
donc une variabilité dans la distribution de cet antigène. Reste
à trouver l'origine de ce portage antigénique.
En 1966, le changement de statut sérologique d'un
patient initialement dépourvu d'antigène Australia renforce
l'hypothèse d'une infection par un agent viral et ce patient a
présenté une hépatite pendant la période de
séroconversion. Ceci conduit à tester de nombreux
échantillons de sang de patients aux antécédents
d'hépatite. A la fin de l'année 1966, la preuve est faite que le
portage de l'Antigène Australia est lié à une
hépatite virale. BLUMBERG établit un protocole de
dépistage du sang destiné aux transfusions, éliminant tous
les lots porteurs de l'antigène; rapidement une nette diminution du
nombre d'hépatite post-transfusionnelle est constatée [12].
L'observation au microscope électronique du
sérum contenant l'Antigène Australia révèle la
présence de particules de 42 nanomètres de diamètre dont
l'antigène Australia constitue une partie. La structure de ce virus
aujourd'hui appelé VHB est vite élucidée.
L'antigène Australia est aujourd'hui connu sous le nom d'antigène
de surface du VHB (AgHBs).
Par la suite, des découvertes provenant du monde entier
n'ont cessé d'accroitre les connaissances sur le virus, notamment depuis
l'avènement de la biologie moléculaire :
· En 1971, DANE découvre la particule qui porte
son nom, d'un diamètre de 40 à 42 nm et qui correspond au virion.
Il apparait sous la forme de petite sphère ou de petit tube
correspondant à des fragments de l'enveloppe du virus
lui-même ;
· En 1972, MAGNIUS découvre l'antigène HBe
soluble qui est le témoin de la multiplication virale.
1.2. CARACTERISTIQUES VIROLOGIQUES
Le VHB appartient à la famille des hepadnaviridae, avec
le virus de l'hépatite de la marmotte, le virus de l'hépatite du
canard et quelques autres variantes aviaires et mammifères. Tous les
virus de la famille sont hépatotropes et ont le même cycle de
réplication chez l'hôte [13].
1.2.1. ULTRASTUCTURE
L'observation en microscopie électronique de
sérum infecté par le VHB met en évidence trois types de
particules (Figure1) correspondant aux différentes formes virales
[14] :
· La particule de DANE ou virion complet, sphère
de 42 nm de diamètre, constituée d'une enveloppe entourant la
capside virale, à l'intérieur de laquelle se trouvent la
molécule d'ADN viral et 2 enzymes (une ADN polymérase et une
protéine kinase) : c'est la particule infectante du VHB ;
· Des particules de forme sphérique de 17 à
25 nm de diamètre ;
· Des particules filamenteuses de longueurs variables,
non infectantes, correspondant à des protéines d'enveloppe
synthétisées en excès.
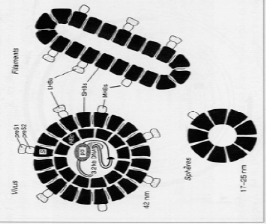
Figure 1. Ultra structure du virus de
l'hépatite B en représentation schématique [14]
1.2.2. ORGANISATION GENOMIQUE
Le génome du VHB est une molécule circulaire
bicaténaire sur les trois quarts du cercle et monocaténaire sur
un quart, constitué d'environ 3200 paires de bases (Figure 2) [15].
On identifie :
· Un brin négatif de 3200 bases, maintenu sous
forme circulaire par son extrémité 5' où se fixe l'ADN
polymérase virale ;
· Un brin positif complémentaire de longueur
variable.
L'organisation génomique de cette molécule d'ADN
est compacte. Elle comprend quatre (4) cadres de lecture ou régions se
chevauchant, permettant la transcription et la traduction des gènes
viraux, pour aboutir à la synthèse de 7 protéines
différentes. Il s'agit de :
· La région
pré-S/S, codant pour trois protéines de
surface : la protéine L (Large), la protéine M (Middle) et
la protéine S (Small). Celle-ci détermine
l'antigénicité HBs.
Cette région est organisée en une région
S, précédée en amont par une
région pré- S2,
elle-même précédée d'une région
pré-S1. A chaque région
correspond un codon permettant la lecture des 3 gènes [15] :
Ø La protéine L correspond à l'expression
du gène pré-S1 +
pré- S2+S ;
Ø La protéine M à l'expression du
gène pré-
S2+S ;
Ø La protéine S à l'expression du
gène S.
· La région pré-C/C,
codant pour 2 protéines : l'antigène HBe, un
peptide de 25 kDa qui, après maturation dans les membranes du
réticulum endoplasmique de l'hôte, aboutit à la
sécrétion d'un peptide soluble de 15 kDa dans le plasma des
patients infectés et l'antigène HBc, protéine
cytoplasmique de 21 kDa encore appelée protéine de core,
détectable dans les hépatocytes infectés mais non
sécrétée dans le plasma.
· La région P, codant
pour l'ADN polymérase, une enzyme permettant la synthèse d'ADN
viral. Cette région est formée de 3 domaines fonctionnels et d'un
domaine non fonctionnel dans l'ordre suivant :
Ø Un domaine N-terminal, lié à la partie
5' du brin négatif de l'ADN viral, il sert également d'amorce
à l'initiation de la synthèse de ce brin négatif par son
activité primase ;
Ø Un domaine intermédiaire non essentiel,
espaceur (spacer), dont la taille et le repliement
permettent l'interaction des différents domaines avec le
génome ;
Ø Un domaine pour la transcriptase
inverse/ADN polymérase ;
Ø Un domaine pour la
RNaseH.
· La région X, codant pour la protéine X
qui a un rôle important dans la transactivation de la transcription
virale (augmentation des ARN messagers) et dans l'augmentation de
l'activité de gènes de la croissance cellulaire(c-myc et c-fos),
contribuant ainsi au processus d'oncogenèse de la cellule
infectée [17].
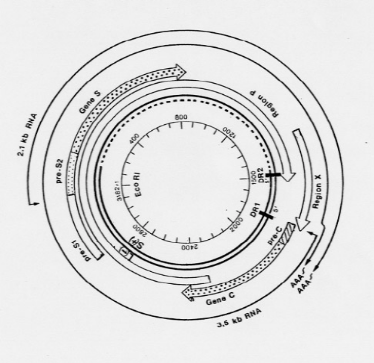
Figure 2. Organisation génomique du VHB
[15]
1.2.3. REPLICATION VIRALE
Il n'existe pas de modèle cellulaire permettant la
culture virale, ce qui complique la compréhension du cycle viral dans la
cellule humaine. Seuls certains primates, dont le chimpanzé, constituent
des modèles de choix pour l'étude du VHB.
Le VHB a un tropisme essentiellement hépatocytaire,
mais l'ADN viral peut être retrouvé dans les cellules de la
moelle osseuse, les cellules mononucléées du sang
périphérique (lymphocytes B et T, monocytes), les cellules
pancréatiques, rénales et cutanées. Cependant les formes
réplicatives sont exceptionnelles en dehors des hépatocytes.
Le cycle viral débute par l'entrée dans la
cellule. Après décapsidation cytoplasmique, le génome
viral pénètre dans le noyau cellulaire. Le brin positif est
complété, donnant naissance à un ADN bi caténaire
circulaire refermé sous forme super enroulée
(supercoiled). C'est le ccDNA
(covalently closed circular DNA).
La transcription s'initie dans le noyau à partir du
brin négatif, produisant un ARN prégénomique de 3,5 kb et
des ARN messagers subgénomiques de 2,4 à 2,1 kb et 0,5 kb, qui
codent pour les protéines de surface, de la capside, mais aussi pour la
protéine transactivatrice X et l'ADN polymérase.
Après l'encapsidation de l'ARN
prégénomique dans le cytoplasme, la transcriptase inverse virale
produit un brin d'ADN négatif, qui sert de matrice pour la
synthèse partielle du brin positif, alors que l'activité RNaseH
virale dégrade l'ARN prégénomique. Le virus finit sa
maturation dans le réticulum endoplasmatique cellulaire par acquisition
de son enveloppe, puis quitte la cellule par un phénomène de
bourgeonnement membranaire [17].
La synthèse des ccDNA à l'intérieur du
noyau cellulaire joue un rôle important dans l'évolution de
l'infection. En effet, cette forme génomique extrêmement stable,
parfois qualifié de mini chromosome, persiste sous forme
épisomale au sein de la cellule hépatique et probablement au sein
d'autres cellules permissives. Cela est à l'origine du portage chronique
du VHB, des phénomènes de réactivation et explique que
l'on puisse détecter l'ADN viral après disparition de l'AgHBs
sérique [17].
L'implication de la transcriptase inverse dans le cycle
réplicatif est à l'origine des mutations dont le nombre est plus
élevé que celle rencontrées dans la réplication des
virus à ADN classiques et explique l'apparition de variants du VHB. En
effet la demi-vie moyenne du VHB dans le sang est de 1 à3 jours et le
taux de production des virions serait proche de 10-11 par jour ; d'autre
part, la transcriptase inverse aurait un taux d'erreur estimé à
10-` par base et par cycle, sans système de correction des erreurs.
Cette combinaison d'une réplication quotidienne élevée et
d'un nombre important d'erreurs non corrigées explique la survenue des
variants génétiques du VHB [18].
1.3. EPIDEMIOLOGIE
1.3.1. Dans le monde
L'hépatite B est une maladie ubiquitaire. On estime que
2 milliards de personnes dans le monde ont eu un contact avec le VHB et environ
360 millions ont développé une infection chronique. Celles-ci ont
un risque accru de développer une cirrhose hépatique, puis un
carcinome hépatocellulaire [19].
La prévalence de l'infection et le mode de transmission
varient en fonction des régions du globe (Figure 3). On
distingue :
o Les régions de forte
endémicité, définies par une prévalence de
l'infection virale chronique supérieure à 8%. Il s'agit de
l'Afrique subsaharienne et des pays asiatiques. La contamination est
essentiellement périnatale à partir d'une mère
infectée ou survient tôt dans l'enfance ; or l'infection de
l'enfant devient plus volontiers chronique, expliquant la forte
prévalence dans ces régions.
o Les régions d'endémicité
intermédiaire ont une prévalence de l'infection
chronique à VHB comprise entre 8 et 1% ; il s'agit des pays
méditerranéens et des pays de l'Europe de l'Est. La contamination
est familiale, sexuelle, périnatale et nosocomiale.
o Les régions de faible
endémicité ont une prévalence de l'infection
chronique à VHB inférieure à 1% ; il s'agit de
l'Europe du Nord, de l'Ouest, de l'Amérique du Nord et de l'Australie.
La transmission se fait essentiellement par voie sexuelle ou par échange
d'aiguilles contaminées chez les utilisateurs de drogues.
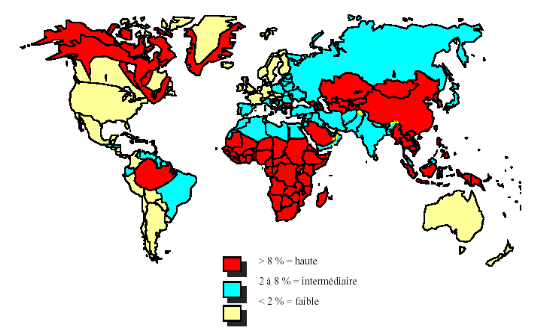
Figure 3. Répartition de la
Prévalence de l'infection à VHB dans le monde [19]
1.3.2. MODE DE TRANSMISSION
Le VHB est très contagieux, environ 100 fois plus que
le VIH et 10 fois plus que le VHC [17]. Le réservoir viral est humain et
la transmission inter humaine. On distingue essentiellement quatre modes de
transmission.
1.3.2.1. Transmission sexuelle
Elle est fréquente partout dans le monde, mais c'est un
mode important de transmission dans les zones de faible endémie.
1.3.2.2. Transmission parentérale
Elle résulte de l'injection ou de contact avec des
produits sanguins ou des dérivés sanguins infectés, de
l'utilisation de matériel médico-chirurgical souillé
(chirurgie, hémodialyse, odontologie, acupuncture et
mésothérapie), de toxicomanie intraveineuse, les tatouages et le
piercing [23].
1.3.2.3. Transmission mère -enfant
La transmission survient chez les femmes enceintes
présentant une hépatite aigue au deuxième et surtout au
troisième trimestre de la grossesse et chez les porteuses chroniques du
virus. Pour ces dernières, le risque de transmission est faible (environ
20% en dehors de tout traitement) chez les porteuses de l'AgHBs sans
réplication virale détectable dans le sérum. A l'inverse,
il est élevé (de l'ordre de 80%) chez les porteuses chroniques
présentant les marqueurs de réplication virale [23].
Dans tous les cas, la transmission est périnatale soit
lors de l'accouchement par contact avec les sécrétions
maternelles infectées dans la filière génitale, soit dans
les mois suivant l'accouchement par contact avec les sécrétions
maternelles infectées (lait, sueur, larmes).
Ce mode de contamination est présent dans le monde
entier, mais prédomine dans les régions de forte
endémicité [23].
1.3.2.4. Transmission interindividuelle
directe
Elle se fait par contact direct interindividuel. Elle semble
particulièrement fréquente en Afrique sub-saharienne où le
contage a souvent lieu entre les enfants en bas âge à la maison
familiale, dans les crèches ou à l'école. Les vecteurs de
la transmission sont alors de très petites quantités de sang ou
de salive à la faveur d'excoriations cutanées ou muqueuses
[23].
1.4. PHYSIOPATHOLOGIE
La physiopathologie de l'infection à VHB est complexe.
En effet, la réplication virale n'est pas directement
cytopathogène pour l'hépatocyte, mais c'est la réaction de
l'hôte vis-à-vis du virus qui est déterminante dans la
physiopathogénie. Il s'agit d'une réponse à la fois
humorale et cellulaire, responsable des lésions hépatiques et des
symptômes [16].
La réponse humorale est fondée sur les
propriétés des récepteurs d'immunoglobulines des cellules,
qui reconnaissent les antigènes viraux à la surface des
hépatocytes infectés ou sous leurs formes solubles dans le
sérum. La réponse cellulaire fait intervenir les lymphocytes T et
les cellules présentatrices d'antigène, essentiellement les
macrophages.
A la surface des hépatocytes infectés, les
molécules HLA de classe 1 présentent des fragments
antigéniques, le plus souvent l'AgHBc, métabolisé dans le
cytosol de l'hépatocyte. Le couple HLA de classe 1-AgHBc est reconnu par
les lymphocytes T CD8 cytotoxiques via un récepteur spécifique.
Ceci induit un processus de lyse cellulaire médié par la
protéine Fas, des cytokines et des perforines.
La capacité des molécules HLA de classe 1 à
présenter l'antigène dépend de la variabilité du
Complexe Majeur d'Histocompatibilité (CMH) et du répertoire des
récepteurs des lymphocytes T de l'hôte. L'intensité de la
réponse va donc varier d'un individu à l'autre [13].
Dans les tissus, les macrophages vont phagocyter les virions
libres circulants. Après protéolyse dans leurs compartiments
d'endocytose, les antigènes viraux sont associés aux
molécules HLA de casse 2 et présentés aux lymphocytes T
CD4+Helpers. La résultante en est une augmentation de la synthèse
de cytokines activatrices de la prolifération des lymphocytes T et une
augmentation de la présentation antigénique par les
molécules HLA de classe 1 à la surface des hépatocytes,
tendant à la clairance virale.
La nature et la qualité de la réponse immune
obéit à un déterminisme multifactoriel, notamment
génétique et aboutit à quatre types de relation
hôte-virus [13]:
Ø La réaction immune de l'hôte est forte,
aboutissant à l'élimination des virus circulants et des
hépatocytes infectés ; c'est l'hépatite aigue
guérie. Dans l'hépatite aigue fulminante, cette réaction
est suraiguë, aboutissant à une nécrose
hépatocellulaire massive ;
Ø La réaction immune de l'hôte est faible
mais adéquate. L'infection reste asymptomatique et évolue vers la
guérison ;
Ø La réaction de l'hôte est faible et
inadéquate. Il s'installe une tolérance partielle combinant la
réplication virale prolongée (AgHBs persistant) et une
destruction tissulaire hépatique à bas bruit. Cette situation
d'hépatite chronique peut se prolonger plusieurs mois, voire des
années et aboutir à la cirrhose. Au cours de cette période
et sous la dépendance de cofacteurs alimentaires et toxiques, peut se
produire la transformation hépatocellulaire conduisant au cancer
primitif du foie ;
Ø La réaction immune de l'hôte est nulle.
Il existe une tolérance totale à la réplication virale.
C'est la situation du portage chronique asymptomatique ou portage inactif.
1.5. CLINIQUE
On distingue l'hépatite virale aiguë et
l'hépatite virale chronique. Dans les deux cas, l'infection peux
être symptomatique ou non.
1.5.1. Incubation
La durée d'incubation est de 50 à 100 jours, 10
semaines en moyenne. Dans 90% des cas l'infection reste asymptomatique d'autant
plus que le sujet est jeune.
1.5.2. INFECTION AIGUË PAR LE VHB
[13]
1.5.2.1. Forme classique
La forme classique de l'infection aiguë à VHB est
la forme ictérique, observée dans 10% des cas. Elle
évolue en 3 phases :
Ø La phase pré-ictérique
qui dure 3 à 7 jours, elle est absente dans 20% des cas. Elle est
caractérisée par des signes non spécifiques :
céphalées, asthénie, anorexie, fièvre, plus
rarement les arthralgies, myalgies, nausées, pesanteur de l'hypochondre
droit, foie sensible à la palpation et rash cutané ;
Ø La phase ictérique qui dure 2
à 6 semaines, caractérisée par un ictère
cutanéo-muqueux, rarement accompagné de prurit. Lorsque
l'ictère apparait la fièvre disparait. Les urines sont brun
acajou, les selles incomplètement décolorées.
L'asthénie est constante et dure tout au long de la phase
ictérique ;
Ø La phase de convalescence voit la
disparition de l'ictère et des signes généraux
Biologiquement la cytolyse est l'élément
primordial avec des taux supérieurs à dix fois la normale,
prédominant sur l'Alanine Amino-Transférase (ALAT). Il n'y a pas
d'insuffisance hépatocellulaire. Le taux de prothrombine(TP) reste
supérieur à 60%, sauf dans les formes sévères
(TP< 50%), imposant une hospitalisation pour la surveillance. Il existe une
cholestase avec élévation de la bilirubine totale et surtout la
fraction conjuguée. Enfin, les marqueurs de l'inflammation sont
perturbés avec élévation de la vitesse de
sédimentation et des bêta et gamma globulines.
1.5.2.2. Forme fulminante
Dans un cas sur 1000, l'hépatite est suraiguë.
Elle met en jeu le pronostic vital car en l'absence de la transplantation
hépatique en urgence, la mortalité est d'environ 90%. Les signes
d'alerte à la phase initiale sont une encéphalopathie
hépatique caractérisée par une inversion du rythme
nycthéméral, un astérixis et un syndrome confusionnel,
associés à une diminution du TP (TP< 30%) et du facteur V,
ayant comme conséquence des hémorragies cutanéo-
muqueuses. La cytolyse est très importante et il existe une
hypoglycémie en rapport à une insuffisance
hépatocellulaire.
Lorsqu'il y a une évolution favorable, le passage
à la chronicité est exceptionnel [19].
1.5.3. INFECTION CHRONIQUE PAR LE VHB
L'infection chronique par le VHB est définie par le
portage pendant plus de six mois de l'AgHBs. Elle survient chez 5 à 10%
des adultes infectés immunocompétents, plus fréquemment
chez les immunodéprimés et chez 90% des nouveaux nés
infectés.
Elle est caractérisée par un polymorphisme,
incluant les patients atteints d'hépatite chronique et les porteurs
inactifs de l'AgHBs.
1.5.3.1. Hépatite chronique
Elle concerne environ deux tiers des porteurs de l'AgHBs. Elle
est définie par l'association du portage chronique de l'AgHBs et de la
présence des lésions hépatiques notamment la
nécrose hépatocytaire, l'inflammation et la fibrose [24].
Sur le plan clinique, elle est généralement
asymptomatique et découverte à l'occasion d'un bilan
systématique, parfois même au stade de cirrhose. Lorsque les
signes cliniques sont présents, ils sont peu évocateurs :
asthénie, anorexie, gène sous costale et plus rarement un prurit
et un ictère dans les formes choléstatiques [23].
Sur le plan biologique, une cytolyse est le plus souvent
retrouvée mais moins importante que dans les formes aiguës (entre
une et cinq fois la normale), prédominant sur les ALAT. Les autres
marqueurs hépatiques sont normaux en dehors des formes
choléstatiques. Il peut exister un syndrome inflammatoire avec
élévation des immunoglobulines prédominant sur les IgG
[23].
Sur le plan histologique, une biopsie hépatique permet
de poser le diagnostic de certitude. Elle renseigne sur 3
éléments fondamentaux :
Ø L'activité hépatique avec des
lésions de nécrose et d'inflammation portales,
péri-portales et lobulaires ;
Ø La fibrose en fonction des lésions
cicatricielles, désorganisant progressivement la structure
parenchymateuse, jusqu'à aboutir à la cirrhose;
Ø Les lésions éventuellement
associées comme la stéatose, la surcharge en fer ou des
lésions d'hépatite alcoolique.
L'infiltrat inflammatoire est souvent intense,
constitué de cellules mononuclées, typiquement lymphocytaires,
les cellules CD4+ sont plus volontiers présentes dans les espaces
portes, alors que les CD8+ prédominent au niveau parenchymateux, dans
les zones de nécrose.
L'évaluation de l'activité cellulaire et de la
fibrose se fait au moyen de scores histologiques tels que le score de KNODELL
ou le score de METAVIR, plus récent et mieux reproductible (Tableau
I).
Tableau I : le score de METAVIR
|
STADE DE FIBROSE
GRADE D'ACTIVITE (nécrose)
|
|
F0 : Pas de fibrose
A0 : Pas d'activité
F1 : Fibrose portale sans septa
A1 : Activité minime
F2 : Fibrose portale et quelques septa
A2 : Activité
modérée
F3 : Fibrose septale sans cirrhose
A3 : Activité
sévère
F4 : Fibrose septale avec cirrhose
|
Il est à souligner que deux méthodes
récentes non invasives permettent d'évaluer la fibrose
hépatique. Il s'agit de :
· Dosage des marqueurs biochimiques des maladies
hépatiques, Fibrotest et Actitest, permettant des estimations de la
fibrose et de l'activité nécrotico- inflammatoire en fonction du
dosage de 5 marqueurs hépatiques : alpha 2 macroglobuline,
haptoglobine, apolipoprotéine A1, bilirubine totale et gamma GT [23].
· Fibroscan qui estime la fibrose hépatique par
mesure de l'élasticité du foie (kPA) en utilisant une nouvelle
technique qui est l'élastométrie impulsionnelle. Les
résultats sont exprimés en kPA avec les valeurs limites
suivantes : 7,5 kPA correspondent à F=2.
1.5.3.2. Hépatite chronique AgHBe
négatif
La séroconversion dans le système HBe marque
classiquement la transition vers la phase de latence, mais dans 1 à 5%
des cas persistent les activités biologique et histologique avec un haut
niveau de réplication virale. Cette situation est due à deux
types de mutation :
Ø Mutants pré-core, qui ont une substitution de
la guanosine en position 1896 par une adénosine (G1896A) qui crée
un codon stop en position 28. Cette mutation entraine un arrêt de
l'expression de l'AgHBe ;
Ø Mutant Basal Core Promoteur (mutant BCP),
présentant une double substitution au niveau du gène X, avec
remplacement de l'adénosine en position 1762 par une thymidine et de la
guanosine en position 1764 par une adénosine (A1762T/G1764A). cette
double mutation entraine une réduction de 70% de la
sécrétion de l'AgHBe.
Ces variants viraux coexistent initialement avec les souches
sauvages, qui perdent progressivement leur avantage sélectif aux
dépend des souches virales mutées émergentes [1].
1.5.3.3. Portage chronique inactif de l'AgHBs
[24]
Le portage chronique inactif de l'AgHBs associe : la
présence pendant plus de 6 mois de l'AgHBs ; l'absence de signes
cliniques ; l'absence d'anomalies biologiques ; l'absence d'infection
par le VHD ou le VHC ; la présence d'anticorps anti-HBe et la
charge virale inférieure à 105 copies/ml.
Cette définition regroupe des patients dont l'infection
n'est pas active mais sans préjuger de l'évolutivité
antérieure et des éventuels retentissements hépatiques
qu'elle aurait pu causer.
1.6. COMPLICATIONS
1.6.1. Cirrhose
La cirrhose est un événement crucial dans
l'histoire de l'infection à VHB, car ses complications propres, de
l'hypertension portale et de l'insuffisance hépatocellulaire sont en
grande partie responsables de la morbidité et de la mortalité de
cette infection.
L'incidence annuelle de la cirrhose chez les patients atteints
d'hépatite chronique AgHBe positif est de 2 à 5,5% et de 8
à 10% chez les patients avec une hépatite chronique AgHBe
négatif [1].
1.6.2. Carcinome hépatocellulaire
La fréquence annuelle de CHC varie en fonction des
populations : chez les porteurs chroniques sans cirrhose, le taux annuel
est inférieur à 0,2% dans les pays occidentaux contre 0,6% en
Asie et l'Afrique. Chez les cirrhotiques ce chiffre s'élève
à 2% [1].
Les patients atteints d'une hépatite chronique B
à AgHBe négatif, mutant BCP ont un risque accru de
développer un CHC par rapport à l'ensemble des porteurs
chroniques de l'AgHBs [24].
1.6.3. Manifestations extra-hépatiques
associées à l'hépatite chronique B
L'hépatite chronique B peut s'accompagner des
manifestations extra-hépatiques liées à la formation des
complexes immuns [23] :
· La périarthrite noueuse, observée chez 1
à 2% des porteurs chroniques du VHB. Elle est due à la
présence de complexe AgHBs-anticorps anti-HBs circulants et une
diminution du complément sérique [23] ;
· La glomérulonéphrite
membrano-proliférative, dont le diagnostic se fait par la mise en
évidence en immunofluorescence de l'AgHBs au sein des
dépôts glomérulaires de complexes immuns [23].
1.7. DIAGNOSTIC
Le diagnostic définitif de l'infection à VHB
repose sur l'utilisation des marqueurs sérologiques, associée
à l'étude des marqueurs de réplication du VHB et aux
stades histologiques hépatiques.
1.7.1. MARQUEURS SEROLOGIQUES
Ø Le système HBs : l'AgHBs est le marqueur
sérologique nécessaire à tout diagnostic d'infection par
le VHB. Il apparait dans le sang pendant la phase d'incubation, 1 à 6
semaines avant les signes cliniques ou biochimiques. Il disparait pendant la
phase de convalescence des hépatites aigues qui guérissent. Sa
disparition signe l'évolution favorable et sa persistance pendant plus
de 6 mois définit le passage à la chronicité.
La présence de l'anticorps anti-HBs permet d'affirmer
la guérison de l'hépatite aiguë B ; il apparait en
général 2 à 8 semaines après la disparition de
l'AgHBs et le plus souvent après amendement des signes cliniques.
L'anticorps anti-HBs persiste au moins 10 ans. C'est un anticorps neutralisant
dont la présence permet d'affirmer l'efficacité d'un vaccin
[23].
Ø Le système HBc : la recherche de l'AgHBc
ne se fait pas en routine clinique. En effet, il est présent à la
surface des hépatocytes infectés où il est la cible de la
réponse immunitaire, responsable de la destruction cellulaire. Il est
détectable en immuno-histochimie à des fins
expérimentales. Par contre l'anticorps anti-HBc dirigé contre la
capside du VHB est le marqueur de choix pour témoigner d'un contact avec
le VHB. En effet, on le retrouve à la fois dans les infections actives
et guéries.
Les IgM anti-HBc apparaissent 1 à 2 semaines
après l'apparition de l'AgHBs, signant la primo-infection et peuvent
persister plusieurs mois. Puis apparaissent les IgG anti-HBc, que l'infection
ait été aiguë et guérie ou qu'elle ait
évolué vers la chronicité. Ceux-ci persistent quasiment
à vie [23].
L'anticorps anti-HBc est un meilleur marqueur
sérologique d'infection ancienne que l'anticorps anti-HBs, car il n'est
pas produit par la vaccination. Il est présent lors de la fenêtre
sérologique où il y a absence de l'AgHBs et de l'anticorps
anti-HBs.
Ø Le système HBe : l'AgHBe est
sécrété sous forme soluble dans le sang. Sa
présence signe une réplication active du VHB. Elle est
généralement parallèle à la présence d'ADN
viral dans le sang. Cette présence est un élément
important en faveur de la contagiosité du patient.
La disparition de l'AgHBe est plus précoce que celle de
l'AgHBs. Associée à l'apparition d'anticorps anti-HBe, elle
définit la séroconversion dans le système HBe. Cette
séroconversion n'est pas un signe formel de guérison, mais un
élément pronostique favorable, généralement
associé à l'arrêt de la réplication virale. Dans 1
à 2% des cas de séroconversion dans le système HBe, l'ADN
viral reste détectable dans le sérum, définissant le
groupe des hépatites B chroniques à AgHBe négatif [23].
1.7.1.1. INTERPRETATION
Les figures 4 et 5 illustrent la cinétique des
marqueurs virologiques dans le sérum au cours de l'hépatite B
aiguë et chronique, alors que le tableau 2 récapitule l'ensemble
des situations sérologiques qu'il est possible de rencontrer au cours de
l'infection chronique par le VHB.
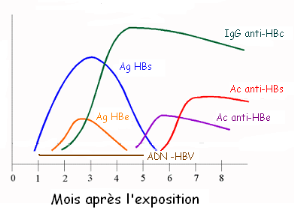
Figure 4. Cinétique de marqueurs
sériques de l'Hépatite virale B aiguë [17]
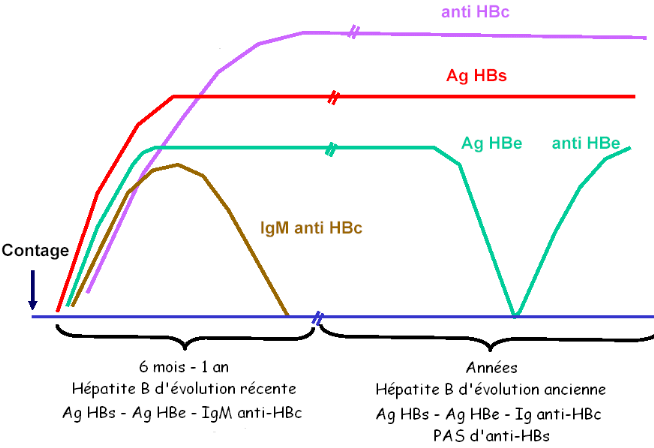
Figure 5. Cinétique des marqueurs
sériques au cours d'une hépatite virale B chronique [17]
|
ANTIGÈNES
|
ANTICORPS
|
DNA
|
|
Ag HBs
|
Ag HBe
|
Ac anti HBs
|
Ac anti HBc
|
Ac anti HBe
|
DNA du virus
|
|
Hépatite aiguë au début
|
+
|
+
|
-
|
-
|
-
|
+
|
|
Hépatite aiguë phase d'état
|
+
|
+
|
-
|
+ (IgM)
|
-
|
+
|
|
Hépatite aiguë phase post-ictérique
|
V
|
-
|
V
|
+ (IgM)
|
+
|
V
|
|
Guérison
|
-
|
-
|
+
|
+ (IgM)
|
+
|
-
|
|
Hépatite chronique avec virus circulant
|
+
|
+
|
-
|
+
|
-
|
+
|
|
Hépatite chronique sans virus circulant
|
+
|
-
|
-
|
+
|
+
|
-
|
|
Porteur asymptomatique avec virus circulant
|
+
|
+
|
-
|
+
|
-
|
+
|
|
Porteur asymptomatique sans virus circulant
|
+
|
-
|
-
|
+
|
+
|
-
|
Tableau II : Différentes
situations sérologiques rencontrées au cours de l'infection
à
VHB
1.7.2. MARQUEURS DE REPLICATION VIRALE
La recherche de l'ADN viral dans le sang est la méthode
de référence pour détecter la présence de virion.
Il existe :
Ø des techniques basées sur le principe
d'hybridation de l'ADN avec amplification du signal (bDNA). Les
résultats sont exprimés de façon quantitative. La limite
est le manque de standardisation des kits de dosage et de l'unité de
mesure de l'ADN du VHB. Les tests ont des sensibilités et des gammes de
linéarité différentes ;
Ø des techniques basées sur le principe de la
PCR (Polymerase Chain Reaction) classique ou en temps réel. La
sensibilité est meilleure avec des seuils de détection à
200 copies par ml, voire à 64 copies par ml pour les techniques de PCR
en temps réel (Cobas Taqman).
Il y a actuellement très peu de données pour
trouver une signification clinique aux différents niveaux des charges
virales. Cependant, de nombreuses études anciennes laissent penser que
le niveau de 105 copies/ml, seuil de sensibilité des techniques
n'utilisant pas la PCR, représente le seuil au dessous duquel
l'hépatite serait non progressive et inactive [1].
1.7.3. HISTOLOGIE
La Ponction Biopsie Hépatique (PBH) permet de confirmer
le diagnostic d'hépatite chronique B, de détecter les autres
causes de maladie hépatique, de juger la sévérité
de l'activité nécrotico-inflammatoire, ainsi que de la fibrose
[1].
L'infection par le VHB peut être associée
à une maladie du foie active ou inactive. Une maladie active secondaire
à l'infection par le VHB se définit par un taux de transaminases
élevé et/ou une inflammation à l'histologie
hépatique qui ne peut être expliquées par une autre cause
que l'infection par le VHB. Une maladie inactive du foie est définie par
un taux de transaminases normal et ou l'absence ou une minime inflammation
à l'histologie [1].
1.8. TRAITEMENT
1.8.1. TRAITEMENT CURATIF
1.8.1.1. Principes généraux
[23]
A la phase aiguë de l'hépatite virale B, le
traitement antiviral spécifique est inutile. Seules des mesures
symptomatiques peuvent être prises, associées à
l'éviction de l'alcool et des médicaments
métabolisés par le foie. Une transplantation hépatique
d'urgence est nécessaire dans la forme fulminante.
Le traitement antiviral spécifique trouve sa place dans
l'hépatite chronique B, l'objectif étant d'obtenir l'arrêt
de la réplication virale, afin de prévenir l'évolution
naturelle de la maladie vers les complications.
La réponse au traitement comporte 3 phases :
Ø La première phase marquée par une
diminution de la réplication virale, traduite par une diminution de
l'ADN viral sérique. L'activité de l'hépatite chronique
régresse, la fibrose se stabilise et peut même diminuer ;
Ø La deuxième phase intervient lorsque
l'activité antivirale est suffisamment forte et prolongée,
accompagnée d'une réponse immunitaire adaptée avec la
clairance des hépatocytes infectés. Une séroconversion HBe
peut intervenir et le risque de réactivation est faible ;
Ø La troisième phase marquée par une
réplication virale complètement interrompue (l'ADN
indétectable). La séroconversion HBe est stable, l'AgHBs
disparait avec ou sans apparition des anticorps anti-HBs. Le risque de
réactivation spontanée est nul et l'activité disparait.
1.8.1.2. Antiviraux actuellement disponibles
[23]
Actuellement en France, trois molécules ont
l'autorisation de mise sur le marché dans le traitement de
l'hépatite virale chronique B. il s'agit de l'interféron, de la
lamivudine et de l'adénofovir.
1.8.1.2.1. Interféron
Les interférons sont des glycoprotéines de la
famille des cytokines endogènes sécrétées par les
lymphocytes et les macrophages activés, en réponse à de
nombreux stimuli en particulier les infections virales. Il en existe deux types
d'activités biologiques différentes. Ce sont :
l'interféron standard et l'interféron alpha 2a sous forme
pégylée.
Les interférons ont 3 types d'activité anti
virale :
· Inhibition de la transcription des ARNm et de
l'encapsidation du génome viral ;
· Stimulation des lymphocytes TCD8+ cytotoxiques et
augmentation de l'expression des molécules HLA de classe1 membranaires,
aboutissant à une présentation plus efficace des antigènes
viraux aux lymphocytes T cytotoxiques ;
· Activité anti tumorale.
1.8.1.2.2. Interféron standard
On distingue : l'interféron alpha 2a
(Roféron A®) et l'interféron alpha 2b (Intron A®).
L'interféron entraine une réponse virologique
prolongée (séroconversion stable 24 semaines après
l'arrêt du traitement) dans 20 à 40% des cas [23].
Les posologies recommandées à l'heure actuelle
sont 5 millions d'unités par jour ou 10 millions d'unités trois
fois par semaine, par voie sous cutanée.
La durée du traitement est de 24 semaines dans les cas
d'hépatite chronique B AgHBe positif et au moins 48 semaines en cas
d'AgHBe négatif [23].
Les effets secondaires de l'interféron sont
fréquents et nombreux, mais peu graves et réversibles à
l'arrêt du traitement ; le plus fréquent est le syndrome
grippal, habituellement modéré. D'autres sont plus rares mais
peuvent être graves ; tels que : le syndrome dépressif,
la décompensation d'une psychose préexistante et la dysthyroidie.
Sont également possibles : asthénie, amaigrissement,
alopécie, troubles du sommeil, troubles de la concentration, troubles de
l'humeur, sécheresse cutanée et biologiquement une
neutropénie et une thrombopénie.
1.8.1.2.3. Interféron
pégylé
L'interféron pégylé est
l'interféron standard, conjugué à une molécule de
polyéthylène glycol (PEG). Cette conjugaison permet de diminuer
la clairance rénale de l'IFN, augmentant ainsi la demi-vie plasmatique
de la molécule. La concentration plasmatique est donc plus stable,
permettant une seule injection par semaine.
L'IFN PEG administré en une injection par semaine est
plus efficace, dans le traitement de l'hépatite chronique B AgHBe
positive, que l'IFN standard en trois injections par semaine.
La tolérance est comparable à celle de l'IFN
standard.
Il existe sous le nom d'interféron alpha 2a sous forme
pégylée (Pegasys®) [23].
1.8.1.2.4. Lamivudine
La lamivudine est un analogue nucléosidique qui inhibe
directement l'ADN polymérase du VHB par intermédiaire de son
métabolite triphosphorylé (lamivudine 5'-triphosphate). Elle agit
également par effet terminateur de chaine.
Initialement, elle avait été
développée comme inhibiteur de la transcriptase inverse du VIH,
puis elle s'est révélée efficace à faible
concentration contre le VHB. Elle est commercialisée sous le nom de
Zeffix® dosée à 100 mg.
Les avantages de la lamivudine sont la prise orale par
comprimé à 100 mg, une excellente tolérance, un effet anti
viral rapide.
Son inconvénient majeur est l'apparition de souches
résistantes à la lamivudine par sélection de mutants dans
la région YMDD de la polymérase. Le taux de résistance
dépend de la durée du traitement : 24% à 1 an, 38%
à 2 ans, 50% à 3 ans et 67% à 4 ans, selon LIAW [24].
Une élévation d'un log (facteur 10) de l'ADN
sérique sous traitement par lamivudine doit faire évoquer la
survenue d'une résistance et introduire l'adénofovir en
poursuivant la lamivudine jusqu'à ce que l'adénofovir ait
provoqué une réponse virologique [23].
1.8.1.2.5. Adénofovir
La molécule administrée est l'adénofovir
dipivoxil, commercialisée sous le nom de Hepsera®,
précurseur de l'adénofovir, analogue nucléosidique de
l'adénosine mono phosphate.
« In vivo », l'adénofovir
dipivoxil est métabolisé en adénofovir, lui-même
phosphorylé en adénofovir diphosphate, métabolite actif,
inhibiteur compétitif de l'ADN polymérase qui bloque la
synthèse de l'ADN du VHB [23].
Peu d'études sont actuellement disponibles concernant
l'adénofovir dipivoxil, mais une résistance a été
récemment décrite, par sélection d'un virus mutant au
niveau du domaine D de la polymérase en position 236, par remplacement
d'une asparagine par une thréonine (rtN236T). Ce mutant reste sensible
à la lamivudine.
1.8.1.2.6. Nouveaux antiviraux
De nouvelles molécules sont en cours d'étude
pour le traitement de l'hépatite chronique B : la ténofovir,
l'entécavir, l'emtricitabine, la telbuvidine et la clévudine
[23].
La ténofovir et l'emtricitabine sont déjà
utilisés dans le traitement anti VIH et sont entrain d'être
testés dans le traitement anti VHB.
1.8.1.3. Stratégie
thérapeutique
L'interféron standard est actuellement la
molécule recommandée en première intention dans le
traitement de l'hépatite chronique B [1]. En pratique il est
supplanté par l'INF PEG, étant donné son efficacité
et sa meilleure maniabilité [23].
En cas d'échec ou de contre-indication au traitement
par interféron, la lamivudine ou l'adénofovir doivent être
utilisés.
La durée du traitement par la lamivudine et
l'adénofovir est mal connue. En cas de séroconversion HBe, la
règle est de poursuivre le traitement pendant 3 à 6 mois, afin de
réduire le risque de, réactivation. En l'absence de
séroconversion dans l'hépatite chronique B AgHBe positif ou dans
le cas d'hépatite chronique AgHBe négatif, le traitement doit
être poursuivi tant qu'il est efficace, c'est-à-dire tant qu'il
n'y a pas de réactivation due à une résistance [24].
1.8.1.4. Indications du traitement
antiviral
Le traitement antiviral ne s'envisage que dans le cadre des
hépatites B chroniques. Le principal facteur à prendre en compte
est la gravité de la maladie hépatique, déterminée
par la PBH.
Le traitement est indiqué chez les patients ayant une
activité modérée ou sévère (activité
METAVIR= A2) et/ou une fibrose sévère (fibrose METAVIR=F2).
Les patients ayant une activité hépatique minime
et/une fibrose minime ne doivent pas être traités, mais
surveillés de façon régulière, afin d'instaurer un
traitement en cas d'apparition d'une activité modérée ou
sévère.
Les patients AgHBs positifs avec des manifestations extra
hépatiques doivent être traités si la multiplication est
active et jugée responsable de ces manifestations.
Au stade des complications, les patients doivent être
traités [1, 23].
1.8.2. TRAITEMENT PREVENTIF
Le traitement préventif de l'infection à VHB
repose sur les mesures d'hygiène, l'immunisation passive et la
vaccination.
1.8.2.1. Mesures d'hygiène
Les mesures d'hygiène visent à éviter la
survenue de l'infection à VHB. Les mesures les plus pertinentes
sont : l'utilisation des préservatifs, l'éviction du don de
sang des échantillons positifs pour l'AgHBs, pour les anticorps anti-HBc
ou ayant les transaminases élevés, l'utilisation du
matériel médico chirurgical et dentaire à usage unique ou
correctement stérilisé, le port de gants lors des soins,
programmes de réduction de drogues illicites par voie veineuse et la
proscription absolue du partage interindividuel du matériel pouvant
être en contact avec le sang (brosse à dents, rasoirs,...)
[21].
1.8.2.2. Immunisation passive
L'immunisation passive repose sur l'injection
d'immunoglobulines spécifiques anti-HBs obtenues à partir de
sujets immunisés contre le VHB. Elle confère une protection
immédiate mais transitoire (environ 6 semaines) et permet de
réduire de 75% le risque d'hépatite B chez les patients ayant eu
un contage pour le VBH [21] :
Ø Contamination accidentelle par piqûre ou
blessure par des produits sanguins contenant l'AgHBs dans les 48 heures
suivant ;
Ø Contact sexuel avec un sujet infecté par le
VHB ;
Ø Sujet à risque élevé d'infection
par le VHB (hémodialysés) pour couvrir la période
précédent la protection par la vaccination ;
Ø Transplantation hépatique chez un porteur
chronique de l'AgHBs, en dehors de toute virémie détectable avant
la transplantation ;
Ø Nouveau-né de mère porteuse d'AgHBs.
Les posologies recommandées sont : 500 UI en cas
de contage accidentel, 30 UI/Kg chez le nouveau-né et 10 000 UI
tous les mois chez les greffés hépatiques infectés par le
VHB et pendant une durée prolongée afin de maintenir un taux
d'anticorps supérieur à 500 mUI/ml.
1.8.2.3. Vaccination
La vaccination est pratiquée de façon courante
depuis les années 80 et repose sur l'injection de l'AgHBs
destinée à induire la production d'anticorps anti-HBs
neutralisants. Les vaccins actuellement disponibles sont produits par
génie génétique et contiennent de l'AgHBs recombinant et
éventuellement d'autres sous unités de l'enveloppe virale.
Les vaccins actuellement disponibles en France sont
[23] :
Ø GENHEVAC B®constitué d'une suspension
inactivée et purifiée de l'AgHBs contenant les protéines S
et pré-s ;
Ø ENGERIX B contenant l'AgHBs purifié ;
Ø TWINRIX est un vaccin combiné, contre
l'hépatite B et l'hépatite A ;
Ø INFANRIX HEXA, est un vaccin combiné
hexavalent contre la diphtérie, le tétanos, la coqueluche, la
poliomyélite et l'haemophilus influenzae b.
La vaccination est indiquée chez tous les
nouveau-nés, tous les sujets à risque d'infection par le
VHB (toxicomanes, sujet avec multiples partenaires sexuels, acteurs des
soins médicaux) et les femmes enceintes des pays où la
vaccination anti-VHB n'est pas pratiquée [23].
Les vaccins sont administrés par voie intramusculaire
selon un schéma classique de 3 doses (0, 1 et 6 mois). Au-delà de
ces 3 injections, il n'est plus nécessaire d'effectuer des rappels
systématiques, la diminution du titre des anticorps anti-HBs sous le
seuil de 10 mUI/ml ne signant pas l'absence de protection.
1.9. GENOTYPES DU VHB
1.9.1. CONCEPTS GENERAUX
Historiquement, la variabilité du VHB a
été évaluée par des techniques sérologiques
utilisant des anticorps monoclonaux dirigés contre l'AgHBs, aboutissant
à une classification sérologique. Celle-ci est définie par
un déterminant antigénique « a »
commun aux différents sous types et deux paires de déterminant
exclusifs d/y, w/r. Après des divisions en 4 types majeurs
(adw, adr, ayw et ayr), un total de 9 sous-types a
été identifié (adw1, adw2, ayw1, ayw2, ayw3,
ayw4, adwyq+ et ayr), en fonction des
différents déterminants liés à des mutations
nucléotidiques d'une région immunologiquement compétente
de l'AgHBs [26].
Grâce aux techniques de séquençage complet
de l'ADN viral, un système de classification génétique du
VHB a été établi. On dénomme par VHB un groupe
complexe de virus relativement proches ayant une spécificité
d'hôte et caractérisés par la présence d'au moins un
des critères suivants :
· Une divergence intergroupe de 8% ou plus de la
séquence nucléotidique dans tout le génome ;
· Une divergence de 4,1% ou plus dans le gène de
surface (pré-S1, pré-S2 et S) [26].
A l'heure actuelle, on définit chez l'homme 8
génotypes du VHB, dénommés A, B, C, D, E, F, G et H. bien
qu'il existe de nombreuses corrélations entre sous-types et
génotypes. C'est le génotype qui est maintenant utilisé
pour étudier la variabilité génétique.
1.9.2. MECANISMES DE VARIATION GENETIQUE
La variabilité génétique du VHB peut
être expliquée par la résultante d'un équilibre
entre plusieurs facteurs [26] :
Ø Les erreurs d'incorporation de la polymérase
non corrigées par l'absence d'activité 3'-5' exonucléase,
le nombre total d'erreurs étant de 1010 paires de bases par
jour ;
Ø L'espace de la réplication virale,
correspondant à la capacité d'intégration par les
hépatocytes de nouveaux ADN superenroulés ;
Ø La pression de sélection exercée lors
de certains traitements ;
Ø Le fitness, c'est-à-dire le pouvoir infectieux
propre à chaque souche virale.
La majorité des particules virales ainsi formées
sont défectives et ne peuvent pas se répliquer. Certains variants
viraux sont, par contre, capables d'infecter de nouvelles cellules, de se
multiplier et d'être sélectionnés.
L'accumulation des mutations, la sélection des
séquences virales les mieux adaptées, la transmission des virus
correspondants au sein d'aires géographiques ou de groupes
épidémiologiques déterminés ont conduit à la
divergence progressive à partir de leur ancêtre viral commun selon
un processus darwinien classique [26].
1.9.3. METHODES DE GENOTYPAGE
Il existe actuellement 4 méthodes principales pour
déterminer les génotypes du VHB. Les deux plus souvent
utilisées sont l'étude du polymorphisme de restriction (RFLP pour
Restriction Fragment Length Polymorphisms) et le LiPA (Line Probe
Assay).
1.9.3.1. Séquençage direct
L'ADN viral est extrait du sérum du patient, puis
amplifié par une méthode de PCR utilisant des amorces dans des
régions spécifiques. Le séquençage est
réalisé sur les produits de la PCR et les séquences sont
comparées aux séquences correspondant connues pour chaque
génotype. C'est une méthode très sensible, actuellement
considérée comme référence en termes de
génotypage du VHB.
Ses limites sont un coût élevé et la
nécessité d'un travail intense, limitant son utilisation à
grande échelle en clinique [26].
1.9.3.2. Etude du polymorphisme de restriction
Comme lors du séquençage direct, l'ADN viral est
extrait du sérum et amplifié en utilisant une méthode de
PCR. Les produits de la PCR, contenant des régions spécifiques du
génotype viral sont ensuite digérés par des enzymes de
restriction et migrent par électrophorèse sur gel d'agarose.
Après coloration, les profils de migration sont comparés aux
profils de migration connus spécifiques de chaque génotype.
L'étude du polymorphisme de restriction est plus simple
à mettre en évidence que le séquençage direct. Elle
est donc plus largement utilisée, notamment lors des études
épidémiologiques [26].
1.9.3.3. Méthode ELISA (Enzyme-Linked
Immunosorbent Assay)
C'est une méthode immunologique qui utilise un
anticorps fixe, dirigé contre le déterminant commun a de l'AgHBs,
afin de capturer l'AgHBs dans le prélèvement. On ajoute ensuite
un anticorps monoclonal spécifique du génotype recherché,
afin de typer le génotype viral contenu dans l'échantillon.
Il existe une étroite corrélation entre le
niveau de détection de l'AgHBs et la capacité de
déterminer le génotype par ELISA. Bien que les kits ELISA soient
simples d'utilisation et peu couteux, il est possible que les patients avec de
faibles taux d'AgHBs circulant ne puissent bénéficier de cette
méthode pour déterminer le génotype de leur virus [26].
1.9.3.4. Méthode LiPA
C'est une technique d'hybridation après amplification
par PCR. Des séquences spécifiques des génotypes sont
connues dans les régions du gène de l'AgHBs. Des sondes
complémentaires de ces régions spécifiques sont
synthétisées et fixées sur un support. Les produits de la
PCR du gène S sont mis en présence des bandelettes
réactives et vont s'hybrider en fonction de leur
complémentarité avec les sondes. On peut ainsi déterminer
les génotypes viraux en comparant les profils d'hybridation avec des
abaques références. C'est une technique fiable et disponible
[26].
1.9.4. DONNEES EPIDEMIOLOGIQUES
Les génotypes du VHB sont retrouvés de
façon ubiquitaire dans le monde, mais il est maintenant établit
que leur distribution varie en fonction des données
géographiques. Ainsi, on peut établir une cartographie (Figure 5)
reflétant la distribution des génotypes prédominants dans
chaque région du globe [27].
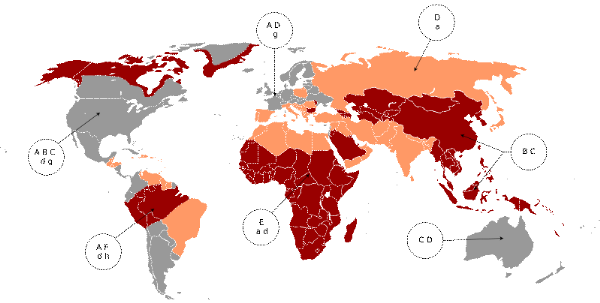
Figure 6. Répartition
géographique des principaux génotypes du VHB [27]
1.9.5. DIFFERENCES VIROLOGIQUES
Différentes études se sont
intéressées aux mutations du VHB et à leur
éventuelle corrélation avec le génotype viral. Ce sont les
mutations pré-core et BCP responsables de l'hépatite chronique
AgHBe positif, qui ont fait l'objet du plus grand nombre d'études.
1.9.5.1. Génotypes et mutation
pré-core
Dans la séquence d'ADN du VHB, la guanosine en position
1896 s'apparie avec le nucléotide en position 1858 (codon 15) pour
former une structure circulaire hautement conservée, signal
d'encapsidation du virus.
Chez les souches sauvages du VHB de génotypes B, C, D,
E et G, ce nucléotide en position 1858 est une thymidine qui forme, avec
la guanosine en position 1896 de la séquence d'encapsidation, une
structure circulaire peu stable. La mutation (G A) en position 1896
crée un codon stop responsable de l'arrêt de l'expression de
l'AgHBe, mais stabilise la structure circulaire de l'encapsidation du virus par
appariement (T-A), ce qui favorise la multiplication virale.
Inversement chez les souches sauvages de VHB de
génotypes A, F, H et quelques C, le nucléotide en position 1858
est une cytidine qui s'apparie de façon stable avec la guanosine en
position 1896 (C-G). La mutation (G A) en position 1896
déstabilise la structure et, est rarement observée chez les
patients infectés par les génotypes A, F et H, à moins
qu'elle ne survienne de façon concomitante avec une autre mutation comme
C1858T [28].
Chu et al ont montré que sur les 694 patients
de leur étude aux Etats Unis en 2003, 27% présentaient des
mutations pré-core. Ces mutations étaient plus fréquentes
chez les patients porteurs de virus de génotypes D (73%) et B (46%) et
rares chez les porteurs de virus de génotype A (3%) [29].
1.9.5.2. Génotypes et mutation
BCP
Les mutations BCP présentent une double substitution
nucléotidique A1762T et G1764A. Elles ont une sécrétion de
l'AgHBe réduite de 70%. Ces mutations n'affectent pas la transcription
des ARN prégénomiques ni la traduction des protéines de
core ou de la polymérase. Au contraire, elles contribuent à
accroitre la réplication virale, d'une part, en levant l'effet
inhibiteur de l'AgHBe sur la réplication virale, d'autre part, en
supprimant la synthèse des ARN messagers pré-core et core, au
profit de la synthèse des ARN prégénomiques [4].
La coexistence des mutations pré-core et BCP est
possible chez un même individu, notamment en cas d'infection par un virus
de génotype D [29].
1.9.6. CONSEQUENCES CLINIQUES
Actuellement, peu d'études sont informatives sur les
conséquences cliniques du génotypage du VHB. Des analyses
comparant un grand nombre de patients infectés par les principaux
génotypes et soumis aux mêmes protocoles thérapeutiques et
de surveillance, sont nécessaires pour prouver l'utilité du
génotypage du VHB en pratique clinique. Fréquemment, les
études asiatiques comparent les génotypes B et C, alors que les
études occidentales comparent le plus souvent les génotypes A et
D.
Il est clairement établi que tous les génotypes
viraux sont potentiellement infectants pour les individus et peuvent conduire
à une hépatite aiguë ou chronique, à la cirrhose, au
CHC et à la mort. Le taux de progression de la maladie et l'importance
des lésions hépatiques pourraient varier en fonction des
génotypes viraux, mais aussi être influencés par des
facteurs environnementaux et par l'hôte [28].
Wai et al ont démontré que l'infection
par un virus de génotype C est associée à une maladie
hépatique plus sévère que celle observée au cours
de l'infection par un virus de génotype B. Ainsi, dans le cas d'un
génotype C, les taux de transaminases et de l'ADN viral sont plus
élevés. De même, l'histologie hépatique est plus
sévère et le risque de cirrhose et plus élevé [26].
Par ailleurs, une étude réalisée à Hong Kong
révèle que le taux de séroconversion HBe est plus
important dans le cas d'un génotype B que C [30].
Sanchez-Tapias et al ont montré que
l'infection chronique due au virus au génotype A aurait un meilleur
pronostic que celles dues aux génotypes D et F. Les réponses
biochimiques et virologiques se rencontrent plus fréquemment chez les
sujets infectés par un virus au génotype A que chez ceux
infectés par le virus au génotype D ou F [31].
En France, une étude récente concernant 308
patients co-infectés par le VIH révèle que le fait
d'être infecté par un virus au génotype G est un facteur
d'évolution rapide vers la fibrose hépatique [32].
1.9.7. GENOTYPES ET TRAITEMENT
1.9.7.1. Génotypes et traitement par
l'interféron
Il existe des différences dans la réponse
à l'INF en fonction du génotype viral. Les données
disponibles comparent les génotypes A et D en rapport avec la
distribution géographique.
En effet, le taux de réponse au traitement par l'INF
est meilleur chez les patients infectés par un virus au génotype
A que ceux infectés par un virus au génotype D. De même, la
réponse au traitement par l'INF est meilleure chez les patients
infectés par un virus au génotype B que ceux infectés par
un virus au génotype C [33].
1.9.7.2. Génotypes et traitement par
lamivudine
A ce jour, peu d'études comparent l'efficacité
de la lamivudine en fonction du génotype. Ces études ne sont pas
comparables compte tenu du faible nombre de patients et des différents
protocoles thérapeutiques adoptés et les résultats sont
contradictoires [34].
Il est donc impossible d'affirmer qu'il existe des
différences dans la réponse au traitement de l'hépatite
chronique B par la lamivudine en fonction du génotype viral.
La résistance à la lamivudine en fonction du
génotype viral est également restreinte à quelques
études qui ne permettent pas de conclure à un rôle du
génotype à la survenue de mutants YMDD [34].
1.9.7.3. Génotypes et traitement par
adénofovir
La réponse virologique au traitement par
adénofovir ne semble pas être influencée par le
génotype du virus responsable de l'hépatite chronique B, comme en
témoignent les résultats de Westland et coll. Concernant 694
patients traités par 10 mg d'adénofovir pendant 48 semaines
[35].
1. CADRE D'ETUDE
Les données épidémiologiques ont
été collectées d'une part par l'intermédiaire d'une
fiche d'enquête standardisée (annexe1), élaborée
spécifiquement pour notre étude; d'autre part, par
l'intermédiaire des registres au Centre inter départemental de
Transfusion Sanguine (CIDTS) de Pointe-Noire.
PATIENTS ET METHODES
Les prélèvements ont été
analysés d'une part au laboratoire de l'Hôpital
Général de Loandjili (HGL) et d'autre part au laboratoire de
virologie/UPRES EA 3610, Faculté de Médecine, Université
Lille II, CHRU Lille, Centre de Biologie Pathologie et Parc EURASANTE.
1.1. Laboratoire de l'HGL
L'Hôpital Général de Loandjili (HGL) est
situé dans l'arrondissement 4 de Pointe-Noire. Il dispose de quatorze
(14) services cliniques et de trois (3) services médico-techniques,
parmi lesquels le laboratoire, où notre étude a été
réalisée.
Le Laboratoire comporte 7 unités (anatomo-pathologie,
virologie, hématologie, biochimie, parasitologie-mycologie,
séro-immunologie et l'unité de bactériologie). Il est
dirigé par le Docteur Donatien MOUKASSA, anatomo-pathologiste.
1.2. Centre inter départemental de Transfusion
Sanguine de Pointe Noire
Le centre inter départemental de transfusion sanguine
de Pointe Noire est situé dans l'arrondissement 1(LUMUMBA) de
Pointe-Noire, dans l'enceinte de l'Hôpital Général Adolphe
CISSE. Il dessert la totalité des 2 départements à savoir
Pointe-Noire et Kouilou, couvrant ainsi une superficie d'environ 13.500
Km2 pour une population de 900.870 Habitants [36].
Ce centre comprend 6 services essentiels : Accueil,
Consultation, Prélèvement, Laboratoire, Production et
Distribution. Il est dirigé par le Docteur Alphonse SAMBA, biologiste,
secondé par 3 médecins pour le service de Consultation et de 5
techniciens supérieurs de Laboratoire.
1.3. Centre Hospitalier Régional et Universitaire de
Lille
Le site du CHRU de Lille s'ouvre sur l'environnement de
l'agglomération lilloise. Il est implanté sur 170 hectares. C'est
un pôle de référence dans le domaine de la qualité
et de la sécurité des soins.
Le CHRU regroupe 11 hôpitaux, 27 cliniques et
instituts, un centre de soin dentaire et un nouveau centre de Biologie
pathologie. C'est dans ce dernier que sont réalisées les
activités diagnostiques du Laboratoire de Virologie.
Le Laboratoire de virologie
Le Laboratoire de Virologie du CHRU de Lille est
composé de 4 Unités Fonctionnelles Communes de Moyens
(UFCM) :
- 1 UFCM de Virologie : Recherche, Développement,
Innovation, Expertise et Formation (UF 9711) dans laquelle s'inclut l'EA
3610 de l'université de Lille 2.
- 3 UFCM de Virologie Médicale impliquées dans
les activités diagnostiques :
- UFCM de Virologie conventionnelle
- UFCM de Virologie moléculaire
- UFCM de Virologie sérologique
Jusqu'en 1988, le Laboratoire de Virologie était
situé à l'Institut Pasteur de Lille. Son transfert s'effectua
à l'Institut Gernez Rieux au CHRU de Lille. En mai 2001, le laboratoire
s'est installé dans le bâtiment Paul Boulanger à
l'hôpital Albert Calmette.
Actuellement, les activités de l'UFCM de
Virologie : Recherche, Développement, Innovation, Expertise et
Formation, sont réalisées dans le laboratoire de virologie/EA3610
qui se trouve depuis Juin 2008 sur le Parc EURASANTE, tandis que les UFCM du
Laboratoire de Virologie impliquées dans les activités
diagnostiques ont été transférées les 6 et 7 juin
2007 dans le Centre de Biologie et Pathologie.
Depuis septembre 2003, le chef du service du Laboratoire de
Virologie est le Professeur Didier HOBER qui a créé en 2002
l'UPRES EA 3610 « Pathogenèse virale du diabète de type
1 » ainsi que l'UFCM Virologie : Recherche,
Développement, Innovation, Expertise et Formation.
2. TYPE ET PERIODE D'ETUDE
Il s'agit d'une étude transversale, comparative
à recueil des données prospectif allant de Novembre 2007 à
Mai 2008, soit une période de 6 mois.
3. POPULATION DE L'ETUDE
3.1. Critères d'inclusion
Ont été inclus, les sujets ayant un
résultat positif de l'AgHBs parmi les donneurs de sang du CIDTS de
Pointe Noire et ayant accepté de participer volontairement à
l'étude, en signant la fiche de consentement personnel.
3.2. Critères d'exclusion
Ont été exclus, les sujets perdus de vu,
après un résultat positif au CIDTS et ceux ayant refusé de
participer à l'étude.
4. Echantillonnage
Un échantillon de 20 sujets a été
constitué sur l'ensemble des donneurs de sang ayant l'Ag HBs positif. La
méthode utilisée est l'échantillonnage par méthode
aléatoire simple. C'est-à-dire par tirage au sort.
5. METHODES
5.1. Variables étudiées
Les variables épidémiologiques sont : le
sexe, l'âge, facteurs de risque de contamination par le VHB et les
antécédents.
Les variables biologiques sont : l'Ag HBs, la
coïnfection (VIH et VHC), l'ADN total et l'ADN viral.
5.2. Analyses sérologiques
5.2.1. Ag HBs
L'Ag HBs a été réalisé avec la
technique de MONOLISA test HBs ultra (BIO-RAD, France). C'est une technique
immuno-enzymatique de type « sandwich » en un temps
utilisant des anticorps monoclonaux et des anticorps polyclonaux
sélectionnés pour leur capacité à se lier aux
différents sous-types de l'Ag HBs et la plupart des souches variantes de
l'hépatite B.
Tous les 20 échantillons ont été
traités avec le même protocole (annexe 2) et les résultats
interprétés de la manière suivante :
La valeur seuil a été calculée en
utilisant la formule suivante :
VS= DO R3+ 0,
050
Avec :
- VS : Valeur Seuil
- DO R3 : Densité optique moyenne
du contrôle négatif (Fourni).
La valeur seuil a été donc de
0,050.
Les ratios ont été calculés selon la
formule suivante :
Pour chaque échantillon : Ratio = DO
échantillon/VS
Ainsi les échantillons dont le ratio est
inférieur à 1 sont considérés négatifs et
les échantillons dont le ratio est supérieur ou égal
à 1 ont été considérés comme initialement
positifs avant d'être retestés en double pour
l'interprétation finale.
La spécificité de ce test est estimée
à 99,94% et la sensibilité à
100%.
Pour l'interprétation, 3 groupes ont été
constitués en fonction du taux de ratio de l'Ag HBs, en intervalle de
1]1 - 2] ; ]2 - 3] et ]3 - 4].
5.2.2. VIH
Le test utilisé pour la recherche du VIH est le
« MUREX HIV Ag/AB Combination » (Murex Biotech Limited,
Angleterre), selon les instructions du fabricant.
5.2.3. VHC
Pour rechercher le VHC nous avons utilisé le MUREX
anti-HCV version 4.0 pour la détection d'anticorps anti VHC.
5.3. Recueil et conservation des échantillons
Les patients sélectionnés ont été
convoqués et un prélèvement sur le tube EDTA a
été réalisé. D'abord, le sang total a
été déposé sur un papier buvard selon le protocole
ci-après, et puis le reste a été centrifugé pendant
10 minutes à 2500 tours/ minute. Enfin, le plasma recueilli a
été également déposé sur un papier buvard,
selon le protocole ci-après. Il s'agit du papier buvard utilisé
pour le test de Guthrie (Figure 7).

Figure 7. Carte de Guthrie
Sur 5 spots, nous avons déposé 30 ul de sang
total chacun et sur 4 spots 30 ul de plasma chacun. Puis la carte a
été séchée à température ambiante
sous ventilateur.
La conservation a été réalisée
selon deux protocoles : pour chaque patient, une carte comportant 5 spots
de sang total et 4 spots de plasma a été conservée
à une température de - 20° C et une autre comportant 5
spots de sang total et 4 spots de plasma conservée à une
température ambiante.
Ainsi 2 groupes ont été
constitués :
Ø Groupe I : Echantillons constitués de
sang total et de plasma conservés à -20°C avec 2 sous
groupes :
· Sous Groupe Is : Sang total conservé
à -20°C ;
· Sous Groupe Ip : Plasma conservé à
-20°C.
Ø Groupe II : Echantillons constitués de
sang total et de plasma conservés à température ambiante,
avec 2 sous groupes :
· Sous Groupe IIs : Sang total conservé
à température ambiante;
· Sous Groupe IIp : Plasma conservé à
température ambiante.
5.4. Transport
Les cartes conservées à température
ambiante (Groupe II) ont été transportées à
température ambiante dans les enveloppes papiers et les cartes
conservées à - 20° C (Groupes I) ont été
transportées dans des sacs plastiques, contenus dans un pack de camping
contenant la glace pilée. Le transport a duré 8 heures. Les
échantillons conservées à - 20°C sont restés
32 heures hors de leurs conditions initiales.
5.5. Protocoles d'élution et d'extraction
d'ADN
A l'arrivée au laboratoire de Virologie/EA3610 de
Lille, les cartes initialement conservées à - 20°C ont
été remises dans les mêmes conditions, tandis que celles
gardées à température ambiante ont été
gardées comme telle.
Dans le but d'obtenir une méthode d'extraction de l'ADN
total à partir des échantillons séchés sur les
papiers buvards, 2 protocoles ont été réalisés dans
les premières semaines de ce travail. Le premier protocole, utilisant le
kit QIAGEN (QIAGEN S.A, Coutrabeuf, France), décrit par Jardi et al
[37]. Le deuxième protocole a été décrit par
Vauloup-Fellous et al [38]. Il a été utilisé avec
quelques modifications. C'est une méthode dite
« chimique », utilisant le Phenol Chloroforme.
Une première phase expérimentale a
précédé notre étude. Il s'est agi d'une extraction
réalisée sur un sujet, dont le statut VHB n'est pas connu, qui a
été soumis aux mêmes conditions de
prélèvement et de traitement que nos patients, en utilisant les 2
méthodes d'extraction afin de pouvoir les comparer.
Une deuxième phase expérimentale a
consisté à l'extraction des plasmas de deux sujets connus VHB
positif (ADN viral positif) en utilisant les 2 méthodes.
L'extraction de l'ADN de l'ensemble des sujets de
l'étude a été réalisée en utilisant le
protocole décrit par Vauloup-Fellous et al.
5.6. Dosage de l'ADN total
L'ADN total a été dosé en utilisant le
Kit Quant-iT DNA Assay (Terner Biosystems, Sunnyvale Californie, USA) selon le
protocole suivant : 10 ul d'extrait d'ADN et 1ul pour chacun des 8 points
de la gamme étalon ont été ajouté à 200 ul
de la solution de travail dans un puits d'une plaque de micro-titration. La
plaque est ensuite centrifugée brièvement et l'évaluation
de la quantité de l'ADN total s'est faite sur le STRATAGENE Mx 3000p.
Cette évaluation est basée sur le principe de la quantification
absolue par étalonnage avec un standard : les cinétiques
sont mesurées pour différentes concentrations des
échantillons. On en déduit une courbe du Ct en fonction de la
quantité d'ADN et une mesure du coefficient d'efficacité E (qui
doit être le plus proche de 2). La courbe d'étalonnage ainsi
constituée permet de déduire la concentration à partir de
la mesure du Ct.
Pour l'analyse statistique, 4 intervalles ont
été définies en fonction de la quantité de l'ADN
total en ng/ul, avec un pas de 2 :] 5-7] ; ]7-9] ;
]9-11] et ]11-13].
5.6.1. Polymerase chain reaction du VHB
La PCR du VHB a été réalisé par le
COBAS® Taq Man® HBV test (Roche, France)
utilisant le nécessaire « Acide nucléique viral high
Pure system » pour la préparation manuelle des
échantillons et l'analyseur COBAS Taq man 48 pour la détection et
l'amplification automatisée. Il s'agit d'une technique de PCR en temps
réel utilisant les amorces complémentaires spécifiques du
VHB et la détection par sondes oligonucléotidiques doubles ou
clivées, à marquage fluorescent, qui permettent la quantification
du produit cible VHB amplifié (amplicons) et de l'ADN du standard de
quantification VHB, qui est traité, amplifié et
détecté simultanément avec l'échantillon. Les
résultats ont été interprétés à
l'aide du logiciel AMPLILINK version 3.2.
5.6.2. Critères de jugement
Il s'agit des paramètres évalués dans le
but de vérifier l'hypothèse de recherche selon laquelle, pour
éluer et extraire l'ADN du papier buvard, la conservation et le
transport à température ambiante des échantillons
séchés ont plus d'avantages que la conservation et le transport
à - 20°C d'une part et le plasma séché a plus
d'avantages que le sang total séché d'autre part.
Ces critères sont :
- La quantité de l'ADN total élué, elle a
été évaluée en ng/ul
- La charge virale, obtenue après PCR du VHB, elle
a permis de confirmer que l'ADN total élué contient l'ADN du
VHB.
5.6.3. Analyse statistique
Les P-values ont été calculées avec le
programme de comparaison de données qui utilise le test de Mann et
Whitney. La P-value nous permet d'affirmer qu'il existe bien une
différence significative entre deux moyennes. Dans ce cas, sa valeur
doit être inférieure à 0,05.
Nous avons utilisé le programme de
corrélation-régression qui utilise le test de Spearman afin de
déterminer s'il existe une corrélation entre les rendements du
plasma séché et du sang total d'un même patient.
Le programme de comparaison de valeurs appariées a
également été nécessaire pour observer les
différences entre 2 échantillons d'un même patient, ayant
subi divers traitements (conservation et transport).
Le logiciel utilisé pour l'analyse statistique est Epi
Data version 3.0.
RESULTATS
1. Fréquences
Durant les 6 mois de l'étude, nous avons
identifié 1086 sujets ayant l'AgHBs positif sur les 9270 donneurs de
sang, soit une fréquence de 11,71%.
Les sujets de sexe masculin ont représenté
83,04% et ceux de sexe féminin 16,96%.
L'échantillon utilisé a été de 20
sujets ce qui représente 1,81% des 1086 sujets, AgHBs positif, dont 17
hommes (85%) et 3 femmes (15%).
2. Paramètres épidémiologiques de
la Population de l'étude
Tableau III: Tableau
récapitulatif des caractéristiques épidémiologiques
de
la population de l'étude
|
AGE (ans)
|
SEXE
|
PROFESSION
|
FACTEURS DE RISQUES
|
|
1
|
42
|
M
|
Commerçant
|
TRANSFUSION
|
|
2
|
49
|
M
|
Fonctionnaire
|
AUCUN
|
|
3
|
46
|
M
|
Ouvrier
|
AUCUN
|
|
4
|
46
|
M
|
Ouvrier
|
TRANSFUSION
|
|
5
|
38
|
M
|
Ouvrier
|
SEXUEL*
|
|
6
|
28
|
M
|
Sans emploi
|
AUCUN
|
|
7
|
24
|
F
|
Etudiant
|
AUCUN
|
|
8
|
33
|
M
|
Sans emploi
|
AUCUN
|
|
9
|
32
|
M
|
Ouvrier
|
AUCUN
|
|
10
|
34
|
M
|
Ouvrier
|
AUCUN
|
|
11
|
37
|
M
|
Fonctionnaire
|
AUCUN
|
|
12
|
26
|
M
|
Ouvrier
|
AUCUN
|
|
13
|
50
|
F
|
Fonctionnaire
|
AUCUN
|
|
14
|
42
|
M
|
Sans emploi
|
AUCUN
|
|
15
|
20
|
F
|
Etudiant
|
AUCUN
|
|
16
|
32
|
M
|
Ouvrier
|
AUCUN
|
|
17
|
26
|
M
|
Etudiant
|
AUCUN
|
|
18
|
18
|
M
|
Etudiant
|
AUCUN
|
|
19
|
43
|
M
|
Fonctionnaire
|
AUCUN
|
|
20
|
42
|
M
|
Fonctionnaire
|
AUCUN
|
*Sexuel : défini comme facteur de risque ; il
s'agit d'un sujet ayant avoué avoir plusieurs partenaires sexuels
2.1. Age et Sexe
Tableau IV : Répartition de la
population étudiée en fonction de l'âge en années et
du sexe
|
HOMMES
FEMMES TOTAL
N %
N % N %
|
|
15-24 1 5,00
2 10,00 3 15,00
25-34 7 35,00
0 0,00 7 35,00
35-45 6 30,00
0 0,00 6 30,00
45-55 3 15,00
1 5,00 4 20,00
|
|
TOTAL 17 85,00 3
15,00 20 100
|
Les extrêmes d'âge sont 18 et 50 ans avec une moyenne
d'âge de 35,40 #177;9,60
2.2. Facteurs de risque et antécédent
Quatre vingt cinq pour cent des sujets de la population
étudiée n'avaient pas de facteurs de risque d'infection à
VHB. Deux sujets ont l'antécédent de transfusion sanguine comme
facteur de risque et un le comportement sexuel à risque (multiples
partenaires sexuels).
La transfusion remonte à 31 ans pour un sujet et 36 ans
pour l'autre.
Dans la population étudiée, aucun sujet n'a
reçu le vaccin contre le VHB.
3. Paramètres biologiques
3.1. Ag HBs
Tableau V : Tableau récapitulatif
des paramètres biologiques
|
STATUT Ag HBs
|
STATUT VIH
|
STATUT VHC
|
|
1
|
3,644
|
Neg
|
Neg
|
|
2
|
3,134
|
Neg
|
Neg
|
|
3
|
1,927
|
Neg
|
Neg
|
|
4
|
2,7
|
Neg
|
Neg
|
|
5
|
3,472
|
Neg
|
Neg
|
|
6
|
2,204
|
Pos
|
Neg
|
|
7
|
2,47
|
Neg
|
Pos
|
|
8
|
2,045
|
Neg
|
Neg
|
|
9
|
2,618
|
Pos
|
Pos
|
|
10
|
2,247
|
Neg
|
Neg
|
|
11
|
1,997
|
Neg
|
Neg
|
|
12
|
2,314
|
Neg
|
Neg
|
|
13
|
2,482
|
Neg
|
Neg
|
|
14
|
2,186
|
Neg
|
Pos
|
|
15
|
1,824
|
Neg
|
Neg
|
|
16
|
2,058
|
Neg
|
Neg
|
|
17
|
1,923
|
Neg
|
Neg
|
|
18
|
2,048
|
Neg
|
Neg
|
|
19
|
3,377
|
Neg
|
Neg
|
|
20
|
3,686
|
Neg
|
Neg
|
Tous les sujets sélectionnés avaient le
résultat positif à l'Ag HBs c'est-à-dire le ratio
supérieur à 1. La valeur du ratio moyenne est de
2,5#177;0,6 et les extrêmes sont 1,82
et 3,69.
Dix huit sujets ont été testés
négatifs au VIH, soit un taux de 90,00% et 2 sujets positifs, soit un
taux de 10,00%. Ces 2 sujets ont un taux de ratio de l'Ag HBs compris entre 2
et 3, soit un taux de 18,18% des sujets ayant un taux compris entre 2 et 3.
Dix sept sujets ont été testés
négatifs au VHC, soit un taux de 85,00% et 3 sujets positifs soit un
taux de 15,00%.
Soit : deux (2) sujets ayant à la fois le VHB et
le VHC, un sujet ayant le VHB et le VIH et un sujet ayant les 3 infections
recherchées.
3.2. ADN total
3.2.1. ADN total des sujets témoins

Figure 8. Comparaison des rendements d'ADN
total obtenu apres extraction par le Qiagen et la méthode au Phenol
Chlorophorme.
La figure suivante montre les résultats du dosage de
l'ADN total obtenus après extraction utilisant les 2 protocoles pour un
sujet testé non connu Ag HBs:

Figure 9: Courbe standard de la
quantité d'ADN extrait pour le témoin dont le statut VHB n'est
pas connu.
3.2.2. ADN total de la population de l'étude
Tableau VI : Tableau
récapitulatif des résultats de l'ADN total extrait
|
GROUPE I
GROUPE II
Is Ip
IIs IIp
|
|
1
|
7,01
|
7,01
|
7,01
|
7,01
|
|
2
|
7,39
|
7,39
|
7,39
|
7,39
|
|
3
|
7,63
|
7,63
|
7,63
|
7,63
|
|
4
|
7,71
|
7,71
|
7,71
|
7,71
|
|
5
|
7,74
|
7,74
|
7,74
|
7,74
|
|
6
|
9,73
|
9,73
|
9,73
|
9,73
|
|
7
|
6,99
|
6,99
|
6,99
|
6,99
|
|
8
|
8,56
|
8,56
|
8,56
|
8,56
|
|
9
|
8,94
|
8,94
|
8,94
|
8,94
|
|
10
|
8,47
|
8,47
|
8,47
|
8,47
|
|
11
|
8,22
|
8,22
|
8,22
|
8,22
|
|
12
|
6,4
|
6,4
|
6,4
|
6,4
|
|
13
|
7,8
|
7,8
|
7,8
|
7,8
|
|
14
|
11,86
|
11,86
|
11,86
|
11,86
|
|
15
|
5,68
|
5,68
|
5,68
|
5,68
|
|
16
|
7,52
|
7,52
|
7,52
|
7,52
|
|
17
|
7,04
|
7,04
|
7,04
|
7,04
|
|
18
|
6,52
|
6,52
|
6,52
|
6,52
|
|
19
|
7,21
|
7,21
|
7,21
|
7,21
|
|
20
|
9,59
|
9,59
|
9,59
|
9,59
|
La moyenne de l'ADN total extrait est de 7,90 ng/ul pour
chaque groupe, avec des extrêmes de 5,68 et 11,86 ng/ul

Figure 10. Courbe standard de la
quantité d'ADN total extrait pour l'ensemble de la population.
3.2.2.1. ADN total et âge

Figure 11. Répartition de la
quantité d'ADN en fonction de l'âge
3.2.2.2. ADN total et coïnfection
Les 2 sujets VIH positif ont un taux de l'ADN total compris
entre 7 et 9.
Tableau VII : Répartition de la
quantité d'ADN total en fonction du statut VHC
|
[5-7] [7-9]
[9-11] [11-13]
TOTAL
N % N %
N % N % N
%
|
|
Négatif 3 15,00 12
60,00 2 10,00 0 0,00 17
85,00
Positif 1 5,00 1
5,00 0 0,00 1 5,00 3
15,00
|
|
TOTAL 4 20,00 13 65,00
2 10,00 1 5,00 20 100
|
p=0,075 ; la différence n'est pas
significative
1. PCR du VHB
Tableau VIII : Tableau
récapitulatif des résultats de la PCR du VHB
|
GROUPE I
GROUPE II
Is Ip
IIs IIp
|
|
1
|
Neg
|
Neg
|
Neg
|
Neg
|
|
2
|
Neg
|
Neg
|
Neg
|
Neg
|
|
3
|
Pos
|
Pos
|
Pos
|
Pos
|
|
4
|
Pos
|
Pos
|
Pos
|
Inh
|
|
5
|
Pos
|
Pos
|
Pos
|
Pos
|
|
6
|
Pos
|
Pos
|
Pos
|
Pos
|
|
7
|
Pos
|
Pos
|
Neg
|
Pos
|
|
8
|
Neg
|
Neg
|
Neg
|
Neg
|
|
9
|
Pos
|
Pos
|
Pos
|
Pos
|
|
10
|
Pos
|
Neg
|
Pos
|
Pos
|
|
11
|
Neg
|
Neg
|
Neg
|
Neg
|
|
12
|
Pos
|
Pos
|
Pos
|
Pos
|
|
13
|
Inh
|
Neg
|
Inh
|
Neg
|
|
14
|
Inh
|
Inh
|
Pos
|
Pos
|
|
15
|
Neg
|
Neg
|
Neg
|
Neg
|
|
16
|
Neg
|
Neg
|
Neg
|
Neg
|
|
17
|
Neg
|
Neg
|
Neg
|
Neg
|
|
18
|
Inh
|
Pos
|
Neg
|
Neg
|
|
19
|
Neg
|
Neg
|
Neg
|
Neg
|
|
20
|
Neg
|
Neg
|
Neg
|
Neg
|
3.3. Résultats de PCR en fonction du mode de
conservation
Tableau IX : Répartition des
résultats de la PCR du VHB en fonction des sujets du
groupe I
a. Groupe I
|
Groupe Is
Groupe Ip
N
% N %
|
|
Inhibiteurs 3 15,00
1 5,00
Négatif 9
45,00 11 55,00
Positif 8
40,00 8 40,00
|
|
TOTAL 20 100
20 100
|
p= 0,54, la différence est non significative
b. Groupe II
Tableau X: Répartition des
résultats de la PCR du VHB en fonction des sujets du
groupe II
|
Groupe IIs
Groupe IIp
N
% N %
|
|
Inhibiteurs 1 5,00
1 5,00
Négatif 11
55,00 11 55,00
Positif 8
40,00 8 40,00
|
|
TOTAL 20 100
20 100
|
p= 1,00 ; la différence est non significative
3.4. Résultats de la PCR en fonction du type de
prélèvement
a. Sang total
Tableau XI : Répartition des
résultats de la PCR du VHB du sang total
|
GI
GII
N
% N %
|
|
Inhibiteurs 3 15,00
1 5,00
Négatif 9
45,00 11 55,00
Positif 8
40,00 8 40,00
|
|
TOTAL 20 100
20 100
|
p= 0,54 ; la différence est non significative
b. Plasma
Tableau XII : Répartition des
résultats de la PCR du VHB du plasma
|
GI
GII
N
% N %
|
|
Inhibiteurs 1 5,00
1 5,00
Négatif 11
55,00 11 55,00
Positif 8
40,00 8 40,00
|
|
TOTAL 20 100
20 100
|
P=1,00 ; pas de différence
Nous avons trouvé 5 patients ADN viral positif et 9
patients ADN viral négatif sur les 4 groupes, c'est-à-dire le
même profil (Positif ou négatif) quelque soit le mode de
conservation et le type de prélèvement.
Par ailleurs, 6 patients ont des profils différents
selon les conditions de conservation et de prélèvement,
soit :
· Un patient positif dans les groupes Is, Ip, IIs mais
avec la présence d'inhibiteurs dans le groupe IIp ;
· Un patient positif dans les groupes Is, Ip, IIp, mais
négatif dans le groupe IIs ;
· Un patient positif dans les groupes Is, IIp, IIs, mais
négatif dans le groupe Is ;
· Un patient négatif dans les Groupes Ip et IIp,
mais avec la présence des inhibiteurs dans les groupes Is et
IIs ;
· Un Patient positif dans les groupes IIs et IIp, mais
ayant présenté les inhibiteurs dans les groupes Is et
Ip ;
· Un patient Négatif dans les groupes IIs et IIp,
mais positif dans le groupe Ip, avec la présence des inhibiteurs dans le
groupe Is.
DISCUSSIONCES
1. Analyse de la méthodologie
1.1. Types et période de
l'étude
Le caractère prospectif de cette étude assure
une qualité optimale aux résultats, le recueil d'informations
étant contemporain au prélèvement.
La comparaison des groupes constitués des mêmes
patients a permis d'éviter le biais lié à la
différence des critères de sélection des patients.
La durée de la période d'étude a
été définie par la nécessité d'obtenir un
échantillon statistiquement significatif, cependant la faible taille de
l'échantillon, limitant l'interprétation des données
épidémiologiques, s'explique par le fait que les moyens
financiers que nous avons eu étaient faibles pour réaliser une
étude fondamentale, comportant plusieurs patients.
1.2. Population de l'étude
Le seul critère d'inclusion à l'étude a
été établi dans le but d'éviter le biais dans
l'interprétation des résultats. Il s'agit de la positivité
à l'AgHBs. Ce critère a été également
utilisé par Khelifa F. et al, dans une étude visant
à déterminer les génotypes du VHB circulant en
Algérie [39]. Ce choix s'explique par le fait que seule la recherche de
l'Ag Hbs est réalisée dans les centres de transfusion sanguine au
Congo, dans le cadre du dépistage du VHB. Cependant, la présence
de l'Ag HBs ne signifie pas toujours la présence de l'ADN viral. Seule
l'Ag HBe est considérée comme témoin indirect de la
présence de l'ADN viral [23].
1.3. Critères de jugement
Les critères définis ont permis de comparer les
2 protocoles de traitement des échantillons de sang
séchés, sans tenir compte de la présence ou non de l'Ag
HBe. Les résultats de la quantification de l'ADN total ont
été repartis en 4 groupes pour pouvoir évaluer le
rendement des protocoles utilisés, car l'ADN total était
considéré comme l'ensemble de l'ADN humain et de l'ADN viral du
VHB y compris les autres virus.
Les résultats de la PCR du VHB ont été
exprimés en positif ou négatif au lieu de valeurs quantitatives
car le protocole utilisé pour l'extraction de l'ADN a permis d'obtenir
50ul d'extrait et que 10ul ont été utilisés pour la
quantification de l'ADN total. Ainsi, pour la PCR du VHB, nous avons
utilisé 40ul d'extrait au lieu de 50ul, tel que prévu par le
protocole du kit COBAS Taq Man test. Cette erreur ne met pas en cause la
qualité de l'étude, car la PCR du VHB permet de détecter
l'ADN viral même pour des volumes plus faibles. Cependant les valeurs
quantitatives doivent être considérées avec
précaution.
1.4. Protocoles d'extraction et d'élution de
l'ADN
Le rendement, après 3 essais, a montré que la
méthode utilisant le kit QIAamp DNA mini kit, décrite par Jardi
et al [37] donne moins d'ADN que la méthode au phénol
chloroforme, décrite par Vauloup-Fellous et al [38]. Ceci a
justifié l'utilisation de la méthode au phénol chloroforme
pour l'extraction et l'élution des échantillons de l'ensemble des
patients.
2. Fréquences
Au cours de notre étude nous avons obtenu une
séroprévalence de 11,71%. Cette séroprévalence n'a
pas changé depuis 2 décennies car elle est similaire à
celle trouvée par J. Miehakanda et al [40] chez les donneurs
de sang du centre de transfusion sanguine de Brazzaville entre 1986 et
1987(11,6%). Elira-Dockekias A. et al [41] ont trouvé en 2002
une séroprévalence de 7,20%. Par ailleurs, dans les autres pays
d'Afrique les études sont divergentes à ce sujet, au Cameroun,
Mbanya DN et al [42] ont trouvé une
séroprévalence du VHB de 10,7% alors que Batina [43] a
trouvé 4,7% en République Démocratique du Congo.
Notre séroprévalence est toute fois proche de
celle fixée par l'OMS qui place le Congo dans la zone de forte
endémie, dont la prévalence est supérieure à 8%
[2].
3. Structure de la population
3.1. Sexe et âge
La population étudiée est constituée de
85% des sujets de sexe masculin pour 15% de sexe féminin. Cette
proportion est similaire à celle retrouvée par Batina et
al [43] soit 75% de sexe masculin. Cependant, cela ne veut pas dire
que le sexe masculin est prédominant chez l'ensemble des porteurs de
l'Ag HBs. Ceci s'explique par le fait que la population des donneurs de sang
est constituée en grande partie des hommes, soit 83,05% pour notre
étude et 91,17% pour Miehakanda et al [40]. Par ailleurs, dans
une population autre que les donneurs de sang, la différence entre les
deux sexes n'est pas significative car Makuwa et al [44] ont
trouvé un sex-ratio de 0,83 dans une population hospitalisée
à Brazzaville.
La majorité des sujets avaient un âge compris
entre 25 et 34 ans, soit 35%, suivi de la tranche de 35 et 44ans avec un
âge moyen de 35,40 #177; 9,60ans. Il n'y a pas eu de différence
significative entre les résultats obtenus (p>0,05). L'âge moyen
est similaire à l'âge trouvé par Batina et al
[43], soit 35 #177; 1,24 ans.
Notre étude a concerné la population des
donneurs de sang et le don de sang est autorisé à partir de 18
ans jusqu' à 60 ans. Il est donc peu probable que l'âge soit un
facteur susceptible d'influencer la qualité des résultats.
3.2. Antécédents
Aucun antécédent n'a été
retrouvé chez 75% de la population étudiée. Ceci
s'explique par le fait que l'interrogatoire réalisé au cours du
recrutement des donneurs de sang, portant sur les antécédents,
les facteurs de risque d'infection à VHB, permet d'écarter les
sujets à risque. Par ailleurs, nous avons trouvé 2 sujets avec
les antécédents de transfusion sanguine ; cependant dans
les 2 cas, la transfusion remontait à plus de 30 ans (31 ans pour un
sujet et 36 ans pour l'autre).
Aucun sujet n'a reçu le vaccin contre le VHB, ceci
témoigne de la faible couverture vaccinale encore remarquable au Congo.
Miehakanda et al [40] ont évoqué une couverture vaccinale de 4,2%
chez les sujets à risque à Brazzaville.
4. Paramètres biologiques
4.1. L'ADN total
Dans notre étude, l'extraction de l'ADN a
été réalisée à partir d'un spot comportant,
d'une part 30 ìl de sang total et d'autre part 30 ìl de plasma.
L'extraction des cartes de référence (sujet témoin non
connu VHB positif et sujet connu VHB+) a montré une sensibilité
supérieure de l'extraction au phénol chloroforme après
traitement par la protéinase K, par rapport par le kit Qiagen. La
détection semble inchangée quelque soit le mode de conservation
et de transport (conservation à température ambiante ou à
-20°C).
Jardi et al [37] ont effectué cette extraction
à partir du papier buvard, en utilisant la méthode par le kit
Qiagen. D'autres ont effectué l'extraction de l'ADN à partir du
papier buvard, mais dans le but de rechercher d'autres infections virales.
Comme c'est le cas de Vauloup-Felloup et al [38], dans la recherche du
Cytomégalovirus. Il s'agissait d'une étude comparative entre la
méthode au Phénol chloroforme, le kit Qiagen et l'extraction par
la chaleur. Les résultats sont en faveur de la méthode au
Phénol Chloroforme.
Fischer A. et al ont également utilisé
cette méthode dans la recherche du VIH.
Nos patients ont été choisis pour leur
positivité de l'Ag HBs et la charge virale étant
imprévisible chez ces patients, nous avons donc retenu les conditions
d'extraction les plus sensibles, soit une extraction classique au
phénol- chloroforme à partir d'un spot du papier buvard.
4.2. PCR du VHB
Les analyses des échantillons de sang total et de
plasma ont révélé une étroite corrélation
entre les résultats de l'ADN viral, car nous avons obtenu les
mêmes résultats lorsqu'il s'agit du plasma. Par ailleurs, pour le
sang total, nous avons observé la présence de quelques
inhibiteurs de la PCR, mais la différence n'est pas significative.
La présence des inhibiteurs de la PCR du VHB est faible
quelques soit le mode de conservation et quelques soit le type de
prélèvement, car dans les 4 groupes la différence n'est
pas significative. Cette constatation indique que le tampon d'élution de
l'ADN du VHB sur du papier buvard, est pur, et ne présente pas de
pertes importantes mesurables au cours d'élution.
La conservation à température ambiante n'a pas
d'incidence sur les niveaux d'ADN du VHB ou l'intégrité d'ADN,
car les résultats sont similaires à ceux des échantillons
qui ont été conservés à -20°C. Cette
constatation nous fait penser que la conservation à température
ambiante présente plus d'avantages en ce sens qu'elle ne
nécessite pas un équipement frigorifique important. Il faut
surtout s'assurer que le prélèvement est bien sec et isolé
pour éviter toute contamination.
Le type de prélèvement semble n'est pas avoir de
conséquences, car dans notre étude, le rendement d'ADN viral est
similaire que ce soit le plasma ou le sang total. Cette constatation nous fait
remarquer que même une goutte épaisse peut permettre d'extraire de
l'ADN du VHB et donc permettre de poser le Diagnostique moléculaire de
l'infection à VHB.
L'absence de disparité dans les groupes (tous les
groupes 40% des sujets VHB positif) nous fait penser que la méthode
d'extraction utilisée est fiable. Cependant, la sensibilité de
notre méthode n'a pas été évaluée, car une
comparaison avec une technique de routine avec les échantillons de sang
non séché n'a pas été possible au cours de notre
étude. En revanche, Vaulaup-Fellout et al [38] ont trouvé une
sensibilité de l'ordre de 10-3, en comparant la méthode
d'extraction à partir du papier buvard par le phénol chloroforme,
après traitement par la protéinase K et l'extraction des
échantillons de sang total non séché.
Dans tous les groupes, nous avons eu 40% de sujets VHB positif
sur l'ensemble des 20 sujets AgHBs positif. Ceci peut s'expliquer par le fait
de la présence de l'AgHBs ne signifie pas toujours la présence de
l'ADN viral, d'où une recherche de l'Ag HBe serait intéressante.
Cependant, l'hypothèse des variants non amplifiés par la PCR est
à évoquer.
Notre étude a porté sur la population des
donneurs de sang, qui sont tous asymptomatiques. L'évolutivité
antérieure de l'infection et des éventuels retentissements
hépatiques qu'elle aurait pu avoir n'ont pas été
évalué. Par conséquent, nous pensons que les sujets ADN
positif sont repartis en 2 groupes :
Le premier groupe, des porteurs sains, chez lesquels on trouve
une réplication virale résiduelle. Ces sujets sont soumis aux
risques théoriques de réactivation, de surinfection par le VHD ou
le VHC. Cependant Pol et al [23] ont démontré que ces
risques sont très faibles en l'absence d'immunodépression.
Le deuxième groupe, des sujets ayant une
réplication intermittente, vus en phase de latence clinique et qui
peuvent avoir des lésions histologiques.
En pratique, il faut surveiller ces sujets, au moins de
façon annuelle, pour distinguer les différents cas de figure. Pol
et al [23] ont proposé un dosage des transaminases, un dépistage
du CHC par le dosage de l'alpha foeto-protéine, l'échographie
hépatique et l'utilisation des tests non invasifs de fibrose
hépatique tels que le fibroscan, le Fibrotest et l'Actitest.
Cette technologie de biologie moléculaire
avancée, de quantification d'ADN du VHB n'est pas disponible dans tous
les pays en développement, et souvent, ces analyses sont
effectuées dans les centres de référence, situés
dans les pays développés et impliquent une série de
problèmes, principalement en ce qui concerne la stabilité des
acides nucléiques, le traitement, et les conditions de transport.
L'utilisation des échantillons de sang séché a
été considérée comme une alternative. La collecte
de sang sur papier buvard nécessite une petite quantité de
l'échantillon ; elle est peu invasive et produit un
échantillon qui est peu coûteux à expédier, et ne
nécessite pas de traitement spécial ou des conditions de
conservation particulières.
Cependant, les conditions de transport d'un pays à
l'autre, sans risque de contamination doivent être bien
précisées dans une étude plus importante. Fischer A. et
al [45], ont proposé des conditions de transport des
échantillons de sang séché sur papier buvard dans le
diagnostic de l'infection à VIH : chaque papier buvard doit
être bien sec et protégé (pochette plastique ou film
cellophane) afin d'éviter tout contact entre les échantillons
lors du transport. Un système d'acheminement au laboratoire doit
être mis en place. Des partenariats avec les Postes et les services de
courrier express doivent être envisagés.
CONCLUSION ET
PERSPECTIVES
En conclusion, l'essaie d'extraction de l'ADN du VHB à
partir du sang séché sur papier buvard a permis le
développement une nouvelle méthode simple et appropriée
pour l'évaluation de la réplication du virus de l'hépatite
B. Le sang séché sur papier buvard représente un moyen
idéal pour les tests de diagnostic du virus de l'hépatite B dans
les pays où les structures biologie moléculaire, la conservation
frigorifique et le transport vers les laboratoires spécialisés
sont problématiques. L'élution de l'ADN du VHB à partir
d'une seule goutte de sang séché permet de poser le diagnostic de
réplication virale de l'infection à VHB. La conservation à
température ambiante n'a pas d'effet néfaste sur le
prélèvement et représente la méthode idéale
et peu onéreuse.
Perspectives
Nous suggérons à l'endroit:
Ø Des partenaires du développement scientifique,
d'assurer le financement d'une :
§ Etude avec un échantillon plus important et
comparative avec des échantillons non séchés afin d'en
dégager la sensibilité quantitative de la charge virale ;
§ Etude permettant l'évaluation de l'utilisation
des échantillons de sang séché sur papier buvard dans le
génotypage virus de l'hépatite B et la détection des
G1896A précoce mutants et des variantes dans le motif YMDD
polymérase ;
Ø Des autorités sanitaires du pays,
d'améliorer le plateau technique et d'équiper des structures de
biologie moléculaire des laboratoires des principales villes, afin de
réaliser, au niveau local, la PCR du VHB et que l'utilisation du papier
buvard soit nécessaire quand il s'agit de centres de santé
éloignés.
RESUME
Le virus de l'hépatite B (VHB) est l'un des
différents virus responsables de l'hépatite virale. Dans le
monde, plus de 2 milliards de personnes ont été infectées
par le VHB et plus de 350 millions d'entre elles ont une infection chronique.
Des marqueurs sérologiques sont couramment utilisés pour
confirmer le diagnostic et/ou aider au pronostic d'une infection aiguë ou
chronique par le VHB. Le principal marqueur de l'infection par le VHB est la
présence de l'antigène d'enveloppe (AgHBs). Bien que les porteurs
puissent éliminer l'AgHBs et développer des anticorps anti-HBs,
il semble qu'il y ait toujours un risque ultérieur de complications
hépatiques graves.
Par conséquent, l'utilisation de ce marqueur peut avoir
un intérêt limité dans la surveillance de
l'évolution de la maladie. L'ADN du VHB a une valeur pronostique pour ce
qui concerne l'évolution des infections aiguës et chroniques.
Cependant, dans les pays en développement, les structures de biologie
moléculaire sont quasi inexistantes. C'est ainsi que nous avons
entrepris cette étude dans le but d'évaluer l'utilisation des
échantillons de sang séché sur papier buvard, en vu de
réaliser la PCR du VHB.
Nous avons réalisé une étude
transversale, à recueil des données prospectif, comparative entre
d'une part les conditions de conservation des échantillons
(température ambiante et -20°C) et d'autre part les types de
prélèvements (sang total et plasma). Ces échantillons
provenaient de 20 sujets Ag HBs positifs, sélectionnés parmi les
donneurs de sang du Centre inter départemental de Pointe-Noire.
L'extraction par la méthode au Phénol
chloroforme est plus sensible que celle utilisant le kit commercial Qiagen.
La différence n'était pas significative en ce
qui concerne les rendements d'extraction par méthode au phénol
chloroforme, quel que soit le type de prélèvement et quel que
soit le mode de conservation des échantillons.
L'utilisation des échantillons de sang
séché sur papier buvard représente une méthode
efficace, simple et peu onéreuse dans le diagnostic moléculaire
de l'infection à VHB.
Mots clés : VHB, papier buvard,
ADN viral
ABSTRACT
The hepatitis B virus (HBV) is one of several viruses
responsible for viral hepatitis. In the world, more than 2 billion people have
been infected with HBV and more than 350 million of them have chronic
infection. Serological markers are used to confirm the diagnosis and / or
assist in the prognosis of acute infection or chronic HBV. The main marker of
HBV infection is the presence of the envelope antigen (HBsAg). Although holders
can eliminate the HBsAg and develop anti-HBs, it seems there is always a risk
of serious liver complications. The antigen HBV e (HBeAg) is generally used as
a marker and indicates a secondary active replication of HBV associated with a
progressive liver disease. Therefore, this marker may have limited interest in
monitoring the disease. The HBV DNA has a prognostic value with regard to the
development of acute and chronic infections. However, in developing countries,
the structures of molecular biology are almost nonexistent. Thus, we undertook
this study to evaluate the use of dried blood spot, with a view to achieving
PCR HBV.
We conducted a cross-sectional study, to prospective data
collection, comparing the one hand the conditions of conservation of samples
(room temperature and -20 ° C) and other types of samples (whole blood and
plasma). These samples came from 20 subjects HBs Ag positive, selected among
blood donors Center inter-departmental Pointe Noire.
The extraction method in Phenol chloroform is more sensitive
than using the commercial Qiagen kit. The difference was not significant in
regard to returns extraction method using phenol chloroform, whatever the type
of sampling and whatever the method of preservation of samples.
The use of blood dried on blotting paper is a simple and
effective method in molecular diagnosis of HBV infection.
Key words: HBV, dried blood spot, Viral
DNA
REFERENCES
1. De Francis R, Hadengue A, Lavanchy D, Lok ASK et
al. International Consensus Conference on Hepatitis B: Consensus
statement. J Hepatol 2003; 39 (1): S3-25.
2. World Health Organization 2000. Hepatitis B. Fact Sheet
WHO/204 (revised October).
3. Yala F, Olembe C, M'Pele P, Rosenheim M. Portage de
l'antigène HBs, d'anticorps anti-VIH, et de leur association chez
les donneurs de sang à Brazzaville. Bull Soc Pathol Exot 1988 ;
81 : 32-39.
4. Taty-Taty R, Yala F. Carrier state for HBs antigen and HBc
antibody in Brazzaville (Congo): sero-epidemiological study in the hospital and
non hospital environment. Bull Soc Patho Exot 1990; 83 (2); 149: 149-154.
5. Ibara JR, Itoua-Ngaporo A et al. Serological
markers of hepatitis B virus in hospitalized patients (Gastroenterology and
Internal Medicine Service of the University Hospital Center of
Brazzaville-Congo). Med Trop 1991; 51 (1):9-13.
6. Jardi R, Buti M, Rodriguez-Frias F et al. The
value of quantitative detection of HBV-DNA amplified by PCR in the study of
hepatitis B infection. J Hepatol 1996; 24:680-685.
7. Ranki M, Schatzl HM, Zachoval R et al.
Quantification of hepatitis B virus DNA over a wide range from serum for
studying viral replicative activity in response to treatment and in recurrent
infection. Hepatology. 1995; 21:1492-1499.
8. Mason AL, Xu L, Guo L et al. Molecular basis for
persistent hepatitis B virus infection in the liver after clearance of serum
hepatitis B surface antigen. Hepatology. 1998;
27:1736-1742.
9. Saito T, Shinzawa H, Uchida T et al. Quantitative
DNA analysis of low-level hepatitis B viremia in two patients with
serologically negative chronic hepatitis B. Journal of Medical Virology.1999;
58:325-331.
10. Nagata I, Colucci G, Gregorio GV et al. The role
of HBV DNA quantitative PCR in monitoring the response to interferon treatment
in chronic hepatitis B virus infection. J Hepatol 1999;
30:965-969.
11. Hadziyannis SJ, Manesis EK, Papakonstantinou A. Oral
ganciclovir treatment in chronic hepatitis B virus infection: a pilot study. J
Hepatol 1999; 31:210-214.
12. Blumberg B S. Encyclopédie Microsoft Encarta 2003.
Product ID: 59578- OEM-1207047-69207. Version: 12.0.0.O602.
13. Lee WM et al. Hepatitis B virus infection. N Engl
J Med 1997; 337: 1733-45.
14. Leroy V, Zarski JP. Virus de l'hépatite B.
Virologie Moléculaire Médicale. Collection Génie
génétique G2. Editions Médicales Internationales 2001.
15. Fleury HJA. Virologie humaine. Edition Masson. 4eme
Edition 2004.
16. Lok ASF, Heathcote J, Hoofnagle JH. Management of
hepatitis B: 2000 Summary of a Workshop. Gastroenterology 2001;
120:1828-1853.
17. Hureaux JM, Nicolas JC, Agut H, Peigue-Lafeuille H.
Traité de virologie médicale. Edition ESTEM. 2003.
18. Halfon P, Pol S, Bourlière M, Courcambeck J, Cacoub
P. Résistance aux analogues de nucléosides dans le traitement de
l'hépatite B. Rev Med Interne 2003 ; 24 : 786-793.
19. Mahoney FJ. Update on diagnosis, management and prevention
of hepatitis B virus infection. Clin Microbiol Rev 1999; 12: 351-366.
20. Gombe MC. HBs antigen: maker of the relation between
hepatitis B virus and primary cancer of the liver: the situation in
Brazzaville. IARC Sci Publ 1984; 63: 221-226.
21. Castéra L, Dhumeaux D, Pawlotsky JM.
Hépatite virales chroniques B et C. Revu Prat 2001 ; 51 :
1247-1257.
22. Pol S. Epidémiologie et histoire naturelle de
l'Hépatite B. Revu Prat 2005 ; 55 : 599-606.
23. Marcellin P, Asselah T, Boyer N. Traitement de
l'Hépatite Chronique B. Revu Prat 2005 ; 55 : 624-632.
24. Liaw YF et al. Resultat of lamivudine trials in
Asia. J Hepatol 2003; 39: 111-115.
25. Wai CT, Fontana RJ. Clinical significance of hepatitis B
virus genotypes, variants and mutants. Clin Liver Dis 2004; 2: 321-352.
26. Halfon P, Pol S, Bourliere M, Cacoub P. les
génotypes du Virus de l'Hépatite B:implications cliniques,
épidémiologique et thérapeutiques. Gastroenterol Biol
2002 ; 26 :1005-1012.
27. Chu CJ, Lok ASF. Clinical significance of hepatitis B
virus genotypes. Hepatology 2002 ; 35 : 1274-1276.
28. Guettouche T, Hnatyszyn HJ. Chronic hepatitis B and viral
genotype: the clinical significance of determining HBV genotypes. Antivir Ther
2005; 5: 593-604.
29. Chu CJ, Keefe EB, Han SH et al. Hepatitis B virus
genotypes in the United States: results of a nationwide study. Gastroenterology
2003; 125: 444-451.
30. Chu CJ, Hussain M, Lok ASK. Hepatitis B virus genotype B
in associated with earlier HBe Ag seroconversion compared with hepatitis B
virus genotype C. Gastroenterology 2002; 122: 1756-1762.
31. Sanchez-Tapis JM, Costa J, Mas A, Bruguera M, Rodes J.
Influence of hepatitis B virus genotype on the long-term outcome of chronic
hepatitis B in western patients. Gastroenterology 2002; 123: 1848-1856.
32. Lacombe K, Massari V, Girard PM et al. Major role of
hepatitis B genotypes in liver fibrosis during coinfection with HIV. AIDS 2006;
20: 419-427.
33. Kao JH, Wu NH, Chen PJ, Lai MY, Chen DS. Hepatitis B
genotypes and the response to interferon therapy. J Hepatol 2003; 33:
998-1002.
34. Kao JH, Liu CJ, Chen DS. Hepatitis B viral genotypes and
lamivudine resistance. J Hepatol 2002; 36: 303-304.
35. Westland C, Delaney W, Yang H et al. Hepatitis B virus
genotype and virologic response in 694 patients in phase III studies of
Adefovir Dipivoxil. Gastroenterology 2003; 125: 107-116.
36. Ministère de la Santé et de la Population.
Draft Plan National de Développement Sanitaire, Juillet 2005.
37. Jardi R, Rodrigues-Frias F et al. Usefulness of dried
blood samples for quantification and molecular characterization of HBV-DNA.
Hepatology 2004; 40: 133-139.
38. Vauloup-Fellous C, Dubreuil P, Grangeot-Keros L.
Optimisation du diagnostic rétrospectif de l'infection
congénitale à cytomégalovirus à partir de la carte
de Guthrie. Pathol Biol 2006 ; 54 :551-555.
39. Khelifa F, Thibault V. Les génotypes du virus de
l'Hépatite B dans l'Est algérien. Pathol biol 2008 ;
67 : 1054-1058.
40. Miehakanda J, Bourgarel J, Nereli BE, Teulieres L, Hillion
AM. Vaccination contre l'hépatite B d'une population a
risque en République Populaire du Congo. Med Afr Noire 1991 ;
38 : 651-669.
41. Elira-Dokekias A, Okandze-Elenga JP, Dzia-Lepfounzou A,
Parra HJ. Prévalence des marqueurs viraux majeurs chez les donneurs de
sang à Brazzaville. Gazette de la transfusion 2002 ; 177 : 4-6.
42. Mbanya DN, Takam D and Ndumbe PM: Serological findings
amongst first-time blood donors in Yaoundé, Cameroon: is safe donation a
reality or a myth? Transfus Med 2003; 13: 267-73.
43. Batina A, Kabemba S, Malengela R. Marqueurs infectieux
chez les donneurs de sang en République Démocratique du Congo.
Rev Med Brux 2005 ; 28 : 145-9.
44. Makuwa M, Bakouetela J, Bassindikila A, Samba-Lefebvre MC.
Etude des marqueurs sérologiques de l'hépatite B chez les
patients congolais testés pour l'infection à VIH. Méd Afr
Noire 1996 ; 43 : 198-200.
45. Fischer A, Lejczak C, Lambert C et al. Simple DNA
Extraction Method for Dried Blood Spots and Comparison of Two PCR Assays for
Diagnosis of Vertical Human Immunodeficiency Virus Type 1 Transmission in
Rwanda. J. Clin. Microbiol 2004; 42: 16-20.
ANNEXES
Annexe1
FICHE D'ENQUETE
Numéro de la fiche :...............
1. Données
épidémiologiques
Noms :.............................................Prénoms :..............................
Date de naissance :...........................
Sexe : Masculin Féminin
Nationalité : congolaise
Autres
Si autre Préciser :........................
Statut socio-économique :
Fonctionnaire Ouvrier
Etudiant/élève Sans emploi Autre
Si autres
Préciser :....................
Adresse :.................................
Téléphone :............................
Facteurs de risque :
Sexuel Toxicomane Transfusion
Transmission mère-enfant
Autre Si autre
Préciser :................................
2. Antécédents
Ictère : Oui Non
Vaccination contre l'hépatite B : Oui
Non
3. Coïnfection : VIH VHD
VHC Aucune
4. Marqueurs viraux
|
Valeur
|
Date de réalisation
|
|
Ag HBs
|
|
|
|
Ag HBe
|
|
|
|
Ac anti HBs
|
|
|
|
Ac anti HBe
|
|
|
5. ADN TOTAL
6. ADN VIRAL
Positif Négatif
Inhibiteurs
Annexe 2
PROTOCOLE DE DOSAGE DE L'Ag HBs PAR LE KIT MONOLISA HBs
Ag Ultra
1. Matériel nécessaire
· Eau distillée ;
· Hypochloride de sodium (Eau de javel) et bicarbonate de
soude ;
· Pipettes automatiques ou semi automatiques
réglables ou fixes, pouvant distribuer 50 ul, 100 ul, 1000 ul et
10ml ;
· Eprouvettes graduées de 100 ml et 1000
ml ;
· Conteneur de déchets contaminés ;
· Bain-marie ou incubateur sec pouvant être
thermostable à 37°C#177;1°C ;
· Système de lavage automatique ou semi
automatique pour microplaque ;
· Appareil de lecture pour microplaque
équipé de filtres 450, 490 et 620-700nm,
· Papier absorbant.
2. Préparation des réactifs
2.1. Réactifs prêts à
l'emploi
· Réactif 1 (R1) : Microplaque
· Réactif 3 (R3) : Contrôle
négatif
· Réactif 4 (R4) : Contrôle positif
· Réactif 10 (R10) : Solution
d'arrêt
2.2. Réactifs à reconstituer
· Réactif 2 (R2) : solution de lavage
(concentration 20x) : diluer au 1/20e la solution de lavage
dans l'eau distillée. Préparer 800ml pour une microplaque de 12
barrettes.
· Conjugué (R6+R7) : Taper doucement le
flacon du conjugué lyophilisé R7 sur la paillasse pour
détacher toute substance pouvant adhérer au bouchon de
caoutchouc. Ouvrir le flacon et y transvaser le contenu d'un flacon de diluant
pour conjugué R6. Reboucher et laisser reposer 10 minutes en
homogénéisant de temps en temps pour faciliter la dissolution.
· Solution de révélation enzymatique
(R8+R9) : Diluer le réactif R9 dans le réactif R8 au
1/11e (exemple : 1ml de réactif R9 dans 10ml de
réactif R8). Cette solution reste stable 6 heures à
l'obscurité. Homogénéiser.
3. Mode opératoire
· Etablir soigneusement le plan de distribution et
d'identification des échantillons
· Préparer la solution de lavage R2
· Préparer la solution du conjugué R6
· Sortir de l'emballage protecteur le cadre support et
le nombre de barrettes nécessaires (R1).
· Distribuer dans les cupules dans l'ordre
suivant :
Ø Cupules A1, B1, C1 et D1 : 100 ul de
contrôle négatif (R3)
Ø Cupule E1 : 100 ul de contrôle positif
(R4)
Ø Cupule F1 : 100 ul de l'échantillon
témoin pour la validation du dépôt des échantillons
et du conjugué.
Ø Cupules G1, H1,... : 100 ul
d'échantillons à tester.
· Secouer la solution du conjugué avant
l'utilisation. Homogénéiser. Distribuer rapidement 50 ul de la
solution reconstituée de conjugué R6+R7 dans toutes les cupules.
Homogénéiser le mélange réactionnel
· Recouvrir d'un film adhésif et incuber pendant
1 heure et 30 minutes à 37#177;1°C.
· Retirer le film adhésif, aspirer le contenu de
chaque cupule et laver au moins 5 fois. Veillez à ce que le volume
résiduel n'excède pas 10 ul (éventuellement, sécher
la plaque par retournement sur une feuille de papier absorbant).
· Distribuer rapidement dans toutes les cupules 100 ul
de la solution de révélation de l'activité enzymatique
(R8+R9). Laisser la réaction se développer è
l'obscurité pendant 30 #177; 5 minutes à température
ambiante (18 à 30°C). lors de cette incubation ne pas utiliser de
film adhésif.
· Ajouter 100 ul de la solution d'arrêt (R10) en
adoptant la même séquence et le même rythme de distribution
que pour la solution de révélation. Homogénéiser le
mélange réactionnel.
· Essuyer soigneusement le dessous des plaques. Attendre
au moins 4 minutes après la distribution de la solution d'arrêt
avant la lecture et dans les 30 minutes qui suivent l'arrêt de la
réaction, lire la densité optique à 450/620 nm à
l'aide d'un lecteur de plaques.
· S'assurer avant la transcription des résultats
de la concordance entre la lecture et le plan de distribution et
d'identification des plaques et des échantillons.
|
UNIVERSITE MARIEN NGOUABI
---------------------------------
FACULTE DES SCIENCES DE LA SANTE
----------------------------------
|
|
REPUBLIQUE DU CONGO
Unité* Travail*
Progrès
-------------------
|

251673600
Année académique : 2007-2008
N° d'ordre : 783
THESE
POUR L'OBTENTION DU DOCTORAT EN MEDECINE
(DIPLÔME D'ETAT)
THEME:
HEPATITE VIRALE B:
INTERET DE L'UTILISATION DES ECHANTILLONS DE SANG SECHE
DANS L'EXTRACTION DE L'ADN VIRAL.
Impétrant : Séraphin NYENYELI
TWAGIRIMANA
Vu, bon pour soutenir
Vu, bon pour imprimer
Le directeur de Thèse
Le Doyen
Professeur Jean-Rosaire IBARA
Professeur Ange Antoine ABENA
| 


