TABLE DES MATIERES
LISTE DES SIGLES ET
ABREVIATIONS..................................................................... .xiv
I- GENERALITE
I.1- Définition sur l'allo immunisation
transfusionnelle ....................................3
I.2- Systèmes immunogènes et
immunoglobulines...........................................3
I.2.1- Système immunogène
....................................................................3
I.2.2-
Immunoglobulines.........................................................................5
I.3- Différentes types d'allo
immunisations...................................................8
I.3.1- Allo immunisation transfusionnelle
....................................................8
I.3.1-1 : Causes de l'allo
immunisation........................................................9
a- Immunogénicité de l'antigène du
donneur.................................................9
b- Nombre et rythme des
stimulations.......................................................10
c- Phénotype érythrocytaire du
receveur.....................................................10
d- Sexe du receveur
............................................................................10
e- Etat immunitaire du receveur
..............................................................10
f- Déterminisme génétique de la
réponse immunitaire....................................11
I.3.1-2 : Conséquences de l'allo immunisation
transfusionnelle.........................12
a- Conséquences
immédiates..................................................................12
b- Conséquences
retardées.....................................................................14
I.3.1-3 : Prévention de l'allo immunisation
transfusionnelle..............................14
a- Phénotypage des donneurs et
receveurs...................................................14
b- Règles de la
transfusion.....................................................................15
c- Test de compatibilité au
laboratoire........................................................17
II- CADRE, MATERIEL ET METHODOLOGIE
II.1- Cadre du travail
...........................................................................19
II.2- Matériel de
travail........................................................................19
II.2.1- Matériel
standard........................................................................19
II.2.1-1 : Equipement
..........................................................................19
II.2.1-2 : Petit matériel
........................................................................20
II.2.1-3 : Matériel
consommable..............................................................20
II.2.2- Réactifs
utilisés.........................................................................21
II.2.2-1 : Test de compatibilité en
Coombs-Liss............................................21
II.2.2-2 : Recherche d'agglutinines
irrégulières ............................................21
a- Réactifs cellulaires
.........................................................................21
b- Matériel spécifique à la RAI
..............................................................22
II.3-Méthodologie...............................................................................22
II.3.1- Echantillonnage
........................................................................23
II.3.1-1 : Test de compatibilité au
laboratoire...............................................23
II.3.1-2 : Recherche d'agglutinines
irrégulières ............................................23
a- Sélection des polytransfusés du
SMAS..................................................23
b- Sélection des enfants transfusés de la
pédiatrie.........................................24
c- Prélèvement et conservation
..............................................................24
II.3.2- Technique
...............................................................................25
II.3.2-1 : Réalisation du test de
compatibilité...............................................25
a-
Principes.....................................................................................25
b- Mode
opératoire.............................................................................25
II.3.2-2 : Recherche d'agglutinines
irrégulières ............................................27
a- Principes du Micro Typing System
(MTS).............................................27
b- Dépistage des agglutinines
irrégulières..................................................28
c- Identification des anticorps
dépistés......................................................28
d- Evaluation de la
réaction...................................................................29
III- RESULTATS
III.1- Test de
compatibilité.....................................................................30
III.1.1- Caractéristiques de la population
étudiée...........................................30
III.1.2- Etude de la
positivité..................................................................31
III.1.3- Résultats du dépistage et de
l'identification des anticorps impliqués dans les
incompatibilités transfusionnelles
............................................................35
III.2- Résultats de la RAI effectuée chez les
patients polytransfusés du SMAS et les enfants transfusés de la
pédiatrie
..............................................................37
III.2.1- Caractéristiques de la
population.....................................................37
III.2.2- Répartition de la positivité des
réactions d'allo immunisation..................40
IV - DISCUSSIONS
IV.1- Analyses des résultats des tests de
compatibilité effectués ........................45
IV.1.1- Caractéristique de la population
....................................................45
IV.1.2- Etude des résultats des test de
compatibilité effectués ...........................45
IV.2- Etude des résultats des travaux effectués
chez les polytransfusés et les enfants de la
pédiatrie....................................................................................47
IV.2.1- Caractéristiques de la
population....................................................47
IV.2.2- Etude des résultats de dépistage d'allo
anticorps .................................48
IV.3- Etude des résultats de l'identification des
anticorps dépistés......................48
IV.4- Difficultés
rencontrées...................................................................50
CONSLUSION
...................................................................................51
SUGGESTIONS................................................................................52
REFERENCES
BIBLIOGRAPHIQUES..................................................53
ANNEXES.......................................................................................59
LISTE DES SIGLES ET ABREVIATIONS
Ac: Anticorps
Ag: Antigène
AGH: Antiglobuline Humaine
AT: Auto-test
BDS : Banque de sang
CGR : Concentré de globules
rouges
CNHU-HKM: Centre national Hospitalier et
Universitaire Hubert K. MAGA
EPAC : Ecole Polytechnique
d'Abomey-Calavi
GR: Globule Rouge
HOMEL:Hôpital de la Mère et de
l'Enfant Lagune
IFM : Incompatibilité
foeto-maternel
Ig: Immunoglobuline
IgA: Immunoglobuline de chaîne
lourde á
IgD: Immunoglobuline de chaîne
lourde ä
IgE: Immunoglobuline de chaîne
lourde å
IgG: Immunoglobuline de chaîne
lourde ã
IgM : Immunoglobuline de chaîne
lourde ì
Kda: Kilo Dalton
LISS: Low Ionic Strengh Solution
MHNN: Maladie hémolytique du Nouveau
Né
MIN : Minute
MTS : Micro Typing System
N : Nombre
NaCl : Chlorure de Sodium
PM : Poids moléculaire
RAI : Recherche d'Anticorps
Irréguliers
SDTS Atl-Lit : Service Départemental
de Transfusion Sanguine Atlantique Littoral
SMAS : Service des Maladies du Sang
TC : Test de Compatibilité
TCD : Test de coombs direct
TPM : Tour par minute
TS : Transfusion sanguine
oC :
Degré Celsius
- : Négatif
+ : Positif
% : Pourcentage
ìL : Micro litre
RESUME
La transfusion sanguine au Bénin est
réalisée uniquement dans un contexte de compatibilité ABO
et Rh D. Dès lors, chaque transfusion faisait courir aux patients des
risques d'immunisation contre les autres systèmes antigéniques
érythrocytaires. D'où la nécessité d'évaluer
la fréquence d'allo immunisation post-transfusionnelle
antiérythrocytaire développée par les patients
transfusés en identifiant les systèmes antigéniques
impliqués.
Pour ce faire, nous avons compatibilisé en milieu
Coombs-LISS 1134 poches de sang cédées dans les BDS du SDTS
Atl/Lit et du CNHU-HKM et, réalisé la RAI également en
milieu Coombs-LISS sur 210 sérums de patients transfusés dont 101
du SMAS, 97 des services de pédiatrie et 12 des tests de
compatibilité positifs avec autotest négatif.
Les résultats ont montré que 7,62% des sujets
ont été immunisés vis-à-vis des antigènes
Rh, Kell, Kidd, Lewis et MNSs et que des cessions de poches de sang
incompatibles sont faites avec une fréquence de 2,65%.
Cette étude tout en confirmant l'immunisation
post-transfusionnelle antiérythrocytaire chez ces patients a permis
d'entrevoir d'autres stratégies transfusionnelles afin de réduire
le risque immunologique.
Mots clés : Patients
transfusés ; allo immunisation ; test de
compatibilité ; RAI ; systèmes
érythrocytaires
SUMMARY
Blood transfusion is done in Benin only under ABO and Rh D
blood types compatibility. Therefore each blood transfusion puts patients at
the risk of immunization against other erythrocyte antigenic systems. It then
becomes necessary to assess the frequency of other anti-erythrocyte
immunization developed by patients in the aftermath of a blood transfusion, by
identifying antigenic systems involved.
For this purpose, we have accessed, in Coombs-LISS
environment, 1134 blood bags gave at the blood banks of the Blood Transfusion
Centers of Atl/Lit and CNHU-HKM, and have performed the unexpected antibodies
searching, also in Coombs-LISS environment, on 210 serums for patients who have
received blood transfusion to include 101 of SMAS, 97 of paediatrics and 12 of
positive compatibility tests with negative self-testing.
Results show that 7.62% of the subjects have been immunized
against Rh, Kell, Kidd, Lewis and MNSs antigens, and that such incompatible
blood bags were given at a frequency of 2.65%.
This study while confirming the anti-erythrocyte immunization
after blood transfusion on those patients, led to glimpse other blood
transfusion ways to reduce immunological risks.
Keys words: Transfused patients; allo
immunization; compatibility test; unexpected antibodies searching; erythrocyte
systems.
INTRODUCTION
La transfusion sanguine ou hémothérapie a
pris son essor à partir du XXè siècle par la
découverte des groupes sanguins ABO par Karl Landsteiner et celle des
autres systèmes de groupes sanguins et tissulaires par différents
auteurs. Aujourd'hui, la transfusion sanguine est une discipline
médicale particulière, carrefour de la quasi totalité des
spécialités de la médecine moderne. En dépit des
multiples travaux de recherche effectués ces cinquante dernières
années, il n'est pas encore possible de fabriquer des produits de
substitution identiques aux produits sanguins labiles utilisés
aujourd'hui. C'est dire la difficulté de cette thématique.
Bien qu'étant une thérapie efficace, elle n'est
utilisée qu'en dernier recours, car elle peut être dangereuse.
Elle ne peut être efficace que si elle est utilisée en cas de
nécessité.
L'objectif de la transfusion sanguine est d'assurer au malade,
une thérapie de substitution compatible, efficace, avec un maximum de
sécurité aux plans de l'immunisation du malade et de la
transmission des maladies infectieuses. Mais ce maximum de
sécurité souvent souhaité et recherché est-il
toujours atteint du fait de la complexité des constituants du
sang ?
Au Bénin, comme dans beaucoup de pays africains, la
transfusion sanguine est réalisée uniquement dans un contexte de
compatibilité ABO et Rh D sans rechercher la compatibilité dans
les autres systèmes érythrocytaires tels que les systèmes
Rh, Kell, Kidd, Duffy, Lewis et MNSs, dont les antigènes sont tout aussi
immunogènes. Une telle pratique comporte des risques d'allo
immunisation, lesquels risques peuvent engendrer des complications cliniques
chez les polytransfusés et compromettre l'avenir obstétrical des
sujets de sexe féminin.
Afin de contribuer à l'amélioration de la
sécurité immunologique des transfusions au Bénin, nous
avons choisi de travailler sur le thème : «
CONTRIBUTION A L'ETUDE DE L'ALLO IMMUNISATION POST-TRANSFUSIONNELLE ANTI
ERYTHROCYTAIRE CHEZ LES PATIENTS TRANSFUSES A COTONOU ».
Notre travail s'est alors fixé pour objectifs :
Objectif général
v Renforcer la sécurité transfusionnelle au
Bénin.
Objectifs spécifiques
v Identifier les incompatibilités transfusionnelles si
elles existent.
v Déterminer les risques que l'on fait courir aux
malades en pratiquant uniquement le contrôle ultime au lit du malade.
v Evaluer la fréquence de l'allo immunisation
transfusionnelle chez les polytransfusés et les enfants de deux à
dix ans bénéficiaires d'une hémothérapie.
v Identifier les systèmes érythrocytaires
impliqués.
v Proposer de nouvelles stratégies
thérapeutiques en vue d'assurer chez les patients, une meilleure
sécurité transfusionnelle sur le plan immunologique.
Dans la première partie de ce travail, nous ferons une
synthèse de la littérature sur l'allo immunisation. Dans la
deuxième partie, nous présenterons le cadre de travail, le
matériel et la méthode de recherche utilisée. Puis
suivront la présentation des résultats et leurs commentaires.
Nous finirons par la conclusion et nos suggestions.
I.1- Définition de l'allo immunisation
transfusionnelle
L'allo immunisation transfusionnelle se définit comme
la formation active in vivo d'anticorps irréguliers (de type IgM et/ou
IgG plus rarement des IgA) chez un individu. Cette production d'anticorps
immuns résulte de l'introduction volontaire ou accidentelle
d'antigènes de groupes sanguins et tissulaires dans l'organisme
d'individus de même espèce. L'allo immunisation
anti-érythrocytaire post-transfusionnelle est donc la réponse
immune développée par les individus transfusés avec des
globules rouges portant des spécificités antigéniques
différentes de celles retrouvées sur leurs hématies.
Cette définition exclut la réponse à
l'environnement (hétéro immunisation) qui explique la formation
des anticorps de groupes sanguins appelés «
Anticorps naturels ».Lesquels résultent de la
réponse aux antigènes glycoprotéïques des membranes
des bactéries saprophytes intestinales
Elle ne s'observe chez l'homme que dans deux situations :
les grossesses et les transfusions [32,46].
I.2- Systèmes immunogènes et
Immunoglobulines
I.2.1- Systèmes immunogènes
Les antigènes sont des substances capables d'induire
une réponse immune et de se lier spécifiquement à des
composants de la réponse immunitaire : comme exemple, nous avons
les récepteurs de la surface membranaire des lymphocytes et les
anticorps. L'immunogénicité de l'antigène traduit sa
capacité à induire une réponse immunitaire
spécifique. Ainsi, tous les antigènes ne sont pas
immunogènes. [13]
On distingue deux parties sur un antigène :
l'haptène et le porteur.
L'haptène ou épitope de faible poids
moléculaire (PM) est assimilé au déterminant
antigénique. Il est la structure contre laquelle est dirigée la
réponse immunitaire. L'haptène n'est pas immunogénique par
lui-même lorsque, isolé, on l'injecte à un animal.
Le porteur ou "carrier " encore appelé
molécule porteuse, est de poids moléculaire élevé
et confère à l'antigène son pouvoir immunogène.
Dans le règne animal, les antigènes sont des
produits géniques de nature protéique, glucidique ou lipidique.
En tant que tel, on les rencontre sur la membrane de toutes les cellules de
l'organisme. Ceux observés sur les cellules sanguines (hématies,
leucocytes, thrombocytes) sont des antigènes de groupes sanguins
regroupés en une trentaine de groupes sanguins. [28,8,20,40]
Les systèmes de groupes sanguins les
plus immunogènes en dehors de ABO sont les systèmes : Rh,
Kell Duffy, Kidd et MNSs.
Ces systèmes ont en commun le fait que l'absence d'un
antigène n'entraîne pas automatiquement la présence d'un
anticorps naturel. Par contre, s'il y a introduction de cellules porteuses de
l'antigène manquant (soit lors des transfusions, soit par passage
d'hématies foetales dans la circulation maternelle), un anticorps peut
apparaître.
Les antigènes des systèmes de groupes sanguins
immunogènes sont responsables des phénomènes d'allo
immunisation transfusionnelle ou foeto-maternelle. Les antigènes en
cause sont par ordre décroissant d'immunogénicité
l'antigène Rh D, l'antigène K, les antigènes c et E du
système Rh, l'antigène Fya, l'antigène
Jka et assez loin derrière eux, les antigènes S et
s.
La structure biochimique de certains de ces antigènes
est mieux connue de nos jours.
Les antigènes Rh font partie intégrante de la
membrane des hématies, Il a pu être démontré que
l'antigène D se trouve sur un polypeptide de 30 Kda
L'usage des anticorps monoclonaux humains anti-K (K1)
préparés in vitro à partir de lymphocytes infestés
par le virus d'Epstein Barr, a permis comme dans le cas du polypeptide Rh, de
définir la structure biochimique qui porte l'antigène Kell (K1).
Il s'agit d'une glycoprotéine de 93 Kda branchée sur le
cytosquelette de la membrane et traversant cette dernière.
La structure biochimique des antigènes MNSs est
très bien précise, ils sont portés par des
glycoprotéines de la membrane des hématies, et il est d'ailleurs
intéressant de constater que deux types de protéines contiennent
ces antigènes : la glycophorine ou glycoprotéine á
pour M et N et une autre glycoprotéine, la glycoprotéine â
pour S et s. [36]
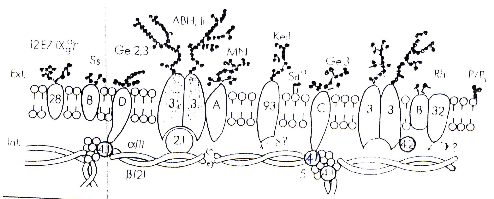
Figure n°1 :
Représentation schématique de la structure des antigènes
de groupes sanguins de la membrane érythrocytaire. [36]
I.2.2- Immunoglobulines
Les anticorps encore appelés immunoglobulines sont des
glycoprotéines solubles dans les liquides biologiques et
présentes sur la membrane des lymphocytes B comme récepteur pour
l'antigène (B Cell Receptor).Dans ces liquides, les immunoglobulines
peuvent exprimer leur fonction après combinaison avec l'antigène
qui leur correspond. Les immunoglobulines secrétées sont le
support de la fonction anticorps qui caractérise la réponse
immunitaire spécifique humorale. Les immunoglobulines sont exclusivement
synthétisées par les cellules lymphocytaires de la lignée
B. [28]
Deux types de fonctions déterminent l'activité
anticorps : la reconnaissance spécifique d'un déterminant
antigénique (ou épitope) et l'activation des systèmes qui
agissent sur les cellules qui expriment cet antigène à leur
surface. Deux régions distinctes de la molécule que l'on peut
séparer par certaines enzymes comme la papaïne ou la trypsine
assurent séparément ces fonctions. Il existe donc une
dualité fonctionnelle des anticorps.
La partie d'une immunoglobuline impliquée dans la
reconnaissance des antigènes est appelée Fab (Fragment antigen
binding) ; elle a pour caractéristique essentielle de
présenter une grande diversité, adaptée à
l'hétérogénéité des antigènes qu'elle
reconnaît.
Par contre, la partie assurant l'activation des
systèmes effecteurs a une structure plutôt conservée. Cette
partie est appelée région Fc : Fragment cristallisable.
(Voir figure N°2 pour la structure d'une immunoglobuline) [18;28;31].
Bien que possédant une structure de base commune, les
immunoglobulines sont extrêmement hétérogènes. En
effet, leurs caractéristiques physico-chimiques et leurs
propriétés biologiques ont permis d'en distinguer cinq classes.
Ce sont par ordre de concentration décroissante dans le sérum IgG
(IgG1, IgG2, IgG3, IgG4) IgM, IgA (IgA1, IgA2) IgD et IgE. [2]
Les anticorps impliqués dans les immunisations
transfusionnelles sont essentiellement les IgM et les IgG. Suivant leur mode
d'apparition nous avons les anticorps naturels à dominance IgM et les
anticorps immuns à dominance IgG. [36]
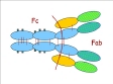
Figure n°2 : Schéma
montrant les deux parties d'une immunoglobuline [51]
IgM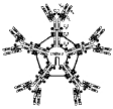
IgAs
IgD
IgG
IgE
Figure n°3: Schéma des
cinq classes d'immunoglobulines [51]
Tableau I : Tableau comparatif des principaux
caractères biochimiques et sérologiques des anticorps IgG et IgM
[51, 1,2]
|
CLASSE d'Ig
|
IgG
|
IgM
|
|
Caractéristiques structurales
|
Monomère (valence 2)
|
Pentamère (valence 10)
|
|
1(2H gamma+2L)
|
5(2H-mu + 2L) + pièce de jonction
|
|
Sous-classes et variations
|
Nombreuses sous classes
IgG (Ig1-2-3-4)
|
Néant
|
|
PM
|
90000
|
150000
|
|
Mode d'apparition
|
Anticorps
« immuns »
|
Anticorps « naturels »
|
|
Affinité et spécificité
|
Forte
|
Faible
|
|
Demi vie en jours (stabilité)
|
5
|
21
|
|
Optimum thermique
|
37°C
|
(#177;grande amplitude) de 0°C à 20°C
|
|
Principales fonctions propres (hormis la formation de complexes
Ag-Ac).
|
Précipitation neutralisation
|
agglutination
|
|
Pouvoir sérologique
|
Anticorps non agglutinants en eau physiologique
|
Anticorps agglutinants en eau physiologique
|
|
Agglutination en milieu albumineux
|
Oui
|
Oui
|
|
Enzymes protéolytiques
|
Favorables
|
Inefficaces
|
|
Capacité à activer le système du
complément
|
+/++ (voie classique) variations selon sous-classes
|
+++ (voie classique)
|
|
Capacité à activer les cellules via le
récepteur Fc
|
+/+++ (phagocytose)
|
-/+
|
|
Passage barrière placentaire
|
oui
|
non
|
I.3- Différents types d'allo immunisation
I.3.1- Allo immunisation transfusionnelle
Classiquement, l'allo immunisation transfusionnelle se
manifeste par la synthèse d'anticorps dirigés contre les
antigènes portés par les hématies, les leucocytes, les
thrombocytes, et quelques fois, certains déterminants des
immunoglobulines.
Ainsi, du fait du polymorphisme de ces antigènes, toute
transfusion de sang est forcément incompatible, exceptée celle
pratiquée entre deux (2) jumeaux monozygotes et celle faite en
autotransfusion. [33]
I.3.1.1- Causes de l'allo immunisation
L'allo immunisation est globale : elle concerne aussi
bien les antigènes HLA (Human Leucocyte Antigen) que les multiples
autres antigènes de groupes sanguins érythrocytaires.
En effet, l'analyse des anticorps dans le sérum des
polytransfusés démontre que les anticorps anti-HLA sont les plus
fréquents et les premiers à apparaître.
L'apparition des anticorps immuns dépend de
plusieurs facteurs dont l'immunogénicité de l'antigène du
donneur, le nombre et le rythme des transfusions, le phénotype
érythrocytaire du receveur, l'état immunitaire du receveur, le
sexe du receveur, le déterminisme génétique de la
réponse immunitaire.
a-) Immunogénicité de l'antigène du
donneur
Elle exprime la capacité d'un antigène à
induire une réponse immunitaire. L'immunisation résulte donc de
l'expressivité de l'antigène et du pouvoir antigénique. Ce
pouvoir est donné par la formule suivante :
Nombre
d'anticorps observés
Pouvoir antigénique (%) =
------------------------------------ ×100
Nombre d'anticorps attendus.
b-) Nombre et rythme des stimulations
Il est admis que le risque d'immunisation
croît proportionnellement au nombre et au rythme des stimulations. L'allo
immunisation transfusionnelle est « tous azimuts » et
s'étend à de nombreux systèmes de groupes sanguins.
[34]
c-) Phénotype érythrocytaire du
receveur
De toute évidence, l'allo immunisation ne
peut se faire contre les antigènes communs au donneur et au receveur.
Cependant, les receveurs de phénotype partiellement ou totalement
silencieux, et ceux n'ayant pas d'antigènes publics représentent
une situation particulièrement redoutable. L'allo immunisation peut
alors « exploser » et aboutir à un blocage
transfusionnel. [14 ; 16 ; 46]
d-) Sexe du receveur
Il a été constaté en France
par SALMON, à propos de 2909 polytransfusés, que la femme
s'immunise deux fois plus souvent que l'homme [32]. Cette constatation a
été faite au Bénin par COMPAORE FELICITE dans son
mémoire de fin de cycle [25]
e-) Etat immunitaire du receveur
Certaines maladies prédisposent le sujet
receveur à l'allo immunisation par la transfusion. Nous citons les
cirrhoses ; la maladie de HODGKIN ; les aplasies
médullaires ; les leucémies lymphoïdes chroniques et
aiguës ; la drépanocytose. [32]
f-) Déterminisme génétique de
réponse immunitaire
L'immunisation ou non d'un sujet contre un
antigène résulte du déterminisme génétique
de la réponse immunitaire. En effet, il existe un gène de
réponse immune (Ir) situé dans la région D du
système HLA (HLA-D) pouvant coder pour des molécules de classe
II. Ces molécules présentes sur les macrophages, les lymphocytes
B et les lymphocytes T helper activés sont indispensables à la
coopération cellulaire en vue de la synthèse d'anticorps. Le
gène dominant Ir confère ainsi au sujet le caractère de
répondeur (R) et son allèle récessif, le caractère
de non répondeur (NR). [14 ;16 ;46]
L'allo immunisation ne s'installe pas
immédiatement après une transfusion incompatible. En effet, un
temps de latence est nécessaire à la stimulation du
système immunitaire.
Les allo anticorps deviennent détectables
dans le sérum entre le huitième (8ième) et le
quinzième (14ième) jours après la transfusion
incompatible.
L'évolution des anticorps se présente comme
suit :
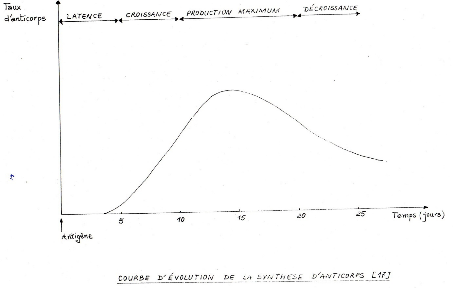
Figure n° 4 :
I.3.1.2- Conséquences de l'allo immunisation
transfusionnelle
La mise en présence d'un antigène et de
l'anticorps correspondant aboutit immédiatement à la fixation du
premier sur le second, et cette combinaison amène des modifications
à la surface de la membrane érythrocytaire qui porte
l'antigène. Ceci peut entraîner des conséquences plus ou
moins graves chez le patient transfusé. [33 ;36]
a-) Conséquences immédiates
Tous les degrés de gravité peuvent être
observés, depuis l'accident hémolytique immédiat,
compliqué d'insuffisance rénale jusqu'à la transfusion
sans bénéfice. [16 ; 27, 46]
- Hémolyse intra vasculaire
Elle est la conséquence de la fixation de
l'anticorps sur le globule rouge et de l'activation du complément. Elle
concerne les anticorps de nature IgM, IgG1, IgG3.La fixation de l'anticorps
entraîne dans un premier temps l'activation séquentielle du
complément jusqu'au C3, puis dans un second temps est mis en
jeu le complexe d'attaque membranaire (C5b-6,7,8,9). Elle correspond
essentiellement à une hémolyse intra vasculaire dont les
principales conséquences cliniques sont :
* Des perturbations vasomotrices allant de l'hypertension
à l'hypotension voire au collapsus cardiovasculaire.
* Des troubles de la coagulation essentiellement de type
coagulation intra vasculaire localisée ou disséminée
pouvant entraîner un état hémorragique.
*Des troubles de la fonction rénale, à type
d'insuffisance rénale, entraînant une oligurie, voire une anurie.
Cette insuffisance peut être transitoire ou définitive.
* Des troubles respiratoires : bien que non classiquement
documentés, ils peuvent aller jusqu'au syndrome de détresse
respiratoire aiguë.
La gravité de ces manifestations cliniques
associées peut aboutir au décès du patient. [26 ;
5 ; 33 ; 16]
En dehors des formes graves citées ci-dessus, nous
avons les formes mineures qui constituent des signes d'alarme pour les
transfusions ultérieures et se manifestent par un syndrome de frissons
hyperthermie, un ictère du lendemain
- Hémolyse intra tissulaire ou
extravasculaire
Elle est induite par la fixation de l'anticorps sur
l'hématie sans activation (ou activation limitée) du
complément. Les IgG, fixées sur les antigènes de groupes
sanguins présents sur la membrane des hématies, interagissent
avec les récepteurs de leur fragment Fc présents sur les cellules
du système des phagocytes mononucléés au niveau de la
rate, entraînant ainsi la phagocytose des hématies et leur lyse.
On observe alors un ictère post transfusionnel : le malade a
cliniquement bien toléré sa transfusion mais, le lendemain, il
apparaît un subictère ou un ictère franc avec parfois un
retentissement rénal. L'ictère peut être retardé et
n'apparaît qu'au cinquième ou sixième jour. [5 ;
33]
- Transfusion sans bénéfice
La lyse frustre et précoce des hématies
transfusées ne s'accompagne d'aucune symptomatologie clinique
immédiate ou retardée. La non amélioration du taux
d'hémoglobine après la transfusion confirme souvent
l'échec transfusionnel. [33]
b-) Conséquences retardées
Une allo immunisation transfusionnelle peut se
révéler des années après une transfusion
immunisante et compromettre l'avenir transfusionnel et surtout
obstétrical chez la femme.
En effet, lors d'une nouvelle transfusion, l'immunisation
antérieure peut soit provoquer un danger hémolytique direct (si
les anticorps sont présents à un titre suffisant), soit plus
souvent provoquer une hémolyse retardée (si les anticorps sont
présents à un titre faible ou même non décelable
sérologiquement lors de la nouvelle transfusion).
Chez la femme ayant été transfusée
même une seule fois, il y a lieu de s'inquiéter pour sa
descendance, l'apparition de la Maladie Hémolytique Néo Natale
(MHNN). [2]
I.3.1.3- Prévention de l'allo immunisation
transfusionnelle
La prévention de l'allo immunisation transfusionnelle
passe par le phénotypage des receveurs et des donneurs, le respect des
règles de compatibilité, le test de compatibilité au
laboratoire, la rationalisation de l'utilisation des produits sanguins.
a-) Phénotypage des donneurs et des
receveurs
Chez la femme ou la petite fille, le groupage Rh complet et
Kell devrait permettre de sélectionner les donneurs. Cela
éviterait les futures allo immunisations aux antigènes c, E et
Kell. [35]
Le phénotypage plus étendu dans les
systèmes de groupes sanguins érythrocytaires, Rh complet, Kell,
Duffy, Kidd, Lewis et MNSs sera effectué chez des malades susceptibles
de polytransfusion atteints d'hémopathies malignes, de
thalassémies, de drépanocytose.... qui sont appelés
à recevoir des transfusions répétées. Ceci
permettra d'éviter les premières stimulations par des
antigènes fortement immunogènes et peut d'autant retarder le
début de l'allo immunisation et la formation ultérieure de ces
mélanges complexes d'anticorps multiples qui rendent difficile la
sélection des donneurs compatibles. [32]
b-) Règles de la transfusion
En général, en transfusion de globules rouges
(GR) ce sont les antigènes apportés par les GR des donneurs qui
peuvent entrer en conflit avec les anticorps présents ou
générés par les receveurs. [26 ; 7]
MALADE DE GROUPE A
MALADE
DE GROUPE B
(Antigène A donc anticorps anti-B)
(Antigène B donc anticorps
anti- A )
MALADE DE GROUPE AB
(Antigène A et antigène B
donc
absence d'anticorps)
Figure n°5 : Règle
de compatibilité dans le système ABO [7]
Tableau II : Règle de
compatibilité dans le système Rh
|
Phénotype Rh du patient
|
Fréquence dans la population béninoise
|
Concentré de globules rouges à transfuser
|
|
D+C+E-c+e+ (R1r)
|
13 ,27%
|
Tout CGR phénotypé sauf
E+
|
|
D+C+E-c-e+ (R1R1)
|
1,28 %
|
Tout CGR phénotypé sauf
E+ et c+
|
|
D-C-E-c+e+ (rr)
|
8,93 %
|
Tout CGR phénotypé sauf
D+, C+ et E+
|
|
D+C+E+c+e+ (R1R2)
|
1,28 %
|
Tout CGR phénotypé
|
|
D+C-E+c+e+ (R2r)
|
13,27 %
|
Tout CGR phénotypé sauf
C+
|
|
D+C-E-c-e+ (R0r)
|
56.12%
|
Tout CGR phénotypé sauf C+
et E+
|
|
D+C-E-c+e- (R2R2)
|
0.77%
|
Tout CGR phénotypé sauf C+
et e+
|
|
D-C+E-c+e+ (r'r)
|
4.85%
|
Tout CGR phénotypé sauf
D+ et E+
|
|
D-C-E+c+e+ (r "r)
|
0.26%
|
Tout CGR phénotypé sauf D+
et C+
|
+ : antigènes présents sur les GR
- : antigènes absents sur les GR
Sources: [5, 7, 18]
Tableau III : Règle de
compatibilité dans le système Kell
|
Phénotype Kell du patient
|
Fréquence de la population béninoise
|
Concentré de globules rouges à transfuser
|
|
K- k+
|
98,72 %
|
Tout CGR phénotypé sauf K+
|
|
K+k+
|
1,28%
|
Tout CGR phénotypé
|
+ : antigènes présents sur les GR
- : antigènes absents sur les GR
Sources: [7, 18]
c-) Test de Compatibilité (TC) au laboratoire
Encore appelé cross match, le test de
compatibilité au laboratoire, est un examen immuno-hématologique
qui sert à vérifier la compatibilité immunologique entre
le sérum du malade et les globules à transfuser.
Son délai maximal de validité est de 72 heures.
Il regroupe les tests en milieu salin, en milieu enzymatique et en milieu
Coombs-LISS. [42]
- Test de compatibilité en milieu salin
Il permet de mettre en évidence d'éventuels
anticorps froids IgM agglutinants actifs entre 4° et 22°C. Les
anticorps naturels réguliers (anti A et anti B) ;
irréguliers (anti Le, anti P1), dirigés contre les
hématies du donneur. [42 ; 2 ; 3]
- Test de compatibilité en milieu
enzymatique
Les enzymes protéolytiques (papaïne,
broméline) coupent les glycoprotéines à leur base,
diminuant de ce fait la charge électrique et permettent plus facilement
l'accès de l'antigène à l'anticorps. Leur utilisation est
nécessaire pour mettre en évidence les anticorps non
agglutinants.
Ce test permet ainsi de mettre en évidence les
anticorps irréguliers tels que les anti Rh, les anti Kell, quelques anti
Lewis, certains anti S, les auto anticorps chauds et jamais les anti Duffy.
[18, 23, 42]
- Test de compatibilité en milieu
Coombs-LISS
Ce test permet de rechercher d'éventuels allo
anticorps IgG du receveur dirigés contre les antigènes des GR
à transfuser.
Sa réalisation nécessite les réactifs
tels que le sérum de Coombs polyvalent et la solution de LISS.
Le sérum de Coombs polyvalent permet la visualisation
des hématies sensibilisées par des anticorps, mettant ainsi en
évidence les allo anticorps ou auto anticorps chauds.
La solution de LISS (Low ionic strengh solution) diminue la
force ionique du milieu et augmente le potentiel ZETA.
Elle diminue la vitesse de la réaction
d'agglutination. Cependant la fixation de l'anticorps sur l'antigène est
activée et le temps raccourci de 60 minutes à 10 minutes. [1, 2,
33]
Se référer à l'annexe 3, 4,5 pour les
techniques de réalisation des différents tests cités
ci-dessus.
II.1- Cadre du travail
Nos travaux se sont déroulés:
- A l'Hôpital de la Mère et de l'Enfant Lagune
(HOMEL) dans le service la pédiatrie
- Au Centre National Hospitalier et Universitaire Hubert
Koutoukou MAGA (CNHU-HKM) dans les services de la Banque de Sang, de la
pédiatrie, et des Maladies du Sang
- Au Centre de santé Béthesda dans le service la
pédiatrie
- A l'Hôpital Saint Luc dans le service la
pédiatrie
- Au centre de santé de Ménontin dans le
service la pédiatrie
- A la Banque de sang du Service Départementale de la
Transfusion Sanguine (SDTS) Atlantique/littoral.
Les deux banques de sang nous ont servi de cadre de
manipulation.
II.2- Matériel de travail
II.2.1- Matériels standards
II.2.1.1-Equipement
- Centrifugeuse de table 1000 à 4000 Tpm
- Congélateur -20°C et -80°C
- Réfrigérateur 2°C à 8°C
- Bain - marie 37°C à 56°C
- Distillateur d'eau
- Microscope
- Balance
- Pipette de précision 25uL
II.2.1.2 -Petits matériels
- Portoirs
- Tubes à hémolyse- 5mL
- Pipettes Pasteur
- Tétines
- Marqueurs
- Paire de ciseaux
- Pissettes de 500mL
- Béchers - 250mL ;500mL
- Minuterie
- Garrot
II.2.1.3- Matériels consommables
- Aiguilles vacutainer stériles
- Alcool
- Lames + Lamelles
- Compresses
- Para film
- Cônes 0 à 200uL
- Tube Eppendorf 1,5 mL
- Sparadraps
- Eau distillée
- Eau de Javel
- Eau savonneuse
- Gants
- Papier essui-tout
II.2.2- Réactifs utilisés
II.2.2.1- Test de compatibilité en
Coombs-Liss
- Solution à basse force ionique (LISS)
- Réactif de Coombs polyvalent (AGH polyvalents)
- Solution de NaCl à 9%o
II.2.2.2- Recherche d'Agglutinines
Irrégulières
a-) Réactifs Cellulaires
*hématies-tests de dépistage: ID-DiaCell
I-II-III : « LISS-Coombs »
*Panel d'identification: ID-DiaPanel 11
hématies : « LISS-Coombs »
b-) Matériels spécifiques à la
RAI


Figure n°6 : ID-Incubateur 37
SI Figure n°7 :
ID-Centrifugeuse 6S

Figure
n°8 : Carte-ID « LISS-Coombs »
II.3- Méthodologie
Nos manipulations se sont déroulées
conjointement à la Banque de Sang (BDS) du CNHU-HKM et à
la Banque de Sang du SDTS Atl/Lit. Ainsi, nous nous relayons sur ces
différents lieux de travail de façon alternative.
II.3.1- Echantillonnage
Notre étude sur l'allo immunisation post
transfusionnelle a été réalisée chez tout malade
candidat à une transfusion et chez les transfusés connus de la
période allant du 24 Octobre 2005 au 02 Juin 2006.
II.3.1.1- Test de compatibilité.
Notre étude a porté sur 189 Poches de sang
cédées à la BDS du CNHU-HKM et 945 Poches de sang
cédées à la Banque de Sang du SDTS Atl/Lit soit un total
de 1134 poches de sang cédées. Soit 1134 tests de
compatibilité réalisés avec 916 sérums de patients
candidats à une transfusion.
II.3.1.2- RAI.
Cette étude a porté sur 101 sérums de
polytransfusés prélevés au cours des consultations
médicales au SMAS (CNHU-HKM) ; 97 sérums des enfants
transfusés âgés de 2 à 10 ans des services de
pédiatrie du CNHU-HKM, de l'HOMEL, de l'Hôpital Saint Luc, de
Centre de santé de Mènontin et du Centre de santé
Béthesda et 12 sérums révélés positifs au
test de compatibilité.
a- Sélection des polytransfusés du SMAS
(CNHU-HKM)
Sur la base du registre de transfusion disponible au SMAS,
nous avons identifié des polytransfusés que nous
prélevons lors de leur consultation médicale dans ledit
service.
Sont prélevés, tous les malades ayant
bénéficié d'au moins deux transfusions
différentes.
b- Sélection des enfants transfusés des
services de pédiatrie
Depuis la banque de sang, les demandes de sang en provenance
des services de pédiatrie des hôpitaux ci-dessus cités sont
ciblées. Les enfants bénéficiaires de ces transfusions et
âgés de 2 à 10 ans sont suivis et font l'objet d'un
prélèvement 8 à 10 jours voir 15 jours après la
transfusion.
NB : Il est à noter que les enfants sont
prélevés systématiquement lors de leur sortie de
l'hôpital même si le délai de 8 à 15 jours n'est pas
atteint.
c- Prélèvement et
conservation
Des prélèvements de sang veineux sont
effectués chez les malades précédemment identifiés
dans leur service respectif. Le prélèvement est fait sur tubes
secs de 5ml dûment étiquetés (voir annexe 1 pour protocole
de prélèvement de sang veineux). Ils sont centrifugés puis
les sérums mis en aliquotes de 1,5 ml pour être congelés
à - 20°C.
Les sérums révélés positifs au
test de compatibilité sont aussi aliquotés et conservés
dans les conditions décrites ci-dessus.
NB : Avant tout prélèvement, une fiche de
renseignements concernant le patient est remplie (voir annexe 11 pour la
fiche).

Figure n° 9 :
Présentation des échantillons en aliquotes
II.3.2- Technique.
Dans le cadre de nos travaux de recherche, nous avons
utilisé la technique en milieu Coombs-LISS.
II.3.2.1- Réalisation du test de
compatibilité (TC).
Nous compatibilisons parallèlement au travail des
techniciens de la Banque de sang, tous les sérums des receveurs
âgés de 2 ans au moins.
a-) Principe
Ce test permet de rechercher d'éventuels allo
anticorps IgG présents dans le sérum du receveur dirigés
contre les antigènes des GR à transfuser.
b-) Mode opératoire
Il se résume en 2 étapes à
savoir :
Première étape
- Réunir le matériel nécessaire à
la réalisation du test.
- Numéroter les échantillons et les bulletins de
demande de sang qui les accompagnent.
- Incuber à 37°C les échantillons (si
nécessaire) dans un bain-marie pendant cinq à dix minutes pour
accélérer la coagulation.
- Centrifuger à 3.000 tours /minutes les
échantillons de sang pendant une à trois minutes.
- Décanter le sérum en respectant les
numéros de chaque échantillon.
- Laver trois fois les GR du receveur en eau physiologique
à 0,9%.
- Laver trois fois les GR de la poche de sang en eau
physiologique à 0,9%.
- Faire la suspension à 5% de chacun des GR
lavés.
Deuxième étape
- Disposer et numéroter les tubes
- Distribuer les réactifs dans les tubes. (Voir annexe
3 pour le TC en milieu Coombs-LISS)
NB : Nombre de tubes à disposer = nombre de
poches à céder + 1 tube (pour auto-test).
Lorsque le TC se révèle positif nous
réalisons le test de Coombs Direct sur les poches de sang et sur les
hématies des receveurs.
(Voir annexe 6 pour le test de Coombs Direct.)

Figure n°10: Disposition du
matériel pour le TC au laboratoire
- Evaluation de la réaction.
· Lecture
*Positionner le tube au dessus d'un éclairage.
*Agiter légèrement le tube de manière
à décoller le culot d'hématies à l'aide du
surnageant.
*Lire et noter les résultats. (Voir annexe 12 pour la
fiche de résultats).
Surnageant clair clair
clair rose rose
Agglutinats 1-3 4-10 >10
fins 0
Positivité +++ ++
+ +/- -
Figure n°11:
Présentation des différentes réactions en tube
II.3.2.2 - Recherche d'agglutinines
irrégulières (RAI).
Pour cette étude, nous avons procédé
au dépistage et à l'identification des anticorps
dépistés.
Les panels utilisés proviennent du laboratoire suisse
DiaMed
La technique utilisée est celle du Micro Typing System
qui est très simple et de réalisation très
aisée.
a-) Principe du Micro Typing System (MTS)
La technique du MTS appliquée à la RAI est une
micro méthode qui permet de réaliser avec de faibles
quantités de réactifs et d'échantillons les tests
immuno-hématologiques. La réaction Ag-Ac se développe dans
un gel spécial sur lequel on dépose les hématies tests et
l'échantillon de sérum. Elle se produit effectivement pendant une
centrifugation de dix minutes à 900TPM et consiste en des
réactions d'agglutination.
b-) Dépistage des agglutinines
irrégulières
Cette recherche préliminaire d'agglutinines
irrégulières permet de détecter la présence d'allo
ou d'auto anticorps dans le plasma ou le sérum mais ne permet pas de
déterminer la spécificité de l'anticorps trouvé. Le
panel de dépistage utilisé pour notre étude est
composé des hématies-tests prêts à l'emploi,
ID-DiaCell I-II-III.
Les sérums révélés positifs au
dépistage sont testés pour l'identification du ou des anticorps
présents.
c-) Identification des anticorps
dépistés
Elle permet d'identifier les anticorps dépistés
à l'aide des hématies-tests, ID-DiaPanel prêtes à
l'emploi. Elle consiste à faire réagir sur les
hématies-tests d'identification ID-DiaPanel, le sérum dans lequel
des anticorps ont été dépistés.
Dans le cadre du présent travail, le panel
d'identification est composé de 11 hématies.
d-) Evaluation de la réaction
-Une réaction est positive lorsque les
hématies agglutinées forment une ligne rouge à la surface
du gel ou sont dispersées dans le gel.
-Une réaction négative se traduit par la
sédimentation complète des hématies au fond du tube.
Positivité +++ ++
+ (+) -
Figure n°12 :
Présentation des différentes sortes de réactions en gel
[23]
Nos résultats se présenteront en deux volets
sous forme de tableaux.
III.1- Tests de compatibilité.
Notre étude a porté sur 1134 poches de sang
cédées à la BDS du CNHU-HKM et à la BDS du SDTS
Atl-Lit. Soit 1134 tests de compatibilité réalisés avec
916 sérums de patients.
III.1.1- Caractéristiques de la population
étudiée
Tableau IV: Répartition des
receveurs selon le sexe et l'âge.
|
Sexe
Tranche d'âge (ans)
|
Masculin
|
Féminin
|
Total
|
|
N %
|
N %
|
N %
|
|
[2 -11]
[12-21]
[22-31]
[32-41]
[42-51]
[52-61]
[62, ? [
|
24 2,62
47 5,13
116 12,66
94 10,26
30 3,28
29 3,17
8 0,87
|
51 5,57
95 10,37
232 25,33
113 12,33
18 1,96
38 4,15
21 2,29
|
75 8,19
142 15,5
348 37,99
207 22,59
48 5,24
67 7,32
29 3,16
|
|
Total
|
348 38
|
568 62
|
916 100
|
Figure n° 13 :
Répartition des receveurs selon le sexe et l'âge.
62% des receveurs sont des femmes et 38% des hommes.
III.1.2- Etude de la positivité.
Tableau V : Résultats
généraux des tests de compatibilité
|
N
|
%
|
|
TC (+) avec AT (-)
|
24
|
2,12
|
|
TC (+) avec AT (+)
|
6
|
0,53
|
|
TC (-) avec AT (+)
|
5
|
0,44
|
|
TC (-) avec AT (-)
|
1099
|
96,91
|
|
Total
|
1134
|
100
|
TC : Test de compatibilité
AT : Auto Test
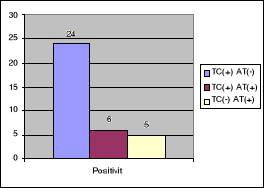
Figure n°14 :
Répartition de la positivité des tests de
compatibilité
2 ,65% des tests de compatibilité sont positifs
contre 96,91% de négatifs. Le nombre de TC (+) avec AT (-) est d'environ
2% ; ce qui correspond à 16 sérums de receveurs. C'est cette
série de résultat qui retiendra notre attention pour le reste de
l'étude.
Tableau VI : Répartition des tests
de compatibilité positifs selon la fréquence des
transfusions.
|
Hôpitaux
Nombre de TS
|
CNHU-HKM
|
HOMEL
|
Autres centres
|
Total
|
|
N
|
%
|
N
|
%
|
N
|
%
|
N
|
%
|
|
01 TS
|
0
|
0,00
|
0
|
0,00
|
0
|
0,00
|
0
|
0,00
|
|
02 TS
|
1
|
6,25
|
0
|
0,00
|
0
|
0,00
|
1
|
6,25
|
|
Supérieur à 02 TS
|
5
|
31,25
|
2
|
12,50
|
2
|
12,50
|
9
|
56,25
|
|
Bulletins ne portant aucune information
|
3
|
18,75
|
0
|
0,00
|
3
|
18,75
|
6
|
37,50
|
|
Total
|
9
|
56,25
|
2
|
12,50
|
5
|
31.25
|
16
|
100,00
|
Figure
n°15 : Répartition des tests de compatibilité
positifs selon la fréquence des transfusions.
La positivité des tests de compatibilité est
plus fréquente chez les patients qui ont reçu plus de deux
transfusions (56%). La prévalence des tests de compatibilité
positifs est de 37,5% pour les bulletins ne portant aucune information
concernant le nombre de transfusion.
Tableau VII: Répartition des
patients suivant le sexe
|
Nombre de cas
Sexe
|
Nombre de cas (-)
|
Nombre de cas (+)
|
Total
|
|
N %
|
N %
|
N %
|
|
Masculin
Féminin
|
344 37,55
556 60,70
|
4 0,44
12 1,31
|
348 37,99
568 62,01
|
|
Total
|
900 98,25
|
16 1,75
|
916 100
|
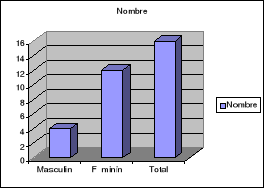
Figure n° 16 :
Répartition des patients allo immunisés selon le
sexe.
1,75% des patients ont réagi au test de
compatibilité dont 0,44% sont des hommes et 1,31% des femmes. Ceci
traduit une prédominance de la positivité des femmes par rapport
à celle des hommes.
Tableau VIII: Répartition des malades
dont les tests de compatibilité sont positifs avec autotest
négatif selon le sexe et l'âge.
|
sexe
|
Hommes
|
|
Femmes
|
|
Total
|
|
|
Tranches d'âge (ans)
|
N
|
%
|
N
|
%
|
N
|
%
|
|
[02-11]
[12-21]
[22-31]
[32-41]
[42-51]
[52-61]
[62,?[
|
0
0
1
2
0
0
1
|
0,00
0,00
6,25
12,50
0,00
0,00
6,25
|
2
1
6
2
0
0
1
|
12,50
6,25
37,5
12,50
0,00
0,00
6,25
|
2
1
7
4
0
0
2
|
12,50
6,25
43,75
25,00
0,00
0,00
12,50
|
|
Total
|
4
|
25
|
12
|
75
|
16
|
100,00
|
68,75% des TC (+) avec AT (-) surviennent
chez les sujets âgés de 22 à 41 ans. Cette
positivité est élevée dans la tranche d'âge de 32-41
ans chez les sujets de sexe masculin et dans la tranche d'âge de 22-31
ans chez les sujets de sexe féminin.
Tableau IX : Résultats des tests
de coombs direct effectués sur les GR des receveurs ayant un AT (+).
|
Positifs
|
Négatifs
|
Total
|
|
N
|
%
|
N
|
%
|
N
|
%
|
|
Receveurs
|
02
|
18.18
|
09
|
81.82
|
11
|
100
|
Sur 11 tests de coombs direct effectués, 82% sont
négatif et 18% positifs.
III.1.3- Résultats du dépistage et de
l'identification des anticorps impliqués dans les
incompatibilités transfusionnelles.
Parmi les 16 sérums sur lesquels le test de
compatibilité est positif avec auto-test négatif, seuls 12 ont
fait l'objet de la RAI.
Tableau X: Résultats du
dépistage des anticorps irréguliers.
|
N
|
%
|
|
Sérums ayant réagi avec les
hématies-tests ID-DiaCell I-II-III
|
08
|
66,67
|
|
Sérums ayant présenté des
réactions négatives avec les hématies-tests ID-DiaCell
I-II-III
|
04
|
33,33
|
|
Total
|
12
|
100
|
8 sérums des receveurs ont réagi avec les
hématies-tests ID-DiaCell I-II-III sur les 12 sérums
testés.
Tableau XI : Résultats
généraux des travaux d'identification des anticorps
irréguliers.
|
N
|
%
|
|
Sérums ayant réagi avec quelques hématies
du panel
|
06
|
75
|
|
Sérums ayant présenté des
réactions positives avec toutes les hématies du panel (qui ne
permettent pas une identification)
|
02
|
25
|
|
Total
|
08
|
100
|
Pour les 8 sérums testés à
l'identification, 6 ont réagi avec quelques hématies du panel
d'identification soit 75% et 2 ont présenté des réactions
positives avec toutes les hématies du panel soit 25%.
Tableau XII : Répartition des
spécificités Ac identifiées par systèmes de groupes
sanguins
|
Systèmes de groupes sanguins
|
Spécificités anticorps
|
Nombres de cas
|
Pourcentage
|
|
Rhésus
|
anti D
|
-
|
-
|
|
anti C
|
04
|
57 ,14
|
|
anti E
|
03
|
42,86
|
|
ant c
|
-
|
-
|
|
anti e
|
-
|
-
|
|
anti Cw
|
-
|
-
|
|
Lewis
|
anti Lea
|
01
|
100
|
|
anti Leb
|
-
|
-
|
|
MNSs
|
anti M
|
-
|
-
|
|
anti N
|
-
|
-
|
|
anti S
|
01
|
100
|
|
anti s
|
-
|
-
|
Les spécificités anticorps ont
été identifiées dans trois systèmes de groupes
sanguins à savoir : Rh, Lewis et MNSs.
Dans le système Rh, sept (7) anticorps ont
été identifiés dont (trois) 3 anticorps anti E et quatre
(4) anticorps anti C.
Dans le système Lewis nous avons identifié un
anticorps anti Lea.
Dans le système MNSs un anticorps anti S a
été identifié.
Tableau XIII : Fréquence des
différents systèmes de groupes sanguins en cause dans l'allo
immunisation transfusionnelle.
|
Systèmes
|
Rhésus
|
Lewis
|
MNSs
|
Total
|
|
Nombre d'Ac identifié
|
07
|
01
|
01
|
09
|
|
Pourcentage
|
77,78
|
11,11
|
11,11
|
100
|
Nous remarquons que les anticorps dirigés contre les
antigènes du système Rh sont plus fréquemment en cause
dans les incompatibilités transfusionnelles. Suivent ceux
dirigés contre les antigènes des systèmes MNSs et
Lewis.
III.2- Résultats de la RAI effectuée
chez les patients polytransfusés du SMAS et les enfants
transfusés de pédiatrie.
III.2.1- Caractéristiques de la population.
Nous étudierons ces caractéristiques suivant le
sexe, l'âge, les pathologies en cause et le nombre de transfusion.
Tableau XIV : Répartition des
patients du SMAS selon le sexe et l'âge.
|
Sexe
|
Masculin
|
Féminin
|
Total
|
|
Tranche d'âge (ans)
|
N %
|
N %
|
N %
|
|
[5-14 ]
|
05 4,95
|
03 2,97
|
08 7,92
|
|
[15 -24]
|
06 5,94
|
19 18,81
|
25 24,75
|
|
[25-34]
|
20 19,80
|
11 10,89
|
31 30,69
|
|
[35-44]
|
16 15,84
|
04 3,96
|
20 19,80
|
|
[45-54]
|
06 5,94
|
04 3,96
|
10 9,90
|
|
[55-64]
|
03 2,97.
|
01 0,99
|
04 3,96
|
|
[65 ;?[
|
01 0,99
|
02 1,98
|
03 2,97
|
|
Total
|
57 56,44
|
44 43,56
|
101 100
|
Dans cette population d'étude, 56,44% sont des hommes
et 43,56% sont des femmes, La tranche d'âge la plus
représentée chez les hommes est celle de 25-34 ans et celle plus
représentée chez les femmes est celle de 15-24 ans.
Tableau XV: Répartition des
patients de la pédiatrie selon le sexe et l'âge.
|
Sexe
|
Masculin
|
Féminin
|
Total
|
|
Tranche d'âge (ans)
|
N %
|
N %
|
N %
|
|
[1-3]
|
19 19,59
|
18 18,56
|
37 38,15
|
|
[4-6]
|
25 25,77
|
13 13,40
|
38 39,17
|
|
[7-9]
|
06 6,19
|
04 4,12
|
10 10,31
|
|
[10-12]
|
08 8,25
|
04 4,12
|
12 12,37
|
|
Total
|
58 59,80
|
39 40,20
|
97 100
|
Dans cette population d'étude, les enfants
âgés de 4 à 6 ans sont plus représentés;
par contre chez les sujets de sexe féminin ce sont les enfants
âgés de 1 à 3 ans qui sont plus
représentés.
Tableau XVI : Répartition des patients
selon les services et les affections
|
Services
|
SMAS
|
Pédiatrie
|
Total
|
|
Pathologies en cause
|
N %
|
N %
|
N %
|
|
Anémie sans drépanocytose
|
10 5,05
|
72 36,36
|
82 41,41
|
|
Drépanocytose
|
50 25,25
|
00 0,00
|
50 25,25
|
|
Hémophilie
|
08 4,04
|
00 0,00
|
08 4,04
|
|
Autres pathologies
|
33 16,67
|
25 12,62
|
58 29,30
|
|
Total
|
101 51,01
|
97 48,99
|
198 100
|
La majorité des enfants de la pédiatrie sont
hospitalisés pour anémie; par contre la majorité des
patients du SMAS souffrent de drépanocytose avec un pourcentage de
25,25%.
Tableau XVII : Répartition des
patients selon le nombre de transfusions et le service.
|
Services
|
SMAS
|
Pédiatrie
|
Total
|
|
Nombre de TS
|
N %
|
N %
|
N %
|
|
Une TS
|
00 0,00
|
93 46,97
|
93 46,97
|
|
Deux TS
|
00 0,00
|
04 2,02
|
4 2,02
|
|
Trois TS
|
17 8,58
|
00 0,00
|
17 8,58
|
|
Quatre TS
|
33 16,67
|
00 0,00
|
33 16,67
|
|
Plus de quatre TS
|
51 25,76
|
00 0,00
|
51 25,76
|
|
Total
|
101 51,01
|
97 48,99
|
198 100
|
26% des polytransfusés ont reçu plus de quatre
transfusions, par contre la majorité des enfants de la pédiatrie
ont reçu une seule transfusion, Soit un pourcentage de 46,97%.
III.2.2- Répartition de la positivité des
réactions d'allo immunisation
Tableau XVIII :
Répartition des résultats globaux du dépistage selon les
services
|
Services
|
SMAS
|
Pédiatrie
|
|
Types de réactions
|
N
|
%
|
N
|
%
|
|
Sérums ayant présenté des
réactions négatives avec les hématies-tests ID-DiaCell
I-II-III
|
93
|
92,08
|
97
|
100
|
|
Sérums ayant réagi avec les
hématies-tests ID-DiaCell I-II-III
|
08
|
7,92
|
00
|
00
|
|
TOTAL
|
101
|
100
|
97
|
100
|
8% des patients polytransfusés du SMAS ont
réagi positivement au dépistage d'anticorps irréguliers.
Alors que ceux de la pédiatrie ont réagi négativement.
Tableau XIX : Répartition des patients
allo immunisés selon le service et le nombre des
transfusions
|
Services
|
SMAS
|
Pédiatrie
|
|
Nombre de transfusion (TS)
|
Nombre de cas
|
Nombre de positif
|
%
|
Nombre de cas
|
Nombre de positif
|
%
|
|
01 TS
|
00
|
00
|
0,00
|
93
|
00
|
0,00
|
|
02 TS
|
00
|
00
|
0,00
|
04
|
00
|
0,00
|
|
03 TS
|
17
|
02
|
1.98
|
00
|
00
|
0,00
|
|
04TS
|
33
|
03
|
2.97
|
00
|
00
|
0,00
|
|
Supérieur à 04 TS
|
51
|
03
|
2,97
|
00
|
00
|
0,00
|
|
Total
|
101
|
08
|
7.92
|
97
|
00
|
0,00
|
Les patients immunisés sont ceux qui ont
reçu plus de deux transfusions.
Tableau XX : Répartition des
patients selon le service et le délai de prélèvement
après la dernière transfusion.
|
Services
|
SMAS
|
Pédiatrie
|
|
Période de
prélèvement
|
Nombre de cas
|
Nombre de positif
|
%
|
Nombre de cas
|
Nombre de positif
|
%
|
|
Avant le 8ème jour
|
26
|
00
|
00
|
39
|
00
|
00
|
|
Entre le 8ème et le 15ème
jour
|
12
|
02
|
1,98
|
57
|
00
|
00
|
|
Entre le 15ème et le 30ème
jour
|
10
|
01
|
0,99
|
01
|
00
|
00
|
|
Plus de 30 jours
|
53
|
05
|
4,95
|
00
|
00
|
00
|
|
Total
|
101
|
08
|
7,92
|
97
|
00
|
00
|
La fréquence de positivité est
élevée parmi les patients prélevés plus de 30 jours
après la dernière transfusion soit un taux d'environ 5% contre
une fréquence de 2% chez ceux qui sont prélevés entre le
8ème et le 15ème jour après la
dernière transfusion. Par contre elle est nulle chez les patients
prélevés avant le 8ème jour après la
dernière transfusion.
Tableau XXI : Répartition des
patients immunisés selon le sexe et l'âge.
|
Sexe
|
Masculin
|
Féminin
|
Total
|
|
Tranche d'âge (ans)
|
N %
|
N %
|
N %
|
|
[5-14]
|
0 0
|
1 12,5
|
1 12,50
|
|
[15-24]
|
0 0
|
1 12,5
|
1 12,50
|
|
[25-34]
|
3 37,50
|
1 12,5
|
4 50,00
|
|
[35-44]
|
1 12,50
|
0 0
|
1 12,50
|
|
[45-54]
|
1 12,50
|
0 0
|
1 12,50
|
|
[55-64]
|
0 0
|
0 0
|
0 0
|
|
[65 ;?[
|
0 0
|
0 0
|
0 0
|
|
Total
|
5 62,5
|
3 37,50
|
8 100
|
La fréquence de positivité est
élevée dans la tranche d'âge de 25-34 ans, soit 50% des
patients allo immunisés,
Tableau XXII : Répartition des patients
allo immunisés selon les affections
|
Affections
|
Nombre de cas
|
Nombre de positif
|
%
|
|
Anémie
|
10
|
01
|
0,99
|
|
Drépanocytose
|
50
|
03
|
2,97
|
|
Hémophilie
|
08
|
01
|
0,99
|
|
Autres
|
33
|
03
|
2,97
|
|
Total
|
101
|
08
|
7,92
|
La fréquence de patients allo immunisés est
élevée chez les drépanocytaires et les patients souffrant
d'autres affections (leucémie...).
Tableau XXIII : Présentation des
résultats après identification.
|
N
|
%
|
|
Sérums dans lesquels des spécificités Ac
ont été identifiées
|
06
|
75
|
|
Sérums ayant présenté des
réactions positives avec touts les hématies du panel (qui ne
permettent pas une identification)
|
02
|
25
|
|
TOTAL
|
08
|
100
|
Tableau XXIV: Répartition des
spécificités Ac identifiées par systèmes de groupes
sanguins.
|
Systèmes de groupes sanguins
|
Spécificités anticorps
|
Nombres de cas
|
%
|
|
Rhésus
|
anti D
|
-
|
-
|
|
anti C
|
03
|
42,86
|
|
anti E
|
03
|
42,86
|
|
anti c
|
-
|
-
|
|
anti e
|
-
|
-
|
|
anti Cw
|
01
|
14,28
|
|
Kidd
|
anti Jka
|
01
|
100
|
|
anti Jkb
|
-
|
-
|
|
Lewis
|
anti Lea
|
02
|
100
|
|
anti Leb
|
-
|
-
|
|
MNSs
|
anti M
|
-
|
-
|
|
anti N
|
-
|
-
|
|
anti S
|
01
|
100
|
|
anti s
|
-
|
-
|
Les spécificités anticorps ont
été identifiées dans 4 systèmes de groupes sanguins
à savoir : Rh; Kidd; Lewis et MNSs.
Dans le système Rh, sept (7) anticorps ont
été identifiés dont trois (3) anticorps anti- C, trois (3)
anticorps anti E et un (1) anticorps anti Cw.
Dans le système Kidd, un (1) anticorps anti
Jka a été identifié.
Dans le système Lewis, deux (2) anticorps anti
Lea ont été identifiés.
Dans le système MNSs, un (1) anticorps anti S a
été identifié.
Tableau XXV: Fréquence des
différents systèmes en cause dans l'allo immunisation
transfusionnelle chez les polytransfusés du SMAS
|
Systèmes
|
Rhésus
|
Kidd
|
Lewis
|
MNSs
|
Total
|
|
Nombre d'Ac identifiés
|
07
|
01
|
02
|
01
|
11
|
|
%
|
63,64
|
0,09
|
0,18
|
0,09
|
100
|
Les anticorps du système Rh sont
fréquemment en cause dans les immunisations transfusionnelles avec une
fréquence de 63,64%, Suivent les anticorps des systèmes Lewis,
Kidd et MNSs.
IV.1- Analyse des résultats des tests de
compatibilité effectués.
IV.1.1- Caractéristiques de la population
L'étude du sexe dans notre série fait remarquer
que les candidats à une transfusion sont à dominance de sexe
féminin ; soit 3 patients sur 5. Chez ces mêmes sujets, la
tranche d'âge comprise entre 22-31 ans est la plus
représentée, suit celle de 32-41 ans. Ceci s'explique par
l'optimum de maternité atteinte dans cette tranche d'âge selon les
travaux d'ENIANLOKO [17] effectuée sur les femmes
accouchées en zone rurale et urbaine.
IV.1.2- Etude des résultats des tests de
compatibilité effectués.
- Etude des résultats généraux
des tests de compatibilité.
Dans notre étude, 35 tests soit 3,09% des tests de
compatibilité effectués sur 1134 poches ont réagi
positivement au Test de compatibilité et/ou à l'autotest
traduisant des cessions d'unités de sang incompatibles.
Les incompatibilités transfusionnelles mises en cause
sont dues à des agglutinines chaudes, lesquelles peuvent entraîner
des réactions post-transfusionnelles allant de l'hémolyse
à la transfusion sans bénéfice. La gravité de ces
réactions prouve l'importance de la réalisation du test de
compatibilité au laboratoire qui pourrait certainement réduire
les risques immunologiques aux patients.
Les études réalisées par
SIBERTZ-JADIN (B.) [23] en 1996 sur une population de 1238
patients au Bénin ont montré que sur 2765 poches
compatibilisées, 569 sont déclarées positives soit 20,60%.
Les travaux réalisés par SOSSA Dagnon [45] en
1995 sur 177 cessions d'unités de sang ont montré que 35%
étaient incompatibles. De même, ceux rapportés par
ADEBO (D.) et HOUNKPONOU (J-B),
révèlent que 311 tests sont positifs sur 1900 tests
effectués soit 16,14%. Ces résultats sont différents de
ceux de notre série. Ceci peut s'expliquer par le fait que nous avons
effectué nos tests uniquement en milieu Coombs-LISS contrairement aux
autres où les tests ont été effectués en plus du
milieu Coombs-LISS, en milieux salin et enzymatique.
- Etude de la répartition des patients allo
immunisés selon la fréquence des transfusions.
L'analyse approfondie de la figure n°15
révèle que le taux de positivité est élevé
chez les patients ayant reçu plus de deux transfusions
antérieures et nul chez ceux n'ayant reçu qu'une seule
transfusion antérieure. Ces transfusions ont induit l'allo immunisation
chez la première série de patients. En effet, il existe une
probabilité plus importante d'allo immunisation liée à des
transfusions antérieures. Ceci concorde avec les résultats des
travaux réalisés par SMITH (F.) [43] à
propos de 132 tests effectués sur les enfants polytransfusés au
CNHU-HKM, ADEBO D. HOUNKPONOU J-B [2]à propos de 1900
tests de compatibilité réalisés à la BDS du
CNHU-HKM. Il parait alors important de phénotyper les patients
susceptibles de polytransfusions.
Aussi sur un grand nombre de bulletins de demande de sang,
aucune information n'était mentionnée concernant le nombre de
transfusions antérieures du malade. Cet état des choses nous a
bloqués dans l'interprétation des résultats.
- Etude de la répartition des patients selon le
sexe.
L'étude de la positivité selon le sexe montre
que 3 patients allo immunisés sur 4 sont de sexe féminin. Ceci
traduit la fréquence d'immunisation plus élevée chez les
femmes, comme l'a remarqué ROUGER (P.) [36] dans les
bases de la Transfusion Sanguine et SALMON (C.) [39] dans
l'immunisation par la Transfusion Sanguine.
Deux patients allo immunisés sur 16 sont dans la
tranche d'âge 2-11 ans soit 12,5% et sont tous de sexe féminin.
Sept (07) patients allo immunisés sur 16 sont dans la tranche
d'âge de 22-31 ans dont six (06) de sexe féminin. Ceci traduit une
immunisation des sujets jeunes de sexe féminin pouvant ainsi
compromettre leur avenir obstétrical.
Si dans certaines études, les réactions d'allo
immunisation sont fréquentes dans des catégories plus jeunes
comme dans notre étude, elles sont plus importantes chez les sujets
âgés, car avec l'âge augmente la fréquence des
transfusions du fait d'un plus grand nombre potentiel d'indications
médicales et/ou chirurgicales.
IV.2- Etude des résultats des travaux
effectués chez les polytransfusés et les enfants de
pédiatrie.
IV.2.1- Caractéristiques de la population.
L'observation des résultats montre que, contrairement
au constat général fait dans la population béninoise,
l'échantillon de notre étude au SMAS comporte plus de sujets de
sexe masculin (56,44%) que de sexe féminin (43,56%). Il en est de
même pour la pédiatrie où nous avons 59,60% d'hommes contre
40,20% de femmes.
L'étude de la répartition selon les services et
les affections montre que 82 patients soit 41,41% sont anémiés
pour diverses causes dont 72 enfants de la pédiatrie. Ceci s'explique
par le fait que le Bénin est dans une zone endémique où
l'anémie palustre est la principale cause de transfusion sanguine chez
les enfants. Viennent ensuite la drépanocytose et les diverses autres
affections.
IV.2.2- Etude des résultats de dépistage
d'allo anticorps.
La lecture des tableaux X et XI montre qu'au
dépistage, seulement huit (08) sérums du SMAS ont donné
des réactions positives avec les hématies-tests
ID-DiaCell I-II-III. Ceci peut s'expliquer par le fait qu'en
pédiatrie tous les enfants ont reçu au plus, deux transfusions
et que la plupart des prélèvements effectués sur les
enfants étaient faits avant le 8ème jour après
la dernière transfusion alors que dans les travaux de SMITH
(F.) [43] la plupart des enfants prélevés avaient
reçu plus de deux transfusions, ce qui traduit la positivité
observée dans son travail. De plus dans les
Bases de la Transfusion Sanguine
de ROUGER (P.) le pic d'anticorps est atteint entre
le 8ème et le 14ème jour.
Par contre la positivité observée chez les
polytransfusés est élevée chez ceux ayant reçu au
moins quatre (04) transfusions. Aussi, soulignons-nous que malgré des
prélèvements faits chez certains de ces polytransfusés,
plus de 30 jours après la dernière transfusion, des
sérums, se sont révélés positifs au
dépistage d'allo anticorps. Ainsi, nous pouvons affirmer qu'en dehors de
la période optimale de dépistage d'anticorps (entre le
10ème et le 21ème jour après la
transfusion) des anticorps peuvent persister dans le sérum pendant
longtemps. Nous revenons au fait que le risque d'allo immunisation est
lié au nombre de transfusions.
IV.3- Etude des résultats de l'identification
des anticorps irréguliers.
Les sérums révélés positifs au
test de compatibilité avec autotest négatif ont
permis l'identification de 09 anticorps dont 04 anti C, 03 anti E, 01 anti
Lea et 01 anti S. Cinq (05) sérums sont
polyspécifiques, ce qui peut s'expliquer par le fait que ces malades
avaient été en contact au cours des différentes
transfusions antérieures avec des antigènes immunogènes
qu'ils ne possèdent pas.
Cette polyspécificité des anticorps des
sérums examinés peut aboutir au blocage de la transfusion, car
il devient plus difficile de trouver des poches de sang compatibles.
Au regard des résultats précédents, en
pratiquant uniquement le contrôle ultime au lit du malade avant une
cession de sang, les receveurs allo immunisés pourraient réagir.
Ces réactions post transfusionnelles vont de l'hémolyse des
hématies transfusées à la transfusion sans
bénéfice.
La fréquence élevée des anticorps
dirigés contre des antigènes du système Rh traduit la
forte immunogénicité de ces antigènes.
L'immunisation à l'antigène E et à
l'antigène C est fréquente dans la population
étudiée. Ce constat avait été fait par
KINTOMONHO (S.R.) [26] chez les donneurs
bénévoles de sang au CNTS et par ADEBO et
HOUNKPONOU [2].
Considérant les résultats des anticorps du
système Kidd, nous avons identifié comme dans les travaux de
YARA (J.) et BAYILI (G.) [48] un anti
Jka contrairement aux travaux de DOFONHAKOU [16] et
YABI [47] qui n'ont pas identifié des
spécificités anticorps dans ce système. Cet anticorps est
dangereux aussi bien en transfusion sanguine que lors de la MHNN. L'existence
de cet antigène dans la population béninoise a été
démontrée dans les travaux de KINTOMONHO [26],
de BIGOT (A.) SECLONDE (H.) et coll [9]. La
rareté de cette allo immunisation est due à la faible
immunogénicité de l'antigène.
Au niveau du système Lewis, des anticorps anti
Lea ont été identifiés en milieu Coombs-LISS.
De tels anticorps pourraient provoquer des incidents transfusionnels du genre
raccourcissement de la durée de vie des hématies Lewis
incompatibles transfusées. Il importerait donc de rechercher de tels
anticorps avant toute transfusion.
Enfin concernant la distribution des anticorps dirigés
contre les antigènes du système MNSs, seul l'anti S a
été identifié. Cet anticorps actif en milieu Coombs-LISS
et donc à température du corps humain est également
dangereux.
IV.4- Difficultés rencontrées.
Au nombre des difficultés rencontrées nous
pouvons citer :
- le refus des parents de laisser prélever leurs
enfants.
- l'impossibilité de suivi des malades de la
pédiatrie, ce qui nous a amené à faire des
prélèvements avant le 8ème jour après la
transfusion.
- l'insuffisance de la quantité des échantillons
tests des patients envoyés à la BDS ne nous permettant pas de
réaliser le TC après celui des techniciens de la BDS.
- les informations incomplètes sur l'ordonnance de
demande de sang. constituant ainsi un handicap dans l'interprétation des
résultats des tests de compatibilité.
- le non acheminement des réactifs de la RAI à
temps, ce qui a constitué un frein à nos travaux.
- l'absence de réactifs de phénotypage pouvant
nous permettre d'exclure éventuellement l'anticorps anti
Cw.
x1. ADDA BRANCO (S.), KOUKPONOU (T.)
Etude comparative des différentes techniques
utilisées lors des tests de compabilité au laboratoire.
Monographie de fin de cycle, ETLAM, 1995-1996
2. ADEBO (D.O), HOUNKPONOU (J.B.M.)
Intérêt des tests de comptabilité au
laboratoire (à propos de 1900 poches cédées)
Mémoire de fin de cycle, CPU, 1998-1999
3. AFIN (E.) LOZES (E.)
Contribution à l'étude de l'allo immunisation
Rhésus (anti D) dans la région de Cotonou.
Mémoire de fin de cycle, CPU, 1981
4.AHRONS (S.) KISSMEYER NIELSEN (F.)
Serogilocal investigations of 1,358 transfusions
réactions in 74,000 transfusions.
Dan Med Bull 1968 ; 15 :684-93
5. ANANI (L.), GUERRERI (C.), DENEYS (V.) SIEBERTZ
(B.),
BIGOT (A.), LATOUNDJI (S.) GNANHOUI (I.), ZOHOUN (I.)
DE BRUYERE (M.)
Prévention des risques immunologiques transfusionnels
à Cotonou au Bénin
Le Bénin médical
2000 ;16 : 13-21
6. BACH (J.F.)
Traité d'immunologie
Editions Flammarion, Médecine-Sciences, Paris,
1993 :11-43
7. BEZIAT (D.) COURBIL (R.) FAURE (C.) MEUDEC.
Jean-Marie
La thérapeutique transfusionnelle : comprendre
pour réussir
Editions Heures de France, Paris, 1996 : 32-34
8. BIGOT A.
Cours d'immunologie
Chapitre : Réaction AntigènesAnticorps
Université Nationale du Bénin /FSS 1998-1999
9. BIGOT (A.), GUERRIERI (C.), SECLONDE (H.),
LATOUNDJI (S.), ZOHOUN (I.), DE BRUYERE (M.), SOKAL (G.)
Les phénotypes érythrocytaires au Sud
Bénin
Louvain Médical 1989 ; 108 :
533-538,
10. BIGOT (A.), SECLONDE (H.), GUERRIERI (C.), ZOHOUN
(I.)
DE BRUYERE (M.)
Recherche d'anticorps irréguliers dans une population
de femme enceinte à Cotonou : Fréquence et nature.
Le Bénin Médical 1994 ;
3 : 52-56
11. BINDER (L.S), GINSBERG (V.) HARMEL (M.H.)
A six years study of incompatible blood transfusions.
Surg gynecol obstet 1959; 108 :19-34
12. BINET (C.), GRUEL
(Y.)
Hématologie
Université François - Rabelais de Tours.
Faculté de Médecine, 1995-1996: 5-96
13. BOON (Th.) MASSON (P.)
Immunologie et immunogénétique. Tome 1 Maison
Médicale U.C.L., Bruxelles, 1993-1994:12-94
14. COMPAORE (F.)
Contribution à l'étude de l'allo immunisation
contre les antigènes érythrocytaires en République du
Bénin (à propos du dépistage d'anticorps
irréguliers chez 132 malades transfusés à l'hôpital
de Porto-Novo).
Mémoire de fin de cycle, CPU, 1986
15. DANSOUNSOU DJERMAKOYE
Mâh-Rabiou
Étude des phénotypes ABO au CNTS de Cotonou
Mémoire de fin de cycle, CPU, 1995-1996
16. DOFONHAKOU (A.)
Contribution à l'étude de l'allo immunisation
foeto-maternelle en République du Bénin
Mémoire de fin cycle, CPU, 1988
17. ENIANLOKO
Thôm1-irène (A.)
Intérêt de la pratique systématique du
test de coombs dans un service de maternité de zone rurale et de zone
urbaine.
Mémoire de fin de cycle, CPU, 1995-1996
18. GENETET (B.)
Immunologie :
Technique et documentation Lavoisier, Paris, 1989 :
22-31
19. GENETET (B), ROBIQUET (R.)
Glossaire de la transfusion sanguine.
Oberthur Rennes, 1980: 15-88
20. GOUDEMAND (M.), SALMON (Ch.)
In " Immunologie et immunogénétique"
Editions Flammarion Médecine-Sciences, Paris, 1980:
21-55
21. GRAHAM D. Sher
La réduction leucocytaire des stocks de sang
GINE Web
22. ID-DiaMed Micro Typing System
Micro Typing System: Technique et interprétation des
réactions
23. JADIN (B.)
Etude comparative des techniques Gel-Tube dans les tests de
compatibilité
24. JAULMES (B.) TERRIER (E.) CHAPUS
(G.) GESLIN (P.)
Prévention des accidents transfusionnels par
incompatibilité sanguine. Le risque d'incompatibilité
transfusionnelle en pratique hospitalière.
Transfusion 1965 ;8 :191-200
25. JURON-DUPRAZ (F.) BETUEL (H.)
JOUVENCAUX (A.)
Accidents immuno hématologiques au cours de la
transfusion de plus de deux millions de concentrés de globules
rouges.
Rev Fr Transfus immunohematol 1982; 4 :
439-50
26. KINTOMONHO S. Raymond
Étude des phénotypes érythrocytaires
autres que ABO et recherche d'Ac irréguliers chez les donneurs
bénévoles de sang au CNTS de Cotonou
Mémoire de fin de cycle, CPU, 1994-1995
27. LEFRERE Jean-Jacques, ROUGER Philipe
La Transfusion Sanguine: une approche sécuritaire
Édition John Libbey Eurotext, Paris,2000 :
244-275
28. LE PENNEC (P.Y.), TISSIER (A.M.)
MANNESSIER (L.)
ROUGER (P.)
Les accidents immuno hématologiques transfusionnels.
III-Etude de 61 cas
Transfus Clin Biol 1996 ;
3 :157-65
29. LOZES E.
Cours d'immunologie générale
Chapitre : Les antigènes
UAC/EPAC/ABM 2003-2004
30. ORTHO-DIAGNOSTICS
Antigènes et anticorps de groupes sanguins et leur
rôle dans la transfusion sanguine.1990:17-65
31. PARNET MATHIEU
Françoise
Incompatibilités foeto-maternelles sanguines :
dépistage et prévention [
http://www.ipp.perinat.com/article.php3?id-article=515]
(Consulté le 13/12/05 à 16H55)
32. ROIT (I.), BROSTOFF (J.), MALE (D.)
Immunologie Fondamentale et appliquée :
2ème édition MEDSI / MC / GRAW-HILL, Paris,
1989 :3-40
33. ROUGER (P.)
Cours d'Immuno hématologie
Formation continue : UV6, INTS, Paris, 1986 : 9
-50
34. ROUGER (P.)
Immuno hématologie érythrocytaire
approfondie : les applications
Formation continue : UV5, INTS, Paris,
1990 :15-53
35. ROUGER (P.)
La Transfusion Sanguine
Deuxième édition : collection Que sais-je.
Paris, 2001 : 3-65
36. ROUGER (P.)
Les bases de la Transfusion Sanguine
INTS, Paris, 1989; 1-5
37. ROUGER (P.)
Les groupes Sanguins : Définition et approche
multidisciplinaire
Formation continue UV5, INTS, Paris, 1986 : 32-80
38. ROUGER (P.)
Sécurité immunologique des transfusions
d'érythrocytes.
Gaz transfus 1993; 92:9-10
39. SALMON (C.)
L'immunisation par transfusion.
Transfusion 1960; 3 :162-73
40. SCHNIDT
The mortality from incompatible transfusion
Prog Clin Biol Res 1980;43: 251-61.
41. SECLONDE (H.)
Cours d'Immuno-hématologie
Chapitre : Le système ABO et ses
associés
UAC/EPAC/ABM 2003-2004
42. SEROUSSI (H.)
Diagnostic biologique d'une Immunisation foeto-maternelle
GINE Web.
43. SMITH ( F.)
Application du Micro-Typing System ou Micro-Groupage à
la surveillance immunologique des enfants polytransfusés. (A propos de
132 tests effectués au CNHU de Cotonou).
Mémoire de fin de cycle, CPU, 1991.
44. SNTS
Guide pratique de transfusion sanguine
APEFE édition 2004
45. SOSSA (D.)
Les épreuves de compatibilité pré
transfusionnelle au laboratoire.
Monographie de fin de cycle, ETLAM, 1995
46. TISSIER (A.M.), Le PENNEC (P.Y), HERGON (E.),
ROUGER (P.).
Les accidents immuno hématologiques transfusionnels
IV. Analyse, risques et prévention.
Tranfus Clin Biol
1996 ;3 :167-80
47. YABI (N.L.O.)
Contribution à l'étude de l'allo immunisation
transfusionnelle anti érythrocytaire en République Populaire du
Bénin.
Mémoire de fin de cycle, CPU, 1987-1988
48. YARA (J.) BAYILI (G.)
Contribution à l'étude de l'allo immunisation
transfusionnelle et foeto-maternelle anti-érythrocytaire :
intérêt du Micro Typing System dans la RAI au CNHU.
Mémoire de fin de cycle, CPU, 1991
49. Allo immunisation transfusionnelle
[
http://www.uvp.univparis5.fr/uv-MED/AC/FaqsAff.asp?FaqsC]
(Consulté le 13/12/05 à 17H05)
50. Immunisation foeto-maternelle
[file://F:/F-A-Q%2-0(IFM).htm]
(Consulté le24/11/05 à 14H50)
51. Réaction Ag-Ac ; structure
des Ig
[
http://www.vet-lym.fr/ens/immuno/ENV-immuno-S5/immun03.htm]
(Consulté le 20/01/06 à 13 H 05)
| 


