|

ROYAUME DU MAROC
ÉÜ?ÈÑÛãáÇ
ÉÜßáããáÇ
??? ?????????
É?æÈÇÛáÇ
É?äØæáÇ
ÉÓÑÏãáÇ
ÉCOLE NATIONALE FORESTIÈRE
D'INGÉNIEURS DE SALE

Effets des incendies de forêts sur la
séquestration du
carbone et la minéralisation de l'azote, et
la typologie des
sols dans les écosystèmes forestiers du Rif
centro -
occidental
MEMOIRE DE 3ème
CYCLE
Présenté par: ORLANDO Collins
Ashianga
POUR L'OBTENTION DU DIPLÔME
D'INGÉNIEUR
DES EAUX ET FORÊTS
OPTION: Écologie et Gestion des
Ressources Naturelles
Soutenu publiquement le 14 juillet 2015 à 14h 00
devant le jury:
MM:
Pr. QARRO M. (ENFI Salé) Président
Pr. BENJELLOUN H. (ENFI Salé) Rapporteur
Pr. SABIR M. (ENFI Salé) Co-rapporteur
Pr. ZAHER H. (ENFI Salé) Co-rapporteuse
Dr. TALLAL M. (CNRF Rabat) Examinateur
Dr. ZOUAHRI A. (INRA Rabat) Examinateur
E.N.F.I. BP: 511, Bd. Moulay Youssef, Tabriquet,
Salé, Maroc - Tél. : 05 37 86 11 49, Fax: 05 37 86 26 07

DEDICATION
To my parents Mr. k Mrs. Enos and Salome Orlando, and to
my
siblings Barnes, Edgar and Martin.
This humble work is a sign of my
love for you as well as an appreciation for
your support throughout my
studies.
Call it a clan, call it a network, call it a tribe, call
it a family. Whatever you call it, whoever you are, you need one.
- Jane Howard (1935-1996) US journalist, writer
ii
REMERCIEMENTS
Je remercie Dieu de m'avoir donné la force et le
courage de m'accrocher, et je sais que si ce document s'est achevé car
c'est sa volonté, la gloire revient à Dieu seul.
Il m'est aussi très agréable d'exprimer ma
reconnaissance et mes vifs remerciements les plus cordiaux à toutes les
personnes qui ont contribué, de près ou de loin, à sa
réalisation.
Le présent mémoire qu'est le fruit d'un
encadrement de proximité, durant toutes ses phases de
réalisation, est un témoignage sur l'intérêt
particulier qui lui a été réservé par le Pr.
BENJELLOUN H., enseignant chercheur à l'ENFI. Ainsi, je saisis cette
opportunité pour lui exprimer ma grande estime et mes profondes
reconnaissances pour avoir voulu encadrer ce travail. Son suivi et ses conseils
très pertinents m'ont été d'une grande importance et m'ont
permis l'aboutissement de ce mémoire dans une forme très
appréciée par la commission de son évaluation.
Le Pr. SABIR M., enseignant chercheur à l'ENFI et la
Pr. ZAHER H., enseignante chercheur à l'ENFI, qui ont bien
co-encadré ce travail, surtout par leur guide et leur soutien lors des
travaux du terrain. Je leur exprime mes sincères remerciements et ma
très grande gratitude de m'avoir soutenu et de m'aider pour la
réalisation de mon mémoire.
Je remercie très vivement le Pr. QARRO M., enseignant
chercheur à l'ENFI, pour l'honneur qu'il m'a fait en acceptant de
présider le jury qui a évalué ce travail.
J'adresse aussi mes sincères remerciements au Dr.
TALLAL M., chercheur au CNRF - Rabat et au Dr. ZOUAHRI A., maitre de recherche
à l'INRA - Rabat qui m'ont fait l'immense honneur d'évaluer ce
travail.
Mes sincères gratitudes sont aussi adressées
à l'équipe de la DPEFLCD Chefchaouen pour leur soutien lors des
travaux du terrain, plus particulièrement Mr. EDOIYER Abdelazid, le
directeur des eaux et forêts, et de lutte contre la
désertification de la province de Chefchaouen et Mr. SEBBAH Mehdi, le
chef de CCDRF de Chefchaouen.
Je tiens de même, à remercier sincèrement
Mr. MOURAD, technicien à l'ENFI, pour son soutien au laboratoire tout au
long de la période du travail.
Finalement, je tiens de même, à remercier
sincèrement les personnes qui durant mon séjour à l'ENFI,
m'ont soutenu et encouragé. Mes camarades de la 44ème
promotion, particulièrement LBAHY et HAFID durant les travaux de terrain
et de laboratoire, et tous les autres que je ne pourrai indexer, pour les bons
moments passés ensemble ; tous les camarades des 42, 43, 45 et
46ème promotions.
iii
Résumé
Les écosystèmes forestiers du Rif, au nord du
Maroc, sont parmi les plus riches en termes de diversité
écologique mais aussi parmi les plus dégradés. Ceci a
été attribué à la forte anthropisation, conduisant
à l'augmentation des épisodes des incendies de forêts et
d'autres pratiques conduisant à la dégradation des sols, surtout
pour la cannabiculture.
Dans la présente étude, quatre sites
incendiés entre les années 2012 et 2014, dans la région du
Rif centro-occidental ont été échantillonnés afin
d'évaluer l'effet des incendies de forêts sur le stockage de
carbone et la minéralisation de l'azote, tout en étudiant les
types des sols. L'étude du processus de stockage de carbone était
faite en déterminant les stocks de carbone contenus dans les
échantillons prélevés tandis que celle du processus de
minéralisation de l'azote était faite par la détermination
des quantités d'azote minéralisées après 4 et 21
semaines, respectivement par voie d'incubation anaérobie et
aérobie. Ainsi, la comparaison de données des sites
incendiés à celles des sites non incendiés
(témoins) était faite afin de révéler l'effet du
feu sur lesdits processus.
Les résultats relatifs à la classification des
sols ont montré que les sites d'Akumssen, de Bab Taza et de Béni
Salah appartenaient à la classe des sols à sesquioxyde de fer,
tandis que le site de Talassemtane appartenait à la classe des sols peu
évolués.
Excepté pour le site de Talassemtane ayant
présenté une augmentation de 70% (+12 t/ha) en stocks de carbone,
des pertes allant de 12% (-8 t/ha) à 37% (-18 t/ha) ont
été enregistrées respectivement à Akumssen et
à Bab Taza. Toutefois, ces changements n'étaient pas
significatifs, ce qui était liée à l'intensité
faible à modérée des feux.
Les résultats de l'incubation du sol ont montré
que le feu a provoqué une augmentation hautement significative des taux
de minéralisation de l'azote dans le sol. Dans des conditions
d'anaérobiose, les valeurs de N minéralisé sous les sites
brûlés et à la fin de la période d'incubation
(semaine 4), variaient de 37 mg/kg (Beni Salah) à 118 mg/kg (Akumssen),
qui étaient deux fois les quantités minéralisées
sous les sites témoins correspondants. En ce qui concerne l'incubation
aérobie, les valeurs d'azote potentiellement minéralisable (N0)
et de constante de vitesse de minéralisation (K) sous les sites
incendiés étaient aussi supérieures par rapport aux sites
témoins, N0 étant comprises entre 53 mg/kg (Beni Salah) et 113
mg/kg (Akumssen), tandis que les valeurs K se situaient entre 0,196 à
0,248 semaines-1 sous les mêmes sites.
Quoi qu'il en soit, le feu, en grande partie, n'a pas eu
d'effets importants sur la plupart des propriétés et de processus
étudiés, ce qui pourrait avoir été liée
à son intensité, en grande partie, faible et sa durée
assez courte, ce qui est commun dans les dits scenarios.
Mots clés : Rif, dégradation,
incendies de forêts, classification des sols, stocks de carbone,
minéralisation de l'azote.
iv
Abstract
Forest ecosystems of the Rif region, north of Morocco are some
of the richest in terms of ecological diversity. However, accounts of the
degradation of these ecosystems are well-documented. This is mainly attributed
to the increased anthropization of the region, leading to increased episodes of
wildfires as well as other soil degrading practices such as clearing of
forests, especially for cannabis culture.
In this study, four sites burnt between 2012 and 2014 in the
mid-western Rif region, were sampled to assess the effects of wildfires on
carbon sequestration and nitrogen mineralization, while at the same time
studying soil classes. To study soil carbon storage, carbon stocks present in
soil samples were approximated, while nitrogen mineralization was evaluated
through the determination while nitrogen mineralized under both anaerobic (4
weeks) and aerobic (21 weeks) conditions in the laboratory. For the evaluation
of the effects of fire on the two processes, comparisons were made between data
from burned and unburned (control) sites.
Findings related to soil classification showed that Akumssen,
Bab Taza and Beni Salah sites belonged to the iron sesquioxide (fersiallitic)
class, while the Talassemtane site fell under weakly evolved soils.
Soil carbon stocks changes were insignificant, statistically
speaking, but mostly decreased after fire, with only the Talassemtane site
presenting an increase of 70% (+12 t/ha). As for the losses, they ranged
between 12% (-8 t/ha) and 37% (-18 t/ha) under Akumssen and Bab Taza sites
respectively.
Soil incubation under both anaerobic and aerobic conditions
showed that fires led to a highly significant increase in nitrogen
mineralization rates. Under anaerobic conditions, values of nitrogen
(N-NH4+) mineralized under burnt sites, at the end of the incubation
period, ranged from 37 mg/kg (Beni Salah) to 113 mg/kg (Akumssen), which were
double the quantities mineralized under their respective control sites. As for
the incubation under aerobic conditions, potentially mineralizable nitrogen
(N0) and the rate constant of mineralization (K) increased after fires, under
all sites, with N0 values ranging from 53 mg/kg (Beni Salah) to 113 mg/kg
(Akumssen), while K values ranged between 0.196 to 0.248 weeks-1,
under the same sites. These were all higher than values registered under
unburned sites, where N0 values ranged between 24 mg/kg (Bab Taza) and 54 mg/kg
(Akumssen) whereas K values ranged between 0.130 and 0.208 weeks-1
under the same sites.
For the most part, fire didn't lead to significant changes in
the soil properties and processes studied. This could have been related to
their intensities, which were largely weak, as well as their short duration, a
common observation under such scenarios.
Keywords: Rif, degrading, wildfires, soil
classification, carbon stocks, nitrogen mineralization.
v
????
ÉæÑËáÇ
äÇÑ?Û ,
íÌæáæß??Ç ?????? ??? ?? ????
ÈÑÛãáÇ áÇãÔ
?ÑáÇ ?????? É?Æ?ÈáÇ
É?æÈÇÛáÇ
ãÙäáÇ ????? ããáÇ
ÏÏÚáÇ Çã ???
ÈÇÈÓ?Ç ?? ?????? ìáÇ
ÚÌÇÑ ßáÏæ
ÇÑãÊÓã
ÇÑæÏÊ ÑÚÊ
ÉÞØäãáÇ åÐÈ
É?æÈÇÛáÇ
ÈÇÓÍ ??? íÏäáÇ
ÈäÞáÇ ?? ÇÑÒ
ÉÑÇÙ ÚÇÊÑÇ ????
ìáÇ ?????
ÉÞØäãáÇ ??????
íÊáÇ
É?æÈÇÛáÇ
ÞÆÇÑÍáá .
íæÈÇÛáÇ
ÁÇØÛáÇ
ÊæÒ?Ç
äÏÚãÊæ
äæÈÑÇßáÇ ????? ?????? ???
É?æÈÇÛáÇ
ÞÆÇÑÍáÇ ?????
ìÏã ????? ìáÇ
ÉÓÇÑÏáÇ åÏ
ÏÊ ÑÚ äÇæ ???
íÊáÇæ äæÇÔÔ
?????? ÉÈÑÊáÇ ??
ÊÇä?Ú ÏÑÌÈ
ãÇ?ÞáÇ ?? ßáÏ
áÌÇ ?? \ ÉÈÑÊáÇ
ìæ??? ??? ÉÈÑÊáÇ
ÚÇæä ??? ÊÞæáÇ ??? ??
ÑÚÊáÇ ?? 2014-2012
???? ??? ?? ÞÆÇÑÍ
íÊÇÈäáÇ ??????
.ÉÓæÑÏãáÇ
ÖÑÚÊ íÊáÇ
ÉÈÑÊáÇ
ìæÊÓã ???
ÉÏÌÇæÊãáÇ
äæÈÑÇßáÇ
ÊÇ?ãß ????? ??
äæÈÑÇßáÇ
äæÒÎã ????
ÉÓÇÑÏá ??? ???? \
(ÉÏÇÔ ÊÇÈÑÊ) ?????
íÊÇÈäáÇ ?????? ÑÚ?
?? ìÑÎÈ
ÇÊäÑÇÞ? ?? ??????
íÊÇÈäáÇ ??????
ÉÈÑÌÊæ
Ú?ÈÇÓ
4ÉÏãá
É?ÆÇæ? ????? ????? \
ÑÈÊÎãáÇ
áÎÇÏ ???????? ãÇ?ÞáÇ
?? ??? ÊæÒ?Ç äÏÚãÊ
ÉÓÇÑÏ .ÚæÈÓ
21ÉÏãá
É?ÆÇæ ?????
äæÈÑÇßáÇ
ìæÊÓã ???
ÇÚÌÇÑÊ ????
ÇÊÓÇÑÏ ??? ÚÈÑ
áÕ ?? ÊÇÈÑÊ Ë?Ë
äÇ ??? ÌÆÇÊäáÇ
ÊÑÙ
37 % ìáÇ 1
2% ?? ÍæÇ??? ???? ßáÏæ
????? íÊÇÈäáÇ
ÁÇØÛáÇ
ÞÇÑÊÍÇ ????
äÒÎãáÇ
. -18 t/ha ìáÇ -8
?? ÑÏÞ? ??? í
ÉÈÑÊáÇ
ìæÊÓã ???
ÉÑæÊãáÇ
íäÏÚãáÇ
ÊæÒ?Ç ÊÇ?ãß ???
íÊÇÈäáÇ
ÁÇØÛáÇ
ÞÇÑÊÍÇ ?????
ÉÓÇÑÏ ??? ???? ?????? ÑÚ
íÊáÇ
ÊÇÈÑÊáÇ
ìæÊÓã ???
íäÏÚãáÇ
ÊæÒ?Ç ?? ÑÈßÇ
ÊÇ?ãß ÏæÌæ
ÌÆÇÊäáÇ ÊÑÙ
??? ÊÍæÇÑÊ
É?ÆÇæ?áÇ
ÉäÇÖÍáÇ ?????
áÇãßÊÓÇ ????
ÉÏÇÔ ìÑÎ
ÊÇÈÑÊ ??
ÉäÑÇÞãáÇÈ ?????
íÊÇÈäáÇ mg/kg 118
ìáÇ mg/kg 37 ??
ÊæÒ?Ç ÊÇ?ãß
áÕæÊáÇ ?? ?? ???
íáÇæÍ
ÊÇ?ãßáÇ åÏ ???? ??????? \
????? íÊÇÈäáÇ ??????
ÑÚ íÊáÇ
ÊÇÈÑÊá ???????
. ÉÏÇÔáÇ
ÊÇÈÑÊáÇ
ìæÊÓã ??? ?áÇ
äÏÚãÊá ?????
áÈÇÞáÇ ÊæÒ?Ç
??? äÇ ??? ÉÙÍ?ãáÇ ???
ÉÈÑÊáÇ
ÊÇä?Úá
É?ÆÇæáÇ
ÉäÇÖÍáÇ ?????
ÊÏßÇ
0,196 ìáÇ 0,248
Ú?ÈÇÓ -1
ÊÍæÇÑÊ
ÊæÒ?Ç äÏÚãÊÈ
ÉÕÇÎáÇ
ÉÚÑÓáÇ ÇãÇ
3gk/gm 11?áÇ 53
mg/kg
ÚÞÇæãáÇ
åÏ ?????? íÊáÇ
ÞÆÇÑÍáÇ äÇ ???
áæÞáÇ ???? ???
ãÇ?ÞáÇ ?? íÊáÇ
???ÇÕÍ?Ç
ÉÓÇÑÏáÇ á?Î ??
ßáÏæ
ÉÈÑÊáÇ
ìæÊÓã ???
íäÏÚãáÇ
ÊæÒ?Çæ
äæÈÑÇßáÇ ???? ???
Ñ?ÈßÑËÇ ??? ??? ??
ÉÓæÑÏãáÇ
É?æÈÇÛáÇ
.ÞÆÇÑÍáÇ
ÉÏÔ ????
.ÊæÒ?Ç
äÏÚãÊ ,
äæÈÑÇßáÇ
äæÒÎã ,
ÉÈÑÊáÇ ÚÇæä ,
É?æÈÇÛáÇ
ÞÆÇÑÍáÇ ,
ÑæÏÊáÇ , ?ÑáÇ
: 4.+o c:,1..015
vi
DEDICATION i
REMERCIEMENTS ii
Résumé iii
Abstract iv
???? v
TABLE DES MATIÈRES vi
Liste des figures
TABLE DES MATIÈRES
ix
Liste des tableaux x
Liste des sigles et acronymes xi
INTRODUCTION GÉNÉRALE 1
PREMIERE PARTIE : REVUE BIBLIOGRAPHIQUE 4
Chapitre 1. Carbone dans les écosystèmes
forestiers 4
1.1. Cycle globale du carbone 4
1.2. Séquestration du carbone dans les
écosystèmes forestiers (accent sur le sol) 5
1.2.1. Définition de séquestration du carbone 5
1.2.2. Formes de carbone dans le sol 6
1.2.3. Processus de séquestration de carbone dans les
écosystèmes forestiers 7
1.2.4. Stocks et flux de carbone dans le sol forestier 7
1.2.5. Facteurs influençant la séquestration de
carbone dans le sol 7
1.2.6. Importance de séquestration du carbone 8
1.3. Aperçu sur la détermination de carbone
organique total dans le sol 9
Chapitre 2. Azote dans les écosystèmes
forestiers 11
2.1. Azote dans le sol 11
2.1.1. Formes d'azote dans le sol 11
2.1.2. Transformations d'azote dans le sol 12
2.2. Minéralisation de l'azote dans le sol 14
2.2.1. Mécanisme de minéralisation d'azote 14
2.2.2. Minéralisation brute et nette d'azote 15
2.2.3. Variation de minéralisation dans le profil du sol
15
2.2.4. Facteurs influençant la minéralisation
d'azote 16
2.3. Aperçu sur l'évaluation de
minéralisation d'azote dans le sol 18
Chapitre 3. Rôle des incendies de forêts dans
les écosystèmes forestiers 19
3.1. Généralités sur les incendies de
forêts 19
3.1.1. Définition d'incendie de forêts 19
3.1.2. Causes d'incendie de forêts 20
vii
3.2. Conséquences des incendies sur les
écosystèmes forestiers (accent sur le sol) 20
3.2.1. Sur les végétaux 20
3.2.2. Sur le sol 21
3.3. Situation marocaine à l'égard des incendies de
forêts 29
DEUXIÈME PARTIE : MATÉRIELS ET
MÉTHODES 30
1. PRÉSENTATION DE LA ZONE D'ÉTUDE
30
1.1. Description de la zone d'étude 30
1.1.1. Situation géographique 30
1.1.2. Situation administrative et forestière 30
1.1.3. Situation géologique et géomorphologique
32
1.1.4. Situation pédologique 33
1.1.5. Climat 33
1.1.6. Végétation 38
1.2. Présentation des sites échantillonnés
39
2. MÉTHODOLOGIE 42
2.1. Matériels 42
? Sur le terrain 42
? Au laboratoire 42
2.2. Méthodes 42
? Sur le terrain 42
? Au laboratoire (ENFI et INRA - Rabat) 43
2.2.1. Préparation des échantillons 43
2.2.2. Méthodes d'analyses des propriétés
physiques du sol 43
2.2.3. Méthodes d'analyses des propriétés
chimiques du sol 45
2.2.4. Méthodes d'évaluation de
minéralisation d'azote dans le sol 50
2.2.5. Analyses statistiques 52
TROISIÈME PARTIE : RÉSULTATS ET DISCUSSIONS
53
1. Étude pédologique des sols pour les
différents sites échantillonnés 53
1.1. Description des caractéristiques morphologiques et
chimiques 53
1.1.1. Caractéristiques morphologiques et physiques 53
1.1.2. Caractéristiques chimiques 53
1.2. Classification des sols 55
2. Effet des incendies sur les propriétés
physicochimiques du sol 56
2.1. Propriétés physiques du sol 56
2.1.1. Granulométrie et texture 56
2.1.2. Densité apparente 57
viii
2.2. Propriétés chimiques du sol 58
2.2.1. pH 61
2.2.2. Azote total 62
2.2.3. Carbone total et matière organique 64
2.2.4. Rapport C : N 64
2.2.5. Phosphore assimilable 64
2.2.6. Calcaire total (CaCO3) 65
2.2.7. Capacité d'échange cationique (CEC) 65
2.2.8. Bases échangeables (S) et le rapport S/T 66
3. Effets des incendies sur la séquestration du
carbone dans le sol 67
4. Effets des incendies sur la minéralisation de
l'azote dans le sol 70
4.1. Incubation anaérobie 70
4.2. Incubation aérobie 76
4.3. Cinétique de minéralisation de l'azote 79
CONCLUSION GÉNÉRALE 84
RÉFÉRENCES BIBLIOGRAPHIQUES ET
WEBOGRAPHIQUES 88
REFERENCES BIBLIOGRAPHIQUES 88
REFERENCES WEBOGRAPHIQUES 96
ANNEXES 97
ANNEXE 1 : DIAGRAMMES OMBROTHERMIQUES DE BAGNOULS ET
GAUSSEN 98
ANNEXE 2 : TABLEAUX STATISTIQUES 100
ANNEXE 3 : DESCRIPTION DES PROFILS PÉDOLOGIQUES
104
ANNEXE 4 : DONNÉES EXPÉRIMENTALES DE
L'INCUBATION AÉROBIE 110
ANNEXE 5 : PHOTOGRAPHES DES SITES D'ETUDES
111
ix
Liste des figures
Figure 1 : Le cycle global du C. Les flux
documentés par IPCC sont approximatifs pour
la période 2000 à 2005 (Source : USGS, 2008).
6
Figure 2: La représentation schématique de
la minéralisation de N selon Stanford et Smith (1972) où Not = N
total; No = N potentiellement minéralisable; Nm = N
minéralisé mesuré; et k = constante de
minéralisation de N. 19
Figure 3 : La situation géographique de
la zone d'étude 31
Figure 4 : Les cartes des communes de Bab Taza
et de Bab Berred présentant les sites
échantillonnés 41
Figure 5 : Le triangle de texture (Source :
Web6) 45
Figure 6: Profil de distribution de C total et
de N total dans le sol 54
Figure 7 : L'évolution de N total dans le
sol suite aux incendies de forêts 63
Figure 8 : L'évolution des stocks de C
dans le sol suite aux incendies de forêts 69
Figure 9 : La comparaison de entre les
quantités de N-NH4+ libérées sous les sites
incendiés et sous les sites non incendiés (témoins) durant
les quatre semaines
d'incubation. 73
Figures 10 :
L'évolution de la minéralisation d'azote durant 21 d'incubation
aérobie pour
les différents sites (10a :
incendiés, 10b : témoins) 77
Figures
11 : Les modèles exponentiels ajustés aux
résultats de Nmin mesurés pour les
différents sites (11a: incendiés,
11b: témoins) 81
x
Liste des tableaux
Tableau 1 : Les seuils de température
pour les caractéristiques physiques du sol (Source :
USDA Forest Service, 2005) 22
Tableau 2 : Les
moyennes pluviométriques mensuelles (en mm) des stations
étudiées.
34
Tableau 3 : Le régime
pluviométrique saisonnier de stations étudiées. 35
Tableau 4: Les moyennes de température
mensuelles (en °C) des stations étudiées. 36
Tableau 5: Les moyennes de température
minimales et maximales, et d'amplitude
thermique (en °C) des stations étudiées 37
Tableau 6: Les bioclimats et variantes des
stations étudiées 38
Tableau 7: Les données
générales sur les sites échantillonnés
(coordonnées entre
parenthèses correspondent aux sites témoins) 40
Tableau 8 : Les caractéristiques
physiques des sols 56
Tableau 9 : Les propriétés
chimiques du sol 59
Tableau 10 : L'évolution des stocks de C
organique total dans le sol des sites étudiés 67
Tableau 11 : Les résultats
(minéralisation nette de N-NTT4 +) de l'incubation anaérobie
après les 1ère, 2ème,
3ème et 4ème semaines.
72
Tableau 12 : Les paramètres de la
cinétique de minéralisation de l'azote (N0, k, et t1/2)
pour les différents sites d'étude 80
xi
Liste des sigles et acronymes
° C : Degré Celsius
C : Carbone
CCDRF : Centre de Conservation et de Développement des
Ressources Forestières
CIS : Carbone inorganique du sol
CO2 : Dioxyde de carbone
COS : Carbone organique du sol
DPEFLCD : Direction Provinciale des Eaux et Forêts et
à la Lutte Contre la Désertification
FAO : Food and Agricultural Organization
g : Gramme
GtC : Gigatonne de carbone
H : Humide
HCEFLCD : Haut-Commissariat aux Eaux et Forêts et à
la Lutte Contre la Désertification
IPCC : Intergovernmental Panel on Climate Change
K : Kelvin
mg/kg : Milligramme per kilogramme
MO : Matière organique
N : Azote
PH : Perhumide
SA : Semi-aride
USDA : United States Department of Agriculture
USGS : United States Geological Survey
APM : Azote potentiellement minéralisable
1
INTRODUCTION GÉNÉRALE
Les incendies de forêts représentent des facteurs
de perturbation majeurs pour les différentes composantes des
écosystèmes terrestres y compris le sol. Les diverses
évolutions survenant sur les propriétés du sol
après le passage des incendies peuvent avoir des implications
importantes sur plusieurs processus critiques tels que les cycles hydrologiques
et biogéochimiques, et par conséquent la dynamique à long
terme des écosystèmes forestiers (DeBano et al., 1998 ;
Neary et al., 1999 ; Certini, 2005). L'on distingue deux
catégories de base pour les feux de forêts : les feux
contrôlés et les incendies proprement dits. Les feux
contrôlés constituent des pratiques courantes d'aménagement
effectuées souvent pour réduire les niveaux de combustibles afin
d'éviter le déclenchement des incendies de forêts. Quant
aux incendies, ils sont des feux non maitrisés en forêts qui sont
dus à l'origine soit naturelle soit anthropique, et qui se distinguent
généralement des feux contrôlés par leurs
températures très élevées de combustion (DeBano
et al., 1998).
Les feux de forêts résultent, à tout le
moins, à une redistribution majeure de nutriments parmi les
différentes composantes des écosystèmes et dans le cas de
certains éléments, des pertes et/ou transferts importants des
sites incendiés peuvent avoir lieu lors de (ou après) la
combustion (Grier, 1975; DeBano et al., 1979; Chandler et al.,
1983; entre autres). Leur rôle dans la dégradation des
écosystèmes forestiers est bien attesté et se
caractérise par la destruction de la végétation conduisant
de plus en plus aux pertes des sols et d'éléments nutritifs par
lessivage et érosion (Chandler et al., 1983). Les effets des
feux sur les propriétés (chimiques, physiques, biologiques) des
sols forestiers varient selon de nombreux facteurs tels que l'intensité
et la durée de l'incendie, le type de sol, l'humidité du sol au
moment de l'incendie, et la durée et l'intensité des
événements après le feu comme les
précipitations.
Une attention particulière a été
accordée aux pools de N ainsi que sa dynamique à l'égard
des feux car le N limite souvent la productivité primaire dans les
écosystèmes naturels. Grâce à sa basse
température de volatilisation (~200 °C), le N est perdu facilement
dans l'atmosphère même dans les cas des feux peu fréquents
et d'intensité faible à modérée. Cela peut avoir
des répercussions importantes sur les pools de N à long terme
dans les écosystèmes forestiers. Un phénomène
souvent remarqué, après un incendie, est l'augmentation de N
inorganique dans les sols (DeBano et al., 1979; Covington et Sacket
1992; Koyama et al., 2010; Caon et al., 2014). La
libération de NH4+
2
ainsi que la création des conditions favorables dans le
sol, conduisant à l'accélération du processus de
nitrification, peuvent conduire à la libération et donc la
disponibilité des NO3- pour les plantes. Cependant, ce
phénomène peut avoir des implications négatives sur les
écosystèmes car le surplus de NO3- peut se perdre
facilement par lessivage ou érosion du sol qui est accentuée
suite aux incendies. Aussi, la minéralisation
accélérée n'a pas toujours lieu puisque les incendies qui
se déclenchent fréquemment sur les mêmes sites ont tendance
à éliminer des quantités importantes de MO, et donc la
source de N. Ainsi, le sol devient stérile, un scenario pouvant influer
grandement sur la productivité des écosystèmes
forestiers.
À côté de N, l'incendie a un impact sur
les stocks de C dans les écosystèmes forestiers. En effet, tout
feu modifie la quantité et la répartition des pools de C dans le
sol forestier (Wells et al., 1979). Ce sont des pools comprenant
environ 70 % de stock global de C dans le sol, soit encore 2 - 3 fois le
stockage de C par la biomasse forestière (IPCC, 2001). Ainsi,
l'étude de l'évolution de la réserve de C dans le sol
forestier, y compris les changements dus à des perturbations
liées aux feux, revêt une importance particulière pour
mieux comprendre le bilan de C dans les écosystèmes
forestiers.
Dans le bassin méditerranéen les incendies, qui
sont considérés comme étant les facteurs principaux de
perturbation des écosystèmes forestiers (Trabaud, 1984; Naveh,
1990, Meddour et al., 2009), sont généralement
liés aux facteurs du climat et de la végétation. En effet,
le climat méditerranéen, sauf aux dernières semaines
d'automne, en hiver et aux premières semaines de printemps, est
généralement chaud et sec, ce qui rend le sol et la
végétation secs (Naveh, 1990). Lorsque ceci est couplé
avec la végétation présentant des caractéristiques
d'adaptation à la sécheresse telles que la sclérophyllie
(chêne vert), la production des résines (pins), les conditions de
déclenchement des feux sont favorisées.
Au Maroc, et plus précisément dans la Province
de Chefchaouen, les constats ont été faits sur la forte
dégradation des écosystèmes par les activités
humaines (déforestation pour la cannabiculture, défrichement,
surpâturage etc.). À ces dernières s'ajoutent les feux de
forêts qui jouent un rôle aggravant de dégradation de ces
écosystèmes forestiers. Ceci accentue les processus
d'érosion du sol (un problème déjà troublant),
pouvant ainsi contribuer à la perte de sa fertilité dans cette
région. La revue de littérature a montré qu'il n'y a pas
eu assez d'études orientées dans ce sens d'où la
nécessité du présent travail.
Les effets des feux de forêts sur les diverses
propriétés du sol sont complexes et varient en fonction de
plusieurs facteurs y compris l'intensité, la durée et la
fréquence des
3
feux, les caractéristiques du site, l'instant
d'échantillonnage du sol. Il est donc difficile de prédire
l'évolution de ces propriétés après le (les)
passage (s) des feux. Ainsi, pour ce travail, les hypothèses
formulées, et donc à vérifier, sont que les stocks de C
sous les sites brûlés seront inférieurs à ceux des
sites témoins (non incendiés) et les concentrations de N
inorganique sous les sites incendiés seront supérieures,
impliquant ainsi des taux plus élevé de minéralisation de
N, à celles des sites témoins.
L'objectif principal de ce travail de recherche est
d'améliorer la connaissance sur l'effet des perturbations sur le
fonctionnement des cycles biogéochimiques au niveau du sol en tant
qu'éléments importants contribuant au maintien de la
fertilité du sol forestier. L'étude vise à
déterminer les impacts potentiels des incendies sur les
propriétés physiques et chimiques des sols dans les
écosystèmes forestiers de la région Marocaine du Rif
occidental. Il s'agit d'évaluer les effets du feu sur le stockage du C
et sur la dynamique de N en tant qu'éléments nutritifs
nécessaires pour le bon fonctionnement des écosystèmes
forestiers. En effet, ce travail vise à fournir les informations des
effets des incendies sur le sol forestier, pour faire face à ce
problème en faisant appel aux politiques plus efficaces de gestion des
incendies dans les forêts marocaines. Pour ce fait, quelques objectifs
spécifiques ont été fixés à savoir :
y' Déterminer les propriétés
physicochimiques des échantillons du sol provenant des divers sites
échantillonnés ;
y' Classifier les sols des différents sites
échantillonnés ;
y' Déterminer les stocks de C contenus dans les
échantillons du sol provenant des divers sites
échantillonnés ;
y' Déterminer le Nmin (par incubation anaérobie
et aérobie), paramètre (cas d'incubation aérobie) qui
servira à la modélisation de minéralisation d'azote pour
les échantillons du sol provenant des divers sites
échantillonnés ;
y' Déterminer et comparer les paramètres de la
cinétique de minéralisation de l'azote : azote potentiellement
minéralisable (N0), constante de vitesse de minéralisation (k) et
temps de demi-vie (t1/2) pour les échantillons du sol provenant des
divers sites échantillonnés.
4
PREMIERE PARTIE : REVUE BIBLIOGRAPHIQUE Chapitre
1. Carbone dans les écosystèmes forestiers
1.1. Cycle globale du carbone
Il y a cinq pools globaux de C dont le plus grand est le pool
océanique qui est estimé à 38000 GtC et qui augmente
à un taux de 2,3 GtC/an. Le pool géologique, comprenant les
combustibles fossiles, est estimé à 4130 GtC, dont 85 % est le
charbon, 5,5 % du pétrole et 3,3 % du gaz. Le troisième plus
grand est le pool pédologique qui est estimé à 2500 GtC
à 1 m de profondeur. Ce pool comporte deux volets distincts, le C
organique et le C inorganique dont les pools sont estimés respectivement
à 1550 GtC et à 950 GtC (Batjes, 1996). Le pool organique
comprend l'humus actif et le charbon qui est relativement inerte. Ainsi, il est
constitué d'un mélange de résidus de plantes et d'animaux
à divers stades de décomposition, des substances
synthétisées microbiologiques et/ou chimiques et des
microorganismes, des petits animaux et de leurs produits de
décomposition (Schnitzer, 1991). Le pool inorganique, quant à
lui, est constitué de C élémentaire et des minéraux
carbonatés (calcites, dolomites), et il est un constituant important du
sol des zones semi-arides et arides. Le quatrième plus grand pool est le
pool atmosphérique comprenant environ 800 GtC sous forme oxydée
gazeuse et qui augmente à un taux de 4,2 GtC/an alors que le plus petit
parmi les pools globaux est le pool biotique, qui est estimé à
620 GtC (560 GtC = biomasse vivante et 60 GtC = détritus). Les pools
pédologique et biotique constituent le pool de C terrestre qui est
estimé à environ 3120 GtC.
Les pools terrestres et atmosphériques interagissent
grâce aux processus de photosynthèse et de respiration où
le taux annuel de la photosynthèse est de 120 GtC et dont une grande
partie est restituée à l'atmosphère par les plantes et le
sol en respirant. La conversion des écosystèmes naturels et
d'autres pratiques telles que l'agriculture extractive basée sur un
faible apport externe ont tendance de dégrader le sol, ce qui aboutit
à la diminution des pools terrestres. Le pool pédologique perd
environ 1,1 GtC/an à l'atmosphère et environ 0,3 - 0,8 GtC/an
vers les océans comme conséquence de l'érosion et par le
transport induit par l'érosion vers les écosystèmes
aquatiques. Cependant, le puits terrestre augmente actuellement à un
taux net de 1,4 #177; 0,7 GtC/an. Ainsi, il absorbe environ 2 - 4 GtC/an, ce
qui peut augmenter jusqu'à 5 GtC/an en 2050 (Cramer et al.,
2001). Ceci peut être dû aux activités d'aménagement
des territoires et surtout les forêts
5
en faisant appel aux politiques de reboisement, de gestion des
terres et aussi par la fertilisation à base de CO2, Ainsi, les
interactions importantes entre les pools de C atmosphérique,
pédologique et biotique comprennent des composantes importantes du cycle
global du C. La compréhension et la gestion de ces interactions
constituent la base de toute stratégie visant à séquestrer
le C dans les pools biotique et pédologique.
1.2. Séquestration du carbone dans les
écosystèmes forestiers (accent sur le sol)
Les forêts jouent un rôle essentiel dans le cycle
global du C. Elles absorbent le C par la photosynthèse, le
piègent sous forme de biomasse, créant ainsi un stockage naturel
du C.
1.2.1. Définition de séquestration du
carbone
Le terme «séquestration du C» est
utilisé pour décrire à la fois des processus naturels et
délibérées (par l'action d'homme) par lequel le CO2 est
réduit dans l'atmosphère ou détourné des sources
d'émission et stockée soit dans l'océan soit dans les
milieux terrestres (végétation, les sols et des formations
géologiques). Avant le commencement des émissions du CO2 par
l'homme, les processus naturels qui composent le cycle global du C
(Figure 1) ont maintenu un quasi-équilibre entre
l'absorption du CO2 et sa libération dans l'atmosphère.
Cependant, les mécanismes d'absorption de CO2 existantes appelés
«puits» de C sont insuffisantes pour compenser
l'accélération des émissions liées aux
activités humaines (Sundquist, 2008).
La séquestration du C consiste donc au piégeage
et au stockage du dioxyde de C qui est un processus consistant à
séparer le CO2 de ses sources industrielles et
énergétiques, à le transporter dans un lieu de stockage et
à l'isoler de l'atmosphère sur le long terme. Son but est de
diminuer le flux net de CO2 dans l'atmosphère par séquestration
du C dans les océans, la végétation, les sols et les
formations rocheuses.
6
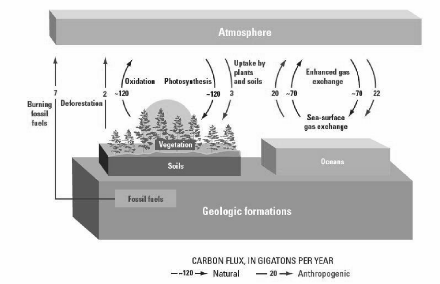
Figure 1 : Le cycle global du C. Les flux
documentés par IPCC sont approximatifs pour la période 2000
à 2005 (Source : USGS, 2008).
1.2.2. Formes de carbone dans le sol
Dans les sols et les sédiments, il existe trois formes
de base de C qui peuvent être présents à savoir le C
élémentaire, le C inorganique (minéral), et le C organique
(Schumacher, 2002). Le C élémentaire est constitué de la
suie, du graphite et du charbon, et ne fera pas partie de l'étude. C'est
le C minéral et le C organique qui constituent ce qu'on appelle le C
total. Les différentes formes de C dans le sol sont les suivantes :
V' Le C organique : Le C organique
total est le C stocké dans la MO du sol. Il provient de la
décomposition des résidus de plantes et d'animaux, des exsudats
racinaires, des microorganismes, et faune du sol.
V' Le C élémentaire :
Les formes de C élémentaire comprennent le charbon de
bois, la suie et le graphite. Les principales sources du C
élémentaire dans les sols sont les produits provenant de la
combustion incomplète de la matière organique, d'origines
géologiques, et de dispersion des formes de C dans l'exploitation
minière.
V' Le C minéral : Les formes
du C inorganique sont dérivées des sources géologiques ou
des roches mères à partir desquelles le sol était
formé.
7
1.2.3. Processus de séquestration de carbone dans les
écosystèmes forestiers
La séquestration du C implique le transfert de CO2
atmosphérique vers des pools stables, à long terme et de le
stocker en toute sécurité de sorte qu'il ne soit pas
immédiatement réémis. Ainsi, ce processus signifie
l'augmentation des stocks de C organique et de C inorganique dans les sols. La
séquestration du C dans les écosystèmes forestiers est un
processus complexe qui commence par la photosynthèse où les
plantes fixent le C jusqu'à son incorporation dans les sols.
1.2.4. Stocks et flux de carbone dans le sol forestier
Les analyses des études récentes
effectuées par Dixon et al. (1994) montrent que dans les
écosystèmes forestiers, la végétation et le sol
contribuent respectivement au stockage de 359 et 787 GtC d'où la
contribution au stockage de 1146 GtC au total. L'allocation du C entre la
végétation et les sols diffère par la latitude. Une grande
partie des stocks de C (végétation (25%) et sol (59%)) est
située dans les forêts des hautes latitudes.
Environ deux tiers de C dans la biosphère terrestre
sont stockés dans le sol, principalement comme la MO
décomposée. Son cycle se fait rapidement entre
l'atmosphère et le sol sous forme de CO2, Les sols, en fonction de la
façon dont ils sont gérés, représentent une
importante source ou puits de CO2 dans l'atmosphère. Il est à
craindre que les sols sont de plus en plus une source de CO2, que le climat se
réchauffe et que les résultats de changement d'utilisation des
terres conduisent à une augmentation de la perturbation du sol. Les sols
contiennent de grandes quantités de C dans les deux formes organiques et
inorganiques. Le C organique se trouve dans les sols sous forme de divers
composés organiques, appelés collectivement MO et sa
quantité dans cette MO varie de 40 à 60% en masse.
1.2.5. Facteurs influençant la
séquestration de carbone dans le sol
Divers facteurs affectent la quantité et la
concentration du C dans les sols forestiers. Les variations en quantité
des pools de C dans le sol est le résultat net des altérations
entre les intrants par rapport aux pertes. Ces facteurs se subdivisent en deux
grands groupes à savoir : les facteurs naturels et les activités
humaines.
? Facteurs climatiques
Il est généralement admis que les facteurs
climatiques, notamment les précipitations et la température, sont
les plus déterministes de contenu COS (Homann et
8
al., 1995; Alvarez et Lavado, 1998). Ils influent sur
le stockage de C dans le sol en raison de leurs effets sur la quantité
et la qualité des intrants du sol et sur les taux de
minéralisation de MO et ainsi que la décomposition de la
litière (Quideau et al., 2001; Heviaa et al.,
2003).
y' Activités humaines
Les perturbations d'origine anthropique exacerbent les
émissions de CO2 du sol par la respiration lors de la
décomposition de MO dans le sol (Schlesinger, 2000). À
l'échelle globale, les activités de défrichement pour des
fins agricoles résultent en diminution importante des stocks de C, ce
qui est accentué par certaines pratiques d'aménagement forestier.
En Australie, l'on estime que les niveaux de COS ont chuté de
près de 50% par rapport aux périodes préagricoles, la
grande partie de ce phénomène ayant lieu dans les 10 premiers
centimètres du sol. En plus de son impact sur la décomposition de
la MO, le macroclimat du sol a un impact important sur la fraction active du
pool de COS (Trumbore et al., 1996; Franzluebbers et al.,
2001). La capacité du sol pour le stockage de C est affectée
aussi par la conversion des écosystèmes naturels aux
écosystèmes agricoles qui augmente la température maximale
du sol, en diminuant en même temps la capacité de rétention
en eau du sol au niveau de la zone racinaire (Lal, 1996). Le
déclenchement des incendies de forêts par l'homme a des
implications sur le C du sol. Souvent l'on assiste à des pertes et la
libération de C sous forme gazeuse par oxydation ainsi que la
volatilisation de C. Cependant, ce phénomène n'est pas toujours
le cas, car lorsque le feu est d'intensité faible, il peut conduire aux
dépôts. Le charbon de bois, produit par la combustion
incomplète, est un composant passif pouvant constituer jusqu'à
35% du pool total de COS dans les écosystèmes vulnérables
aux incendies (Skjemstad et al., 2002).
Dans l'ensemble, toute activité favorisant
l'accumulation de la biomasse dans les écosystèmes forestiers
contribue à la séquestration du C dans le sol. Ainsi, elle doit
être considérée lors de la planification des projets de
gestion et d'aménagement en forêts.
1.2.6. Importance de séquestration du carbone
y' Qualité et fertilité du sol
Le stockage et le maintien de COS en teneurs importantes est
d'intérêt important puisque le COS joue un rôle essentiel
dans le fonctionnement des écosystèmes terrestres. Le COS
favorise l'agrégation, augmente la rétention d'eau et
l'approvisionnement en
9
éléments nutritifs donc le bilan de ces pools
est important pour le maintien de la fertilité des sols. La
quantité et la qualité de COS influent sur la productivité
potentielle du sol, et reflètent la distribution spatiale et la
succession des communautés végétales. Une
propriété du sol dépendant directement de la teneur du sol
en MO (C organique) est la capacité d'échange cationique qui est
fonction de l'augmentation de C organique dans le sol. La présence de MO
en importance favorise la biodisponibilité des autres
éléments nutritifs alors que les phénomènes
néfastes comme la toxicité du sol provenant des
éléments tels que l'aluminium sont inhibées par la
formation des chélates ou d'autres liaisons.
? Impacts sur l'environnement
Le sol peut également jouer le rôle de puits de
CO2 atmosphérique où l'augmentation de séquestration de C
dans les sols forestiers a le potentiel d'atténuer l'effet de serre.
Ainsi, la séquestration du C dans les sols est une stratégie
d'atténuation climatique basée sur l'hypothèse que le flux
de CO2 atmosphérique au sol peut être accrue tandis que sa
libération du sol vers l'atmosphère est atténué
(Leifeld et al., 2005). Cela suppose que certaines activités
peuvent transformer le sol d'une source de C en puits de C. Cette
transformation a le potentiel de réduire les concentrations
atmosphériques de dioxyde de C, ce qui ralentit le réchauffement
climatique et atténuation des changements climatiques. Toutefois, la
séquestration du C, en particulier dans les sols agricoles, a un
potentiel fini et est non permanente, la force de puits dans le sol diminuant
de plus en plus avec le temps. Cela se passe en même temps que le stock
de C dans les sols se rapproche d'un nouvel équilibre (Smith, 2004).
1.3. Aperçu sur la détermination de carbone
organique total dans le sol
Le contenu du sol en C organique total peut être
évalué soit directement en le mesurant soit indirectement en
soustrayant le C inorganique du C total qui sont déterminés au
préalable. Pour les sols ayant des quantités de C inorganique
négligeables, le contenu du C organique est approximativement
égal au C total (Schumacher, 2002). Cependant, dans les sols provenant
des roches mères calcaires ou dolomitiques, ou qui contiennent des
minéraux carbonatés, le C inorganique peut exister dans les
quantités appréciables et donc on doit le tenir en compte dans la
détermination du C organique total.
Il existe plusieurs approches disponibles pour la
détermination de C total (organique et inorganique) ou de C organique
dans les sols qui sont largement basées soit sur l'oxydation thermique
et/ou chimique du C organique dans les sols. L'oxydation
10
chimique ou par voie humide est suivie par la mesure du CO2
libéré (méthode de Snyder - Trofymow) ou la consommation
d'oxydant nécessaire pour oxyder quantitativement le C organique
(méthode de Walkley - Black). Dans les conditions acides, ces
méthodes comprendront la mesure du carbonate et donc seront utiles dans
la mesure du C total. Dans les procédés de combustion à
sec, les échantillons sont chauffés à des
températures élevées, dépassant
généralement 1000 °C en présence d'un excès
d'O2, Dans ces conditions, tout le C présent dans la fraction organique
et dans le carbonate est quantitativement converti en CO2 qui peut être
déterminée par gravimétrie, de façon
volumétrique, par titrimétrie, ou par spectrométrie.
Ainsi, le principe de base pour la quantification du C organique total
dépend de la dégradation de la MO dans les échantillons du
sol. Les méthodes qualitatives ont l'avantage du fait qu'il n'y a pas
besoin d'extraction de la matière organique, mais elles restent toujours
couteuses et fastidieuses (Rumpel et al., 2001 in Schumacher,
2002).
V' La méthode de combustion à
sec
La combustion est effectuée habituellement à des
températures élevées (> 1000 °C) et en
présence d'excès d'O2, ce qui assure que toutes les composantes
de C soient quantitativement converties en CO2, À des
températures inférieures, la combustion peut ne pas être
complète, ce qui entraîne la libération du CO ou la
décomposition incomplète des carbonates. La décomposition
des carbonates se fait à des températures élevées
(500 -1000 °C) pour produire le CO2 donc pour la mesure de C organique,
ils doivent être éliminés (par l'acide sulfureux) avant la
combustion ou une correction doit être faite à la fin des analyses
pour éliminer le contenu qui leur est dû.
V' Les méthodes redox de Heanes (1984)
et de Walkley - Black (1934)
Dans ces cas, la solution de dichromate en combinaison avec
l'acide sulfurique est utilisée pour oxyder le C organique en CO2, Si la
consommation d'oxydant est utilisé, l'analyse peut être
effectuée avec chauffage (méthode de Heanes), sinon la
méthode de Walkley-Black sans chauffage externe est utilisée. La
détermination de C se fait soit par titrage en utilisant un indicateur
ou une électrode de platine-calomel soit par colorimétrie. V'
La méthode de piégeage de C de Snyder et Trofymow
(1984)
L'échantillon du sol est oxydé par un
mélange acide sulfurique-dichromate et le CO2 libéré est
capté dans une solution de NaOH suivi par la détermination de C
par titrage à l'aide d'un indicateur ou d'un pH-mètre. Cette
approche est plus complexe que l'approche redox mais la plupart des
interférences rencontrées avec les méthodes redox
11
sont éliminées. Un autre avantage est que le CO2
piégé peut également être utilisé pour
déterminer la composition isotopique (Amato, 1983).
Chapitre 2. Azote dans les écosystèmes
forestiers
2.1. Azote dans le sol
2.1.1. Formes d'azote dans le sol
Le N dans les sols se trouve sous formes organique et
inorganique (minérale), les deux dernières constituant ce qu'on
appelle l'azote total.
V' L'azote organique
Dans les sols naturels, non perturbés, environ 95% de N
est présent sous forme organique reliée à la MO et qui
constitue une source importante de nutriments pour les plantes, après sa
minéralisation. Les organismes vivants contiennent des composés
riches en N, y compris des acides aminés, des acides nucléiques
et des protéines dans leurs tissus. Lorsque les déchets ou
cadavres de ces organismes sont déposés dans le sol, les produits
de leur dégradation forment la MO du sol et par conséquent une
source importante de N organique. En effet, N organique du sol provient de la
décomposition de la MO du sol, des débris végétaux
et animaux ou des amendements organiques (fumier, compost ou litière)
ajoutés au sol, qui sont également des sources importantes de N
organique.
V' L'azote inorganique (minéral)
Les formes inorganiques de N dans l'environnement comprennent
l'ammonium (NH+4), le nitrite (NO-2), le nitrate
(NO-3), l'oxyde nitreux (N2O), l'oxyde nitrique (NO),
et le N moléculaire (N2). Parmi ces formes seules les
NH+4 et NO- 3sont de grande importance du point de vue
fertilité des sols. Dans les sols, l'N minéral est
constitué de nitrates et d'ammonium, et représente moins de 2 %
de N total du sol. C'est cette forme qui est absorbable par les plantes et
provient de la décomposition de la MO (minéralisation de N
organique). Il est à signaler que il y'a des plantes
(légumineuses) qui, par le processus de fixation, arrivent à
capter et convertir le N atmosphérique (N2) en formes minérales
utilisables pour leur alimentation et l'alimentation des autres plantes
après leur mort (Postgate, 2008 in Web 4).
12
2.1.2. Transformations d'azote dans le sol
Bien que les sols ne contiennent qu'une fraction minuscule de
N lithosphérique, c'est ce petit réservoir qui est essentiel dans
le maintien de la vie à travers son approvisionnement pour les plantes
sous formes inorganiques ainsi que par sa mise à l'abri des
microorganismes qui participent aux processus complexes de transformation des
composés azotés. Ces processus peuvent être divisés
en trois catégories fonctionnelles à savoir : la conversion de N2
atmosphérique inactifs en formes organiques et le transfert
appelé fixation; la conversion de N des formes
organiques en formes inorganiques assimilables par les plantes, appelé
minéralisation (ammonification, nitrification); et le
retour de N du sol à l'atmosphère par
dénitrification. A ces derniers s'ajoutent
également d'autres processus contribuant aux pertes d'N des
écosystèmes à savoir : immobilisation,
lessivage et volatilisation.
? Fixation d'azote
La fixation de N constitue la transformation de N
atmosphérique (N2) inerte en N minéral (N-ammoniacal) qui est
intégré directement dans le métabolisme des plantes. Ce
processus est réalisé uniquement par des organismes procaryotes
vivant librement (dans le sol) ou en association avec certaines plantes
(Haynes, 1986). On estime que près d'un quart de N fixé
globalement est effectuée par la bactérie Rhizobium, en
association (fixation symbiotique) avec des légumineuses (par les
racines et les nodules racinaires) et que le reste est fixé par diverses
bactéries et des actinomycètes. La fixation biologique est
assurée par l'enzyme nitrogénase qui réalise la
réduction du N2 en N ammoniacal (Child, 1981). Le N fixé est
libéré dans le sol après la décomposition
microbienne et donc les facteurs affectant la minéralisation, affectent
également la quantité de N fixée et libérée
sous forme minérale.
? Minéralisation - Immobilisation
La minéralisation et l'immobilisation de N sont des
processus importants du cycle de N dans les écosystèmes
forestiers. La minéralisation consiste en la transformation de N
organique en N inorganique alors que l'immobilisation comprend la
transformation de N inorganique en N organique. Les deux processus se
déroulent simultanément dans le sol, avec des amplitudes
relatives déterminant ainsi si l'effet global est la
minéralisation (ou l'immobilisation) nette de N (Alexander, 1977 ;
Jansson et Persson, 1982). Le déroulement de ces deux processus dans le
sol dépend largement de qualité de la MO, plus
précisément sa teneur en N. Les microorganismes du sol
s'attaquent au détritus aussi bien comme source d'énergie que des
nutriments, et principalement le N, afin d'assembler
13
les protéines, acides nucléiques etc. Lorsque le
détritus est riche en N (rapport C : N faible), ces besoins sont
facilement atteints et il y a une libération de N. Dans ce cas, la
minéralisation de N a lieu. Dans le cas contraire où le
détritus est pauvre en N (rapport C : N élevé), les
microorganismes utilisent le N du sol et le rendent temporairement indisponible
pour plantes. L'immobilisation de N a lieu.
? Dénitrification
La dénitrification survient lorsque le N est perdu par
la conversion des nitrates vers les formes gazeuses d'N telles que le NO2, le
NO et le N2, C'est la seule voie par laquelle l'N dans les
écosystèmes terrestres et aquatiques est retransformé en N
gazeux (Galloway et al., 2004). Dans les écosystèmes
forestiers, l'élimination d'N par dénitrification peut impliquer
une diminution de la fertilité du site mais ceci est rarement
observé puisque ces pertes sont souvent compensées par les
entrées de N provenant de précipitations ou de fixation N2
non-symbiotique. Dans le sol, ce processus se produit lorsqu'il est
saturé et les bactéries (généralement
hétérotrophes) utilisent les nitrates comme source
d'oxygène. Dans les régions connaissant des dépôts
importants de N atmosphérique, l'augmentation du processus de lessivage
des nitrates a été observée (Dise et Wright, 1995). Cela
implique que les écosystèmes forestiers deviennent saturés
en N et ils se transforment de plus en plus en sources de N pour
l'hydrosphère et l'atmosphère. Ainsi, le processus de
dénitrification peut équilibrer certains apports de N, et donc
réduire en partie les effets de l'excès de N dans les
écosystèmes forestiers.
? Lessivage
La mobilité des deux principales formes de N
minérale dans les sols (NH+4 et NO3-)
diffère nettement. L'ammonium est moins susceptible d'être
lixivié que le nitrate en raison d'être tenu dans le sol par
l'échange cationique, par la fixation par les argiles, et par
l'immobilisation microbienne. En outre, l'ammonium, dans de nombreuses
conditions, est rapidement nitrifié en N. Contrairement à
l'ammonium, il y a moins de tendance pour les nitrates d'être
absorbés par les colloïdes du sol car ils possèdent souvent
une charge nette négative. Ils sont donc sensibles à la diffusion
et au transport dans l'eau du sol. La quantité de nitrates
lessivée des écosystèmes naturels augmente souvent suite
à des perturbations (Khanna, 1981). Cela pourrait être dû au
découplage des processus de minéralisation et de nitrification
ainsi que d'absorption de N par la végétation. L'absorption de N
peut donc jouer un rôle important dans l'atténuation des pertes
par lixiviation dans les écosystèmes. En effet, les travaux
réalisés par Vitousek et Reiners (1975) montrent que les pertes
des nitrates par lixiviation sont au minimum dans les stades
14
intermédiaires de la succession végétale,
lorsque l'accumulation (d'où absorption importante de N) de la biomasse
végétale est importante.
? Volatilisation
La volatilisation est la perte de N par la conversion
d''ammonium en ammoniac gazeux (NH3), qui est libéré dans
l'atmosphère. Les pertes par volatilisation augmentent à des pH
élevés et dans les conditions favorisant l'évaporation au
niveau du sol. Dans les sols acides, il y a une forte concentration de H+
par rapport aux sols calcaires ce qui permet la formation de
NH+4 due à l'oxydation de NH3, et donc la perte de N est
minime. À l'inverse, de faibles concentrations de H+ dans les
sols calcaires, la libre NH3 reste pendant un certain temps et est sensible
à la perte. Ainsi, la perte par volatilisation est directement
affectée par le pH du sol. La possibilité ou la
probabilité de perte est plus élevée lorsque le pH du sol
est supérieur à 7,4 (sols plus ou moins calcaires). De
même, le risque de perte est beaucoup moins dans les sols avec un pH
acide ou neutre.
2.2. Minéralisation de l'azote dans le sol 2.2.1.
Mécanisme de minéralisation d'azote
La minéralisation consiste à la
dégradation de N organique en N inorganique (NH+4 et
NO-3) par les microorganismes du sol. C'est un processus important
dans le fonctionnement des écosystèmes car il permet aux plantes
d'absorber le N sous sa forme minérale. La minéralisation de N
implique des étapes successives, où des protéines
complexes sont dégradées en composés azotés simples
qui sont ensuite hydrolysées, et elle se réalise en deux phases
à savoir : l'ammonification et la nitrification.
L'ammonification : résulte de la
décomposition de la MO et elle comprend la conversion de N organique en
ammonium (ou ammoniac) qui est alors disponible soit pour la nitrification soit
pour l'assimilation.
La nitrification : c'est le processus par
lequel l'ammonium se transforme en nitrate par oxydation. Ce processus est
effectué par certains microorganismes (bactéries :
Nitrosomonas et Nitrobacter) qui transforment l'ammonium en
nitrite (NO- 2) qui, à son tour, s'oxyde rapidement pour
former le nitrate. La nitrification se réalise en deux étapes
à savoir : La nitritation qui est l'oxydation de l'ammonium en nitrite
et qui est effectuée par les Nitrosomonas, les Nitrosolobus et les
Nitrospira qui sont les bactéries autotrophes
15
(Équation 1), et la nitratation
où les nitrites formés dans la première étape sont
oxydés en nitrates principalement par les Nitrobacter
(Équation 2).
Équation 1: Première étape
de nitrification (= Nitritation) 2NH+4 + 3O2
?2NO2- + 2H2O + 4H+ + Énergie Équation
2: Deuxième étape de nitrification (= Nitratation)
2NO2- + O2 ?2NO3- + Énergie
Étant donné que la nitrification est
assurée par un groupe limité de bactéries, les facteurs
environnementaux ont une influence marquée dans ce processus. Toutefois,
de nombreux écosystèmes naturels (terrestres) ne parviennent pas
à produire le nitrate de façon significative malgré les
conditions favorables propices pour la nitrification (Vitousek et al.,
1979). Ceci conduit à conclure que cette dernière joue un
rôle mineur dans le cycle de N dans les écosystèmes non
perturbés.
2.2.2. Minéralisation brute et nette d'azote
La minéralisation brute de N reflète les flux de
minéralisation de N, qui résultent de la décomposition de
la biomasse métabolique active ou passive. Ainsi, c'est le passage de N
de la forme organique à la forme minérale. Lorsque la
minéralisation brute dépasse l'assimilation, un gain net de N
inorganique se réalise alors que dans le cas contraire lorsque la
croissance de la biomasse nécessite plus de N que la quantité
disponible, une immobilisation nette de N inorganique est observée dans
le sol (Rosswall, 1982). Dans la plupart des sols, la disponibilité de C
détermine la croissance microbienne et en conséquence, puisque la
plupart des sols en sont limités, la minéralisation nette de N
est observée.
2.2.3. Variation de minéralisation dans le profil du
sol
La variation de minéralisation nette de N dans le
profil du sol a fait l'objet de plusieurs études qui montrent qu'elle a
tendance à diminuer avec la profondeur du sol (Stanford et al.,
1974; Mahli et al., 1992; Benjelloun, 1993; Kandeler et al.,
1994; Benjelloun et Ahmiri, 2000). Linden et al. (1992) par
exemple ont trouvé que l'accumulation de N minéral était
la plus importante dans les 20 premiers centimètres du sol suivi par une
diminution suivie d'une baisse marquée au-delà de ladite
profondeur. Ceci est en bon accord avec d'autres résultats qui montrent
qu'il y a généralement une
16
diminution de l'activité microbienne dans les couches
profondes du sol. Les travaux effectués par Kandeler et al.
(1994) ont montré que l'ampleur d'activités enzymatiques
liées à la biomasse microbienne du sol diminue de façon
similaire à celle de minéralisation nette de N avec la profondeur
de 0 à 50 cm. De la même façon, Kaiser et al.
(1995) ont trouvé des différences significatives dans les
niveaux de C microbien entre trois couches (10 cm chacune) dans les premiers 30
cm sol. Une enquête plus approfondie sur les différentes fractions
de N dans le sol a révélé qu'avec une augmentation de
profondeur, la quantité totale, ainsi que celle de nitrates
extractibles, diminuent tandis que celle d'ammonium extractible était
uniforme (Cassman et Munns, 1980). Dans ce cas, la minéralisation nette
de N dans les 18 cm supérieurs a contribué à 42% de
minéralisation nette totale sur une profondeur étudiée de
108 cm. Comparativement à ces découvertes, Kandeler et al.
(1994) ont aussi trouvé que les 20 cm supérieurs
contribuaient de près de 75% de minéralisation nette totale dans
une étude sur la profondeur variant de 0 à 50 cm.
La diminution avec la profondeur du contenu azoté
d'acides aminés est aussi relativement plus marquée que celle de
N total, ce qui peut être dû au piégeage d'acides
aminés dans les composés organiques complexes qui sont moins
décomposables par des processus biologiques. Soudi et al.
(1990) ont également trouvé qu'il y a une baisse au niveau
des constantes de vitesse d'hydrolyse qui montre une dégradation
chimique réduite de composés N avec la profondeur. Cela
suggère que la biodégradabilité diminue avec la profondeur
des sols.
2.2.4. Facteurs influençant la minéralisation
d'azote ? Quantité et qualité de litière (matière
organique)
En plus des facteurs pédologiques et environnementaux,
l'incorporation de la MO provenant des résidus de plantes et d'animaux
influent sur la minéralisation de N. Parmi les facteurs liés
à la MO, la quantité et la qualité de détritus sont
à la fois impliquées dans le processus de sa dégradation
ainsi que la production d'ammonium dans le sol.
En termes pratiques, la quantité et la qualité
de la MO (par exemple le rapport C: N, la teneur en lignine) influencent la
production d'ammonium et la disponibilité en N dans les sols et les
sédiments (Updegraff et al., 1995; Kumar et Goh 2000; Kyuma
2004).
La litière provenant d'espèces typiques des
écosystèmes productifs (herbes, espèces à feuilles
caduques) se décompose généralement plus rapidement que
celle provenant des écosystèmes à base des
conifères qui sont généralement moins productifs
(Cornelissen, 1996; Perez-Harguindeguy et al., 2000).
17
y' Humidité du sol
L'humidité du sol influe aussi directement sur
l'activité microbienne et, ce qui à son tour, affecte la
minéralisation de N dans sol. Elle est liée étroitement
à la température et ses niveaux optimaux favorisent aussi
l'activité microbienne. La MO se décompose plus rapidement
à des potentiels d'eau de l'ordre de -10 à -50 kPa (Web 5), et la
décomposition ralentit progressivement à mesure que teneur en eau
dévie dans les deux sens à partir de cette gamme optimale.
Lorsque l'humidité du sol s'approche à la saturation totale, la
décomposition ralentit car les conditions deviennent de plus en plus
anaérobies. La teneur en eau du sol peut également influer sur le
système sol-plante où on assiste à des pertes de N dans le
sol. Le N mobilisé (nitrates) peut se déplacer facilement dans ce
système de sol, ce qui amplifiera les processus de lixiviation des
nutriments nécessaires pour les plantes. Il est à signaler que
les conditions particulièrement humides du sol, mais pas de saturation,
peuvent conduire à la surabondance des processus de décomposition
microbienne et de minéralisation, et donc provoquant un excès de
N qui sera perdu dans les eaux souterraines.
y' Température du sol
La température est un facteur primordial
influençant la minéralisation de N du sol car elle affecte
directement la décomposition microbienne, étant donné que
c'est elle qui arrête le processus de libération de N.
Généralement, les conditions de température favorables
à la croissance des plantes ressemblent étroitement à des
conditions optimales pour décomposition microbienne. Les travaux
réalisés par Powers (1980) ont montré que dans les
conditions optimales de température au niveau des sols forestiers, la
minéralisation de N augmente à mesure que la température
moyenne du sol en été, augmente. Ceci est en raison de
l'activité microbienne qui augmente au fur et mesure que la
température augmente.
y' pH du sol
Le pH est l'un des facteurs les plus importants
influençant la décomposition qui se déroule
généralement plus facilement dans les sols neutres que dans ceux
qui sont acides. L'acidité du sol et la teneur élevée en
sels de la solution du sol ont des effets marqués sur tous les processus
microbiens, y compris la minéralisation de l'N. En régulant le
type, la quantité et les activités de microorganismes
impliqués, le taux de transformation de N ainsi que sa
disponibilité dans le sol sont affectés. Le pH optimal
18
pour la croissance de la biomasse du sol a été
établi proche de la neutralité, la minéralisation
étant restreinte à des niveaux bas. Ceci est
particulièrement vrai dans les cas où la végétation
est composée principalement des conifères dont la matière
est généralement acide avec le pli qui varie entre 3,5 et 4,5
(Swift et al., 1979). Dans ces conditions, la décomposition de
la MO ainsi que la minéralisation d'N sont plus lentes par rapport aux
cas où la végétation est décideuse.
2.3. Aperçu sur l'évaluation de
minéralisation d'azote dans le sol
L'estimation du potentiel de minéralisation de N pour
un sol revêt une importance considérable permettant de maximiser
l'efficacité dans l'utilisation de N à partir de toutes les
sources de N et au même temps minimisant ses pertes. Il existe plusieurs
méthodes pour évaluer la minéralisation de N dans le sol
mais aucune de ces méthodes n'est globalement acceptée (pour
différents types de sols), vue la complexité de facteurs qui
affectent les taux de minéralisation (Robertson et al., 1999).
Les efforts visant à développer des méthodes biologiques
ou chimiques rapides pour identifier le potentiel de minéralisation de N
organique ont une longue histoire avec différents niveaux de
succès. Plusieurs de ces méthodes correspondent
étroitement à la composante de N minéralisable (Griffin,
2008). Une approche généralement adoptée pour
déterminer le pool d'N potentiellement minéralisable est celle
d'incubations anaérobie et aérobie. Il est à signaler que
cette approche ne peut pas être considérée comme
étant la mesure directe de N disponible pour les plantes mais elle n'est
qu'un indice pour le processus de minéralisation. Ainsi, cette approche
peut être réalisée soit au laboratoire, dans les conditions
contrôlées, soit sur le terrain (in situ).
L'incubation aérobie est une
méthode satisfaisante pour l'évaluation de la
disponibilité de N dans le sol pour les plantes, tenant compte du fait
que la minéralisation de N pendant l'incubation est
réalisée par les mêmes organismes qui minéralisent
le N dans les conditions naturelles. C'est une méthode standard
utilisée pour l'estimation de N potentiellement minéralisable
(N0) par Stanford et Smith (1972), et l'estimation résultant de cette
méthode représente la quantité de N qui est susceptible
d'être libéré sous forme minérale des
réserves organiques du sol dans une solution dans la période
d'incubation. Ainsi, la méthode permet d'estimer le N0 ainsi que la
constante cinétique de minéralisation de N (k). Cela est
basé sur le concept de décomposition d'un pool de N disponible
selon la cinétique de premier ordre (Figure 2).
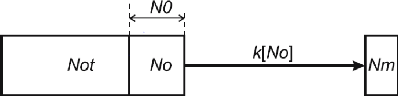
19
Figure 2: La représentation
schématique de la minéralisation de N selon Stanford et Smith
(1972) où Not = N total; No = N potentiellement minéralisable; Nm
= N minéralisé mesuré; et k = constante de
minéralisation de N.
Quant à l'incubation anaérobie,
elle a été suggérée par Waring et Bremner
(1964), en tenant compte des limites de l'incubation aérobie, pour
déterminer l'indice de disponibilité de N. Cette méthode
diffère de la méthode aérobie par le fait que seule la
quantité de N ammoniacal est estimée (N-NO3- est perdu
par dénitrification). Cela signifie que cette méthode a
l'avantage d'être plus rapide que la précédente, ce qui
peut être important dans quelques analyses.
Chapitre 3. Rôle des incendies de forêts
dans les écosystèmes forestiers
3.1. Généralités sur les incendies de
forêts 3.1.1. Définition d'incendie de forêts
Le feu de forêt est un incendie incontrôlable qui
se propage sur une étendue boisée (forêt ou formation
subforestière) d'une surface minimale d'un hectare et qu'une partie au
moins des étages arbustifs et/ou arborés soit détruite.
Lors d'un incendie, il y a la combustion de la MO (combustible) qui
libère une grande quantité d'énergie. Cette énergie
est transférée à partir des combustibles brûlants
aux combustibles non brûlés en avant du front de feu, et c'est ce
phénomène qui assure la propagation de l'incendie. Le
début d'incendie dépend de l'inflammabilité de la
végétation et sa propagation dépendra d'un certain nombre
de variables, y compris les caractéristiques des combustibles (taille,
teneur en eau et structure), les conditions météorologiques et la
topographie.
20
3.1.2. Causes d'incendie de forêts
Les feux de forêts peuvent être d'origines
naturelles (foudre, éruption volcanique) ou anthropique dues aux actions
intentionnelles et criminelles ou involontaires et accidentelles de l'homme en
forêt (défrichement, apiculture etc.).
V' Causes naturelles
La végétation ne s'enflammant pas seule,
même dans le cas d'une forte sécheresse. Pour qu'un incendie se
déclenche, il faut que trois critères soient remplis. Il faut
qu'il y'ait un combustible (végétation ou n'importe quel
matériau pouvant brûler), une source externe de chaleur (flamme,
étincelle) et un apport en oxygène nécessaire pour
alimenter le feu : le vent active la combustion. L'unique cause naturelle
connue dans le bassin méditerranéen est la foudre. Ce
phénomène, très répandu dans la forêt
boréale, est relativement rare dans la région
méditerranéenne où il ne concerne que 1 à 5 % des
cas d'incendies. Des exceptions peuvent toutefois être observées,
notamment en Espagne, où, dans certaines régions, la foudre
représente 30 % des départs de feu. Les éruptions
volcaniques peuvent également être à l'origine d'incendies
de forêt. Ce phénomène est cependant exceptionnel dans le
bassin méditerranéen.
V' Causes anthropiques
Les causes naturelles sont plus fréquentes en
particulier en Europe et en Amérique, mais dans la plupart des cas et en
ce qui concerne le Maroc, les facteurs anthropiques restent toujours les
principales causes des feux de forêt. Les activités de
recréation comme le camping, la chasse etc., les fumeurs
négligents qui jettent les mégots en (ou à
proximité des) forêts, le défrichement en utilisant le feu
par des agriculteurs constituent les facteurs causaux des feux de
forêt.
3.2. Conséquences des incendies sur les
écosystèmes forestiers (accent sur le sol) 3.2.1. Sur les
végétaux
Plusieurs études ont été
réalisées sur les effets des incendies sur la
végétation. Ces effets résultent de l'interaction entre
les propriétés chimiques et physiques du feu et des
caractéristiques de la plante. Chaque feu se comporte
différemment, et chaque espèce à une combinaison unique de
caractéristiques physiologiques et physiques, donc il est à
souligner qu'il y a un vaste éventail des effets résultant de feu
sur les plantes (Schwilk, 2003). La probabilité d'une couronne d'arbre
de survivre à un incendie dépend de sa
21
forme, sa taille, sa hauteur, et le degré de protection
offert par ses bourgeons. Le feuillage qui est très proche des flammes
et de chaleur est plus susceptible de subir la mort des tissus. Les arbres
ayant des couronnes qui s'étendent de la surface (ou près de la
surface) du sol au sommet ont généralement une mortalité
importante de tissu parce que les branches et le feuillage près du sol
forment une «échelle» de combustible verticale fournissant un
conduit pour la combustion.
Les feux de forêts sont souvent présentés
comme de véritables problèmes écologiques et
environnementaux mais l'un de leurs effets peut être positif dans le fait
qu'ils interviennent dans l'évolution de certaines plantes en permettant
leur rajeunissement. Ces plantes, appelées pyrophytes, sont
adaptées aux incendies et possèdent généralement
des écorces très épaisses ou difficilement inflammables,
les souches profondément enfoncées sous terre protègent
les tissus de croissance plus fragiles et les fruits (cônes)
résistants à la chaleur. Le feu peut affecter les étapes
de développement des plantes y compris le stade végétatif,
la floraison et la fructification (Chandler et al., 1983). Certaines
(pins, cistes etc.) dépendent également de passages
réguliers des feux pour lever la dormance de leurs graines par les
températures dégagées.
3.2.2. Sur le sol
Les effets spécifiques sur le sol peuvent varier
considérablement. La fréquence, la durée et
l'intensité du feu, ainsi que les caractéristiques du sol doivent
être considérées. Plusieurs propriétés
physiques, chimiques, minéralogiques et biologiques du sol peuvent
être affectées par les incendies de forêt. Ces effets sont
principalement en raison de la gravité (intensité et
durée) des incendies (Certini, 2005).
3.2.2.1. Conséquences sur les
propriétés physiques
Les propriétés physiques du sol sont des
caractéristiques, des processus, ou des réactions d'un sol qui
sont causées par des forces physiques. Ces propriétés
physiques influencent la composante minérale du sol et la façon
dont elle interagit avec les deux autres composantes (chimiques et
biologiques). Les plantes dépendent des caractéristiques
physiques des sols comme support pour leur croissance et
développement.
Généralement, la plupart des incendies ne
dégagent pas suffisamment de chaleur au niveau du sol pour provoquer des
changements importants aux propriétés physiques du sol
(Hungerford et al., 1990). Cependant, les petites modifications de ces
propriétés
22
peuvent avoir des implications importantes sur les autres
propriétés (chimiques et biologiques) et par conséquent
sur le fonctionnement du système du sol. L'ampleur des modifications des
propriétés physiques dépend largement de la gravité
d'un incendie dont les effets sont généralement liés
à la perte de la MO qui joue un rôle important dans le maintien de
la structure du sol.
Parmi les propriétés physiques du sol
touchées par les incendies, on cite la couleur, la texture, la
structure, la densité apparente, la porosité, la teneur en
argiles et la teneur en eau du sol. Les effets sur ces propriétés
varient considérablement selon la durée, la
sévérité et la fréquence des incendies. Les seuils
critiques de température pour quelques propriétés figurent
dans le Tableau 1. Généralement, il n'y a pas de
changement significatif sur ces propriétés (ex. le quartz, qui
contribue à la texture du sol, a un seuil de température
d'environ 1400°C (Tableau 1) car dans la plupart des cas
le sol ne se chauffe pas de façon importante. Même là
où les incendies n'entraînent des changements directs aux
propriétés physiques du sol, leurs effets indirects sur
l'hydrologie et l'érosion du sol ne vont que varier en fonction de
l'état du sol, de la topographie et du climat (Hungerford et al.,
1990).
Tableau 1 : Les seuils critiques de
température pour les caractéristiques physiques du
sol (Source
: USDA Forest Service, 2005)
Caractéristique du sol Seuil de température
(°C) Source
|
Mouillabilité 250 DeBano et Krammes,
1986
|
Structure 300 DeBano, 1990
Formation de calcite 300-500 Iglesias et
al., 1997
Argiles 460-980 DeBano, 1990
Calcaire (quartz) 1414 Lide, 2001
? La couleur
L'apparence du sol forestier suite à des feux peut
aider à évaluer la quantité de chaleur rayonnée en
profondeur durant l'incendie et, par extension, de la gravité de l'effet
d'un feu sur le sol (Wells et al., 1979). La couleur du sol est une
bonne indication de la quantité et de l'état des résidus
organiques qui restent après le feu. La MO légèrement
décomposée sera d'une couleur brunâtre, tandis que la MO
décomposée de manière plus approfondie sera noire (Fisher
et Binkley, 2000). Dans les zones avec peu ou pas de MO résiduelle
post-incendie, le sol peut apparaître gris, blanc, ou rouge, selon le
type de roche
23
à partir de laquelle le sol est dérivé et
les températures atteintes lors d'un incendie. Les feux de faibles
intensités ne consomment qu'une petite portion de la litière et
la MO à la surface du sol, ce qui se caractérise par le
noircissement du sol. Dans le cas des feux à intensités
modérées et importantes, le sol apparaitrait soit grisâtre
(ou blanchâtre) soit brunâtre (ou rougeâtre) en fonction de
la roche mère parente à partir de laquelle le sol était
dérivé. Ceci est dû à la consommation quasi totale
de la MO ce qui fait apparaitre la fraction minérale du sol (Web 2).
V' La texture et la
minéralogie
Les composants de la texture du sol (sable, limon et argile)
ont des seuils de température élevés et
généralement ne sont pas touchés par le feu, sauf s'ils
sont soumis à des températures élevées à la
surface du sol minéral (Neary et al., 2005). Pour les sols
incendiés, la texture devient généralement
grossière en raison de la diminution des argiles. Les feux intenses
peuvent altérer de façon permanente la texture du sol par
l'agrégation des particules d'argile en particules, ayant la taille du
sable stables. La fraction de texture le plus sensible est celle d'argiles, qui
commence à changer à des températures d'environ 400°C
(Tableau 1) lorsque la structure d'argiles commence à
s'effondrer. À des températures de 700 à 800°C, il
y'a la destruction complète de la structure interne des argiles. Le
sable et le limon, généralement à base du quartz, ont un
point de fusion d'environ 1 414°C (Tableau 1) qui est
rarement atteint lors des incendies, donc ils restent souvent intacts (Ulery et
Graham, 1993; Neary et al., 2005). Il est à signaler que
l'effet de température sur la stabilité des argiles est
atténué par la concentration des argiles dans les horizons B du
sol. Dans certains cas, l'augmentation de la propriété
grossière des argiles peut néanmoins rendre les sols plus
perméables à l'air et à l'eau (Chandler et al.,
1983).
V' La structure
D'après Neary et al. (1999), la structure du
sol est dégradée suite à des incendies d'intensités
modérées voire importantes. Les feux ont tendances d'exposer le
sol minéral et l'impact des gouttes d'eau lors des précipitations
sur le sol nu, pauvre en MO, conduit à la dispersion des agrégats
et à la fermeture des pores, et par conséquent la diminution de
la porosité. On assiste souvent à la formation d'une couche
discrète ou continue imperméable, parallèle à la
surface du sol et qui n'excède rarement 6 - 8 cm de profondeur. Ceci
diminue l'infiltration et conduit à une accentuation des processus de
ruissellement lors des pluies et par conséquent l'érosion du sol.
Les feux peuvent
24
également avoir d'effets néfastes sur la
structure du sol car lors de combustion, il y a une grande perte de la MO qui
relie les particules du sol en agrégats.
V' La densité apparente et la
porosité
La densité apparente est le rapport de la masse du sol
sec au volume frais et elle est en relation avec la porosité qui est le
volume des vides dans le sol (micropores + macropores), ce qui permet de
refléter la capacité du sol à fonctionner pour le soutien
structurel, le mouvement de l'eau et de solutés, et l'aération du
sol. Dans les sols bien structurés, il y a une
prépondérance des macropores et des micropores, ce qui permet
à la fois la circulation rapide de l'eau et de l'air dans les
macropores, et la rétention de l'eau par capillarité dans les
micropores.
Le feu et le chauffage du sol peuvent conduire à la
destruction de la structure du sol, affectant à la fois la
porosité totale (microporosité + macroporosité) et la
distribution des pores dans les horizons de surface d'un sol (DeBano et
al, 1998). Les changements au niveau de la MO provoquent une diminution
à la fois de la porosité totale et de la taille des pores. La
densité apparente augmente généralement en raison de
l'effondrement des agrégats et le colmatage des vides par les cendres et
les minéraux argileux dispersés (Certini, 2005). La perte de
macropores dans le sol de surface réduit les taux d'infiltration et
produit le ruissellement. La modification de la MO peut aussi conduire à
une condition du sol hydrofuge qui diminue encore les taux d'infiltration.
V' La capacité de stockage de l'eau et la
rétention en eau
L'eau est retenue dans les pores du sol par
capillarité. Plus la taille des pores est petite, plus la
capacité de rétention d'eau est importante. Les petites tailles
de pores des matières inorganiques du sol à taille argileuse ont
une grande capacité de rétention d'eau par unité de volume
et en conséquence, permet la rétention de quantités
importantes d'eau nécessaires pour la croissance des plantes. La MO
relie des particules minérales du sol ce qui constitue des
agrégats ayant des micropores qui favorisent la rétention d'eau
et qui améliorent la structure du sol donc sa perte lors des incendies a
un effet négatif sur la rétention d'eau par le sol.
3.2.2.2. Conséquences sur les
propriétés chimiques
Les propriétés chimiques sont souvent
touchées dans les cas où on assiste à des incendies
provoquant des températures élevées dans le sol.
L'allocation ou les pertes des
25
composés organiques et des éléments
nutritifs dans le sol provoquent souvent des changements des
propriétés chimiques (Wells et al., 1979). La tendance
commune associée à des feux de forêt est la perte des
nutriments du sol qui se caractérise par la volatilisation des
éléments tels que le N, le phosphore et le C. Cependant, il est
à noter que les feux, dans le cas où ils sont
contrôlés, peuvent être utilisés comme des outils
d'aménagement des forets car ils provoquent dans ce cas, une
libération d'éléments nutritifs dans le sol sous forme
d'ions inorganiques. La MO se décompose en ses éléments
constitutifs pendant la combustion (Fisher et Binkley, 2000 in Web 1).
Il est à signaler que la plupart des éléments nutritifs du
sol sont transportés hors site par l'action de vent, de ruissellement,
de lessivage et de volatilisation.
? La matière organique et le carbone
L'une des premières modifications constatées au
niveau du sol, après les incendies, est la diminution marquée de
la matière organique. Cette diminution est en fonction des niveaux de
températures atteints durant les incendies. De nombreuses
propriétés et processus chimiques survenant dans les sols
dépendent de la présence de matière organique. Non
seulement elle joue un rôle déterminant dans la chimie du sol,
mais elle affecte également les propriétés physiques et
biologiques des sols. La MO est particulièrement importante pour
l'approvisionnement des nutriments, la capacité d'échange
cationique et la rétention d'eau.
Le feu ne touche pas seulement la MO en affectant directement
sa composition chimique, mais aussi indirectement sur le taux ultérieure
de décomposition. L'ampleur des changements est
généralement liée à la gravité de
l'incendie. Les travaux effectués par Schnitzer et Hoffman (1964) ont
montré qu'à des températures moins élevées
à modérées (250 à 400°C), des changements sont
perçus au niveau des groupes fonctionnels les plus sensibles (les
groupes phénoliques et carboxyliques sont perdus). À des
températures plus élevées, la décomposition
thermique des noyaux se produit. D'autres travaux montrent que les acides
humiques sont convertis en substances alcalins insolubles contribuant à
l'humus du sol, tandis que les acides fulviques sont transformés en
polymères insolubles dans l'acide. La biomasse qui n'est pas
complètement brûlée contient à la fois des
composés de lignine solubles dans les alcalins et d'autres produits
formés par déshydratation d'hydrates de C. Ces composés
sont plus résistants à d'autres changements d'ordre chimiques et
biologiques (Knoepp et al., 2005).
26
Tout incendie de forêt modifie la quantité et la
répartition de C dans le sol (Wells et al., 1979). La
quantité de C perdue dépendra de plusieurs facteurs y compris
l'intensité du feu, la quantité et la répartition de la MO
à la surface du sol, du taux de décomposition résiduelle
de la MO après feu etc. Les variations en quantité de la MO et du
C (surtout organique), suite au passage des feux au niveau du sol, sont
considérées comme étant semblable car le C (organique) est
l'un des principaux constituants de la matière organique. Les pertes
sont surtout accentuées lorsque les feux sont localisés sur une
petite surface pendant une longue période car cela favorise le transfert
de chaleur en profondeur du sol (Neary et al, 1999).
Le type de végétation, la structure et
l'âge du peuplement sont aussi des variables qui entrent en jeu lors de
l'évaluation des pertes en C dans le sol forestier. Dans les peuplements
s'approchant du stade climax, les débris provenant des arbres jouent le
rôle de combustibles pour les feux. À cela s'ajoute la
mortalité des arbres âgés, qui deviennent partie importante
dans le cycle de C dans le sol, et contribue à des pertes importantes de
C dans ces écosystèmes. Ross et al. (1997) ont
constaté qu'il y a une diminution de la quantité du C total et de
C extractible par le sulfate de potassium dans le sol après 1,5 à
2,5 ans à la date de passage du feu. Des études ont montré
que même dans une période prolongée après le passage
des feux, la quantité de C reste inferieure dans les sites
incendiés par rapport à ceux qui n'ont pas été
touchés par le feu. Ceci était vrai pour toutes les composantes
du C étudiées par Sands (1983), qui a constaté que la
quantité du C organique total, du C extractible, des acides humiques et
des carbohydrates pour les sites brûlés était toujours
inférieure à celle des sites non incendiés à
côté, même après une période de 24 ans.
? L'azote
L'azote est l'élément le plus susceptible de
limiter la croissance des arbres dans les forêts et d'autres
écosystèmes naturels, et en raison de cette limitation
inhérente, ses pertes importantes lors des incendies pourraient nuire
à la productivité de nombreux écosystèmes
forestiers à long terme. En particulier, si les mécanismes de
réapprovisionnement en N ne sont pas prévues lors de la gestion
après feu. Les feux d'intensité modérée voire
élevée conduisent souvent à la conversion de la plus
grande partie d'N organique en formes inorganiques. Les formes ammoniac
(N-NH4+) et nitrates
(N-NO3 -) sont souvent celles qui dérivent de la
combustion ainsi que la conversion de N-organique. La teneur totale en N
après l'incendie évolue comme résultat de compensation
27
entre une baisse de N en raison de volatilisation et une
augmentation provenant d'incorporation des composés contenant N dans les
cendres déposées. Ainsi, N-NH4+ qui
-
est un produit direct de la combustion et N-NO3 qui en
résulte par nitrification qui a lieu
quelques semaines voire mois après le feu, sont souvent
perdus par volatilisation (Covington et Sacket, 1992).
y' Le phosphore
Il a été signalé que le phosphore (P)
joue un rôle limitant dans certains écosystèmes forestiers
et dont les carences sont très susceptibles d'apparaître dans les
sols fixateurs de P. Le feu peut provoquer la libération de phosphore
inorganique dans la MO du sol. Toutefois, l'effet d'un feu sur la
disponibilité du phosphore dans le sol est complexe et cette
disponibilité pourrait être diminuée par adsorption sur les
surfaces d'oxyde hydraté de fer ou d'aluminium nouvellement
exposées ou créés. La disponibilité du phosphore
peut être également augmentée par la combustion et la
dégradation partielle de la MO qui conduisent à une augmentation
du pH, ce qui provoque la désorption de Fe et Al à partir des
surfaces des oxydes hydratés. L'assimilation (par les plantes) et la
disponibilité du phosphore sont aussi fortement dépendantes de
l'interrelation entre les mycorhizes et la MO qui sont touchées lors du
passage des feux, plutôt qu'elles se fassent par la simple absorption
à partir de la solution du sol.
y' Le pH
Le pH du sol est une mesure importante qui consiste à
l'évaluation de la disponibilité potentielle de nutriments
bénéfiques et des éléments toxiques pour les
plantes. Il renseigne sur l'acidité du sol et aussi sur l'état du
complexe absorbant. Généralement le pH des sols (surtout non
calcaires) a tendance d'augmenter après le passage des feux, quoique
éphémèrement, en raison de la libération des
cations alcalins (Ca2+, Mg2+, K+,
Na+) liés à la MO (Certini, 2005). La grandeur et la
durée de ce changement dépend de la quantité et du contenu
de base pour les cendres, de texture du sol, et de teneur en MO du sol
(Pritchett et Fisher, 1987). Les cations basiques contenus dans les cendres
peuvent faire augmenter le pH à la surface du sol jusqu'à trois
fois le pH initial, et donc modifier fondamentalement plusieurs
réactions d'altération chimique (Ulery et Graham, 1993). Les
études effectuées par Wells et al. (1979) ont
montré aussi que la combustion affecte les propriétés
chimiques des sols en convertissant la matière organique, notamment les
résidus dans la litière en cendres qui sont lessivées lors
des
28
pluies vers le bas, modifiant donc le pH et la concentration
du sol en solutés. Il est signaler que la température diminue
avec la profondeur du sol, donc la modification du pH est plus importante
à la surface qu'en profondeur. Les études ont montré que
le pH tend à évoluer vers les niveaux pré-incendies au
cours du temps en raison du lessivage et de l'absorption des
éléments contenus dans les cendres (Wodmansee et Wallach, 1981).
Ceci est vrai surtout pour les cas des feux d'intensités faibles
à modérées.
? La CEC et les bases échangeables
La CEC peut diminuer après le passage des feux et
rester faible pendant au moins un an après un incendie car la
matière organique, qui fournit une grande surface pour les
réactions chimiques au niveau du sol, est consommée (Saint-John
et Rundel, 1976).
Même si la CEC diminue souvent après les
incendies, quelques éléments nutritifs restent disponibles pour
les plantes et dans certains cas, ils augmentent. Ceci est le cas des
éléments tels que le potassium, le sodium, le calcium et le
magnésium qui sont trouvés dans les cendres
déposées suites au passage des feux. Ces éléments
sont rarement déficients dans de nombreux écosystèmes et
ceci en plus de leurs seuils de températures élevés,
contribuent à la saturation en bases, ce qui augmente souvent le pH du
sol.
3.2.2.3. Conséquences sur les
propriétés biologiques
Les propriétés biologiques des sols comportent
un large éventail d'organismes qui vivent dans le sol, ainsi que les
processus biologiques qu'ils régulent. Le bien-être de ces
organismes du sol affecte directement la productivité et la
durabilité des écosystèmes forestiers à court et
à long terme (Borchers et Perry, 1990 in Neary et al.,
2005).
Les feux de forêts touchent les organismes vivants du
sol de façon, soit directe soit indirecte. Le chauffage du sol affecte
directement les microorganismes, soit en les tuant soit en altérant
leurs fonctions reproductives. Quant aux effets indirects, ils provoquent
habituellement des changements à long terme pour l'environnement du sol
ce qui a une incidence sur le bien-être des organismes biologiques du
sol. Il y a une modification de la MO (source d'énergie) ce qui peut
augmenter (ou diminuer) la disponibilité des nutriments et donc affecter
la croissance microbienne. La concurrence pour l'habitat, l'approvisionnement
en nutriments et d'autres changements plus subtils affectent également
le rétablissement et la succession des plantes et des animaux (Verma, et
al., 2012). Bien que la relation entre le chauffage du sol et les populations
microbiennes du sol soit complexe, il apparaît que la durée du
chauffage, les températures maximales
29
atteintes, et la teneur en eau du sol affectent les
réponses microbiennes (Dunn et al., 1985). Les groupes
microbiens diffèrent sensiblement par leur sensibilité à
la température et les bactéries nitrifiantes sont
particulièrement sensibles à la chaleur du sol. Les populations
de microorganismes physiologiquement actives dans les sols humides sont plus
sensibles que les populations dormantes dans les sols secs (DeBano, 1991). Les
endomycorhizes et ectomycorhizes sont aussi touchées par
l'échauffement du sol lors des incendies.
3.3. Situation marocaine à l'égard des
incendies de forêts
Le feu de forêt, au Maroc, est considéré
comme étant un feu touchant les formations forestières et les
matorrals appartenant au domaine forestier de l'État ou soumis au
régime forestier. Les incendies, au Maroc, sont liés surtout
à la combinaison du climat (chaud et sec en été), des
forêts ayant des espèces flammables et de la fréquentation
humaine des forêts. Les études réalisées par le
HCEFLCD montrent que le Maroc a connu près de 12912 incendies de
forêts entre 1960 et 2009, Les pertes en couvert végétal
enregistrées ont atteints les 149292 ha, soit une moyenne de 2986 ha par
an, ce qui représente 0,05 % de la surface totale boisée du pays
(Web 3). Au Maroc, les incendies et les superficies incendiées sont
jugés relativement élevés. Cette situation devient
contraignante pour le bien-être des forêts car en combinant avec
d'autres facteurs déjà existants tels que les taux de boisement
faible, l'aridité du climat, l'anthropisation des surfaces
forestières etc., elle accentue les phénomènes de
dégradation des écosystèmes forestiers marocains et rend
difficile la reconstitution des espaces boisés.
La Province de Chefchaouen, qui englobe la zone
d'étude, est parmi les plus incendiées au Maroc, connaissant en
moyenne environ 46 incendies avec une superficie incendiée d'environ 932
ha chaque année dans le période entre 2004 et 2013, Les CCDRFs de
Jebha et Bab Berred sont les plus touchés avec environ 73 % des
incendies qu'a connu la Province de Chefchaouen. Quant aux 27 communes rurales
comprenant la région, 16 d'entre elles ont connu au moins un incendie,
les deux les plus touchées étant celles de M'tioua et de Bab
Berred.
30
DEUXIÈME PARTIE : MATÉRIELS ET
MÉTHODES
1. PRÉSENTATION DE LA ZONE D'ÉTUDE 1.1.
Description de la zone d'étude
Le Rif centro-occidental est une zone montagneuse qui se
trouve dans la région du Nord du Maroc. Sa situation géographique
privilégiée entre l'océan Atlantique et la mer
Méditerranée, lui confère une originalité
climatique dont, la combinaison avec la diversité orographique et
géologique régionale, favorisent une grande richesse
écologique (Benabid, 1983 in Taiqui, 1997). Cependant, cette
région est caractérisée par une forte dégradation
des ressources naturelles. La région connaît une forte
anthropisation qui se traduit par le défrichement pour la culture du kif
(Cannabis sativa) et la coupe pour le bois de chauffage, ce qui
représente environ 90% du processus de déforestation dans la
région (Grovel, 1996). À cette problématique s'ajoute
celle des incendies de forêts. Cette région est
particulière dans le fait qu'elle est aussi parmi les plus
incendiées au Maroc, ce qui conduit à une accentuation des
processus d'érosion du sol (perte des éléments), et par
conséquent des fortes dégradations des écosystèmes
dans la région.
1.1.1. Situation géographique
Les quatre forêts comprenant les sites d'étude se
trouvent au Nord-Ouest du Maroc dans la Province de Chefchaouen qui se situe
entre les méridiens 4°30' W et 5°30' W, et les
parallèles 34°45' N et 35°30' N (Figure 3).
La forêt domaniale d'Akumssen, qui comprend le site I, se situe à
environ 70 km de la ville de Chefchaouen entre les villages de Bab Berred et
Ketama. En ce qui concerne les forêts domaniales de Talassemtane, de Bab
Taza et de Béni Salah, elles comprennent respectivement les sites II,
III et IV situés à 18 km, à 20,5 km et à 30 km de
la ville de Chefchaouen.
1.1.2. Situation administrative et forestière
Administrativement, les quatre forêts faisant partie de
la zone d'étude, relèvent toutes de la Province de Chefchaouen.
Les forêts domaniales de Bab Taza, de Béni Salah et de
Talassemtane dépendent de la commune rurale, du caïdat et du cercle
de Bab Taza. Concernant la forêt domaniale d'Akumssen, elle est
rattachée à la commune rurale, au caïdat et au cercle de Bab
Berred.
31
Carte du Maroc
Figure 3 : La situation géographique de
la zone d'étude
32
Du point de vue forestier, la zone d'étude
relève de la DREFLCD du Rif où toutes les forêts faisant
l'objet d'étude sont gérées par la DPEFLCD de Chefchaouen.
Les forêts de Bab Taza, de Béni Salah et de Talassemtane sont
gérées par le secteur de Bab Taza et le CCDRF de Chefchaouen Sud.
Quant à la forêt d'Akumssen, elle est gérée par le
secteur et le CCDRF de Bab Berred.
1.1.3. Situation géologique et
géomorphologique
La région du Rif est une chaine de montagnes se
caractérisant par une originalité et qui est la plus
méditerranéenne parmi les chaines de montagnes marocaines
(Maurer, 1968). C'est une région qui est constituée en majeure
partie par des marnes, des schistes et des flyschs, roches tendres et
imperméables, facilement érodées. Ce sont des roches qui
datent généralement des époques secondaire et tertiaire,
localement primaire. La région a fait l'objet de plusieurs études
sur les aspects géologiques et géomorphologiques,
réalisées par différents auteurs (Maurer (1968), Lacoste
(1934), El Gharbaoui (1980), entre autres), ce qui a permis de distinguer
plusieurs formations structurales à savoir : y' La dorsale calcaire dont
les composantes principales comprennent les calcaires et les dolomies de
l'ère mésozoïque (Maurer, 1968 ; Mattauer, 1960 in
Benjelloun, 1993) y' Les nappes de charriage constituées de flyschs
schisto-gréseux et qui englobent les nappes Numidienne, de Bni Ider et
de Tizirene
y' Les unités autochtones comprenant :
· L'unité de Tanger caractérisée par
les marnes grises et les roches marno-calcaires,
· L'unité de Ketama caractérisée par
les schistes et les grès quartzitiques,
· L'unité d'Ouezzane constituée des roches
d'âge tertiaire y compris les marnes blanches de l'Éocène
et les séries détritiques du Miocène constituées de
grès.
Concernant les sites échantillonnés, la
forêt d'Akumssen relève de l'unité de Ketama tandis que la
forêt de Talassemtane relève de la dorsale calcaire. Les
forêts de Bab Taza et de Béni Salah, quant à elles
relèvent de la nappe Numidienne.
Quant à la géomorphologie, elle est
caractérisée par un relief très accidenté, les
principales caractéristiques de la zone d'étude comprenant les
crêtes qui sont nombreuses et assez basses, les pentes nues et abruptes
se connectant à ces dernières, les vallées et des
frontons. Ainsi, la région du Rif centro-occidental est composée
de chaînes de montagnes qui sont liés aux processus
édifiants du Pliocène.
33
1.1.4. Situation pédologique
La région du Rif est caractérisée par une
richesse importante des espèces, ce qui reflète la
diversité en termes pédologiques. Les sols proviennent en grande
partie de l'altération des roches immédiatement sous-jacentes,
présentes dans le Rif sous forme de marnes, de grès et surtout de
flyschs. Leurs caractéristiques dépendent beaucoup de la
roche-mère dont ils proviennent. Cette région est aussi
caractérisée par une forte anthropisation qui joue un rôle
important dans la pédogenèse et l'évolution des sols.
Ainsi, divers travaux ont permis de distinguer plusieurs types de sol à
savoir : y' Les sols bruns associés aux lithosols et régosols qui
reposent sur les schistes et les calcaires.
y' Les sols bruns reposant sur le quartzite et
caractérisés par une richesse floristique.
y' Les sols rouges fersialitiques souvent
caractérisés par le phénomène d'hydromorphie et de
lessivage d'argiles.
y' Les sols minéraux bruts et peu
évolués d'érosion sur schistes. Ce sont des sols
très dégradés.
y' Les sols hydromorphes occupant des zones de replats.
y' Les vertisols reposant sur les marnes et les
marno-calcaires.
Concernant les sites échantillonnés, ils sont
liés aux sols fersialitiques et peu évolués, et dont la
description détaillée est présentée dans la partie
résultats (1.2).
1.1.5. Climat
Le climat de la région du Rif est de type
méditerranéen à influence océanique (atlantique et
mer méditerranéenne). Ceci lui confère une
diversité au point de vue climatique qui se caractérise par une
saison estivale de mois de juin-juillet au mois d'octobre, et une autre
hivernale s'étendant de novembre-décembre au mars. Les
étés sont chauds mais adoucis par les entrées maritimes
d'une part et l'altitude de l'autre alors que les hivers sont froids et
enneigés en altitude, plus doux et humides en descendant.
Pour cette étude, on a considéré quatre
stations climatiques plus ou moins proches des différents sites
d'échantillonnage à savoir : la station de Chefchaouen, la
station de Derdara, la station de Bab Taza et la station de Bab Berred.
34
1.1.5.1. Précipitations
La tendance, de point de vue pluviométrique, est que
les précipitations augmentent de l'Ouest vers l'Est et l'on note
généralement que 75 % des pluies tombent pendant 5 mois de
novembre à mars alors que la sécheresse est prononcée
durant le reste de l'année.
? Précipitations mensuelles et
annuelles
Le Rif constitue l'une des régions les plus
arrosées au Maroc où l'on enregistre jusqu'à 2000 mm de
précipitation annuellement. Les précipitations annuelles varient
en fonction d'altitude et l'on assiste généralement à une
augmentation du littoral vers le continental. Pour les stations
étudiées, les précipitations s'étalent de 851 mm
à 1115 mm (Tableau 2).
Tableau 2 : Les moyennes
pluviométriques mensuelles (en mm) des stations
étudiées.
Mois
Station
|
J
|
F
|
M
|
A
|
M
|
J
|
J
|
A
|
S
|
O
|
N
|
D
|
Tot
|
Chefchaouen
|
161
|
141
|
157
|
65
|
37
|
9
|
1
|
3
|
15
|
53
|
104
|
145
|
891
|
Derdara
|
148
|
138
|
142
|
62
|
34
|
8
|
0
|
2
|
12
|
50
|
97
|
142
|
1008
|
Bab Taza
|
180
|
196
|
192
|
93
|
49
|
15
|
1
|
3
|
18
|
69
|
122
|
177
|
1115
|
Bab Berred
|
145
|
130
|
150
|
74
|
49
|
10
|
2
|
4
|
21
|
66
|
138
|
62
|
851
|
|
Source : http://fr.climate-data.org/
Les moyennes pluviométriques annuelles pour les stations
sont les suivantes :
Chefchaouen : 891 mm
Derdara : 835 mm
Bab Taza: 1115 mm
Bab Berred: 851 mm
En ce qui concerne la répartition des
précipitations moyennes mensuelles au cours de l'année
(Tableau 2), ces dernières varient d'un mois à
l'autre. Ainsi, ce paramètre nous permet de distinguer entre les mois
secs favorables aux incendies et les mois humides favorables à la
reprise de la végétation après ces perturbations. Il
ressort que les mois les plus humides varient entre janvier et février
(selon les stations) alors que le mois le plus sec est de juillet.
35
V' Précipitations saisonnières
L'étude des régimes pluviométriques
moyens saisonniers consiste à classer les saisons par ordre de
pluviosité décroissante c'est-à-dire donner les bilans
d'eau reçus saison par saison. L'analyse du Tableau 3
montre que pour toutes les stations étudiées, le
régime saisonnier est du type HPAE
(Hivers-Printemps-Automne-Été).
Tableau 3 : Le régime
pluviométrique saisonnier de stations étudiées.
Station
|
Hiver
(mm)
|
Printemps
(mm)
|
Été
(mm)
|
Automne
(mm)
|
Totale
(mm)
|
Régime
saisonnier
|
Chefchaouen
|
447
|
259
|
13
|
172
|
891
|
|
|
|
|
|
|
|
HPAE
|
|
(50,2%)
|
(29,1%)
|
(1,5%)
|
(19,3%)
|
|
|
Derdara
|
428
|
238
|
10
|
159
|
|
|
|
|
|
|
|
835
|
HPAE
|
|
(51,3%)
|
(28,5%)
|
(1,2%)
|
(19,4%)
|
|
|
Bab Taza
|
553
|
334
|
19
|
209
|
|
|
|
|
|
|
|
1115
|
HPAE
|
|
(49,6%)
|
(30,0%)
|
(1,7%)
|
(18,7%)
|
|
|
Bab Berred
|
337
|
273
|
16
|
225
|
|
|
|
|
|
|
|
851
|
HPAE
|
|
(39,6%)
|
(32,1%)
|
(1,9%)
|
(26,4%)
|
|
|
|
Source : http://fr.climate-data.org/
V' Précipitations occultes et neige
Les précipitations sous forme de neige sont abondantes
en période hivernale surtout au-dessus de 1400 m, en particulier pour la
forêt d'Akumssen. Ainsi, la période d'enneigement est d'environ 9
jours à Bab Berred, la nébulosité étant
également importante dans cette zone (HCEFLCD, 2004 in ALLAM,
2005). Concernant les brouillards, ils sont fréquents sur les parties
hautes des versants opposées, ayant lieu environ 17 jours à Bab
Taza où la chute de neige ayant également lieu à partir
d'altitude de 800 m.
1.1.5.2. Températures
Les facteurs thermiques combinés avec les
précipitations jouent un rôle important dans les processus
biogéochimiques, donc il convient de les considérer dans les
études dirigées dans le même sens.
36
V' Températures mensuelles et
annuelles
Les donnes de températures moyennes mensuelles se
présentent sur le Tableau 4 où Bab Taza
présente le mois qui a la température la plus basse de 5,3
°C en janvier tandis que Derdara présente la moyenne la plus
élevée de 25,8 °C en aout.
Tableau 4: Les moyennes de température
mensuelles (en °C) des stations étudiées.
Mois
Station
|
J
|
F
|
M
|
A
|
M
|
J
|
J
|
A
|
S
|
O
|
N
|
D
|
Chefchaouen
|
9,3
|
9,8
|
12,3
|
14,4
|
16,7
|
21,2
|
24,7
|
24,9
|
21,5
|
17,2
|
14,4
|
11,1
|
Derdara
|
10,1
|
11,1
|
13,6
|
15,8
|
18,2
|
22,3
|
25,7
|
25,8
|
22,9
|
18,7
|
15,0
|
11,7
|
Bab Taza
|
5,3
|
6,3
|
8,8
|
13,1
|
15,6
|
19,5
|
22,9
|
21,6
|
17,8
|
11,9
|
8,9
|
6,1
|
Bab Berred
|
7,7
|
8,3
|
10,7
|
13,4
|
15,8
|
20,1
|
24,1
|
24,2
|
21,5
|
15,9
|
13,0
|
9,2
|
|
Source : http://fr.climate-data.org/
Concernant les moyennes de température annuelles pour les
stations, elles sont :
Chefchaouen : 16,5 °C
Derdara : 17,6 °C
Bab Taza : 13,2 °C
Bab Berred : 15,3 °C
V' Températures minimales et maximales, et
amplitude thermique
Le Tableau 5 montre que le mois le plus
froid est janvier avec le minimum le plus bas étant de 0 °C
enregistré à Bab Berred tandis que le mois le plus chaud est
août, le maximum le plus haut étant de 32,8 °C
enregistré à Derdara.
En ce qui concerne l'amplitude thermique, elle traduit la
continentalité d'une région. Ainsi, les travaux de Debrache,
(1953) in Belghazi, (1983) ont permis de définir les types de
climats selon ce paramètre. L'analyse de données d'amplitude
thermique pour les quatre stations révèle ainsi que leur climat
est de type semi-continentale (15 °C < A < 35 °C).
37
Tableau 5: Les moyennes de température
minimales et maximales, et d'amplitude
thermique (en °C) des stations
étudiées.
Mois
Station
|
|
J
|
F
|
M
|
A
|
M
|
J
|
J
|
A
|
S
|
O
|
N
|
D
|
|
M
|
14,3
|
15,1
|
17,5
|
19,6
|
22,5
|
27,6
|
31,9
|
32,0
|
28,1
|
22,7
|
19,6
|
15,7
|
Chefchaouen
|
m
|
4,3
|
4,6
|
7,2
|
9,3
|
11,0
|
14,8
|
17,6
|
17,9
|
14,9
|
11,7
|
9,2
|
6,5
|
|
A
|
10,0
|
10,5
|
10,3
|
10,3
|
11,5
|
12,8
|
14,3
|
14,1
|
13,2
|
11,0
|
10,4
|
9,2
|
|
M
|
15,1
|
16,3
|
18,7
|
20,9
|
23,9
|
28,6
|
32,7
|
32,8
|
29,4
|
24,3
|
20,2
|
16,4
|
Derdara
|
m
|
5,1
|
5,9
|
8,5
|
10,7
|
12,5
|
16,0
|
18,7
|
18,9
|
16,4
|
13,2
|
9,9
|
7,1
|
|
A
|
10,0
|
10,4
|
10,2
|
10,2
|
11,4
|
12,6
|
14,0
|
13,9
|
13,0
|
11,1
|
10,3
|
9,3
|
|
M
|
13,0
|
13,8
|
16,1
|
18,8
|
21,8
|
26,8
|
31,8
|
31,7
|
28,5
|
21,6
|
18,3
|
13,9
|
Bab Taza
|
m
|
2,5
|
2,9
|
5,4
|
8,0
|
9,9
|
13,5
|
16,4
|
16,8
|
14,6
|
10,2
|
7,7
|
4,6
|
|
A
|
10,5
|
10,9
|
10,7
|
10,8
|
11,9
|
13,3
|
15,4
|
14,9
|
13,9
|
11,4
|
10,6
|
9,3
|
|
M
|
10,5
|
11,9
|
14,3
|
18,7
|
21,7
|
26,4
|
31,0
|
29,4
|
25,0
|
17,7
|
14,3
|
10,8
|
Bab Berred
|
m
|
0,0
|
0,7
|
3,3
|
7,5
|
9,5
|
12,7
|
14,9
|
13,9
|
10,7
|
6,2
|
3,5
|
1,5
|
|
A
|
10,5
|
11,2
|
11,0
|
11,2
|
12,2
|
13,7
|
16,1
|
15,5
|
14,3
|
11,5
|
10,8
|
9,3
|
|
Source : http://fr.climate-data.org/
1.1.5.3. Synthèse climatique et bioclimatique
Le climat est la résultante de nombreux facteurs, une
synthèse bioclimatique s'avère indispensable afin de
refléter les contraintes climatiques qui régissent les processus
biogéochimiques dans le sol. Dans cette optique, plusieurs indices,
formules et graphiques ont été élaborés. En ce qui
concerne cette étude, deux indices envisagés, qui sont aussi les
plus utilisés en région méditerranéenne, sont
l'indice pluviothermique de Bagnouls et Gaussen (1953) et le coefficient
pluviométrique d'Emberger (1930, 1955) complété par
Sauvage (1963) et Daget (1977).
? Classification d'Emberger
Emberger a défini une expression permettant de
déterminer le coefficient de pluviométrie (Q2), valable pour le
climat méditerranéen. Cette expression a connu des modifications
par les auteurs tels que Sauvage (1963) et elle s'exprime comme suit :
2000 * P
=
M^2 - m^2
Où :
P = Pluviométrie moyenne annuelle en mm
M2 = Moyenne des températures maximales du mois le plus
chaud en °K
m2 = Moyenne des températures minimales du mois le
plus froid en °K
Ainsi, la combinaison et la synthèse de valeurs de Q2 et
de m permettent de définir les bioclimats et leurs variantes pour les
quatre stations (Tableau 6).
Tableau 6: Les bioclimats et variantes des
stations étudiées
Station
|
Précipitations (mm)
|
M
(°C)
|
m
(°C)
|
Q2
|
Bioclimat
|
Variante
|
Chefchaouen
|
891,0
|
32,0
|
4,3
|
110,4
|
Humide
|
Tempérée
|
Derdara
|
835,0
|
32,8
|
5,1
|
102,5
|
Humide
|
Tempérée
|
Bab Taza
|
1115,0
|
31,8
|
2,5
|
131,1
|
Humide
|
Fraîche
|
Bab Berred
|
851,0
|
31,0
|
0,0
|
95,1
|
Humide
|
Fraîche
|
|
? Classification de Bagnouls et Gaussen
(1953)
L'étude de travaux de Bagnouls et Gaussen (1953)
permet de distinguer les mois secs tout en se basant sur la définition
du mois sec qui est tout mois dont la totalité des précipitations
est égale ou inférieure au double de la température
moyenne (Pmm = 2T°C). Ainsi, l'analyse des diagrammes ombrothermiques
(Annexe 1) montre que la période sèche
s'étend sur quatre mois pour les stations de Chefchaouen, de Derdara, de
Bab Taza et de Bab Berred.
1.1.6. Végétation
Le domaine rifain, dans son ensemble compte, parmi les
régions marocaines dont la flore terrestre est très
variée, puisqu'elle se compose de plus de 2000 espèces ; 30
à 40 % de cette flore se retrouvent sur le versant
méditerranéen. Toutefois, le Rif est surtout connu pour sa valeur
biogéographique, vu les affinités étroites de sa flore
avec celle des
39
montagnes de la rive nord de la Méditerranée
(Valdès, 1991), notamment entre le Tangérois et la
cordillère bétique.
Dans l'étage thermoméditerranéen, qui
est le plus étendu dans la région, l'altitude varie de 900
à 1000 m. C'est un étage caractérisé par des
bioclimats semi-aride (SA) à humide (H) (perhumide PH dans les cas
exceptionnels) où les précipitations varient de 300 - 1500 mm/an.
Le bioclimat SA est dominé par le thuya (Tetraclinis
articulata) sur les substrats marno-calcaire et/ou gréseux.
Au niveau de l'étage
mésoméditerranéen, la superficie est réduite par
rapport au cas précèdent où l'amplitude altitudinale est
comprise entre de 900 - 1000 m et 1300 - 1400 m. L'étage se situe dans
les bioclimats SA supérieur, SH, H et PH où les
précipitations vont jusqu'à 2000 m. C'est un étage qui est
caractérisée par l'abondance de chênaies, où le
chêne vert (Quercus rotundifolia) et le chêne liège
(Quercus suber) constitue les essences majeures. L'on trouve
également le chêne tauzin (Quercus pyrenaica) et le
chêne zéen (Quercus canariensis) sur le substrat
siliceux. Le sous-bois dans les chênaies est plus au moins
diversifié, composé d'espèces telles que l'arbousier
(Arbutus unedo), la bruyère (Erica sp.), les cistes
(Cistus sp.), entre autres.
L'étage supraméditerranéen, quant
à lui, se situe dans une tranche altitudinale comprise entre 1300 et
1700 m dans le bioclimat PH à variante fraiche à froide. C'est un
étage composé de chênes caducifoliés, souvent
mélangés avec les conifères de hautes altitudes qui sont
essentiellement le cèdre de l'atlas (Cedrus atlantica) et le
sapin marocain (Abies maroccana) + le pin noir (Pinus nigra
var. mauretanica) sur le substrat calcaire.
Quant à l'étage montagnard
méditerranéen, il se situe entre 1650 - 1800 m et 2200 - 2300 m
en fonction de l'exposition dans les bioclimats H et PH a variantes froide a
très froide. C'est une zone des conifères des hautes altitudes
soient le cèdre de l'atlas, le sapin marocain et le pin noir. L'on
trouve également le chêne vert, une espèce rustique pouvant
supporter les conditions extrêmes de froid.
En ce qui concerne la zone étudiée, elle
s'étend sur quatre forêts caractérisées, sauf pour
la forêt de Talassemtane, des pins comme espèce
végétale dominante. En outre, leur composition se présente
dans la partie Annexe 3.
1.2. Présentation des sites
échantillonnés
Quatre sites d'étude composés de trois
différentes espèces d'arbres (végétation dominante)
ont été sélectionnés. Ainsi, le premier (I) site
échantillonné était la forêt
40
domaniale d'Akumssen situé dans la commune de Bab
Berred (Figure 4b) et constituée d'un peuplement
naturel de pin maritime des Landes (Pinus pinaster ssp. atlantica
var. maritima). Concernant le deuxième (II), il
était défriché se trouvant dans la forêt domaniale
de Talassemtane dont le peuplement était mixte composé de
chêne-liège (Quercus suber) et chêne vert
(Quercus rotundifolia). Le troisième (III) site était
situé dans la forêt domaniale de Bab Taza Tifouzal tandis que le
quatrième était situé dans la forêt domaniale de
Béni Salah. Les deux derniers sites étaient des reboisements, le
troisième composé de pin maritime de Landes tandis que le
quatrième était un reboisement de pin radiata (Pinus
radiata) ayant subi une coupe rase dans la partie incendiée. Les
sites II, III et IV étaient tous situés dans la commune rurale de
Bab Taza (Figure 4a).
Tableau 7: Les données
générales sur les sites échantillonnés
(coordonnées entre parenthèses correspondent aux sites
témoins)
Site
|
Coordonnées
|
Altitude (m)
|
Pente (%)
|
Expo
|
I
|
4°51'23,10"W 34°59'29,32"N
|
1280
|
15 - 30
|
SSW
|
|
(4°51'21,96"W 34°59'28,96"N)
|
|
|
|
II
|
5°9'44,57"W, 35°5'20,05"N
|
1290
|
30 - 50
|
SSW
|
|
(5°9'47,04"W, 35°5'18,83"N)
|
|
|
|
III
|
5°13'11,90"W, 35°4'2,72"N
|
765
|
2 - 5
|
NW
|
|
(5°13'12,79"W 35°4'1,16"N)
|
|
|
|
IV
|
5°12'30,47"W, 35°3'33,87"N
|
840
|
-
|
-
|
|
(5°12'23,45"W, 35°3'33,21"N)
|
|
|
|
|
Où :
I : Forêt domaniale de Akusmssen (Bab Berred - Ketama)
II : Forêt domaniale de Talassemtane
III : Forêt domaniale de Bab Taza Tifouzal
IV : Forêt domaniale de Béni Salah
En ce qui concerne les incendies qui ont eu lieu dans ces
forêts, deux des quatre sites échantillonnés ont connu les
derniers incendies en 2014. La forêt de Bab Taza Tifouzal dont une
superficie de 0,5 ha étaient incendié le 07/09/2014 tandis que
celle d'Akumssen a connu l'incendie le 06/08/2014, 0,08 ha et 4,15 ha de
superficie étant incendiés respectivement aux endroits Lmghabra
et Bab Talaouda. La forêt de Béni Salah quant à elle,
était incendiée le 03/07/2013 dont 3 ha touchée à
l'endroit Ain d'Amghar tandis que la forêt de Talassemtane était
incendiée le 23/9/2012 dont 0,2 ha de superficie touchée. Dans
tous les cas, la maitrise de l'incendie était plus ou moins rapide avec
seulement le feu de Talassemtane prenant plus de 24 heures pour le
maîtriser.
41
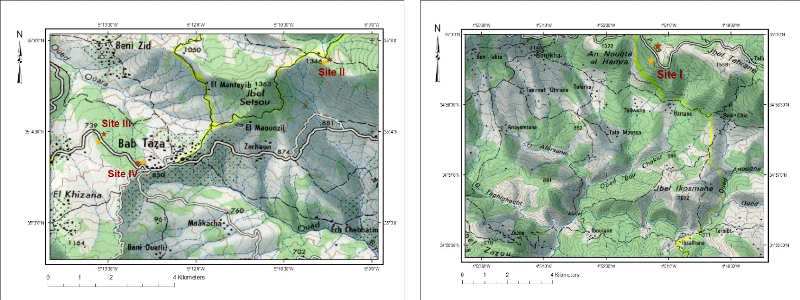
Figure 4 : Les cartes des communes de Bab Taza
et de Bab Berred présentant les sites échantillonnés
42
2. MÉTHODOLOGIE
2.1. Matériels
+ Sur le terrain
Les matériels utilisés sur le terrain sont les
suivants :
V' Un couteau pédologique
V' Des boites cylindres en aluminium de dimensions
connues pour déterminer la
densité apparente
V' Des sachets en plastique pour collecter des
échantillons du sol à analyser
V' Un appareil GPS pour la prise des coordonnées
géographiques
V' Un altimètre pour la détermination de
l'altitude
+ Au laboratoire
Pour le travail expérimental au laboratoire, on a fait
appel aux matériels suivant :
V' Une étuve
V' Un incubateur
V' Un distillateur d'eau
V' Un pH-mètre
V' Une électrode combinée
V' Un calcimètre
V' Un appareil de distillation à vapeur
Pro-Nitro
V' Un agitateur magnétique
V' Un agitateur mécanique
V' Un poste de titrage
V' Des matériels accessoires : burettes,
pipettes, fioles jaugées, éprouvettes, béchers,
entonnoirs.
2.2. Méthodes
+ Sur le terrain
V' Description morphologique des
profils
Une étude détaillée des profils
pédologiques a été faite au niveau des sites
étudiés. Un profil pédologique pour le site I, un pour le
site II et un autre pour les sites III et IV ont fait l'objet de la
description, en se basant sur les caractéristiques morphologiques des
profils du sol. On a procédé par la description de certains
indicateurs pour les horizons
43
leurs nombre et dimensions, leur couleur, leur texture,
structure et porosité, proportion des éléments grossiers
ainsi que des racines et leur orientation.
? Échantillonnage du sol
La principale difficulté dans l'échantillonnage
après les incendies de forêt est le manque d'informations sur les
caractéristiques du sol avant l'incendie, en particulier lorsque l'on
considère la variabilité spatiale des propriétés du
sol. Quoique parfois critiqué par les chercheurs, la solution habituelle
est d'échantillonner les zones avoisinantes non-incendiées afin
de jouer le rôle de sites témoins (à quelque mètres
des peuplements incendiés). L'échantillonnage a été
fait après avoir situé les sites touchés par les
incendies. Pour chaque site, l'échantillonnage a été fait
sur trois répétitions dans les parties incendiées et
non-incendiées du peuplement. La sélection des sites
témoins, non incendiés pour chaque site, a été
réalisée en se basant sur les caractères
écologiques, pédologiques et climatiques afin d'avoir les sites
aussi homogènes que possible. Cela est primordial car l'on minimise les
effets (résultats) qui peuvent être dus aux caractères des
sites au lieu des incendies (objet d'étude).
Ainsi, vingt - quatre échantillons du sol ont
été prélevés sous (4 * 3)* 2 (incendiés et
témoins) sites, dans la profondeur entre 0 et 20 cm.
? Au laboratoire (ENFI et INRA - Rabat) 2.2.1.
Préparation des échantillons
Au laboratoire, les échantillons ont été
séchés à l'air libre suivi par le tamisage à l'aide
d'un tamis de 2 mm de maille. Ceci nous permet d'exclure les grands
agrégats du sol, les cailloux, la MO etc., dans lesquels certains
éléments peuvent être protégés physiquement,
ce qui entravera leur extraction lors des analyses. C'est une étape de
préparation des échantillons pour les analyses à
suivre.
2.2.2. Méthodes d'analyses des
propriétés physiques du sol
L'efficacité des racines pour l'alimentation des
arbres est liée aux propriétés physiques du sol qui
agissent sur le volume prospecté. Ces propriétés
interviennent dans la vie des arbres en mettant à leur disposition une
certaine quantité d'air et d'eau par unité de volume, et aussi en
permettant un enracinement plus ou moins profond à la recherche de l'eau
et des éléments nutritifs (Bonneau, 1963). Dans ce cas on parle
de la fertilité physique du sol qui permet une bonne aération du
sol, un enracinement de qualité et
44
favorise le flux d'eau et l'activité biologique. C'est
la raison pour laquelle il est nécessaire d'étudier les effets
des incendies de forêts sur les dites propriétés.
Le présent travail consiste à
l'évaluation des propriétés physiques suivantes : la
densité apparente du sol, l'eau du sol, la granulométrie - la
texture du sol.
2.2.2.1. Densité apparente
La densité apparente d'un sol est définie comme
étant le rapport entre la masse du sol sec (généralement
séché à l'étuve) à son volume frais. Elle
reflète la capacité du sol à fonctionner pour le soutien
structurel, le mouvement de l'eau et de solutés, et l'aération du
sol. Elle était déterminée par collecte de carottes du sol
à l'aide de boites en aluminium de volume connu. Les carottes du sol
frais sont passées à un séchage à l'étuve
à une température de 105 °C pendant une période de 24
heures et puis leur poids (sol sec) déterminé. Le volume du sol
frais était aussi estimé en déterminant celui des boites
en aluminium utilisées.
La densité apparente était calculée
selon la formule suivante :
Densité apparente (Da) =
Volume frais du sol (cm3) en g/cm3
Masse du sol sec (g)
2.2.2.2. Granulométrie
Le sol est constitué d'un ensemble de particules de
différentes formes et tailles. Ainsi, l'objet d'une analyse
granulométrique est de regrouper ces particules dans des gammes
distinctes de tailles ainsi que la détermination de leur proportion
relative en pourcentage (ou poids) du sol. La méthode utilisée
pour cette étude consistait à deux phases principales à
savoir : la phase de pré-traitement (dispersion) comprenant l'attaque de
MO, de calcaire et l'élimination des cations adsorbants, et la
granulométrie proprement dite basée sur la sédimentation
en faisant appel à la méthode d'hydromètre de Bouyoucos
(1962).
2.2.2.3. La texture du sol
L'évaluation manuelle (sensation manuelle) est la
méthode la plus répandue, surtout sur le terrain, pour
déterminer le type de texture d'un sol. Par contre, une analyse
granulométrique donne généralement un portrait
détaillé. Pour cette étude, les résultats de la
granulométrie, tout en se basant sur le triangle textural
(Figure 5), ont été utilisés pour la
détermination de texture des échantillons du sol. La proportion
relative de chaque
45
composante de la terre fine, c'est-à-dire les
proportions de sables, de limons et d'argiles qui étaient
déterminées, a permis ainsi de définir la texture du sol
en question.
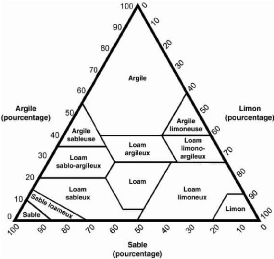
Figure 5 : Le triangle de texture (Source :
Web6)
2.2.3. Méthodes d'analyses des
propriétés chimiques du sol
Les propriétés chimiques du sol correspondent
aux teneurs et disponibilités des éléments minéraux
nutritifs pour les plantes et aux paramètres chimiques du sol en lien
avec leur restitution ou disponibilité. Les incendies peuvent agir sur
la MO, conduisant à des pertes, dans les cas où les feux sont
d'intensité importante. La chaleur dégagée lors des
incendies induit une oxydation chimique de la MO ce qui modifie les
transformations de C et de N dans le sol (Choromanska et Deluca, 2001).
L'horizon organique, étant un composant critique de la durabilité
des écosystèmes, est affecté, ce qui peut entraver la
dynamique des nutriments, car la MO joue un rôle important dans la CEC du
sol et la rétention des ions (Crasswell et Lefroy, 2001).
Pour le présent travail, les analyses chimiques
consistaient à déterminer l'effet des feux de forêts sur
les propriétés suivantes : le pH du sol, les bases
échangeables, la CEC, le C organique total, le N total et inorganique
46
2.2.3.1. pH
La détermination du pH-H2O était faite en
pesant 20 g de sol (< 2 mm) séché à l'air libre dans un
bécher et en ajoutant 50 ml d'eau déminéralisée
(i.e. distillée) d'où le rapport sol : eau de 1 : 2,5. La
suspension a été remuée de façon intermittente
pendant 30 minutes puis laissée reposer pendant 12 h. Ensuite,
l'électrode a été plongée dans le surnageant clair
suivi par l'enregistrement du pH une fois que la lecture s'est
stabilisée.
Quant au pH-KCl, le principe était le même que
celui du pH-H2O sauf dans ce cas, environ 3 g de KCl ont été
ajoutés dans le surnageant avant d'y plonger l'électrode, juste
après la détermination de pH-H2O.
2.2.3.2. Calcaire total
Pour la détermination du calcaire total, elle s'est
réalisée en utilisant le calcimètre Bernard. Ainsi,
l'analyse s'est faite en pesant environ 2 g d'échantillons du sol qui
ont été placés dans une bouteille en verre. Une solution
de HCl (au 1/2), contenue dans une petite boite a été
placée dans la bouteille contenant le sol. Ensuite, le contenu de la
bouteille était agité légèrement afin d'avoir une
réaction par action de l'acide sur les carbonates du sol. Pour chaque
échantillon, le volume correspondant au CO2 dégagé lors de
la réaction était noté en vérifiant le changement
du niveau d'eau sur le calcimètre.
2.2.3.3. Carbone organique total et matière
organique
La détermination du C organique dans les
échantillons du sol était basée sur la méthode de
Walkley-Black (1934) d'oxydation humide à acide chromique. La MO dans le
sol est oxydée par une solution de dichromate de potassium (K2Cr2O7 1N).
La réaction est assistée par la chaleur
générée lorsque deux volumes d'acide sulfurique sont
mélangés avec un volume de dichromate. Le dichromate
résiduel est dosé avec le sulfate ferreux et dans ce cas le titre
est inversement proportionnel à la quantité de C présent
dans l'échantillon de sol.
· Réactifs
V' Dichromate de potassium (K2Cr2O7 1 N)
V' Sel de Mohr
((NH4)2Fe(SO4)2 0,5 N)
V' Acide phosphorique concentré (85 % H3PO4, d =
1,71)
V' Acide sulfurique concentré (H2SO4, d =
1,83)
V' Indicateur diphénylamine
47
? Procédure
1. Phase de digestion
C'est la première étape qui consiste en la
dégradation (minéralisation) de C, où ses formes sont
oxydées en présence d'excès de dichromate. Pour ce
présent travail, l'on a procédé par le pesage de 0,5 - 2 g
(en fonction de la teneur en matière organique) du sol, tamisé
à 2 mm, qui était placé dans un erlenmeyer de 250 ml. A
ces derniers, 15 ml de la solution de K2Cr2O7 1N était ajoutée
puis le mélange était agité doucement. Ensuite, 20 ml de
H2SO4 concentré était ajouté tout en agitant doucement le
mélange qui était laissé reposer pendant 30 minutes. La
réaction dans ce milieu acide concentré est exothermique (? 120
°C) et se développe à une cinétique rapide
(Équation 3).
Équation 3: 3C + 2Cr2O7 + 16H+
120°C 4Cr3+ + 8H20 + 3CO2
2. Phase de titrage
C'est la deuxième phase où 115 ml d'eau
distillée était ajouté au mélange de la
première phase pour homogénéiser la solution puis
laissé reposer pendant deux heures. Ensuite, 50 ml de la solution
surnageant était prélevé dans un erlenmeyer de 250 ml et
dans laquelle l'on a ajouté 5 ml de H3PO4 concentré. 3 gouttes
d'indicateur diphénylamine était également ajoutées
dans la solution destinée au titrage.
Ainsi, le titrage proprement dit était
réalisé en titrant l'excès de solution de K2Cr2O7 non
consommé par le C organique. Ceci était effectué par
réduction à solution de sel de Mohr (Équation
4), en présence d'un indicateur jusqu'à ce que la
couleur passe de bleu foncé au vert.
Équation 4: Cr2O72- +
6Fe2+ +14H+ 2Cr3+ + 6Fe3+ +7H20
Les mêmes étapes sont
répétées pour le témoin et le calcul du C organique
total contenu dans le sol s'est fait en appliquant la formule suivante :
(Vt - Vi)
C (%) = 5,85 *
p * Vt
Où :
Vt = volume de solution de sel de Mohr correspondant au
titrage du témoin en ml Vi = volume de solution de sel de Mohr
correspondant au titrage d'échantillon i
en ml
p = poids d'échantillon du sol pris en g
Pour la détermination de MO, le calcul se fait comme suit
:
MO (%) = C (%) * 1,724
48
Concernant l'estimation des stocks de C organique dans le sol
par unité de surface, la formule suivante a été
appliquée :
COstock = COT * DA * L
Où:
COstock = stock de carbone organique en t/ha
COT = carbone organique total en % (= g de C/100 de sol) DA =
densité apparente en g/cm3
L = profondeur du sol en cm
2.2.3.4. Azote total
Quantitativement parlant, la teneur en N total du sol exprime
non seulement les composés de N organique du sol et de la biomasse, mais
aussi des composés inorganiques. La méthode utilisée pour
la détermination de N total était celle de Kjeldahl (1883) et qui
comprend trois phases à savoir : la digestion (minéralisation)
qui consiste à la conversion d'N organique en ammonium par
ébullition dans l'acide sulfurique. Cela est suivi par la distillation
avec une solution alcaline pour libérer l'ammoniac qui sera
déterminé par titrage. C'est une méthode qui a subi
plusieurs modifications, par exemple, les modifications de Cope (1916)
in Bradstreet (1965) à l'acide salicylique, de Davidson et
Parsons (1919) in Bradstreet (1965) consistant à la
réduction alcaline, de Bremner (1960) etc.
· Réactifs
V' Acide sulfurique concentré (H2SO4, d = 1,84)
V' Sulfates de potassium et de cuivre (K2SO4 et CuSO4) =
catalyseurs
V' Hydroxyde de sodium (40 % NaOH)
V' Acide chlorhydrique (HCl N/70)
V' Indicateur de Tashiro
· Procédure
La phase de minéralisation s'est
réalisée en pesant 2 g de sol qui était placé dans
un matras de 100 ml dans lequel l'on a ajouté le catalyseur ainsi que 10
ml H2SO4 concentré. Ceci était suivi du chauffage pendant 2
heures. Après le refroidissement 25 ml d'eau distillée
était ajouté puis le contenu (sulfate d'ammonium) a
été laissé reposer.
La phase de distillation se fait en plaçant 30 ml de
la solution de (NH4)2SO4 dans une fiole jaugée et dans laquelle 50 ml de
la solution de 40 % NaOH a été ajouté. Ceci
49
était suivi par le dosage de NH3 dégagé
dans une fiole contenant 50 ml d'eau distillée, l'acide HCl en
présence de l'indicateur. Le calcul de N total s'est fait comme suit
:
N (%) =
p
0,014
*
70
(Vi - Vt)
* 100
Où :
Vi = volume de solution HCl N/70 correspondant au titrage
d'échantillon i en ml Vt = volume de solution de HCl N/70 correspondant
au titrage du témoin en ml p = pois d'échantillon du sol pris en
g
0,014 = quantité de N correspondant à 1ml de HCL
1N
1/70 = Normalité de HCl
2.2.3.5. Bases échangeables
La détermination des Bases échangeables
(Ca2+, Mg2+, Na+ et K+)
était effectuée en utilisant la technique
développée par Lavkulich (1981), qui consiste à saturer
des échantillons du sol par une solution tamponnée
d'acétate d'ammonium (1M) à pH 7, C'est une méthode qui
est fiable pour la plupart des sols à l'exception de ceux contentant des
taux élevés de calcaire et de gypse car cela conduira à la
surestimation de Ca2+, comparativement aux autres méthodes
(ex à BaCl2).
2.2.3.6. Capacité d'échange cationique
(CEC)
La capacité d'échange cationique (CEC) d'un sol
est la mesure du nombre de sites chargés négativement sur la
surface du sol qui peuvent retenir les cations par des forces
électrostatiques. Il existe plusieurs méthodes pour la mesure de
la CEC, mais le principe général est souvent de déplacer
les cations qui sont adsorbés sur les sites d'échanges, puis de
saturer ces sites par un cation unique, qui est souvent l'ammonium. Ainsi, la
méthode utilisée pour la détermination de la CEC dans la
présente étude était celle de Bower (1950) in
Mathieu et Pieltain (2003).
2.2.3.7. Phosphore assimilable (P2O5)
La détermination du P2O5 a été
réalisée en faisant appel à la méthode
développée par Olsen et al. (1954). C'est une
méthode convenable pour les sols neutres ou faiblement calcaires.
50
2.2.4. Méthodes d'évaluation de
minéralisation d'azote dans le sol
La détermination de la minéralisation de N pour
la présente étude a été réalisée en
appliquant les techniques d'incubation aérobie et anaérobie comme
suit :
2.2.4.1. Incubation anaérobie
· Réactifs
V' Chlorure de potassium (KCl) 4 M V' Acide sulfurique (H2SO4)
0,005N V' Oxyde de magnésium (MgO) V' Acide borique (Indicateur)
· Procédure
Cinq grammes du sol pour chaque échantillon,
séchés à l'air libre ont été pesés et
mis dans les tubes à essai contenant 12,5 ml d'eau distillée
(déminéralisée). Les tubes ont été
bouchés pour atteindre les conditions anaérobies puis
installés dans l'étuve à une température de 40
#177; 1°C (Waring et Bremner, 1964). La période d'incubation
était de 0 (avant l'incubation où les analyses étaient
effectuées immédiatement), puis 1, 2, 3 et 4 semaines.
Après l'incubation, le contenu des tubes a été
transféré quantitativement dans le tube de distillation par
rinçage à 12,5 ml de KCl 4N afin d'extraire le N
minéralisé (N-NH4+) lors d'incubation. La distillation
a été effectuée à l'aide du MgO (calciné
à 600°C) jusqu'à obtenir 30 ml de la solution (25 ml du
distillat + 5 ml de l'indicateur). Le titrage a été
réalisé à l'aide de H2SO4 0,005N où N
minéralisé pour les échantillons du sol était
calculé comme suit :
N-NH4+ (mg/kg) = [(Vi -Vt) * MN * NH2SO4 *
1000]/p
Où :
Vi = volume de H2SO4 utilisé pour l'échantillon i
en ml
Vt = volume de H2SO4 utilisé pour le témoin en
ml
MN = masse molaire de N (14 gmol-1)
NH2SO4 = normalité de H2S04
p = prise de l'échantillon du sol en g
51
2.2.4.2. Incubation aérobie
? Réactifs
V' Chlorure de potassium (KCl) 2 M
V' Acide sulfurique (H2SO4) 0,005N
V' Oxyde de magnésium (MgO)
V' Alliage de Devarda
V' Acide borique + méthyle rouge (Indicateur)
? Procédure
La préparation des échantillons à
analyser a commencé par le pesage de 15 g de sol qui ont
été placés dans les flacons puis recouverts par des films
plastiques percés pour créer des conditions d'aération du
sol. À ces échantillons, l'eau distillée, dont la
quantité a été déterminée au
préalable, était ajoutée pour garder l'humidité du
sol à 75 % de l'humidité à la capacité au champ
(HCC), aussi déterminée au préalable pour chaque
échantillon, pour favoriser le processus de minéralisation.
Ensuite, les échantillons ont été placés dans
l'incubateur à une température de 27 #177; 1°C. La
période d'incubation allait de 0 à 21 semaines (0, 1, 2, 3, 6, 9,
12, 15, 18, 21, 21) où la vérification de l'humidité des
échantillons se faisait chaque semaine par le pesage pour remplacer
l'eau perdue par évaporation. La préparation des
échantillons pour S0 (semaine 0) était faite immédiatement
en les mettant dans les boites en plastique de 250 ml de volume et dans
lesquels 100 ml de KCl 2M ont été ajoutés. Les
échantillons étaient ensuite agités mécaniquement
pendant une heure pour favoriser l'extraction des ions d'ammonium
adsorbés aux colloïdes. Après l'agitation le mélange
a été reposé et décanté pendant 30 minutes
et puis l'on a passé à une filtration. Le filtrat destiné
aux analyses était ensuite placé dans le
réfrigérateur.
L'analyse consiste à prélever un aliquote de 20
ml que l'on a placé dans un tube de distillateur Pro-Nitro. Dans cette
procédure, le MgO (premièrement) puis l'alliage de Devarda, un
agent réducteur, ont été ajoutés dans l'aliquote
pour séparer les deux formes de N inorganique (NH4+ et NO3 -
respectivement). 25 ml de distillat pour chacun des deux cas
précédents étaient collectés dans l'erlenmeyer
contenant 5 ml de la solution indicatrice d'origine d'acide borique. Cela
était suivi par le dosage du mélange par l'acide H2SO4 0,005N
où le N (N-NH4+ + N-NO3-) minéralisé
était calculé comme suit :
N-NH4+ + N-NO3- (mg/kg) = [[(Vi
-Vt) * MN * NH2SO4 * 1000]/p] * f
52
Où :
Vi = volume de H2SO4 utilisé pour l'échantillon i
en ml
Vt = volume de H2SO4 utilisé pour le
témoin en ml
MN = masse molaire de N (14 gmol-1)
NH2SO4 = normalité de H2S04
p = prise de l'aliquote
f = facteur de correction de l'humidité = 100/(100 + H%
à la sortie de l'incubateur)
2.2.4.3. Cinétique de minéralisation d'azote
(Modélisation)
Les valeurs de N0 et de k ont été estimées
en utilisant l'équation de premier ordre pour la cinétique de
minéralisation de N qui s'exprime comme suit:
log10 (N0 - Nm) = - Kt/2,303 + log10 N0
Y = Ax + B
Où :
N0 = potentiel de minéralisation de N en mg/kg
Nm = quantité de N minéralisée au
temps t en mg/kg
K = constante de vitesse minéralisation en
semaine-1
t = temps en semaines
2,303 = facteur de conversion du logarithme
népérien (ln) au logarithme décimal
(log10)
2.2.5. Analyses statistiques
L'importance des différences entre les moyennes des
propriétés du sol pour les échantillons
prélevés aux sites incendiés et les témoins
(différences au sein de chaque site pris individuellement) a
été évaluée en utilisant le test de Student pour
les échantillons appariés. Pour étudier les effets
d'état du site (2 niveaux : incendié et
non incendié) et/ou de site (4 niveaux : I, II,
III et IV, indépendamment de l'état de
chacun), les données ont été analysées sur ANOVA
à deux critères (facteurs) de classification. Ainsi, les tests a
posteriori (post-hoc) de Tukey (HSD) ont été utilisés pour
déterminer les sources de variation dans les cas où il y'avait de
différences significatives entre les moyennes. L'analyse des
données a été faite à l'aide des logiciels
Microsoft Excel 2013 et IBM SPSS version 21,
53
TROISIÈME PARTIE : RÉSULTATS ET
DISCUSSIONS
1. Étude pédologique des sols pour les
différents sites échantillonnés 1.1. Description des
caractéristiques morphologiques et chimiques
Les propriétés physiques et surtout chimiques du
sol sont complexes, souvent liées de façon non linéaire,
et en même temps elles sont spatialement et temporellement dynamiques.
Leur distribution verticale dans les différents horizons du profil de
sol influence la capacité inhérente de ce dernier à
fournir des éléments nutritifs pour les plantes. Il convient de
signaler que le profil du site II n'a pas présenté l'horizon (B),
donc l'on n'a considéré que les profils des sites I et III pour
l'étude de la distribution verticale des propriétés du
sol. (pour rappel, le profil III couvre les sites III et IV).
1.1.1. Caractéristiques morphologiques et
physiques
La description des caractéristiques morphologiques des
profils des sols pour les sites étudiés se présente dans
la partie Annexe 3.
La couleur peut indiquer la composition du sol et donner des
indices sur les conditions auxquelles le sol est soumis. La couleur des sols
étudiés (des horizons A et (B) était essentiellement
jaunâtre à rougeâtre, indiquant ainsi la présence des
oxydes de fer et donc la dynamique de fer.
Les sols étaient assez poreux présentant en
grande partie la texture argilo-sableuse offrant ainsi un bon moyen pour
l'infiltration ainsi que la rétention de l'eau.
En ce qui concerne la granulométrie, le passage de
l'horizon A à l'horizon (B) n'a pas présenté des
résultats surprenants avec la proportion d'argile augmentant. Ceci est
à prévoir car le risque d'érosion et transport de ces
particules fines est atténué dans les horizons inferieurs du
profil du sol. Dans tous les cas (sites) le sable était dominant, sa
proportion changeant légèrement de A à (B).
1.1.2. Caractéristiques chimiques
Sauf pour le pH du sol qui a légèrement
augmenté, les niveaux des autres propriétés chimiques ont
baissé en fonction de la profondeur du sol, c'est-à-dire en
passant de A à (B).
Le pH (eau), dans l'horizon A, était acide sous les
sites I et III, tandis qu'il était légèrement acide sous
le site II. Le passage à (B) n'a pas eu d'effets considérables
sur le pH, ce dernier, malgré l'augmentation, est resté acide et
légèrement acide respectivement
54
pour les sites I et III. L'augmentation est
généralement attribuée au phénomène de
lixiviation et de translocation d'éléments basiques (cations
basiques) dans les conditions de précipitations importantes. En effet,
les horizons inferieurs sont moins susceptibles à ces
phénomènes où l'accumulation de certains
éléments tels que le calcium est favorisée. Ceci
entraîne l'augmentation du pH au niveau de ces horizons et donc offre
l'explication la plus probable dans notre cas, étant donné que la
région connaît de fortes précipitations pendant la
période hiver-printemps, suivies de longues périodes de
sécheresse en été.
La MO, le C et le N, dont les teneurs étaient assez
faibles, ont évolué de la même façon, leurs niveaux
baissant en passant de A à (B). Cela n'est pas surprenant puisque les
trois sont intrinsèquement liés. L'effet de profondeur du sol sur
l'évolution de ces paramètres était plus marqué
sous le site I par rapport au site III (Figure 6).
|
C total et N total
|
Horizon A Horizon (B)
|
|
2.00
1.75
|
|
-69,39%
|
-36,84%
|
-51,17%
|
|
-37,50%
|
|
|
|
1.50 1.25 1.00 0.75 0.50 0.25 0.00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I II
C total
|
III
|
I
|
II
N total
|
III
|
%
Figure 6: Profil de distribution de C total et
de N total dans le sol
La diminution des contenus MO, de C total et de N total
lorsque l'on passe des horizons supérieurs aux horizons inferieurs est
un constat qui a été fait dans de nombreuses études (Sdej
et Przekwas, 2008; Hiederer, 2009; Guillaume et al., 2015). Ainsi, ces
dernières ont montré que la décomposition de la MO est
accentuée en profondeur, ce qui peut expliquer les faibles contenus de
ces composantes (MO, C et N) dans l'horizon B. Le rapport C : N, qui est
étroitement lié à ces propriétés,
était faible, présentant une faible diminution, de 5,74 à
3,59 sous le site I tout en restant inchangé sous le site III, et donc
pourrait aussi expliquer cette observation de décomposition
accentuée dans les horizons inferieurs.
Pour la CEC, l'on a observé une baisse allant
jusqu'à -10,80 meq/100 g, donc de -53,73% (site III), en passant de
l'horizon A à l'horizon (B). Cette baisse avec l'augmentation de la
profondeur du sol pourrait avoir été attribuée à la
fois à l'évolution
55
de MO dont le contenu a baissé et à
l'altération des roches sur place, plutôt que celle des argiles
qui ont présenté une augmentation.
Concernant les niveaux de S (? bases échangeables), ils
n'ont pas changé de façon considérable en passant de
l'horizon A à (B) sous les deux sites, présentant respectivement
de faibles augmentation et diminution. Le Mg2+ est le seul cation
qui a présenté une augmentation de l'horizon A à (B) sous
tous les sites. Sauf pour le Mg2+ sous les sites I et III, et le
Na+ sous le site I, les niveaux des autres cations ont baissé
dans l'horizon (B) par rapport à A. L'augmentation observée,
telle expliquée précédemment (cas du pH) est
attribuée au lessivage de cations lors des évènements
pluvieux et également à l'altération des roches sur place
d'où la libération des cations.
Les niveaux du phosphore assimilable ont également
diminué de A à (B), le site I présentant la diminution la
plus marquée d'environ -66,67%.
Dans l'ensemble, ces résultats montrent que les sols,
sauf pour le site II, étaient assez bons en termes de fertilité
chimique. Le site II étant situé sur la pente et dont le
sous-bois était tres faible, subit régulièrement les
processus de transport (érosion) et donc la redistribution hors site des
éléments nutritifs.
1.2. Classification des sols
Les processus biogéochimiques tels que la
minéralisation de N et le stockage du C dans le sol varient en fonction
de type du sol. Dans la présente étude, l'on a classifié
les sols en fonction de leurs caractéristiques morphologiques, chimiques
et de substrat de leur origine. Selon la classification française, l'on
a distingué deux classes de sols à savoir la classe des sols
à sesquioxyde de fer (sites I, III et IV) et celle des sols peu
évolués (site II). Cette distinction a été faite en
se basant sur certains critères tels que la couleur du sol, le profil du
sol, la position du site en fonction de la pente, le substrat etc. Ainsi, les
sites I, III et IV présentent les sols de couleur jaunâtre
à rougeâtre, ce qui a permis d'avoir l'idée sur leurs
classes. Il convient de signaler que l'on a observé les taches
d'hydromorphie au niveau du profil du site III.
En ce qui concerne les sous-classes ainsi que les groupes et
les sous-groupes, les sites I, III et IV relevaient tous de la sous classe
fersialitique sans réserve calcique, lessivé et appauvri au site
III et IV, et légèrement hydromorphe en profondeur au site I.
Concernant le site II, il appartenait de la sous-classe non climatique et de
groupe régosolique d'apport colluvial.
56
2. Effet des incendies sur les propriétés
physicochimiques du sol 2.1. Propriétés physiques du sol
La distribution spatiale des propriétés du sol
dans le profil du sol détermine, dans une large mesure, l'ampleur des
changements survenant lors des incendies. Les propriétés
situées sur (ou près de) la surface du sol sont plus susceptibles
aux modifications car elles sont directement exposées à la
chaleur dégagée lors des incendies. Ainsi, pour les sites
étudiés, le Tableau 8 présente les
propriétés physiques du sol.
Tableau 8 : Les caractéristiques
physiques des sols
|
Propriétés
|
Sites
|
|
|
I
|
II
|
III
|
IV
|
Pvaleur
|
|
Granulométrie
|
Argiles
|
35.00 #177; 0,00 bc
|
26,67 #177; 2,89 ab
|
40,00 #177; 5,00 c
|
18,33 #177; 5,77 a
|
0,0021**
|
|
(%)
|
(31,67 #177; 7,64 b)
|
(20,00 #177; 0,00 a)
|
(26,67 #177; 2,89 ab)
|
(16,67 #177; 2,89 a)
|
|
|
Limons
|
38,68 #177; 2,90 c
|
32,87 #177; 1,71 bc
|
26,23 #177; 2,21 ab
|
15,38 #177; 7,78 a
|
0,0318*
|
|
(%)
|
(36,07 #177; 9,36 ab)
|
(66,32 #177; 23,70 b)
|
(36,60 #177; 1,86 ab)
|
(11,03 #177; 2,57 a)
|
|
|
Sables
|
26,32 #177; 2,90 a
|
40,47 #177; 1,98 bc
|
33,77 #177; 4,83 ab
|
66,28 #177; 2,14 c
|
0,4239ns
|
|
(%)
|
(32,27 #177; 1,75 a)
|
(13,68 #177; 23,70 a)
|
(36,73 #177; 4,36 a)
|
(72,30 #177; 1,13 b)
|
|
|
Texture
|
argilo-limoneuse
|
limoneuse
|
argileuse
|
sablo-limoneuse
|
|
|
(argilo-limoneuse)
|
(limoneuse)
|
(limoneuse)
|
(sablo-limoneuse)
|
|
|
DA (g/cm3)
|
0,78 #177; 0,24 a
|
0,71 #177; 0,29 a
|
0,86 #177; 0,11 a
|
0,99 #177; 0,09 a
|
0,1512ns
|
|
(0,72 #177; 0,08 a)
|
(0,55 #177; 0,02 a)
|
(0,70 #177; 0,16 a)
|
(0,97 #177; 0,06 b)
|
|
NB : x #177; écart type ; Les valeurs
entre parenthèses représentent les données des sites
témoins correspondant à chacun des sites incendiés alors
que les différentes lettres indiquent les différences
significatives entre les sites selon le test de Tukey - HSD. Les
différences entre les sites incendiés et non incendiés :
(ns) non significative; (*) p < 0,05; (**) p < 0,01; (***) p <
0,001
2.1.1. Granulométrie et texture
Les résultats des analyses de la granulométrie
sont présentés sur le Tableau 8. La proportion
d'argiles sous les sites incendiés variait de 18,33 % (site IV) à
40 % (site III) tandis qu'à leurs sites témoin celle-ci
était comprise entre 16,67 % (site IV) à 31,67 % (site I).
Concernant les limons qui dominaient dans trois des quatre sites
échantillonnés, leur proportion sous les sites incendiés
variait de 15,38 % (site IV) à 38,68 % (site I) tandis qu'aux sites
témoins, elle était comprise entre 11,03 % (site IV) et 66,32 %
(site II). La proportion des sables quant à elle sous les sites
incendiés variait de 26,32 % (site I) à 66,28 % (site IV) tandis
qu'aux sites témoins elle se situait entre 13,68 % (site II) et 72,30 %
(site IV). La fraction de sable élevée sous le site IV pourrait
être expliquée par
57
des effets probables de l'érosion du sol car ce site
était laissé à nu après la coupe rase, ainsi pas de
couvert végétal pour protéger les particules les plus
fines du sol de transport et de leur redistribution hors site.
Sous tous les sites incendiés, la teneur moyenne en
argiles a augmenté par rapport à leurs témoins respectifs.
Cette augmentation était hautement significative (p < 0,01 :
Annexe 2.2.1) et elle est paradoxale car les feux contribuent
généralement à la diminution de la fraction argileuse.
L'argile est la fraction la plus susceptible aux effets de température
dont l'effondrement de sa structure cristalline commence à des
températures d'environ 400 °C et la destruction complète a
lieu à 700 - 800 °C (Neary et al., 2005).
L'évolution des limons après les incendies
était contradictoire, deux sites présentant une augmentation
tandis que les deux autres ont présenté une diminution.
La proportion des sables quant à elle, excepté
pour le site II, a augmenté légèrement de façon non
significative statistiquement sous les autres sites. Les mêmes
résultats d'augmentation des sables ont été
reportés par Granged et al. (2011) dans leurs études
dans les Landes méditerranéens au sud-ouest d'Espagne. Cette
augmentation de la proportion de sable est une évolution attendue
puisque l'effet du feu, combinée avec des effets ultérieurs
d'érosion, à une tendance d'augmenter la proportion de ces
particules grossières.
En ce qui concerne la texture du sol, les résultats
sont présentés sur le Tableau 8. La texture du
sol pour les sites était dominée par le type limoneux.
Étant donné que la texture du sol est en fonction de la
proportion des différentes composantes de la terre fine, son
évolution était liée à la leur. Ainsi, le feu n'a
pas eu d'effets importants sur la texture puisque trois (I, II et IV) des
quatre sites ont présenté la même texture avant et
après le passage du feu. Ceci pourrait s'expliquer par le fait que les
feux n'étaient pas d'intensités suffisamment
élevées pour aboutir à des changements importants.
2.1.2. Densité apparente
Les résultats obtenus pour la DA, sur le
Tableau 8, montrent une faible augmentation dans l'ensemble
des sites incendiés par rapport aux sites témoins. La DA varie de
0,71 g/cm3 (site II) à 0,99 g/cm3 (site IV)
comparée avec 0,55 à 0,97 g/cm3 sous les
témoins des mêmes sites.
L'analyse de la variance a montré que le feu n'avait
pas d'effet significatif sur la variation de la DA (Annexe
2.2.1) dans les sites étudiés. Ceci était attendu
puisque
58
l'ampleur des changements en la DA est souvent liée
à la sévérité du feu, ce qui était
probablement faible dans la plupart des cas pour la présente
étude.
L'augmentation, statistiquement significative (p < 0,05 :
Annexe 2.3.1.2), sous le site III aurait pu être
liée à l'intensité du feu. Une observation des autres
propriétés analysées donne l'impression que le site
était le plus touché, chose qui est due probablement à
l'intensité supérieure du feu par rapport aux autres sites.
L'augmentation de la DA, quoique non significative
statistiquement parlant, dans l'ensemble les sites brulés, est une
évolution courante généralement liée à la
consommation de la MO ainsi qu'à la destruction des argiles. Dans le cas
de cette étude, l'augmentation de DA était probablement
liée à l'évolution de MO plutôt que celle d'argiles
qui ont présenté une augmentation. La combustion de MO
entraîne la destruction des agrégats du sol et le colmatage
subséquent des vides créés par les cendres,
résultant ainsi à cette évolution de DA (Giovannini et
al., 1988; Certini, 2005). Aussi, l'élimination de la microfaune du
sol, élément important à la création des
micropores, par les feux, peut jouer le rôle indirect de l'augmentation
de DA.
La DA du sol est presque toujours modifiée après
le passage des feux, mais même si cette modification est souvent une
augmentation, des différences importantes sont rarement
observées, sauf dans les rares occasions des feux sévères.
Il convient de noter que la DA du sol sous les sites incendiés a
tendance à revenir à des niveaux pré-incendie quelques
mois voire années à condition qu'il n'y ait pas passage des feux
de nouveau.
2.2. Propriétés chimiques du sol
La sévérité (durée et
intensité) des feux n'était pas importante pour aboutir à
des changements importants. Quoi qu'il en soit le feu a entraîné
une augmentation de la variabilité spatiale pour la plupart des
propriétés chimiques comme le montre le Tableau 9.
Sauf pour les rapports C/N et S/T, l'absence de l'interaction
significative entre le site et l'état du site (p > 0,05:
Annexe 2.2.2) pour les propriétés
étudiées signifiait que les sites d'étude ont
répondu plus ou moins de façon similaire aux effets des feux.
59
Tableau 9 : Les propriétés
chimiques du sol
|
Propriétés
|
Sites
|
Petat de site
|
|
I
|
II
|
III
|
IV
|
|
pH (H2O)
|
6,05 #177; 0,45 ab
|
6,78 #177; 0,04 b
|
5,94 #177; 0,15 a
|
6,60 #177; 0,34 ab
|
0,0002***
|
|
(5,28 #177; 0,57 a)
|
(5,83 #177; 0,54 a)
|
(5,49 #177; 0,07 a)
|
(5,98 #177; 0,16 a)
|
|
|
pH (KCl)
|
5,14 #177; 0,63 ab
|
5,86 #177; 0,07 b
|
4,67 #177; 0,28 a
|
5,89 #177; 0,40 b
|
0,0003***
|
|
(4,40 #177; 0,51 a)
|
(5,11 #177; 0,28 a)
|
(4,51 #177; 0,16 a)
|
(4,92 #177; 0,06 a)
|
|
|
Ntot (%)
|
0,47 #177; 0,18 b
|
0,15 #177; 0,04 a
|
0,24 #177; 0,04 a
|
0,14 #177; 0,00 a
|
0,0867ns
|
|
(0,29 #177; 0,10 a)
|
(0,20 #177; 0,12 a)
|
(0,14 #177; 0,01 a)
|
(0,11 #177; 0,04 a)
|
|
|
Ctot (%)
|
3,98 #177; 1,37 b
|
2,14 #177; 0,50 ab
|
1,84 #177; 0,45 a
|
1,16 #177; 0,44 a
|
0,1591ns
|
|
(4,59 #177; 1,62 b)
|
(1,53 #177; 0,33 a)
|
(3,38 #177; 1,14 ab)
|
(1,80 #177; 0,30 a)
|
|
|
MO (%)
|
6,86 #177; 2,36 b
|
3,69 #177; 0,87 ab
|
3,18 #177; 0,78 a
|
2,00 #177; 0,77 a
|
0,1601ns
|
|
(7,92 #177; 2,80 b)
|
(2,65 #177; 0,56 ab)
|
(5,83 #177; 1,97 a)
|
(3,11 #177; 0,52 a)
|
|
|
C : N
|
8,87 #177; 2,84
|
14,77 #177; 2,03
|
7,89 #177; 2,35
|
8,11 #177; 2,84
|
0,0487*
|
|
(18,66 #177; 13,84)
|
(8,88 #177; 2,88)
|
(24,18 #177; 8,08)
|
(17,71 #177; 5,06)
|
|
|
P2O5 (mg/kg)
|
17,30 #177; 6,34 a
|
10,40 #177; 8,28 a
|
7,00 #177; 7,53 a
|
5,00 #177; 2,77 a
|
0,3162ns
|
|
(8,40 #177; 8,17 a)
|
(6,90 #177; 2,56 a)
|
(9,90 #177; 2,95 a)
|
(7,40 #177; 3,50 a)
|
|
|
CaCO3 (%)
|
1,17 #177; 1,61
|
0,07 #177; 0,12
|
-
|
-
|
-
|
|
(0,13 #177; 0,12)
|
(0,40 #177; 0,17)
|
|
|
|
NB : x #177; écart type ; Les valeurs
entre parenthèses représentent les données des sites
témoins correspondant à chacun des sites incendiés alors
que les valeurs désignées par la même
lettre ne sont pas significativement différents les uns des autres parmi
les quatre sites selon le test de Tukey-HSD.; Les
différences entre les sites incendiés et non incendiés :
(ns) non significative; (*) p < 0,05; (**) p < 0,01; (***) p <
0,001
60
(Suite) Tableau 9 : Les
propriétés chimiques du sol
|
Propriétés
|
Sites
|
Petat de site
|
|
I
|
II
|
III
|
IV
|
|
CEC (meq/100 g)
|
40,42 #177; 9,53 b
|
27,25 #177; 5,51 ab
|
32,27 #177; 9,63 ab
|
12,92 #177; 6,02 a
|
0,0777ns
|
|
(45,24 #177; 5,25 b)
|
(24,79 #177; 2,26 a)
|
(46,14 #177; 5,52 b)
|
(15,95 #177; 0,86 a)
|
|
|
Na+ (meq/100 g)
|
3,10 #177; 0,79
|
2,03 #177; 0,23
|
5,90 #177; 3,47
|
3,83 #177; 3,03
|
0,2809ns
|
|
(4,67 #177; 2,46)
|
(2,43 #177; 0,45)
|
(2,63 #177; 0,31)
|
(1,70 #177; 0,40)
|
|
|
K+ (meq/100 g)
|
1,77 #177; 2,80 a
|
0,80 #177; 0,62 a
|
6,80 #177; 1,56 b
|
2,47 #177; 0,47 a
|
0,0276*
|
|
(0,40 #177; 0,69 a)
|
(0,00 #177; 0,00 a)
|
(5,13 #177; 0,45 c)
|
(1,53 #177; 0,06 b)
|
|
|
Ca2+ (meq/100 g)
|
1,60 #177; 0,96
|
3,90 #177; 3,06
|
2,97 #177; 1,46
|
2,93 #177; 1,59
|
0,0298*
|
|
(2,43 #177; 2,41)
|
(1,30 #177; 0,26)
|
(0,97 #177; 0,15)
|
(0,40 #177; 0,20)
|
|
|
Mg2+ (meq/100 g)
|
0,67 #177; 0,35
|
0,40 #177; 0,17
|
0,37 #177; 0,29
|
1,13 #177; 1,31
|
0,8487ns
|
|
(0,40 #177; 0,10)
|
(0,17 #177; 0,15)
|
(0,97 #177; 0,06)
|
(1,23 #177; 1,10)
|
|
|
S
|
7,13 #177; 3,01 a
|
7,13 #177; 2,92 a
|
16,03 #177; 6,69 a
|
10,37 #177; 3,55 a
|
0,0247*
|
|
(7,90 #177; 4,65 a)
|
(3,90 #177; 0,36 a)
|
(9,70 #177; 0,79 a)
|
(4,87 #177; 1,58 a)
|
|
|
S/T
|
0,18 #177; 0,06 a
|
0,28 #177; 0,15 a
|
0,49 #177; 0,10 ab
|
0,90 #177; 0,42 b
|
0,0027**
|
|
(0,18 #177; 0,13 a)
|
(0,16 #177; 0,02 a)
|
(0,21 #177; 0,02 a)
|
(0,30 #177; 0,09 a)
|
|
NB : x #177; écart type ; S = ? (Na+,
K+, Ca2+, Mg2+) et T = CEC ; Les valeurs entre parenthèses
représentent les données des sites témoins correspondant
à chacun des sites incendiés alors que les valeurs
désignées par la même lettre ne sont pas significativement
différents les uns des autres parmi les quatre sites selon le test de
Tukey-HSD. ; Les
différences entre les sols de sites incendiés et
non incendiés : (ns) non significative; (*) p < 0,05; (**) p <
0,01; (***) p < 0,001
61
2.2.1. pH
Les valeurs de pH obtenu sont présentées sur le
Tableau 9. Le pH du sol était légèrement
acide voire neutre sous les sites incendiés, variant entre de 5,94 (Site
III) et 6,78 (Site II) tandis qu'aux sites témoins il était
modérément acide compris entre 5,28 (site I) a 5,98 (site IV).
Cette acidité du sol était attendue puisque trois des quatre
sites d'étude étaient composées de conifères dont
la litière est acidifiante par excellence. Ainsi, le pH le plus
élevé était observé au niveau du site II,
dominée par le chêne-liège (Quercus suber) avec
quelques pieds de chêne vert (Quercus rotundifolia), qui sont
tous les deux les feuillus. Des valeurs légèrement
élevées ont été enregistrées dans tous les
cas des sites incendiés par rapport à leurs témoins. La
variabilité à l'intérieur des sites incendiés
était faible avec des valeurs d'écart type comprises entre 0,04
et 0,45 (soit 0,59% à 7,44% de variabilité).
Le feu a eu l'effet très hautement significatif sur le
pH (H2O et KCl) dans l'ensemble des sites échantillonnés (p <
0,001 : Annexe 2.2.2). L'augmentation du pH que l'on a
constaté sous les sites incendiés est une évolution qui a
été reportée par plusieurs auteurs (DeBano, 1991 et 1998;
Certini, 2005; Ekinci, 2006; Verma et Jayakurma, 2012; entre autres). Elle
pourrait être attribuée principalement à une augmentation
de taux de cations basiques contenus dans les résidus de cendres, en
raison de la consommation de MO par des procédés d'oxydation lors
de l'incendie. Au niveau du sol, la dénaturation des acides organiques
due au chauffage pourrait avoir contribué également à
cette évolution de pH dans l'ensemble des sites incendiés. Le feu
s'est déclenché aussi sur ce site en 2012, ainsi deux ans avant
l'échantillonnage, et donc il est probable que le pH retournait à
des niveaux pré - incendie.
Au niveau du site II où l'augmentation du pH
était la plus forte (+0,95 unités), peut s'expliquer par le fait
que la MO issue des feuillus est plus riche que celle issue des résineux
en bases. Cette situation peut avoir lieu dans les cas des feux
d'intensité modérée à importante, ce qui se traduit
par la quantité de MO consommée et par le niveau de profondeur du
sol impacté (Verma et Jayakurma, 2012).
Il convient de signaler que l'augmentation du pH après
le passage des feux est un phénomène temporaire qui dépend
de plusieurs facteurs tels que le pH initial du sol, la quantité et la
qualité de cendres libérées ainsi que l'humidité du
climat. Le pH retourne généralement aux valeurs
pré-incendie, ce qui est en fonction du temps qui peut varier d'une
année à des décennies.
62
2.2.2. Azote total
L'effet du feu sur les pools de N dans le sol a toujours fait
l'objet de controverse. Certains chercheurs ont enregistrée une
augmentation en N total (Christensen 1973 ; Covington et Sackett 1984 ; Kovacic
et al., 1986 ; Ubeda et al., 2009), d'autres ont
trouvé qu'il diminue (DeBano et Conrad, 1978 ; DeBano et al., 1979 ;
Raison et al., 1985 ; Kutiel et Naveh. 1987) alors qu'il y a ceux qui n'ont
observé aucun changement en ces pools dans le sol (Richter et al.,
1982 ; Binkley et al., 1992 ; Knoepp et Swank, 1993).
Les résultats obtenus sur les pools de N total ainsi
que leur évolution suite au passage du feu se présentent sur le
Tableau 9 et la Figure 7. Les
quantités sous les sites incendiés variaient de 0,14 N % soit
1421,00 mg/kg (site IV) à 0,47 N % soit 4737,58 mg/kg (site I). Quant
à leurs sites témoins, ils ont présenté des valeurs
entre 0,11 N % soit 1094,80 mg/kg (site IV) et 0,29 N % soit 2921,40 mg/kg
(site I).
Le feu a eu d'effets variés mais pas significatifs
(Annexe 2.2.2) sur le N total au niveau des quatre sites
étudiés avec seulement les sites I et III (+62,17% et +71,43%
respectivement) présentant un changement de plus de 50 % (Figure
7). L'une des principales raisons pour lesquelles les feux
n'entraînent pas de changements significatifs sur les pools de N total
est que les pertes dues aux feux, à une certaine profondeur
d'échantillonnage, sont relativement faibles par rapport à la
quantité totale de N contenu dans sol. L'incohérence de la
profondeur d'échantillonnage, qui vient du fait que la couche de sol la
plus influencée par le feu se limite aux quelques centimètres
supérieurs du sol, pourrait aussi avoir contribué à la
réponse non significative des pools de N total. D'autres facteurs (ex.
humidité du sol, hétérogénéité
spatiale, déposition et transformations de N etc.) ainsi que leurs
variabilités compliquent aussi la variation temporelle de N total
après le passage de l'incendie et peuvent être responsables de
l'incohérence des résultats obtenus, en même temps
diminuant le pouvoir statistique de détecter les changements des pools
de N total dans le sol incendié.
+62,07%
-25,00%
+71,43%
+27,27%
Influence des incendies sur l'azote total
0.5
I II III IV
Site
Non incendiés Incendiés
Azote total(%)
0.4
0.3
0.2
0.1
0.0
63
Figure 7 : L'évolution de N total dans le
sol suite aux incendies de forêts
La diminution de N total observée sous les sites II,
quoique non significative, pourrait être liée à des
facteurs tels que la nature du couvert végétal, l'érosion,
l'immobilisation par les microorganismes, l'assimilation par les plantes etc.
plutôt qu'aux effets directes de du feu tels que la combustion importante
de MO et la volatilisation de N. Ces derniers processus affectent souvent les
horizons organiques plutôt que la partie minérale du sol de
laquelle le prélèvement des échantillons était
fait.
En ce qui concerne les sites I, III et IV, l'augmentation de N
total, quoique non significative (Annexe 2.3.2.1),
était en accord avec les résultats de Ubeda et al.
(2009). La combustion de la MO (carbone) conduit
généralement à une baisse de rapport C : N (plus
marquée sous ces sites : 2.3) conduisant ainsi au
phénomène de `flush' de N assimilable puisque l'activité
microbienne est favorisée dans ces conditions. Ceci contribue ainsi
à l'augmentation des pools de N total, tenant en compte qu'ils sont
constitués de N organique et inorganique. La volatilisation ainsi que
d'autres processus conduisant à des pertes de N tels que
l'érosion auraient été minimes par rapport au
scénario expliqué précédemment conduisant ainsi
à l'augmentation de N total sous ces sites après le passage des
feux.
64
2.2.3. Carbone total et matière organique
Les deux éléments, le C total et la MO
évoluent de le même sens. Excepté pour le site II où
les feux ont provoqué une augmentation de ces éléments,
tous les autres sites ont présenté une diminution après le
passage des feux. En effet, l'évolution de C, qui est directement
lié à la MO, est bien détaillée dans la partie 3
(séquestration de carbone).
2.2.4. Rapport C : N
Les résultats du rapport C : N sont
présentés sur le Tableau 9. Ainsi, le rapport C
: N sur les sites incendiés variaient de 7,89 (site III) à 14,77
(site II) alors qu'aux sites témoins, la variation était de 8,88
(site II) à 24,18 (site III). Étant donné que ce rapport
est directement lié à des concentrations de N total et COS total,
leur évolution après les incendies a contribué à
ses changements sur les sites d'étude. Ainsi, en se basant sur le
référentiel pédologique (1995) in Ambassa (2005),
les sols des sites étudiés sont de qualité moyenne voire
active en terme de décomposabilité (minéralisation) des
composés organiques.
Le feu a eu un effet significatif (p < 0,05 :
Annexe 2.2.2) sur ce paramètre où l'on a
observé que l'incendie a causé une diminution au niveau des sites
I, III et IV alors que le site II a présenté une augmentation.
C'était une évolution attendue puisque le site II était le
seul ayant présenté une augmentation de CO total après le
passage du feu. L'évolution de rapport C : N, étant donné
que ce dernier est directement corrélé au carbone et à
l'azote, a suivi leur évolution sous les sites incendiés.
2.2.5. Phosphore assimilable
Les résultats obtenus se présentent sur le
Tableau 9 où les concentrations de P2O5 sous les sites
brûlés varient de 5 à 17,30 mg/kg, respectivement aux sites
IV et I, comparée avec 6,90 mg/kg (site II) à 9,90 mg/kg (site
III) au niveau des sites témoins. Ainsi, une diminution a
été enregistrée, après le passage d'incendie, sous
deux sites (III et IV) alors qu'une augmentation a été
observée au niveau des sites I et II. Dans l'ensemble des sites, ni le
feu, ni le site, ni l'interaction entre ces deux n'ont contribué
à un changement significatif en concentration de P2O5 à partir
des résultats obtenus (Annexe 2.2.2). Les tests
supplémentaires au sein de chaque site ont montré que seulement
le site I présentait une différence significative entre les
moyennes (P2O5) du site incendié par rapport au site témoin
(Annexe 2.3.2.4).
65
Les résultats d'augmentation de P2O5 sous les sites I
et II coïncident avec ceux d'Ekinci (2006) qui a observé une
différence hautement significative sous les pinèdes
incendiées en Turquie. Ceci est caractéristique des feux à
températures faibles qui provoquent des dépôts des cendres
et d'autres résidus riches en phosphore. Quant à la diminution
observée au niveau des sites III et IV, elle pourrait probablement
être lié à l'érosion et redistribution des cendres
hors site par le vent et/ou les eaux de ruissellement après le passage
du feu.
2.2.6. Calcaire total (CaCO3)
Étant donné que les sites
échantillonnés sont composés des sols
(légèrement) acides, la teneur des échantillons du sol en
calcaire était très faible voire nul dans certains cas
(Tableau 9). Il convient de noter que le feu a tendance
d'augmenter la teneur du sol en CaCO3, selon certaines études y compris
celle qui a été faite par Campo et al. (2008) dans la
zone semi-aride méditerranéenne de Valence (Espagne). Ainsi, ils
ont constaté que le feu a conduit à une augmentation de CaCO3
ainsi que de MO, et par conséquent l'agrégation des particules du
sol. Dans notre étude, cet effet n'était pas visible à
cause de l'absence des carbonates dans le sol.
2.2.7. Capacité d'échange cationique
(CEC)
Les résultats obtenus montrent une diminution suite au
passage du feu sur trois sites (I, III et IV), les valeurs du site II restant
à peu près les mêmes (Tableau 9). Au
niveau des sites incendiés les valeurs de CEC variées de 12,92
à 40,42 meq/100 g de sol alors qu'aux sites témoins la variation
était de 15,95 à 46,14 meq/100 g de sol (Tableau
9). L'analyse de la variance indique qu'il n'y avait pas de
différence significative parmi les sites (Annexe 2.2.2)
alors qu'on analysant les moyennes de CEC obtenues par le test de Student au
sein de chaque site, l'on remarque une différence
légèrement significative seulement au site I (Annexe
2.3.2.2). Cette évolution de CEC suite aux incendies peut
être un phénomène commun qui est proportionnel aux effets
du feu sur la MO et, dans une moindre mesure, d'argile minérale.
Sous les sites I, III et IV la diminution enregistrée
sous l'effet de l'incendie, même si non significative, était
principalement liée à la consommation de MO dont la
corrélation avec la CEC était très hautement significative
(r = 0,758 : p < 0,001). L'érosion du sol qui est
caractéristique de la zone d'étude pourrait également
contribué à cette évolution. Ces phénomènes
contribuent à la diminution des sites d'échange pour les
cations.
66
L'évolution des argiles suite au passage du feu n'a
probablement pas joué de rôle sur la diminution de niveaux de CEC
car ces dernières (argiles) ont présenté une augmentation
sous tous les trois sites (Tableau 8).
Concernant le site II qui a présenté une
augmentation, tout en étant un phénomène rare après
un incendie serait liée au dépôt de substrats riches en
composés organiques. Cela survient généralement lorsque
l'on assiste à un feu de gravite faible tel qu'il était le cas de
ce site qui a subi le défrichement plutôt que l'incendie
proprement dit.
2.2.8. Bases échangeables (S) et le rapport S/T
Les cations majeurs présents dans le sol qui sont
touchés par le feu comprennent Na+, K+,
Mg2+ et Ca2+. Ce sont les bases échangeables qui
bien qu'ils ne soient pas habituellement déficientes dans la plupart des
sols forestiers, leur libération ainsi que leur disponibilité
sont favorisées par le passage des feux.
Les résultats obtenus sont présentés sur
le Tableau 9. Ainsi, les valeurs de S au niveau des sites
incendiés étaient comprises entre 7,13 meq/100 g (sites I et II)
et 16,03 meq/100 g (site III). Comparé aux valeurs des sites
témoins, l'on a observé que le feu a provoqué une
augmentation sous trois sites (II, III et IV), la seule légère
diminution étant observée au niveau du site I. Ainsi, l'analyse
de la variance a montré que le feu a eu un effet significatif (p <
0,05 : Annexe 2.2.2). Ainsi, en analysant les résultats
au sein de chaque site par le test de Student, seul le site IV présente
une différence significative (p < 0,05 : Annexe
2.3.2.3) entre les parties incendiées (10,37 meq/100g) et non
incendiées (4,87 meq/100g). L'augmentation des Bases échangeables
dans le sol est une tendance commune survenant après le passage des
incendies et elle a été observée par plusieurs auteurs
dont DeBano et Conrad (1978), Kutiel et Inbar (1993), entre autres. Ainsi, elle
peut s'expliquer par la combustion de la MO et la libération des cendres
minérales au niveau du sol.
En ce qui concerne le site I, la diminution des Bases
échangeables concorde avec les résultats de Kutiel et Shaviv
(1992) qui ont aussi observé la même évolution sous une
forêt de pin immédiatement après le passage du feu. Cette
évolution, dans les horizons O et A, est souvent liée aux
processus subséquents d'érosion accélérée,
de ruissellement et de lessivage, conduisant ainsi aux pertes des cendres qui
se sont accumulées à la surface du sol après le feu.
Étant donné que le rapport S/T est fonction de
CEC et de bases échangeables, son évolution suite au passage des
feux était régie par celle de ces deux dernières.
Ainsi,
67
l'augmentation des cations basiques couplée avec la
baisse des niveaux de CEC sous les sites brûlés a conduit à
une augmentation de la saturation en bases, tel traduit par les rapports S/T
(Tableau 9). Le site IV a présenté la plus forte
augmentation de 0,30 à 0,90 (soit 200%) alors que le site I n'a pas
présenté de changement. Quoi qu'il en soit, les résultats
obtenus montrent que les sites étaient principalement
désaturés avant les feux et oligotrophes (à l'exception de
site IV) après le passage des feux.
3. Effets des incendies sur la séquestration du
carbone dans le sol
La détermination précise d'évolution des
stocks de C est une condition préalable pour comprendre le rôle
des sols dans le cycle global du C et de vérifier les variations de
stocks en raison de pratiques humaines. L'un des phénomènes
provenant des pratiques humaines est le déclenchement des incendies de
forêts qui peut aboutir à des variations des stocks de C dans les
sols forestiers. Étant donné que le pool pédologique est
le pool terrestre le plus important, ces évolutions ainsi que les
modifications des propriétés du sol dues aux incendies peuvent
avoir des implications importantes sur les sols forestiers en tant que puits de
C.
Tableau 10 : L'évolution des stocks de
C organique total dans le sol des sites étudiés
|
Sites
|
I
|
II
|
III
|
IV
|
|
COstock
|
57,23 #177; 4,78 b
|
28,68 #177; 8,68 a
|
31,37 #177; 6,68 a
|
22,56 #177; 7,02 a
|
|
(t/ha)
|
(65,23 #177; 19,88 b)
|
(16,91 #177; 3,33 a)
|
(49,51 #177; 28,26 ab)
|
(35,01 #177; 5,19 ab)
|
|
ÄCOstock (%)
|
- 12,28 ns
|
+ 69,59 ns
|
- 36,65 ns
|
- 35,57 ns
|
Les valeurs entre parenthèses représentent les
données des sites témoins correspondant à chacun des sites
incendiés alors que les différentes lettres indiquent les
différences significatives entre les sites selon le test de Tukey - HSD.
Les différences entre les sols de sites incendiés et non
incendiés : (ns) non significative; (*) p < 0,05; (**) p < 0,01;
(***) p < 0,001
Les résultats obtenus sur les stocks de C se
présentent sur le Tableau 10 ainsi qu'à la
Figure 8 pour l'appréciation visuelle de leur
évolution suite au passage du feu. Les stocks de C variaient de 22,56
t/ha (site IV) à 57,23 t/ha (site I) sous les sites incendiés
alors qu'aux sites témoins, ils étaient compris entre 16,91 et
65,23 t/ha respectivement sous les sites II et I. La variabilité des
stocks de carbone au sein des sites incendiés est assez faible, avec des
écarts types, variant entre 47,80 t/ha et 70,24 t/ha (soit 8,35%
à 31,14% de variabilité) respectivement sous les sites I et IV
alors que sous les sites témoins, ils se situent entre 5,19 t/ha et
28,26 t/ha (soit 14,81% à 57,08% de variabilité)
68
respectivement sous les sites IV et III. En ce qui concerne la
variabilité inter sites, l'on a observé une différence
très hautement significative (p < 0,001 : Annexe
2.2.3) parmi les sites, avec le feu semblant diminuer
légèrement cette variabilité (Tableau
10).
Le feu semble avoir eu un effet négatif sur les stocks
de C, trois (I, III et IV) des quatre sites d'étude présentant
une diminution. Les sites III et IV sont ceux qui ont connu plus de pertes en
stocks de C présentant respectivement la diminution de 36,65% (-18,14
t/ha) et 35,57% (-12,46 t/ha) des stocks initiaux de C (Tableau 10 et
Figure 8). En ce qui concerne le site (II) ayant
présenté une augmentation, les gains sont de l'ordre de 69,59% de
stock initial soit +11,77 t/ha. Bien que ces changements aient
été observés, ils ne sont pas significatifs comme le
montre le test d'analyse de la variance (Annexe 2.2.3). Cette
observation pourrait s'expliquer par le fait que le feu n'était pas
suffisamment intense pour provoquer des changements considérables dans
les stocks de carbone organique sous ce site. Les températures maximales
atteintes lors de la combustion ainsi que la durée des feux sont des
facteurs importants qui entrent en jeu. Les études ont montré que
la plupart des pertes en C des sols ont lieu lorsque le feu est localisé
sur une surface limitée, pendant une longue période de temps
permettant le transfert de chaleur dans le sol minéral. Dans la
présente étude, l'on pourrait conclure que les changements ont
été essentiellement limités à la partie
supérieure du sol étant donné que l'intensité du
feu était probablement faible à modérée avec une
durée courte (moins de 24 heures pour la plupart des cas).
Les pertes significatives de C après le passage des
feux dans le sol minéral sont assez rares, sauf dans les cas où
les feux d'intensités élevées sont impliqués.
Ainsi, dans ces conditions, les pertes de C organique sont essentiellement
liées à la combustion de la MO, l'oxydation et donc la
volatilisation du C et l'élimination et/ou la redistribution des cendres
avant qu'elles soient incorporées dans le sol minéral.
Étant donné que les feux d'intensités
élevées peuvent ne pas avoir eu lieu dans ces sites, alors la
diminution des stocks de C dans le sol minéral sous les sites I, III et
IV, notamment par la volatilisation, qui commence de 500 à 700 °C,
pourraient avoir été assez limitées.
D'autres phénomènes, plus probables, pouvant
expliquer les pertes en stocks de C dans le sol après les incendies sont
ceux d'érosion par le vent et/ou ruissellement. La combustion de
végétation, en particulier le sous-bois, rend le sol nu et
susceptible aux processus subséquents d'érosion et de
ruissellement. La zone d'étude se trouve dans une région dont la
topographie est très accidentée et dont le substrat est
très friable. À ces faits s'ajoute les évènements
pluvieux qui peuvent favoriser les processus d'érosion du sol,
étant donné que la région soit parmi les plus
arrosées au Maroc. En effet, les valeurs les
69
plus élevées au Maroc en termes d'érosion
ont été enregistrées dans cette région. Cela
pourrait expliquer le cas des sites III et IV (ayant subi une coupe rase) qui
se trouvent dans la même zone de Bab Taza (~ 1 km l'un de l'autre) et
dont le sous-bois était presque non existant (Image sur
Annexe 5). En outre, ces deux sites ont également
présenté la plus de perte en stocks de C par rapport aux autres
sites (Tableau 10 et Figure 8). Ainsi, cette
explication est en accord avec de nombreuses études. Kimble et al.
(2001) aux USA ont enregistré des pertes de COS dues à
l'érosion dans les 25 premiers cm du profil du sol sous quatre sites.
De nombreuses études ont montré que la
diminution en stocks de C par érosion et ruissellement se fait par
déplacement ainsi que la redistribution de COS. La dégradation
des agrégats du sol favorise la minéralisation de CO, ce qui
accentue la libération ainsi que les pertes de C dans
l'atmosphère (Lal, 1995). Un autre facteur favorisant la
minéralisation de CO est l'augmentation de la température du sol
en absence de sous-bois car le sol est plus exposé au soleil. Cela
pourrait aussi expliquer les pertes en stocks de C sous les sites III et en
particulier IV dont le peuplement a subi une coupe rase.
Influence des incendies sur les stocks de
carbone
organique
-12,28% +65,59% -36,65% -35,57%
700
COS (t/ha)
400
600
500
300
200
100
0
Site
I II III IV
Non incendié Incendié
Figure 8 : L'évolution des stocks de C
dans le sol suite aux incendies de forêts
La teneur du sol en argile pourrait également
être appelé à expliquer l'évolution des stocks de C
après le feu, en particulier dans le site II qui a
présenté une augmentation. Les argiles présentent une
grande stabilisation de la COS en protégeant la MO des
décomposeurs (Duchaufour, 1983; Six et al., 2002). Cependant,
le cas des sites I, III et
70
IV était paradoxal car l'on a observé une
diminution en stocks de C malgré l'augmentation de la teneur en argiles
pour chacun d'eux.
Au niveau du site II, l'augmentation des stocks de C pourrait
s'expliquer par le fait que le site était défriché et dont
le feu était probablement de faible intensité. Ces
résultats coïncident avec ceux de plusieurs auteurs y compris
Pardini et al. (2004) sous un peuplement de chêne-liège
en Espagne, Kara et Bolat, (2009) sous une plantation de pin noir en Turquie et
Zhao et al. (2012) en Chine. Cette évolution est souvent
liée à une faible combustion de la MO ainsi que du C suivi par
l'accumulation et l'incorporation des dépôts (résidus)
partiellement brulés dans la surface du sol. Ainsi, les particules de
charbon résultant de la combustion incomplète de la biomasse
peuvent être incorporées dans la matrice du sol résultant
à l'augmentation et au stockage du C.
Cette étude n'a pas signalé d'effets
considérables des incendies sur la séquestration du carbone dans
le sol. Ce sont des observations qui sont courantes où les incendies
ayant eu lieu étaient de faible gravité à
modérée. Considérant que ce fut généralement
le cas dans la présente étude, les résultats obtenus
n'étaient pas tout à fait surprenants.
4. Effets des incendies sur la minéralisation de
l'azote dans le sol 4.1. Incubation anaérobie
Le Tableau 11 et la Figure 9
présentent les quantités de N-NH4 +
minéralisées après 1, 2, 3 et 4 semaines. La
quantité de N minéralisée après la première
semaine d'incubation variait de 24,36 mg/kg soit 1,71 % de N total (site IV)
à 49,65 mg/kg soit 1,05% de N total (site I). Concernant les sites
témoins correspondants, N-NH4 + variait de 9,94 mg/kg (0,72 % de N
total) sous le site III à 21,89 mg/kg (0,75 % de N total) sous le site
I. À la fin de la période d'incubation (4 semaines) la
quantité de N-NH4+ minéralisé avait
augmenté considérablement dans l'ensemble des sites variant de
36,73 mg/kg (2,58 % de N total) sous le site IV à 118,21 mg/kg (2,50 %
de N total) sous le site I. C'est une évolution qui a été
également observée au niveau des sites témoins avec les
quantités de N-NH4+ sous les mêmes sites se situant
entre 18,99 mg/kg et 61,83 mg/kg soit respectivement 1,73 % et 2,12 % de N
total.
La variabilité à l'intérieur des sites
était faible (site IV) à importante (site II), avec les
écarts-types allant de 4,53 mg/kg (soit 14,64% de variation) à
29,28 mg/kg (soit 77% de variation) respectivement sous ces sites
(Tableau 11). Le feu semble avoir eu d'effets
71
importants sur cette variabilité telle montrée
par l'augmentation des écarts-types dans l'ensemble des sites
d'étude. Sauf pour la première semaine, l'effet du site sur les
quantités de N-NH4+ était hautement (p < 0,01)
à très hautement significatif (p < 0,001) le long de la
période d'incubation (Annexe 2.1). Cela était
attendu, même pour les sites caractérisés par la même
espèce dominante, et il est attribué au fait que la
minéralisation de N dans le sol est régie par différents
facteurs variant d'un site à l'autre, y compris
72
Tableau 11 : Les résultats
(minéralisation nette de N-NH4 +) de l'incubation anaérobie
après les 1ère, 2ème, 3ème et
4ème semaines.
|
Sites
|
Ntot
(mgkg-1)
|
1ère Semaine
|
2ème Semaine
|
3ème Semaine
|
4ème Semaine
|
|
Nmin1
(mgkg-1)
|
Nmin1/Ntot
(%)
|
Nmin2 (mgkg-1)
|
Nmin2/Ntot
(%)
|
Nmin3
(mgkg-1)
|
Nmin3/Ntot
(%)
|
Nmin4
(mgkg-1)
|
Nmin4/Ntot
(%)
|
|
I
|
4737,58 #177; 1760,16
|
49,65 #177; 26,51 a
|
1,05
|
81,76 #177; 25,78 a
|
1,73
|
105,05 #177; 13,54 b
|
2,22
|
118,21 #177; 29,60 b
|
2,50
|
|
(2921,40 #177; 1026,06)
|
(21,89 #177; 8,55 a)
|
(0,75)
|
(44,75 #177; 3,52 c)
|
(1,53)
|
(53,25 #177; 25,09 b)
|
(1,82)
|
(61,83 #177; 34,73 a)
|
(2,12)
|
|
II
|
1467,17 #177; 422,52
|
37,47 #177; 24,91 a
|
2,55
|
37,94 #177; 29,28 a
|
2,59
|
47,37 #177; 26,73 a
|
3,23
|
50,21 #177; 22,15 a
|
3,42
|
|
(1982,10 #177; 1195,03)
|
(21,79 #177; 15,64 a)
|
(1,10)
|
(31,17 #177; 10,40 bc)
|
(1,57)
|
(43,31 #177; 11,11 ab)
|
(2,18)
|
(42,19 #177; 12,41 a)
|
(2,13)
|
|
III
|
2375,10 #177; 363,31
|
48,35 #177; 21,20 a
|
2,04
|
53,25 #177; 19,07 a
|
2,24
|
63,42 #177; 23,07 ab
|
2,67
|
75,97 #177; 29,47 ab
|
3,20
|
|
(1376,31 #177; 105,38)
|
(9,94 #177; 2,66 a)
|
(0,72)
|
(12,04 #177; 5,33 a)
|
(0,87)
|
(15,12 #177; 7,43 a)
|
(1,10)
|
(21,98 #177; 4,31 a)
|
(1,60)
|
|
IV
|
1421,00 #177; 42,65
|
24,36 #177; 11,77 a
|
1,71
|
26,18 #177; 4,53 a
|
1,84
|
30,94 #177; 4,53 a
|
2,18
|
36,73 #177; 7,73 a
|
2,58
|
|
(1094,80 #177; 447,87)
|
(16,80 #177; 9,08 a)
|
(1,53)
|
(13,35 #177; 6,95 ab)
|
(1,22)
|
(17,41 #177; 6,55 ab)
|
(1,59)
|
(18,99 #177; 9,48 a)
|
(1,73)
|
NB : x #177; écart type ; Les valeurs
entre parenthèses représentent les données des sites
témoins correspondant à chacun des sites incendiés alors
que les valeurs désignées par la même lettre ne sont pas
significativement différents les uns des autres parmi les quatre sites
selon le test de Tukey-HSD.
Evolution de la minéralisation nette de
N
140
120
100
80
(Nmin)
(mgkg-1)
60
40
20
0
Semaine
|
S1
|
S2
|
S3
|
S4
|
S1
|
S2
|
S3
|
S4
|
S1
|
S2
|
S3
|
S4
|
S1
|
S2 S3
|
S4
|
|
|
Site I
|
|
|
|
Site II
|
|
|
|
Site III
|
|
|
Site IV
|
|
Non incendié Incendié
73
Figure 9 : La comparaison entre les
quantités de N-NH4+ libérées sous les sites
incendiés et sous les sites non incendiés (témoins) durant
les quatre semaines d'incubation.
74
l'activité microbienne, la quantité
(concentration) des composés organiques et la qualité
(facilité d'utilisation et l'accessibilité par des
microorganismes).
Vers la fin des quatre semaines d'incubation, les taux de
minéralisation semblaient baisser comme le montre la faible augmentation
de la semaine 3 à la semaine 4, le site II
montrant même une diminution, de quantités de
N-NH4+ minéralisées à la semaine 4 par rapport
à la semaine 3 sous le site témoin, Ce phénomène
est fréquent dans ces genres d'expériences où la
diminution de vitesse de minéralisation de N est liée souvent
à l'épuisement des ressources. Ainsi, l'on pourrait juger que les
quatre semaines d'incubation étaient suffisantes pour
l'expérience.
Les quantités de NH4+ libérées
sous l'ensemble des sites incendiés étaient largement
supérieures à celles des sites témoins. Cela ressort
d'ailleurs des tests d'analyse de la variance, où l'on a observé
des différences hautement significatives (p < 0,01) dans les 2
premières semaines à très hautement significatives (p <
0,001) dans les deux dernières semaines, entre les quantités de
N-NH4+ libérées sous les sites brûlés et
celles des sites témoins (Annexe 2.1.2). Ceci
était probablement dû à l'augmentation des taux
d'ammonification, ce qui implique l'accélération de processus de
minéralisation suite au passage des feux. Ce phénomène a
été reporté par plusieurs auteurs à savoir DeBano
et al. (1979), Kovacic et al. (1986), Klopatek et al.
(1990), qui ont observé des quantités importantes de
N-NH4+ dans le sol minéral immédiatement après
le passage des incendies sur la surface du sol. Ainsi, les résultats
obtenus corroborent ces observations, particulièrement le cas des sites
I et III qui ont été incendiés tout récemment,
respectivement en octobre et en aout de l'année 2014, Les
quantités de NH4+ sous la partie brûlée de ces
sites étaient environ 2 et 4 fois celles enregistrées sous leurs
témoins correspondants à la fin de la période
d'incubation. Ceci implique que les feux ont favorisé le processus
d'ammonification comme prévu sur le sol minéral. L'observation
des quantités supérieures de N-NH4+ sous les sites
incendiés a été montrée par plusieurs auteurs,
l'attribuant à divers facteurs dont l'évolution favorise
l'activité microbienne.
La Figure 9 ainsi que les tests
supplémentaires de Student des résultats des sites pris
individuellement (à la fin de chaque période d'incubation) ont
montré que le site II présentait le moins de changement
(augmentation) en quantité de N minéralisée sous les sites
incendiés par rapport aux sites témoins. Il y avait une
légère augmentation, mais elle n'était pas statistiquement
significative (Annexe 1.2) tout au long des quatre semaines.
Une explication probable à cela est que le feu n'a pas eu autant
d'impacts sur le sol (surtout
75
la partie minérale) sous ce site puisque ce dernier
était défriché et situé à une altitude
supérieure, donc des conditions plus fraiches ne favorisent pas le
non-lieu du feu sur le site. Aussi, le site a été
échantillonné plus d'un an après avoir connu le feu, donc
une certaine résilience des conditions déterminatrices de
minéralisation.
L'interaction entre le site (indépendamment de l'effet
d'incendie) et l'état du site (incendié/non incendié)
était très hautement significative (p < 0,001 : Annexe
2.1), ce qui était attendue car les différents sites
échantillonnés étaient composés de
différentes espèces dominantes. Ainsi, cette interaction a
montré que les différents sites ont réagi
différemment aux changements des conditions du site après le
passage des feux. Ceci était attendu puisque les différents sites
échantillonnés auraient connu des incendies d'intensités
différentes, conduisant ainsi à des changements variés du
microclimat du sol.
Le processus d'ammonification (minéralisation), comme
d'autres processus biogéochimiques, est influencé par la
qualité de la MO ainsi que par l'acidité du sol. Dans les sols,
ceci se traduit par le rapport C : N. Ainsi, la minéralisation est
étroitement liée à ce paramètre qui influence
l'activité microbienne. Dans la présente étude,
l'observation des quantités élevées de N-NH4+
libérées sous les sites incendiés par rapport aux sites
témoin pourrait être aussi attribuée à
l'évolution de ce paramètre. La MO provenant des incendies est
généralement riche en azote, ce qui contribue à la baisse
de ce paramètre et par conséquent favorise l'activité des
bactéries minéralisatrices. Étant donné que les
rapports C : N pour la plupart des sites échantillonnés
étaient déjà en dessous de la limite citée de 20 -
25 pour les sols minéraux même avant le passage du feu, l'on
pourrait conclure que son évolution n'a pas beaucoup influencée
celle des taux de minéralisation. L'amélioration de la
qualité des résidus qui deviennent moins résistants
à la décomposition après la diminution des niveaux de
lignine et d'autres composés phénoliques pourrait avoir
été un facteur favorisant le processus d'ammonification
après le passage des feux.
L'augmentation du pH du sol après les incendies que
l'on a observé, a été également signalée
comme étant un facteur favorisant la libération de
N-NH4+, mais divers travaux ont montré qu'elle agit plus sur
la nitrification que sur l'ammonification.
Des niveaux élevés de N-NH4+
persistent généralement pendant plusieurs mois voire des
années puis décline à des niveaux pré-incendies en
raison d'augmentation de la nitrification, suivi par le lessivage,
l'immobilisation microbienne, et l'absorption par les plantes (Covington et
Sackett, 1992; Kaye et Hart, 1998). Ainsi, l'augmentation des
taux d'ammonification est un phénomène temporaire qui est
généralement succédé par la nitrification.
76
4.2. Incubation aérobie
L'évolution de la minéralisation de N au cours
des 21 semaines d'incubation aérobie est illustrée sur la
Figure 10 (a et b
respectivement pour les sites incendiés et témoins). Les
quantités de N inorganique (N-NH4 + + N-NO3 -) après la
première semaine, pour les sites incendiés, variaient de 5,68
à 25,40 mg/kg respectivement sous les sites I et IV alors qu'aux sites
témoins, elles se situaient entre 8,62 et 17,24 mg/kg respectivement
sous les IV et III (Annexe 4). À la fin de la
période d'incubation (semaine 21), pour les sites incendiés, les
quantités nettes d'azote minéralisées se chiffraient entre
55,72 mg/kg (site IV) et 116,77 mg/kg (site I) tandis qu'aux sites
témoins, elles se situent entre 34,50 mg/kg et 60,25 mg/kg
respectivement sous ces mêmes sites (IV et I).
Les quantités de N-NH4+
libérées étaient faibles tout au long de la période
d'incubation par rapport à celles de N-NO3-, la plus
élevée étant de 22,75 mg/kg (site I incendié)
enregistrée après trois semaines d'incubation. Elles
n'étaient plus élevées que dans les premières
semaines d'incubation, devenant plus ou moins négligeables au fur et
à mesure que la durée d'incubation augmentait (Figure 10a
et 10b). À l'inverse, les quantités de
N-NO3-qui étaient faibles au début augmentaient au fur
et à mesure, présentant les quantités les plus
élevées vers la fin de la période d'incubation. Cette
observation était plus marquée sous les sites brûlés
par rapport aux sites témoins, ce qui implique l'intensification avec le
temps du processus de nitrification par rapport à l'ammonification.
Ainsi, cela pourrait être attribué au fait que, dans les
conditions d'aérobiose et en particulier les conditions de
température et d'humidité sont favorables, les quantités
de N-NH4+ libérées par ammonification étaient
facilement transformées en N-NO3- par des microbes
nitrifiants.
Les quantités élevées de N inorganique
observées au début de l'incubation pourrait être
expliquée par la méthode de préparation utilisée
où les échantillons du sol ont été tamisés
et séchés, suivi par la réhumectation avant l'incubation.
Cette forte, mais brève, hausse de minéralisation était
observée, en particulier pour le cas d'échantillons provenant des
sites incendiés (Figure 10a), avec le site IV
enregistrant une différence allant jusqu'à 25 unités de N
inorganique libérées entre le début de la période
d'incubation (teneur initiale) et la fin de la première semaine. Ce
phénomène appelé effet de "flush ou Birch", reporté
par Birch (1958), est courant en particulier dans les expériences de
laboratoire et il est attribué au fait qu'une proportion importante des
microorganismes peut être tuée lors de séchage et la
réhumectation conduira ainsi à la minéralisation des
cellules mortes par la microflore restante. Ceci, combiné avec
l'état de jeunesse de la population microbienne qui se développe
après la réhumectation, entraîne la minéralisation
accélérée de N (Birch, 1958).
77
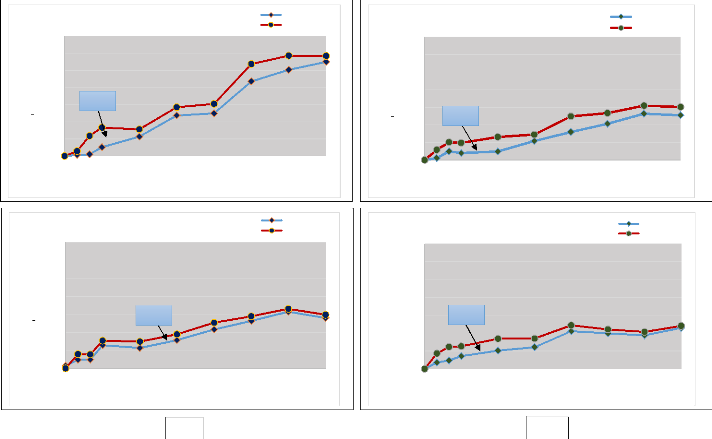
10b
Nmin
(mgkg-1)
Nmin
(mgkg-1)
140
120
100
140
120
100
40
40
80
60
80
60
20
20
0
0
0 3 6 9 12 15 18 21
0 3 6 9 12 15 18 21
NH4
NH4
NO3-
Site II : Talassemtane NH4+ + NO3-
Période d'incubation (semaines)
Période d'incubation (semaines)
NO3-
Site I : Akumssen NH4+ + NO3-
Nmin
(mgkg-1)
Nmin
(mgkg-1)
140
120
100
140
120
100
40
80
60
20
40
80
60
20
0
0
0 3 6 9 12 15 18 21
0 3 6 9 12 15 18 21
Période d'incubation (semaines)
NH4
Site II' : Talassemtane
Période d'incubation (semaines)
NO3-
Site I' : Akumssen NH4+ + NO3-
NH41
NO3-
NH4+ + NO3-
10a
Figures 10 : L'évolution de la
minéralisation d'azote durant 21 d'incubation aérobie pour les
différents sites (10a : incendiés, 10b
: témoins)
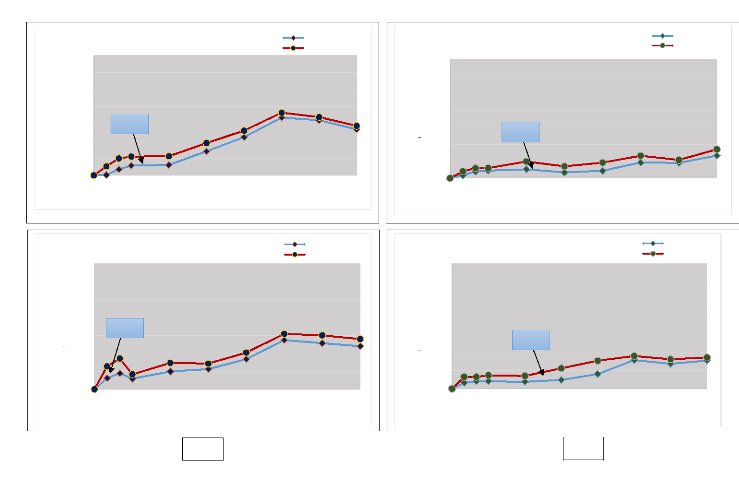
10a
Nmin
(mgkg-1)
Nmin
(mgkg-1)
140
120
100
140
120
100
40
80
60
20
40
80
60
20
0
0
0 3 6 9 12 15 18 21
Période d'incubation (semaines)
0 3 6 9 12 15 18 21
NH4+
NH4+
NO3-
Site IV' : Béni Salah NH4+ + NO3-
Période d'incubation (semaines)
NO3-
Site III' : Bab Taza NH4+ + NO3-
78
10b
Nmin
(mgkg-1)
Nmin
(mgkg-1)
140
120
100
140
120
100
40
80
60
20
40
80
60
20
0
0
0 3 6 9 12 15 18 21
Période d'incubation (semaines)
0 3 6 9 12 15 18 21
NO3-
Site IV : Béni Salah NH4+ + NO3-
Période d'incubation (semaines)
NO3-
Site III : Bab Taza NH4+ + NO3-
NH4+
NH4+
(Suite) Figure 10 : L'évolution de la
minéralisation d'azote durant 21 d'incubation aérobie pour les
différents sites (10a : incendiés, 10b :
témoins)
79
4.3. Cinétique de minéralisation de
l'azote
Une régression linéaire entre les variables log
(N0 - Nmin) et t était réalisée pour
évaluer les paramètres de la cinétique de
minéralisation. Ainsi, une valeur `optimale' de N0 était
déterminée en appliquant la procédure itérative
comprenant des régressions répétées basées
sur le choix de différentes valeurs de N0, Les meilleures valeurs de N0,
de K et de t1/2, sont présentées sur le Tableau
12, et représentent les valeurs obtenues par itération
(régression répétitives) ayant le plus grand coefficient
de détermination, R2. La valeur N0 est
interprétée comme une estimation de la quantité de N qui
sera minéralisée dans une période de temps infini dans des
conditions optimales de température et d'humidité (Stanford et
Epstein, 1974).
Les Figures 11a et 11b
montrent que les données expérimentales étaient
bien ajustées au modèle de la cinétique de premier ordre.
En effet, les valeurs obtenues pour le coefficient de détermination
étaient comprises entre 0,81 et 0,92 sous les sites brûlés,
et 0,80 et 0,93 sous les sites témoins. La forme des courbes de
régression exponentielle pour les sites brûlés
(Figure 11a) ont montré que les taux de
minéralisation étaient plus rapides que ceux des sites
témoins (Figure 11b). En outre, les valeurs du
potentiel de minéralisation, N0, les plus élevées ont
été enregistrées sous les sites brûlés. Elles
variaient ainsi de 53,12 mg/kg (site IV) à 113,24 mg/kg (site I)
comparées aux valeurs des sites témoins qui se situaient entre
23,69 mg/kg (site III) et 56,78 mg/kg (site I). Ces valeurs de N0/Ntotal
étaient assez faibles allant de 2,39% (site I) à 3,81% (site II)
de N total, mais elles sont toujours restées supérieures à
celles des sites témoins.
Les Figures 11a et 11b
montrent que les taux de minéralisation sont rapides au
début de la période d'incubation, mais ils ralentissent en grande
partie vers la semaine 12, Ceci pourrait être lié à la
décomposition rapide de la fraction la plus labile de N organique dans
les premières semaines. Au fur et à mesure que ce pool labile
s'épuise, les fractions assez résistantes dominent d'où la
baisse des taux de minéralisation.
En ce qui concerne la constante de vitesse de
minéralisation, K, elle se situait entre 0,196 à 0,248
semaines-1 respectivement sous les sites IV et I brûlés
comparée avec 0,130 semaines-1 (site III) à 0,208
semaines-1 (site I) enregistrée sous les sites
témoins. Ce paramètre traduit la vitesse de décomposition
des composés organiques dans le sol et puisque les valeurs
étaient plus élevées sous tous les sites brulés par
rapport à leurs témoins, l'on pourrait conclure que
l'activité microbienne était plus intense après le passage
des feux. L'ammonification après les incendies, telle expliquée
précédemment
80
Tableau 12 : Les paramètres de la
cinétique de minéralisation de l'azote (N0, k, et t1/2) pour les
différents sites d'étude
|
Sites
|
Équation linéaire : log10 (N0 - Nmin) = -
Kt/2,303 + log10 N0
Y = Ax + B
|
Ntot
(mgkg-1)
|
N0 / Ntot
(%)
|
|
N0
(mgkg-1)
|
K
(semaines-1)
|
t1/2
(semaines)
|
tres
(semaines)
|
R2
|
|
I
|
113,24 #177; 60,04
|
0,248
|
2,794
|
4,032
|
0,85
|
4737,58 #177; 1760,16
|
2,39
|
|
(56,78 #177; 8,62)
|
(0,208)
|
(3,332)
|
(4,808)
|
(0,93)
|
(2921,40 #177; 1026,06)
|
(1,94)
|
|
II
|
55,89 #177; 15,69
|
0,217
|
3,195
|
4,608
|
0,92
|
1467,17 #177; 422,52
|
3,81
|
|
(42,34 #177; 12,49)
|
(0,185)
|
(3,747)
|
(5,405)
|
(0,88)
|
(1982,10 #177; 1195,03)
|
(2,14)
|
|
III
|
58,26 #177; 6,41
|
0,227
|
3,054
|
4,405
|
0,91
|
2375,10 #177; 363,31
|
2,45
|
|
(23,69 #177; 19,59)
|
(0,130)
|
(5,333)
|
(7,692)
|
(0,80)
|
(1376,31 #177; 105,38)
|
(1,72)
|
|
IV
|
53,12 #177; 4,88
|
0,196
|
3,537
|
5,102
|
0,81
|
1421,00 #177; 42,65
|
3,74
|
|
(34,00 #177; 11,99)
|
(0,185)
|
(3,747)
|
(5,104)
|
(0,91)
|
(1094,80 #177; 447,87)
|
(3,11)
|
NB : x #177; écart type ; Les valeurs
entre parenthèses représentent les données des sites
témoins (non incendiés)
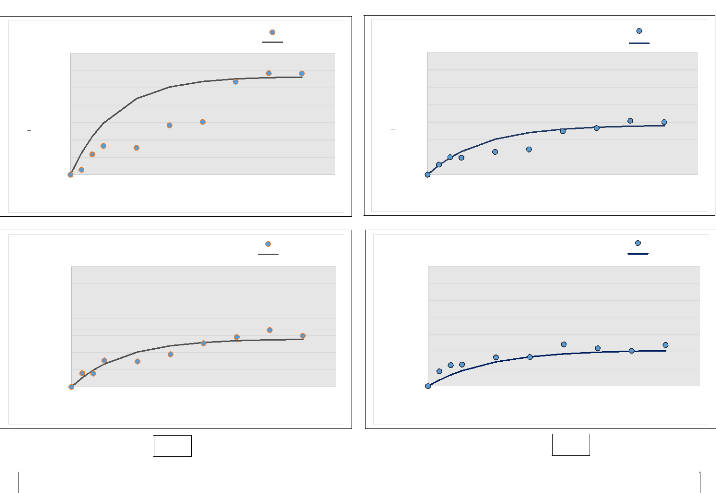
Figures 11 : Les modèles exponentiels
ajustés aux résultats de Nmin mesurés pour les
différents sites (11a: incendiés,
11b: témoins)
140
120
100
80
60
40
20
0
Nmin
(mgkg-1)
0 3 6 9 12 15 18 21 24
Période d'incubation (semaines)
Nmin = 113,24 (1 - e(-0,248 t))
Nmin mesuré
Site I': Akumssen Nmin modèle
11a
140
120
100
80
60
Nmin
(mgkg-1)
40
20
0
Nmin mesuré
Site II': Talassemtane Nmin modèle
Nmin = 55,89 (1 - e(-0,217 t))
0 3 6 9 12 15 18 21 24
Période d'incubation (semaines)
81
11b
Nmin
(mgkg-1)
Nmin
(mgkg-1)
140
120
100
140
120
100
40
80
60
20
40
80
60
20
0
0
0 3 6 9 12 15 18 21 24
Période d'incubation (semaines)
0 3 6 9 12 15 18 21 24
Période d'incubation (semaines)
Nmin mesuré
Site II: Talassemtane Nmin modèle
Nmin mesuré
Site I: Akumssen
Nmin modèle
Nmin = 56,78 (1 - e(-0,208 t))
Nmin = 42,34 (1 - e(-0,185 t))
(Suite) Figures 11 : Les modèles
exponentiels ajustés aux résultats de Nmin mesurés pour
les différents sites (11a: incendiés,
11b: témoins)
82
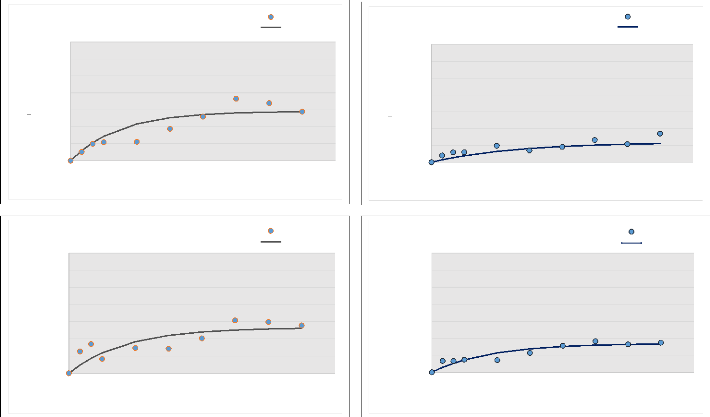
140
120
100
80
60
Nmin
(mgkg-1)
40
20
0
Nmin mesuré
Site III': Bab Taza Nmin modèle
Nmin = 58,26 (1 - e(-0,227 t))
0 3 6 9 12 15 18 21 24
Période d'incubation (semaines)
140
120
100
80
60
Nmin
(mgkg-1)
40
20
0
Nmin mesuré
Site III: Bab Taza Nmin modèle
Nmin = 23,69 (1 - e(-0,130 t))
0 3 6 9 12 15 18 21 24
Période d'incubation (semaines)
Nmin mesuré
Site IV': Beni Salah Nmin modèle
140
120
100
80
60
Nmin
(mgkg-1)
40
20
0
Nmin = 53,12 (1 - e(-0,196 t))
0 3 6 9 12 15 18 21 24
Période d'incubation (semaines)
Nmin mesuré
Site IV: Beni Salah Nmin modèle
140
120
100
80
60
Nmin
(mgkg-1)
40
20
0
Nmin = 34,00 (1 - e(-0,185 t))
0 3 6 9 12 15 18 21 24
Période d'incubation (semaines)
11a
83
(4.2), contribue à la
libération de quantités importantes de N-NH4+. Ainsi,
si ces dernières ne sont pas perdues par érosion, assimilation
etc., alors elles sont oxydées par les bactéries
hétérotrophes, nitrifiantes, contribuant ainsi à des
niveaux élevés de N-NO3- dans le sol
brûlé.
Les temps de demi-vie (t1/2) correspondant à la
minéralisation de 50% de substrat organique azoté initial, ainsi
que le temps de résidence moyen (tres : temps de minéralisation
de la totalité du substrat organique azoté), quant à eux
sont directement liés aux taux de minéralisation (K), de sorte
que les valeurs observées sous les sites brûlés
étaient inférieures à celles des sites témoins.
Ainsi, sous les sites brûlés, le site I a présenté
le temps (t1/2) le plus court parmi les quatre étudiés, de 2,794
(tres = 4,032) semaines comparé à 3,332 (4,808) semaines sous le
témoin, tandis que le site IV présenté le plus de temps
(Tableau 12). Les courbes de régression pour les sites
II et IV brûlés, telles présentées sur les
Figures 11a et 11b, ne montrent pas beaucoup
de variation par rapport à celles des témoins, impliquant ainsi
que les taux de minéralisation retournaient à des niveaux
pré-feux. En effet, ces deux sites sont ceux dont l'augmentation de
valeurs de K après le passage des feux était la plus faible
(0,185 à 0,217 et 0,185 à 0,196 semaines-1
respectivement sous II et IV).
Aucun facteur unique ne peut être identifié pour
expliquer l'augmentation de la capacité de minéralisation de N
sous les sites brûlés. Parmi les facteurs influençant cette
dernière, et à l'exception de ceux qui sont
contrôlés au laboratoire (humidité, température,
aération), le pH a probablement la plus grande influence par son
augmentation qui était très hautement significative après
le passage des feux (Tableau 9). La minéralisation de
N, et surtout le sous-processus de nitrification qui a dominé sous les
sites brûlés (Figure 11a), est fortement
influencé par l'acidité du sol puisque les bactéries
hétérotrophes responsables de nitrification sont plus à
l'aise dans des conditions légèrement basiques comparées
aux conditions acides. Ainsi, leur activité est favorisée dans
des conditions neutres voire légèrement basiques, par opposition
à des conditions acides observées sous les sites non
brûlés, conduisant à des valeurs plus élevées
de N0 et de K observées sous les sites incendiés (Tableau
12). L'on n'a pas assisté à des conditions basiques mais
la diminution de l'acidité du sol, en passant des sites témoins
aux sites incendiés, pourrait avoir contribué à des
valeurs plus élevés de nitrification sous ces derniers.
Après tout, l'augmentation des taux de nitrification,
qui dominait dans l'expérience d'incubation aérobie, est
étroitement liée à celle d'ammonification, cette
dernière contribuant à la libération des quantités
importantes de N-NH4+ après le passage des feux qui sont
ensuite oxydées facilement pour former le N-NO3-. Ainsi, les
modifications des taux de nitrification suivent de près ceux
d'ammonification.
84
CONCLUSION GÉNÉRALE
Les objectifs de cette étude étaient
d'évaluer les effets des incendies de forêt sur le stockage du C
dans les sols ainsi que sur la minéralisation de N dans les
écosystèmes forestiers de la région du Rif
centro-occidental y compris les forêts domaniales d'Akumssen, de
Talassemtane, de Bab Taza et de Béni Salah. Ce sont des
écosystèmes qui sont riches en termes de biodiversité,
mais qui ont été aussi embourbés dans la
dégradation, souvent d'origine anthropozoogène, de certaines de
ces composantes y compris les sols. Vus comme étant aussi un facteur de
dégradation, les incendies de forêt, qui sont assez
fréquents, ont joué un rôle majeur dans l'évolution
de ces écosystèmes. En influençant certains processus
biogéochimiques par leurs effets directs ou par les processus
subséquents tels que l'érosion, les incendies, ont
contribué à la dégradation des écosystèmes
rifains conduisant dans certains cas à la perte de la fertilité
des sols. En regard de ces problèmes inquiétants, il s'est
avéré d'étudier le rôle des incendies dans
l'évolution de certains processus régissant le fonctionnement des
sols ainsi que des écosystèmes forestiers.
L'étude des propriétés du sol a
montré que la plupart d'entre elles diminuent avec la profondeur du sol,
en passant de l'horizon A à l'horizon (B). La typologie des sols
caractérisant les sites étudiés a montré que les
sites d'Akumssen, de Bab Taza et de Béni Salah appartiennent à la
classe des sols à sesquioxyde de fer et sous classe fersialitique sans
réserves calciques. Quant au site à mis chemin vers Talassemtane,
qui se situe sur la dorsale calcaire, il appartient à la classe des sols
peu évolués et de sous-classe non climatique. En outre, par
rapport à sa position topographique caractérisée par des
pentes assez importantes, il appartient au groupe régosolique et au
sous-groupe d'apport colluvial.
Les propriétés physiques analysées y
compris la texture et la densité apparente sont restées plus ou
moins inchangées après les incendies sous la plupart des sites
étudiés, en particulier avec les feux sites vraisemblablement de
faible intensité. Malgré les changements significatifs dans les
proportions d'argiles et de limons, le sol a maintenu la même texture qui
est en grande partie limoneuse. Seul le périmètre de reboisement
à pin maritime des Landes, incendié à Bab Taza a
présenté une texture carrément différente de son
témoin, passant de texture limoneuse à argileuse.
Quant aux propriétés chimiques, leurs
réponses aux feux étaient variées avec quelques
propriétés présentant des modifications significatives
tandis que d'autres étant
85
légèrement touchées, que ce soit
l'augmentation ou la diminution de leurs niveaux. L'augmentation significative
du pH, et donc la baisse de l'acidité du sol, était plus ou moins
prévue compte tenu du fait que les bases échangeables ont aussi
évolué de façon similaire. Ces deux, étant
intrinsèquement liées entre elles, sont parmi les
propriétés du sol les plus sensibles aux feux et
présentent presque toujours une augmentation après le passage des
feux de forêts. Une autre propriété ayant
présenté une modification significative était le rapport C
: N, qui est un paramètre important surtout dans le processus de
minéralisation de N en influençant la transformation des
composés organiques.
Le N total, dont la teneur dans le sol influe directement sur
les quantités de N minéralisées, a augmenté
après les incendies, avec seulement le site de Talassemtane
présentant une diminution d'environ 25% (-514,93 mg/kg) par rapport
à son témoin correspondant. Ceci a prouvé que le feu
n'entraîne pas toujours des pertes nettes de N, étant donné
que les processus d'oxydation ainsi que de volatilisation de ce dernier sont
souvent annulés par les dépôts des composés
organiques riches en N, surtout lorsqu'il s'agit des feux de faible
intensité.
Conformément à la première
hypothèse de l'étude, le feu a entraîné en grande
partie la diminution des stocks de C. Sauf au niveau du site de Talassemtane
où l'on a observé une augmentation, les trois sites d'Akumssen,
de Bab Taza et de Béni Salah ont présenté des baisses en
stocks de C après le passage des feux. En effet, ces pertes varient de
12,28% à 36,65% soit -80,08 t/ha à -181,45 t/ha respectivement
sous les sites d'Akumssen et de Bab Taza, et elles étaient
attribuées plus aux phénomènes ultérieurs tels que
l'érosion qu'aux effets directs du feu sur le C et d'autres
propriétés connexes. La seule augmentation, de 69,59% soit
+117,67 t/ha, au niveau du site de Talassemtane était largement
attribuée à la nature du feu, étant donné que le
site était défriché, dont le feu qui a été
déclenché était probablement d'intensité faible
plutôt qu'ayant connu un incendie proprement dit.
L'étude a montré une augmentation des taux de
minéralisation de N après le passage des feux comme largement
prévue, confirmant ainsi la deuxième hypothèse que les
incendies de forêts provoquent l'accélération du processus
de minéralisation de N. Tous les sites brûlés ont
présenté des quantités plus élevées de N
minéralisé par rapport à leurs témoins.
L'incubation dans les conditions d'anaérobiose a
montré que les feux ont eu d'effets hautement significatifs sur
l'ammonification, tous les sites brûlés présentant les
86
quantités de N-NH4+ plus
élevées par rapport à leurs témoins. En outre, ces
dernières étaient de deux (sites I et IV) à trois (site
III) fois plus élevées sous les sites brûlés tout le
long de la période d'incubation, le site d'Akumssen présentant
les quantités les plus élevées (118,21 mg/kg). Le site de
Talassemtane étant défriché et connaissant un feu de
faible intensité, deux ans avant l'échantillonnage
présentait des taux d'ammonification à peine plus
élevés que ceux de son témoin.
Les modèles ajustés aux données
expérimentales de l'incubation aérobie, utilisés afin de
déterminer l'azote potentiellement minéralisable (APM)
présentaient des valeurs de N0 plus grandes sous tous les sites
brûlés par rapport à leurs témoins. La tendance
était presque identique à celle de l'incubation anaérobie
où le site Akumssen présenté la valeur N0 la plus
élevée de 113,24 mg/kg, tandis que la plus basse a
été observée sous le site de Béni Salah, avec une
valeur de 53,12 mg/kg. Ainsi, le site d'Akumssen apparaissait être le
plus productif parmi les quatre étudiés.
En ce qui concerne l'évolution de la constante de
vitesse de minéralisation, K, ainsi que du temps de demi-vie, t1/2, la
première a augmenté sous tous les sites après le passage
des feux, se situant entre 0,196 et 0,248 semaines-1 respectivement
sous les sites de Béni Salah et d'Akumssen. Le t1/2 quant à lui a
présenté une diminution sous tous les sites incendiés par
rapport à leurs témoins, variant de 2,794 à 3,537 semaines
respectivement sous les mêmes sites que ceux du cas
précèdent.
Il convient de mentionner que la méthode d'incubation
in vitro pour étudier la minéralisation de N reste
toujours utile afin de comprendre la signification considérable de ce
processus jouant un grand rôle dans le fonctionnement des
écosystèmes forestiers. Le seul souci est que de telles
expériences de laboratoire ont tendance de surestimer les
quantités de N inorganique libérées. Les conditions
expérimentales très favorables d'humidité et de
température sont loin de réalité sur le terrain. Aussi,
l'on n'a pas pris en considération les processus tels que
l'immobilisation et l'assimilation et surtout le lessivage qui peuvent conduire
à des pertes importantes de NO3-, si en excès comme il
est le cas après les incendies, des écosystèmes.
Néanmoins, l'expérience reste toujours un moyen
intéressant de prédire la minéralisation de N, même
si elle ne reflète pas totalement la réalité sur le
terrain.
À la lumière de la présente étude,
certains aspects n'ont pas été pris en considération en
raison de manque de temps et des conditions météorologiques
87
désagréables lors du choix des sites et
d'échantillonnage. Ainsi, les recommandations suivantes sont
proposées pour la recherche future ayant rapport avec ce domaine:
y' Étant donné que l'effet des incendies sur le
sol varient selon la profondeur, une étude approfondie prenant cette
dernière comme variable devrait être entreprise afin
d'évaluer l'évolution du stockage du C, de minéralisation
de N et d'autres propriétés du sol.
y' L'instant d'échantillonnage après l'incendie
est extrêmement important. Ainsi, une étude, tenant en compte le
temps écoulé (immédiatement, 1 an, 5 ans...) depuis
l'incendie, devrait être entreprise pour évaluer son rôle
dans l'évolution des aspects cités ci-dessus.
y' Une étude comparant l'impact, sur le sol, des feux
dirigés avec ceux des incendies proprement dits devrait être faite
afin d'évaluer l'effet d'intensité du feu surtout sur la
minéralisation de N.
88
RÉFÉRENCES BIBLIOGRAPHIQUES ET
WEBOGRAPHIQUES
REFERENCES BIBLIOGRAPHIQUES
Alexander, M. (1977). Introduction to soil microbiology (2nd
ed.), 467p.
Allam, K. (2005). Écosystèmes forestiers et
incendies dans la province de Chefchaouen: Structure, architecture et
résilience. Mémoire de fin d'études, 106p.
Alvarez, R. & Lavado, R. S. (1998). Climate, organic
matter and clay content relationships in the Pampa and Chaco soils, Argentina.
Geoderma(83), pp: 127 - 141.
Amato, M. (1983). Determination of carbon 12C and
14C in plants and soil. (15), pp: 611 - 612.
Ambassa, B. (2005). L'étude comparative du stockage du
carbone et de la minéralisation de l'azote dans les sols des
forêts de chêne-liège et de résineux dans le bassin
versant de Moulay Bouchta. Mémoire de fin d'études,
68p.
Bagnouls, F., & Gaussen, H. (1953). Saison sèche et
indice xérothermique. Bull. Soc. Hist., Tome 88. pp: 193 -
239.
Batjes, N. H. (1996). Total C and N in soils of the world.
Eur. J. Soil Sci.(47), pp: 151 - 163.
Belghazi, B. (1983). Contribution à l'étude de
l'écologie et de la productivité du Pin d'Alep (Pinus halepensis
Mill.) dans le versant nord du Haut Atlas (forêt de Tamga).
Thèse de Doc. Ing, Montpellier. 192p.
Benjelloun, H. (1993). Soil genesis, classification, and
nitrogen cycling in ecosystems of the Northwestern Rif region of Morocco.
PhD Thesis Report, Oregon State University, Corvalis, USA.
pp: 168 - 219.
Benjelloun, H. & Ahmiri, E. (2000). Minéralisation
de l'azote dans les sols sous différents peuplements forestiers de la
Mamora occidentale (Sidi Amira). Annales de la recherche forestière
au Maroc, T (33), pp: 68 - 86.
Birch, H. F. (1958). Mineralization of plant nitrogen
following alternate wet. Plant and Soil, 20. pp: 43 - 49.
Bonneau, M. (1963). L'importance des propriétés
physiques du sol dans la production forestière. Rev. Forest Fr,
pp: 19 - 31.
Bouyoucos, G. (1962). Hydrometer method improved for making
particle size analysis of soils. Agronomy Journal, 54. pp: 464 -
465.
Bradstreet, R.B. (1965). The Kjeldahl Method for Organic
Nitrogen. New York Academic Press, 239p.
Bremner, J.M. (1960). «Determination of nitrogen in soil
by the Kjeldahl method», J. Agric. Sci. 55. pp: 11-33.
Campo, J., Andreu, V., Gimeno-Garcia, E., Gonzalez-Pelayo, O.
& Rubio, J. L. (2008). Medium Term Evolution of Soil Aggregate Stability,
Organic Matter and Calcium
89
Carbonate of a Mediterranean Soil Burned at two Different Fire
Intensities. The Soils Of Tomorrow: Soils Changing In A Changing World, 9 :
344p.
Caon, L., Ramón Vallejo, V., Coen, R. J. & Geissen,
V. (2014). Effects of wildfire on soil nutrients in Mediterranean ecosystems.
Earth-Science Reviews, 139 (2014), pp: 47 - 58.
Cassman, K. G. & Munns, D. N. (1980). Nitrogen
mineralization as affected by soil moisture, temperature, and depth. Soil
Science Society of America, 44 No.6. pp: 1233 - 1237.
Certini, G. (2005). Effects of fire on properties of forest
soils: A review. Oecologia(143), pp: 1 - 10.
Chandler, C., Cheney, P., Thomas, P., Trabaud, L. &
Williams, D. (1983). Fire in Forestry. New York, USA: John Wiley
& Sons, 298p.
Child, J. J. (1981). Biological nitrogen fixation. In Soil
Biochemistry , E. A. Paul and J. N. Ladd. Marcel Dekker, Inc., New York
(5), pp: 297 - 322.
Choromanska, U. & Deluca, T. H. (2001). Microbial activity
and nitrogen mineralization in forest mineral soils following heating :
evaluation of post-fire effects. Soil Biology & Biochemistry(34),
pp: 263 - 271.
Christensen, N. L. (1973). Fire and the nitrogen cycle in
California chaparral. Science, 181. pp: 66 - 68.
Cornelissen, J. H. (1996). An experimental comparison of leaf
decomposition rates in a wide range of temperate plant species and types.
J. Ecol, 84. pp: 573 - 582.
Covington, W. W. & Sackett, S. S. (1984). The effect of a
prescribed fire in southwestern ponderosa pine on organic matter and nutrients
in woody debris and forest floor. Forest Science, 30. pp: 183 -
192.
Covington, W. W. & Sackett, S. S. (1992). Soil mineral
nitrogen changes following prescribed burning in ponderosa pine. Forest
Ecology and Management,, 54. pp: 175 - 191.
Cramer, W., Bondeau, A., Woodward, F. I., Prentice, I. C.,
Betts, R. A., Brovkin, V., . . . Young - Molling, C. (2001). Global response of
terrestrial ecosystem structure and function to CO2 and climate change: results
from six dynamic global vegetation models. Global Change Biol.(7), pp:
357 - 373.
Craswell, E. T. & Lefroy, R. D. (2001). The role and
function of organic matter in tropical soils. Nutrient Cycling in
Agroecosystem, 61 (1 - 2), pp: 7 - 18.
Daget, P. (1977). Le bioclimat méditerranéen,
caractères généraux, modes de caractérisation.
Végétation (34), pp. 1 - 20.
DeBano , L. F., Eberlein, G. E., & Dunn, P. H. (1979).
Effects of burning on chaparral soils: I. Soil nitrogen. Soil Science
Society of America Journal, 43. pp: 504 - 509.
DeBano, L. F. (1991). The effects of fire on soil properties.
Proceedings management and productivity of western-Montane. Forest
Soils, pp: 151 - 155.
DeBano, L. H., Neary, D. G., & Ffolliott, P. F. (1998).
Fire effects on ecosystems. John Wiley & Sons. Inc.: New York, NY,
USA, 612p.
90
Dise, N. B., & Wright, R. F. (1995). Nitrogen leaching
from European forests in relation to nitrogen deposition. For. Ecol.
Manage(71), pp: 153 - 161.
Dixon, R. K., Brown, S., Houghton, R. A., Solomon, A. M.,
Trexler, M. C., & Wisniewski, J. (1994). Carbon Pools and Flux of Global
Forest Ecosystems. Science(263), pp: 185 - 190.
Duchaufour, P. (1983). Pédologie:
Pédogenèse et Classification. Masson, Paris, France.
477p.
Dunn, P. H., Barrow, S. C., & Poth, M. (1985). Soil
moisture affects survival of microorganisms in heated chaparral soil. Soil
Biology & Biochemistry, 17. pp: 143 - 148.
Ekinci, H. (2006). Effect of forest fire on some physical,
chemical, and biological properties of soil in Çanakkale, Turkey.
International Journal of Agriculture and Biology, 8. pp: 102 - 106.
El Gharbaoui, A. (1981). la terre et l'homme dans la
péninsule Tingitane. Etude sur l'homme et le milieu naturel dans le Rif
occidental. T.I.S Geol. & Geographie Phys. N.15. 377p.
Emberger, L. (1930). La végétation de la
région méditerranéenne. Essai d'une classification des
groupements végétaux. Rev Gen Bot (42), pp. 641 -
662.
Emberger, L. (1955). Une classification biogéographique
des climats. Rec. Trav. Lab.
Bot. Géol. Fac. Se. 7(11): pp. 3 - 43.
Fisher, R. F. & Binkley, D. (2000). Ecology and Management
of Forest Soils (3rd Edition). John Wiley and Sons, New York, USA,
486p.
Franzluebbers, A. J., Honey, R. L., Honeycutt, C. W., Arshad,
M. A., Schomberg, H. H., & Hons, F. M. (2001). Climatic influences on
active fractions of soil organic matter. Soil Biology &
Biochemistry(33), pp: 1103 - 1111.
Gabert, P. & Maurer, G. (1970). Les montagnes du Rif
marocain. Etude géomorphologique. In: Méditerranée,
Nouvelle série, 1e année, N°1. pp. 89-91.
Galloway, J. N., Dentener, D. G., Capone, E. W., Boyer, E. W.,
Howarth, R. W., Seitzinger, S. P., Vörösmarty, C. J. (2004). Nitrogen
cycles: past, present and future. Biogeochemistry(70), pp: 153 -
226.
Giovannini, G., Lucchesi, S. & Giachetti, M. (1988).
Effects of heating on some physical and chemical parameters related to soil
aggregation and erodibility. Soil Sci., 146. pp: 255 - 261.
Granged, A. J., Jordán, A., Zavala, L. M., &
Bárcenas-Moreno, G. (2011). Post-fire evolution of soil properties and
vegetation cover in a Mediterranean Heathland after experimental burning: A
3-year study. Geoderma, 164 (1 - 2), pp: 85 - 94.
Grier, C. C. (1975). Wildfire effects on nutrient distribution
and leaching in a coniferous ecosystem. Canadian Journal of Forest
Research, 5. pp: 559 - 607.
Griffin, T. S. (2008). Nitrogen availability. In J. Schepers
and W.R. Raun (ed.) Nitrogen in agricultural systems. Agron. Monogr. CSSA,
and SSSA, pp: 613-646.
91
Guillaume, T., Damris, M. & Kuzyakov, Y. (2015). Losses of
soil carbon by converting tropical forest to plantations: erosion and
decomposition estimated by 13C. Global Change Biology,
13p.
Haynes, R. J. (1986). Nitrification. In Mineral nitrogen in
the plant-soil system (ed. T.T. Kozlowski). Academic press, Madison,
Wisconsin, pp: 127 - 157.
Heanes, D. (1984). Determination of total organic-C in soils
by an improved chromic acid digestion and spectrophotometric procedure.
Commun. Soil Sci. Plant Anal.(15), pp: 1191 - 1213.
Heviaa, G. G., Buschiazzoa, D. E., & Heppera, E. N.
(2003). Organic matter in size fractions of soils of the semiarid Argentina.
Effects of climate, soil texture and management. Geoderma, 116. pp:
265 - 277.
Hiederer, R. (2009). Distribution of Organic Carbon in Soil
Profile Data. 148p.
Homann, P. S., Sollins, P., Chappell, H. N., &
Stangenberger, A. G. (1995). Soil organic carbon in a mountainous, forested
region: relation to site characteristics. Soil Science Society of America
Journal(49), pp: 1468 - 1475.
Hungerford, R. D., Harrington, M. G., Frandsen, W. H., Ryan,
R. C., & Niehoff, J. G. (1990). Influence of fire on factors that affect
site productivity. In A.E. Harvey and L. F. Neuenschwander, editors, Proceeding
of the management and productivity of western Montane forest soils. USDA Forest
Service, Intermountain Research Station, GTR INT, 280p.
IPCC. (2001). Climate Change 2001: The Scientific Basis.
Contribution of Working Group I to the Third Assessment Report of the
Intergovernmental Panel on Climate Change, pp: 183 - 239.
Jansson, S. L. & Persson, J. (1982). Mineralization and
immobilization of soil nitrogen. In F. J. Stevenson (ed.) Nitrogen in
agricultural soils. Agron. 2: pp: 229-252.
Kaiser, E. A., Martens, R. & Heinemeyer, O. (1995).
Temporal changes in soil microbial biomass carbon in an arable soil.
Consequences for soil sampling. Plant and Soil, 170 No.2. pp: 287 -
295.
Kandeler, E., Eder, G. & Sobotik, M. (1994). Microbial
biomass, N mineralization, and the activities of various enzymes in relation to
nitrate leaching and root distribution in a
slurry-amended grassland. Biology and Fertility of Soils, 18
No.1. pp: 7 - 12.
Kara, O. & Bolat, I. (2009). Short-term effects of
wildfire on microbial biomass and abundance in black pine plantation soils in
Turkey. Ecological Indicators, 9. pp: 1151 - 1155.
Kaye, J. P. & Hart, S. C. (1998). Ecological restoration
alters N transformations in a ponderosa pine-bunchgrass ecosystem.
Ecological Applications, 8. pp: 1052 - 1060.
Khanna, P. (1981). Leaching of nitrogen from terrestrial
ecosystems. Patterns, mechanisms and ecosystem responses. In "Terrestrial
Nitrogen Cycles: Processes, Ecosystem Strategies and Management Impacts", pp:
343 - 352.
Kjeldahl, J. (1883) «A new method for the estimation of
nitrogen in organic compounds», Z. Anal. Chem., 22. 366p.
92
Klopatek, C. C., Klopatek, J. M. & DeBano, L. F. (1990).
Potential variation of nitrogen transformations in Pinyon-Juniper ecosystems
resulting from burning. Biol. Fertil. Soils, 10. pp: 35 - 44.
Knoepp, J. D., DeBano, L. F. & Neary, D. G. (2005).
Wildland fire in ecosystems : Effects of fire on soil and water.
General technical report RMRS ; GTR-42-Vol 4. Soil Chemistry, pp: 53 -
72.
Kovacic, D. A., Swift, D. M., Ellis, J. E. & Hakonson, T.
E. (1986). Immediate effects of prescribed burning on mineral soil nitrogen in
ponderosa pine of New Mexico. Soil Sci., 141(1), pp: 71 - 76.
Koyama, A., Kavanagh, K. & Stephan, K. (2010). Wildfire
effects on soil gross nitrogen transformation rates in coniferous forests of
central Idaho, USA. Ecosystem, 13 (7), pp: 1112 - 1126.
Kumar, K. & Goh, H. M. (2000). Crop residue management:
Effects on soil quality, soil nitrogen dynamics, crop yield, and nitrogen
recovery. Adv Agron., 68. pp: 197 - 319.
Kutiel, P. & Naveh, Z. (1987). The effect of fire on
nutrients in a pine forest soil. Plant and soil, 104. pp: 269 -
274.
Kyuma, K. (2004). Paddy soil science. Kyoto, Japan:
Kyoto University Press. 480p.
Lal, R. (1996). Deforestation and land use effects on soil
degradation and rehabilitation in western Nigeria. II: soil chemical
properties. Land Degradation and Development(7), pp: 87 - 98.
Lavkulich, L.M. (1981). Methods Manual, Pedology Laboratory.
Department of Soil Science, University of British Columbia, Vancouver.
Leifeld, J., Bassin, S. & Fuhrer, J. (2005). Carbon stocks
in Swiss agricultural soils predicted by land-use, soil characteristics, and
altitude. Agriculture, 105. pp: 255 - 266.
Lindén , B., Lyngstad, I., Sippola, J., Nielsen, J. D.,
Søgaard, K. & Kjellerup, V. (1992). Nitrogen mineralization during
the growing season. 1. Contribution to the nitrogen supply of spring barley.
Swedish Journal of Agricultural Research, 22 No.1. pp: 3 - 12.
Malhi, S. S., Nyborg , M. & Heaney, D. J. (1992).
Potential for nitrogen mineralization in central Alberta soils. Fertilizer
Research, 32 No. 3. pp: 321-325.
Mathieu, C., & Pieltain, F. (2003). Analyse chimique des
sols, méthodes choisies (1st ed.), 389p.
Maurer, G. (1968). La montagne du Rif Central. Étude
Géomorphologique. Université de Paris, Faculté
des lettres et sciences, Thèse Doctorat d'Etat, Édition Marocaine
et internationales, 499p.
Meddour-Sahar, O., Derridj, A. & Meddour, R. (2009). Bilan
des incendies de forêt dans le bassin méditerranéen : Cas
du Portugal, l'Espagne, la France, l'Italie et la Grèce, (Période
1986-2005). pp 1-8.
93
Naveh, Z. (1990). Fire in the Mediterranean-A landscape
ecological perspective. In: Goldammer, J.G. and M.J. Jenkins, (Eds.). Fire
in ecosystems dynamics: Mediterranean and Northern perspective, pp: 1 -
20.
Neary, D. G., Klopatek, C. C. & DeBano, L. F. (1999). Fire
effects on belowground sustainability: a review and synthesis. Forest
Ecology and Management(122), pp: 51 - 71.
Neary, D. G., Ryan, K. C., DeBano, L. F. & Knoepp, J. D.
(2005). Wildland fire in ecosystems: Effects of fire on soils and water.
General Technical Report RMRS - GTR - 42. USDA Forest Service, 262p.
Olsen, S. R., Cole C. V., Watanabe, F. S. & Dean, L. A.
1954. Estimation of Available Phosphorus in Soils by Extraction with Sodium
Bicarbonate. U. S. Department of
Agriculture Circular No. 939. Banderis, A. D., D. H. Barter
and K. Anderson.
Agricultural and Advisor.
Pansu, M. & Gautheyrou , J. (2006). Handbook of Soil
Analysis. Mineralogical, Organic and Inorganic Methods, 995p.
Pardini, G., Gispert, M. & Dunjü, G. (2004). Relative
influence of wildfire on soil properties and erosion processes in different
Mediterranean environments in NE Spain. Science of the Total Environment,
328. pp: 237 - 246.
Pérez-Harguindeguy, N., Diaz, S., Cornelissen, J. F.,
Vendramini, F., Cabido, M. & Castellanos, A. (2000). Chemistry and
toughness predict leaf litter decomposition rates over a wide spectrum of
functional types and taxa in central Argentina. Plant Soil, 218. pp:
21 - 30.
Powers, R. F. (1980). Mineralizable nitrogen as an index of
nitrogen availability to forest trees. Soil Sci. Soc. Am., 44. pp:
1314 - 1320.
Pritchett, W. L. & Fisher, R. F. (1987). Properties and
Management of Forest Soils. John Wiley & Sons, New York, 494p.
Quideau, S. A., Chadwick, Q. A., Benesi, A., Graham, R. C.
& Anderson, M. A. (2001). A direct link between forest vegetation type and
soil organic matter composition. Geoderma(104), pp: 41 - 60.
Grovel, R. (1996). La préservation des forêts du
Rif centro-occidental : un enjeu de développement de la montagne rifaine
/ Preservation of forests in the central western Rif massif : a key element in
the development of the Rif Mountains, Revue de géographie alpine
(84), pp: 75 - 94.
Robertson , G. D., Wedin, D., Groffman, P. M., Blair, J. M.,
Holland, E. A., Nadelhoffer, K. J. & Harris, D. (1999). Soil Carbon and
Nitrogen Availabilty. Nitrogen Mineralization, Nitrification and Soil
Respiration Potentials. In: Robertson, G.P., Coleman, D.C., Bledsoe, C.S.P.S.
(Eds.), Standard Soil Methods for LongTerm Ecological Research. Oxford
University Press, 462p.
Ross, D. J., Speir, T. W., Tate, K. R. & Feltham, C. W.
(1997). Burning in a New Zealand snow-tussock grassland: effects on soil
microbial biomass an N and P availability. New Zealand Journal of Ecology,
21. pp: 63 - 71.
94
Rosswall, T. (1982). Microbiological regulation of the
biogeochemical nitrogen cycle. Plant Soil, 67. pp: 15 - 34.
Sdej, W. & Przekwas, K. (2008). Fluctuations of nitrogen
levels in soil profile under conditions of a long-term fertilization
experiment. Plant, Soil and Environmental, 54 (5), pp: 197 - 203.
Sands, R. (1983). Physical changes to sandy soils planted to
radiata pine, in IUFRO Symposium on Forest Site and Continuous Productivity,
Ballard, R. and Gessel, S.P., Eds., Gen. Tech. Rep. PNW-GTR-163. USDA Forest
Service, Pacific Northwest Station, Portland, OR, pp: 146 - 152.
Sauvage, C. (1963). Etages bioclimatiques. Comité
de géographie du Maroc, Sect II. Planche 63.
Schlesinger, W. (2000). Carbon sequestration in soil: some
cautions amidst optimism. Agricultural Ecosystems and Environment(82),
pp: 121 - 127.
Schnitzer, M. (1991). Soil organic matter-the next 75 years.
Soil Sci.(151), pp: 41 - 58.
Schnitzer, M. & Hoffman, I. (1964). Pyrolysis of soil
organic matter. Soil Sci. Soc. Am. Proc, 24. pp: 520 - 525.
Schumacher, B. A. (2002). Methods for the determination of
total organic carbon (TOC) in soils and sediments. NCEA-C-1282.
EMASC-001. United States Environmental Protection Agency., Las Vegas, USA,
25p.
Schwilk, D. W. (2003). Flammability is a niche construction
trait: Canopy architecture affects fire intensity. The American
naturalist(162), pp: 725 - 733.
Six, J., Callewaert, P., Lenders, S., De Gryze, S., Morris, S.
J., Gregorich, E. G., . . . Paustian, K. (2002). Measuring and understanding
carbon storage in afforested soils by physical fractionation. Soil Sci Soc
Am J, 66. pp: 1981 - 1987.
Skjemstad, J. O., Reicosky, D. C., Wilts, A. R. & McGowan,
J. A. (2002). Charcoal carbon in U.S. agricultural soils. Soil Science
Society of America Journal(66), pp: 1255 - 1949.
Snyder, J. D. & Trofymow, J. A. (1984). A rapid accurate
wet oxidation diffusion procedure for determining organic and inorganic carbon
in plant and soil samples. Commun. Soil Sci. Plant Anal.(15), pp: 587
- 597.
Soudi, B., Sbai, A. & Chiang, C. N. (1990). Nitrogen
Mineralization in Semiarid Soils of Morocco: Rate Constant Variation with
Depth, Soil Sci Soc Amer (Madison), 54. pp: 756 - 761.
St. John, T. V. & Rundel, P. W. (1976). The role of fire
as a mineralizing agent in a Sierran coniferous forest. Oecologia, 25.
pp: 35 - 45.
Sundquist, E.T., Burruss, R.C., Faulkner, S.P., Gleason, R.A.,
Harden, J.W., Kharaka, Y.K., Tieszen, L.L. & Waldrop, M.P. (2008). Carbon
Sequestration to Mitigate Climate Change: USGS, Fact Sheet 2008 - 3097. 4p.
95
Stanford , G., Carter , J. N. & Smith, S. J. (1974).
Estimates of potentially mineralizable soil nitrogen based on short-term
incubations. Soil Science Society of America, Proceedings, Vol .38 no.1.
pp: 99 - 102.
Stanford, F. & Smith, S. J. (1972). Nitrogen mineralization
potentials of soil. Soil Science Society of America Proceedings
(36), pp: 465 - 472.
Swift, M. J., Heal, O. W. & Anderson, J. M. (1979).
Decomposition in Terrestrial Ecosystems, 372p.
Taiqui, L. (1997). La dégradation écologique au Rif
marocain: nécessités d'une nouvelle approche. Serie de
estudios biológicos, pp: 5 - 17.
Townsend, J. H. & Vörösmarty, C. J. (2004).
Nitrogen cycles: past, present and future. Biogeochemistry(70), pp:
153 - 226.
Trabaud, L. (1984). Man and fire: impacts on Mediterranean
vegetation. In: Castri, F., D.W. Goodall and R.L. Spetch, (eds.).
Mediterranean-types shrublands Ecosystems of the World, 11. pp: 523 -
537.
Trumbore, S. E., Chadwick, O. A. & Amundson, R. (1996).
Rapid exchange of soil C and atmospheric CO2 driven by temperature change.
Science(272), pp: 393 - 396.
Ulery, A. L. & Graham, R. C. (1993). Forest fire effects
on soils color and texture. Soil Science Society of America
Journal(57), pp: 135 - 140.
Updegraff, K. J., Pastor, J., Brigham, S. & Johnston, C.
(1995). Environmental and substrate controls over carbon and nitrogen
mineralization in Northern wetlands. Ecolog Applic., 5. pp: 151 -
163.
Verma, S. & Jayakumar, S. (2012). Impact of forest fire on
physical, chemical and biological properties of soil: A review. Proceedings
of the International Academy of Ecology and Environmental Sciences 2 (3),
pp: 168 - 176.
Vitousek, P. M. & Mellilo, J. M. (1979). Nitrate losses
from disturbed forests: Patterns and mechanisms. For. Sci.(25), pp:
605 - 619.
Vitousek, P. M. & Reiners, W. A. (1995). Ecosystem
succession and nutrient retention: a hypothesis. BioScience, 25. pp:
376 - 381.
Walkley, A. & Black, I. A. (1934). An examination of the
Degtjareff method for determining soil organic matter, and a proposed
modification of the chromic acid titration method. Soil Sci.(37), pp:
29 - 38.
Walworth, J. (2013). Nitrogen in Soil and the Environment.
Waring, S. A. & Bremner, J. M. (1964). Ammonium production
in soil under waterlogged conditions as an index of N availability, Nature
London (201), pp: 951 - 952.
Warren, G. P. & Whitehead, D. C. (1988). Available soil
nitrogen in relation to fractions of soil nitrogen and other soil properties.
Plant and Soil (112), pp: 155 - 165.
Wells, C. G., Campbell, J., DeBano, L. F., Lewis, C. E.
Fredricksen, R. L.; Franklin, E. C. Froelich, R. C. & Dunn, P. H. (1979).
Effects of fire on soil: a state-of-knowledge review. USDA For. Serv. Gen.
Tech. Rep. WO-7. Washington, D.C., 34p.
96
Wodmansee, R. G. & Wallach, L. S. (1981). Effects of fire
regimes on biogeochemical cycles. Fire Regimes and Ecosystem Properties In
Mooney, H. A., Bonnicksen, T. M., Christensen, N. L., Lotan, J. E., and
Reiners, W. A., Proceedings of the Conference Fire Regimes and Ecosystem
Properties. Honolulu. USDA Forest Service,[Washington, DC], pp: 379 - 400.
Zhao, H., Tong, D. Q., Lin, Q., Lu, X. & Wang, G. (2012).
Effect of fires on soil organic carbon pool and mineralization in a
Northeastern China wetland. Geoderma (189 - 190), pp: 532 - 539.
REFERENCES WEBOGRAPHIQUES
Web1, After the Fire: Indirect Effects on the Forest
Soil. FOREST FIRE IN THE U.S. NORTHERN ROCKIES: A PRIMER accessible au:
http://www.northernrockiesfire.org/effects/soilindi.htm
Web2, Rating the Severity of Fire in Forest Soils.
FOREST FIRE IN THE U.S. NORTHERN ROCKIES: A PRIMER, accessible au:
http://www.northernrockiesfire.org/effects/soilrate.htm
Web3, Incendies des forêts. Haut Commissarat aux
Eaux et Forêts et à la Lutte Contre la Désertification
accessible au:
http://www.eauxetforets.gov.ma/fr/text.aspx?id=1157&uid=37
Web4, Nitrogen fixation, accessible au:
http://en.wikipedia.org/wiki/Nitrogen
fixation
Web5, Influences on Soil Nitrogen Mineralization:
Implications for Soil Restoration and Revegetation, accessible au:
http://www.123helpme.com/view.asp?id=30291
Web6, Texture du sol. accessible au:
http://www.omafra.gov.on.ca/CropOp/fr/general_agronomics/soil_management/soil
texture.html
97
ANNEXES
98
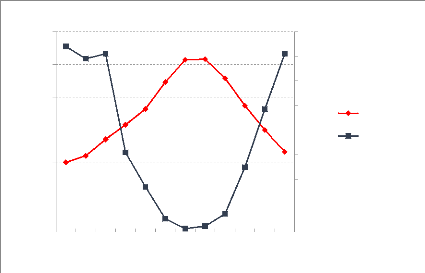
T °C
30
25
20
15
10
0
5
Jan Feb Mar Apr May Jun Jul Aug Sep Oct Nov Dec
Mois
Derdara
40
80
0
60
20
160
140
120
100
P mm
Températures Précipitations
Figure 2: Diagramme ombrothermique de la station
de Derdara
ANNEXE 1 : DIAGRAMMES OMBROTHERMIQUES DE
BAGNOULS
ET GAUSSEN
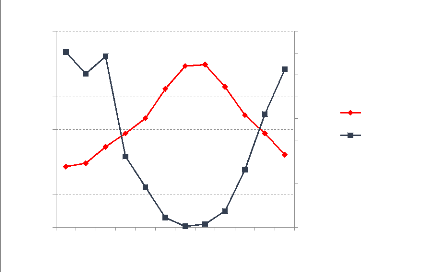
T °C
30
25
20
15
10
0
5
J F M A M J JASON D
Chefchaouen
Mois
40
80
0
60
20
180
160
140
120
100
P mm
Température Précipitation
Figure 1: Diagramme ombrothermique de la
station de Chefchaouen
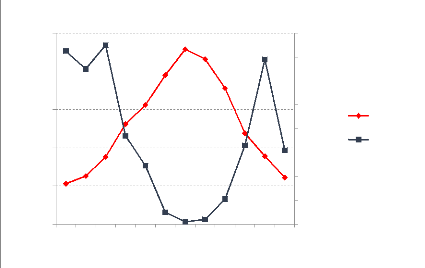
T °C
25.0
20.0
15.0
10.0
0.0
5.0
J F M A M J JASON D
Bab Berred
Mois
40.0
80.0
0.0
60.0
20.0
160.0
140.0
120.0
100.0
P mm
Température Précipitation
99
Figure 3: Diagramme ombrothermique de la
station de Bab Berred
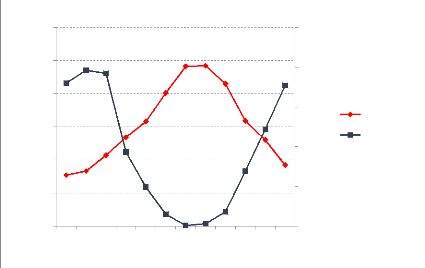
T °C
30.0
25.0
20.0
15.0
10.0
0.0
5.0
J F M A M J JASON D
Mois
Bab Taza
0.0
250.0
200.0
50.0
150.0
100.0
P mm
Température Précipitation
Figure 4: Diagramme ombrothermique de la
station de Bab Taza
100
ANNEXE 2 : TABLEAUX STATISTIQUES Cas des
parties 2.1 et 2.2:
y' Effet du Site : variation inter sites
indépendamment de l'effet de l'incendie ; y' Effet de
l'État_du_site: variation entre les sites
incendiés et les sites témoins (non incendiés) ;
y' Effet du Site *
État_du_site: interaction entre les deux effets
précédents.
2.1 - Résultats de test d'ANOVA (2 * 4) les
quantités d'azote minéralisées lors de l'incubation
anaérobie
|
Source
|
Var. dep.
|
CE
|
df
|
CM
|
F
|
Sig.
|
|
Site
|
Nmin1
|
701,762
|
3
|
233,921
|
0,805
|
0,509
|
|
Nmin2
|
6061,401
|
3
|
2020,467
|
7,684
|
0,002
|
|
Nmin3
|
9701,899
|
3
|
3233,966
|
11,253
|
0,000
|
|
Nmin4
|
12387,89
|
3
|
4129,296
|
8,777
|
0,001
|
|
État_du_site
|
Nmin1
|
2998,029
|
1
|
2998,029
|
10,321
|
0,005
|
|
Nmin2
|
3587,793
|
1
|
3587,793
|
13,645
|
0,002
|
|
Nmin3
|
5194,395
|
1
|
5194,395
|
18,074
|
0,001
|
|
Nmin4
|
6948,926
|
1
|
6948,926
|
14,77
|
0,001
|
|
Site * État_du_ site
|
Nmin1
|
825,585
|
3
|
275,195
|
0,947
|
0,441
|
|
Nmin2
|
1329,154
|
3
|
443,051
|
1,685
|
0,210
|
|
Nmin3
|
2629,252
|
3
|
876,417
|
3,05
|
0,059
|
|
Nmin4
|
2759,271
|
3
|
919,757
|
1,955
|
0,162
|
2.2 - Résultats de test d'ANOVA (2 * 4) simple pour
les propriétés physicochimiques du sol ainsi que les stocks de
carbone
2.2.1 - Propriétés physiques
|
Source
|
Dependent
Variable
|
SS
|
df
|
MS
|
F
|
Sig.
|
|
Etat_du_site
|
Argiles
|
234,38
|
1
|
234,38
|
13,24
|
0,0022
|
|
Limons
|
509,22
|
1
|
509,22
|
5,53
|
0,0318
|
|
Sables
|
52,66
|
1
|
52,66
|
0,67
|
0,4238
|
|
Densité_apparenté
|
0,06
|
1
|
0,06
|
2,27
|
0,1512
|
|
Site
|
Argiles
|
1103,13
|
3
|
367,71
|
20,76
|
0,0000
|
|
Limons
|
4131,60
|
3
|
1377,20
|
14,97
|
0,0001
|
|
Sables
|
6972,49
|
3
|
2324,16
|
29,73
|
0,0000
|
|
Densité_apparenté
|
0,38
|
3
|
0,13
|
5,01
|
0,0122
|
|
Etat_du_site *
Site
|
Argiles
|
119,79
|
3
|
39,93
|
2,25
|
0,1213
|
|
Limons
|
1368,99
|
3
|
456,33
|
4,96
|
0,0127
|
|
Sables
|
1143,97
|
3
|
381,32
|
4,88
|
0,0135
|
|
Densité_apparenté
|
0,02
|
3
|
0,01
|
0,32
|
0,8075
|
101
2.2.2 - Propriétés chimiques
|
Source
|
Dependent variable
|
SS
|
df
|
MS
|
F
|
Sig.
|
|
Etat_du_site
|
CEC
|
139,35
|
1
|
139,35
|
3,554
|
0,078
|
|
Cations_echangeables
|
76,68
|
1
|
76,68
|
6,143
|
0,025
|
|
Azote_total
|
0,002
|
1
|
0,002
|
3,332
|
0,087
|
|
Carbone_total
|
1,82
|
1
|
1,82
|
2,182
|
0,159
|
|
Matiere_organique
|
5,38
|
1
|
5,38
|
2,170
|
0,160
|
|
pHeau
|
2,92
|
1
|
2,92
|
23,753
|
0,000
|
|
pHKCL
|
2,59
|
1
|
2,59
|
20,725
|
0,000
|
|
C : N
|
15,34
|
1
|
15,34
|
4,550
|
0,049
|
|
S/T
|
0,37
|
1
|
0,37
|
12,504
|
0,003
|
|
P2O5
|
27,74
|
1
|
27,74
|
1,071
|
0,316
|
|
Na+
|
4,42
|
1
|
4,42
|
1,245
|
0,281
|
|
K+
|
8,52
|
1
|
8,52
|
5,874
|
0,028
|
|
Ca2+
|
14,88
|
1,00
|
14,88
|
5,691
|
0,030
|
|
Mg2+
|
0,02
|
1,00
|
0,02
|
0,038
|
0,849
|
|
Site
|
CEC
|
3036,91
|
3,00
|
1012,30
|
25,822
|
0,000
|
|
Cations_echangeables
|
177,94
|
3,00
|
59,31
|
4,751
|
0,015
|
|
Azote_total
|
0,23
|
3,00
|
0,08
|
9,984
|
0,001
|
|
Carbone_total
|
27,94
|
3,00
|
9,31
|
11,196
|
0,000
|
|
Matiere_organique
|
83,25
|
3,00
|
27,75
|
11,199
|
0,000
|
|
pHeau
|
2,22
|
3,00
|
0,74
|
6,033
|
0,006
|
|
pHKCL
|
3,65
|
3,00
|
1,22
|
9,744
|
0,001
|
|
C : N
|
14,31
|
3,00
|
4,77
|
0,489
|
0,694
|
|
S/T
|
0,66
|
3,00
|
0,22
|
7,339
|
0,003
|
|
P2O5
|
106,71
|
3,00
|
35,57
|
1,373
|
0,287
|
|
Na+
|
16,18
|
3
|
5,39
|
1,519
|
0,248
|
|
K+
|
111,65
|
3
|
37,22
|
25,660
|
0,000
|
|
Ca2+
|
2,74
|
3
|
0,91
|
0,349
|
0,790
|
|
Mg2+
|
2,59
|
3
|
0,86
|
2,165
|
0,132
|
|
Etat_du_site *
Site
|
CEC
|
206,61
|
3
|
68,87
|
1,757
|
0,196
|
|
Cations_echangeables
|
45,42
|
3
|
15,14
|
1,213
|
0,337
|
|
Azote_total
|
0,07
|
3
|
0,02
|
1,873
|
0,175
|
|
Carbone_total
|
3,47
|
3
|
1,16
|
1,392
|
0,281
|
|
Matiere_organique
|
10,37
|
3
|
3,46
|
1,394
|
0,281
|
|
pHeau
|
0,20
|
3
|
0,07
|
0,550
|
0,655
|
|
pHKCL
|
0,54
|
3
|
0,18
|
1,439
|
0,268
|
|
C : N
|
319,64
|
3
|
106,55
|
4,616
|
0,016
|
|
S/T
|
0,31
|
3
|
0,10
|
3,464
|
0,041
|
|
P2O5
|
174,14
|
3
|
58,05
|
2,241
|
0,123
|
|
Na+
|
22,33
|
3
|
7,44
|
2,097
|
0,141
|
|
K+
|
0,71
|
3
|
0,24
|
0,164
|
0,919
|
|
Ca2+
|
11,92
|
3
|
3,97
|
1,520
|
0,248
|
|
Mg2+
|
0,73
|
3
|
0,24
|
0,609
|
0,619
|
102
2.2.3 - Les stocks de carbone organique
|
Source
|
SS
|
df
|
MS
|
F
|
Sig.
|
|
Site
|
5167.634
|
3
|
1722.545
|
9.676
|
0.001
|
|
Etat_du_site
|
270.212
|
1
|
270.212
|
1.518
|
0.236
|
|
Site * Etat_du_site
|
760.234
|
3
|
253.411
|
1.424
|
0.273
|
2.3 - Résultats de test de Student pour les
échantillons appariés 2.3.1 - Propriétés
physiques
2.3.1.1 - Densité apparente
|
Paired Differences
|
t
|
df
|
Sig.
(2-tailed)
|
|
Mean
|
SD
|
SEM
|
95% CI of d
|
|
Lower
|
Upper
|
|
Pair 1
|
I' - I
|
0,053
|
0,212
|
0,123
|
-0,474
|
0,580
|
0,435
|
2
|
0,706
|
Pair 2
|
II' - II
|
0,160
|
0,282
|
0,163
|
-0,540
|
0,860
|
0,984
|
2
|
0,429
|
Pair 3
|
III' - III
|
0,160
|
0,062
|
0,036
|
0,005
|
0,315
|
4,438
|
2
|
0,047
|
Pair 4
|
IV' - IV
|
0,017
|
0,142
|
0,082
|
-0,337
|
0,370
|
0,203
|
2
|
0,858
|
|
2.3.2 - Propriétés chimiques 2.3.2.1 - Azote
total
|
Paired Differences
|
t
|
df
|
Sig.
(2-tailed)
|
|
Mean
|
SD
|
SEM
|
95% CI of d
|
|
Lower
|
Upper
|
|
Pair 1
|
I' - I
|
0,183
|
0,180
|
0,104
|
-0,263
|
0,629
|
1,769
|
2
|
0,219
|
Pair 2
|
II' - II
|
-0,050
|
0,078
|
0,045
|
-0,244
|
0,144
|
-1,109
|
2
|
0,383
|
Pair 3
|
III' - III
|
-0,097
|
0,038
|
0,022
|
-0,191
|
-0,003
|
-4,422
|
2
|
0,048
|
Pair 4
|
IV' - IV
|
0,033
|
0,047
|
0,027
|
-0,084
|
0,151
|
1,222
|
2
|
0,346
|
|
2.3.2.2 - CEC
|
Paired Differences
|
t
|
df
|
Sig.
(2-tailed)
|
|
Mean
|
SD
|
SEM
|
95% CI of d
|
|
Lower
|
Upper
|
|
Pair 1
|
I' - I
|
-4,817
|
5,495
|
3,173
|
-18,467
|
8,834
|
-1,518
|
2
|
0,268
|
Pair 2
|
II' - II
|
1,767
|
2,215
|
1,279
|
-3,735
|
7,268
|
1,382
|
2
|
0,301
|
Pair 3
|
III' - III
|
-13,870
|
7,916
|
4,570
|
-33,534
|
5,794
|
-3,035
|
2
|
0,094
|
Pair 4
|
IV' - IV
|
-3,023
|
6,374
|
3,680
|
-18,856
|
12,809
|
-0,822
|
2
|
0,498
|
|
103
2.3.2.3 - Bases échangeables
|
Paired Differences
|
t
|
df
|
Sig.
(2-tailed)
|
|
Mean
|
SD
|
SEM
|
95% CI of d
|
|
Lower
|
Upper
|
|
Pair 1
|
I' - I
|
-0,767
|
5,811
|
3,355
|
-15,201
|
13,668
|
-0,229
|
2
|
0,840
|
Pair 2
|
II' - II
|
3,233
|
2,570
|
1,484
|
-3,150
|
9,617
|
2,179
|
2
|
0,161
|
Pair 3
|
III' - III
|
6,333
|
6,341
|
3,661
|
-9,418
|
22,084
|
1,73
|
2
|
0,226
|
Pair 4
|
IV' - IV
|
5,500
|
1,998
|
1,153
|
0,538
|
10,462
|
4,769
|
2
|
0,041
|
|
2.3.2.4 - Phosphore assimilable (P2O5)
|
Paired Differences
|
t
|
df
|
Sig.
(2-tailed)
|
|
Mean
|
SD
|
SEM
|
95% CI of d
|
|
Lower
|
Upper
|
|
Pair 1
|
I' - I
|
10,400
|
3,775
|
2,179
|
1,023
|
19,777
|
4,772
|
2
|
0,041
|
Pair 2
|
II' - II
|
3,500
|
6,338
|
3,659
|
-12,244
|
19,244
|
0,956
|
2
|
0,440
|
Pair 3
|
III' - III
|
-2,900
|
5,268
|
3,041
|
-15,986
|
10,186
|
-0,954
|
2
|
0,441
|
Pair 4
|
IV' - IV
|
-2,400
|
5,902
|
3,407
|
-17,061
|
12,261
|
-0,704
|
2
|
0,554
|
|
104
ANNEXE 3 : DESCRIPTION DES PROFILS PÉDOLOGIQUES
Profil I: Forêt domaniale d'Akumssen (Bab Berred -
Ketama)
I. Description de la station
· Localisation : Pinède (maritime
des Landes) d'Akumssen
· Date : 34°59'29,32"N,
4°51'23,10"W
· Exposition : SSW
· Élévation : 1280 m
· Classe de pente : 15 - 30 % sur la
partie moyenne de relief
· Roche mère : Quartzite
· Sol : Rouge fersialitique
· Végétation dominante : Pin
maritime des Landes (Pinus pinaster ssp. atlantica var.
maritima)
· Végétation accompagnatrice :
Cistes (Cistus) : C. salviifolius, C.
crispus ; Daphné garou (Daphne gnidium)
II. Description morphologiques
Hor.
|
Profo.
(cm)
|
Description
|
L
|
5 - 2,5
|
Matière organique non décomposée
|
F
|
2,5 - 2
|
Matière organique partiellement
décomposée
|
H
|
2 - 0
|
Matière organique complètement
décomposée
|
A
|
0 - 40
|
C'est l'horizon minéral formé à la
surface ou sous l'horizon O. L'horizon est de couleur brune jaunâtre
sombre (10YR 4/6) lorsqu'il est sec et prend la couleur brune jaunâtre
sombre (10YR 3/4) à l'état humide. Il est constitué de
fragments grossiers dont 25 % dépassent la taille de 10 cm, 30 % sont de
taille de 1 - 10 cm et 2 % sont de taille inférieure à 1 cm.
C'est un horizon assez poreux, constitué d'agrégats fins de
taille inférieure à 1 cm avec une netteté faible. La
texture est sableuse. En ce qui concerne la consistance, la cohésion est
moyenne à l'état sec, nulle à peu humide et collant
à très humide. Les racines grossières ainsi que celles de
taille moyenne sont rares, présentant respectivement d'orientations
oblique et horizontale oblique. Les racines fines sont moyennement abondantes
ne présentant pas d'orientation définie. La transition entre
l'horizon organique (L+F+H) et A est très tranchée et
rectiligne.
|
(B)
|
40 - 70
|
Considéré comme le sous-sol, c'est la zone
d'accumulation dans le sol. L'horizon est de couleur rouge jaunâtre (5YR
5/8) lorsqu'il est sec et prend la couleur rouge jaunâtre (5YR 4/6)
à humide. Il est constitué de fragments grossiers dont 10 %
dépassent la taille de 10 cm, 30 % sont de 1 - 10 cm et 1 % sont de
taille inférieure à 1 cm. C'est un horizon assez poreux dont la
structure est grumeleuse polyédrique, prismatique et equidimensionnelle
avec une netteté faible. La texture est argileuse.
|
|
105
|
|
En ce qui concerne la consistance, elle est faible à
des états sec et humide, et collant à très humide. Les
racines grossières sont absentes alors que celles de taille moyenne et
fines sont très rares. Les moyennes présentent une orientation
horizontale oblique alors que les fines ne présentant pas d'orientation
définie. La transition entre A et (B) est nette et rectiligne.
|
CR
|
> 70
|
C'est l'horizon localisé immédiatement
au-dessus de la roche mère constitué de matériel
géologique non (ou très faiblement) altéré. Les
fragments grossiers de taille de 1 - 30 cm constituent 80 % de l'horizon. Les
racines grossières sont très rares et d'orientation horizontale
alors que les racines de taille moyenne ainsi que les fines sont rares. Les
racines moyennes présentent également une horizontale alors que
les fines ne présentent aucune orientation définie. La transition
entre (B) et C est nette et fortement ondulée.
|
|
III. Propriétés chimiques + image du
profil
Horizon
|
A
0 - 40
|
(B)
40 - 70
|
C
> 70
|
Profondeur (cm)
|
|
5,24
|
5,75
|
-
|
pH (KCl)
|
4,85
|
4,75
|
-
|
Argiles (%)
|
25
|
45
|
-
|
Limons (%)
|
40,33
|
18,66
|
-
|
Sables (%)
|
34,65
|
36,4
|
-
|
Ctot (%)
|
1,47
|
0,45
|
-
|
MO (%)
|
2,53
|
0,78
|
-
|
Ntot (%)
|
0,256
|
0,125
|
-
|
C/N
|
5,74
|
3,59
|
-
|
P205 (mg/kg)
|
17,10
|
5,70
|
-
|
CEC (meq/100g)
|
16,30
|
12,10
|
-
|
Na+ (meq/100g)
|
1,40
|
1,70
|
-
|
K+ (meq/100g)
|
2,20
|
1,90
|
-
|
Ca2+ (meq/100g)
|
1,10
|
0,60
|
-
|
Mg2+ (meq/100g)
|
0,10
|
0,30
|
-
|
S (meq/100g)
|
4,80
|
4,50
|
-
|
S/T
|
0,29
|
0,37
|
-
|
|
IV. Classification du sol Classe : Sols
à sesquioxyde de fer Sous-classe : Fersialitique
Groupe : Sans réserve calcique

Sous-groupe : Légèrement
hydromorphe en profondeur
106
Profil II : Forêt domaniale de
Talassemtane
I. Description de station
· Localisation : Subéraie et
chênaie verte de Canton Talassemtane
· Date : 11/03/2015
· Coordonnées géographiques :
35°5'20,05"N, 5°9'44,57"W
· Exposition : SSW
· Élévation : 1250 m
· Classe de pente : 30 - 50 % sur la
partie moyenne de relief
· Roche mère : Schistes +
Grès numidien
· Sol : Peu évolué
régosolique
· Végétation dominante :
Chêne-liège (plus dominant) + chêne vert
· Végétation accompagnatrice :
Cistes (Cistus) : C. salviifolius, C.
crispus, C. albidus, C. monspeliensis ; Asphodèle (Asphodelus
microcarpus) ; Daphné garou (Daphne gnidium)
II. Description morphologiques
Horizon
|
Prof. (cm)
|
Description
|
L + F + H
|
0,5 - 0
|
C'est l'horizon organique compose de matière organique
non
décomposée, partiellement
décomposée et totalement
décomposée
|
A
|
0 - 27
|
C'est l'horizon minéral formé à la
surface ou sous l'horizon O. L'horizon est de couleur brune jaunâtre
(10YR 5/4) lorsqu'il est sec et prend la couleur brune jaunâtre
foncée (10YR 4/4) à l'état humide. C'est un horizon
poreux, constitué de 30% de schistes marneux et dont la structure est
angulaire et de netteté faible (< 1 cm). La texture est argile
limoneuse. En ce qui concerne la consistance, la cohésion est faible
à l'état sec, de plasticité nulle à peu humide et
collant à
très humide. Les racines grossières sont
très rares et
d'orientation oblique alors que les racines de taille
moyenne ainsi que les fines sont rares. Les racines moyennes présentent
une orientation horizontale alors que les fines ne présentent aucune
orientation définie. La transition entre l'horizon organique et A est
très tranchée et rectiligne.
|
C
|
> 27
|
C'est l'horizon localisé immédiatement au-dessus
de la roche
mère constitué de matériel
géologique non (ou très
faiblement) altéré. Il
constitué essentiellement des feuillets schisteux de taille entre 0 - 6
cm. Les racines grossières et fines sont très rares d'orientation
horizontale oblique et horizontale respectivement tandis que les moyennes sont
rares
d'orientation horizontale oblique. La transition
entre
l'horizon A et C est très diffuse et rectiligne.
|
|
107
III. Propriétés physicochimiques + image du
profil
Horizon
|
A
0 - 27
|
C
> 27
|
Profondeur (cm)
|
|
6,20
|
-
|
pH (KCl)
|
5,12
|
-
|
Argiles (%)
|
25
|
-
|
Limons (%)
|
20,6
|
-
|
Sables (%)
|
54,4
|
-
|
Ctot (%)
|
0,09
|
-
|
MO (%)
|
0,16
|
-
|
Ntot (%)
|
0,15
|
-
|
C/N
|
0,62
|
-
|
P205 (mg/kg)
|
15,30
|
-
|
CEC meq/100g
|
15,05
|
-
|
Na+ meq/100g
|
1,40
|
-
|
K+ meq/100g
|
3,90
|
-
|
Ca2+ meq/100g
|
1,00
|
-
|
Mg2+ meq/100g
|
0,20
|
-
|
S meq/100g
|
10,50
|
-
|
S/T
|
0,70
|
-
|
|
IV. Classification du sol Classe : Sols peu
évolués
Sous-classe : Non climatique

Groupe : Régosolique
Sous-groupe : D'apport colluvial
Profil III : Forêt domaniale de Bab Taza Tifouzal
(pin maritime des Landes)
I. Description de la station
· Localisation : Pinède (maritime
des Landes) de Bab Taza
· Date : 11/03/2015
· Coordonnées géographiques :
35°4'2,72"N, 5°13'11,90"W
· Exposition : NW
· Élévation : 760 m
· Classe de pente : 2 - 5 % sur la partie
supérieure de relief
· Roche mère : Grès
numidien
· Sol : Rouge fersialitique
· Végétation dominante : Pin
maritime des Landes (Pinus pinaster ssp. atlantica var.
maritima)
108
? Végétation accompagnatrice :
Cistes (Cistus) : C. salviifolius, C.
crispus ; Bruyère (Erica arborea) ; Asphodèle
(Asphodelus microcarpus) ; Daphné garou (Daphne
gnidium) ; Chamaecytisus sp. ; quelques pieds de
chêne-liège en régénération
II. Description morphologiques
|
Hor.
|
Profo.
(cm)
|
Description
|
|
L
|
3 - 2
|
Matière organique non décomposée
|
|
F + H
|
2 - 0
|
Matière organique partiellement et complètement
décomposée
|
|
A
|
0 - 35
|
C'est l'horizon minéral formé à la
surface ou sous l'horizon O. L'horizon est de couleur brune intense (7,5YR 4/6)
lorsqu'il est sec et prend la couleur brune sombre (7,5YR 3/4) à
l'état humide. Il est constitué de fragments grossiers dont 20 %
sont de taille de 5 - 10 cm, 10 % sont de 1 - 5 cm et 2 % sont de taille
inférieure à 1 cm. C'est un horizon assez poreux,
constitué d'agrégats de taille inférieure à 1 cm
dont la structure est angulaire et de netteté faible (2 - 1 cm). La
texture est argile sableuse. En ce qui concerne la consistance, la
cohésion est faible à l'état sec, de plasticité
faible à peu humide et collant à très humide. Les racines
grossières sont très rares et d'orientation horizontale alors que
les racines de taille moyenne ainsi que les fines sont rares. Les racines
moyennes présentent une orientation horizontale oblique alors que les
fines ne présentent aucune orientation définie. La transition
entre l'horizon organique (L+F+H) et A est très tranchée et
rectiligne.
|
|
(B)
|
35 - 73
|
Considéré comme le sous-sol, c'est la zone
d'accumulation dans le sol. L'horizon est de couleur brune rougeâtre
claire (5YR 6/4) lorsqu'il est sec et prend la couleur brune rougeâtre
à humide. Il est constitué de fragments grossiers dont 20 %
dépassent la taille de 10 cm, 15 % sont de 5 - 10 cm, 5 % sont de 1 - 5
cm et 1 % sont de taille inférieure à 1 cm. C'est un horizon
assez poreux dont la structure est grumeleuse equidimensionnelle et de
netteté faible (2 - 1 cm). La texture est argile sableuse. En ce qui
concerne la consistance, elle est faible à l'état sec, de
plasticité faible à peu humide et collant à très
humide. Les racines grossières sont absentes alors que celles de taille
moyenne et fines sont très rares. Les moyennes présentent une
orientation horizontale oblique alors que les fines ne présentant pas
d'orientation définie. La transition (entre A et (B)) est diffuse et
rectiligne.
|
|
CR
|
> 73
|
C'est l'horizon localisé immédiatement au-dessus
de la roche mère constitué de matériel géologique
non (ou très faiblement) altéré. Les racines
grossières sont très rares et d'orientation horizontale alors que
les racines de taille moyenne ainsi que les fines sont rares. Les racines
moyennes présentent une horizontale oblique alors que les fines ne
présentent aucune orientation définie. La transition ((B) et C)
est très diffuse et faiblement ondulée.
|
109
III. Propriétés physicochimiques + image du
profil
|
Horizon
|
A
0 - 35
|
(B)
35 - 73
|
C
> 73
|
|
Profondeur (cm)
|
|
pH (eau)
|
5,58
|
6,33
|
-
|
|
pH (KCl)
|
5,10
|
5,60
|
-
|
|
Argiles (%)
|
25
|
35
|
-
|
|
Limons (%)
|
18,33
|
19,8
|
-
|
|
Sables (%)
|
56,65
|
45,2
|
-
|
|
Ctot (%)
|
0,19
|
0,12
|
-
|
|
MO (%)
|
0,33
|
0,20
|
-
|
|
Ntot (%)
|
0,112
|
0,070
|
-
|
|
C/N
|
1,70
|
1,71
|
-
|
|
P205 (mg/kg)
|
9,30
|
5,70
|
-
|
|
CEC meq/100g
|
20,1
|
9,3
|
-
|
|
Na+ meq/100g
|
1,90
|
1,20
|
-
|
|
K+ meq/100g
|
3,10
|
2,70
|
-
|
|
Ca2+ meq/100g
|
0,50
|
0,40
|
-
|
|
Mg2+ meq/100g
|
0,50
|
2,10
|
-
|
|
S meq/100g
|
6,00
|
6,40
|
-
|
|
S/T
|
0,30
|
0,69
|
-
|

IV. Classification du sol
Classe : Sols à sesquioxyde de fer
Groupe : Sans réserve calcique
Sous-classe : Fersialitique Sous-groupe
: Lessivé et appauvri
Profil IV : Forêt de Béni Salah (pin
radiata)
I. Description de la station
? Localisation : Pinède (radiata) de Bab
Taza
? Coordonnées géographiques :
35°3'33,87"N, 5°12'30,47"W ? Végétation
dominante : Pin radiata (Pinus radiata)
II. Description morphologiques (identique
au profil III)
III. Propriétés chimiques
(identique au profil III)
110
ANNEXE 4 : DONNÉES EXPÉRIMENTALES DE
L'INCUBATION
AÉROBIE
|
Nmin1
|
Nmin2
|
Nmin3
|
Nmin6
|
Nmin9
|
|
I
|
5,68 #177; 4,11 a
|
23,47 #177; 11,12 ab
|
33,12 #177; 13,32 a
|
31,14 #177; 16,42 a
|
56,93 #177; 24,25 b
|
|
(11,60 #177; 13,11 a)
|
(20,17 #177; 11,23 a)
|
(19,50 #177; 4,12 a)
|
(26,16 #177; 16,52 a)
|
(28,93 #177; 3,68 a)
|
|
II
|
15,91 #177; 3,53 ab
|
24,17 #177; 8,64 ab
|
30,81 #177; 13,91 a
|
29,71 #177; 12,10 a
|
37,86 #177; 12,28 ab
|
|
(17,24 #177; 5,52 a)
|
(24,62 #177; 1,61 a)
|
(25,36 #177; 6,67 a)
|
(33,76 #177; 4,21 a)
|
(33,96 #177; 6,98 a)
|
|
III
|
9,48 #177; 3,31 a
|
18,85 #177; 2,13 a
|
20,96 #177; 4,53 a
|
34,58 #177; 3,87 a
|
36,73 #177; 8,55 a
|
|
(8,62 #177; 1,56 a)
|
(13,69 #177; 1,26 a)
|
(12,50 #177; 2,60 a)
|
(21,71 #177; 9,44 a)
|
(14,46 #177; 4,13 a)
|
|
IV
|
25,40 #177; 6,59 b
|
34,08 #177; 10,00 b
|
23,21 #177; 7,65 a
|
29,31 #177; 7,70 a
|
28,57 #177; 3,94 ab
|
|
(13,42 #177; 2,43 a)
|
(17,21 #177; 4,13 a)
|
(19,11 #177; 4,72 a)
|
(21,43 #177; 2,46 a)
|
(22,93 #177; 1,52 a)
|
|
Nmin12
|
Nmin15
|
Nmin18
|
Nmin21
|
|
I
|
60,90 #177; 29,97 b
|
107,26 #177; 59,31 a
|
117,05 #177; 34,99 b
|
116,77 #177; 60,04 a
|
|
(49,68 #177; 13,88 a)
|
(53,29 #177; 20,69 a)
|
(61,74 #177; 32,84 a)
|
(60,25 #177; 8,62 a)
|
|
II
|
50,77 #177; 7,20 ab
|
57,80 #177; 15,76 a
|
66,03 #177; 13,71 ab
|
59,54 #177; 15,69 a
|
|
(48,92 #177; 16,81 a)
|
(44,26 #177; 13,84 a)
|
(41,43 #177; 12,12 a)
|
(48,24 #177; 12,81 a)
|
|
III
|
51,13 #177; 0,55 a
|
72,18 #177; 19,27 a
|
66,96 #177; 18,45 a
|
56,71 #177; 18,11 a
|
|
(18,84 #177; 4,36 a)
|
(26,98 #177; 9,78 a)
|
(21,99 #177; 5,18 a)
|
(34,50 #177; 6,13 a)
|
|
IV
|
40,72 #177; 5,54 ab
|
61,64 #177; 7,82 a
|
52,52 #177; 12,60 a
|
55,72 #177; 4,88 a
|
|
(31,26 #177; 7,43 a)
|
(36,48 #177; 8,04 a)
|
(32,87 #177; 10,97 a)
|
(34,90 #177; 11,99 a)
|
NB : Nmin en mg/kg ; x #177; écart
type ; Les valeurs entre parenthèses représentent les
données des sites témoins correspondant à chacun des sites
incendiés alors que les valeurs désignées par la
même lettre ne sont pas significativement différents les uns des
autres parmi les quatre sites selon le test de Tukey-HSD.
111
ANNEXE 5 : PHOTOGRAPHES DES SITES D'ETUDES
1. Forêt domaniale d'Akumssen (Bab Berred -
Ketama)

Peuplement de pin maritime des Landes incendiés
(Photographe prise par Orlando
Collins)

Vue aérienne (Source : Google Earth)
112
2. Forêt domaniale de Talassemtane

Peuplement mixte de chêne-liège et chêne vert
incendiés (Photographe prise par Orlando
Collins)

Vue aérienne (Source : Google Earth)
113
3. Forêt domaniale de Bab Taza Tifouzal

Périmètre de reboisement de pin maritime des Landes
incendiés (Photographe prise par
Orlando Collins)

Vue aérienne (Source : Google Earth)
114
4. Forêt domaniale de Béni Salah

Vue aérienne (Source : Google Earth)
|
|



