|

RESUME
Ce travail présente les résultats de
l'étude de solubilisation des Under-flow du premier décanteur en
milieu sulfurique aux Usines à Cuivre de Kolwezi. L'objectif est de
solubiliser la presque totalité du cuivre et du cobalt lors de la
lixiviation étant donné que le stockage des Under-flow
présente un handicap à l'usine, d'où l'innovation de
l'étude.
L'étude a porté sur un échantillon des
Under-flow du premier décanteur de l'usine, dont l'analyse chimique
à révéler que ces solides regorgent 0,42% Cu total et
0,19% Co. Deux séries d'essais ont été faites dont la
première réalisée en milieu acide a montré qu'il
est presque impossible de solubiliser le cuivre et le cobalt, étant
donné que notre échantillon est en grande partie sous forme de
sulfures.
La seconde réalisée en milieu acide-oxydante
avec variation des paramètres de lixiviation proposés, a permis
de solubiliser le cuivre avec un rendement de 89,71% et le cobalt avec un
rendement de 78,28%.
Ces résultats montrent qu'il y a lieu de relixivier les
Under-flow du premier décanteur en se référant aux
paramètres étudiés avec comme oxydant le Fe3+.
ii
TABLE DES MATIERES
Contenus page
RESUME i
TABLE DES MATIERES ii
LISTE DES TABLEAU iv
LISTE DES FIGURES v
LISTE DES ABREVIATIONS vi
EPIGRAPHE vii
DEDICACE viii
REMERCIEMENTS ix
INTRODUCTION GENERALE 1
CHAP I : LIXIVIATION ET DECANTATION A UCK 2
I.1. Présentation de l'usine 2
I.1.1 Situation géographique 2
I.1.2 Historique de l'usine 2
I.2. Lixiviation à l'UCK 4
I.3. Décantation à l'UCK 6
CHAP II. CONSIDERATION THEORIQUE SUR LA LIXIVIATION DES SULFURES
10
II.1. Généralités sur la lixiviation
10
II.1.1. Définitions 10
II.1.2. Réactifs de lixiviation 10
II.1.3 Critères de choix d'un réactif de
lixiviation 11
II.1.4 Techniques de lixiviation 11
II.1.5. Types de lixiviation 13
II.2 Types de lixiviation des sulfures 14
II.3. Approche thermodynamique et cinétique de la
lixiviation 16
II.3.1. Approche thermodynamique 16
II.3.2. Approche cinétique 18
II.4. Paramètres de lixiviation 21
CHAP III. CARACTERISATION DES UNDER-FLOW ET PROCEDURES
EXPERIMENTALES
23
III.1. Échantillonnage et
caractérisation chimique 23
III.1.1. Echantillonnage 23
III.1.2 Caractérisation chimique 23
III.2 Procédure expérimentale,
réactifs et matériels utilisés 23
III
III.2.1 Procédure expérimentale
23
III.2.2. Réactifs 26
III.2.3 Matériel utilisé 27
CHAP IV. PRESENTATION DES RESULTATS DE SOLUBILISATION DES UNDER-
FLOW 28
IV.1. Introduction 28
IV.2. Présentation des résultats
28
IV.2.1. Essai préliminaire 28
IV.2.1. Essais d'optimisation des rendements
29
CONCLUSION 38
BIBLIOGRAPHIE 39
iv
LISTE DES TABLEAU
|
Tableau 1 : Composition chimique de l'échantillon en
pourcentage
|
.23
|
|
Tableau 2 : Résultats de l'essai préliminaire
|
.28
|
|
Tableau 3 : Influence de l'acidité
|
30
|
|
Tableau 4 : Influence de la dose du fer ferrique
|
.31
|
|
Tableau 5 : Influence du pourcentage solide
|
..33
|
|
Tableau 6 : Influence de la température
|
34
|
|
Tableau 7 : Influence du temps
|
36
|
V
LISTE DES FIGURES
|
Figure 1 : Flow sheet UCK
|
.4
|
|
Figure 2 : Série des Pachuca
|
5
|
|
Figure 3 : Décanteur DEGREMONT
|
..8
|
|
Figure 4 : Diagramme de POURBAIX du système
Cu-H2O à 25°C
|
...17
|
|
Figure 5 : Diagramme de POURBAIX du système
Fe-H2O à 25°C
|
17
|
|
Figure 6 : Diagramme de POURBAIX du système
Co-H2O à 25°C
|
18
|
|
Figure 7 : Rendement de récupération en fonction de
l'acidité
|
.30
|
|
Figure 8 : Rendement de récupération en fonction de
la dose ferrique
|
.32
|
|
Figure 9 : Rendement de récupération en fonction du
pourcentage solide
|
33
|
|
Figure 10 : Rendement de récupération en fonction
de la température
|
....35
|
|
Figure 11 : Rendement de récupération en fonction
du temps
|
36
|
vi
LISTE DES ABREVIATIONS
DM : Départ Moyen
DN : Décharge Neutre
UF: Under- Flow
OF: Over-Flow
E: Potentiel
g: gramme
Kg: Kilo-gramme
T: Tonne
%: Pourcentage
Rdt: rendement
Rec : récupération
Sol: solubilisation
CA : consommation d'acide
Pds : poids
Vol : Volume
HEAP LEACHING: lixiviation en tas
DUMP LEACHING: dépôt de lixiviation.
VII
EPIGRAPHE
« Tout ce qui est appris sans peine est oubliée sans
délai. »
BENIGNE BOSSUET Jacques.
VIII
DEDICACE
A l'Eternel Dieu tout puissant, le Roi de gloire, en qui ce
travail a été réalisé,
A mon feu père Victor MWENDO paix à son
âme,
A ma mère Lyliane MUKEMBE pour l'éducation, tant
d'amour et tant de sacrifices consentis,
A ma grand-mère maternelle Mathilde ILUNGA, mon oncle
maternel Ladislas MUKEMBE, mes tantes Concilie MUKEMBE, Larissa MUKEMBE et
Charlotte MWEWA pour le grand soutien moral, spirituel et matériel
qu'ils ne cessent de manifester à mon égard,
A toi Péguy LUHATA pour tes encouragements,
A mes frères Marcin MWENDO, Armel MWENDO, Adry MWENDO et
à tous mes proches, voici le travail signe d'accomplissement de leur
souhait.
Je dédie ce travail.
Ophélie MWENDO KABAYO
ix
REMERCIEMENTS
Gloire, honneur et majesté soient rendus à notre
créateur, le Dieu de l'univers, source de toute sagesse et de toute
intelligence pour sa grâce, son amour et le courage qu'il ne cesse de
nous donner.
Le présent travail réalisé à
l'Usine à Cuivre de Kolwezi, marque la fin du premier cycle en science
de l'ingénieur et nous initie aux travaux scientifiques. Il n'aurait pas
vu le jour sans le concours de plusieurs personnes, qu'il nous soit permis de
leur témoigner notre gratitude.
Nous sommes reconnaissante à l'égard du Chef de
Travaux l'ingénieur civil Camille BOTULU BOT'BEN qui a bien voulu
diriger ce travail, du Directeur de l'UCK l'ingénieur civil Odilon MWEPU
WA NZOVU qui a initié ce travail, de l'ingénieur civil KAPENDA
SAMPASA pour ces conseils et ses orientations, de Mr PESHI pour son
encadrement, du corps professoral de la Faculté Polytechnique de
l'Université de Kolwezi.
Nous remercions Mr Jean Luc TSHIJIKA pour sa disponibilité
et pour ses conseils.
Qu'il me soit permis, enfin de remercier tous mes amis et
camarades : Gandhi BOTULU, Clark BIREGE, Emmanuela Wa SAMBA, Sylvie NANSONG,
Yves MULONGA, Fancy FATUMA, Joël MAYAVA, Ghislain KIBWE, Hugues KANDA.
Ophélie MWENDO KABAYO.
1
INTRODUCTION GENERALE
La plupart des usines métallurgiques sont butées
au problème de résidus provenant des différentes
opérations de traitement des minerais. L'Usine hydrométallurgique
à Cuivre de Kolwezi (UCK) traite le concentré venant du
Concentrateur de Kolwezi (KZC) qui est de nature Cupro-cobaltifère sous
la forme oxyde et d'une faible proportion des sulfures qui demeure insoluble
dans les conditions de traitement de ce dernier.
Ce concentré est alimenté au circuit cuivre en
vue de produire le cuivre cathodique puis, une partie des rejets du circuit
cuivre est lavée et est ramenée au circuit secondaire pour la
production des sels de cobalt. La pulpe qui ne peut être traitée
est tout simplement renvoyée dans la nature.
N'étant pas totalement épuisés en cuivre
et en cobalt ces rejets constituent une perte en minéral utile et un
problème environnemental à cause de la présence des
sulfures. En dehors de ce problème que nous venons d'évoquer, il
a été constaté en plus une accumulation des rejets solides
au niveau des décanteurs, cet état de chose alourdi le processus
de stockage et l'évacuation ultérieure.
C'est dans ce contexte qu'UCK nous a proposé
d'étudier la solubilisation du cuivre et du cobalt contenus dans les
Under-flow du premier décanteur en milieu sulfurique.
Pour étudier cette solubilisation des Under-flow nous
avons premièrement lixivié en milieu acide seul puis en
présence de l'agent oxydant, l'ion ferrique [Fe3+], afin de
comparer les deux lixiviations et choisir celle qui donnerait les meilleurs
résultats.
Notre travail sera subdivisé en deux parties
essentielles, après la présente introduction, à savoir une
partie théorique dans laquelle sont exposés un aperçu
théorique sur la lixiviation et la décantation à l'UCK et
sur la lixiviation des sulfures ; et une partie expérimentale
consacrée aux essais, à la présentation des
résultats et leur interprétation. Une conclusion est
donnée à la fin du travail.
2
CHAP I : LIXIVIATION ET DECANTATION A UCK
I.1. Présentation de l'usine
I.1.1 Situation géographique
L'usine à cuivre de Kolwezi (UCK), de son temps usine
à zinc de Kolwezi (UZK) ; est une usine hydro métallurgique
située en République Démocratique du Congo dans la
province du Katanga et à 15 Km au nord-ouest de la ville minière
de Kolwezi, à mi-chemin entre l'usine hydro métallurgique de
Luilu (KCC) et le concentrateur de Kolwezi (KZC).
L'industrie de production du zinc électrolytique
étant une grosse consommatrice de courant électrique (5000
kilowatt heure par tonne de zinc), le fonctionnement de la nouvelle usine
était conditionné par la construction de la centrale de Nzilo
mise en service en 1952 et plus tard celle de Nseke opérationnelle en
1956.
Le site de l'usine avait été choisi à
l'époque de manière à être le plus près
possible de la source d'alimentation en courant électrique pour
réduire le coût d'investissement du transport de l'énergie
électrique et être à côté d'une source d'eau
suffisante.
I.1.2 Historique de l'usine
La Générale des Carrières et des Mines
est née le 02 janvier 1967 à la suite de la nationalisation de
l'Union minière du Haut Katanga (UMHK). Cette dernière,
créée le 28 octobre 1906, était une association entre :
+ Les détenteurs de droits de concessions des gisements de
cuivre (l'Etat
Indépendant du Congo EIC) ;
+ La Tanganyika concessions limited ;
+ La société générale de la Belgique
;
+ Robert WILLIAMS et la société qu'il dirigeait
;
+ La compagnie du Katanga.
Cette société comprend plusieurs usines en
occurrence :
+ L'usine de Lubumbashi ; + L'usine de Shituru
+ Le concentrateur de Kolwezi + L'usine à cuivre de
Kolwezi.
3
Cette dernière, devant l'importance croissante des
tonnes des concentrés qui étaient produits à partir des
minerais cupro-zincufère, de la mine de Kipushi, a été
créée le 30 juin 1948 sous le nom de la société
métallurgique du Katanga METALKAT en abrégé.
Le rôle était de traiter la blende (sulfure de
zinc) grillée de manière à obtenir un métal de
zinc. Avant d'être livrée à l'UZK, la blende subissait
à la division acide des usines de Shituru (US / DA), un grillage qui
permettait de transformer le sulfure de zinc insoluble en oxyde de zinc
soluble. Cet oxyde (blende grillée) ainsi obtenu restait encore
associé, en proportion variable des divers impuretés telles que
le cuivre, le cadmium, l'antimoine, le germanium, le cobalt...
Toutes ces imputées qui sont nobles que le zinc
étaient susceptibles de se déposer à l'électrolyse
avant le zinc et de compromettre ainsi l'extraction métallurgique de ce
métal, il fallait donc purifier au maximum, avant l'électrolyse,
la solution de sulfate de zinc obtenu par l'oxyde de zinc impur. Cette
purification qui s'opérait par étape avec l'ajout des morceaux de
cathode et de poudre de zinc, de l'antimoine et du permanganate de potassium
permettait d'écarter au maximum possible du circuit direct de production
du zinc des éléments tels que le cuivre, le cobalt, le cadmium,
le fer. La première tonne de zinc électrolytique a
été produite en juin 1953 par METALKAT.
En 1962 fut créée la société
métallurgique du Katanga (MTK) qui devient en 1971, la
société métallurgique de Kolwezi qui finalement le 30 juin
1974 intégra la Gécamines sous le nom de l'usine à zinc de
Kolwezi UZK en sigle. De 1955 à 1966, cette usine traitait pour le
compte d'UMHK (Union Minière du Haut Katanga), les poussières des
filtres à sac des UL (usine hydro métallurgique de LUBUMBASHI) et
extrayait du cadmium et des hydrates de germanium.
L'UZK a fonctionnée dans son entièreté
aux files des années mais en 1989, la baisse de production fut
observée à cause de la baisse de l'exploitation de la mine de
Kipushi et en 1992, la mine a été mise à l'arrêt et
toutes les filières du zinc avec (concentrateur de Kipushi, usine acide,
usine à zinc).
C'est vers 2008 que l'usine à zinc de Kolwezi
était transformée en usine à cuivre de Kolwezi UCK en
abrégé, et c'est au cours de cette même année qu'a
vu le jour le premier cuivre cathodique.
4
DM
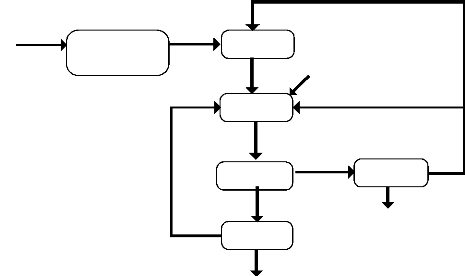
Filtration
Alimentation
Reprise et stockage
Pulpage
H2SO4 frais
Lixiviation
UF
Décantation
OF
Électrolyse
Cuivre
cathodique
Gâteau vers brousse
Figure1: Flow sheet UCK
I.2. Lixiviation à l'UCK
L'usine à cuivre alimentée par KZC
(concentrateur de Kolwezi), reçoit un concentré titrant en
moyenne 1 à 2% cobalt, 10 à 15% de cuivre et une humidité
de 15 à 20%.
Après la décharge et le stockage, la reprise de
ces concentrés à l'aide d'une goulotte est faite pour être
alimentée aux conditionneurs afin de préparer la pulpe.
La pulpe ayant été préparée dans
les conditionneurs avec une quantité DM (départ moyen, solution
acidifiée titrant #177;20g» l) provenant de la salle
d'électrolyse est alimentée à la lixiviation. La
lixiviation étant une mise en solution d'un minerai ou d'un
concentré à l'aide d'un solvant qui permet d'obtenir une phase
aqueuse susceptible de dissoudre le métal du minerai, à UCK cette
mise en solution est faite avec la pulpe venant des conditionneurs et un ajout
d'acide sulfurique concentré dans le but d'obtenir une bonne
concentration en cuivre et en cobalt dans les Pachuca.
5
L'Usine à Cuivre de Kolwezi possède sept Pachuca
de 36m3 de capacité et une de 80m3 dit cuve DN,
mais actuellement l'usine ne fonctionne qu'avec quatre Pachuca et la cuve
DN.
Le Pachuca est un réacteur ayant une forme cylindrique
dont l'alimentation de la pulpe et/ou du concentré et même la
décharge du produit de lixiviation se fait par le haut, le bas est un
peu allongé par une tuyauterie par laquelle il reçoit l' air
comprimé ou de la vapeur d'eau si un apport calorifique est
nécessaire.
Ces quatre Pachuca sont mis en série afin de permettre
un processus continu et l' air comprimé est injecté avec une
pression de 3kg »cm2 , par gravité le produit de
lixiviation s'écoule du premier Pachuca jusqu'à la cuve DN qui
est au faite un agitateur mécano-pneumatique.
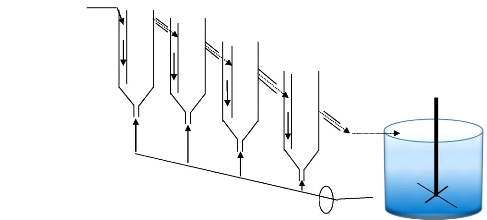
Pulpe + H2SO4 frais
+DM
Agitateur
3kg/cm2 d'air
DN
Figure 2 : série des Pachuca
6
Les paramètres de marche de la
lixiviation
+ L'acidité au début de lixiviation :
80g»l
+ L'acidité en fin de lixiviation : 13 à
17g»l
+ Température : les réactions de lixiviation
étant exothermiques, elle est d'environ 60°C.
+ Temps de lixiviation : le temps est compris entre 2 heures
et 3 heures.
+ L'allure de marche est de 80m3»h.
+ Le pH à l' entrée de Pachuca : compris entre 0,8
et 1. + Le pH à la sortie : 1,5
L'objectif de la lixiviation à UCK est de
récupérer en milieu sulfurique le cuivre et le cobalt, avec les
paramètres cités ci-hauts, le rendement de lixiviation atteint
environ 98% pour le cuivre.
Après la lixiviation, tous les solides entre autre la
silice, les sulfures et les oxydes non dissous se trouvant au font de la cuve
(DN) sont aspirés par une pompe vers un hydrocyclone où ils
subissent déjà une première décantation ; les
over-flow de cette séparation retournent à la cuve DN et les
Under-flow vont à la filtration, la solution se trouvant à la
surface de la DN s'écoule dans le chenal où l'on injecte une
quantité de floculent à 3000 l/h selon que le débit
d'écoulement est de 80 m3/h.
Le floculant est un élément chimique servant
à favoriser la séparation solides-liquides dans les
décanteurs, l'usine prépare ce floculant à partir d'un
mélange du guarfloc 64 et la Brontë 234 à 1g/l dans une
bâche d'une capacité de 1.2m3, on y met 1.2kg de ce
mélange. Le mélange solution-floculant continu sa course
jusqu'à la décantation.
I.3. Décantation à l'UCK
La solution lixiviée quittant la section de lixiviation
s'écoule dans un chenal ou on y ajoute un floculant du type guarfloc 64
et la Brontë 234 servant à l'amélioration des
caractéristiques de décantation des particules solides dans les
décanteurs.
7
Les décanteurs (clarificateur) sont des
réacteurs en forme cylindrique munis d'une caisse centrale et un
mécanisme de racleur pour assurer une bonne décantation qui est
au faite un processus de séparation de particules solides et de la
solution clarifiée qui quitte le décanteur par
débordement.
La pulpe lixiviée alimente le premier décanteur
; UCK possède quatre décanteurs dont deux servent de stockage des
Under-flow au cas où le filtre à tambour est en panne,
jusqu'à l'obtention des surverses qui est la phase liquide servant
à alimenter les deux salles d'électrolyse et les souverses qui
constituent la phase solide de notre pulpe lixiviée, cette phase est un
mélange de tous les métaux qui ne sont pas solubilisés
dans les Pachuca, ce mélange a une composition en Cu sous la forme
d'oxyde et sulfure ; la grande partie est sulfuré à cause de la
lixiviation acide qui solubilise la partie oxyde, nous avons également
le cobalt, le manganèse, le fer, le zinc et autres...
a. Caractéristique du premier
décanteur
Le premier décanteur est un
décanteur-clarificateur généralement
caractérisé par un temps de séjour des boues et leur
concentration limite, les surverses ont généralement une
concentration en particule nulle et sous verses concentré en boue.
Les dimensions du décanteur :
+ hauteur : 3.45 m + diamètre : 21.44 m + capacité
: 1475 m3
b. Paramètres de
décantation
+ La solution doit être la plus claire possible ;
+ Les UF doivent avoir pratiquement tous les solides ;
+ Les UF doivent avoir au moins 230mg/l de solide, au-delà
de cette
valeur, il y a risque d'avoir formations des bourgeons à
l'électrolyse ;
+ Les UF doivent avoir une densité autour de 1650 ;
+ La notion de charge et la montée des filets des
décanteurs doit
être contrôlé, c'est une notion que l'on
situe sur le mécanisme des racles se
trouvant dans les décanteurs ;
+ L'acidité de la solution doit être au moins de
5g/l.
? La décantation accélérée ; celle
qui exigent un traitement de
coagulation-floculation, elle est appliquée à des
solides finement divisés.
8
La décantation (clarification) permet d'obtenir,
partant d'une solution solides-liquides : un liquide clair très peu
chargés en solides sous l'influence de la pesanteur et de la floculation
(phénomène par lesquelles particules solides individuelles
s'agglomèrent entre elles). Le type de décanteur est un
décanteur-clarificateur DEGREMONT,montré par la figure 3 pour la
clarification de la solution sortant de lixiviation chargé en particules
et le principe de fonctionnement pour ce type de décanteur est que la
répartition de la suspension à décanter se fait à
partir d'une unité centrale munie d'une jupe de répartition,
l'effluent décanté est récupéré à la
périphérie alors que les solides sont extraites au bas de
l'appareil.
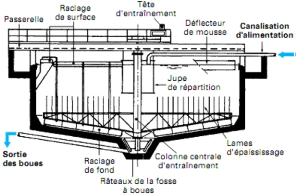
Figure3 : décanteur DEGREMONT
c. Quelques notions sur la
décantation
Etant une notion basée sur la séparation, la
décantation se fait selon trois grands modes sur le plan technique :
? La décantation statique ; celle des particules solides
dans un
liquide, l'opération d'extraction des boues et du
liquide clair se font d'une manière continue et est
réalisé dans des bassins rectangulaires ou circulaires avec ou
sans raclage.
9
+ La décantation lamellaire ; celle où l'on
réduit le trajet des
particules solides pour être capté par une paroi de
la cuve et ainsi de la séparée de la phase liquide.
La clarification, l'épaississement et le lavage des
solides sont des opérations de séparation faite dans le but de
maximiser la dite séparation et cette séparation est
influencé par les facteurs qui sont :
+ La concentration de la phase solide (rapport
solide/liquide), débit, température ;
+ La nature, densité, viscosité du liquide ;
+ La solubilité des solides, densité solide,
granulométrie des solides, structure des solides (grains, fibres,
colloïdes) ;
+ La vitesse et courbe de sédimentation, durée
de la sédimentation, type d'appareil, mode de fonctionnement ;
+ La concentration de la phase liquide dans le
sédiment, concentration de la phase solide dans la surverse.
Les équipements de décantation sont
utilisés chacun selon sa fonction, nous avons : les décanteurs
clarificateurs, décanteurs à lits de boues et à
recirculation de boues, les décanteurs-épaississeurs. (KASHALA
M., 2015)
Les acides tels que l'acide sulfurique et l'acide
chlorhydrique sont utilisés pour la lixiviation des minerais et
concentrés oxydés.
10
CHAP II. CONSIDERATION THEORIQUE SUR LA
LIXIVIATION
DES SULFURES
II.1. Généralités sur la
lixiviation
II.1.1. Définitions
L'obtention du métal en métallurgie extractive
se fait par deux voies, soit par l'hydrométallurgie (voie humide) ou
soit par la pyrométallurgie (voie sèche).
L'hydrométallurgie commence par la lixiviation, qui est
un procédé consistant en une mise en solution sélective
d'un concentré ou d'un minerai par un solvant (acide ou base),
l'objectif de cette opération est de dissoudre une grande
quantité des métaux utiles. (ALVAYAI C., 2006)
II.1.2. Réactifs de lixiviation
Le choix de réactifs utilisés comme agents de
lixiviation dépend de plusieurs facteurs qui sont :
+ Les caractéristiques physiques et chimiques du minerai
à lixivier ;
+ Le coût du réactif ;
+ La sélectivité vis-à-vis du constituant
à lixivier ;
+ Une disponibilité quantitative ;
+ Un bon prix sur le marché ;
Le réactif doit avoir les possibilités d'être
recyclé après sa régénération. . (MWEPU NZ.,
2013)
+ Les réactifs de lixiviation les plus couramment
utilisés sont :
a. L'eau
Elle est utilisée pour la lixiviation des minerais
solubles dans l'eau tels que les sulfates et même les oxydes.
b. Les acides
11
c. Les bases
Les bases telles que l'hydroxyde de sodium (NaOH) et
l'hydroxyde d'ammonium (NH4OH) sont utilisées respectivement
pour la lixiviation des bauxites ainsi que celle des minerais de cuivre et de
nickel
d. Les sels solubles
Le sulfates ferreux, les chlorures, les carbonates et
cyanures de sodium permettent la lixiviation de certains minerais
sulfurés tels que le CuS.
e. Les bactéries
Les microorganismes tels que les thiobacillus pour les
sulfures des métaux, les minerais complexes ainsi que pour les roches
à faible teneur en minerai (< 0.4%). On effectue donc une
biolixiviation.
f. Les gaz
dissouts
Le SO2, Cl2, O2
utilisés pour la lixiviation du Zinc. (BLAZY P., 1979)
II.1.3 Critères de choix d'un réactif de
lixiviation
Plusieurs critères doivent être satisfaits pour
un réactif de lixiviation, le prix du réactif étant le
plus important, la capacité sélective à dissoudre le
métal que l'on désire, la facilité de manipulation et de
préparation, la capacité de régénération et
le taux de corrosion. (KASHALA M., 2014)
II.1.4 Techniques de lixiviation
La lixiviation demande la mise en contact d'un fluide avec un
solide, les techniques de lixiviation dépendent de la teneur en
éléments utile ainsi que de la facilité de dissolution. On
tient à signaler que toutes ces techniques citées ci-dessous se
font soit dans les cuves ayant des différentes formes ou dans les
fossés préparés. . (HABASHI F., 1970)
12
II.1.4.1 Par percolation
Dans cette technique le contact est réalisé par
circulation de la solution lixiviante à travers un lit fixe des solides
en couches de grain relativement perméable.
a) Lixiviation en place (in situ)
Cette technique est utilisée lorsque la teneur en
minéraux utiles est faible ou pour des minéraux pauvres, elle
consiste en la lixiviation directe du minerai en place vu que les
opérations de minages et de transport n'est pas rentable.
Pour réaliser cette lixiviation, on introduit dans le
gisement le solvant et la solution est récupérée à
l'aide d'un drain soit par irrigation ; lorsque le gisement est exposé,
ou soit par injection lorsqu'il est enterré.
Cette technique exige :
? Une bonne fragmentation du gisement pour permettre un
contact efficace entre le réactif et le minerais.
? Un bon isolement du gisement vis-à-vis de
l'hydraulique souterrain afin d'éviter la pollution de l'eau et une
dilution des solutions obtenue.
b) Lixiviation en tas
Cette technique est utilisée pour des minerais
très pauvres, l'opération se fait sur une surface plane
inclinée préalablement nettoyée et imperméable,
au-dessus de cette surface on dépose les minerais grenus en tas et on
asperge ensuite le réactif.
La solution riche est recueillie à
l'extrémité inferieure de la surface afin d'être
pompée aux bassins de récupération, lorsque la surface est
naturellement imperméable on parle de DUMP LEACHING et lorsqu'elle est
préparée artificiellement on parle de HEAP LEACHING.
c) Lixiviation en stalles
Le minerai à traiter est placé dans un
réservoir rectangulaire et est placé sur la base de ce
réservoir, l'agent de lixiviation est ajouté continuellement
à la surface du minerai de manière ascendant. La solution riche
est continuellement recueillie et évacuée du réservoir.
II.1.4.2. Par agitation
L'agitation permet un meilleur contact entre l'agent de
lixiviation et solides à lixivier. On distingue :
13
? Agitation pneumatique : elle se fait dans les Pachuca
(réacteur cylindrique) munit d'une tubulure centrale à travers
laquelle une injection d'air comprimé détermine un mouvement
ascendant de la pulpe.
? Agitation mécanique : le réacteur de
lixiviation est agité mécaniquement afin de permettre un bon
contact.
II.1.4.3. Lixiviation sous pression
Cette technique permet de l'accélérer la mise en
solution des éléments utiles qui sont lentes à pression
atmosphérique, elle a lieu dans les autoclaves et la pulpe est
injecté sous pression. Étant donné que la cinétique
réactionnelle des sulfures est lente, cette technique est recommandable
pour ce type de minerais.
II.1.5. Types de lixiviation
Les types de lixiviation sont classés suivant les
agents lixiviants utilisées (MWEPU NZ., 2013). On distingue :
II.1.5.1. Lixiviation acide
Cette lixiviation est utilisée pour les minerais
à gangue acide, le milieu solvant est constitué de l'acide.
On distingue dans cette catégorie :
a) Lixiviation acide et oxydante : elle se déroule en
présence d'un agent oxydant (sel ferrique ou O2) et est
utilisée pour les minerais oxydés, mixtes ou sulfurés
Exemple:
Cu2O + H2SO4 + Fe2
(SO4)3 ? 2CuSO4 + 2FeSO4 +
H2O (1) Cu2S + 2Fe2 (SO4)
3? 2CuSO4 +4FeSO4 +S (2)
b) Lixiviation acide et réductrice : elle se
déroule en présence d'un agent réducteur (SO2,
Na2S2O3,...)
Exemple:
Co2O3 + Cu + 3H2SO4 ?
2CoSO4 + CuSO4 + 3H2O (3)
Dans cette réaction le Cu est utilisé comme
réducteur du Co
14
II.1.5.2. Lixiviation ammoniacale
La lixiviation ammoniacale est utilisée pour les minerais
à gangue dolomitique (CaO, MgO) qui se prêtent mal à une
attaque acide. Pour les minerais sulfurés, la lixiviation ammoniacale se
fait en présence d'oxygène comme agent lixiviation.
Exemple : NiS + 6NH3 + 2O2 ?
Ni(NH3) 6 SO4 (4)
II.1.5.3. Lixiviation par
cyanuration
Dans les solutions dilué de cyanure saturé en
oxygène se dissolve l'or et l'argent, les métaux lixiviés
passent à l'état de complexe : Au(CN) 2 et Ag(CN) 2
Exemple : 2Au + 4NaCN + O2 ? 2NaAu(CN) 2 +
2NaOH (5)
II.1.5.4. Lixiviation par les
chlorures
Cette lixiviation est utilisée pour les minerais
sulfurés mais l'utilisation de l'acide chlorhydrique est exclue compte
tenu de son prix qui est élevé, cependant on emploie une solution
acide de FeCl3.
Exemple: CuFeS2 + FeCl3 ? CuCl + FeCl2
+ 2S (6)
II.1.5.5. Lxiviation par la soude
caustique
Cette lixiviation est pour dissoudre les oxydes tels que la
bauxite.
Exemple : Al2O3 + 2NaOH ? 2NaAlO2
+ H2O (7)
II.1.5.6. Lixiviation
bactérienne
Elle est utilisée pour la mise en solution des mineras
sulfurés, pauvres et complexes. Les microorganismes comme les
thiobacilles et les ferrobacilles possèdent des propriétés
catalytiques permettant d'augmenter la cinétique de lixiviation.
II.2 Types de lixiviation des sulfures
A. La biolixiviation
Ce type de lixiviation est utilisé pour les roches
à faible teneur en minerais (< 0.4%), les microorganismes sont
utilisés pour dissoudre les sulfures afin d'en extraire les
métaux : Au, Cu, U, etc. (MICHEL B., 1998)
Les bactéries oxydent le soufre et le converti en
espèces solubles :
4FeS2 + 15O2 + 2H2O =
2Fe2 (SO4) 3 + 2H2SO4
(8)
15
Les techniques de lixiviation utilisée pour la
biolixiviation :
ü Lixiviation en tas (heap leaching) : Apres concassage
du minerais, le produit concassé est placés dans un fossé
étroit recouvert d'une membrane imperméable et le tout est
saturé avec une solution acide ayant un pH=2ou3 et des thiobacilles .Le
minerais est aéré pendant la lixiviation, le lixiviat est
recueilli à la base du fossé.
ü Lixiviation en stalles (vat leaching) : La roche
concassée est mélangée de façon continue avec les
bactéries et la solution acide dans des grands réservoirs.
Les microorganismes pour la biolixiviation :
ü Les bactéries acidophiles, sont
impliquées dans l'oxydation des sulfures de métaux avec le
thiobacillus ferroxidans entre 30-35°C à un pH --2.
ü Les bactéries mésophiles du fer et du
soufre ; parmi lesquels le leptospirillium ferrooxydant oxyde fer entre 30 et
40°C, le thiobacillus thioxydant oxyde le soufre à 30°C.
Autres microorganismes : le thermophiles
modérés(T-- 50°C) et les thermophiles extrêmes(T
65-80°C).
Le Fe(III) agit comme oxydant, une fois réduit en
Fe(II), il peut être ré-oxydé en Fe(III) par le
thiobacillus ferrooxidans et le leptospirillium ferrooxydant. Une étape
essentielle de la biolixiviation est la régénération du
sulfate ferrique.
ü Oxydation bactérienne du Fe(II) 4Fe2+ +
O2 + 4H+ = 4 Fe3+ + 2H2O (9)
ü Oxydation chimique du Fe(II)
FeS2 + 14Fe3+ + 8H2O =
15Fe2+ + 2SO42-+ 16H+ (10)
Biolixiviation des sulfures de fer et de cuivre
ü Oxydation microbienne de la pyrite :
2FeS2 + 7 O2 + 2H2O =
2Fe3+ + 4SO42- + 4H+ (11)
ü Oxydation chimique de la pyrite :
FeS2 + 14Fe3+ + 8H2O =
15Fe2+ + 2SO42- + 16H+ (12)
16
? Oxydation microbienne de la pyrrhotite (FeS) et de la
chalcopyrite (CuFeS2) est lente et parfois incomplet
2CuFeS2 + 8 H2O = 2Cu2? +
2Fe3? + 4SO42- + 16H? (13)
Les solutions de biolixiviation de la chalcopyrite produisent
du soufre qui tend à recouvrir les particules minérales et
à interférer dans le transfert d'électrons, la formation
du soufre à la surface des particules se produit dans les processus
chimiques et microbiens. Pour empêcher la formation du soufre on ajoute
à la solution une catalyse (sels d'argent) du soufre afin de modifier la
chimie du soufre.
B. La biosorption
La biosorption est un terme utilisé pour
décrire tous les processus reliés à la
récupération des métaux en présence des absorbant,
qui sont des cellules vivantes ou morte.
La biosorption se fait avec des bactéries active ;
lorsque les interactions métaux-bactéries se fait avec des
cellules vivantes (précipitations, oxydation-réduction, ...),
passive ; lorsque les métaux sont transformé suite à des
réactions physico-chimiques (complexation par des substances produites
par les cellules, absorption du métal sur la paroi cellulaire). (MICHEL
B., 1998)
C. La précipitation
Le processus se fait sous des conditions anaérobies
(qui se déroule en l'absence de l'oxygène) et performe une
oxydation complète des sulfures à l'aide des bactéries
sulfato-réducteur.
II.3. Approche thermodynamique et cinétique de la
lixiviation
II.3.1. Approche thermodynamique
La thermodynamique nous permet de prévoir si une
espèce chimique donnée est stable ou ne l'est pas, nous permet
également de prévoir si une réaction est possible ou non.
Les conditions de mise en solution des espèces métalliques sont
étudiés en fonction de l'acidité (pH) ainsi que du
potentiel d'oxydo-réduction de la solution et cela grâce au
diagramme de POURBAIX spécifique à chaque métal (diagramme
tension-pH).
17
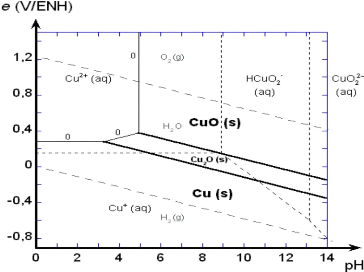
Figure4 : diagramme de POURBAIX du système
Cu-H2O à 25°C
L'examen du diagramme Cu-H2O montre que l'obtention
des ions Cu2+en milieu aqueux se fait à un pH de = 4 et ces
ions sont stables en milieu acide et oxydant.
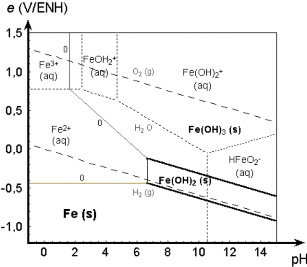
Figure 5 : diagramme E-PH du système Fe-H2O
à 25°C
18
Selon ce diagramme le fer est stable dans le domaine oxydant
et moins acide. La présence d'un réducteur en milieu acide
favorise la formation de l'ion ferreux.
On tient à signaler que le fer est l'une des
impuretés majeures, qu'il faut donc éviter sa mise en solution.
Du fait que les conditions de mise en solution du cuivre et du cobalt font que
le fer entre aussi en solution, il faut donc procéder à la
minimisation de sa solubilisation.
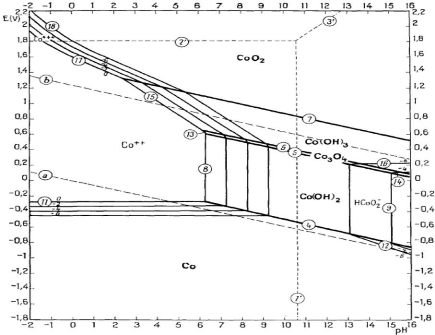
Figure 6 : Diagramme E-pH du système Co-H2O
à 25°C
L'ion Co2+ est soluble en milieu acide tandis que
l'ion Co3+ne l'est pas et exige un réducteur pour sa
solubilisation. Ce diagramme indique les domaines de stabilités du
cobalt ainsi que ses dérivés.
II.3.2. Approche cinétique
La cinétique chimique nous renseigne sur la vitesse de
réaction qui inclut le mécanisme des transformations chimiques
ainsi que leurs vitesses.
Avec,
19
La lixiviation étant une réaction
hétérogène mettant en contact une phase solide et une
phase liquide. Les caractéristiques des réactions
hétérogènes sont :
+ Nature de l'interface solide-liquide ;
+ Présence d'une interface entre les réacteurs ;
+ La géométrie de l'interface ;
+ L'aire de l'interface. (MWEPU NZ., 2013)
Le contact solide- liquide est recouvert d'une couche de
liquide immobile liée à l'adhésion du liquide à la
surface et à la vitesse de déplacement de la couche par suite de
la viscosité du liquide, au travers laquelle les réactants de
lixiviation doivent diffuser avant d'atteindre l'interface. L'étape la
plus lente est celle qui impose la cinétique globale de la
réaction hétérogène, trois cas sont possibles :
y' La réaction est contrôlée par la
diffusion lorsque la vitesse de réaction à
l'interface est plus rapide que la diffusion des
réactants à l'interface. y' La réaction est
contrôlée chimiquement lorsque la vitesse de la réaction
chimique est plus lente que la vitesse de diffusion.
y' Le contrôle mixte est observé lorsque la vitesse
de la réaction chimique est du même ordre que celle de la
diffusion.
Facteurs qui influencent la cinétique de lixiviation
(MAYELE K., 2009) : + La nature de la surface solide
La nature de la surface des solides réactants joue un
rôle sur la cinétique de la réaction mettant en jeu des
solides, ceci est dû à la présence des défauts tels
que les dislocations, les impuretés chimique et les atomes
interstitiels.
+ La température
La température a une influence sur les processus
chimique car la constante cinétique k, dans l'expression de la vitesse
(v = k. A .Ci) varie exponentiellement avec la température selon la
relation d'Arrhenius :
Ea
k = K. e? R.T
20
K: Constante caractéristique Ea: Energie d'activation R :
Constante de gaz parfait T : Température en Kelvin
? L'agitation
La diffusion est très sensible à l'agitation ;
l'augmentation de la vitesse d'agitation permet de réduire
l'épaisseur de la couche limite, ce qui augmente la vitesse de
réaction selon :
V = ? ? .?(C - Ci)
Où ? : Epaisseur de la couche limite A : Aire
de la surface considérée
C : Concentration du réactant
Ci : Concentration du réactant à l'interface
D : Coefficient de diffusion de la substance ? La
granulométrie
La taille des particules augmente la surface de contact entre
les solides et le liquide, ce qui augmente la vitesse de réaction.
? La densité de la pulpe
L'augmentation du rapport phase aqueuse sur phase solide tout
en maintenant la constance de la concentration de l'espèce lixiviante
provoque l'augmentation de la vitesse de lixiviation.
? La concentration de l'espèce lixiviante en solution
ou la pression
de gaz
La solubilité du gaz dans le liquide est
favorisée par l'augmentation de la pression des gaz, ce qui conduit
à une augmentation de la concentration de l'espèce lixiviante en
solution. Ainsi la vitesse de la réaction s'agrandie.
21
II.4. Paramètres de lixiviation
Les réactions de lixiviation sont des réactions
hétérogènes qui dépendent fortement de la finesse
du minerais ; plus le minerais est fin plus grand est la surface de contact et
la lixiviation s'accélère proportionnellement à cette
surface de contact, l'agitation qui permet de renouveler la surface de contact
entre le solide et la solution lixiviante.
Les paramètres de lixiviation consistent à
définir les conditions donnant un bon rendement de solubilisation pour
un cout minimum.
Les paramètres importants sont :
+ La température
+ L'agitation
+ Le pourcentage des solides
+ Le pH
+ La concentration des réactifs
+ La granulométrie
+ Le temps (MWEPU NZ., 2013)
Les critères d'évaluation suivis pour une
étude de mise en solution de solides
sont :
+ Le rendement de lixiviation(Rdt), est un rapport de la
quantité du métal solubilisé sur celui alimenté
avant la
lixiviation. il est exprimé
en pourcentage.
+ La solubilisation(Sol), nous renseigne sur la
quantité de métal lixivié d'une quantité
donnée du minerai. Elle s'exprime en Kg /t de minerai, calculée
sur base des analyses sur les solides.
+ La consommation d'acide(CA), se calcule par analyse des
solutions (acidité initial et final), c'est la quantité d'acide
consommé au cours de la lixiviation et s'exprime en Kg/t de minerai.
Soient :
22
-P1 et T1, respectivement poids
alimenté sec(g) et teneur de l'élément
considéré alimenté(%)
-P2 et T2, respectivement poids du
résidu sec(g) et teneur de l'élément
considéré dans le résidu(%)
-A1 et A2, respectivement concentration
initiale d'acide dans la solution d'attaque (g/l) et concentration d'acide dans
le filtrat (g/l).
|
?1·?1 ?
?2·?2
Rdt =
|
?100
|
|
|
?1·?1
|
|
|
|
?1·?1
|
|
?2·?2
|
|
|
|
Sol =
|
???
|
|
???
|
?1000
|
|
|
|
|
|
?1
|
|
|
|
|
?1 ? ??2
CA =?1
|
?1000
|
23
CHAP III. CARACTERISATION DES UNDER-FLOW ET
PROCEDURES
EXPERIMENTALES
III.1. Échantillonnage et caractérisation
chimique
III.1.1. Echantillonnage
L'étude a été faite sur les résidus
de lixiviation du premier décanteur de l'Usine à Cuivre de
Kolwezi (UCK) ; ces résidus sont composés du cuivre, du cobalt,
du fer ainsi que d'autres éléments que nous n'avions pas eu le
moyens de les faire analyser.
Les résidus mis à notre disposition est sous forme
de pulpe ayant un pH de 1,3 ; il a donc nécessité un lavage, un
filtrage et un séchage dans l'étuve à 100°C. Ensuite,
il est broyé, homogénéisé dans le but d'avoir une
composition chimique uniforme
III.1.2 Caractérisation chimique
La composition chimique des Under-flow est reprise dans le
tableau 1 après analyse
chimique.
Tableau 1 : composition chimique de l'échantillon
|
Eléments
|
Cu total
|
Cu oxyde
|
Co
|
Fe
|
|
Teneur(%)
|
0,42
|
0,13
|
0,19
|
0,22
|
Le cuivre sulfure est calculé par la différence
entre le cuivre total et le cuivre oxyde, soit 0,29% de cuivre.
L'analyse granulométrique et l'analyse
minéralogique n'ont pas pu être effectuées compte tenue de
l'indisponibilité d'équipements et de matériels
adéquats.
III.2 Procédure expérimentale,
réactifs et matériels utilisés
III.2.1 Procédure expérimentale
La procédure utilisée pour nos essais consiste
en la mise en solution des Under - flow du premier décanteur, la
lixiviation. Cette dernière s'est effectuée en deux séries
:
ds : densité solide
24
? La première série d'essais a consisté
à effectuer une lixiviation en variant l'acidité, dans le but de
retenir la concentration maximum donnant un bon rendement pour le cuivre et le
cobalt.
? La deuxième série d'essais a consisté
à effectuer des lixiviations avec l'acidité retenue dans la
première série en variant respectivement ; le pourcentage
solides, la concentration de l'oxydant, la température et le temps.
L'échantillon mis à notre disposition doit
être préparé pour sa mise en solution sous forme de pulpe
faite en mélangeant X g de l'Under-flow avec Y ml d'eau acidulée
pour la première série et pour la deuxième
sérié X g de l'Under-flow avec Y ml d'eau acidulée et Z ml
de l'oxydant (Fe3+) concentré à 89g/l
La préparation de l'eau acidulée (acide frais
+eau distillé) se fait chaque fois dans une éprouvette de 2000ml
en prenant un volume d'acide sulfurique en ml selon la relation :
?×?×1??
Avec :
c : concentration en g/l
v : volume de la solution en l p : pureté en %(98)
d : densité (1,84)
VH2SO4 : volume acide concentré en
ml
La pulpe est préparée selon la consigne de
l'usine qui est de 1200, et le pourcentage solide est calculé en
fonction de cette densité et la densité de notre
échantillon est de 3,9. Le pourcentage solide est donné par la
relation :
??(??-1)
%?o?i?e = ??(??-1) ?100
Avec :
25
dp : densité pulpe
La concentration de l'ion ferrique, étant une
différence entre le fer total et l'ion ferreux est connue en faisant une
analyse chimique sur ces deux dernier contenue dans une solution de sulfate de
fer insufflé de l'air préparer à partir d'un
mélange d'une quantité importante de copeau de fer et une eau
acidulée à 150 g/l dans un récipient de 5000 ml.
Le mode opératoire pour utiliser pour les essais de
lixiviation est le suivant : Pour la première série d'essais :
y' Prendre une quantité connue de solides à
lixivier dans 500 ml
d'eau acidulée d'une concentration voulue ;
y' Placer le récipient sur une plaque chauffante et
maintenir la
température constante ;
y' Homogénéiser le mélange avec un agitateur
mécanique ;
y' Maintenir le pH de 1,2 ;
y' Après le temps donné arrêter la
lixiviation ;
y' Filtrer la solution de lixiviation et laver le gâteau
avec de l'eau
distillée jusqu'à la solution clair ;
y' Sécher le gâteau pendant 24 h dans une
étuve à 100°C ;
y' Faire l'analyse chimique du filtrat et du gâteau.
y' Pour la deuxième série d'essais :
y' Prendre un volume de sulfate fer contenant le Fe3+
de
concentration voulue ;
y' Mettre dans un récipient de 500 ml le volume de sulfate
de fer
de concentration voulue, un volume d'eau acidulée dont
la
concentration est celle retenue dans la première
série d'essais
et une quantité de solide connu;
y' Sur une plaque chauffante placé le récipient et
rendre
homogène le mélange avec un agitateur
mécanique à la
température voulue et la maintenir constante;
y' Maintenir le pH à 1,2 ;
y' Arrêter la lixiviation après le temps fixé
;
y' Filtrer la pulpe, laver et sécher le gâteau ;
26
y' Analyser chimiquement le gâteau et le filtrat,
déterminer ensuite le rendement de solubilisation du cuivre et du cobalt
en appliquant la formule :
|
?LixMe = ?.%?????.%???
?.%???
Avec :
|
X 100
|
a : poids de l'Under-flow
b : poids du résidu sec
Me : métal considéré
%MeA : teneur du métal dans l'alimentation
%MeB : teneur du métal considéré dans le
gâteau
Pour nos essais de lixiviation les paramètres
étudiés ont été
+ Le pourcentage solide
+ La concentration de l'acide
+ La concentration de l'oxydant
+ Le temps de lixiviation
+ La température.
Les essais de lixiviation ont été
réalisés dans les conditions de l'usine suivantes :
+ Le pH : 1,2
+ La densité de la pulpe : 1200
III.2.2. Réactifs
+ L'acide sulfurique à 98% et de densité 1,84
est le réactif qu'on a utilisé pour la mise en solution des
Under-flow. Des solutions d'attaque pour la première série
d'essais de concentration variables en acide sulfurique ont été
à savoir 20, 40,60 et 80 g/l. Pour la deuxième série
d'essais la concentration futilisée est celle qui a donné un bon
rendement de solubilisation dans la première série.
27
+ Le fer III utilisé comme oxydant à des
différentes concentrations dans
la deuxième série d'essais. III.2.3
Matériel utilisé
+ la balance électronique
+ un ballon de 500 ml et 1000 ml
+ un verre à pieds de 250ml
+ une plaque chauffante
+ un agitateur mécanique
+ une burette graduée de 2000ml
+ un ph mètre
+ les papiers filtres
+ une étuve
+ un thermomètre
+ une pissette
+ une pompe à vide pour la filtration
+ broyeur pulvérisateur
28
CHAP IV. PRESENTATION DES RESULTATS DE SOLUBILISATION DES
UNDER- FLOW
IV.1. Introduction
Les essais de lixiviation ont été
réalisés dans le but d'étudier la solubilisation en milieu
sulfurique du cuivre et du cobalt en présence d'un oxydant. Pour y
arriver nous avons procédé en deux séries d'essais dans le
but d'avoir un bon résultat sur l'étude faite.
IV.2. Présentation des résultats IV.2.1.
Essai préliminaire
Cet essai a été effectué dans les conditions
opératoires de l'UCK et les résultats de cet essai sont repris
dans le tableau 2.
Tableau 2 : Résultats de l'essai préliminaire
Conditions de travail :
? Temps : 3 heures ;
? Température : ambiante ;
? L'acidité de départ : 80g/l
;
? Densité pulpe : 23%sol ;
? Volume solution lixiviante : 500
ml
Ech. Résidu Filtrat + eau de lavage
Solubilisation Rendement
(Kg/Ts) (%)
Pds (g) Pds (g) Cu Co Vol Cu++
Co++ Cu Co Cu Co
(%) (%) (L) (g/l) (g/l)
166,52 142 0,25 0,12 0,90 0,38 0,16 2,05 0,87
48,90 45,80
De ces résultats, on confirme que l'échantillon
étudié contient des sulfures de Cu et Co et qu'il faudrait
améliorer la solubilisation de ces métaux en utilisant des
conditions oxydantes de lixiviation. Ces résultats sont en concordance
avec ceux de l'analyse chimique de l'échantillon qui a indiqué la
présence des sulfures.
29
Légende :
Pds : poids de l'échantillon sec
Cutot : pourcentage de cuivre dans l'échantillon
alimenté
Co : pourcentage de cobalt dans l'échantillon
alimenté
Vol : volume d'eau de lixiviation plus l'eau de lavage de
gâteau
Cu++ et Co++ : quantité de cuivre et
de cobalt dans Vol
Cu et Co: quantité de cuivre et de cobalt
solubilisée
%Cu et %Co : rendement de récupération de cuivre et
de cobalt
IV.2.1. Essais d'optimisation des rendements
La deuxième série d'essais nous permet de faire
l'étude de solubilisation en nous fixant cinq paramètres de
lixiviation qui sont :
? L'acidité ;
? La dose du Fe3+ ; ? La densité pulpe ; ? La
température ; ? Le temps.
IV.2.1.1. Influence de
l'acidité
Les résultats de la concentration d'acide sont repris au
tableau 3 et présenté à la
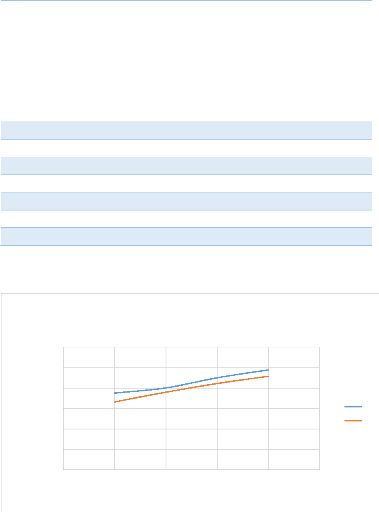
figure 7.
30
Tableau 3 : Influence de l'acidité
60,00
50,00
rendement de rec
(%)
40,00
Cu Co
30,00
20,00
10,00
0,00
Conditions de départ :
+ Température : 25°C ; + % solides : 23
;
|
+ Agitation : 300 tr/min
;
+ Temps de lixiviation : 2 h ; + pH
: 1,2 ;
+ Volume solution : 500
ml.
|
|
|
|
|
|
|
|
|
Param
|
Ech
|
Résidus
|
|
|
Filtrat + eau
|
|
Solubilisation
|
Rendement
|
|
[H+]
|
Pds
|
Pds
|
Cutot
|
Co
|
Vol
|
Cu++
|
Co++
|
Cu
|
Co
|
Cu
|
Co
|
|
g/l
|
G
|
G
|
%
|
%
|
L
|
g/l
|
g/l
|
Kg/T
|
Kg/T
|
%
|
%
|
|
20
|
153,64
|
128,2
|
0,31
|
0,15
|
0,97
|
0,25
|
0,10
|
1,58
|
0,63
|
37,58
|
33,23
|
|
40
|
157,94
|
133,2
|
0,30
|
0,14
|
0,95
|
0,28
|
0,12
|
1,68
|
0,72
|
40,10
|
37,99
|
|
60
|
162,23
|
135,2
|
0,28
|
0,13
|
0,93
|
0,33
|
0,14
|
1,89
|
0,80
|
45,04
|
42,24
|
|
80
|
166,52
|
142
|
0,25
|
0,12
|
0,90
|
0,38
|
0,16
|
2,05
|
0,87
|
48,90
|
45,80
|
Influence de l'acidité
0 20 40 60 80 100
acidité (g/l)
Figure 7 : Rendement de solubilisation en fonction de
l'acidité
31
Le résultat montre que le rendement du cuivre et cobalt
croit avec l'acidité, mais est médiocre pour nos deux
éléments alors que thermodynamiquement ils sont dans la zone de
solubilisation selon le pH, cela peut s'expliquer par la présence des
sulfures dans notre échantillon qui rendent la solubilisation complexe
et consomme l'acide ,la gangue également consomme l'acide par sa
solubilisation.
Ce qui nous amène à choisir l'acidité de
20g/l pour la suite de nos essais et avec l'ajout du Fe3+ qui nous
permettra de récupérer nos éléments se trouvant
sous la forme de sulfure.
IV.2.1.2. Influence de la dose du fer ferrique
L'ion ferrique est utilisé comme oxydant dans notre
solution de lixiviation, cinq essais ont été faite dans le but de
choisir la dose qui nous donnera une bonne solubilisation.
Les résultats de la dose ferrique sont donnés au
tableau 4 et à la figure 8. Tableau 4 : Influence de la dose du fer
ferrique
Condition de départ :
+ température : 25°C
+ % solides : 23
+ agitation : 300 tr/min
+ temps de lixiviation : 2 h
+ pH : 1,2
+ volume solution : 500 ml
+ concentration de l'acide : 20 g/l.
|
Param
|
Ech
|
Résidus
|
|
|
Filtrat + eau
|
|
Solubilisation
|
Rendement
|
|
[Fe3+]
|
Pds
|
Pds
|
Cutot
|
Co
|
Vol
|
Cu++
|
Co++
|
Cu
|
Co
|
Cu
|
Co
|
|
g/l
|
g
|
G
|
%
|
%
|
L
|
g/l
|
g/l
|
Kg/T
|
Kg/T
|
%
|
%
|
|
1
|
153,64
|
127
|
0,26
|
0,14
|
0,95
|
0,33
|
0,12
|
2,04
|
0,74
|
48,58
|
39,05
|
|
1,5
|
153,64
|
126,2
|
0,24
|
0,13
|
0,95
|
0,36
|
0,13
|
2,23
|
0,80
|
53,00
|
42,31
|
|
2
|
153,64
|
126,1
|
0,22
|
0,13
|
0,95
|
0,39
|
0,14
|
2,41
|
0,87
|
57,42
|
45,56
|
|
2,5
|
153,64
|
125,8
|
0,20
|
0,12
|
0,95
|
0,41
|
0,15
|
2,54
|
0,93
|
60,36
|
48,82
|
|
3
|
153,64
|
123,1
|
0,5
|
0,11
|
0,95
|
0,48
|
0,17
|
2,97
|
1,05
|
70,67
|
55,32
|
32
Influence de la dose
du fer ferrique
|
rendement de rec
(%)
|
80,00 70,00 60,00 50,00 40,00 30,00 20,00 10,00 0,00
|
|
Cu Co
|
|
|
|
|
0 0,5 1 1,5 2 2,5 3 3,5
conc de l'ion ferrique (g/l)
Figure 8 : Rendement de solubilisation en fonction du fer
ferrique
En voyant notre graphique, on constate que plus on augmente la
dose de l'ion ferrique dans la solution de lixiviation, plus le rendement du
cuivre et du cobalt croient. Ce qui nous amène à dire que l'ajout
de l'oxydant a amélioré considérablement nos rendement de
solubilisation par rapport à la lixiviation faite dans la
première série d'essais. Cet ajout du fer ferrique a fait
réagir le cuivre et le cobalt qui se trouvaient sous la forme de
sulfures en le solubilisant et cela jusqu'à expliquer la croissance de
nos rendements. Mais malgré cette croissance que l'on voit sur le
résultat de la figure 8, il y a encore une proportion du cuivre et du
cobalt qui ne passe pas en solution et se retrouve dans le gâteau
après la filtration, et pour récupérer cette proportion
dans la suite des essais nous retenons la concentration en ion ferrique de 3 g
/l pour des raisons évidentes.
IV.2.1.3. Influence du pourcentage
solide
La variation du pourcentage solide est étudiée
pour voir par rapport à la solubilisation du cuivre et du cobalt aux
essais précèdent, quel serait la quantité de solides
à alimenter à la lixiviation pour donner une solubilisation
considérable du cuivre et du cobalt. Notons que l'influence du
pourcentage solide a été étudiée dans la condition
à avoir une densité pulpe selon la marche de l'usine (1200).
Les résultats de l'influence du pourcentage solide sont
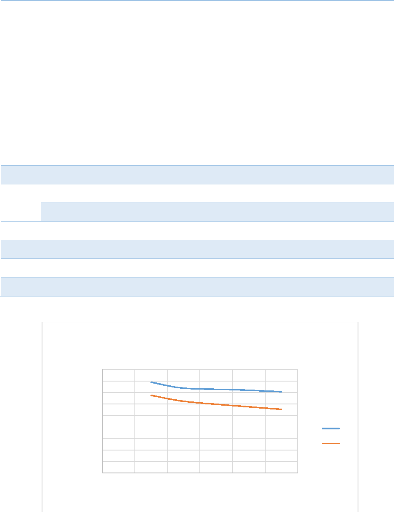
donnés au tableau 5 et à la figure 9
90,00
80,00
rendement de rec
(%)
70,00
60,00
50,00
40,00
Cu Co
30,00
20,00
10,00
0,00
Conditions de départ :
+ température : 25°C + Agitation
: 300 tr/min + temps de lixiviation : 2 h
+ pH : 1,2
|
|
+
+
+
|
volume solution : 500 ml
concentration de l'acide : 20 g/l concentration de l'ion
ferrique : 3 g/l.
|
|
|
|
|
Param
|
Ech
|
Résidus
|
|
|
Filtrat + eau
|
|
Solubilisation
|
Rendement
|
|
%sol
|
Pds
|
Pds
|
Cutot
|
Co
|
Vol
|
Cu++
|
Co++
|
Cu
|
Co
|
Cu
|
Co
|
|
g
|
G
|
%
|
%
|
L
|
g/l
|
g/l
|
Kg/T
|
Kg/T
|
%
|
%
|
|
15
|
90,77
|
87,25
|
0,09
|
0,06
|
0,97
|
0,3
|
0,12
|
3,31
|
1,28
|
78,88
|
67,49
|
|
17
|
105,35
|
100,3
|
0,12
|
0,07
|
0,96
|
0,34
|
0,13
|
3,10
|
1,18
|
73,77
|
62,35
|
|
20
|
128,59
|
118
|
0,13
|
0,09
|
0,96
|
0,41
|
0,15
|
3,04
|
1,11
|
72,50
|
58,63
|
|
23
|
153,64
|
123
|
0,15
|
0,11
|
0,95
|
0,48
|
0,17
|
2,97
|
1,05
|
70,67
|
55,32
|
Influence du pourcentage solide
12,00 14,00 16,00 18,00 20,00 22,00 24,00
% solides
33
Figure 9 : influence du pourcentage solide
Tableau 5 : Influence du pourcentage solide
34
La quantité des solides dans la solution joue un
rôle sur la cinétique de nos réactions, en ayant une
quantité minimum de solide dans la solution ; le contact solide -liquide
se fait beaucoup plus rapidement que lorsqu'on a une quantité importante
de solide dans la solution. On voit qu'au fur et à mesure qu'on alimente
beaucoup plus de solide dans la solution de lixiviation, le rendement de
solubilisation décroit alors qu'il croit lorsqu'on alimente un peu moins
de solide. Pour la suite de notre étude on prend 15 % en solide pour
constituer notre pulpe de lixiviation.
IV.2.1.4. Influence de la
température
Les réactions étant exothermiques, le
dégagement de chaleur impose la température de travail lorsqu'on
commence une lixiviation à température ambiante. L'étude
de la température est faite pour voir si ce paramètre joue un
rôle sur la solubilisation de notre échantillon.
Les résultats de l'influence de la température sont
donnés au tableau 6 et à la figure 10 Tableau 6 : Influence de la
température
Condition de départ :
+ pourcentage solide : 15% + agitation : 300
tr/min
+ temps de lixiviation : 2 h
|
|
+ pH : 1,2
+ volume solution : 500
ml
+ concentration de l'acide : 20
g/l
+ concentration de l'ion ferrique : 3
g/l.
|
|
|
|
|
Param
|
Ech
|
Résidus
|
|
|
Filtrat + eau
|
|
Solubilisation
|
Rendement
|
|
T
|
Pds
|
Pds
|
Cutot
|
Co
|
Vol
|
Cu++
|
Co++
|
Cu
|
Co
|
Cu
|
Co
|
|
oC
|
g
|
g
|
%
|
%
|
L
|
g/l
|
g/l
|
Kg/T
|
Kg/T
|
%
|
%
|
|
25
|
90,77
|
87,25
|
0,09
|
0,06
|
0,97
|
0,31
|
0,12
|
3,31
|
1,28
|
78,88
|
67,49
|
|
45
|
90,77
|
85,20
|
0,07
|
0,05
|
0,92
|
0,35
|
0,14
|
3,55
|
1,39
|
84,46
|
73,08
|
|
60
|
90,77
|
83,00
|
0,11
|
0,08
|
0,87
|
0,33
|
0,12
|
3,16
|
1,15
|
75,31
|
60,53
|
|
80
|
90,77
|
81,01
|
0,06
|
0,05
|
0,70
|
0,48
|
0,19
|
3,70
|
1,47
|
88,13
|
77,12
|
35
Influence de la température
|
rendement de rec
(%)
|
100,00 90,00 80,00 70,00 60,00 50,00 40,00 30,00 20,00 10,00
0,00
|
|
Cu Co
|
|
|
|
|
- 20,00 40,00 60,00 80,00 100,00
temperature(°C)
Figure 10 : influence de la température
Les résultats montrent qu'à 25°C la
solubilisation du cuivre et du cobalt n'est pas médiocre et est
considérable. Mais nous nous rendons compte qu'à 45°C et
80°C la solubilisation croit alors qu'il décroit à
60°C. Par crainte de ne plus avoir notre solution de lixiviation par le
phénomène de vaporisation à cause d'une grande
température, on choisit la température de 45°C qui cette
dernière agit également sur la cinétique de nos
réaction chimique.
IV.2.1.5. Influence du temps
L'influence du temps dans la lixiviation nous permet savoir le
temps nécessaire pour une solubilisation donnant un bon rendement de
récupération.
Les résultats sont donnés au tableau 7 et à
la figure 11
36
Tableau 7 : Influence du temps
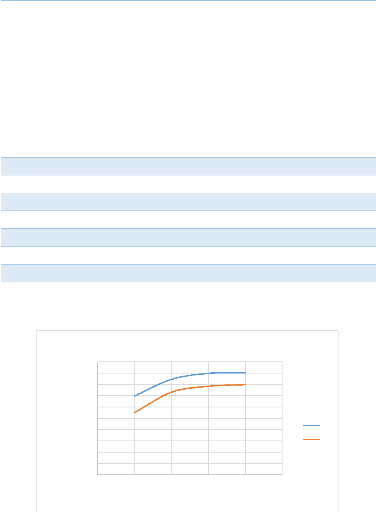
100,00
90,00
80,00
rendement de rec
(%)
70,00
60,00
50,00
Cu Co
40,00
30,00
20,00
10,00
0,00
Conditions de départ :
+ pourcentage solide : 15% +
Agitation : 300 tr/min + Température : 45°C + pH :
1,2
|
|
+
+
+
|
volume solution : 500 ml
concentration de l'acide : 20 g/l concentration de l'ion
ferrique : 3 g/l.
|
|
|
|
|
Param
|
Ech
|
Résidus
|
|
|
Filtrat + eau
|
|
Solubilisation
|
Rendement
|
|
Temps
|
Pds
|
Pds
|
Cutot
|
Co
|
Vol
|
Cu++
|
Co++
|
Cu
|
Co
|
Cu
|
Co
|
|
H
|
G
|
g
|
%
|
%
|
L
|
g/l
|
g/l
|
Kg/T
|
Kg/T
|
%
|
%
|
|
1
|
90,77
|
88,00
|
0,13
|
0,06
|
0,95
|
0,28
|
0,10
|
2,93
|
1,05
|
69,77
|
55,09
|
|
2
|
90,77
|
85,20
|
0,07
|
0,05
|
0,92
|
0,35
|
0,14
|
3,55
|
1,39
|
84,46
|
73,08
|
|
3
|
90,77
|
82,10
|
0,05
|
0,05
|
0,90
|
0,38
|
0,15
|
3,77
|
1,49
|
89,71
|
78,28
|
|
4
|
90,77
|
78,52
|
0,05
|
0,04
|
0,86
|
0,40
|
0,16
|
3,79
|
1,52
|
90,23
|
79,79
|
Influence du temps
- 1,00 2,00 3,00 4,00 5,00
Temps(h)
Figure 11 : influence du temps
37
La gamme du temps proposée pour faire la lixiviation
varie le rendement de solubilisation du cuivre et du cobalt, à quatre
heures les résultats sont meilleurs mais nous choisissons le temps de
lixiviation de trois heures parce qu'entre les deux le rendement varie
faiblement.
38
CONCLUSION
Nous avons au cours de ce travail, effectué des essais
dans le but de déterminer la solubilisation du cuivre et du cobalt se
trouvant dans les Under-flow du premier décanteur. A la suite de nos
essais nous sommes arrivés à nous fixer les conditions de
fonctionnement qui permettraient de solubiliser une quantité importante
de cuivre et du cobalt dans ces solides.
En travaillant à un pH de 1,2 et à 45°C
pendant 3 heures, avec une agitation de 300 trs/min et une densité pulpe
de 1200, à des concentrations respectives d'acide et d'ion ferrique de
20 g /l et 3 g/l ; pour un pourcentage de 15% des solides, nous obtenons un
rendement de lixiviation de 89,71% pour le cuivre et 78,28% pour le cobalt, une
solubilisation de 3,77 Kg de Cu/T de minerai et 1,49 Kg de Co/T de minerai.
Nos résultats ont été obtenus pour une
teneur en cuivre de 0,42% et en cobalt de 0,19%. D'autres études peuvent
être menées afin de déterminer la solubilisation des
Under-flow d'autre décanteur se trouvant à UCK.
39
BIBLIOGRAPHIE
ALVAYAI C., Traitement hydrométallurgique de
minerais cupro-cobaltifère du Katanga, D.E.A., Université de
liège, 2006.
BLAZY P., La Métallurgie extractive des
métaux non ferreux, Société de l'industrie
minérale, Saint Etienne, 1979.
HABASHI F., Principles of Extractive Metallurgy, volume
2 Hydrometallurgy, Gordon and Breach, Science Publishers, New York, 1970.
MICHEL BONAN., Lixiviation de la chalcopyrite en milieu chlorure:
contribution à l'étude de la cinétique et du
mécanisme de la réaction, Université des sciences et
technique, LILLE, 1998.
MAYELE KIMA Nadège., Contribution à l'étude
de récupération du cuivre et du cobalt contenus dans les
résidus de lixiviation des usines de LWILU ,TFE ,inédit,
UNILU,2009.
POURBAIX M., métal. Atlas d'équilibres
électrochimiques, Gauthier-Villars et Cie, Paris, 1963.
MWEPU wa NZOVU. Notes de cours de métallurgie
générale destinées aux étudiants de deuxième
graduat métallurgie, Faculté Polytechnique, UNIKOL,
inédit, 2013-2014.
KASHALA MPANGA. Notes de cours de métallurgique des
métaux non ferreux destinées aux étudiants de
troisième graduat métallurgie, Faculté Polytechnique
inédit, UNIKOL, 2014-2015.
| 


