|
|
UNIVERSITE DE TOLIARA
**************
FACULTE DES
SCIENCES
**************
DEPARTEMENT DES SCIENCES
BIOLOGIQUES
************
FORMATION DOCTORALE EN BIODIVERSITE ET
ENVIRONNEMENT
************
Option : Biologie Animale (12ème
promotion)
************
MEMOIRE
EN VUE DE L'OBTENTION DU
Diplôme d'etudes Approfondies (D.e.A)
|
|
|
BIO-ECOLOGIE ET ABONDANCE DU RALE D'OLIVIER
Amwa rte i (Grandidier & Berlioz , 1929)
DANS L'AIRE
PROTEGEE MANDROZO, DISTRICT DE MAINTIRANO,
REGION
MELAKY
|
|
Présenté par :
PRUVOT Yverlin Zito Michel
Soutenu publiquement le 03 Août 2016 devant les membres du
jury composés de :
Président : Professeur REJO-FIENENA
Félicitée
Rapporteur : Professeur RENE DE
ROLAND Lily-Arison
Examinateur: Docteur ANDRIANJOHANY Solange
|
|

Photo de couverture :
Adulte et jeune de Râle d'Olivier Amaurornis olivieri
(Pruvot, 2015)
Merci à Monsieur RAKOTONDRATSIMA
Marius, Coordinateur scientifique au sein de l'ONG « The
Peregrine Fund » Madagascar, qui m'a apporté ses conseils pour la
rédaction
REMERCIEMENTS
Ce mémoire est le fruit de la collaboration entre la
Faculté des Sciences de l'Université de Toliara et l'ONG «
The Peregrine Fund » à Madagascar. Pour ce travail, j'ai
bénéficié l'aide de nombreuses personnes dont je tiens
à remercier tous.
Je tiens tout d'abord à remercier la Faculté des
Sciences de l'Université de Toliara à travers Monsieur le Doyen,
Professeur FATIANY Pierre Ruffin, d'avoir autorisé la
soutenance de ce mémoire. Qu'il trouve ici ma profonde
reconnaissance.
Je remercie vivement Madame REJO-FIENENA
Félicitée, Professeur titulaire,
Directeur de l'Ecole Doctorale de la Biodiversité et Environnements
Tropicaux de l'Université de Toliara, d'avoir bien voulu présider
la soutenance de ce mémoire. Qu'elle soit rassurée de ma profonde
gratitude.
Mes remerciements s'adressent plus particulièrement
à Monsieur RENE DE ROLAND Lily-Arison, Professeur titulaire,
Enseignant chercheur de l'Université de Toliara, Directeur
National de l'ONG « The Peregrine Fund » à Madagascar, qui a
non seulement accepté d'être mon encadreur, mais aussi m'a permis
de réaliser mon stage au sein de l'ONG qu'il dirige. Malgré son
emploi du temps très chargé, il a toujours trouvé du temps
pour m'encadrer avec le soutien et les conseils qu'il m'a apporté tout
au long de ce travail. Je lui exprime toute ma profonde reconnaissance.
Je manifeste également ma gratitude envers
Docteur ANDRIANJOHANY Solange, Enseignant chercheur à
la Faculté des Sciences de l'Université de Toliara, qui a bien
voulu accepter la responsabilité en tant qu'Examinateur de ce
mémoire.
Un grand merci à Monsieur THORSTROM Russel K.,
Directeur chargé des programmes Afrique-Madagascar de l'ONG
« The Peregrine Fund », qui a fourni des moyens matériels et
financiers pour la réalisation de ce mémoire.
J'ai l'occasion d'exprimer ici toute ma reconnaissance au
Docteur RAZAFIMANJATO Gilbert qui m'a encouragé et
dirigé aussi bien avant et pendant la descente sur terrain que dans la
rédaction de ce mémoire. Malgré ses
responsabilités, il n'a cessé de m'apporter son aide et ses
conseils. Merci pour tout !
de ce mémoire et qui m'a beaucoup aidé lors de
l'analyse des résultats et la réalisation des cartes. Qu'il
trouve ici mon vif remerciement.
Merci également à Monsieur le Docteur
RABARISON Harison, Botaniste, Enseignant chercheur à la
Faculté des Sciences de l'Université d'Antananarivo, qui m'a
beaucoup aidé pour l'étude de la structure de l'habitat de
l'espèce étudiée et pour la détermination de
l'espèce des plantes dans cet habitat.
Je tiens aussi à remercier tout le personnel et
étudiants du Peregrine Fund à Antananarivo: Madame RAJESY
Jeannette, Messieurs BENJARA Armand, RAZARAZAFY Duvivier
et RAVELOSON Laurent, Mesdemoiselles
RAZAKARATRIMO Stéphanie, FANOMEZANA Salohy et
RAVELOMANANTSOA Ny Anjara Fifi, pour leur assistance
matérielle, technique et leurs conseils.
Un merci tout particulier aux techniciens du « The
Peregrine Fund » au sein de l'Aire Protégée Mandrozo qui,
par leur contribution et leur implication, participent grandement à la
réalisation d'étude et aux collectes des données sur
terrain. Merci au Docteur RAMAMONJISOA Juliot Carl,
Responsable du site de l'Aire protégée Mandrozo, pour son
encadrement et ses conseils sur terrain. Merci également à
Bienvenu, Gaston, Mbiny et Akily pour leurs
aides.
Je ne saurais oublier d'adresser ma chaleureuse gratitude
à tous mes collègues et amis qui m'ont toujours soutenu
moralement et amicalement. Qu'ils trouvent ici mes chaleureuses
amitiés.
Enfin, un immense merci à mes parents, à mes
soeurs et à toute ma famille qui n'ont jamais cessé de me
soutenir moralement et financièrement durant mes années
d'étude. Qu'ils récoltent ici le fruit de leur labeur.
Que tous ceux qui ne sont pas cités mais nous ont
soutenu et aidé, soient tous infiniment remerciés.
Mots clés : Bio-écologie, Râle d'Olivier
Amaurornis olivieri, Oiseau d'eau, Endémique, Aire
Protégée Mandrozo, Madagascar.
RESUME
L'étude bio-écologique et d'abondance du
Râle d'Olivier Amaurornis olivieri, une espèce d'oiseau
d'eau en danger et endémique de Madagascar, a été
effectuée dans l'Aire Protégée Mandrozo, district de
Maintirano, partie Ouest de Madagascar. Elle a été
réalisée du mois de juillet au mois d'octobre 2015. Des
recensements ont été réalisés dans le lac Mandrozo
et ses alentours en utilisant les méthodes de point d'écoute et
«play-back». La méthode de suivi des individus du couple, la
prospection de la végétation du lac et l'enquête
auprès des pêcheurs ont été utilisées pour
localiser les nids. Seuls les nids actifs ont fait l'objet des observations
directes et continues, de 6 h à 18 h, pour suivre toutes les
activités du couple pendant la période de reproduction. Le
régime alimentaire a été déterminé à
l'aide de l'observation directe et la prise de photo des nourritures
consommées. Un total de 16 individus de cette espèce a
été recensé sur une surface de 23,55 ha. La densité
de sa population est estimée à 0,68 individu/ha. Trois couples
appartenant aux trois nids différents ont été directement
et continuellement observés. La construction du nid qui dure en moyenne
trois jours (n = 2 nids) est assurée par le couple, mais le mâle
semble assurer néanmoins la plupart de travail. Les nids sont
placés dans des touffes de roseaux Phragmites mauritianus et se
situent en moyenne à 56,67 cm (n = 3 nids) par rapport à la
surface de l'eau. Treize (13) accouplements ont été
observés et durent en moyenne 4,08 #177; 0,07 secondes (n = 2 couples).
La taille de ponte est de trois oeufs par nichée (nid 1 et nid 3).
L'incubation des oeufs a eu lieu dès la première ponte et est
assurée par les deux sexes pendant 17 jours (n = 1 nid). Durant les 204
heures d'observation du nid pendant l'incubation, la femelle a incubé
pendant 105 heures (51,5 %) contre 88 heures (43,1 %) pour le mâle, et le
couple s'absente du nid pendant 11 heures (5,4 %). L'élevage des
poussins est assurée par les deux sexes depuis l'éclosion
jusqu'à la dispersion des jeunes à l'âge de 45 jours.
Basé sur 194 nourritures identifiées, le Râle d'Olivier se
nourrit essentiellement des invertébrés : Araignées (53,1
%), Insectes (32 %), Crustacés (10,8 %) et Mollusques (4,1 %). L'habitat
de cette espèce est caractérisé par la dominance des
roseaux dans lesquels elle nidifie et s'alimente. Les surfaces des domaines
vitaux des deux individus radiopistés sont respectivement 0,95 ha et
1,98 ha. Le Râle d'Olivier manifeste une certaine agressivité
pendant la période de reproduction.
ABSTRACT
A bio-ecological and abundance study of Sakalava Rail
Amaurornis olivieri, an endangered and endemic waterbird of
Madagascar, was conducted from July to October 2015 in the Mandrozo Protected
Area, in the western part of Madagascar. Listening point and play-back methods
were used to census individuals of Sakalava Rail in Mandrozo Lake and its
surroundings. Nests were discovered from tracking the individuals of the pair,
and using a questionnaire with the fisherman. Located active nests were
directly and continuously observed, every day from 6:00 a.m to 6:00 p.m, in
order to track all activities during the breeding period (from nest building to
the full independence of Juveniles). The diet has been studied using direct
observation and taking pictures of the consumed foods. At the site of survey,
16 individuals of this species were counted on a surface of 23,55 ha, which was
used to estimate the population density to 0,68 individual/ha. Three pairs
belonging to three different nests were directly and continuously observed.
Nest construction was assured by both adults and it took three days' on average
to complete a nest (n = 2 nests). Male did more work than female during nest
construction. Nests were constructed in a dense mat of reeds Phragmites
mauritianus and located 56,67 cm (n = 3 nests) on average above water
level. Thirteen matings were observed and lasted 4,08 #177; 0,07 seconds on
average (n = 2 pairs). Clutch size was three eggs in each active nest (nest 1
and nest 3). Incubation started on laying of the first egg and both sexes
incubated. Eggs hatched after 17 days (n = 1 nest). During the 204 hours of the
nest observation, female incubated 51,5 % (105 hours), male 43,1 % (88 hours)
and the nest was unattended for 5,4 % (11 hours). Both male and female brooded
and fed the young. Young remained three days in the nest and they were
completely independent of their parents at 45 days of age. Based on 194
identified food items, Sakalava Rail ate invertebrates: Spiders (53,1 %),
Insects (32 %), Crustaceans (10,8 %) and Mollusks (4,1 %). The habitat of this
species is characterized by the dominance of Reeds in which it nests and feeds.
The home ranges of two radio-tracked individuals were respectively 0,95 and
1,98 hectares. Sakalava rail was aggressive during reproduction season.
Keywords: Bio-ecology, Sakalava rail
Amaurornis olivieri, Waterbird, Endemic, Protected Area of Madrozo,
Madagascar.
i
SOMMAIRE
INTRODUCTION 1
I. ZONE D'ETUDE 3
I.1. CHOIX ET IMPORTANCE DE LA ZONED'ETUDE 3
I.2. LOCALISATION DE LA ZONE D'ETUDE 3
I.3. CLIMAT 4
I.3.1. La température 5
I.3.2. La précipitation 5
I.4. MILIEU NATUREL 6
I.4.1. Ecosystèmes 6
I.4.2. Flore et végétation 6
I.4.3. Faune 7
II. MATERIELS ET METHODES 10
II.1. MATERIEL BIOLOGIQUE: ESPECE ETUDIEE 10
II.1.1. Systématique 10
II.1.2. Description morphologique 10
II.1.3. Aire de répartition 11
II.1.4. Mode de vie de l'espèce 12
II.2. MATERIELS UTILISES SUR LE TERRAIN 12
II.3. METHODES DE COLLECTES DES DONNEES 13
II.3.1. Période d'étude sur le terrain 13
II.3.2. Méthodes de recensement 13
II.3.3. Recherche des nids 14
II.3.4. Observation du nid 15
II.3.5. Capture-recapture 15
II.3.6. Mensuration des individus 16
II.3.7. Etude biologique de l'espèce 16
a) Formation du couple 17
b) Construction du nid 17
c) Accouplement 17
d) Ponte 17
e) Mensuration des oeufs 18
f) Incubation des oeufs 18
g) Eclosion des poussins 18
ii
h) Elevage des poussins 19
II.3.8. Etude écologique de l'espèce 19
a) Analyse de l'habitat 19
b) Détermination du régime alimentaire 22
c) Estimation du domaine vital par radiopistage 22
II.4. TRAITEMENT DE DONNEES 24
II.4.1. Estimation de l'abondance 24
II.4.2. Analyse statistique 24
III. RESULTATS 27
III.1. ABONDANCE ET DISTRIBUTION LOCALE 27
III.2. EFFECTIFS DES INDIVIDUS CAPTURES 28
III.3. MORPHOLOGIE ET MORPHOMETRIE DE L'ESPECE 29
III.3.1. Morphologie 29
III.3.2. Morphométrie 31
III.4. BIOLOGIE DE LA REPRODUCTION 33
III.4.1. Formation du couple 34
III.4.2. Construction du nid 35
III.4.3. Accouplement 37
III.4.4. Ponte 37
III.4.5. Incubation 39
III.4.6. Eclosion 40
III.4.7. Elevage des poussins 40
III.5. ECOLOGIE 42
III.5.1. Habitat 42
a) Emplacement et caractéristiques des nids 42
b) Caractéristiques de l'habitat de nidification 43
c) Perturbations et menaces 45
III.5.2. Domaine vital 47
III.5.3. Régime alimentaire 48
III.6. ETHOLOGIE 51
III.6.1. Types de cris 51
III.6.2. Comportement pendant la période de reproduction
52
III.6.3. Agressivité 55
IV. DISCUSSIONS 56
IV.1. ABONDANCE ET DISTRIBUTION DES INDIVIDUS 56
IV.2.
iii
CAPTURE DES INDIVIDUS 56
IV.3. MORPHOLOGIE ET MORPHOMETRIE DE L'ESPECE 57
IV.4. BIOLOGIE DE LA REPRODUCTION 58
IV.4.1. Formation du couple 58
IV.4.2. Construction du nid 59
IV.4.3. Accouplement 60
IV.4.4. Ponte 60
IV.4.5. Incubation 61
IV.4.6. Elevage des poussins 62
IV.5. ECOLOGIE 63
IV.5.1. Emplacement et caractéristiques des nids 63
IV.5.2. Habitat de nidification 64
IV.5.3. Régime alimentaire 64
IV.6. ETHOLOGIE 65
IV.6.1. Agressivité 65
CONCLUSION 66
REFERENCES BIBLIOGRAPHIQUES 68
iv
LISTE DES FIGURES
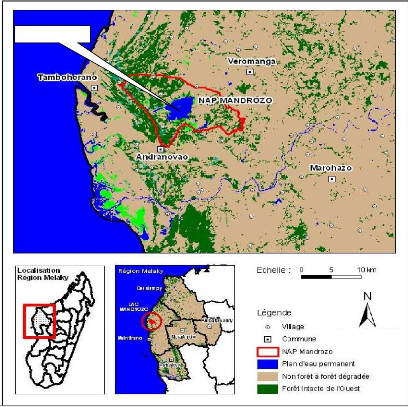
Figure 1: Carte de la localisation de l'Aire
protégée Mandrozo (TPF, 2015) 4
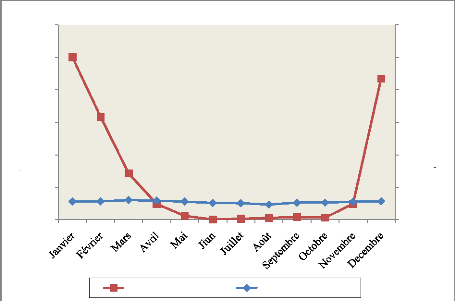
Figure 2: Courbe ombrothermique de l'Aire
protégée Mandrozo de l'année 2015 5
Figure 3: Lac Mandrozo avec des formations
végétales (Pruvot, 2015) 6
Figure 4: Adulte femelle d'un Aigle
pêcheur de Madagascar Haliaeetus vociferoides
(«Ankoay ») (Rene de Roland, 2006) 9
Figure 5: Un adulte et un jeune du Râle
d'Olivier Amaurornis olivieri (Pruvot, 2015) 11
Figure 6: Schéma annoté montrant
la disposition du filet de capture 16
Figure 7: Schéma montrant la mensuration
de l'oeuf. 18
Figure 8: Schéma montrant la mise en
place des transects pour évaluer la richesse spécifique
de la flore de l'habitat de nidification 21
Figure 9: Schéma montrant un
émetteur et sa mise en place sur un oiseau 23
Figure 10: Adulte femelle du Râle
d'Olivier Amaurornis olivieri munie d'émetteur
(Pruvot, 2015) 23
Figure 11: Carte montrant la distribution des
individus et des nids trouvés dans le lac
Mandrozo pendant la période d'étude (TPF, 2015)
27
Figure 12: Adultes du Râle d'Olivier
Amaurornis olivieri : mâle à gauche ; femelle à
droite
(Pruvot, 2015) 29
Figure 13: Photos des trois poussins de
Râle d'Olivier Amaurornis olivieri à l'âge de 4
jours
après l'éclosion (Pruvot, 2015) 30
Figure 14: Photos montrant l'évolution
morphologique de jeunes de Râle d'Olivier Amaurornis olivieri:
a- Poussin à l'âge de 18 jours; b-
Juvénile à l'âge de 31 jours; c-
Juvénile à l'âge de 39 jours; d-
Juvénile à l'âge de 45 jours
(Pruvot, 2015) 31
Figure 15: Durée d'observation des
différentes phases de reproduction du Râle d'Olivier
Amaurornis olivieri pendant la période
d'étude 34
Figure 16: Taux de la participation du
mâle et de la femelle pendant la construction du nid 35
Figure 17: Un nid du Râle d'Olivier
Amaurornis olivieri (Pruvot, 2015) 36
v
Figure 18: Photo des oeufs du Râle
d'Olivier Amaurornis olivieri dans un nid
(Pruvot, 2015) 38
Figure 19: Taux de la participation du
mâle et de la femelle à l'incubation des oeufs pendant
la journée et durant la nuit 39
Figure 20: Taux de la participation du
mâle et de la femelle à la couvaison des poussins et à
l'apport des nourritures pendant l'élevage des poussins
dans le nid 41
Figure 22: Un nid du Râle d'Olivier avec
un adulte incubant les oeufs (Pruvot, 2015) 43
Figure 21: Photo montrant les plantes de
l'emplacement du nid 1 (Pruvot, 2015) 43
Figure 23: Photo montrant la structure
végétale de l'habitat de nidification du Râle d'Olivier
dans le lac Mandrozo (Pruvot, 2015) 44
Figure 24: Un poussin du Râle d'Olivier
Amaurornis olivieri mort abandonné dans le nid 1
suite à l'attaque des fourmis (Pruvot, 2015) 46
Figure 25: Photo montrant la destruction de
quelques parties de l'habitat par la coupe et les
feux (Pruvot, 2015) 46
Figure 26: Carte montrant les domaines vitaux de
deux individus (Frq28 et Frq34) du Râle
d'Olivier Amaurornis olivieri radiopistés dans le
site d'étude (TPF, 2015). 48
Figure 27: Effectifs des nourritures
consommées par le mâle et la femelle pendant la période
d'incubation des oeufs du couple 1. 49
Figure 28: Effectifs des nourritures
consommées pendant l'élevage des poussins du couple 3
49
Figure 29: Proportion des
invertébrés consommés par le Râle d'Olivier pendant
toute la
période d'étude 50
Figure 30: Photos d'exemples des
araignées consommées par le Râle d'Olivier dans le lac
Mandrozo (Pruvot, 2015) 50
vi
LISTE DES TABLEAUX
Tableau 1: Résumé du
résultat des captures effectuées dans le lac Mandrozo pendant
la
période d'étude 28
Tableau 2: Mensuration des individus adultes
capturés présentée en moyenne et écart- type ....
32 Tableau 3: Mensurations d'un poussin au jour
d'éclosion et d'un juvénile à l'âge de 39 jours ...
33
Tableau4: Dimensions et poids des oeufs du
Râle d'Olivier pris sur un échantillon de
trois oeufs.dans le nid 1 38
Tableau 5: Caractéristiques des nids du
Râle d'Olivier durant la période d'étude 42
Tableau 6: Distance des nids par rapport aux
autres paramètres étudiés 45
Tableau 7: Tableau montrant les codes des
individus, la fréquence des émetteurs qu'ils
portent, le nombre de jours de suivi et la surface de leur
domaine vital 47
LISTE DES ANNEXES
Annexe 1: Données climatiques de l'Aire
Protégée Mandrozo pendant l'année 2015 I
Annexe 2: De haut en bas et de gauche à
droite: Lambeau de forêts de l'AP, Marécages (Razakaratrimo,
2011), Savane boisée des Palmiers, couverture végétale
des
roseaux (Pruvot, 2015) I
Annexe3: Liste des espèces d'oiseaux
d'eau recensées dans l'AP de Mandrozo
(Razafimanjato et al., 2015). II
Annexe 4: Mensurations des quatre adultes du
Râle d'Olivier Amaurornis olivieri capturés à
Mandrozo pendant la période d'étude III
Annexe 5: Nombre et fréquence
d'accouplements observés chez le couple 1 et le couple 2 du
Râle d'Olivier Amaurornis olivieri pendant la
période d'étude IV
Annexe 6: Heures et durée de chacun des
accouplements observés à Mandrozo en 2015 IV
Annexe 7: Liste des espèces des plantes
recensées dans chaque habitat de nidification V
Annexe 8: Cartes montrant la répartition
des coordonnées géographiques et les domaines
vitaux des deux individus d'Amaurornis olivieri
radiopistés VI
Annexe 9: Photo montrant certaines
espèces d'invertébrés constituant le régime
alimentaire du Râle d'Olivier dans le lac Mandrozo pendant la
période d'étude
(Juillet à Octobre 2015) VII
vii
LISTE DES ACRONYMES
AP : Aire Protégée
CITES : Convention on International Trade in
Endangered Species of wild fauna and
flora (Convention sur le Commerce International des
Espèces de faune et de
flore sauvages menacées d'extinction)
CR : Critically endangered (En Danger
critique)
EN : En Danger
GPS : Global Positioning System
LC : Least Concerned (à
préoccupation mineur)
NT : Near Threatened (quasi menacé)
ONG : Organisation Non Gouvernementale
R : Rare
TPF : The Peregrine Fund
UICN : Union Internationale pour la Conservation
de la Nature
VU : Vulnérable
ZICOMA : Zone d'Importance pour la Conservation
des Oiseaux à Madagascar
ZOC : Zone d'Occupation
Contrôlée
ZUC : Zone d'Utilisation
Contrôlée
1
INTRODUCTION
Madagascar, en raison de son taux d'endémisme
élevé (85%) en espèces vivantes, se trouve parmi les dix
pays au monde de plus grande importance en biodiversité (Mittermeier
et al., 2004). Ce pays est également riche en zones humides qui
font partie des ressources les plus précieuses sur le plan de la
diversité biologique et de la productivité naturelle. Les zones
humides jouent un rôle considérable dans les processus vitaux,
entretenant des cycles hydrologiques et accueillant une flore et une faune
importante (Lardjane-Hamiti, 2012). Parmi la faune inféodée dans
ces zones humides, les oiseaux, notamment les oiseaux d'eau, tiennent une place
importante. L'avifaune aquatique et les zones humides constituent une
entité indissociable. Parmi les 283 espèces d'oiseaux
recensées dans la Grande île (Goodman & Hawkins, 2008), 68
espèces sont aquatiques (Dodman & Diagana, 2003) dont 18 d'entre
elles sont endémiques (Langrand & Wilme, 1993).
Le Râle d'Olivier Amaurornis olivieri
appartenant à la famille des Rallidae figure parmi les
espèces d'oiseaux d'eau endémiques de Madagascar. Espèce
emblématique des zones humides de la partie ouest de Madagascar, le
Râle d'Olivier présente un niveau de population extrêmement
bas et une aire de distribution restreinte. Au niveau mondial, Amaurornis
olivieri est actuellement menacée, et classée dans la
catégorie En Danger (EN) de la liste rouge de l'UICN (ver. 2015). Ceci
repose sur le fait que sa population, en plus d'être petite, est
fragmentée, et elle est de ce fait suspectée d'être en
déclin. Cette espèce a également disparu de nombreuses
régions dans lesquelles elle était abondante auparavant, et se
cantonne désormais aux quelques sites répartis dans la partie
Ouest de l'île (Rabenandrasana, 2007). Des recensements effectués
dans les zones humides de l'Ouest de Madagascar entre le fleuve Betsiboka au
nord et le fleuve Mangoky au sud, ont trouvé l'espèce dans cinq
sites: lac Kinkony, lac Ampandra, lac Amparihy, lac Sahapy et lac Mandrozo
(Rabenandrasana et al., 2009). Les résultats de ces
recensements ont estimé un total de 215 individus dans ces cinq sites,
en suggérant que la population totale ne peut pas dépasser 250
individus (Rabenandrasana et al., 2009). Cette distribution restreinte
rend l'espèce vulnérable à toutes formes de pression
d'origine anthropique.
Les raisons du déclin de Râle d'Olivier sont
multiples, mais la perte d'habitat ainsi que l'intensification des pratiques
agricoles sont considérées comme les causes principales de ce
phénomène. En effet, cette menace est décuplée par
le fait que les zones humides de Madagascar ont été sujettes
à la dégradation continue et à la conversion en terrain de
culture, en particulier la riziculture.
2
Suite aux projets menés par l'ONG « The Peregrine
Fund » (TPF) dans l'ouest de Madagascar depuis 1992 à Antsalova et
2007 à Maintirano, deux Aires Protégées (AP) ont
été créées qui sont respectivement l'AP Complexe
Tsimembo Manambolomaty et l'AP Mandrozo. Ces deux AP sont des sites
prioritaires pour la conservation des zones humides et la protection
d'espèces mondialement menacées comme l'Aigle pêcheur de
Madagascar Haliaeetus vociferoides et le Râle d'Olivier
Amaurornis olivieri. Ce dernier est l'une des espèces cibles de
conservation dans l'AP Mandrozo (Razafimanjato et al., 2012).
Quelques chercheurs ont déjà apporté
certaines informations sur la distribution, habitat et statut de
l'espèce Amaurornis olivieri. En revanche, les informations
concernant la biologie de la reproduction, l'écologie et
l'éthologie de cette espèce demeurent encore très peu
documentées. Ceci nous a incité d'entreprendre une étude
bio-écologique de cette espèce dans l'AP Mandrozo. Cette
étude s'appuie principalement sur une des actions du programme de
conservation d'oiseaux endémiques de Madagascar mené par TPF.
Elle a pour but d'apporter de nouvelles connaissances sur la biologie,
l'écologie et le comportement de Râle d'Olivier tout en
fournissant des informations indispensables pour sa conservation dans le milieu
concerné. Pour atteindre ce but, nous avons fixé les objectifs
spécifiques suivants :
- Inventorier les individus de cette espèce dans l'AP
Mandrozo;
- Estimer leur abondance et leur distribution dans le milieu
d'étude;
- Décrire la morphologie de l'espèce;
- Connaître la période et les différents
stades de reproduction;
- Déterminer les types d'habitats et comprendre les
conditions d'installation de cette
espèce dans le milieu d'étude;
- Etudier le régime alimentaire et le domaine vital de
l'espèce.
Ce document présentera dans sa première partie
la zone d'étude avec ses différentes caractéristiques. La
deuxième partie portera sur les matériels et méthodes
d'étude. La troisième partie sera consacrée aux
résultats obtenus. Nous aborderons ensuite des discussions dans la
quatrième partie. Enfin, nous terminerons par la conclusion avec
quelques recommandations et perspectives en vue d'une meilleure conservation de
l'espèce.
3
I. ZONE D'ETUDE
I.1 CHOIX ET IMPORTANCE DE LA ZONE D'ETUDE
Cette étude a été effectuée dans
l'AP Mandrozo. Nous avons choisi ce site en raison de son importance pour la
conservation de la biodiversité, et du fait qu'il inclut le lac Mandrozo
(site d'étude), un des sites « Ramsar » de Madagascar,
abritant une population non négligeable de l'espèce
étudiée (Amaurornis olivieri).
L'importance de cette AP pour la conservation de la
biodiversité et la valorisation des ressources naturelles se confirme
consécutivement depuis sa classification dans la catégorie ZICOs
ou Zone d'Importance pour la Conservation des Oiseaux d'eau en 1999 (ZICOMA,
1999). De plus, elle constitue une zone humide d'importance internationale
labélisée « Site Ramsar » le 05 juin
2012 grâce à la présence des ressources naturelles d'une
valeur inestimable et de sa forte diversité biologique dont la
majorité est endémique (TPF, 2013). Elle est classée dans
la catégorie V de l'UICN : «Paysage Harmonieux
Protégé», depuis avril 2015. Il s'agit d'une aire
protégée gérée principalement dans le but d'assurer
la conservation des paysages terrestres et à des fins
récréatives, et où les interactions harmonieuses
Homme/Nature contribuent à maintenir la biodiversité. Cette AP,
avec ses lacs satellites environnants, abrite non seulement de populations
importantes d'espèces d'oiseaux aquatiques, mais elle constitue
également un habitat pour plusieurs espèces de poissons. Ces
derniers octroient à la population riveraine une source de revenue
importante grâce aux activités de pêche.
I.2 LOCALISATION DE LA ZONE D'ETUDE
L'AP Mandrozo est localisée dans la partie Ouest de
Madagascar, dans la Région Melaky, District de Maintirano. Elle se
trouve à 60 km (à vol d'oiseau) au nord de Maintirano et est
à cheval sur trois communes rurales Andranovao, Tambohorano et
Veromanga, qui l'entourent respectivement au Sud, à l'Ouest et à
l'Est. Elle se situe entre les coordonnées géographiques
17°31'- 17°33' de latitude Sud et 44°02'- 44°06' de
longitude Est. Elle est située dans un relief morphologiquement plat,
d'altitude comprise entre 7 à 60 m (TPF, 2013). Elle couvre une
superficie de 15145 ha et comprend deux zones biens distinctes : quelques
noyaux durs dispersés et une zone tampon (ZUC, ZOC) (TPF, 2013).
L'AP Mandrozo est l'unique AP créée dans la partie
nord du District de Maintirano.
Lac Mandrozo
4
Figure 1 : Carte de la localisation de l'Aire
protégée Mandrozo (TPF, 2015)
I.3. CLIMAT
L'AP Mandrozo se trouve dans une région ayant un climat
tropical sec avec la présence de deux saisons bien marquées : une
saison sèche d'avril à octobre et une saison humide de novembre
à mars (Ravalison, 2008).
Etant donnée la non disponibilité des
données climatiques pour les cinq dernières années dans
notre zone d'étude, seules les températures et
pluviométries enregistrées par la station de recherche de TPF
à Andapabe-Andranovao, au sein de la zone d'étude pendant
l'année 2015, ont été utilisées dans cette
étude.
5
I.3.1. La température
La température moyenne de l'année 2015 est de
27,17° C. Le mois le plus chaud de cette année est le mois de mars
avec une température moyenne de 30,25° C. La température
moyenne mensuelle la plus basse enregistrée est de 23,3° C au mois
de juillet. Par ailleurs, la température maximale journalière
peut atteindre 36,7° C au mois de mars, et la température
journalière minimale peut se baisser jusqu'à 13,6° C au mois
de juillet.
I.3.2. La précipitation
La précipitation annuelle enregistrée en 2015
est de 1525,9 mm avec un maximum de pluies enregistrées en janvier
(500,5 mm). Le mois le plus sec est le mois de juin avec une
pluviométrie de 0,46 mm (Figure 2, Annexe 1).
Précipitation (mm)
400
200
600
500
300
100
0
Précipitation (mm) Température
(°C)
250
200
0
300
50
150
100
Température (°C)
Figure 2 : Courbe ombrothermique de l'Aire
protégée Mandrozo de l'année 2015
6
I.4. MILIEU NATUREL
I.4.1. Ecosystèmes
Les écosystèmes de l'AP
Mandrozo sont composés du lac Mandrozo, des
marécages, des lambeaux de forêts sèches, des forêts
de palmiers et des savanes (Annexe 2).
Le lac Mandrozo s'étale sur une
superficie de 1800 ha, d'où son rang à l'échelle
nationale en tant que cinquième grand lac de
Madagascar (Figure 3) . Il est constitué par une eau douce
permanente de faible profondeur (2 à 3 m) , caractéristique des
écosystèmes lacustres de l'Ouest (TPF, 2013). Ce lac
avec les marécages et les différents types de
végétation qui les bordent, constituent une zone humide
jouant un rôle écologique très
important, tout en fournissant une zone de prédilection
des oiseaux aquatiques et des autres espèces faunistiques.

Figure 3 : Lac Mandrozo avec des formations
végétales (Pruvot, 2015)
I.4.2. Flore et végétation
L'AP Mandrozo est incluse dans
l'écorégion de l'ouest à laquelle dispose une
végétation climatique de forêt dense sèche
semi-caducifolié (Rajaonarison et
al., 2009). La végétation dans cette zone
est caractérisée par cinq types: des reliques
des forêts denses sèches semi-caducifoliées,
des lambeaux forestiers de galeries longeant des rives
et des cours d'eau, des savanes boisées et
herbeuses, et des formations végétales
marécageuses bordant le lac (Annexe 2).
7
Les forêts denses sèches recèlent
d'espèces floristiques et faunistiques typiques de
l'écorégion ainsi que quelques espèces endémiques
locales. Les savanes boisées occupent les deux tiers de la surface
totale de l'AP (Ravalison, 2008) et elles sont majoritairement
constituées par les palmiers Bismarckia nobilis ou
«Mokoty». La végétation aquatique est
dominée par la présence de roseaux Phragmites mauritianus
ou « Bararata » concentrée tout au tour du lac
et dans les îlots du lac. Une importante couverture
végétale de Massettes Typha angustifolia ou «
Vondro » et de Fougère Thelypteris palustris
(« Faritsoky ») bordent également le lac
Mandrozo. Deux espèces des nénuphars (Nymphae lotus et
Nymphae nouchali) y poussent également.
L'AP Mandrozo compte 108 espèces floristiques
appartenant aux 44 familles avec 80 % d'espèces endémiques
(Rajaonarison et al., 2009). Parmi elles, sept espèces d'arbre
sont menacées et classées dans la liste rouge de l'UICN (2015) :
le Palissandre représenté par trois espèces Dalbergia
bathiei (EN), D. purpurescens (VU) et D. greveana (NT),
les Baobabs comme Adansonia madagascarensi (NT) et Adansonia za
(NT), et les Palmiers comme Dypsis madagascariensis (NT) et
Ravenea madagascariensis (LC).
I.4.3. Faune
a) Poissons
Le nombre d'espèce de poissons dans le lac Mandrozo
reste encore inconnu, malgré l'identification de cinq espèces,
à savoir, Gobbius giuris (Gobidés), Oreochromis
mossambicus ou «Mahaimiteraka» (Cichlidae), O.
macrochir ou «Voaloboky» (Cichlidae), Tilapia zilii ou
«Borivava» (Cichlidae) et Anguilla mossambica
(Anguillidés).
b) Reptiles et Amphibiens
L'AP Mandrozo héberge également 47
espèces d'herpétofaune dont 36 Reptiles et 11 Amphibiens. Presque
la totalité des espèces d'Amphibiens recensées sont
endémiques de Madagascar dont une espèce Boophis occidentalis
est endémique de la région Ouest. Parmi les espèces
de reptiles, deux espèces de Boidae endémiques de l'île,
Acrantophis madagascariensis et Sanzinia madagascariensis,
sont classées vulnérable (VU) dans le statut de l'UICN (2015), et
deux espèces de scinques (Lézards) Trachylepsis tandrefana
et Trachylepsis volamenaloha sont endémiques de la
région Ouest. De plus, les résultats d'inventaire
herpétologique ont montré la présence d'une espèce
de Gecko Phelsuma klemmeri dont la distribution était connue
seulement dans la partie Nord de Madagascar avant 2009.
8
Du côté commerce international, trois
espèces de reptiles, Acrantophis madagascariensis, Sanzinia
madagascariensis, et Erymnochelys madagascariensis, sont
figurées dans l'annexe I de la CITES. Par contre, Brookesia
brygooi, Crocodylus niloticus, Furcifer lateralis,
F. oustaleti, Pelusios castanoides, Phelsuma
madagascariensis, P. klemmeri, P. mutabilis, Uroplatus guentheri,
et U. henkeli, sont classées dans l'annexe II de la CITES.
c) Oiseaux
Pour l'avifaune, 91 espèces d'oiseau
répartissant dans 44 familles ont été recensées
dans l'AP Mandrozo dont 33 sont endémiques de Madagascar. Sur ces 91
espèces répertoriées, 43 espèces regroupées
en 16 familles sont des oiseaux d'eau, parmi lesquelles sept espèces
sont menacées (Razafimanjato et al., 2015) : l'Aigle
pêcheur de Madagascar Haliaeetus vociferoides (CR) (Figure 4),
le Râle d'Olivier Amaurornis olivieri (EN), le Héron
Crabier blanc Ardeola idea (EN), le Héron de Humblot Ardea
humbloti (EN), l'Ibis Sacré Therskiornis bernieri (EN), le
Grèbe malgache Tachybaptus pelzelnii (VU), et le Flamant nain
Phoeniconaias minor (VU) (Annexe 3).
Il y existe également 14 espèces de rapace dont
trois nocturnes et 11 espèces diurnes. Les trois espèces
nocturnes sont : le Petit duc de Madagascar Otus madagascariensis
(LC), la Chouette effraie Tyto alba (LC), et le Ninoxe à
sourcils blancs Ninox superciliaris (LC). Les 11 espèces
diurnes appartiennent toutes à l'Ordre des Falconiformes dont sept
espèces endémiques de Madagascar: l'Aigle pêcheur de
Madagascar Haliaeetus vociferoides (CR), l'Autour de Henst
Accipiter henstii (NT), l'Epervier de Frances Accipiter
francesii (LC), la Buse de Madagascar Buteo brachypterus (LC), le
Baza malgache Aviceda madagascariensis (LC), le Polyboroïde
rayé Polyboroïdes radiatus (LC) et le Faucon à
ventre rayé Falco zoniventris (LC). Celles dont l'île
partage avec d'autres localités du globe sont : le Milan noir à
bec jaune Milvus aegyptius, le Faucon de Newton Falco
newtoni, le Faucon d'Eleonore Falco eleonorae (LC) ainsi que le
Milan des chauves-souris Macheiramphus alcinus (LC).

9
Figure 4 : Adulte femelle d'un Aigle
pêcheur de Madagascar Haliaeetus vociferoides
(«Ankoay
») (Rene de Roland, 2006)
d) Mammifères
L'AP Mandrozo abrite 10 espèces de Mammifères
dont deux Carnivores, deux Afrosoricides (Insectivores), un Chiroptère
et cinq Primates. Ces cinq espèces de Primates observées sont
toutes des Lémuriens composées de trois espèces diurnes
(Eulemur rufus, Propithecus deckenii, Hapalemur
occidentalis) et deux espèces nocturnes (Microcebus murinus
et Lepilemur ruficaudatus). Parmi les autres Mammifères,
trois espèces sont également endémiques de l'île :
Cryptoprocta ferox, Eidolon dupreanum et Tenrec ecaudatus.
La présence des espèces endémiques de
Madagascar et certaines espèces endémiques régionale de
l'ouest montre la potentialité de l'AP Mandrozo et la
nécessité de la priorisation du site sur le plan de conservation
de la biodiversité et des ressources naturelles (Ranjaonarison et
al., 2009).
10
II. MATERIELS ET METHODES
II.1. MATERIEL BIOLOGIQUE : ESPECE ETUDIEE
II.1.1. Systématique
Cette étude a comme matériel biologique
l'espèce Amaurornis olivieri qui se trouve dans la position
systématique suivante, selon Gill et Wright (2006) :
REGNE : ANIMAL
EMBRANCHEMENT : VERTEBRES
CLASSE : OISEAUX
SOUS-CLASSE : CARINATES
ORDRE : GRUIFORMES
FAMILLE : RALLIDAE
GENRE : Amaurornis
ESPECE : olivieri (Grandidier & Berlioz, 1929)
Cet Oiseau est également connu sous les noms vernaculaires
suivants :
- Vorofaly, Kibedabeda (Malagasy)
- Râle d'Olivier (Français) - Sakalava rail
(Anglais)
II.1.2. Description morphologique
Le Râle d'Olivier Amaurornis olivieri est un
petit Râle dont le corps mesure 19 cm de longueur (Sinclair &
Langrand, 1998). Il possède une silhouette caractéristique de la
famille des Rallidae avec de longs doigts fins, et des ailes et queues courtes.
Cette espèce est facilement distinguée des autres espèces
de Râle malgache par quelques caractères des adultes tels que les
couleurs du bec et des pattes qui sont respectivement jaune claire et
rosâtre. La partie dorsale et les ailes sont à plumage marron;
tandis que les plumages de la tête, de la partie ventrale et de la queue
sont noirâtres. L'iris est rouge. Le jeune diffère de l'adulte par
son corps à plumage brun sombre sur la partie dorsale et noir pour le
reste du corps, ses yeux noirs, son bec gris ardoisé et ses pattes
brunes (Figure 5).

11
Figure 5 : Un adulte et un jeune du Râle
d'Olivier Amaurornis olivieri
(Pruvot, 2015)
II.1.3. Aire de répartition
Amaurornis olivieri est une espèce d'oiseau
d'eau endémique de Madagascar. Elle a une aire de répartition
assez limitée. Sur la totalité de la superficie de Madagascar
(587 000 km2), cette espèce ne se rencontre que dans quelques
zones humides de la partie Ouest de l'île. Elle n'a été
localisée actuellement que dans cinq zones humides appartenant aux trois
districts : lac Kinkony (District de Mitsinjo, Région Boeny), lac
Ampandra, lac Amparihy, lac Sahapy (tous les trois se trouvent dans le District
de Besalampy, Région Melaky), et lac Mandrozo (District de Maintirano,
Région Melaky) (Rabenandrasana, 2007). L'AP Mandrozo constitue la limite
sud de l'aire de distribution actuelle de cette espèce, étant
délimitée au nord par la zone humide de Mahavavy-Kinkony, en
passant par Besalampy (TPF, 2015). Le Râle d'Olivier possède donc
une aire de répartition très restreinte qui se concentre
particulièrement dans la partie Ouest de Madagascar où sa
population est petite et fragmentée.
12
II.1.4. Mode de vie de l'espèce
Amaurornis olivieri est une espèce diurne,
très discrète, et mène une vie généralement
solitaire en dehors de la saison de reproduction. L'espèce vit
cachée dans la végétation bordant un lac mais peut se
montrer à découvert, restant pour s'alimenter à
proximité du couvert végétal où elle se
réfugie à la moindre alerte. Cette espèce se
déplace généralement par la marche. Bien que ses pattes ne
soient pas palmées comme les canards, Amaurornis olivieri est
capable de nager sur une distance plus ou moins longue. Par contre, en
général, cette espèce ne vole pas beaucoup. Quand elle
vole sur de courtes distances, elle vole bas et faiblement avec les pattes
pendantes. Dans la plupart du temps, elle se déplace en journée
pour se nourrir en cherchant sa nourriture soit sur ou sous les feuilles et
dans les racines des plantes flottant dans l'eau, soit à la surface de
l'eau.
II.2. MATERIELS UTILISES SUR LE TERRAIN
L'utilisation des matériels suivants nous a permis de
collecter les données sur terrain et de mener à terme cette
étude :
- une paire de jumelle (10 x 42) et télescope pour les
observations;
- des balances à ressort (pesola) de 200 g et 50 g pour
peser les individus et les oeufs;
- un pied à coulisse (caliper) de 200 mm pour les
mensurations des individus et des
oeufs;
- un mètre ruban de 25 m pour prendre des mesures sur les
caractéristiques du nid et ses
alentours;
- un magnétophone (utilisé pour la méthode
« play-back ») pour enregistrer et diffuser
le chant de l'espèce;
- un filet de capture pour capturer les individus adultes et
jeunes;
- un GPS pour la prise des coordonnées
géographiques;
- un appareil photo pour la prise des photos;
- une montre avec chronomètre pour mesurer les temps
d'observations ainsi que les
temps de suivis de l'espèce;
- des blocs notes, stylos, crayons pour la prise des notes;
- une pirogue en fibre de verre pour le déplacement dans
l'eau;
- des émetteurs télémétriques et une
radio réceptrice (Model MS-1000) avec antenne
directionnelle pour l'estimation des domaines vitaux des
individus radiopistés.
13
II.3. METHODES DE COLLECTES DES DONNEES
II.3.1. Période d'étude sur le terrain
L'étude sur terrain s'est déroulée du
mois de juillet au mois d'octobre 2015, soit une durée de quatre mois.
Elle a été réalisée durant une saison correspondant
à la période de reproduction de l'espèce
étudiée (Amaurornis olivieri).
II.3.2. Méthodes de recensement
Le recensement a été fait par comptage direct
des individus détectés (vus et/ou entendus). Pour ce faire, nous
avons fait le tour du lac Mandrozo en se déplaçant lentement,
avec une vitesse approximative de 1km/h, à l'aide d'une pirogue le long
du bord du lac tout en notant les individus du Râle d'Olivier vus et/ou
entendus dans la végétation bordant ce lac. A chaque 100 m du
parcours, nous nous sommes arrêtés sur un point fixe que l'on
appelle « point d'écoute »
(Blondel et al., 1970). Ainsi, au total, 30 points
d'écoute distancés de 100 m ont été
effectués pendant le recensement. Ils sont tous marqués à
l'aide d'un ruban coloré et disposés le long de la bordure tout
autour du lac Mandrozo. Sur chaque point d'écoute, nous sommes
restés pendant 10 mn en observant et écoutant attentivement les
individus de l'espèce cible. Pour chaque point, nous avons
considéré un rayon de 50 m comme distance de détection
afin d'éviter les doublons.
Si aucun individu n'est visible et ne chante
spontanément pendant les 10 mn d'un point d'écoute donné,
la méthode dite de la repasse ou «play-back» est
utilisée. Cette méthode consiste à utiliser une cassette
préenregistrée avec le chant de l'espèce Amaurornis
olivieri et attendre la réponse pour confirmer la présence
ou l'absence d'individus (Lor & Malecki, 2002). A l'aide d'un
magnétophone, le chant de l'espèce est diffusé et stimule
ainsi les éventuels individus qui se trouvent à proximité,
et qui vont répondre et/ou s'approcher. La diffusion du chant est
répétée à trois reprises pendant 30 secondes,
séparées par deux minutes de temps d'écoute. La
portée du chant diffusé est réglée pour atteindre
jusqu'à 50 m de rayon vers l'intérieur de la
végétation. Par conséquent, tous les individus qui ont
répondu au chant diffusé ont été également
comptés.
Les recensements ont été effectués dans
la matinée de 6 h à 11 h et dans l'après-midi de 14 h 30
à 18 h. Notons que durant cette étude, deux sessions de deux
jours de recensement ont été effectuées avec les
mêmes méthodes et dans les mêmes points prospectés et
distances parcourues.
14
La première session de comptage a eu lieu à la
mi-juillet, et la deuxième a été effectuée vers la
fin du mois de septembre. Nous avons retenu pour l'analyse uniquement
l'effectif le plus élevé dans l'une ou l'autre session de
recensement, afin d'estimer l'abondance et la densité de la population
du Râle d'Olivier dans la zone d'étude.
II.3.3. Recherche des nids
Trois méthodes ont été utilisées
pour localiser les nids. Il s'agit du suivi des individus du couple, la
prospection de la végétation du lac et l'enquête.
a) Suivi des individus du couple
La recherche des nids a été effectuée
à partir du lendemain de la première session de recensement. En
effet, nous avons revisité tous les endroits où des individus ont
été trouvés ou entendus lors de recensements. Mais cette
fois ci, quand un individu est repéré (observé directement
ou localisé à partir de son cri), il est suivi jusqu'à la
confirmation qu'il soit solitaire ou en couple. Dans ce dernier cas, il est
talonné partout jusqu'à la découverte de son nid.
L'exploration a été effectuée tôt
le matin à partir de 5 h 30, car l'oiseau se trouve souvent non loin du
nid à ce moment, jusqu'à 10 h, et vers la fin de
l'après-midi à partir de 17 h jusqu'à 18 h 30, l'heure
correspondant généralement à la rentrée de l'oiseau
dans son nid.
Notons que la méthode de «play-back» a
été également appliquée pour stimuler le chant ou
le cri des individus.
b) Prospection de la végétation du lac et
enquête
Une méthode complémentaire a été
employée pendant la recherche des nids. Elle consiste à
prospecter méthodiquement la végétation du lac
émergée sur tous les endroits suspectés d'accueillir les
nids vers 14 h, même si aucun individu n'est observé. Cette
méthode semble un peu aléatoire, mais souvent efficace pour la
découverte des nids.
Par ailleurs, des enquêtes auprès des villageois,
notamment les pêcheurs, ont constitué également un atout
pendant la recherche des nids. Une photo du Râle d'Olivier a
été montrée aux pêcheurs dans le but de savoir s'ils
connaissent cette espèce ou s'ils avaient déjà vu son nid,
afin de localiser les endroits les plus fréquentés par
l'espèce.
15
Les nids actifs ou inactifs localisés ont
été marqués à l'aide d'un ruban coloré ou
flag. Un nid est considéré comme actif quand un ou des oeufs, des
jeunes, ou des adultes couvant sont observés. Dans le cas contraire, il
est inactif.
II.3.4. Observation du nid
Une fois qu'un nid est localisé ou bien dès que
le couple commence le construire, l'observation est commencée
immédiatement après avoir installé un point d'observation
lequel fournissait un bon angle pour observer l'intérieur du nid. Il
s'agit d'une observation directe à l'oeil nu ou à l'aide d'une
paire de jumelles. Pour cette étude, la distance entre le point
d'observation et le nid est de 6 m.
L'observation a été effectuée tous les
jours, de 6 h à 18 h (soit 12 heures de temps par jour), jusqu'à
ce que les poussins quittent le nid. Tous les comportements et les
activités du couple à l'intérieur du nid et aux alentours
ont été observés et enregistrés.
II.3.5. Capture-recapture
La capture est nécessaire pour peser, mesurer, marquer,
et équiper d'émetteurs les individus adultes.
Vu le type d'habitat (roseaux parfois très dense)
fréquenté par le Râle d'Olivier et son comportement
très discret, aucune méthode et piège standards n'ont
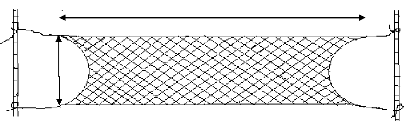
été utilisés pour capturer les individus. Pourtant, nous
avons bricolé un filet de capture de 3 m de long et de 1 m de large
à partir d'un filet de pêche à mailles 30 mm x 30 mm et
dont la section du fil est de 0,15 mm. A noter que c'est à partir de
l'observation du comportement des individus adultes qu'est née
l'idée de bricoler ce filet de capture.
· Principe d'installation du filet et de
capture:
Il convient, dans un premier temps, de repérer
l'individu à capturer. Une fois que l'individu est localisé, nous
avons installé rapidement le filet dans un endroit situé à
quelques mètres (environ 7 à 10 m) de l'individu. Le filet est
installé verticalement suivant sa largeur en attachant les quatre
extrémités sur les tiges ou branches des plantes situées
à proximité (Figure 6). De plus, il est impératif que ce
filet ne soit pas bien étendu et que sa partie inférieure soit au
ras de l'eau ou fixée au sol pour que l'individu ne puisse pas passer
en-dessous.
16
Une fois que le filet est bien installé, on
procède tout de suite à la méthode « play-back »
en leurrant l'individu avec un chant diffusé à l'aide d'un
magnétophone pour l'attirer vers le piège. L'endroit où
l'on diffuse le chant doit se trouver à l'opposé de l'endroit
où l'individu à capturer se trouve par rapport au filet. Par
conséquent, l'individu voulant s'approcher du chant diffusé
percute le filet et est ainsi capturé.
La même méthode a été
utilisée pour la recapture des individus porteurs d'émetteurs.
Ceci a pour but d'enlever ces émetteurs pour que les individus ne les
portent pas durant toute leur vie.
3 m
1 m
Eau ou sol
Figure 6 : Schéma annoté montrant
la disposition du filet de capture II.3.6. Mensuration des
individus
La mensuration a pour but de collecter des données
morphométriques sur les individus capturés. Ces derniers ont
été mesurés à l'aide d'un pied à coulisse de
200 mm et pesés à l'aide d'une balance à ressort (Pesola)
de 200 g. Pour chaque individu mesuré, nous avons pris les
paramètres suivants : les longueurs du corps, du bec (supérieur
et inférieur), de l'aile, de la patte, du tibio-tarse, des doigts et
griffes, de la queue, la longueur et la largeur du crâne.
II.3.7. Etude biologique de l'espèce
L'étude biologique relatée dans cette partie se
focalise notamment sur la biologie de la reproduction. Pour cela, nous avons
observé tous les comportements et activités des couples durant
tous les stades de reproduction, c'est-à-dire, depuis la formation du
couple jusqu'à l'indépendance des jeunes.
17
a) Formation du couple
La formation du couple est considérée lorsque
l'un des individus du couple commence à s'occuper de l'autre
(Andriamalala, 2005). En plus, quelques comportements et activités
effectués par deux individus de sexes différents permettent de
reconnaitre un couple, à savoir, la participation des deux individus
à la construction du nid, la prise de bain de soleil de deux individus
fréquent à un endroit, le toilettage des plumes ensemble. Ces
comportements et activités sont donc observés et notés
pour déterminer la formation du couple.
b) Construction du nid
L'observation de la construction du nid débute par la
vérification de l'état du nid dans le but de savoir si le couple
réutilise un ancien nid ou construit un nouveau nid. Dans ce dernier
cas, les types de matériaux utilisés, la distance de prise de ces
matériaux par rapport à l'emplacement du nid, le nombre de
matériaux collectés par chaque sexe pour la nidification, ont
été observés, comptés et enregistrés. Les
comportements et les rôles des deux sexes pendant cette activité
ont également fait l'objet d'observations directes tout au long de cette
phase. Enfin, la durée totale de la construction du nid est
déterminée.
c) Accouplement
L'accouplement correspond à une phase de la
reproduction pendant laquelle le mâle et la femelle s'unissent
sexuellement dans le but de féconder la femelle. Pendant l'observation
de cette phase, nous avons notés les paramètres suivants : la
durée de l'accouplement, la date et l'heure de cette activité, le
lieu de l'accouplement et sa distance par rapport à l'emplacement du
nid, et le nombre d'accouplement. La durée d'accouplement, correspondant
à la phase cloaque- cloaque, a été
chronométrée et enregistrée. Les comportements des deux
sexes au moment de cette action ont été également
notés. Cette méthode a pour but de connaitre la période,
la durée et la fréquence journalière de l'accouplement.
d) Ponte
La détermination de la période de ponte a
été basée sur l'attitude de la femelle. A partir du moment
où elle a commencé à rester au nid pendant la nuit, nous
avons vérifié le nid chaque matin pendant sept jours
consécutifs. Ceci a pour but de déterminer la date des pontes, le
nombre exact des oeufs pondus et l'intervalle de pontes.
Quand tous les oeufs sont pondus, leurs
caractéristiques telles que la couleur, la dimension (longueur et
largeur) et le poids sont notés.
e) Mensuration des oeufs
La dimension (longueur et largeur) des oeufs a
été mesurée à l'aide d'un pied à coulisse de
200 mm avec une marge d'erreur de 0,01 mm. Puis, les oeufs ont
été mis un à un dans un petit sac en tissus bien
taré et pesés à l'aide d'une balance à ressort
(pesola) de 50 g avec 0,05 près.
Notons qu'après leurs mensurations, les oeufs ont
été remis dans le nid avec précaution, tout en respectant
leur emplacement et leur orientation.
Longueur
18
Figure 7 : Schéma montrant la
mensuration de l'oeuf.
f) Incubation des oeufs
L'incubation est un stade de la reproduction pendant lequel
un individu passe beaucoup de temps dans le nid pour couver les oeufs.
Dès que la première ponte est constatée, nous avons
vérifié si l'incubation commence déjà. Ainsi, la
durée d'incubation est comptée à partir du premier jour de
couvaison jusqu'à la première éclosion. Durant cette
période, l'effort de participation des deux individus du couple,
c'est-à-dire, le temps passés par chaque sexe à la
couvaison des oeufs ainsi que le nombre total de changements entre les deux
conjoints, ont été estimés pendant les heures
d'observation. Tous les comportements du couple pendant la phase d'incubation
ont été également notés.
g) Eclosion des poussins
L'éclosion consiste en un moment où le poussin
sort de l'oeuf. Le jour et le moment de cette phase ont été
déterminés à partir du changement de comportement d'un
individu (femelle ou mâle) dans le nid. Ceci a été suivi
d'une vérification dans le nid afin de confirmer la présence des
poussins et de déterminer l'intervalle entre chaque éclosion.
19
h) Elevage des poussins
Cette phase correspond au moment où les adultes
prennent soin de leurs poussins, en les couvant et leurs apportant de
nourritures. Elle est comptée dès le premier jour de
l'éclosion jusqu'à la date de l'indépendance totale des
jeunes envers leurs parents. L'effort de la participation de deux sexes
à l'élevage des poussins a été estimé. Leurs
comportements ont été également observés et
enregistrés.
II.3.8. Etude écologique de l'espèce
L'écologie consiste à étudier les
conditions d'existence des êtres vivants en fonction du milieu naturel
où ils vivent. Notre étude écologique s'est
concentrée particulièrement sur l'analyse de l'habitat, le
domaine vital et le régime alimentaire de l'espèce
étudiée.
a) Analyse de l'habitat
Cette méthode permet de savoir l'influence des facteurs
externes sur le mode de vie de l'espèce cible et de comprendre les
conditions nécessaires pour son existence dans le milieu
d'étude.
Durant cette étude, deux sortes d'analyses d'habitat
ont été réalisées. L'une porte sur l'habitat du
territoire de nidification, afin de connaitre la structure écologique
exigée par l'espèce pendant la période de reproduction; et
l'autre analyse concerne l'évaluation de toutes sortes de perturbations
et menaces sur l'ensemble de l'habitat de cette espèce dans le site
d'étude.
+ Analyse de l'habitat de nidification
L'analyse de l'habitat de nidification a été
basée sur les paramètres suivants : les caractéristiques
et l'emplacement du nid, les caractéristiques de l'environnement du
nid.
Caractéristiques et emplacement du
nid
La détermination des caractéristiques et de
l'emplacement du nid repose sur les paramètres ci-dessous :
· nombre des branches (tiges) soutenant le nid ;
· diamètre de plante de l'emplacement du nid ;
· hauteur de l'emplacement du nid par rapport à la
surface d'eau ;
·
20
profondeur interne du nid ;
· hauteur externe du nid (de la base jusqu'à
l'extrémité supérieure du nid) ;
· diamètres interne et externe du nid ;
· hauteur des plantes de nidification ;
· orientation de l'ouverture du nid.
Caractéristiques de l'environnement du
nid
Pour analyser les caractéristiques de l'environnement
du nid, il faut tenir compte des paramètres suivants pour chaque nid
trouvé :
· la structure de la végétation aux alentours
de l'emplacement du nid ;
· la profondeur de l'eau entourant l'emplacement du nid
;
· la distance de l'emplacement du nid par rapport aux
éléments perturbateurs d'ordre anthropiques (campement et zones
fréquentées par les pêcheurs) ;
· la distance entre deux nids voisins ;
· la distance entre l'emplacement du nid par rapport aux
nids des autres espèces d'oiseaux.
Pour étudier la « structure de la
végétation » de l'habitat de nidification, nous avons choisi
d'adopter la méthode de Herrick et al., 2005. Cette
méthode est la mieux adaptée pour l'étude de l'habitat
caractérisé par les espèces Herbacées. Elle est
basée sur la richesse spécifique de la flore aux alentours du nid
et la hauteur de la végétation.
Richesse spécifique :
La méthode des points-contacts a été
utilisée afin d'estimer la richesse spécifique de la flore au
sein de l'habitat de nidification étudié (Herrick et
al., 2005). Elle consiste à tracer deux lignes (transects) de 25 m
de long, sur lesquels des relevés floristiques sont effectués
tous les mètres. Ces lignes sont tracées de telle sorte que
l'emplacement du nid se trouve au milieu (25 m vers le gauche et 25 m vers la
droite) (Figure 8).
Pour cela, nous avons étendu une corde de 25 m de long
marquée tous les mètres (point de chaque relevé). Le long
de cette corde, une tige de bois est placée perpendiculairement au sol
ou à la surface de l'eau sur chaque point de relevé, et toutes
les espèces de plantes qui touchent cette tige ont été
recensées. Si plusieurs parties d'un même individu touchent la
tige, cet individu ne sera compté qu'une seule fois.
21
Pendant ce travail, le nom vernaculaire de chaque plante
relevée a été déterminé par des guides
locaux et des techniciens de TPF. Puis, l'espèce a été
identifiée sur place par un Botaniste pour correspondre ces noms
vernaculaires avec leurs noms scientifiques.
Eau
Eau Eau
2 5 m 2 5 m
Végétation dense impénétrable
: Emplacement du nid
Figure 8 : Schéma montrant la mise en
place des transects pour évaluer la richesse spécifique de la
flore de l'habitat de nidification
Hauteur de végétation
Pour estimer la hauteur de végétation, la tige
(5 m de long) utilisée pour les relevés floristiques est
graduée. De cette manière, la hauteur dominante de la strate
supérieure, ainsi que celle de la sous-strate peuvent directement
être lues. Les mesures des hauteurs sont effectuées tous les deux
mètres le long de chaque transect.
Pour éviter la perturbation des activités du
couple dans le nid et à ses alentours, l'étude des
caractéristiques du nid et celles de son environnement ont
été faites après l'abandon du nid par le couple.
+ Evaluation des menaces et perturbations dans l'ensemble
d'habitat
Cette méthode vise à estimer toutes sortes de
perturbations et menaces, d'origines anthropiques et naturelles, sur l'habitat
ainsi que leurs impacts sur le mode de vie de l'espèce
étudiée. Il s'agit de constatations par des observations directes
pendant lesquelles nous identifions la nature de perturbation ou menace
(destruction d'habitat, gêne, prédation, etc.).
Les données issues de cette méthode permettent
d'adapter au mieux les mesures de gestion et d'exploitation des milieux dans
lesquels niche l'espèce cible (Amaurornis olivieri) ainsi que
les autres espèces inféodées.
b) 22
Détermination du régime
alimentaire
Le régime alimentaire de cette espèce a
été déterminé à partir des observations
directes des individus entrain de se nourrir. En plus de la
détermination des nourritures apportées par les adultes lors de
l'élevage des poussins dans le nid, nous avons suivi quelques individus
cherchant de nourritures en s'efforçant d'observer les différents
types de nourritures consommés. L'individu suivi est observé
autant que possible jusqu'à ce qu'il soit hors de la vue, notamment
lorsqu'il pénètre à l'intérieur d'une
végétation de roseaux parfois très dense. Pendant ce
suivi, des photos de nourritures consommées ont été prises
en vue de les identifier ultérieurement.
c) Estimation du domaine vital par
radiopistage
Le radiopistage permet de suivre les individus pendant leur
déplacement dans leur territoire. Grâce à cette
méthode, il est possible d'estimer le domaine vital,
c'est-à-dire, l'utilisation de l'espace et les rythmes
d'activités d'un individu suivi.
Pour ce faire, deux émetteurs ont été mis
sur deux individus adultes différents. Ils sont fixés sur le dos
des individus porteurs à l'aide d'un ruban spécial de
façon à ce que ces individus ne puissent pas les couper à
l'aide de leur bec (Figures 9 et 10). Ces émetteurs pèsent 3 g et
représentent en moyenne l'équivalent de 2 à 3 % du poids
de l'animal. Chaque émetteur possède sa propre fréquence,
et les individus munis d'émetteurs ont été codés
selon la fréquence de l'émetteur qu'ils portent (Rene de Roland,
2010).
Les individus porteurs d'émetteurs sont ensuite
pistés plusieurs fois, grâce à une radio réceptrice
(Model MS-1000) de fréquence 148-160 MHZ reliée à une
antenne directionnelle (model F217-3FB) jusqu'à ce que les
émetteurs ne donnent plus de signal. Afin de minimiser la perturbation
de l'animal, les suivis ont été alternés de deux jours
pour chaque individu.
Les positions géographiques de chaque point
d'arrêt des individus suivis ont été prises à l'aide
d'un GPS. Les coordonnées GPS obtenus lors des suivis ont
été transférées dans un ordinateur, puis
traitées avec le logiciel SIG `Arc GIS 10'. Ce logiciel donne ensuite la
répartition des points GPS sur une carte. Puis, nous avons
calculé la superficie des domaines vitaux des individus
radiopistés par le biais de la méthode du polygone convexe
minimum (PCM) (Morh, 1947) en utilisant toujours le logiciel SIG `Arc GIS 10'.
Le PCM est délimité en reliant les points de localisations les
plus externes les uns aux autres (Harris et al., 1990).
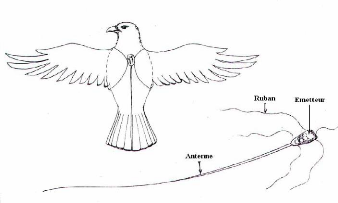
23
Figure 9 : Schéma montrant un
émetteur et sa mise en place sur un oiseau

Figure 10 : Adulte femelle du Râle
d'Olivier Amaurornis olivieri munie d'émetteur
(Pruvot, 2015)
24
II.4. TRAITEMENT DE DONNEES
II.4.1. Estimation de l'abondance
Dans cette étude, l'abondance de Râle d'Olivier
dans le milieu d'étude est exprimée par la densité de sa
population. Cette densité est obtenue en utilisant la formule suivante
:
n
D = S
D = densité, en nombre d'individu par
hectare n = nombre d'individus comptés
S = surface totale de comptage (en hectare)
Nous avons calculé la surface totale de comptage à
partir de la formule suivante :
S = N x ð x r2 /
10000
Où : S est la superficie en hectare ;
N est le nombre de points d'écoute ; et r
est le rayon de détection, soit 50 m.
II.4.2. Analyse statistique
Le traitement des données récoltées sur
terrain a été basé sur des analyses statistiques. Pour
l'harmonisation et la bonne gestion de ces données, des tests
statistiques ont été effectués à l'aide des
logiciels STATISTICA 6.0 et XLSTAT version 2015.1.
a) Moyenne et Ecart-type
Certains résultats sont représentés sous
forme des moyennes avec leur écart-type (moyenne #177;
écart-type) selon les formules suivantes :
Moyenne Ecart-type
=1
X = ~~~
s =
n
n-1
? ~.
~ ~~ ~ ~~~ ~~~~
X= moyenne de la variable x
du rang n S= écart-type
x j= valeur de la variable
x au rang j n= nombre
d'échantillon
25
b) Test du Khi-deux
Le test de Khi-deux est employé pour tester
l'homogénéité des faits observés avec ceux à
espérer pour deux ou plusieurs échantillons (Johnson, 1992). Ce
test a été utilisé pour déterminer s'il y a ou non
de différences significatives entre les nombres de matériaux
apportés par le mâle et la femelle pendant la construction du nid.
Il nous a également servi à comparer les quantités de
nourritures apportées par le mâle et la femelle pendant le
nourrissage des poussins. Les hypothèses nulles (H0)
établies sont :
- « il n'y pas de différence significative
entre les nombres de matériaux de construction du nid apportés
par le mâle et la femelle ».
- « la femelle apporte la même quantité
de nourritures que le mâle pendant le nourrissage des poussins
».
Procédé
Les données brutes sont réparties en classes
dans la table de contingence (tableau de lignes et de colonnes).
La valeur de ÷2 est obtenue selon la formule
suivante :
!
X2 = (Qi - Ci)
Ci
i=1
O= Valeur observée C= Valeur calculée ou
théorique
La valeur observée représente le nombre de
matériaux (feuilles) apportés par le male ou la femelle pour la
construction du nid.
La valeur calculée est obtenue en divisant le produit
du total de ligne et total de colonne par le total général.
Le degré de liberté (d.d.l.) est
obtenu par la formule :
d.d.l.= (Nombre de ligne-1) x (Nombre de
colonne-1)
Dans le cas où le degré de liberté serait
égal à un (d.d.l.=1), il faut passer par la correction de Yate
(Fowler et Cohen, 1985) avec la formule suivante :
k
X2 Yate = ~
26
(|oi - Ci| - 0,5)
Ci
i=1
Pour évaluer le test du Khi-deux, la valeur
calculée (÷2 cal ) est comparée à celle
donnée par la table (÷2 tab). La probabilité de
risque est de 5 % avec hypothèse nulle H0 : « il n'y a pas de
différence significative entre les variables testées ».
- Si ÷2 cal > ÷2
tab, la différence est significative, l'hypothèse nulle H0
est alors rejetée.
- Si ÷2 cal < ÷2
tab, la différence est non significative et H0 est
acceptée.
c) Test-t (non apparié)
Le test-t non apparié est un test paramétrique
permettant de comparer les moyennes de deux échantillons
indépendants issus d'une même population. Ce test est
appliqué pour des données à distribution normale. Il a
été utilisé pour tester la différence entre la
durée d'incubation des oeufs assurée par le mâle et celle
de la femelle. L'hypothèse nulle (H0) suppose qu'il
n'y a pas de différence significative entre la durée d'incubation
des oeufs pour les deux sexes.
La valeur de t est obtenue par la formule
suivante (Fowler & Cohen, 1985) :
t =
X1 - X2
Se .\11 + 1
1i 12
X = moyenne
Se = écart type commun n = effectif
La valeur de t calculée (tc) est
comparée avec celle de la table (tt). Avec un seuil de
signification á= 0,05, si tc >
tt, la probabilité p < 0,05.
Autrement dit, la différence entre les moyennes des deux variables
concernées est significative, et l'hypothèse nulle (H0) est
rejetée. Dans le cas contraire, c'est-à-dire, p
> 0,05, les deux variables sont homogènes ; par
conséquent, H0 est acceptée.
27
III. RESULTATS
III.1. ABONDANCE ET DISTRIBUTION LOCALE
Le premier comptage, ayant lieu le 12 et le 13 juillet 2015, a
permis de dénombrer 11 individus adultes. Le deuxième comptage a
été réalisé le 21 et le 22 septembre 2015, et a
permis de recenser 16 individus adultes. En prenant la valeur maximale, nous
pouvons donc estimer que le lac Mandrozo abrite au moins 16 individus adultes
de Râle d'Olivier dans une surface de 23,55 hectares (surface totale
couverte par les 30 points d'écoute). Ainsi, la densité de la
population de cette espèce obtenue dans le site d'étude est de
0,68 individu/ha.
En ce qui concerne la distribution de ces individus
recensés, la majorité d'entre eux ont été
trouvés dans la partie Sud du lac, avec 10 individus recensés,
dont deux couples. Deux individus (couple) seulement et quatre individus
solitaires ont été trouvés respectivement dans la partie
Ouest et dans la partie Nord de ce lac. Aucun individu n'a été
localisé dans la partie Est (Figure 11).
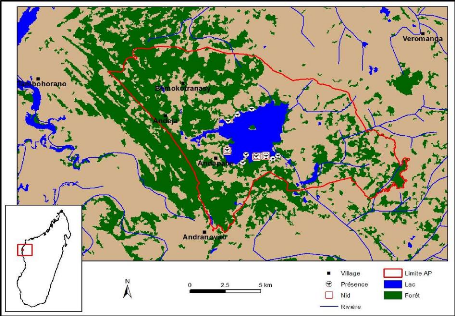
Figure 11 : Carte montrant la distribution des
individus et des nids trouvés dans le lac
Mandrozo pendant la
période d'étude (TPF, 2015)
28
III.2. EFFECTIFS DES INDIVIDUS CAPTURES
Quatre séances de capture ont été
effectuées durant cette étude. Cinq individus dont quatre adultes
(deux mâles et deux femelles) et un juvénile ont été
capturés à l'aide du filet de capture utilisé.
La première capture effectuée le 03 août
2015 a permis de capturer deux individus (un mâle et une femelle) en
couple. Ces individus ont été mesurés, pesés et
marqués à l'aide d'un ruban de couleur bien visible sur leurs
pattes. La deuxième et la troisième captures ont
été réalisées respectivement le 14 août et le
04 septembre 2015. Ainsi, un autre individu mâle solitaire et une autre
femelle ont été piégés, mesurés,
pesés, marqués et équipés d'un émetteur
chacun. La quatrième séance a été effectuée
le 19 octobre 2015 et a permis de capturer un juvénile. Le tableau
suivant résume ce résultat.
Tableau 1 : Résumé du
résultat des captures effectuées dans le lac Mandrozo pendant la
période d'étude
|
Date de capture
|
Nombre
d'individu
capturé
|
Sexe
|
Age
|
marquage
|
Radio
télémétrie
|
|
03 août 2015
|
2
|
Mâle et Femelle
|
Adulte
|
Ruban bleu /
ruban orange
|
-
|
|
14 août 2015
|
1
|
Mâle
|
Adulte
|
-
|
oui
|
|
04 septembre
2015
|
1
|
Femelle
|
Adulte
|
-
|
oui
|
|
19 octobre 2015
|
1
|
indéterminé
|
Juvénile
|
-
|
-
|
29
III.3. MORPHOLOGIE ET MORPHOMETRIE DE L'ESPECE
III.3.1. Morphologie
Durant cette étude, la description morphologique des
adultes et des jeunes a été basée sur l'observation
directe, puis elle a été vérifiée sur tous les
individus capturés.
a) Adultes
Les adultes de Râle d'Olivier présentent une
coloration noire ardoisée pour la tête, la queue et la partie
ventrale, marron pour les ailes et la partie dorsale en partant de la nuque
jusqu'à la base de la queue (Figure 12). Leur bec, leur iris et leurs
pattes sont respectivement jaune, rouge, et rosâtres. Le mâle et la
femelle ont un plumage relativement similaire, ce qui a rendu difficile leur
distinction de loin.
Néanmoins, pendant cette étude, de
légères différences ont été
constatées entre le mâle et la femelle pendant le moment où
ils se mettent ensemble. Le mâle possède un plumage de couleur
plus vive, notamment sur la partie supérieure, que la femelle. Autrement
dit, la couleur marron de la partie dorsale est plus foncée chez le
mâle alors qu'elle est un peu pâle chez la femelle (Figure 12). De
plus, le mâle est légèrement plus petit que la femelle.
Cette différence de taille a été confirmée lors de
la mensuration des individus capturés (Tableau 2). De ce
résultat, nous pouvons affirmer que le Râle d'Olivier
présente donc un dimorphisme sexuel notamment au niveau de la taille de
deux sexes.

Mâle
Femelle
Figure 12 : Adultes du Râle d'Olivier
Amaurornis olivieri : mâle à gauche ; femelle à
droite
(Pruvot, 2015)
30
b) Poussins et juvéniles
A l'éclosion, les poussins sont couverts de duvets
complètement noirs. Il en est de même pour les yeux et les pattes.
Le bec est de couleur rose pâle avec une bande de tâche noire
(Figure 13).
Les jeunes Râles gardent toujours ces duvets noirs
jusqu'à l'âge de 18 jours (Figure 14a). Mais à partir du
15ème jour, des ébauches des plumes (rémiges)
alaires commencent à apparaitre et donnent une coloration blanche au
niveau des points d'attachement des rémiges. Les juvéniles
acquièrent une coloration brune sombre sur la partie supérieure
à partir du 25ème jour. Cette coloration devient de
plus en plus visible au fur à mesure que les jeunes grandissent et
atteignent l'âge de 31ème jour (Figure 14b). Les
juvéniles sont entièrement couverts des plumes à partir du
35ème jour (Figure 14c). A partir de cet âge, leur
plumage évolue progressivement vers celui des adultes. A l'âge de
45 jours, ils ne se diffèrent des adultes que par la coloration du bec,
des yeux et des pattes. A cet âge, ils ont un bec grisâtre
ardoisé, des pattes et yeux encore brunâtres (Figure 14d).
Cette étude n'a pas pu avancer le jour quand les jeunes
acquièrent les plumages adultes.

Figure 13 : Photos des trois poussins de
Râle d'Olivier Amaurornis olivieri à l'âge de 4
jours
après l'éclosion (Pruvot, 2015)

a b
c d
31
Figure 14: Photos montrant l'évolution
morphologique de jeunes de Râle d'Olivier Amaurornis olivieri :
a- Poussin à l'âge de 18 jours; b-
Juvénile à l'âge de 31 jours; c-
Juvénile à l'âge de 39 jours; d-
Juvénile à l'âge de 45 jours (Pruvot, 2015)
III.3.2. Morphométrie
a) Adultes
Durant cette étude, les données
morphométriques ont été prises sur les quatre individus
adultes capturés. Les deux femelles capturées mesurent 19,6 cm et
19,7 cm de longueur avec une moyenne de 19,65 #177; 0,07 cm, et elles
pèsent 96 g et 100 g avec une moyenne de 98 #177; 2,83 g. Les
mâles mesurent 19 cm et 19,3 cm de longueur avec une moyenne de 19,25
#177; 0,07 cm (n = 2 mâles). Ils pèsent respectivement 80 g et 90
g, ce qui donne une moyenne de 85 #177; 7,07 g (n = 2 mâles).
32
Les autres paramètres mesurés sont
présentés dans le tableau ci-dessous (Tableau 2). Ils sont
transformés en moyenne et écart-type. Les données
morphométriques de chaque individu adulte capturé sont
données dans l'Annexe 4.
Tableau 2 : Mensuration des individus adultes
capturés présentée en moyenne et écart- type
|
Sexe
|
Femelle (n=2)
|
Mâle (n=2)
|
|
Paramètres mesurés
|
Moyenne
|
Ecart-type
|
Moyenne
|
Ecart-type
|
|
Poids (g)
|
98
|
2,83
|
85
|
7,07
|
|
Longueur du corps (cm)
|
19,65
|
0,07
|
19,25
|
0,07
|
|
Longueur du bec supérieur (mm)
|
20,41
|
0,02
|
20,40
|
0,007
|
|
Longueur du bec inférieur (mm)
|
20,16
|
0,06
|
20,22
|
0,03
|
|
Longueur de l'aile (mm)
|
138,3
|
3,25
|
130,53
|
0,18
|
|
Longueur du crâne (mm)
|
20,7
|
0,14
|
20,65
|
0,21
|
|
Largeur du crâne (mm)
|
10,71
|
0,01
|
10,64
|
0,06
|
|
Longueur de la patte (mm)
|
135,37
|
7,44
|
130,73
|
0,10
|
|
Longueur du doigt postérieur (mm)
|
10,45
|
0,21
|
10,31
|
0,13
|
|
Longueur de la griffe postérieure (mm)
|
5,95
|
0,35
|
5,55
|
1,20
|
|
Longueur du doigt intérieur (mm)
|
20,81
|
0,01
|
20,77
|
0,03
|
|
Longueur de la griffe du doigt intérieur (mm)
|
7,5
|
0,14
|
7,1
|
0,14
|
|
Longueur du doigt extérieur (mm)
|
30,3
|
0,03
|
30,22
|
0,11
|
|
Longueur de la griffe du doigt extérieur (mm)
|
5,85
|
0,07
|
5,5
|
0,42
|
|
Longueur du doigt médiane (mm)
|
30,65
|
0,20
|
30,69
|
0,01
|
|
Longueur de la griffe médiane (mm)
|
8,05
|
0,07
|
7,95
|
0,21
|
|
Longueur du tibio-tarse (mm)
|
48,42
|
2,72
|
48,65
|
2,05
|
|
Longueur de la queue (mm)
|
50,42
|
0,39
|
50,05
|
0,07
|
b) Poussin et juvénile
Un seul poussin au jour d'éclosion et un seul
juvénile à l'âge de 39 jours ont été
mesurés et pesés pendant cette étude. En effet, nous
n'avons pas pu faire la mensuration de ces jeunes qu'une seule fois afin de
minimiser toute éventuelle perturbation de leurs activités. Tous
les paramètres mesurés sont présentés dans le
tableau ci-après.
33
Tableau 3 : Mensurations d'un poussin au jour
d'éclosion et d'un juvénile à l'âge de 39 jours
|
PARAMETRES
|
Poussin au jour d'éclosion
|
Juvénile à l'âge
de 39
jours
|
|
Poids du corps (g)
|
14,5
|
70
|
|
Longueur du corps (cm)
|
6,7
|
15,2
|
|
Longueur du bec supérieur (mm)
|
7
|
17,5
|
|
Longueur du bec inférieur (mm)
|
6,8
|
17,1
|
|
Longueur de l'aile (mm)
|
20,4
|
100,5
|
|
Longueur du crâne (mm)
|
10,7
|
20,3
|
|
Largeur du crâne (mm)
|
10,11
|
10,6
|
|
Longueur de la patte (mm)
|
60,25
|
130,14
|
|
Longueur du doigt médiane (mm)
|
20
|
30,2
|
|
Longueur du doigt extérieur (mm)
|
19,30
|
20,9
|
|
Longueur du doigt intérieur (mm)
|
10,60
|
20,6
|
|
Longueur du doigt postérieur (mm)
|
6
|
10,15
|
|
Longueur de la griffe du doigt médiane (mm)
|
4
|
7,5
|
|
Longueur de la griffe du doigt extérieur (mm)
|
2,5
|
5,2
|
|
Longueur de la griffe du doigt intérieur (mm)
|
3,2
|
6
|
|
Longueur de la griffe du doigt postérieur (mm)
|
-
|
5
|
|
Longueur de la queue (mm)
|
-
|
36,8
|
III.4. BIOLOGIE DE LA REPRODUCTION
Pendant la période d'étude, trois couples de
Râle d'Olivier ont été étudiés. Les couples
1, 2 et 3 ont été respectivement découverts le 14 juillet
2015, le 04 septembre 2015 et le 22 septembre 2015. Leurs nids respectifs (nid
1, nid 2 et nid 3) ont fait l'objet d'observations directes et continues
dès le jour de leur découverte. La durée totale
d'observations est de 816 heures qui se répartissent dans les
différentes phases de reproduction de l'espèce
étudiée : la formation du couple, la construction du nid,
l'incubation des oeufs et l'élevage des poussins. La figure ci-dessous
montre la répartition des heures d'observation de ces différentes
phases.
Total d'observation (Heures)
48
36
24
600
504
500
400
300
204
Formation du couple
Construction du nid
Incubation des oeufs
Elévage des
poussins dans
le
nid
Elévage des
poussins hors
du nid
200
100
0
Phases de la reproduction
34
Figure 15 : Durée d'observation des
différentes phases de reproduction du Râle
d'Olivier
Amaurornis olivieri pendant la
période d'étude
III.4.1. Formation du couple
Au cours de notre étude, nous n'avons pas pu
observer la formation du couple 1, qui est découvert deux jours
avant la première ponte, et du couple 3 étant
repéré en pleine phase d'incubation. Pourtant,
nous avons pu assister à la formation du couple 2
qui s'est formé entre mi-août et le
début du mois de septembre.
Quelques comportements ont marqué la
formation de ce couple : présence fréquente de deux sexes
dans un même endroit, émission de cris effectués par chaque
individu du couple, recherche des nourritures ensemble,
toilettage des plumes ensemble, l'accouplement et le
transport des matériaux de construction du nid.
Pendant la formation du couple, la femelle suit partout le
mâle qui essaye de la montrer leur territoire de nidification. Le
couple se déplace fréquemment jusqu'à ce qu'il trouve
l'endroit le plus favorable pour placer le nid. Cet endroit est proposé
par le mâle où il commence en premier à apporter quelques
matériaux pour agencer le nid. Durant ce temps, quand
la femelle accepte l'emplacement du nid, elle aide
son partenaire pour accomplir ce travail en apportant aussi des
matériaux de construction. Dans le cas contraire,
c'est-à-dire, quand la femelle refuse l'endroit
proposé par le mâle, ce dernier est obligé
de chercher d'autres endroits plus convenables à sa
conjointe.
pour la
III.4.2. Construction du nid
Le nid 1 a été trouvé en phase de
construction. Son agencement s'est effectué du
14 juillet au 15 juillet 2015, soit deux jours de
construction. Pour le nid 2, sa construction s'est
déroulée du 08 septembre au 11 septembre 2015,
soit quatre jours de construction. Le nid 3 est
déjà construit à sa trouvaille. Ainsi,
ces résultats nous ont permis d'avancer que la
construction du nid chez le Râle d'Olivier
s'effectue entre le mois de juillet et le mois de septembre ,
et dure en moyenne trois jours (n = 2 nids).
En général, les deux sexes participent
à la construction du nid, mais le mâle
semble assurer néanmoins la majorité de tâche.
Cette activité a eu lieu notamment entre 7 h
et 9 h. Durant la construction du nid 2, le couple a
apporté et arrangé au total 201 feuilles mortes
de plantes servant comme matériaux de construction du
nid. La figure suivante présente les
pourcentages d'efforts de la participation des deux sexes
à la construction du nid.
Participation de chaque sexe (%J
40
70
20
60
50
30
80
10
0
Transport des matériaux Arrangement des
matériaux
71
29
51,2
48,8
Mâle Femelle
Figure 16 : Taux de la participation du mâle et de
la femelle pendant la construction du nid
% (n = 142 feuilles) contre 29 % (n = 59 feuilles)
Cette figure montre que parmi ces construction
du nid 2, le mâle a apporté 71
201 feuilles transportées par le couple
2
35
pour la femelle. Par contre, le taux de participation
pour l'arrangement de ces matériaux semble être similaire pour les
deux sexes, 51,2 % (n = 103 feuilles) pour le mâle et
48,8 % (n = 98 feuilles) pour sa conjointe.
36
La différence entre le nombre de matériaux de
construction du nid apportés par les deux sexes est statistiquement
significative par le biais de test du Khi-deux (÷2cal = 28,77
>÷2tab = 3,84; d.d.l = 1; p = 0,0001 <
0,05). Alors, l'hypothèse nulle (H0) établie au
départ est rejetée. Nous pouvons donc conclure que le mâle
participe beaucoup plus à la construction du nid que la femelle.
Matériaux de construction du
nid
Les nids de Râle d'Olivier sont principalement
composés de feuilles mortes de plantes poussant dans le lac, notamment
dans le site de nidification. Le plus souvent, ce sont les feuilles mortes de
Phragmites mauritianus (« Bararata »), de
Panicum sp. (« Ahidrano ») et de Typha
angustifolia (« Vondro ») qui sont les plus
utilisées.
Pour les trois nids trouvés, le nid 1 a
été construit avec les feuilles mortes de Phragmites
mauritianus et de Panicum sp. Le nid 2 a été
fabriqué uniquement avec les feuilles mortes de roseau Phragmites
mauritianus. Et le nid 3 est composé des feuilles de roseau et de
Typha angustifolia.
Les feuilles servant de matériaux de construction du
nid mesurent 5 à 37 cm de long, et 0,5 à 2,5 cm de large (Figure
17). Presque toutes ces feuilles ont été prises dans un rayon de
7 m aux alentours de l'emplacement du nid.

Figure 17 : Un nid du Râle d'Olivier
Amaurornis olivieri (Pruvot, 2015)
37
III.4.3. Accouplement
Pendant la période d'étude, l'accouplement a eu
lieu entre le mois de juillet et le mois de septembre. Au total, 13 copulations
ont été enregistrées dont neuf observées chez le
couple 1 et quatre chez le couple 2. Parmi ces 13 copulations, dix ont eu lieu
dans la matinée entre 6 h et 11 h. Les trois autres ont
été observées entre 14 h et 17 h de l'après midi
(Annexe 5). Tous ces accouplements ont été observés dans
le territoire de nidification (de l'emplacement du nid jusqu'à 8 m aux
alentours). Ils durent en moyenne 4,08 #177; 0,07 secondes (n = 13
copulations). Les détails relatifs à ce sujet sont donnés
en Annexe 6.
III.4.4. Ponte
Pendant cette étude, la période de ponte se
situe entre le mois de juillet et le mois de septembre.
Trois oeufs ont été pondus dans le nid 1. Ils
ont été pondus à un jour d'intervalle, soit trois jours
consécutifs. La première ponte a eu lieu le 16 juillet 2015, le
lendemain de la finition du nid. Le deuxième et le troisième
oeufs ont été pondus respectivement le 17 et le 18 juillet
2015.
La femelle du couple 2 n'a pondu aucun oeuf malgré
l'accouplement effectué par le couple.
Pour le nid 3, la date de ponte est estimée au mois de
septembre car ce nid a déjà contenu trois oeufs au moment de sa
découverte le 22 septembre 2015.
Ponte de remplacement
La ponte de remplacement a été constatée
chez cette espèce. Pour le couple 1, les poussins ont succombé le
jour de leur éclosion par suite d'attaque des fourmis. Ainsi, le couple
a dû abandonner leur nid et change de territoire. Dans ce nouveau
territoire, il a construit un nouveau nid dans lequel au moins trois oeufs ont
été pondus. En réalité, ce nouveau nid n'a pas pu
être observé car il a été inaccessible,
c'est-à-dire, à l'intérieur d'une couverture de la
végétation de roseau où nous n'avons pas pu y
accéder. Mais, 38 jours après la mort de leurs premiers poussins,
le même couple (couple 1) est réapparu avec trois poussins encore
tous petits (à l'âge d'une semaine environ). Ce qui fait qu'il y a
eu une ponte de remplacement avec au moins trois oeufs pondus. Il paraît
alors que la ponte de remplacement est possible chez le Râle
d'Olivier.
38
Caractéristiques des oeufs
Les oeufs présentent une coloration blanche
parsemée des taches marron (Figure 18). Ils mesurent en moyenne 31,4
#177; 0,15 mm (n = 3 oeufs) de long et 26 #177; 0,14 mm (n = 3 oeufs) de large.
Le poids moyen est de 14,8 #177; 0,21 g (n = 3 oeufs).
Tableau 4 : Dimensions et poids des oeufs du
Râle d'Olivier pris sur un échantillon de trois oeufs dans le nid
1.
|
oeuf 1
|
oeuf 2
|
oeuf 3
|
Moyenne #177; écart-type
|
|
Poids (g)
|
15
|
14, 5
|
14,7
|
14,8 #177; 0,21
|
|
Longueur (mm)
|
31,5
|
31,2
|
31,4
|
31,4 #177;0,15
|
|
Largeur (mm)
|
26, 2
|
26,1
|
25,9
|
26 #177;0,14
|

Figure 18 : Photo des oeufs du Râle
d'Olivier Amaurornis olivieri dans un nid
(Pruvot, 2015)
39
III.4.5. Incubation
|
et dure 17 jours
|
pour le couple 1.
|
L'incubation commence dès la première
ponte
Le couple 3, découvert en pleine phase
d'incubation, n'est observé incuber leurs oeufs que
cinq jours après lesquels l'éclosion a eu
lieu.
Les deux sexes ont participé à la
couvaison en se succédant tour à tour depuis la
première ponte jusqu'à l'éclosion. Les
oeufs sont couvés pendant le jour et la nuit.
La durée totale de l'observation de ce
stade durant la journée est de 204 h. Les oeufs sont
incubés par la femelle pendant 105 h (soit 51,5 % du
temps d'observation) contre 88 h (43,1 %) pour le mâle.
Ils ne s ont pas couvés pendant 11 h (5,4 % du
temps d'observation), c'est-à-dire, absence de deux
sexes dans le nid (Figure 19).
Parmi les 17 nuits d'incubation, neuf nuits
(53 %) ont été assurées par la femelle contre
huit (47 %) pour le mâle (Figure 19) .
Le nid n'est jamais abandonné durant la nuit.
Statistiquement, l e résultat du
test-t a montré une différence non significative
entre les moyennes de durée d'incubation du
mâle et de la femelle (t= -1 ,10 ; d.d.l = 15 ;
p= 0,28 > 0,05) . Ce qui fait que
l'hypothèse nulle est acceptée. La tâche
d'incubation des oeufs est donc plus ou moins
équilibrée pour les deux sexes.
Participation de chaque sexe (%)
40
20
60
50
30
10
0
51,5
Femelle Mâle Absence
53
43,1
47
5,4
0
Jour Nuit
|
Figure 19 : Taux de la participation du mâle et de
la femelle à l'incubation des oeufs la journée et durant
la nuit
|
pendant
|
40
III.4.6. Eclosion
Les éclosions des oeufs dans le nid 1 et dans le nid 3
ont eu lieu respectivement le 02 août 2015 et le 28 septembre 2015. Ce
résultat nous permet d'avancer que la période d'éclosion
du Râle d'Olivier se situe entre août et septembre.
Dans ces deux nids, tous les oeufs (trois oeufs par
nichée) ont éclos le même jour (entre 6 h et 10 h) à
environ une heure d'intervalle. Le taux de réussite d'éclosion
est donc de 100 % (n = 2 nids) pendant cette étude. Cependant, le jour
d'éclosion même (vers 10h 30), le nid 1 a été envahi
par des fourmis, ce qui a entrainé la mort des poussins qui viennent
juste d'éclore.
III.4.7. Elevage des poussins
Notons que la phase d'élevage des poussins a
été observée chez le couple 3. La durée de cette
phase est de 45 jours dont trois jours seulement dans le nid et 42 jours hors
du nid. Les poussins sont nidifuges, c'est-à-dire, ils quittent le nid
très tôt, dans les trois jours qui suivent l'éclosion.
Les deux individus du couple élèvent ensemble
les poussins depuis leur éclosion jusqu'à leur
indépendance. Ainsi, ils participent tous les deux à la couvaison
et au nourrissage des poussins.
La couvaison des poussins a eu lieu surtout pendant leur
séjour dans le nid, soit donc trois jours. Les deux adultes assurent
cette tâche à tour de rôle. Durant notre observation, le
couple a dépensé au total 19,4 h pour couver leurs
progénitures. La femelle a dépensé plus de temps, 14,2 h
(73 %), par rapport à son partenaire, 5,2 h (27 %) (Figure 20).
Le nourrissage des poussins a commencé dès le
deuxième jour de leur éclosion. Un total de 161 nourritures a
été livré par les adultes au nid pour nourrir leurs
poussins. Parmi ces nourritures, le mâle a amené 85 (53 %) contre
76 (47 %) pour la femelle (Figure 20).
Le résultat du test de Khi-deux (÷2cal
= 0,008 < ÷2tab = 3,84 ; d.d.l = 1; p =
0,93 > 0,05) a montré une différence non significative entre
le nombre de nourritures apportées par les adultes pendant le
nourrissage des poussins. Par conséquent, l'hypothèse nulle selon
laquelle la femelle apporte autant de nourritures que le mâle pour
nourrir les poussins, est acceptée. Ce qui permet d'en déduire
que la femelle contribue aussi bien au nourrissage des poussins que le
mâle.
Mâle Femelle
Participation de chaque sexe (%)
80
70
60
50
40
30
20
10
0
73
53
47
27
Couvaison des poussins Apport des nourritures
41
Figure 20 : Taux de la participation du mâle et
de la femelle à la couvaison des poussins et à
l'apport des
nourritures pendant l'élevage des poussins dans le nid
A partir du quatrième jour, les poussins
quittent le nid et suivent leurs parents qui les nourrissent à
l'extérieur du nid. Pendant ce temps, les adultes
occupent toujours ensemble leurs progénitures. Parfois,
nous avons constaté qu'un des poussins a suivi
le mâle et les deux autres ont suivi la femelle et vice
versa, mais ils se trouvent toujours proches (à une distance maximale de
10 m) les uns des autres.
Avant 14ème jour de leur
âge, les poussins sont nourris par leurs parents de
manière bec à bec. Mais à partir du 15
ème jour, ils commencent à
chercher petit à petit leur propre nourriture bien que les adultes
les en apportent encore. L'apport de nourritures des parents
diminue progressivement au fur et à mesure que les poussins
sont de plus en plus aptes à chercher de
nourritures.
Les parents cessent de nourrir les jeunes au bout de
40 jours, même si ceux-ci les suivent encore. Les jeunes
Râles sont totalement indépendants de leurs parents
à l'âge de 45 jours. Ainsi, ils se sont
dispersés.
42
III.5. ECOLOGIE
III.5.1. Habitat
a) Emplacement et caractéristiques des
nids
Rappelons que trois nids de Râle d'Olivier (deux actifs
et un inactif) ont été observés. Ils se trouvent tous dans
de touffes de roseau Phragmites mauritianus d'une hauteur variant de 2
à 4 m et de diamètre entre 1 et 3 cm. Ils sont placés dans
la partie inférieure de ces plantes et supportés en moyenne par
18 tiges (n = 3 nids) allongées qui se superposent et dont quelques
extrémités des feuilles touchent la surface de l'eau. En
général, l'emplacement des nids dans la touffe de tiges est
à l'abri des prédateurs d'une part, et moins exposé
à l'ensoleillement d'autre part.
Dans la présente étude, les mesures de distances
inter-nids durant la saison de reproduction ont montré que les trois
nids trouvés se trouvent éloignées les uns des autres. La
distance entre le nid 1 et le nid 2 est de 648 m. Le nid 3 se trouve à
2,14 km du nid 1, et la distance entre le nid 2 et le nid 3 est de 2,7 km.
Tableau 5 : Caractéristiques des nids
du Râle d'Olivier durant la période d'étude
(Juillet -
Octobre 2015)
|
Caractéristiques
|
Nid 1
|
Nid 2
|
Nid 3
|
Moyenne #177; écart-type
|
|
Diamètre externe (cm)
|
14,5
|
16
|
13,7
|
14,73 #177; 1,17
|
|
Diamètre interne (cm)
|
13,75
|
15,6
|
13,33
|
14,23 #177; 1,21
|
|
Profondeur interne (cm)
|
5,1
|
7
|
6,2
|
6,1 #177; 0,95
|
|
Hauteur externe des nids (cm)
|
13
|
16
|
11
|
13,33 #177; 2,51
|
|
Hauteur des nids par rapport à la surface d'eau (cm)
|
40
|
60
|
70
|
56,67 #177; 15,27
|
|
Eloignement des berges (m)
|
100
|
70
|
36
|
68,67 #177; 32,02
|
|
Profondeur de l'eau (cm)
|
100
|
80
|
45
|
75 #177; 27,84
|
De ce tableau, on s'aperçoit que les trois nids
trouvés sont caractérisés par un diamètre externe
moyen de 14,73 #177; 1,17 cm (n = 3 nids), un diamètre interne moyen de
14,23 #177; 1,21 cm (n = 3 nids), une profondeur moyenne interne de 6,1 #177;
0,95 cm (n = 3 nids) et une hauteur externe moyenne de 13,33 #177; 2,51 cm (n =
3 nids).
La hauteur des nids par rapport à la surface d'eau est
en moyenne 56,67 #177; 15,27 cm (n = 3 nids). Les nids se situent à une
distance moyenne de berges de 68,67 #177; 32,02 m (n = 3 nids). La profondeur
moyenne de l'eau dans les zones de nidification est de 75 #177; 27,84 cm (n = 3
nids).

Figure 22: Photo montrant les plantes de
l'emplacement du nid 1 (Pruvot, 2015)
: Place du nid par rapport à ces plantes
Figure 21: Un nid du Râle d'Olivier
avec un adulte incubant les oeufs (Pruvot, 2015)
43
b) Caractéristiques de l'habitat de nidification
+ Structure de la
végétation
En général, le type d'habitat environnant le
site de nidification est caractérisé par des roseaux et d'autres
plantes herbacées. Au total, 22 espèces de plantes ont
été recensées sur l'ensemble des transects
réalisés (Annexe 7). Les roseaux Phragmites mauritianus
(« Bararata ») sont dominants sur 58 %. Viennent
ensuite Thelypteris palustris ou « Faritsoky » (21
%) et Typha angustifolia (5 %). Les autres espèces
herbacées occupent les 16 % restant.
De plus, les roseaux présentent une hauteur variant de
2 à 4 m. Cette hauteur varie de 0,5 à 1 m, et de 0,6 à 1,5
m respectivement pour Thelypteris palustris et Typha angustifolia.
Elle est inférieure à un mètre pour les autres
espèces. Ces résultats permettent de conclure que la strate
supérieure de végétation est principalement
constituée par des inflorescences de roseaux et la strate
inférieure contient les autres espèces herbacées ainsi que
la partie basse des roseaux. La strate inférieure représente la
tranche de végétation la plus utilisée par le Râle
d'Olivier pour la quête de nourritures et le déplacement.

44
Figure 23 : Photo montrant la structure
végétale de l'habitat de nidification du Râle d'Olivier
dans le lac Mandrozo (cliché par Pruvot en 2015)
+ Autres facteurs environnementaux
Les autres facteurs pris en compte ici se focalisent notamment
sur la distance de l'emplacement de nids de l'espèce
étudiée par rapport aux habitations humaines et par rapport aux
nids des autres espèces d'oiseau.
L'emplacement de nids est en général loin du
village et des campements des pêcheurs. La distance varie de 1000
à 2300 m (Tableau 6). Ainsi, nous pouvons dire que le territoire de
nidification de cette espèce dans le lac Mandrozo est plus ou moins
épargné de la perturbation humaine.
Des nids de Rousserolle de Newton Acrocephalus newtoni
sont les plus fréquemment trouvés au voisinage de nids de
l'espèce étudiée. La présence des nids de cette
autre espèce non loin de ceux des couples étudiés
n'affecte pas directement le choix de leur milieu de nidification. Pourtant,
des conflits ont été quelquefois observés entre le couple
de Râle d'Olivier et le couple de Rousserolle de Newton.
Plusieurs espèces d'oiseaux fréquentent
également ce même type d'habitat, mais durant notre observation,
nous avons remarqué que le Coucal Malgache Centropus toulou
constitue particulièrement une sorte de dérangement le plus
fréquent pendant la période d'incubation de l'espèce
étudiée.
45
Tableau 6 : Distance des nids par rapport aux
autres paramètres étudiés
|
Paramètres
|
Distance
en moyenne (n = 3 nids)
|
|
Nid de Rousserolle de Newton Acrocephalus newtoni
|
5, 7 m
|
|
Village le plus proche
|
2586 m
|
|
Campements des pêcheurs
|
2226,33m
|
|
Riziculture avec un petit campement
|
1733,33 m
|
c) Perturbations et menaces
Différentes types de pressions et menaces ont
été enregistrées, à savoir, l'envahissement du nid
par les fourmis au moment de l'éclosion, la pêche intensive au
voisinage du territoire de nidification, l'abattage des roseaux par les
pêcheurs et même la présence des feux ravageant quelques
partie de roseaux (Bararata) (Figure 25). Néanmoins, le
degré de ces pressions et menaces semble encore faible.
Durant cette étude, nous avons constaté le
danger représenté par les fourmis au moment de l'éclosion
des oeufs. En effet, le jour d'éclosion, le nid 1 a été
envahi par les fourmis entrainant ainsi l'abandon du nid par les adultes qui
devraient couver leurs poussins. Par conséquent, un des poussins a
succombé sur place, abandonné dans ce nid et les deux autres ont
été tombés du nid dans l'eau (Figure 24). Ainsi, suite
à l'attaque des fourmis dans le nid, les trois poussins ont tous
succombé. Ce qui fait que les fourmis constituent une grande menace pour
cette espèce.

46
Figure 24 : Un poussin du Râle d'Olivier
Amaurornis olivieri mort abandonné dans le nid 1
suite
à l'attaque des fourmis (Pruvot, 2015)
En ce qui concerne la perturbation et menace d'origine
anthropique, nous avons également pu observer directement que les
pêcheurs constituent une sorte de perturbation. Ils viennent
fréquemment pêcher proche des couvertures végétales
(roseaux) bordant le lac avec des bruits, ce qui entraine l'abandon du nid par
le couple. En effet, le Râle d'Olivier préfère construire
son nid à la périphérie de la couverture
végétale plutôt qu'à l'intérieure. De plus,
ces pêcheurs coupent chaque année des roseaux pour construire
leurs cottages (petites maisons dans leur campement) et de plate-forme pour
étaler les poissons grillés.

Figure 25 : Photo montrant la destruction de
quelques parties de l'habitat par la coupe
à gauche, par les feux
à droite (Pruvot, 2015)
47
Enfin, bien que nous n'avions pas pu observer directement la
prédation sur cette espèce, des prédateurs redoutables ont
été identifiés dans le lac et aux alentours. Il s'agit des
crocodiles, des rats, des serpents (Boidae) et une espèce d'Oiseau de
proies (Milvus aegyptus ou Milan à bec jaune).
III.5.2. Domaine vital
Pendant la période d'étude, deux individus
adultes (la femelle du couple 2 et le mâle du couple 3) ont
été équipés d'émetteurs et suivis pour
l'estimation du domaine vital. Il est à rappeler que ces deux individus
ont été codés selon la fréquence d'émetteur
qu'ils portaient. Le mâle et la femelle ont été
codés respectivement Frq28 et Frq34.
Tableau 7: Tableau montrant les codes des
individus, la fréquence des émetteurs qu'ils portent, le nombre
de jours de suivi et la surface de leur domaine vital
|
Code-individu
|
Fréquence
d'émetteur
|
Sexe
|
Nombre de
jours de suivi
|
Domaine vital
|
|
Individu Frq28
|
216-2855
|
Mâle
|
25
|
1,98 ha
|
|
Individu Frq34
|
216-3440
|
Femelle
|
19
|
0,95 ha
|
L'individu Frq28 a été suivi pendant 25 jours
avec 60 coordonnées collectées. Ainsi, cet individu a
utilisé un territoire d'une surface de 1,98 ha (Figure 26) durant la
période de suivi.
Le suivi de l'individu Frq34 durant 19 jours a permis de
récolter 39 points qui se répartissent sur une surface de 0,95 ha
(Figure 26).
Aucun chevauchement des territoires n'a été
observé entre ces deux individus
radiopistés (Figure 26).
Les cartes montrant les détails relatifs à la
répartition des coordonnées géographiques et les domaines
vitaux de chacun des individus radiopistés sont séparément
données en Annexe 8.
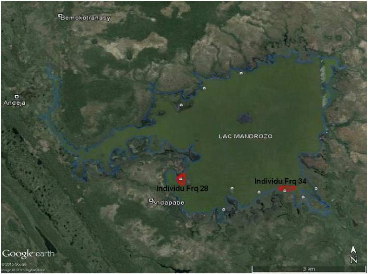
48
Figure 26 : Carte montrant les domaines
vitaux de deux individus (Frq28 et Frq34) du Râle d'Olivier
Amaurornis olivieri radiopistés dans le site d'étude
(TPF, 2015).
III.5.3. Régime alimentaire
L'observation directe couplée avec la prise de photo de
nourritures consommées par les adultes et jeunes ont permis de
déterminer les types de nourritures de Râle d'Olivier dans le
milieu d'étude.
Durant la phase d'incubation du couple 1, nous avons pu
observer la femelle s'alimenter 26 fois avec 26 nourritures consommées
dont 21 identifiées et 05 non identifiées. Ces 21 nourritures
identifiées se répartissent comme suit : 11 araignées, 09
insectes et un mollusque. En revanche, le mâle a été
observé entrain de se nourrir 12 fois avec 12 nourritures
consommées dont 05 araignées, 05 insectes (composés de 03
libellules, 01 chenille, et 01 coléoptère) et 02 crustacés
(écrevisses) (Figure 27) (Annexe 9).
12
10
8
6
4
2
Nombre pour chaque type
Mâle Femelle
0
Insecte Araignée Crustacé Mollusque Non
identifiée
Types de nourritures consommées
49
Figure 27 : Effectifs des nourritures
consommées par le mâle et la femelle pendant la période
d'incubation des oeufs du couple 1.
Pendant la phase d'élevage des poussins du couple 3,
nous avons identifié 161 nourritures. Elles sont composées de 87
araignées, 48 insectes, 19 crustacés, 07 mollusques (Figure
28).
|
100
|
|
|
|
|
90
|
|
87
|
|
|
80
|
|
|
|
|
|
|
70
|
|
|
|
|
|
|
60
|
|
|
|
|
|
|
48
|
|
|
|
|
|
50
|
|
|
|
|
|
|
40
|
|
|
|
|
|
|
|
30
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
|
20
|
|
|
|
|
|
|
|
|
|
|
10
|
|
|
|
|
7
|
|
|
0
|
|
|
|
|
|
|
|
|
|
|
|
|
Insecte
|
Araignée Mollusque
|
Crustacé
|
Types de nourritures consommées
Nombre pour chaque type
Figure 28 : Effectifs des nourritures
consommées pendant l'élevage des poussins du couple 3
50
En somme, durant toute la période
d'étude, nous avons enregistré 194 nourritures
consommées par tous les individus (adultes et
juvéniles) observés. Parmi ces nourritures, 103
(53,1 %) sont des araignées; 62 (32 %) sont des
insectes (chenilles, libellules et coléoptères);
21 (10,8 %) crustacés et 08 (4,1 %) mollusques (Figure
29).
Ces résultats montrent que le Râle
d'Olivier se nourrit essentiellement d'invertébrés.
Les araignées sont les plus consommés pendant la
période d'étude, tandis que les mollusques sont les
moins consommés.
10, 8 %
53, 1%
4,1%
32%
Insecte Araignée Crustacé
Mollusque
Figure 29 : Proportion des invertébrés
consommés par le Râle d'Olivier pendant toute la
période d'étude

Figure 30 : Photos d'exemples
des araignées consommées par le Râle
d'Olivier dans le lac Mandrozo (Pruvot, 2015)
51
Notons que dans cette étude, l'identification des
invertébrés constituant le régime alimentaire du
Râle d'Olivier reste au niveau des classes. Les autres photos de
certaines espèces d'invertébrés consommées par
cette espèce dans le lac Mandrozo sont présentées en
Annexe 9.
III.6. ETHOLOGIE
III.6.1. Types de cris
Différents types de cris d'adulte et de jeune ont
été connus et enregistrés pendant cette
étude.
+ Cris des adultes
· Cri pendant la recherche de nourritures
: lors de la recherche de nourritures, les adultes
d'Amaurornis olivieri émettent souvent des cris comme «
tic- tic huawwk » ou « huawwk » seulement.
· Cri caractéristique du couple
: « prrrrrrrourourururrrurruruururu !!!! ». Ce
type de cri est effectué simultanément par les deux individus du
couple, notamment lorsque qu'ils se rencontrent. Il est entendu surtout le
matin. Il précède le plus souvent l'accouplement.
· Cri d'appel : «
tic-tic....tic-tic ». Ce type de cri est entendu en particulier
pendant la période d'incubation des oeufs. En effet, il est émis
d'une part par l'individu couvant dans le nid pour appeler son partenaire,
d'autre part par l'individu qui va remplacer pour signaler son arrivé.
En général, ce cri, émis par un individu, provoque une
réponse de la part d'autre individu. Notons que ce type de cri a
été également entendu chez des individus solitaires.
· Cri d'alarme : «
tic tswook- tswouak!! ». Ce cri est émis par les adultes
pour avertir les jeunes du danger.
· Autre type de cris : «
kok, kok, kakkok...kokkok !! ». Ce type de cri est notamment
entendu pendant la phase de construction du nid et avant la ponte. Il est
émis surtout par la femelle à la manière d'une caquette
d'une poule.
+ Cris des poussins
· Cris de faim : «
kwiiii...kiouwiiii...kiouw ». Il est répété
chaque cinq secondes et ne s'arrête que lorsqu'un des parents apporte de
nourriture. De plus, lorsque que les parents arrivent avec des nourritures, les
poussins émettent un autre type de cri. C'est une sorte de «
tswuiiikproouiii-tswuikproouiii...».
52
III.6.2. Comportement pendant la période de
reproduction
a) Pendant la construction du nid
Rappelons que les deux individus du couple assurent la
construction du nid. Au début de la construction du nid, le mâle
transporte et arrange à lui seul les matériaux de construction.
Pendant ce temps, il travaille de façon continue qui dure 25 minutes,
tandis que la femelle cherche de nourriture aux alentours et fait le toilettage
de ses plumes. Une fois que la femelle accepte l'endroit proposé par son
partenaire, elle commence à participer à la construction du nid.
A partir de ce moment, nous avons constaté une tâche bien
répartie pour les deux sexes. Si le mâle apporte les
matériaux de construction (feuilles mortes de roseaux), la femelle les
arrange à l'intérieur du nid, et vice versa. Le transfert de ces
matériaux d'un individu à l'autre se fait de bec à bec.
Pendant l'agencement du nid, le couple travaille de
façon discontinue, c'est-à-dire, les individus ont parfois pris
de petites pauses de 5 à 25 mn pour s'accoupler ou prendre de repos ou
faire de toilettage. Durant ces périodes, ils restent toujours aux
alentours de l'emplacement du nid. Chaque séance de travail dure en
moyenne 1 h 30 mn, incluant les petites pauses. Parfois, les deux
séances consécutives sont intercalées de 3 h d'intervalle
au maximum pour la quête de nourritures. Après chaque pause ou
après la recherche de nourriture, lors que le couple retourne au
travail, les deux sexes apportent chacun une feuille. La femelle entre dans le
nid, dépose et arrange la feuille qu'elle transporte, puis elle prend
avec son bec la feuille transportée par le mâle.
b) Parade nuptial et accouplement
En général, la femelle invite le mâle
à s'accoupler. Dans ce cas, elle se pose sur des tiges de plantes
flottées dans l'eau ou sur le sol émergeant à
proximité et émet des cris répétitifs
spécifiques. Le mâle entendant ces cris s'approche rapidement en
criant à voix basse et grave (à la manière d'une caquette
d'une poule). Lorsque la femelle a vu le mâle s'approcher, elle
écarte ses ailes pour signaler son partenaire qu'elle est
déjà prête à s'accoupler. Puis elle replie ses ailes
quand le mâle est tous près. Ce geste est accompagné d'une
émission de cris simultanés émis par les deux sexes. C'est
une sorte de « prrrrrrrourourrrrrourrouououruru !!!!». A
partir de là, au moment où les deux sexes sont prêts
à s'accoupler, la femelle s'accroupit permettant ainsi au mâle de
grimper sur son dos en lui pinçant la tête. Le corps du mâle
dévie de gauche à droite et vice versa pour prendre
l'équilibre. La queue du mâle se bascule en arrière et
descend vers le bas, tandis que
53
celle de la femelle se bascule vers le haut pour faciliter le
contact de leurs cloaques. Pendant ce temps, la femelle crie de plus en plus
fort et le mâle émet toujours un faible gloussement.
Sur les neuf copulations enregistrées chez le couple 1,
la femelle invite le mâle à s'accoupler pendant six copulations
contre trois pour le mâle. Par contre, parmi les quatre copulations
observées chez le couple 2, le mâle sollicite la femelle à
s'accoupler pour trois copulations contre un seulement pour la femelle.
Lorsque le mâle étant prêt à
s'accoupler n'est pas invité par la femelle, il suit sa partenaire d'un
pas saccadé, cou tendu en avançant et en reculant la tête
et en émettant des cris à voix basse. Il arrive que le mâle
sollicite la femelle à s'accoupler en nettoyant les plumes du cou et de
la tête de celle-ci. Ce comportement de toilettage s'est terminé
par un accouplement. Bien que rarement observé, il fait sans doute
partie des parades sexuelles.
Notons qu'en générale, après chaque
accouplement les deux individus du couple se nettoient souvent les plumes
(essentiellement de la tête et du cou). Il est également à
noter que ce comportement de toilettage a été observé sans
qu'il y ait un accouplement.
c) Pendant la ponte et l'incubation des oeufs
Le comportement relaté dans cette partie concerne en
particulier celui du couple 1, puisqu'il est le seul couple suivi depuis la
première ponte jusqu'à l'éclosion des oeufs.
La femelle commence à rester au nid pendant la nuit de
la finition du nid. La première ponte a eu lieu le lendemain, et
dès lors les deux sexes assurent l'incubation durant la journée
à tour de rôle. Cependant, durant les trois jours successifs de
ponte, la participation du mâle à la couvaison est encore faible
(en moyenne 3 h de temps par jour au maximum) et il ne couve pas encore durant
la nuit. Le mâle ne commence à incuber les oeufs pendant la nuit
qu'après la dernière ponte, et sa participation à
l'incubation durant la journée augmente également à partir
de ce jour. L'individu qui couve répare souvent le nid et change parfois
de position et d'orientation.
Durant la période d'incubation, le mâle ne
nourrit pas la femelle et vice versa. Le changement permet à l'individu
libre de trouver ses propres nourritures. Au total, 82 changements ont eu lieu
entre les deux sexes durant toute la phase d'incubation. Il y a eu lieu en
moyenne cinq changements par jour. Le changement se déroule le matin
à 6 h 38 le plus tôt et le soir à 17 h 52 le plus tard. Le
relais se fait de façon continue.
54
Dans la plupart de cas, avant chaque changement l'individu qui
va remplacer prévient son partenaire en criant pour signaler son
arrivée. Ce comportement incite celui qui couve à sortir du nid.
Le couple ne s'absente du nid que de courte durée. Cette absence n'a eu
lieu que pendant la période la plus chaude de la journée (entre
10 h 30 et 14 h) lorsque les individus se relaxent. La durée de cette
relaxation peut atteindre 26 minutes au maximum. Lorsqu'un individu incubant
quitte le nid en absence de son partenaire, il reste toujours aux alentours du
nid.
Pendant cette phase, en général avant chaque
changement, l'individu remplaçant coupe et apporte avec son bec une
feuille morte de roseau ou de Panicum sp pour renforcer et
réparer le nid. Durant notre observation, nous avons constaté que
le renforcement ou la réparation du nid s'est intensifié aux
13ème et 14ème jours d'incubation,
c'est-à-dire, cinq et quatre jours avant l'éclosion des oeufs.
Pendant le 13ème jour d'incubation, le mâle et la
femelle ont apporté respectivement 40 et 46 feuilles. Pour le
14ème jour, 82 feuilles ont été
apportées par le mâle contre 44 pour la femelle. Nous
considérons que cette intensification du renforcement du nid a un
rapport avec l'approche du jour d'éclosion. En effet, le couple
prépare bien l'arrivé de leurs progénitures.
d) Pendant l'élevage des poussins
+ Comportements des adultes
Rappelons que les deux adultes participent à
l'élevage des poussins depuis leur éclosion jusqu'à leur
dispersion. Le premier jour d'éclosion, les deux adultes se
succèdent pour couver les poussins. L'individu couvant ne quitte le nid
que lorsque son conjoint arrive pour le remplacer. L'individu qui va remplacer
émet toujours des cris pour signaler son arrivé. La femelle passe
beaucoup de temps à couver les poussins que le mâle, car une fois
remplacée elle revient toujours vite (ne dépassant pas une heure
de temps). De plus, il arrive parfois qu'elle refuse d'être
remplacée par le mâle. Dans ce cas, le mâle apporte des
feuilles sèches de roseau à l'aide de son bec et les passe
à la femelle qui les arrange dans le nid pour le renforcer.
Pendant que les poussins sont encore dans le nid, les parents
apportent des nourritures à l'aide de leurs becs et nourrissent les
poussins d'une manière bec à bec. Pendant ce temps, si un
individu recherche de nourritures, l'autre assure la garde des poussins en
cherchant des nourritures non loin du nid. Durant notre observation, dans la
majorité des cas, c'est la femelle qui assure la garde des poussins
alors que le mâle peut aller plus loin (jusqu'à 30 m environ) pour
chercher de nourritures.
55
Pendant l'élevage des poussins hors du nid, même
si les poussins sont déjà capable de suivre leurs parents, ils
sont encore nourris d'une manière bec à bec jusqu'à une
semaine. A partir de là, les adultes apportent des nourritures et les
déposent au sol pour que les poussins les prennent à l'aide de
leur bec. Ce comportement a été observé notamment lorsque
les parents sont pressés pour chercher des nourritures. Cependant, nous
avons également observé que les parents peuvent encore nourrir
les poussins d'une manière bec à bec jusqu'à 39 jours.
+ Comportements des jeunes
Pendant la période de couvaison, les poussins
émettent des cris lorsque l'adulte les quitte. Ils ne cessent de crier
qu'à l'arrivée d'un adulte qui va les couver.
Durant leur élevage hors du nid, les jeunes
émettent des cris de faim (« kwiiii...kiouwiiii...kwiiii
» répétés chaque cinq secondes en suivant leurs
parents. Quelques fois ils restent sur un endroit en attendant leurs parents
à apporter des nourritures tout en criant. Quand ils voient leurs
parents apportés de nourritures, ils courent rapidement vers ceux-ci en
émettant des cris simultanés («
tswuiiikproouiii-tswuikproouiii...»). Aucune compétition
entre les poussins n'a été observée.
Notons que pendant l'élevage des poussins hors du nid,
lors que les jeunes sont prévenus par les adultes d'un éventuel
danger, ils pénètrent rapidement à l'intérieure de
la couverture végétale pour se cacher.
III.6.3. Agressivité
Le Râle d'Olivier montre une certaine agressivité
pendant la saison de reproduction. En général, cette
espèce est agressive, en particulier envers les autres individus de la
même espèce. En revanche, elle est tolérante envers les
autres espèces d'oiseaux sauf envers quelques espèces de
Rallidés (Porphyrio porphyrio, Gallinula chloropus) et
le Coucal Malgache Centropus toulou. L'agressivité s'est
accentuée au fur et à mesure de l'avancée de la phase de
reproduction, c'est-à-dire, en passant d'un stade de reproduction
à l'autre. Par exemple, durant notre observation, pendant les six
premiers jours d'incubation, le couple a été encore moins
agressif envers les autres espèces de Rallidés. Pendant ce temps,
il arrive que quelques individus de Poule d'eau Gallinula chloropus
passent juste près du nid (environ 1 à 1,5 m) sans que le
couple les pourchasse. Cependant, à partir d'une semaine d'incubation
jusqu'à l'indépendance des jeunes, le couple devient très
agressif et attaque les autres espèces de Rallidés ou autres.
56
IV. DISCUSSIONS
IV.1 ABONDANCE ET DISTRIBUTION
Aux vues des effectifs enregistrés depuis 2005,
l'effectif (16 individus) obtenu pendant cette étude est
considéré comme un effectif le plus élevé des
individus de Râle d'Olivier recensés dans le lac Mandrozo.
Rabenandrasana et al.(2009) ont trouvé 12 individus de cette
espèce dans le même site d'étude (lac Mandrozo) en 2005.
Les suivis de la communauté aviaire aquatique menés du 2009 au
2013 par les équipes de TPF dans le lac Mandrozo ont estimé un
total de neuf individus de cette espèce pour ces cinq années
(Razafimanjato et al., 2015). Même si nous avons obtenu un
effectif plus élevé que ceux des années
précédentes, il est toujours nécessaire de garder à
l'esprit que les comptages ne peuvent pas être exhaustifs. En effet,
certains individus pourraient être présents, mais ne s'expriment
pas au moment du comptage. L'effectif obtenu cette année à l'issu
des comptages globaux n'est donc qu'une estimation minimale de la taille de
population de Râle d'Olivier effectivement présent dans le lac
Mandrozo.
L'absence des individus de Râle d'Olivier dans la partie
Est du lac lors des deux sessions de recensement serait probablement due
à la présence des rizicultures avec quelques campements dans
cette partie. De même, la rareté d'individus de cette
espèce dans les parties Nord et Ouest de ce lac serait également
liée à la présence de campements des pêcheurs dans
ces parties. Le Râle d'Olivier, une espèce très
discrète, éviterait l'endroit où il y a tant des bruits et
perturbations. Ce comportement est commun dans la famille des Rallidae (Taylor
& Van Perlo, 1998). Cela expliquerait la présence de la
majorité des individus recensés dans la partie Sud du lac
Mandrozo où il y a moins de perturbation.
IV.2 CAPTURE DES INDIVIDUS
D'après la bibliographie, aucun individu de Râle
d'Olivier n'a été déjà capturé dans le lac
Mandrozo avant cette étude. Le type d'habitat fréquenté
par cette espèce dans ce site n'aurait pas permis l'utilisation des
méthodes standards pour capturer les individus (obs. pers.).
Rabenandrasana (2007) a pu capturer sept individus de cette espèce
à l'aide du filet japonais et épuisette (« Hand net »)
dans le lac Amparihy à Besalampy. Pour la présente étude,
nous avons capturé cinq individus de la même espèce dans le
lac Mandrozo en utilisant un seul type de filet de capture bricolé
(filet de pêche). L'utilisation de ce filet couplé à la
méthode «play-back» paraît efficace pour capturer les
individus de cette espèce.
57
Durant cette étude, nous avons constaté que la
capture de Râle d'Olivier nécessite de trouver d'abord l'endroit
fréquenté par les individus à capturer avant d'installer
le piège. Ce cas a été aussi remarqué par
Rabenandrasana (2007) pendant la capture de cette espèce dans les lacs
Ampandra et Amparihy à Besalampy. Les séances de capture
réalisées ont été donc fonction de la localisation
des individus. Il faut également noter que la capture du Râle
d'Olivier dans le lac Mandrozo pendant cette étude serait très
difficile sans l'utilisation de la méthode de «play-back»
laquelle permet d'attirer l'individu à capturer vers le piège.
IV.3. MORPHOLOGIE ET MORPHOMETRIE DE L'ESPECE
Le dimorphisme sexuel n'apparaît pas très net
chez les adultes de Râle d'Olivier. Le mâle et la femelle sont
presque semblables et ceci a rendu difficile la détermination du sexe
par observation directe en présence d'un seul individu.
Morphologiquement, la similarité entre les deux sexes a
été signalée chez beaucoup d'espèces dans la
famille des Rallidae (Bouglouan, 2010). Pourtant, sur un échantillon de
trois couples observés pendant cette étude, les
différences entre le mâle et la femelle ont été
constatées notamment au niveau de la coloration du plumage de la partie
dorsale et au niveau de taille. Alors que Taylor (1998) a stipulé que
pour la plupart des Rallidae tels que la Poule d'eau Gallinula chloropus,
le Râle d'eau Rallus aquaticus et le Râle à
bec jaune Amauronis flavirostra, le mâle a une taille plus
grande que la femelle, nous avons trouvé un cas inverse pour le
Râle d'Olivier Amaurornis olivieri. Pour cette espèce,
notre observation et le résultat de la mensuration des individus adultes
capturés ont montré que le mâle est
légèrement plus petit et présente une coloration plus
foncée sur la partie dorsale que la femelle. Cette constatation rejoint
ce qui a été signalé par Rabenandrasana (2007). Pour la
présente étude, sur les quatre adultes mensurés, nous
avons trouvé une longueur du corps variant de 19 à 19,7 cm. Ces
mesures ne s'éloignent pas de celle (19 cm) mentionnée dans
diverses littératures relatives à la description de cette
espèce (Grandidier & Berlioz, 1929; Benson & Wagstaff, 1972; del
Hoyo et al., 1996 ; Sinclair & Langrand, 1998; Willard &
Goodman, 2002).
Les poussins de Râle d'Olivier sont couverts de duvets
noirs à l'éclosion, comme chez toutes les espèces de
Râle (Taylor & Van Perlo, 1998). La durée jusqu'à quand
les jeunes gardent ces duvets noirs varie selon l'espèce. Pour le
Râle d'Olivier, les poussins restent couverts des duvets noirs
jusqu'à l'âge de 18 jours, ce qui est également le cas des
poussins de Râle des genêts Crex crex (Broyer, 1996).
58
Robertson (2004) a rapporté que le juvénile
d'Amaurornis olivieri présente un plumage brun couvert de suie
et un bec noir. Pour cela, cet auteur n'a pas mentionné l'âge de
juvénile. Par la présente étude, l'évolution des
plumes des jeunes a pu être suivie depuis leur éclosion
jusqu'à leur dispersion. En fait, les jeunes d'Amaurornis olivieri
présentent une morphologie qui se rapproche de celle
mentionnée par cet auteur à l'âge de 25 jours.
IV.4. BIOLOGIE DE LA REPRODUCTION
IV.4.1. Formation du couple
Les évènements qui se passent avant et le
début de la formation du couple sont souvent difficiles à
observer chez les oiseaux en période de reproduction (Rafarantsoa,
2008). Notre observation sur terrain semble concordante avec cette affirmation.
Nous avons déjà mentionné dans les résultats que
sur les trois couples étudiés, seul le couple 2 a
été observé en cours de formation entre mi-août et
début de septembre. En effet, le comportement discret du Râle
d'Olivier Amaurornis olivieri et le type d'habitat qu'elle
fréquente ont rendu difficile sa localisation avant la formation du
couple. Le couple 1 découvert en phase de construction du nid le 14
juillet 2015 aurait dû se former au début de mois de juillet, et
le couple 3 localisé le 22 septembre 2015 en phase d'incubation (5 jours
avant l'éclosion des oeufs) devrait se former entre mi-août et
début de mois de septembre. Même si des couples pourraient se
former au mois de novembre tel que Rabenandrasana (2007) a observé de 3
à 6 novembre 2006 au Lac Amparihy (à Besalampy), aucun couple n'a
été observé se former au-delà de mois d'octobre
dans le lac Mandrozo pendant cette étude. Les trois couples suivis
s'installent dans le système monogamique, comme chez beaucoup de
Râle tels que Râle d'eau Rallus aquaticus (Le-Dantec,
2003), le Râle tacheté Pardirallus maculatus (Bouglouan,
2012) et le Râle des Moluques Amaurornis moluccana (Le-Dantec,
2009). En plus, Gill (1990) affirme que 90 % des oiseaux sont monogames.
Pendant la formation du couple de Râle d'Olivier
observé durant cette étude, les deux sexes se courtisent en se
déplaçant fréquemment pour chercher le meilleur
emplacement du nid. Ce cas a été également observé
chez le Râle à bec jaune Amaurornis flavirostra (Taylor
& Van Perlo, 1998).
59
IV.4.2. Construction du nid
Les trois nids trouvés dans le lac Mandrozo pendant
notre période d'étude sont nouvellement construits. Même si
nous n'avons pas assisté à la construction du nid 3,
l'état encore frais de ses matériaux de construction nous a
permis de confirmer sa construction cette année même. Le cas de
réutilisation de nid est rare chez les Râles (Taylor & Van
Perlo, 1998). En plus, les études antérieures ont
déjà affirmé que le Râle d'Olivier construit un
nouveau nid à chaque saison de reproduction (Rabenandrasana et
al., 2009). Comme chez la plupart des espèces dans la famille
des Rallidae (Bouglouan, 2010), la construction du nid est assurée par
les deux sexes pour l'espèce Amaurornis olivieri. Des cas
similaires ont été observés au lac Kinkony en 2003
(Rabenandrasana et al., 2009). La participation de deux individus du
couple à la construction du nid repose sur le fait que chacun apporte et
arrange de matériaux pour construire leur nid. Pendant cette
étude, le couple observé a réalisé la construction
du nid notamment le matin entre 07h et 09h au cours de laquelle un partage de
tâche a été constaté. Ceci est en accord avec
l'heure de construction du nid entre 6h30 et 09h observée dans le lac
Kinkony en 2003 (Rabenandrasana et al., 2009). Alors que ces auteurs
n'ont pas pu apporter les informations sur l'effort de la participation des
deux sexes à la construction du nid, la présente étude
réalisée dans le lac Mandrozo a pu combler le vide sur ce sujet.
Bien que la construction du nid soit assurée par le couple, les taux de
participation de deux sexes à cette tâche ne sont pas les
mêmes. Nos résultats ont montré que pour Amaurornis
olivieri, le mâle assure toujours plus de travail tant pour l'apport
des matériaux que pour leurs arrangements pendant la construction du
nid.
La durée de construction des deux nids observés
pendant cette étude est de trois jours en moyenne. Cette durée
semble être similaire à celle de quelques espèces des
Rallidae comme Gallinula chloropus qui construit son nid pendant trois
à cinq jours (Hemery & Blaize, 2013) et Rallus aquaticus
construisant son nid au bout de quatre jours (Guillemont & Koenig,
1994). Par ailleurs, cette durée ne pourrait pas être
généralisée pour l'ensemble de l'espèce puisqu'elle
n'a été observée que sur deux couples. En effet, la
durée de construction du nid pourrait varier selon le couple et le
milieu.
Les matériaux de construction de nids dans notre milieu
d'étude sont constitués majoritairement par les feuilles mortes
de roseaux. Rabenandrasana et al. (2009) ont déjà
signalé la dominance des feuilles de cette plante dans le nid de
Râle d'Olivier.
60
IV.4.3. Accouplement
Aucune information sur la période, la fréquence
et la durée de l'accouplement du Râle d'Olivier n'a
été disponible. Lors de la présente étude, la
durée totale d'accouplement n'a pas pu être
déterminée. Tous les accouplements observés ont eu lieu
pendant la période de construction du nid dont la plupart a
été enregistrée dans la matinée. Le nombre
d'accouplement enregistré pendant cette étude (13 copulations
pour deux couples observés) semble être faible. D'ailleurs,
l'observation et le suivi des couples hors de l'emplacement du nid ont
été très difficiles. La structure dense de l'habitat de
nidification parfois inaccessible, empêche l'observation et le suivi du
couple dans ce site. Il se peut que d'autres accouplements aient eu lieu mais
non enregistrés en dehors de ce territoire. Et tous ceux-ci pourraient
expliquer la faiblesse de la fréquence d'accouplement observée
lors de cette étude.
IV.4.4. Ponte
Rabenandrasana et al. (2009) a soulevé une
période de ponte allant de juillet à novembre. Ces mêmes
auteurs ont annoncé la possibilité de Râle d'Olivier
d'étendre la période de ponte jusqu'au mois de mars. De plus,
Benson et Wagstaffe (1972) a trouvé un nid avec deux oeufs au mois de
mars. Pour la présente étude, la première ponte
observée a eu lieu le 16 juillet 2015 pour le couple 1. Le couple 3
découvert en phase d'incubation le 22 septembre 2015 aurait
déposé ses oeufs au mois de septembre même. Quoi qu'il en
soit, la période de ponte enregistrée durant cette étude a
eu lieu entre juillet et septembre. Cette période est comprise entre la
période signalée par Rabenandrasana et al. (2009).
Au sujet du nombre d'oeufs par nichée, nous avons
enregistré deux nids contenant chacun trois oeufs. Par rapport aux
autres résultats, un nid contenant deux oeufs a été
trouvé dans le lac Mandrozo en octobre 2005, et un autre nid avec trois
oeufs a été trouvé dans le lac Amparihy (Rabenandrasana
et al., 2009). Comme aucune littérature n'a encore
mentionnée un nombre plus de trois oeufs dans le nid de Râle
d'Olivier, nous pouvons émettre une hypothèse que cette
espèce ne pondrait pas plus de trois oeufs, ce qui est le cas de
Râle à bec jaune Amaurornis flavirostra (Bouglouan,
2013).
61
La taille de ponte de Râle d'Olivier connue
jusqu'à maintenant (trois oeufs au maximum), semble être faible
comparée aux autres espèces de même genre comme le
Râle à poitrine blanche (Amaurornis phoenicurus) dont la
femelle pond quatre à neuf oeufs (Le-Dantec, 2015), le Râle de
Moluques (Amaurornis moluccana) avec une ponte de quatre à sept
oeufs (Le-Dantec, 2009), le Râle akool (Amaurornis akool) dont
la ponte comprend cinq à six oeufs (Le-Dantec, 2014). Cette
différence serait due à la variation de taille des
espèces. En effet, les espèces sus-mentionnées, ayant
respectivement une taille de 33 cm, 30 cm et 28 cm, sont plus grande que le
Râle d'Olivier (19 cm en moyenne). Par ailleurs, chez les Oiseaux d'eau,
en particulier chez les espèces dans la famille des Rallidae, plus
l'espèce est de grande taille, plus la taille de ponte est grande
(Taylor & Van Perlo, 1998).
Pour la présente étude, l'intervalle de ponte
est d'un jour, comme chez la plupart des espèces de Râles (Taylor
& Van Perlo, 1998). Concernant les caractéristiques des oeufs, dans
le lac Amparihy (à Besalampy), Rabenandrasana (2007) a trouvé une
longueur de trois oeufs variant de 33,3 à 35,2 mm, une largeur de 26,5
à 27,3 mm, et un poids variant de 14 à14,5 g. Nos
résultats pris sur trois oeufs dans le lac Mandrozo se rapprochent de
ceux précédant, mais nous avons trouvé une dimension un
peu plus petite avec une longueur variant de 31,2 à 31,5 mm et une
largeur de 25,9 à 26,2 mm, et un poids variant de 14,5 à 15 g.
Cette légère différence pourrait être due à
la variation du milieu de nidification.
Une ponte de remplacement a été constatée
pour la première fois chez le Râle d'Olivier pendant cette
étude. Elle a été remarquée par le fait que le
couple 1 (marqué) a été redécouvert avec trois
poussins encore tous petits après 38 jours d'échec. Ceci nous
permet de supposer que cette ponte de remplacement a eu lieu après
environ 25 jours d'échec. La ponte de remplacement est un
phénomène fréquent chez les oiseaux (Walters, 1995), et
les Râles n'en font pas exception (Taylor & Van Perlo, 1998).
IV.4.5. Incubation
L'incubation commence dès que le premier oeuf est
pondu. Cette situation diffère Amaurornis olivieri de quelques
espèces de Rallidés tel que Gallinula choloropus dont
l'incubation commence avant la ponte du dernier oeuf (Fenoglio et al.,
2003). Pour la présente étude, la durée d'incubation des
oeufs est de 17 jours (n= 1 couple). Bien qu'obtenue sur un seul couple, cette
durée semble être moyenne en comparant avec celle d'Amaurornis
flavirostra (une espèce la plus voisine) dont la durée
d'incubation est de 13 à 19 jours
62
(Taylor & Van Perlo, 1998). En plus, Bouglouan (2010) a
annoncé que, sauf quelques rares exceptions, l'incubation des oeufs dure
généralement entre 15 et 19 jours chez les Rallidés.
Le fait que les deux sexes assurent l'incubation des oeufs
s'observe également chez les espèces du même genre comme
Amaurornis moluccana (Le-Dantec, 2009), A. flavirostra
(Bouglouan, 2013), A. phoenicurus (Le-Dantec, 2015).
IV.4.6. Elevage des poussins
Chez la majorité des espèces dans la famille des
Rallidae, les deux parents élèvent ensemble leurs poussins
(Bouglouan, 2010). Pour Amaurornis olivieri, la présente
étude confirme la participation des deux sexes à l'élevage
des jeunes depuis leur éclosion jusqu'à leur dispersion.
L'élevage des poussins a été caractérisé par
leur couvaison et leur nourrissage. La couvaison des poussins n'a eu lieu que
pendant leur séjour dans le nid alors que leur nourrissage se poursuit
hors du nid jusqu'à leur indépendance. Chez presque tous les
Râles, les poussins sont nidifuges, c'est-à- dire ils restent
très peu de temps dans le nid (Taylor & Van Perlo, 1998). Les
poussins de certaines espèces comme le Râle d'eau (Rallus
aquaticus) sont capables de quitter le nid dès le jour
d'éclosion (Guillemont & Koenig, 1994). Pour Gallinula
chloropus, les poussins restent au moins deux jours dans le nid (Wood,
1974). Pour la présente étude, les poussins de Râle
d'Olivier Amaurornis olivieri restent trois jours dans le nid. Ceci
est similaire aux poussins de Râle à bec jaune Amaurornis
flavirostra (Bouglouan, 2013).
Pendant l'élevage des poussins, les deux adultes
nourrissent leurs poussins jusqu'à 40 jours. Cette durée se
rapproche de celle (trois à six semaines) de l'espèce
Amaurornis flavirostra (Bouglouan, 2013). Pourtant, elle est un peu
longue par rapport à celle de Râle d'eau Rallus aquaticus
dont les poussins sont nourris par les parents pendant 20 à 30
jours (Bouglouan, 2013). Les poussins de Râle d'Olivier se dispersent le
jour de leur indépendance totale envers leurs parents. Cette dispersion
a eu lieu 45 jours après leur éclosion. Chez d'autres
espèces, la dispersion des poussins a lieu 60 jours après
l'éclosion chez Rallus aquaticus, 25 jours chez Marouette
ponctuée Porzana porzana, 45 à 50 jours chez Marouette
poussin Porzana parva (Godin, 2003). L'âge de dispersion des
jeunes Amaurornis olivieri se rapproche de celle de Porzana
parva.
63
IV.5. ECOLOGIE
IV.5.1. Emplacement et caractéristiques des nids
Les plantes de l'emplacement du nid pourraient varier d'un
territoire à un autre. Un nid du Râle d'Olivier a
été trouvé sur des touffes de Typha (Taylor &
Van Perlo, 1998), et d'autres ont été construits sur des roseaux
Phragmites (Rabenandrasana et al., 2009). Dans notre site
d'étude, les trois nids trouvés ont été
placés tous sur des roseaux Phragmites mauritianus. Il
s'avère alors que les roseaux sont les plantes les plus
recherchées par le Râle d'Olivier pour construire son nid.
Concernant la hauteur des nids par rapport à la surface
d'eau, Taylor (1998) a mentionné un emplacement du nid à une
hauteur de 50 cm de la surface d'eau, et Rabenandrasana et al. (2009)
ont trouvé des nids placés entre 50 et 70 cm au-dessus de la
surface de l'eau. Pour la présente étude, les trois nids
trouvés sont situés respectivement à une hauteur de 40 cm,
60 cm et 70 cm par rapport à la surface de l'eau avec une moyenne de
56,67 #177; 15,27 cm. Cette hauteur se rapproche de celles trouvées
précédemment. Par rapport à la hauteur (2 à 3 m) de
plantes de nidification, ces nids se trouvent dans la partie inférieure
de ces plantes. La place du nid sur la partie basse de plante de nidification
pourrait s'expliquer par le fait que les poussins étant encore
incapables de voler quittent le nid très tôt. Les parents
éviteraient donc l'emplacement très haut duquel les poussins
peuvent tomber entrainant ainsi leur blessure. En plus, l'emplacement du nid au
dessus de la surface d'eau semble être une stratégie pour
éviter l'action de prédateur.
Pendant cette étude, les nids de Amaurornis
olivieri dans le lac Mandrozo présentaient un diamètre
externe moyen de 14,73 #177; 1,17 cm (n = 3 nids), un diamètre interne
moyen de 14,23 #177; 1,21 cm (n = 3), une profondeur moyenne de 6,1 #177; 0,95
cm, et une hauteur externe moyenne de 13,33 #177; 2,51 cm. Ces valeurs sont
proches de celles fournies par Rabenandrasana (2007) dans le lac Amparihy, soit
13,63 cm de diamètre externe, 13,27 cm de diamètre interne et
6,65 cm de profondeur.
64
IV.5.2. Habitat de nidification
L'habitat de nidification du Râle d'Olivier se compose
principalement de roseaux Phragmites mauritianus et d'autres
espèces de plantes herbacées. La composition spécifique de
la flore de l'habitat pourrait varier selon la zone d'étude. Des
études et observations antérieures stipulent que les roseaux
constituent un habitat dans lequel Amaurornis olivieri passe la
majorité de sa vie (Rabenandrasana et al., 2009).
Robertson (2004) a rapporté que cette espèce
fréquente préférentiellement les roseaux pendant la saison
sèche, mais occupe un milieu plus ouvert pendant la saison de pluies. La
présente étude, effectuée durant une saison sèche,
confirme que le Râle d'Olivier Amaurornis olivieri habite la
couverture végétale constituée majoritairement par les
roseaux dans lesquelles il nidifie et s'alimente. En fait, pendant cette
étude, nous avons constaté que les roseaux seuls ne pourvoient
pas au besoin de cette espèce. En effet, malgré sa
prédilection de placer son nid sur cette plante, Amaurornis olivieri
exige une certaine richesse floristique dans le site de nidification. Ceci
pourrait s'expliquer par le fait que l'abondance de sa nourriture serait
liée à la richesse floristique du milieu.
IV.5.3. Régime alimentaire
Rabenandrasana et Zefania (2005) ont rapporté que le
Râle d'Olivier se nourrit des crustacés, des insectes et des
araignées. Nos résultats sont concordants avec ceux de ces
auteurs. Pendant cette étude, l'alimentation de Râle d'Olivier se
compose principalement d'araignées et d'insectes (larves et adultes),
mais elle peut aussi se nourrir de petits crustacés et de petits
mollusques. Ces résultats, bien qu'obtenus sur un petit
échantillon, permettent d'affirmer que le Râle d'Olivier se
nourrit essentiellement des petits invertébrés, en particulier
les Arthropodes. Au cours de la présente étude, les
araignées ont constituée la majorité (53,1 %) des
nourritures consommées par cette espèce, suivis par les insectes
(32 %), crustacés (10,8 %) et mollusques (4,1 %). La plupart de ces
nourritures ont été enregistrées pendant la période
d'élevage des poussins qui coïnciderait sans doute avec la
période d'activité des araignées. Cela pourrait expliquer
la forte abondance des araignées dans le régime alimentaire de
cette espèce enregistré pendant cette étude. La base du
régime alimentaire pourrait donc varier en fonction du site et la
période d'étude.
65
Par ailleurs, comme certaines nourritures consommées
pendant nos observations n'ont pas pu être identifiées et que les
individus ne sont pas toujours vus en train de se nourrir, il est possible que
le Râle d'Olivier se nourrisse d'autres types de nourritures. En effet,
les autres espèces voisines peuvent se nourrir d'autres nourritures en
plus des invertébrés. Par exemple, Amaurornis flavirostra
se nourrit des graines et certaines parties des plantes aquatiques,
d'invertébrés et de vertébrés aquatiques tels que
les petits poissons, têtards et petites grenouilles (Bouglouan, 2013).
IV.6. ETHOLOGIE
IV.6.1. Agressivité
Nous avons observé que le Râle d'Olivier
manifeste une certaine agressivité pendant la saison de reproduction. Ce
comportement a été également observé chez certaines
espèces de Râle comme le Râle wéka Gallirallus
australis (Wikipedia) et le Râle à bec jaune Amaurornis
flavirostra (Bouglouan, 2013). L'agressivité a été
considérée par le fait que le couple observé attaque et
repousse d'autres individus de la même espèce ou d'autres
espèces. Durant notre observation, Amaurornis olivieri a
été agressive envers d'autres espèces de Rallidés.
Cette agressivité serait liée à la compétition
alimentaire, puisque ces espèces partagent le même régime
alimentaire (invertébrés) que le Râle d'Olivier
Amaurornis olivieri. Il paraît que l'agressivité de
l'espèce étudiée envers Centropus oulou
reposerait sur la fréquentation de celle-ci de l'emplacement de son
nid. Par ailleurs, Rabenandrasana et al. (2009) a déjà
signalé que Centropus toulou pourrait être une menace
pour l'espèce Amaurornis olivieri.
66
CONCLUSION
Peu de données sur le Râle d'Olivier
Amaurornis olivieri ont été disponibles avant la
réalisation de la présente étude. Seules quelques
informations sommaires sur cette espèce ont été
relatées. Notre étude effectuée dans le lac Mandrozo
apporte des nouvelles informations sur la biologie, l'écologie et le
comportement de cette espèce. Elle a également renforcé
des faits que certains auteurs avaient déjà rapportés sur
cette espèce dans d'autres sites. Les résultats obtenus serviront
comme outil et moyen indispensables pour la protection et la conservation de
cette espèce ainsi que d'autres espèces dans le lac Mandrozo,
faisant partie intégrante de l'Aire Protégée Mandrozo.
Au terme de ce travail, nous pouvons affirmer que le lac
Mandrozo constitue un site potentiel dans lequel Amaurornis olivieri
est inféodée. Ce site abrite au moins 16 individus adultes
de cette espèce recensés pendant cette étude.
Malgré le nombre de couples (3 couples)
étudiés relativement faible, cette étude nous a permis de
comprendre certains aspects de la biologie de la reproduction, de
l'écologie et de comportements de Râle d'Olivier.
La biologie de la reproduction et l'écologie de cette
espèce présentent une certaine similarité avec celles des
autres espèces dans la même famille (Rallidae) tout en ayant ses
particularités. Il apparaît que le début de ponte de
Râle d'Olivier a eu lieu au mois de juillet. Cette espèce pond
trois oeufs au maximum (taille de ponte connue jusqu'à maintenant).
Pendant la période de reproduction, depuis la construction du nid
jusqu'à l'élevage des jeunes, les tâches sont bien
partagées entre les deux sexes du couple : la construction du nid,
l'incubation des oeufs, la couvaison et le nourrissage des poussins sont tous
assurés par les deux sexes mais à un taux différent. Le
mâle est plus impliqué dans la construction du nid et nourrissage
des jeunes, tandis que la femelle a participé un peu plus à
l'incubation des oeufs et à la couvaison des poussins que son
partenaire.
Amaurornis olivieri nidifie dans des touffes de
roseaux Phragmites mauritianus. Les matériaux utilisés
pour la construction des nids sont à base de plantes, recueillis aux
alentours de nids. Il s'agit en général des feuilles mortes du
roseau Phragmites mauritianus, mélangées ou non avec des
feuilles d'autres plantes tels que le Typha Typha angustifolia et
Panicum sp. Le régime alimentaire de cette espèce est
basé principalement sur les invertébrés (Araignées,
Insectes, Crustacés et Mollusques). Pendant toute la période
d'étude, les Araignées ont constituées la majeure partie
des nourritures consommées.
67
Les domaines vitaux des deux individus suivis par
télémétrie durant cette étude sont relativement
petits et ne présentent pas de chevauchement. Ils sont respectivement
0,95 ha et 1,98 ha de surface.
A l'issue de cette étude, quelques recommandations et
perspectives sont proposées.
Pour une meilleure conservation de l'espèce
Amaurornis olivieri, comme elle est strictement dépendante des
roseaux pour toute sa vie (alimentation, nidification, etc), il est donc
pratiquement nécessaire de diminuer toutes sortes d'activités
anthropiques entrainant la destruction de l'habitat de cette espèce.
Pour ce faire, nous recommandons la culture de roseaux dans d'autres endroits
où les pêcheurs pourraient l'exploiter rationnellement. Cette
recommandation a pour but de mieux assurer la disponibilité des sites de
nidification de cette espèce. Par ailleurs, en plus de la
sensibilisation des villageois et des pêcheurs, la surveillance du lac
pendant la période de reproduction devient une nécessité
primordiale afin de contribuer à l'amélioration de la
reproduction de Râle d'Olivier et éventuellement d'autres
espèces d'oiseaux d'eau. Des mesures de gestion doivent donc
impérativement être prises pour préserver cet habitat.
En fin, pour une meilleure connaissance sur cette
espèce, il serait plus intéressant de poursuivre la
présente étude, en se focalisant notamment sur la dynamique de la
population. Celle-ci permettra de se renseigner sur l'évolution de
croissance de la population, les taux de survie et de fécondité
de cette espèce, ce qui aidera à comprendre comment cette
espèce est capable de peupler une zone donnée et à quel
point elle est en danger par rapport à sa capacité de
reproduction. Il est également nécessaire d'approfondir
l'étude sur l'écologie trophique (régime alimentaire) et
sur l'éthologie (rythme d'activités). Des études dans
d'autres sites où existe Amaurornis olivieri sont à
envisager pour comparer les différents paramètres
bio-éco-éthologique de cette espèce.
68
REFERENCES BIBLIOGRAPHIQUES
1. ANDRIAMALALA, T. R. A. 2005.
Contribution à l'étude de la biologie de reproduction du
Milan noir à bec jaune Milvus aegyptius (Hartlaub, 1877) dans
le Complexe des trois lacs (Ankerika, Befotaka, Soamalipo) du District
d'Antsalova. Mémoire de D.E.A en Biologie, Ecologie et Conservation
Animales, Département de Biologie Animale, Faculté des Sciences,
Université d'Antananarivo. 74p.
2. BENSON, C.W. & WAGSTAFFE, R. 1972.
Porzana olivieri and Limnocorax flavirostris: a
likely affinity. Bulletin of British Ornithologists'Club.
92: 160-164..
3. BLONDEL, FERRY & FROCHOT. 1970.
Méthode des Indices Ponctuels d'Abondance (IPA) ou des relevés
d'avifaune par stations d'écoute. Alauda, vol 38
pp. 55-70.
4. BROYER, J. 1996. Le Râle des
genêts. Eveil, 72 p.
5. DEL HOYO, J., ELLIOTT, A. & SARGATAL, J. 1996.
Handbook of the Birds of the World, vol. 3: Hoatzin to Auks.
Lynx Editions, Barcelona, Spain.
6. DODMAN, T. & DIAGANA, C.H. 2003.
Madagascar. In African waterbird census: Les
Dénombrements d'Oiseaux d'Eau en Afrique 1999,2000 & 2001.
Wetlands International, Global series 16. Pp 296-300.
7. FENOGLIO, S., CUCCO, M., & MALACARNE, G. 2003.
Moorhen females lay eggs of different size and ß-carotene
content. Ardea 91(1): 117-121.
8. FOWLER, R. A. & COHEN, L. 1985.
Statistcs for ornithologists. British Trust for Ornithology,
London. 175p.
9. GILL, F.B. 1990. Ornithology.
W.H. Freeman and Company. U.S.A. 660p.
10. GILL, F. & WRIGHT, M. 2006.
Birds of the World: Recommended English Names. Princeton, NJ,
and London, UK: Princeton University Press. 259 p.
11. GIRARD, M. 2013. Evaluation de la
qualité des habitats pour le Râle des genêts en Moyenne
vallée de l'Oise. Mémoire de Master 2 en Expertise
Ecologique et Gestion de la Biodiversité, Sciences de l'Environnement
terrestre, Université d'Aix Marseille. 34p.
12. GODIN, J. 2003. Partez à la
rencontre de la Biodiversité : Les Oiseaux des roselières du
bassin Artois-Picardie. Agence de l'eau Artois- Picardie. 28p.
13.
69
GOODMAN, S. M. & HAWKINS, A. F. A. 2008. Les
oiseaux. In Paysages naturels et biodiversité de Madagascar.
Publications scientifiques du Muséum, Paris, WWF. Pp. 383435.
14. GRANDIDIER, G. & BERLIOZ, J. 1929.
Description d'une espèce nouvelle d'oiseau de Madagascar de la
famille des Rallidés. Bulletin de l'Académie Malgache
10: 83-85.
15. GUILLEMONT, A. & KOENIG, P. 1994. Le
Râle d'eau Rallus aquaticus. In Yeatman-Berthelot D. & Jarry
G. Nouvel Atlas des Oiseaux nicheurs de France 1985-1989.
Société Ornithologique de France. 1994 Paris : 242-243.
16. HARRIS, R. B., CRESSWELL, W. J., FORDE, P. G.,
TREWHELLA, W. J., WOOLLARD, T. & WRAY, S. 1990. Home-range
analysis using radio-tracking data-are view of problems and techniques
particularly as applied to the study of mammals. Mammal Review
20(2/3): 97-123.
17. HEMERY, D. & BLAIZE, C. 2013. Suivi
des rallidés sur les pièces d'eau du Bois de Vincennes et des
lacs périphériques en 2012 : Foulque macroule Fulicaatra
et Gallinule poule d'eau Gallinula chloropus. Rapport
d'activité Grumpy Nature / Mairie de Paris, 15p.
18. HERRICK, J., VANZEE, J., HAVSTAD, K., BURKETT, L.
& WHITFORD, W. 2005. Monitoring Manual for Grassland, Shrubland
and Savanna Ecosystems - Volume 1: Quick start. The University of Arizona
Press, Tucson. 1: 9-15.
19. JOHNSON, R. R. 1992. Elementary
Statistics. PWS-KENT, USA. 733p.
20. LANGRAND, O. & WILME, L. 1993.
Protection des zones humides et Conservation des espèces
d'oiseaux endémiques de Madagascar. Proc. VIII Pan-Afr. Orn. Congr.
201-208.
21. LARDJANE-HAMITI, A. 2012. Ethologie
et biologie de la reproduction du Fuligule nyroca Aythya nyroca (Guldenstadt,
1770) et du Fuligule milouin Aythya ferina ( Linnaeus, 1758) dans la
réserve naturelle du la Reghaia. Thèse de Doctorat en
Sciences Biologiques, Département de Biologie Animale et
Végétale, Faculté des Sciences biologiques et des Sciences
Agronomiques, Université Mouloud Mammeri de Tizi-Ouzou. 120p.
22. LOR, S. & MALECKI, R. A. 2002.
Call-response surveys to monitor marsh bird population trends.
Wildlife Society Bulletin, 30 (4): 1195-1201.
23.
70
MITTERMEIER, R. A., GIL, P. R., PILGRIM, M. H. J.,
BROOKS T., MITTERMEIER, C. G., LAMOUREUX, J. & DA FONSECA, G. A. B. 2004.
Hot spots revisited. CEMEX. Mexico. 390p.
24. MOHR, C.O. 1947. Table of equivalent
populations of North American small mammals. American Naturalist
37: 223-249.
25. RABENANDRASANA, M. 2007. Conservation
biology of Sakalava rail Amaurornis olivieri an Endangered Malagasy
water bird and public awareness in Besalampy wetlands complex, Western
Madagascar. Final report, ASITY (Ligue Malgache pour la protection des
Oiseaux). 22p.
26. RABENANDRASAN, M. & ZEFANIA, S. 2005.
Population size, distribution, habitat use and threats of Sakalava
rail Amaurornis olivieri surveyed between Mahajanga and Toliary,
Western Madagascar (August 2003 - April 2004). Final report available at
Conservation International Madagascar and ASITY (Malagasy Bird Club).
Antananarivo.
27. RABENANDRASANA, M., ZEFANIA, S., LONG, P., SAM
THE SEING, VIRGINIE
M. C., RANDRIANARISOA, M., SAFFORD, R. &
SZÉKELY, T. 2009. Distribution, habitat and status of
«Endangered» Sakalava Rail of Madagascar. Bird Conservation
International 19 (1): 23-32.
28. RAFARANTSOA, F. 2008. Contribution
à l'étude bio-éco-éthologique, comparative des
couples hétéromorphes et homomorphes des espèces de Milan
dans la réserve privée de Berenty, partie Sud de Madagascar.
Mémoire de DEA en Biodiversité et Environnement Tropicaux (option
Biologie Animale), Faculté des Sciences de l'Université de
Toliara. 54p.
29. RAJAONARISON, J. L., RAZANAMEHARIZAKA, J. H.
& RANDRIANIRINA, E. F. 2009. Etude d'Impact Environnemental et
Social de la NAP de Mandrozo, District de Maintirano. The Peregrine Fund,
Madagascar. 202p.
30. RAZAFIMANJATO, G., RAZAFIMAHATRATRA, B.,
RANDRIANJAFINIASA, D. & ANDRIAMALALA, T. 2015. Suivi de la
communauté aviaire aquatique dans la Nouvelle Aire
Protégée Mandrozo, Ouest de Madagascar. Malagasy Nature,
9: 49-57.
31. RAZAFIMANJATO, G., RENE DE ROLAND, L. A.,
RAKOTONDRATSIMA, M., ANDRIAMALALA, T. R. A. & ANDRIANARIVELO, R. M. 2012.
Fiche descriptive sur les zones humides Ramsar (FDR)- version
2009-2012. Zone humide de Mandrozo. The Peregrine Fund, Madagascar.
21p.
32.
71
RAVALISON. 2008. Inventaire biologique rapide
de la forêt de Tambohorano, Maintirano, Volet : Flore et
Végétation (Rapport final). 34p.
33. RENE DE ROLAND, L. A. 2010. Les
oiseaux endémiques, outils de la conservation. Mémoire de
H.D.R, Volume 1-Document de Synthèse. Département de la Biologie
Animale, Faculté des Sciences, Université d'Antananarivo. 98p.
34. ROBERTSON, I. 2004. First-ever
photographs of Sakalava Rail Amaurornis olivieri and first detailed
observations since 1962. Bulletin of the African Bird Club,
11(1): 18-21.
35. SINCLAIR, I. & LANGRAND, O. 1998.
Birds of Indian Ocean islands. 183p
36. TAYLO, B. & VAN PERLO, B. 1998.
Rails : a guide to the rails, crakes, gallinules and coots of the
world. Pica Press, Roberts bridge, UK. 600 p.
37. TPF. 2013. Plan d'Aménagement
et de Gestion de la Nouvelle Aire Protégée de Mandrozo. The
Peregrine Fund, Madagascar. 77p.
38. TPF. 2015. Rapport Trimestriel Aire
Protégée Mandrozo (Avril - Juin 2015), Financement FAPBM. Rapport
non publié, The Peregrine Fund, Madagascar. 33p.
39. WALTERS, M. 1995. Les oeufs
d'Oiseaux. Ed. Bordas, Collection « L'oeil nature », 256p.
40. WILLARD, D.E. & GOODMAN, S. M. 2002.
Observation of the Sakalava Rail (Amaurornis olivieri) and
other water birds in the region on Andimaka, south of Bekopaka wetland.
Working Group on Birds in the Madagascar Region News letter,
10: 32 -33.
41. WOOD, N. A. 1974. The breeding behavior
and biology of Moorhen. British Birds, 67:
104-115.
42. ZICOMA. 1999. Zones d'Importance
pour la Conservation des Oiseaux à Madagascar. Projet Zicoma,
Antananarivo, Madagascar. 266p.
WEBOGRAPHIE
43. BOUGLOUAN, N. 2010. Les Rallidés.
<
www.
Oiseaux-birds.com>, consulté le 24 novembre 2015.
44. BOUGLOUAN, N. 2012. Le Râle
tacheté Pardirallus maculatus. <www.
Oiseaux-birds.com>, consulté le 25 novembre 2015.
45. BOUGLOUAN, N. 2013. Le Râle
à bec jaune Amaurornis flavirostra.<www.
Oiseaux-birds.com>, consulté le 25 novembre 2015.
46.
https://fr.wikipedia.org/wiki/Râle_wéka#
visité en Décembre 2015
47. LE-DANTEC, D. 2003. Râle d'eau
Rallus aquaticus. <
www.Oiseau.net>,
consulté le 12 décembre 2015.
48. LE-DANTEC, D. 2009. Râle des Moluques
Amaurornis moluccana. <
www.Oiseau.net>,
consulté le 12 décembre 2015.
49. LE-DANTEC, D. 2014. Râle akool
Amaurornis akool. <
www.Oiseau.net>,
consulté le 14 décembre 2015.
50. LE-DANTEC, D. 2015. Râle à
poitrine blanche Amaurornis phoenicurus. <
www.Oiseau.net>,
consulté le 16 décembre 2015.
51. UICN. 2015. Red List of Threatened
Species. <
www.iucnredlist.org>,
consulté le 02 avril 2016.
72
.
I
ANNEXES
Annexe 1: Données climatiques de l'Aire
Protégée Mandrozo pendant l'année 2015
|
Mois
|
T°max (°C)
|
T°min (°C)
|
T° Moyenne (°C)
|
Précipitation moyenne
(mm)
|
|
Janvier
|
34
|
22
|
28
|
500,5
|
|
Février
|
34,2
|
22,2
|
28,2
|
316,5
|
|
Mars
|
36,3
|
24,2
|
30,25
|
143,1
|
|
Avril
|
35,5
|
23,0
|
29,2
|
48,6
|
|
Mai
|
34,8
|
20,7
|
27,7
|
11,3
|
|
Juin
|
33,1
|
18,3
|
25,7
|
0,46
|
|
Juillet
|
33,5
|
17,0
|
25,3
|
0,52
|
|
Août
|
31,7
|
14,9
|
23,3
|
5,6
|
|
Septembre
|
34,2
|
18,4
|
26,3
|
7,9
|
|
Octobre
|
33,4
|
19,2
|
26,3
|
6,2
|
|
Novembre
|
34,1
|
21
|
27,6
|
48,62
|
|
Décembre
|
34
|
22,4
|
28,2
|
434,7
|
Annexe 2 : De haut en bas et de gauche à droite:
Lambeau de forêts de l'AP, Marécages (Razakaratrimo, 2011), Savane
boisée des Palmiers, couverture végétale des roseaux
(Pruvot, 2015)

II
Annexe 3: Liste des espèces d'Oiseaux d'eau
recensées dans l'AP de Mandrozo
(Razafimanjato et al., 2015).
|
N°
|
ESPECE
|
FAMILLE
|
NOMS EN FRANÇAIS
|
|
1
|
Acrocephalus newtoni
|
SYLVIIDAE
|
Rousserolle de Newton
|
|
2
|
Actophilornis albinucha
|
JACANIDAE
|
Jacana malgache
|
|
3
|
Amaurornis olivieri
|
RALLIDAE
|
Râle d'Olivier
|
|
4
|
Anas erythrorhyncha
|
ANATIDAE
|
Canard à bec rouge
|
|
5
|
Anas hottentota
|
ANATIDAE
|
Sarcelle hottentote
|
|
6
|
Anastomus lamelligerus
|
CICONIIDAE
|
Cignone à bec ouvert
|
|
7
|
Anhinga rufa
|
ANHINGIDAE
|
Anhinga d'Afrique
|
|
8
|
Ardea cinerea
|
ARDEIDAE
|
Héron cendré
|
|
9
|
Ardea humbloti
|
ARDEIDAE
|
Héron de Humblot
|
|
10
|
Ardea purpurea
|
ARDEIDAE
|
Héron pourpré
|
|
11
|
Ardeola idae
|
ARDEIDAE
|
Héron Crabier blanc
|
|
12
|
Ardeola ralloides
|
ARDEIDAE
|
Héron Crabier chevelu
|
|
13
|
Bubulcus ibis
|
ARDEIDAE
|
Héron garde-boeufs
|
|
14
|
Butorides striatus
|
ARDEIDAE
|
Héron strié
|
|
15
|
Charadrius tricollaris
|
CHARADRIIDAE
|
Pluvier à triple collier
|
|
16
|
Chlidonias hybridus
|
STERNIDAE
|
Guifette moustac
|
|
17
|
Chlidonias leucopterus
|
STERNIDAE
|
Guifette leucoptère
|
|
18
|
Corythornis vintsioides
|
ALCEDINIDAE
|
Martin-pêcheur vintsi
|
|
19
|
Dendrocygna bicolor
|
ANATIDAE
|
Dendrocygne fauve
|
|
20
|
Dendrocygna viduata
|
ANATIDAE
|
Dendrocygne veuf
|
|
21
|
Dryolimnas cuvieri
|
RALLIDAE
|
Râle de Cuvier
|
|
22
|
Egretta alba
|
ARDEIDAE
|
Grande Aigrette
|
|
23
|
Egretta ardesiaca
|
ARDEIDAE
|
Aigrette ardoisée
|
|
24
|
Egretta dimorpha
|
ARDEIDAE
|
Aigrette dimorphe
|
|
25
|
Gallinula chloropus
|
RALLIDAE
|
Gallinule poule d'eau
|
|
26
|
Haliaeetus vociferoides
|
ACCIPITRIDAE
|
Aigle pêcheur de
Madagascar
|
|
27
|
Himantopus himantopus
|
RECURVIROSTRIDAE
|
Échasse blanche
|
|
28
|
Ixobrychus minutus
|
ARDEIDAE
|
Blongios nain
|
|
29
|
Mycteria ibis
|
CICONIIDAE
|
Tantale ibis
|
|
30
|
Nettapus auritus
|
ANATIDAE
|
Anserelle naine
|
|
31
|
Nycticorax nycticorax
|
ARDEIDAE
|
Bihoreau gris
|
|
32
|
Phalacrocorax africanus
|
PHALACROCORACIDAE
|
Cormoran africain
|
|
33
|
Phoeniconaias minor
|
PHOENICOPTERIDAE
|
Flamant nain
|
|
34
|
Phoenicopterus ruber
|
PHOENICOPTERIDAE
|
Flamant rose
|
|
35
|
Platalea alba
|
THRESKIORNITHIDAE
|
Spatule d'Afrique
|
|
36
|
Plegadis falcinellus
|
THRESKIORNITHIDAE
|
Ibis falcinelle
|
|
37
|
Porphyrio porphyrio
|
RALLIDAE
|
Talève sultane
|
|
38
|
Porphyrula alleni
|
RALLIDAE
|
Talève d'Allen
|
III
39
|
Porzana pusilla
|
RALLIDAE
|
Marouette de Baillon
|
|
40
|
Sarkidiornis melanotos
|
ANATIDAE
|
Canard à bosse
|
|
41
|
Tachybaptus pelzelnii
|
PODICIPEDIDAE
|
Grèbe malgache
|
|
42
|
Tachybaptus ruficollis
|
PODICIPEDIDAE
|
Grèbe castagneux
|
|
43
|
Threskiornis bernieri
|
THRESKIORNITHIDAE
|
Ibis sacré de Madagascar
|
Annexe 4: Mensurations des quatre adultes du Râle
d'Olivier Amaurornis olivieri capturés à Mandrozo pendant la
période d'étude
|
Femelle 1
|
Mâle 1
|
Femelle 2
|
Mâle 2
|
|
Date de la mensuration
|
03/08/2015
|
03/08/2015
|
14/08/2015
|
04/09/2015
|
|
Poids (g)
|
100
|
90
|
96
|
80
|
|
Longueur du corps (cm)
|
19,7
|
19,3
|
19,6
|
19
|
|
Longueur du bec supérieur (mm)
|
20,43
|
20,41
|
20,4
|
20,4
|
|
Longueur du bec inférieur (mm)
|
20,12
|
20,2
|
20,2
|
20,24
|
|
Longueur de l'aile (mm)
|
120
|
130,4
|
140,6
|
130,66
|
|
Longueur du crâne (mm)
|
20,8
|
20,5
|
20,6
|
20,8
|
|
Largeur du crâne (mm)
|
10,72
|
10,6
|
10,7
|
10,68
|
|
Longueur de la patte (de la base du fémur à
l'extrémité de la griffe médiane) (mm)
|
130,11
|
130,8
|
140,63
|
130,66
|
|
Longueur du doigt postérieur (mm)
|
10,3
|
10,4
|
10,6
|
10,22
|
|
Longueur de la griffe postérieure (mm)
|
5,7
|
6,4
|
6,2
|
4,7
|
|
Longueur du doigt intérieur (mm)
|
20,8
|
20,8
|
20,82
|
20,75
|
|
Longueur de la griffe du doigt intérieur (mm)
|
7,6
|
7,2
|
7,4
|
7
|
|
Longueur du doigt extérieur (mm)
|
30,32
|
30,3
|
30,28
|
30,15
|
|
Longueur de la griffe du doigt extérieur (mm)
|
5,9
|
5,8
|
5,8
|
5,2
|
|
Longueur du doigt médiane (mm)
|
30,51
|
30,7
|
30,8
|
30,68
|
|
Longueur de la griffe médiane (mm)
|
8
|
8,1
|
8,1
|
7,8
|
|
Longueur du tibio-tarse (mm)
|
46,5
|
50,1
|
50,35
|
47,2
|
|
Longueur de la queue (mm)
|
50,7
|
50
|
50,15
|
50,1
|
IV
Annexe 5: Nombre et fréquence d'accouplements
observés chez le couple 1 et le couple 2 du Râle d'Olivier
Amaurornis olivieri pendant la période d'étude
|
Couple 1
|
Couple 2
|
Total
|
|
Date
Heures
|
14/07/2015
|
15/07/2015
|
09/09/2015
|
10/09/2015
|
|
6h-7h
|
0 fois
|
0
|
1
|
0
|
1
|
|
7h -8h
|
1
|
1
|
0
|
1
|
3
|
|
8h-9h
|
0
|
1
|
0
|
0
|
1
|
|
9h-10h
|
1
|
1
|
1
|
1
|
4
|
|
10h-11h
|
1
|
0
|
0
|
0
|
1
|
|
11h-12h
|
0
|
0
|
0
|
0
|
0
|
|
12h-13h
|
0
|
0
|
0
|
0
|
0
|
|
13h-14h
|
0
|
0
|
0
|
0
|
0
|
|
14h-15h
|
1
|
0
|
0
|
0
|
1
|
|
15h-16h
|
0
|
1
|
0
|
0
|
1
|
|
16h-17h
|
1
|
0
|
0
|
0
|
1
|
|
17h-18h
|
0
|
0
|
0
|
0
|
0
|
|
Total
|
5 fois
|
4 fois
|
2 fois
|
2 fois
|
13
copulations
|
Annexe 6: Heures et durée de chacun des
accouplements observés à Mandrozo en 2015
|
Date
|
Heure du début
|
Durée (seconde)
|
Couple
|
|
14/07/2015
|
08:03
|
4,17
|
1
|
|
09:15
|
4,08
|
1
|
|
10:17
|
4
|
1
|
|
15:23
|
4,14
|
1
|
|
16:42
|
4,16
|
1
|
|
15/07/2015
|
07:23
|
4,1
|
1
|
|
08:02
|
4,12
|
1
|
|
09:12
|
4,09
|
1
|
|
15:25
|
4,1
|
1
|
|
09/09/2015
|
06:43
|
3,89
|
2
|
|
09:26
|
4,1
|
2
|
|
10/09/2015
|
07:14
|
4,1
|
2
|
|
09:25
|
4
|
2
|
|
Moyenne
|
|
4,080769231
|
|
|
Ecart-type
|
|
0,076535562
|
|
Annexe 7: Liste des espèces des plantes
recensées dans chaque habitat de nidification
(Sites 1, 2 et 3)
|
Famille
|
Nom scientifique
|
Nom vernaculaire
|
Site 1
|
Site 2
|
Site 3
|
|
POACEAE
|
Phragmites
mauritianus
|
Bararata
|
+
|
+
|
+
|
|
TYPHACEAE
|
Typha angustifolia
|
Vondro
|
-
|
-
|
+
|
|
NYMPHACEAE
|
Nymphea lotus
|
Hetrevo
|
-
|
+
|
+
|
|
NYMPHACEAE
|
Nymphea nouchali
|
Jijo
|
-
|
+
|
+
|
|
FABACEAE
|
Acacia sensitiva
|
Rohy
|
-
|
+
|
+
|
|
CYPERACEAE
|
Cyperus aequalis
|
Beandoha
|
+
|
+
|
+
|
|
CYPERACEAE
|
Scleria rotundifolia
|
Vendramalonina
|
+
|
+
|
-
|
|
THELYPTERIDACEAE
|
Thelypteris palustris
|
Faritsoky
|
+
|
+
|
+
|
|
POACEAE
|
Panicum sp.
|
Ahidrano
|
+
|
+
|
-
|
|
OENOTHERACEAE
|
Ludwigia repens
|
Sarihera
|
+
|
-
|
-
|
|
OENOTHERACEAE
|
Ludwigia stolonifera
|
Tranonkapiky
|
-
|
-
|
+
|
|
MALVACEAE
|
Hibiscus sp.
|
Mandalia
|
+
|
+
|
+
|
|
ASTERACEAE
|
Erigeron sp.
|
Botratry
|
+
|
+
|
+
|
|
CONVOLVULACEAE
|
Ipomoea aquatica
|
Lalanda
|
-
|
+
|
+
|
|
CYPERACEAE
|
Scirpus sp.
|
Moita
|
+
|
-
|
+
|
|
CYPERACEAE
|
Eleocharis
plantaginea
|
Reforefo
|
+
|
+
|
+
|
|
COMMELINACEAE
|
Commelina sp.
|
Nifinankanga
|
-
|
-
|
+
|
|
CYPERACEAE
|
Cyperus latifolius
|
Hera
|
+
|
+
|
+
|
|
FABACEAE
|
Mimosa sp.
|
Mangorondefo/
Fandriankapiky
|
+
|
-
|
-
|
|
CONVOLVULACEAE
|
Ipomoea sp.
|
Vahinamalo
|
+
|
+
|
+
|
|
FABACEAE
|
Vigna sp.
|
Teloravy
|
+
|
-
|
+
|
|
PASSIFLORACEAE
|
Passiflora sp.
|
***
|
-
|
-
|
+
|
V
(+ : présence ; - : absence)
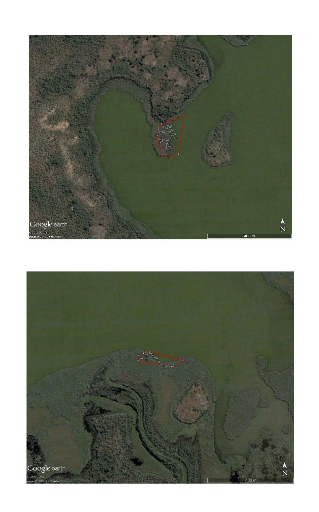
VI
Annexe 8: Cartes montrant la répartition des
coordonnées géographiques et les domaines vitaux des deux
individus d'Amaurornis olivieri radiopistés
Carte de répartition des coordonnées GPS et du
domaine vital du mâle (Frq28)
Carte de répartition des coordonnées GPS et du
domaine vital de la femelle (Frq34)

Libellule Libellule
Araignée Araignée
Coléoptère Mollusques
VII
Annexe 9: Photo montrant certaines espèces
d'invertébrés constituant le régime alimentaire du
Râle d'Olivier dans le lac Mandrozo pendant la période
d'étude (Juillet à Octobre 2015)

RESUME
L'étude bio-écologique et d'abondance du
Râle d'Olivier Amaurornis olivieri, une espèce d'oiseau
d'eau en danger et endémique de Madagascar, a été
effectuée dans l'Aire Protégée Mandrozo, district de
Maintirano, partie Ouest de Madagascar. Elle a été
réalisée du mois de juillet au mois d'octobre 2015. Des
recensements ont été réalisés dans le lac Mandrozo
et ses alentours en utilisant les méthodes de point d'écoute et
«play-back». La méthode de suivi des individus du couple, la
prospection de la végétation du lac et l'enquête
auprès des pêcheurs ont été utilisées pour
localiser les nids. Seuls les nids actifs ont fait l'objet des observations
directes et continues, de 6 h à 18 h, pour suivre toutes les
activités du couple pendant la période de reproduction. Le
régime alimentaire a été déterminé à
l'aide de l'observation directe et la prise de photo des nourritures
consommées. Un total de 16 individus de cette espèce a
été recensé sur une surface de 23,55 ha. La densité
de sa population est estimée à 0,68 individu/ha. Trois couples
appartenant aux trois nids différents ont été directement
et continuellement observés. La construction du nid qui dure en moyenne
trois jours (n = 2 nids) est assurée par le couple, mais le mâle
semble assurer néanmoins la plupart de travail. Les nids sont
placés dans des touffes de roseaux Phragmites mauritianus et se
situent en moyenne à 56,67 cm (n = 3 nids) par rapport à la
surface de l'eau. Treize (13) accouplements ont été
observés et durent en moyenne 4,08 secondes (n = 2 couples). La taille
de ponte est de trois oeufs par nichée (nid 1 et nid 3). L'incubation
des oeufs a eu lieu dès la première ponte et est assurée
par les deux sexes pendant 17 jours (n = 1 nid). Durant les 204 heures
d'observation du nid pendant l'incubation, la femelle a incubé pendant
105 heures (51,5 %) contre 88 heures (43,1 %) pour le mâle, et le couple
s'absente du nid pendant 11 heures (5,4 %). L'élevage des poussins est
assurée par les deux sexes depuis l'éclosion jusqu'à la
dispersion des jeunes à l'âge de 45 jours. Basé sur 194
nourritures identifiées, le Râle d'Olivier se nourrit
essentiellement des invertébrés : Araignées (53,1 %),
Insectes (32 %), Crustacés (10,8 %) et Mollusques (4,1 %). L'habitat de
cette espèce est caractérisé par la dominance des roseaux
dans lesquels elle nidifie et s'alimente. Les surfaces des domaines vitaux des
deux individus radiopistés sont respectivement 0,95 ha et 1,98 ha. Le
Râle d'Olivier manifeste une certaine agressivité pendant la
période de reproduction.
Mots clés : Bio-écologie,
Râle d'Olivier Amaurornis olivieri, Oiseau d'eau,
Endémique, Aire Protégée Mandrozo, Madagascar,
Reproduction.
ABSTRACT
A bio-ecological and abundance study of Sakalava Rail
Amaurornis olivieri, an endangered and endemic waterbird of
Madagascar, was conducted from July to October 2015 in the Mandrozo Protected
Area, in the western part of Madagascar. Listening point and play-back methods
were used to census individuals of Sakalava Rail in Mandrozo Lake and its
surroundings. Nests were discovered from tracking the individuals of the pair,
and using a questionnaire with the fisherman. Located active nests were
directly and continuously observed, every day from 6:00 a.m to 6:00 p.m, in
order to track all activities during the breeding period (from nest building to
the full independence of Juveniles). The diet has been studied using direct
observation and taking pictures of the consumed foods. At the site of survey,
16 individuals of this species were counted on a surface of 23,55 ha, which was
used to estimate the population density to 0,68 individual/ha. Three pairs
belonging to three different nests were directly and continuously observed.
Nest construction was assured by both adults and it took three days' on average
to complete a nest (n = 2 nests). Male did more work than female during nest
construction. Nests were constructed in a dense mat of reeds Phragmites
mauritianus and located 56,67 cm (n = 3 nests) on average above water
level. Thirteen matings were observed and lasted 4,08 #177; 0,07 seconds on
average (n = 2 pairs). Clutch size was three eggs in each active nest (nest 1
and nest 3). Incubation started on laying of the first egg and both sexes
incubated. Eggs hatched after 17 days (n = 1 nest). During the 204 hours of the
nest observation, female incubated 51,5 % (105 hours), male 43,1 % (88 hours)
and the nest was unattended for 5,4 % (11 hours). Both male and female brooded
and fed the young. Young remained three days in the nest and they were
completely independent of their parents at 45 days of age. Based on 194
identified food items, Sakalava Rail ate invertebrates : Spiders (53,1 %),
Insects (32 %), Crustaceans (10,8 %) and Mollusks (4,1 %). The habitat of this
species is characterized by the dominance of Reeds in which it nests and feeds.
The home ranges of two radio-tracked individuals were respectively 0,95 and
1,98 hectares. Sakalava rail was aggressive during reproduction season.
Keywords: Bio-ecology, Sakalava rail Amaurornis
olivieri, Waterbird, Endemic, Protected
VIII
Area of Madrozo, Madagascar, Reproduction.



