|
|
UNIVERSITE MARIEN NGOUABI
**********************
|
1
ECOLE NATIONALE SUPERIEURE D'AGRONOMIE ET
DE
FORESTERIE
******************
SECRETARIAT ACADEMIQUE
************
DEPARTEMENT DES MASTERS
MEMOIRE DE FIN DE FORMATION
En vue de l'obtention du Diplôme de Master
Professionnel
|
Option: Sciences et Techniques
Forestières
Thème
Etude comparée de la structure forestière
entre les forêts intactes et dégradées
|
de l'axe Impfondo-Dongou (Département de la
Likouala, République du
Congo)
Présenté par:
Saint Fédriche NDZAI
|
Sous la direction de:
Dr. Félix KOUBOUANA
|
Dr. Suspense Averti IFO
|
Maître-assistant CAMES, ENSAF
Maître-assistant CAMES, ENS
Sous la supervision du Pr. Jean-Marie MOUTSAMBOTE,
Maître de
Conférences, ENSAF.
Jurys
Président : Pr.
ATTIBAYEBA, Maître de Conférences CAMES, UMNG
Examinateur : Pr. Jean-Marie MOUTSAMBOTE,
Maître de Conférences
CAMES UMNG
Dr. Suspense Averti IFO Maître-assistant CAMES
UMNG
Le 22 Décembre 2015 à 14 h 00
2
saintfedriche@gmail.com Tel
: 00242 06-858-23-48/05738-57-77
RESUME
Cette étude a pour objectif général de
contribuer à une meilleure connaissance de la Flore de la
République du Congo en général et de la Likouala en
particulier général et d'évaluer l'impact de la
dégradation de la forêt sur la structure forestière et sur
la biodiversité végétale des forêts de l'axe
Impfondo-Dongou, Département de la Likouala. Au total 15 parcelle ont
été installée dans les forêts de terre ferme
(forêt intacte et forêt dégradée) et les forêts
marécageuses dont 10 dans les forêts primaires, 4 dans les
forêts secondaires et 1 dans l'agroforesterie. Nous avons installé
nos parcelles en suivant les orientations de la boussole: Nord-Sud et
Est-Ouest, chaque parcelle avait une dimension de 50 m x 50 m soit une
superficie de 2500 m2 ou 0,25 ha, subdivisée en 4 placettes
de 25 m x 25 m. Tous les individus de diamètre supérieur ou
égal 5 ont été inventorié à 1,30 m du sol.
1611 arbres ont été inventorié sur l'axe Impfondo-Dongou
appartenait à 38 familles, 114 espèces et 83 genres. Sur le plan
qualitatif c'est la famille des Euphorbiaceae (14,84%) qui dominent et sur le
plan quantitatif c'est la famille des Euphorbiaceae toujours (239). La valeur
de l'indice de Shannon varie de 0,82 bits b et 4,49 bits et
l'Equitabilité de 0,99 et 0,24, les valeurs les plus fortes sont
obtenues dans les forêts intactes. La densité à l'hectare
varie de 144 tiges/ha à 868 tiges/ha, la plus forte valeur est obtenue
dans la parcelle de forêt dégradée, la valeur de la surface
terrière la plus forte est obtenues dans la parcelle de forêt
intacte soit 36,38 m2 / ha.
Mots clés : Structure
forestière, biodiversité, forêts intactes et forêts
secondaires.
SUMMARY
This study has as a general objective to contribute to a
better knowledge of the Flora of the Republic of Congo in general and Likouala
in particular and to evaluate the impact of the degradation of the forest on
the forest structure and the vegetable biodiversity of the forests of the axis
Impfondo-Dongou, Department of Likouala. On the whole 15 pieces were installed
in the forests of firm ground (intact forest and degraded forest) and the
forests marshy including 10 in the primary forests, 4 in the secondary forests
and 1 in the agroforestery.We installed our pieces while following the
orientations of the compas: North-South and East-West, each piece had a
dimension of 50 m X 50 m is a surface of 2500 m2 or 0,25 ha,
subdivided into 4 placates of 25 m X 25 Mr. All the individuals of higher or
equal diameter 5 were inventoried to 1,30 m of the ground.1611 trees were
inventoried on the axis Impfondo-Dongou belonged to 38 families, 114 species
and 83 kinds. On the qualitative level it is the family of Euphorbiaceae
(14,84%) which dominates and on the quantitative level it is the family of
Euphorbiaceae always (239).The value of the index of Shannon varies from 0,82
bits and 4,49 bits and Equitabilité of 0,99 and 0,24, the strongest
values are obtained in the intact forests. The density with the hectare varies
from 144 stems/ha with 868 stems/ha, the strongest value is obtained in the
piece of degraded forest, the value of surface the strongest terriere is
obtained in the piece of intact forest is 36,38 m2/ha.
Key words:Forest structure, biodiversity,
forests intact and secondary forests.

DEDICACES

Au moment où j'achève ce document,
j'éprouve une pensée pieuse à celle qui a
généré ma vie sur cette terre et que la mort l'arracher
précocement de ce monde, notamment, ma mère Adrienne
ANAKALA. Que la terre lui soit légère.
A mon père Albert NDZAI et mon fils
Heureux Fédrich NDZAI

iii
REMERCIEMENTS
Au terme de ce travail, j'ai le plaisir d'adresser mes vifs
remerciements à tous ceux on contribuer de loin ou de près pour
l'aboutissement de ce document:
Je remercie le projet GEOFORAFRI pour le financement qui a
permis l'exécution des travaux de ce Master.
Mes remerciements au Pr Parisse AGOUANGO, Directeur de l'Ecole
Nationale Supérieure d'Agronomie et de Foresterie (ENSAF), au Pr Henri
BOUKOULOU, Directeur Adjoint, Pr OPOYE ITOUA, chef de Département
Master. Enfin au personnel enseignant et non enseignant de l'ENSAF.
Mes sincères remerciements, au jury qui examinera ce
travail.
Mes grands remerciements au Dr IFO Suspens Averti, pour avoir
nous sélectionné à travailler dans ce projet et de sa
disponibilité d'assurer la direction de ce travail, merci infiniment
pour votre gentillesse envers nous.
Mes remerciements au Dr Felix KOUBOUANA pour son soutien, son
encouragement ; son accueil et son apport pour l'amélioration de ce
mémoire, un grand merci.
Au Pr Jean Marie MOUTSAMBOTE pour ces conseils et son aide sur
le terrain, son lui l'identification des espèces serait difficile.
A madame Leslie BOUETOU pour son expérience en
cartographie, sans elle nous ne devrions pas y avoir la carte de a zone
d'étude.
Mes remerciements à MANTOTA Alima Brigitte, MOUANGA
SOKATH Dulsaint, MBEMBA Mackline, avec qui nous avons passée des moments
difficiles sur le terrain lors de la collecte des données et leur
contribution pour la rédaction de document au laboratoire de l'ENS.
Mes remerciements vont également à l' endroit
des guides locaux : Gautier, Alain, Abdoul, Stephan. Grace à eux que
nous avons pris la connaissance de la forêt de la Likouala.
A tous mes collègues du laboratoire notamment: LOUMONI
Fresnel, NGOKA David, BINSANGOU Stoffenne, MOUBOUHA Colombe, MAKAYA Helischa et
ATSOUMPARI Leticia. Merci pour votre contribution et l'ambiance au
laboratoire.
A mes amis: MPELA Guy Foly, EKANGA Geoffroi Sosthène,
BADIABIO Gunel, ALOUMBE Fridolin, MOUNGALA Gautier, MATONDO MALONGA Gontron,
NGASSAKI OKA, OYEROSSILA Rolvy pour leur assistance et leur conseil lors de la
rédaction de ce mémoire.
A tous mes collègue de la promotion: OBAMBI Camille,
YKAMA Nichelia, MANTADI MATOUMBOU Gostel, ZAMEBE DONG, et BOUKITA Firmin.
A mes frère et soeur: ASSIMI NDZAI Caroline, NDZAI
Léa, NDZAI Christian, NDZAI Romeo, NDZAI Laure, NDZAI Aline, NDZAI
Urfette, NDZAI Cyrille et NDZAI Guidrine pour leur soutien.
Mes remerciements à MONDZALI Romarick pour son aide sur le
plan de la documentation.
Mes remerciements vont également à MAMPOUYA
Weniana pour son assistance, son aide pour l'élaboration de ce
travail.
Mes sincères remerciements à la famille GAKONO pour
son appui sur le plan matériel. A la famille KAKINDE pour son soutien
sur le plan scolaire

iv
V
ACRONYMES ET ABREVIATIONS
AF : Agroforesterie
CCNUCC : Convention-Cadre des Nations Unies sur le Changement
Climatique
CERAPE : Centre d'Etude de la Recherche sur les Analyses et
Politiques Economiques
CO2 : Dioxyde de Carbone
COMIFAC : Commission des Forêts d'Afrique Centrale
E : Indice d'Equitabilité de Pielou
FAO : Organisation des Nations Unies pour l'Alimentation et
l'Agriculture
FD : Forêt Dégradée
FP : Forêt Primaire
FS : forêt secondaire
GES : Gaz à Effet de Serre
GIEC : Groupe Intergouvernemental d'Expert sur l'Evolution du
Climat
H' : Indice de Shannon et Weaver
IPCC : Intergouvermental Panel on Climate Change
OIBT : Organisation Internationale du Bois Tropicaux
PAM : Programme Alimentaire Mondial
PANLCD : Programme d'Action Nationale de Lutte Contre la
Désertification
RDC : République Démocratique du Congo
S : indice de Simpson
UFA : Unité Forestière d'Aménagement
UFE : Unité Forestière d'Exploitation
TABLE DE MATIERES
INTODUCTION 1
Contexte et Justification 1
Problématique 3
Objectif général et spécifiques 4
Les hypothèses de recherche 4
CHAPITRE I : REVUE BIBLIOGRAPHIQUE 6
I-1- Les forêts tropicales 6
I-2- Dégradation 7
I-3- La forêt Congolaise 7
I-4- Biodiversité 8
I-4-1- La Richesse 9
I-4-2- Indice de biodiversité 9
I-5- Densité 9
CHAPITRE II : MATERIELS ET METHODES 10
II- Matériel et Méthodes 10
II-1- Site d'étude 10
II-1-1- Localisation des parcelles expérimentale 10
II-2- Milieu Physique 11
II-2-1- Climat 11
II-2-1- Pédologie 12
II-2-3- Végétation 12
II-2-4- Le Relief 13
II-3- Matériel végétal 13
II-4- Méthodologie 13
II-4-1- Sélection des parcelles 13
II-4-2- Mise en place des parcelles 14
II-4-3- Collecte de données floristiques 15
II- 5- Méthode de traitement des données 16
II-6-Méthode d'analyse floristique 17
II-6-1- Richesse floristique 17
II-6-2- Fréquence 17
II-7- La diversité biologique 18
vi
7
vii
II-7-1- L'indice de Pielou ou de régularité
(équitabilité). 18
II-7-2- La similarité 19
II-8-3- Analyse structurale 20
CHAPITRE III : PRESENTATION DES RESULTATS 23
III-1- Composition floristique 23
III-2- Types de végétation 28
III-2-1- Forêt primaire sur terre ferme à Celtis
adolphi-friderici Engl. 30
III-2-2- Forêt sur sol hydromorphe à Guibourtia
demeusei (Harms) Léon. 31
III-2-3- Forêt primaire sur les sols hydromorphes à
Lophira alata Banks ex Gaertu. 32
III-2-4- Forêt dégradée sur terre ferme
à Macaranga monandra Mull. Arg. 33
III-3-Comparaison de structure et de composition floristique
entre les forêts primaires et les
forêts dégradées 37
III-3-1- Comparaison de composition floristique 37
III-3- La diversité biologique 41
III-4- Indice de similarité 43
III-5- Analyse structurale 43
III-5-1- Répartition des arbres dans les parcelles
inventoriée 43
III-5-2- Surface terrière 45
III- 5-3- Répartition des arbres en classe de
diamètre dans les parcelles expérimentales 46
CHAPITRE IV : DISCUSSION 49
IV-1- Composition floristique 49
IV-2- Les indices biodiversité 50
IV-3- Indice de similarité 51
IV-4- La densité à l'hectare et la surface
terrière 52
CONCLUSION ET PERSPECTIVES 54
Références bibliographiques 55
ANNEXES Erreur ! Signet non défini.
VIII
LISTES DES FIGURES
Figure 1 : Carte de la situation géographique de la
Likouala 10
Figure 2 : Diagramme ombrothermiquede la Likouala 'moyenne
de1932-2015 (source ANAC Congo) 11
Figure 3 : Evolution de la teneur en humidité relative de
l'air (Station météorologique d'Impfondo) 12
Figure 4 : Mode de mesure des différents arbres (IFO,
2010) 15
Figure 5 : Contribution spécifique et pondérale des
différentes familles 28
Figure 6 : Cercle des corrélations de l'ACP 29
Figure 7 : Projection des observations dans le plan principal
30
Figure 8 : Contribution spécifique des familles composant
la forêt à Celtis adolfi-frederrici Engl. 31
Figure 9 : Contribution spécifique des différentes
familles de la forêt primaire à Guibourtia demeusei
(Harms)
Léon. 32
Figure 10 : Contribution
spécifique des différentes familles de la forêt primaire
à Lophira alata Banks ex Gaertu.
33
Figure 11 : Contribution spécifique des différentes
familles de la forêt dégradée à Macaranga monandra
Mull
Arg. 34
Figure 12 : Contribution spécifique des différentes
familles de la forêt à Musanga cecropioides 35
Figure 13 : Répartition des types de forêts en
pourcentage 36
Figure 14 : Contribution spécifique des différentes
familles rencontrées dans les forêts primaires 40
Figure 15 : Contribution spécifique des différentes
familles rencontrées dans les forêts dégradées 41
Figure 16 : Indice de Shannon et Weaveret Equitabilité de
Pielou 42
Figure 17 : Valeurs des indices de similarité de Jaccard
et de Sorensen 43
Figure 18 : Répartition du nombre d'arbres dans les
parcelles inventoriées 44
Figure 19 : Distribution diamétrique des individus de la
forêt dégradée 46
Figure 20 : Distribution diamétrique d'arbres en classe de
diamètre dans les forêts primaires 47
LISTE DES TABLEAUX
Tableau 1 : Tableau de fréquences 2x2 pour le calcul de
similarité d'échantillons 20
Tableau 2 : Composition floristique de toutes les parcelles
inventoriées 24
Tableau 3 : Comparaison de la forêt primaire et de la
forêt dégradée 38
Tableau 4 : Les espèces caractéristiques de la
forêt dégradées. 40
Tableau 5 : Valeur des surfaces terrières par parcelle
46
LISTE DES PHOTOS
Photo 1 : Choix de la parcelle dans une forêt intacte
15
Photo 3 : Arbre à racines échasses 17
Photo 2 : Matérialisation de la parcelle 17
Photo 4 Savane à Jardinea congoensis (NDZAI, 2015) 37
1
INTODUCTION
Contexte et Justification
Les forêts tropicales se caractérisent par une
diversité végétale très importante et suscitent un
grand intérêt de la communauté des chercheurs pour ses
rôles multiples dans le maintien de l'équilibre global, la
préservation de l'environnement (rôle dans l'atténuation et
l'adaptation aux changements climatiques) que pour l'alimentation et la
santé des milliers de populations qui dépendent directement
d'elles. La diversité, la structure et le fonctionnement des
forêts tropicales humides sont particulièrement complexes et
insuffisamment connus. Cette méconnaissance est un obstacle à la
définition de règles de gestion durable.
Il est donc nécessaire de connaitre le rôle que
jouent les forêts dans la régulation du climat et la conservation
de la diversité biologique (Pascal 2003). Les connaissances prises sur
la superficie forestière, la composition floristique et sa dynamique
fournissent des informations qui sont essentielles à la mise en place et
au suivi des politiques environnementales et économiques. Ces
rôles essentiels des forêts sont pris en compte par les accords
multilatéraux sur l'environnement tels que la Convention-Cadre des
Nations Unies sur le Changement Climatique (CCNUCC) COMIFAC, (2013), pour
réduire la dégradation de celles-ci, car la dégradation
forestière est l'un des facteurs majeur de la destruction des
forêts affectant ainsi le bien être de millions de personnes. Vue
leur importance capitale pour la vie de l'homme sur terre, un certain nombre de
question se pose: ces formations forestières constituent-elles un puits
de carbone susceptible d'absorber l'augmentation des émissions du CO2
produit par l'homme et si oui, jusqu'à quel point? Peut-on les exploiter
sans les détruire, en conciliant la rentabilité économique
et le maintien de leur biodiversité? Leurs destructions totale ou
partielle auront un impact sur les populations autochtones?
En langage forestier classique, la structure d'un peuplement,
c'est simplement l'histogramme du nombre de tiges par catégories de
diamètres (Decourt, 1969 ; Suzuki, 1973). Pascal, (2003) affirme que la
structure de la forêt correspond à l'agencement de ses
différents composants. Cet agencement peut être envisagé
globalement ou séparément pour les différentes
espèces (ou groupes d'espèces). La caractérisation de la
structure forestière des forêts tropicales constitue un enjeu
majeur pour la gestion des forêts naturelles que les objectifs
prioritaires soient l'exploitation forestière, la conservation des
biomes forestiers ou l'estimation des stocks de
2
carbone. A large échelle, la structure
forestière varie avec le climat et la géomorphologie. Les
variations de la qualité chimique ou physique des sols (et notamment les
régimes de drainage associés) et le stade
sylvigénétique (c'est-à-dire le stade de
développement post perturbation) ajoutent de la variabilité
à la structure des peuplements forestiers à une échelle
plus locale (Oldeman, 1989; Sabatier, 1997). Classiquement les
paramètres de structure forestière sont obtenus par
agrégation de mesures dendrométriques individuelles
(diamètre, hauteur,...) (Hall, 1998).
Dans ce mémoire nous faisons une étude
comparative de la structure forestière entre les forêts primaires
et les forêts dégradées de la Likouala. Nous ne nous
intéresserons ici qu'à la structuration du peuplement et la flore
forestière: la distribution verticale entre les deux types de
forêts d'une part et d'autre part voir ensemble comment varie la surface
terrière, la densité à l'hectare.
En République du Congo notre pays, la couverture
végétale subit une régression significative suite aux
actions anthropiques liées à l'agriculture itinérante sur
brûlis, à l'exploitation industrielle du bois d'oeuvre, au feu de
brousse annuel, à la culture de rente (palmier à huile,
café, cacao), à la culture vivrière intensive (manioc,
riz), au système agro-forêt, au lotissement anarchique, à
l'infrastructure de communication physique. Ces différents facteurs
conduisent à une couverture imparfaite du sol au Congo, l'exposant ainsi
aux aléas des agents climatiques (précipitations et vents).
Pour pallier à cette situation actuelle de
dégradation des forêts, le Congo a défini :
La Loi 003/91 du 23 avril 1991, sur la protection de
l'environnement qui vise entre autres objectifs : gérer, maintenir,
restaurer et protéger ou conserver les ressources naturelles.
La loi n°16-2000 du 20/11/2000 portant code forestier a
pour objectifs de :
y' instituer un cadre juridique approprié pour assurer
la gestion durable des forêts et des terres forestières sur la
base d'un aménagement rationnel des ressources ;
y' définir le domaine forestier national et de
déterminer les critères et les normes d'organisation et de
gestion concertée et participative ;
y' concilier l'exploitation des produits forestiers avec les
exigences de la conservation du patrimoine forestier et de la diversité
biologique en vue d'un développement durable. (Code forestier 2000)
3
Ces forêts sont considérées comme le plus
riche centre d'endémisme et de diversité. L'analyse
phytoécologique de la flore ligneuse de la Haute Sangha
révèle l'existence d'une grande variabilité de la
biodiversité de la flore (Kimpouni et al 2013).
Problématique
Le département de la Likouala couvre à peu
près 85% de forêts avec une superficie de 6270801.48 ha en 2010
(Facet Congo, 2012), soit environ 28% des forêts du Congo, et se
caractérise par une faible densité de la population humaine, mais
aussi l'existence d'une superficie importante de forêt inondée.
Cette zone forestière connait aujourd'hui une régression
progressive de sa superficie. La dégradation causée par l'homme
affecte la structure de la forêt. Cependant, les tentatives de connaitre
la diversité biologique de cet important écosystème sont
compromises par un manque de données exhaustives d'inventaire forestier.
L'inventaire forestier national étant en cours, aucun résultat
n'est pas encore disponible à ce jour IFO (2015). C'est dans cette
optique, que cette étude a été menée dans le cadre
du projet GEOFORAFRI dans le but d'apporter des informations sur la structure
forestière de la forêt de l'axe Impfondo-Dongou afin de garantir
une gestion durable et rationnelle. Car la conservation à long terme de
la biodiversité dépend fondamentalement de la connaissance de la
structure, de la richesse spécifique et des caractéristiques
écologiques de la végétation (Mondzali, 2015). Pour une
gestion saine et durable des ressources forestières de notre pays le
Congo, il convient d'élaborer des politiques de gestion approprié
pour les générations présentes et futures.
De nombreuses études de connaissances de la ressource
floristique ont été faites à travers le Congo d'une part
et d'autre part dans la forêt du Nord du pays. Mais elles sont
généralement parcellaires. On peut donc citer les travaux de
Nkokolo (2013) dans UEFA Mokabi-dzanga, situé au Nord de la Likouala,
Moutsamboté (1998) pour la végétation du Nord-Congo et
Mondzali (2015) pour la l'analyse floristique dans l'UFA Mbomo-Kellé
dans la Cuvette Ouest et Evrard (1968) sur la recherche écologique sur
le peuplement forestier des sols hydromorphes de la Cuvette Centrale
Congolaise. Cependant très peu sinon aucune étude botanique n'a
été entreprise dans la zone de Dongou. Cette zone du fait des
activités humaines comprennent les forêts dégradées
dans le périmètre proche des villages et des forêts moins
dégradées plus loin des villages. Dans cette optique que nous
avons entrepris l'étude comparée de la structure
forestière des forêts et intactes et des forêts
dégradées de la zone Impfondo-Dongou.
4
Objectif général et
spécifiques
Cette étude a pour objectif général de
contribuer à une meilleure connaissance de la Flore de la
République du Congo en général et de la Likouala en
particulier et d'évaluer l'impact de la dégradation de la
forêt sur la structure forestière et sur la biodiversité
végétale des forêts de l'axe Impfondo-Dongou.
Les objectifs spécifiques sont :
- évaluer le niveau d'avancement de la dégradation
forestière.
- préciser les caractères floristiques et
structuraux de deux forêts, l'une forêt primaire et l'autre
forêt dégradée ;
- connaitre la composition floristique de la zone.
Les hypothèses de recherche
Pour répondre à ces interrogations, les
hypothèses suivantes ont été formulées :
y' Est-ce que, la structure forestière peut être
la même entre la forêt primaire et la forêt
dégradée.
y' la densité des arbres dans la forêt primaire
diffère-t-elle de celle de la forêt dégradée. y'
Quels sont les arbres caractéristiques de la forêt primaire et
dégradée.
Les forêts de la Likouala subissent une importante
dégradation du fait des activités anthropiques ;
Le présent travail est structuré en quatre
chapitres en plus de l'introduction et de la conclusion: Introduction dans
lequel, nous avons : Contexte et justification, problématiques,
objectifs général et spécifiques et les hypothèses
de recherches.
y' Le premier traite la revue bibliographique; dans ce
chapitre nous avons parlé de l'importance que joue les forêts
tropicales en général et celles du Congo en particulier ainsi que
les conséquences et le taux de dégradation des forêts
tropicales.
y' le deuxième abordera le matériel et les
méthodes; nous avons décrit le milieu où cette
étude a été réalisée et toutes les
activités de sélection, du traçage des parcelles et de la
collecte des données puis la méthode de calcul des indices de
biodiversité.
y' le troisième parlera des résultats obtenus ;
nous avons décrit toutes les espèces inventoriées pendant
notre étude et la comparaison entre des paramètres entre les
forêts primaires et dégradées.
5
? le quatrième traitera la discussion (les
résultats obtenus ont été comparés avec ceux
obtenus par les autres auteurs) et enfin se terminera par la conclusion.
6
CHAPITRE I : REVUE BIBLIOGRAPHIQUE
I-1- Les forêts tropicales
L'extension des forêts tropicales n'a fait que fluctuer
tout au long de l'histoire et beaucoup de formation que nous connaissons
actuellement n'ont pas plus de 2000 ans. Les forêts tropicales sont donc
des milieux très dynamiques et chaque formation est
nécessairement l'aboutissement d'un processus plus ou moins long, dont
on connait rarement le début et la fin (Vande, 2004). La forêt
tropicale est une formation végétale caractérisée
par un grand nombre d'espèces d'arbres et de plantes en milieu tropical
ou subtropical (température stable, forte précipitation,
lumière faible Francis (2010). De nombreux facteurs environnementaux
(climat, humidité, qualité du sol, saisonnalité) influent
sur les écosystèmes forestiers et modifient profondément
les relations entre les êtres vivants.
Pour Sébastien Jesel (2007), les forêts
tropicales humides sont des écosystèmes complexes composés
des populations de nombreuses espèces d'arbres qui interagissent entre
elles, avec les populations animales et le milieu physique. Toutes les
solutions envisagées aujourd'hui pour la conservation des forêts
tropicales humides, la mise en place de réserves biologiques,
l'exploitation forestière durable, la restauration des forêts
dégradées ou la création de plantations
forestières, nécessitent un approfondissement des connaissances
sur l'écologie et la dynamique de la régénération
des espèces d'arbres dans ces écosystèmes (Janzen et
Vasquez-Yañes 1991 ;Ter Steege et al. 1995 ; Guariguata et
Pinard, 1998 ; Sheil et van Heist, 2000). Selon la FAO (2010), la forêt
est une portion de terre occupant une superficie de plus de 0,5 hectares avec
des arbres atteignant une hauteur supérieure à cinq (5)
mètres et avec un couvert arboré de plus de 10%. La forêt
reste un bien commun universel et un écosystème complexe qui sert
d'habitat à un grand nombre d'espèces animales et
végétales (Kabulu et al., 2000), en s'appuyant de la
(FAO, 2010 ; Hakim, 2007) les forêts gérées durablement ont
de nombreuses fonctions socio-économiques et environnementales
particulièrement importante à l'échelle mondiale,
nationale et locale. Elles restent également tout de même l'objet
d'étude privilégiée en particulier sur les aspects qui
portent sur son mode de gestion, sa protection, sa valorisation à des
échelles intra-spécifiques et interspécifiques ainsi
qu'à la diversité des écosystèmes et des paysages
et en particulier la diversité de la strate arborée Boudelal
(2014).
I-2- Dégradation
La dégradation des forets et des terres est un grave
problème, en particulier dans les pays en développement. En 2000,
la superficie totale de forêts et de terres boisées
dégradées dans 77
7
pays tropicaux était estimée à environ
800 millions d'hectares, dont quelques 500 millions d'hectares de forêts
primaires et secondaires (OIBT, 2002). La dégradation des forêts
est une des principales sources d'émissions de gaz à effet de
serre (GES), même si son rôle n'a pas été
estimé à l'échelle Mondiale. Dans la forêt
amazonienne brésilienne, la dégradation est responsable de 20%
des émissions totales (Asner et al., 2005). En
Indonésie, le stock forestier a diminué de 6% par an et la
dégradation des forets en est la cause pour les deux tiers, alors que la
déforestation ne représente qu'un tiers (Marklund & Schoene,
2006). En Afrique, le taux annuel de dégradation des forets avoisine les
50% du taux annuel de déforestation (Lambin et al., 2003)
La dégradation des forêts se réfère
à la réduction de la capacité d'une forêt de
produire des biens et des services (OIBT 2002). La capacité comprend le
maintien de la structure et des fonctions d'écosystèmes (OIBT
2005). Une forêt dégradée ne fournit qu'une quantité
limitée de biens et services et ne conserve qu'une diversité
biologique restreinte. Elle a perdu la Structure, la fonction, la composition
des essences et/ou la productivité normalement associées a le
foret naturel (OIBT 2002).
En zone forestière, la dégradation de la
végétation se manifeste par l'apparition des espèces
héliophiles telles que : Musanga cecropioides, Trema orientalis,
Harungana madagascariensis, Alchornea cordifolia, Macaranga spp., Pteridium
aquilinum, Chromolaena odorata. Dans les zones forestières
dégradées ou secondarisées, le sous-bois est souvent
dominé par les différentes espèces de Marantaceae, de
Zingiberaceae et de Commelinaceae. Le raccourcissement de la durée des
jachères engendre la dégradation des terres qui a pour
conséquence l'apparition de nouveaux faciès forestier
constitués essentiellement des espèces héliophiles
(PANLCD, 2006).
I-3- La forêt Congolaise
Les forêts congolaises se répartissent en trois
grand ensembles à savoir: le Mayombe, le chaillu et la forêt du
Nord-Congo Vennitier (1968), mais c'est la forêt du Nord-Congo qui, avec
ses 12000000 ha, occupe la plus vaste superficie. Elle s'étend sur la
Likouala et la Sangha toute entière, et dessine deux avancées
vers le Sud: à l'Ouest, jusqu'au niveau de Kellé, à l'Est,
jusqu'à la basse-Alima, à la faveur des zones humides qui
accompagnent le cours du Congo et celui de ses affluents de droite. Elle est
loin d'être homogène. Le passage de la forêt à la
savane se fait par une région de transition, dans laquelle les
clairières apparaissent de plus en plus vastes et nombreuses, en
particulier entre la Likouala- Mossaka et Mambili.
8
La loi 16-2000 du 20 Novembre 2000, portant code forestier en
République du Congo, fonde la gestion durable des forêts sur la
base de l'aménagement des écosystèmes forestiers. Elle
vient consolider la politique forestière qui vise entre autre à
:
? améliorer les connaissances des
écosystèmes forestiers et promouvoir leur aménagement, en
prenant en compte, non seulement le bois, mais également les autres
produits forestiers ;
? promouvoir la conservation des écosystèmes
forestiers et notamment la faune, à travers la création et
l'aménagement des aires protégées ;
? promouvoir le développement du tourisme
cynégétique et de vision ;
? transformer localement la quasi-totalité de la
production grumière et diversifier la valorisation des produits de bois,
notamment par l'implantation des industries à haut rendement
matière ;
I-4- Biodiversité
En forêt tropicale Africaine, de nombreuses études
sur la biodiversité ont été réalisées.
Selon Demangeot (1996 et 1997), les régions
intertropicales sont les plus riches en espèces
animales et végétales du monde. La richesse
floristique de l'Afrique sur 10.000 km2 se répartie
comme suit :
- 1000 à 1200 espèces en zone sahélienne,
- 2000 dans la forêt dense d'Afrique occidentale et
centrale,
- 3200 à 3800 dans la région des Grands lacs,
- 5400 à Madagascar,
Selon l'état des forêts du bassin du Congo 2010,
l'Afrique centrale est réputée posséder le plus grand
nombre d'espèces végétales par unité de surface au
monde. Ainsi, Reitsma (1998) a dénombré plus de 200
espèces différentes de plantes sur une parcelle de 0,02 ha au
Gabon et Letouzey (1985 et 1986) en a dénombré 227 sur une
parcelle de 0,01 ha au Cameroun. Au Congo, une estimation de 6000
espèces de plantes vasculaires (Hecketsweiler, 1990) a été
plus récemment révisée à environ 4538
espèces dont 15 endémiques selon Sonke et al(2010).
Michael Brastetter désigne la diversité
biologique comme étant toutes formes de vie sur terre,
c'est-à-dire les plantes, les animaux et les organismes microscopiques
ainsi que leurs caractéristiques propres. En plus de l'étude du
maintien de la biodiversité, il est important de comprendre les
mécanismes de son établissement, une forêt qui
s'établit est riche en quelques
9
espèces à croissance rapide (espèces
pionnières), qui petit à petit laissent à des
espèces de forêt à croissance rapide (Chave, 2000),
Legendre et Legendre (1998).
I-4-1- La Richesse
Selon Pavoine et al (2014), Jaffré et Veillon
(1991), la richesse est l'indice le plus simple pour mesurer la
biodiversité. Pascal (2003),on réalise classiquement, pour
illustrer la variation de la richesse avec la zone considérée,
des courbes dites aire-espèces ou individus-espèces selon
qu'elles représentent en abscisse la surface ou le nombre d'arbres
observés. En forêt tempérée, ou tropicale
caducifoliée, ces courbes finissent par se stabiliser à partir
d'une certaine surface ou d'un certain nombre d'individus.
I-4-2- Indice de biodiversité
Shannon (1975) a développé son indice H' dans le
cadre de la théorie de l'information qui suppose que la diversité
peut être mesurée de la même façon que l'information
contenu dans un code ou un message. Les indices développés dans
le cadre de cette théorie sont qualifiés de fonction d'entropie
Kimpouni et al, (2013). D'après Boudelal, 2014, l'indice le
plus couramment utilisé dans la littérature est celui de Shannon
(H'), (Rakotomalaza et al, 2003).
I-5- Densité
Curtis a analysé le terme « densité »
à travers son usage couramment: il en ressort que ce mot est
étroitement lié aux notions de « concurrence, occupation den
surface, et fermeture de couvert », qui sont les concepts fondamentaux de
la sylviculture Curtis (1970). Cette remarque cependant ne suffit pas. Lorsque
l'on utilise des mesures dans l'intention de préciser des lois de
croissance, il devient nécessaire de s'appuyer sur une définition
qui doit permettre d'évaluer du point de vue des notions citées
les conditions moyennes du développement et de la croissance des arbres
d'un peuplement (Ottorini, 1978), Doucet, 2003.
10
CHAPITRE II : MATERIELS ET METHODES
II- Matériel et Méthodes
II-1- Site d'étude
Le milieu dans lequel cette étude a été
menée est localisé dans le Département de la Likouala. Il
occupe presque la partie Nord de la République du Congo et couvre une
superficie environ 64044 km2 PAM (2009). Du point de vue
géographique, le Département de la Likouala est limité, au
Nord par la République Centrafricaine, au Sud par le Département
de la Cuvette centrale et à l'Est par le fleuve Oubangui qui le
sépare par la République Démocratique du Congo, (figure
n°1).

Figure 1 : Carte de la situation
géographique de la Likouala
II-1-1- Localisation des parcelles expérimentale
Le dispositif expérimental installé est
situé dans le Département de la Likouala plus
précisément sur l'axe Impfondo-Dongou. Trois (3) sites ont
été choisis pour réaliser cette étude notamment :
Dongou, Bondzalé et Impfondo.
11
II-2- Milieu Physique
II-2-1- Climat
La combinaison des facteurs atmosphériques et
géologiques et surtout le rythme des précipitations permettent de
distinguer trois nuages climatiques en République du Congo : un nuage
équatorial, un nuage tropical et un nuage subéquatorial Moukolo
(1992).
Le département de la Likouala se trouve plus
précisément dans le nuage équatorial qui règne le
climat équatorial caractérisé par les
précipitations relativement modestes allant de 1600 mm à 1800 mm
par an (Vennetier, 1966). Cette zone ne connait presque pas la saison
sèche c'est-à-dire qu'il pleut presque toute l'année
malgré un ralentissement des pluies observée entre
décembre et février ainsi qu'en juillet. La température
moyenne annuelle est voisine de 25° à 26°C (figure 2) avec une
amplitude annuelle faible de 1 à 2%, des écarts diurnes sont un
peu plus marqués 9 à14%.
Dans le Département de la Likouala, il existe une
saison sèche principalement, mais relative, de mi-décembre
à fin février, un ralentissement des pluies en Juin-Juillet et un
maximum des précipitations en août; (figure 2)

humidité (mm)
Temp °C
220
Jan. Févr. Mars Avril Mai Juin JuilletAoût Sept
Oct. Nov. Déc.
110
100
90
80
70
60
50
40
30
20
10
0
200
180
160
140
120
100
80
60
40
20
0
Figure 2 : Diagramme ombrothermique de la
Likouala 'moyenne de1932-2015 (source ANAC Congo)
12
L'humidité relative est élevée durant
toute l'année, y compris au cours des saisons sèches. Les vents
sont faibles, sauf au moment des orages de saison de pluie (figure3).
90
80
70
60
50
40
30
20
10
0
100
Janv. Févr. Mars Avril Mai Juin Juillet Août
Sept. Oct. Nov. Déc.
Figure 3 : Evolution de la teneur en
humidité relative de l'air (Station météorologique
d'Impfondo)
II-2-1- Pédologie
Selon Vennitier (1966), on distingue deux (2) types du sol dans
le Département de la Likouala : Les sols ferralitiques : ces sols se
subdivisent en trois (3), à savoir :
? les sols ferralitiques typiques : ils sont de couleur rouge et
sont là où les précipitations atteignent au moins 1500 mm
par an, essentiellement sur les terrains précambriens. Leurs pH est
acide voisine de 4.
? Les sols ferralitiques lessivés : ce sont les sols
sableux, perméables et pauvres. Cette pauvreté est liée
à l'infiltration des eaux qui entraine en profondeur les
éléments minéraux.
? Les sols faiblement ferralitique ou sols remaniés :
ce sont les sols jaune présentant de l'humus en surface et des cailloux
en profondeur.
Les sols hydromorphes : ce sont les sols qu'on rencontre le plus
souvent dans les zones où se produit une inondation, soit en surface,
soit en profondeur.
II-2-3- Végétation
A l'exception de quelques rares espaces non forestiers, savanes,
implantations humaines, cultures et jachères, lits des cours d'eau, sol
nu (Nkokolo, 2013), l'ensemble du Département de la Likouala est
couverte par des forêts appartenant aux forêts denses humides
sempervirentes
13
(Vennetier, 1966;Sita,1989). La végétation de la
Likouala précisément vers Epena, présente un aspect
très classique avec une succession en hauteur des diverses essences :
l'étage dominant constitué des grands arbres 40 à 60 m de
haut tel que Limba (Teminalia superba), Iroko (Milicia
excelsa), Ayous (Triplochiton sclerosylon), Azobé
(Lophira alata), etc. Haut de 20 à 30 m, ces arbres comportent
surtout des essences de bois dur à croissance lente et à faible
diamètre. La forêt marécageuse règne sur presque
toute la Likouala (forêt inondé et forêt inondable)
Vennetier (1966). La couverture végétale subit une petite
régression significatif suite aux activités anthropiques
liées à : l'agriculture itinérante sur brulis, le feu de
brousse annuel, la culture de rente (Palmier à huile, Café,
Cacao), la culture vivrier intensive (Manioc), l'infrastructure de
communication physique etc. ces différents facteurs conduisent à
une couverture imparfaite du sol l'exposant ainsi aux aléas des agents
climatiques (PAN, 2006).
II-2-4- Le Relief
Faisant partie intégrante de l'unité structurale
de la Cuvette congolaise, le Département de la Likouala a un relief
relativement moins accidenté avec des altitudes n'excédant pas
500 mètres et des dénivellations inférieures à 50 M
entre les interfluves et les fonds de vallées (CIRAPE, 2011).
II-3- Matériel végétal
L'étude a porté sur l'inventaire de tous arbres
de forêts primaire et dégradée de l'axe Impfondo-Dongou.
Car la zone est relativement peu perturbée présentant ainsi un
intérêt particulier pour la biodiversité.
II-4- Méthodologie
II-4-1- Sélection des parcelles
L'axe Impfondo-Dongou se trouve dans une zone
forestière sur terre ferme et des zones marécageuses qui de nos
jour subit quelques peu, la pression humaine notamment l'agriculture
itinérante sur brulis et les plantations sur les grandes superficies de
Palmier à huile et la culture du Cacao. Le choix des parcelles
expérimentales a été orienté suivant leur
accessibilité et leur physionomie de paysage par rapport au type de
forêt (photo 1). L'installation des parcelles est portée dans les
forêts secondaires de terre ferme d'une part et dans les forêts
primaires de terre ferme et marécageuses (inondée et inondable)
d'autre part. En fonction de la dominance des espèces, ces forêts
ont été qualifiées tantôt des forêts primaires
à Lophira alata, forêt à Celtis
14
adolphi-friderici, forêt à Guibourtia
demeusei tantôt des forêts secondaires à Macaranga
spp et à Musanga cecropioides.

Photo 1 : Choix de la parcelle dans une
forêt intacte II-4-2- Mise en place des parcelles
Pour mettre en place nos parcelles sur l'ensemble de la zone
étudiée, nous avons procédé par l'ouverture de
piste de 50 m, est exécuté par le macheteur en suivant les
orientations de la boussole de manière à obtenir les parcelles
carré au moyen d'un double décamètre, chaque parcelle a
été matérialisé par des piquets après une
distance de 25 m. Pour un meilleur comptage des espèces
végétales, une surface de 50 m x 50 m a été
délimité soit une superficie de 2500 m2 ou 0,25 ha par
parcelle. Ensuite, chaque parcelle est subdivisé en placette de 25m x 25
m soit 4 placettes par parcelle (figure 4). 15 parcelles ont été
installées et inventoriée en suivant la direction Nord-Sud et
Est- Ouest, sur l'axe Impfondo-Dongou avec une superficie totale de 37500
m2 ou 3,75 ha dont quatre (4) parcelles de forêts
dégradées, 10 de forêts primaires ou intactes et une
parcelle d'agroforesterie
Nord
25 m
Figure 4 :

50 m
625 m2
Sud
Schéma de la délimitation d'une parcelle
II-4-3- Collecte de données floristiques
L'étude de la structure forestière dans les deux
(2) forêts est faite en procédant à un inventaire
floristique et structural de tous les arbres ayant un DBH (diamètre
à hauteur de poitrine)
supérieur à 5 cm (figure 5) en suivant le protocole
ci-dessous.
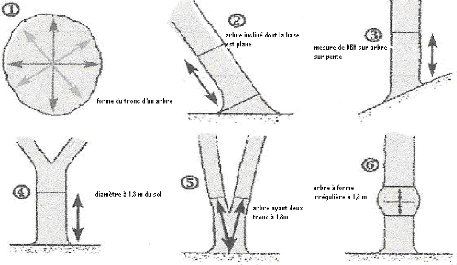
15
Figure 4 : Mode de mesure des différents
arbres (IFO, 2010)
Les arbres ayant les contreforts ou les racines échasses
sont mesures à 30 cm au-dessus de celui-ci (photo1). Au total trois (3)
sites ont été inventoriés : Dongou, Bondzalé et
Impfondo ont été choisis pour cette étude. Cette
étude est portée sur une superficie de 37500 m2 soit
3.75 ha. La
superficie de la parcelle est de 50 m X 50 m soit
2500m2 ou 0.25 ha (photo2). Nous
avons inventorié au total
15 parcelles dont 6 à Dongou, 5 à Bondzalé et 4 à
Impfondo.

16
Photo 3 : Arbre à racines échasses
Photo 2 : Matérialisation de la parcelle
Cette étude est portée sur l'inventaire des
espèces et le dénombrement de tous les individus, ici le seul
paramètre pris en compte est le diamètre, et la hauteur n'a pas
été prise en compte faute des instruments de mesure. Chaque arbre
inventorié est marqué par un coup de machette pour éviter
le comptable double de l'individu. Les noms locaux et les noms scientifiques
sont inscrits dans un cahier de comptage. Les mesures de diamètre ont
été conventionnellement rangé selon la classification de
Dentienne & Chanson, 1999 et dans un système simple de classe :
classe 0 = valeur comprise entre 0 et 0.9 m; classe I = valeur comprise entre
0.10 m et 0.19 m; la classe II = valeur comprise entre 0.20 m et 0.29 m ; la
classe III = valeur comprise entre 0.30 m et 0.39 m etc.
II- 5- Méthode de traitement des données
Pour une meilleure organisation des données
recueillies, nous avons créées une base de données au
tableur Microsoft Excel 2013. La reconnaissance des arbres sur le terrain est
effectuée, par les noms pilotes, les noms vernaculaires et les noms
scientifiques. Les identifications des essences ont été faites
sur le terrain à partir des connaissances botaniques des membres de
l'équipe et à partir de la littérature scientifique
existante. Pour y parvenir, les documents suivant nous en servis pour
l'identification de certains arbres :
17
Introduction aux arbres du Nord de la République du Congo
(Moutsamboté & al, 2011) ;
- Guide pratique d'identification : les arbres de la
Guinée Equatoriale, région continentale (Wilks et al 2000) ;
- Arbres des forêts denses d'Afrique Centrale
espèces du Cameroun (Vivien et al 1985).
Toutes les données d'inventaire ont été
compilées dans une base de données comprenant la liste
complète des espèces inventoriées avec leur nombre
d'individus par classe de diamètre. Cette base de données nous a
permis de calculer des paramètres permettant de faire une étude
comparative de la flore et d'apprécier la structure de la zone
forestière de l'axe Impfondo-Dongou étudiée.
II-6-Méthode d'analyse floristique
II-6-1- Richesse floristique
Selon Husson 2014, la richesse spécifique consiste
à quantifier le nombre d'espèces différentes sur une zone
donnée.
Il s'agit du nombre d'espèces rencontrées dans
une surface donnée ou pour un nombre d'individus donnés (Pascal
2003). Selon Boudelal, 2014, on détermine la composition floristique
d'un peuplement en faisant un inventaire des essences présentes et
importances de leur nombre et de la surface qu'elles couvrent.
II-6-2- Fréquence
Selon Rakotomalaza et al (2003), la fréquence
correspond au nombre d'occurrence d'une
famille; genres et espèces dans les parcelles
considérées.
Selon Schwal (2004). Les espèces sont les unités de
base de systèmes modernes de
classification des organismes vivants
Nous avons calculé la fréquence suivante:
- La fréquence brute de nature floristique,
utilisée pour déterminer le nombre d'espèces
par famille par rapport au nombre total d'espèce.
- La fréquence pondérale pour déterminer le
nombre d'individus par famille.
Il est déterminé par la formule suivante :
Fréquence(F) = (Nombre d'espèces ou d'individus par
famille x 100)/nombre totale d'espèces
ou d'individus
18
II-7- La diversité biologique
La diversité par contre est le descripteur qui
désigne la richesse d'une biocénose en espèce. Ce
paramètre est fondamental car il permet de comparer la richesse en
espèce de deux biocénoses (IFO, 2010). La biodiversité
désigne la variété de toutes formes de vie sur terre.
Selon Legendre et Legendre (1984), La diversité
biologique est considérée comme un paramètre de dispersion
de la communauté ou du moins de l'échantillon d'individus
extraits de cette communauté par observation ou échantillonnage.
Ce paramètre renseigne sur le plus ou moins grand étalement de la
distribution des individus regroupés en espèces.
D'après Boudelal, 2014, l'indice le plus couramment
utilisé dans la littérature est celui de Shannon (H') basé
sur la théorie de l'information. Shannon et Weaver (1962) ont
donné à la formule de Shannon le nom d' «entropie ».
Pour un nombre constant d'espèces comptabilisées, l'indice de
Shannon est minimal (0) si par exemple, dans un peuplement, une espèce
est dominante et les autres espèces sont représentées par
un seul individu. Il est donc maximal (tend vers 5) quand les espèces
sont variées et reparties de façon équitable Boudelal,
2014. Savant que les deux (2) valeurs sont les limites d'un intervalle dans
laquelle H' est variable.
Pour l'uniformité et la distribution des espèces
au sein de l'habitat (Rakotomalaza et al(2003), nous avons
utilisé l'indice de Shannon qui est calculé à partir des
données quantitatives. Il varie de 0 à 5 bits.
L'indice de Shannon est déterminé par la formule
ci-dessous.

Avec pi = abondance proportionnelle ou pourcentage d'importance
de l'espèce, se calcule ainsi :
pi = ni/N ;
S = nombre total d'espèces ;
ni = nombre d'individus d'une espèce dans
l'échantillon ;
N = nombre total d'individus de toutes les espèces dans
l'échantillon.
II-7-1- L'indice de Pielou ou de régularité
(équitabilité).
Selon Masharabu & al (2010)
l'équitabilité (E), résulte du rapport de l'indice de
diversité de Shannon-Weaver (H') ou diversité réelle et de
la valeur théorique maximale (H'max). Il varie donc entre 0 et 1. Plus
cet indice tend vers un (1), plus la dispersion des éléments de
la biodiversité est équitable, plus il tend vers zéro (0),
plus il y a une dominance d'une espèce par rapport aux autres
c'est-à-dire une dispersion non équitable (Boudelal, 2014).
Est le rapport de l'indice de diversité de Shannon sur
l'indice de diversité maximale. Il marque le niveau de diversité
atteint par le système par rapport au maximum possible (Kimpouni et
al, 2013). Selon Bassatnh (2006), cet indice permet d'estimer la
répartition des arbres au sein des relevés en évaluant la
proportion des espèces dominantes et dominées. Il se calcule de
la façon suivante :
H'
E =
H'max
H'max est le logarithme du nombre total d'espèces (S)
H'max= logS
II-7-2- La similarité
Cette catégorie d'indices est destinée à
comparer des objets sur la base de présence-absence d'espèces.
Elle est déterminée par le coefficient de similarité, mais
ne font pas intervenir la case de double zéros (Legendre et Legendre,
1998)
Tous ces coefficients sont calculés à partir des
données de présence-absence résumées dans un
tableau de fréquences 2 x 2.
Tableau 1 : Tableau de fréquences 2x2
pour le calcul de similarité d'échantillons Objet x1
20 0
Objet X2 1
0
a+b c+d
19
a+c b +d
n=a+b+c+d
20
a=nombre de présence commune pour les deux
échantillons (x1 et x2) b = nombre de présence propre à
l'échantillon X2 c= nombre de présence propre à
l'échantillon X1 d = nombre d'espèces absentes pour les deux
échantillons (x1 et x2)
Les doubles absences sont fréquentes dans les
communautés biologiques car plusieurs espèces sont rares et peu
sont dominantes. Comme on veut en général fonder la recherche des
associations biologiques sur la totalité des espèces d'un
groupement, la matrice de base vas contenir un grand nombre de zéro. Or,
le double zéro ne permet pas une interprétation écologique
aussi claire que la double présence. On peut y remédier en
éliminant de l'étude des espèces peu fréquentes, en
éliminant le double zéro des comparaisons (en les
déclarante comme information manquante) Legendre et Legendre (1998).
Pour calculer les coefficients de similarité de nos
échantillons, nous avons utilisé deux coefficients binaires
excluant les doubles zéros ; il s'agit du coefficient de Jaccard(S) et
le coefficient de Sorensen(K).
Dans le plus connu est le coefficient de communauté de
Jaccard. Le coefficient de Sørensen donne un poids deux fois plus
élevé à la double présence, on peut
considérer la présence d'une espèce plus informative que
son absence.
a
S(%)= X 100
a+b-c
2a
K(%)= x100
b+c
Selon Legendre et Legendre (1998), les coefficients de Jaccard
et Sørensen se distinguent par le faite que le premier donne la
même cotation à la présence et à l'absence, alors
que, le second accorde un double avantage à la présence. Dans ce
dernier cas, la présence est plus informative que la présence.
21
II-8-3- Analyse structurale
La structure de la forêt correspond à
l'agencement de ses différents composants. Cet agencement peut
être envisagé globalement ou séparément pour les
différentes espèces (ou groupes d'espèces). La
structuration du peuplement arborescent constitue, en quelque sorte, l'ossature
de la forêt (Pascal, 2003). La structure est définie
d'après Boudelal (2014) par la répartition des arbres en fonction
de leur âge ou corrélation de leur diamètre. Une structure
est dite régulière, quand tous les arbres ont le même
âge ou approximativement le même diamètre et la même
taille. Elle est dite irrégulière, lorsque plusieurs classes
d'âge coexistent.
Les paramètres structurales suivantes ont
été calculés ou établis :
II-8-3-1- Densité
La densité (D) représente le nombre d'individu
recensé par unité de surface (ha) Rakotomalaza et al
(2003).
Elle est déterminée par la formule suivante :
Densité = Nombre d'individus recensés/Superficie
inventoriée
C'est la distribution des arbres en classes de
diamètre, est souvent appelée «structure totale» par
les forestiers ce qui montre son importance pour les gestionnaires des
forêts. Elle peut être envisagée à deux niveaux : le
peuplement arborescent dans son ensemble ou les populations d'espèces.
Les distributions des classes de diamètre apportent donc plusieurs
catégories d'information. Elles reflètent l'état dynamique
du peuplement dans son ensemble (rapport jeunes/adultes), les
tempéraments des espèces (sciaphiles, héliophiles), les
situations particulières de dynamique, de contrainte (Pascal, 2003)
II-8-3-2- La surface terrière
La surface terrière correspond à la somme des
sections horizontales des troncs, prises par convention à 1,30 m du sol
(Pascal 2003).
Elle peut être calculée, pour l'ensemble du
peuplement, par espèces ou par groupes d'espèces. Elle est un
excellent indicateur de la richesse du peuplement. Les valeurs calculées
varient généralement entre 25 et 50 m2/ha. Elle
s'exprime en mètres carrés par hectare. La surface
terrière est symbolisée par la lettre G.
??
??= ?? ????
22
S = (m2) ; d =
diamètre de l'arbre à 1.30 m du sol
Pour déterminer la somme des surfaces à l'hectare
G (m2. ha), la formule est la suivante :
s
G= NxD
N = nombre total des arbres et D = densité des arbres.
III-8-3-3- Distribution des classes de diamètre
La situation est différente si l'on s'intéresse
aux espèces séparément. Plusieurs types de distribution
s'observent alors :
-- Une distribution en exponentielle décroissante, ou
en diminution régulière des effectifs avec les classes de
diamètre. Ce type de distributions est caractéristique des
espèces sciaphiles, tolérant l'ombre. On la retrouve aussi bien
chez celles qui passent tout leur cycle en sous-bois (les diamètres
maximaux sont alors peu importants) que chez celles qui commencent leur
développement en sous-bois et le terminent au niveau de la
canopée (atteignant ainsi de forts diamètres).
-- Des distributions en cloche très aplatie ou avec une
faible décroissance des effectifs avec l'augmentation du
diamètre. Pour ces espèces, il y a peu de jeunes par rapport aux
adultes. Ces distributions correspondent aux espèces héliophiles,
c'est-à-dire qui ont besoin de bonnes conditions lumineuses pour se
développer.
-- Des distributions irrégulières,
présentant des déficits ou des sureffectifs, pour certaines
classes, ou parfois des accumulations de gros diamètres. Une telle
distribution n'est pas toujours facile à interpréter car elle
résulte de situations différentes (Pascal, 2003).
23
CHAPITRE III : PRESENTATION DES RESULTATS
III- PRESENTATION DES RESULTATS
L'analyse de la structure et de la biodiversité des
deux forêts (Dégradée et Primaire) de l'axe Impfondo-Dongou
a permis de révéler d'une part la variabilité de la
structure de la flore forestière entre les deux types de forêt et
d'autre part la composition floristique de ces forêts. Ce présent
chapitre présente les résultats de cette étude, en
composition floristique, en richesse floristique et la distribution structurale
en diamètre des deux types de forêt (primaire et
dégradée) étudiés puis la structure en
diamètre des essences principales desdites forêts.
III-1- Composition floristique
L'inventaire floristique effectué dans les sites
Dongou, Bondzalé et Impfondo a permis de dénombrer 1611 arbres de
DBH = 5 cm, répartis en 114 espèces dans 37 familles et 83
genres, comme l'indique le tableau 2 ci-dessous.
Tableau 2: Composition floristique de toutes les
parcelles inventoriées
|
Familles
|
Noms scientifiques
|
Nombre d'espèce
|
Nombre d'arbre
|
|
Achariaceae
|
Caloncoba welwitschii (Oliv.) Gilg
|
1
|
9
|
|
Anacardiaceae
|
Pseudospondias microcarpa (A.Rich.)
Engl.
|
2
|
14
|
|
Trichoscypha acuminata Engl.
|
|
Annonaceae
|
Anonidium mannii (Oliv.) Engl. & Diels
|
2
|
19
|
|
Monodora angolensis Welw.
|
|
Apocynaceae
|
Alstonia boonei De Wild.
|
1
|
1
|
|
Aptandraceae
|
Ongokea gore (Hua) Pierre
|
1
|
1
|
|
Bignoniaceae
|
Markhamia tomentosa (Benth..) K.
|
1
|
1
|
|
Burseraceae
|
Dacryodes pubescens (Verm.) Lam
|
1
|
3
|
|
Cannabaceae
|
Celtis adolfi-friderici Engl.
|
1
|
12
|
|
Chrysobalanaceae
|
Parinari congensis F. Didr.
|
4
|
32
|
|
Parinari congolana T. Durand
|
|
Parinari excelsa Sabine
|
24
|
Maranther glabra (Oliv.)
|
|
|
|
Combretaceae
|
Terminalia superba Engl. Et Diels.
|
1
|
3
|
|
Ebenaceae
|
Diospyros crassiflora Hiern
|
2
|
47
|
|
Diospyros ituriensis (Gùrke) R. Let et F.
white
|
|
Euphorbiaceae
|
Cleistanthus itsogohensis Pellegr.
|
12
|
239
|
|
Croton haumananus J. Léonard
|
|
Dichostemma glaucescens Pierre
|
|
Grossera macrantha Pax
|
|
Macaranga barteri Mull-Arg.
|
|
Macaranga monandra Mull- Arg.
|
|
Macaranga schwinfurthii Pax
|
|
Macaranga spinosa Müll-Arg.
|
|
Plagiostyles africana (Mull.-Arg.) Prain
|
|
Ricynodendrom heudolotii (Baill.) Pierre ex Pax
|
|
Sapium ellipticum (Hochst.) Pax
|
|
Tetrorchidium didymostemom j(Baill.)
Pax & K. Hoffm.
|
|
Fabaceae-
Caesalpinioideae
|
Copaifera saliouunda Heckel
|
5
|
116
|
|
Daniellia pynaertii De Willd.
|
|
Dialum pachyphyllum Harms
|
|
Guibourtia demeusei (Harms) Léon.
|
|
Swartzia fustiloides Harms
|
|
Fabaceae- Faboideae
|
Angylocalyx pynaertii De Wild
|
4
|
123
|
|
Baphia dewevrei De Wild.
|
|
Milletia sanagana Harmes
|
|
Pterocarpus soyauxii Taub.
|
|
Fabaceae-Mimosoideae
|
Albizia ferruginea (Guill. & Perr.) Benth.
|
10
|
58
|
|
Albizia laurentii De Wild.
|
|
Albizia rhomboidea
|
|
Albizia zygia (DC.) J.F. Macbr
|
|
Newtonia devredii G.C.C. Gilbert
|
25
|
Parkia filicoidea Welw. ex Oliv.
|
|
|
|
Parkia bicolor A. Chev.
|
|
Penthacletra macrophylla Benth
|
|
Piptadeniasthrum africanum (Hook. F.) Bren.
|
|
Tetrapleura tetraptera (Schum. &
Thonn.) Taub.
|
|
Guttifereae
|
Allamblackia floribunda Oliv.
|
7
|
55
|
|
Garcinia punctata Oliv.
|
|
Garcinia punctata Stapf
|
|
Garcinia ovalifolia Oliv.
|
|
Mammea africana Sabine
|
|
Symphonia globulifera L. f.
|
|
Garcinia smeathmannaü Oliv
|
|
Irvingiaceae
|
Irvingia exselsa
|
3
|
16
|
|
Irvingia grandifolia (Engl.) Engl.
|
|
Klainedoxa gabonensis Pierre ex Engl
|
|
Lamiaceae-Viticoideae
|
Vitex pachyphylla Bak
|
1
|
8
|
|
Lauraceae
|
Persea americana L.
|
1
|
1
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.)
Liben
|
2
|
63
|
|
Brazzeia congensis Baill.
|
|
Malvaceae-Sterculioideae
|
Cola nitida (Vent.) Schott & Endl
|
1
|
2
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
8
|
|
Meliaceae
|
Carapa procera var palustre DC.
|
5
|
46
|
|
Carapa procera var procera DC.
|
|
Entandrophragma cylindricum (Sprague) Sprague
|
26
|
Trichilia monadelpha (Thonn.) J. J. DE Wild
|
|
|
|
Trichilia tessmannii Harms
|
|
Moraceae
|
Anthiaris toxicaria var. welwitschii Lesch
|
5
|
17
|
|
Ficus exasperata Vahl
|
|
Ficus vogeliana (Miq.) Miq
|
|
Milicia excelsa (Welw.) C.C. Berg
|
|
Trelipisium madagascariensis DC
|
|
Myristicaceae
|
Ceolocaryan preussü Warb.
|
3
|
226
|
|
Pycnantus angolensis (Welv.) Exell
|
|
Staudtia kamerounensis Warb. Var.
gabonensis Fouilloy
|
|
Ochnaceae
|
Lophira alata Banks ex Gaertu.
|
2
|
14
|
|
Rhabdophillum welwitschii Van Tigh
|
|
Olacaceae
|
Heisteria parvifolia Smth.
|
3
|
52
|
|
Strambosia grandifolia Hoof. F.
|
|
Strombosia pustulata Oliv.
|
|
Pandaceae
|
Panda oleosa Pierre
|
1
|
6
|
|
Passifloraceae
|
Barteria fistulosa Mast.
|
1
|
1
|
|
Putranjivaceae
|
Drypetes pellegrinii Léandri
|
2
|
7
|
|
Drypetes leonensis (Pax). Pax et K. Hoffm.
|
|
Phyllanthaceae
|
Cleistanthus mildbraedrüJabl
|
6
|
37
|
|
Hymenocardia ripicola J. Léonard
|
|
Hymenocardia ulmoides Oliv.
|
|
Maesobotrya dusenii (Pax.) Hutch.
|
|
Uapaca guineensis Mull. Arg
|
|
Uapaca heudelotii Baill.
|
|
Rubiaceae
|
Aidia micrantha (K. Schum.) F. White
|
9
|
44
|
|
Aoranthe micrantha
|
|
Colleactina papalis N. Hallé
|
27
|
Massularia acuminata (G. Don) Bullock ex Hoyle
|
|
|
|
Morelia senegalensis A. Rich.
|
|
Morinda pynaertü Benth.
|
|
Oxyanthus schumannianus De Wild. Et Th. Dur
|
|
Psidrax subcordata DC
|
|
Psydrax arnoldiana (De Wild).
|
|
Rutaceae
|
Zanthoxylum heitzii (Aubrév. & Pellegr.) P. G.
Waterman
|
1
|
1
|
|
Sapendaceae
|
Blighia welwitschii (Hiern) Radlk
|
4
|
55
|
|
Eriocoelum microspermum Radlk.
|
|
Lecaniodiscus cupanioides Planch. Ex Benth
|
|
Pancovia pedecelaris Rod lk. Et Gilg
|
|
Sapotaceae
|
Chrysophyllum beguei Aubrev.
|
4
|
18
|
|
Synsepalum brevipes (Baker) T.D Penn
|
|
Tridesmostemom omphalocarpoides
Engl.
|
|
Manilkara sp
|
|
ManilKara fouilloyana Aubr. Et Pellegr
|
|
Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
21
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
2
|
235
|
|
Myrianthus arboreus P. Beauv.
|
|
Total
|
114
|
1611
|
28
A partir de ce tableau 1, il est possible de calculer les
proportions des fréquences brutes et des fréquences
pondérées des différentes familles (figure 5).
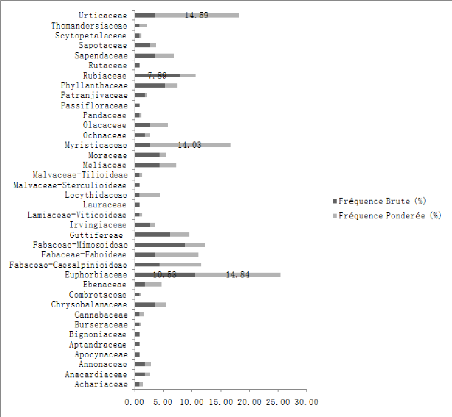
Figure 5 : Contribution spécifique et
pondérale des différentes familles
Sur le plan floristique ce sont les Euphorbiaceae (14,84%)
suivies des Urticaceae (14,49%), des Myristicaceae (14,09%) des
Fabaceae-Fabioideae (7,64%), Fabaceae-Mimisoideae (7,20%). En terme de nombre
d'arbres c'est la famille des Euphorbiaceae qui ont le grand nombre d'individus
(239), suivi des Urticaceae (235), Myristicaceae (226), Fabaceae-Faboideae
(123), Fabaceae-Caesalpiniodeae (116).
III-2- Types de végétation
Les espèces représentées dans le tableau
2 ont été inventoriées dans les milieux environnementaux
différents. A partir d'un tableau à double axe en mettant les
espèces en ligne et les variables représentées par les
types de forêts dans lesquelles les inventaires ont été
29
effectués, nous avons effectué une analyse en
composantes principales qui a permis de discriminer nos relevés (figure
6).

F2 (24,21 %)
-0,25
-0,75
0,75
0,25
-0,5
0,5
-1
0
1
-1 -0,75 -0,5 -0,25 0 0,25 0,5 0,75
F1 (30,04 %)
Variables (axes F1 et F2 : 54,25 %)
FDMa
FDMu
FPG
FPL
FPC
Figure 6 : Cercle des
corrélations de l'ACP
Le plan principal (axe 1 et axe 2) donne une contribution de
54,25% à l'explication de la répartition de nos forêts. De
façon générale les variables ou types de forêts sont
toutes placées de même côte positif de l'axe des abscisses.
Ce qui nous permet de conclure que tous les relevés ont
été effectués dans une même zone écologique.
Par contre l'axe 2 discrimine nos relevés en deux groupes. Le premier
groupe situé du côté positif de l'axe comprend la
forêt primaire à Guibourtia demeusei (FPG) et la
forêt dégradée à Musanga cecropioides
(FDMu). Du côté négatif de ce même axe, on note
la forêt dégradée à Macaranga monandra
(FDMa), la forêt primaire à Celtis adolfi-frederrici
(FPC) et la forêt primaire à Lophira alata.
En ce qui concerne les forêts dégradées,
il faut noter que la forêt dégradée à Musanga
cecropioides s'oppose à la forêt dégradée
à Macaranga monandra. On pourrait penser que l'axe 2 discrimine
les forêts dégradées suivant leur âge. En effet, la
forêt dégradée à Musanga cecropioides est
plus âgée que la forêt dégradée à
Macaranga monandra.
Pour ce qui est des forêts primaires, l'axe 2 les
discrimine en forêt inondée et en forêt exondée. En
effet, la forêt primaire à Guibourtia demeusei est une
forêt inondée tandis que la forêt
30
primaire à Lophira alata et la forêt
primaire à Celtis adolfi-frederici sont des forêts
exondées sinon temporairement inondées.
La projection des espèces ou des observations dans le
plan principal permet de connaître les espèces
caractéristiques de chaque type de forêt (figure 7).
Biplot (axes F1 et F2 : 54,25 %)
|
3
|
|
|
|
Obs45Obs3
|
Obs12
|
|
|
|
2
|
|
Obs49
|
|
|
|
8 1 3 Obs26 Obs4
|
FPG
|
|
|
|
|
17Obs32
|
|
|
|
1
|
|
FDMu Obs41
|
|
|
|
|
|
Obs20
|
|
|
Obs31 Obs29
|
|
|
|
|
0
|
|
8 15 24 50 Obs43 Obs7 O
bs38Obs18
|
11Obs30
|
|
|
|
|
Obs33FPL FPC 6 7 4 34 Obs8
|
|
|
|
-1
|
|
Obs22
|
|
|
|
2 3 1 27 39
Obs40 5 Obs6
|
|
|
|
|
Obs46Obs2
|
9Obs19
|
|
|
|
|
FDMa
|
|
|
|
-2
|
0Obs14
|
|
|
-3 -2 -1 0 1 2 3 4
F1 (30,04 %)
F2 (24,21 %)
Figure 7 : Projection des observations dans le
plan principal
Cette figure montre que les espèces comme Baphia
sp, Angylocalyx pynaertii, Albizia laurentii,
Cleistanthus itsogohensis caractérisent la forêt
inondée à Guibourtia demeusei. Pour ce qui est de la
forêt à Lophira alata et la forêt Celtis
adolfi-frederici, on y note les espèces comme Aidia
micrantha, Alstonia boonei, Antiaris toxicariaBlighia
welwitschii etc.
Le sous chapitre ci-dessous présente la composition et
les caractéristiques de chaque forêt mise en évidence par
l'analyse en composantes principales.
III-2-1- Forêt primaire sur terre ferme à
Celtis adolphi-friderici Engl.
La forêt à Celtis adolphi-friderici est
une forêt primaire de terre ferme qui contient un nombre varié
d'espèces. Cette strate forestière est dominée par
l'espèce Celtis adolphi-friderici d'où cette
appellation. Nous avons considéré ici les stratifications
verticales pour identifier les types forestiers. L'inventaire
réalisé dans ces forêts a montré une
biodiversité importante: vingt-quatre (24) familles, trente-six (36)
espèces et cent cinquante-trois (153) individus, Annexe 1 et figure
8).

31
Figure 8 : Contribution spécifique des
familles composant la forêt à Celtis adolfi-frederrici
Engl.
La famille la plus représentée dans cette figure
est celle des Euphorbiaceae (11,11%) suivies des Meliaceae et les Myristicaceae
(8,33%).
En termes de structure pondérale c'est la famille des
Myristicaceae qui est la plus représentées (24,84%), suivi des
Olacaceae (13,73%) individus, Sapotaceae (8,20%).
III-2-2- Forêt sur sol hydromorphe à
Guibourtia demeusei (Harms) Léon.
La forêt à Guibourtia demeusei est une
forêt primaire inondée, cette espèce caractérise les
zones inondées de l'axe Impfondo-Dongou. Plus de vingt-deux (22)
familles, cinquante-quatre (54) espèces y sont présentes avec
trois cent deux (302) individus (annexe 3 et figure 9)

32
Figure 9 : Contribution spécifique des
différentes familles de la forêt primaire à Guibourtia
demeusei (Harms) Léon.
Ce graphique nous montre que, la famille la plus
représentée est celle des Fabaceae-Mimosoideae et des
Guittifereae (9,26%), suivi des Fabaceae-Ceasalpinioideae, Phyllanthaceae et
Rubiaceae (7,41%). En terme pondéral, c'est la famille des
Fabaceae-Ceasalpinioideae (22,85%) est la plus représentée suivie
des Fabaceae-Faboideae (10,26%), Ebenaceae (8,28%).
III-2-3- Forêt primaire sur les sols hydromorphes
à Lophira alata Banks ex Gaertu.
Lophira alata ou Azobe est une espèce de
forêt primaire qui caractérise les zones inondables. Le
dépouillement de notre inventaire sur la base des parcelles
installées montrent qu'au total vingt-huit (28) Familles, cinquante-cinq
(55) espèces et cinq cent vingt (520) individus ont été
inventoriés (figure 10 et annexe 4)
La famille des Fabaceae-Mimosoideae, Rubiaceae, Euphorbiaceae,
Guttifereae et des Phyllanthaceae sont les mieux représentées
qualitativement (7,27%). La forêt primaire à Lophira alata
nous présente également les familles les plus riches sur le
plan quantitatif. La
33
famille des Myristicaceae (18,35%), suivie des
Fabaceae-Faboideae (14,62%), Euphorbiaceae (14,23%). Staudtia kamerounensis
var gabonensis est l'espèce la plus abondante (figure 10).

Figure 10 : Contribution spécifique
des différentes familles de la forêt primaire à Lophira
alata Banks ex Gaertu.
III-2-4- Forêt dégradée sur terre ferme
à Macaranga monandra Mull. Arg.
La forêt à Macaranga représente
une forêt dégradée c'est-à-dire qui a subi une
pression humaine. L'espèce Macaranga caractérise une
forêt dégradée en abondance-dominance, sur l'axe
Impfondo-Dongou, cette forêt représente au total vingt-sept (27)
familles, soixante (60) espèces et trois cent cinquante-huit (358)
individus (figure 11 et annexe 5).

34
Figure 11 : Contribution spécifique
des différentes familles de la forêt dégradée
à Macaranga monandra Mull. Arg.
La famille des Euphorbiaceae est la plus marquée
qualitativement (12,20%) suivie des Rubiaceae (11,11%), Fabaceae-Mimosoideae
(9,52%).
En termes pondéral, c'est la famille des Euphorbiaceae
(29,89%), en suite c'est la famille des Myristicaceae (17,32%).
III-2-5- Forêt dégradée sur terre ferme
à Musanga cecropiodes R. Br (Parasolier)
La forêt de l'axe Impfondo-Dongou est une forêt
dégradée caractérisée par Musanga cecropiodes
(Parasolier). Cette espèce forme parfois des peuplements purs ou
homogènes. Cette forêt présente un nombre assez
réduit en termes d'espèce soit dix-huit (18) espèces,
douze (12) familles et deux cent soixante- dix-huit (278) arbres (figure 11 et
annexe 6).

35
Figure 12 : Contribution spécifique
des différentes familles de la forêt à Musanga
cecropioides
Ce graphique nous montre que, la famille des Euphorbiaceae et
des Urticaceae présentent quantitativement (16.67%), suivies des
Myristicaceae et Chrysobalanaceae (11.11%). Sur le plan qualitatif c'est la
famille des Urticaceae qui (72,22%). Dans cette forêt, nous disons que
l'espèce la plus abondance et dominante est le Musanga
cecropioides.
En considérant la contribution pondérale des
familles de chacune des strates forestières décrites ci-dessus
(figure 10). Il apparaît que la strate à forêt primaire de
Lophira alata est la plus étendue et la plus fréquemment
rencontrée dans la zone d'étude suivie de la forêt
dégradée à Macaranga spp (FDMa) (21.94%), la forêt
primaire à Guibourtia demeusei (FPG) (17.95%), la forêt
dégradée à Musanga cecropioides (FDMu) (17.17%)
et la strate la moins représentée est celle de la forêt
primaire à Celtis adolphi-friderichii avec 9.72%.

Figure 13 : Répartition des types de
forêts en pourcentage
Les différentes strates forestières
décrites ci-dessus occupent la quasi-totalité de la surface de la
Likouala, aussi bien sur terre ferme que sur le sol hydromorphe. On note aussi
la présence des savanes incluses qui sont soit Inondables comme les
savanes à Jardinia congoensis (Photo 4), soit sur terre
ferme.

36
Photo 4 : Savane à Jardinea
congoensis (NDZAI, 2015)
37
III-3-Comparaison de structure et de composition
floristique entre les forêts primaires et les forêts
dégradées
Le tableau 3 ci-dessous marque la différence qui existe
entre les forêts primaires et les forêts dégradées
sur l'axe Impfondo-Dongou.
III-3-1- Comparaison de composition floristique
En regroupant la composition floristique de toutes les
forêts primaires et celle des forêts dégradées
rencontrées, on peut dégager les caractéristiques aussi
bien physionomiques que floristiques entre les forêts primaires et les
forêts dégradées. Le tableau 3 ci-dessous
Tableau 3 : Comparaison de la forêt
primaire et de la forêt dégradée
|
Eléments de comparaison
|
Forêt primaire ou intacte
|
Forêt dégradée
|
|
Sous-bois
|
Clair et facile de circuler, accès rapide à la
ressource
|
Touffu avec de nombreuses espèces, difficile de
travailler
|
|
Diamètre des arbres
|
Gros
|
Petit
|
|
Hauteur des arbres
|
50 à 60 m
|
20 à 30 m
|
|
Croissance
|
Lente
|
Rapide
|
|
Strates
|
Supérieure, inferieure et
herbacée
|
Supérieure, moyenne,
inferieure et herbacée
|
|
Espèces caractéristiques
|
Lophira alata, Guibourtia
demeusei, Celtis adolphi-
friderichii
|
Musanga cecropioides,
Macaranga spp,
Chromolena odorata, Trema orientalis
|
|
Composition
|
Hétérogène, dominance
|
Homogène, #177; hétérogène,
abondance-dominance
|
|
Sol
|
Avec humus
|
Sans humus
|
|
Canopée
|
Fermée
|
#177; ouverte
|
|
Superficie
|
Grande
|
Petite
|
|
Insectes
|
Présents
|
Absents
|
|
Espèces
|
Héliophiles, sciaphiles et
conservatrices
|
Héliophiles, pionnières et
édificatrices
|
Source : NDZAI 2015
38
En comparaison avec la forêt dégradée, la
forêt primaire présente une canopée fermée avec des
arbres à cimes jointives. Cependant dans les forêts
dégradées visitées, nous avons noté des
trouées laissant transparaître la lumière dans le sous-bois
et par conséquent, nous avons noté un sous bois touffu. Les
principaux caractères physionomiques sont les suivantes:
y' stratification verticale complète formée des
strates biens individualisée;
y' strate arborescente supérieure uniforme, dense,
dominée par une ou quelques « essence d'ombre » dont la
régénération est abondante et la représentation
bien fournie dans tous les étages;
y' strate arborescente inferieure et arbustive moins denses
que l'étage supérieur, surtout formées du recrutement des
essences dominantes;
y' strate suffrutescente et inferieur relativement claire,
constituées en majeur partie de plantes ligneuses sciaphiles et
hemisciaphiles et des plantules des grands arbres;
y' les essences héliophiles sont pratiquement absentes,
les lianes et les grandes monocotylées sont mal
représentées.
A côté des espèces qui dominent largement
le peuplement, apparaissent d'autres arbres qui tolèrent plus ou moins
l'ombre: Anonidium mannii, Panda oleosa, Staudtia kameroonensis var
gabonensis etc.
Les strates arborescentes inferieures (plus ou moins 20-25 m)
et arbustive (4-15 m) sont surtout peuplées des baliveaux de
régénération des grands arbres; quelques
éléments propres méritent d'être notés:
Garcinia punctata, Diospyros crassiflora, Massularia acuminata,
Cleistanthus itsoghensis etc.
La strate inferieure est peuplée de plantes
herbacées sciaphiles: Palisota spp, Geophila hirsuta,
Marantacées, Hyscelodelphys poggeana, Atenidia conferta, costus affer
etc.
Les lianes ou les plantes grimpantes sont moins nombreuses, on
note:
Urera cameroonensis, Olera gratiflora, Monniophytum
fulfum, Lacosperma spp etc.
A la différence des forêts primaires, les
forêts dégradées montrent, à l'intérieur de
la zone étudiée une assez grande uniformité, tant sur le
plan de leur structure que de leur écologie et de leur composition
floristique. Les forêts dégradées sont le plus souvent
dominées par un petit nombre d'espèces dans la strate
arborescente, mais ces essences ne se régénèrent pas dans
la strate inferieure. Le dôme ne dépasse jamais 15-20 m de haut,
le sous-bois est très dense et se
39
remarque surtout par de jeunes brins arbres des forêts
primaires destinées à relayer la succession. Les espèces
suivantes ont été notées dans les forêts secondaires
(tableau 4)
Tableau 4 : Les espèces
caractéristiques de la forêt dégradées.
|
Arbres et arbustes
|
Lianes ou plantes
grimpantes
|
Plantes herbacées
|
|
Musanga cecropiodes
|
Adenia lobata
|
Palisota hirsuta
|
|
Myrianthus arboreus
|
Montandra guinensis
|
Palisota schweinfurthii
|
|
Macaranga monondra
|
Paullinia pinnata
|
Aframonum stipulatum
|
|
Macaranga spinosa
|
Tetracera clessensii
|
Costus affer
|
|
Ficus spp
|
Combretum paniculatum
|
Nephrolepis biserrata
|
|
Etc.
|
. Urera
camerounensis
|
Canna indica
|
Il faut signaler que les lianes sont très abondantes
dans toutes les strates de la forêt dégradée; leur
biodiversité spécifique est très grande. Sur les sols
pauvres ou dégradés par un trop long cycle cultural, la
végétation est beaucoup moins dense; elle n'atteint que 2-3 m de
haut en moyenne et le couvert est irrégulier. La reconstitution
forestière est beaucoup plus longue.
Nous avons calculé les fréquences brutes de la
contribution spécifiques de chaque famille dans les forêts
primaires prises dans leur ensemble et celles de l'ensemble des forêts
dégradées.
40
En ce qui concerne les forêts primaires (figure 14) La
répartition des fréquences brutes des familles varie de 0.12%
à 10%, sur les 37 familles identifiées 28 familles sont
présentes dans cette forêt.
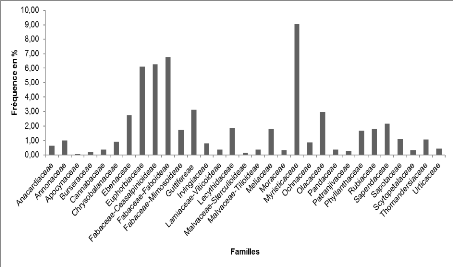
Figure 14 : Contribution spécifique
des différentes familles rencontrées dans les forêts
primaires
La famille des Myristicaceae dans la forêt primaire (FP)
est la plus représentée (9.06%), suivies des Fabaceae-Faboideae
(6.77%), Fabacae-Ceasalpiniodeae (6.27%), Euphorbiaceae (6.06%) et les autres
familles sont faiblement représentées.
41
Pour ce qui est des forêts dégradées, les
valeurs de la fréquence brute varient de 0.1% à 14.15%. Sur 37
familles identifiées sur l'axe, seule 27 familles sont
présentées dans la forêt dégradée (figure
15).

Figure 15 : Contribution spécifique
des différentes familles rencontrées dans les forêts
dégradées
La famille des Urticaceae est la plus
représentée (14.15%) suivies des Euphorbiaceae (8.44%),
Myristicaceae (4.47%). Le reste des familles sont faiblement
représentées.
La famille des Urticaceae est la plus
représentée par ce que l'espèce Musanga cecropiodes
est beaucoup plus dominante dans les forêts dégradées,
suivies des Macaranga spp de la famille des Euphorbiaceae.
III-3- La diversité biologique
Pour comparer la richesse en espèces entre les deux
forêts sur l'axe Impfondo-Dongou, nous avons calculé les valeurs
d'indice de Shannon Weaver et d'équitabilité de Pielou dans
chaque parcelle par type de forêt en considérant le nombre
d'individu par espèce et le nombre total d'individus de chaque parcelle
(figure 9).
42
Les résultats montrent que l'indice de Shannon et
Weaver varie entre 0 et 4,50 bits et l'équitabilité entre 0,4 et
0,9.

FD = Forêt dégradée FP = Forêt primaire
AF = Agroforesterie
Figure 16 : Indice de Shannon et Weaveret
Equitabilité de Pielou
Dans cet exemple, on a observé 15 parcelles dont le
nombre d'espèces est différent. L'indice de Shannon rend bien
compte de l'Equitabilité. Dans notre cas, la valeur maximale de l'indice
de Shannon est obtenue dans la forêt primaire notamment, dans la parcelle
5 avec la valeur de 4,49 bits suivis de la parcelle 6 soit 4,44 bits de
forêt primaire ou intacte et la parcelle 15 d'agroforesterie 4,47 bits.
Ce qui signifie que, dans ces parcelles nous avons une diversité
d'espèces c'est-à-dire toutes les espèces ont presque la
même abondance (équilibre). Par contre, la valeur de l'indice de
Shannon la plus faible est observée dans la parcelle 11 avec la valeur
de 0,82 bits de forêt dégradée (forêt
homogène). Cette parcelle est dominée par une seule espèce
ce qui conduit à une valeur plus faible de l'indice (une distribution
non équitable) par rapport aux autres parcelles. La valeur de
l'Equitabilité la plus élevée est obtenue dans la parcelle
5 (forêt primaire) et 15 (Agroforesterie) soit 0,99, ce qui signifie la
variabilité des espèces dans ces parcelles. La valeur la plus
faible est obtenue dans la parcelle 11 avec la valeur de 0,24.
43
III-4- Indice de similarité
Les indices de diversité nous a permis de conclure que les
zones étudiées sont riches en espèces. Les
différentes forêts étudiées sont-elles similaires du
point de vue composition floristique ? Les valeurs de coefficient de
similarité varient de 17,18% à 28,48% pour l'indice de Jaccard et
de 29,33% à 44,33% pour l'indice de Sorensen voir figure 15.

Figure 17 : Valeurs des indices de
similarité de Jaccard et de Sorensen
Cette figure montre que les valeurs des indices de
similarité sont inférieure à 50%, ce qui nous a permet de
conclure qu'il ya évidemment une différence de point de vue
composition floristique entre les forêts primaires et les forêts
secondaires confirmant ainsi les données floristiques que nous avons
présentées ci-dessus.
III-5- Analyse structurale
III-5-1- Répartition des arbres dans les parcelles
inventoriée
L'inventaire floristique et structural des forêts de
l'axe Impfondo-Dongou nous a permis de dénombrer 1611 arbres dans une
superficie de 3.75 ha, soit une densité de 447.2 arbres/ha dans les 15
parcelles inventoriées.
La densité des arbres varie suivant les parcelles d'une
part et en fonction du type de forêt d'autre part. Elle varie de 144
tiges/ha à 868 tiges/ha selon de le type de forêt et ceci, toutes
les espèces confondue comme montre la figure 18.
|
P = parcelle
FP = Forêt primaire FD = Forêt dégradée
AF = Agroforesterie
|
Figure 18 : Répartition du nombre
d'arbres dans les parcelles inventoriées
La densité à l'hectare la plus importante est
obtenue dans la parcelle 11 avec 868 individus par hectare suivi de la parcelle
3 (848) de la forêt dégradée, parcelles 13 (648), parcelle
4 avec (532) individus par hectare dans la forêt primaire. La plus faible
densité à l'hectare est observée dans la parcelle 9 avec
144, une parcelle installée dans une forêt primaire inondée
riche en Arecaceae (Lacosperma laive), Azymorpha
senegalensis, et Raphia spp, qu'en espèces ligneuses.
Cela s'explique du fait que les forêts
dégradées en général sont très riches en
espèces héliophiles notamment des forêts homogènes
(abondance d'une seule espèce, c'est le cas de la forêt à
Musanga cecropioides) que les forêts primaires ou intactes. Le
sous-bois dans les forêts dégradée est très touffu
et difficile a pénétré avec un nombre important de lianes
ce qui n'est pas le cas dans les forêts primaires sur l'axe
Impfondo-Dongou.
III-5-2- Surface terrière
Les valeurs de la surface terrière en m2/ha
varient d'une part en fonction des types de forêt d'autre part, en
fonction des parcelles des forêts de l'axe Impfondo-Dongou (tableau 5)
44
Tableau 5 : Valeur des surfaces terrières
par parcelle
45
Type de forêt
|
Parcelles
|
Nombre d'arbre
|
Densité (n/ha)
|
G (m2/ha)
|
|
FD
|
P1
|
67
|
268
|
6.75
|
|
P2
|
73
|
312
|
9.11
|
|
P3
|
212
|
848
|
34.24
|
|
P11
|
217
|
868
|
26.73
|
|
FP
|
P5
|
115
|
460
|
23.06
|
|
P6
|
103
|
412
|
25.88
|
|
P7
|
64
|
256
|
36.37
|
|
P8
|
70
|
280
|
30.80
|
|
P9
|
36
|
144
|
16.01
|
|
P10
|
115
|
460
|
29.20
|
|
P4
|
133
|
532
|
36,38
|
|
P12
|
132
|
528
|
29.51
|
|
P13
|
162
|
648
|
35.54
|
|
P14
|
121
|
484
|
21.60
|
|
AF
|
P15
|
51
|
204
|
36.52
|
Dans ce tableau, la valeur de la surface terrière en
m2/ah la plus élevée est observée dans la
parcelle quinze (15), 36.52 m2/ha (agroforesterie). Du fait que les
individus inventoriés dans cette parcelle sont des arbres à gros
diamètre. Les forêts de l'axe Impfondo-Dongou nous
présentent les valeurs les plus élevées dans les parcelles
de forêts primaires notamment, parcelle sept (7) soit 36.37
m2/ha suivie de la parcelle quatre (4) 36,38 m2/ha,
parcelle treize (13) soit 35.54 m2/ha, parcelle huit (8) soit 30.80
m2/ha et la valeur la plus faible dans cette forêt
observée dans la parcelle neuf (9) soi 16.01 m2/ha. Tant
disque, la forêt dégradée présente les valeurs les
plus faibles de cet axe notamment dans la parcelle une (1) soit 6.75
m2/ha et parcelle deux (2) soit 9.11 m2/ha. Ce qui
s'explique par l'abondance des individus mais de petit diamètre.
III- 5-3- Répartition des arbres en classe de
diamètre dans les parcelles expérimentales
La distribution des individus des deux (2) types (forêt
intacte et dégradée) de forêts ainsi que l'agroforesterie
de l'axe Impfondo-Dongou dans les classes de diamètre est
représentée dans les figures ci-dessous.
46
III-5-1-1- Structure diamétrique de la forêt
dégradée de l'axe Impfondo-Dongou
La figure 19 ci-dessous présente le nombre d'individus
en classe de diamètre dans la forêt dégradée de
notre zone d'étude. Cette figure montre que le nombre d'individu vari de
0 à 221 suivant les classes de diamètre.
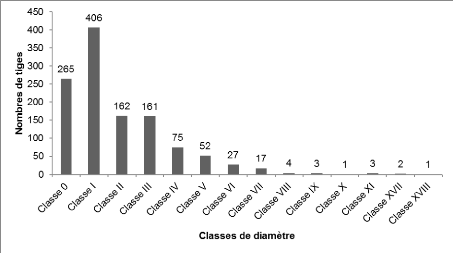
Figure 19 : Distribution diamétrique des
individus de la forêt dégradée
Cette figure qui montre une distribution de type exponentiel
décroissant des arbres en fonction des classes de diamètre. On
remarque que, la classe I est la plus élevée en nombre d'arbres
avec deux cent vingt un (221) arbres ce qui signifie que la forêt est
pleine régénération mais ce sont beaucoup plus les
espèces pionnières. La classe 0 succède également
la première classe avec cent quatre-vingt-dix (190) arbres suivie de la
classe II quatre-vingt-dix-huit (98) arbres. Par contre, les classes IX, X,
XVII et XVIII ne présentent aucun arbre du fait que, la forêt a
été dégradée. Il faut noter cependant un
défaut de réduction du potentiel de
régénération dans la classe 0
47
III-3-1-2- Structure diametrique de la forêt intacte
de l'axe Impfondo-Dongou
La structure diamétrale dans la forêt primaire
dans notre zone d'étude varie de 0 à 406 individus suivant les
classes de diamètre (figure 20).

Figure 20 : Distribution diamétrique
d'arbres en classe de diamètre dans les forêts primaires
La courbe de distribution des arbres en classe de
diamètre est aussi de type exponentiel mais avec un potentiel de
régénération supérieur à celui
observé dans les forêts dégradée. Dans la classe I
on note 406 arbres suivie de la classe 0 avec deux cent soixante-cinq (265),
classe II cent soixante-deux (162), classe III cent soixante-un (161) arbres.
Les classes des arbres à gros diamètre sont faiblement
représentée en nombre comme: classe IX trois (3) arbres, classe X
un (1) arbre, classe XI trois (3) arbres, classe XVII deux (2) arbres et la
classe XVIII un (1) arbre. Une distribution en exponentielle
décroissante qui est observée dans cette forêt intacte.
48
CHAPITRE IV : DISCUSSION IV-1- Composition
floristique
L'inventaire floristique et structural de l'axe
Impfondo-Dongou nous présente 1611 arbres réparti dans 37
familles, 114 espèces et 83 genres. La famille la plus
représentée qualitativement est celle des Euphorbiaceae (14,84%),
suivi des Urticaceae (14.59%) et des Myristicaceae (14.03%).
C'est dans la forêt dégradée que la
famille la plus représentée qualitativement est obtenue, il
s'agit des Urticaceae (14.15%), et des Euphorbiaceae (8.44%), comme stipule
Moutsamboté 1985, dans les forêts dégradée ou au
stade 2, la végétation devient dense aux espèces banales
héliophiles, annuelles de la famille des Urticaceae et des
Euphorbiaceae. Par contre, dans la forêt intacte un taux de pourcentage
faible observé dans la famille des Myristicaceae (9.06%) des
Fabaceae-Faboideae (6.77%), Fabacae-Ceasalpiniodeae (6.27%) et les
Myristicaceae (17.39%) dans l'agroforesterie.
L'analyse de ces résultats montre que les
espèces telle que: Musanga cecropioides R. Br(222 individus),
Staudtia kamerounensis var gabonensis (117 individus), Angylocalyx
pynaertii De Wild (102 individus), Macaranga spinosa Mûll.Arg
(88 individus) et Ceolocaryan preusii Warb. (66 individus) sont
les cinq (5) espèces les plus représentée sur l'axe
Impfondo-Dongou.
Mais les plus dominantes, celles qui occupent la strate
supérieure se répartissent de la manière suivante en
considérant les différents types de forêts: de la
forêt intacte Celtis adolphi-friderici Engl.
(forêt de terre ferme), Lophira alata (forêt
inondables), Guibourtia demeusei (forêt inondée).
Ces résultats correspondent à ceux obtenus par Vennitier
(1966), étude de la géographie du Cogo, Sita (1989), les
forêts du Congo; Moutsamboté (1998) dans son étude sur la
végétation du Nord-Congo qui disent que les forêts de la
Likouala sont caractérisées par les espèces de terre ferme
comme Celtis adolphi-friderici Engl., les espèces de
forêt inondée comme Guibourtia demeusei, les
espèces de forêt primaire inondable comme Lophira alata
d'où leur appellation.
Par contre les résultats dans les forêts
dégradées avec l'abondance-dominante de Musanga cecropioides
et Macaranga spp rejoint ceux obtenus par Omania et al,
2013 qui a étudié l'analyse floristique de la République
démocratique du Congo. Dans leurs études, ils affirment que de
façon générale les forêts dégradées
sont caractérisées par les espèces à croissance
rapides comme Musanga cecropioides R.Br et Macaranga spp, qui
forment à certains endroits des peuplements pur ou homogène. Lors
de notre collecte des données, nous avons observé des
49
peuplements purs de ces deux espèces. La parcelle 11 de
notre base d'inventaire est essentiellement constituée de peuplement pur
de Musanga cecropioides.
Nos résultats ont montré que, les forêts
primaires sur terre ferme sont beaucoup plus dominées par les
espèces comme Celtis adolphi-friderici et sur les sols
hydromorphes ce sont les espèces comme Guibourtia demeusei, Lophira
alata qui dominent.
Dans les forêts dégradées le sous-bois est
dense et l'inventaire a montré la présence des espèces
suivantes: Palisota hirsuta, Costus afer, Aframomum
giganteum, etc. Ces résultats correspondent avec ceux de Evrard
1968, qui dit que, les forêts primaires de terre ferme sont
caractérisées par les espèces dominante à hauteur
importante et à diamètre considérable telles que
Celtis adolphi-friderici, Terminalia superba, et les forêts
primaire sur le sol hydromorphe sont caractérisées par
Guibourtia demeusei, Lophira alata. Par contre, il stipule que les
forêts dégradées sont fortement caractérisées
par les espèces héliophiles comme: Musanga cecropioides R.Br
et Macaranga spp avec un sous-bois diversifié et la
présence des lianes est très remarquables dans ces forêts
que dans les forêts primaires ou intactes (Moutsamboté, 1985),
dynamique de reconstituions de la forêt Yombé: Dimonika, Congo.
IV-2- Les indices biodiversité
Les indices de biodiversité fournies un moyen
particulier de mesurer la biodiversité. Selon Farina, 2000 et Barbault,
1995, la valeur de l'indice de Shannon est égale 0 si l'ensemble du
peuplement contient une seule espèce est égale 5 lorsque toutes
les espèces contiennent le même nombre d'individu. Cette valeur
varie de 0 à 5 bits. L'Equitabilité varie de 0 à 1, plus
cet indice tend vers 1, plus la dispersion des éléments de la
biodiversité est équitable, plus il tend vers 0, plus il y a
dominance d'une seule espèce par rapport aux autres c'est-à-dire
la dispersion non équitable (Blondel, 1979).
Dans le cas de notre étude, les valeurs de l'indice de
Shannon varient de 0 à 4.4 bits et l'Equitabilité de 0 à
0.9. Dans les quinze (15) parcelles étudiées, la
biodiversité est bien présente, mais n'est pas équitable.
La plus forte valeur de H' est obtenue dans les parcelles 5 et 15 (4.4 bits) en
forêt primaire, la plus faible valeur est observée dans la
parcelle 11 (0.8 bit) de forêt dégradée et la valeur de E
la plus forte est obtenue dans la parcelle 15 (0.9) qui est une forêt
dégradée, parcelle agro forestière du fait de la
présence des cultures sous la canopée. La plus faible valeur a
été obtenue dans la parcelle 11 (avec une valeur de 0.2) de la
forêt dégradée dominée par Musanga cecropiodes
R. Br. Nous constatons alors que, pour les quinze (15) parcelles
étudiées l'indice de Shannon évolue dans le même
sens que l'Equitabilité.
50
Ces résultats obtenus sur l'axe Impfondo-Dongou rejoint
la théorie de Vennetier, 1966 ; Moutsambote et al 2012 et Sita
1989 ; qui stipulent que les forêts primaires du Nord-Congo sont des
forêts denses avec une diversité d'espèces
c'est-à-dire il y a une variabilité d'arbres et les forêts
dégradées sont beaucoup plus dominée par une
espèce. Ces même résultats de la parcelle 11 de la
forêt dégradé rejoint également ceux obtenus par
PANLCD, 2006 qui stipule que les forêts dégradées sont dus
aux actions anthropiques ou par les chablis qui occasionnent les
dégâts majeurs et se manifestent par l'apparition des
espèces héliophiles telles que Musanga cecropiodes, et
Macaranga spp.
Selon Evrard, 1968 et Moutsamboté, 1985, les
forêts dégradées sont beaucoup plus dominées par les
espèces héliophiles du premier ordre et du deuxième ordre
comme les Musanga cecropioides R. Br. et les Macaranga
spp. C'est pour cela, dans notre parcelle 11 de foret
dégradé nous avons une valeur de l'indice qui tend ver 0 car
cette parcelle présente une abondance-dominance de Musanga
cecropiodes R. Br. La première augmentation de la diversité
correspond bien au développement du groupe des espèces
héliophiles pionnières, alors que, les espèces
pionnières régressent fortement et les espèces tardives
commencent à s'installer, la diversité diminue beaucoup.
Mais par contre nos résultats ne correspondent pas avec
ceux de Mondzali (2015) qui a travaillé dans l'UEFA Mbomo-Kellé,
au Centre-Ouest de la république du Congo. Cet auteur a obtenu des
valeurs de l'indice de Shannon qui varient de 5 à 6 bits entre les blocs
étudiés.
IV-3- Indice de similarité
Le coefficient de similarité dans le cas de notre
étude varie de 17,18% à 28,48% pour l'indice de Jaccard et de
29,33% à 44,33% pour l'indice de Sorensen. Par contre, De Bello et
al (2007) stipulent que, lorsque le coefficient de Jaccard augmente, un
nombre important d'espèces se rencontre dans les deux habitats et la
biodiversité inter-habitat est faible. Dans le cas contraire, s'il
diminue, on ne rencontre qu'un nombre faible d'espèces présentes
dans les deux habitats. Ainsi, les espèces des deux habitats
comparés sont totalement différentes.
Le coefficient de Sorensen varie de 0 à 1 quand il
n'existe pas d'espèce commune entre les deux habitats et il va
au-delà de 1 quand les espèces rencontrées dans l'habitat
I existent également dans l'habitat II.
Ces résultats ne correspondent pas avec ceux obtenu par
Kimpouni et al, 2013 qui ont travaillé sur la diversité
floristique du sous-bois de la Patte d'Oie dont la valeur du coefficient de
Jaccard varie de 52% à 62% et le coefficient de Sorensen de 69,2%
à 77,6%.
51
Ce qui explique dans nos 3 forêts étudiées
(forêt primaire, dégradée et agroforesterie), la
biodiversité dans les parcelles est fortes, par contre la
similarité est faible. Dans ce cas, nous disons que, ceci s'explique par
le fait que les forêts étudiées sont de grande distance
voir des kilomètres entre Dongou, Bondzalé et Impfondo.
IV-4- La densité à l'hectare et la surface
terrière
La densité correspond au nombre d'individus pour une
surface donnée. La densité à l'hectare dans les
forêts de l'axe Impfondo-Dongou varie de 144 tiges/ha de forêt
dégradée à 868 tiges/ha de forêt primaire dans les
15 parcelles étudiées. De ce fait, nos résultats ne
correspondent pas avec ceux obtenus par Pascal (2003) qui à travailler
sur « les notions sur les structures et dynamique des forêts
tropicales humides stipule que, les densités varient beaucoup plus selon
les forêts denses tropicales humides, et elles varient entre 450 tiges/ha
et 750 tiges/ha. Ces résultats ne rejoignent pas ceux obtenus par
Doucet, 2003au Gabon sur la gestion forestière et de la
biodiversité du centre du Gabon avec 411 tiges/ha. Amania et al.
2013 en RDC ont trouvé dans leur étude, une densité
moyenne à l'hectare de 650 individus pour les strates inferieure et 51
individus pour les strates supérieures. Mondzali, 2015, a trouvé
dans les forêts de l'UFA Mbomo-Kellé une densité des
espèces qui varie entre 0,01 pied/ha à 18,12 pieds/ha et la
densité globale de cette forêt est de 124,43 tiges/ha.
Ceci s'explique par le fait que, dans nos parcelles
étudiées, d'autre parcelle avaient plus d'Arecaceae que des
arbres surtout dans les zones marécageuses. Nous avons observé
dans la parcelle 9 installée dans une zone inondée riche en
Arecaceae comme: Lascosperma laive, Azymorpha senegalensis,
et les Raphia spp ce qui empêche le développement et la
croissance des arbres. Un autre facteur qui explique cela est la
présence d'eau en permanence où la majorité
d'espèces ne supporte pas l'étouffement et meurent par asphyxie.
Par contre la valeur 868 tiges/ha est obtenu dans la parcelle 11 de forets
dégradées avec une abondance-dominance de Musanga
cecropioides.
Selon Moutsamboté 1985 ; Vande, 2004 et Evrard, 1968
ont montré que la densité est plus forte dans les classes les
plus jeunes, puis qu'elles se stabilisent sensiblement, la forêt
secondaire étant plus dense que la forêt climacique.
La surface terrière (basal area pour les auteurs
anglo-saxons) correspond à la somme des sections horizontales des troncs
prises par convention à 1,30 m sol. Selon Pascal (2003), les valeurs de
la surface terrière calculée pour les forêts denses
tropicales humides varient entre 25 et 50 m2/ha. Ce qui n'est pas le
cas pour nos résultats.
52
Les résultats de la présente étude
montrent une valeur de la surface terrière variant de 6,75
m2/ha et 34,24 m2/ha pour la forêt
dégradée de 16,01 m2/ha et 36,37 pour la forêt
primaire et une valeur de 36,52 m2/ha pour l'agroforesterie.
L'analyse de la structure a montré une différence très
significative entre les surfaces terrières.
De ce fait, les forêts dégradées ont
généralement des arbres de petit diamètre d'où la
plus faible valeur de la surface terrière. Plus la valeur de la surface
terrière est maximale plus les arbres sont de gros diamètre et
plus la valeur est faibles plus les arbres sont de petit diamètre.
53
CONCLUSION ET PERSPECTIVES
L'inventaire floristique et structural de l'axe
Impfondo-Dongou a été effectué sur une superficie total de
3.75 ha, se qui nous a permis de comprendre la structure forestière
entre les forêts intactes et les forêts dégradées.
Cet inventaire nous a permis également d'obtenir 1611
arbres de DBH = 5 cm appartenant à 114 espèces, 37 familles et 83
genres.
L'analyse de la structure nous montre que les espèces
telles Musanga cecropiodes, Macaranga spinosa et monondra, Staudtia
camerounensis var gabonensis, Myrianthus arboreus, Angylocalyx pyneartii,
Ceolocaryan preusii sont les plus représentées en termes
d'individus sur l'axe Impfondo-Dongou. La famille la plus
représentée est celle des Urticaceae (14.6%) avec la
présence importante de Musanga cecropiode suivie des
Myristicaceae (14.0%) avec la présence de Staudtia camerounensis var
gabonensis et Myrianthus arboreu, Euphorbiaceae (12.9%) avec
Macaranga spinosa et monondra.
En définitive, sur les 5 groupements
étudiés, la forêt primaire sur sol hydromorphe est la plus
représentée avec 521 arbres, suivi de la forêt
dégradées a Macaranga spinosa (358), forêt
primaire sur sol hydromorphe à Guibourtia demeusei (301),
forêt dégradée à Musanga cecropiodes (278)
arbres et un faible nombre observé dans la forêt sur terre ferme
à Cltis adolphi-friderici (153) arbres.
La comparaison faite entre les structures forestières
de l'axe Impfondo-Dongou laisse à comprendre que les forêts
primaires dans l'ensemble présentent une variabilité
d'espèces plus ou moins équitable avec les arbres de gros
diamètre, par contre, les forêts dégradées ne
présente pas une structure variable, les arbres sont de faible
diamètre concentrés entre 0 et 30 cm formant des peuplements
parfois homogènes avec l'abondance-dominance d'une seule espèce.
Les arbres sont héliophile et à peu près la même
taille.
En perspective, nous souhaitons augmenter la connaissance sur
toutes les forêts de la zone Nord-Congo, en étudiant la
végétation, l'inventaire des arbres et la
régénération des forets.
54
Références bibliographiques
Abdourhaman H., Morou B., Rabiou H., & Mahamane A.
Caractéristique floristique, diversité et structure de la
végétation ligneuse dans le Centre-Sud du Niger: cas du complexe
des forêts classées de Dan Kada Dodo-Dan Gado. Université
de Madrid, Espagne 7(3) 21p.
Amania et al., 2013. Analyse floristique et impact du
déterminisme édaphique sur l'organisation de la
végétation dans les forêts de l'Ile Kongolo RD Congo.
Géo. Eco. Trop, 2013, 37(2) Pp. 255-272.
Asner G. P., Knapp D. E, Broadbent E. P., Oliviera P., Keller M.,
Sila J., 2005. Selective logging in the Brazilian Amazon. Science 310:
480-482
Babulu D. J., Bamba I., Munyemba K. F., Defourny F., Vancutsem
C., Nyemwe N. S., Ngongo L. M. et Borgaert J., 2008. Analyse de la structure
spatiale des forêts au Katanga. Université libre de Bruxelles.
Bruxelles, Belgique. Ann. Fac. Sc. Agro. I, (2), 2008, 12-18. Barbault R.,
1995. Ecologie des peuplements. Structure et dynamique de la
biodiversité. Masson 266p.
Baudrann C. & Blanchard P., 2008. Forêt et
biodiversité: Région, Pays de la Loire. ONF-CRPF, pays de la
Loire, 49p.
Biodiversity Research, Monitoring and Modeling.
Paris: UNESCO Paris and The Parthenon Publishing Group, International
Publishers in Science, Technology & Education.
Blondel J., 1979. Biogéographie et écologie.
Masson, Paris France 173p.
Bouchon J., 1979. Structure des peuplements forestiers. Anales
des Sciences forestières, 1979, 36(3), Pp. 175-209
Boudelal Mahmoud A. B., 2014. Relations structure des
peuplements forestiers, biodiversité au niveau du Parc National de
Tlemcen. Mémoire de Master. Université Abou Bekr Belbkaid,
Algérie 120p.
Branstetter M., mesure de la biodiversité 6p.
CERAPE., 2011. Monographie départementale de la
Likouala. Etude du secteur agricole, République du Congo 95p.
Chave J., 2000. Dynamique spatio- temporelle de la forêt
tropicale. Ann. Phys. Fr. 25, N°6, 2000, 186p.
55
Clark D. A and Clark., 1999. Assessing the growth of tropical
rain forest trees issues for forest modeling and management. Ecological
Applications 9: 181-99p.
Code forestier, 2000. Loi n°16-2000 du 20 Nomvembre 2000.
Republique du Congo, 21p.
COMIFAC, 2013. Les forêts du bassin du Congo: Evolution
du couvert forestier du niveau national ou régional et moteur de
changement Pp.21-47
Correia M., 2008. Ecologie des agroforêts à
café de Guinée Forestière (Guinée, Afrique de
l'Ouest):quand les pratiques paysannes locales permettent de conserver la
biodiversité. Université de Montpellier II, France, 82p.
Correia M., Diabate M., Beavogui P., Guilavogui K., Lamanda
N., & De Foresta M., 2008. Analyse comparative de la structure et de la
composition entre Agroforêt à café et forêt naturelle
en Guinée forestier (Guinée, Afrique de l'Ouest) 33p.
Counsel S., 2006. Gouvernance forestier en République
Démocratique Congo. Le point de vue d'une ONG. Rapport FERN. 37p.
Curtis R. O., 1970. Stand density measures an interpretation.
Forest. Sci 16(4) Pp. 103414.
De Bellot F. & Al., 2007. Garzing effects on the
species-area relation-ship: variation along a cliamatique gradient in NE
Spain-journal of vegetation Science 18(2007) Pp.25-34. Demangeot, J. 1996. Les
milieux naturels du globe. 60 éd., A., Colin, Paris : 337p.
Demangeot, J. 1997. La biodiversité tropicale,
Finisterra XXXII, 63, 1997, pp.107-113. Dentienne P. & Chanson B., 1999.
L'éventail de la densité du bois des feuillus: comparaison entre
différents régions du monde. CIRAD-Forêt, 1999. Pp.
19-30
Devineau J. L., 2009. Structure et dynamique de quelques
forêts tropicales de l'Ouest Africaine (Côte d'Ivoire). Ecologie,
Environnement. Université Pierre et Marie Curie-Paris VI 1984. 304p.
Doucet J. L., 2003. Alliance de la gestion forestière
et de la biodiversité dans les forêts du centre Gabon.
Thèse de doctorat. Faculté universitaire des sciences
agronomiques de Gembloux 323p.
Doyon F. & Lafleur B., 2004. Caractérisation de la
structure et du dynamisme des peuplements mixtes à bouleau jaune: pour
une sylviculture irrégulière proche de la nature. Québec,
Canada 137p.
56
Etat des forêts, 2010. Les forêts du bassin du
Congo. Biodiversité dans les forêts d'Afrique Centrale: Panorama
des connaissances, principaux enjeux et mesures de conservation. Pp.63-97.
Evrard C., 1968. Recherches écologiques sur le
peuplement forestier des sols hydromorphes de la Cuvette Centrale Congolaise
FAO., 2000. FRA, 2000. On definition of forest and forest
change. Forest ressources assessment working. Paper. 33. Rome. 13P.
FAO., 2010. Evaluation des ressources forestières
mondiale. Rapport national Congo. Pp.6-19
Gaudin S., 1996. Dendrométrie des peuplements. BTSA,
Gestion Forestière, Module D42, 66p.
GFOI., 2014. Intégration des données de
télégestion et d'observation au sol pour l'estimation des sources
et des puis de gaz à effet de serre dans les forêts:
Méthodes et pratiques recommandées par l'initiative mondiales
pour l'observation des forêts. Version 1, 192p.GIEC., 2003.
Recommandation en matière de bonne pratique pour le secteur de
l'utilisation des terres, changements d'affectations des terres et foresteries,
594p.
GIEC., 2007. Bilan 2007 des changements climatiques:
atténuation du changement climatique-contribution du groupe de travail
III au partenaire. Rapport d'évaluation du GIEC sur l'évolution
du climat. Cambridge, GB et New-York, NY, USA. Gimaret-Carpentier C. &
al., 1998. Sampling strategies for the assessment of tree species
diversity. University Claude Bernard, Lyon I. France 12p.
Godard V. et Simon L., 1998. Analyse des structures
forestières des de Saint-Gobain et Coucy-Basse (Aisne, France) à
l'aide de l'imagerie Satellitaire et de l'enquêtes de terrain: choix
d'échantillonnage. Université de Paris, France, 7p.
Goreaud F. & Pelisssier R. 2000. Analyse de la structure
spatiale de semis de points hétérogènes: exemple
d'application à des peuplements forestiers, 49p.
Goreaud F., 2000. Apport de l'analyse de la structure spatiale
en forêt tempérée à l'étude et la
modélisation des peuplements complexe. Earth Science. EN. Grief. (Agro
Paris Tech), Pp.12-20
Guariguata M. R., & Pinard M. A., 1998. Ecological
knowledge of regeneration from seed in neotropical forest tree: implication for
natural forest management. Forest Ecology and management 99p.
Guianan rain forest. Plant Ecology 131:
81-108.
57
Hakim Ouzennou, 2007. Indice de qualité de station des
pressières noires irrégulières. Mémoire de
Maitrise. Université Laval Québec 46p.
Hakizimana P., Bangirinama F., Hauyarimana F., Habomimana B.,
Et Bogaert J., 2011. Analyse de l'effet de la structure spéciale des
arbres sur la régénération naturelle de la forêt
claire de Rumonge au Burundi. Université de Burundi, Bujumbura 7p.
Hall P, Ashton PS, Condit R, Manokaran N, Hubbell SP.
1998.Signal and Noise in Sampling Tropical Forest Structure and Dynamics. In:
Dallmeier F, Comiskey JA eds. Forest
Harris D. J., Moutsambote J. M., Kami E., Florence J.,
Bridgewater S. G. M. et Wortley A. H., 20011. Une introduction aux arbres du
Nord de la République du Congo. Royal Botanic Garden Edinburgh, 208p.
Hecketsweiler, P.1990. La conservation des
écosystèmes forestièrs du Congo. IUCN, Tropical Forest
Programme, 187p.
IPCC., 2003. Definition and methodological options to
inventory emission from direct Humaninduced degradation of forests and DE
vegetation of other vegetal types.
Jaffre T., Veillon J. M., 1990. Etude floristique et structurale
de deux forêts denses humides sur les roches ultrabasique en Nouvelle
Calédonie. Rap. Sci. Tech. Vie. Nouméa 42p. Jaffre T., Veillon J.
M., 1995. Structural and floristic characteristics of a rain forest on schist
in New Caledonia: a comparison with an ultramafic rain forest. Bull. Mus. Hist.
Nat., Paris 26p.
Janzen D. H. & Vasquez-Yanes C., 1991. Aspect of tropical
seed ecology of relevance to management of tropical forest. Wild lands Pp.:
137-157.
Kimpouni V., Mbou P., Gakosso G. Et Motom M., 2013.
Biodiversité floristique du sous-bois et
régénération naturelles de la forêt de la Patte
d'Oie de Brazzaville. Ecole Normal Supérieure. Université Marien
NGOUABI, Brazzaville, Congo. Int. J. Biol. Chem. Sci. 7(3), 1255-1270. June
2013.
Koubouana F., Ifo S. A., Moutsambote J. M., Banzouzi R. R. F.,
Akobe A., Openga Ikama C., Mantota A. B., Ndzai S. Et Mbemba M., 2015.
Structure and flora tree biodiversity in Congo Basin: case of a secondary
tropical forest in southwest of Congo-Brazzaville. Reserachin plan Sciences,
2015, vol. 3, No. 3, 49-60.
Kumba S., Nshimba H., Ndjele L., De Carrière C., Visser
M., Et Bogaert J., 2013. Structure spatiale des trois espèces les plus
abondantes dans la réserve forestières de la Yoko, Ubundu, RDC.
Tropicultura, 2013, 31, 1, 53-61.
58
Lambin E. F., Geist H. J. et Lepers E., 2003. Dynamics of
land-use and Land-cover change in Tropical Regions. Annual Review of
Environemental Ressource 20: 205-241
Legendre L. et Legendre P., 1984. Ecologie Numérique,
tome 2 : - La structure des données écologiques
2ème éd. Masson : Paris, 335p.
Legendre P. & Legendre L., 1998. Ecologie numérique.
Introduction à l'analyse multidimensionnelle. Dép. de Sciences
biologique, Université de Montréal, Canada, 45p. Les forêts
du bassin du Congo, 2005. Evaluation préliminaire: la protection des
écosystèmes et de la biodiversité tout en
améliorant le bien-être des populations dans la région du
bassin du Congo. 39p.
Letouzey, R.1985. Notice de la carte phytogéographique
du Cameroun au 1 :500 000. Domaines sahélien et soudanien. Région
agro-montagnarde et étagée sub-montagnarde. Domaine de la
forêt dense humide semi caducifoliée. Domaine de la forêt
dense humide toujours verte. Toulouse (FRA) : Institut de la Carte
Internationale de la Végétation, 1985, 5 vol., 240 p.
Letouzey, R.1986. Manuel de botanique forestière.
Centre Technique Forestier Tropical, 3 vol., Nogent-sur-Marne, France.
Madelaine-Antin C., 2009. Dynamique des peuplements forestiers
tropicaux hétérogènes: variabilité inter et intra
spécifique de la croissance des arbres et trajectoire de
développement en forêt dense humide sempervirente.
Université de Montpellier II, Montpellier Supagro. Ecole doctorale
SIBAGHE, France, 258p.
Marcon E., 2010. Mesure de la biodiversité: Ecologie
des forêts de Guyane Agro Paris. Tech 58p.
Marklud L. G. et Schoene D., 2006. Global Assessment of Growing
stock, biomass and carbon stock. Forest ressources assessment Programme Working
Paper 106/E, Rome.
Marman. C &al., 2006. Facteur du milieu, gestion
sylvicole et organisation de la biodiversité: les systèmes
forestiers de la montagne de Lure (Alpes de Haute Province, France),
Université Cézanne de France. Thèse de Doctorat 240p.
Marwan C. &Al., 2006. Facteur du milieu, gestion
sylvicole et organisation de la biodiversité: les systèmes
forestiers de la montagne de Lure (Alpes de Haute-Province, France). Ecologie,
environnement. Université Paul Cézanne-Aise- Marseille III,
France, 240p.
59
Masharabu T., Noret N., Lejoly J., Bicendake M.J., Bagagaert
J., 2010. Etude comparative des paramètres floristiques du Parc National
de la Ruvulu, Burundi 16p.
Mondzali R., 2015. Analyse floristique et quantitative de la
forêt de l'UFA Mbomo-Kellé. Mémoire de fin de formation,
ENSAF, UNMG, Brazzaville Congo 57p.
Moukolo N., 1992. Etat des connaissances actuelles sur
l'hydrogéologie du Congo Brazzaville. 12P.
Moutsamboté J. M., 1985. Dynamique de la reconstituions
de forêt Yombé (Dimonoka, R.P. Congo. Thèse pour obtenir le
grade de Doctorat de Spécialité. Université de Bordeaux
III, Paris Pp 48-109.
Moutsamboté, J,M. 1988. Etude
écologique, phytogéographique et phyto sociologique du Congo
septentrional (Plateaux, Cuvette, Likouala, Sangha) Université Marien
Ngouabi. République du Congo.341p.
Nkokolo Nkaya D., 2012. Suivi de la dynamique des jeunes tiges
des essences de valeur commerciale dans les parcelles après
exploitation: cas de l'AAC3-2012 de l'UFP1, l'UFA Mokabi-Dzanga,
Société Mokabi Département de la Likouala. UMNG, IDR, BZV
Congo 61P.
Nusbaumer L., 2003. Structure et composition floristique de la
forêt classée du Scio (Côte d'Ivoire). Etude descriptive et
comparative. Université de Genève 153p.
Nusbaumer L., L. Gautier C. Chatelain & Spichger R., 2005.
Structure et composition floristique de la forêt Classée du Scio
(Côte d'Ivoire). Etude descriptive et comparative. Candollea 60:
393-443.
OGDE., 2008. Biodiversité: Perspective de
l'environnement de l'OGDE à l'horizon 2030, Pp.10-26.
OIBT., 1994. Meilleure utilisation des ressources
forestières tropicales en vue d'assurer une production soutenue et de
réduire les impacts écologiques nuisibles, volume 1, 2eme partie,
rapport final des études en forêts 82p.
OIBT., 2002. Directive OIBT pour la restauration:
l'aménagement et la réhabilitation des forêts tropicales
dégradées et secondaires. Série OIBT: politique
forestière n° 13. OIBT. Yokohama.
OIBT., 2005. Critère et indicateur révisé de
l'OIBT pour l'aménagement durable des forêts tropicales,
modèle du rapport sur C et I inclus. Série OIBT. Politique
forestière n°15. Oldeman R. A. A., 1989. Dynamics
in tropical rain forests. In: Mielsen LBH ed. Tropical Forests,Botanical
Dynamics, Speciation and Diversity: Academic Press.
60
Ottorini J., 1978. Aspects de la notion de densité et
de croissance des arbres en peuplement. Anales des sciences forestières,
1978, 35. Ann. Sci. Forest. 35 (4) 23p.
PAM., 2009. Evaluation rapide de la sécurité
alimentaire des refugiés au Département de la Likouala. Likouala,
République du Congo 12p.
PANLCD., 2006. Problématique de la dégradation des
terres au Congo-Brazzaville 57p. Pascal, 2003. Notion sur les structures et
dynamique des forêts tropicales humide 13p. Pavoine S., Dufour A.B.,
2014. Mesure de la biodiversité. Fiche TD avec le logiciel R 15p. Pernot
C., 2012. Comparaison de la structure et de la biodiversité entre les
forêts exploitées et non exploitées en France: bilan des
données acquises et première perspective. Mémoire de
Master, université de Lorraine, France 72p.
Pongui B. S. & Kenfack C. E., 2012. Adaptation et
Atténuation en République du Congo. Acteurs et processus
politique, document de travail 99. CIFOR, Bogor, Indonésie, 46p.
Rakotomalaza & Mcknight M., 2014. Etude de la variation de la structure et
de la composition floristique de la forêt de Mikea du Sud-Ouest de
Madagascar. University of Nord Carolina, Chapel Hill, USA. Phelsuma 14;
13-36.
Rakotomalaza P., & Meknigh M., 2003. Etude de la variation
de la structure et de la composition floristique de la forêt des Mikea du
Sud- Ouest de Madagascar. Université du Nord Caroline, USA 24p.
Reitsma J.M.,1988. Végétation du Gabon / Forest
vegetation of Gabon. Tropenbos TechnicalSeries 1. The Tropenbos
Foundation, Ede, The Netherlands.
Sabatier D., Grimaldi M., Prévost M-F., Guillaume J.,
Gordon M., Dosso M., Curmi P., 1997. The influence of soil
cover organization on the floristic and structural heterogeneity of a
Sara. B. H., 2008. Biomasse aérienne e plantation
d'arbres tropicaux. Université du Québec, Montréal Canada
58p.
Schannon C. & Waerren, 1975. Théorie
mathématique de la communication, 14p.
Schwal B., 2004. Dynamique de la biodiversité
végétale dans les paysages d'agriculture intensive : utilisation
des sols, composition floristique, végétale et structures
paysagères du Lauragais haut-garonnais (Sud- Ouest- France), XIXe et XXe
siècles. Doctorat de l'Université de Toulouse II-Le Mirail.
Département de géographie-aménagement, 370p.
Sebastien J., 2007. Regeneration Ecology and Population.
Dynamics of Dicorynia guianenis (Ceasalpiniaceae) in a French Guiana Rain
forest. Life science. INAPG (Agroparis Tech) 21p.
61
Simula Markku, 2009. Vers une définition de la
dégradation des forêts: analyse comparative des définitions
existantes. Rome, Italie, 66p.
Sita P., 1989. La forêt tropicale au Congo. Brazzaville,
Congo. 8P.
Sonke B., Lachenaud O., Simo M., Taedoumg H., Droissart V.,
Lemaire B., Stévart T., Dessein S.,2010. Botanical survey in Central
Africa: taxonomical novelties and new records for the flora or Cameroun.19th
AETFAT Congress, 25-30/04/2010. Antananarivo, Madagascar.
Ter Steeg H., Boot R. G. A., Brouver L., Hummond D. S., Vander
Hout P., 1995. Basic and applied research for sound rain forest management in
Guyana. Ecological application 5(4) Pp. 904-910.
Tsayem Demaze M., 2007. La déforestation en Amazonie
Brésilienne: une rupture apparente entre développement et
environnement. Presse Universitaire de Rennes. Le Mans, France. Presse
Universitaire de Rennes Pp.165-187
Usson J., 2014. Impact de l'exploitation sélective sur
les relations biomasse et diversité floristique en forêt
guyanaise. Université de Montpellier II, France 45p.
Vande Weghe J. P., 2004. Forêts d'Afrique Centrale: la
nature et l'homme 367p. Vennetier P., 1966. Géographie du Congo
Brazzaville: la couverture végétale et les sols du Congo. Pp.
47-53
Vivien J. et Faure J.J., 1985. Arbres des forêts denses
d'Afrique Centrale espèces du Cameroun: Agence de Coopération
Culturelle et Technique, 565p.
Yoka J., Loumeto J. J., Djego J., Vouidibio J, Epron D., 2013.
Evaluation de la biodiversité floristique en herbacées des
savanes de la Cuvette Congolaise (République du Congo). UMNG, Fac des
Sci et Tech. Brazzaville Congo 14P.
ANNEXES
Annexe 1: liste des espèces dans la forêt
sure terre ferme à Celtis adolphi-friderici Engl.
|
Familles
|
Noms scientifiques
|
Nombre d'espèces
|
Nombre d'arbres
|
|
Anacardiaceae
|
Pseudospondias microcarpa (A. Rich.) Engel
|
3
|
3
|
|
Annonaceae
|
Anonidium mannii (Olive) Engl. & Diels
|
1
|
2
|
|
Monodora angolensis Welw.
|
|
Bignoniaceae
|
Markhamia tomentosa (Benth.) K Schum et Thonn.
|
1
|
1
|
|
Cannabaceae
|
Celtis adolfi-friderici Engl.
|
1
|
10
|
|
Combretaceae
|
Terminalia superba Engl. Et Diels.
|
1
|
3
|
|
Ebenaceae
|
Diospyros crassiflora Hiern
|
1
|
3
|
|
Euphorbiaceae
|
Cleistanthus itsogohensis Pellegr.
|
4
|
10
|
62
|
Grossera macrantha Pax
|
|
|
|
Macaranga monandra Mull. Arg.
|
|
Macaranga spinosa Müll.Arg.
|
|
Fabaceae-Faboideae
|
Angylocalyx pynaertii De Wild
|
2
|
6
|
|
Baphia dewevrei De Wild.
|
|
Fabaceae-Mimosoideae
|
Penthacletra macrophylla Benth.
|
1
|
2
|
|
Guttifereae
|
Garcinia punctata Oliv.
|
2
|
5
|
|
Trichilia sp
|
|
Irvingiaceae
|
Irvingia exselsa
|
1
|
2
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
1
|
5
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
5
|
|
Meliaceae
|
Carapa procera var procera DC
|
3
|
5
|
|
Entandrophragma cylindricum (Sprague) Sprague
|
|
Trichilia sp
|
|
Moraceae
|
Anthiaris toxicaria var. welwitschii Lesch
|
2
|
4
|
|
Milicia excelsa (Welw.) C.C. Berg
|
|
Myristicaceae
|
Ceolocaryan preussü Warb.
|
3
|
38
|
|
Pycnantus angolensis (Welv.) Warb.
|
|
Staudtia kamerounensis Warb. Var. gabonensis Fouilloy
|
|
Olacaceae
|
Strambosia grandifolia
|
1
|
21
|
|
Pandaceae
|
Panda oleosa Pierre
|
1
|
2
|
|
Putranjivaceae
|
Drypedes pellegriniana
|
|
1
|
|
Phyllanthaceae
|
Uapaca guineensis Mull. Arg
|
1
|
1
|
|
Rubiaceae
|
Aidia micrantha (K. Schum.) F. White
|
1
|
3
|
|
Sapendaceae
|
Blighia welwitschii (Hierm) Radlk
|
1
|
4
|
|
Sapotaceae
|
Tridesmostemom omphalocarpoides Engel.
|
1
|
13
|
|
Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
2
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
1
|
2
|
|
Total
|
36
|
153
|
Annexe 2: liste des espèces par famille dans la
forêt à Guibourtia demeusei (Harms) Léon.
|
Familles
|
Noms scientifiques
|
Nombre d'espèces
|
Nombre d'arbres
|
|
Anacardiaceae
|
Pseudospondias microcarpa (A. Rich.) Engel
|
1
|
1
|
|
Annonaceae
|
Monodora angolensis Welw.
|
1
|
8
|
|
Burseraceae
|
Dacryodes pubescens (Verm.) Lam.
|
1
|
3
|
|
Chrysobalanaceae
|
Parinari congensis F. Didr.
|
3
|
15
|
|
Parinari congolana T. Durand
|
|
Parinari sp
|
|
Ebenaceae
|
Diospyros crassiflora Hiern
|
2
|
25
|
|
Diospyros iturensis (Gùrke) R. Let et F. White
|
|
Euphorbiaceae
|
Dichostemma glaucescens Pierre
|
|
19
|
|
Macaranga barteri Mull-Arg.
|
|
|
|
Macaranga schwinfurthii Pax
|
4
|
|
|
Macaranga spinosa Müll.Arg.
|
|
|
|
Fabaceae-
Caesalpinioideae
|
Copaifera salikounda Heckel
|
4
|
69
|
|
Daniellia pynaertii De Wild.
|
63
|
Dialum pachyphyllum Harms
|
|
|
|
Guibourtia demeusei (Harms) Léon.
|
|
Fabaceae-Faboideae
|
Angylocalyx pynaertii De Wild
|
3
|
31
|
|
Baphia dewevrei De Wild.
|
|
Pterocarpus soyauxis Taud.
|
|
Fabaceae-Mimosoideae
|
Albizia laurentii De Wild
|
5
|
11
|
|
Albizia rhomboidea
|
|
Newtonia devredii G.C.C. Gilbert
|
|
Parkia bicolor A. Chev.
|
|
Penthacletra macrophylla Benth.
|
|
Guttifereae
|
Garcinia ovalifolia Oliv.
|
5
|
17
|
|
Garcinia punctata Oliv.
|
|
Garcinia sp
|
|
Symphonia globulifera L. f.
|
|
Trichilia sp
|
|
Irvingiaceae
|
Irvingia exselsa
|
2
|
4
|
|
Klainedoxa gabonensis Pierre ex Engl
|
|
Lamiaceae-Viticoideae
|
Vitex pachyphyllum Bak
|
|
2
|
|
Meliaceae
|
Carapa procera var palustre DC
|
1
|
11
|
|
Myristicaceae
|
Ceolocaryan preussü Warb.
|
3
|
18
|
|
Staudtia kamerounensis Warb. Var. gabonensis Fouilloy
|
|
Pycnanthus angolensis (Welv.) Exell.
|
|
Ochnaceae
|
Lophira alata Banks ex Gaertu.
|
2
|
5
|
|
Rhabdophyillum welwitschii Van Tigh.
|
|
Olacaceae
|
Strombosia pustulata Oliv.
|
1
|
10
|
|
Phyllanthaceae
|
Cleistanthus mildbraedrü Jabel.
|
4
|
15
|
|
Uapaca guineensis Mull. Arg
|
|
Uapaca heudelotii Baill.
|
|
Maesobotrya dusenii (Pax) Hutch
|
|
Rubiaceae
|
Aoranthe micrantha
|
4
|
16
|
|
Morelia senegalensis A. Rich.
|
|
Morinda lucida Benth.
|
|
Psydrax arnoldiana (De Wild.)
|
|
Sapendaceae
|
Eriocoelum microspermum Radelk
|
1
|
12
|
|
Sapotaceae
|
ManilKara fouilloyana Aubr. Et Pellegr
|
4
|
5
|
|
Manilkara sp
|
|
Tridesmostemom omphalocarpoides Engel.
|
|
Chrysophyllum beguei Aubrev.
|
|
Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
3
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
2
|
2
|
|
Total
|
54
|
302
|
Annexe 3:liste des espèces par famille de la
forêt à Lophira alata Banks ex Gaertu.
|
Familles
|
Noms scientifiques
|
Nombre d'arbres
|
Nombre d'espèces
|
|
Anacardiaceae
|
Pseudospondias microcarpa (A. Rich.) Engel
|
2
|
7
|
|
Trichoscypha acuminata Engl.
|
|
Annonaceae
|
Monodora angolensis Welw.
|
1
|
6
|
64
Apocynaceae
|
Alstonia boonei De Wild
|
1
|
1
|
|
Ebenaceae
|
Diospyros crassiflora Hiern
|
2
|
19
|
|
Diospyros iturensis (Gùrke) R. Let et F. White
|
|
Euphorbiaceae
|
Cleistanthus itsogohensis Pellegr.
|
4
|
74
|
|
Grossera macrantha Pax
|
|
Macaranga spinosa Müll.Arg.
|
|
Plagiostyles africana (Müll-Arg) Parain
|
|
Fabaceae-
Caesalpinioideae
|
Dialum pachyphyllum Harms
|
3
|
32
|
|
Guibourtia demeusei (Harms) Léon.
|
|
Swartzia fustiloides Harms
|
|
Fabaceae-Faboideae
|
Angylocalyx pynaertii De Wild
|
2
|
76
|
|
Pterocarpus soyauxis Taud.
|
|
Fabaceae-Mimosoideae
|
Albizia ferruginea (Guill. & Perr.) Benth
|
4
|
16
|
|
Penthacletra macrophylla Benth.
|
|
Piptadeniasthrum africanum (Hook. F) Bren.
|
|
Tetrapleura tetraptera (Schum. & Thonn.) Taub.
|
|
Guttifereae
|
Garcinia ovalifolia Oliv.
|
4
|
29
|
|
Garcinia punctata Oliv.
|
|
Mammea africana Sabine
|
|
Trichilia sp
|
|
Irvingiaceae
|
Irvingia exselsa
|
3
|
3
|
|
Irvingia grandifolia (Engl.) Engl.
|
|
Klainedoxa gabonensis Pierre ex Engl
|
|
Lamiaceae-Viticoideae
|
Vitex pachyphyllum Bak
|
1
|
4
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
1
|
28
|
|
Malvaceae-Sterculioideae
|
Cola nitida (Vent.) Schott et Endl.
|
1
|
2
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
1
|
|
Meliaceae
|
Carapa procera var palustre DC
|
2
|
14
|
|
Entandrophragma cylindricum (Sprague) Sprague
|
|
Moraceae
|
Anthiaris toxicaria var. welwitschii Lesch
|
2
|
4
|
|
Trelipisium madagascariensis DC.
|
|
Myristicaceae
|
Ceolocaryan preussü Warb.
|
3
|
98
|
|
Staudtia kamerounensis Warb. Var. gabonensis Fouilloy
|
|
Pycnanthus angolensis (Welv.) Exell.
|
|
Ochnaceae
|
Lophira alata Banks ex Gaertu.
|
|
9
|
|
Olacaceae
|
Strombosia pustulata Oliv.
|
3
|
20
|
|
Heisteria parvifolia Smith
|
|
Strambosia grandifolia Hoof.
|
|
Pandaceae
|
Panda oleosa Pierre
|
1
|
4
|
|
Patranjivaceae
|
Drypetes pellegrinii Léandri
|
1
|
3
|
|
Phyllanthaceae
|
Hymenocardia ripicola J. Léonard
|
4
|
11
|
|
Hymenocardia ulmoides Oliv.
|
|
Uapaca guineensis Mull. Arg
|
|
Uapaca heudelotii Baill.
|
|
Rubiaceae
|
Aidia micrantha (K. Schum.) F. White
|
4
|
12
|
|
Aoranthe micrantha
|
|
Massularia acuminata (G. Don)
|
65
|
Psydrax arnoldiana (De Wild.)
|
|
|
|
Sapendaceae
|
Blighia welwitschii (Hierm) Radlk
|
1
|
21
|
|
Sapotaceae
|
Tridesmostemom omphalocarpoides Engel.
|
2
|
3
|
|
Synsepalum brevipes (Baker) T.D Penn
|
|
Scytopetalaceae
|
Brazzeia congensis Baill.
|
1
|
5
|
|
Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
12
|
|
Total
|
55
|
514
|
Annexe 4: liste des espèces de la forêt
à Macaranga monandra Mull. Arg.
|
Familles
|
Noms scientifiques
|
Nombre d'espèces
|
Nombre d'arbres
|
|
Achariaceae
|
Caloncoba welwitschii (Oliv.) Gilg
|
1
|
9
|
|
Anacardiaceae
|
Pseudospondias microcarpa (A. Rich.) Engel
|
1
|
3
|
|
Annonaceae
|
Anonidium mannii (Olive) Engl. & Diels
|
2
|
3
|
|
Monodora angolensis Welw.
|
|
Aptandraceae
|
Ongokea gore
|
1
|
1
|
|
Cannabaceae
|
Celtis adolfi-friderici Engl.
|
1
|
2
|
|
Euphorbiaceae
|
Cleistanthus itsogohensis Pellegr.
|
8
|
107
|
|
Croton haumananus J. Léonard
|
|
Grossera macrantha Pax
|
|
Macaranga monandra Mull. Arg.
|
|
Macaranga spinosa Müll.Arg.
|
|
Ricynodendrom heudolotii (Baill.)
|
|
Sapium ellipticum (Hochst.) Pax
|
|
Fabaceae-
Caesalpinioideae
|
Tetrorchidium didymostemom (Baill.)
|
2
|
7
|
|
Daniellia pynaertii De Wild.
|
|
Dialum pachyphyllum Harms
|
|
Fabaceae-Faboideae
|
Angylocalyx pynaertii De Wild
|
3
|
3
|
|
Milletia sanagana Harms
|
|
Pterocarpus soyauxis Taud.
|
|
Fabaceae-Mimosoideae
|
Albizia ferruginea (Guill. & Perr.) Benth
|
6
|
27
|
|
Albizia zygia (DC) J.F Marcbr.
|
|
Parkia filicoidea Welw. Exe Oliv.
|
|
Penthacletra macrophylla Benth.
|
|
Piptadeniasthrum africanum (Hook. F) Bren.
|
|
Tetrapleura tetraptera (Schum. & Thonn.) Taub.
|
|
Guttifereae
|
Allamblackia floribunda Oliv.
|
2
|
4
|
|
Garcinia sp
|
|
Lamiaceae-Viticoideae
|
Vitex pachyphyllum Bak
|
1
|
2
|
|
Lauraceae
|
Persea americana L.
|
1
|
1
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
1
|
23
|
|
Malvaceae-Tilioideae
|
Duboscia macrocarpa Brocq.
|
1
|
2
|
|
Meliaceae
|
Entandrophragma cylindricum (Sprague) Sprague
|
2
|
16
|
|
Trichilia monadelpha (Thonn.) J.J. De Wild.
|
|
Moraceae
|
Anthiaris toxicaria var. welwitschii Lesch
|
|
9
|
|
Ficus exasperata Vahl
|
|
|
66
|
Milicia excelsa (Welw.) C.C. Berg
|
5
|
|
|
Trelipisium madagascariensis DC.
|
|
|
|
Ficus vogeliana (Miq) Miq
|
|
|
|
Myristicaceae
|
Ceolocaryan preussü Warb.
|
3
|
62
|
|
Staudtia kamerounensis Warb. Var. gabonensis Fouilloy
|
|
Pycnanthus angolensis (Welv.) Exell.
|
|
Olacaceae
|
Heisteria parvifolia Smith
|
1
|
1
|
|
Passifloraceae
|
Barteria fistulosa Mast.
|
1
|
1
|
|
Putranjivaceae
|
Drypetes leonensis (Pax). Pax et K. Hoffm.
|
2
|
3
|
|
Drypetes pellegrinii Léandri
|
|
|
|
Phyllanthaceae
|
Uapaca guineensis Mull. Arg
|
2
|
10
|
|
Maesobotrya dusenii (Pax) Hutch
|
|
Rubiaceae
|
Aidia micrantha (K. Schum.) F. White
|
7
|
11
|
|
Aoranthe micrantha
|
|
Colleactina papalis N. Hallé
|
|
Morinda lucida Benth.
|
|
Oxyanthus schumannianus De Wild et Th. Dur.
|
|
Psidrax subcordata (DC)
|
|
Psydrax arnoldiana (De Wild.)
|
|
Rutaceae
|
Zanthoxylum heitzii (Aubrév. & Pellegr.) P. G.
Waterman
|
1
|
1
|
|
Sapendaceae
|
Blighia welwitschii (Hierm) Radlk
|
4
|
15
|
|
Pancovia pedecellaris Radlk et Gilg
|
|
Eriocoelum microspermum Radelk
|
|
Lecaniodiscus cupanioides Planch ex Benth.
|
|
Sapotaceae
|
Tridesmostemom omphalocarpoides Engel.
|
1
|
1
|
|
Thomandersiaceae
|
Thomandersia hensii De Wild.
|
1
|
4
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
2
|
30
|
|
Myrianthus arboreus P. Beauv.
|
|
Total
|
63
|
358
|
Annexe 5: répartition des espèces dans la
forêt à Musanga cecropiodes R. Br
|
Familles
|
Noms scientifiques
|
Nombre d'espèces
|
Nombre d'arbres
|
|
Chrysobalanaceae
|
Parinari excelsa Sabine
|
2
|
17
|
|
Parinari sp
|
|
Euphorbiaceae
|
Cleistanthus itsogohensis Pellegr.
|
4
|
29
|
|
Macaranga monandra Mull. Arg.
|
|
Macaranga spinosa Müll.Arg.
|
|
Ricynodendrom heudolotii (Baill.)
|
|
Fabaceae-Caesalpinioideae
|
Guibourtia demeusei (Harms) Léon.
|
1
|
8
|
|
Fabaceae-Faboideae
|
Baphia dewevrei De Wild.
|
1
|
7
|
|
Fabaceae-Mimosoideae
|
Albizia laurentii De Wild
|
1
|
2
|
|
Irvingiaceae
|
Irvingia exselsa
|
1
|
1
|
|
Lecythidaceae
|
Petersianthus macrocarpus (P.Beauv.) Liben
|
1
|
2
|
|
Myristicaceae
|
Ceolocaryan preussü Warb.
|
2
|
10
|
|
Staudtia kamerounensis Warb. Var. gabonensis
Fouilloy
|
67
Rubiaceae
|
Psydrax arnoldiana (De Wild.)
|
1
|
2
|
|
Sapendaceae
|
Eriocoelum microspermum Radelk
|
1
|
1
|
|
Sapotaceae
|
ManilKara fouilloyana Aubr. Et Pellegr
|
2
|
3
|
|
Tridesmostemom omphalocarpoides Engel.
|
|
Urticaceae
|
Musanga cecropioides R. Br.
|
2
|
196
|
|
Myrianthus arboreus P. Beauv.
|
|
Total
|
19
|
278
|
Table des matières
INTODUCTION 1
Contexte et Justification 1
Problématique 3
Objectif général et spécifiques 4
Les hypothèses de recherche 4
CHAPITRE I : REVUE BIBLIOGRAPHIQUE 6
I-1- Les forêts tropicales 6
I-2- Dégradation 6
I-3- La forêt Congolaise 7
I-4- Biodiversité 8
I-4-1- La Richesse 9
I-4-2- Indice de biodiversité 9
I-5- Densité 9
CHAPITRE II : MATERIELS ET METHODES 10
II- Matériel et Méthodes 10
II-1- Site d'étude 10
II-1-1- Localisation des parcelles expérimentale 10
II-2- Milieu Physique 11
II-2-1- Climat 11
II-2-1- Pédologie 12
II-2-3- Végétation 12
II-2-4- Le Relief 13
II-3- Matériel végétal 13
II-4- Méthodologie 13
II-4-1- Sélection des parcelles 13
68
II-4-2- Mise en place des parcelles 14
II-4-3- Collecte de données floristiques 15
II- 5- Méthode de traitement des données 16
II-6-Méthode d'analyse floristique 17
II-6-1- Richesse floristique 17
II-6-2- Fréquence 17
II-7- La diversité biologique 18
II-7-1- L'indice de Pielou ou de régularité
(équitabilité). 19
II-7-2- La similarité 19
Tableau 1 : Tableau de fréquences 2x2 pour le calcul de
similarité d'échantillons 19
II-8-3- Analyse structurale 21
CHAPITRE III : PRESENTATION DES RESULTATS 23
III-1- Composition floristique 23
Tableau 2: Composition floristique de toutes les parcelles
inventoriées 23
III-2- Types de végétation 28
III-2-1- Forêt primaire sur terre ferme à Celtis
adolphi-friderici Engl. 30
III-2-2- Forêt sur sol hydromorphe à Guibourtia
demeusei (Harms) Léon. 31
III-2-3- Forêt primaire sur les sols hydromorphes à
Lophira alata Banks ex Gaertu. 32
III-2-4- Forêt dégradée sur terre ferme
à Macaranga monandra Mull. Arg. 33
III-3-Comparaison de structure et de composition floristique
entre les forêts primaires et les forêts
dégradées 37
III-3-1- Comparaison de composition floristique 37
Tableau 3 : Comparaison de la forêt primaire et de la
forêt dégradée 37
Tableau 4 : Les espèces caractéristiques de la
forêt dégradées. 39
III-3- La diversité biologique 41
III-4- Indice de similarité 43
III-5- Analyse structurale 43
III-5-1- Répartition des arbres dans les parcelles
inventoriée 43
III-5-2- Surface terrière 44
Tableau 5 : Valeur des surfaces terrières par parcelle
44
III- 5-3- Répartition des arbres en classe de
diamètre dans les parcelles expérimentales 45
CHAPITRE IV : DISCUSSION 48
IV-1- Composition floristique 48
IV-2- Les indices biodiversité 49
IV-3-
69
Indice de similarité 50
IV-4- La densité à l'hectare et la surface
terrière 51
CONCLUSION ET PERSPECTIVES 53
Références bibliographiques 54
ANNEXES 61
| 


